Настоящее изобретение относится к некоторым соединениям общей формулы (I), описанным далее, к указанным соединениям в качестве лекарственных средств, а также к применению их с получением лекарственного средства, предназначенного для ингибирования моноаминоксидаз (MAO), и/или перекисного окисления липидов, и/или для действия в качестве модуляторов натриевых каналов.
Соединения, указанные выше, обычно обладают 2 или 3 видами активностей, указанных выше, что обуславливает их полезные фармакологические свойства.
Действительно, играющие важную роль в физиопатологии MAO и ROS (виды активного кислорода при возникновении перекисного окисления липидов), новые производные, описываемые соответствующей общей формулой (I), могут проявлять полезные или благоприятные эффекты при лечении патологий, в которые вовлечены эти ферменты и/или эти виды радикалов.
В частности:
- расстройства центральной или периферической нервной системы, таких как, например, неврологические заболевания, среди которых могут быть указаны болезнь Паркинсона, травма головного или спинного мозга, ишемический инсульт, субарахноидальное кровоизлияние, эпилепсия, старение, старческое слабоумие, болезнь Альцгеймера, хорея Гантингтона, боковой амиотрофический склероз, периферические невропатии, боль;
- шизофрения, депрессия, психозы;
- расстройства памяти и настроения;
- патологии, такие как, например, мигрень;
- поведенческие расстройства, булемия и анорексия;
- аутоиммунные и вирусные заболевания, такие как, например, волчанка, СПИД, паразитарные и вирусные инфекции, диабет и его осложнения, рассеянный склероз;
- пристрастие к токсическим веществам;
- воспалительные и пролиферативные заболевания;
- и, более обобщенно, все патологии, характеризующиеся чрезмерной продукцией ROS и/или участием MAO.
Для всех этих патологий существует экспериментальное доказательство участия ROS (Free Radic. Blol. Med. (1996) 20, 675-705; Antioxid. Health. Dis. (1997) 4 (Handbook of Synthetic Antioxidants), 1-52), а также участия MAO (Goodman & Oilman's: The pharmacological basis of therapeutics, 9-ое издание, 1995, 431-519).
Значение сочетания MAO-ингибирующей активности и ингибирующей активности в отношении перекисного окисления липидов, например, хорошо проиллюстрировано на болезни Паркинсона. Эта патология характеризуется потерей допаминергических нейронов нигростриатного пути, причина которой частично связана с оксидативным стрессом, обусловленным ROS. Для поддержания достаточных уровней допамина в терапии используется экзогенный допамин, основанный на L-допа. Для того, чтобы избежать метаболическую деградацию L-допа, вместе с ним также применяются ингибиторы MAO, но они не действуют на ROS. Поэтому соединения, действующие как на MAO, так и на ROS, имеют определенные преимущества.
Кроме того, способность модулировать натриевые каналы очень эффективна при таких терапевтических показаниях, как:
- лечение или профилактика боли и, в частности:
- послеоперационная боль,
- мигрень,
- невропатическая боль, такая как невралгия тройничного нерва, постгерпетическая боль, диабетические невропатии, невралгия языкоглоточного нерва, вторичные радикулопатии и невропатии, связанные с метастатическими инфильтрациями, болезненным ожирением, и боли, ассоциированные с ожогами,
- боли центрального генеза, как результата сосудисто-мозговых явлений, таламических повреждений и рассеянного склероза, и
- боли при хронических воспалительных заболеваниях или боли, связанной с раком;
- лечение эпилепсии;
- лечение расстройств, связанных с нейродегенерацией и, в частности:
- с сосудисто-мозговыми повреждениями,
- с мозговой травмой и
- с нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз;
- лечение биполярных расстройств и синдрома раздраженной кишки.
Таким образом, конкретные преимущества наличия у соединения, по крайней мере, одного из этих видов активности ясно видно из вышеуказанного.
В европейской патентной заявке EP 432740 описаны производные гидроксифенилтиазола, которые могут использоваться при лечении воспалительных заболеваний, в частности ревматических заболеваний. Эти производные гидроксифенилтиазола обладают свойствами улавливания свободных радикалов и свойствами ингибирования метаболизма арахидоновой кислоты (они ингибируют липоксигеназу и циклооксигеназу).
Другие производные гидроксифенилтиазола или гидроксифенилоксазола описаны в патентной заявке PCT WO 99/09829. Последние обладают анальгетическими свойствами.
Некоторые производные имидазола со структурами, подобными или идентичными структурам соединений, соответствующих общей формуле (I) по данному изобретению, кроме того, описаны заявителем в патентной заявке PCT WO 99/64401 в качестве агонистов или антагонистов соматостатина. Однако указанные производные имидазола обладают терапевтическими свойствами в области, отличной от указанной выше (в частности, супрессия гормона роста и лечение акромегалии, лечение рестеноза, ингибирование секреции желудочной кислоты и профилактика желудочно-кишечного кровотечения).
Далее, в патентной заявке PCT WO 96/16040 были описаны соединения общей формулы (A1)
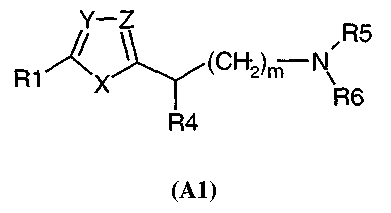
где
R1 является одним из радикалов арил, гетероарил, аралкил или циклоалкил, необязательно замещенных от одного до трех заместителями, независимо выбранными из атома галогена, CF3, CN, OH, алкила или алкокси, радикала SO2R9, где R9 представляет собой NH2 или NHCH3;
X представляет собой NR2, R2 представляет собой H или алкил;
Y представляет собой N или CR3;
Z представляет собой CR3 или N;
при условии, однако, что Y и Z одновременно не являются CR3 или N;
R3 представляет собой H, алкил, галоген, гидроксиалкил или фенил, необязательно замещенный 1-3 заместителями, выбранными из H, CF3, CN, SO2NH2, OH, алкила или алкокси;
m равно 0, 1 или 2;
R4 представляет собой H или алкил;
когда Z представляет собой CR3, тогда R3 и R4 вместе также могут представлять собой -(CH2)n1-, где n1 равно целому числу от 2 до 4, или R2 и R4 вместе также могут представлять собой
-(CH2)n2-, где n2 равно целому числу от 2 до 4;
R5 и R6 независимо представляют собой H, алкил, алкокси, арил или аралкил;
NR5R6 вместе также могут представлять собой (в частности): необязательно замещенный 2-(1,2,3,4-тетрагидрохинолин) радикал,
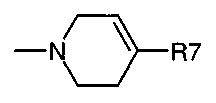
радикал, где R7 является одним из радикалов фенил, бензил или фенетил, где фенильное кольцо может быть замещенным;
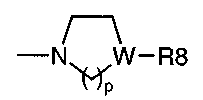
радикал, где p равно целому числу от 1 до 3,
W представляет собой N, и R8 представляет собой H, CF3, один из радикалов фенил, пиридил или пиримидинил, необязательно замещенных 1-2 радикалами, выбранными из галогена, OH, алкила или алкокси, или
W представляет собой CH, и R8 представляет собой необязательно замещенный фенил или аралкил, необязательно замещенный в арильной группе;
в качестве частичных агонистов или антагонистов допаминовых субрецепторов мозга или в качестве пролекарственных форм этих частичных агонистов или антагонистов. Таким образом, эти соединения могли бы обладать полезными свойствами для диагностики и лечения аффективных расстройств, таких как шизофрения и депрессия, а также определенных двигательных расстройств, таких как болезнь Паркинсона.
Также в патентной заявке WO 98/27108 были описаны некоторые амиды общей формулы (A2)
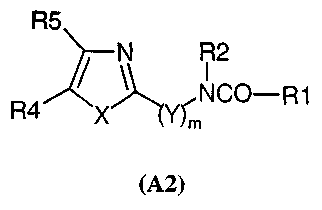
где
R1, в частности, представляет собой необязательно замещенный радикал алкил, фенил или необязательно замещенный радикал гетероциклический арил;
R2 представляет собой H или фенилалкил;
R4 представляет собой H, хинолил, 3-4-метилендиоксифенил или один из радикалов фенил или пиридил, необязательно замещенных одним или несколькими радикалами, выбранными, в частности, из алкила, алкокси, алкилтио, необязательно защищенного гидрокси, амино, алкиламино, диалкиламино;
R5 представляет собой H или радикал имидазолил, фенил, нитрофенил, фенилалкил, или также радикал -CO-N(R7)(R8), где R7 и R8 независимо представляют собой H, фенил, фенилалкил, алкил или алкокси;
или R4 и R5 в сочетании образуют группу формулы -CH=CH-CH=CH-;
Y представляет собой радикал фенилен, замещенный радикалом фенилом, фенокси или фенилалкокси, или группу формулы -CH(R3)-, где R3 представляет собой H или радикал формулы -(CH2)n-, где R6 представляет собой необязательно защищенный радикал гидрокси, ацил, карбокси, ациламино, алкокси, фенилалкокси, алкилтио, необязательно замещенный фенил, необязательно замещенный пиридил, пиразинил, пиримидинал, фурил, имидазолил, нафтил, N-алкилиндолил или 3,4-метилендиоксифенил, и n равно целому числу от 0 до 3;
R2 и R3, взятые вместе с несущим их атомом углерода, могут образовывать фенильную группу;
X представляет собой S или NR9;
R9 представляет собой H, радикал алкил или циклоалкил, или также радикал бензил, необязательно однозамещенный в своей фенильной части H, алкилом или алкокси;
которые являются ингибиторами синтазы NO и могут быть эффективны при лечении заболеваний, которые включают в себя, в частности, сердечно-сосудистую ишемию или ишемию мозга, кровоизлияние в мозг, расстройства центральной нервной системы, болезнь Альцгемера, рассеянный склероз, диабет, гепатит, мигрень, ревматоидный артрит и остеопороз.
С другой стороны, до этого самими заявителями в патентной публикации PCT WO 98/58934 были описаны производные амидина, обладающие способностью ингибировать синтазы NO и/или перекисное окисление липидов.
Совсем недавно в патентной заявке PCT/FROO/02805 заявителем были описаны некоторые промежуточные продукты с первой стадии синтеза амидина, описанного в патентной заявке PCT WO 98/58934, и, в общем виде, некоторые производные пятичленных гетероциклов, то есть продукты общей формулы (I), определенной ниже, обладающие, по крайней мере, одним из трех свойств, выбранных из нижеследующих свойств (и даже чаще двумя из этих трех свойств, а иногда и всеми тремя сразу):
- свойствами ингибирования MAO;
- свойствами ингибирования перекисного окисления липидов; и
- свойствами модулирования натриевых каналов.
Эти полезные свойства способны обеспечить возможность многочисленных применений таким соединениям, в частности, при лечении нейродегенеративных заболеваний и, в частности, тех, которые указаны ранее, боли или эпилепсии.
В соответствии с патентной заявкой WO 01/26656 соединения, соответствующие общей формуле (I)

в рацемической, энантиомерной форме или в виде сочетания этих форм, где Het представляет собой 5-членный гетероцикл, содержащий 2 гетероатома, и в виде общей формуле (I), соответствуют исключительно одной из следующих подформул:
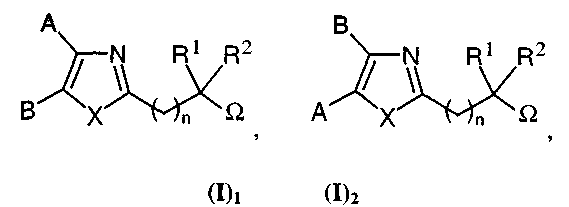
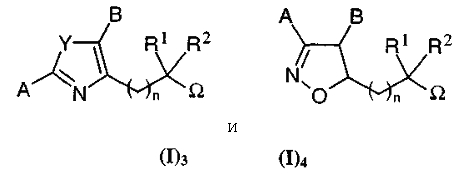
где
A представляет собой
либо радикал
где R3 представляет собой атом водорода, OH-группу или радикал алкокси или алкил,
либо радикал
где R4, R5, R6, R7 и R8 независимо представляют собой атом водорода, галоген, OH группу или радикал алкил, алкокси, циано, нитро или NR10R11,
R10 и R11 независимо представляют собой атом водорода, радикал алкил или группу -COR12, или R10 и R11 образуют вместе с атомом азота необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R12 представляет собой атом водорода или радикал алкил, алкокси или NR13R14,
R13 и R14 независимо представляют собой атом водорода или радикал алкил, или R13 и R14 вместе с атомом азота образуют необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R9 представляет собой атом водорода, радикал алкил или группу -COR15,
R15 представляют собой атом водорода или радикал алкил, алкокси или NR16R17,
R16 и R17 независимо представляют собой атом водорода или радикал алкил, или R16 и R17 образуют вместе с атомом азота необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы независимо выбраны из группы, включающей атомы O, N и S, указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
и W отсутствует или представляет собой связь, или -O-, -S- или -NR18-, где R18 представляет собой атом водорода или радикал алкил;
или
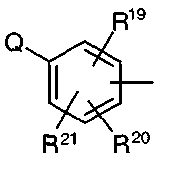
радикал, где Q представляет собой H, радикал -OR22, -SR22,
-NR23R24, фенил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из атома галогена, радикала OH, циано, нитро, алкила, алкокси или -NR10R11, и группа из двух заместителей вместе представляет собой радикал метилендиокси или этилендиокси, или Q также представляет собой радикал -COPh, -SO2Ph или -CH2Ph, указанный радикал -COPh, -SO2Ph или -CH2Ph, необязательно замещенный в своей ароматической части одним или несколькими заместителями, независимо выбранными из радикала алкил или алкокси и атома галогена,
R10 и R11 независимо представляют собой атом водорода, радикал алкил или группу -COR12, или R10 и R11 образуют вместе с атомом азота необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R12 представляет собой атом водорода, алкил, или алкокси, или радикал NR13R14,
R13 и R14 независимо представляют собой атом водорода или радикал алкил, или R13 и R14 вместе с атомом азота образуют необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R22 представляет собой атом водорода, радикал алкил или арил, необязательно замещенный одним или несколькими заместителями, выбранными из радикалов алкил, OH, галоген, нитро и алкокси,
R23 и R24 независимо представляют собой атом водорода, радикал алкил или радикал -CO-R25,
R25 представляет собой радикал алкил,
и R19, R20 и R21 независимо представляют собой водород, галоген, группу OH или SR26, или радикал алкил, циклоалкил, алкенил, алкокси, циано, нитро, -SO2NHR49, -CONHR55, -S(O)qR56,
-NH(CO)R57, -CF3, -OCF3 или NR27R28,
R26 представляет собой атом водорода или радикал алкил,
R27 и R28 независимо представляют собой атом водорода, радикал алкил или группу -COR29, или R27 и R28 образуют вместе с атомом азота необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R49 и R55 независимо представляют собой, каждый раз, когда они включены, атом водорода или радикал алкил или алкилкарбонил,
q равно целому числу от 0 до 2,
R56 и R57 независимо представляют собой, каждый раз, когда они включены, атом водорода или радикал алкил или алкокси,
R29 представляет собой атом водорода, радикал алкил, алкокси или -NR30R31,
R30 и R31 независимо представляют собой атом водорода или радикал алкил, или R30 и R31 образуют вместе с атомом азота необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
или

радикал, где R32 представляет собой атом водорода или радикал алкил, и Т представляет собой радикал -(CH2)m-, где m = 1 или 2,
или, наконец,
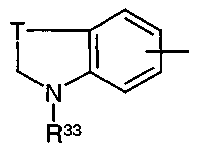
радикал, где R33 представляет собой атом водорода или радикал алкил, -Σ-NR34R35 или -Σ-CHR36R37,
Σ представляет собой линейный или разветвленный радикал алкилена, содержащий от 1 до 6 атомов углерода,
R34 и R35 независимо представляют собой атом водорода или радикал алкил,
R36 и R37 независимо представляют собой атом водорода или радикал карбоциклический или гетероциклический арил, необязательно замещенный одним или несколькими заместителями, выбранными из радикалов алкил, OH, галоген, нитро, алкокси или NR10R11,
R10 и R11 независимо представляют собой атом водорода, радикал алкил или группу -COR12, или R10 и R11 вместе с атомом азота образуют необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R12 представляет собой атом водорода или алкил, алкокси или радикал NR13R14,
R13 и R14 независимо представляют собой атом водорода или радикал алкил, или R13 и R14 вместе с атомом азота образуют необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином, и Т представляет собой радикал
-(CH2)m-, где m = 1 или 2,
или A также представляет собой радикал алкил, циклоалкил или циклоалкилалкил;
X представляет собой S или NR38,
R38 представляет собой атом водорода или радикал алкил, цианоалкил, аралкил, алкилкарбонил или аралкилкарбонил,
Y представляет собой О или S;
R1 представляет собой атом водорода, радикал алкил, аминоалкил, алкоксиалкил, циклоалкил, циклоалкилалкил, трифторметилалкил, алкенил, алленил, алленилалкил, алкинил, цианоалкил, -(СН2)g-Z1R39, -(CH2)g-COR40, -(CH2)g-NHCOR70, арил, аралкил, арилкарбонил, гетероарилалкил или аралкилкарбонил, где арильная группа радикалов арил, аралкил, арилкарбонил, гетероарилалкил или аралкилкарбонил, в свою очередь, необязательно замещена одним или несколькими заместителями, выбранных из группы, включающей радикалы алкил, галоген, алкокси, нитро, циано, цианоалкил, амино, алкиламино, диалкиламино, -(CH2)k-Z2R39 или -(CH2)k-COR40,
Z1 и Z2 представляют собой связь, -O-, -NR41- или -S-,
R39 и R41 независимо представляют собой, каждый раз, когда они включены, атом водорода или радикал алкил, алкенил, алкинил или цианоалкил,
R40 независимо представляет собой, каждый раз, когда он включен, атом водорода или радикал алкил, алленил, алленилалкил, алкенил, алкинил, цианоалкил, алкокси или NR42R43,
R42 и R43 независимо представляют собой, каждый раз, когда они включены, атом водорода или радикал алкил, алленил, алленилалкил, алкенил, алкинил или цианоалкил,
и R2 представляет собой атом водорода, радикал алкил, аминоалкил, алкоксиалкил, циклоалкил, циклоалкилалкил, трифторметилалкил или -(CH2)g-NHCOR71, или также один из радикалов аралкила или гетероарилалкила необязательно замещен в арильной или гетероарильной группе одним или несколькими группами, независимо выбранными из группы, содержащей атом галогена и радикал алкил радикал, алкокси, гидрокси, циано, нитро, амино, алкиламино или диалкиламино,
R70 и R71 независимо представляют собой радикал алкил или алкокси;
или R1 и R2, взятые вместе с несущим их атомом углерода, образуют карбоцикл с 3-7 членами;
В представляет собой атом водорода, радикал алкил, радикал -(CH2)g-Z3R44 или карбоциклический арильный радикал, необязательно 1-3 замещенный радикалами, выбранными из группы, содержащей атом галогена, линейный или разветвленный алкильный или алкокси радикал, содержащие от 1 до 6 атомов углерода, радикал гидрокси, циано или нитро, амино, алкиламино или диалкиламино радикал и карбоциклический арильный радикал,
Z3 представляет собой связь, -O-, -NR45- или -S-,
R44 и R45 независимо представляют собой атом водорода или радикал алкил, алкенил, алкинил, алленил, алленилалкил или цианоалкил;
Ω представляет собой один из радикалов NR46R47 или OR48, где:
R46 и R47 независимо представляют собой атом водорода или радикал алкил, циклоалкил, циклоалкилалкил, алкенил, алкинил, алленил, алленилалкил, цианоалкил, -(CH2)g-Z4R50, -(CH2)k-COR51,
-(CH2)k-COOR51, -(CH2)k-CONHR51 или -SO2R51, или также радикал, выбранный из радикалов арил, аралкил, арилоксиалкил, арилкарбонил, арилимино, аралкилкарбонил, гетероарил и, в частности, радикалы пиридинил, пиридинилалкил или пиридинилкарбонил, где арильная или гетероарильная группа указанных радикалов арил, аралкил, арилоксиалкил, арилкарбонил, арилимино, аралкилкарбонил, гетероарил, пиридинилалкил или пиридинилкарбонил необязательно замещена одним или несколькими заместителями, независимо выбранными из галогена, алкила, алкокси, гидрокси, нитро, циано, цианоалкила, амино, алкиламино, диалкиламино, -(CH2)kZ5R50, -(CH2)k-COR51 и -(CH2)k-COOR51,
Z4 и Z5 представляют собой связь, -O-, -NR52- или -S-,
или R46 и R47, взятые вместе с атомом азота, образуют неароматический гетероцикл с 4-8 членами, элементы цепи выбраны из группы, содержащей -CH(R53)-, -NR54-, -O-, -S- и -CO-, указанный гетероцикл может быть, например, азетидином, пиперазином, гомопиперазином, 3,5-диоксопиперазином, пиперидином, пирролидином, морфолином или тиоморфолином,
R50 и R52 независимо представляют собой, каждый раз, когда они включены, атом водорода или радикал алкил, алкенил, алкинил, алленил, алленилалкил или цианоалкил,
R51 независимо представляет собой, каждый раз, когда он включен, атом водорода, один из радикалов циклоалкил или циклоалкилалкил, где циклоалкил радикал содержит от 3 до 7 атомов углерода, линейный или разветвленный радикал алкил, содержащий от 1 до 8 атомов углерода, радикал алкенил, алкинил, алленил, алленилалкил, цианоалкил, алкоксиалкил или NR58R59, или также радикал арил или аралкил, где указанный радикал арил или аралкил может быть замещен одним или несколькими заместителями, независимо выбранными из атома галогена и радикала алкил или алкокси,
R58 и R59 независимо представляют собой атом водорода или радикал алкил, алкенил, алкинил, алленил, алленилалкил или цианоалкил,
R53 и R54 независимо представляют собой атом водорода или радикал -(CH2)k-Z7R60 или -(CH2)k-COR61,
Z7 представляет собой связь, -O-, -NR62- или -S-,
R60 и R62 независимо представляют собой атом водорода или радикал алкил, алкенил, алленил, алленилалкил, алкинил, цианоалкил, арил, аралкил, арилкарбонил, аралкилкарбонил, пиридинил, пиридинилалкил или пиридинилкарбонил, где арильная или пиридинильная группа радикала арил, аралкил, арилкарбонил, аралкилкарбонил, пиридинил, пиридинилалкил или пиридинилкарбонил необязательно замещена одним или несколькими заместителями, выбранными из группы, состоящей из радикалов алкил, галоген, нитро, алкокси, циано, цианоалкил, -(CH2)k-Z8R63 и -(CH2)k-COR64,
R61 представляет собой атом водорода, радикал алкил, алленил, алленилалкил, алкенил, алкинил, цианоалкил, алкокси или NR65R66,
R65 и R66 независимо представляют собой атом водорода или радикал алкил, алленил, алленилалкил, алкенил, алкинил или цианоалкил,
Z8 представляет собой связь, -O-, -NR67- или -S-,
R63 и R67 независимо представляют собой атом водорода, радикал алкил, алленил, алленилалкил, алкенил, алкинил или цианоалкил,
R64 представляет собой атом водорода, радикал алкил, алленилалкил, алкенил, алкенил, алкинил, цианоалкил, алкокси или NR68R69,
R68 и R69 независимо представляют собой атом водорода или радикал алкил, алленил, алленилалкил, алкенил, алкинил или цианоалкил,
и R48 представляет собой атом водорода или радикал алкил, алкинил или цианоалкил;
g и p, каждый раз, когда они включены, независимо равны целому числу от 1 до 6, и k и n, каждый раз, когда они включены, независимо равны целому числу от 0 до 6;
понятно, что, когда Het такой, что соединение общей формулы (I) соответствует общей подформуле (I)4, то:
A представляет собой радикал 4-гидрокси-2,3-ди-трет-бутилфенил;
B, R1 и R2 все представляют собой H; и, наконец,
Ω представляет собой OH;
или фармацевтически приемлемые соли соединений общей формулы (I);
могут использоваться с получением лекарственного средства, обладающего, по крайней мере, одним из следующих трех видов активности:
- ингибирование моноаминоксидаз, в частности, моноаминоксидазы B,
- ингибирование перекисного окисления липидов,
- проявление модулирующей активности в отношении натриевых каналов.
Это дает возможность соединениям общей формулы (I) быть эффективными при лечении вышеуказанных заболеваний, связанных с MAO, перекисным окислением липидов и натриевыми каналами.
Под алкилом, если не указанно иначе, подразумевают линейный или разветвленный радикал алкил, содержащий от 1 до 6 атомов углерода. Под циклоалкилом, если не указано иначе, подразумевают моноциклическую углеродную систему, содержащую от 3 до 7 атомов углерода. Под алкенилом, если не указано иначе, подразумевают линейный или разветвленный радикал алкил, содержащий от 1 до 6 атомов углерода и имеющий, по крайней мере, одну ненасыщенность (двойная связь). Под алкинилом, если не указано иначе, подразумевают линейный или разветвленный радикал алкил, содержащий от 1 до 6 атомов углерода, и имеющий, по крайней мере, одну двойную ненасыщенность (тройная связь). Под алленилом подразумевают радикал -CH=C=CH2. Под карбоциклическим или гетероциклическим арилом подразумевают карбоциклическую систему (в частности, радикал фенил, который может быть обозначен аббревиатурой Ph) или гетероциклическую систему, содержащую, по крайней мере, одно ароматическое кольцо, система является гетероциклической, когда, по крайней мере, одно из колец, содержащееся в ней, содержит гетероатом (O, N или S). Под гетероциклом подразумевают моно- или полициклическую систему, где указанная система включает в себя, по крайней мере, один гетероатом, выбранный из O, N и S, и является насыщенной, частично или полностью ненасыщенной или ароматической. Под гетероарилом подразумевают гетероцикл, определенный выше, где, по крайней мере, одно из образующих его колец является ароматическим. Под галогеналкилом подразумевают радикал алкил, по крайней мере, один (и, необязательно, все) из атомов водорода которого замещен атомом галогена.
Более того, если не указано иначе, под необязательно замещенным радикалом подразумевают радикал, содержащий один или несколько заместителей, независимо выбранных из группы, содержащей атом галогена и радикалы алкил и алкокси.
Под радикалами алкилтио, алкокси, галогеналкил, алкоксиалкил, трифторметилалкил, циклоалкилалкил, галогеналкокси, аминоалкил, алкенил, алкинил, алленилалкил, цианоалкил и аралкил подразумевают, соответственно, радикалы алкилтио, алкокси, галогеналкил, алкоксиалкил, трифторметилалкил, циклоалкилалкил, галогеналкокси, аминоалкил, алкенил, алкинил, алленилалкил, цианоалкил и аралкил, в которых радикал алкил (алкильные радикалы) имеет(ют) значение(я), приведенное(ые) выше.
Под гетероциклом подразумевают, в частности, радикалы тиофен, пиперидин, пиперазин, хинолин, индолин и индол. Под линейным или разветвленным алкилом, содержащим от 1 до 6 атомов углерода, подразумевают, в частности, радикалы метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил, пентил, неопентил, изопентил, гексил, изогексил. Наконец, под галогеном подразумевают атомы фтора, хлора, брома или йода.
Настоящее изобретение относится к выбранному ряду соединений общей формулы (I), представленной выше, а именно к следующим соединениям:
- 2,6-ди-трет-бутил-4-{2-[2-(метиламино)этил]-1,3-тиазол-4-ил}фенолу (далее соединение 1);
- 2,6-ди-трет-бутил-4-[4-(гидроксиметил)-1,3-оксазол-2-ил]фенолу (далее соединение 2);
- 2,6-ди-трет-бутил-4-{2-[1-(метиламино)этил]-1,3-тиазол-4-ил}фенолу (далее соединение 3);
- 2,6-ди-трет-бутил-4-[2-(метоксиметил)-1,3-тиазол-4-ил]фенолу (далее соединение 4);
- 2,6-ди-трет-бутил-4-{4-[(метиламино)метил]-1,3-оксазол-2-ил}фенолу (далее соединение 5);
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}ацетамиду (далее соединение 6);
- этил [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метилкарбамату (далее соединение 7);
- 2,6-ди-трет-бутил-4-[2-(морфолин-4-илметил)-1,3-тиазол-4-ил]фенолу (далее соединение 8);
- 2,6-ди-трет-бутил-4-[2-(тиоморфолин-4-илметил)-1,3-тиазол-4-ил]фенолу (далее соединение 9);
- 4-[2-(анилинометил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенолу (далее соединение 10);
- 2,6-ди-трет-бутил-4-(2-{[[2-(диметиламино)этил](метил)амино]метил}-1,3-тиазол-4-ил)фенолу (далее соединение 11);
- 2,6-ди-трет-бутил-4-{5-метил-2-[(метиламино)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 12);
- 1-[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанамину (далее соединение 13);
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-N-метилацетамиду (далее соединение 14);
- 1-[4-(3,5-ди-трет-бутил-4-метоксифенил)-1,3-тиазол-2-ил]-N-метилметанамину (далее соединение 15);
- 2,6-ди-трет-бутил-4-{2-[(этиламино)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 16);
- 2,6-ди-трет-бутил-4-{2-[(4-фенилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 17);
- 2,6-ди-трет-бутил-4-{2-[(4-метил-1,4-диазепан-1-ил)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 18);
- N-{1-[4-(4-анилинофенил)-1,3-тиазол-2-ил]этил}-N-метиламину (далее соединение 19);
- 2,6-ди-трет-бутил-4-{2-[(изопропиламино)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 20);
- 2,6-ди-трет-бутил-4-{2-[(циклогексиламино)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 21);
- 2,6-ди-трет-бутил-4-{2-[(4-изопропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 22);
- N-метил-1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]этанамину (далее соединение 23);
- 2,6-ди-трет-бутил-4-{2-[(4-этилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 24);
- N-{[4-(4-анилинофенил)-1,3-тиазол-2-ил]метил}-N-этиламину (далее соединение 25);
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}этанамину (далее соединение 26);
- 2,6-ди-трет-бутил-4-(2-{[4-(диметиламино)пиперидин-1-ил]метил}-1,3-тиазол-4-ил)фенолу (далее соединение 27);
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-олу (далее соединение 28);
- 4-метилпентил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамату (далее соединение 29);
- 3,3-диметилбутил 2-[4-(4-пирролидин-1-илфенил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 30);
- изопентил 2-[4-(1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 31);
- гексил 2-[4-(4'-бром-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 32);
- бензил 2-[4-(4-трет-бутилфенил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 33);
- 3,3-диметилбутил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамату (далее соединение 34);
- гексил 2-[4-(4-пирролидин-1-илфенил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 35);
- гексил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1Н-имидазол-2-ил]этилкарбамату (далее соединение 37);
- 3,3-диметилбутил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 38);
- 3,3-диметилбутил 2-[4-(4-метоксифенил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 39);
- бензил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 40);
- бензил 2-[4-(4-пирролидин-1-илфенил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 41);
- 2-фенилэтил 2-[4-(1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 42);
- бутил 2-[4-(4'-фтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 43);
- бутил 2-[4-(1,1'-бифенил-4-ил)-5-метил-1H-имидазол-2-ил]этилкарбамату (далее соединение 44);
- бутил 2-[4-(4'-метил-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 45);
- бутил 2-[4-(4'-хлор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 46);
- бутил 2-[4-(2'-фтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 47);
- бутил 2-[4-(2',4'-дифтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 49);
- 2,6-ди-трет-бутил-4-{2-[(пропиламино)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 50);
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}-N-пропиламину (далее соединение 51);
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}бутан-1-амину (далее соединение 52);
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пентан-1-амину (далее соединение 53);
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-3-олу (далее соединение 54);
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-олу (далее соединение 55);
- [4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанолу (далее соединение 56);
- N,N-диметил-N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амину (далее соединение 57);
- 2-{2-[(4-метилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10Н-фенотиазину (далее соединение 58);
- 2-[2-(пиперидин-1-илметил)-1,3-тиазол-4-ил]-10Н-фенотиазину (далее соединение 59);
- 2-[2-(пиперазин-1-илметил)-1,3-тиазол-4-ил]-10H-фенотиазину (далее соединение 60);
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}азетидин-3-олу (далее соединение 61);
- 2-[2-(морфолин-4-илметил)-1,3-тиазол-4-ил]-10Н-фенотиазину (далее соединение 62);
- 2-[2-(тиоморфолин-4-илметил)-1,3-тиазол-4-ил]-10Н-фенотиазину (далее соединение 63);
- 2-{2-[(4-метил-1,4-диазепан-1-ил)метил]-1,3-тиазол-4-ил}-10Н-фенотиазину (далее соединение 64);
- (3R)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-олу (далее соединение 65);
- (3S)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-олу (далее соединение 66);
- 2,6-ди-трет-бутил-4-[2-(пирролидин-1-илметил)-1,3-тиазол-4-ил]фенолу (далее соединение 67);
- 2,6-ди-трет-бутил-4-{2-[(бутиламино)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 68);
- 2-{2-[(4-этилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10Н-фенотиазину (далее соединение 69);
- N-метил-N-{[4-(10Н-фенотиазин-2-ил)-1H-имидазол-2-ил]метил}амину (далее соединение 70);- метил [4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамату (далее соединение 71);
- бутил [4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамату (далее соединение 72);
- N-неопентил-N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амину (далее соединение 73);
- 1-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперидин-4-олу (далее соединение 74);
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}ацетамиду (далее соединение 75);
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}бутанамиду (далее соединение 76);
- 2,6-ди-трет-бутил-4-{2-[(4-пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 77);
- 2,6-ди-трет-бутил-4-{2-[2-метил-1-(метиламино)пропил]-1,3-тиазол-4-ил}фенолу (далее соединение 78);
- N,2-диметил-1-[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]пропан-1-амину (далее соединение 79);
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}гексанамиду (далее соединение 80);
- (3R)-1-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пирролидин-3-олу (далее соединение 81);
- (3S)-1-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пирролидин-3-олу (далее соединение 82);
- 1-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}азетидин-3-олу (далее соединение 83);
- 2-{2-[(4-пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10Н-фенотиазину (далее соединение 84);
- 2-{2-[(4-ацетилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10Н-фенотиазину (далее соединение 85);
- 2-{2-[(4-бутилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10Н-фенотиазину (далее соединение 86);
- метил 4-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилату (далее соединение 87);
- 4-[2-(аминометил)-1H-имидазол-4-ил]-2,6-ди-трет-бутилфенолу (далее соединение 88);
- 4-{2-[(бензиламино)метил]-1,3-тиазол-4-ил}-2,6-ди-трет-бутилфенолу (далее соединение 89);
- 4-{2-[(4-ацетилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-2,6-ди-трет-бутилфенолу (далее соединение 90);
- N-метил-N-{[4-(10Н-феноксазин-2-ил)-1,3-тиазол-2-ил]метил}амину (далее соединение 91);
- 4-[2-(азетидин-1-илметил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенолу (далее соединение 92);
- 2,6-ди-трет-бутил-4-{2-[(4-бутилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенолу (далее соединение 93);
- бутил 2-[4-(3'-хлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамату (далее соединение 94);
- бутил 2-[4-(3'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамату (далее соединение 95);
-бутил 2-[4-(4-изобутилфенил)-1Н-имидазол-2-ил]этилкарбамату (далее соединение 96);
- бензил 2-[4-(4-изобутилфенил)-1Н-имидазол-2-ил]этилкарбамату (далее соединение 97);
- бутил 2-[4-(3'-хлор-4'-фтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 98);
- бутил 2-[4-(3',4'-дихлор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 99);
- бутил 2-[4-(4-пропилфенил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 100);
- бутил 2-[4-(4-этилфенил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 101);
- бутил 2-[4-(4'-циано-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 102);
- бутил 2-[4-(1,1'-бифенил-4-ил)-5-этил-1H-имидазол-2-ил]этилкарбамату (далее соединение 104);
- бутил 2-[4-(2'-хлор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 105);
- бутил 2-[4-(2',3'-дифтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 106);
- бутил 2-[4-(2'-бром-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамату (далее соединение 107);
- бутил 2-[4-(3',5'-дифтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 108);
- бутил 2-[4-(2'-метокси-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 109);
- бутил 2-[4-(3'-нитро-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 110);
- бутил 2-[4-(2',5'-дифтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 111);
- бутил 2-[4-(3'-метокси-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамату (далее соединение 112);
- метил 4-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилату (далее соединение 113);
- метил [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метилкарбамату (далее соединение 114);
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}бензамиду (далее соединение 115);
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-2-фенилацетамиду (далее соединение 116);
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пропанамиду (далее соединение 117);
- ацетат 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-илу (далее соединение 118);
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3,4-диолу (далее соединение 119);
и солям последних.
В частности, данное изобретение относится к соединениям 1-112 и их солям и, в частности, к соединениям 1-49 и их солям.
В соответствии с предпочтительными вариантами изобретения, эти соединения обладают, по крайней мере, двумя видами активности, указанными выше. В частности, они и ингибируют MAO, и улавливают ROS, или они обладают и антагонистической активностью в отношении натриевых каналов, и активностью улавливания ROS. В некоторых случаях соединения общей формулы (I) сочетают в себе даже три вида активности.
В соответствии с конкретным вариантом изобретения, когда соединения по данному изобретению обладают в основном ингибирующей активностью в отношении MAO и/или ROS, они предпочтительно выбраны из соединений 1-28, 50-93 и 113-119 и солей этих соединений (в частности, из соединений 1-28 и 50-93 и солей этих соединений и, в частности, из соединений 1-28 и солей этих соединений).
Более предпочтительно, соединения по данному изобретению, когда они обладают ингибирующей активностью в отношении MAO и/или ROS, выбраны из соединений 1, 3, 6-8, 12, 13, 15, 16, 18-20, 22-28, 50-62, 64-71, 73-86, 89, 91-93 и 119 и солей этих соединений (в частности, из соединений 1, 3, 6-8, 12, 13, 15, 16, 18-20, 22-28, 50-62, 64-71, 73-86, 89 и 91-93 и солей этих соединений и, в частности, из соединений 1, 3, 6-8, 12, 13, 15, 16, 18-20 и 22-28 и солей этих соединений).
Еще более предпочтительно, соединения по данному изобретению, когда они обладают ингибирующей активностью в отношении MAO и/или ROS, выбраны из соединений 1, 3, 6-8, 12, 13, 15, 16, 18-20, 22-24, 26, 28, 50-52, 54, 55, 57, 58, 61, 62, 65-69, 73, 75, 77-82, 86, 89, 91, 92 и 119 и солей этих соединений (в частности, из соединений 1, 3, 6-8, 12, 13, 15, 16, 18-20, 22-24, 26, 28, 50-52, 54, 55, 57, 58, 61, 62, 65-69, 73, 75, 77-82, 86, 89, 91 и 92 и солей этих соединений и, в частности, из соединений 1, 3, 6-8, 12, 13, 15, 16, 18-20, 22-24, 26 и 28 и солей этих соединений).
В частности, соединения по данному изобретению, когда они обладают ингибирующей активностью в отношении MAO и/или ROS, выбраны из соединений 1, 3, 6, 15, 16, 18, 20, 23, 24, 26, 28, 50, 52, 55, 61, 65-69, 77, 78, 79, 81, 86, 89, 91, 92 и 119 и солей этих соединений (в частности, из соединений 1, 3, 6, 15, 16, 18, 20, 23, 24, 26, 28, 50, 52, 55, 61, 65-69, 77, 78, 79, 81, 86, 89, 91 и 92 и солей этих соединений и, в частности, из соединений 1, 3, 6, 15, 16, 18, 20, 23, 24, 26 и 28 и солей этих соединений).
Более предпочтительно, соединения по данному изобретению, когда они обладают ингибирующей активностью в отношении MAO и/или ROS, выбраны из соединений 3, 15, 16, 20, 23, 26, 28, 50, 55, 61, 65-68, 78, 79, 91 и 92 и солей этих соединений (в частности, из соединений 3, 15, 16, 20, 23, 26 и 28 и солей этих соединений).
Еще более предпочтительно, соединения по данному изобретению, когда они обладают ингибирующей активностью в отношении MAO и/или ROS, выбраны из соединений 3, 15, 16, 28, 55, 61, 65, 66 и 79 и солей этих соединений (в частности, из соединений 3, 15, 16 и 28 и солей этих соединений).
В соответствии с другим вариантом изобретения, когда соединения по данному изобретению в основном обладают модулирующей активностью в отношении натриевых каналов, то они, предпочтительно, выбраны из соединений 1, 3, 5, 12, 15, 16, 29-35, 37-47, 49, 94-102 и 104-112 и солей этих соединений (в частности, из соединений 1, 3, 5, 12, 15, 16, 29-35, 37-47 и 49 и солей этих соединений).
Более предпочтительно, соединения по данному изобретению, обладающие модулирующей активностью в отношении натриевых каналов, выбраны из соединений 3, 15, 16, 29-35, 37-47, 49, 94-102 и 104-112 и солей этих соединений (в частности, из соединений 1, 3, 5, 12, 15, 16, 29-35, 37-47 и 49 и солей этих соединений).
Еще более предпочтительно, соединения общей формулы (I), обладающие модулирующей активностью в отношении натриевых каналов, выбраны из соединений 30, 37, 42, 44-46, 48, 49, 106, 108, 109 и 112 и солей этих соединений (в частности, из соединений 30, 37, 42, 44-46, 48 и 49 и солей этих соединений).
Далее, соединения, главным образом обладающие ингибирующей активностью в отношении перекисного окисления липидов, предпочтительно выбраны из соединений 1-28, 37, 38, 40, 50-93 и 113-119 и солей этих соединений (в частности, из соединений 1-28, 37, 38, 40 и 50-93 и солей этих соединений и, в частности, из соединений 1-28, 37, 38 и 40 и солей этих соединений).
Более предпочтительно, соединения, в основном обладающие ингибирующей активностью в отношении перекисного окисления липидов, предпочтительно выбраны из соединений 1-28, 50-62, 64-93 и 113-119 и солей этих соединений (в частности, из соединений 1-28, 50-62 и 64-93 и солей этих соединений и, в частности, из соединений 1-28 и солей этих соединений).
Еще более предпочтительно, соединения, в основном обладающие ингибирующей активностью в отношении перекисного окисления липидов, предпочтительно выбраны из соединений 13, 18, 19, 22-27, 51-53, 55-60, 62, 64, 69, 73-76, 79, 81-86 и 91 и солей этих соединений (в частности, из соединений 13, 18, 19 и 22-27 и солей этих соединений).
В частности, соединения, в основном обладающие ингибирующей активностью в отношении перекисного окисления липидов, предпочтительно выбраны из соединений 13, 23, 58, 64, 81, 82 и 91 и солей этих соединений (в частности, из соединений 13 и 23 и солей этих соединений).
Далее, изобретение относится к выбранным соединениям, указанным выше, и их фармацевтически приемлемым солям в качестве лекарственных средств. Изобретение также относится к композициям, содержащим в качестве активного ингредиента, по крайней мере, одно из выбранных соединений, указанных выше, или фармацевтическую соль одного из этих соединений.
Целью данного изобретения также является применение одного из выбранных соединений, указанных выше, или фармацевтически приемлемой соли одного из этих соединений, с получением лекарственного средства, обладающего, по крайней мере, одним из трех следующих видов активности:
- ингибирование моноаминоксидаз, в частности моноаминоксидазы B,
- ингибирование перекисного окисления липидов,
- проявление модулирующей активности в отношении натриевых каналов.
В частности, настоящее изобретение относится к применению одного из выбранных соединений, указанных выше, или фармацевтически приемлемой соли одного из этих соединений, с получением лекарственного средства, предназначенного для лечения одного из следующих расстройств или заболеваний: болезни Паркинсона, старческого слабоумия, болезни Альцгеймера, хореи Гантингтона, бокового амиотрофического склероза, шизофрении, депрессии, психоза, мигрени или боли и, в частности, невропатической боли.
Изобретение, кроме того, относится к соединениям общей формулы (I'), общая формула идентична общей формуле (I), за исключением того, что:
(a) либо A заменен на радикал A'
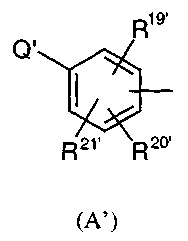
где Q' представляет собой радикал фенил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из атома галогена, радикала OH, циано, нитро, алкила, галогеналкила, алкокси, алкилтио или -NR10'R11', и группа из двух заместителей вместе представляет собой радикал метилендиокси или этилендиокси,
R10' и R11' независимо представляют собой атом водорода, радикал алкил или группу -COR12', или R10' и R11' образуют вместе с атомом азота необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, где указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R12' представляет собой атом водорода, алкил, или алкокси, или радикал NR13'R14',
R13' и R14' независимо представляют собой атом водорода или радикал алкил, или R13' и R14' образуют вместе с атомом азота необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, где указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
и R19', R20' и R21' независимо представляют собой водород, галоген, OH или группу SR26', или радикал алкил, циклоалкил, алкенил, алкокси, алкилтио, циано, нитро, -SO2NHR49', -CONHR55', -S(O)qR56', -NH(CO)R57', -CF3, -OCF3 или NR27'R28',
R26' представляет собой атом водорода или радикал алкил,
R27' и R28' независимо представляют собой атом водорода, радикал алкил или группу -COR29', или R27' и R28' вместе с атомом азота образуют необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, где указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R49' и R55' независимо представляют собой, каждый раз, когда они включены, атом водорода, или радикал алкил, или алкилкарбонил,
q представляет собой целое число от 0 до 2,
R56' и R57' независимо представляют собой, каждый раз, когда они включены, атом водорода, или радикал алкил, или алкокси,
R29' представляет собой атом водорода, радикал алкил, алкокси или -NR30'R31',
R30' и R31' независимо представляют собой атом водорода или радикал алкил, R30' и R31' вместе с атомом азота образуют необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, где указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R51, более того, заменен на радикал R51', указанный радикал R51' представляет собой один из радикалов, определенных для R51 в общей формуле (I), или радикал галогеналкил,
понятно, что либо Q' представляет собой радикал фенил, замещенный, по крайней мере, одним галогеналкильным радикалом, либо, по крайней мере, один из Q', R19', R20' и R21' представляет собой радикал алкилтио;
(b) либо Ω заменен радикалом Ω', где указанный радикал Ω' представляет собой радикал NR46R47, где один из R46' и R47' представляет собой радикал -COOR51' и другой представляет собой атом водорода, R51' представляет собой радикал галогеналкил;
и солям указанных соединений.
В частности, данный аспект изобретения относится к соединению общей формулы (I'), общая формула идентична общей формуле (I), за исключением того, что:
(a) либо A заменен на радикал A'
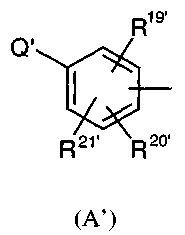
где Q' представляет собой радикал фенил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из атома галогена, радикала OH, циано, нитро, алкила, алкокси, алкилтио или -NR10'R11', и группа из двух заместителей представляет собой вместе радикал метилендиокси или этилендиокси,
R10' и R11' независимо представляют собой атом водорода, радикал алкил или группу -COR12', или R10' и R11' вместе с атомом азота образуют необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, где указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R12' представляет собой атом водорода, радикал алкил, или алкокси, или NR13'R14',
R13' и R14' независимо представляют собой атом водорода или радикал алкил, или R13' и R14' вместе с атомом азота образуют необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, где указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
и R19', R20' и R21' независимо представляют собой водород, галоген, OH или группу SR26', или радикал алкил, циклоалкил, алкенил, алкокси, алкилтио, циано, нитро, -SO2NHR49', -CONHR55', -S(O)qR56', -NH(CO)R57', -CF3, -OCF3 или NR27'R28',
R26' представляет собой атом водорода или радикал алкил,
R27' и R28' независимо представляют собой атом водорода, радикал алкил или группу -COR29', или R27' и R28' вместе с атомом азота образуют необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, где указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R49' и R55' независимо представляют собой, каждый раз, когда они включены, атом водорода, или радикал алкил, или алкилкарбонил,
q представляет собой целое число от 0 до 2,
R56' и R57' независимо представляют собой, каждый раз, когда они включены, атом водорода, или радикал алкил, или алкокси,
R29' представляет собой атом водорода, алкил, алкокси или радикал -NR30'R31',
R30' и R31' независимо представляют собой атом водорода или радикал алкил, R30' и R31' вместе с атомом азота образуют необязательно замещенный гетероцикл, содержащий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже имеющийся атом азота, дополнительные гетероатомы, независимо выбранные из группы, включающей атомы O, N и S, где указанный гетероцикл может быть, например, азетидином, пирролидином, пиперидином, пиперазином, морфолином или тиоморфолином,
R51, более того, замещен радикалом R51', указанный радикал R51' представляет собой один из радикалов, определенных в R51 в общей формуле (I), или радикал галогеналкил,
понятно, что, по крайней мере, один Q', R19', R20' и R21' представляет собой радикал алкилтио;
(b) либо Ω заменен радикалом Ω', где указанный радикал Ω' представляет собой радикал NR46R47, где один из R46' и R47' представляет собой радикал -COOR51' и другой представляет собой атом водорода, R51' представляет собой радикал галогеналкил;
и солям указанных соединений.
В случае (a) соединения общей формулы (I') предпочтительно такие, что n равно 0 или 1, и Ω представляет собой радикал NR46R47 (когда n = 1, то один из R46 и R47 предпочтительно представляет собой радикал COOR51). Аналогичным образом, R1 и R2, предпочтительно, независимо выбраны из группы, состоящей из атома водорода и радикала алкил или циклоалкил (и, предпочтительно, радикала метил). Еще предпочтительней, в случае (a) соединения общей формулы (I') соответствуют соединениям общей подформулы (I)1 или (I)2, X предпочтительно представляет собой S или NH и, более предпочтительно, NH. Кроме того, радикал алкилтио предпочтительно представляет собой радикал этилтио или метилтио, более предпочтительно, радикал метилтио.
В случае (b) соединения общей формулы (I') предпочтительно такие, что n равно 0 или 1 (и, предпочтительно, 1). Аналогичным образом, R1 и R2 предпочтительно представляют собой атомы водорода. Более того, еще предпочтительней, в случае (b) радикал галогеналкил предпочтительно представляет собой радикал, замещенный исключительно одним или несколькими атомами фтора (например, радикал 4,4,4-трифторбутил). Также предпочтительно в случае (b), что соединения общей формулы (I') соответствуют соединениям общей подформулы (I)1 или (I)2, X предпочтительно представляет собой S или NH, и, более предпочтительно, NH.
Данное изобретение, следовательно, также, в частности, относится к следующим соединениям общей формулы (I'):
- бутил 2-{4-[4'-(метилтио)-1,1'-бифенил-4-ил]-1H-имидазол-2-ил}этилкарбамату;
- 4,4,4-трифторбутил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамату;
- бутил 2-{4-[4'-(трифторметил)-1,1'-бифенил-4-ил]-1H-имидазол-2-ил}этилкарбамату;
и солям указанных соединений;
и, в частности:
- бутил 2-{4-[4'-(метилтио)-1,1'-бифенил-4-ил]-1H-имидазол-2-ил}этилкарбамату;
- 4,4,4-трифторбутил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамату;
и солям указанных соединений.
Кроме того, изобретение относится к соединениям общей формулы (I'), определенной выше, и к их фармацевтически приемлемым солям в качестве лекарственных средств. Изобретение также относится к композициям, содержащим в качестве активного ингредиента, по крайней мере, одно соединение общей формулы (I'), определенной выше, или фармацевтически приемлемую соль одного из этих соединений.
Объектом данного изобретения также является применение одного из соединений общей формулы (I'), определенной выше, или фармацевтически приемлемой соли одного из этих соединений, с получением лекарственного средства, обладающего, по крайней мере, одним из трех следующих видов активности:
- ингибирование моноаминоксидаз, в частности моноаминоксидазы B,
- ингибирование перекисного окисления липидов,
- проявление модулирующуй активности в отношении натриевых каналов.
В частности, настоящее изобретение относится к применению одного из соединений общей формулы (I'), указанной выше, или фармацевтически приемлемой соли одного из этих соединений, с получением лекарственного средства, предназначенного для лечения одного из следующих расстройств или заболеваний: болезни Паркинсона, старческого слабоумия, болезни Альцгеймера, хореи Гантингтона, бокового амиотрофическиого склероза, шизофрении, депрессии, психоза, мигрени или боли и, в частности, невропатической боли.
В некоторых случаях соединения по настоящему изобретению могут содержать ассиметрические атомы углерода. Поэтому соединения по настоящему изобретению быть в двух возможных энантиомерных формах, то есть в «R» и «S» конфигурациях. К настоящему изобретению относятся две энантиомерные формы и все комбинации этих форм, включая «RS» рецемические смеси. Для простоты, если не указано конкретной конфигурации в структурных формулах или названиях соединений, то понятно, что представлены две энантиомерные формы и их смеси.
Изобретение также относится к соединениям, указанным выше, или их фармацевтически приемлемым солям в качестве лекарственных средств. Аналогично, оно относится к фармацевтически приемлемым композициям, содержащим в качестве активного ингредиента указанные соединения или их фармацевтически приемлемые соли, а также к применению этих соединений и их фармацевтически приемлемых солей с получением лекарственного средств, предназначенного для ингибирования моноаминоксидаз, в частности моноаминоксидазы B, для ингибирования перекисного окисления липидов, имеющего модулирующую активность в отношении натриевых каналов, или обладающим двумя из трех или тремя вышеуказанными активностями.
В частности, соединения по данному изобретению могут использоваться с получением лекарственного средства, предназначенного для лечения одного из следующих расстройств или заболеваний: болезни Паркинсона, старческого слабоумия, болезни Альцгеймера, хореи Гантингтона, бокового амиотрофического склероза, шизофрении, депрессии, психоза, мигрени или боли и, в частности, невропатической боли. Более конкретно, соединения, представленные как ингибирующие MAO и/или ROS, могут использоваться для лечения одного из следующих расстройств или заболеваний: болезни Паркинсона, старческого слабоумия, болезни Альцгеймера, хореи Гантингтона, бокового амиотрофического склероза, шизофрении, депрессии, психоза; и соединения, представленные как обладающие модулирующей активностью в отношении натриевых каналов, могут использоваться для лечения следующих расстройств или заболеваний: болезни Паркинсона, болезни Альцгеймера, бокового амиотрофического склероза, мигрени или боли и, в частности, невропатической боли.
Под солью в данной заявке подразумевают, в частности, соли добавления неорганических или органических кислот, а также соли, образованные с помощью оснований.
Под фармацевтически приемлемой солью подразумевают, в частности, соли добавления неорганических кислот, такие как гидрохлорид, гидробромид, гидройодид, сульфат, фосфат, дифосфат и нитрит, или органических кислот, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, памоат и стеарат. Также в рамки настоящего изобретения входят соли, образованные с помощью оснований, таких как гидроксид натрия или калия, когда они могут быть использованы. Ссылка на другие примеры фармацевтически приемлемых солей может быть дана в «Salt selection for basic drugs», Int. J. Pharm. (1986), 33, 201-217.
Фармацевтическая композиция может быть в виде твердого продукта, например порошки, гранулы, таблетки, желатиновые капсулы, липосомы или суппозитории. Соответствующими твердыми носителями могут быть, например, фосфат кальция, стеарат магния, тальк, сахар, лактоза, декстрин, крахмал, желатин, целлюлоза, метилцеллюлоза, натрий карбоксиметил целлюлоза, поливинилпирролидин и воск. Фармацевтические композиции, содержащие соединение по данному изобретению, также могут быть представлены в виде жидкости, например растворы, эмульсии, суспензии или сиропы. Соответствующими жидкими носителями могут быть, например, вода, органические растворители, такие как глицерин или гликоли, а также их смеси в различных пропорциях в воде.
Введение лекарственного средства согласно данному изобретению может происходить местным, пероральным, парентеральным путем, путем внутримышечной инъекции и тому подобное.
Вводимая доза, предусмотренная для лекарственных средств по данному изобретению, составляет от 0,1 мг до 10 г, в зависимости от типа используемого активного соединения.
В соответствии с данным изобретением, соединения общей формулы (I) могут быть получены с помощью способов, описанных ниже.
Получение соединений по изобретению
Общая информация
Получения соединений по данному изобретению, где Ω представляет собой OH, осуществляют способами, аналогичными описанным в патентной заявке PCT WO 99/09829 и в европейской патентной заявке EP 432740.
Что касается соединений по данному изобретению, где Het представляет собой имидазольное кольцо, специалист в данной области также может с успехом обратиться к патентной заявке PCT WO 99/64401.
Получение других соединений по данному изобретению осуществляют способами, аналогичными описанным в патентной заявке PCT WO 98/58934 (см., в частности, стр. 39-45 данного документа, синтезы промежуточных соединений формул (XXV) и (XXVIII)) или соответствует способам, описанным ниже.
Более того, соединения общей формулы (I') получали способом, аналогичным способу получения соединений общей формулы (I); анализ описания, который следует ниже для соединений общей формулы (I), может в целом распространяться на синтез соединений общей формулы (I').
Получение соединений общей формулы (I)
Соединения общей формулы (I) могут быть получены 8 синтетическими путями, проиллюстрированными ниже (диаграмма 1) из промежуточных соединений общих формул (IV), (V), (VI), (VII), (VIII), (IX), (X) и (I)a, где A, B, Ω, R1, R2, Het и n такие, как определено выше, L представляет собой удаляемую группу, такую как, например, галоген, Alk представляет собой радикал алкил, Gp представляет собой защитную группу для аминной функциональной группы, например группу 2-(триметилсилил)этоксиметил (SEM), и Gp' представляет собой защитную группу для спиртовой функциональной группы, например группу типа бензил, ацетат или также силил, такой как трет-бутилдиметилсилил, и, наконец, Λ представляет собой связь или радикал -(CH2)X-, -CO-(CH2)X-, -(CH2)y-O- или -C(=NH)-. Разумеется, специалист в данной области может выбрать для использования другие защитные группы Gp и Gp' из известных ему групп и, в частности, из тех, которые указаны в: Protective groups in organic synthesis, 2-ое издание, (John Wiley & Sons Inc., 1991).
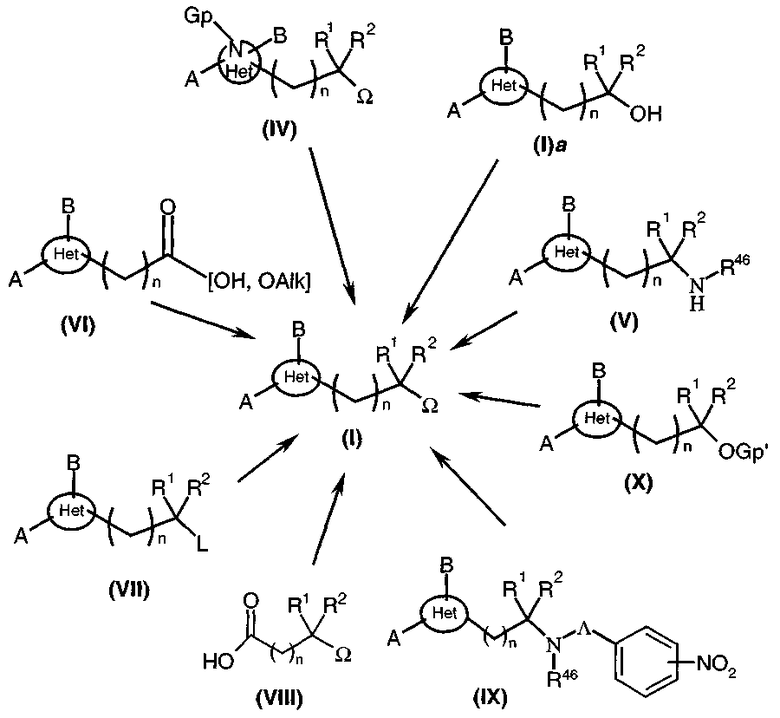
Диаграмма 1
Путь 1: Het представляет собой имидазол, и Ω представляет собой NR46R47, но не радикал карбаматного типа
Амины и карбоксамиды общей формулы (I), диаграмма 2, где A, B, R1, R2, R46, R47, Het и n такие, как определено выше, получают путем удаления защиты, в случае, когда Gp представляет собой SEM, с помощью фторида трет-бутиламмония (TBAF) в ТГФ, у амина общей формулы (IV) для освобождения амина в гетероцикле соединения общей формулы (I). Защищенные амины общей формулы (IV) могут быть получены общим путем синтеза, описанным в Biorg. и Med. Chem. Lett., 1993, 3, 915 и Tetrahedron Lett., 1993, 34, 1901 и, более предпочтительно, в патентной заявке PCT WO 98/58934.

Диаграмма 2
Путь 2: Het представляет собой имидазол, оксазол или тиазол, и Ω представляет собой NR46R47
Амины и карбоксамиды общей формулы (I), диаграмма 3, где A, B, R1, R2, R46, Het, g, k и n такие, как определено выше, Δ представляет собой радикал алкил, циклоалкилалкил, арилалкил, арил, алленил, алленилалкил, алкенил, алкинил, цианоалкил или гидроксиалкил, и Δ' представляет собой радикал алкил, циклоалкилалкил, арилалкил или арил, когда g или k не являются 0, или Δ' представляет собой радикал алкил, циклоалкилалкил, арилалкильный радикал или арил, предпочтительно, дезактивированный (то есть радикал арил замещен группой, притягивающей электроны, такой как, например, нитро или цианогруппа), когда g или k равны 0, получают путем конденсирования аминов общей формулы (V) с карбоновыми кислотами (или соответствующими хлоридами кислот) общей формулы (XIII) в условиях, стандартных для пептидного синтеза, с альдегидами общей формулы (XII) в присутствии восстанавливающего агента, такого как триацетоксиборгидрид натрия или боргидрид натрия, в низшем алифатическом спирте, таком как метанол, и, необязательно, в присутствии молекулярных сит, или с галогенированными производными (Hal = атом галогена) общей формулы (XI). В частности, когда Δ представляет собой радикал алленил, алленилалкил, алкенил, алкинил, цианоалкил или гидроксиалкил, соединения общей формулы (V) преобразуют в соответствующие соединения общей формулы (I) путем взаимодействия с галогенированными производными общей формулы (XI) в растворителе, таком как ацетонитрил, дихлорметан или ацетон, и в присутствии основания, такого как, например, триэтиламин или карбонат калия, при температуре, находящейся в интервале от комнатной температуры до температуры кипения растворителя с обратным холодильником.
Производные общей формулы (V) могут быть получены, в частности, общим путем синтеза, описанным в Biorg. и Med. Chem. Lett., 1993, 3, 915 и Tetrahedron Lett., 1993, 34, 1901, и, более предпочтительно, в патентной заявке WO 98/58934. Когда R46 = H, то соединения общей формулы (V) могут быть получены, например, в соответствии со способом, описанным в патентной заявке WO 98/58934 (используя вместо N-Boc-саркозинамида соответствующую аминокислоту).
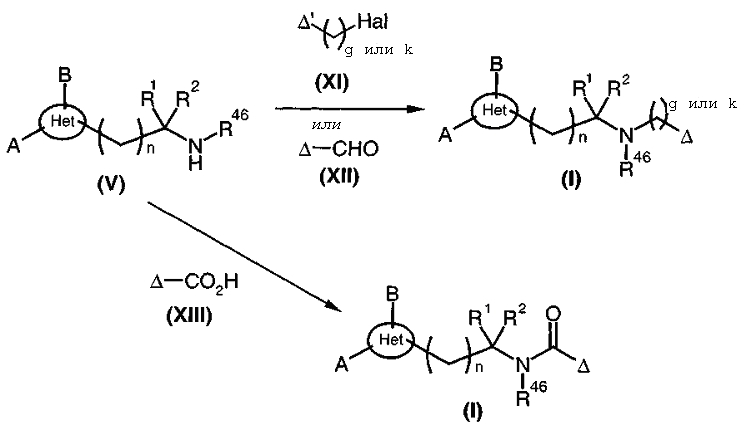
Диаграмма 3
В частности, когда R47 представляет собой радикал циклоалкил, амины общей формулы (I), диаграмма 3a, где A, B, R1, R2, R46, Het и n такие, как определено выше, и i представляет собой целое число от 0 до 4, получают путем конденсации аминов общей формулы (V) с циклоалкилкетонами общей формулы (XIV) в присутствии восстанавливающего агента, такого как триацетоксиборгидрид натрия или боргидрид натрия, в низшем алифатическом спирте, таком как метанол, и, необязательно, в присутствии молекулярных сит при комнатной температуре.
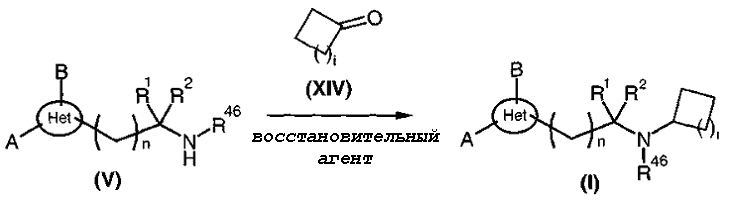
Диаграмма 3а
Сульфонамиды общей формулы (I), диаграмма 3b, где A, B, R1, R2, R46, Het и n такие, как определено выше, R47 представляет собой радикал -SO2-Δ, и Δ представляет собой радикал алкил, циклоалкил, циклоалкилалкил или арилалкил, получают путем конденсации аминов общей формулы (V) с сульфохлоридами общей формулы (XV) в стандартных условиях, например, в растворителе, таком как диметилформамид, при комнатной температуре.
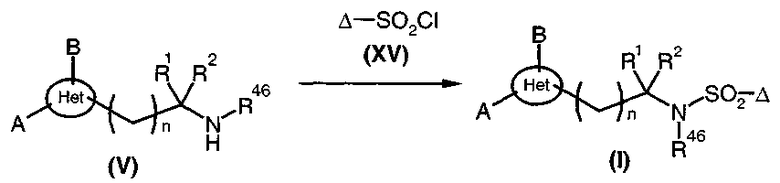
Диаграмма 3b
Уреазы общей формулы (I), диаграмма 3c, где A, B, R1, R2, R46, Het и n такие, как определено выше, R47 представляет собой радикал -CO-NH-Δ, и Δ представляет собой радикал алкил, циклоалкил, циклоалкилалкил или арилалкил, получают путем взаимодействия аминов общей формулы (V) с изоцианатами общей формулы (XVI) в инертном растворителе, таком как дихлорметан или 1,2-дихлорэтан.
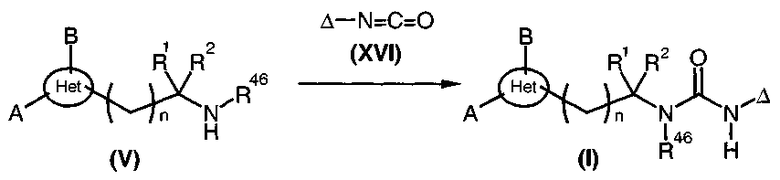
Диаграмма 3c
Путь 3: Het представляет собой оксазол или тиазол, R1 и R2 оба представляет собой H, и Ω представляет собой OH.
Производные спиртов общей формулы (I), диаграмма 4, где A, B, Het и n такие, как определено выше, и R1 и R2 представляют собой атомы водорода, получают путем восстановления кислот или эфиров общей формулы (VI) (получены общим путем синтеза, описанного в J. Med Chem., 1996, 39, 237-245, и в патентной заявке PCT WO 99/09829). Это восстановление можно, например, проводить путем воздействия бора или литийалюмогидрида, или также диизобутилалюмогидрида, в апротонном полярном растворителе, таком как тетрагидрофуран.

Диаграмма 4
Путь 4: Het представляет собой оксазол или тиазол, и Ω представляет собой NR46R47
Амины общей формулы (I), диаграмма 5, где A, B, R1, R2, R46, R47, Het, и n такие, как определено выше, получают путем конденсации первичных или вторичных аминов общей формулы R46-NHR47 с соединениями общей формулы (VII) (где L предпочтительно представляет собой атом галогена Hal, но также может представлять собой группу мезилат или тозилат) в соответствии с общим путем синтеза, описанным в J. Med. Chem., 1996, 39, 237-245, и патентной заявке PCT WO 99/09829 или в патенте США 4123529. Этот путь синтеза, в частности, может использоваться, когда R46 и R47, взятые вместе с атомом азота, к которому они присоединены, образуют неароматический 4-8-членный гетероцикл. Взаимодействие обычно проводят в безводном растворителе (например, диметилформамиде, дихлорметане, тетрагидрофуране или ацетоне) в присутствии основания (например, Na2CO3 или К2СО3 в присутствии триэтиламина) и, предпочтительно, при нагревании.
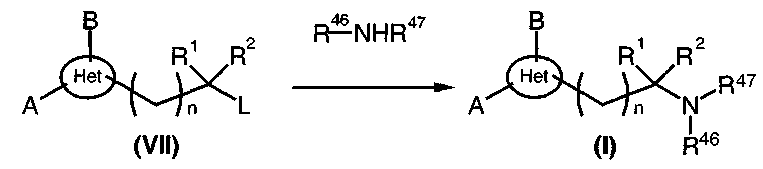
Диаграмма 5
Путь 5: Het представляет собой имидазол, и Ω представляет собой радикал карбаматного типа
Когда Ω представляет собой радикал карбаматного типа, кислоты общей формулы (VIII) могут быть циклизованы в виде имидазольных производных общей формулы (I), диаграмма 6, путем добавления карбоната цезия, с последующей конденсацией с α-галогенкетоном формулы A-CO-CH(B)-[Br,Cl] и далее добавлением большого избытка ацетата аммония (например, 15 или 20 эквивалентов на эквивалент кислоты общей формулы (VIII)). Это взаимодействие, предпочтительно, осуществляют в смеси ксилолов и при нагревании (если целесообразно, то также можно одновременно удалять воду, образовавшуюся в процессе взаимодействия).
Диаграмма 6
Путь 6: Het представляет собой имидазол, оксазол или тиазол, и Ω представляет собой NR46R47
Когда Ω представляет собой радикал NR46R47, где R47 представляет собой радикал, содержащий аминофениленовую, алкиламинофениленовую или диалкиламинофениленовую концевую группу, соединения общей формулы (I), где A, B, Het, n, R1, R2 и R46 такие, как определено выше, и Λ представляет собой связь или радикал -(CH2)X-, -CO-(CH2)X-, -(CH2)y-O- или -C(=NH)-, x и у являются целыми числами от 0 до 6, могут быть получены, диаграмма 7, путем восстановления соединения общей формулы (IX), например, под действием водорода в присутствии катализатора типа «палладий на угле» в растворителе, таком как, например, метанол, этанол, дихлорметан или тетрагидрофуран. Восстановление функциональной нитрогруппы также можно проводить, например, при нагревании продукта в соответствующем растворителе, таком как этилацетат, с небольшим количеством этанола в присутствии SnCl2 (J. Heterocyclic Chem. (1987), 24, 927-930; Tetrahedron Letters (1984), 25 (8), 839-842), или в присутствии SnCl2/Zn (Synthesis (1996), 9.1076-1078), используя NaBH4-BiCl3, (Synth. Com. (1995) 25 (23), 3799-3803) в растворителе, таком как этанол, или затем, используя Ni Ренея, к которому добавляли гидразингидрат (Monatshefte für Chemie, (1995), 126, 725-732), или используя также индий в смеси этанола и хлорида аммония при кипячении с обратным холодильником (Synlett (1998) 9, 1028).
Когда R47 представляет собой радикал аминофениленового, алкиламинофениленового или диалкиламинофениленового типа (Alk и Alk' являются одинаковыми или разными алкильными радикалами), соединение общей формулы (IX) восстанавливают с получением анилинового производного общей формулы (I) и осуществляют, необязательно, моно- или диалкилирование в соответствии со стандартными реакциями, известными специалисту в данной области. Моноалкилирование осуществляют путем восстановительного аминирования с альдегидом или путем нуклеофильного замещения путем взаимодействия с эквивалентом галогеноалкила Alk-Hal. Затем, необязательно, можно проводить второе алкилирование, посредством галогеноалкила Alk'-Hal.

Диаграмма 7
В частности, когда Alk = Alk' = -СН3 и когда Λ не является -CH2-, нитропроизводное общей формулы (IX) обрабатывают соответствующими количествами параформальдегида в токе водорода в растворителе, таком как этанол, и в присутствии катализатора типа «палладий на угле» (диаграмма 7a).
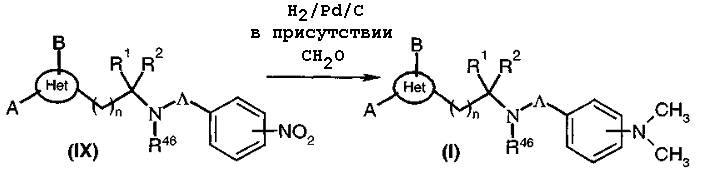
Диаграмма 7а
Путь 7: Het представляет собой имидазол, оксазол или тиазол, и Ω представляет собой OH
Этот путь может использоваться, когда Ω представляет собой OH. В отличие от пути 3, R1 и R2 не могут быть атомами водорода. В этом случае соединения общей формулы (I) могут быть получены, диаграмма 8, путем удаления защиты с защищенного спирта общей формулы (X).
В случае, когда Gp' представляет собой защитную группу силильного типа, удаление защиты может проводиться, например, путем добавления фторида тетра-трет-бутиламмония к растворителю, такому как тетрагидрофуран. В случае, когда Gp' представляет собой защитную группу бензильного типа, удаление осуществляют гидрированием в растворителе, таком как, например, метанол, дихлорметан или тетрагидрофуран. В случае, когда Gp' представляет собой защитную группу ацетатного типа, удаление защиты осуществляют, например, используя карбонат натрия или калия в спиртовом растворителе, таком как метанол. В противном случае, специалист в данной области может с успехом обратиться к следующему документу: Protective groups in organic synthesis, 2-ое издание (John Wiley & Sons Inc., 1991).
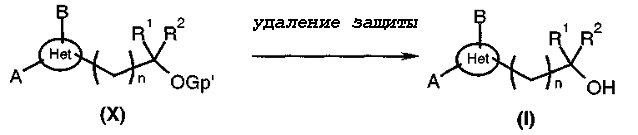
Диаграмма 8
Путь 8: Het представляет собой имидазол, оксазол или тиазол, и Q представляет собой OR48, где R48 ≠ Н. Соединения общей формулы (I), где Ω представляет собой радикал OR48, где R48 ≠ Н, получают, например, диаграмма 9, из спиртов общей формулы (I)a (которые представляют собой соединения общей формулы (I), как определено выше, где Ω представляет собой OH) путем взаимодействия последнего с галогенидом общей формулы R48-Hal (Hal = Br, Cl или I) в растворителе, таком как дихлорметан, ацетонитрил, безводный тетрагидрофуран или безводный простой эфир, и в присутствии основания, такого как карбонат калия или натрия, гидрид натрия или триэтиламин.
В случае, когда радикалы A, B, R1 и R2 содержат функциональные группы спирта, фенола, амина или анилина, может быть необходимым добавление стадий защиты/удаления защиты этих функциональных групп в соответствии со стандартными способами, известными специалистам в данной области (стадии не представлены на диаграмме 9).

Диаграмма 9
Получение промежуточных соединений
Получение имидазолов и тиазолов общей формулы (V)
Общая диаграмма
Коммерчески недоступное производное кетона общей формулы (V.i) или (V.i)2, где A и В такие, как определено в общей формуле (I), преобразуют, диаграмма 3.1, в соответствующий α-бромкетон общей формулы (V.ii) или (V.ii)2 путем взаимодействия с бромирующим агентом, таким как CuBr2 (J. Org. Chem. (1964), 29, 3459), бром (J. Het. Chem. (1988), 25, 337), N-бромсукцинимид (J. Amer. Chem. Soc. (1980), 102, 2838) в присутствии уксусной кислоты в растворителе, таком как этилацетат или дихлорметан, HBr или Br2 в простом эфире, этаноле или уксусной кислоте (Biorg. Med. Chem. Lett. (1996), 6(3), 253-258; J. Med. Chem. (1988), 31(10), 1910-1918; J. Am. Chem. Soc. (1999), 121, 24), или также используя бромированный полимер (J. Macromol. Sci. Chem. (1977), A11, (3) 507-514). В конкретном случае, когда A представляет собой радикал п-диметиламинофенил, можно использовать рабочий способ, схематически представленный в публикации Tetrahedron Lett., 1998, 39 (28), 4987. Затем в соответствии со способами, представленными ниже на диаграммах 3.2 (имидазолы) и 3.3 (тиазолы), получают амин общей формулы (V).
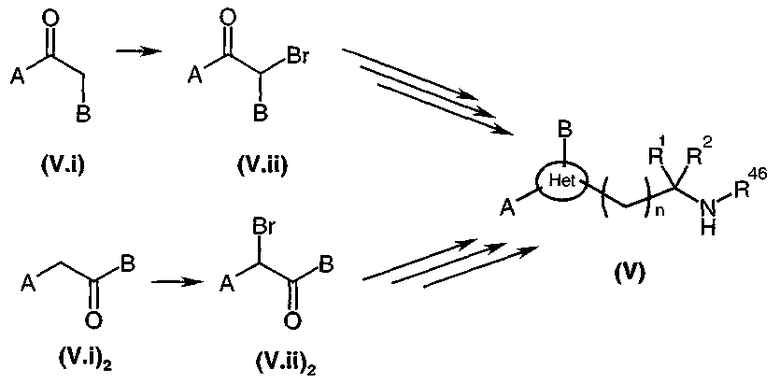
Диаграмма 3.1
В качестве варианта синтеза, представленного на диаграмме 3.1, специалист в данной области может необязательно использовать α-хлоркетон вместо α-бромкетона.
Получение имидазолов общей формулы (V)
Кислоту общей формулы (V.iii), где Gp представляет собой защитную группу для функциональной аминогруппы, например защитную группу карбаматного типа, обрабатывают, диаграмма 3.2, с помощью Cs2CO3 в растворителе, таком как метанол или этанол. К восстановленной соли цезия добавляли α-галогенкетон общей формулы (V.ii) в инертном растворителе, таком как диметилформамид. Промежуточный кетоэфир циклизовали с помощью кипячения с обратным холодильником в ксилоле (смесь изомеров) в присутствии большого избытка ацетата аммония (например, 15 или 20 эквивалентов) с получением имидазольного производного общей формулы (V.iv) (в течение реакции образовавшуюся воду необязательно удаляли).
В случае, когда R38 не является H, функциональную аминогруппу имидазольного кольца соединения общей формулы (V.iv) замещали путем взаимодействия с галогенированным производным R38-Hal (Hal = атом галогена); затем с защищенной функциональной аминогруппы удаляли защиту в стандартных условиях (например: трифторуксусная кислота или HCl в органическом растворителе, если это защитная группа карбаматного типа, или также гидрированием в присутствии палладия на угле, когда защитная группа представляет собой карбамат бензила).
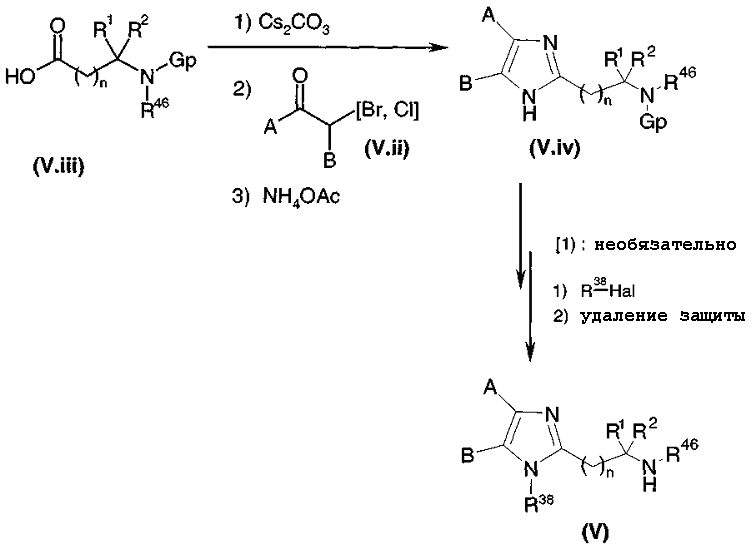
Диаграмма 3.2
Получение тиазолов общей формулы (V), предназначенных для получения соединений общей формулы (I)1 или (I)2:
Тиокарбоксамид общей формулы (V.v), где Gp представляет собой защитную группу для функциональной аминогруппы, например, защитную группу карбаматного типа, полученную, например, путем взаимодействия соответствующего карбоксамида с реагентом Лавессона (Lawesson) или с (P2S5)2, подвергали взаимодействию, диаграмма 3.3, с α-бромкетоном общей формулы (V.ii) или (V.ii)2 в соответствии со способом, описанным в литературе (J. Org. Chem., (1995), 60, 5638-5642). Затем у защищенной функциональной аминогруппы удаляли защиту в стандартных условиях в среде сильной кислоты (например: трифторуксусной кислоты или HCl в органическом растворителе, когда группа является защитной группой карбаматного типа), высвобождая амин общей формулы (V).
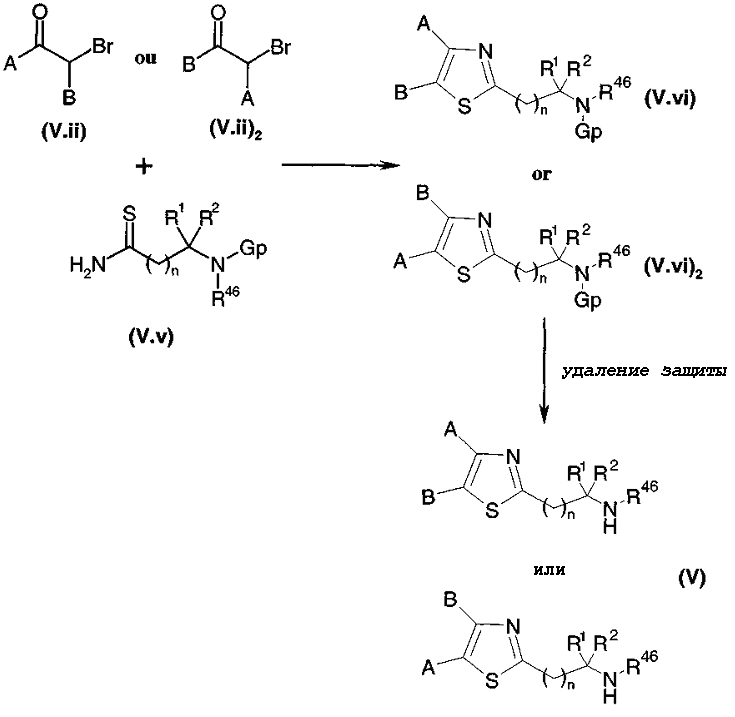
Диаграмма 3.3
Получение тиазолов общей формулы (V), предназначенных для получения соединений общей формулы (I)3:
Эти соединения получают в соответствии со способом, представленным на диаграмме 3.4 ниже. Сначала обрабатывают карбоксамид общей формулы (VII.ii), например, реагентом Лавессона или (P2S5)2, затем путем взаимодействия с галогенированным производным общей формулы (V.vii) получают тиокарбоксамид общей формулы (VII.iii) (см. Biorg. Med. Chem, Lett, (1996), 6(3), 253-258; J. Med. Chem. (1988), 31(10), 1910-1918; Tetrahedron Lett., (1993), 34(28), 4481-4484; или J. Med. Chem. (1974), 17, 369-371; или также Bull Acd. Sci. USSR Div. Chem. Sci. (Engl Transl) (1980) 29, 1830-1833). Затем у полученного таким образом защищенного амина общей формулы (V.viii) удаляли защиту в стандартных условиях, известных специалисту в данной области (например: трифторуксусная кислота или HCl в органическом растворителе, когда Gp представляет собой защитную группу карбаматного типа).
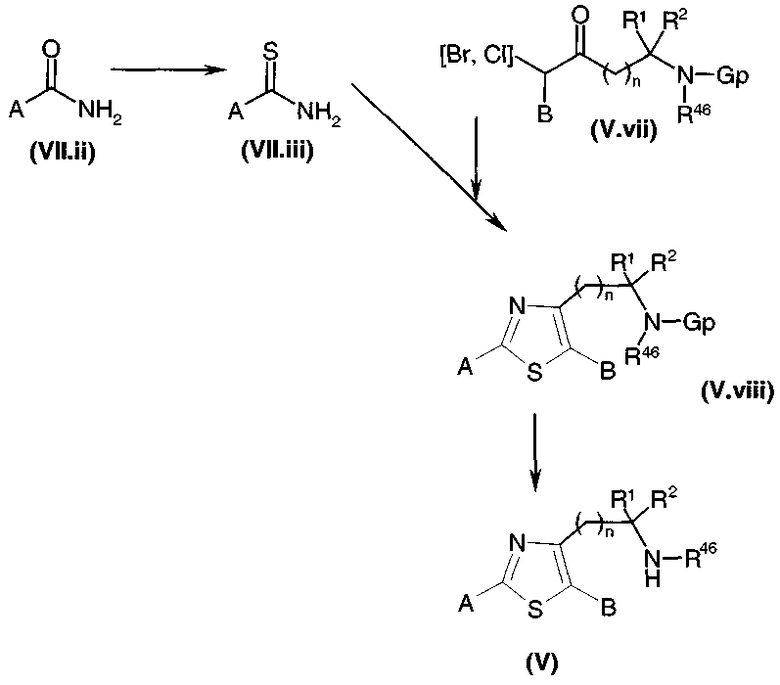
Диаграмма 3.4
Получение оксазолов общей формулы (V), предназначенных для получения соединений общей формулы (I)3:
Эти соединения получают в соответствии со способом, представленным на диаграмме 3.5 ниже. Кабоксамид общей формулы (VII.ii) сначала подвергали взаимодействию с галогенированным производным общей формулы (V.vii). Затем у полученного таким образом защищенного амина общей формулы (V.ix) удаляли защиту в стандартных условиях, известных специалисту в данной области, с получением соединения общей формулы (V) (например: трифторуксусная кислота или HCl в органическом растворителе, когда Gp представляет собой защитную группу карбаматного типа).
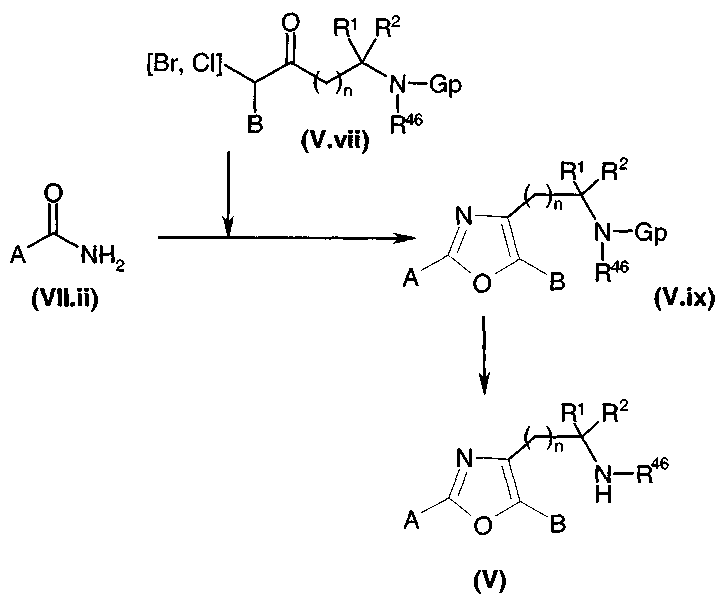
Диаграмма 3.5
Получение производных кетона общей формулы (V.i) и конкретных производных α-бромкетона общей формулы (V.ii), (V.ii)2 или (V.vii)
Коммерчески недоступные производные кетона общей формулы (V.i) или их α-бромкетоновые гомологи могут быть получены способами, описанными в литературе, или сходными способами, адаптированными специалистом в данной области. В частности:
- когда A представляет собой радикал индолинил или тетрагидрохинолил, соединения общей формулы (V.i) могут быть получены способами, описанными в литературе, такими как, например, в J. Med. Chem. (1986), 29, (6), 1009-1015 или J. Chem. Soc., Perkin Trans. 1(1992), 24, 3401-3406.
Альтернативно, соединения общей формулы (V.ii), где A представляет собой радикал индолинил или тетрагидрохинолил, где R33 представляет собой H, могут быть синтезированы в соответствии со способом, описанным в J. Chem. Soc., Perkin Trans 1 (1992), 24, 3401-3406, который незначительно модифицировали. Этот способ представлен на диаграмме 3.6 ниже.
Диаграмма 3.6
Индолин или тетрагидрохинолин (T представляет собой -CH2- или -(CH2)2-) защищали, используя хлорацетилхлорид, с получением соединения общей формулы (XVII), которое подвергали реакции Фриделя-Крафтса (замещенный хлорацетилхлорид общей формулы (XVIII), где В имеет значение, обозначенное выше, в растворителе, таком как дисульфид углерода, и в присутствии хлорида алюминия) с получением соединения общей формулы (XIX). Затем соединение общей формулы (XIX) гидролизовали в присутствии кислоты, например смеси уксусной кислоты/HCl, с получением соединений общей формулы (V.ii) в виде смеси мета- и пара-изомеров. Эти изомеры могут быть разделены фракционной кристаллизацией в растворителе, таком как ледяная уксусная кислота.
Специалист в данной области может адаптировать способы синтеза, описанные выше, для случая, когда A представляет собой радикал индолинил или тетрагидрохинолил, где R33 не является H, например когда R33 представляет собой радикал алкил или аралкил, стадии защиты и удаления защиты являются лишними.
- когда A представляет собой радикал типа 4-(4-гидроксифенил)фенил, соединения общей формулы (V.i) могут быть получены способами, описанными в литературе, такими как, например, в J. Org. Chem., (1994), 59(16), 4482-4489.
Альтернативно, соединения общей формулы (V.i) и (V.ii), где A представляет собой радикал типа 4-(4-гидроксифенил)фенил, могут быть получены, например, способами, проиллюстрированными на диаграмме 3.7 ниже.
Диаграмма 3.7
Соединения общей формулы (V.i) или (V.ii), где S1, S2, S3 и S4 независимо выбраны из атома водорода и OH, циано, нитро, алкил, алкокси или -NR10R11, как определено для общей формулы (I), получают, диаграмма 3.7, из сложных эфиров общей формулы (XX) (см. в частности, Chem. Lett. (1998), 9, 931-932 и Synthesis (1993), 8, 788-790). Конечно, наличие функциональных групп фенола или анилина, обусловленное природой заместителей R19, R20, R21, S1, S2, S3 и S4, может вынудить специалиста в данной области добавить к стадиями на диаграмме 3.7 стадии защиты (и, впоследствии, при синтезе соединения общей формулы (I), удаления защиты) этих функциональных групп таким образом, чтобы они не влияли на остальной химический синтез. Сложные эфиры общей формулы (XX) гидролизовали с получением кислот общей формулы (XXI). Последние затем подвергали реакции присоединения с N,O-диметилгидроксиламином (Syn. Commun. (1995), 25(8), 1255; Tetrahedron Lett. (1999), 40(3), 411-414) в растворителе, таком как диметилформамид или дихлорметан, в присутствии основания, такого как триэтиламин, с дициклогексилкарбодиимидом или гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида и гидроксибензотриазолом, с получением промежуточных соединений общей формулы (XXII). Соединения общей формулы (V.i) получают из соединения общей формулы (XXII) путем реакции замещения с MeLi (J. Med. Chem. (1992), 35(13), 2392). Бромацетофеноны общей формулы (V.ii) далее могут быть получены из ацетофенона общей формулы (V.i) в ранее описанных условиях.
- Когда A представляет собой радикал карбазолил, соединения общей формулы (V.i) могут быть получены способами, описанными в литературе, такими как, например, в J. Org. Chem., (1951), 16, 1198 или Tetrahedron (1980), 36, 3017.
Альтернативно, соединения общей формулы (V.ii), где A представляет собой радикал карбазолил, где R9 представляет собой H, могут быть синтезированы в соответствии с незначительно модифицированным способом, описанным для случая, когда A = карбазолил, Tetrahedron (1980), 36, 3017. Этот способ представлен на диаграмме 3.8 ниже:
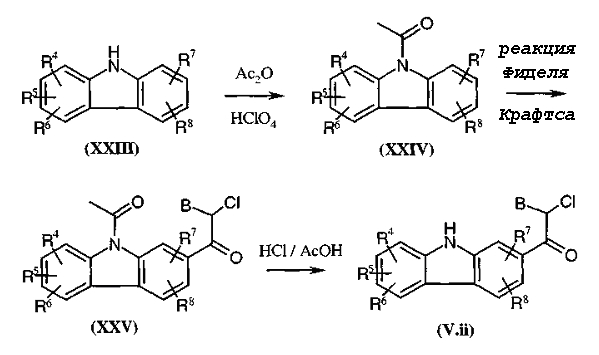
Диаграмма 3.8
Карбазол общей формулы (XXIII) защищали, используя уксусный ангидрид, с получением соединения общей формулы (XXIV), которое подвергали реакции Фриделя-Крафтса (замещенный хлорацетил хлорид общей формулы (XVIII), как определено выше, в растворителе, таком как дисульфид углерода, и в присутствии хлорида алюминия) с получением соединения общей формулы (XXV). Затем ацильную группу, защищающую функциональную аминогруппу, гидролизовали в присутствии кислоты, например, смеси AcOH/HCl, с получением соединения общей формулы (V.ii). Когда A представляет собой радикал карбазолил, где R9 представляет собой алкил или группу -COR15 (этот случай не представлен на диаграмме 3.8), начальная стадия ацилирования не нужна, и соединения общей формулы (V.ii) могут быть получены двумя последними стадиями на диаграмме 3.8. Конечно, наличие функциональных групп фенола или анилина, обусловленное природой заместителей R4, R5, R6, R7 и R8, может вынудить специалиста в данной области добавить к стадиям, представленным на диаграмме 3.8, стадии защиты (и впоследствии, при синтезе соединения общей формулы (I), удаления защиты) этих функциональных групп таким образом, чтобы они не влияли на остальной химический синтез.
- Когда A представляет собой фенотиазинильный радикал, промежуточные соединения общей формулы (V.i) и (V.ii) могут быть получены способами, описанными в литературе: J. Heterocyclic. Chem. (1978), 15, 175-176 и Arzneimittel Forschung (1962), 12, 48.
Альтернативно, промежуточные соединения общей формулы (V.ii), где A представляет собой фенотиазинильный радикал, могут быть получены в соответствии с незначительно модифицированным способом, описанным для фенотиазинильного радикала в Arzneimittel Forschung (1962), 12, 48, который представлен на диаграмме 3.9, ниже (смотри также примеры). Фенотиазин общей формулы (XXVI) защищали, используя хлорацетилхлорид с получением соединения общей формулы (XXVII), которое затем подвергали реакции Фриделя-Крафтса (соединение общей формулы (XVIII) в растворителе, таком как дисульфат углерода в присутствии хлорида алюминия) с получением соединения общей формулы (XXVIII). В ходе последней стадии процесса, наряду с галогеновым обменом осуществляют гидролиз HCl/уксусной кислотой, что давало возможным получение хлоркетона общей формулы (V.ii). Конечно, наличие функциональных групп фенола или анилина, обусловленное природой заместителей R4, R5, R6 и R8, может вынудить специалиста в данной области добавить к стадиям, представленным на диаграмме 3.9, стадии защиты (и впоследствии, при синтезе соединения общей формулы (I), удаления защиты) этих функциональных групп таким образом, чтобы они не влияли на остальной химический синтез.
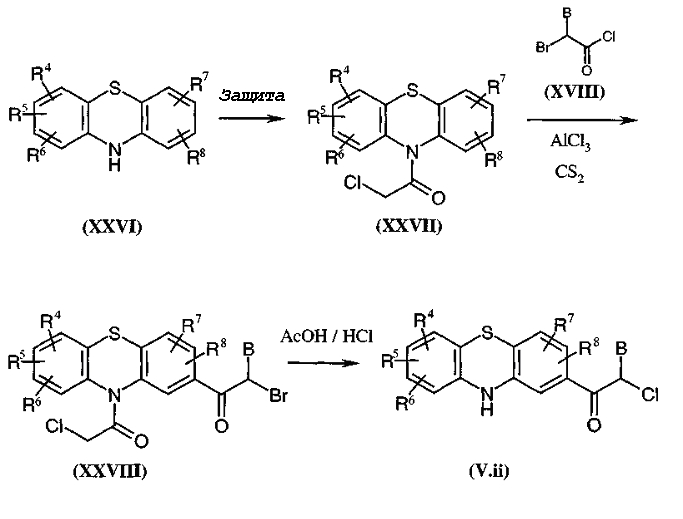
Диаграмма 3.9
- когда A представляет собой радикал фениламинофенил, соединения общей формулы (V.i) могут быть получены способами, описанными в литературе, такими как, например, Chem. Commun., (1998), 15, (6) 1509-1510 или Chem Ber., (1986), 119, 3165-3197, или сходными методами, адаптированными специалистом в данной области.
Например, промежуточные соединения общей формулы (V.i)a и (V.ii)a, где A представляет собой радикал фениламинофенил (который соответствует соответствующей функциональной анилиновой группе соединений общей формулы (V.i) и (V.ii), которая была ацетилирована), могут быть получены в соответствии с незначительно измененным способом, описанным для радикала фениламинофенила в Chem Ber. (1986), 119, 3165-3197. Этот способ представлен на диаграмме 3.10 ниже.

Диаграмма 3.10
В случае (представленном на диаграмме 3.10), когда радикал R9 синтезируемого соединения общей формулы (I) представляет собой атом водорода или ацетильную группу, дифениламин общей формулы (XXIX), образованный реакцией присоединения в присутствии CuI, защищали путем ацетилирования, используя, например, уксусный ангидрид с получением соединения общей формулы (V.i)a. В случае (не представленном на диаграмме 3.10), когда R9 радикал синтезируемого соединения общей формулы (I) не является атомом водорода или ацетильным радикалом, стадию ацетилирования заменяли стадией замещения на анилин в соответствии со стандартными способами, известными специалисту в данной области, с получением соответствующего соединения общей формулы (V.i). Соединение общей формулы (V.i)a (или (V.i), в случае, не представленном на диаграмме 3.10) затем подвергали реакции бромирования, используя бромированный полимер, полимер PVPHP (поливинилпиридиний гидробромид пербромид), описанный в J. Macromol. Sci. Chem. (1977), All, (3), 507-514, с получением соединения общей формулы (V.ii)а (или (V.ii), в случае не представленном на диаграмме 3.10). Конечно, наличие функциональных групп фенола или анилина, обусловленное природой заместителей R4, R5, R6, R7 и R8, может вынудить специалиста в данной области к стадиям, представленным на диаграмме 3.10, добавить стадии защиты (и впоследствии, при синтезе соединения общей формулы (I), удаления защиты) этих функциональных групп таким образом, чтобы они не влияли на остальной химический синтез. Удаление защиты ацетилированной функциональной анилиновой группы по существу осуществляют в ходе последней стадии синтеза соединений общей формулы (I).
- Когда A представляет собой радикал бензопиран или бензофуран, такой как определен в общей формуле (I), где R32 представляет собой атом водорода, промежуточные соединения общей формулы (V.i) и (V.ii) могут быть получены способами, проиллюстрированными на диаграмме 3.11 ниже.
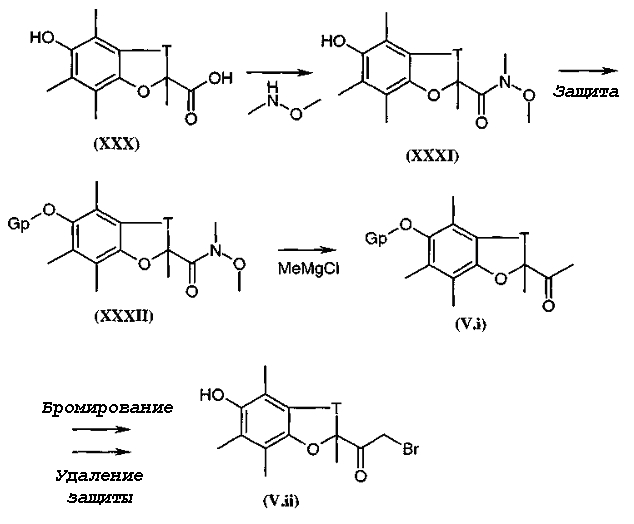
Диаграмма 3.11
Соединения общих формул (V.i) и (V.ii), диаграмма 3.11, где Т такой, как определено выше, и Gp = защитная группа, получают из кислот общей формулы (XXX). Кислоты общей формулы (XXX) подвергали реакции присоединения с N,O-диметилгидроксиламином (Syn. Commun. (1995), 25, (8), 1255; Tetrahedron Lett. (1999), 40, (3), 411-414) в растворителе, таком как диметилформамид или дихлорметан, в присутствии основания, такого как триэтиламин, с дициклогексилкарбодиимид или гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида и гидроксибензотриазолом, с получением промежуточных соединений общей формулы (XXXI). Затем осуществляют защиту функциональной фенольной группы в виде бензилированного или трет-бутилдиметилсилированного производного или с помощью других защитных групп (Gp), известных специалисту в данной области, с получением соединений общей формулы (XXXII). Соединения общей формулы (V.i) получают из соединений общей формулы (XXXII) путем реакции замещения с реагентами Гриньяра, MeMgCl (J. Het. Chem. (1990), 27, 1709-1712) или с MeLi (J. Med. Chem. (1992), 35, 13). Бромацетофеноны общей формулы (V.ii) далее могут быть получены из ацетофенона общей формулы (V.i) в условиях, описанных выше.
Альтернативно, соединение общей формулы (V.ii), где R32 представляет собой атом водорода или радикал алкил, могут быть получены в соответствии со способом только в 3 стадии (см. диаграмма 3.12 - также смотри примеры). В данном способе бромирование соединения общей формулы (V.i) на последней стадии с получением соединения общей формулы (V.ii) предпочтительно проводят в соответствии с J. Am. Chem. Soc. (1999), 121, 24.
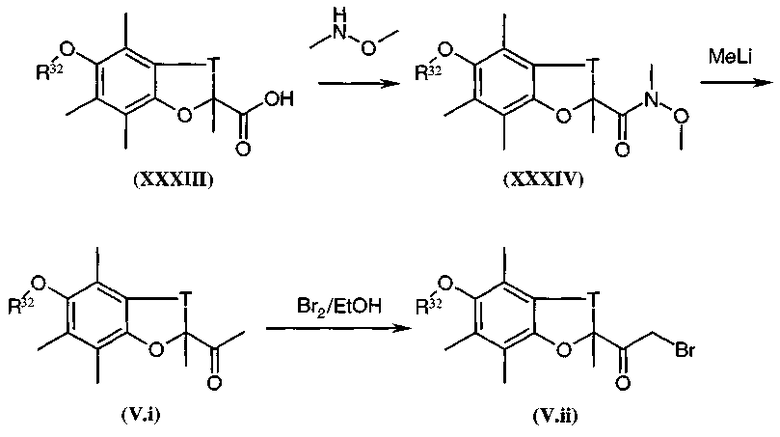
Диаграмма 3.12
- когда A представляет собой радикал замещенный бифенил, промежуточные кетоны общей формулы (V.i), в частности, могут быть получены с помощью синтеза Сузуки (Suzuki) (см. Baroni et al., J.Org. Chem. 1997, 62, 7170-7173; также см. пример 44 данной заявки, стадия 44.1).
Когда A представляет собой радикал замещенный фенол, может быть необходимым использование промежуточных соединений общей формулы (V.ii), как описано выше, функциональная фенольная группа которых была ацетилирована (ниже обозначены как соединения общей формулы (V.ii)b). В частности:
- когда A представляет собой радикал 4-гидрокси-3,5-диизопропилфенил, гомологичные α-бромкетоновые производные функциональной фенольной группы соединений общей формулы (V.ii), которые замещены ацетильным радикалом, могут быть получены как представлено на диаграмме 3.13 ниже.

Диаграмма 3.13
2,6-Диизопропилфенол ацетилировали в соответствии со способами, известными специалисту в данной области, например, путем взаимодействия с уксусной кислотой в присутствии ангидрида трифторуксусной кислоты или с ацетилхлоридом в присутствии основания, такого как, например, К3СО3. Ацетилированный гомолог 2,6-диизопропилфенола затем подвергали перегруппировке Фрая (Fries) в присутствии хлорида алюминия в растворителе, таком как нитробензол, с получением соединения формулы (V.i). Затем соединение формулы (V.i) ацетилировали с получением соединения формулы (V.i)b. Затем осуществляют бромирование с CuBr2, как описано выше, с получением соединения формулы (V.ii)b. Затем в синтезе соединений общей формулы (I) проводили стадию удаления защиты с высвобождением функциональной фенольной группы (во время, которое специалист в данной области считает наиболее подходящим).
- Когда A представляет собой радикал диметоксифенольного типа, соединения общей формулы (V.ii)b могут быть получены способом, аналогичным способу синтеза, описанному для соединения формулы (V.ii)b, полученному из 2,6-диизопропилфенола, необязательно, с незначительными изменениями в рамках знаний специалиста в данной области. Например, когда A представляет собой радикал 3,5-диметокси-4-гидроксифенил, соответствующее α-бромкетоновое производное формулы (V.ii)b может быть получено из коммерчески доступного соединения формулы (XXXV), например, как показано на диаграмме 3.13:.
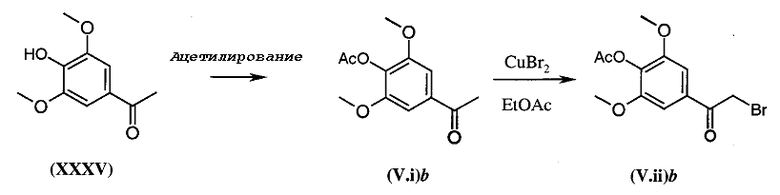
Диаграмма 3.14
Соединения общей формулы (V.ii)2, где A и В такие, как определено выше, могут быть получены в соответствии со способом, представленным на диаграмме 3.15 ниже.
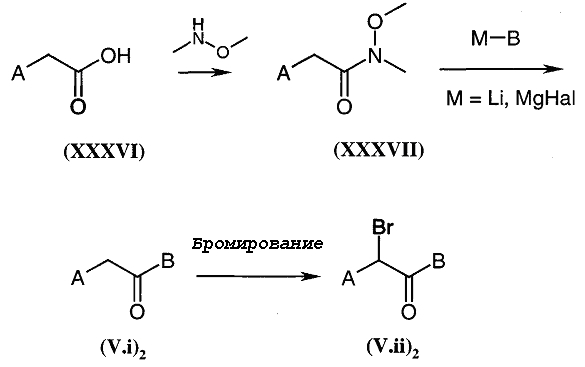
Диаграмма 3.15
Кислоты общей формулы (XXXVI) подвергали реакции присоединения с N,O-диметилгидроксиламином (Syn. Commun. (1995), 25, (8), 1255; Tetrahedron Lett. (1999), 40, (3), 411-414) в растворителе, таком как диметилформамид или дихлорметан, в присутствии основания, такого как триэтиламин, с дициклогексилкарбодиимидом или гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида и гидроксибензотриазолом, с получением промежуточных соединений общей формулы (XXXVII). Соединения общей формулы (V.i)2 получают из соединений общей формулы (XXXVII) путем реакции замещения производных лития или магния общей формулы B-M, где M представляет собой Li или MgHal (Hal = I, Br или Cl), в растворителях, таких как простой эфир или безводный тетрагидрофуран. α-Бром- или α-хлоркетоны общей формулы (V.ii)2 далее могут быть получены из кетонов общей формулы (V.i)2 в условиях, описанных выше.
Кроме того, коммерчески недоступные α-галогенокетоновые производные общей формулы (V.vii) могут быть получены, используя способы, описанные в литературе. В частности, они могут быть получены в соответствии со способом, представленным на диаграмме 3.16.
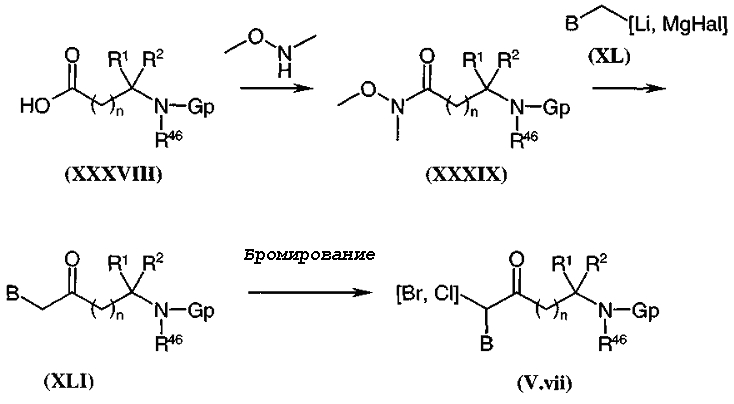
Диаграмма 3.16
Замещенные аминокислоты общей формулы (XXXVIII) получают путем защиты соответствующих аминокислот группой карбаматного типа в соответствии со способами, известными специалисту в данной области. Затем кислоты общей формулы (XXXVIII) подвергали реакции присоединения с N,O-диметилгидроксиламином (Syn. Commun. (1995), 25, (8), 1255; Tetrahedron Lett. (1999), 40, (3), 411-414) в растворителе, таком как диметилформамид или дихлорметан, в присутствии основания, такого как триэтиламин, с дициклогексилкарбодиимидом или гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида и гидроксибензотриазолом, с получением промежуточных соединений общей формулы (XXXIX). Соединения общей формулы (XLI) получают из соединений общей формулы (XXXIX) путем реакции замещения с производными лития или магния общей формулы (XL) (Hal = I, Br или Cl), в растворителях, таких как простой эфир или безводный тетрагидрофуран. Бром или хлорацетофеноны общей формулы (V.vii) далее могут быть получены из ацетофенона общей формулы (XLI) в условиях, описанных выше.
Альтернативно, специалист в данной области также может использовать или адаптировать синтезы, описанные в Angew. Chem. Int. (1998), 37 (10), 411-414, Liebigs Ann. Chem. (1995), 1217 или Chem. Pharm. Bull (1981), 29(11), 3249-3255.
Получение производных кислот общей формулы (V.iii)
Производные кислот общей формулы (V.iii) могут быть непосредственно получены, диаграмма 3.17, путем взаимодействия коммерчески доступных аминокислот общей формулы (V.vi) с соединениями типа (ар)алкилхлорформиата или ди(ар)алкилкарбоната (Δ представляет собой радикал алкил или бензил) в стандартных условиях, известных специалисту в данной области.
Диаграмма 3.17
Получение соединений общей формулы (V.v)
Тиокарбоксамиды общей формулы (V.v) могут быть получены в три стадии из соединений общей формулы (V.vi), как указано на диаграмме 3.18 ниже. Функциональную аминогруппу аминокислоты общей формулы (V.vi) сначала защищали в стандартных условиях с помощью tBu-O-CO-Cl или (tBu-O-CO)2O (или другими защитными группами, известными специалисту в данной области), затем полученное промежуточное соединение преобразуют в его соответствующий амид способами, описанными в литературе (см., например, J. Chem. Soc., Perkin Trans. 1, (1998), 20, 3479-3484 или патентную заявку PCT WO 99/09829). Наконец, карбоксамид преобразуют в тиокарбоксамид общей формулы (V.v), например, путем взаимодействия с реагентом Лавессона в растворителе, таком как диоксан или тетрагидрофуран при температуре, предпочтительно, находящейся в интервале от комнатной температуры до температуры кипения смеси с обратным холодильником, или также используя (P2S5)2 в стандартных условиях, известных специалисту в данной области.
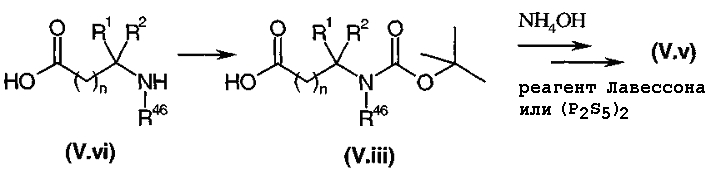
Диаграмма 3.18
Альтернативно, тиокарбоксамиды общей формулы (V.v) могут также быть получены, диаграмма 3.19, путем добавления H2S к соответствующим цианопроизводным общей формулы (V.x) в стандартных условиях, известных специалисту в данной области.
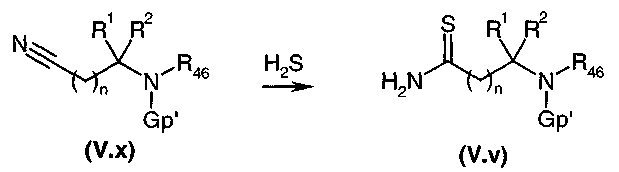
Диаграмма 3.19
Получение кислот общей формулы (VI)
Получение кислот, производных тиазолов общей формулы (VI)
Кислоты общей формулы (VI), производные тиазолов, могут быть получены в соответствии со способами, представленными на диаграмме 4.1 ниже.
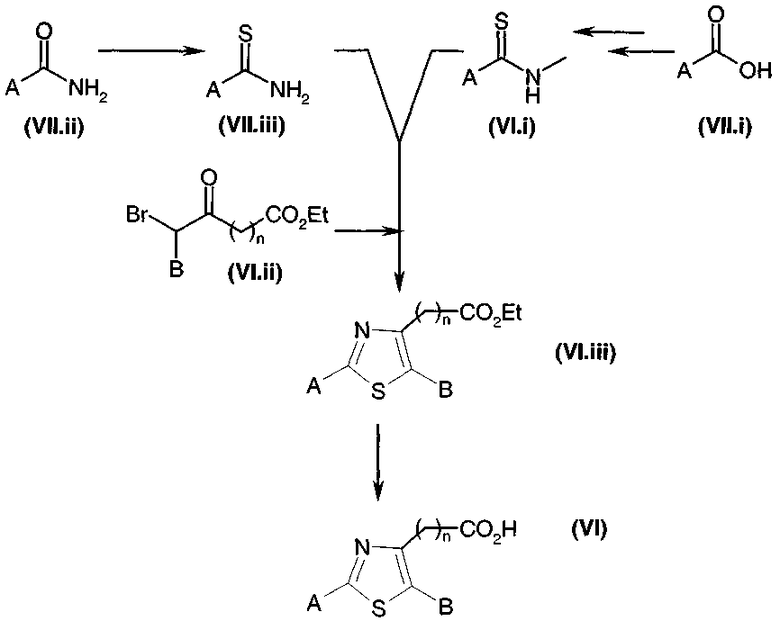
Диаграмма 4.1
Карбоксамиды общей формулы (VII.ii) обрабатывают в стандартных условиях с получением тиокарбоксамида общей формулы (VII.iii), например, с помощью реагента Лавессона или используя также (P2S5)2 в стандартных условиях, известных специалисту в данной области. Альтернативно, кислоту общей формулы (VII.i) активировали действием 1,1'-карбонилдиимидазола, затем обрабатывают метиламином в апротонном полярном растворителе, таком как, например, тетрагидрофуран. Полученный промежуточный карбоксамид преобразуют в тиокарбоксамид общей формулы (VI.i) в стандартных условиях, например, используя реагент Лавессона или используя также (P2S5)2 в стандартных условиях, известных специалисту в данной области. Затем тиокарбоксамид общей формулы (VII.iii) или (VI.i) подвергали взаимодействию с соединением общей формулы (VI.ii), например, при кипячении с обратным холодильником в растворителе, таком как бензол, диоксан или диметилформамид. Полученные сложные эфиры общей формулы (VI.iii) могут быть затем гидролизованы под действием основания, такого как, например, углекислый калий в спиртовой среде или LiOH в тетрагидрофуране, с получением кислоты общей формулы (VI).
Получение кислот, производных оксазола, общей формулы (VI)
Кислоты общей формулы (VI), производные оксазолов, могут быть получены в соответствии со способом, представленным на диаграмме 4.2 ниже.
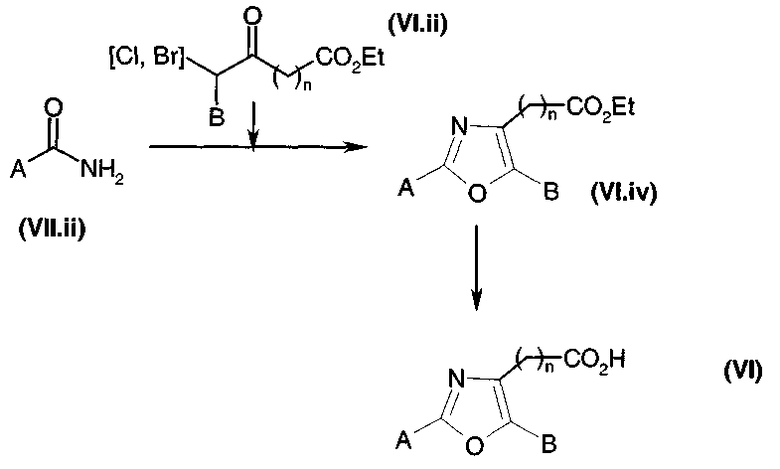
Диаграмма 4.2
Карбоксамиды общей формулы (VII.ii) подвергали взаимодействию с соединением общей формулы (VI.ii) при нагревании, например, при кипячении с обратным холодильником, вместе или без растворителя, такого как диметилформамид. Полученный сложный эфир общей формулы (VI.iv) может быть затем гидрирован под действием основания, такого как, например, углекислый калий в спиртовой среде или LiOH в тетрагидрофуране, с получением кислоты общей формулы (VI).
Получение кислот, производных оксазолинов, общей формулы (VI)
Кислоты, производные изоксазолинов, общей формулы (VI), которые используются с получением соединений общей формулы (I)4, могут быть получены в соответствии со способом, представленным на диаграмме 4.3 ниже.
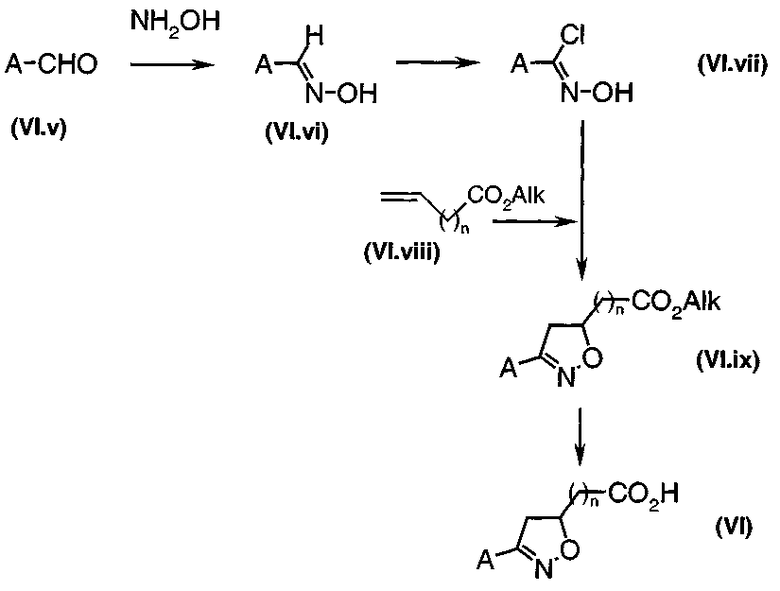
Диаграмма 4.3
Кислоты общей формулы (VI), производные изоксазолинов, могут быть получены следующим образом: коммерчески доступные альдегиды общей формулы (VI.v) подвергали взаимодействию с гидрохлоридом гидроксиламина. Полученный таким образом оксим общей формулы (VI.vi) активировали в форму хлорида оксима общей формулы (VI.vii) путем взаимодействия с N-хлорсукцинимидом в ДМФ, затем подвергали взаимодействию со сложными эфирами общей формулы (VI.viii) (где Alk представляет собой радикал алкил) с получением изоксазольных производных в соответствии со способом, описанным в литературе (Tetrahedron Lett., 1996, 37 (26), 4455; J. Med. Chem., 1997, 40, 50-60 и 2064-2084). Затем проводили гидролиз изоксазолинов общей формулы (VI.ix) стандартным способом (например, путем действия KOH в спиртовом растворителе или LiOH в растворителе, таком как тетрагидрофуран) с получением кислотного производного общей формулы (VI).
Коммерчески недоступные ненасыщенные сложные эфиры общей формулы (VI.x) могут быть получены в соответствии со способами, описанными в литературе (J. Med. Chem., 1987, 30, 193; J. Org. Chem., 1980, 45, 5017).
Получение тиазолов и оксазолов общей формулы (VII)
Общая диаграмма
Кислоты общей формулы (VII.i), диаграмма 5.1, преобразуют в соответствующие карбоксамиды общей формулы (VII.ii) способами, описанными в литературе (см, например, J. Chem. Soc., Perkin Trans. 1, (1998), 20, 3479-3484 или патентную заявку PCT WO 99/09829). Затем соединения общей формулы (VII) могут быть получены стандартным способом в соответствии со способами, представленными на диаграмме 5.2 и 5.3 (тиазолы) и на диаграмме 5.4 (оксазолы) ниже.
Этот путь синтеза используется затем с получением соединений, соответствующих общей подформуле (I)1 и (I)3.
Диаграмма 5.1
Получение тиазолов общей формулы (VII)
Когда R1 и R2 оба представляют собой H, тиазолы общей формулы (VII), предназначенные с получением соединений общей формулы (I)3, могут быть получены в соответствии со способом, представленным на диаграмме 5.2. Карбоксамид общей формулы (VII.ii) преобразуют в соответствующий тиокарбоксамид общей формулы (VII.iii) в присутствии реагента Лавессона в растворителе, таком как диоксан или бензол, при температуре, предпочтительно, находящейся в интервале от комнатной температуры до температуры кипения смеси с обратным холодильником. Тиокарбоксамид общей формулы (VII.iii) затем обрабатывают α-галогенкетоэфиром общей формулы (VII.iv), где Alk представляет собой радикал алкил (например, метил, этил или трет-бутил), с получением сложного эфира общей формулы (VII.v), который восстанавливают до соответствующего спирта общей формулы (VII.vi), например, при воздействии алюмогидрида лития или диизобутилалюминий гидрида в растворителе, таком как тетрагидрофуран. Последний мог быть затем преобразован в галогенированное производное общей формулы (VII) в соответствии со способами, известными специалисту в данной области, например, в случае бромированного производного (L = Br), путем взаимодействия с CBr4 в присутствии трифенилфосфина в дихлорметане при комнатной температуре.
Диаграмма 5.2
Тиазолы общей формулы (VII), предназначенные с получением соединений общей формулы (I)1, могут быть получены в соответствии со способом, представленным в диаграмме 5.3. Цианопроизводное общей формулы (VII.vii), где Gp' представляет собой защитную группу для спиртовой функциональной группы (например, бензил или -CO-ρ группа, где ρ представляет собой алкил, например, метил или трет-бутил), преобразуют в соответствующий тиокарбоксамид общей формулы (VII.viii) под действием H2S в растворителе, таком как этанол, в присутствии триэтаноламина при температуре, предпочтительно, находящейся в интервале от комнатной температуры до температуры кипения смеси с обратным холодильником. Тиокарбоксамид общей формулы (VII.viii) затем обрабатывают α-галогенокетоном общей формулы (VII.x) с получением соединения общей формулы (VII.xi), у которого удаляли защиту с получением соответствующего спирта общей формулы (VII.xi) в соответствии со способами, известными специалисту в данной области (например, когда Gp' представляет собой защитную группу ацетатного типа, последний экстрагировали in situ с помощью водного раствора карбоната натрия). Последний затем может быть преобразован в галогенированное производное общей формулы (VII) в соответствии со способами, известными специалисту в данной области, например, в случае бромированного производного (L = Br), путем взаимодействия с CBr4 в присутствии трифенилфосфина в дихлорметане при комнатной температуре.
Диаграмма 5.3
Получение оксазолов общей формулы (VII)
Когда R1 и R2 оба представляют собой H, оксазолы общей формулы (VII), предназначенные для получения соединений общей формулы (I)3, могут быть получены в соответствии со способом, представленным на диаграмме 5.4. Карбоксамид общей формулы (VII.ii) обрабатывают α-галогенокетоэфиром общей формулы (VII.iv), где Alk представляет собой радикал алкил (например, метил, этил или трет-бутил) с получением сложного эфира/кислоты общей формулы (VII.xii). Последний восстанавливают в соответствующий спирт общей формулы (VII.xiii), например, под действием литийалюмогидрида или диизобутилалюминий гидрида в растворителе, таком как тетрагидрофуран, если исходным продуктом был сложный эфир, или под действием диборана в тетрагидрофуране, если исходным продуктом была кислота. Последний затем может быть преобразован в галогенированное производное общей формулы (VII) в соответствии со способом, известным специалисту в данной области, например, в случае бромированного производного (L = Br) путем взаимодействия с CBr4 в присутствии трифенилфосфина в дихлорметане при комнатной температуре.
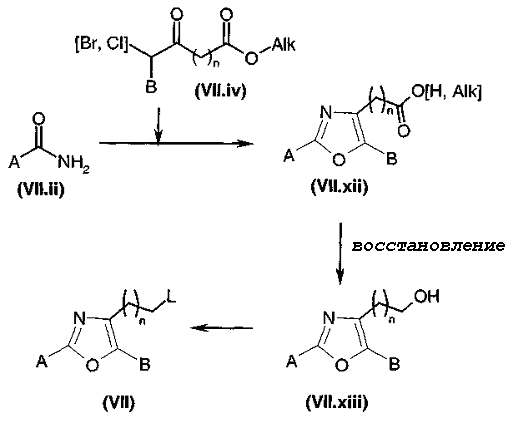
Диаграмма 5.4
Получение кислот общей формулы (VII.i)
Коммерчески недоступные кислоты общей формулы (VII.i) могут быть получены способами из литературы. В частности:- когда A представляет собой фенотиазиниловый радикал, кислоты общей формулы (VII.i) могут быть получены способами, описанными в литературе, так, например, в J. Med. Chem. (1992), 35, 716-724, J. Med. Chem. (1998), 41, 148 -156; Synthesis (1988) 215-217; или J. Chem. Soc. Perkin. Trans. 1 (1998), 351-354;
- когда A представляет собой радикал индолинил, кислоты общей формулы (VII.i) могут быть получены способами, описанными в литературе, так, например, в J. Het. Chem. (1993), 30, 1133-1136 или Tetrahedron (1967), 23, 3823;
- когда A представляет собой радикал фениламинофенил, кислоты общей формулы (VII.i) могут быть получены способами, описанными в литературе, так, например, в J. Amer. Chem Soc. (1940), 62, 3208; Zh. Obshch. Khim. (1953), 23, 121-122 или J. Org. Chem. (1974), 1239-1243;
- когда A представляет собой радикал карбазолил, кислоты общей формулы (VII.i) могут быть получены способами, описанными в литературе, так, например, в J. Amer. Chem Soc., (1941), 63, 1553-1555; J. Chem. Soc. (1934), 1142-1144; J. Chem. Soc. (1945), 945-956; или Can. J. Chem. Soc. (1982), 945-956; и
- когда A представляет собой радикал типа 4-(4-гидроксифенил)фенил, ссылка может быть сделана, например, к следующей публикации: Synthesis, (1993) 788-790.
Получение соединений общей формулы (VIII)
Когда R1 и R2 оба представляют собой H, защищенные аминокислоты общей формулы (VIII) являются либо коммерчески доступными, либо их получают путем защиты коммерчески доступных аминокислот с помощью группы карбаматного типа в соответствии со способами, известными специалисту в данной области.
Когда, по крайней мере, один из R1 и R2 не является H, и n = 0, защищенные аминокислоты общей формулы (VIII) получают в одну стадию, диаграмма 6.1, путем алкилирования в растворителе, таком как тетрагидрофуран, и при низкой температуре коммерчески доступного соединения общей формулы (VIII.i), используя 3 эквивалента бутиллития и приблизительно один эквивалент галогенированного производного общей формулы (VIII.ii), где R1 представляет собой радикал типа алкила, циклоалкила, циклоалкилалкила или арилалкила, и Hal представляет собой атом галогена. В соответствии с этим случаем, второе алкилирование (не представлено на диаграмме 6.1) может проводиться подобным образом, делая возможным получение соединений общей формулы (VIII), где ни R1, ни R2 не являются H.
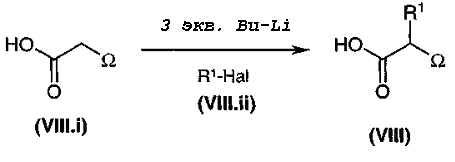
Диаграмма 6.1
Получение имидазолов, тиазолов и оксазолов общей формулы (IX)
Получение промежуточных соединений общей формулы (IX) описано в патентной заявке WO 98/58934 (см. в частности, стр. 10-50 и примеры данного документа) или его проводят аналогично, используя коммерчески доступные исходные продукты.
Получение спиртов общей формулы (X)
Получение соединений общей формулы (X), производных имидазолов
Кислоту общей формулы (X.i) последовательно обрабатывают, диаграмма 8.1, Cs2CO3, соединением общей формулы (V.ii) и NH4OAc, с получением соединения общей формулы (X). Условия реакции аналогичны тем, которые описаны выше для этого типа синтеза.
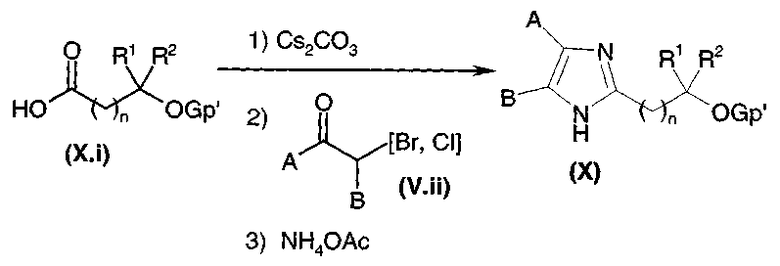
Диаграмма 8.1
Получение соединений общей формулы (X), производных тиазолов
Цианопроизводное общей формулы (X.ii) обрабатывают, диаграмма 8.2, с помощью H2S с получением тиокарбоксамида общей формулы (Х.iii), который конденсировали с соединением общей формулы (V.ii), делая возможным получение соединения общей формулы (X). Условия реакции аналогичны условиям, описанным выше (диаграмма 5.3) для этого типа синтеза.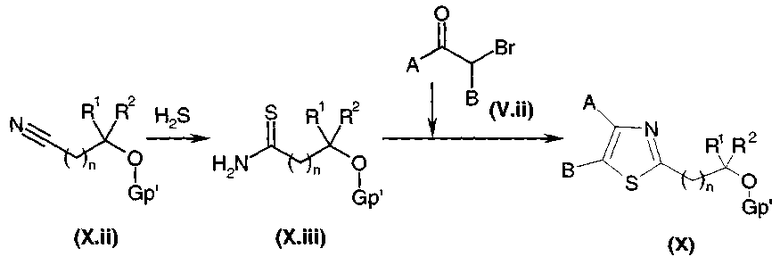
Диаграмма 8.2
Получение кислот общей формулы (XXXVI)
Коммерчески недоступные кислоты общей формулы (XXXVI) могут быть получены способами, описанными в литературе или сходными способами, адаптированными специалистом в данной области. В частности:
- когда A представляет собой фенотиазиниловый радикал, кислоты общей формулы (XXXVI) могут быть получены способами, описанными в литературе, так, например, J. Org. Chem., (1956), 21, 1006; Chem. Abstr., 89, 180029 и Arzneimittel Forschung (1969), 19, 1193.
- Когда A представляет собой радикал дифениламин, кислоты общей формулы (XXXVI) могут быть получены способами, описанными в литературе, так, например, в Chem Ber., (1986), 119, 3165-3197; J. Heterocyclic. Chem. (1982), 15, 1557-1559; Chem. Abstr., (1968), 68, 68730x; или адаптированием этих способов специалистом в данной области;
- когда A представляет собой радикал типа 4-(4-гидроксифенил)фенила, кислоты общей формулы (XXXVI) могут быть получены способами, описанными в литературе, так, например, в Tetrahedron Lett. (1968), 4739 или J. Chem. Soc. (1961), 2898.
- Когда A представляет собой радикал карбазолил, кислоты общей формулы (XXXVI) могут быть получены способами, описанными в литературе, так, например, в J. Amer. Chem., (1946), 68, 2104 или J. Het. Chem (1975), 12, 547-549.
- Когда A представляет собой радикал типа бензопирана или бензофурана, кислоты общей формулы (XXXVI) могут быть получены способами, описанными в литературе, так, например, в Syn. Commun. (1982), 12(8), 57-66; J. Med. Chem. (1995), 38(15), 2880-2886; или Helv. Chim. Acta. (1978), 61, 837-843.
- Когда A представляет собой радикал индолинил или тетрагидрохинолил, кислоты общей формулы (XXXVI) могут быть получены способами, описанными в литературе, так, например, в J. Med. Chem. (1997), 40, (7), 1049-1062; Bioorg. Med. Chem. Lett. (1997), 1519-1524; Chem. Abstr. (1968), 69, 43814k; или Chem. Abstr. (1966), 66, 17538с.
Конечно, наличие функциональных групп фенола, амино или анилина, обусловленное природой заместителей на радикале А соединений общей формулы (XXXVI), может вынудить специалиста в данной области добавить к описанным стадиям стадии защиты/удаления защиты этих функциональных групп таким образом, чтобы они не влияли на остальной химический синтез.
Если не указано иного, все технические и научные термины, используемые здесь, имеют те же значения, что и значения, обычно понятные простому специалисту в области, к которой относится данное изобретение. Аналогично, все публикации, патентные заявки, все патенты и все другие ссылки, указанные здесь, приведены в качестве ссылки.
Следующие примеры приведены для иллюстрации вышеуказанных способов и ни в коем случае не должны рассматриваться как ограничивающие рамки данного изобретения.
Примеры
Пример 1: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[2-(метиламино)этил]-1,3-тиазол-4-ил}фенола:
1.1) Трет-бутил 2-цианоэтил(метил)карбамат:
В дихлорметане (100 мл), содержащем 20,9 мл (0,12 моль) диизопропилэтиламина, растворяли 0,1 моль N-метил-β-аланиннитрила. Смесь охлаждали до 0°C, затем по частям добавляли Boc-O-Boc (26,2 г; 0,12 моль), и смесь перемешивали в течение ночи при температуре окружающей среды. Затем реакционную смесь выливали в ледяную воду и экстрагировали дихлорметаном. Органическую фазу последовательно промывали 10% водным раствором бикарбоната натрия и водой, и, в конце, насыщенным раствором хлорида натрия. Затем органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме. В таком виде полученное коричнево-красное масло использовали на следующей стадии.
1.2) Трет-бутил 3-амино-3-тиоксопропил(метил)карбамат:
В этаноле (40 мл), содержащем триэтиламин (6,1 мл), растворяли 43,4 ммоль промежуточного продукта 1.1. Далее в смесь барботировали H2S в течение 3 часов, затем растворители упаривали досуха. Ожидаемый продукт получают после хроматографии на колонке с силикагелем (элюент: 50% этилацетата в гептане) в виде светло-оранжевого масла. Кристаллизация данного масла из диизопропильного эфира давала белый твердый продукт с выходом 15%. Точка плавления: 104°C.
1.3) 4-[3,5-Бис(1,1-диметилэтил)-4-гидроксифенил]-N-[(1,1-диметилэтокси)карбонил]-N-метил-2-тиазолэтанамин:
Промежуточный продукт 1.2 (2,11 ммоль) и бром-1-(3,5-ди-трет-бутил-4-гидроксифенил)этанон (6,9 г; 2,11 ммоль) растворяли в толуоле (75 мл) в атмосфере аргона, затем смесь перемешивали при температуре окружающей среды в течение 12 часов. Реакционную среду кипятили с обратным холодильником в течение 4 часов. После упаривания растворителей остаток разбавляли дихлорметаном и промывали насыщенным раствором NaCl. Органическую фазу отделяли, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Ожидаемый продукт кристаллизовался в виде белого твердого продукта. Точка плавления: 204°C.
1.4) Гидрохлорид 2,6-ди-трет-бутил-4-{2-[2-(метиламино)-этил]-1,3-тиазол-4-ил}фенола
В этилацетате (20 мл) растворяли 1,95 ммоль промежуточного продукта 1.3. Раствор охлаждали до 0°C, затем барботировали газообразный HCl в течение 10 минут. Смеси давали нагреться до температуры окружающей среды при перемешивании. После фильтрации и сушки в вакууме ожидаемый продукт выделяли в виде белых кристаллов, которые промывали эфиром. Количественный выход. Точка плавления: 206-208°C.
Пример 2: 2,6-Ди-трет-бутил-4-[4-(гидроксиметил)-1,3-оксазол-2-ил]фенол:
Данное соединение может быть получено в соответствии со способом, аналогичным описанному для промежуточного продукта 1.C в заявке PCT WO 99/09829, где 4-хлорацетоацетат заменяют на этилбромпируват, и выделенный промежуточный сложный эфир затем восстанавливают, используя DIBAL в дихлорметане при 0°C. Затем реакционную смесь обрабатывают водным раствором NH4Cl и фильтровали на целите, с последующей экстракцией 50/50 смесью дихлорметана и этилацетата. После декантации, сушки над сульфатом магния, фильтрации и упаривания фильтрата, кристаллизация из этанола делала возможным получение ожидаемого продукта в виде белого порошка. Точка плавления: 167-168 °C.
Пример 3: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[1-(метиламино)этил]-1,3-тиазол-4-ил}фенола:
3.1) N'-(Трет-бутоксикарбонил)-N'-метилаланинамид:
В диметоксиэтане растворяли 12 ммоль Boc-N-Me-DL-Ala-OH. По каплям добавляли N-метилморфолин, затем изобутилхлорформиат. После перемешивания смеси в течение 15 минут при -15°C барботировали аммиак (NH3), затем смесь непрерывно перемешивали при данной температуре в течение ночи. Полученный осадок фильтровали. После сушки продукт использовали таким как он есть в следующей стадии.
3.2) Трет-бутил 2-амино-1-метил-2-тиоксоэтил(метил)-карбамат:
Данное соединение получают путем взаимодействия c P2S5 в условиях, описанных в примере 12 для стадии 12.2.
3.3) Трет-бутил 1-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]этил(метил)карбамат:
Промежуточный продукт 3.2 и бром-1-(3,5-ди-трет-бутил-4-гидроксифенил)этанон конденсировали в соответствии со способом, аналогичным способу, описанному для стадии 1.3.
3.4) Гидрохлорид 2,6-ди-трет-бутил-4-{2-[1-(метиламино)-этил]-1,3-тиазол-4-ил}фенола:
Используемый способ эксперимента аналогичен описанному для стадии 1.4 примера 1, заменяя промежуточный продукт 1.3 на промежуточный продукт 3.3. Ожидаемый продукт получают в виде белого порошка. Точка плавления: 236-237°C.
Пример 4: 2,6-Дит-ретбутил-4-[2-(метоксиметил)-1,3-тиазол-4-ил]фенол;
4.1) Пивалат [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метила:
Промежуточный продукт 4.1 получают в соответствии со способом, идентичным способу, описанному в примере 1, стадия 1.3, используя вместо промежуточного продукта 1.2 2-(трет-бутилкарбонилокси)тиоацетамид и заменяя бензол на толуол. Ожидаемое соединение получают в виде белого твердого продукта с выходом 100%. Точка плавления: 114,6-116,0°C.
4.2) 2,6-Ди-трет-бутил-4-[2-(гидроксиметил)-1,3-тиазол-4-ил]фенол:
Промежуточный продукт 4.1 (1,25 ммоль) растворяли в метаноле (20 мл). Раствор охлаждали, используя ледяную баню, затем по каплям добавляли 1 н. раствор NaOH. Смеси давали нагреться до температуры окружающей среды при перемешивании. После упаривания досуха и разбавления остатка водой, раствор нейтрализовали, используя лимонную кислоту, и экстрагировали дихлорметаном. Перед сушкой над сульфатом магния органическую фазу промывали насыщенным водным раствором хлорида натрия, затем фильтровали и концентрировали в вакууме. Белый твердый продукт получают с выходом 88%. Точка плавления: 126,4-127,4 °C.
4.3) 2,6-Ди-трет-бутил-4-[2-(метоксиметил)-1,3-тиазол-4-ил]фенол:
Промежуточный продукт 4,2 (1 эквивалент) метилировали путем взаимодействия c 1,1 эквивалентом йодметила в присутствии 2 эквивалентов триэтиламина, реакцию осуществляют в тетрагидрофуране. Получают темно-кремовый порошок. Точка плавления: 115,8-117°C.
Пример 5: Гидрохлорид 2,6-ди-трет-бутил-4-{4-[(метиламино)-метил]-1,3-оксазол-2-ил}фенола:
5.1) 2,6-Ди-трет-бутил-4-[4-(бромметил)-1,3-оксазол-2-ил]фенол:
Соединение примера 2 (4,70 ммоль) растворяли в дихлорметане (30 мл). После добавления CBr4 (2,02 г; 6,10 ммоль) реакционную смесь охлаждали до 0°С. По частям добавляли PPh3 (1,48 г; 5,63 ммоль), затем смесь оставляли нагреваться до температуры окружающей среды. Затем реакционную среду выливали в ледяную воду и экстрагировали дихлорметаном. Органическую фазу промывали солевой водой, фильтровали и концентрировали в вакууме, затем сушили над сульфатом магния. Полученное сырое масло является достаточно чистым для того, чтобы непосредственно использовать его в следующей стадии.
5.2) Гидрохлорид 2,6-ди-трет-бутил-4-{4-[(метиламино)-метил]-1,3-оксазол-2-ил}фенола:
В ацетонитриле (50 мл) растворяли 33 ммоль метиламина (2 M раствор в ТГФ). При 0°C добавляли 5,48 ммоль промежуточного продукта 5.1, растворенного в ацетонитриле (50 мл), затем смесь перемешивали при температуре окружающей среды в течение 3 часов. Растворители упаривали, затем остаток распределяли между этилацетатом и 10% водным раствором NaHCO3. Органическую фазу промывали солевой водой, фильтровали и концентрировали в вакууме, затем сушили над сульфатом магния. Затем, растворяя основание в простом эфире и добавляя в эфир 1,2 мл 1 н. раствора HCl, получают гидрохлорид. После фильтрации и промывки эфиром полученного твердого продукта получают темно-оранжевый порошок. Точка плавления: разлагается при 150°C.
Пример 6: N-{[4-(3,5-Ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}ацетамид:
6.1) Бензил {4-[3,5-ди(трет-бутил)-4-гидроксифенил]-1,3-тиазол-2-ил}метилкарбамат:
Данное соединение получают в соответствии со способом, описанным в патентной заявке WO 98/58934 (смотри получение промежуточных продуктов 26.1 и 26.2), используя Z-Gly-NH2 вместо N-Boc саркозинамида. Ожидаемое соединение получают в виде бледно-желтого масла с выходом 99%. MH+ = 453,20
6.2) 4-[2-(Аминометил)-1,3-тиазол-4-ил]-2,6-ди(трет-бутил)фенол:
К раствору 0,106 г (1,1 ммоль) промежуточного продукта 6.1 в 10 мл метанола по каплям добавляли 0,1 мл 40% раствора гидроксида калия. После перемешивания в течение ночи при кипячении с обратным холодильником реакционную смесь концентрировали в вакууме, и остаток разбавляли дихлорметаном и промывали 1 н. раствором HCl, затем 50 мл насыщенного раствора NaCl. Органическую фазу отделяли и сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Ожидаемый продукт получают после хроматографии на колонке с силикагелем (элюент: 5% этанол в дихлорметане) в виде коричневой пены с выходом 76%. MH+ = 319,29.
6.3) N-{[4-(3,5-Ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}ацетамид:
Промежуточный продукт 6.2 (2 ммоль) растворяли в дихлорметане (20 мл). Добавляли триэтиламин (3 ммоль) и смесь охлаждали до 0°C. Затем по каплям добавляли ацетилхлорид (3 ммоль). После завершения добавления смеси давали нагреться до температуры окружающей среды и перемешивали в течение ночи при данной температуре и затем выливали в ледяную воду. Водную фазу экстрагировали дихлорметаном, и полученную органическую фазу промывали солевой водой, затем сушили над сульфатом магния. После фильтрации и упаривания растворителей и далее хроматографии на колонке с силикагелем (элюент: 3% этанол в дихлорметане) получают ожидаемый продукт с выходом 79%. Темно-кремовая пена. MH+ = 361,2.
Пример 7: Этил [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метилкарбамат:
Раствор, содержащий промежуточный продукт 6.2, описанный выше (5 ммоль), и 5 мл 1 н. раствора гидроксида натрия, охлаждали до 10°C. Одновременно добавляли этилхлорформиат (5 ммоль) и 2,5 мл 2 н. раствора гидроксида натрия. После перемешивания в течение 16 часов при 23°C для установления значения pH, равным 4-5, добавляли приблизительно 0,5 мл раствора концентрированной соляной кислоты (приблизительно 11 н.). Полученное масло экстрагировали этилацетатом (2x5 мл), промывали водой, затем сушили над сульфатом магния. Растворители упаривали и ожидаемый продукт получали в виде белых кристаллов. MH+ =391,2.
Пример 8: 2,6-Ди-трет-бутил-4-[2-(морфолин-4-илметил)-1,3-тиазол-4-ил]фенол;
8.1) 4-[2-(Бромметил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенол:
В дихлорметане (30 мл) растворяли 1,5 г (4,70 ммоль) промежуточного продукта 4.2, (2,6-ди-трет-бутил-4-[2-(гидроксиметил)-1,3-тиазол-4-ил]фенола. После добавления CBr4 (2,02 г; 6,10 ммоль) реакционную среду охлаждали до 0°C. Добавляли по частям PPh3 (1,48 г; 5,63 ммоль), затем смесь оставляли нагреваться до температуры окружающей среды. Затем реакционную среду выливали в ледяную воду и экстрагировали дихлорметаном. Органическую фазу промывали солевой водой, фильтровали и концентрировали в вакууме, затем сушили над сульфатом магния. Ожидаемый продукт получают после хроматографии на колонке с силикагелем (элюент: 30% этилацетат в гептане) с выделением коричневого масла с выходом 92%. Данный продукт являлся достаточно чистым для использования его непосредственно в следующей стадии. MH+ = 382,20.
8.2) 2,6-Ди-трет-бутил-4-[2-(морфолин-4-илметил)-1,3-тиазол-4-ил]фенол:
В диметилформамиде (15 мл) растворяли 1,57 ммоль морфолина и 0,4 мл (2,62 ммоль) триэтиламина. Добавляли 0,400 г (1,05 ммоль) промежуточного продукта 8.1, растворенного в диметилформамиде (5 мл), затем смесь перемешивали при температуре окружающей среды в течение 18 часов. Потом реакционную среду выливали в ледяную воду и экстрагировали этилацетатом. Органическую фазу промывали солевой водой, фильтровали и концентрировали в вакууме, затем сушили над сульфатом магния. Ожидаемый продукт получают после хроматографии на колонке с силикагелем (элюент: 50% этилацетат в гептане) с получением оранжевого масла с выходом 92%. Получают светло-кремовые кристаллы. Точка плавления: 136,7-137,2°C.
Пример 9: 2,6-Ди-трет-бутил-4-[2-(тиоморфолин-4-илметил)-1,3-тиазол-4-ил]фенол:
Используемый способ является аналогичным способу, который описан в примере 8, заменяя на второй стадии морфолин на тиоморфолин. Ожидаемый продукт получают в виде светло-оранжевого твердого продукта. Точка плавления: 153,4-154,6°C.
Пример 10: 4-[2-(Анилинометил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенол;
Используемый способ является таким же, как способ, описанный в примере 8, заменяя во второй стадии морфолин на анилин. Ожидаемый продукт получали в виде коричневых кристаллов. Точка плавления: 147,2-148,0°C.
Пример 11: 2,6-Ди-трет-бутил-4-(2-{[[2-(диметиламино)этил]-(метил)амино]метил}-1,3-тиазол-4-ил)фенол:
11.1) Гидрохлорид 4-[3,5-бис(1,1-диметилэтил)-4-гидроксифенил]-N-метил-2-тиазолметанамина:
Данное соединение получали, используя способ, идентичный способу стадий 14.1-14.4 примера 14 (смотри ниже).
11.2) 2,6-Ди-трет-бутил-4-(2-{[[2-(диметиламино)этил]-(метил)амино]метил}-1,3-тиазол-4-ил)фенол:
К раствору 1 ммоль промежуточного продукта 11.1 в 20 мл диметилформамида по каплям добавляли 5 ммоль триэтиламина и небольшой избыток (1,2 ммоль) N-диметил-N-(2-хлорэтил)амина при температуре окружающей среды в атмосфере аргона. После перемешивания в течение 24 часов при 80°C реакционную смесь выливали в ледяную воду, затем экстрагировали этилацетатом, промывали насыщенным раствором NaCl, сушили над сульфатом магния и раствор концентрировали. После хроматографии на колонке с силикагелем (элюент:дихлорметан, содержащий 5% этанол со следами аммиака) получают ожидаемый продукт. После упаривания чистые фракции давали коричневое вязкое масло. MH+ = 404,26.
Пример 12: Гидрохлорид 2,6-ди-трет-бутил-4-{5-метил-2-[(метиламино)метил]-1,3-тиазол-4-ил}фенола:
12.1) N-Boc-саркозинамид:
В дихлорметане, содержащем 46,2 мл (0,265 моль) диизопропилэтиламина, растворяли 15,0 г (0,120 моль) саркозинамидгидрохлорида (N-Me-Gly-NH2•HCl). Смесь охлаждали до 0°C, затем по частям добавляли Boc-O-Boc (28,8 г; 0,132 моль), и смесь перемешивали в течение ночи при температуре окружающей среды. Затем реакционную среду выливали в ледяную воду и экстрагировали дихлорметаном. Органическую фазу промывали последовательно 10% водным раствором бикарбоната натрия и водой, затем, в конце, насыщенным раствором хлорида натрия. Затем органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученный продукт очищали путем кристаллизации из диизопропилового эфира с получением белого твердого продукта с выходом 72%. Точка плавления: 103°C.
12.2) 2-{[(1,1-Диметилэтокси)карбонил]метил}амино-этантиоамид:
В диметоксиэтане (500 мл) растворяли 16,0 г (0,085 моль) промежуточного продукта 12.1, и полученный раствор охлаждали до 5°C. Затем небольшими порциями добавляли бикарбонат натрия (28,5 г; 0,34 моль) и (P2S5)2 (38,76 г; 0,17 моль). Реакционной смеси давали нагреться до температуры окружающей среды при перемешивании в течение 24 часов. После упаривания растворителей в вакууме к остатку добавляли 10% водный раствор бикарбоната натрия, и раствор экстрагировали, используя этилацетат. Органическую фазу последовательно промывали 10% водным раствором бикарбоната натрия и водой, затем, в конце, насыщенным раствором хлорида натрия. Затем органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученный продукт очищали путем кристаллизации из эфира с получением окрашенного в белый цвет твердого продукта с выходом 65%. Точка плавления: 150-151°C.
12.3) Бром-1-(3,5-ди-трет-бутил-4-гидроксифенил)пропан-1-он:
Данное соединение получают простым способом путем взаимодействия 1-(3,5-ди-трет-бутил-4-гидроксифенил)пропан-1-она (полученного из 2,6-ди-трет-бутилфенола в соответствии с Russ. J. Org. Chem. (1997), 33, 1409-1416) с бромом в уксусной кислоте, или также в соответствии со способом, описанным в одной из следующих ссылок: Biorg. Med. Chem. Lett.(1996), 6(3), 253-258; J. Med. Chem. (1988), 31(10), 1910-1918; J. Am. Chem. Soc. (1999), 121, 24.
12.4) 5-Метил-4-[3,5-бис(1,1-диметилэтил)-4-гидроксифенил]-N-[(1,1-диметилэтокси)карбонил]-N-метил-2-тиазолметанамин:
Промежуточный продукт 12.2 (4,3 г; 2,11 ммоль) и промежуточный продукт 12.3 (2,11 ммоль) растворяли в толуоле (75 мл) в атмосфере аргона, затем смесь перемешивали при температуре окружающей среды в течение 12 часов. Реакционную среду кипятили с обратным холодильником в течение 4 часов. После упаривания растворителей остаток разбавляли этилацетатом и промывали 10% раствором NaHCO3, затем насыщенным раствором NaCl. Органическую фазу отделяли, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Ожидаемый продукт получают после хроматографии на колонке с силикагелем (элюент: 30% этилацетат в гептане). Полученное масло использовали в данном виде в следующей стадии.
12.5) Гидрохлорид 2,6-ди-трет-бутил-4-{5-метил-2-[(метиламино)метил]-1,3-тиазол-4-ил}фенола:
Данное соединение получают в виде белого порошка в соответствии со способом эксперимента, аналогичным способу стадии 1.4 примера 1. Точка плавления: 140-142°C.
Пример 13: Гидрохлорид 1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанамина:
13.1) 2-Хлор-1-(10H-фенотиазин-2-ил)этанон:
2-Хлор-1-[10-(хлорацетил)-10H-фенотиазин-2-ил)этанон получают из фенотиазина в соответствии со способом, описанным в литературе (J. Heterocyclic. Chem. (1978), 15, 175 и Arzneimittel Forschung, (1962), 12, 48), а затем реакцией удаления защиты в кислой среде (уксусная кислота и хлористоводородная кислота) хлорацетильной группы (которая служит для защиты позиции 10 фенотиазина в реакции Фриделя-Крафтса).
13.2) Бензил 2-амино-2-тиоксоэтилкарбамат:
В диметоксиэтане растворяли 85 ммоль Z-Gly-NH2 (500 мл), и полученный раствор охлаждали до 5°C. Затем небольшими порциями добавляли бикарбонат натрия (28,5 г; 0,34 моль) и (P2S5)2 (38,76 г; 0,17 моль). Реакционной смеси давали нагреться до температуры окружающей среды при перемешивании в течение 24 часов. После упаривания растворителей в вакууме к остатку добавляли 10% водный раствор бикарбоната натрия, и раствор экстрагировали, используя этилацетат. Органическую фазу последовательно промывали 10% водным раствором бикарбоната натрия и водой, затем, в конце, насыщенным раствором хлорида натрия. Потом органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Затем полученный продукт очищали путем кристаллизации из простого эфира.
13.3) Бензил [4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамат:
Осуществляют реакцию присоединения промежуточных продуктов 13.1 и 13.2 в соответствии со способом, аналогичным способу, описанному для стадии 1.3 примера 1.
13.4) Гидрохлорид 1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанамина
Используемый способ аналогичен способу, описанному для стадии 1.4 примера 1, заменяя промежуточный продукт 1.3 на промежуточный продукт 13.3. После сушки в вакууме ожидаемый продукт получают в виде темно-зеленого порошка. Точка плавления:> 275°C.
Пример 14: N-{[4-(3,5-Ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-N-метилацетамид:
14.1) N-Boc-саркозинамид:
Получение данного соединения уже было описано для стадии 12.1 примера 12.
14.2) 2-{[(1,1-Диметилэтокси)карбонил]метил}-аминоэтантиоамид:
Получение данного соединения было описано для стадии 12.2 примера 12.
14.3) 4-[3,5-бис(1,1-диметилэтил)-4-гидроксифенил]-N-[(1,1-диметилэтокси)карбонил]-N-метил-2-тиазолеметанамин:
Промежуточный продукт 14.2 (4,3 г; 2,11 ммоль) и бром-1-(3,5-ди-трет-бутил-4-гидроксифенил)этанон (6,9 г; 2,11 ммоль) растворяли в бензоле (75 мл) в атмосфере аргона, затем смесь перемешивали при температуре окружающей среды в течение 12 часов. Реакционную среду кипятили с обратным холодильником в течение 4 часов. После упаривания растворителей остаток разбавляли дихлорметаном и промывали насыщенным раствором NaCl. Органическую фазу отделяли, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Ожидаемый продукт получают после хроматографии на колонке с силикагелем (элюент: 20% этилацетата в гептане) в виде масла, которое очень медленно кристаллизовалось в холодильнике с выходом 28%. Точка плавления: 126,5-127,3°C.
14.4) Гидрохлорид 4-[3,5-бис(1,1-диметилэтил)-4-гидроксифенил]-N-метил-2-тиазолеметанамина:
В этилацетате (20 мл) растворяли 1,95 ммоль промежуточного продукта 14.3. Раствор охлаждали до 0°C, затем барботировали газообразным HCl в течение 10 минут. Смесь оставляли нагреваться до температуры окружающей среды при перемешивании. После фильтрации и сушки в вакууме получали ожидаемый продукт (количественный выход).
14.5) N-{[4-(3,5-Ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-N-метилацетамид:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 6.3 примера 6, заменяя промежуточный продукт 6.2 на промежуточный продукт 14.5. Белые кристаллы. Точка плавления: 132,3-133,1°C.
Пример 15: Гидрохлорид 1-[4-(3,5-ди-трет-бутил-4-метоксифенил)-1,3-тиазол-2-ил]-N-метилметанамина:
15.1) 4-[3,5-Бис(1,1-диметилэтил)-4-метоксифенил]-N-[(1,1-диметилэтокси)карбонил]-N-метил-2-тиазолеметанамин:
Промежуточный продукт 14.3 метилировали путем взаимодействия метилйодида в присутствии NaH в тетрагидрофуране с получением ожидаемого продукта. Полученное коричневое масло в данном виде использовали на следующей стадии.
15.2) Гидрохлорид 1-[4-(3,5-ди-трет-бутил-4-метоксифенил)-1,3-тиазол-2-ил]-N-метилметанамина
Способ аналогичен способу стадии 14.4 примера 14, заменяя промежуточный продукт 14.3 на промежуточный продукт 15.1 и этилацетат, замененный на смесь этилацетата и эфира. Ожидаемый продукт получают в виде светло-кремовых кристаллов. Точка плавления: 218,4-219,6°C.
Пример 16: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[(этиламино)метил]-1,3-тиазол-4-ил}фенола:
Способ идентичен способу, используемому на стадиях 14.1-14.4 примера 14, заменяя на первой стадии N-саркозинамид на N-этилглицинамид (J. Med. Chem. (1995), 38(21), 4244-4256). Белые кристаллы. Точка плавления: 232,4-234,6°C.
Пример 17: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[(4-фенилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола:
Используемый способ аналогичен способу, описанному в примере 8, заменяя на второй стадии морфолин на 4-фенилпиперазин. Светло-кремовые кристаллы. Точка плавления: 225,3-226,9°C.
Пример 18: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[(4-метил-1,4-диазепан-1-ил)метил]-1,3-тиазол-4-ил}фенола:
Используемый способ аналогичен способу, описанному в примере 8, заменяя на второй стадии морфолин на N-метилгомопиперазин. Белые кристаллы. Точка плавления: 222,1-225,4°C.
Пример 19: Гидрохлорид N-{1-[4-(4-анилинофенил)-13-тиазол-2-ил]этил}-N-метиламина:
19.1) 7-(4-Анилинофенил)этанон
В диметилформамиде (75 мл) растворяли 4-аминоацетофенон (4,87 г; 36,0 ммоль). Добавляли 15 г (0,108 моль) карбоната калия (предварительно высушенного при 170°C в атмосфере аргона), 7,236 г (36,0 ммоль) йодбензола, 0,4 г меди в виде порошка и каталитическое количество йодида меди. Реакционную смесь кипятили с обратным холодильником в течение 12 часов. Затем реакционной среде давали нагреваться до температуры окружающей среды, порошок йодида меди фильтровали на целите и выливали в ледяную воду. После экстракции этилацетатом органическую фазу промывали водой и сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученный продукт очищали путем кристаллизации из гептана с получением желтого твердого продукта с выходом 53,4%. Точка плавления: 105°C.
19.2) N-(4-ацетилфенил)-N-фенилацетамид:
Данное соединение получают в соответствии со способом, предложенным в Tetrahedron (1980), 36, 3017-3019. Промежуточный продукт 19.1 (60 ммоль) суспендировали в 150 мл уксусного ангидрида. Добавляли 70% перхлорную кислоту (0,5 мл). После нагревания в течение 15 минут при 70°C смесь выливали в лед и полученный осадок фильтровали. После сушки в вакууме, повторного растворения в дихлорметане и обработки активированным углем суспензию фильтровали на целите, и растворители упаривали. После кристаллизации из гептана получали желтый твердый продукт с выходом 54,2%. Точка плавления: 118-120°C (литературные данные: 122-123°C).
19.3) N-[4-(бромацетил)фенил]-N-фенилацетамид
Промежуточный продукт 19.2 (0,633 г; 2,5 ммоль) растворяли в метаноле (20 мл) и добавляли 1 г (2,0 ммоль) бромированного полимера PVPHP (J. Macromol. Sci. Chem. (1977), A11, (3), 507-514). После перемешивания в атмосфере аргона в течение 4 часов смолистые продукты отфильтровывали и промывали метанолом. После упаривания отфильтрованных растворителей и кристаллизации из метанола получают белый твердый продукт с выходом 59%. Точка плавления: 152-153°C.
19.4) Трет-бутил (4-{4-[ацетил(фенил)амино]фенил}-1,3-тиазол-2-ил)метил(метил)карбамат:
Промежуточный продукт 19.3 (2,11 ммоль) и промежуточный продукт 3.2 (2,11 ммоль) растворяли в толуоле (75 мл) в атмосфере аргона, затем смесь перемешивали при температуре окружающей среды в течение 12 часов. Реакционную среду кипятили с обратным холодильником в течение 4 часов. После упаривания растворителей остаток разбавляли дихлорметаном и промывали насыщенным раствором NaCl. Органическую фазу отделяли, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Получают ожидаемый продукт и в таком виде использовали в следующей стадии.
19.5) Гидрохлорид N-{1-[4-(4-анилинофенил)-1,3-тиазол-2-ил]этил}-N-метиламина
Промежуточный продукт 19.4 (1,5 ммоль) обрабатывают концентрированной HCl (15 мл) и уксусной кислотой (30 мл). После кипячения с обратным холодильником в течение 24 часов и упаривания растворителей остаток обрабатывали толуолом, растворители вновь упаривали, затем продукт кристаллизовали из небольшого количества воды. Получают серый порошок. Точка плавления: > 250°C.
Пример 20: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[(изопропиламино)метил]-1,3-тиазол-4-ил}фенола:
Промежуточный продукт 6.2 (2 ммоль), в растворе в метаноле (20 мл) подвергали взаимодействию с ацетоном (2,2 ммоль), NaBH4 (2,2 ммоль) в присутствии молекулярных сит. Затем продукт реакции преобразуют в гидрохлорид в соответствии со способом, аналогичным способу стадии 1.4 примера 1. Белые кристаллы. Точка плавления: 197,1-198,8°C
Пример 21: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[(циклогексиламино)метил]-1,3-тиазол-4-ил]фенола:
Используемый способ аналогичен способу, описанному в примере 20, заменяя ацетон на циклогексанон. Белые кристаллы. Точка плавления: 202,1-203,4°C.
Пример 22: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[(4-изопропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола:
Используемый способ аналогичен способу, описанному в примере 8, заменяя на второй стадии морфолин на N-изопропилпиперазин. Белые кристаллы. Точка плавления: 238,4-239,7°C.
Пример 23: Гидрохлорид N-метил-1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]этанамина:
Используемый способ аналогичен способу, описанному для стадии 19.4 примера 19, заменяя промежуточный продукт 19.3 на промежуточный продукт 13.1, эта стадия следует за стадией, аналогичной стадии 1.4 примера 1 с получением гидрохлорида. Темно-зеленый порошок. Точка плавления: > 250°C.
Пример 24: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[(4-этилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола:
Используемый способ аналогичен способу, описанному в примере 8, заменяя на второй стадии морфолин на N-этилпиперазин. Белые кристаллы. Точка плавления: 247,0-248,8°C.
Пример 25: Гидрохлорид N-{[4-(4-анилинофенил)-1,3-тиазол-2-ил]метил}-N-этиламина:
Используемый способ аналогичен способу, описанному для стадий 14,1-14,4 примера 14, заменяя саркозинамид на N-этил-глицинамид (J. Med. Chem. (1995), 38(21), 4244-56) и заменяя бром-1-(3,5-ди-трет-бутил-4-гидроксифенил)этанон на промежуточный продукт 19.3. Темно-зеленый порошок. Точка плавления: > 250°C.
Пример 26: Гидрохлорид N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}этаномина:
Используемый способ аналогичен способу, описанному для стадий 14.1 - 14.4 примера 14, заменяя саркозинамид на N-этил-глицинамид (J. Med. Chem. (1995), 38(21), 4244-56), и заменяя бром-1-(3,5-ди-трет-бутил-4-гидроксифенил)этанон на промежуточный продукт 13.1. Темно-зеленый порошок. Точка плавления: > 250°C.
Пример 27: Гидрохлорид 2,6-ди-трет-бутил-4-(2-{[4-(диметиламино)пиперидин-1-ил]метил}-1,3-тиазол-4-ил)фенола:
Используемый способ аналогичен способу, описанному в примере 8, заменяя морфолин на второй стадии на 4-диметиламинопиперидин (J. Med. Chem. (1983), 26, 1218-1223 or J. Chem. Soc. (1957), 3165-3172). Темно-зеленый порошок. Точка плавления: 113,0-113,4°C.
Пример 28: Гидрохлорид 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-ола:
28.1) 1-{[4-(3,5-Ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-ол
Используемый способ аналогичен способу, описанному в примере 8, заменяя морфолин на пиперидин-4-он гидрохлорид (J. Org. Chem. (1949), 14, 530-535), и 2 дополнительных эквивалента триэтиламина использовали на второй стадии. Полученный продукт в таком виде использовали на следующей стадии.
28.2) Гидрохлорид 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-ола:
Промежуточный продукт 28.1 восстанавливают до спирта путем взаимодействия с NaBH4 в метаноле. После завершения реакции в реакционную среду добавляли дихлорметан и солевую воду. Водную фазу экстрагировали дихлорметаном и промывали солевой водой. Объединенные органические фазы сушили над сульфатом магния и растворители упаривали. Полученный продукт предварительно растворяли в этилацетате, и раствор охлаждали до 0°C. Медленно добавляли 1 н. раствор HCl в эфире (3 эквивалента), при добавлении температуру смеси поддерживали равной 0°C, затем оставляли нагреваться до температуры окружающей среды, перемешивали в течение 12 часов. Получают ожидаемый продукт в виде белого твердого продукта. Точка плавления: 215,4-218,2°C.
Пример 29: 4-Метилпентил 2-[4-(1,1'-,бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
29.1) N-{[(4-Метилпентил)окси]карбонил}-β-аланин:
В раствор, содержащий 4-метил-1-пентанол (5 г; 0,049 моль) в 80 мл дихлорметана, добавляли трифосген при 23°C (5,3 г; 0,019 моль). Смесь охлаждали до 0°C, затем по каплям добавляли пиридин (3,8 г; 0,049 моль). Смесь доводили до 23°C и перемешивали в течение 2 часов. Растворители упаривали, используя роторный испаритель. После растирания в эфире, полученный белый твердый продукт фильтровали на фритте. Отфильтрованный эфир упаривали. Смесь, содержащую β-аланин (4,4 г, 0,049 моль) и 50 мл 1 н. раствора гидроксида натрия, охлаждали до 10°C. Одновременно в смесь β-аланина и гидроксида натрия, полученного выше, добавляли предварительно полученный свежий хлорид 4-метилпентилкарбоната и 50 мл 1 н. раствора гидроксида натрия при 5°C. После перемешивания в течение 16 часов при 23°C, для установления уровня pH до 4-5, добавляли приблизительно 80 мл раствора соляной кислоты (приблизительно 1 н.) с получением светло-белого осадка. Реакционную смесь экстрагировали этилацетатом (2 x 50 мл), и экстракт промывали водой, затем сушили над сульфатом магния. Получают бесцветное масло (7,2 г; выход 68%).
ЯМР H1 (δ м.д., ДМСО): 0,85 (дкв, 6H); 1,15 (м, 2H); 1,49-1,53 (м, 3H); 2,35 (т, 2H); 3,14-3,19 (м, 2H); 3,88-3,91 (м, 2H); 7,04 (се, 1H); 12 (се, 1H)
29.2) 4-Метилпентил 2-[4-(1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Смесь промежуточного продукта 29.1 (4,52 г; 0,021 моль) и карбоната цезия (3,4 г; 0,0105 моль) в 35 мл метанола перемешивали при 23°C в течение 1 часа. Метанол удаляли путем упаривания при пониженном давлении в роторном испарителе. Полученную смесь растворяли в 70 мл диметилформамида, затем добавляли 2-бром-4-фенилацетофенон (5,7 г; 0,021 моль). После перемешивания в течение 16 часов растворитель упаривали при пониженном давлении. Полученную смесь обрабатывали этилацетатом, затем отфильтровывали бромид цезия. Этилацетат из фильтрата упаривали, и реакционное масло обрабатывали смесью ксилолов (300 мл) и ацетата аммония; 0,42 моль). Реакционную смесью кипятили с обратным холодильником в течение приблизительно полутора часов, воду удаляли, используя аппарат Дина-Старка, затем, после охлаждения, смесь ледяной воды и этилацетата выливали в реакционную среду. После декантации органическую фазу промывали насыщенным раствором бикарбоната натрия, сушили над сульфатом магния, затем упаривали в вакууме. После очистки на колонке с силикагелем (элюент: этилацетат-гептан/5-5 - 10-0) получают порошок белого цвета (выход 10%). Точка плавления: 128,3°C. MH+ = 392,3.
Соединения примеров 30-43 получают в соответствии со способами, аналогичными способам, описанным в примере 29 или выше, в части под названием "Получение соединений общей формулы (I)".
Пример 30: 3,3-Диметилбутил 2-[4-(4-пирролидин-1-илфенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 119,2°C. MH+ = 385,3.
Пример 31: Изопентил 2-[4-(1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 128-130°C. MH+ = 378,3.
Пример 32: Гексил 2-[4-(4'-бром-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 138-140°C. MH+ = 470,2.
Пример 33: Бензил 2-[4-(4-трет-бутилфенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 173°C. MH+ = 378,2.
Пример 34: 3,3-Диметилбутил 2-[4-(1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 98,4°C. MH+ = 392,15.
Пример 35: Гексил 2-[4-(4-пирролидин-1-илфенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 110-114°C. MH+ = 385,3.
Пример 36: 4,4,4-Трифторбутил 2-[4-(4-пирролидин-1-илфенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 148,3°C. MH+ = 411,3.
Пример 37: Гексил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 197,4°C. MH+ = 444,4.
Пример 38: 3,3-Диметилбутил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 118-120°C. MH+ = 441,3.
Пример 39: 3,3-Диметилбутил 2-[4-(4-метоксифенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 116,8°C. MH+ = 346,2.
Пример 40: Бензил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 177,5°C. MH+ = 450,3.
Пример 41: Бензил 2-[4-(4-пирролидин-1-илфенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 122,4°C. MH+ = 391,2.
Пример 42: 2-Фенилэтил 2-[4-(1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 142-143°C. MH+ = 412,2.
Пример 43: Бутил 2-[4-(4'-фтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 149,3°C. MH+ = 382,2.
Пример 44: Бутил 2-[4-(1,1'-бифенил-4-ил)-5-метил-1H-имидазол-2-ил]этилкарбамат:
44.1) 1-(1,1'-бифенил-4-ил)пропан-1-он:
Смесь, содержащую фенилборную кислоту (6,1 г; 50 ммоль), 4'-бромпропиофенон (10,65 г; 50 ммоль), карбонат натрия (5,3 г; 50 ммоль) и хлорид палладия (500 мг, 2,8 ммоль) в 300 мл воды кипятили с обратным холодильником в течение 4 часов. Затем добавляли борную кислоту (1 г; 0,8 ммоль) с последующим нагреванием в течение еще 30 минут. Когда температура смеси снижалась до 23°C, добавляли 250 мл этилацетата, потом фильтровали на фритте, затем на бумаге GFA. Фильтрат декантировали, и органическую фазу, перед сушкой над MgSO4, промывали насыщенным раствором NaCl и концентрировали, используя роторный испаритель. Осадок перемешивали в течение 30 минут в 100 мл изопентана и 5 мл дихлорметана. После фильтрации на фритте твердый продукт промывали изопентаном. Получали порошок кремового цвета (8,7 г; 83%). Точка плавления: 98-99°C. MH+ = 211,1
44.2) 1-(1,1'-Бифенил-4-ил)-2-бромпропан-1-он:
Предварительно полученный промежуточный продукт 43.1 перемешивали с бромированным полимером PVPHP (30 г; 2 ммоль Br3/г) в 120 мл толуола в течение 3 часов при температуре, равной приблизительно 5°C. Добавляли приблизительно 15 г бромированного полимера, затем продолжали перемешивать в течение дополнительных 3 часов при 23°C. Вновь добавляли приблизительно 15 г полимера, затем смесь перемешивали в течение 16 часов. Полимер получают путем фильтрации на фритте с последующей промывкой толуолом, затем дихлорметаном. Фильтрат концентрировали досуха, и полученный осадок перемешивали в изопропилацетате в течение 30 минут, затем фильтровали на фритте и промывали изопентаном. Получают порошок кремового цвета (9,58 г; 87%). Точка плавления: 102-104°C. MH+ = 398,2.
44.3) N-(Бутоксикарбонил)-β-аланин:
Раствор, содержащий β-аланин (8,9 г; 0,1 моль) и 100 мл 1 н. раствора гидроксида натрия, охлаждали до 10°C. Добавляли одновременно N-бутилхлорформиат (13,66 г; 0,1 моль) и 50 мл 2 н. раствора гидроксида натрия. После перемешивания в течение 16 часов при 23°C для установления уровня pH, равным 4-5, добавляли приблизительно 10 мл раствора концентрированной соляной кислоты (приблизительно 11 н.). Полученное масло экстрагировали этилацетатом (2 x 50 мл), промывали водой, затем сушили над сульфатом магния. Продукт кристаллизовали из изопентана в виде белого порошка (выход 68%). Точка плавления: 50,5°C.
44.4) Бутил 2-[4-(1,1'-бифенил-4-ил)-5-метил-1H-имидазол-2-ил]этилкарбамат:
Смесь N-(бутоксикарбонил)-β-аланина (полученного на стадии 44.3; 3,27 г; 0,0173 моль) и карбоната цезия (2,81 г; 0,0087 моль) в 50 мл метанола перемешивали при 23°C в течение 1 часа. Метанол удаляли путем упаривания при пониженном давлении в роторном испарителе. Полученную смесь растворяли в 50 мл диметилформамида, затем добавляли промежуточный продукт 44.2 (5 г; 0,0173 моль). После перемешивания в течение 16 часов растворитель упаривали при пониженном давлении. Полученную смесь обрабатывали этилацетатом, затем бромид цезия отфильтровывали. Этилацетат из фильтрата упаривали, и реакционное масло обрабатывали смесью ксилола (80 мл) и ацетата аммония (26,6 г; 0,35 моль). Реакционную смесь кипятили с обратным холодильником в течение приблизительно полутора часов с удалением воды, используя аппарат Дина-Старка, затем, после охлаждения, смесь ледяной воды и этилацетата выливали в реакционную среду. После декантации органическую фазу промывали насыщенным раствором бикарбоната натрия, сушили над сульфатом магния, затем упаривали в вакууме. После очистки на колонке с силикагелем (элюент: CH2Cl2-этанол/9-1) получают бесцветное масло, которое кристаллизовали из смеси изопентана и изопропилового эфира. После фильтрации и сушки получают порошок белого цвета (3,31 г, выход 50%). Точка плавления: 143-144°C. MH+ = 378,2.
Соединения примеров 45 - 49 получают в соответствии со способами, аналогичными способам, описанным в примере 44 или выше в части под названием "Получение соединений общей формулы (I)".
Пример 45: Бутил 2-[4-(4'-метил-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 168,4°C. MH+ = 378,2.
Пример 46: Бутил 2-[4-(4'-хлор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 164,2°C. MH+ = 398,2.
Пример 47: Бутил 2-[4-(2'-фтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 113,8 °C. MH+ = 382,2.
Пример 48: Бутил 2-{4-[4'-(метилтио)-1,1'-бифенил-4-ил]-1H-имидазол-2-ил}этилкарбамат:
Точка плавления: 167,9°C. MH+ = 410,3.
Пример 49: Бутил 2-[4-(2',4'-дифтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 105,7°C. MH+ = 430,2.
Пример 50: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[(пропиламино)метил]-1,3-тиазол-4-ил}фенола:
50.1) 2,6-Ди-трет-бутил-4-{2-[(пропиламино)метил]-1,3-тиазол-4-ил}фенол:
В колбу, содержащую 20 мл безводного MeOH, последовательно добавляли 0,636 г (2,0 ммоль) промежуточного продукта 6.2, 0,16 мл (2,2 ммоль) пропиональдегида и 1 г предварительно активированного порошкообразного 4 Å молекулярного сита, в атмосфере инертного газа. Реакционную смесь интенсивно перемешивали в течение 18 часов и затем добавляли, порциями, 0,083 г (2,2 ммоль) NaBH4. Перемешивали в течение еще 4 часов, затем добавляли 5 мл воды. Спустя четверть часа сито отфильтровывали, и реакционную смесь дважды экстрагировали 100 мл СН2Cl2. Органическую фазу промывали последовательно 50 мл воды и 50 мл солевой воды, затем сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали на колонке с силикагелем (элюент: 30% этилацетат в гептане). Полученное желтое масло использовали в данном виде на следующей стадии.
50.2) Гидрохлорид 2,6-ди-трет-бутил-4-{2-[(пропиламино)-метил]-1,3-тиазол-4-ил}фенола:
Промежуточный продукт 50.1 растворяли в безводном эфире (15 мл). Раствор охлаждали до 0°C, затем по каплям добавляли избыток 1 н. раствора HCl в эфире (0,6 мл). Смесь оставляли нагреваться до температуры окружающей среды при перемешивании. После фильтрации промывали эфиром, затем изопентаном и сушили в вакууме с получением бело-серого твердого продукта с выходом 4%. MH+ = 361,2.
Пример 51: Гидрохлорид N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}-N-пропиламина:
Используемый способ является аналогичным способу, описанному для стадии 50.1 примера 50, заменяя соединение примера 13 на промежуточный продукт 6.2. Получают желто-зеленый твердый продукт с выходом 32%. MH+ = 354,2.
Пример 52: N-{[4-(10H-Фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}бутан-1-амин:
Используемый способ аналогичен способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на бутиламин. Желтый твердый продукт получают с выходом 25,6%. Точка плавления: 139,0-141,0°C.
Пример 53: Гидрохлорид N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пентан-1-амина:
Используемый способ является аналогичным способу, описанному для стадии 50.1 примера 50, заменяя промежуточный продукт 6.2 и пропиональдегид на соединение примера 13 и валеральдегид соответственно. Получают твердый продукт темного цвета с выходом 38%. MH+ = 382,2.
Пример 54: Гидрохлорид (R,S)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-3-ола:
Используемый способ аналогичен способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на (R,S)-3-гидроксипиперидин. Полученный в виде основания продукт переводили в соль в соответствии со способом, описанным для стадии 50.2 с получением светло-кремового твердого продукта с выходом 81%. Точка плавления: 126,9-130,1°C.
Пример 55: Гидрохлорид (R,S)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола:
Используемый способ аналогичен способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на (R,S)-3-гидроксипирролидин. Полученный в виде основания продукт переводили в соль в соответствии со способом, описанным для стадии 50.2 с получением светло-кремового твердого продукта с выходом 93%. Точка плавления: 79,8-83,3°C.
Пример 56: [4-(10H-Фенотиазин-2-ил)-1,3-тиазол-2-ил]метанол:
56.1) [4-(10H-Фенотиазин-2-ил)-1,3-тиазол-2-ил]метилпивалат:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 1.3 примера 1, используя 2-(трет-бутилкарбонилокси)тиоацетамид и 2-бром-1-[10-(хлорацетил)-10H-фенотиазин-2-ил)этанон вместо, соответственно, промежуточного продукта 1.2 и бром-1-(3,5-ди-трет-бутил-4-гидроксифенил)этанона. Ожидаемое соединение получают в виде зеленоватого твердого продукта с выходом 63,2%. Точка плавления: 120,0-122,0°C.
56.2) [4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанол:
Данное соединение получают из промежуточного продукта 56.1 в соответствии со способом, идентичным способу, описанному для стадии 4.2 примера 4. Ожидаемое соединение получают в виде зеленоватого твердого продукта с выходом 61%. Точка плавления: 145,0-147,0°C.
Пример 57: N,N-диметил-N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амин:
57.1) 2-[2-(Бромметил)-1,3-тиазол-4-ил]-10H-фенотиазин:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 8.1 примера 8, используя промежуточный продукт 56.2 вместо промежуточного продукта 4.2. Ожидаемое соединение получают в виде светлых, ярко-золотистых желто-зеленых кристаллов с выходом 42%. Точка плавления: 165-170°C (разлож.).
57.2) N,N-Диметил-N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амин:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 8.2 примера 8, используя промежуточный продукт 57.1 и N,N-диметиламин, соответственно, вместо промежуточного продукта 8.1 и морфолина. Ожидаемое соединение получают в виде желтого твердого продукта с выходом 41,8%. Точка плавления: 155,0-157,0°C.Пример 58: Гидрохлорид 2-{2-[(4-метилпиперазин-1-ил)метил]-1,3-тиазол-4-ил)-10H-фенотиазин:
Используемый способ аналогичен способу, описанному в примере 8, заменяя промежуточный продукт 8.1 и морфолин на стадии 8.2, соответственно, на промежуточный продукт 57.1 и N-метилпиперазин. Полученный в виде основания продукт переводили в соль в соответствии со способом, описанным для стадии 50.2 с получением серого твердого продукта с выходом 67%. Точка плавления: 210,0-212,0°C.
Пример 59: 2-[2-(Пиперидин-1-илметил)-1,3-тиазол-4-ил]-10H-фенотиазин;
Используемая методика эксперимента аналогична методике, описанной в примере 8, заменяя промежуточный продукт 8.1 и морфолин на стадии 8.2, соответственно, на промежуточный продукт 57.1 и пиперидин. Полученный продукт в виде основания осаждали в соответствии с методом, описанным для стадии 50.2 с получением серо-желтого твердого продукта с выходом 67%. Точка плавления: 186,0-188,0°C.
Пример 60: Гидрохлорид 2-[2-(пиперазин-1-илметил)-1,3-тиазол-4-ил]-10H-фенотиазина:
60.1) Трет-бутил 4-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилат:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, используя промежуточный продукт 57.1 и N-трет-бутоксикарбонилпиперазин, соответственно, вместо промежуточного продукта 8.1 и морфолина. Ожидаемое соединение получают с выходом 81,2%. MH+ = 481,2.
60.2) Гидрохлорид 2-[2-(пиперазин-1-илметил)-1,3-тиазол-4-ил]-10Н-фенотиазина:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 1,4 примера 1, заменяя промежуточный продукт 1.3 на промежуточный продукт 60.1. Ожидаемое соединение получают в виде серо-зеленого твердого продукта с выходом 78,9%. Точка плавления: 210,0-215,0°C.
Пример 61: Гидрохлорид 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}азетидин-3-ола:
61.1) Гидрохлорид 1-(дифенилметил)-3-гидроксиазетидина:
Аминодифенилметан (55 г; 0,3 моль) и эпихлоргидрин (23,5 мл; 0,3 моль) смешивали в метаноле (200 мл). Смесь подвергали кипячению с обратным холодильником в течение 5 дней. Затем метанол упаривали с получением бежевого твердого продукта. Этот продукт фильтровали и промывали эфиром с получением белого твердого продукта с выходом 45%. Точка плавления: 186,0-186,4°C.
61.2) Азетидин-3-ол:
Промежуточный продукт 61.1 растворяли в смеси этанол/ТГФ (7:3), к которой добавляли воду для достижения хорошего растворения. Перед помещением смеси в атмосферу водорода под давлением 3 бар при температуре окружающей среды, смесь продували аргоном, затем водородом. После фильтрации и промывки этанолом растворители упаривали, и пастообразный остаток обрабатывали эфиром. Полученный твердый продукт фильтровали и промывали эфиром с получением белого твердого продукта (выход 86%). Точка плавления: 74,0-76,8°C.
61.3) Гидрохлорид 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}азетидин-3-ола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя морфолин на стадии 8.2 на промежуточный продукт 61.2. Полученный в виде основания продукт переводили в соль в соответствии со способом, описанным для стадии 50.2 с получением светло-кремового твердого продукта с выходом 74%. Точка плавления: 124,2-126,5°C.
Пример 62: 2-[2-(Морфолин-4-илметил)-1,3-тиазол-4-ил]-10H-фенотиазин:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 промежуточный продукт 8.1 на промежуточный продукт 57.1 с получением не совсем белого твердого продукта с выходом 86,0%. Точка плавления: 203,0-205,0°C.
Пример 63: 2-[2-(Тиоморфолин-4-илметил)-1,3-тиазол-4-ил]-10H-фенотиазин:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2, соответственно, промежуточный продукт 8.1 и морфолин на промежуточный продукт 57.1 и тиоморфолин. Ожидаемый продукт получают в виде желтого твердого продукта с выходом 80,8%. Точка плавления: 229,0-231,0°C.
Пример 64: 2-{2-[(4-Метил-1,4-диазепан-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазин:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2, соответственно, промежуточный продукт 8.1 и морфолин на промежуточный продукт 57.1 и гомопиперазин. Ожидаемый продукт получают в виде желтого твердого продукта с выходом 27,0%. Точка плавления: 135-137°C.
Пример 65: Гидрохлорид (3R)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на (R)-3-пирролидинол. Полученный в виде основания продукт переводили в соль в соответствии со способом, описанным на стадии 50.2 с получением белого твердого продукта с выходом 93%. Точка плавления: 162,0-164,6°C.
Пример 66: Гидрохлорид (3S)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на (S)-3-пирролидинол. Полученный в виде основания продукт переводили в соль в соответствии со способом, описанным для стадии 50.2 с получением белого твердого продукта с выходом 93%. Точка плавления: 162,8-165,9°C.
Пример 67: Гидрохлорид 2,6-ди-трет-бутил-4-[2-(пирролидин-1-илметил)-1,3-тиазол-4-ил]фенола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на пирролидин. Полученный в виде основания продукт переводили в соль в соответствии со способом, описанным для стадии 50.2 с получением не совсем белого твердого продукта с выходом 73%. Точка плавления: 188,0-195,0°C.
Пример 68: Гидрохлорид 2,6-ди-трет-бутил-4-{2-(бутиламино)-метил]-1,3-тиазол-4-ил}фенола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на бутиламин. Полученный в виде основания продукт переводили в соль в соответствии со способом, описанным для стадии 50.2, с получением не совсем белого твердого продукта с выходом 72%. Точка плавления: 179,7-180,2°C.
Пример 69: 2-{2-[(4-Этилпиперазин-1-ил)метил-1,3-тиазол-4-ил}-10H-фенотиазин:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя, соответственно, промежуточный на стадии 8.2 продукт 8.1 и морфолин на промежуточный продукт 57.1 и N-этилпиперазин. Ожидаемый продукт получают в виде белого твердого продукта с выходом 57.7%. Точка плавления: 182,0-184,0°C.
Пример 70: Гидрохлорид N-метил-N-{[4-(10H-фенотиазин-2-ил)-1H-имидазол-2-ил]метил}амина:
70.1) Трет-бутилметил{[4-(10H-фенотиазин-2-ил)-1H-имидазол-2-ил]метил}карбамат:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 44.4 примера 44, заменяя, соответственно, N-(бутоксикарбонил)-β-аланин и промежуточный продукт 44.2 на Boc-Sar-OH и 2-хлор-1-[10-(хлорацетил)-10H-фенотиазин-2-ил)этанон (сравни стадия 13.1 примера 13) при этом заменяя на стадии 44.4 этанол на метанол. Ожидаемый продукт получают с выходом 81,6% и использовали в данном виде на следующей стадии.
70.2) Гидрохлорид N-метил-N-{[4-(10H-фенотиазин-2-ил)-1H-имидазол-2-ил]метил}амина:
Перед преобразованием в гидрохлорид у промежуточного продукта 70.1 удаляли защитные группы в соответствии с методом, аналогичным методу, используемому на стадии 1.4 примера 1. Ожидаемый продукт получают в виде коричневого порошка с выходом 53,7%. Точка плавления: 190,0-195,0°C.
Пример 71: Метил [4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамат:
Соединение примера 13 (0,622 г; 2,0 ммоль) растворяли в диоксане (100 мл), охлаждали до 0°C. Добавляли триэтиламин, затем, по каплям, метилхлорформиат (2,5 ммоль). Затем реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды и выливали в ледяную воду и экстрагировали этилацетатом. Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Ожидаемый продукт очищали на колонке с силикагелем (элюент: 10% ацетон в дихлорметане). Чистые фракции собирали, и растворители упаривали с получением не совсем белого твердого продукта с выходом 46,0%. Точка плавления: 151-153°C.
Пример 72: Бутил [4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамат:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 71, используя н-бутилхлорформиат вместо метилхлорформиата. Ожидаемый продукт получают в виде желтого твердого продукта с выходом 61,0%. Точка плавления: 186,0-188,0°C.
Пример 73: N-Неопентил-N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амин:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 50.1 примера 50, заменяя, соответственно, промежуточный продукт 6.2 и пропиональдегид на соединение примера 13 и пивальдегид. Ожидаемый продукт получают в виде не совсем белого твердого продукта с выходом 40,6%. Точка плавления: 172,0-174,0°C.
Пример 74: 1-{[4-(10H-Фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперидин-4-ол:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2, соответственно, промежуточный продукт 8.1 и морфолин на промежуточный продукт 57.1 и 4-гидроксипиперидин. Ожидаемый продукт получают в виде белого твердого продукта с выходом 52,5%. Точка плавления: 205,0-207,0°C.
Пример 75: N-{[4-(10H-Фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}ацетамид:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 6, заменяя на стадии 6.3 промежуточный продукт 6.2 на соединение примера 13. Ожидаемый продукт получают в виде желтого твердого продукта с выходом 25,0%. Точка плавления: 219,0-221,0°C.
Пример 76: N-{[4-(10H-Фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}бутанамид:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 6, заменяя на стадии 6.3, соответственно, промежуточный продукт 6.2 и ацетилхлорид на соединение примера 13 и бутаноилхлорид. Ожидаемый продукт получают в виде желтого твердого продукта с выходом 47,2%. Точка плавления: 218,0-220,0°C.
Пример 77: 2,6-Ди-трет-бутил-4-{2-[(4-пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенол:
77.1) Гидрохлорид трет-бутил 4-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилата:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя морфолин на стадии 8.2 на N-Boc-пиперазин. Получают бледно-оранжевый твердый продукт с выходом 64%. Точка плавления: 108-109°C.
77.2) Гидрохлорид 2,6-ди-трет-бутил-4-[2-(пиперазин-1-илметил)-1,3-тиазол-4-ил]фенола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 1.4, заменяя промежуточный продукт 1.3 на промежуточный продукт 77.1. Получают белый твердый продукт с выходом 86%. Точка плавления: 255,4-257,7°C.
77.3) 2,6-Ди-трет-бутил-4-{2-[(4-пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенол:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 50.1 примера 50, заменяя промежуточный продукт 6.2 на промежуточный продукт 77.2, и добавляя сначала избыток триэтиламина для преобразования промежуточного продукта 77.2 в соответствующее основание. Ожидаемый продукт получают в виде не совсем белого твердого продукта с выходом 45%. Точка плавления: 236,5-238,2°C.
Пример 78: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[2-метил-1-(метиламино)пропил]-1,3-тиазол-4-ил}фенола:
78.1) N-(Трет-бутоксикарбонил)-N-метилвалин:
N-метил-D,L-валин (10,0 г; 0,0763 моль) растворяли в смеси диоксан-вода (9:1) (100 мл), содержащей триэтиламин (13 мл). Смесь охлаждали до 0°C, затем порциями добавляли Boc-O-Boc (18,32 г; 0,0763 моль), и смесь выдерживали при перемешивании в течение ночи при температуре окружающей среды. Затем реакционную среду выливали в ледяную воду и экстрагировали этилацетатом. Органическую фазу промывали последовательно 10% водным раствором бикарбоната натрия и водой, затем, в конце, насыщенным раствором хлорида натрия. Затем органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением маслянистого продукта, который кристаллизовали из петролейного эфира. Получают ожидаемый продукт с выходом 67% и использовали в таком виде на следующей стадии. Точка плавления: 83-85°C.
78.2) N2-(Трет-бутоксикарбонил)-N2-метилвалинамид:
Последовательно добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимид (9,777 г; 0,051 моль) и гидроксибензотриазол (7,8 г; 0,051 моль) к промежуточному продукту 78.1 (11,8 г; 0,051 моль) в дихлорметане (200 мл). Затем по каплям добавляли триэтиламин (13 мл) и далее смесь перемешивали в течение 12 часов при температуре окружающей среды. Затем реакционную смесь выливали в 10% водный раствор бикарбоната натрия. После декантации органическую фазу промывали водой, затем насыщенным раствором хлорида натрия. Затем органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток обрабатывали метанолом, предварительно насыщенным газообразным аммиаком (150 мл). Смесь помещали в автоклавную печь при 50°C и перемешивали в течение 4 дней при этой температуре. Метанол упаривали, и продукт обрабатывали дихлорметаном и промывали насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Продукт очищали растиранием в эфире с получением белого твердого продукта с выходом 23,5%. Точка плавления: 181-183°C.
78.3) Трет-бутил 1-(аминокарбонотиоил)-2-метилпропил-(метил)карбамат:
Данное соединение получают путем взаимодействия промежуточного продукта 78.2 с P2S5 в условиях, описанных в примере 12, стадия 12.2. Ожидаемый продукт очищали хроматографией на колонке с силикагелем (элюент = 5% метанол в дихлорметане) с получением не совсем белого твердого продукта с выходом 32,5%. Точка плавления: 199,0-201,0°C.
78.4) Гидрохлорид 2,6-ди-трет-бутил-4-{2-[2-метил-1-(метиламино)пропил]-1,3-тиазол-4-ил}фенола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 1.3 примера 1, при этом промежуточный продукт 78.3 заменяет промежуточный продукт 1.2. У полученного промежуточного соединения удаляли защитные группы с помощью бромистоводородной кислоты, образуемой in situ, с получением ожидаемого продукта в виде свободного основания, которое очищали хроматографией на колонке с силикагелем (элюент: 30% этилацетат в гептане). Затем свободное основание переводили в соль путем растворения в этилацетате, через который пропускали поток газообразного HCl в течение 10 минут. После перемешивания смеси в течение одного часа ее упаривали досуха и остаток обрабатывали эфиром. После фильтрации получают бледно-розовый твердый продукт с выходом 92%. Точка плавления: 248,6-250,0°C.
Пример 79: Гидрохлорид N,2-диметил-1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]пропан-1-амина:
79.1) Трет-бутил метил{2-метил-1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]пропил}карбамат:
Промежуточные продукты 78.3 и 13.1 подвергали взаимодействию в соответствии со способом, аналогичным способу, описанному для стадии 1.3 примера 1. Ожидаемое соединение получают в виде масла, которое очищали хроматографией на колонке с силикагелем (элюент:чистый дихлорметан). Ожидаемый продукт получают в виде белого твердого продукта с выходом 72,4%. В таком виде его использовали на следующей стадии.
79.2) Гидрохлорид N,2-диметил-1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]пропан-1-амина:
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 1.4 примера 1, заменяя промежуточный продукт 1.3 на промежуточный продукт 79.1. После промывания эфиром и изопентаном его сушили и получали ожидаемое соединение в виде темно-зеленого порошка с выходом 62%. MH+ = 368,1.
Пример 80: N-{[4-(10H-Фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}гексанамид;
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 6, заменяя на стадии 6.3, соответственно, промежуточный продукт 6.2 и ацетилхлорид на соединение примера 13 и гексаноилхлорид. Ожидаемый продукт получают в виде коричневого твердого продукта с выходом 40,7%. Точка плавления: 192,0-194,0°C.
Пример 81: (3R)-1-{[4-(10H-Фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пирролидин-3-ол:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2, соответственно, промежуточный продукт 8.1 и морфолин на промежуточный продукт 57.1 и (R)-3-пирролидинол. Ожидаемый продукт получают в виде белого твердого продукта с выходом 49,5%. Точка плавления: 180,0-182,0°C.
Пример 82: (3S)-1-{[4-(10H-Фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пирролидин-3-ол:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2, соответственно, промежуточный продукт 8.1 и морфолин на промежуточный продукт 57.1 и (S)-3-пирролидинол. Ожидаемый продукт получают в виде белого твердого продукта с выходом 49,5%. Точка плавления: 178,0-180,0°C.
Пример 83: 1-{[4-(10H-Фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}азетидин-3-ол:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2, соответственно, промежуточный продукт 8.1 и морфолин на промежуточный продукт 57.1 и азетидин-3-ол (промежуточный продукт 61.2). Ожидаемый продукт получают в виде не совсем белого твердого продукта с выходом 20,4%. Точка плавления: 240,0-242,0°C.
Пример 84: 2-{2-[(4-Пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазин:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2, соответственно, промежуточный продукт 8.1 и морфолин на промежуточный продукт 57.1 и N-пропилпиперазин. Ожидаемый продукт получают в виде белого твердого продукта с выходом 42,6%. Точка плавления: 189,0-190,0°C.
Пример 85: 2-{2-[(4-Ацетилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазин:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2, соответственно, промежуточный продукт 8.1 и морфолин на промежуточный продукт 57.1 и N-ацетилпиперазин. Ожидаемый продукт получают в виде не совсем белого твердого продукта с выходом 53,5%. Точка плавления: 218,0-220,0°C.
Пример 86: 2-{2-[(4-Бутилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазин:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2, соответственно, промежуточный продукт 8.1 и морфолин на промежуточный продукт 57.1 и N-бутилпиперазин. Ожидаемый продукт получают в виде белого твердого продукта с выходом 69,3%. Точка плавления: 188,0-190,0°C.
Пример 87: Метил 4-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилат:
Промежуточный продукт 60.2 (0,380 г; 1 ммоль) растворяли в ТГФ. К полученному таким образом раствору добавляли триэтиламин (1 мл), затем по каплям добавляли метилхлорформиат (0,1 мл). Когда реакция завершалась, реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Отделенную органическую фазу фильтровали, и растворители упаривали. После кристаллизации из изопропанола, ожидаемый продукт получают в виде белого твердого продукта с выходом 66,1%. Точка плавления: 180,0-182,0°C.
Пример 88: Гидрохлорид 4-[2-(аминометил)-1H-имидазол-4-ил]-2,6-ди-трет-бутилфенола:
88.1) Бензил [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1H-имидазол-2-ил]метилкарбамат
Данное соединение получают в соответствии со способом, идентичным способу, описанному для стадии 44.4 примера 44, заменяя, соответственно, N-(бутоксикарбонил)-β-аланин и промежуточный продукт 44.2 на карбобензилоксиглицин и бром-1-(3,5-ди-трет-бутил-4-гидроксифенил)этанон. Ожидаемый продукт получают с выходом 55%. Точка плавления: 212,1-213,4°C.
88.2) Гидрохлорид 4-[2-(аминометил)-1H-имидазол-4-ил]-2,6-ди-трет-бутилфенола:
Промежуточный продукт 88.1 (2,2 г; 5,05 ммоль) растворяли в смеси 50/50 этанола и ТГФ (70 мл). Добавляли 0,7 г палладия на угле (10 %) и смесь помещали в атмосферу водорода (давление 3,5 бар). Катализатор отфильтровывали, затем растворитель упаривали при пониженном давлении. Полученное основание растворяли в эфире и получают гидрохлорид путем добавления 1н. раствора HCl в эфире (20 мл). После фильтрации и сушки в вакууме получают ожидаемый продукт в виде твердого продукта цветом от белого до светло-серого, который промывали эфиром, затем изопентаном (выход 56%). Точка плавления: 225-228,3°C.
Пример 89: Гидрохлорид 4-{2-[(бензиламино)метил]-1,3-тиазол-4-ил}-2,6-ди-трет-бутилфенола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на бензиламин. Ожидаемый продукт получают в виде белого твердого продукта с выходом 62%. Точка плавления: 166,4-167,8°C.
Пример 90: Гидрохлорид 4-{2-[(4-ацетилпиперазин-1-ил)метил-1,3-тиазол-4-ил}-2,6-ди-трет-бутилфенола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на N-ацетилпиперазин. Ожидаемый продукт получают в виде белого твердого продукта с выходом 64%. Точка плавления: 199,0-200,4°C.
Пример 91: Гидрохлорид N-метил-N-{[4-(10H-феноксазин-2-ил)-1,3-тиазол-2-ил]метил}амина:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 12, заменяя бром-1-(3,5-ди-трет-бутил-4-гидроксифенил)пропан-1-он на 2-хлор-1-(10H-феноксазин-2-ил)этанон (2-хлор-1-(10H-феноксазине-2-ил)этанон, полученный аналогичным способом, используемым с получением промежуточного продукта 13.1 -см. J. Org. Chem. (1960), 25, 747-753). Ожидаемый продукт получали после взаимодействия и удаления защиты и преобразовывали в соль в виде зеленого твердого продукта. Точка плавления: 218-220°C.
Пример 92: Гидрохлорид 4-[2-(азетидин-1-илметил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, азетидин заменяет морфолин на стадии 8.2. Ожидаемый продукт получают в виде белого твердого продукта с выходом 90%. Точка плавления: 141,7-144,2°C.
Пример 93: Гидрохлорид 2,6-ди-трет-бутил-4-{2-[(4-бутилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на N-бутил-пиперазин. Ожидаемый продукт получают в виде не совсем белого твердого продукта с выходом 68%. Точка плавления: 229,9-230,5°C.
Соединения примеров 94 - 112 получают в соответствии со способами, аналогичными способам, описанным в примере 29 или выше в части под названием "Получение соединений общей формулы (I)".
Пример 94: Бутил 2-[4-(3'-хлор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 142,6°C. MH+ = 398,3.
Пример 95: Бутил 2-[4-(3'-фтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 141,5°C. MH+ = 381,2.
Пример 96: Бутил 2-[4-(4-изобутилфенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 95,5°C. MH+ = 344,2.
Пример 97: Бензил 2-[4-(4-изобутилфенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 125,2°C. MH+ = 378,4.
Пример 98: Бутил 2-[4-(3'-хлор-4'-фтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 132,4°C. MH+ = 416,3.
Пример 99: Бутил 2-[4-(3',4'-дихлор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 137,5°C. MH+ = 432,2.
Пример 100: Бутил 2-[4-(4-пропилфенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 83,2°C. MH+ = 330,4.
Пример 101: Бутил 2-[4-(4-этилфенил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 92,4°C. MH+ = 316,3.
Пример 102: Бутил 2-[4-(4'-циано-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 147°C. MH+ = 389,2.
Пример 103: Бутил 2-{4-[4'-(трифторметил)-1,1'-бифенил-4-ил]-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 168,5°C. MH+ = 432,3.
Пример 104: Бутил 2-[4-(1,1'-бифенил-4-ил)-5-этил-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 127-128°C. MH+ = 392,2.
Пример 105: Бутил 2-[4-(2'-хлор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 99,7°C. MH+ = 398,1.
Пример 106: Бутил 2-[4-(2',3'-дифтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 90°C. MH+ = 400,1.
Пример 107: Бутил 2-[4-(2'-бром-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 109,6 °C. MH+ = 442,1.
Пример 108: Бутил 2-[4-(3',5'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамат:
Точка плавления: 111,1°C. MH+ = 400,2.
Пример 109: Бутил 2-[4-(2'-метокси-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 116-121 °C. MH+ = 394,3.
Пример 110: Бутил 2-[4-(3'-нитро-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 100,5-101,5°C. MH+ = 409,2.
Пример 111: Бутил 2-[4-(2',5'-дифтор-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 109,5 °C. MH+ = 400,2.
Пример 112: Бутил 2-[4-(3'-метокси-1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамат:
Точка плавления: 112-113°C. MH+ = 394,2.
Пример 113: Гидрохлорид метил 4-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилата:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на метиловый эфир пиперазин-1-карбоновой кислоты. Ожидаемый продукт получают в виде белых кристаллов с выходом 51%. Точка плавления: 240,6-241,4°C.
Пример 114: Метил [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метилкарбамат:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 71, заменяя соединение примера 13 промежуточный продукт 6.2. Ожидаемый продукт получают в виде кристаллического белого твердого продукта с выходом 18%. Точка плавления: 94,0-95,9°C.
Пример 115: N-{[4-(3,5-Ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}бензамид:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 71, заменяя соединение примера 13 на промежуточный продукт 6.2, и заменяя метилхлорформиат на бензоилхлорид. Ожидаемый продукт получают в виде кристаллического белого твердого продукта с выходом 84%. Точка плавления: 200,4-201,2°C.
Пример 116: N-{[4-(3,5-Ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-2-фенилацетамид:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 71, заменяя соединение примера 13 на промежуточный продукт 6.2, и заменяя метилхлорформиат на фенилацетилхлорид. Ожидаемый продукт получают в виде кристаллического белого твердого продукта с выходом 45%. Точка плавления: 123,5-125,4°C.
Пример 117: N-{[4-(3,5-Ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пропанамид:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 71, заменяя соединение примера 13 на промежуточный продукт 6.2, и заменяя метилхлорформиат на пропионилхлорид. Ожидаемый продукт получают в виде кристаллического белого твердого продукта с выходом 45%. Точка плавления: 82,0-83,5°C.
Пример 118: Ацетат 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-ила:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на 1-ацетил-пиперазин. Ожидаемый продукт получают в виде кристаллического оранжевого твердого продукта с выходом 50%. Точка плавления: 160,3-160,6°C.
Пример 119: 1-{[4-(3,5-Ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3,4-диол:
Данное соединение получают в соответствии со способом, идентичным способу, описанному в примере 8, заменяя на стадии 8.2 морфолин на 3,4-дигидроксипирролидин. Ожидаемый продукт получают в виде коричневой пены с выходом 29%. MH+ = 405,20. Фармакологическое исследование продуктов по данному изобретению
Исследование эффектов по связыванию специфического лиганда MAO-B, [3H]Ro 19-6327
Ингибирующую активность продуктов по данному изобретению определяли путем измерения их действия по связыванию специфического лиганда MAO-B, [3H]Ro 19-6327.
a) Получение митохондриальной фракции из коры головного мозга крысы
Получение митохондриальной фракции из коры головного мозга крысы проводили в соответствии со способом, описанным Cesura A.M., Galva M.D., Imhof R. и Da Prada M., J. Neurochem. 48 (1987)0, 170-176. Крыс обезглавливали, и кору головного мозга удаляли, гомогенизировали в 9 объемах 0,32 M сахарозного буфера, забуферированного при pH 7,4 с помощью 5 мМ HEPES, затем центрифугировали при 800 g в течение 20 минут. Супернатанты удаляли и осадок дважды промывали 0,32 M сахарозным буфером, описанным выше. Супернатанты собирали центрифугированием при 10000 g в течение 20 минут. Полученные осадки суспендировали в буфере Tris (50 мМ Tris, 130 мМ NaCl, 5 мМ KCl, 0,5 мМ EGTA, 1 мМ MgCl2, pH 7,4) и центрифугировали при 10000 g в течение 20 минут. Эту стадию повторяли дважды и окончательный осадок, соответствующий митохондриальной фракции, хранили при -80°C в буфере Tris. Содержание белка в образце определяли методом Лоури.
b) Связывание [3H]Ro 19-6327
В пробирке Эппендорфа инкубировали 100 мкл митохондриального образца (2 мг белка/мл) в течение 1 часа при 37°C в присутствии 100 мкл [3H]Ro 19-6327 (33 нМ, конечная концентрация) и 100 мкл буфера Tris, содержащего или не содержащего ингибиторы. Реакцию останавливали добавлением в каждую пробирку 1 мл немеченого буфера Tris, затем образцы центрифугировали в течение 2 минут при 12000 g. Супернатанты отсасывали и осадки промывали 1 мл буфером Tris. Осадки затем растворяли в 200 мкл додецилсульфата натрия (20% масса/объем) в течение 2 часов при 70°C. Радиоактивность определяли с помощью жидкосцинциляционного обсчета образцов.
c) Результаты
Соединения примеров 1, 3, 5, 11 и 18, описанные выше, имеют IC50 ниже или равное 10 мкМ.
Исследование эффектов на перекисное окисление липидов коры головного мозга крыс
Ингибирующую активность продуктов по данному изобретению определяли измерением их действия на степень перекисного окисления липидов, определяемой как концентрация малондиальдегида (MDA). MDA, образуемый при перекисном окислении ненасыщенных жирных кислот, является хорошим индикатором перекисного окисления липидов (H. Esterbauer и K.H. Cheeseman, Meth. Enzymol. (1990) 186: 407-421). Самцов крыс Спрег-Доули, весом от 200 до 250 г (Charles River) убивали обезглавливанием. Кору головного мозга удаляли, затем гомогенизировали, используя гомогенизатор Томаса в 20 мМ Tris-HCl буфере, pH = 7,4. Гомогенат центрифугировали дважды при 50000 g в течение 10 минут при 4°C. Осадок хранили при -80°C. В день эксперимента осадок переводили в суспензию с концентрацией 1 г/15 мл и центрифугировали при 515 g в течение 10 минут при 4°C. Супернатант сразу использовали для определения перекисного окисления липидов. Гомогенат коры головного мозга крыс (500 мкл) инкубировали при 37°С в течение 15 минут в присутствии исследуемого соединения или растворителя (10 мкл). Реакцию перекисного окисления липидов инициировали добавлением 50 мкл FeCl2 1 мМ, ЭДТА 1 мМ и аскорбиновой кислоты 4 мМ. После инкубирования в течение 30 минут при 37°C реакцию останавливали добавлением 50 мкл раствора гидроксилированного ди-трет-бутилтолуола (BHT, 0,2%). MDA количественно оценивали, используя колориметрический тест, путем взаимодействия хромогенного реагента (R), N-метил-2-фенилиндола (650 мкл) с 200 мкл гомогената в течение 1 часа при 45°C. Конденсация MDA молекулы с двумя молекулами реагента R давала стабильный хромофор, с максимальной длиной волны поглощения, равной 586 нм. (Caldwell et al. European J. Pharmacol. (1995) 285, 203-206). Значение IC50 соединений примеров 1, 3-28, 50-62, 64-86, 88-93 и 114-118, описанных выше, ниже или равно 10 мкМ.
Тест связывания в отношении натриевых каналов коры головного мозга крыс
Тест заключается в измерении воздействия соединений на связывание тритированного батрахотоксина с вольтзависимыми натриевыми каналами в соответствии со способом, описанным Brown (J. Neurosci. (1986), 6, 2064-2070).
Получение гомогенатов кортекса головного мозга крыс
Удаляли кору головного мозга крыс Спрег-Доули, весом 230-250 г (Charles River, France), взвешивали и гомогенизировали, используя гомогенизатор Поттера, оснащенный тефлоновым поршнем (10 ударов) в 10 объемах буфера для выделения следующей композиции (сахароза 0,32 M, K2HPO4 5 мМ, pH 7,4). Гомогенат подвергали первому центрифугированию при 1000 g в течение 10 минут. Супернатант удаляли и центрифугировали при 20000 g в течение 15 минут. Осадок помещали в буфер для выделения и центрифугировали при 20000 g в течение 15 минут. Полученный осадок вновь суспендировали в буфере для инкубирования (HEPES 50 мМ, KCl 5,4 мМ, MgSO4 0,8 мМ, глюкоза 5,5 мМ, холинхлорид 130 мМ pH 7,4), затем делили на аликвоты и хранили при -80°C до дня эксперимента. Концентрация конечного белка составляла от 4 до 8 мг/мл. Анализ белков осуществляют с использованием набора, выпускаемого BioRad (Франция).
Измерение связывания тритированного батрахотоксина
Реакцию связывания осуществляют путем инкубирования в течение 1 часа 30 минут при 25°C 100 мкл гомогената коры крыс, содержащего 75 мкг белков, со 100 мкл [3H] бензоата батрахотоксин-A-20-альфа (37,5 Кю/ммоль, NEN) при 5 нМ (конечная концентрация), 200 мкл тетродотоксина при 1 мкМ (конечная концентрация) и яда скорпиона при 40 мкг/мл (конечная концентрация) и 100 мкл буфера для инкубирования, самостоятельно или с исследуемыми продуктами в различных концентрациях. Неспецифическое связывание определяли в присутствии 300 мкМ вератридина, и значение этого неспецифического связывания вычитали из всех других значений. Образцы затем фильтровали, используя Brandel (Gaithersburg, Maryland, USA), используя Unifilter GF/C плашки для преинкубирования с 0,1% полиэтиленимином (20 мкл/ячейку) и дважды промывали 2 мл буфера для фильтрования (HEPES 5 мМ, CaCl2 1,8 мМ, MgSO4 0,8 мМ, холинхлорид 130 мМ, BSA 0,01%, pH 7,4). После добавления 20 мкл Microscint 0 ®, подсчитывали радиоактивность, используя жидкосцинциляционный счетчик (Topcount, Packard). Измерение осуществляют с повторением. Результаты выражены как % специфического связывания тритированного батрахотоксина по отношению к контролю.
Результаты
Значение IC50 всех соединений примеров 1, 3, 5, 12, 15, 16, 18, 20, 28-47, 49, 52, 61, 65-69, 89 и 94-112, описанных выше, было ниже или равно 1 мкМ.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПЯТИЧЛЕННЫХ ГЕТЕРОЦИКЛОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2000 |
|
RU2380362C2 |
| ПРОИЗВОДНЫЕ ПЯТИЧЛЕННЫХ ГЕТЕРОЦИКЛОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2009 |
|
RU2530882C2 |
| ПРОИЗВОДНЫЕ ПЯТИЧЛЕННЫХ ГЕТЕРОЦИКЛОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2000 |
|
RU2271355C2 |
| ПРИМЕНЕНИЕ ТИАЗОЛЬНЫХ ПРОИЗВОДНЫХ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ЗАЩИТЫ МИТОХОНДРИЙ | 2002 |
|
RU2297832C2 |
| ПРОИЗВОДНЫЕ 2-(ИМИНОМЕТИЛ)АМИНОФЕНИЛА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2202543C2 |
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2000 |
|
RU2260009C2 |
| ПРОИЗВОДНЫЕ 2-(ИМИНОМЕТИЛ)АМИНОФЕНИЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНЫЕ ВЕЩЕСТВА | 1998 |
|
RU2183211C2 |
| ПРОИЗВОДНЫЕ АМИДИНОВ, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1999 |
|
RU2238939C2 |
| ОТВЕРЖДАЕМАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТЕРМОЛАТЕНТНОЕ ОСНОВАНИЕ | 2009 |
|
RU2487867C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ АРИЛИМИДАЗОЛА, ИХ ПРЕПАРАТЫ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2003 |
|
RU2323216C2 |
Изобретение относится к соединению 2,6-ди-трет-бутил-4-{2-[2-(метиламино)этил]-1,3-тиазол-4-ил}фенола; 2,6-ди-трет-бутил-4-[4-(гидроксиметил)-1,3-оксазол-2-ил]фенола и т.д., 4-метилфенил 2-[4-(1,1-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата и т.д. или его фармацевтически приемлемой соли. Также изобретение относится к применению указанных соединений для получения лекарственного средства, обладающего одним из трех видов активностей: ингибирование моноаминоксидаз, ингибирование перекисного окисления липидов, проявление модулирующей активности в отношении натриевых каналов. Технический результат - производные тиазола, оксазола или имидазола, обладающие одним из следующих видов фармакологической активности: ингибирование моноаминоксидаз; ингибирование перекисного окисления липидов; модулирование натриевых каналов. 11 н. и 23 з.п.
- 2,6-ди-трет-бутил-4-{2-[2-(метиламино)этил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-[4-(гидроксиметил)-1,3-оксазол-2-ил]фенола;
- 2,6-ди-трет-бутил-4-{2-[1-(метиламино)этил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-[2-(метоксиметил)-1,3-тиазол-4-ил]фенола;
- 2,6-ди-трет-бутил-4-{4-[(метиламино)метил]-1,3-оксазол-2-ил]фенола;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}ацетамида;
- этил [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метилкарбамата;
- 2,6-ди-трет-бутил-4-[2-(морфолин-4-илметил)-1,3-тиазол-4-ил]фенола;
- 2,6-ди-трет-бутил-4-[2-(тиоморфолин-4-илметил)-1,3-тиазол-4-ил]фенола;
- 4-[2-(анилинометил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенола;
- 2,6-ди-трет-бутил-4-(2-{[[2-(диметиламино)этил](метил)амино]метил}-1,3-тиазол-4-ил)фенола;
- 2,6-ди-трет-бутил-4-{5-метил-2-[(метиламино)метил]-1,3-тиазол-4-ил}фенола;
- 1-[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанамина;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-N-метилацетамида;
- 1-[4-(3,5 -ди-трет-бутил-4-метоксифенил)-1,3-тиазол-2-ил]-N-метилметанамина;
- 2,6-ди-трет-бутил-4-{2-[(этиламино)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[(4-фенилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[(4-метил-1,4-диазепан-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- N-{1-[4-(4-анилинофенил)-1,3-тиазол-2-ил]этил}-N-метиламина;
- 2,6-ди-трет-бутил-4-{2-[(изопропиламино)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[(циклогексиламино)метил]-1,3-тиазол-4-ил} фенола;
- 2,6-ди-трет-бутил-4-{2-[(4-изопропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- N-метил-1-[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]этанамина;
- 2,6-ди-трет-бутил-4-{2-[(4-этилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- N-{[4-(4-анилинофенил)-1,3-тиазол-2-ил]метил}-N-этиламина;
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}этанамина;
- 2,6-ди-трет-бутил-4-(2-{[4-(диметиламино)пиперидин-1-ил]метил}-1,3-тиазол-4-ил)фенола;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-ола;
- 4-метилпентил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
3,3-диметилбутил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамата;
- изопентил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- гексил 2-[4-(4'-бром-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(4-трет-бутилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- 3,3-диметилбутил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- гексил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамата;
- гексил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- 3,3-диметилбутил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- 3,3-диметилбутил 2-[4-(4-метоксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамата;
- 2-фенилэтил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(1,1'-бифенил-4-ил)-5-метил-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-метил-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-хлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
бутил 2-[4-(2',4'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата,
или фармацевтически приемлемая соль одного из вышеуказанных соединений.
- 2,6-ди-трет-бутил-4-{2-[(пропиламино)метил]-1,3-тиазол-4-ил}фенола;
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}-N-пропиламина;
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}бутан-1-амина;
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пентан-1-амина;
1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-3-ола;
1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- [4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанола;
- N,N-диметил-N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амина;
- 2-{2-[(4-метилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10Н-фенотиазина;
- 2-[2-(пиперидин-1-илметил)-1,3-тиазол-4-ил]-10Н-фенотиазина;
- 2-[2-(пиперазин-1-илметил)-1,3-тиазол-4-ил]-10Н-фенотиазина;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}азетидин-3-ола;
- 2-[2-(морфолин-4-илметил)-1,3-тиазол-4-ил]-10Н-фенотиазина;
- 2-[2-(тиоморфолин-4-илметил)-1,3-тиазол-4-ил]-10Н-фенотиазина;
- 2-{2-[(4-метил-1,4-диазепан-1-ил)метил]-1,3-тиазол-4-ил}-10Н-фенотиазина;
- (3R)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил} пирролидин-3-ола;
- (3S)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил} пирролидин-3-ола;
- 2,6-ди-трет-бутил-4-[2-(пирролидин-1-илметил)-1,3-тиазол-4-ил]фенола;
-2,6-ди-трет-бутил-4-{2-[(бутиламино)метил]-1,3-тиазол-4-ил}фенола;
- 2-{2-[(4-этилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10Н-фенотиазина;
- N-метил-N-{[4-(10Н-фенотиазин-2-ил)-1Н-имидазол-2-ил]метил}амина;
- метил [4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамата;
- бутил [4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамата;
- N-неопентил-N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амина;
- 1-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперидин-4-ола;
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}ацетамида;
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}бутанамида;
- 2,6-ди-трет-бутил-4-{2-[(4-пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[2-метил-1-(метиламино)пропил]-1,3-тиазол-4-ил}фенола;
- N,2-диметил-1-[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]пропан-1-амина;
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}гексанамида;
- (3R)-1-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- (3S)-1-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- 1-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}азетидин-3-ола;
- 2-{2-[(4-пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- 2-{2-[(4-ацетилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- 2-{2-[(4-бутилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- метил 4-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилата;
- 4-[2-(аминометил)-1Н-имидазол-4-ил]-2,6-ди-трет-бутилфенола;
- 4-{2-[(бензиламино)метил]-1,3-тиазол-4-ил}-2,6-ди-трет-бутилфенола;
- 4-{2-[(4-ацетилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-2,6-ди-трет-бутилфенола;
- N-метил-N-{[4-(10H-феноксазин-2-ил)-1,3-тиазол-2-ил]метил}амина;
- 4-[2-(азетидин-1-илметил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенола;
- 2,6-ди-трет-бутил-4-{2-[(4-бутилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- бутил 2-[4-(3'-хлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4-изобутилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(4-изобутилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-хлор-4'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3',4'-дихлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4-пропилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4-этилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-циано-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(1,1'-бифенил-4-ил)-5-этил-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-хлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2',3'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-бром-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3',5'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-метокси-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-нитро-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2',5'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-метокси-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата,
или фармацевтически приемлемая соль одного из вышеуказанных соединений.
- метил 4-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилата;
- метил [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метилкарбамата;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил} бензамида;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-2-фенилацетамида;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пропанамида;
- ацетат 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-ила;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3,4-диола,
или фармацевтически приемлемая соль одного из вышеуказанных соединений.
ингибирование моноаминоксидаз, в частности моноаминоксидазы В;
ингибирование перекисного окисления липидов;
проявление модулирующей активности в отношении натриевых каналов.
ингибирование моноаминоксидаз, в частности моноаминоксидазы В;
ингибирование перекисного окисления липидов;
проявление модулирующей активности в отношении натриевых каналов.
ингибирование моноаминоксидаз, в частности, моноаминоксидазы В;
ингибирование перекисного окисления липидов;
проявление модулирующей активности в отношении натриевых каналов.
- 2,6-ди-трет-бутил-4-{2-[2-(метиламино)этил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-[4-(гидроксиметил)-1,3-оксазол-2-ил]фенола;
- 2,6-ди-трет-бутил-4-{2-[1-(метиламино)этил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-[2-(метоксиметил)-1,3-тиазол-4-ил]фенола;
- 2,6-ди-трет-бутил-4-{4-[(метиламино)метил]-1,3-оксазол-2-ил]фенола;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}ацетамида;
- этил[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метилкарбамата;
- 2,6-ди-трет-бутил-4-[2-(морфолин-4-илметил)-1,3-тиазол-4-ил]фенола;
- 2,6-ди-трет-бутил-4-[2-(тиоморфолин-4-илметил)-1,3-тиазол-4-ил]фенола;
- 4-[2-(анилинометил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенола;
- 2,6-ди-трет-бутил-4-(2-{[[2-(диметиламино)этил](метил)амино]метил}-1,3-тиазол-4-ил)фенола;
- 2,6-ди-трет-бутил-4-{5-метил-2-[(метиламино)метил]-1,3-тиазол-4-ил}фенола;
- 1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанамина;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-N-метилацетамида;
- 1-[4-(3,5-ди-трет-бутил-4-метоксифенил)-1,3-тиазол-2-ил]-N-метилметанамина;
- 2,6-ди-трет-бутил-4-{2-[(этиламино)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[(4-фенилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[(4-метил-1,4-диазепан-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- N-{1-[4-(4-анилинофенил)-1,3-тиазол-2-ил]этил}-М-метиламина;
- 2,6-ди-трет-бутил-4-{2-[(изопропиламино)метил]-1,3-тиазол-4-ил} фенола;
- 2,6-ди-трет-бутил-4-{2-[(циклогексиламино)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[(4-изопропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- N-метил-1-[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]этанамина;
- 2,6-ди-трет-бутил-4-{2-[(4-этилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- N-{[4-(4-анилинофенил)-1,3-тиазол-2-ил]метил}-N-этиламина;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}этанамина;
- 2,6-ди-трет-бутил-4-(2-{[4-(диметиламино)пиперидин-1-ил]метил}-1,3-тиазол-4-ил)фенола;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-ола;
- 4-метилпентил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- 3,3-диметилбутил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамата;
- изопентил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- гексил 2-[4-(4'-бром-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(4-трет-бутилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- 3,3-диметилбутил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- гексил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамата;
- гексил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- 3,3-диметилбутил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- 3,3-диметилбутил 2-[4-(4-метоксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамата;
- 2-фенилэтил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(1,1'-бифенил-4-ил)-5-метил-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-метил-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-хлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2',4'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата,
или фармацевтически приемлемой соли одного из вышеуказанных соединений для получения лекарственного средства, обладающего, по крайней мере, одним из следующих трех видов активностей:
ингибирование моноаминоксидаз, в частности, моноаминоксидазы В,
ингибирование перекисного окисления липидов,
проявление модулирующей активности в отношении натриевых каналов.
- 2,6-ди-трет-бутил-4-{2-[(пропиламино)метил]-1,3-тиазол-4-ил}фенола;
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}-N-пропиламина;
- N-{[4-(10H-фенотиазин-2-ил)-1,3 -тиазол-2-ил]метил}бутан-1-амина;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пентан-1-амина;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-3-ола;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- [4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанола;
- N,N-диметил-N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амина;
- 2-{2-[(4-метилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- 2-[2-(пиперидин-1-илметил)-1,3-тиазол-4-ил]-10H-фенотиазина;
- 2-[2-(пиперазин-1-илметил)-1,3-тиазол-4-ил]-10H-фенотиазина;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}азетидин-3-ола;
- 2-[2-(морфолин-4-илметил)-1,3-тиазол-4-ил]-10H-фенотиазина;
- 2-[2-(тиоморфолин-4-илметил)-1,3-тиазол-4-ил]-10H-фенотиазина;
- 2-{2-[(4-метил-1,4-диазепан-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- (3R)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- (3S)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- 2,6-ди-трет-бутил-4-[2-(пирролидин-1-илметил)-1,3-тиазол-4-ил]фенола;
- 2,6-ди-трет-бутил-4-{2-[(бутиламино)метил]-1,3-тиазол-4-ил}фенола;
- 2-{2-[(4-этилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- N-метил-N-{[4-(10H-фенотиазин-2-ил)-1Н-имидазол-2-ил]метил}амина;
- метил [4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамата;
- бутил [4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамата;
- N-неопентил-N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амина;
- 1-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперидин-4-ола;
- N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}ацетамида;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}бутанамида;
- 2,6-ди-трет-бутил-4-{2-[(4-пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[2-метил-1-(метиламино)пропил]-1,3-тиазол-4-ил}фенола;
- N,2-диметил-1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]пропан-1-амина;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}гексанамида;
- (3R)-1-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- (3S)-1-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- 1-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}азетидин-3-ола;
- 2-{2-[(4-пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- 2-{2-[(4-ацетилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- 2-{2-[(4-бутилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- метил 4-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилата;
- 4-[2-(аминометил)-1Н-имидазол-4-ил]-2,6-ди-трет-бутилфенола;
- 4-{2-[(бензиламино)метил]-1,3-тиазол-4-ил}-2,6-ди-трет-бутилфенола;
- 4-{2-[(4-ацетилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-2,6-ди-трет-бутилфенола;
- N-метил-N-{[4-(10H-феноксазин-2-ил)-1,3-тиазол-2-ил]метил}амина;
- 4-[2-(азетидин-1-илметил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенола;
- 2,6-ди-трет-бутил-4-{2-[(4-бутилпиперазин-1-ил)метил]-1,3-тиазол-4-ил)фенола;
- бутил 2-[4-(3'-хлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4-изобутилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(4-изобутилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-хлор-4'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3',4'-дихлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4-пропилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4-этилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-циано-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(1,1'-бифенил-4-ил)-5-этил-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-хлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2',3'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-бром-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3',5'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-метокси-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3 '-нитро-1,1 '-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2',5'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-метокси-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата,
или фармацевтически приемлемой соли одного из вышеуказанных соединений для получения лекарственного средства, обладающего по крайней мере одним из следующих трех видов активностей:
ингибирование моноаминоксидаз, в частности, моноаминоксидазы В,
ингибирование перекисного окисления липидов,
проявление модулирующей активности в отношении натриевых каналов.
- метил 4-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилата;
- метил [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метилкарбамата;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}бензамида;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-2-фенилацетамида;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пропанамида;
ацетат 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-ила;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3,4-диола,
или фармацевтически приемлемой соли одного из вышеуказанных соединений для получения лекарственного средства, обладающего по крайней мере одним из следующих трех видов активностей:
ингибирование моноаминоксидаз, в частности, моноаминоксидазы В,
ингибирование перекисного окисления липидов,
проявление модулирующей активности в отношении натриевых каналов.
- 2,6-ди-трет-бутил-4-{2-[2-(метиламино)этил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-[4-(гидроксиметил)-1,3-оксазол-2-ил]фенола;
- 2,6-ди-трет-бутил-4-{2-[1-(метиламино)этил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-[2-(метоксиметил)-1,3-тиазол-4-ил]фенола;
- 2,6-ди-трет-бутил-4-{4-[(метиламино)метил]-1,3-оксазол-2-ил]фенола;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}ацетамида;
- этил [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метилкарбамата;
- 2,6-ди-трет-бутил-4-[2-(морфолин-4-илметил)-1,3-тиазол-4-ил]фенола;
- 2,6-ди-трет-бутил-4-[2-(тиоморфолин-4-илметил)-1,3-тиазол-4-ил]фенола;
- 4-[2-(анилинометил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенола;
- 2,6-ди-трет-бутил-4-(2-{[[2-(диметиламино)этил](метил)амино]метил}-1,3-тиазол-4-ил)фенола;
- 2,6-ди-трет-бутил-4-{5-метил-2-[(метиламино)метил]-1,3-тиазол-4-ил}фенола;
- 1-[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанамина;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-N-метилацетамида;
- 1-[4-(3,5-ди-трет-бутил-4-метоксифенил)-1,3-тиазол-2-ил]-N-метилметанамина;
- 2,6-ди-трет-бутил-4-{2-[(этиламино)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[(4-фенилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[(4-метил-1,4-диазепан-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- N-{1-[4-(4-анилинофенил)-1,3-тиазол-2-ил]этил}-N-метиламина;
- 2,6-ди-трет-бутил-4-{2-[(изопропиламино)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[(циклогексиламино)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[(4-изопропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- N-метил-1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]этанамина;
- 2,6-ди-трет-бутил-4-{2-[(4-этилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- N-{[4-(4-анилинофенил)-1,3-тиазол-2-ил]метил}-N-этиламина;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}этанамина;
- 2,6-ди-трет-бутил-4-(2-{[4-(диметиламино)пиперидин-1-ил]метил}-1,3-тиазол-4-ил)фенола;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-ола,
или фармацевтически приемлемой соли одного из вышеуказанных соединений для получения лекарственного средства для ингибирования моноаминоксидаз и/или для ингибирования перекисного окисления липидов.
- 2,6-ди-трет-бутил-4-{2-[(пропиламино)метил]-1,3-тиазол-4-ил}фенола;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}-N-пропиламина;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}бутан-1-амина;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пентан-1-амина;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-3-ола;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- [4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метанола;
- N,N-диметил-N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амина;
- 2-{2-[(4-метилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- 2-[2-(пиперидин-1-илметил)-1,3-тиазол-4-ил]-10Н-фенотиазина;
- 2-[2-(пиперазин-1-илметил)-1,3-тиазол-4-ил]-10H-фенотиазина;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}азетидин-3-ола;
- 2-[2-(морфолин-4-илметил)-1,3-тиазол-4-ил]-10H-фенотиазина;
- 2-[2-(тиоморфолин-4-илметил)-1,3-тиазол-4-ил]-10H-фенотиазина;
- 2-{2-[(4-метил-1,4-диазепан-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- (3R)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- (3S)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- 2,6-ди-трет-бутил-4-[2-(пирролидин-1-илметил)-1,3-тиазол-4-ил]фенола;
- 2,6-ди-трет-бутил-4-{2-[(бутиламино)метил]-1,3-тиазол-4-ил}фенола;
- 2-{2-[(4-этилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- N-метил-N-{[4-(10H-фенотиазин-2-ил)-1Н-имидазол-2-ил]метил}амина;
- метил [4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамата;
- бутил [4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метилкарбамата;
- N-неопентил-N-{[4-(10Н-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}амина;
- 1-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперидин-4-ола;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}ацетамида;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}бутанамида;
- 2,6-ди-трет-бутил-4-{2-[(4-пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[2-метил-1-(метиламино)пропил]-1,3-тиазол-4-ил}фенола;
- N,2-диметил-1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]пропан-1-амина;
- N-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}гексанамида;
- (3R)-1-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- (3S)-1-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- 1-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}азетидин-3-ола;
- 2-{2-[(4-пропилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- 2-{2-[(4-ацетилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- 2-{2-[(4-бутилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-10H-фенотиазина;
- метил 4-{[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилата;
- 4-[2-(аминометил)-1Н-имидазол-4-ил]-2,6-ди-трет-бутилфенола;
- 4-{2-[(бензиламино)метил]-1,3-тиазол-4-ил}-2,6-ди-трет-бутилфенола;
- 4-{2-[(4-ацетилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}-2,6-ди-трет-бутилфенола;
- N-метил-N-{[4-(10H-феноксазин-2-ил)-1,3-тиазол-2-ил]метил}амина;
- 4-[2-(азетидин-1-илметил)-1,3-тиазол-4-ил]-2,6-ди-трет-бутилфенола;
- 2,6-ди-трет-бутил-4-{2-[(4-бутилпиперазин-1-ил)метил]-1,3-тиазол-4-ил}фенола,
или фармацевтически приемлемой соли одного из вышеуказанных соединений для получения лекарственного средства для ингибирования моноаминоксидаз и/или для ингибирования перекисного окисления липидов.
- метил 4-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперазин-1-карбоксилата;
- метил [4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метилкарбамата;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}бензамида;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}-2-фенилацетамида;
- N-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пропанамида;
- ацетат 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пиперидин-4-ила;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3,4-диола,
или фармацевтически приемлемой соли одного из вышеуказанных соединений для получения лекарственного средства для ингибирования моноаминоксидаз и/или для ингибирования перекисного окисления липидов.
- 1-[4-(3,5-ди-трет-бутил-4-метоксифенил)-1,3-тиазол-2-ил]метил}-N-метилметанамина;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- 1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}азетидин-3-ола;
- (3R)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- (3S)-1-{[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазол-2-ил]метил}пирролидин-3-ола;
- N,2-диметил-1-[4-(10H-фенотиазин-2-ил)-1,3-тиазол-2-ил]пропан-1-амина,
и фармацевтически приемлемых солей вышеуказанных соединений.
- 2,6-ди-трет-бутил-4-{2-[2-(метиламино)этил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{2-[1-(метиламино)этил]-1,3-тиазол-4-ил}фенола;
- 2,6-ди-трет-бутил-4-{4-[(метиламино)метил]-1,3-оксазол-2-ил]фенола;
- 2,6-ди-трет-бутил-4-{5-метил-2-[(метиламино)метил]-1,3-тиазол-4-ил}фенола;
- 1-[4-(3,5-ди-трет-бутил-4-метоксифенил)-1,3-тиазол-2-ил]-N-метилметанамина;
- 2,6-ди-трет-бутил-4-{2-[(этиламино)метил]-1,3-тиазол-4-ил}фенола;
- 4-метилпентил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- 3,3-диметилбутил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамата;
- изопентил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- гексил 2-[4-(4'-бром-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(4-трет-бутилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- 3,3-диметилбутил 2-[4-(1,1'-бифенил-4-ил)-1H-имидазол-2-ил]этилкарбамата;
- гексил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамата;
- гексил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- 3,3-диметилбутил 2-[4-(4-метоксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(3,5-ди-трет-бутил-4-гидроксифенил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(4-пирролидин-1-илфенил)-1Н-имидазол-2-ил]этилкарбамата;
- 2-фенилэтил 2-[4-(1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(1,1'-бифенил-4-ил)-5-метил-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-метил-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-хлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2',4'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата,
или фармацевтически приемлемой соли одного из вышеуказанных соединений для получения лекарственного средства, предназначенного для модулирования натриевых каналов.
- бутил 2-[4-(3'-хлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4-изобутилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бензил 2-[4-(4-изобутилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-хлор-4'-фтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3',4'-дихлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4-пропилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4-этилфенил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(4'-циано-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(1,1'-бифенил-4-ил)-5-этил-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-хлор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2',3'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-бром-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3',5'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2'-метокси-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-нитро-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(2',5'-дифтор-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
- бутил 2-[4-(3'-метокси-1,1'-бифенил-4-ил)-1Н-имидазол-2-ил]этилкарбамата;
или фармацевтически приемлемой соли одного из вышеуказанных соединений для получения лекарственного средства, предназначенного для модулирования натриевых каналов.
| WO 9858934 A1, 30.12.1998 | |||
| US 5326770 A, 05.07.1994 | |||
| ПРОИЗВОДНЫЕ 5-(ГИДРОКСИМЕТИЛ)-ОКСАЗОЛИДИН-2-ОНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВО И ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ | 1996 |
|
RU2164226C2 |
Авторы
Даты
2006-11-27—Публикация
2002-04-09—Подача