Настоящее изобретение относится к новым гетероциклическим соединениям, обладающим ингибирующей кальпаины активностью и/или улавливающей реакционноспособные формы кислорода (ROS="реакционноспособная форма кислорода") активностью. Изобретение относится также к способам их получения, к фармацевтическим композициям на их основе и к их применению в терапевтических целях, в частности, в качестве ингибиторов кальпаинов и улавливателей реакционноспособных форм кислорода как селективных, так и неселективных.
Принимая во внимание потенциальную роль кальпаинов и ROS в физиопатологии, новые производные согласно изобретению могут оказывать полезное и благоприятное воздействие при лечении патологий, в которых задействованы эти ферменты и/или эти радикальные элементы, в частности, таких как:
- воспалительные и иммунологические заболевания, как, например, ревматоидный артрит, панкреатиты, рассеянный склероз, воспаления желудочно-кишечной системы (язвенный или неязвенный колит, болезнь Крона);
- сердечно-сосудистые и цереброваскулярные заболевания, включающие, например, артериальную гипертензию, септический шок, инфаркт сердца или мозга ишемического, или геморрагического происхождения, ишемии, а также нарушения, связанные с агрегацией тромбоцитов;
- расстройства центральной или периферической нервной системы, как, например, нейродегенеративные заболевания, из которых, в частности, можно назвать черепно-мозговые или спинномозговые травмы, субарахноидную геморрагию, эпилепсию, старение, старческое слабоумие, включая болезнь Альцгеймера, хорею Гентингтона, болезнь Паркинсона, периферические невропатии;
- остеопороз;
- мышечные дистрофии;
- пролиферативные заболевания, как, например, атеросклероз или рестиноз;
- катаракта;
- трансплантации органов;
- аутоиммунные и вирусные заболевания, как, например, волчанка, СПИД, паразитарные и вирусные инфекции, диабет и его осложнения, рассеянный склероз;
- рак;
- все патологии, характеризующиеся чрезмерным продуцированном ROS и/или активацией кальпаинов.
В отношении перечисленных патологий существуют экспериментальные подтверждения, свидетельствующие о причастности ROS (Free Radic. Biol. Med., 20, 675-705 (1996); Antioxid. Health. Dis., 4 (Handbook of Synthetic Antioxidants), 1-52 (1997), а также причастности кальпаинов (Trends Pharmacol. Sci., 15, 412-419 (1994)); Drug News Perspect, 12, 73-82 (1999) к указанным патологиям. Так, в качестве примера, сообщается, что церебральные патологические изменения, ассоциированные с инфарктом мозга или экспериментальной черепно-мозговой травмой, уменьшаются с помощью антиоксидантов (Acta Physiol. Scand., 152, 349-350 (1994); J. Cereb. Blood Flow Metabol., 15, 948-952 (1995); J. Pharmacol. Exp. Ther., 2, 895-904 (1997)), а также с помощью ингибиторов кальпаинов (Proc. Natl. Acad. Sci. USA, 93, 3428-3433 (1996); Stroke, 29, 152-158 (1998); Stroke, 25, 2265-2270 (1994)).
Объектом настоящего изобретения, следовательно, являются соединения общей формулы (I):

в которой:
R1 означает атом водорода, радикал -OR3, -SR3, оксогруппу или циклическую ацетальную группу, в котором:
R3 означает атом водорода, алкил, арилалкил, гетероциклоалкилкарбонил, алкилкарбонил, арилкарбонил или аралкилкарбонил,
в которых алкил, арил или гетероциклоалкил возможно замещены одним или несколькими, одинаковыми или разными заместителями, выбираемыми из алкила, ОН, алкоксила, нитрогруппы, цианогруппы, атома галогена или -NR4R5; где
R4 и R5 означают, независимо, атом водорода или алкил, или же R4 и R5 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R2 означает атом водорода, алкил, арил или аралкил, причем арильная группа возможно замещена одним или несколькими, одинаковыми или разными радикалами, выбираемыми из -OR6, -NR7R8, атома галогена, цианогруппы, нитрогруппы или алкила; в котором:
R6, R7 и R8 означают, независимо, атом водорода, алкил, арил, аралкил, алкилкарбонил, арилкарбонил или аралкилкарбонил;
А означает:
либо радикал А1 или А'1:
 или
или 
в котором:
R9, R10, R11, R12, R13 означают, независимо, атом водорода, атом галогена, группу ОН, алкил, алкоксил, цианогруппу, нитрогруппу или -NR15R16;
R15 и R16 означают, независимо, атом водорода, алкил или группу -COR17, или же R15 и R16 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R17 означает атом водорода, алкил, алкоксил или -NR18R19;
R18 и R19 означают, независимо, атом водорода или алкил, или же R18 и R19 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R14 означает атом водорода, алкил или группу -COR20;
R20 означает атом водорода, алкил, алкоксил, арил, аралкил, гетероциклоалкил или -NR21R22,
в которых алкил, арил или гетероциклоалкил возможно замещены одним или несколькими, одинаковыми или разными заместителями, выбираемыми из алкила, ОН, алкоксила, нитрогруппы, цианогруппы, атома галогена или -NR4R5;
R21 и R22 означают, независимо, атом водорода или алкил, или же R21 и R22 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
W означает связь, О или S или радикал -NR23, в котором R23 означает атом водорода или алкил;
либо радикал А2:

в котором:
R24, R25 и R26 означают, независимо, атом водорода, атом галогена, группу ОН или SR27, алкил, алкенил, алкоксил или радикал -NR28R29;
R27 означает атом водорода или алкил;
R28 и R29 означают, независимо, атом водорода, алкил или группу -COR30, или же R28 и R29 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R30 означает атом водорода, алкил, алкоксил или радикал -NR31R32;
R31 и R32 означают, независимо, атом водорода или алкил, или же R31 и R32 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
Q означает -OR33, -SR33, -NR34R35 или арил, замещенный одним или несколькими, одинаковыми или разными заместителями, выбираемыми из атома галогена, группы ОН, алкила, алкоксила, цианогруппы, нитрогруппы или радикала -NR15R16;
R33 означает атом водорода, алкил, арилалкил, гетероциклоалкилкарбонил, алкилкарбонил, арилкарбонил или аралкилкарбонил, в которых алкил, арил или гетероциклоалкил возможно замещены одним или несколькими, одинаковыми или разными заместителями, выбираемыми из алкила, ОН, алкоксила, нитрогруппы, цианогруппы, атома галогена или -NR4R5;
R34 и R35 означают, независимо, атом водорода, алкил или радикал -CO-R36, или же вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R36 означает алкил;
либо радикал A3:

в котором:
R37 означает атом водорода, алкил, арилалкил, гетероциклоалкилкарбонил, алкилкарбонил, арилкарбонил или аралкилкарбонил,
в которых алкил, арил или гетероциклоалкил возможно замещены одним или несколькими, одинаковыми или разными заместителями, выбираемыми из алкила, ОН, алкоксила, нитрогруппы, цианогруппы, атома галогена или -NR4R5;
Т означает радикал -(СН2)m-, где m=1 или 2;
либо радикал А4:

в котором:
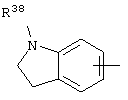
R38 означает атом водорода, алкил, -(CH2)q-NR39R40 или аралкил, причем арильная группа возможно замещена одним или несколькими, одинаковыми или разными заместителями, выбираемыми из ОН, алкила, атома галогена, нитрогруппы, алкоксила или -NR39R40;
причем
q означает целое число от 2 до 6;
либо радикал А5:

в котором:
R'38 и R''38 означают, независимо, атом водорода, нитрогруппу, -NR'39R'40, алкил или арилалкил, причем арильная группа возможно замещена одним или несколькими, одинаковыми или разными заместителями, выбираемыми из ОН, алкила, атома галогена, нитрогруппы, алкоксила или радикала -NR39R40;
R'39, R'40, R39 и R40 означают, независимо, атом водорода, алкил или группу -COR41, или же R39 и R40 или R'39 и R'40 вместе с атомом азота образуют возможно замещенный гетероцикл;
R41 означает атом водорода, алкил, алкоксил или радикал -NR42R43;
R42 и R43 означают, независимо, атом водорода или алкил, или же R42 и R43 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
Т означает радикал -(CH2)m-, где m=1 или 2;
либо, наконец, радикал А6:

в котором:
R44 означает атом водорода, группу ОН или алкил или алкоксил;
Х означает -(CH2)n-, -(CH2)n-CO-, -N(R45)-СО-(СН2)n-СО-, -N(R45)-CO-D-CO-, -CO-N(R45)-D-CO-, -CO-D-CO-, -CH=CH-(СН2)n-CO-, -N(R45)-(CH2)n-CO-, -N(R45)-CO-C(R46R47)-CO-, -О-(СН2)n-CO-, -N(R45)-CO-NH-C(R46R47)-CO-, -CO-N(R45)-C(R46R47)-CO-, -S-(CH2)n-CO- или -Z-CO-;
D означает фениленовый радикал, возможно замещенный одним или несколькими, одинаковыми или разными радикалами, выбираемыми из алкила, алкоксила, ОН, нитрогруппы, атома галогена, цианогруппы или карбоксила, возможно этерифицированного с помощью алкила;
Z означает гетероцикл;
R45 означает атом водорода или алкил;
R46 и R47 означают, независимо, атом водорода, алкил, арил или аралкил, алкильная и арильная группы которых возможно замещены одним или несколькими, одинаковыми или разными заместителями, выбираемыми из группы ОН, -SH, атома галогена, нитрогруппы, алкила, алкоксила, алкилтиогруппы, аралкоксила, арилалкилтиогруппы, -NR48R49 и карбоксила, возможно этерифицированного с помощью алкила;
R48 и R49 означают, независимо, атом водорода, алкил или группу -COR50, или же R48 и R49 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R50 означает атом водорода, алкил, алкоксил или радикал -NR51R52;
R51 и R52 означают, независимо, атом водорода или алкил, или же R51 и R52 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл; причем n означает целое число от 0 до 6;
Y означает -(СН2)р-, -C(R53R54)-(CH2)p-, -С(R53R54)-CO-;
R53 и R54 означают, независимо, атом водорода, алкил, аралкил, арильная группа которого возможно замещена одним или несколькими, одинаковыми или разными заместителями, выбираемыми из группы ОН, атома галогена, нитрогруппы, алкила, алкоксила, -NR55R56;
R55 и R56 означают, независимо, атом водорода, алкил или группу -COR57, или же R55 и R56 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R57 означает атом водорода, алкил, алкоксил или радикал -NR58R59;
R58 и R59 означают, независимо, атом водорода или алкил, или же R58 и R59 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл; причем р означает целое число от 0 до 6;
Het означает гетероцикл;
а также аддитивные соли с неорганическими и органическими кислотами или с неорганическими и органическими основаниями вышеуказанных соединений общей формулы (I),
за исключением соединений формулы (I), в которой, когда Het означает тетрагидрофуран или тетрагидропиран, R1 означает радикал OR3, где R3 означает атом водорода, алкил, арилалкил, гетероциклоалкилкарбонил, гетероциклоалкильный радикал которого разветвлен с помощью атома углерода, алкилкарбонила, арилкарбонила или аралкилкарбонила, R2 означает атом водорода, и Y означает радикал -(CH2)p-, где р=0, тогда Х не означает -CO-N(R45)-C(R46R47)-CO-, где R45=R46=H.
В некоторых случаях соединения согласно настоящему изобретению могут включать асимметрические атомы углерода (конфигурации "R" или "S"). Следовательно, настоящее изобретение включает энантиомерные, диастереоизомерные формы и любые комбинации этих форм, включая рацемические смеси "RS". Ради простоты, когда в структурных формулах не указана никакая специфическая конфигурация, нужно понимать, что представлены две энантиомерные (или диастереоизомерные) формы и их смеси.
Под алкилом, когда он более точно не указан, понимают линейный или разветвленный алкильный радикал с 1-6 атомами углерода, как, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил, пентил, неопентил, изопентил, гексил, изогексил. Алкоксильные радикалы могут соответствовать вышеуказанным алкильным радикалам, как, например, метокси-, этокси-, пропилокси- или изопропилоксигруппа, а также линейная, вторичная или третичная бутоксигруппа. Алкилтиогруппы также могут соответствовать вышеуказанным алкильным радикалам, как, например, метилтио-или этилтиогруппа.
Под алкенилом, когда он более точно не указан, понимают линейный или разветвленный алкильный радикал с 1-6 атомами углерода и имеющий по меньшей мере одну двойную связь. Под галогеном понимают атомы фтора, хлора, брома или иода.
Под арилом понимают карбоциклическую или гетероциклическую систему, включающую по меньшей мере один ароматический цикл, причем система является гетероциклической, когда по меньшей мере один из циклов, составляющих ее, включает гетероатом (О, N или S). В качестве примера карбоциклического арила можно назвать фенил или нафтил. В качестве примера гетероциклического арила (или гетероарила) можно назвать тиенил, фурил, пирролил, имидазолил, пиразолил, изотиазолил, тиазолил, изоксазолил, оксазолил, пиридил, пиразинил, пиримидил, бензотиенил, бензофурил и индолил.
Термин "гетероцикл" (или "гетероциклоалкил"), представляемый, например, радикалами Het или Z, предпочтительно означает моно- или бициклический, насыщенный или ненасыщенный гетероцикл с 1-5 гетероатомами, выбираемыми из О, S, N. Атом азота, в случае необходимости, может быть замещен радикалом, выбираемым из алкила, арила, аралкила и алкилкарбонила. В качестве примера насыщенного гетероцикла можно назвать: тетрагидрофуран, тетрагидропиран, оксетан, оксепан, тетрагидротиофен, тетрагидротиопиран, тиетан, пирролидин, пиперидин, азетидин, 1,3-диоксан, 1,3-диоксолан, 1,3-дитиолан, 1,3-дитиан, 1,3-оксатиолан, 1,3-оксазолидин, 1,3-имидазолидин или 1,3-тиазолидин. В качестве примера ненасыщенного гетероцикла можно назвать: тиофен, фуран, пиррол, имидазол, пиразол, изотиазол, тиазол, иэоксазол, оксазол, пиридин, пиразин, пиримидин, бензимидазол, бензофуран, бензопиран, 1,3-бензотиазол, бензоксазол, хинолин.
Арилалкилами (или аралкилами) называют радикалы, в которых, соответственно, арил и алкил являются такими, как указано выше, например, бензил, фенетил или нафтилметил. Аралкоксилами (арилалкоксилами) называют радикалы, в которых, соответственно, арил и алкоксил являются такими, как указано выше, например, бензилокси- или фенилэтоксигруппа. Арилалкилтиогруппами называют группы, в которых, соответственно, арил и алкилтиогруппа являются такими, которые указаны выше, как, например, бензилтиогруппа.
Алкилкарбонилом, гетероциклоалкилкарбонилом, арилкарбонилом или аралкилкарбонилом называют радикалы, в которых, соответственно, алкил, гетероциклоалкил, арил и аралкил имеют вышеуказанное значение.
В случае радикалов формулы -NRiRj, где Ri и Rj вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл; гетероцикл предпочтительно является насыщенным и включает 4-7 членов цикла и 1-3 гетероатома, включая уже имеющийся атом азота, причем дополнительные гетероатомы выбирают, независимо, из группы, состоящей из атомов О, N и S. Вышеуказанный гетероцикл может представлять собой, например, азетидиновый, пирролидиновый, пиперидиновый, пиперазиновый, морфолиновый или тиоморфолиновый цикл.
Вышеуказанный гетероцикл может быть замещен одним или несколькими, одинаковыми или разными заместителями, выбираемыми из гидроксила, алкила, арила, аралкила или алкоксила или атома галогена.
Объектом изобретения, в частности, являются соединения формулы (I), указанной выше, в которой Het означает моноциклический радикал с 1-2 гетероатомами, выбираемыми из О и N, и предпочтительно радикал, соответствующий тетрагидрофурановому, диоксолановому, пирролидиновому, 1,3-оксазолидиновому циклу, и R1 означает атом водорода, радикал -OR3 или оксогруппу.
Объектом изобретения, в частности, являются также соединения формулы (I), указанной выше, в которой Х означает -(СН2)n-, -(CH2)n-CO-, -O-(CH2)n-CO-, -CO-N(R45)-D-CO-, -N(R45)-CO-(CH2)n-CO-, -N(R45)-СО-С(R46R47)-СО-, -N(R45)-CO-NH-C(R46R47)-СО-, -N(R45)-(CH2)n-CO-, -CO-N(R45)-C(R46R47)-CO-или -Z-CO-;
и предпочтительно, когда R45 и R47 означают атом водорода, R46 означает атом водорода, алкил или фенил, D означает фениленовый радикал, и Z означает тиазольный радикал.
Объектом изобретения, в частности, являются соединения формулы (I), указанной выше, в которой R2 означает атом водорода или аралкил, и предпочтительно, бензил.
Объектом изобретения в особенности являются также соединения формулы (I), такой, как указанная выше, в которой А означает:
либо А1 с W, означающим атом серы;
либо А'1;
либо А2 с R24, R25 и R26, которые означают, независимо,
атом водорода или алкил, и Q, который означает -OR33;
либо A3 с Т, означающим радикал -(CH2)2-;
либо А4 с Т, означающим радикал -(СН2)-;
и предпочтительно радикалы формулы:




Более конкретно, объектом изобретения являются соединения, описанные ниже в примерах, предпочтительно, продукты, отвечающие следующим формулам:
(2R)-6-гидрокси-N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-карбоксамид;
N-1-(4-анилинофенил)-N-4-[(3S)-2-гидрокситетрагидро-3-фуранил]сукцинамид;
(3S)-3-{[4-(4-анилиноанилино)-4-оксобутаноил]амино}тетрагидро-2-фуранилацетат;
N-1-(4-анилинофенил)-N-4-[(1S)-1-(1,3-диоксолан-2-ил)-3-метилбутил]сукцинамид;
N-1-(4-анилинофенил)-N-3-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенилмалонамид;
3-(4-анилиноанилино)тетрагидро-2-фуранол;
N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-2-карбоксамид;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилацетат;
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксамид;
N-[4-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)фенил]-10Н-фенотиазин-2-карбоксамид;
N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-1-карбоксамид;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилпивалат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-3,3-диметилбутаноат;
(3S)-3-({(2S)-4-Метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилбензоат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилфенилацетат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-(2S)-2-(диметил-амино)-3-фенилпропаноат;
(3S)-3-({(2S)-4-Метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-4-морфолинкарбоксилат;
N-{(1S)-3-метил-1-[(3-оксо-1-пирролидинил)карбонил]бутил}-10Н-фенотказин-2-карбоксамид;
2-(3,5-ди-трет-бутил-4-гидроксифенокси)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]ацетамид;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенил-N3-(1-пропил-2,3-дигидро-1Н-индол-5-ил)малонамид;
N-(2-анилинофенил)-N'-[(3S)-2-гидрокситетрагидро-3-фуранил]мочевина;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-N2-(1-пропил-2,3-дигидро-1Н-индол-5-ил)этандиамид;
(2R)-N-[(1S)-1-(1,3-диоксолан-2-ил)-2-фенилэтил]-6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-карбоксамид;
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-5-индолинкарбоксамид.
Соединения согласно изобретению формулы (I) могут быть получены согласно нескольким способам синтеза в зависимости от конкретного значения различных групп.
Соединения общей формулы (I), в которой Het означает тетрагидрофурановый цикл, и Y означает радикал -(СН2)p-, могут быть получены согласно следующей схеме:

где А, X, R2 и R3 имеют вышеуказанное значение,
путем реакции конденсации кислот общей формулы (II) с аминами общей формулы (III) в обычных условиях пептидного синтеза (М.Bodansky и A.Bodansky, The Practice of Peptide Synthesis, 145 (изд. Springer, 1984)), в тетрагидрофуране, дихлорметане или диметилформамиде, в присутствии реагента реакции сочетания, такого, как дициклогексилкарбодиимид (DCC), 1,1'-карбонилдиимидазол (CDI) (J. Med. Chem., 35 (23), 4464-4472 (1992)) или 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (EDC или WSCI) (John Jones, The chemical synthesis of peptides, 54 (Clarendon Press, Оксфорд, 1991)), приводящей к промежуточным карбоксамидам общей формулы (IV). Лактоновый цикл промежуточных соединений общей формулы (IV) затем восстанавливают с помощью восстановителя, такого, как, например, диизобутилалюминийгидрид (DIBAL), в инертном растворителе, таком, как, например, тетрагидрофуран или СН2Cl2, при температуре в пределах от 0°С до -78°С. Таким образом полученное лактольное производное общей формулы (I') может быть ацилировано с помощью, например, хлорангидрида кислоты (R3-Cl) или ангидрида кислоты (уксусный ангидрид, бензоилхлорид,...) в присутствии основания, такого, как, например, триэтиламин, в инертном растворителе, например, CH2Cl2, для получения соединения общей формулы (I).
Соединения формулы (I), в которой Het означает пирролидинил и Y означает -С(R53R54)-СО-, причем R53 и R54 имеют значения, указанные выше, могут быть получены согласно следующей схеме:

где А, Х и R имеют вышеуказанное значение,
путем реакции конденсации кислот общей формулы (V) с аминами общей формулы (VI) (J. Med. Chem., 35 (8), 1392-1398 (1992)) в обычных условиях пептидного синтеза, описанных выше, приводящей к соединениям общей формулы (I'). Затем осуществляют удаление возможной защитной группы от кетогруппы согласно способам, описанным в литературе (T.W.Greene и P.G.M. Wuts, Protective Groups in Organic Synthesis, второе издание (Wiley-Interscience, 1991)) для получения соединений общей формулы (I).
Соединения формулы (I), в которой Het означает 1,3-диоксолановый, 1,3-диоксановый, 1,3-дитиановый, 1,3-дитиолановый, 1,3-оксатиолановый, 1,3-оксазолидиновый, 1,3-имидазолидиновый или 1,3-тиазолидиновый цикл, и Y означает -С(R53R54)-CO-, причем R53 и R54 являются такими, как указанные выше, могут быть получены согласно следующей схеме:

где А, Х и R2 имеют вышеуказанное значение и V и V означают, независимо, N, О или S,
путем реакции конденсации кислот общей формулы (II), описанных выше, с имеющимися в продаже сложными аминоэфирами общей формулы (VII) в обычных условиях пептидного синтеза, описанных выше, приводящей к промежуточным соединениям общей формулы (VIII). Восстановление эфира карбоновой кислоты с помощью восстановителя, такого, как, например, DIBAL, в инертном растворителе, таком, как, например, тетрагидрофуран или СН2Cl2, при температуре в пределах от 0°С до -78°С, приводит к альдегидам общей формулы (IX). Превращение альдегида в гетероцикл осуществляют согласно известным из литературы способам (T.W.Greene и P.G.M. Wuts, Protective Groups in Organic Synthesis, второе издание (Wiley-Interscience, 1991)).
Соединения общей формулы (I), в которой Het означает оксазолидиновый цикл, могут быть получены согласно следующей схеме:

где А, X, Y, R2 и R3 имеют вышеуказанное значение,
путем реакции конденсации кислот общей формулы (V), описанных выше, с имеющимися в продаже сложными аминоэфирами общей формулы (X) в вышеописанных условиях пептидного синтеза. Промежуточно полученные сложные эфиры общей формулы (XI) затем омыляют для получения карбоновых кислот общей формулы (XII), которые путем нагревания в присутствии параформальдегида и кислоты, такой, как, например, APTS (паратолуолсульфоновая кислота), при непрерывном улавливании образующейся во время реакции воды с помощью аппарата Дина Старка, приводят к оксазолидинонам общей формулы (XIII). Их затем восстанавливают с помощью восстановителя, такого, как, например, DIBAL, в инертном растворителе, таком, как, например, тетрагидрофуран или CH2Cl2, при температуре в пределах от 0°С до -78°С, для получения производных оксазолидина общей формулы (I'). Таким образом полученные соединения общей формулы (I') могут быть ацилированы с помощью, например, хлорангидрида кислоты (R3-Cl) или ангидрида кислоты (уксусный ангидрид, бензоилхлорид,...), в присутствии основания, такого, как, например, триэтиламин, в инертном растворителе, например, CH2Cl2, для получения соединений формулы (I).
Соединения общей формулы (I), в которой Het означает тетрагидрофурановый цикл, Х означает радикал -(CH2)n- (n=0), и Y означает радикал -(CH2)p- (р=0), могут быть получены согласно следующей схеме:
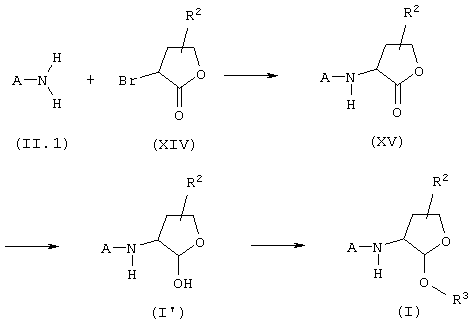
где A, R2 и R3 имеют вышеуказанное значение, путем реакции нуклеофильного замещения атома галогена лактонов общей формулы (XV) с помощью аминов общей формулы (II.1), нагревая реакционную смесь при температуре в пределах от 50°С до 110°С в инертном растворителе, таком, как, например, ацетонитрил или диметилформамид, в течение времени в диапазоне от 30 минут до 5 часов, приводящей к промежуточным соединениям общей формулы (XV). Восстановление лактоновой группы с последующим ацилированием лактола общей формулы (I') осуществляют в вышеописанных условиях.
Соединения общей формулы (I), в которой Het означает тетрагидрофурановый цикл, Х означает радикал -N(R45)-(СН2)n-СО- (n=0), и Y означает радикал -(CH2)p- (p=0), представляют собой мочевины, которые могут быть получены согласно следующей схеме синтеза:
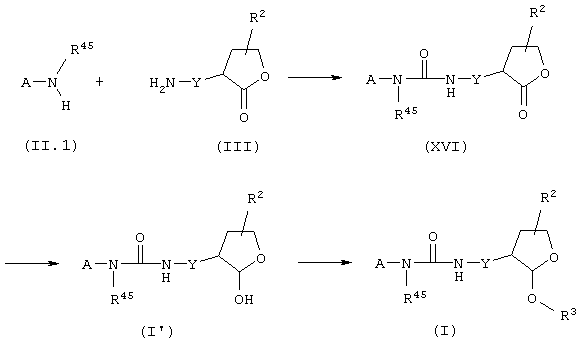
где A, R2 и R3 имеют вышеуказанное значение,
путем реакции конденсации аминов общей формулы (II.1) с аминами общей формулы (III) в присутствии трифосгена и основания, такого, как, например, диизопропилэтиламин, в инертном растворителе, таком, как дихлорметан, согласно экспериментальному протоколу, описанному в J. Org. Chem., 59 (7), 1937-1938 (1994). Лактоновый цикл мочевин общей формулы (XVI) затем восстанавливают и модифицируют в вышеописанных экспериментальных условиях для получения соединений общей формулы (I).
Соединения согласно настоящему изобретению обладают ценными фармакологическими свойствами: они ингибируют кальпаины и/или улавливают реакционноспособные формы кислорода.
Соединения согласно настоящему изобретению могут найти различное терапевтическое применение. Они могут оказывать полезное или благоприятное воздействие при лечении патологий, в которых задействованы эти ферменты и/или эти радикальные элементы.
Эти свойства делают продукты формулы (I) пригодными для фармацевтического применения. Объектом настоящей заявки являются также лекарственные средства, которыми являются продукты формулы (I), указанной выше, а также их аддитивные соли с фармацевтически приемлемыми неорганическими или органическими кислотами или неорганическими и органическими основаниями, а также фармацевтические композиции, содержащие в качестве действующего начала по меньшей мере одно из лекарственных средств, указанных выше.
Таким образом, изобретение относится к фармацевтическим композициям, содержащим соединение согласно изобретению или аддитивную соль его с фармацевтически приемлемой кислотой в комбинации с фармацевтически приемлемым носителем.
Фармацевтическая композиция согласно изобретению может быть в форме твердого вещества, как, например, порошки, гранулы, таблетки, желатиновые капсулы или суппозитории. Соответствующими твердыми носителями могут быть, например, фосфат кальция, стеарат магния, тальк, сахара, лактоза, декстрин, крахмал, желатина, целлюлоза, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, поливинилпирролидон и воск.
Фармацевтические композиции, содержащие соединение согласно изобретению, могут также находиться в жидкой форме, как, например, растворы, эмульсии, суспензии или сиропы. Соответствующими жидкими носителями могут быть, например, вода, органические растворители, такие, как глицерин или гликоли, а также их смеси в различных соотношениях с водой, добавляемые к фармацевтически приемлемым маслам или жирам. Стерильные жидкие композиции могут быть использованы для внутримышечных, интраперитонеальных или подкожных инъекций и стерильные композиции также можно вводить внутривенно.
Некоторые соединения вышеуказанной общей формулы (I) раскрыты в заявке на Европейский патент ЕР 641800. Соединения согласно этой заявке обладают ингибирующей катепсин L активностью, которая отлична от ингибирующей кальпаины активности и/или улавливающей реакционноспособные формы кислорода активности.
Объектом изобретения, следовательно, также является применение соединений общей формулы (Ia), указанной выше:
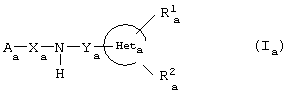
в рацемической форме, форме энантиомеров, диастереоизомеров или в виде любых комбинациях этих форм, в которой:
Ra 1 означает атом водорода, радикал -OR3, -SR3, оксогруппу или циклическую ацетальную группу, в котором:
R3 означает атом водорода, алкил, арилалкил, гетероциклоалкилкарбонил, алкилкарбонил, арилкарбонил или аралкилкарбонил,
в которых алкил, арил или гетероциклоалкил возможно замещены одним или несколькими, одинаковыми или разными заместителями, выбираемыми из алкила, ОН, алкоксила, нитрогруппы, цианогруппы, атома галогена или -NR4R5;
R4 и R5 означают, независимо, атом водорода или алкил, или же R4 и R5 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
Ra 2 означает атом водорода, алкил, арил или аралкил, причем арильная группа возможно замещена одним или несколькими, одинаковыми или разными радикалами, выбираемыми из -OR6, -NR7R8, атома галогена, цианогруппы, нитрогруппы или алкила;
в котором:
R6, R7 и R8 означают, независимо, атом водорода, алкил, арил, аралкил, алкилкарбонил, арилкарбонил или аралкилкарбонил;
Аа означает: либо радикал А1 или А'1:
 или
или 
в котором:
R9, R10, R11, R12, R13 означают, независимо, атом водорода, атом галогена, группу ОН, алкил, алкоксил, цианогруппу, нитрогруппу или -NR15R16;
R15 и R16 означают, независимо, атом водорода, алкил или группу -COR17, или же R15 и R16 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R17 означает атом водорода, алкил, алкоксил или -NR18R19;
R18 и R19 означают, независимо, атом водорода или алкил, или же R18 и R19 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R14 означает атом водорода, алкил или группу -COR20;
R20 означает атом водорода, алкил, алкоксил, арил, аралкил, гетероциклоалкил или -NR21R22,
в которых алкил, арил или гетероциклоалкил возможно замещены одним или несколькими, одинаковыми или разными заместителями, выбираемыми из алкила, ОН, алкоксила, нитрогруппы, цианогруппы, атома галогена или -NR4R5;
R21 и R22 означают, независимо, атом водорода или алкил, или же R21 и R22 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
W означает связь, О или S или радикал -NR23, в котором R23 означает атом водорода или алкил;
либо радикал А2:

в котором:
R24, R25 и R26 означают, независимо, атом водорода, атом галогена, группу ОН или SR27, алкил, алкенил, алкоксил или радикал -NR28R29;
R27 означает атом водорода или алкил;
R28 и R29 означают, независимо, атом водорода, алкил или группу -COR30, или же R28 и R29 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R30 означает атом водорода, алкил, алкоксил или радикал -NR31R32;
R31 и R32 означают, независимо, атом водорода или алкил, или же R31 и R32 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
Q означает -OR33, -SR33, -NR34R35 или арил, замещенный одним или несколькими, одинаковыми или разными заместителями, выбираемыми из атома галогена, группы ОН, алкила, алкоксила, цианогруппы, нитрогруппы или радикала -NR15R16;
R33 означает атом водорода, алкил, арилалкил, гетероциклоалкилкарбонил, алкилкарбонил, арилкарбонил или аралкилкарбонил,
в которых алкил, арил или гетероциклоалкил возможно замещены одним или несколькими, одинаковыми или разными заместителями, выбираемыми из алкила, ОН, алкоксила, нитрогруппы, цианогруппы, атома галогена или -NR4R5;
R34 и R35 означают, независимо, атом водорода, алкил или радикал -CO-R36, или же вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R36 означает алкил; либо радикал A3:

в котором:
R37 означает атом водорода, алкил, арилалкил, гетероциклоалкилкарбонил, алкилкарбонил, арилкарбонил или аралкилкарбонил,
в которых алкил, арил или гетероциклоалкил возможно замещены одним или несколькими, одинаковыми или разными заместителями, выбираемыми из алкила, ОН, алкоксила, нитрогруппы, цианогруппы, атома галогена или -NR4R5;
Т означает радикал -(СН2)m-, где m=1 или 2;
либо радикал А4:

в котором:
R38 означает атом водорода, алкил, -(CH2)q-NR39R40 или аралкил, причем арильная группа возможно замещена одним или несколькими, одинаковыми или разными заместителями, выбираемыми из ОН, алкила, атома галогена, нитрогруппы, алкоксила или -NR39R40;
причем
q означает целое число от 2 до 6;
либо радикал А5:

в котором:
R'38 и R''38 означают, независимо, атом водорода, нитрогруппу, -NR'39R'40, алкил или арилалкил, причем арильная группа возможно замещена одним или несколькими, одинаковыми или разными заместителями, выбираемыми из ОН, алкила, атома галогена, нитрогруппы, алкоксила или радикала -NR39R40;
R'39, R'40, R39 и R40 означают, независимо, атом водорода, алкил или группу -COR41, или же R39 и R40 или R'39 и R'40 вместе с атомом азота образуют возможно замещенный гетероцикл;
R41 означает атом водорода, алкил, алкоксил или радикал -NR42R43;
R42 и R43 означают, независимо, атом водорода или алкил, или же R42 и R43 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
Т означает радикал -(CH2)m-, где m=1 или 2;
либо, наконец, радикал А6:

в котором:
R44 означает атом водорода, группу ОН или алкил или алкоксил;
Ха означает -(CH2)n-, -(CH2)n-CO-, -N(R45)-CO-(CH2)n-CO-, -N(R45)-CO-D-CO-, -CO-N(R45)-D-CO-, -CO-D-CO-, -CH=CH-(CH2)n-CO-, -N(R45)-(CH2)n-CO-, -N(R45)-CO-C(R46R47)-CO-, -О-(CH2)n-CO-, -N(R45)-CO-NH-C(R46R47)-CO-, -CO-N(R45)-C(R46R47)-CO-, -S-(CH2)n-CO- или -Z-CO-;
D означает фениленовый радикал, возможно замещенный одним или несколькими, одинаковыми или разными радикалами, выбираемыми из алкила, алкоксила, ОН, нитрогруппы, атома галогена, цианогруппы или карбоксила, возможно этерифицированного с помощью алкила;
Z означает гетероцикл;
R45 означает атом водорода или алкил;
R46 и R47 означают, независимо, атом водорода, алкил, арил или аралкил, алкильная и арильная группы которых возможно замещены одним или несколькими, одинаковыми или разными заместителями, выбираемыми из группы ОН, -SH, атома галогена, нитрогруппы, алкила, алкоксила, алкилтиогруппы, аралкоксила, арилалкилтиогруппы, -NR48R49 и карбоксила, возможно этерифицированного с помощью алкила;
R48 и R49 означают, независимо, атом водорода, алкил или группу -COR50, или же R48 и R49 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R50 означает атом водорода, алкил, алкоксил или радикал -NR51R52;
R51 и R52 означают, независимо, атом водорода или алкил, или же R51 и R52 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
причем n означает целое число от 0 до 6;
Ya означает -(СН2)р-, -C(R53R54)-(СН2)р-, -С(R53R54)-СО-;
R53 и R54 означают, независимо, атом водорода, алкил, аралкил, арильная группа которого возможно замещена одним или несколькими, одинаковыми или разными заместителями, выбираемыми из группы ОН, атома галогена, нитрогруппы, алкила, алкоксила, -NR55R56;
R55 и R56 означают, независимо, атом водорода, алкил или группу -COR57, или же R55 и R56 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
R57 означает атом водорода, алкил, алкоксил или радикал -NR58R59;
R58 и R59 означают, независимо, атом водорода или алкил, или же R56 и R53 вместе с атомом азота, с которым они связаны, образуют возможно замещенный гетероцикл;
причем р означает целое число от 0 до 6;
Heta означает гетероцикл;
а также аддитивных солей с неорганическими и органическими кислотами или с неорганическими и органическими основаниями вышеуказанных соединений общей формулы (Ia),
для получения лекарственных средств в целях лечения патологий, в которых принимают задействованы кальпаины и/или реакционноспособные формы кислорода.
Более конкретно, объектом изобретения является применение соединений формулы (Ia), указанной выше, для получения лекарственных средств для лечения патологий, в которых принимают активное участие реакционноспособные формы кислорода. Объектом изобретения более конкретно является применение соединений формулы (Ia), указанной выше, для получения лекарственных средств для лечения патологий, в которых принимают активное участие реакционноспособные формы кислорода и кальпаины. Изобретение относится, следовательно, к применению соединений формулы (Ia), указанной выше, для получения лекарственных средств для лечения патологий, таких как воспалительные и иммунологические заболевания, сердечнососудистые и цереброваскулярные заболевания, расстройства центральной или периферической нервной системы, остеопороз, мышечные дистрофии, пролиферативные заболевания, катаракта, трансплантации органов, аутоиммунные и вирусные заболевания, рак, и все патологии, характеризующиеся чрезмерным продуцированием ROS и/или активацией кальпаинов.
Более конкретно, объектом изобретения является применение соединений формулы (Ia), указанной выше, где Heta означает моноциклический радикал с 1-2 гетероатомами, выбираемыми из О и N. Предпочтительно, Heta означает тетрагидрофуран, диоксолан, пирролидин, 1,3-оксазолидин, и R1 a означает атом водорода, радикал -OR3 или оксогруппу.
Более конкретно, объектом изобретения является применение соединений формулы (Ia), указанной выше, где Ха означает -(CH2)n-, -(CH2)n-CO-, -O-(CH2)n-CO-, -CO-N(R45)-D-CO-, -Z-CO-, -N(R45)-CO-(CH2)n-CO-, -N(R45)-CO-C(R46R47)-CO-, -N(R45)-(CH2)n-CO-, -N(R45)-CO-NH-C(R46R47)-CO- или -CO-N(R45)-C(R46R47)-CO-; и предпочтительно, когда R45 и R47 означают атом водорода, R46 означает атом водорода, алкил или фенил, D означает фениленовый радикал, и Z означает тиазольный радикал.
Более конкретно, объектом изобретения является применение соединений формулы (Ia), указанной выше, где R2 a означает атом водорода или аралкил, и предпочтительно бензил.
Более конкретно, объектом изобретения является применение соединений формулы (Ia), указанной выше, где Аа означает либо А1, с W, означающим атом серы; либо A'1; либо А2 с R24, R25 и R26, которые означают, независимо, атом водорода или алкил, и Q, который означает -OR33; либо A3 с Т, означающим радикал -(CH2)2-; либо А4 с Т, означающим радикал -(CH2)-. Предпочтительно Аa означает радикал, выбираемый среди:





Более конкретно, объектом изобретения является применение, указанное выше, соединений общей формулы (Ia), таких, которые описаны в примерах, и предпочтительно соединений, отвечающих одной из следующих формул:
(2R)-6-гидрокси-N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-карбоксамид;
N-1-(4-анилинофенил)-N-4-[(3S)-2-гидрокситетрагидро-3-фуранил]сукцинамид;
(3S)-3-{[4-(4-анилиноанилино)-4-оксобутаноил]амино}тетрагидро-2-фуранилацетат;
N-1-(4-анилинофенил)-N-4-[(1S)-1-(1,3-диоксолан-2-ил)-3-метилбутил]сукцинамид;
N-1-(4-анилинофенил)-N-3-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенилмалонамид;
3-(4-анилиноанилино)тетрагидро-2-фуранол;
N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-2-карбоксамид;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилацетат;
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксамид;
N-[4-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)фенил]-10Н-фенотиазин-2-карбоксамид;
N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-1-карбоксамид;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилпивалат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-3,3-диметилбутаноат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилбензоат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилфенилацетат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-(2S)-2-(диметиламино)-3-фенилпропаноат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-4-морфолинкарбоксилат;
N-{(1S)-3-метил-1-[(3-оксо-1-пирролидинил)карбонил]бутил}-10Н-фенотиазин-2-карбоксамид;
2-(3,5-ди-трет-бутил-4-гидроксифенокси)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]ацетамид;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенил-N3-(1-пропил-2,3-дигидро-1Н-индол-5-ил)малонамид;
N-(2-анилинофенил)-N'-[(3S)-2-гидрокситетрагидро-3-фуранил]мочевина;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-N2-(1-пропил-2,3-дигидро-1Н-индол-5-ил)этандиамид;
(2R)-N-[(1S)-1-(1,3-диоксолан-2-ил)-2-фенилэтил]-6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-карбоксамид;
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-5-индолинкарбоксамид.
Не имеющиеся в продаже промежуточные соединения синтеза формулы (II), (III) и (V) могут быть получены различными, указанными ниже способами синтеза:
1) Синтез промежуточных соединений формулы (II):
Карбоновые кислоты общей формулы (II), в которых А, X, D, n, R45, R46 и R47 имеют вышеуказанное значение, получают исходя из следующих схем синтеза:
1.1) из A-NH(R45):
Карбоновые кислоты общей формулы (II) могут быть получены, в этом случае, исходя из 3 различных производных с кислотными и сложноэфирными группами формул (11.2), (11.4) и (11.6):
Реакцию конденсации анилинов общей формулы (II-1) с торговыми соединениями с кислотными и сложноэфирными группами (Alk=акил) общей формулы (II.2), схема 1.1, осуществляют путем обычной пептидной конденсации. Промежуточно полученный карбоксамид формулы (II.3) затем омыляют для получения карбоновых кислот общей формулы (II). Синтез промежуточных соединений общей формулы (II.1) описан дальше.

Синтез карбоновых кислот общей формулы (II) также может быть осуществлен путем реакции конденсации анилинов общей формулы (II.1) с производными с кислотными и сложноэфирными группами общей формулы (II.4) в вышеописанных условиях. За этой конденсацией следует обычное омыление, приводящее к получению кислот общей формулы (II). Синтез промежуточных соединений общей формулы (II.4) описан дальше.
Реакция конденсации аминов общей формулы (II.1) с торговыми ароматическими кислотами общей формулы (II.6) в уже описанных условиях пептидного синтеза, после омыления промежуточных соединений общей формулы (II.7), также позволяет получать карбоновые кислоты общей формулы (II).
В качестве альтернативы, карбоновые кислоты общей формулы (II) могут быть получены также путем раскрытия циклических ангидридов, таких, как, например, янтарный ангидрид, с помощью аминов общей формулы (II.1) согласно экспериментальному протоколу, описанному в литературе (J. Amer. Chem. Soc., 73, 4007 (1951)).
1.1.1) Получение промежуточных соединений формулы (II.1):
Анилины общей формулы (II.1), не имеющиеся в продаже, производные индолина или 1,2,3,4-тетрагидрохинолина, схема 1.1.1, в которых Т и R38 имеют вышеуказанное значение, могут быть получены из соответствующих нитропроизводных общей формулы (II.1.1). 6-Нитро-1,2,3,4-тетрагидрохинолин описан в Can. J. Chem., 30, 720-722 (1952). Апкилирование амина осуществляют классически с помощью сильного основания, такого, как, например, NaH, в полярном апротонном растворителе, таком, как, например, диметилформамид, в присутствии галогенпроизводного R38-Hal, такого, как, например, 3-диметиламинопропанхлорид или бензилбромид. Промежуточное нитропроизводное общей формулы (II.1.2) затем восстанавливают, например, с помощью никеля Ренея в присутствии гидразингидрата, для получения анилинов общей формулы (II.1).

Кроме того, некоторые производные фенилендиаминов общей формулы (II.1), не имеющиеся в продаже, могут быть получены согласно Farmaco, 6, 713-717 (1951).
В частном случае, когда А означает фенольное производное (А=А2), анилины общей формулы (II.1) получают путем гидрирования, в присутствии Pd/C, нитрофенольных производных, являющихся предшественниками. Нитропроизводные диалкилфенолов могут быть получены согласно способам, описанным в J. Org. Chem., 33 (1), 223-226 (1968), или J. Med. Chem., 41, 1846-1854 (1998).
Промежуточные соединения общей формулы (II.1), в которых А'1 означает дифениламин, могут быть получены исходя из способов, описанных в литературе (Synthesis, 430 (1990); Indian J. Chem., 20B, 611-613 (1981); J. Med. Chem., 18 (4), 386-391 (1975), которые включают восстановление промежуточного нитродифениламина. Восстановление нитрогруппы осуществляют обычно путем гидрирования в присутствии каталитического количества Pd/C, получая аминодифениламины общей формулы (II.1).
Когда А означает карбазольное производное (W означает тогда прямую связь), способы получения аминокарбазолов общей формулы (II.1) включают синтез промежуточного нитрокарбазола. Эти способы описаны в Pharmazie, 48 (11), 8127-820 (1993); Synth. Commun., 24 (1), 1-10 (1994); J. Org. Chem., 45, 1493-1496 (1980); J. Org. Chem., 29 (8), 2474-2476 (1964); Org. Prep. Proced. Int., 13 (6), 419-421 (1981); или J. Org. Chem., 28, 884 (1963). Восстановление нитрогруппы в промежуточных нитрокарбазолах в этом случае осуществляют предпочтительно с помощью гидразингидрата в присутствии никеля Ренея.
Промежуточные соединения общей формулы (II.1), в которых А означает фенотиазиновое производное (W означает атом серы), могут быть получены исходя из описанных в литературе способов, которые включают синтез нитрофенотиазинового производного. В частности, 3-нитрофенотиазин описан в J. Org. Chem., 37, 2691 (1972). Восстановление нитрогруппы для получения аминофенотиазинов общей формулы (II.1) осуществляют согласно классическому методу гидрирования в присутствии каталитического количества Pd/C в растворителе, таком, как этанол.
1.1.2) Получение промежуточных соединений формулы (II.4):
Соединения с кислотными и сложноэфирными группами общей формулы (II.4), схема 1.1.2, могут быть получены из имеющихся в продаже сложных диэфиров общей формулы (II.4.1) согласно способу, описанному в литературе (Tetrahedron Asymmetry, 8 (11), 1821-1823 (1997)).

1.2) Из А-CO2Н:
Промежуточные карбоновые кислоты общей формулы (II) также могут быть получены путем реакции конденсации карбоновых кислот общей формулы (II.8) с имеющимися в продаже сложными аминоэфирами общей формулы (II.9A) или (II.9B), схема 1.2, во время стадии вышеописанного пептидного синтеза. Промежуточные карбоксамиды формул (II.10A) и (II.10В) затем омыляют для получения карбоновых кислот общей формулы (II).

1.2.1) Получение промежуточных соединений формулы (II.8):
Не имеющиеся в продаже карбоксильные производные общей формулы (II.8) могут быть получены исходя из описанных в литературе способов (например, J. Org. Chem., 26, 1221-1223 (1961); Acta Chem. Scandinavica, 21, 888-890 (1973); Can. J. Chem., 50, 1276-1282 (1972); J. Med. Chem., 35 (4), 716-724 (1992); J. Org. Chem., 54, 560-569 (1989); J. Med. Chem., 41 (2), 148-156 (1998); Bull. Soc. Chim. Fr., 1049-1066 (1960).
1.3) Из А-ОН или А-SH:
Кислоты общей формулы (II) (схема 1.3), в которых Х означает -O-(СН2)n-СО-, получают из гидрохинонов общей формулы (II.11), получаемых согласно описанному в литературе способу (J. Chem. Soc. Perkin, 1, 303-306 (1981)). Реакцию конденсации с имеющимися в продаже сложными галогенэфирами общей формулы (II.12) осуществляют в присутствии основания, такого, как, например, К2СО3, путем нагревания в полярном растворителе, как, например, тетрагидрофуран, в течение по меньшей мере 5 часов. Из промежуточных сложных эфиров общей формулы (II.13) затем удаляют защитные группы (в случае трет-бутиловых сложных эфиров - в кислой среде) для получения кислот общей формулы (II).

Кислоты общей формулы (II), в которых Х означает -S-(СН2)n-СО-, получают согласно описанному в литературе способу (J. Med. Chem., 40 (12), 1906-1918 (1997)).
1.4) Из A-CO2H, когда Z означает гетероцикл с V=S или О:
1.4 а) В случае, когда Z означает ненасыщенный гетероцикл, карбоновые кислоты общей формулы (II), схема 1.4а, могут быть получены из карбоновых кислот общей формулы (II.8).

Карбоксамид общей формулы (II.14) получают согласно описанному в литературе экспериментальному протоколу (Synthesis, 1, 37 (1989)). Путем нагревания при температуре в диапазоне от 50°С до температуры кипения с обратным холодильником растворителя, в течение времени от одного до 15 часов, промежуточного соединения формулы (II.14) в присутствии алкилбромпирувата получают оксазолы (V=0) общей формулы (II.16). В качестве альтернативы, тиазолы (V=S) общей формулы (II.16) могут быть получены в две стадии исходя из карбоксамидов общей формулы (II.14). Они, в присутствии реактива Lawesson, в растворителе, таком, как, например, 1,4-диоксан, приводят, как правило, к тиокарбоксамидам общей формулы (II.15). Затем осуществляют стадию циклизации в присутствии алкилбромпирувата, как описано выше. Карбоновые кислоты общей формулы (II), наконец, получают путем удаления защитной группы от карбоксильной группы в обычных условиях.
1.4b) В случае, когда Z означает насыщенный гетероцикл, и, в частности, тиазолидин, карбоновые кислоты общей формулы (II), схема 1.4b, также могут быть получены из карбоновых кислот общей формулы (II.8).
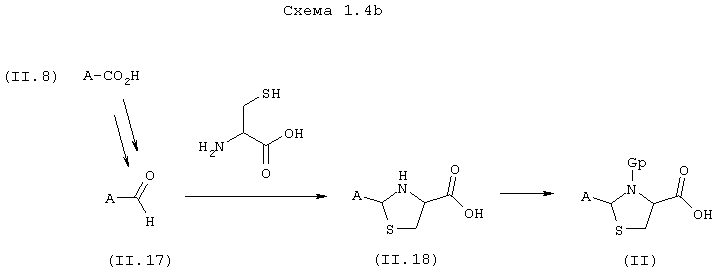
Альдегиды общей формулы (II.17) получают классическим путем после активации карбоксильной группы промежуточных соединений общей формулы (II.8) в форме сложного эфира или алкилгидроксамата, в присутствии DIBAL или LiAlH4, согласно экспериментальным протоколам, описанным в литературе (например, J. Med. Chem., 33, 11-13 (1990)). Реакция этих альдегидов с цистеином в присутствии ацетатных солей приводит непосредственно к тиазолидинам общей формулы (II.18) согласно экспериментальному протоколу, описанному в J. Org. Chem., 22, 943-946 (1957). Аминогруппу тиазолидинового цикла затем защищают в форме карбамата (например, Boc) в обычных условиях, описанных в литературе, для получения карбоновых кислот общей формулы (II).
1.5) Из A-N(R45)-CO-:
Карбоновые кислоты общей формулы (II), в которых X=-N(R45)-(CH2)n-СО-, где n=0, образованы функционализированной мочевиной цепью, схема 1.5.

Синтез этих мочевин осуществляют путем реакции конденсации аминов общей формулы (II.1) со сложными аминоэфирами общей формулы (II.9) в присутствии трифосгена и третичного амина согласно экспериментальному протоколу, описанному в литературе (J. Org. Chem., 59 (7), 1937-1938 (1994)), получая промежуточные соединения общей формулы
(II.19). Карбоновую кислоту общей формулы (II) затем получают обычным образом путем удаления защитной группы от промежуточного сложного эфира.
2) Синтез промежуточных соединений формулы (III):
Промежуточные соединения общей формулы (III), схема 1, в которых R2 имеет вышеуказанное значение и Y означает -(CH2)p-, где р=0, получают из производных N-Cbz-аспарагиновой кислоты общей формулы (III.1), синтез которых описан в литературе (J. Med. Chem., 16 (11), 1277-1280 (1973)). Путем нагревания этих промежуточных соединений в присутствии триоксана и каталитического количества APTS при температуре кипения с обратным холодильником растворителя, такого, как, например, толуол, (Synthesis, 7, 542-544 (1989)) получают производные оксазолидинона общей формулы (III.2). Затем осуществляют восстановление карбоксильной группы с помощью B2H6. ТГФ в тетрагидрофуране (ТГФ) согласно методу, описанному в Chem. Pharm. Bull., 43 (10), 1683-1691 (1995), и получают спирты общей формулы (III.3). Их затем обрабатывают в щелочной среде и таким образом полученное промежуточное соединение формулы (III.4) циклизуют с помощью классического дегидратирующего средства, такого, как, например, дициклогексилкарбодиимид, получая замещенный лактон общей формулы (III.5). Промежуточное соединение общей формулы (III) получают после расщепления бензилкарбамата с помощью Pd/C в атмосфере водорода.

3) Синтез промежуточных соединений формулы (V):
Промежуточные соединения общей формулы (V), схема 3, в которых А, X, Y, R53 и R54 имеют вышеуказанное значение, обычно получают путем пептидной конденсации вышеуказанных кислот общей формулы (II) с имеющими в продаже сложными аминоэфирами общей формулы (V.I). Карбоновые кислоты общей формулы (V) получают после омыления промежуточных сложных эфиров общей формулы (V.2).

Объектом изобретения также являются новые промышленные продукты и, в частности, промышленные продукты, предназначенные для получения продуктов формулы (I). Новые продукты отвечают одной из следующих формул:
N-1-(4-анилинофенил)-N-4-[(3S)-2-оксотетрагидро-3-фуранил]сукцинамид;
метил-(2S)-2-{[4-(4-анилиноанилино)-4-оксобутаноил]амино}-4-метилпентаноат;
N-1-(4-анилинофенил)-N-4-[(1S)-1-формил-3-метилбутил]сукцинамид;
бензил-3-(4-анилиноанилино)-3-оксо-2-фенилпропаноат;
3-(4-анилиноанилино)-3-оксо-2-фенилпропановая кислота;
N-1-(4-анилинофенил)-N-3-[(3S)-2-оксотетрагидро-3-фуранил]-2-фенилмалонамид;
3-(4-анилиноанилино)дигидро-2(3Н)-фуранон;
метил-(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноат;
(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентановая кислота;
N-[(1S)-3-метил-1-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)бутил]-10Н-фенотиазин-2-карбоксамид;
этил-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксилат;
2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоновая кислота;
N-[(3S)-2-оксотетрагидро-3-фуранил]-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксамид;
метил-4-[(10Н-фенотиазин-2-илкарбонил)амино]бензоат;
4-[(10Н-фенотиазин-2-илкарбонил)амино]бензойная кислота;
N-[4-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)фенил]-10Н-фенотиазин-2-карбоксамид;
метил-(2S)-4-метил-2-[(10Н-фенотиазин-1-илкарбонил)амино]пентаноат;
(2S)-4-метил-2-[(10Н-фенотиазин-1-илкарбонил)амино]пентановая кислота;
N-[(1S)-1-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-1-карбоксамид;
N-[(1S)-1-(1,4-диокса-7-азаспиро[4.4]нон-7-илкарбонил)-3-метилбутил]-10Н-фенотиазин-2-карбоксамид;
2-(3,5-ди-трет-бутил-4-гидроксифенокси)-N-[(3S)-2-оксотетрагидро-3-фуранил] ацетамид;
5-нитро-1-пропилиндолин;
1-пропил-2,3-дигидро-1Н-индол-5-иламин;
3-оксо-2-фенил-N-(1-пропил-2,3-дигидро-1Н-индол-5-ил)-β-аланин;
N1-[(3S)-2-оксотетрагидро-3-фуранил]-2-фенил-N3-(1-пропил-2,3-дигидро-1Н-индол-5-ил)малонамид;
N-(2-анилинофенил)-N'-[(3S)-2-оксотетрагидро-3-фуранил]мочевина;
этилоксо[(1-пропил-2,3-дигидро-1Н-индол-5-ил)амино]ацетат;
оксо[(1-пропил-2,3-дигидро-1Н-индол-5-ил)амино]уксусная кислота;
метил-(2S)-2-({[(2R)-6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил]карбонил}амино)-3-фенилпропаноат;
(2R)-N-[(1S)-1-бензил-2-оксоэтил]-6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-карбоксамид;
трет-бутил-5-метил-1,5-индолиндикарбоксилат;
1-(трет-бутоксикарбонил)-5-индолинкарбоновая кислота;
трет-бутил-5-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)-1-индолинкарбоксилат;
трет-бутил-5-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-1-индолинкарбоксилат.
Экспериментальная часть
Следующие примеры представлены для пояснения вышеуказанных методик и ни в коем случае не должны рассматриваться как ограничение объема изобретения.
Пример 1
(2К)-6-гидрокси-N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2,5,1,8-тетраметил-3,4-дигидро-2Н-хромен-2-карбоксамид
1.1) (2R)-6-гидрокси-2,5,7,8-тетраметил-N-[(3S)-2-оксотетрагидро-3-фуранил]-3,4-дигидро-2Н-хромен-2-карбоксамид
Раствор 1,82 г (7,27 ммоль) (R)-тролокса и 1,18 г (7,27 ммоль) 1,1'-карбонилдиимидазола (CDI) в 15 мл безводного тетрагидрофурана перемешивают в течение 1 часа при температуре 23°С, после чего добавляют раствор 1 г (7,27 ммоль) (S)-2-амино-4-бутиролактонгидрохлорида и 1,27 мл (7,27 ммоль) N,N-диизопропилэтиламина (DIEA) в 15 мл безводного диметилформамида. Реакционную смесь перемешивают в течение 15 часов при температуре 23°С и, наконец, концентрируют досуха в вакууме. Остаток растворяют в 100 мл этилацетата, и органический раствор промывают последовательно с помощью 50 мл 1 н. водного раствора HCl, 50 мл H2O, 50 мл водного насыщенного раствора NaHCO3, 50 мл Н2О и, наконец, 50 мл рассола. После высушивания над сульфатом магния органический раствор фильтруют и концентрируют досуха в вакууме. Остаток обрабатывают с помощью 50 мл диэтилового эфира, перемешивают и отфильтровывают. После промывки 2 раза по 25 мл диэтиловым эфиром полученный порошок белого цвета высушивают в вакууме. Температура плавления: 195-196°С.
1.2) (2R)-6-гидрокси-1М-[(3S)-2-гидрокситетрагидро-3-фуранил]-2,5,7,8-тетраметил-З,4-дигидро-2Н-хромен-2-карбоксамид
В трехгорлой колбе, в атмосфере аргона, 1,53 г (4,59 ммоль) промежуточного соединения 1.1 растворяют в 75 мл безводного тетрагидрофурана. Раствор охлаждают до температуры -78°С, после чего вводят по каплям с помощью капельной воронки 18,4 мл (18,4 ммоль) 1М раствора DIBAL в CH2Cl2. После перемешивания в течение 3 часов при температуре -78°С реакцию прекращают путем медленного введения 10 мл метанола. После возврата к температуре 20°С реакционную смесь при интенсивном перемешивании выливают в 150 мл раствора сегнетовой соли. Перемешивание продолжают вплоть до появления двух фаз. Реакционную смесь декантируют и водную фазу снова экстрагируют 2 раза по 50 мл CH2Cl2. Органические фазы объединяют и промывают последовательно с помощью 50 мл Н2О и 50 мл рассола. После высушивания над сульфатом магния и отфильтровывания растворитель выпаривают в вакууме, и остаток очищают на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении 2:8). Получают порошок белого цвета. Температура плавления: 67-70°С.
Примеры 2-11 иллюстрируют соединения, которые могут быть получены согласно вышеописанным схемам синтеза.
Пример 2
2-[(3,5-ди(трет-бутил)-4-гидроксифенил)сульфанил]-N-(2-гидрокситетрагидро-3-фуранил)ацетамид
Пример 3
N-1-(2-гидрокситетрагидро-3-фуранил)-N-4-(1-метил-2,3-дигидро-1Н-индол-5-ил)сукцинамид
Пример 4
N-1-(4-анилинофенил)-N-3-(2-гидрокситетрагидро-3-фуранил)-2-изопропилмалонамид
Пример 5
N-1-(4-анилинофенил)-N-3-(2-гидрокситетрагидро-3-фуранил)изофталамид
Пример 6
N-1-(4-анилинофенил)-N-4-(2-гидрокситетрагидро-3-фуранил)терефталамид
Пример 7
N-1-(4-анилинофенил)-N-2-(2-гидрокситетрагидро-3-фуранил)фталамид
Пример 8
N-{1-[(4-бензил-5-гидрокси-1,3-оксазолидин-3-ил)карбонил]-2-метилпропил}-6-гидрокси-2,5,7,8-тетраметил-2-хроманкарбоксамид
Пример 9
N-(4-анилинофенил)-N'-{1-[(4-бензил-5-гидрокси-1,3-оксазолидин-3-ил)карбонил]-2-метилпропил}мочевина
Пример 10
N-{1-[(4-бензил-5-оксо-1,3-оксазолидин-3-ил)карбонил]-2-метилпропил}-2-[3,5-ди(трет-бутил)-4-гидроксифенокси]ацетамид
Пример 11
6-гидрокси-2,5,7,8-тетраметил-N-{2-метил-1-[(3-оксо-1-пирролидинил)карбонил]пропил}-2-хроманкарбоксамид
Пример 12
N-1-(4-анилинофенил)-N-4-[(3S)-2-гидрокситетрагидро-3-фуранил]сукцинамид
12.1) 4-(4-анилиноанилино)-4-оксобутановая кислота
Используемый экспериментальный протокол является тем, который описан в J. Amer. Chem. Soc., 73, 4007 (1951), исходя из N1-фенил-1,4-бензолдиамина и ангидрида янтарной кислоты с получением порошка бледного серо-голубого цвета. Температура плавления: 175-176°С.
12.2) N-1-(4-анилинофенил)-N-4-[(3S)-2-оксотетрагидро-3-фуранил]сукцинамид
4-(4-Анилиноанилино)-4-оксобутановую кислоту в количестве 1,14 г (4 ммоль) конденсируют с 0,5 г (3,6 ммоль) (S)-2-амино-4-бутиролактонгидрохлорида в присутствии 0,54 г (4 ммоль) НОВТ, 1,53 г (8 ммоль) EDC и 1,66 мл (11,9 ммоль) триэтиламина в 25 мл безводного диметилформамида. Смесь перемешивают в течение 15 часов, после чего концентрируют досуха в вакууме. Остаток после выпаривания распределяют между 100 мл этилацетата и 100 мл 1М водного раствора НС1. Выпавший осадок отфильтровывают на фриттированном стекле и промывают последовательно с помощью воды, этилацетата, диэтилового эфира и дихлорметана. Получают 1,12 г порошка светло-серого цвета. Температура плавления: 202-203°С.
12.3) N-1-(4-анилинофенил)-N-4-[(3S)-2-гидрокситетрагидро-3-фуранил]сукцинамид
Используемый экспериментальный протокол идентичен описанному для получения промежуточного соединения 1.2. Порошок белого цвета. Температура плавления: 178-179°С.
Пример 13
(3S)-3-{[4-(4-анилиноанилино)-4-оксобутаноил]амино}тетрагидро-2-фуранилацетат
Промежуточное соединение 12.3 в количестве 0,15 г (0,4 ммоль) растворяют в 4 мл уксусного ангидрида в присутствии 10 мг (0,08 ммоль) N,N-диметил-4-пиридинамина. Реакционную смесь перемешивают в течение 3 часов при температуре 20°С. Всю смесь выливают в 25 мл воды со льдом и экстрагируют 2 раза по 25 мл этилацетатом. Органический раствор промывают последовательно с помощью 20 мл 2М раствора лимонной кислоты, 20 мл Н2О, 20 мл насыщенного раствора NaHCO3 и, наконец, 20 мл рассола. После высушивания над сульфатом натрия, фильтрации и выпаривания растворителя остаток очищают на колонке с диоксидом кремния (элюирующее средство: этилацетат). Порошок белого цвета. Температура плавления: 191-192°С.
Пример 14
N-1-(4-анилинофенил)-N-4-[(1S)-1-(1,3-диоксолан-2-ил)-3-метилбутил]сукцинамид
14.1) метил-(2S)-2-{[4-(4-анилиноанилино)-4-оксобутаноил]амино}-4-метилпентаноат
Используемый экспериментальный протокол идентичен описанному для получения промежуточного соединения 12.2, причем (S)-2-амино-4-бутиролактон заменяют метиловым эфиром L-лейцина. Порошок серого цвета. Температура плавления: 134-135°С.
14.2) N1-(4-анилинофенил)-N4-[(1S)-1-формил-3-метилбутил]сукцинамид
Используемый экспериментальный протокол идентичен тому, который описан для получения промежуточного соединения 1.2, но исходят из промежуточного соединения 14.1. Порошок белого цвета. Температура плавления: 128-129°С.
14.3) N-1-(4-анилинофенил)-N-4-[(1S)-1-(1,3-диоксолан-2-ил)-3-метилбутил]сукцинамид
Смесь 0,38 г (1 ммоль) промежуточного соединения 14.2, 0,06 мл (1,1 ммоль) этиленгликоля и 20 мг п-толуолсульфоки слоты в 30 мл толуола кипятят с обратным холодильником в течение 3 часов. После возврата к температуре 20°С реакционную смесь разбавляют с помощью 20 мл этилацетата и этот органический раствор промывают водой, затем рассолом. После высушивания над сульфатом магния, фильтрации и концентрирования досуха в вакууме остаток очищают на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении 1:9). Порошок кремового цвета. Температура плавления: 156-157°С.
Пример 15
N-1-(4-анилинофенил)-М-3-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенилмалонамид
15.1) бензил-3-(4-анилиноанилино)-3-оксо-2-фенилпропаноат
Используемый экспериментальный протокол является тем, который описан для получения промежуточного соединения 12.2, но исходят из N1-фенил-1,4-бензолдиамина и 3-(бензилокси)-3-оксо-2-фенилпропановой кислоты.
15.2) 3-(4-анилиноанилино)-3-оксо-2-фенилпропановая кислота
Промежуточное соединение 15.1 в количестве 1,4 г (3,2 ммоль), растворенное в 30 мл смеси CH2Cl2 с этанолом в соотношении 2:1, в течение 1 часа выдерживают в атмосфере водорода (15 бар) в присутствии 100 мг 10%-ного Pd/C. После удаления Pd/C путем отфильтровывания фильтрат концентрируют в вакууме и очищают на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении от 1:1 до 0:1). Частично кристаллизующееся масло.
15.3) N-1-(4-анилинофенил)-N-3-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенилмалонамид
Это соединение получают в две стадии, исходя из промежуточного соединения 15.2, согласно экспериментальным протоколам, описанным для последовательного синтеза промежуточных соединений 12.2 и 12.3. Порошок светло-бежевого цвета. Температура плавления: 86-86,5°С.
Пример 16
3-(4-анилиноанилино)тетрагидро-2-фуранол
16.1)3-(4-анилиноанилино)дигидро-2(3Н)-фуранон
Смесь 1,84 г (10 ммоль) N1-фенил-1,4-бензолдиамина и 0,41 мл (5 ммоль) α-бром-γ-бутиролактона в 20 мл ацетонитрила кипятят с обратным холодильником в течение 5 часов. После возврата к температуре примерно 20°С выпавший в процессе реакции осадок (N1-фенил-1,4-бензолдиамингидробромид) отфильтровывают и промывают с помощью 20 мл ацетонитрила. Фильтрат концентрируют досуха в вакууме и остаток очищают на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении от 1:1 до 4:6). Порошок бежевого цвета. Температура плавления: 142,5-143°С.
16.2) 3-(4-анилиноанилино)тетрагидро-2-фуранол
Используемый экспериментальный протокол является тем, который описан для получения промежуточного соединения 1.2, исходя из промежуточного соединения 16.1. Порошок нечистого белого цвета. Температура плавления: 139-139,4°С.
Пример 17
N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-2-карбоксамид
17.1) метил-(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноат
К раствору 1,82 г (10 ммоль) гидрохлорида метилового эфира L-лейцина, 2,43 г (10 ммоль) 10Н-фенотиазин-2-карбоновой кислоты (J. Med. Chem., 41 (2), 148-156 (1998)), 1,48 г (11 ммоль) НОВТ (N-гидроксибензотриазол) и 4,21 г (22 ммоль) EDC в 30 мл безводного диметилформамида добавляют 4,6 мл (33 ммоль) триэтиламина. Реакционную смесь перемешивают в течение 15 часов. После выпаривания растворителя в вакууме остаток распределяют между 100 мл этилацетата и 50 мл 1М раствора HCl. Органическую фазу декантируют и промывают последовательно с помощью 50 мл Н2O, 50 мл насыщенного раствора NaHCO3 и 50 мл рассола. Органический раствор сушат над сульфатом магния, фильтруют и концентрируют досуха в вакууме. Остаток после выпаривания обрабатывают диэтиловым эфиром и отфильтровывают. Порошок желтого цвета (71%). Температура плавления: 160,5-161°С.
17.2) (23)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентановая кислота
К раствору 1,85 г (5 ммоль) промежуточного соединения 17.1 в 20 мл тетрагидрофурана добавляют за один раз раствор 0,44 г (11 ммоль) LiOH, H2O в 20 мл воды. Реакционную смесь перемешивают в течение 1 часа 30 минут при температуре 20°С. Реакционную смесь охлаждают с помощью бани со льдом, после чего добавляют водный концентрированный раствор HCl вплоть до кислого значения рН. После разбавления с помощью 100 мл этилацетата и перемешивания органическую фазу декантируют. Затем ее промывают с помощью 20 мл 1М водного раствора HCl, затем 20 мл рассола. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют досуха в вакууме. Порошок желто-зеленого цвета. Порошок используют таким, какой есть, в следующей стадии.
17.3) N-[(1S)-3-метил-1-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)бутил]-10Н-фенотиазин-2-карбоксамид
Используемый экспериментальный протокол является таким, который описан для получения промежуточного соединения 12.2, причем промежуточное соединение 12.1 заменяют промежуточным соединением 17.2. Порошок желтого цвета. Температура плавления: 151-152°С.
17.4) N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил] амино}карбонил)-3-метилбутил]-10Н-фенотиазин-2-карбоксамид
Используемый экспериментальный протокол является таким, который описан для получения промежуточного соединения 1.2, причем промежуточное соединение 1.1 заменяют промежуточным соединением 17.3. Порошок желтого цвета. Температура плавления: 100-101°С.
Пример 18
(3S)-3-({[(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилацетат
Используемый экспериментальный протокол является таким, который описан в примере 13, исходя из промежуточного соединения 17.4. Два диастереоизомера 18.1 и 18.2 разделяют путем хроматографии на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении 1:1).
18.1) (2R,3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилацетат
Порошок бледно-желтого цвета. Температура плавления: 199-201°С.
18.2) (2S,3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино[пентаноил}амино)тетрагидро-2-фуранилацетат
Порошок бледно-желтого цвета. Температура плавления: 205-208°С.
Пример 19
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксамид
19.1) 10Н-фенотиазин-2-карботиоамид
Реакционную смесь, состоящую из 3,4 г (14 ммоль) 10Н-фенотиазин-2-карбоксамида (J. Org. Chem., 26, 1138-1143 (1961)) и 3,4 г (8,4 ммоль) реактива Lawesson в виде раствора в 40 мл 1,4-диоксана с добавкой 20 мл пиридина, нагревают при температуре 110°С в течение 1 часа 30 минут. Раствор коричневого цвета затем концентрируют в вакууме и остаток разбавляют с помощью 200 мл этилацетата и 100 мл воды. После перемешивания и декантации органическую фазу промывают последовательно с помощью 100 мл 1н. водного раствора HCl и 100 мл рассола. После высушивания над сульфатом натрия, фильтрации и выпаривания растворителя в вакууме получают порошок оранжевого цвета. Этот порошок промывают диэтиловым эфиром, фильтрат удаляют и экстрагируют ацетоном. Ацетоновый фильтрат затем концентрируют в вакууме и остаток после выпаривания очищают на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении от 1:1 до 4:6). Порошок оранжевого цвета. Температура плавления: 208-209°С.
19.2) этил-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксилат
К суспензии 1,43 г (5,53 ммоль) промежуточного соединения 19.1 в 70 мл абсолютного этанола добавляют 2,09 мл (16,5 ммоль) этилбромпирувата. Реакционную смесь кипятят с обратным холодильником в течение 1 часа 30 минут. После концентрирования досуха в вакууме, полученный остаток черного цвета промывают диэтиловым эфиром, после чего помещают в верхнюю часть хроматографической колонки (элюирующее средство: гептан/этилацетат/тетрагидрофуран в соотношении от 6:4:0 до чистого тетрагидрофурана). Порошок желтого цвета (83%).
19.3) 2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоновая кислота
Раствор 1,62 г (4,57 ммоль) промежуточного соединения 19.2 в 50 мл тетрагидрофурана охлаждают до температуры 0°С, после чего добавляют в одну порцию раствор 300 мг (7,3 ммоль) NaOH в 30 мл воды. Перемешивание продолжают в течение 15 часов при температуре 20°С, после чего реакционную смесь подкисляют, при температуре 0°С, с помощью концентрированного водного раствора HCl. Продукт затем экстрагируют с помощью 100 мл этилацетата и органический раствор промывают с помощью 25 мл воды, затем рассола. После высушивания над сульфатом натрия, фильтрации и концентрирования в вакууме остаток очищают на колонке с диоксидом кремния (элюирующее средство: CH2Cl2/CH3OH в соотношении от 8:2 до 1:1). Порошок желтого цвета.
19.4) N-[(3S)-2-оксотетрагидро-3-фуранил]-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксамид
Используемый экспериментальный протокол является таким, который описан для получения промежуточного соединения 12.2, причем промежуточное соединение 12.1 заменяют промежуточным соединением 19.3. Порошок желтого цвета. Температура плавления: 277-277,5°С.
19.5) N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксамид
Используемый экспериментальный протокол является таким, который описан для получения промежуточного соединения 1.2, причем промежуточное соединение 1.1 заменяют промежуточным соединением 19.4. Порошок желтого цвета. Температура плавления: 189-190°С.
Пример 20
N-[4-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)фенил]-10Н-фенотиазин-2-карбоксамид
20.1) 4-[(10Н-фенотиазин-2-илкарбонил)амино]бензойная кислота
Используемый экспериментальный протокол является таким, который описан для синтезов промежуточных соединений 17.1 и 17.2, причем метиловый эфир L-лейцина заменяют метил-4-аминобензоатом.
20.2) N-[4-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)фенил]-10Н-фенотиазин-2-карбоксамид
Используемый экспериментальный протокол является таким, который описан для синтеза промежуточного соединения 12.2, причем 4-(4-анилиноанилино)-4-оксобутановую кислоту заменяют промежуточным соединением 20.1. Порошок желто-зеленого цвета. Температура плавления: 284-285°С.
20.3) N-[4-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)фенил]-10Н-фенотиазин-2-карбоксамид
Используемый экспериментальный протокол является таким, который описан для получения промежуточного соединения 1.2, причем промежуточное соединение 1.1 заменяют промежуточным соединением 20.2. Порошок темно-желтого цвета. Температура плавления: 234-235°С.
Пример 21
N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-1-карбоксамид
Используемый экспериментальный протокол идентичен такому, который описан для получения соединения 17, причем 10Н-фенотиазин-2-карбоновую кислоту заменяют 10Н-фенотиазин-1-карбоновой кислотой. Порошок желтого цвета. Температура плавления: 99-101°С.
Пример 22
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилпивалат
0,14 мл 2,2-Диметилпропаноилхлорида добавляют по каплям к охлажденному до температуры 0°С раствору 0,45 г (1,02 ммоль) промежуточного соединения 17.4 и 0,28 мл (2,04 ммоль) Et3N в 20 мл CH2Cl2. Реакционную смесь затем перемешивают в течение 24 часов при температуре 22°С. После разбавления с помощью 50 мл дихлорметана органический раствор промывают с помощью 20 мл воды, затем 20 мл рассола, сушат над сульфатом магния, фильтруют и концентрируют досуха в вакууме. Продукт очищают путем хроматографии на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении 1:1). Твердое вещество бледно-желтого цвета. Температура плавления: 107-109°С.
Пример 23
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-3,3-диметилбутаноат
Используемый экспериментальный протокол является таким, который описан в примере 22, исходя из промежуточного соединения 17.4 и 3,3-диметилбутаноилхлорида. Твердое вещество желтого цвета. Температура плавления: 111-113°С.
Пример 24
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилбензоат
Используемый экспериментальный протокол является таким, который описан в примере 22, исходя из промежуточного соединения 17.4 и бензоилхлорида. Твердое вещество бледно-желтого цвета. Температура плавления: 193-195°С.
Пример 25
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилфенилацетат
Используемый экспериментальный протокол является таким, который описан в примере 22, исходя из промежуточного соединения 17.4 и фенилацетилхлорида. Твердое вещество желтого цвета. LC-MS (жидкостная хроматография-масс-спектрометрия): МН+=560,2.
Пример 26
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-(2S)-2-(диметиламино)-3-фенилпропаноат
К раствору 0,5 г (1,13 ммоль) промежуточного соединения 17.4 в 2 мл дихлорметана добавляют 0,22 г (1,13 ммоль) (2S)-2-(диметиламино)-3-фенилпропановой кислоты и 0,23 г (1,13 ммоль) 1,3-дициклогексилкарбодиимида. После перемешивания в течение 72 часов при температуре 22°С осадок отфильтровывают и промывают с помощью 10 мл дихлорметана. Фильтрат затем промывают с помощью 10 мл насыщенного раствора NaHCO3, затем 10 мл воды и 10 мл рассола. Органический раствор сушат над сульфатом магния, фильтруют и концентрируют досуха. Остаток после выпаривания очищают на колонке с диоксидом кремния (элюирующее средство: этилацетат). Твердое вещество желтого цвета. LC-MS: MH+=617,2.
Пример 27
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-4-морфолинкарбоксилат
Используемый экспериментальный протокол является таким, который описан в примере 22, исходя из промежуточного соединения 17.4 и морфолинхлорформиата. Твердое вещество желтого цвета. Температура плавления: 165-167°С.
Пример 28
N-{(1S)-3-метил-1-[(3-оксо-1-пирролидинил)карбонил]бутил}-10Н-фенотиазин-2-карбоксамид
28.1) N-[(1S)-1-(1,4-диокса-7-азаспиро[4.4]нон-7-илкарбонил)-3-метилбутил]-10Н-фенотиазин-2-карбоксамид
К раствору 0,62 г (1,76 ммоль) промежуточного соединения 17.2 в 30 мл дихлорметана добавляют последовательно 0,23 г (1,76 ммоль) 1,4-диокса-7-азаспиро[4.4]нонана (J. Med. Chem., 35 (8), 1392-1398 (1992)), 0,26 г (1,93 ммоль) НОВТ, 0,74 г (3,86 ммоль) EDC и, наконец, 0,54 мл (3,86 ммоль) триэтиламина. Реакционную смесь перемешивают в течение 15 часов при температуре 22°С. После разбавления с помощью 20 мл воды и перемешивания органическую фазу декантируют и промывают последовательно с помощью 20 мл воды и 20 мл рассола. Органический раствор сушат над сульфатом магния, фильтруют и концентрируют досуха. Остаток после выпаривания очищают на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении 1:1). Твердое вещество желтого цвета. Температура плавления: 75-77°С.
28.2) N-{(1S)-3-метил-1-[(3-оксо-1-пирролидинил)карбонил]бутил}-10Н-фенотиазин-2-карбоксамид
Раствор 0,28 г (0,6 ммоль) промежуточного соединения 28.1 в 14 мл СН3ОН и 10 мл 8%-ной H2SO4 нагревают в течение 7 часов при температуре 60°С. Реакционную смесь, наконец, разбавляют с помощью 20 мл воды и 30 мл этилацетата. После перемешивания и декантации органическую фазу промывают последовательно с помощью 20 мл 1М раствора NaHCO3 и 20 мл рассола. Органический раствор сушат над сульфатом натрия, фильтруют и концентрируют досуха. Остаток после выпаривания очищают на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении 1:1). Твердое вещество желтого цвета. LC-MS: MH+=424,3.
Пример 29
2-(3,5-ди-трет-бутил-4-гидроксифенокси)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]ацетамид
29.1) 2-[3,5-ди(трет-бутил)-4-гидроксифенокси]уксусная кислота
К раствору 1,56 г (4,64 ммоль) трет-бутил-2-[3,5-ди (трет-бутил)-4-гидроксифенокси]ацетата (полученного согласно J. Heterocycl. Chem., 31, 1439-1443 (1994)) в 20 мл дихлорметана добавляют 3,6 мл (46 ммоль) трифторуксусной кислоты. Реакционную смесь перемешивают в течение 1 часа, концентрируют в вакууме и остаток растворяют в 50 мл диэтилового эфира. Органический раствор экстрагируют 2 раза по 25 мл насыщенным раствором NaHCO3, водную фазу затем промывают с помощью 25 мл диэтилового эфира. Водный щелочной раствор затем подкисляют, при температуре 0°С, с помощью насыщенного раствора KHSO4 и, затем, целевой продукт экстрагируют 2 раза по 25 мл диэтиловым эфиром. Органический раствор сушат над сульфатом натрия, фильтруют и концентрируют в вакууме, получая порошок белого цвета с выходом 70%. Температура плавления: 172-173°С.
29.2) 2-(3,5-ди-трет-бутил-4-гидроксифенокси)-N-[(3S)-2-оксотетрагидро-3-фуранил]ацетамид
Используемый экспериментальный протокол является таким, который описан для получения промежуточного соединения 12.2, исходя из промежуточного соединения 29.1. Твердое вещество белого цвета. Температура плавления: 162,5-163°С.
29.3) 2-(3,5-ди-трет-бутил-4-гидроксифенокси)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]ацетамид
Используемый экспериментальный протокол является таким, который описан для получения промежуточного соединения 1.2, исходя из промежуточного соединения 29.2. Твердое вещество белого цвета. Температура плавления: 133,5-134°С.
Пример 30
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенил-N3-(1-пропил-2,3-дигидро-1Н-индол-5-ил)малонамид
30.1) 5-нитро-1-пропилиндолин
К раствору 2 г (12,18 ммоль) 5-нитроиндолина в 16 мл безводного диметилформамида при температуре 20°С порциями добавляют 0,51 г (12,79 ммоль) 60%-ного гидрида натрия. После перемешивания в течение дополнительных 30 минут по каплям добавляют 2,32 мл (25,58 ммоль) 1-бромпропана. Перемешивание поддерживают в течение ночи и реакционную смесь затем разбавляют с помощью 50 мл воды и 50 мл этилацетата. После перемешивания и декантации органическую фазу промывают последовательно с помощью 25 мл воды и 25 мл рассола, сушат над сульфатом натрия, фильтруют и концентрируют досуха в вакууме. Остаток после выпаривания затем очищают на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении 9:1). Масло оранжевого цвета.
30.2) 1-пропил-2,3-дигидро-1Н-индол-5-иламин
К смеси 3,28 г (15,9 ммоль) 5-нитро-1-пропилиндолина и 4 мл (80 ммоль) гидразингидрата в 60 мл абсолютного этанола добавляют примерно 400 мг никеля Ренея. Реакционную смесь кипятят с обратным холодильником в течение 5 часов. После возврата к температуре 23°С, в колбу добавляют небольшое количество диоксида кремния и растворитель выпаривают в вакууме. Остаток после выпаривания помещают в верхнюю часть хроматографической колонки. Целевой продукт элюируют с помощью смеси гептана и этилацетата в соотношении 1:9. Получают масло черного цвета, которое прямо используют в следующей стадии.
30.3) N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенил-N3-(1-пропил-2,3-дигидро-1Н-индол-5-ил)малонамид
Используемый экспериментальный протокол является таким, который описан в примере 15, исходя из промежуточного соединения 30.2. Твердое вещество желтого цвета. LC-MS: MH+=424,2.
Пример 31
N-(2-анилинофенил)-N'-[(3S)-2-гидрокситетрагидро-3-фуранил]мочевина
31.1) N-(2-анилинофенил)-N'-[(3S)-2-гидрокситетрагидро-3-фуранил]мочевина
В трехгорлую колбу, содержащую 0,89 г (3 ммоль) трифосгена в 45 мл безводного дихлорметана, в инертной атмосфере, медленно (в течение 4 часов) добавляют раствор 1,48 г (8,15 ммоль) (S)-2-амино-4-бутиролактонгидробромида и 3,12 мл (17,9 ммоль) диизопропилэтиламина в 80 мл безводного дихлорметана. После дополнительного перемешивания в течение 15 минут добавляют за один раз раствор 1,5 г (8,15 ммоль) N1-фенил-1,2-бензолдиамина и 3,12 мл (17,9 ммоль) диизопропилэтиламина в 45 мл безводного дихлорметана. Реакционную смесь, затем нагревают в течение 5 часов при температуре 60°С. После концентрирования досуха в вакууме остаток распределяют между 50 мл этилацетата и 50 мл воды. После перемешивания и декантации органическую фазу промывают последовательно с помощью 50 мл воды и 50 мл рассола. Органический раствор затем сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток после выпаривания затем очищают на колонке с диоксидом кремния (элюирующее средство: гептан/этилацетат в соотношении 1:2). Твердое вещество розового цвета. Температура плавления: 63-65°С.
31.2) N-(2-анилинофенил)-N'-[(3S)-2-гидрокситетрагидро-3-фуранил]мочевина
Используемый экспериметальный протокол является таким, который описан для получения промежуточного соединения 1.2, но исходят из промежуточного соединения 31.1. Твердое вещество бледно-розового цвета. LC-MS: MH+=314,3.
Пример 32
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-N2-(1-пропил-2,3-дигидро-1Н-индол-5-ил)этандиамид
Используемый экспериметальный протокол является таким, который описан в примере 30, причем вместо 3-(бензилокси)-3-оксо-2-фенилпропановой кислоты используют этилхлор(оксо)ацетат. Твердое вещество бледно-желтого цвета. Температура плавления: 120-122°С.
Пример 33
(2R)-N-[(1S)-1-(1,3-диоксолан-2-ил)-2-фенилэтил]-6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-карбоксамид
Используемый экспериметальный протокол является таким, который описан в примере 14, причем вместо промежуточного соединения 12.1 используют (R)-тролокс и метиловый эфир L-лейцина заменяют метиловым эфиром L-фенилаланина. Масло желтого цвета. LC-MS: МН+=426,2.
Пример 34
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-5-индолинкарбоксамид
34.1) трет-бутил-5-метил-1,5-индолиндикарбоксилат
К раствору 0,85 г (4,8 ммоль) метил-5-индолин-карбоксилата (J. Heterocycl. Chem., 30 (4), 1133-1136 (1993)) в 15 мл дихлорметана, при температуре 20°С, добавляют последовательно 1,26 г (5,8 ммоль) ди-трет-бутилдикарбоната и 0,80 мл (5,8 ммоль) триэтиламина. Реакционную смесь перемешивают в течение 20 часов и концентрируют досуха в вакууме. Остаток распределяют между 50 мл этилацетата и 25 мл воды. После перемешивания и декантации органическую фазу промывают с помощью 25 мл рассола, сушат над сульфатом магния, фильтруют и концентрируют досуха в вакууме. Полученный порошок суспендируют в гептане, перемешивают и отфильтровывают, получая твердое вещество белого цвета с выходом 73%. Температура плавления: 107-107,5°С.
34.2) 1-(трет-бутоксикарбонил)-5-индолинкарбоновая кислота
Раствор 0,97 г (3,49 ммоль) промежуточного соединения 34.1 и 0,16 г (3,84 ммоль) LiOH в смеси из 20 мл тетрагидрофурана и 20 мл воды перемешивают в течение 24 часов при температуре 20°С. Реакционную смесь затем охлаждают с помощью бани со льдом, подкисляют с помощью 1М раствора KHSO4 и разбавляют с помощью 50 мл этилацетата. Органическую фазу затем декантируют, промывают с помощью 25 мл рассола, сушат над сульфатом магния, фильтруют и концентрируют досуха в вакууме. Получают твердое вещество белого цвета (92%), используемого таким, какое есть, в следующей стадии.
34.3) трет-бутил-5-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)-1-индолинкарбоксилат
Используемый экспериментальный протокол является таким, который описан для получения промежуточного соединения 12.2, причем промежуточное соединение 12.1 заменяют промежуточным соединением 34.2. Твердое вещество белого цвета. Температура плавления: 172,5-173°С.
34.4) трет-бутил-5-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-1-индолинкарбоксилат
Используемый экспериментальный протокол является таким, который описан для получения промежуточного соединения 1.2, причем промежуточное соединение 1.1 заменяют промежуточным соединением 34.3. Твердое вещество белого цвета. Температура плавления: 141-141,5°С.
34.5) N-[(3S)-2-гидрокситетрагидро-3-фуранил]-5-индолинкарбоксамид
К раствору 0,4 г (1,15 ммоль) промежуточного соединения 34.4 в 10 мл дихлорметана, охлажденному с помощью бани со льдом, добавляют по каплям 6 мл (24 ммоль) 4н. раствора HCl в диоксане. После перемешивания в течение 2 часов при температуре 20°С реакционную смесь концентрируют досуха в вакууме. Остаток растворяют в 20 мл воды и водный раствор промывают последовательно с помощью 20 мл этилацетата и 20 мл дихлорметана. Водную фазу затем подщелачивают путем добавления насыщенного раствора Na2СО3 и продукт экстрагируют 2 раза по 20 мл этилацетатом. Органический раствор сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Остаток после выпаривания очищают на колонке с диоксидом кремния (элюирующее средство: СН2Cl2/ацетон в соотношении 1:1). Твердое вещество белого цвета. LC-MS: МН+=249,2.
Примеры 35-37 иллюстрируют соединения, которые могут быть получены согласно вышеописанным схемам синтеза.
Пример 35
(2S)-2-{[(4-анилиноанилино)карбонил]амино}-N-[(3S)-2-гидрокситетрагидро-3-фуранил]-4-метилпентанамид
Пример 36
(2S)-2-{[(1-бензил-2,3-дигидро-1Н-индол-5-ил)амино]карбонил}амино)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]-4-метилпентанамид
Пример 37
(2S)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]-4-метил-2-[({[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]амино}карбонил)пентанамид
Фармакологическое исследование продуктов согласно изобретению
Исследование воздействий на кальпаин I свиньи
Используемым методом является метод, описанный Mallya и др. (Biochemical and biophysical research communications, 248, 293-296 (1998)). Активность кальпаина in vitro контролируют путем измерения флуоресценции, возникающей вследствие деструкции синтетического субстрата фермента Suc-LY-AMC (Suc-Leu-Tyr-аминометилкумарин). Высвобождаемый аминометилкумарин флуоресцирует при длине волны 460 нм с экстинкцией при длине волны 380 нм. Тестируемые ингибиторы растворяют в диметилсульфоксиде в концентрации, соответствующей 40-кратной конечной концентрации. 5 мкл раствора помещают в 96-луночный планшет с черной поверхностью. После этого добавляют 175 мкл на лунку буфера для реакции, содержащего кальпаин I и его субстрат. Реакцию инициируют путем добавления 20 мкл 50 мМ раствора CaCl2. Планшеты инкубируют при температуре 25°С и флуоресценцию (экстинкция при 380 нм и эмиссия при 460 нм) определяют по истечении 30 минут с помощью устройства для считывания микропланшетов (Victor, Wallack). ИК50 (ингибирующая на 50% концентрация) определяют путем расчета соотношений флуоресценция продукта/флуоресценция контроля (диметилсульфоксид). Состав буфера для ферментативной реакции: 50 мМ трис-HCl, рН=7,5; 50 мМ NaCl, 1 мМ ЭДТУ (этилендиаминтетрауксусная кислота), 5 мМ β-меркаптоэтанола, 1 мМ Suc-LY-AMC (Bachem, номер по каталогу 1-1355) и 2,5 Ед./мл кальпаина (эритроциты свиньи, Calbiochem, номер по каталогу 208712). В этом тесте величина ИК5о некоторых соединений согласно изобретению составляет ниже 5 мкмоль.
Исследование воздействий на липидное перокисление коры головного мозга крысы
Ингибирующую активность продуктов согласно изобретению определяли путем меры их воздействий на степень липидного перокисления, определяемую по концентрации малондиальдегида (MDA). MDA, получающийся за счет перокисления ненасыщенных жирных кислот, является хорошим показателем липидного перокисления (Н. Esterbauer и К.Н. Cheeseman, Meth. Enzymol., 186, 407-421 (1990)). Самцов крыс Sprague Dawley массой 200-250 г (Charles River) умерщвляли путем обезглавливания. Кору головного мозга извлекали, затем гомогенизировали в гомогенизаторе Томаса в 20 мМ буфере Трис-HCl, рН=7,4. Гомогенат центрифугировали два раза при ускорении 50000 г в течение 10 минут при температуре 4°С. Осадок после центрифугирования хранили при температуре -80°С. В день эксперимента осадок суспендировали при концентрации 1 г/15 мл и центрифугировали при ускорении 515 г в течение 10 минут при температуре 4°С. Супернатант использовали немедленно для определения липидного перокисления. Гомогент коры головного мозга крысы (500 мкл) инкубировали при температуре 37°С в течение 15 минут в присутствии тестируемых соединений или растворителя (10 мкл). Реакцию липидного перокисления инициировали путем добавления 50 мкл раствора 1 мМ FeCl2, 1 мМ ЭДТУ (этилендиаминтетрауксусная кислота) и 4 мМ аскорбиновой кислоты. После инкубации в течение 30 минут при температуре 37°С реакцию прекращали путем добавления 50 мкл 0,2%-ного раствора трет-бутилгидрокситолуола (ВНТ). MDA количественно определяли с помощью колориметрического теста, вводя во взаимодействие 650 мкл хромогенного реагента (R) N-метил-2-фенилиндола с 200 мкл гомогената в течение 1 часа при температуре 45°С. Конденсация молекулы MDA с двумя молекулами реагента R продуцирует стабильный хромофор, максимальная длина волны абсорбции которого равна 586 нм. (Caldwell и др., European J. Pharmacol., 285, 203-206 (1995)). В этом тесте, величина ИК50 соединений согласно изобретению составляет ниже 5 мкмоль.
Настоящее изобретение относится к новым гетероциклическим производным, обладающим ингибирующей кальпаины активностью и/или улавливающей реакционноспособные формы кислорода активностью, формулы (I)  где Het означает моноциклический 5-6-членный гетероциклический радикал, содержащий 1-2 гетероатома, выбранных из O или N; A выбирают из А1, А/1, А2 и А3, А4,
где Het означает моноциклический 5-6-членный гетероциклический радикал, содержащий 1-2 гетероатома, выбранных из O или N; A выбирают из А1, А/1, А2 и А3, А4, 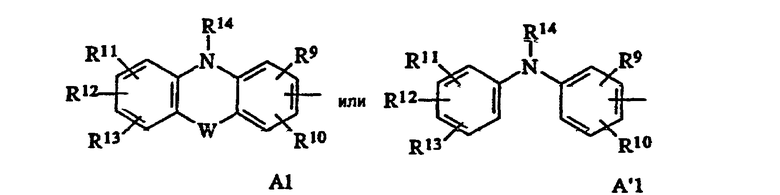



Х означает -(СН2)n-, -(СН2)n-СО-, -N (R45) -СО- (СН2)n-СО-, -CO-N(R45)-D-CO-, -N(R45)-(СН2)n-СО-, -N(R45)-CO-C(R46R47)-CO-, -О-(СН2)n-СО-, -N (R45) -CO-NH-C (R46R47) -СО-, -CO-N (R45) -С (R46R47) -СО- или -Z-CO-; Y означает -(СН2)p-, -C(R53R54) - (СН2)р-, -С (R53R54)-СО-; R1 означает атом водорода, радикал -OR3 или оксогруппу, R3 означает атом водорода, моноциклический насыщенный 6-членный гетероциклоалкилкарбонил, в котором гетероциклоалкил содержит 2 гетероатома, выбранных из атомов азота или кислорода; C1-C6алкилкарбонил, фенилкарбонил или фенил(C1-C6)алкилкарбонил, возможно замещенный группой -NR4R5; фенилкарбонил или фенил(C1-C6)алкилкарбонил, возможно замещенный группой -NR4R5; R4 и R5 означают, независимо, (C1-C6)алкил; R2 означает атом водорода; и их фармацевтическим композициям. 6 н. и 12 з.п.ф-лы.

в рацемической форме, в форме энантиомеров, диастереоизомеров или в виде любых комбинаций этих форм,
в которой R1 означает атом водорода, радикал -OR3 или оксогруппу, где R3 означает атом водорода, моноциклический насыщенный 6-ти членный гетероциклоалкилкарбонил, в котором гетероциклоалкил содержит 2 гетероатома, выбранные из атомов азота или кислорода; C1-C6алкилкарбонил, фенилкарбонил или фенил(C1-C6)алкилкарбонил, возможно замещенный группой -NR4R5;
R4 и R5 означают независимо радикал (C1-C6)алкил;
R2 означает атом водорода;
А означает
либо радикал А1 или А'1

в котором R9, R10, R11, R12, R13 означают независимо атом водорода;
R14 означает атом водорода;
W означает S;
либо радикал А2

в котором R24, R25 и R26 означают, независимо, атом водорода или (C1-C6)алкил;
Q означает -ОН;
либо радикал A3

в котором R37 означает атом водорода,
Т означает радикал -(CH2)m- , где m=2;
либо радикал А4

в котором R38 означает атом водорода, радикал (C1-C6)алкил, или арил(C1-C6)алкил, в котором арильная группа выбрана из фенила или нафтила;
Т означает радикал -(СН2)m-, где m=l;
Х означает -(СН2)n-, -(СН2)n-СО-, -N (R45) -СО- (СН2)n-СО-, -CO-N(R45)-D-CO-, -N(R45)-(СН2)n-СО-, -N(R45)-CO-C(R46R47)-CO-, -О-(СН2)n-СО-, -N (R45) -CO-NH-C (R46R47) -СО-, -CO-N (R45) -С (R46R47) -СО- или -Z-CO-;
D означает фениленовый радикал,
Z означает тиазол;
R45 означает атом водорода;
R46 и R47 означают независимо атом водорода, радикал (C1-C6)алкил, фенил;
причем n означает целое число от 0 до 2;
Y означает -(СН2)p-, -C(R53R54) - (СН2)р-, -С (R53R54)-СО-;
R53 и R54 означают независимо атом водорода, радикал (C1-C6)алкил или радикал фенил(C1-C6)алкил;
причем р означает целое число от 0 до 2;
Het означает моноциклический 5-6-членный гетероциклический радикал, содержащий 1-2 гетероатома, выбранные из O или N;
а также аддитивные соли с неорганическими и органическими кислотами или с неорганическими и органическими основаниями вышеуказанных соединений общей формулы (I), за исключением соединений формулы (I), в которой, когда Het означает тетрагидрофуран или тетрагидропиран, R1 означает радикал OR3, где R3 означает атом водорода, моноциклический ненасыщенный 6-членный гетероциклоалкилкарбонильный радикал, в котором гетероциклоалкил содержит 2 гетероатома, выбранные из азота или кислорода, алкилкарбонил, фенилкарбонил или фенилалкилкарбонил, R2 означает атом водорода и Y означает радикал -(CH2)p-, где р=0, то Х означает -CO-N(R45)-C(R46R47)-CO-, где R45 = R46 = Н.

(2R)-6-гидрокси-N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2,5,7,8-тетраметил-З,4-дигидро-2Н-хромен-2-карбоксамид;
N-1-(4-анилинофенил)-N-4-[(3S)-2-гидрокситетрагидро-3-фуранил]сукцинамид;
(3S)-3-{[4-(4-анилиноанилино)-4-оксобутаноил]амино}тетрагидро-2-фуранилацетат;
N-1-(4-анилинофенил)-N-4-[(1S)-1-(1,3-диоксолан-2-ил)-3-метилбутил]сукцинамид;
N-1-(4-анилинофенил)-N-3-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенилмалонамид;
3-(4-анилиноанилино)тетрагидро-2-фуранол;
N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-2-карбоксамид;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилацетат;
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксамид;
N-[4-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)фенил]-10Н-фенотиазин-2-карбоксамид;
N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-1-карбоксамид;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилпивалат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-З,3-диметилбутаноат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилбензоат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилфенилацетат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-(2S)-2-(диметиламино)-3-фенилпропаноат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-4-морфолинкарбоксилат;
N-{(1S)-3-метил-1-[(3-оксо-1-пирролидинил)карбонил]бутил}-10Н-фенотиазин-2-карбоксамид;
2-(3,5-дитретбутил-4-гидроксифенокси)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]ацетамид;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенил-N3-(1-пропил-2,3-дигидро-1Н-индол-5-ил)малонамид;
N-(2-анилинофенил)-N'-[(3S)-2-гидрокситетрагидро-3-фуранил]мочевина;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-N2-(1-пропил-2,3-дигидро-1Н-индол-5-ил)этандиамид;
(2R)-N-[(1S)-1-(1,3-диоксолан-2-ил)-2-фенилэтил]-6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-карбоксамид;
N-[(3S)-2-гидрокситетрагидро-З-фуранил]-5-индолинкарбоксамид.
(3S)-3-({(2S)-4-метил-2-[(10H-фенотиазин-2-илкарбонил)амино]-пентаноил}амино)тетрагидро-2-фуранилацетат;
(2R,3S)-3-({(2S)-4-метил-2-[(10H-фенотиазин-2-илкарбонил)амино]-пентаноил}амино)тетрагидро-2-фуранилацетат;
(2S,3S)-3-({(2S)-4-метил-2-[(10H-фенотиазин-2-илкарбонил)амино]-пентаноил}амино)тетрагидро-2-фуранилацетат;
(2S)-2-({[(1-бензил-2,3-дигидро-1H-индол-5-ил)амино]карбонил}амино)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]-4-метилпентанамид;
в рацемической форме, в форме энантиомеров, диастереоизомеров или в виде любых комбинаций этих форм, а также аддитивные соли с неорганическими и органическими кислотами или с неорганическими и органическими основаниями вышеуказанных соединений.

в рацемической форме, форме энантиомеров, диастереоизомеров или в виде любых комбинаций этих форм,
в которой Ra 1 означает атом водорода, оксогруппу или радикал -OR3, где R3 означает атом водорода, моноциклический насыщенный 6-членный гетероциклоалкилкарбонил, в котором гетероциклоалкил содержит 2 гетероатома, выбранные из атомов азота или кислорода; C1-C6алкилкарбонил, фенилкарбонил или фенил(C1-C6)алкилкарбонил, возможно замещенный группой -NR4R5;
R4 и R5 означают, независимо, радикал (C1-C6)алкил;
Rа 2 означает атом водорода;
Аа означает
либо радикал А1 или А'1

в котором R9, R10, R11, R12, R13 означают независимо атом водорода;
R14 означает атом водорода;
W означает S;
либо радикал А2

в котором R24, R25 и R26 означают независимо атом водорода или (C1-C6)алкил;
Q означает -ОН;
либо радикал A3

в котором R37 означает атом водорода,
Т означает радикал -(CH2)m- , где m=2;
либо радикал А4

в котором R38 означает атом водорода, радикал (C1-C6)алкил, или аралкил, причем арильная группа выбрана из фенила или нафтила;
Т означает радикал -(СН2)m-, где m=1;
Х означает -(СН2)n-, -(СН2)n-СО-, -N (R45) -СО- (СН2)n-СО-,
-CO-N(R45)-D-CO-, -N(R45)-(СН2)n-СО-, -N(R45)-CO-C(R46R47)-CO-, -О-(СН2)n-СО-, -N (R45) -CO-NH-C (R46R47) -СО-, -CO-N (R45) -С (R46R47) -СО- или -Z-CO-;
D означает фениленовый радикал,
Z означает тиазол;
R45 означает атом водорода;
R46 и R47 означают независимо атом водорода, радикал (C1-C6)алкил или фенил;
причем n означает целое число от 0 до 2;
Y означает -(СН2)p-, -C(R53R54) - (СН2)р-, -С (R53R54)-СО-;
R53 и R54 означают, независимо, атом водорода, радикал (C1-C6)алкил или радикал фенил(C1-C6)алкил;
причем р означает целое число от 0 до 2;
Het означает моноциклический 5-6-ти членный гетероцикл, содержащий 1-2 гетероатома, выбранные из O или N;
а также аддитивные соли с неорганическими и органическими кислотами или с неорганическими и органическими основаниями вышеуказанных соединений общей формулы (Ia).

(2R)-6-гидрокси-N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-карбоксамид;
N-1-(4-анилинофенил)-N-4-[(3S)-2-гидрокситетрагидро-3-фуранил]сукцинамид;
(3S)-3-{[4-(4-анилиноанилино)-4-оксобутаноил]амино}тетрагидро-2-фуранилацетат;
N-1-(4-анилинофенил)-N-4-[(1S)-1-(1,3-диоксолан-2-ил)-3-метилбутил]сукцинамид;
N-1-(4-анилинофенил)-N-3-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенилмалонамид;
3-(4-анилиноанилино)тетрагидро-2-фуранол;
N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-2-карбоксамид;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилацетат;
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксамид;
N-[4-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)фенил]-10Н-фенотиазин-2-карбоксамид;
N-[(1S)-1-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-1-карбоксамид;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилпивалат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-З,3-диметилбутаноат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилбензоат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилфенилацетат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-(2S)-2-(диметиламино)-3-фенилпропаноат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-4-морфолинкарбоксилат;
N-{(1S)-3-метил-1-[(3-оксо-1-пирролидинил)карбонил]бутил}-10Н-фенотиазин-2-карбоксамид;
2-(3,5-дитретбутил-4-гидроксифенокси)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]ацетамид;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенил-N3-(1-пропил-2,3-дигидро-1Н-индол-5-ил)малонамид;
N-(2-анилинофенил)-N'-[(3S)-2-гидрокситетрагидро-3-фуранил]мочевина;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-N2-(1-пропил-2,3-дигидро-1Н-индол-5-ил)этандиамид;
(2R)-N-[(1S)-1-(1,3-диоксолан-2-ил)-2-фенилэтил]-6-гидрокси-2,5,7,8-тетраметил-З,4-дигидро-2Н-хромен-2-карбоксамид;
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-5-индолинкарбоксамид.
(3S)-3-({(2S)-4-метил-2-[(10H-фенотиазин-2-илкарбонил)амино]-пентаноил}амино)тетрагидро-2-фуранилацетат;
(2R,3S)-3-({(2S)-4-метил-2-[(10H-фенотиазин-2-илкарбонил)амино]-пентаноил}амино)тетрагидро-2-фуранилацетат;
(2S,3S)-3-({(2S)-4-метил-2-[(10H-фенотиазин-2-илкарбонил)амино]-пентаноил}амино)тетрагидро-2-фуранилацетат;
(2S)-2-({[(1-бензил-2,3-дигидро-1H-индол-5-ил)амино]карбонил}амино)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]-4-метилпентанамид.
N-1-(4-анилинофенил)-N-4-[(3S)-2-оксотетрагидро-3-фуранил] сукцинамид;
метил-(2S)-2-{[4-(4-анилиноанилино)-4-оксобутаноил]амино}-4-метилпентаноат;
N-1-(4-анилинофенил)-N-4-[(1S)-1-формил-3-метилбутил] сукцинамид;
бензил-3-(4-анилиноанилино)-3-оксо-2-фенилпропаноат;
3-(4-анилиноанилино)-3-оксо-2-фенилпропановая кислота;
N-1-(4-анилинофенил)-N-3-[(3S)-2-оксотетрагидро-3-фуранил]-2-фенилмалонамид;
3-(4-анилиноанилино)дигидро-2(3Н)-фуранон;
метил-(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино] пентаноат;
(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентановая кислота;
N-[(1S)-3-метил-1-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)бутил]-10Н-фенотиазин-2-карбоксамид;
этил-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксилат;
2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоновая кислота;
N-[(3S)-2-оксотетрагидро-3-фуранил]-2-(10Н-фенотиазин-2-ил)-1,3-тиазол-4-карбоксамид;
4-[(10Н-фенотиазин-2-илкарбонил) амино] бензойная кислота;
N-[4-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)фенил]-10Н-фенотиазин-2-карбоксамид;
метил-(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино] пентаноат;
(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино] пентановая кислота;
N-[(1S)-1-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)-3-метилбутил]-10Н-фенотиазин-2-карбоксамид;
N-[(1S)-1-(1,4-диокса-7-азаспиро[4.4]нон-7-илкарбонил)-3-метилбутил]-10Н-фенотиазин-2-карбоксамид;
2-(3,5-дитретбутил-4-гидроксифенокси)-N-[(3S)-2-оксотетрагидро-3-фуранил] ацетамид;
5-нитро-1-пропилиндолин;
1-пропил-2,3-дигидро-1Н-индол-5-иламин;
3-оксо-2-фенил-N-(1-пропил-2,3-дигидро-1H-индол-5-ил)-β-аланин;
N1-[(3S)-2-оксотетрагидро-3-фуранил]-2-фенил-N3-(1-пропил-2,3-дигидро-1Н-индол-5-ил)малонамид;
N-(2-анилинофенил)-N'-[(3S)-2-оксотетрагидро-3-фуранил] мочевина;
трет-бутил-5-метил-1,5-индолиндикарбоксилат;
1-(трет-бутоксикарбонил)-5-индолинкарбоновая кислота;
трет-бутил-5-({[(3S)-2-оксотетрагидро-3-фуранил]амино}карбонил)-1-индолинкарбоксилат;
трет-бутил-5-({[(3S)-2-гидрокситетрагидро-3-фуранил]амино}карбонил)-1-индолинкарбоксилат, в качестве промышленных продуктов.
Разноска приоритетов по пунктам уточненной формулы:
Приоритет 05.11.1999 п.1, кроме признаков: для соединений, когда R1 означает атом водорода, R3 означает гетероциклоалкилкарбонил, Х означает «-N (R45) -CO-NH-C (R46R47) -СО-», «-Z-CO-», «Z означает тиазол»; п.2 кроме признака, когда Het означает « диоксолан», пп.3,4,6-18.
Приоритет 23.05.2000 признак: Х означает «Z-CO-», «Z означает тиазол», п.5, кроме признаков «(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилпивалат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-3,3-диметилбутаноат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилбензоат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилфенилацетат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-(2S)-2-(диметиламино)-3-фенилпропаноат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-4-морфолинкарбоксилат;
N-{(1S)-3-метил-1-[(3-оксо-1-пирролидинил)карбонил]бутил}-10Н-фенотиазин-2-карбоксамид;
2-(3,5-дитретбутил-4-гидроксифенокси)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]ацетамид;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенил-N3-(1-пропил-2,3-дигидро-1Н-индол-5-ил)малонамид;
N-(2-анилинофенил)-N'-[(3S)-2-гидрокситетрагидро-З-фуранил]мочевина;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-N2-(1-пропил-2,3-дигидро-1Н-индол-5-ил)этандиамид;
(2R)-N-[(1S)-1-(1,3-диоксолан-2-ил)-2-фенилэтил]-6-гидрокси-2,5,7,8-тетраметил-З,4-дигидро-2Н-хромен-2-карбоксамид;
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-5-индолинкарбоксамид».
Приоритет установлен по дате поступления заявки по признакам: для соединений, когда R1 означает атом водорода, R3 означает гетероциклоалкилкарбонил, Х означает «-N (R45) -CO-NH-C (R46R47) -СО-», за исключением соединений, когда R3 «моноциклический насыщенный 6-ти членный гетероциклоалкилкарбонильный радикал, в котором гетероциклоалкил содержит 2 гетероатома, выбранные из азота или кислорода, алкилкарбонил, фенилкарбонил или фенилалкилкарбонил»; «(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилпивалат; (3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-3,3-диметилбутаноат; (3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилбензоат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранилфенилацетат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-(2S)-2-(диметиламино)-3-фенилпропаноат;
(3S)-3-({(2S)-4-метил-2-[(10Н-фенотиазин-2-илкарбонил)амино]пентаноил}амино)тетрагидро-2-фуранил-4-морфолинкарбоксилат;
N-{(1S)-3-метил-1-[(3-оксо-1-пирролидинил)карбонил]бутил}-10Н-фенотиазин-2-карбоксамид;
2-(3,5-дитретбутил-4-гидроксифенокси)-N-[(3S)-2-гидрокситетрагидро-3-фуранил]ацетамид;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-2-фенил-N3-(1-пропил-2,3-дигидро-1Н-индол-5-ил)малонамид;
N-(2-анилинофенил)-N'-[(3S)-2-гидрокситетрагидро-3-фуранил]мочевина;
N1-[(3S)-2-гидрокситетрагидро-3-фуранил]-N2-(1-пропил-2,3-дигидро-1Н-индол-5-ил)этандиамид;
(2R)-N-[(1S)-1-(1,3-диоксолан-2-ил)-2-фенилэтил]-6-гидрокси-2,5,7,8-тетраметил-З,4-дигидро-2Н-хромен-2-карбоксамид;
N-[(3S)-2-гидрокситетрагидро-3-фуранил]-5-индолинкарбоксамид».
| RU 96121907 A, 27.01.1999.EP 641800 A1, 08.03.1995.EP 925786 A1, 30.07.1999. |
Авторы
Даты
2005-09-10—Публикация
2000-11-03—Подача