Предметом настоящего изобретения являются новые производные амидинов, которые обладают ингибирующей активностью в отношении ферментов NO-синтаз, продуцирующих монооксид азота NO, и/или активностью, которая относится к улавливанию активной формы кислорода (АФК). Данное изобретение относится, в частности, к производным, соответствующим общей формуле (I), определенной ниже, способам их получения, фармацевтическим препаратам, содержащим их, и их использованию для терапевтических целей, в особенности, их использованию в качестве ингибиторов NO-синтазы и селективных или неселективных ловушек для реакционноспособных форм кислорода.
При условии потенциальной роли NO и АФК в физиопатологии описанные новые производные, соответствующие общей формуле (I), могут индуцировать полезные или благоприятные эффекты при лечении патологий, в которых принимают участие данные химические виды. В частности, в:
- Пролиферативных и воспалительных заболеваниях, таких как, например, атеросклероз, легочная гипертензия, респираторный дистресс-синдром, гломерулонефрит, портальная гипертензия, псориаз, артроз и ревматоидный артрит, фиброзы, развитие кровеносных сосудов, амилоидозы, воспаления желудочно-кишечной системы (неспецифический язвенный или неязвенный колит, болезнь Крона), диарея.
- Заболеваниях, поражающих легочную систему или дыхательные пути (астма, синусит, ринит).
- Сердечно-сосудистых и церебро-васкулярных нарушениях, включающих, например, мигрень, артериальную гипертензию, септический шок, ишемические или геморрагические сердечные или церебральные инфаркты, ишемию и тромбозы.
- Нарушениях центральной или периферической нервной системы, таких как, например, нейродегенеративные заболевания, где можно, в особенности, упомянуть церебральные инфаркты, субарахноидальное кровоизлияние, старение, сенильную деменцию, включая болезнь Альцгеймера, хорею Хантингтона, болезнь Паркинсона, болезнь Крейтцфельда-Якоба и заболевания, вызванные преонами, боковой амиотрофический склероз; глазные невропатии, такие как глаукома, но также боль, церебральные травмы и травмы костного мозга, аддикцию к опиатам, хронический алкоголизм и аддикцию к аддиктивным веществам, расстройство познавательной способности, энцефалопатии и энцефалопатии вирусного или токсичного происхождения.
- Нарушениях скелетных мышц и нервно-мышечных суставов (миопатия, миоз), а также кожных заболеваниях.
- Катарактах.
- Органах-трансплантатах.
- Аутоиммунных и вирусных заболеваниях, таких как, например, волчанка, СПИД, инфекции, вызванные паразитами и вирусами, диабеты и рассеянный склероз.
- Раковом заболевании.
- Неврологических заболеваниях, ассоциированных с интоксикацией (отравление кадмием, вдыхание н-гексана, пестицидов, гербицидов), ассоциированных с лечениями (радиотерапия) или нарушениями генетического происхождения (болезнь Вильсона).
- Всех патологиях, характеризующихся избыточным продуцированием или дисфункцией NO и/или АФК.
Во всех указанных патологиях имеется экспериментальное доказательство, демонстрирующее вовлечение в патологический процесс NO или АФК (J. Med. Chem. (1995) 38, 4343-4362; Free Radic. Biol. Med. (1966) 20, 675-705; The Neuroscientist (1977) 3, 327-333).
Более того, в более ранних патентах авторы данного изобретения уже описали ингибиторы NO-синтазы и их использование (патент США 5081148; патент США 5360925) и совсем недавно описали сочетание этих ингибиторов с продуктами, обладающими антиоксидантными или антирадикальными свойствами (заявка на патент РСТ WO 98/09653). В заявках, еще не опубликованных, они описали также другие производные амидинов или, совсем недавно, производные аминопиридинов. Эти производные амидинов или аминопиридинов имеют характерную особенность, заключающуюся в том, что они являются как ингибиторами NO-синтаз, так и ингибиторами АФК.
Предметом заявки WO 95/05363 являются соединения, которые являются ингибиторами NO-синтаз, общей формулы (А1)
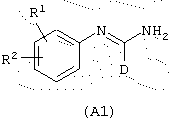
в которой
D представляет фенил, пиридинил или ароматический гетероцикл с 5 членами, содержащий от 1 до 4 гетероатомов, выбранных из О, Ни S, причем эти три группы, необязательно, замещены одной или несколькими группами, выбранными из (C1-C6)алкила, (C1-C6)алкокси, галогена, (C1-C6)перфторалкила, или D представляет (C1-C6)перфторалкил;
R1 представляет водород, (C1-C6)алкил или галоген;
R2 представляет -X(СН2)nZCONR3R4; -X(СН2)nNHCO(CH2)sNR3R4, -X(CH2)pNR3R4, -X(CH2)nNHCOR5 или (CH2)qNHC(NH)R6, R3 и R4 представляют, независимо, водород, (C1-C6)алкил, -(СН2)rА, -(СН2)mОА или -СН(СН3)(CH2)tA;
или группа NR3R4 представляет 1-инданил, пиперониламино, пиперидинил, морфолинил, пирролидинил, 1,2,3,4-тетрагидроизохинолинил или пиперазинил, необязательно замещенный в положении 4 (C1-C6)алкилом;
R5 представляет (C1-C6)алкил, (C1-C6)перфторалкил, -(СН2)rА или -O(CH2)wA;
А представляет фенил, пиридинил, пиримидинил или ароматический гетероцикл с 5 членами, содержащий от 1 до 4 гетероатомов, выбранных из О, N и S, причем эти 4 группы, необязательно, замещены одной или несколькими группами, выбранными из (C1-C6)алкила, галогена, нитро, циано и трифторметила;
R6 представляет фенил, пиридинил или ароматический гетероцикл с 5 членами, содержащий от 1 до 4 гетероатомов, выбранных из О, N и S, причем эти три группы, необязательно, замещены одной или несколькими группами, выбранными из (C1-C6)алкила, (C1-C6)алкокси, галогена, (C1-C6)перфторалкила, или R6 представляет (C1-C6)перфторалкил;
n и r независимо равны целым числам от 0 до 6;
p и w независимо равны целым числам от 1 до 5;
m равно целому числу от 2 до 5;
q и t, независимо, равны целым числам от 0 до 5;
s равно целому числу от 1 до 3;
Х представляет О или связь;
Z представляет О, NR7 или связь;
R7 представляет водород или (C1-C6)алкил;
причем предполагается, что:
(a) D, когда он содержит гетероатом, не связан с остальной частью соединения формулы (А1) посредством гетероатома;
(b) когда R2 представляет -X(CH2)nZCONR3R4 и ни X, ни Z не представляют связь, тогда n равно целому числу от 2 до 6;
(c) когда R2 представляет -X(CH2)nNHCO(CH2)sNR3R4 или -X(СН2)nNHCOR5 и X представляет О, тогда n равно целому числу от 2 до 6;
(d) когда R2 представляет -X(СН2)pNR3R4 и Х представляет О, тогда p равно целому числу от 2 до 5;
(e) когда R2 представляет -(СН2)qNHC(NH)R6, R1 представляет водород, D представляет фенил и R6 представляет фенил, тогда q не равно 0;
(f) когда R2 представляет -(CH2)qNHC(NH)R6, R1 представляет водород, D и R6 представляют 2-хлорфенил, тогда q не равно 0;
(g) когда R2 представляет (CH2)qNHC(NH)R6, R1 представляет водород, D и R6 представляют 3-пиридинил, тогда q не равно 0; и
(h) когда R2 представляет -(СН2)qNHC(NH)R6, R1 представляет водород, D и R6 представляют 4-пиридинил, тогда q не равно 0.
Предметом заявки на патент РСТ WO 98/42696 являются соединения, которые являются ингибиторами NO-синтаз и ловушками для АФК, общей формулы (А2)
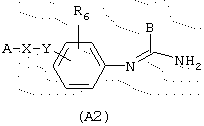
в которой А представляет один из радикалов формул
в которых R1 и R2 представляют, независимо, атом водорода, галоген, ОН-группу, неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R3 представляет атом водорода, неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -COR4,
R4 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, и R5 представляет атом водорода, ОН-группу или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
В представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, карбоциклический или гетероциклический арил с 5 или 6 членами, содержащий от 1 до 4 гетероатомов, выбранных из О, S, N, особенно радикалы тиофена, фурана, пиррола или тиазола, причем арильный радикал, необязательно, замещен одной или несколькими группами, выбранными из неразветвленных или разветвленных алкильных, алкенильных или алкоксирадикалов, имеющих от 1 до 6 атомов углерода,
Х представляет –Z1, -Z1-CO-, -CH=CH-CO-, -Z1-NR3CO-, -Z1-NR3-CS-, -Z1NR3-SO2- или одинарную связь;
Y представляет радикал, выбранный из радикалов –Z2-Q, пиперазина, гомопиперазина, 2-метилпиперазина, 2,5-диметилпиперазина, 4-аминопиперидина, -NR3-Z2-Q-, -NR3-CO-Z2-Q-, -NR3-NH-CO-Z2-, -NH-NH-Z2-, -NR3-O-Z2-, -NR3-SО2-NR3-Z2-, -Q-Z2-Q-, -O-CO-Z2-Q- или -S-Z2-Q-, в которых Q представляет одинарную связь, -О-Z3, -R3N-Z3 или -S-Z3,
Z1, Z2 и Z3 представляют, независимо, одинарную связь или неразветвленный или разветвленный алкиленовый радикал, имеющий от 1 до 6 атомов углерода,
и R6 представляет атом водорода или ОН-группу.
Предметом настоящего изобретения являются новые производные амидинов, их получение и их терапевтическое использование.
Соединения данного изобретения соответствуют общей формуле (I), характеризующейся тем, что она включает соединения общей формулы (I’):
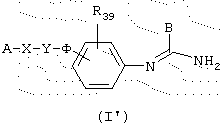
в которой А представляет либо радикал
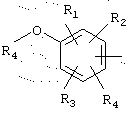
в котором R1, R2 и R3 представляют, независимо, галоген, группу ОН или SR6 или неразветвленный или разветвленный алкильный, алкенильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода, или радикал NR7R8,
R4 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R5 представляет атом водорода, группу ОН или SR6 или неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода,
R6 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R7 и R8 представляют, независимо, атом водорода, ОН-группу, неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -CO-R9, в котором R9 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
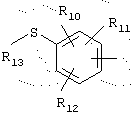
в котором R10, R11 и R12 представляют, независимо, атом водорода, группу ОН или SR14, галоген или неразветвленный или разветвленный алкильный, алкенильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода, или радикал NR15R16,
R13 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R14 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R15 и R16 представляют, независимо, атом водорода, ОН-группу, неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -CO-R17, в котором R17 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
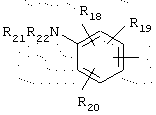
в котором R18, R19 и R20 представляют, независимо, атом водорода, галоген, группу ОН или SR23 или неразветвленный или разветвленный алкильный, алкенильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода, или радикал NR24R25,
R21 и R22 представляют, независимо, атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
или R21 и R22 вместе с атомом азота образуют, необязательно, замещенный гетероцикл, имеющий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже присутствующий атом азота, причем дополнительные гетероатомы независимо выбраны из группы, составленной атомами О, N и S, или, кроме того, R21 представляет алкилсульфонильный, алкилсульфоксидный или алкилкарбонильный радикал, и тогда R22 представляет Н,
R23 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R24 и R25 представляют, независимо, атом водорода, ОН-группу, неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -CO-R26, в котором R26 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
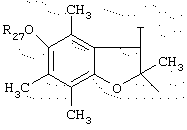
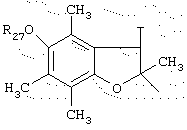
в котором Т представляет радикал -(СН2)k-, k равно 1 или 2 и R27 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
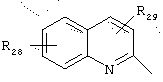
в котором R28 и R29 представляют, независимо, атом водорода или ОН-группу,
либо радикал
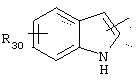
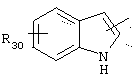
в котором R30 представляет атом водорода, ОН-группу или неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода,
либо радикал
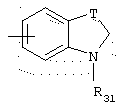
в котором Т представляет радикал -(CH2)k-, k равно 1 или 2 и R31 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или арилалкильный, диарилалкильный, бис-арилалкильный, аминоалкильный, алкиламиноалкильный или диалкиламиноалкильный радикал или R31 представляет также (гетероцикло)алкильный радикал, в котором гетероцикл насыщен или ненасыщен, имеет от 3 до 7 членов и включает, по меньшей мере, один атом азота, причем указанный атом азота, необязательно, замещен атомом водорода или алкильным радикалом, или радикал
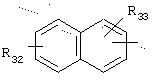
в котором R32 и R33 представляют, независимо, атом водорода или ОН-группу,
либо, наконец, один из радикалов
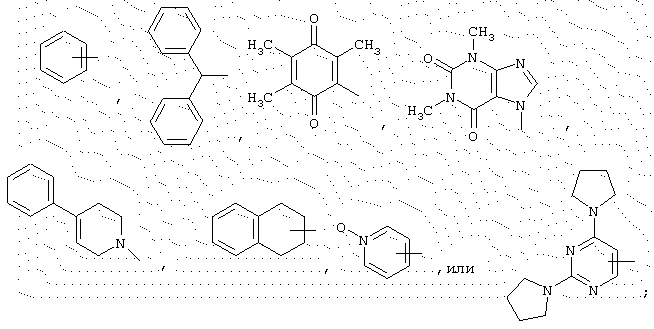
В представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, карбоциклический или гетероциклический арил с 5 или 6 членами, содержащий от 1 до 4 гетероатомов, выбранных из О, S, N, и, особенно, радикалы тиофена, фурана, пиррола или тиазола, причем арильный радикал, необязательно, замещен одной или несколькими группами, выбранными из неразветвленных или разветвленных алкильных, алкенильных и алкоксирадикалов, имеющих от 1 до 6 атомов углерода, или В представляет также радикал NR34R35, в котором R34 и R35 представляют, независимо, атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или R34 и R35 вместе с атомом азота образуют неароматический гетероцикл с пятью или шестью членами, причем элементы цепи выбраны из группы, включающей -СН2-, -NH-, -О- или -S-;
Х представляет связь или радикал -(CH2)m-, (CH2)m-CO-, -O-(СН2)m-, -S-(СН2)m-, -NR36-(СН2)m-, -СО-NR36-, -О(CH2)m-CO-, -S-(CH2)m-CO-, -NR36-(СН2)m-СО-, -(СН2)m-С(ОН)(СН3)-СО-, -СН=СН- или -CH=N-,
Y представляет связь или радикал -(СН2)n- или (СН2)r-Q-(CH2)s-,
Q представляет пиперазиновый, гомопиперазиновый, 2-метилпи-перазиновый, 2,5-диметилпиперазиновый, пиперидиновый, 1,2,3,6-тетрагидропиридиновый, пирролидиновый, азетидиновый или тиазолидиновый радикал или насыщенное углеродное кольцо, имеющее от 3 до 7 членов;
Ф представляет связь или радикал -(CH2)p-O-(CH2)q-, -(CH2)p-S-(CH2)q-, -(CH2)p-NR37-(CH2)q-, (CH2)р-СО-NR37(CH2)q- или -СО-(CH2)p-NR37-(CH2)q-;
R36 и R37 представляют, независимо, атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -СО-R38, в котором R38 представляет неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R39 представляет атом водорода или неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
причем m, n, р, q, r и s равны целым числам от 0 до 6;
причем предполагается, что:
- если А представляет радикал
тогда Y представляет пиперидиновый радикал;
- если А представляет радикал
тогда Y представляет радикал -(СН2)r-Q-(CH2)s-, в котором Q представляет насыщенное углеродное кольцо, имеющее от 3 до 7 членов, причем указанная общая формула (I) включает также следующие соединения:
- 2-гидрокси-5-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
- 2,5-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
- 2-гидрокси-3-изопропил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
- 2,6-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
- 2-гидрокси-4,6-диметокси-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
- 2-гидрокси-3,5-ди-трет-бутил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
- 2-гидрокси-3,5-диизопропил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
- 2-гидрокси-4-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
- 2-гидрокси-3-изопропил-5-метокси-N-{2-[4-[(2-тиенил(имино)-метил)амино]фенил]этил}бензамид;
- N-(2-гидрокси-3-трет-бутил-5-метокси)-4-{[2-тиенил(имино)-метил]амино}бензолбутанамид;
- 3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{2-[4-[(2-тиенил (имино)метил)амино]фенил]этил}-2Н-1-бензопиран-2-карбоксамид;
- 3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{1-[4-[(2-тиенил(имино)метил)амино]фенил]метил}-2Н-1-бензопиран-2-карбоксамид;
- N-(4-гидроксифенил)-2-тиофенкарбоксимидамид;
- N-(2-гидроксифенил)-2-тиофенкарбоксимидамид;
- N-(3-гидроксифенил)-2-тиофенкарбоксимидамид;
- N-(3-гидрокси-4-метоксифенил)-2-тиофенкарбоксимидамид;
- N-(3-гидрокси-4-метилфенил) -2-тиофенкарбоксимидамид;
- N-(4-метоксифенил)-2-тиофенкарбоксимидамид;
- N-(3,5-диметил-4-гидроксифенил)-2-тиофенкарбоксимидамид;
- N-(3,5-дихлор-4-гидроксифенил)-2-тиофенкарбоксимидамид;
- N-(2,6-бис-(1,1-диметилэтил)-4-гидроксифенил)-2-тиофенкар- боксимидамид;
- N-{4-[4-[(3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-2Н-1-бензопиран-2-ил)метил]-1-пиперазинил]фенил}-2-тиофенкарбоксимидамид;
- 1-(2-гидрокси-4,6-диметоксибензоил)-3-{4-[(имино(2-тиенил)-метил)амино]фенокси}азетидин;
- N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}-бензолбутанамид;
- N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}-бензолпропанамид;
- N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-гидрокси-5-метокси-3-метилбензамид;
- (Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(2-гидроксифенил)-2-пропенамид;
- (E)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидроксифенил)-2-пропенамид;
- (Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(3,4-дигидроксифенил)-2-пропенамид;
- (E)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)-4-гидроксифенил]пропанамид;
- N’-(4-{2-[(2-гидрокси-4,6-диметоксибензил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
или также соли продуктов общей формулы (I).
Под термином алкил, когда он не указывается более точно, подразумевается неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода. Под термином циклоалкил, если он не указывается более точно, подразумевается углеродная моноциклическая система, имеющая от 3 до 7 атомов углерода. Под термином алкенил, если он не указывается более точно, подразумевается неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода и содержащий, по меньшей мере, одну ненасыщенную связь (двойная связь). Под термином алкинил, если он не указывается более точно, подразумевается неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода и содержащий, по меньшей мере, одну двойную ненасыщенную связь (тройная связь). Под термином карбоциклический или гетероциклический арил подразумевается карбоциклическая или гетероциклическая система, включающая, по меньшей мере, одно ароматическое кольцо, причем система является указанной гетероциклической, когда, по меньшей мере, один из циклов, который составляет ее, включает гетероатом (О, N или S). Под термином гетероцикл подразумевается моно- или полициклическая система, причем указанная система включает, по меньшей мере, один гетероатом, выбранный из О, N и S, и является насыщенной, частично или полностью насыщенной или ароматической. Под термином галогеналкил подразумевается алкильный радикал, по меньшей мере, один из атомов водорода (и, необязательно, все из них) которой заменен на атом галогена.
Под терминами алкилтио, алкокси, галогеналкильный, галогеналкокси, алкенильный, алкинильный и аралкильный радикалы подразумеваются, соответственно, алкилтио, алкокси, галогеналкил, галогеналкокси, аминоалкил, алкенил, алкинил, аралкил и (гетероцикло)алкил, алкильный радикал которых имеет указанные ранее значения.
Под термином гетероцикл подразумеваются, особенно, тиофеновый, пиперидиновый, пиперазиновый, хинолиновый, индолиновый и индольный радикалы. Под термином разветвленный или неразветвленный алкил, имеющий от 1 до 6 атомов углерода, подразумевается, особенно, метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, втор-бутильный и трет-бутильный, пентильный, неопентильный, изопентильный, гексильный, изогексильный радикалы. Наконец, под термином галоген подразумеваются атомы фтора, хлора, бром и иода.
Предпочтительными соединениями общей формулы (I’) являются соединения, у которых:
А представляет либо радикал
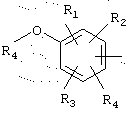
в которой R1, R2 и R3 представляют, независимо, группу ОН или SR6 или неразветвленный, или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода,
R4 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R5 представляет атом водорода, группу ОН или SR6 или неразветвленный, или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода,
R6 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
либо радикал
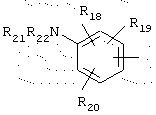
в котором R18, R19 и R20 представляют, независимо, атом водорода, группу ОН, неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода,
R21 и R22 представляют, независимо, атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
или R21 и R22 вместе с атомом азота образуют, необязательно, замещенный гетероцикл, имеющий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже присутствующий атом азота, причем дополнительные гетероатомы независимо выбраны из группы, составленной атомами О, N и S, или R21 представляет также алкилсульфонильный или алкилкарбонильный радикал и тогда R22 представляет Н,
либо радикал
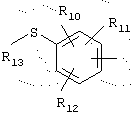
в которой R10, R11 и R12 представляют, независимо, атом водорода, группу ОН или SR14, галоген или неразветвленный, или разветвленный алкильный, алкенильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода,
R13 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R14 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
либо радикал
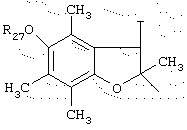
в котором Т представляет радикал -(CH2)k-, k равно 1 или 2 и R27 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
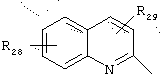
в котором R28 и R29 представляют, независимо, атом водорода или ОН-группу,
либо радикал
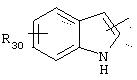
в котором R30 представляет атом водорода, ОН-группу или неразветвленный, или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
либо радикал
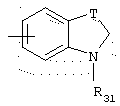
в котором Т представляет радикал -(СН2)k-, k равно 1 или 2 и R31 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или арилалкильный, диарилалкильный, бис-арилалкильный, аминоалкильный, алкиламиноалкильный или диалкиламиноалкильный радикал или R31 дополнительно представляет (гетероцикло)алкильный радикал, в котором гетероцикл насыщен или ненасыщен, имеет от 3 до 7 членов и включает, по меньшей мере, один атом азота, причем указанный атом азота, необязательно, замещен атомом водорода или алкильным радикалом, либо радикал
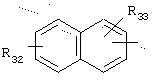
в котором R32 и R33 представляют, независимо, атом водорода или ОН-группу,
либо, наконец, один из радикалов
В представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, карбоциклический или гетероциклический арил с 5 или 6 членами, содержащий от 1 до 4 гетероатомов, выбранных из О, S, N, и, особенно радикалы тиофена, фурана, пиррола или тиазола, причем арильный радикал, необязательно, замещен одной или несколькими группами, выбранными из неразветвленных или разветвленных алкильных, алкенильных и алкоксирадикалов, имеющих от 1 до 6 атомов углерода,
Х представляет связь или радикал -(СН2)m-, -(СН2)m-СО, -O-(СН2)m-, -S-(CH2)m-, -NR36-(СН2)m-, -СО-NR36-, -О(СН2)m-СО-, -S-(CH2)m-CO-, -NR36-(СН2)m-СО- или (СН2)m-С(ОН)(СН3)-СО-, Y представляет связь или радикал -(СН2)n- или -(CH2)r-Q-(CH2)s-,
Q представляет пиперазиновый, пиперидиновый, 1,2,3,6-тетра-гидропиридиновый, азетидиновый или тиазолидиновый радикал или насыщенное углеродное кольцо, имеющее от 3 до 7 членов;
Ф представляет связь или радикал (СН2)р-O-(CH2)q-,
R36 и R37 представляют, независимо, атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -СО-R38, в котором R38 представляет неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R39 представляет атом водорода или неразветвленный, или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
причем m, n, p, q, r и s равны целым числам от 0 до 6.
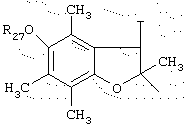
Среди радикалов А, которые могут быть использованы в изобретении, предпочтительны радикалы типа
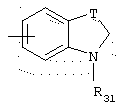
в котором R31 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, аминоалкильный, алкиламиноалкильный, диалкиламиноалкильный, арилалкильный, диарилалкильный или бис-арилалкильный радикал, и, особенно те, у которых R31 представляет метильный, бензильный или нафтилметильный радикал.
Соединения по данному изобретению, предпочтительно, представляют собой одно из следующих соединений:
- 2-гидрокси-5-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
- 2-гидрокси-5-метилтио-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
- 2,5-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
- 2-гидрокси-3-изопропил-N-{2-[4-[(2-тиенил(имино)метил)- амино]фенил]этил}бензамид;
- 2,6-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
- 2-гидрокси-4,6-диметокси-N-{2-[4-[(2-тиенил (имино) метил)-амино]фенил]этил}бензамид;
- 2-гидрокси-4,5,6-триметокси-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
- 2-гидрокси-3,5-ди-трет-бутил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
- 2-гидрокси-3,5-диизопропил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
- 2,4-дигидрокси-3,6-диметил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
- 2,7-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}-нафталинкарбоксамид;
- 2-гидрокси-4-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
- 2-гидрокси-3-изопропил-5-метокси-N-{2-[4-[(2-тиенил(имино)-метил)амино]фенил]этил}бензамид;
- N-(2-гидрокси-3-трет-бутил-5-метокси)-4-{[2-тиенил(имино)-метил]амино}бензолбутанамид;
- 3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{2-[4-[(2-тиенил (имино)метил)амино]фенил]этил}-2Н-1-бензопиран-2-карбоксамид;
- 3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{1-[4-[(2-тиенил (имино)метил)амино]фенил]метил}-2Н-1-бензопиран-2-карбоксамид;
- N-(4-гидроксифенил)-2-тиофенкарбоксимидамид;
- N-(2-гидроксифенил)-2-тиофенкарбоксимидамид;
- N-(3-гидроксифенил)-2-тиофенкарбоксимидамид;
- N-(3-гидрокси-4-метоксифенил)-2-тиофенкарбоксимидамид;
- N-(4-метоксифенил)-2-тиофенкарбоксимидамид;
- N-(3,5-диметил-4-гидроксифенил)-2-тиофенкарбоксимидамид;
- N-(3,5-дихлор-4-гидроксифенил)-2-тиофенкарбоксимидамид;
- N-(3,5-бис-(1,1-диметилэтил)-4-гидроксифенил)-2-тиофенкар-боксимидамид;
- N-{4-[4-{(3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-2Н-1-бензопиран-2-ил)метил]-1-пиперазинил]фенил}-2-тиофенкарбоксимидамид;
- 1-(2-гидрокси-4,6-диметоксибензоил)-3-{4-{(имино(2-тиенил)-метил)амино]фенокси}азетидин;
- N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}-бензолбутанамид;
- N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}-бензолпропанамид;
- трет-бутил-2-{[(4-{[амино(2-тиенил)метилиден]амино}фенетил)-амино]карбонил}-4-метоксифенилкарбамат;
- 2-амино-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил-5-метоксибензамид;
- 5-амино-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-гидроксибензамид;
- N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-гидрокси-5-метокси-3-метилбензамид;
- N-[2-(4-{[амино(2-тиенил)метилиден]амино}анилино)-2-оксо-этил]-3,5-ди(трет-бутил)-4-гидроксибензамид;
- N-{4-[4-(1,2,3,4-тетрагидро-2-нафталинилкарбонил)-1-пиперазинил] фенил}-2-тиофенкарбоксимидамид;
- 4-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-{4-[(метил-сульфонил)амино]фенил}бутанамид;
- 4-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино)фенил]бутанамид;
- 5-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино)фенил]пентанамид;
- (E)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(2-гидроксифенил)-2-пропенамид;
- (E)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидроксифенил)-2-пропенамид;
- (Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(3,4-дигидроксифенил)-2-пропенамид;
- (E)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенамид;
- (4R)-2-(3-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино)фенил]-1,З-тиазолидин-4-карбоксамид;
- N’-[4-(4-{2-[3,5-ди(трет-бутил)-4-гидроксифенокси]ацетил}-1-пиперазинил)фенил]-2-тиофенкарбоксимидамид;
- N-{4-[4-(2-{[3,5-ди(трет-бутил)-4-гидроксифенил]тио}ацетил)-1-пиперазинил]фенил}-2-тиофенкарбоксимидамид;
- N’-(4-{4-[2-(4-гидрокси-2,3,5,6-тетраметилфенокси)ацетил]- пиперазинил}фенил)-2-тиофенкарбоксимидамид;
- N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-[3,5-ди-(трет-бутил)-4-гидроксифенокси]ацетамид;
- N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этил}-амино)этил]фенил}-2-тиофенкарбоксимидамид;
- трет-бутил-3-{[амино(2-тиенил)метилиден]амино}бензил-{3-[4-(диметиламино)анилино]-3-оксопропил}карбамат;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(диметиламино)фенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)4-гидроксифенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(4-метил-1-пиперазинил)фенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(4-морфолинил)фенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-метил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-бензил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамид;
- N’-[4-(2-{[5-(диметиламино)-2-гидроксибензил]амино}этил)-фенил]-2-тиофенкарбоксимидамид;
- N-(4-{[(4-{[амино(2-тиенил)метилиден]амино}фенетил)амино]-метил}фенил)ацетамид;
- N’-[4-(2-{[(8-гидрокси-2-хинолинил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[3-фенил-2-пропенил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[3-(4-гидрокси-3-метоксифенил)-2-пропенил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил]-амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[5-(диметиламино)-2-гидрокси-3-метоксибензил]-амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-(4-{2-[(2-гидрокси-4,6-диметоксибензил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-(4-{2-[[(Е)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил](метил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
- 4-{[(4-{[амино(2-тиенил)метилиден]амино}фенетил)амино]метил}-1-пиридинийолат;
- N’-[4-(2-{[(2-гидрокси-4,6-диметоксифенил)метилиден]амино}-этил)фенил]-2-тиофенкарбоксимидамид;
- трет-бутил-4-{[амино(2-тиенил)метилиден]амино}фенетил-(2-гидрокси-4,6-диметоксибензил)карбамат;
- N’-{4-[4-фенил-3,6-дигидро-1(2Н)-пиридинил]фенил}-2-тиофенкарбоксимидамид;
- N’-(4-{2-[4-фенил-3,6-дигидро-1(2Н)-пиридинил]этил}фенил)-2-тиофенкарбоксимидамид;
- N’-{4-{(1-бензгидрил-3-азетидинил)окси]фенил}-2-тиофенкарбоксимидамид;
- N’-[4-(2-хинолинилметокси)фенил]-2-тиофенкарбоксимидамид;
- N’-(4-{4-[2-гидрокси-2-метил-4-(2,4,5-триметил-3,6-диоксо-1,4-циклогексадиен-1-ил)бутаноил]-1-пиперазинил}фенил)-2-тиофенкарбоксимидамид;
- N-{4-[2-(1,3-диметил-2,6-диоксо-1,2,3,6-тетрагидро-7Н-пурин-7-ил)этил]фенил}-2-тиофенкарбоксимидамид;
- N’-(4-{4-[2,6-ди-(1-пирролидинил)-4-пиримидинил]-1-пиперазинил}фенил)2-тиофенкарбоксимидамид;
- N’-{4-[2-({[4-(диметиламино)анилино]карбонил}амино)этил]-фенил}-2-тиофенкарбоксимидамид;
- N-{[1-(4-{[амино(2-тиенил)метилиден]амино}фенил)циклобутил]метил}-6-гидрокси-2,5,7,8-тетраметил-2-хроманкарбоксамид;
- N’-{4-[4-(5-метокси-1Н-индол-3-ил)-1-пиперидинил]фенил}-2-тиофенкарбоксимидамид;
- N’-(4-{2-[[5-(диметиламино)-2-гидрокси-3-метоксибензил]-(метил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
- 4-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-{1-[3-(диметиламино)пропил]-2,3-дигидро-1Н-индол-5-ил}бутанамид;
- 3-[(5-{[амино(2-тиенил)метилиден]амино}-2-метоксибензил)-амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамид
или соль последнего соединения.
Более предпочтительными соединениями по данному изобретению являются одно из следующих соединений:
- 2-гидрокси-5-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино] фенил]этил}бензамид;
- 2,3-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил] этил}бензамид;
- 2-гидрокси-4,6-диметокси-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
- N-(2-гидрокси-3-трет-бутил-5-метокси)-4-{[2-тиенил(имино) метил]амино}бензолбутанамид;
- 3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}-2Н-1-бензопиран-2-карбоксамид;
- 3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{1-[4-[(2-тиенил(имино)метил)амино]фенил]метил}-2Н-1-бензопиран-2-карбоксамид;
- N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}-бензолпропанамид;
- 5-амино-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-гидроксибензамид;
- 5-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино)фенил]пентанамид;
- (E)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(2-гидроксифенил)-2-пропенамид;
- (E)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидроксифенил)-2-пропенамид;
- (Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(3,4-дигидроксифенил)-2-пропенамид;
- (E)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенамид;
- N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этил}-амино)этил]фенил}-2-тиофенкарбоксимидамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(диметиламино)фенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)-4-гидроксифенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(4-метил-1-пиперазинил)фенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(4-морфолинил)фенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-метил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-бензил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамид;
- N’-[4-(2-{[5-(диметиламино)-2-гидроксибензил]амино}этил)-фенил]-2-тиофенкарбоксимидамид;
- N-(4-{[(4-{[амино(2-тиенил)метилиден]амино}фенетил)амино]-метил}фенил)ацетамид;
- N’-[4-(2-([(8-гидрокси-2-хинолинил)метил]амино}этил)фенил}-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[3-фенил-2-пропенил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[3-(4-гидрокси-3-метоксифенил)-2-пропенил]амино}-этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил]-амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-(4-{2-[[(Е)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил] (метил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
- N’-(4-{2-[4-фенил-3,6-дигидро-1(2Н)-пиридинил]этил}фенил)-2-тиофенкарбоксимидамид;
- N’-{4-[2-({[4-(диметиламино)анилино]карбонил}амино)этил]-фенил}-2-тиофенкарбоксимидамид;
- N-{[1-(4-{[амино(2-тиенил)метилиден]амино}фенил)циклобутил]-метил}-6-гидрокси-2,5,7,8-тетраметил-2-хроманкарбоксамид;
или соли последнего.
Также более предпочтительными соединениями по данному изобретению являются одно из следующих соединений:
- 2-гидрокси-5-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
- 2,5-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
- N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}-бензолпропанамид;
- 5-амино-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил-2-гидроксибензамид;
- 5-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино) фенил]пентанамид;
- (E)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(2-гидроксифенил)-2-пропенамид;
- (Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(3,4-дигидроксифенил)-2-пропенамид;
- (Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенамид;
- N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этил}-амино)этил]фенил}-2-тиофенкарбоксимидамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(диметиламино)фенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)-4-гидроксифенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-метил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-бензил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамид;
- N’-[4-(2-{[5-(диметиламино)-2-гидроксибензил]амино}этил)-фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[(8-гидрокси-2-хинолинил)метил]амино}этил)фенил}-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[3-(4-гидрокси-3-метоксифенил)-2-пропенил]амино}-этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил]-амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-(4-(2-[[(Е)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил] (метил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
- N’-(4-{2-[4-фенил-3,6-дигидро-1(2Н)-пиридинил]этил}фенил)-2-тиофенкарбоксимидамид;
или соли последнего соединения.
Наконец, следующие соединения будут также более особенно предпочтительными:
- N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}-бензолпропанамид;
- N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этил}-амино)этил]фенил}-2-тиофенкарбоксимидамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(диметиламино)фенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)-4-гидроксифенил]пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-метил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-бензил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
- 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамид;
- N’-[4-(2-{[5-(диметиламино)-2-гидроксибензил]амино}этил)-фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[3-(4-гидрокси-3-метоксифенил)-2-пропенил]амино}-этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил]-амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
- N’-(4-{2-[[(Е)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил] (метил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
или соли последнего соединения.
В некоторых случаях соединения по настоящему-изобретению могут включать асимметричные атомы углерода. В результате этого соединения по настоящему изобретению имеют две возможные энантиомерные формы, то есть конфигурации “R” и “S”. Настоящее изобретение включает две энантиомерные формы и все сочетания этих форм, включая рацемические смеси “RS”. Чтобы упростить материал, когда в структурных формулах не указывается конкретная конфигурация, следует понимать, что представлены две энантиомерные формы и их смеси.
Данное изобретение, кроме того, предлагает в качестве новых промышленных продуктов соединения общей формулы (IS), которые являются пригодными промежуточными продуктами синтеза при получении продуктов общей формулы (I)
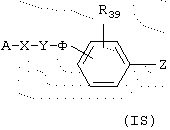
В формуле (IS) А представляет:
либо радикал
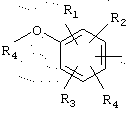
в котором R1, R2 и R3 представляют, независимо, галоген, группу ОН или SR6 или неразветвленный, или разветвленный алкильный, алкенильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода, или радикал NR7R8,
R4 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R5 представляет атом водорода, группу ОН или SR6 или неразветвленный, или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода,
R6 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R7 и R8 представляют, независимо, атом водорода, ОН-группу, неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -CO-R9, в котором R9 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
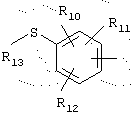
в которой R10, R11 и R12 представляют, независимо, атом водорода, группу ОН или SR14, галоген или неразветвленный, или разветвленный алкильный, алкенильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода, или радикал NR15R16,
R13 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R14 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R15 и R16 представляют, независимо, атом водорода, ОН-группу, неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -CO-R9, в котором R9 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
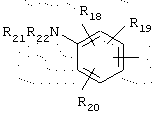
в котором R18, R19 и R20 представляют, независимо, атом водорода, галоген, группу ОН или SR23 или неразветвленный, или разветвленный алкильный, алкенильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода, или радикал NR24R25,
R21 и R22 представляют, независимо, атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
или R21 и R22 вместе с атомом азота образуют, необязательно, замещенный гетероцикл, имеющий от 4 до 7 членов и от 1 до 3 гетероатомов, включая уже присутствующий атом азота, причем дополнительные гетероатомы независимо выбирают из группы, составленной атомами О, N и S, или R21 представляет также алкилсульфонильный, алкилсульфоксидный или алкилкарбонильный радикал и R22 представляет Н,
R23 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
R24 и R25 представляют, независимо, атом водорода, ОН-группу, неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -CO-R26, в котором R26 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
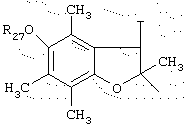
в котором Т представляет радикал -(CH2)k-, k равно 1 или 2 и R27 представляет атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода,
либо радикал
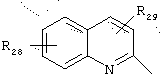
в котором R28 и R29 представляют, независимо, атом водорода или ОН-группу,
либо радикал
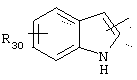
в котором R30 представляет атом водорода, ОН-группу или неразветвленный, или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
либо радикал
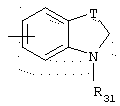
в котором Т представляет радикал -(CH2)k-, k равно 1 или 2 и R31 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или арилалкильный, диарилалкильный, бис-арилалкильный, аминоалкильный, алкиламиноалкильный или диалкиламиноалкильный радикал и R31 представляет также (гетероцикло)алкильный радикал, в котором гетероцикл насыщен или ненасыщен, имеет от 3 до 7 членов и включает, по меньшей мере, один атом азота, причем указанный атом азота, необязательно, замещен атомом водорода или алкильным радикалом,
и
либо радикал
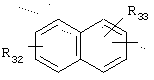
в котором R32 и R33 представляют, независимо, атом водорода или ОН-группу,
либо, наконец, один из радикалов
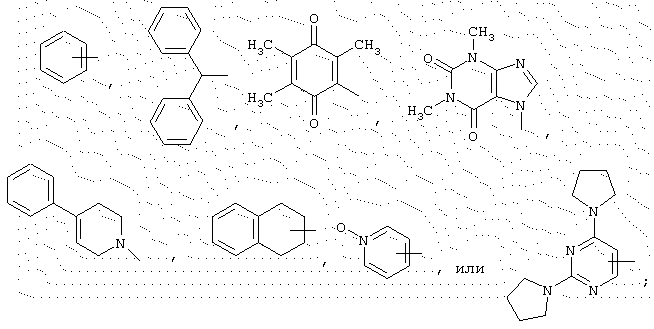
В представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, карбоциклический или гетероциклический арил с 5 или 6 членами, содержащий от 1 до 4 гетероатомов, выбранных из О, S, N, особенно радикалы тиофена, фурана, пиррола или тиазола, причем арильный радикал, необязательно, замещен одной или несколькими группами, выбранными из неразветвленных или разветвленных алкильных, алкенильных или алкоксирадикалов, имеющих от 1 до 6 атомов углерода, или В представляет также радикал NR13R14, в котором R13 и R14 представляют, независимо, атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или R13 и R14 вместе с атомом азота образуют неароматический гетероцикл с пятью или шестью членами, причем элементы цепи выбирают из группы, включающей
-СН2-, -NH-, -О- или -S-;
Х представляет связь или радикал -(CH2)m-, -O-(СН2)m, -S-(СН2)m-, -NR36-(CH2)m-, -СО-NR36-, -О-(CH2)m-СО-, -S-(CH2)m-СО-, -NR36-(СН2)m-СО-, -(СН2)m-С(ОН)(СН3)-СО-, -СН=СН- или -CH=N-,
Y представляет связь или радикал -(СН2)n- или -(CH2)r-Q-(СН2)s-,
Q представляет пиперазиновый, гомопиперазиновый, 2-метилпи-перазиновый, 2,5-диметилпиперазиновый, пиперидиновый, 1,2,3,6-тетрагидропиридиновый, пирролидиновый, азетидиновый или тиазолидиновый радикал или насыщенное углеродное кольцо, имеющее от 3 до 7 членов;
Ф представляет связь или радикал (CH2)p-O-(CH2)q-, -(CH2)p-S-(CH2)q-, -(CH2)p-NR37-(CH2)q-, (CH2)p-CO-NR37-(CH2)q- или -СО-(CH2)p-NR37-(CH2)q-;
Z представляет NO2 или NH2;
R36 и R37 представляют, независимо, атом водорода или неразветвленный, или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -СО-R38, в котором R38 представляет неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R39 представляет атом водорода или неразветвленный, или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
причем m, n, р, q, r и s равны целым числам от 0 до 6;
причем предполагается, что:
- если А представляет радикал
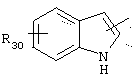
тогда Y представляет пиперидиновый радикал;
- если А представляет радикал
тогда Y представляет радикал (CH2)r-Q-(СН2)s-, в котором Q представляет насыщенное углеродное кольцо, имеющее от 3 до 7 членов.
Изобретение далее относится к соединениям общей формулы (IS’), которые являются промежуточными продуктами синтеза при получении продуктов общей формулы (I), в которой А представляет радикал индолина, как определено ранее, Х представляет радикал –NR15-CO-, Y представляет связь и Ф представляет радикал (CH2)p-NR16-(СН2)q.
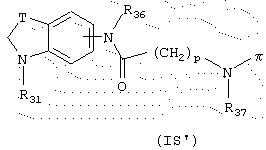
В общей формуле (IS’) π представляет атом водорода или защитную группу карбаматного типа;
R36 и R37 представляют, независимо, атом водорода, неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -СО-R38, в котором R38 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
Т представляет радикал -(CH2)k-, k равно 1 или 2;
R31 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, арилалкильный, диарилалкильный, бис-арилалкильный, аминоалкильный, алкил-аминоалкильный или диалкиламиноалкильный радикал или R31 представляет также (гетероцикло)алкильный радикал, в котором гетероцикл насыщен или ненасыщен, имеет от 3 до 7 членов и включает, по меньшей мере, один атом азота, причем указанный атом азота, необязательно, замещен атомом водорода или алкильным радикалом;
и p равно целому числу от 0 до 6.
Данное изобретение относится также к соединениям общей формулы (I), описанным ранее, или их фармацевтически приемлемым солям в качестве лекарственного средства. Оно относится также к фармацевтическим композициям, содержащим эти соединения или их фармацевтически приемлемые соли, и использованию этих соединений или их фармацевтически приемлемых солей для получения лекарственных средств, предназначенных для ингибирования нейронной NO-синтазы или индуцируемой NO-синтазы, для ингибирования липидного перокисления или для обеспечения двойной функции ингибирования NO-синтазы и функции ингибирования липидного перокисления.
Под термином фармацевтически приемлемая соль подразумеваются, особенно, аддитивные соли неорганических кислот, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, дифосфат и нитрат, или органических кислот, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, памоат, оксалат и стеарат. Соли, образованные из оснований, таких как гидроксид натрия или калия, также включены в объем настоящего изобретения, когда их можно использовать. Для других примеров фармацевтически приемлемых солей ссылку можно дать на “Pharmaceutical salts”, J. Pharm. Sci. 66:1 (1977).
Фармацевтическая композиция может быть в твердой форме, например, в форме порошков, гранул, таблеток, желатиновых капсул, липосом или суппозиторий. Подходящими твердыми носителями могут быть, например, фосфат кальция, стеарат магния, тальк, сахара, лактоза, декстрин, крахмал, желатин, целлюлоза, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, поливинилпирролидон и воск.
Фармацевтические композиции, содержащие соединение согласно изобретению, могут присутствовать также в жидкой форме, например, в форме растворов, эмульсий, суспензий или сиропов. Подходящими жидкими носителями могут быть, например, вода, органические растворители, такие как глицерин или гликоли, а также их смеси, в различных пропорциях, в воде.
Введение лекарственного средства по данному изобретению можно проводить местным, пероральным, парентеральным путем, внутримышечной инъекцией и т.п.
Предусмотренная доза введения лекарственного средства по данному изобретению находится между 0,1 мг и 10 г в соответствии с типом используемого активного соединения.
В соответствии с данным изобретением соединения общей формулы (I) можно получить способом, описанным ниже.
Получение соединений данного изобретения
Соединения изобретения, соответствующие общей формуле (I), но не общей формуле (I’), можно получить в соответствии с процедурами, описанными в примерах. Продукты формулы (I’) получают, как описано ниже.
Получение соединений общей формулы (I’)
Соединения общей формулы (I’) можно получить из промежуточных продуктов общей формулы (II) в соответствии со схемой 1, где А, В, Х Y, Ф и R39 имеют указанные выше значения и Gp представляет защитную группу карбаматного типа, например, трет-бутоксикарбонильную группу
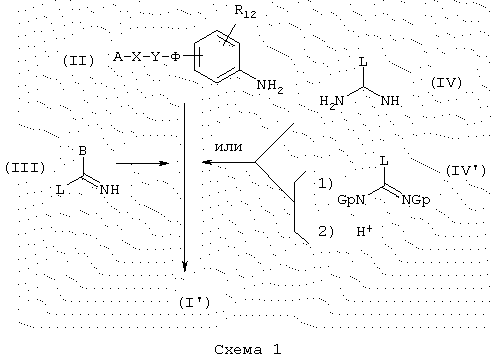
Производные анилина общей формулы (II) могут быть сконденсированы с соединениями общей формулы (III), в которой L представляет уходящую группу (например, радикал алкокси, алкилтио, аралкилтио, сульфоновой кислоты, галогенида, арилового спирта или тозильный), чтобы получить конечные соединения общей формулы (Т) замещенного амидинового типа (ср. схему 1). Например, для случая, когда В = тиофен, производные общей формулы (II) можно конденсировать с гидроиодидом S-метилтиофентиокарбоксамида, полученным по способу, описанному в литературе (Ann. Chim. (1962), 7, 303-337). Конденсацию можно проводить нагреванием в спирте (например, в метаноле или изопропаноле), необязательно, в присутствии ДМФ при температуре, предпочтительно, находящейся между 50 и 100° С, в течение времени, обычно находящимся между несколькими часами и всей ночью.
В конкретном случае, когда А представляет оксид пиридина, окисление пиридина проводят только на последней стадии синтеза вследствие неустойчивости этих соединений в восстанавливающей среде. Метахлорпербензойная кислота, используемая в качестве окисляющего агента, позволяет получить производные оксида пиридина общей формулы (I’).
Образование солей соединений общей формулы (I’), когда его проводят в присутствии сильной кислоты, такой как, например, хлористовородная кислота, позволяет аминам, которые были защищены в форме трет-бутилкарбамата во время синтеза, одновременно освобождаться от защитной группы.
В случае, когда В представляет амин, конечными соединениями общей формулы (I’) являются гуанидины. Их можно получить, например, конденсацией аминов общей формулы (II) с производными общей формулы (IV) или (IV)’. Реагенты общей формулы (IV), в которой L представляет, например, кольцо пиразола, конденсируют с аминами общей формулы (II) в соответствии с условиями, описанными в литературе (J. Оrg. Сhem. (1992), 57, 2497-2502), аналогичными для реагентов общей формулы (IV’), в которой L представляет, например, кольцо пиразола и Gp представляет трет-ВuОСО-группу (Tetrahedron Lett. (1993) 43 (21), 3389-3392), или когда L представляет группу -N-SO2-СF3 и Gp представляет трет-ВuОСО-группу (J. Оrg. Сhem. (1998) 63, 3804-3805). Во время конечной стадии синтеза снятие защитной группы гуанидиновой функции проводят в присутствии сильной кислоты, такой как, например, трифторуксусная кислота.
Следовательно, данное изобретение относится также к способу получения соединений общей формулы (I’), как определено выше, причем указанный способ характеризуется тем, что соединение общей формулы (II)
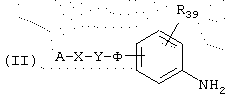
в которой А, В, X, Y, Ф и R39 имеют указанные выше значения, подвергают реакции с промежуточным продуктом общей формулы (III)
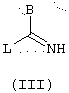
в которой В имеет указанные выше значения и L представляет уходящую группу, например, радикал алкокси, алкилтио, аралкилтио, сульфоновой кислоты, галогенида, арилового спирта или тозильный.
Следовательно, данное изобретение относится также к способу получения соединений общей формулы (I’), как определено выше, в которой В представляет амин, причем указанный способ характеризуется тем, что соединение общей формулы (II)
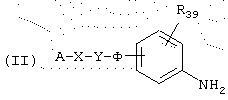
в которой А, В, X, Y, Ф и R39 имеют значения, указанные выше, подвергают реакции
а) либо с промежуточным продуктом общей формулы (IV)
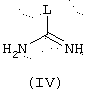
в которой L представляет уходящую группу, например, радикал алкокси, алкилтио, аралкилтио, сульфоновой кислоты, галогенида, арилового спирта или тозильный,
б) либо с промежуточным продуктом общей формулы (IV’)
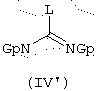
в которой L представляет уходящую группу, например, радикал алкокси, алкилтио, аралкилтио, сульфоновой кислоты, галогенида, арилового спирта или тозильный, и Gp представляет защитную группу карбаматного типа, например, трет-бутоксикарбонильную группу, с последующим, в случае, когда выбирают реакцию с соединением общей формулы (IV), гидролизом в присутствии сильной кислоты, например, трифторуксусной кислоты.
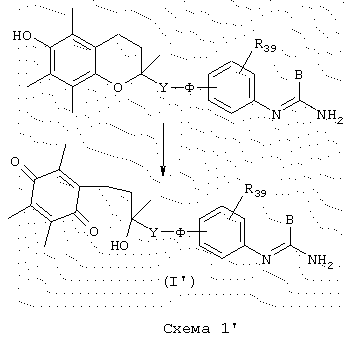
Конкретный случай, где А представляет 2,3,5-триметилбензохинон
Соединения общей формулы (I’), в которой А представляет 2, 3, 5-триметилбензохинон и Х = -(СН2)m-С(ОН)(СН3)-СО- и В, Y, Ф и Y39 имеют указанные выше значения, можно получить из соединений, включающих группу тролокса, схема I’. Реакционная способность тролокса относительно свободных радикалов позволяет рассматривать химическую модификацию этой группы, фактически, действие FеСl3 в водной среде (Helv Chim. Acta (1963) 46, 333) вызывает радикальное размыкание цикла бензопирановой системы и приводит к образованию соединений общей формулы (I’)
Получение соединений общей формулы (II)
Некоммерческие промежуточные продукты общей формулы (II) получают либо удалением защитной группы, либо восстановлением нитропроизводного, как показано в приведенных ниже схемах синтеза.
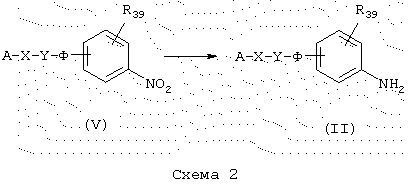
Восстановление нитропроизводного
Восстановление функциональной нитрогруппы промежуточных продуктов общей формулы (V), схема 2, в которой А, X, Y, Ф и R39 имеют указанные выше значения, обычно проводят каталитическим гидрированием в этаноле в присутствии Pd/C, за исключением тех случаев, когда молекула восприимчива к этим условиям, когда нитрогруппу селективно восстанавливают, например, нагреванием продукта в подходящем растворителе, таком как этилацетат с небольшим количеством этанола, в присутствии SnCl2 (J. Heterocyclic Chem. (1978), 24, 927-930; Tetrahedron Letters (1984), 25 (8), 839-842) или с использованием NаВН4-ВiСl3 (Synth. Corn. (1995), 25 (23), 3799-3803) в растворителе, таком как этанол, или затем с использованием никеля Ренея с добавленным гидразин-гидратом (Monatshefte fur Chemie, (1995), 126, 725-732) или также с использованием SnCl2 в присутствии Zn (Synthesis (1996), (9), 1076-1078).
В конкретном случае при получении индольных производных общей формулы (V) (схема 6) проводят восстановление функциональной нитрогруппы (Zn в уксусной кислоте) в мягких условиях, при этом неизбежно происходит потеря ненасыщенности у 1,2,3,6-тетрагидропиридина с образованием пиперидина.
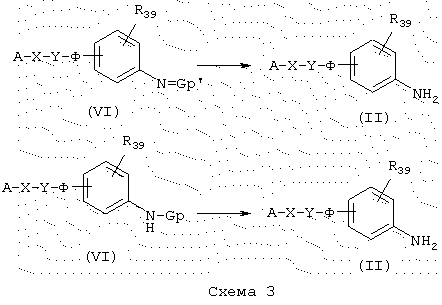
Снятие защиты у аминогруппы
Промежуточные продукты общей формулы (II), в которой А, X, Y, Ф и R39 имеют указанные выше значения, можно также получить из промежуточных продуктов общей формулы (VI), схема 3, которые являются соединениями, включающими амин, защищенный в форме, например, 2,5-диметилпиррола (N=Gp’) или трет-бутилкарбамата (NH-Gp). Пирролы, например, освобождают от защитной группы нагреванием в присутствии гидрохлорида гидроксиламина в течение, по меньшей мере, 24 часов, чтобы в конце получить первичные амины общей формулы (II). Амины, защищенные в форме трет-бутилкарбаматов, освобождают от защитной группы стандартным способом в кислотной среде обработкой трифторуксусной кислотой или хлористовородной кислотой.
Получение соединений общей формулы (V)
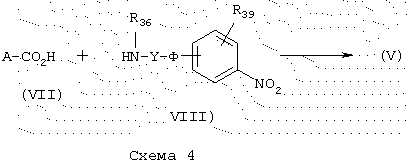
Синтез карбоксамидов:
Карбоксамиды общей формулы (V), схема 4, в которой Х представляет -CO-NR36- и A, Y, Q, Ф, R39, R36 имеют указанные выше значения, получают конденсацией кислот общей формулы (VII) с коммерческими аминами общей формулы (VIII) в стандартных условиях для синтеза пептидов (М. Bodanszky and A. Bodanszky, The Practice of Peptide Synthesis, 145 (Springer-Verlag, 1984)) в ТГФ, дихлорметане или ДМФ в присутствии реагента сочетания, такого как дициклогексилкарбодиимид (DCC), 1,1’-карбонилдиимидазол (CDI) (J. Med. Chem. (1992), 35 (23), 4464-4472) или гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC или WSCI) (John Jones, The chemical synthesis of peptides, 54 (Clarendon Press, Oxford, 1991)).
Синтез некоммерческих кислот общей формулы (VII) описывается в разделе “Получение промежуточных продуктов”.
(A-X-CO-N-ряд)
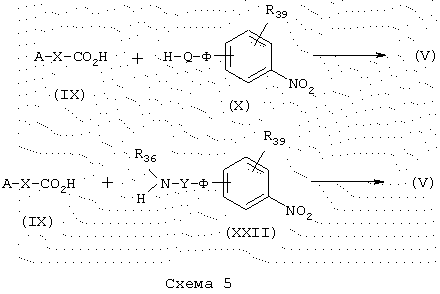
Карбоксамиды общей формулы (V), схема 5, в которой Х представляет -O-(CH2)m-, -S-(CH2)m- или –NR36-(CH2)m-, A, Y, Ф, R39 и R36 имеют указанные выше значения (причем Q представляет гетероцикл), получают конденсацией кислот общей формулы (IX) с аминами общей формулы (X) или (XXII) в стандартных условиях для синтеза пептидов, как описано ранее. Синтезы кислот общей формулы (IX) и аминов общей формулы (X), некоммерческие продукты, описываются в разделе “Получение промежуточных продуктов”.
Синтез производных 1,2,3, 6-тетрагидропиридина
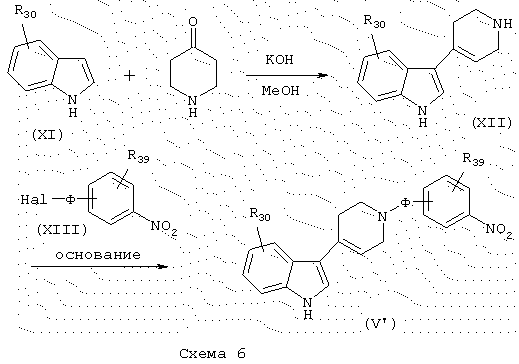
Индольные производные общей формулы (V), в которой Q представляет 1,2,3,6-тетрагидропиридин, причем Ф, R30 и R39 имеют указанные выше значения, получают из коммерческих замещенных индолов общей формулы (XI), схема 6. Экспериментальный протокол реакции конденсации с пиперидоном описывается в Eur. J. Med. Chem. (1987), 22, 33-43. Промежуточный продукт общей формулы (XII) затем конденсируют стандартным способом с галогенированными производными общей формулы (XIII) в присутствии основания, такого как, например, Nа2СО3, в подходящем полярном растворителе, таком как, например, ДМФ, чтобы получить промежуточные продукты общей формулы (V’) (конкретный случай промежуточных продуктов общей формулы (V)).
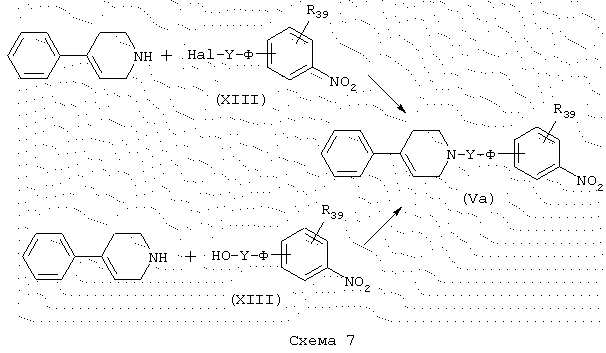
Промежуточные продукты общей формулы (Va) (конкретный случай промежуточных продуктов общей формулы (V)), схема 7, в которой Q представляет 1,2,3,6-тетрагидропиридин, причем Ф, Y и R39 имеют указанные выше значения, Hal представляет атом галогена, получают также конденсацией 4-фенил-1,2,3,6-тетрагидропиридина с галогенированными производными общей формулы (XIII) в присутствии основания, такого как, например, К2СО3, в подходящем полярном растворителе, таком как, например, ДМФ. В альтернативном случае соединения общей формулы (Va) доступны путем конденсации типа Мицонобу (Synthesis (1981), 1) между 4-фенил-1,2,3,6-тетрагидропиридином и спиртовыми производными общей формулы (XVIII).
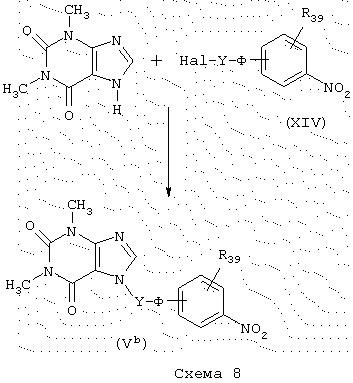
Синтез производных теофиллина
Производные теофиллина общей формулы (Vb) (конкретный случай промежуточных продуктов общей формулы (V)), схема 8, в которой Y, Ф и R39 имеют указанные выше значения, получают конденсацией коммерческого теофиллина с галогенированным производным общей формулы (XIV) в присутствии основания, такого как, например, NaOH, в водно-спиртовом растворителе.
Синтез простых эфиров общей формулы (V)
Когда Ф представляет (CH2)p-O-(CH2)q- и A, Q, R39, Р и q имеют указанные выше значения, простые эфиры общей формулы (V), схема 9, можно получить в одну стадию конденсацией спиртов общей формулы (XV) с галогенированными производными общей формулы (XVI) в присутствии основания, такого как, например, NaH, в полярном растворителе, таком как, например, ТГФ.
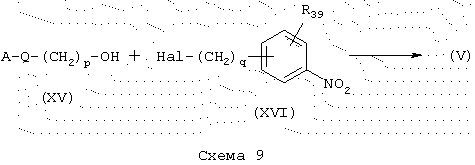
Когда Ф представляет -(CH2)p-O-(CH2)q-и А, R39, Р и q имеют указанные выше значения, простые эфиры общей формулы (V) можно также получить из галогенированных производных формулы (XVII) и спиртов общей формулы (XVIII), схема 10, в присутствии основания, такого как, например, NaH, в полярном растворителе, таком как, например, ДМФ.
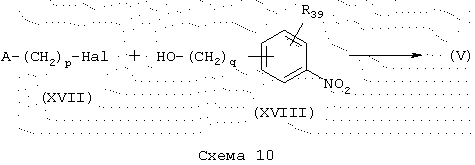
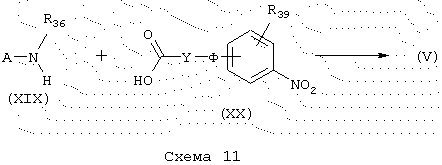
Синтез карбоксамидов (A-X-N-CO-ряд)
Карбоксамиды общей формулы (V), схема 11, в которой А, R39, R36, Y и Ф имеют указанные выше значения, получают в таких же условиях конденсации пептидов, как карбоксамиды А-X-CO-N-ряда. Получение некоммерческих аминов общей формулы (XIX) и кислот общей формулы (XX) описывается в разделе “Получение промежуточных продуктов”.
Синтез аминов восстанавливающим аминированием
Амины общей формулы (V), схема 12, в которой А, R39, R36, Y, m и Ф имеют указанные выше значения, можно получить конденсацией альдегида общей формулы (XXI) с коммерческим амином общей формулы (XXII) в восстанавливающей среде. Реакция протекает в спиртовом растворителе, таком как, например, метанол, в присутствии порошкообразного молекулярного сита 4  , активированного заранее, и восстанавливающего агента, такого как, например, NaBH4 или NаВН3СN. Перед добавлением восстанавливающего агента некоторые амины можно выделить как промежуточные продукты общей формулы (V).
, активированного заранее, и восстанавливающего агента, такого как, например, NaBH4 или NаВН3СN. Перед добавлением восстанавливающего агента некоторые амины можно выделить как промежуточные продукты общей формулы (V).
Вторичные амины общей формулы (V) затем защищают в форме трет-бутилкарбамата в присутствии ди-трет-бутилдикарбоната и основания, такого как, например, триэтиламин, и в растворителе, таком как, например, дихлорметан. Синтез некоммерческих альдегидов общей формулы (XXI) описывается в разделе “Получение промежуточных продуктов”.
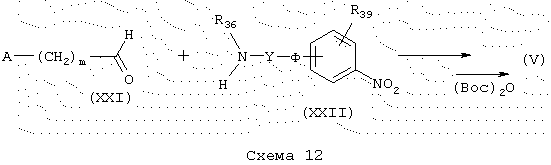
Амины общей формулы (V), схема 13, в которой А, X, R39, R37, p и q имеют указанные выше значения, можно также получить конденсацией амина общей формулы (XXIII) с коммерческим альдегидом общей формулы (XXIV) в восстанавливающей среде в условиях, описанных ранее. Вторичные амины общей формулы (V) затем защищают в форме трет-бутилкарбамата в условиях, описанных ранее. Синтез аминов общей формулы (XXIII) описывается в разделе “Получение промежуточных продуктов”. Кроме того, некоммерческие альдегиды общей формулы (XXVI) можно получить в соответствии с J. Org. Chem., 1993, 58, 1385-92.
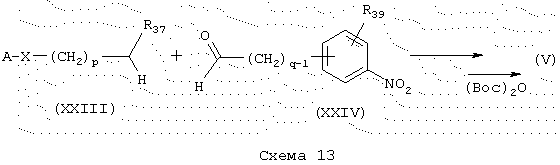
Синтез аминов восстановлением карбоксамидов
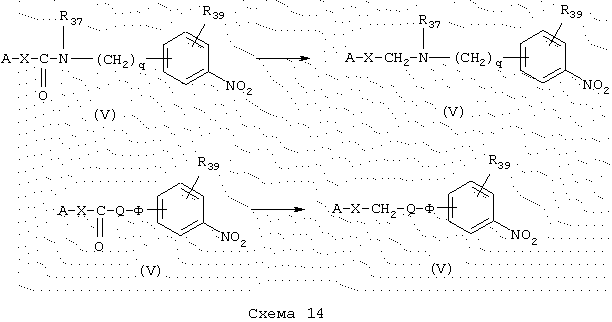
Амины общей формулы (V), схема 14, в которой А, X, R39, R37 и q имеют указанные выше значения, получают путем восстановления производных карбоксамидов общей формулы (V), синтез которых описывается в разделе “Получение промежуточных продуктов” (схема 4). Стадию восстановления проводят в безводной среде нагреванием при 70-80° С в присутствии селективного для карбоксамида реагента, такого как, например, ВН3·ТГФ, в растворителе, таком как, например, ТГФ. Полученные таким образом вторичные амины можно защитить в форме трет-бутилкарбамата в условиях, описанных ранее.
Синтез мочевин
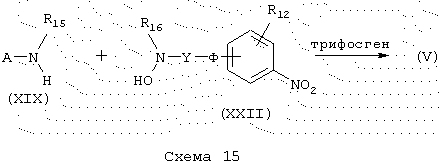
Мочевины общей формулы (V), схема 15, в которой A, Y, Ф, R39, R36 и R37 имеют указанные выше значения, получают реакцией аминов общей формулы (XIX) с аминами общей формулы (XXII) в присутствии трифосгена и основания, такого как, например, диизопропилэтиламин, в инертном растворителе, таком как дихлорметан, в соответствии с экспериментальным протоколом, описанным в J. Org. Cheio. (1994), 59 (7), 1937-1938.
Синтез производных пирролидинилпиримидина
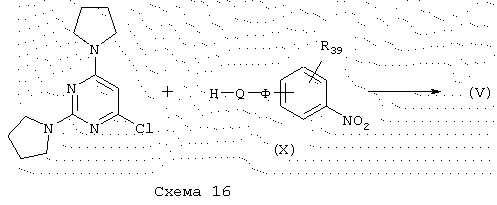
Производные пиримидина общей формулы (V), схема 16, в которой Q представляет пиперазин, причем Ф и R39 имеют указанные выше значения, получают конденсацией 4-хлор-2,6-дипирролидин-1-илпиримидина (J. Med. Chem. (1990), 33 (4), 1145-1151) с производными пиперазина общей формулы (X) путем нагревания в течение от 24 до 48 часов в безводном пиридине при температуре 80-110° С.
Синтез карбоксидов (A-X-CO-N-ряда)
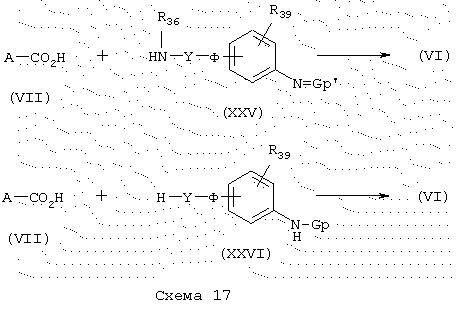
Карбоксамиды общей формулы (VI), схема 17, в которой А, Y, Ф, R39, R36, Gp и Gp’ имеют указанные выше значения, можно получить из коммерческих кислот общей формулы (VII) и аминов общей формулы (XXV) или (XXVI) в стандартных условиях для синтеза пептидов, как описано ранее. Синтез аминов общей формулы (XXV) и (XXVI) описывается в разделе “Получение промежуточных продуктов”.
Синтез карбоксамидов (A-X-N-CO-ряда)
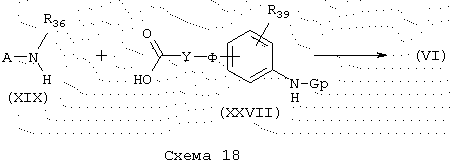
Карбоксамиды общей формулы (VI), схема 18, в которой А, Y, Ф, R39, R36 и Gp имеют указанные выше значения, можно получить конденсацией аминов общей формулы (XIX), описанных ранее, с кислотами общей формулы (XXVII) в стандартных условиях для синтеза пептидов, как описано ранее. Кислоты общей формулы (XXVII) легко доступны. посредством защиты функциональной группы анилина в форме, например, трет-бутилкарбамата, в стандартных условиях.
Получение различных промежуточных продуктов синтеза
Синтез промежуточных продуктов (VII)
Некоммерческие кислоты общей формулы (VII), в которой А имеет указанные выше значения, доступны с использованием способов, описанных в литературе. Например, 2-гидрокси-4,5,6-триметоксибензойную кислоту получают в две стадии из 3,4,5-триметоксифенола в соответствии с J. Org. Chem. (1961), 26, 1221-1223, Acta Chem. Scandinavica (1973), 27, 888-890 или Can. J. Chem. (1972), 50, 1276-1282.
Некоторые кислоты общей формулы (VII), в которой А имеет указанные выше значения, включают амин (заместитель R1), который нужно защитить в форме карбамата, в особенности, трет-бутилом, до проведения стадии конденсации. Такую защиту проводят в стандартных условиях, описанных в “М. Bodanszky et A. Bodanszky, The Practice of Peptide Synthesis, 145 (Springer Verlag, 1984)”.
Кислотные производные бензофуранов получают с использованием экспериментального протокола, описанного в J. Org. Chem. (1989), 54, 560-569.
Синтез промежуточных продуктов (IX)
Некоммерческие кислоты общей формулы (IX), в которой Х представляет -O-(СН2)m- и А имеет указанные выше значения, получают из гидрохинонов общей формулы (IX.1), полученных в соответствии с литературой (J. Chem. Soc. Perkin 1 (1981), 303-306). Конденсацию с коммерческими сложными галогенэфирами общей формулы (IX.2) проводят в присутствии основания, такого как, например, К2СО3, нагреванием в полярном растворителе, таком как, например, ТГФ, в течение, по меньшей мере, 5 часов. Сложные эфиры общей формулы (IX.3), полученные как промежуточные продукты, затем освобождают от защитной группы (в кислотной среде в случае третичных бутиловых эфиров), чтобы получить кислоты общей формулы (IX).
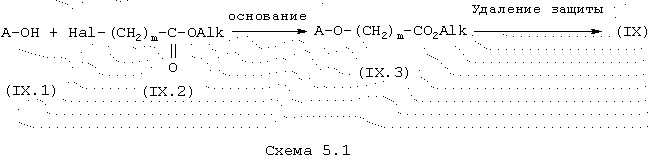
Кислоты общей формулы (IX), в которой Х представляет -S-(CH2)m- и А имеет указанные выше значения, получают в соответствии с литературой (J. Med. Chem. (1997), 40 (12), 1906-1918).
Синтез промежуточных продуктов (X)
Некоммерческие амины общей формулы (X), в которой Q представляет гомопиперазин, 2-метилпиперазин, 2,5-диметилпиперазин, 4-аминопиперидин, синтезируют в три стадии из соответствующих коммерческих диаминов. Диамины селективно монозащищают в форме карбамата (Synthesis (1984), (12). 1032-1033, Synth. Commun. (1990), 20, (16), 2559-2564) до реакции нуклеофильного замещения на галогене нитробензола, в частности, 4-фторнитробензола. Амины, предварительно защищенные, освобождают от защиты в последней стадии в соответствии со способами, описанными в литературе (T.W.Greene and P.G.M.Wuts, Protective Group in Organic Synthesis, Second edition (Wiley-Interscience, 1991)), чтобы получить промежуточные продукты общей формулы (X).
Синтез промежуточных продуктов (XIX)
Амины общей формулы (XIX), которые являются производными индолина или 1,2,3,4-тетрагидрохинолина, схема 11.1, в которой Т и R31 имеют указанные выше значения, можно получить из соответствующих нитропроизводных общей формулы (XIX.1). 6-Нитро-1,2,3,4-тетрагидрохинолин описывается в Can. J. Chem. (1952), 30, 720-722. Алкилирование амина проводят стандартным способом обработкой сильным основанием, таким как, например, NaH, в апротонном полярном растворителе, таком как, например, ДМФ, в присутствии галогенированного производного, такого как, например, МеI или PhCH2Br. Полученное в качестве промежуточного продукта нитропроизводное общей формулы (XIX.2) затем восстанавливают, например, никелем Ренея в присутствии гидразингидрата для получения анилинов общей формулы (XIX).
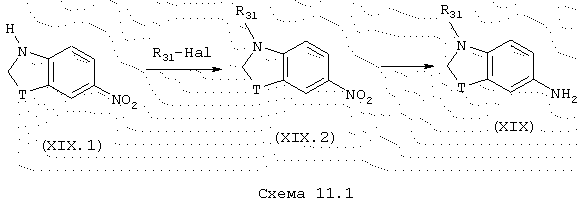
Некоторые некоммерческие производные фенилендиамина общей формулы (XIX) можно получить также в соответствии с Farmaco (1951), 6, 713-717.
В конкретном случае, когда А представляет фенольное производное, анилины общей формулы (XIX) получают гидрированием в присутствии Pd/C производных нитрофенольных предшественников. Нитрованные производные ди-трет-бутилфенолов доступны в соответствии со способом, описанным в J. Org. Chem. (1968), 33 (1), 223-226.
Синтез промежуточных продуктов (XX)
Некоммерческие карбоновые кислоты общей формулы (XX), в которой R12, Y и Ф имеют указанные выше значения, доступны при помощи способов, описанных в литературе. Синтез нескольких ω -(4’-нитрофенил)алкановых кислот описывается в J. Med. Chem. (1978), 21 (5), 430-437.
Синтез карбоновых кислот общей формулы (XX), в которой R12 и Y имеют указанные выше значения и Ф = тиазолидин, проводят по протоколу, описанному в Liebigs Ann. Chem. (1987), 927-934.
Синтез промежуточных продуктов (XXI)
Некоммерческие альдегиды общей формулы (XXI), в которой А и m имеют указанные выше значения, получают способами, описанными в литературе: Bull. Chem. Soc. Jpn. (1978), 51 (8), 2433-2434, Bioorg. Med. Chem. Lett. (1998), 8, 3453-3458.
Синтез промежуточных продуктов (XXIII)
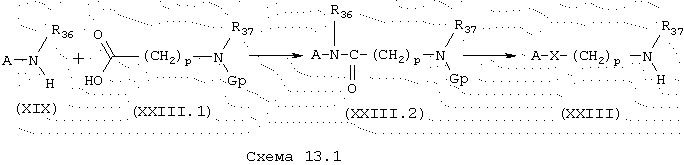
Амины общей формулы (XXIII), схема 13.1, в которой А, X, R37, Gp и p имеют указанные выше значения, получают путем конденсации аминов общей формулы (XIX), описанных ранее, и защищенных аминокислот общей формулы (XXIII.1) в стандартных условиях синтеза пептидов (см. раздел Синтез карбоксамидов (схема 4)). Снятие защиты у амина соединений общей формулы (XXIII.2) затем проводят в кислотной среде, такой как, например, трифторуксусная кислота или хлористовородная кислота.
Синтез промежуточных продуктов (XXV)
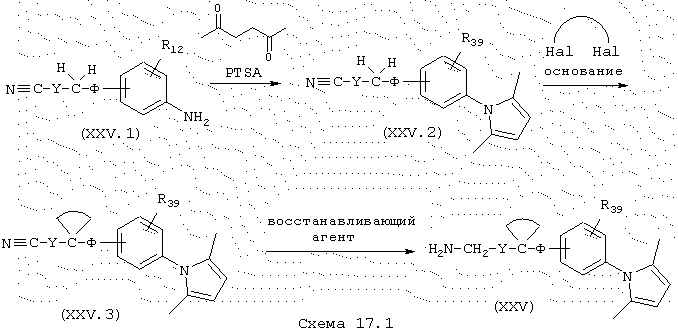
Амины общей формулы (XXV), в которой Y и Ф имеют указанные выше значения, получают в несколько стадий из коммерческих производных анилина общей формулы (XXV.1), схема 17.1. С целью защиты функциональной группы анилина используют защитную группу, которая устойчива к действию сильно основной среды, например, группу 2,5-диметилпиррола. Нагреванием при кипячении с обратным холодильником в подходящем растворителе (например, толуоле) смеси промежуточного продукта (XXV.1) с 2,5-гександионом и пара-толуолсульфоновой кислотой с одновременным удалением воды, образованной в течение реакции, получают промежуточный продукт общей формулы (XXV.2). Промежуточный продукт общей формулы (XXV.3) получают двойным алкилированием углерода с использованием двух эквивалентов сильного основания, такого как, например, NaH в ДМСО (J. Org. Chem. (1971), 36 (9), 1308-1309) в присутствии дигалогенированного производного. Амины общей формулы (XXV) затем получают восстановлением нитрила с использованием, например, LiAlH4, в растворителе, таком как, например, безводный ТГФ.
Синтез промежуточных продуктов (XXVI)
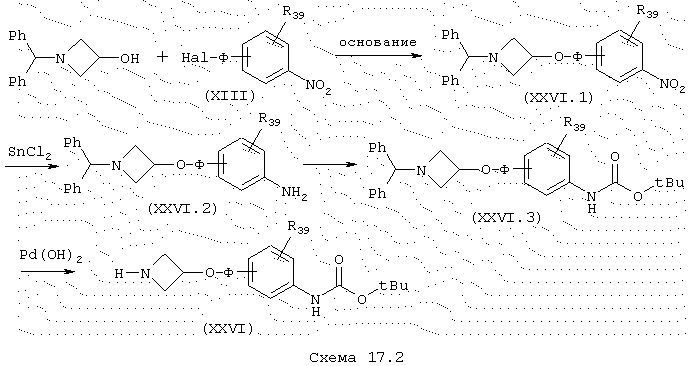
Амины общей формулы (XXVI), схема 17.2, в которой R39 и Ф имеют указанные выше значения, получают в несколько стадий из коммерческого производного азетидина и галогенированного производного общей формулы (XIII). Стадию конденсации проводят стандартным способом в присутствии сильного основания, такого как, например, NaH, в инертном безводном растворителе, таком как, например ТГФ. Восстановление нитропроизводного хлоридом олова (J. Heterocyclic Chem. (1987), 24, 927-930; Tetrahedron Letters (1984), 25 (8), 839-842) дает производное анилина общей формулы (XXVI.2), которое сразу защищают в форме трет-бутилкарбамата в условиях, описанных ранее. Амин общей формулы (XXVI) получают гидрогенолизом дибензильной группы в присутствии гидроксида палладия.
Если все технические и научные термины, использованные здесь, не определяются по-другому, они имеют такие же значения, как значения, обычно используемые средним специалистом в области, к которой принадлежит данное изобретение. Аналогично этому, все публикации, заявки на патенты, все патенты и все другие ссылки, указанные здесь, включаются путем ссылки.
Следующие примеры представлены для иллюстрации вышеуказанных процедур и не должны никоим образом рассматриваться в качестве ограничения объема данного изобретения.
Примеры
Пример 1: Гидрохлорид 2-гидрокси-5-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамида:
1.1.) 2-Гидрокси-5-метокси-N-{2-(4-нитрофенил)этил}бензамид
Гидрохлорид 4-нитрофенетиламина (1,81 г; 8,9 ммоль), триэтиламин (2,8 мл; 20 ммоль), гидроксибензотриазол (1,45 г; 10,7 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (3,75 г; 19,62 ммоль) добавляют к раствору 1,5 г (8,9 ммоль) 5-метоксисалициловой кислоты в дихлорметане (80 мл). Реакционную среду перемешивают в течение ночи при 25° С. Смесь разбавляют 40 мл воды и перемешивают в течение десяти минут, затем продукт экстрагируют дихлорметаном. Органический раствор сушат над сульфатом натрия, фильтруют и концентрируют в вакууме и остаток упаривания очищают на колонке с диоксидом кремния (элюент = этилацетат/гептан; 50:50) с получением белого твердого вещества, которое получают с выходом 64%. Точка плавления: 200° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 3,00 (м, 2Н, CH2); 3,60 (м, 2Н, CH2); 3,70 (S, 3Н, -ОСН3); 6,80 (д, 1Н, аром., J=8,8 Гц, 7,00 (д, 1Н, аром., J=8,8 Гц); 7,35 (с, 1Н, аром.); 7,50 (д, 2Н, аром., J=7,8 Гц); 8,10 (д, 2Н, аром., J=7,6 Гц); 8,90 (шир. с, 1Н, CO-NH); 11,90 (шир. с, 1Н, -ОН).
1.2) 2-Гидрокси-5-метокси-N-{2-(4-аминофенил)этил}бензамид:
Промежуточный продукт 1.1, 2,10 г (6,64 ммоль), растворяют в смеси этанола (40 мл) и дихлорметана (60 мл) и добавляют 0,3 г палладия на угле (10%). Реакционную смесь помещают в атмосферу водорода при давлении 4 бара (3,948 атм). Катализатор отделяют фильтрованием и растворитель выпаривают при пониженном давлении. Остаток упаривания очищают на колонке с диоксидом кремния (элюент = этилацетат/гептан; 50:50) с получением бело-кремового твердого вещества. Точка плавления: 130° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,67 (т, 2Н, СН2, J=7,4 Гц); 3,43 (м, 2Н, СН2); 3,73 (с, 3Н, -ОСН3); 4,90 (с, 2Н, NH2); 6,50 (д, 2Н, аром., J=7,8 Гц); 6,82 (д, 1Н, аром., J=8,8 Гц); 6,90 (д, 2Н, аром., J=7,8 Гц); 7,00 (д, 1Н, аром., J=8,8 Гц); 7,39 (с, 1Н, аром.); 8,87 (шир с, 1Н, CO-NH); 12,09 (шир с, 1Н, -ОН).
1.3) Гидрохлорид 2-гидрокси-5-метокси-N-{2-[4-[(2-тиенил-(имино)метил)амино]фенил]этил}бензамида
Промежуточный продукт 1,2 (0,6 г; 2,1 ммоль) растворяют в 2-пропаноле (10 мл), добавляют 0,896 г гидроиодида 3-метил-2-тиофентиокарбоксимида (3,14 ммоль) (Ann. Chim. (1962), 7, 303-337).
После нагревания при 50° С в течение 15 часов реакционную смесь концентрируют досуха в вакууме. Остаток растворяют в этилацетате и насыщенном растворе карбоната натрия. После декантации органическую фазу промывают последовательно 50 мл насыщенного раствора карбоната натрия, воды и рассола. Органический раствор сушат над сульфатом натрия, фильтруют и упаривают при пониженном давлении. Остаток упаривания очищают на колонке с диоксидом кремния (элюент этанол/дихлорметан, 5,95). Получают 0,523 г свободного основания. Гидрохлорид получают из 0,523 г (1,32 ммоль) основания, растворенного в 20 мл ацетона и превращенного в соль в присутствии 2,0 мл (2,0 ммоль) молярного раствора НС1 в безводном диэтиловом эфире. Полученные кристаллы фильтруют и промывают в диэтиловом эфире с получением после сушки 0,58 г (выход 64%) целевого продукта в виде белого твердого вещества. Точка плавления: 242° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,94 (т, 2Н, СН2, J=7,2 Гц); 3,58 (м, 2Н, СН2); 3,73 (с, 3Н, -ОСН3); 6,85 (д, 1Н, аром., J=9,0 Гц); 7,01 (д, 1Н, аром., J=8,8 Гц); 7,20-7,70 (м, 6Н, аром.); 8,16 (м, 2Н, тиофен); 8,88 (шир с, 1Н, NH+); 9,11 (шир т, 1Н, CO-NH, J=5,15 Гц); 9,83 (шир с, 1Н, NH+); 11,54 (шир с, 1Н, NH+); 12,10 (с, 1Н, -ОН).
ИК: ν C=N (амидин): 1645 см-1; ν C=O (амид): 1645 см-1.
Пример 2: Гидроиодид 2-гидрокси-5-метилтио-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, за исключением того, что 5-метилтиосалициловая кислота заменяет 5-метоксисалициловую кислоту. Образованный гидроиодид осаждается во время реакции. Образованные кристаллы отделяют фильтрованием и промывают диэтиловым эфиром. Получают не совсем белое твердое вещество. Точка плавления 211,4-212,6° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,49 (с, 3Н, SСН3); 2,94 (т, 2Н, СН2, J=7,36 Гц); 3,57 (м, 2Н, СН2); 6,90 (д, 1Н, аром., J=8,64 Гц); 7,20-7,60 (м, 6Н, аром.); 7,80 (с, 1Н, аром.); 8,10 (м, 2Н, тиофен); 8,87 (шир с, 1Н, NH+); 9,02 (шир т, 1Н, CO-NH, J=5,12 Гц); 9,77 (шир с, 1Н, NH+); 11,35 (шир с, 1Н, NH+); 12,84 (с, 1Н, -ОН).
ИК: ν C=N (амидин): 1639 см-1; ν C=O (амид): 1656 см-1.
Пример 3: Гидрохлорид 2,5-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 2,5-дигидроксибензойной кислотой, заменяющей 5-метоксисалициловую кислоту. Получают розовато-белое твердое вещество. Точка плавления: 250° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,92 (т, 2Н, CH2, J=7,20 Гц); 3,55 (м, 2Н, СН2); 6,75 (д, 1Н, аром., J=8,76 Гц); 6,85 (д, 1Н, аром. J=8,76 Гц); 7,24 (с, 1Н, аром.); 7,30-7,50 (м, 5Н, аром.); 8,16 (м, 2Н, тиофен); 8,83 (шир CO-NH); 8,9 (шир с, 1Н, NH+); 9,07 (с, 1Н, -ОН); 9,8 (шир с, 1Н, NH+); 11,40 (с, 1Н, -ОН); 11,70 (с, 1Н, NH+);
ИК: ν C=N (амидин): 1652 см-1; ν C=O (амид): 1668 см-1.
Пример 4: Гидрохлорид 2-гидрокси-3-изопропил-N-{2-[4-[(2-ти-енил(имино)метил)амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 2-гидрокси-3-изопропилбензойной кислотой, заменяющей 5-метоксисалициловую кислоту. Получают белое твердое вещество. Точка плавления: 142,5-144° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,17 (д, изопропил, J=6,9 Гц); 2,93 (м, 2Н, CH2); 3,24 (м, 1Н, изопропил); 3,58 (м, 2Н, СН2); 6,82 (т, 1Н, аром., J=7,8 Гц); 7,20-7,60 (м, 6Н, аром.); 7,80 (д, 1Н, аром. J=7,9 Гц); 8,19 (м, 2Н, тиофен); 8,89 (шир с, 1Н, NН+); 9,23 (шир с, 1Н, CO-NH); 9,86 (шир с, 1Н, NH+); 11,62 (шир с, 1Н, NH+); 13,45 (с, 1Н, -ОН).
ИК: ν C=N (амидин): 1637 см-1; ν C=O (амид): 1648 см-1.
Пример 5: Гидрохлорид 2,6-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил) амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 2,6-дигидроксибензойной кислотой, заменяющей 5-метоксисалициловую кислоту.
Получают бледно-желтовато-белое твердое вещество. Точка плавления: >280° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,94 (т, 2Н, CH2, J=7,14 Гц); 3,61 (м, 2Н, СН2); 6,40 (д, 2Н, аром., J=8,32 Гц); 7,14 (т, 1Н, аром., J=8,28 Гц); 7,20-7,60 (м, 5Н, аром.); 8,17 (м, 2Н, тиофен); 8,9 (шир с, 1Н, NH+); 9,03 (т, 1Н, CO-NH J=5,24 Гц); 9,85 (шир с, 1Н, NH+); 11,55 (шир с, 1Н, NH+); 12,71 (шир с, 2Н, -ОН).
ИК: ν C=N (амидин): 1593 см-1; ν C=O (амид): 1633 см-1.
Пример 6: Гидрохлорид 2-гидрокси-4,6-диметокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 2-гидрокси-4,6-диметоксибензойной кислотой, заменяющей 5-метоксисалициловую кислоту. Получают белое твердое вещество. Точка плавления: 196-199° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,92 (т, 2Н, CH2, J=7,24 Гц); 3,58 (м, 2Н, СН2); 3,76 (с, 3Н, -ОСН3); 3,85 (с, 3Н, -ОСН3); 6,07 (с, 1Н, аром.); 6,10 (с, 1Н, аром.); 7,30-7,60 (м, 5Н, аром.); 8,17 (м, 2Н, тиофен); 8,58 (шир т, 1Н, CONH, J=5,36 Гц); 8,88 (шир с, 1Н, NH+); 9,85 (шир с, 1Н, NH+); 11,60 (шир с, 1Н, NH+); 14,39 (с, 1Н, -ОН).
ИК: ν C=N (амидин): 1598 см-1; ν C=O (амид): 1637 см-1.
Пример 7: Гидрохлорид 2-гидрокси-4,5,6-триметокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 2-гидрокси-4,5,6-триметоксибензойной кислотой (J. Or д. Chem. (1961), 26, 1221-1223; Acta Chem. Scandinavica (1973), 27, 888-890), заменяющей 5-метоксисалициловую кислоту. Точка плавления: 90-95° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,95 (т, 2Н, СН2, J=7,12 Гц); 3,61 (м, 2Н, СН2); 3,66 (с, 3Н, -ОСН3); 3,79 (с, 3Н, -ОСН3); 3,80 (с, 3Н, -ОСН3); 6,32 (с, 1Н, аром.); 7,39-7,48 (м, 5Н, аром.); 8,16 (м, 2Н, тиофен); 8,62 (шир т, 1Н, CO-NH); 8,90 (шир с, 1Н, NH+); 9,80 (шир с, 1Н, NH+); 11,40 (шир с, 1Н, NH+); 13, 67 (с, 1Н, ОН).
ИК: ν C=N (амидин): 1591 см-1; ν C=O (амид): 1631 см-1.
Пример 8: Гидрохлорид 2-гидрокси-3,5-ди-трет-бутил-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 2-гидрокси-3,5-ди-трет-бутилбензойной кислотой, заменяющей 5-метоксисалициловую кислоту. Получают белое твердое вещество. Точка плавления: 172,4-173,8° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,28 (с, 9Н, трет-Вu); 1,36 (с, 9Н трет-Вu); 2,96 (т, 2Н, СН2, J=7,28 Гц); 3,58 (м, 2Н, СН2); 7,36-7,46 (м, 6Н, аром.); 7,70 (с, 1Н, аром.); 8,17 (м, 2Н, тиофен); 8,88 (шир с, 1Н, NH+); 9,22 (шир т, 1Н, CONH, J=5,32 Гц); 9,82 (шир с, 1Н, NH+); 11,55 (шир с, 1Н, NH+); 13,60 (с, 1Н, -ОН).
ИК: ν C=N (амидин): 1585 см-1; ν C=O (амид): 1631 см-1.
Пример 9: Гидрохлорид 2-гидрокси-3,5-диизопропил-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 2-гидрокси-3,5-диизопропилбензойной кислотой, заменяющей 5-метоксисалициловую кислоту. Получают белое твердое вещество. Точка плавления: 212,6-214° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,35 (м, 12Н, изопропил); 2,98 (м, 1Н, изопропил); 3,12 (т, 2Н, СН2, J=7,58 Гц); 3,38 (м, 1Н, изопропил); 3,72 (м, 2Н, СН2); 7,37 (с, 1Н, аром.); 7,54-7,63 (м, 5Н, аром.); 7,77 (с, 1Н, аром.); 8,33 (м, 2Н, тиофен); 9,00 (шир с, 1Н, NH+); 9,30 (м, 1Н, CONH); 10,00 (шир с, 1Н, NH+).
ИК: ν C=N (амидин): 1590 см-1; ν C=O (амид): 1637 см-1.
Пример 10: Гидрохлорид 2,4-дигидрокси-3,6-диметил-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 2,4-дигидрокси-4,6-диметилбензойной кислотой, заменяющей 5-метоксисалициловую кислоту. Получают бежевое твердое вещество. Точка плавления: 150,3-151,9° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,08 (с, 3Н, СН3); 2,38 (с, 3Н, СН3); 3,09 (т, 2Н, СН2, J=7,36 Гц); 3,61 (м, 2Н, СН2); 6,38 (с, 1Н, аром.); 7,55-7,63 (м, 5Н, аром.); 8,15 (шир т, 1Н, CONH, J=7,28 Гц); 8,35 (м, 2Н, тиофен); 9,00 (шир с, 1Н, NH+); 9,78 (шир с, 1Н, NH+); 10,00 (с, 1Н, -ОН); 10,70 (шир с, 1Н, NH+); 11,69 (шир с, 1Н, NH+).
ИК: ν C=N (амидин): 1590 см-1; ν C=O (амид): 1637 см-1.
Пример 11: Гидрохлорид 2,7-дигидрокси-N-{2-[4-[(2-тиенил-(имино)метил)амино]фенил]этил}-2-нафталинкарбоксамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 3,7-дигидрокси-2-нафтойной кислотой, заменяющей 5-метоксисалициловую кислоту. Получают желтое твердое вещество. Точка плавления: 219-219,7° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,98 (т, 2Н, СН2, J=7,30 Гц); 3,64 (м, 2Н, СН2); 7,09-7,60 (м, 9Н, аром.); 8,16 (м, 2Н, тиофен); 8,32 (с, 1Н, аром.); 8,90 (шир с, 1Н, NH+); 9,16 (шир с, 1Н, CONH); 9,60 (с, 1Н, -ОН); 9,80 (шир с, 1Н, NH+); 11,40 (шир с, 1Н, NH+); 11,77 (с, 1Н, ОН).
ИК: ν C=N (амидин): 1625 см-1; ν C=O (амид): 1657 см-1.
Пример 12: Гидрохлорид 2-гидрокси-4-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 2-гидрокси-4-метоксибензойной кислотой, заменяющей 5-метоксисалициловую кислоту. Точка плавления: >250° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,93 (т, 2Н, СН2, J=7,20 Гц); 3,54 (м, 2Н, СН2); 3,76 (с, 3Н, -ОСН3); 6,44 (м, 2Н, аром.); 7,40 (м, 5Н, аром.); 7,87 (д, 1Н, аром., J=8,80 Гц); 8,17 (м, 2Н, тиофен); 8,91 (шир с, 1Н, CONH); 8,91 (шир с, 1Н, NH+); 9,82 (шир с, 1Н, NH+); 13,08 (с, 1Н, ОН).
ИК: ν C=N (амидин): 1599 см-1; ν C=O (амид): 1640 см-1.
Пример 13: Гидрохлорид 2-гидрокси-3-изопропил-5-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамида
Используемый экспериментальный протокол является таким же, как протокол, описанный в примере 1, с 2-гидрокси-3-изопропил-5-метоксибензойной кислотой (Can. J. Chem. (1972), 50, 1276-1282), заменяющей 5-метоксисалициловую кислоту. Получают белое твердое вещество. Точка плавления: 170-175° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,15 (д, 6Н, изопропил, J=6,88 Гц); 2,96 (т, 2Н, CH2, J=7,36 Гц); 3,23 (м, 1Н, изопропил); 3,57 (м, 2Н, СН2); 3,75 (с, 3Н, -ОСН3); 6,93 (с, 1Н, аром.); 7,39 (м, 6Н, аром.); 8,17 (м, 2Н, тиофен); 8,90 (шир с, 1Н, NH+); 9,27 ((шир т, 1Н, CONH, J=5,14 Гц); 9,90 (шир с, 1Н, NH+); 11,60 (шир с, 1Н, NH+); 13,00 (с, 1Н, ОН).
ИК: ν C=N (амидин): 1594 см-1; ν C=O (амид): 1648 см-1.
Пример 14: Гидрохлорид N-(2-гидрокси-3-трет-бутил-5-метокси)-4-{[2-тиенил(имино)метил]амино}бензолбутанамида
14.1.) N-(2-Метоксиметокси-3-трет-бутил-5-метокси)-4-нитро-бензолбутанамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1.1, с 4-(4-нитрофенил)бутановой кислотой, заменяющей 5-метоксисалициловую кислоту, и 2-метоксиметокси-3-трет-бутил-5-метоксианилином (Biorg. and Med. Chem. (1998), 6, 849-868), заменяющим гидрохлорид 4-нитрофенетиламина. Получают красное масло с выходом 82%.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,32 (с, 9Н, трет-бутил); 1,93 (м, 2Н, СН2); 2,37 (м, 2Н, СН2); 3,53 (с, 3Н, ОСН3); 3,68 (с, 3Н, ОСН3); 4,903 (с, 2Н, OCH2O-); 6,57 (с, 1Н, аром.); 7,38 (с, 1Н, аром.); 7,51 (д, 2Н, аром., J=8,50 Гц); 8,16 (м, 2Н, аром., J=8,50 Гц); 9,28 (с, 1Н, NHCO).
14.2) N-(2-Гидрокси-3-трет-бутил-5-метокси)-4-нитробензолбутанамид
Концентрированную хлористовородную кислоту (0,6 мл) добавляют к 1,49 г (3,86 ммоль) N-(2-метоксиметокси-3-трет-бутил-5-метокси)-4-нитробензолбутанамида в метаноле (30 мл). Реакционную среду перемешивают в течение ночи при 25° С. Растворители выпаривают и остаток промывают последовательно 3× 40 мл воды, затем 40 мл рассола. Органический раствор сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении с получением коричневого масла, которое является достаточно чистым, чтобы его использовать непосредственно в следующей стадии.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,34 (с, 9Н, трет-Вu); 1,76 (м, 2Н, СН2); 2,44 (м, 2Н, СН2); 2,78 (м, 2Н, СН2); 3,65 (с, 3Н, ОСН3); 6,61 (с, 1Н, аром.); 6,66 (с, 1Н, аром.); 7,53 (д, 2Н, аром., J=8,62 Гц); 8,18 (д, 2Н, аром., J=8,62 Гц); 8,56 (с, 1Н, NH-CO); 9,94 (с, 1Н, NH-CO).
14.3) N-(2-Гидрокси-3-трет-бутил-5-метокси)-4-аминобензолбутанамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1.2, с N-(2-гидрокси-3-трет-бутил-5-метокси)-4-нитробензолбутанамидом, заменяющим 2-гидрокси-5-метокси-N-{2-(4-нитрофенил)-этил}бензамид.
14.4) Гидрохлорид N-(2-гидрокси-3-трет-бутил-5-метокси)-4-{[2-тиснил(имино)метил]амино}бензолбутанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 3, с N-(2-гидрокси-3-трет-бутил-5-метокси)-4-аминобензолбутанамидом, заменяющим 2-гидрокси-5-метокси-N-{2-(4-аминофенил)этил}бензамид. Точка плавления 146-154° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,34 (с, 9Н, трет-бутил); 1,96 (м, 2Н, СН2); 2,70 (м, 2Н, СН2); 3,42 (м, 2Н, СН2); 3,65 (с, 3Н, ОСН3); 6,59 (с, 1Н, аром.); 6,83 (с, 1Н, аром.); 7,36-7,41 (м, 5Н, аром.); 8,17 (м, 2Н, тиофен); 8,75 (с, 1Н, NHCO); 8,90 (шир с, 1Н, NH+); 9,80 (шир с, 1Н, NH+); 10,35 (с, 1Н, ОН); 11,60 (шир с, 1Н, NH+).
ИК: ν C=N (амидин): 1596 см-1; ν C=O (амид): 1698 см-1.
Пример 15: Гидрохлорид 3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}-2Н-1-бензопиран-2-карбоксамида
Используемый экспериментальный протокол является таким же, как протокол, использованный для примера 1.1, с TROLOX, заменяющим 5-метоксисалициловую кислоту. Получают белое твердое вещество. Точка плавления: 160-168° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,34 (с, 3Н, СН3); 1,70 (м, 1Н, СН2-Тrоlох); 1,99 (с, 3Н, СН3); 2,07 (с, 6Н, СН3×2); 2,13 (м, 1Н, CH2-Trolox); 2,40 (м, 1Н, CH2-Trolox); 2,60 (м, 1Н, CH2-Trolox); 2,72 (м, 2Н, СН2); 3,31 (м, 2Н, CH2); 4,30 (шир с, 1Н, NH+); 7,20-7,23 (м, 6Н, аром.); 7,57 (с, 1Н, -ОН); 8,17 (м, 2Н, тиофен); 8,90 (шир с, 1Н, NH+); 9,80 (шир с, 1Н, NH+).
ИК: ν C=N (амидин): 1599 см-1; ν C=O (амид): 1653 см-1.
Пример 16: Гидрохлорид 3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-d[4-[(2-тиенил(имино)метил)амино]фенил]этил}-2Н-1-бензопиран-2-карбоксамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, с TROLOX, заменяющим 5-метоксисалициловую кислоту. Получают белое твердое вещество. Точка плавления: 128-130° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,45 (с, 3Н, СН3); 1,95 (м, 2Н, Ω СН2-СН3); 2,00 (с, 3Н, СН3); 2,10 (с, 6Н, 2× СН3); 2,50( м, 2Н, Ω СН2-СН2); 4,25 (м, 2Н, CH2-N); 6,35 (шир с, 2Н, ОН + NH+); 6,65 (д, 2Н, аром.); 6,90 (д, 2Н, аром.); 7,10 (м, 1Н, аром.); 7,60 (м, 2Н, аром.); 7,75 (шир с, 2Н, NH+).
ИК: ν C=N (амидин): 1617 см-1; ν C=O (амид): 1654 см-1.
Пример 17: Гидроиодид N-(4-гидроксифенил)-2-тиофенкарбоксимидамида
Смесь, включающую 0,55 г (5 ммоль) 4-аминофенола и 1,42 г (5 ммоль) гидроиодида 3-метил-2-тиофентиокарбоксимида в растворе 20 мл изопропанола перемешивают в течение 2 часов при 40° С. Образованный осадок затем отделяют фильтрованием и промывают два раза 25 мл этилового эфира. После сушки ожидаемый продукт получают в форме белого порошка с выходом 77%.
Точка плавления: 258-259° С.
Пример 18: Гидрохлорид N-(2-гидроксифенил)-2-тиофенкарбокс-имидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 17, с 2-аминофенолом, заменяющим 4-аминофенол. Продукт реакции очищают на колонке с диоксидом кремния (элюент: дихлорметан/метанол; 9,1). Свободное основание затем превращают в соль с использованием 1М раствора НСl в безводном этиловом эфире.
Гидрохлорид получают в форме кремового порошка с выходом 20%.
Точка плавления: 206-207° С.
Пример 19: Гидроиодид N-(3-гидроксифенил)-2-тиофенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 17, с 3-аминофенолом, заменяющим 4-аминофенол. После сушки ожидаемый продукт получают в форме кремового порошка с выходом 72%. Т.пл. 198-100° С.
Пример 20: Гидрохлорид N-(3-гидрокси-4-метоксифенил)-2-тио-фенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 18, с 5-амино-2-метоксифенолом, заменяющим 2-аминофенол. После сушки ожидаемый продукт получают в форме кремового порошка с выходом 30%. Т.пл. 253-254° С.
Пример 21: Гидрохлорид N-(3-гидрокси-4-метилфенил)-2-тиофенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 18, с 3-амино-о-крезолом, заменяющим 2-аминофенол. После сушки ожидаемый продукт получают в форме кремового порошка с выходом 61%. Т.пл. 245-246° С.
Пример 22: Гидрохлорид N-(4-метоксифенил)-2-тиофенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 18, с п-анизидином, заменяющим 2-аминофенол. После сушки ожидаемый продукт получают в форме кремового порошка с выходом 40%. Т.пл. 78-79° С.
Пример 23: Гидроиодид N-(3,5-диметил-4-гидроксифенил)-2-тио-фенкарбоксимидамида
23.1) 4-Амино-2,6-диметилфенол
Раствор 1 г (6 ммоль) 2,6-диметил-4-нитрофенола в 20 мл этанола помещают в атмосферу водорода с давлением 1,5 бара (1,48 атм) в присутствии 10% Pd/C на время 1 час. Pd/C удаляют фильтрованием на целите и фильтрат концентрируют при пониженном давлении. Остаток упаривания кристаллизуется самопроизвольно, его промывают два раза 50 мл гептана и сушат в течение ночи в вакууме. Получают окрашенное в кремовый цвет твердое вещество с выходом 86%.
Точка плавления 139-140° С.
23.2) Гидроиодид N-(3,5-диметил-4-гидроксифенил)-2-тиофен-карбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 17, с 4-амино-2,6-диметилфенолом, заменяющим 4-аминофенол. После сушки ожидаемый продукт получают в форме белого порошка с выходом 65%.
Т.пл. 253-254° С.
Пример 24: Гидрохлорид N-(3,5-дихлор-4-гидроксифенил)-2-тио-фенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 18, с 4-амино-2,6-дихлорфенолом, заменяющим 2-аминофенол. После сушки ожидаемый продукт получают в форме кремового порошка с выходом 30%. Т.пл. >260° С.
Пример 25: Гидрохлорид N-(3,5-бис(1,1-диметилэтил)-4-гидроксифенил)-2-тиофенкарбоксимидамида
25.1) 4-Амино-2,6-бис-(1,1-диметилэтил)фенол
4-Нитро-2,6-бис-(1,1-диметилэтил)фенол (J. Org. Chem. (1968), 33 (1), 223-226) в количестве 3,6 г (14 ммоль) растворяют в 60 мл смеси (2,1) этанола и дихлорметана в склянке Парра на 250 мл в присутствии каталитического количества 10% Pd/C. Смесь перемешивают в течение 2 часов при 20° С при давлении водорода 20 фунтов на квадратный дюйм (1,406 кг/см2 ). После фильтрования на целите фильтрат концентрируют досуха при пониженном давлении. Полученный красновато-коричневый порошок суспендируют в гептане (30 мл), фильтруют и промывают таким же объемом гептана. Ожидаемый продукт получают в форме оранжево-розового порошка с выходом 50% (1,56 г).
Точка плавления: 123-124° С.
ЯМР 1H (100 МГц, СDСl3, δ ): 6,60 (с, 2Н, Ph); 4,65 (шир. с, 1Н, ОН); 3,15 (шир. с, 2Н, NH2); 1,42 (с, 18Н, 2х трет-Вu).
25.2) Гидрохлорид N-(3,5-бис-(1,1-диметилэтил)-4-гидроксифенил)-2-тиофенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 18, с 4-амино-2,6-бис-(1,1-диметилэтил)фенолом, заменяющим 2-аминофенол. После сушки ожидаемый продукт получают в форме бледно-желтого порошка с выходом 65%. Точка плавления: 258-259° С.
ЯМР 1H (400 МГц, СDСl3, δ ): 1,42 (с, 18Н, 2х трет-Вu); 7,18 (с, 2Н, Ph); 7,38 (с, 1Н, ОН); 7,39 (с, 1Н, тиофен), 8,18 (м, 2Н, тиофен), 8,80 (шир. с, 1Н, NH+); 9,70 (шир. с, 1Н, NH+); 11,30 (шир. с, 1Н, NH+).
Пример 26: N-{4-[4-[(3,4-Дигидро-6-гидрокси-2,5,7,8-тетраметил-2Н-1-бензопиран-2-ил)метил]-1-пиперазинил]фенил}-2-тиофенкарбоксимидамид
26.1) 3,4-Дигидро-2,5,7,8-тетраметил-2-{4-[(фенилметил)-1-пиперазинил]карбонил}-2Н-1-бензопиран-6-ол
1,1’-Карбонилдимидазол в количестве 3,3 г (20,4 ммоль) добавляют к раствору 5 г (20 ммоль) тролокса в 40 мл ТГФ. После перемешивания в течение 1 часов при 23° С добавляют 3,52 г (20 ммоль) 1-бензилпиперазина, растворенного в 20 мл ТГФ. После перемешивания в течение 15 часов реакционную смесь концентрируют в вакууме. Остаток упаривания растворяют в 50 мл дихлорметана и раствор промывают два раза 50 мл воды. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток упаривания очищают на колонке с диоксидом кремния (элюент: этилацетат/гептан: 3,2). Получают 6,17 г белого порошка с выходом 75%.
Точка плавления: 63-65° С.
26.2) 3,4-Дигидро-2,5,7,8-тетраметил-2-{4-[(фенилметил)-1-пиперазинил]метил}-2Н-1-бензопиран-6-ол
Раствор 4 г (9,8 ммоль) промежуточного продукта 26.1 добавляют по каплям к суспензии 0,74 г (19,6 ммоль) LiAlH4 в 20 мл ТГФ при 0° С. После выдерживания 15 минут при 0° С реакционную смесь перемешивают в течение 18 часов при 23° С. Реакционную смесь затем охлаждают с использованием ледяной бани и гидролизуют последовательным добавлением 4 мл этилацетата, 0,8 мл воды, 0,8 мл 15% соды и, наконец, 2,4 мл воды. Реакционную смесь затем фильтруют на целите и осадок промывают 3 раза 25 мл этилацетата. Фильтрат концентрируют в вакууме и остаток очищают на колонке с диоксидом кремния (элюент: этилацетат/гептан: 1,1). Получают оранжевое масло с выходом 65%.
26.3) 3,4-Дигидро-2,5,1, 8-тетраметил-2-[(1-пиперазинил)метил] -2Н-1-бензопиран-6-ол
10% Pd/C в количестве 0,4 г добавляют к раствору 2,52 г (6,39 ммоль) промежуточного продукта 26.2 в 15 мл уксусной кислоты. Смесь перемешивают при давлении водорода 3 бара (2,96 атм) в течение 1 часа. Катализатор удаляют фильтрованием и фильтрат концентрируют в вакууме. Остаток распределяют в смеси 80 мл этилацетата и 100 мл 2 н NaOH. После декантирования органический раствор промывают два раза 150 мл воды, сушат над сульфатом натрия и фильтруют. Фильтрат концентрируют в вакууме и остаток очищают на колонке с диоксидом кремния (элюент: дихлорметан/метанол/NН4ОН (28%): 25/1/0,5). Получают белое твердое вещество с выходом 62%.
26.4) 3,4-Дигидро-2,5,7,8-тетраметил-2-{4-[(4-нитрофенил)-1-пиперазинил]метил}-2Н-1-бензопиран-6-ол
Промежуточный продукт 26,3 в количестве 0,6 г (1,97 ммоль), 0,54 г (3,94 ммоль) карбоната калия и 0,31 г (2,17 ммоль) 1-фтор-4-нитробензола растворяют в 20 мл ДМФ. Реакционную смесь нагревают при 100° С в течение 16 часов. После охлаждения до 23° С смесь разбавляют 30 мл воды и 30 мл этилацетата. Органическую фазу декантируют, промывают два раза 20 мл воды, сушат над сульфатом натрия и фильтруют. Фильтрат концентрируют в вакууме и остаток упаривания очищают на колонке с диоксидом кремния (элюент: этилацетат/-гептан: 1/1). Получают желтый продукт с выходом 52%.
Точка плавления: 72-75° С.
26.5) 3,4-Дигидро-2,5,7,8-тетраметил-2-{4-[(4-аминофенил)-1-пиперазинил]метил}-2Н-1-бензопиран-6-ол
Экспериментальный протокол является идентичным с протоколом, описанным для промежуточного продукта 1.2, с промежуточным продуктом 26.4, заменяющим промежуточный продукт 1.1. Желтое твердое вещество получают с выходом 37%.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,30 (с, 3Н, СН3); 2,00 (м, 4Н, CH2-CH2); 2,10 (с, 6Н, 2x СН3); 2,60 (с, 2Н, СН2); 2,75 (м, 6Н, пиперазин, NH2); 3,00 (м, 4Н, пиперазин); 4,00 (шир с, 1Н, ОН); 6,70 (м, 4Н, аром).
26.6) N-{4-[4-[(3,4-Дигидро-6-гидрокси-2,5,7,8-тетраметил-2Н-1-бензопиран-2-ил)метил]-1-пиперазинил]фенил}-2-тиофенкарбоксимидамид
Экспериментальный протокол является таким же самым, как протокол, описанный для промежуточного продукта 1.3, за исключением того, что продукт остается в форме свободного основания. Получают желтый порошок с выходом 55%.
Точка плавления: 100-102° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,25 (с, 3Н, СН3); 1,90 (м, 2Н, Ω CH2-CH2); 2,14 (с, 3Н, СН3); 2,15 (с, 3Н, СН3); 2,20 (с, 3Н, СН3); 2,60 (с, 2Н, NH2); 2,65 (шир с, 2Н, Ω CH2-CH2); 2,80 (м, 4Н, пиперазин, NH2); 3,15 (м, 4Н, пиперазин); 4,80 (шир с, 1Н, ОН); 6,90 (с, 4Н, аром.); 7,05 (м, 1Н, тиофен); 7,40 (м, 2Н, тиофен).
(МН)+: 505,3.
Пример 27: Гидрохлорид 1(2-гидрокси-4,6-диметоксибензоил)-3-{4-[(имино-(2-тиенил)метил)амино]фенокси}азетидина
27.1) 1-(Дифенилметил)-3-(4-нитрофенокси)азетидин
1-(Дифенилметил)-3-гидроксиазетидин в количестве 0,5 г (2 ммоль) добавляют к суспензии 0,06 г (2,3 ммоль) NaH в 20 мл сухого ТГФ в атмосфере аргона. После перемешивания в течение одного часа при 23° С к реакционной смеси добавляют по каплям раствор 0,29 г (2,1 ммоль) 4-фторнитробензола в 5 мл сухого ТГФ. Перемешивание сохраняют в течение еще 2 часов при 23° С, и смесь, наконец, выливают в 25 мл воды. Продукт экстрагируют два раза 25 мл этилацетата, органическую фазу затем промывают два раза 25 мл рассола, сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Продукт очищают на колонке с диоксидом кремния (элюент: 12% этилацетат в гептане). Чистые фракции упаривают с получением бесцветного масла с выходом 40%.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 3,20 (м, 2Н, азетидин); 4,50 (с, 1Н, CH-(Ph)2); 4,80 (м, 2Н, азетидин); 4,90 (м, 1Н, СН-0); 6,80 (м, 2Н, Н аром.); 7,20-7,50 (м, 10Н, Н аром.); 8,20 (м, 2Н, Н аром.).
27.2) 1-(Дифенилметил)-3-(4-аминофенокси)азетидин
SnCl2·2H2O в количестве 3,59 г (16 ммоль) вводят в раствор промежуточного продукта 27.1 (1.14 г; 3,18 ммоль) в 50 мл смеси этилацетат/этанол/ацетон (2,1,2). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 5 часов и, наконец, после охлаждения концентрируют до половины объема в вакууме. Остаток упаривания затем выливают в 50 мл холодного насыщенного раствора NаНСО3 и экстрагируют 100 мл этилацетата. Мутную смесь фильтруют на целите и фильтрат декантируют. Органическую фазу промывают последовательно 50 мл воды и 50 мл рассола. После сушки над сульфатом магния и фильтрования органический раствор концентрируют в вакууме. Получают бесцветное масло с выходом 75%.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 3,10 (м, 2Н, азетидин); 3,40 (шир с, 2Н, NH2); 4,40 (с, 1Н, СН-(Рh)2); 4,70 (м, 2Н, азетидин); 4,75 (м, 1Н, СН-O); 6,60 (с, 4Н, Н аром.); 7,10-7,40 (м, 10Н, Н аром.).
27.3) 1-(Дифенилметил)-3-{4-[(1,1-диметилэтокси)карбонил]-аминофенокси}азетидин
Защиту амина проводят стандартным способом с использованием ВосОВос в присутствии триэтиламиыа в дихлорметане. Белое твердое вещество получают с выходом 77%.
Точка плавления: 149-151° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,40 (с, 9Н, трет-Вu); 2,90 (шир с, 2Н, азетидин); 3,60 (шир с, 2Н, азетидин); 4,50 (м, 1Н, CH-(Ph)z); 4,70 (м, 1Н, СН-O); 6,70 (м, 2Н, Н аром.); 7,10-7,60 (м, 12Н, Н аром.); 9,10 (с, 1Н, NH).
27.4) 3-{4-[(1,1-Диметилэтокси)карбонил]аминофенокси}азетидин
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1.2, за исключением того, что катализатор гидрированием заменяют Pd(OH)2. Получают белое твердое вещество с выходом 78%.
Точка плавления: 184-186° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): δ ): 1,50 (с, 9Н, трет-Bu); 3,50 (м, 2Н, азетидин); 3,70 (м, 2Н, азетидин); 4,90 (м, 1Н, СН-O); 6,70 (м, 2Н, Н аром.); 7,30 (м, 2Н, Н аром.); 9,10 (с, 1Н, NH).
27.5) 1-(2-Гидрокси-4,6-диметоксибензоил)-3-{4-[(1,1-диметилэтокси)карбонил]аминофенокси}азетидин
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, с 2-гидрокси-4,6-диметоксибензойной кислотой, заменяющей 5-метоксисалициловую кислоту. Получают белое твердое вещество.
Точка плавления: 95° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,45 (с, 9Н, Воc); 3,72 (с, 3Н, -ОСН3); 3,73 (с, 3Н, -ОСН3); 3,90 (м, 2Н, азетидин); 4,20 (м, 1Н, азетидин); 4,40 (м, 1Н, азетидин); 5,00 (м, 1Н, азетидин); 6,07 (д, 2Н, аром., J=8,95 Гц); 6, 67 (д, 2Н, аром., J=8,95 Гц); 7,36 (м, 2Н, аром.); 9,2 (шир с, NH-Вос); 10,3 (шир с, 1Н, -ОН).
27.6) 1-(2-Гидрокси-4,6-диметоксибензоил)-3-аминофеноксиазетидин
Промежуточный продукт 27,5 (0,8 г; 1,8 ммоль) вводят в 20 мл дихлорметана в колбе в атмосфере аргона. Раствор охлаждают с использованием ледяной бани и по каплям добавляют трифторуксусную кислоту (0,7 мл: 9,0 ммоль). Перемешивание продолжают при нагревании до комнатной температуры в течение ночи. Реакционную смесь упаривают досуха, остаток растворяют в бикарбонате натрия и затем экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Очистку затем проводят на колонке с диоксидом кремния (элюент = хлороформ с 3% этанола) с получением белого твердого вещества с выходом 52%.
Точка плавления: 95° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 3,60 (м, 2Н, СН2, азетидин); 3,80 (с, 3Н, -ОСН3); 3,83 (с, 3H, -ОСН3); 4,20 (шир с, 2Н, CH2); 4,37 (м, 2Н, СН2, азетидин); 4,86 (м, 1Н, азетидин); 5,95 (с, 1Н, аром.); 6,15 (с, 1Н, аром.); 6,62 (м, 4Н, аром.); 11,61 (шир с, 1Н, -ОН).
27.7) Гидрохлорид 1-(2-гидрокси-4,6-диметоксибензоил)-3-{4-[(имино-(2-тиенил)метил)амино]фенокси}азетидина
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1,3, с промежуточным продуктом 27.6, заменяющим 2-гидрокси-5-метокси-N-{2-(4-аминофенил)этил}бензамид. Получают белое твердое вещество.
Точка плавления: 185-187,7° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 3,71 (с, 3H, -ОСН3); 3,73 (с, 3H, -OCH3); 3,85 (м, 2Н, СН2, азетидин); 4,32 (м, 2Н, СН2, азетидин); 5,08 (м, 1Н, СН, азетидин); 6,09 (м, 2Н, аром.); 7,02 (м, 2Н, аром.); 7,36 (м, 3H, аром.); 8,16 (м, 2Н, тиофен); 8,74 (шир с, 1Н, NH+); 9,72 (шир с, 1Н, NH+); 10,33 (с, 1Н, -ОН); 11,39 (шир с, 1Н, NH+).
ИК: ν C=N (амидин): 1590 см-1.
Пример 28: Гидрохлорид N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}бензолбутанамида
28.1) 2-Амино-4-метоксифенол
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1.2, с 4-метокси-2-нитрофенолом, заменяющим 2-гидрокси-5-метокси-N-{2-(4-нитрофенил)этил}бензамид
28.2) N-(2-Гидрокси-5-метокси)-4-нитробензолбутанамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1.1, с 4-(4-нитрофенил)бутановой кислотой, заменяющей 5-метоксисалициловую кислоту, и с 2-амино-4-метоксифенолом, заменяющим гидрохлорид 4-нитрофенетиламина.
28.3) N-(2-Гидрокси-5-метокси)-4-аминобензолбутанамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1.2, с N-(2-гидрокси-5-метокси)-4-нитробензолбутанамидом, заменяющим 2-гидрокси-5-метокси-Н-{2-(4-нитрофенил)этил}-бензамид.
28.4) Гидрохлорид N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино) метил]амино}бензолбутанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, с N-(2-гидрокси-5-метокси)-4-аминобензолбутанамидом, заменяющим 2-гидрокси-5-метокси-N-{2-(4-аминофенил)этил}-бензамид.
Точка плавления: 199,1-200,7° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,9 (м, 2Н, СН2); 2,45 (м, 2Н, СН2); 2,70 (м, 2Н, СН2); 3,64 (с, 3H, -OCH3); 6,51 6,9 (м, 2Н, аром.); 7,36 (м, 3H, аром.); 8,17 (м, 2Н, тиофен); 8,88 (шир с, 1Н, NH+); 9,38 (с, 2Н, -ОН & CONH); 9,81 (шир с, 1Н, NH+); 11,52 (шир с, 1Н, NH+).
ИК: ν C=N (амидин): 1662 см-1; ν C=O (амид): 1693 см-1.
Пример 29: N-(2-Гидрокси-5-метокси)-4-{[2-тиенил(имино)метил] амино}бензолпропанамид
29.1) N-(2-Гидрокси-5-метокси)-4-N-Вос-бензолпропанамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 28.2, с 3-(4-трет-бутоксикарбониламино)фенилпропановой кислотой, заменяющей 4-(4-нитрофенил)бутановую кислоту.
29.2) N-(2-Гидрокси-5-метокси)-4-аминобензолпропанамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 14.2, с N-(2-гидрокси-5-метокси)-4-N-(4-трет-бутоксикарбониламино) бензолпропанамидом, заменяющим N-(2-метоксиметокси-3-трет-бутил-5-метокси)-4-нитробензолбутанамид.
29.3) Гидрохлорид N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)-метиламино}бензолпропанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 28, с N-(2-гидрокси-5-метокси)-4-аминобензолпропанамидом, заменяющим N-(2-гидрокси-5-метокси)-4-аминобензолбутанамид.
Точка плавления: 197,6-197,8° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,49 (м, 2Н, СН2); 2,70 (м, 2Н, CH2); 3,61 (с, 3H, -OCH3); 6,50 7,00 (м, 2Н, аром.); 7,40 (м, 6Н, аром.); 8,90 (шир с, 1Н, NH+); 9,40 (с, 2Н, -ОН и -CONH); 9,90 (шир с, 1Н, NH+); 11,60 (шир с, 1Н, NH+).
ИК: ν C=N (амидин): 1660 см-1; ν C=O (амид): 1685 см-1.
Пример 30: трет-Бутил-2-{[4-{[амино(2-тиенил)метилиден]амино}фенетил)амино]карбонил}-4-метоксифенилкарбамат
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, с 2-[(трет-бутоксикарбонил)амино]-5-метоксибензойной кислотой (получена стандартным способом из коммерческой 2-амино-5-метоксибензойной кислоты), заменяющей 5-метоксисалициловую кислоту. Белое твердое вещество.
Точка плавления: 190-192° С.
Пример 31: 2-Амино-N-(4-{[амино(2-тиенил)метилиден]амино}-фенетил)-5-метоксибензамид
Соединение 31 получают из соединения 30, которое обрабатывают стандартным способом хлористовородной кислотой в органическом растворе, продукт реакции затем очищают на колонке с диоксидом кремния (элюент: CH2Cl2/MeOH/NH4OH: 80/20/0,5). Белое твердое вещество.
Точка плавления: >200° С.
Пример 32: 5-Амино-N-(4-{[амино(2-тиенил)метилиден]амино}-фенетил)-2-гидроксибензамид
Используемый экспериментальный протокол является идентичным протоколу, описанному для примера 31, с 5-[(трет-бутоксикарбонил)амино]-2-гидроксибензойной кислотой, заменяющей 2-амино-5-метоксибензойную кислоту в первой стадии. Желтоватое белое твердое вещество. Точка плавления >260° С.
Пример 33: N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-гидрокси-5-метокси-3-метилбензамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, с 2-гидрокси-5-метокси-3-метилбензойной кислотой (Can. J. Chem. (1972), 50, 1276-1282), заменяющей 5-метоксисалициловую кислоту. Бледно-желтое твердое вещество. Точка плавления: 175,2-175,8° С.
Пример 34: N-[2-(4-{[амино(2-тиенил)метилиден]амино}анилино)-2-оксоэтил]-3,5-ди-(трет-бутил)-4-гидроксибензамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, начиная с 3,5-ди-(трет-бутил)-4-гидроксибензойной кислоты и глицин-п-нитроанилида. Белое твердое вещество. Точка плавления: >250° С.
Пример 35: Гидрохлорид N’-{4-[4-(1,2,3,4-тетрагидро-2-нафта-линилкарбонил)-1-пиперазинил]фенил}-2-тиофенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, начиная с 1,2,3,4-тетрагидро-2-нафтойной кислоты и 4-нитрофенилпиперазина. Бледно-желтое твердое вещество. Точка плавления: 191-194° С.
Пример 36: 4-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-{4-[(метилсульфонил)амино]фенил}бутанамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, начиная с 4-нитрофенилбутановой кислоты и N-(4-аминофенил)метансульфонамида) Farmaco (1951), 6, 713-717). Бледно-желтое твердое вещество. Точка плавления: 187,3-187,5° С.
Пример 37: Гидрохлорид 4-(4-{[амино(2-тиенил(метилиден]амино}фенил)-N-[4-(диметиламино)фенил]бутанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, начиная с 4-нитрофенилбутановой кислоты и N,N-диметил-п-фенилендиамина. Розовое твердое вещество. Точка плавления: 175-179° С.
Пример 38: Гидрохлорид 5-(4-{[амино(2-тиенил(метилиден]амино}фенил)-N-[4-(диметиламино)фенил]пентанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, начиная с 4-нитрофенилпентановой кислоты (J. Med. Chem. (1978), 21 (5), 430-437) и N,N-диметил-п-фенилендиамина. Белое твердое вещество. Точка плавления: 166-168° С.
Соединения примеров от 39 до 43 синтезировали в соответствии с такой же стратегией, как стратегия, использованная для примера 1, за исключением стадии восстановления нитропроизводного, которую не проводят с водородом и Pd/C, но в присутствии SnCl2·2H2O, как указано в синтезе промежуточного продукта 27.2.
Пример 39: (Е)-N(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(2-гидроксифенил)-2-пропенамид
Белое твердое вещество. Точка плавления: 145-155° С.
Пример 40: (Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидроксифенил)-2-пропенамид
Белое твердое вещество. МН+: 392,12.
Пример 41: (Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(3,4-дигидроксифенил)-2-пропенамид
Желтое масло. МН+: 408,08.
Пример 42: (Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенамид
Бледно-желтое твердое вещество. Точка плавления: 196,4-197,6° С.
Пример 43: (4R)-2-(3-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино)фенил]-1,3-тиазолидин-4-карбоксамида
Соединение 43 получают из (4R)-2-(4-нитрофенил)тиазолидин-4-карбоновой кислоты (Liebigs Ann. Chem. (1987), 927-934).
Белое твердое вещество. Точка плавления: 195-197° С.
Пример 44: Дигидрохлорид N’-[4-(4-{2-[3,5-ди(трет-бутил)-4-гидроксифенокси]ацетил}-1-пиперазинил)фенил]-2-тиофенкарбоксимидамида
44.1) 2-[3,5-Ди(трет-бутил)-4-гидроксифенокси]уксусная кислота
Трифторуксусную кислоту в количестве 3,6 мл (46 ммоль) добавляют к раствору 1,56 г (4,64 ммоль) трет-бутил-2-[3,5-ди(трет-бутил)-4-гидроксифенокси]ацетата (получен в соответствии с J. Heterocycl. Chem. (1994), 31, 1439-1443) в 20 мл дихлорметана. Реакционную смесь перемешивают в течение 1 часа, концентрируют в вакууме и остаток растворяют в 50 мл Et2O. Органический раствор экстрагируют два раза 25 мл насыщенного раствора NaHCO3, водную фазу затем промывают 25 мл Et2O. Раствор основного характера затем подкисляют при 0° С насыщенным раствором KHSO4 и, наконец, ожидаемый продукт экстрагируют с использованием два раза по 25 мл Et2O. Органический раствор сушат над сульфатом натрия, фильтруют и концентрируют в вакууме с получением белого порошка с выходом 70%. Точка плавления: 172-173° С.
44.2) Дигидрохлорид N’-[4-(4-{2-[3,5-ди(трет-бутил)-4-гидроксифенокси]ацетил}-1-пиперазинил)фенил]-2-тиофенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, начиная с промежуточного продукта 44.1 и 4-нитрофенилпиперидина.
Желтое твердое вещество. Точка плавления: 187-188° С.
Пример 45: N-{4-[4-(2-{[3,5-ди(трет-бутил)-4-гидроксифенил]-тио}ацетил)-1-пиперазинил}фенил}-2-тиофенкарбоксимидамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, начиная с 2-{[3,5-ди(трет-бутил)-4-гидроксифенил]тио}уксусной кислоты (получена в соответствии с J. Med. Chem. (1997), 40 (12), 1906-1918) и 4-нитрофенилпиперазина.
Желтое твердое вещество. Точка плавления: 67-69° С.
Пример 46: Гидрохлорид N’-(4-{4-[2-(4-гидрокси-2,3,5,6-тет-раметилфенокси)ацетил]-1-пиперазинил}фенил)-2-тиофенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, начиная с 2-(4-гидрокси-2,3,5,6-тетраметилфенокси)уксусной кислоты и 4-нитрофенилпиперазина.
Бледно-желтое твердое вещество. Точка плавления: 210-212° С.
Пример 47: Гидроиодид N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-[3,5-ди(трет-бутил)-4-гидроксифенокси]ацетамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, начиная с промежуточного продукта 44.1 и 4-нитрофенетиламина.
Желтое твердое вещество. Точка плавления: 158-159° С.
Пример 48: Гидрохлорид N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси] этил}амино)этил]фенил}-2-тиофенкарбоксимидамида
48.1) 2,6-Ди-(трет-бутил)-4-{2-[(4-нитрофенил)амино]этокси}-фенол
2-[3,5-Ди-трет-бутил)-4-гидроксифенокси]-N-(4-нитрофенетил)ацетамид (синтез промежуточного соединения 47) в количестве 1,92 г (4,5 ммоль) вводят в 80 мл безводного ТГФ в колбе в атмосфере аргона. Раствор 13,45 мл (13,45 ммоль) ВН3 в ТГФ добавляют к реакционной смеси, и смесь перемешивают при нагревании с кипячением с обратным холодильником в течение 4 часов 30 минут. В конце реакции добавляют 10 мл МеОН и нагревание продолжают в течение дополнительных 30 минут. Реакционную смесь затем концентрируют в вакууме, остаток растворяют в 30 мл 3 н смеси МеОН/НСl (2,1), и смесь нагревают при кипячении с обратным холодильником в течение дополнительного часа. Реакционную смесь охлаждают до 22° С, разбавляют 50 мл CH2Cl2 и добавляют 2 М водную соду до получения основного значения рН. После декантации органическую фазу промывают последовательно 20 мл воды и 20 мл рассола, сушат над сульфатом натрия и концентрируют в вакууме. Ожидаемый продукт очищают хроматографией на колонке с диоксидом кремния (элюент: CH2Cl2/EtOH: 25/1). Бледно-желтое твердое вещество.
48.2) трет-Бутил-2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этил(4-нитрофенетил)карбамат
Промежуточный продукт 48.1 в количестве 1,27 г (3 ммоль) растворяют в смеси 15 мл CH2Cl2 и 0,53 мл (3 ммоль) N,N-диизопропилэтиламина. Смесь охлаждают с использованием ледяной бани до добавления в виде одной порции 0,67 г (3 ммоль) (Вос)2O. Реакционную смесь перемешивают при 23° С в течение 5 часов. После концентрирования в вакууме остаток растворяют а 50 мл этилацетата и выливают в смесь вода-лед. Органическую фазу декантируют, промывают последовательно 20 мл воды и 20 мл рассола. После сушки над сульфатом натрия, фильтрования и концентрирования в вакууме получают желтое твердое вещество с количественным выходом.
48.3) трет-Бутил-4-аминофенетил-{2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этил}карбамат
Промежуточный продукт 48.2 в количестве 1,7 г (3 ммоль) и 0,8 мл (15 ммоль) гидразин-гидрата растворяют в 50 мл абсолютного этанола до добавления 0,2 г никеля Ренея. Реакционную смесь затем нагревают до кипячения с обратным холодильником до тех пор, пока исходный продукт целиком не исчезнет (4 часа 30 минут). После охлаждения в колбу добавляют небольшое количество диоксида кремния и растворитель, наконец, удаляют в вакууме. Полученный таким образом порошок помещают непосредственно в верхнюю часть хроматографической колонки. Продукт элюируют с использованием смеси AcOEt/гептан: 1/2. Ожидаемый продукт получают в форме оранжевого масла с выходом 83%.
48.4) трет-Бутил-4-{[амино(2-тиенил)метилиден]амино}фенетил-{2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этилкарбамат
Промежуточный продукт 48.3 в количестве 0,93 г (1,9 ммоль) и 0,60 г (2,1 ммоль) гидроиодида S-метил-2-тиофентиокарбоксимида (Ann. Chim. (1962), 1, 303-337) растворяют в 50 мл изопропанола. Реакционную смесь перемешивают в течение 15 часов при 60° С. После выпаривания растворителя в вакууме остаток растворяют в 60 мл AcOEt и 40 мл насыщенного раствора Nа2СО3. Смесь энергично перемешивают и, наконец, декантируют. Органическую фазу промывают последовательно 20 мл воды, 20 мл рассола, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Продукт используют непосредственно в следующей стадии без дополнительной очистки.
48.5) N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси]-этил}амино)этил]фенил}-2-тиофенкарбоксимидамид
Промежуточный продукт 48.4 в количестве 0,8 г (1,3 ммоль) растворяют в 20 мл этанола и добавляют 7 мл 3 н раствора хлористовородной кислоты. Смесь перемешивают в течение 1 часа при 23° С. После охлаждения с использованием ледяной бани раствор подщелачивают добавлением Na2CO3 в форме порошка и смесь, наконец, разбавляют 50 мл AcOEt. После энергичного перемешивания и декантации органическую фазу промывают 20 мл рассола, сушат над сульфатом натрия, фильтруют и концентрируют досуха. Остаток очищают на колонке с диоксидом кремния (элюент: AcOEt/гептан/NН2ОН: 12,5/12,5/0,5).
48.6 Гидрохлорид N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси] этил}амино)этил]фенил}-2-тиофенкарбоксимидамида
Промежуточный продукт 48.5 (0,29 г, 0,6 ммоль) растворяют в 30 мл абсолютного этанола, смесь охлаждают с использованием ледяной бани до добавления 2,4 мл (2,4 ммоль) 1 н раствора НСl в безводном эфире. После перемешивания в течение 30 минут при 23° С растворитель выпаривают в вакууме с получением розового твердого вещества. Точка плавления: 151-153° С.
Пример 49: трет-Бутил-3-{[амино(2-тиенил)метилиден]амино}-бензил-{3-{4-(диметиламино)анилино]-3-оксопропил}карбамат
49.1) трет-Бутил-3-[4-(диметиламино)анилино]-3-оксопропил-карбамат
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1.1, начиная с N-Boc-β -аланина и N.N-диметил-п-фенилендиамина. Белое твердое вещество. Точка плавления: 166-168° С.
49.2) 3-Амино-N-[4-(диметиламино)фенил]пропанамид
35 мл 6 н раствора НС1 добавляют к раствору 3,46 г (11,3 ммоль) промежуточного продукта 49.1 в 85 мл AcOEt. Реакционную смесь перемешивают в течение 15 минут при 23° С. После декантации водную фазу охлаждают, делают основным добавлением 2 н NaOH при 0° С. Продукт затем экстрагируют с использованием два раза по 100 мл CH2Cl2. Органический раствор затем промывают 25 мл рассола, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Получают оранжевый твердый продукт (73%), который используют как таковой в следующей стадии.
49.3) N-[4-(Диметиламино)фенил]-3-{(3-нитробензил)амино]пропанамид
Промежуточный продукт 49.2 в количестве 1,15 г (5,5 моля), 0,92 г (6 ммоль) 3-нитробензальдегида и 3 г предварительно активированного порошкообразного молекулярного сита 4 А последовательно добавляют в колбу, содержащую 100 мл безводного МеОН в атмосфере инертного газа. Реакционную смесь энергично перемешивают в течение 15 часов до добавления по частям 0,24 г (6 ммоль) NaBH4. Перемешивание продолжают в течение еще 4 часов до добавления 10 мл воды. Через четверть часа сита отделяют фильтрованием и реакционную смесь экстрагируют два раза 100 мл СН2Сl2. Органическую фазу промывают последовательно 50 мл воды, 50 мл рассола, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают на колонке с диоксидом кремния (элюент: CH2Cl2/EtOH: 20,1). Получают оранжевое вещество с выходом 86%.
49.4) трет-Бутил-3-{[амино(2-тиенил)метилиден]амино}бензил-{3-[4-(диметиламино)анилино]-3-оксопропил}карбамат
Используемый экспериментальный протокол является идентичным протоколу, описанному для синтеза промежуточных продуктов от 48.2 до 48.4. Получают белое твердое вещество. Точка плавления: 70-72° С.
Пример 50: Гидрохлорид 3-[(3-{[амино(2-тиенил)метилиден]амино}-бензил)амино]-N-[4-(диметиламино)фенил]пропанамида
Данное соединение получают превращением соединения 49 в соответствии с экспериментальным протоколом, описанным для промежуточных продуктов 48.5 и 48.6. Получают бежевое твердое вещество. Точка плавления: 142-144° С.
Пример 51: Гидрохлорид 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)-4-гидроксифенил]пропанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для соединения 50, с 4-амино-2,6-ди-трет-бутил)фенолом (промежуточный продукт 25.1), заменяющим N,N-диметил-п-фенилендиамин. Получают бежевое твердое вещество. Точка плавления: 166-169° С.
Пример 52: Гидрохлорид 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(4-метил-1-пиперазинил)фенил]пропанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для соединения 50, с 4-(4-метил-1-пиперазинил)анилина, заменяющим N,N-диметил-п-фенилендиамин. Получают светло-бежевое твердое вещество. Точка плавления: 195-197° С.
Пример 53: Гидрохлорид 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(4-морфолинил)фенил]пропанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для соединения 50, с 4-(4-морфолинил)анилином, заменяющим N,N-диметил-п-фенилендиамин. Получают светло-бежевое твердое вещество. Точка плавления: 190-192° С.
Пример 54: Гидрохлорид 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-метил-2,3-дигидро-1H-индол-5-ил) пропанамида
54.1) 1-Метил-5-нитроиндол
Безводный ДМФ в количестве 25 мл вводят в 150 мл трехгорлую колбу на 150 мл в атмосфере инертного газа с последующим добавлением 0,84 г (21 ммоль) 60% NaH. Реакционную смесь охлаждают с использованием ледяной бани до добавления по каплям раствора 3,28 г (20 ммоль) 5-нитроиндолина в 5 мл безводного ДМФ. После того, как это добавление заканчивается, перемешивание продолжают в течение 1 часа при 23° С до введения по каплям раствора 1,31 мл (21 ммоль) МеI в 5 мл безводного ДМФ. Перемешивание продолжают в течение 15 часов при 23° С. Реакционную смесь, наконец, нейтрализуют при 0° С 20 мл воды и 50 мл AcOEt. После декантации органическую фазу промывают последовательно 20 мл воды, 20 мл рассола, сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Получают темно-желтый порошок.
54.2) 1-Метил-5-аминоиндолин
Приблизительно 400 мг никеля Ренея добавляют к смеси 2,84 г (15,9 ммоль) 1-метил-5-нитроиндолина и 4 мл (80 ммоль) гидразин-гидрата в 60 мл абсолютного эфира. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 5 часов. После охлаждения до 23° С в колбу добавляют небольшое количество диоксида кремния и растворитель выпаривают в вакууме. Остаток выпаривания помещают непосредственно на верх хроматографической колонки. Ожидаемый продукт элюируют с использованием смеси гептан/AcOEt (3/7). Получают фиолетовый порошок (65%), который используют непосредственно в следующей стадии.
54.3) Гидрохлорид 3-[(3-{[амино(2-тиенил)метилиден]амино}-бензил)амино]-N-(1-метил-2,3-дигидро-1Н-индол-5-ил)пропанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для соединения 49, с 1-метил-5-аминоиндолином, заменяющим N,N-диметил-п-фенилендиамин. Снятие защиты и превращение в соль проводят в соответствии с экспериментальным протоколом, описанным для промежуточного продукта 48.5. Получают светло-бежевое твердое вещество. Точка плавления: 134-136° С.
Пример 55: Гидрохлорид 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-бензил-2,3-дигидро-1Н-индол-5-ил)пропанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для соединения 54, с бензилбромидом, заменяющим иодметан. Получают белое твердое вещество. Точка плавления: 193-195° С.
Пример 56: Гидрохлорид 3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для соединения 54, с 1-(хлорметил)нафталином, заменяющим иодметан. Получают бежевое твердое вещество. Точка плавления: 185-187° С.
Пример 57: N’-[4-(2-{[5-(диметиламино)-2-гидроксибензил]амино}этил)фенил]-2-тиофенкарбоксимидамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточных продуктов 49.3 и от 48,2 до 48.5, исходя из 4-нитрофенетиламина и 5-(диметиламино)-2-гидроксибензальдегида (Bull. Chem. Soc. Jpn. (1978), 51(8), 2433-2434).
Белое твердое вещество. Точка плавления: 182,3-182,6° С.
Соединения примеров от 58 до 65 синтезируют в соответствии с такой же стратегией, как стратегия, использованная для примера 57.
Пример 58: N-(4-{[4-{[амино(2-тиенил)метилиден]амино}фенетил)амино]метил}фенил)ацетамид
Белое твердое вещество. Точка плавления: 237,8-239° С.
Пример 59: N’-[4-(2-{[(8-гидрокси-2-хинолинил)метил]амино}-этил)фенил]-2-тиофенкарбоксимидамид
Бледно-желтое твердое вещество. Точка плавления: >230° С.
Пример 60: Гидроиодид N’-[4-(2-{[3-фенил-2-пропенил]амино}-этил)фенил]-2-тиофенкарбоксамидамида
Белое твердое вещество. Точка плавления: 151-153° С.
Пример 61: Дифумарат N’-[4-(2-{[3-(4-гидрокси-3-метоксифенил)-2-пропенил]амино}этил)фенил]-2-тиофенкарбоксимидамид
Белое твердое вещество. Точка плавления: 174-176° С.
Пример 62: Дифумарат N’-[4-(2-{[3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил]амино}этил)фенил]-2-тиофенкарбоксимидамид
Бежевое твердое вещество. Точка плавления: 182-184° С.
Пример 63: N’-[4-(2-{[5-(диметиламино)-2-гидрокси-3-метокси-бензил]амино}этил)фенил]-2-тиофенкарбоксимидамид
5-(Диметиламино)-2-гидрокси-3-метоксибензальдегид получают в соответствии с Bull. Chem. Soc. Jpn. (1978)? 51 (8)? 2433-2434).
Коричневая пена.
Пример 64: N’-(4-{2-[(2-гидрокси-4,6-диметоксибензил)амино]-этил}фенил)-2-тиофенкарбоксимидамид
Белое твердое вещество. Точка плавления >230° С.
Пример 65: N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид
Данное соединение получают из 6-гидрокси-2,5,7,8-тетраметил-2-хроманкарбальдегид (Bioorg. Med. Chem. Lett. (1998), 8, 3453-3458).
Белое твердое вещество. Точка плавления >230° С.
Пример 66: 4-(4-{2-[[(Е)-3-(4-гидрокси-3,5-диметоксифенил) -2-пропенил](метил)амино]этил}фенил)-2-тиофенкарбоксимидамид
Данное соединение получают из гидрохлорида N-метил-2-(4-нитрофенил)этиламина и (Е)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропеналя в соответствии с экспериментальными протоколами, описанных последовательно для промежуточных продуктов 49.3, 27.2 и 1.3 (продукт, остающийся в форме свободного основания).
Розовато-белое твердое вещество. Точка плавления: 153,2-154° С.
Пример 67: 4-{[4-{[Амино(2-тиенил)метилиден]амино}фенетил)-амино]метил}-1-пиридинийолат
67.1) N’-(4-{[(4-{[Амино(2-тиенил)метилиден]амино}фенетил)-амино]метил}-1-пиримидинийолат
Используемый экспериментальный протокол является таким же, как протокол, описанный для соединения 50, исходящий из изоникотинового альдегида и 4-нитрофенетиламина.
67.2) 4-{[4-{[Амино(2-тиенил)метилиден]амино}фенетил)амино]метил}-1-пиридинийолат
Промежуточный продукт 67.2 в количестве 0,1 г (0,23 ммоль) растворяют в атмосфере аргона в 10 мл хлороформа. Раствор охлаждают до 0° С до добавления по каплям 0,052 г (0,3 ммоль) метахлорпербензойной кислоты в 10 мл хлороформа. Реакционную смесь перемешивают в течение 30 минут при 0° С до выливания в смесь вода + лед. Продукт экстрагируют с использованием два раза по 20 мл СН2Сl2, органический раствор промывают 20 мл рассола, сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Остаток очищают на колонке с диоксидом кремния (элюент: CH2Cl2/EtOH/NH2OH: 0,5/9,5/0,5) для получения желтого масла с выходом 20%. MН+ = 453,18.
Пример 68: N’-[-(2-{[2-гидрокси-4,6-диметоксифенил)метилиден]-амино}этил)фенил]-2-тиофенкарбоксимидамид
Образование имина реакцией между 2-гидрокси-4,6-диметоксибензальдегидом и 4-нитрофенетиламином проводят в соответствии с экспериментальным протоколом, использованным для синтеза промежуточного продукта 49.3, за исключением добавления NаВH4. Другие стадии идентичны стадиям, описанным для синтеза промежуточных продуктов 27.2 и 1.3 (причем продукт остается в форме свободного основания).
Ярко-желтое масло, которое частично кристаллизуется.
Пример 69: трет-Бутил-4-{[амино(2-тиенил)метилиден]амино}фенетил(2-гидрокси-4,6-диметоксибензил)карбамат
Используемый экспериментальный протокол является таким же, как протокол, описанный для синтеза промежуточных продуктов 49,3 и 49.4, начинающийся с 2-гидрокси-4,6-диметоксибензальдегида и 4-нитрофенетиламина.
Бледно-желтая пена. МН+ = 512,23.
Пример 70: N’-{4-[4-фенил-3,6-дигидро-1(2Н)пиридинил]фенил}-2-тиофенкарбоксимидамид
70.1) 1-(4-Нитрофенил)-4-фенил-1,2,3,6-тетрагидропиридин
Смесь 0,5 г (2,5 ммоль) 4-фенил-1,2,3,6-тетрагидропиридина, 0,51 мл (2,8 ммоль) диизопропилэтиламина, 0,71 г (5 ммоль) К2СО3, 0,40 г (2,8 ммоль) 4-фторнитробензола в 10 мл ДМФ нагревают при 100° С в течение 24 часов. В конце реакции смесь выливают в 25 мл насыщенного раствора NаНСО3 и продукт экстрагируют с использованием 25 мл AcOEt. После декантации органический раствор промывают два раза 20 мл воды, затем 20 мл рассола, сушат над сульфатом магния, фильтруют и растворитель испаряют в вакууме с получением желтого твердого вещества с выходом 42%. Точка плавления: 185-192° С (разложение).
70.2) N’-{4-[4-Фенил-3,б-дигидро-1(2Н)пиридинил]фенил}-2-тиофенкарбоксимидамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточных продуктов 27.2 и 1.3 (причем продукт остается в форме свободного основания).
Пример 71: Дигидрохлорид N’-(4-{2-[4-фенил-3,6-дигидро-1(2Н)пиридинил]этил}фенил)-2-тиофенкарбоксимидамида
71.1) 1-(4-Нитрофенетил)-4-фенил-1,2,3,6-тетрагидропиридин
Гидрохлорид 4-фенил-1,2,3,6-тетрагидропиридина в количестве 1,29 г (6,6 ммоль), 0,92 мл (6,6 ммоль) Et3N и 1,62 мл (6,6 ммоль) трибутилфосфина добавляют к раствору 1,0 г (5,98 ммоль) 4-нитрофенетилового спирта в 25 мл CH2Cl2. Реакционную смесь энергично перемешивают при 23° С и по каплям добавляют 1,04 мл (6,6 ммоль) диэтилазодикарбоксилата. Спустя 4 часа реакцию останавливают добавлением 5 мл насыщенного раствора NH4Cl. После декантации водную фазу экстрагируют два раза 5 мл CH2Cl2, органические фазы объединяют и два раза промывают 5 мл воды, два раза по 5 мл рассола, сушат сульфатом магния, фильтруют и концентрируют в вакууме. Остаток очищают на колонке с диоксидом кремния (элюент гептан/AcOEt: от 9,1 до 7,3) с получением 1,20 г ожидаемого продукта.
71.2) Дигидрохлорид N’-(4-{2-[4-фенил-3,6-дигидро-1(2Н)пиридинил]этил}фенил)-2-тиофенкарбоксимидамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточных продуктов 27.2 и 1.3.
Бледно-желтое твердое вещество. Точка плавления 185° С (разложение).
Пример 72: N’-{4-{(1-бензгидрил-3-азетидинил)окси]фенил}-2-тиофенкарбоксимидамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1.3 (причем продукт выделяют в форме свободного основания), с использованием промежуточного продукта 27.2, заменяющего промежуточный продукт 1.2.
Белое твердое вещество. Точка плавления: 210-211° С.
Пример 73: Гидроиодид N’-[4-(2-хинолинилметокси)фенил]-2-тиофенкарбоксимидамид
73.1) 60% NaH в количестве 0,4 г (11 ммоль) вводят в колбу, содержащую 25 мл безводного ДМФ в атмосфере аргона. При перемешивании при 23° С добавляют по каплям раствор 1,38 г (10 ммоль) 4-нитрофенола в 5 мл безводного ДМФ. Спустя 30 минут по каплям добавляют раствор 1,77 г (10 ммоль) 2-(хлорметил)хинолина в 5 мл безводного ДМФ и перемешивание продолжают в течение 15 минут при нагревании смеси при 90° С. В конце реакции смесь выливают на лед, после чего образуется большое количество осадка. Суспензию фильтруют, промывают два раза по 25 мл воды, затем 20 мл этилового эфира. Белое твердое вещество таким образом получают с выходом 75%. Точка плавления 154-155° С.
73.2) Гидроиодид N’-[4-(2-хинолинилметокси)фенил]-2-тиофен-карбоксимидамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточных продуктов 1.2 и 1.3, за исключением того, что гидроиодид осаждается в реакции самопроизвольно, его поэтому выделяют в чистом виде во время простого фильтрования.
Пример 74: N’-(4-{4-[2-Гидрокси-2-метил-4-(2,4,5-триметил-3,6-диоксо-1,4-циклогексадиен-1-ил)бутаноил]-1-пиперазинил}-фенил-2-тиофенкарбоксимидамид
Используемый экспериментальный протокол является таким же, как протокол, описанный в литературе (Helv. Chim. Acta (1963), 46, 333), начинающийся с дигидрохлорида N’-[4-(4-{[(2S)-6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил]карбонил}-1-пиперазинил)фенил]-2-тиофенкарбоксимидамида (WO 98,42696, пример 27). Получают коричневую кристаллическую пену. МН+ = 534,20.
Пример 75: Фумарат N’-{4-[2-(1,3-диметил-2,6-диоксо-1,2,3,6-тетрагидро-7Н-пурин-7-ил)этил]фенил}-2-тиофенкарбоксимидамид
75.1) 1,3-Диметил-7-(4-нитрофенетил)-3,7-дигидро-1Н-пурин-2,6-дион
Смесь 0,59 г (3,26 ммоль) теофиллина, 1,5 г (6,52 ммоль) 2-(4-нитрофенил)этилбромида, 0,13 г (3,26 ммоль) гранул NaOH в 4 мл воды и 8 мл изопропанола нагревают для кипячения с обратным холодильником в течение 24 часов. После нагревания до 23° С нерастворимую часть удаляют фильтрованием и экстрагируют 25 мл СН2Сl2. Органическую фазу промывают 10 мл воды, затем 10 мл рассола. После сушки над сульфатом натрия, фильтрования и концентрирования досуха остаток очищают на колонке с диоксидом кремния (элюент: CH2Cl2/MeOH: 95/5). Белое твердое вещество получают с выходом 50%. 72.2:
75.2) Фумарат N’-{4-[2-(1,3-диметил-2,6-диоксо-1,2,3,6-тетрагидро-7Н-пурин-7-ил)этил]фенил}-2-тиофенкарбоксимидамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточных продуктов 1.2 и 1.3, за исключением того, что свободное основание превращают в соль в этаноле в присутствии фумаровой кислоты.
Белое твердое вещество. Точка плавления: 225-227° С.
Пример 76: N’-(4-{4-[2,6-Ди-(1-пирролидинил)-4-пиримидинил]-1-пиперазинил}фенил]-2-тиофенкарбоксимидамид
76.1) 4-[4-(4-Нитрофенил)пиперазинил]-2,6-ди-(1-пирролидинил)пиримидин
4-Хлор-2,6-дипирролидин-1-илпиримидин (J. Med. Chem. (1990), 33 (4), 1145-1151) в количестве 2,52 г (10 ммоль) и 2,07 г (10 ммоль) 4-нитрофенилпиперазина растворяют в 250 мл колбе, содержащей 20 мл безводного пиридина, в атмосфере аргона. Реакционную смесь нагревают при 100° С в течение 48 часов. После охлаждения содержимое колбы выливают в 250 мл воды и продукт экстрагируют с использованием два раза по 50 мл CH2Cl2. Органическую фазу затем промывают 50 мл рассола, сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Остаток очищают на колонке с диоксидом кремния (элюент: гептан/AcOEt: 2/1). Получают оранжевое твердое вещество с выходом 49%. Точка плавления: 200-201° С.
76.2) N’-(4-{4-[2,6-Ди-(1-пирролидинил)-4-пиримидинил]-1-пиперазинил}фенил)-2-тиофенкарбоксимидамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточных продуктов 1.2 и 1.3, за исключением того, что продукт выделяют в форме свободного основания.
Желтое твердое вещество. Точка плавления: 215-217° С.
Пример 77: Гидроиодид N’-{4-[2-({[4-(диметиламино)анилино]-карбонил}амино)этил]фенил}-2-тиофенкарбоксимидамида
77.1) N-[4-(Диметиламино)фенил)-N’-(4-нитрофенетил)мочевина
Фосген в количестве 0,9 г (3,3 ммоль) растворяют в 5 мл безводного CH2Cl2 в трехгорлой колбе на 100 мл в атмосфере аргона, и раствор перемешивают при 23° С. В течение 1 часа по каплям добавляют при помощи шприца с мотором раствор 2,09 г (10 ммоль) дигидрохлорида N,N-диметил-п-фенилендиамина и 5,2 мл (30 ммоль) диизопропилэтиламина в 20 мл безводного CH2Cl2. Спустя десять минут после завершения добавления добавляют в виде одной порции раствор 1,36 г (10 ммоль) 2-(4-аминофенил)этиламина и 1,8 мл диизопропилэтиламина в 5 мл безводного CH2Cl2. После перемешивания в течение 2 часов при 23° С образованный осадок удаляют фильтрованием, фильтрат промывают 10 мл воды, затем 10 мл рассола. Органический раствор сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Полученный остаток очищают быстрым пропусканием через колонку с диоксидом кремния (элюент: AcOEt).
Белое твердое вещество.
77.2) Гидроиодид N’-{4-[2-({[4-(диметиламино)анилино]карбонил}амино)этил]фенил}-2-тиофенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточных продуктов 1.2 и 1.3, за исключением того, что гидроиодид осаждается самопроизвольно во время реакции, его поэтому выделяют в чистом виде во время простого фильтрования.
Желтое твердое вещество. МН+ = 408.2.
Пример 78: Гидрохлорид N-{[1-(4-{[амино(2-тиенил)метилиден]-амино}фенил)циклобутил]метил}-6-гидрокси-2,5,7,8-тетраметил-2-хроманкарбоксамида
78.1) 2-[4-(2,5-Диметил-1Н=пиррол-1-ил)фенил]ацетонитрил
п-Аминобензилцианид в количестве 20 г (0,15 моль), 19 мл (0,17 моль) 2,5-диацетогексана и 2,88 г (0,015 моль) гидратированной п-толуолсульфоновой кислоты растворяют в 500 мл колбе. Данную смесь нагревают для кипячении с обратным холодильником, образованную воду улавливают в ловушке устройства Дина-Старка. В конце реакции растворитель выпаривают в вакууме и остаток растворяют в 300 мл AcOEt. Органический раствор промывают последовательно два раза по 200 мл воды, 200 мл насыщенного раствора Nа2СО3, 200 мл воды, 200 мл насыщенного раствора KHSO4 и, наконец, 200 мл воды м 200 мл рассола. После сушки над сульфатом натрия, фильтрования и концентрирования в вакууме остаток быстро очищают на колонке с диоксидом кремния. Получают светло-оранжевое твердое вещество с выходом 34%. Точка плавления 112-113° С.
78.2) 1-[4-(2,5-Диметил-1Н-пиррол-1-ил)фенил]циклопентанкарбонитрил
60% NaH в количестве 0,88 г (22 моль) вводят в 100 мл трехгорлую колбу, содержащую 20 мл безводного ДМСО в атмосфере аргона. Так быстро, как возможно, к этой суспензии при перемешивании добавляют 2,1 г (10 ммоль) промежуточного продукта 78.2 и 2,23 мл (11 ммоль) 1,3-дибромпропана в 10 мл безводного ДМСО. Скорость добавления регулируют в соответствии с температурой реакционной среды, которая должна оставаться в диапазоне 25-35° С. В конце реакции (1 час 30 минут) содержимое колбы выливают в 100 мл смеси вода + лед. Продукт экстрагируют 50 мл AcOEt и органический раствор промывают последовательно 5 раз 20 мл воды, 20 мл рассола, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают на колонке с диоксидом кремния (элюент: гептан/AcOEt: 9/1). Получают белое твердое вещество с выходом 55%. Точка плавления: 117-120° С.
78.3) {1-[4-(2,5-Диметил-1Н-пиррол-1-ил)фенил]циклопентил}-метанамин
Раствор 2,03 г (8,1 ммоль) промежуточного продукта 78.2 в 20 мл безводного ТГФ вводят по каплям при 0° С в 100 мл трехгорлую колбу в атмосфере аргона, содержащую 20 мл (20 ммоль) 1 М раствора LiAlH4 в безводном ТГФ. В конце добавления реакционную смесь перемешивают в течение 3 часов при 23° С. Реакционную смесь затем охлаждают с использованием ледяной бани и избыток LiAlH4 разрушают медленным добавлением 20 мл AcOEt, затем 10 мл 1 М водного раствора NaOH. После энергичного перемешивания в течение 30 минут при 23° С содержимое трехгорлой колбы фильтруют через целит, фильтрат разбавляют 40 мл AcOEt и 20 мл воды. После декантации органический раствор промывают 20 мл 1 М раствора NaOH, 20 рассола, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают на колонке с диоксидом кремния (элюент: CH2Cl2/EtOH: от 9,1 до 8,2).
Желтое масло получают с выходом 64%.
78.4): N-({1-[4-(2,5-диметил-1Н-пиррол-1-ил)фенил]циклопентил}метил)-6-гидрокси-2,5,7,8-тетраметил-2-хроманкарбоксамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 26.1, с промежуточным продуктом 78.3, заменяющим 1-бензилпиперазин. Белое твердое вещество получают с выходом 79%. Точка плавления: 90-94° С.
78.5) N-{[1-(4-Аминофенил)циклопентил]метил}-6-гидрокси-2,5,7,8-тетраметил-2-хроманкарбоксамид
Раствор 0,49 г (1 ммоль) промежуточного продукта 78.4 и 1,05 г (15 ммоль) гидрохлорида гидроксиламина в смеси 15 мл изопропанола и 1 мл воды нагревают при 100° С в течение 72 часов. После охлаждения растворитель испаряют в вакууме и остаток растворяют в 20 мл AcOEt и 20 мл воды. Органическую фазу декантируют и промывают 20 мл воды, затем 20 мл рассола, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток упаривания очищают на колонке с диоксидом кремния (элюент: гептан/AcOEt: 6/4). Ожидаемый продукт получают в форме желтого масла с выходом 50%.
78.6) Гидрохлорид N-{[1-(4-{[амино(2-тиенил)метилиден]амино}фенил)циклобутил]метил}-6-гидрокси-2,5,7,8-тетраметил-2-хроманкарбоксамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1.3, с промежуточным продуктом 78.5, заменяющим промежуточный продукт 1.2. Бежевое твердое вещество. Точка плавления: 185-187° С.
Пример 79: Гидрохлорид N’-{4-[4-(5-метокси-1Н-индол-3-ил)-1-пиперидинил]фенил}-2-тиофенкарбоксимидамида
79.1) 5-Метокси-3-(1,2,3,6-тетрагидро-4-пиридинил)-1H-индол
Используемый экспериментальный протокол описывается в литературе (Eur. J. Med. Chem. (1987), 22, 33-53), исходя из 5-метокси-1Н-индола и 4,4-пиперидиндиола.
79.2) 5-Метокси-3-[1-(4-нитрофенил)-1,2,3,6-тетрагидро-4-пиридинил]-1H-индол
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 26.4, исходящим из промежуточного продукта 79.1.
79.3) 4-[4-(5-Метокси-1H-индол-3-ил)-1-пиперидинил]фениламин
Цинк в количестве 9,2 г добавляют маленькими порциями к охлажденному ледяной баней раствору 0,7 г (2 ммоль) промежуточного продукта 79,2 в 35 мл уксусной кислоты. Эту смесь перемешивают в течение 18 часов при 20° С до фильтрования. Фильтрат концентрируют в вакууме и следы уксусной кислоты удаляют совыпариванием в присутствии толуола. Остаток выпаривания, наконец, растворяют в 100 мл CH2Cl2. Полученный органический раствор затем промывают последовательно 50 мл воды и 50 мл рассола. После сушки над МgSO4, фильтрования и выпаривания растворителя в вакууме остаток используют непосредственно в следующей стадии.
79.4) Гидрохлорид N’-{4-[4-(5-метокси-1Н-индол-3-ил)-1-пиперидинил]фенил}-2-тиофенкарбоксимидамида
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 1.3, причем промежуточный продукт 78.3 заменяют промежуточный продукт 1.2. Оранжевое твердое вещество. Точка плавления: 209-213° С.
Пример 80: N’-(4-{2-[[5-(Диметиламино)-2-гидрокси-3-метокси-бензил](метил)амино]этил}фенил)-2-тиофенкарбоксимидамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 57, исходя из 5-(диметиламино)-2-гидрокси-3-метоксибензальдегида (получен в соответствии с Bull. Chem. Jpn. (1978), 51 (8), 2433-2434) и гидрохлорида N-метил-2-(4-нитрофенил)этиламина. Темно-желтое твердое вещество. МН+: 439,2.
Пример 81: 4-(4-{[Амино(2-тиенил)метилиден]амино}фенил)-N-{1-[3-(диметиламино)пропил]-2,3-дигидро-1Н-индол-5-ил}бутанамид
81.1) N,N-Диметил-3-(5-нитро-2,3-дигидро-1Н-индол-1-ил)-1-пропанамин
5-Нитроиндолин в количестве 4,92 г (30 ммоль) вводят по частям в 250 мл двугорлую колбу в атмосфере аргона, содержащую суспензию 2,4 г (60 ммоль) NaH (60%) в 60 мл ДМФ. Энергичное выделение водорода сопровождается образованием красной суспензии. Перемешивание продолжают в течение 30 минут при 23° С до добавления в виде порций 4,74 г (30 ммоль) гидрохлорида 3-диметиламинопропилхлорида. Реакционную смесь перемешивают и нагревают при 60° С в течение 18 часов. Всю смесь, наконец, выливают в 200 мл смеси вода/лед. Продукт затем экстрагируют два раза 100 мл AcOEt. Органический раствор промывают последовательно 100 мл воды и 100 мл рассола. После сушки над МgSO4 и концентрирования в вакууме остаток упаривания очищают флэш-хроматографией на колонке с диоксидом кремния (элюент: AcOEt/MeOH: от 100,0 до 0,100). Темно-желтое масло получают с выходом 48%.
81.2) 1-[3-(Диметиламино)пропил]-5-индолинамин
Используемый экспериментальный протокол является таким же, как протокол, описанный для промежуточного продукта 54.2, причем промежуточный продукт 81.1 заменяет промежуточный продукт 54.1. Фиолетовое масло.
81.3) 4-(4-{[Амино(2-тиенил)метилиден]амино}фенил)-N-{1-[3-(диметиламино)пропил]-2,3-дигидро-1Н-индол-5-ил}бутанамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 1, исходящим из промежуточного продукта 81.2 и 4-нитрофенилбутановой кислоты.
Пример 82: 3-[(5-{[Амино(2-тиенил)метилиден]амино}-2-меток-сибензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1H-индол-5-ил]пропанамид
Используемый экспериментальный протокол является таким же, как протокол, описанный для примера 56, причем 2-метокси-5-нитробензальдегид (J. Org. Chem. (1993), 58, 1385-1392) заменяет 3-нитробензальдегид.
Фармакологическое изучение продуктов данного изобретения. Изучение влияния на нейронную конститутивную NO-синтазу мозжечка крыс
Ингибирующую активность продуктов данного изобретения определяют измерением их действия на превращение [3H]L-аргинина в [3H]L-цитруллин с помощью NO-синтазы по модифицированному способу Bredt и Snyder (Proc. Natl. Acad. Sci, USA, (1990), 87: 682-685). Мозжечок крыс Sprague-Dawley (300 г Charles River) быстро удаляют, рассекают при 4° С и гомогенизируют в объеме буфера для экстракции (50 мМ HEPES, 1 мМ ЭДТК, рН 7,4, 10 мг/мл пепстатина А, 10 мг/мл лейпептина). Гомогенаты затем центрифугируют при 21000 г в течение 15 мин при 4° С). Дозирование проводили в стеклянных трубках для испытания, в которых распределяют 100 мкл буфера для инкубации, содержащего 100 мМ HEPES (рН 7,4), 2 мМ ЭДТК, 2,5 мМ CaCl2, 2 мМ дитиотреита, 2 мМ восстановленного НАДФ и 10 мг/мл калмодулина. Добавляют 25 мкл раствора, содержащего 100 нМ {3H]L-аргинина (удельная активность: 56,4 Ки/ммоль, Amercham) и 40 мкМ нерадиоактивного L-аргинина. Реакцию инициируют добавлением 50 мкл гомогената, причем конечный объем составляет 200 мкл (недостающими 25 мкл являются либо вода, либо испытуемое соединение). Спустя 15 мин реакцию останавливают 2 мл останавливающего буфера (20 мМ HEPES, рН 5,5, 2 мМ ЭДТК). После пропускания образцов через 1 мл колонку DOWEX-смолы, радиоактивность количественно определяют жидкостным сцинтилляционным спектрометром. Соединения примеров 1-7, 10-12, 19, 21, 22, 26-28, 31. 32, 38-42, 48, 50-62, 65, 66, 68, 71 и 73, описанные выше, проявляют IС50 ниже, чем 3,5 мкМ.
Изучение влияния на липидное перокисление коры головного мозга крыс
Ингибирующую активность соединений данного изобретения определяют измерением их влияния на степень липидного перокисления, определяемую концентрацией малонового диальдегида (MDA). MDA, продуцированный перокислением ненасыщенных жирных кислот, представляет собой хороший указатель липидного перокисления (Н. Esterbauer and KH Cheeseman, Meth. Enzymol. (1990), 186: 407-421). Самцов крыс Sprague Dawley, весящих от 200 до 250 г (Charles River) умерщвляли декапитацией. Кору головного мозга удаляли, затем гомогенизировали с использованием керамической посуды Thomas в 20 мМ буфере Трис-HCl, рН 7,4. Гомогенат центрифугировали два раза при 50000 г в течение 10 минут при 4° С. Осадок центрифугирования хранили при -80° С. В день эксперимента осадок центрифугирования помещали в суспензию при концентрации 1 г/15 мл и центрифугировали при 515 г в течение 10 минут при 4° С. Супернатант используют сразу для определения липидного перокисления. Гомогенат коры головного мозга (500 мкл) инкубируют при 37° С в течение 15 минут в присутствии соединений, которые испытывают, или растворителя (10 мкл). Реакцию липидного перокисления инициируют добавлением 50 мкл FeCl2 при 1 мМ, ЭДТК при 1 мМ и аскорбиновой кислоты при 4 мМ. После инкубации в течение 30 минут при 37° С реакцию останавливают добавлением 50 мкл раствора гидроксилированного ди-трет-бутилтолуола (ВНТ, 0,2%). MDA количественно определяют с использованием колориметрической пробы реакцией хромогенного реагента (R), N-метил-2-фенилиндола (650 мкл) с 200 мкл гомогената в течение 1 часа при 45° С. Конденсация молекулы MDA с двумя молекулами реагента R образует стабильный хромофор, максимальная длина волны поглощения которого равна 586 нм (Caldwell et al. European J. Pharmacol. (1995), 285, 203-206). Соединения примеров 1, 3, 14-16, 25, 29, 32-34, 37-39, 41,42, 44-48, 50, 51, 54-57, 61, 62, 70, 74 и 76-78, описанные выше, все проявляют IC50, ниже чем 30 мкМ.
Изобретение относится к новым производным амидина общей формулы (I’)
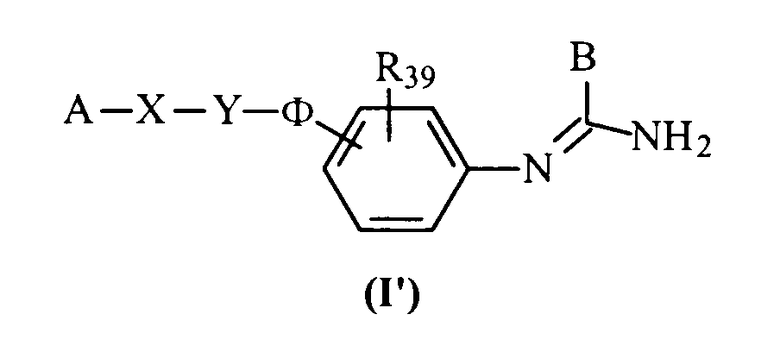
где А представляет:
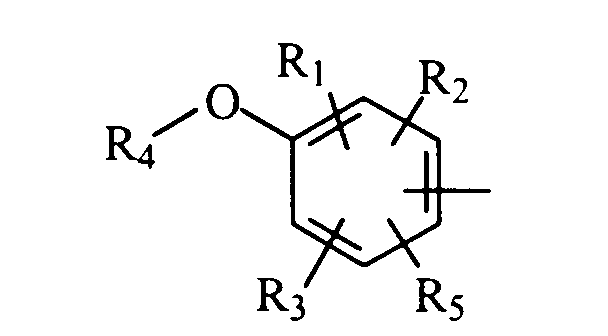
в котором R1, R2 и R3 – ОН или С1-C6 алкил, С1-C6 алкокси, R4 – H, С1-C6 алкил, R5 – H, С1-C6 алкил или радикал:
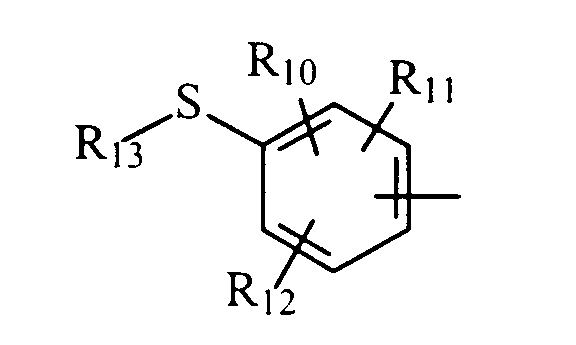
где R10, R11 и R12 – OH или Н, R13 – H, С1-C6 алкил; или радикал:
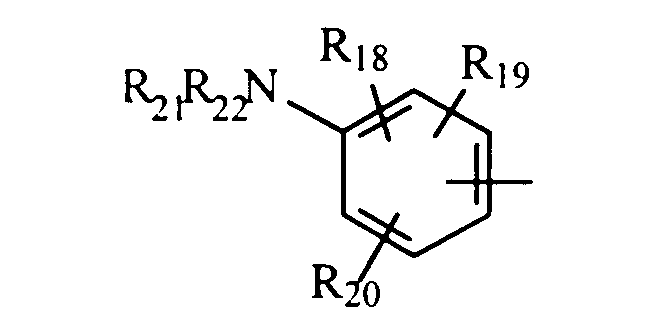
где R18, R19 и R20 – Н, ОН, С1-C6 алкил, R21 и R22 – Н, С1-C6 алкил или R21-алкилсульфонил, алкилсульфоксид, алкилкарбонил, а R22 – Н или радикал:
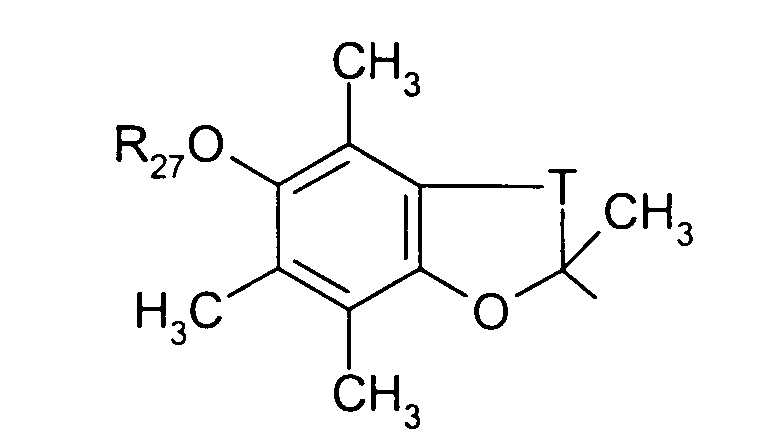
где Т – -(СН2)k-, k = 1, 2, R27 – Н, С1-C6 алкил.
Соединения обладают ингибирующей способностью в отношении NO-синтазы и липидного перокисления. 4 н. и 9 з.п. ф-лы.
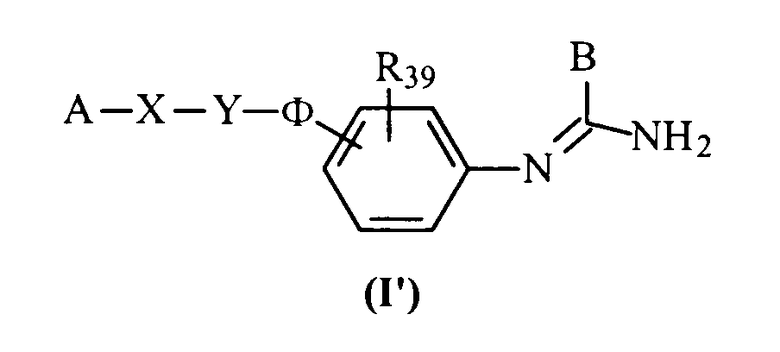
в которой А представляет либо радикал
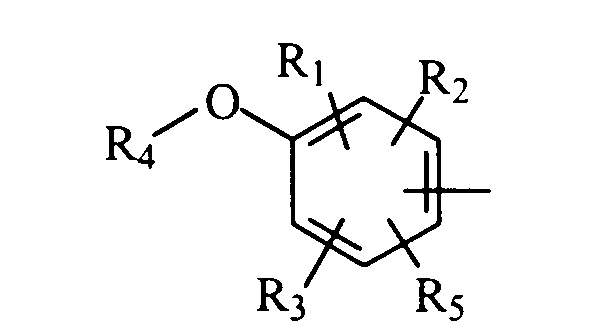
в котором R1, R2 и R3 представляют независимо группу ОН или неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R4 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
R5 представляет атом водорода или неразветвленный или разветвленный алкильный, имеющий от 1 до 6 атомов углерода;
либо радикал
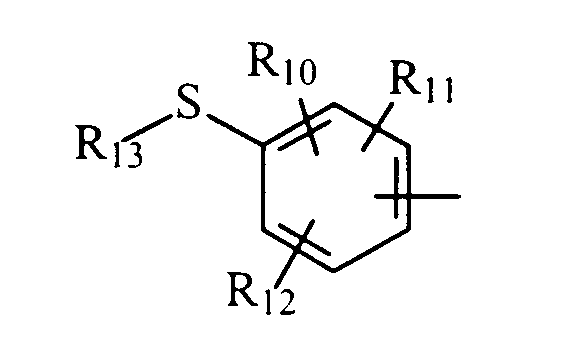
в котором R10, R11 и R12 представляют независимо атом водорода, группу OH;
R13 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
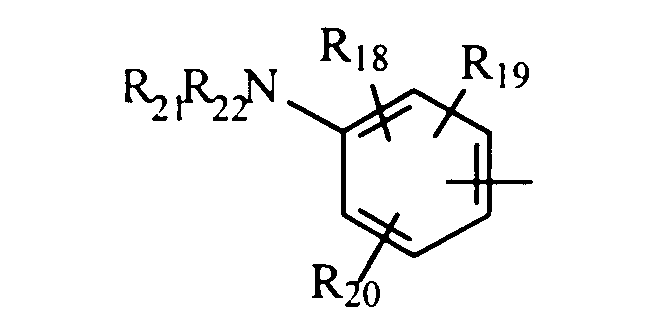
в котором R18, R19 и R20 представляют независимо атом водорода, группу OH или неразветвленный или разветвленный алкильный, алкенильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R21 и R22 представляют независимо атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или R21 представляет также алкилсульфонильный, алкилсульфоксидный или алкилкарбонильный радикал и тогда R22 представляет Н,
либо радикал
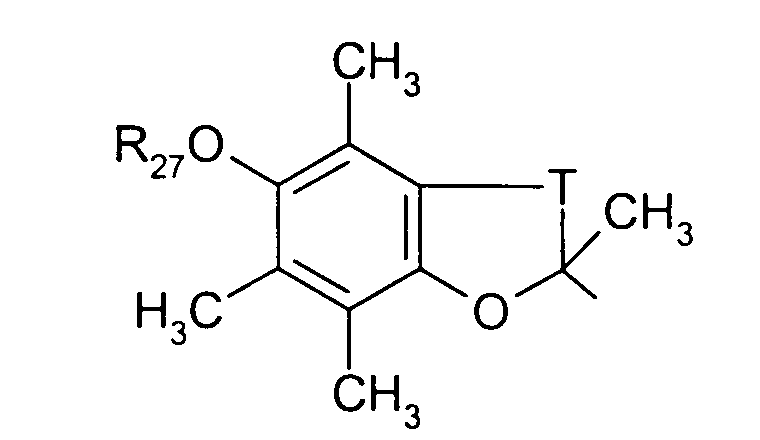
в котором Т представляет радикал -(СН2)k-, где k=1 или 2;
R27 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
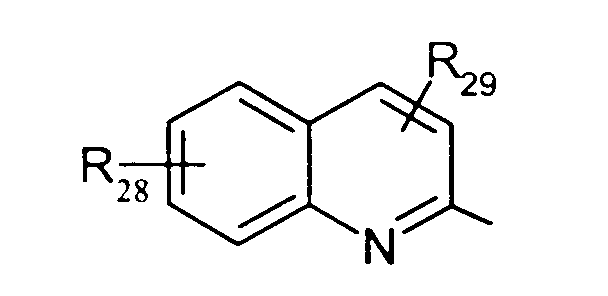
в котором R28 и R29 представляют независимо атом водорода или ОН-группу;
либо радикал
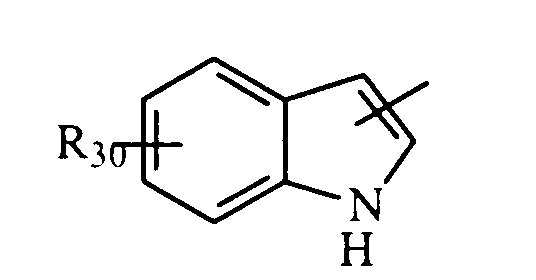
в котором R30 представляет атом водорода или неразветвленный или разветвленный алкоксирадикал, имеющий от 1 до 6 атомов углерода;
либо радикал
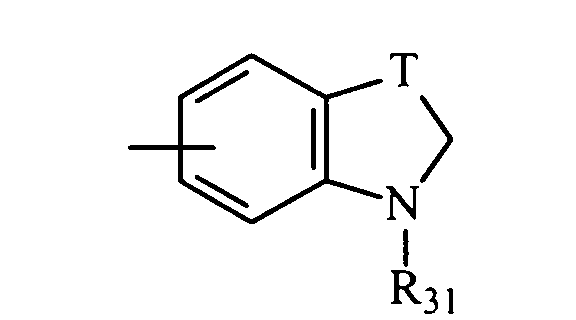
в котором Т представляет радикал -(СН2)k-, где k=1;
R31 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или арилалкильный, диарилалкильный, бис-арилалкильный, аминоалкильный, алкиламиноалкильный или диалкиламиноалкильный радикал;
либо радикал
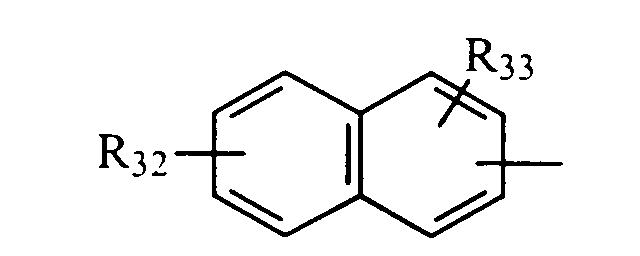
в котором R32 и R33 представляют независимо атом водорода или ОН-группу;
либо радикал
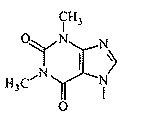

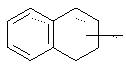
В представляет тиофен;
Х представляет связь или радикал -(СН2)m-, -(CH2)m-CO-, -O-(CH2)m-, -CO-NR36-, -O-(CH2)m-CO-, -S-(CH2)m-CO-, -NR36-(CH2)m-CO-, -(CH2)m-C(OH)(CH3)-CO-, -CH=CH- или -СН=N-;
Y представляет связь или радикал -(CH2)n- или -(CH2)r-Q-(CH2)s-;
Q представляет пиперазиновый, пиперидиновый, азетидиновый или насыщенное углеродное кольцо, имеющее от 3 до 5 членов;
Ф представляет связь или радикал -(CH2)p-O-(CH2)q-,
-(CH2)p-NR37-(CH2)q-, -(CH2)p-CO-NR37(CH2)q-;
R36 и R37 представляют независимо атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -СО-R38, в котором R38 представляет неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R39 представляет атом водорода или неразветвленный или разветвленный алкоксирадикал, имеющий от 1 до 6 атомов углерода;
причем m, n, p, q, r и s равны целым числам от 0 до 6;
причем предполагается, что
если А представляет радикал
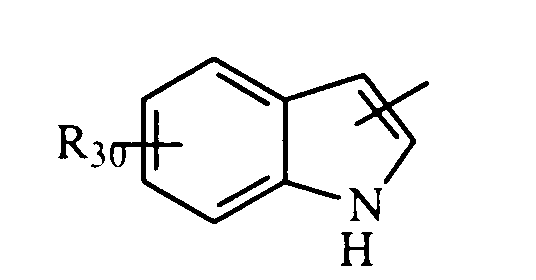
тогда Y представляет пиперидиновый радикал;
если А представляет радикал
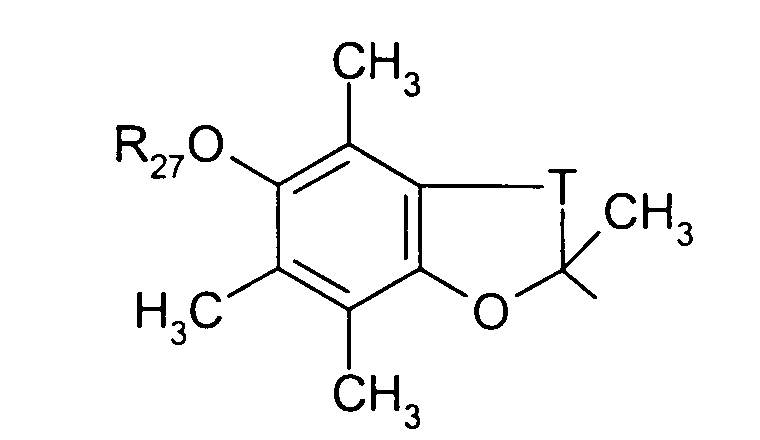
тогда Y представляет радикал -(CH2)r-Q-(CH2)s-, в котором Q представляет насыщенное углеродное кольцо, имеющее от 3 до 5 членов;
причем указанная формула (I') также включает следующие соединения:
2-гидрокси-5-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
2,5-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
2-гидрокси-3-изопропил-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамид;
2,6-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
2-гидрокси-4,6-диметокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамид;
2-гидрокси-3,5-ди-трет-бутил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
2-гидрокси-3,5-диизопропил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
2-гидрокси-4-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
2-гидрокси-3-изопропил-5-метокси-N-{2-[4-[(2-тиенил(имино)-метил)амино]фенил]этил}бензамид;
N-(2-гидрокси-3-трет-бутил-5-метокси)-4-{[2-тиенил(имино)-метил]амино}бензолбутанамид;
3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{2-[4-[(2-тиенил-(имино)метил)амино]фенил]этил}-2Н-1-бензопиран-2-карбоксамид;
3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{1-[4-[(2-тиенил(имино)метил)амино]фенил]метил}-2Н-1-бензопиран-2-карбоксамид;
N-(4-гидроксифенил)-2-тиофенкарбоксимидамид;
N-(2-гидроксифенил)-2-тиофенкарбоксимидамид;
N-(3-гидроксифенил)-2-тиофенкарбоксимидамид;
N-(3-гидрокси-4-метоксифенил)-2-тиофенкарбоксимидамид;
N-(3-гидрокси-4-метилфенил)-2-тиофенкарбоксимидамид;
N-(4-метоксифенил)-2-тиофенкарбоксимидамид;
N-(3,5-диметил-4-гидроксифенил)-2-тиофенкарбоксимидамид;
N-(3,5-дихлор-4-гидроксифенил)-2-тиофенкарбоксимидамид;
N-(2,6-бис-(1,1-диметилэтил)-4-гидроксифенил)-2-тиофенкарбоксимидамид;
N-{4-[4-[(3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-2Н-1-бензопиран-2-ил)метил]-1-пиперазинил]фенил}-2-тиофенкарбоксимидамид;
1-(2-гидрокси-4,6-диметоксибензоил)-3-{4-[(имино(2-тиенил)-метил)амино]фенокси}азетидин;
N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}бензолбутанамид;
N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}бензолпропанамид;
N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-гидрокси-5-метокси-3-метилбензамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(2-гидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(3,4-дигидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)-4-гидроксифенил]пропанамид;
N’-(4-{2-[(2-гидрокси-4,6-диметоксибензил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид,
или соли продуктов общей формулы (I').
либо радикал
в котором R1, R2 и R3 представляют независимо группу ОН или неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R4 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
R5 представляет атом водорода, группу ОН или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
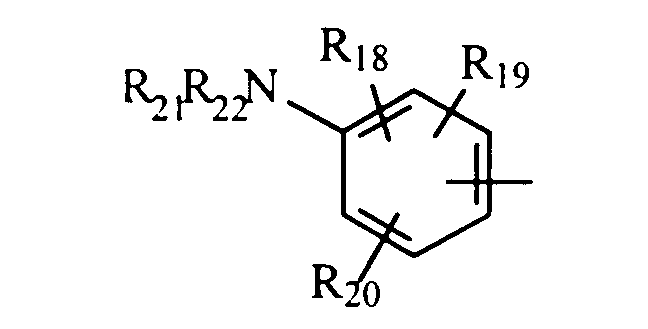
в котором R18, R19 и R20 представляют независимо атом водорода, OH-группу, неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R21 и R22 представляют независимо атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или R21 представляет также алкилсульфонильный или алкилкарбонильный радикал и тогда R22 представляет Н;
либо радикал
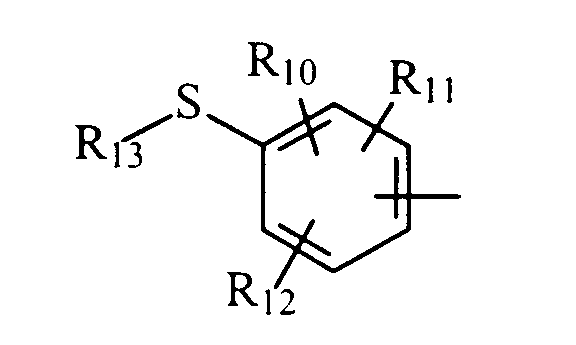
в котором R10, R11 и R12 представляют независимо атом водорода, группу OH,
R13 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
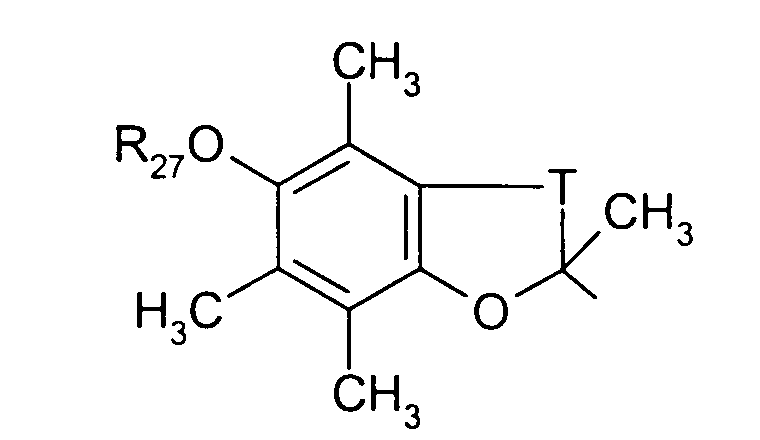
в котором Т представляет радикал -(СН2)k-, где k=2;
R27 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
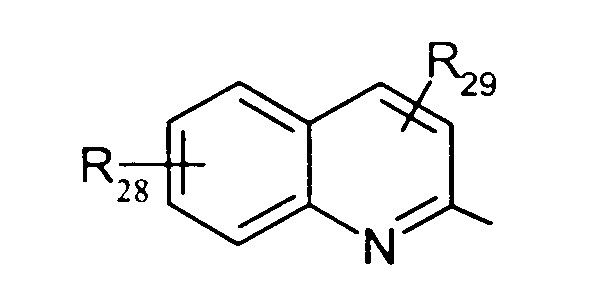
в котором R28 и R29 представляют независимо атом водорода или ОН-группу;
либо радикал
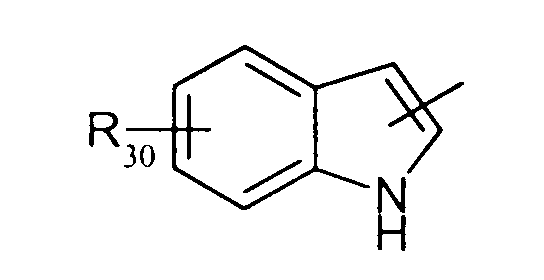
в котором R30 представляет атом водорода или неразветвленный или разветвленный алкоксирадикал, имеющий от 1 до 6 атомов углерода;
либо радикал
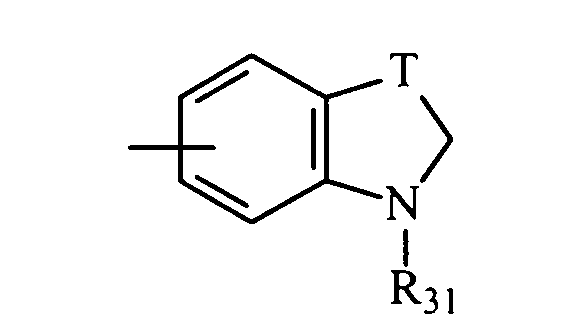
в котором Т представляет радикал -(СН2)k-, где k=1 или 2;
R31 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или арилалкильный, диарилалкильный, бис-арилалкильный, аминоалкильный, алкиламиноалкильный или диалкиламиноалкильный радикал;
либо радикал
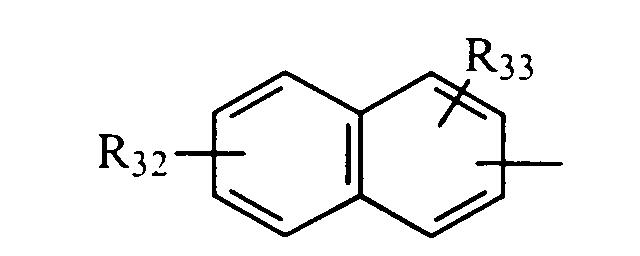
в котором R32 и R33 представляют независимо атом водорода или ОН-группу;
или радикал
В представляет тиофен,
Х представляет связь или радикал -(СН2)m-, -(CH2)m-CO, -O-(CH2)m-, -CO-NR36-, -O-(CH2)m-CO-, -S-(CH2)m-CO-, -NR36-(CH2)m-CO- или -(CH2)m-C(OH)(CH3)-CO-;
Y представляет связь или радикал -(CH2)n- или -(CH2)r-Q-(CH2)s-;
Q представляет пиперазиновый, пиперидиновый, азетидиновый или насыщенное углеродное кольцо, имеющее от 3 до 5 членов;
Ф представляет связь или радикал -(CH2)p-O-(CH2)q-;
R36 и R37 представляют независимо атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -СО-R38, в котором R38 представляет неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R39 представляет атом водорода или неразветвленный или разветвленный алкоксирадикал, имеющий от 1 до 6 атомов углерода,
причем m, n, p, q, r и s равны целым числам от 0 до 6;
или его соль.
2-гидрокси-5-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
2-гидрокси-5-метилтио-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
2,5-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
2-гидрокси-3-изопропил-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамид;
2,6-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
2-гидрокси-4,6-диметокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамид;
2-гидрокси-4,5,6-триметокси-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
2-гидрокси-3,5-ди-трет-бутил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
2-гидрокси-3,5-диизопропил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
2,4-дигидрокси-3,6-диметил-N-{2-[4-[(2-тиенил(имино)метил)-амино]фенил]этил}бензамид;
2,7-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}-2-нафталинкарбоксамид;
2-гидрокси-4-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
2-гидрокси-3-изопропил-5-метокси-N-{2-[4-[(2-тиенил(имино)-метил)амино]фенил]этил}бензамид;
N-(2-гидрокси-3-трет-бутил-5-метокси)-4-{[2-тиенил(имино)метил]амино}бензолбутанамид;
3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}-2Н-1-бензопиран-2-карбоксамид;
3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{1-[4-[(2-тиенил(имино)метил)амино]фенил]метил}-2Н-1-бензопиран-2-кар-боксамид;
N-(4-гидроксифенил)-2-тиофенкарбоксимидамид;
N-(2-гидроксифенил)-2-тиофенкарбоксимидамид;
N-(3-гидроксифенил)-2-тиофенкарбоксимидамид;
N-(3-гидрокси-4-метоксифенил)-2-тиофенкарбоксимидамид;
N-(3-гидрокси-4-метилфенил)-2-тиофенкарбоксимидамид;
N-(4-метоксифенил)-2-тиофенкарбоксимидамид;
N-(3,5-диметил-4-гидроксифенил)-2-тиофенкарбоксимидамид;
N-(3,5-дихлор-4-гидроксифенил)-2-тиофенкарбоксимидамид;
-N-(2,6-бис-(1,1-диметилэтил)-4-гидроксифенил)-2-тиофенкарбоксимидамид;
N-{4-[4-{(3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-2Н-1-бензопиран-2-ил)метил]-1-пиперазинил]фенил}-2-тиофенкарбоксимидамид;
1-(2-гидрокси-4,6-диметоксибензоил)-3-{4-{(имино(2-тиенил)-метил)амино]фенокси}азетидин;
N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}бензолбутанамид;
N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}бензолпропанамид;
трет-бутил-2-{[(4-{[амино(2-тиенил)метилиден]амино}фенетил)-амино]карбонил}-4-метоксифенилкарбамат;
2-амино-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-5-метоксибензамид;
5-амино-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-гидроксибензамид;
N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-гидрокси-5-метокси-3-метилбензамид;
N-[2-(4-{[амино(2-тиенил)метилиден]амино}анилино)-2-оксоэтил]-3,5-ди(трет-бутил)-4-гидроксибензамид;
N’-{4-[4-(1,2,3,4-тетрагидро-2-нафталинилкарбонил)-1-пиперазинил]фенил}-2-тиофенкарбоксимидамид;
4-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-{4-[(метилсульфонил)амино]фенил}бутанамид;
4-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино)фенил]бутанамид;
5-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино)фенил]пентанамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(2-гидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(3,4-дигидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенамид;
(4R)-2-(3-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино)фенил]-1,3-тиазолидин-4-карбоксамид;
N’-[4-(4-{2-[3,5-ди(трет-бутил)-4-гидроксифенокси]ацетил}-1-пиперазинил)фенил]-2-тиофенкарбоксимидамид;
N-{4-[4-(2-{[3,5-ди(трет-бутил)-4-гидроксифенил]тио}ацетил)-1-пиперазинил]фенил}-2-тиофенкарбоксимидамид;
N’-(4-{4-[2-(4-гидрокси-2,3,5,6-тетраметилфенокси)ацетил]—пиперазинил}фенил)-2-тиофенкарбоксимидамид;
N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-[3,5-ди(трет-бутил)-4-гидроксифенокси]ацетамид;
N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этил}амино)этил]фенил}-2-тиофенкарбоксимидамид;
трет-бутил-3-{[амино(2-тиенил)метилиден]амино}бензил-{3-[4-(диметиламино)анилино]-3-оксопропил}карбамат;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(диметиламино)фенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)-4-гидроксифенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(4-метил-1-пиперазинил)фенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(4-морфолинил)фенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-метил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-бензил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамид;
N’-[4-(2-{[5-(диметиламино)-2-гидроксибензил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N-(4-{[(4-{[амино(2-тиенил)метилиден]амино}фенетил)амино]метил}фенил)ацетамид;
N’-[4-(2-{[(8-гидрокси-2-хинолинил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[3-фенил-2-пропенил]амино}этил)фенил]-2-тиофен-карбоксимидамид;
N’-[4-(2-{[3-(4-гидрокси-3-метоксифенил)-2-пропенил]амино}-этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[5-(диметиламино)-2-гидрокси-3-метоксибензил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-(4-{2-[(2-гидрокси-4,6-диметоксибензил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-(4-{2-[[(E)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил](метил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
4-{[(4-{[амино(2-тиенил)метилиден]амино}фенетил)амино]метил}-1-пиридинийолат;
N’-[4-(2-{[(2-гидрокси-4,6-диметоксифенил)метилиден]амино}-этил)фенил]-2-тиофенкарбоксимидамид;
трет-бутил-4-{[амино(2-тиенил)метилиден]амино}фенетил-(2-гидрокси-4,6-диметоксибензил)карбамат;
N’-{4-[4-фенил-3,6-дигидро-1(2Н)-пиридинил]фенил}-2-тиофен-карбоксимидамид;
N’-(4-{2-[4-фенил-3,6-дигидро-1(2Н)-пиридинил]этил}фенил)-2-тиофенкарбоксимидамид;
N’-{4-{(1-бензгидрил-3-азетидинил)окси]фенил}-2-тиофенкарбоксимидамид;
N’-[4-(2-хинолинилметокси)фенил]-2-тиофенкарбоксимидамид;
N’-(4-{4-[2-гидрокси-2-метил-4-(2,4,5-триметил-3,6-диоксо-1,4-циклогексадиен-1-ил)бутаноил]-1-пиперазинил}фенил)-2-тиофенкарбоксимидамид;
N-{4-[2-(1,3-диметил-2,6-диоксо-1,2,3,6-тетрагидро-7Н-пурин-7-ил)этил]фенил}-2-тиофенкарбоксимидамид;
N’-(4-{4-[2,6-ди-(1-пирролидинил)-4-пиримидинил]-1-пиперазинил}фенил)-2-тиофенкарбоксимидамид;
N’-{4-[2-({[4-(диметиламино)анилино]карбонил}амино)этил]фенил}-2-тиофенкарбоксимидамид;
N-{[1-(4-{[амино(2-тиенил)метилиден]амино}фенил)циклобутил]метил}-6-гидрокси-2,5,7,8-тетраметил-2-хроманкарбоксамид;
N’-{4-[4-(5-метокси-1Н-индол-3-ил)-1-пиперидинил]фенил}-2-тиофенкарбоксимидамид;
N’-(4-{2-[[5-(диметиламино)-2-гидрокси-3-метоксибензил](метил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
4-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-{1-[3-(диметиламино)пропил]-2,3-дигидро-1Н-индол-5-ил}бутанамид;
3-[(5-{[амино(2-тиенил)метилиден]амино}-2-метоксибензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамид
или его соль.
2-гидрокси-5-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
2,5-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
2-гидрокси-3-диметокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}бензамид;
N-(2-гидрокси-3-трет-бутил-5-метокси)-4-{[2-тиенил(имино)-метил]амино}бензолбутанамид;
3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]этил}-2Н-1-бензопиран-2-карбоксамид;
3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-N-{1-[4-[(2-тиенил(имино)метил)амино]фенил]метил}-2Н-1-бензопиран-2-карбоксамид;
N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}бензолпропанамид;
5-амино-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-2-гидроксибензамид;
5-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино)фенил]пентанамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(2-гидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(3,4-дигидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенамид;
N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этил}амино)этил]фенил}-2-тиофенкарбоксимидамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(диметиламино)фенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)-4-гидроксифенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(4-метил-1-пиперазинил)фенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(4-морфолинил)фенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-метил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-бензил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамид;
N’-[4-(2-{[5-(диметиламино)-2-гидроксибензил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N-(4-{[(4-{[амино(2-тиенил)метилиден]амино}фенетил)амино]метил}фенил)ацетамид;
N’-[4-(2-{[(8-гидрокси-2-хинолинил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[3-фенил-2-пропенил]амино}этил)фенил]-2-тиофен-карбоксимидамид;
N’-[4-(2-{[3-(4-гидрокси-3-метоксифенил)-2-пропенил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-(4-{2-[[(E)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил](метил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
N’-(4-{2-[4-фенил-3,6-дигидро-1(2Н)-пиридинил]этил}фенил)-2-тиофенкарбоксимидамид;
N’-{4-[2-({[4-(диметиламино)анилино]карбонил}амино)этил]-фенил}-2-тиофенкарбоксимидамид;
N-{[1-(4-{[амино(2-тиенил)метилиден]амино}фенил)циклобутил]метил}-6-гидрокси-2,5,7,8-тетраметил-2-хроманкарбоксамид,
или его соль.
2-гидрокси-5-метокси-N-{2-[4-[(2-тиенил(имино)метил)амино]-фенил]этил}бензамид;
2,5-дигидрокси-N-{2-[4-[(2-тиенил(имино)метил)амино]фенил]-этил}бензамид;
N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}бензолпропанамид;
5-амино-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил-2-гидроксибензамид;
5-(4-{[амино(2-тиенил)метилиден]амино}фенил)-N-[4-(диметиламино)фенил]пентанамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(2-гидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(3,4-дигидроксифенил)-2-пропенамид;
(Е)-N-(4-{[амино(2-тиенил)метилиден]амино}фенетил)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенамид;
N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этил}амино)этил]фенил}-2-тиофенкарбоксимидамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(диметиламино)фенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)-4-гидроксифенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-метил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-бензил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамид;
N’-[4-(2-{[5-(диметиламино)-2-гидроксибензил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[(8-гидрокси-2-хинолинил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[3-(4-гидрокси-3-метоксифенил)-2-пропенил]амино}-этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-(4-{2-[[(E)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил](метил)амино]этил}фенил)-2-тиофенкарбоксимидамид;
N’-(4-{2-[4-фенил-3,6-дигидро-1(2Н)-пиридинил]этил}фенил)-2-тиофенкарбоксимидамид,
или его соль.
N-(2-гидрокси-5-метокси)-4-{[2-тиенил(имино)метил]амино}бензолпропанамид;
N-{4-[2-({2-[3,5-ди(трет-бутил)-4-гидроксифенокси]этил}амино)этил]фенил}-2-тиофенкарбоксимидамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[4-(диметиламино)фенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[3,5-ди(трет-бутил)-4-гидроксифенил]пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-метил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-(1-бензил-2,3-дигидро-1Н-индол-5-ил)пропанамид;
3-[(3-{[амино(2-тиенил)метилиден]амино}бензил)амино]-N-[1-(1-нафтилметил)-2,3-дигидро-1Н-индол-5-ил]пропанамид;
N’-[4-(2-{[5-(диметиламино)-2-гидроксибензил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[3-(4-гидрокси-3-метоксифенил)-2-пропенил]амино}-этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-[4-(2-{[(6-гидрокси-2,5,7,8-тетраметил-3,4-дигидро-2Н-хромен-2-ил)метил]амино}этил)фенил]-2-тиофенкарбоксимидамид;
N’-(4-{2-[[(E)-3-(4-гидрокси-3,5-диметоксифенил)-2-пропенил](метил)амино]этил}фенил)-2-тиофенкарбоксимидамид,
или его соль.
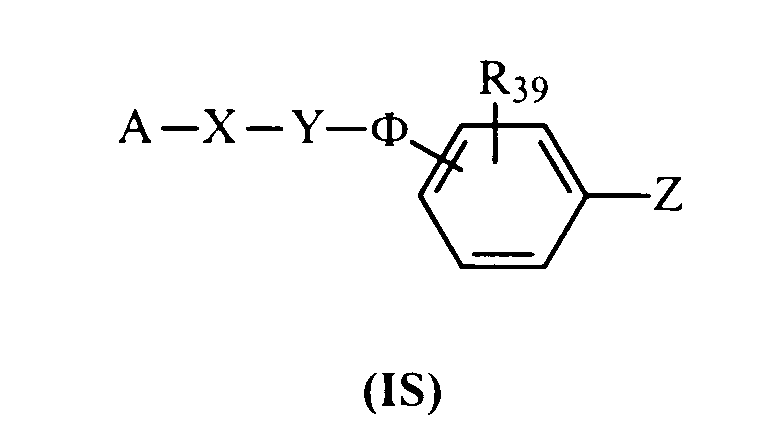
в которой A представляет
либо радикал
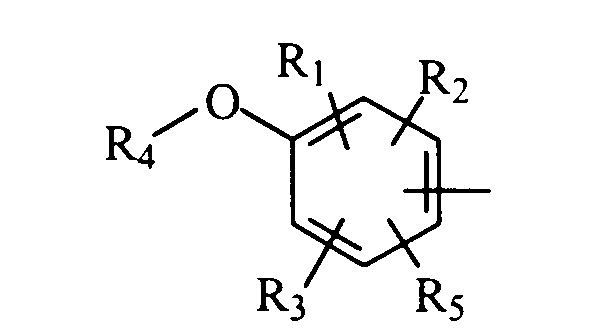
в котором R1, R2 и R3 представляют независимо группу ОН или неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R4 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
R5 представляет атом водорода или неразветвленный или разветвленный алкильный, имеющий от 1 до 6 атомов углерода;
либо радикал
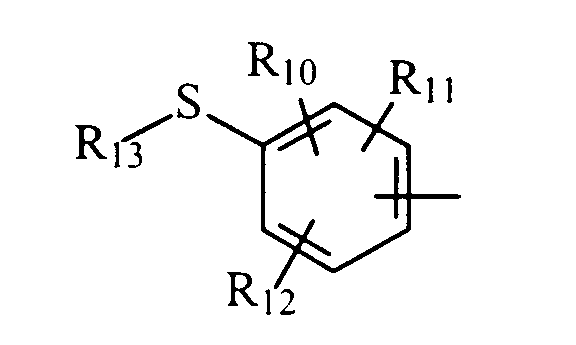
в которой R10, R11 и R12 представляют независимо атом водорода, группу OH;
R13 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
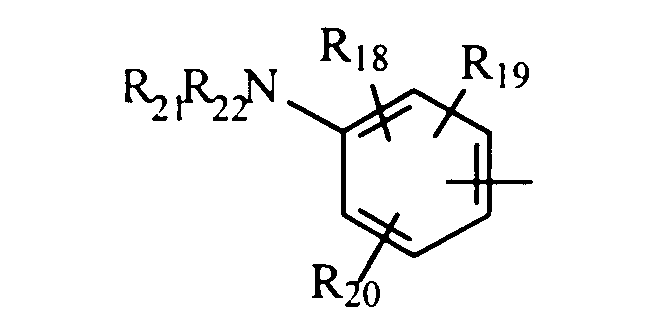
в котором R18, R19 и R20 представляют независимо атом водорода, галоген, группу OH или неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода,
R21 и R22 представляют независимо атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или R21 представляет также алкилсульфонильный, алкилсульфоксидный или алкилкарбонильный радикал и R22 представляет Н;
либо радикал
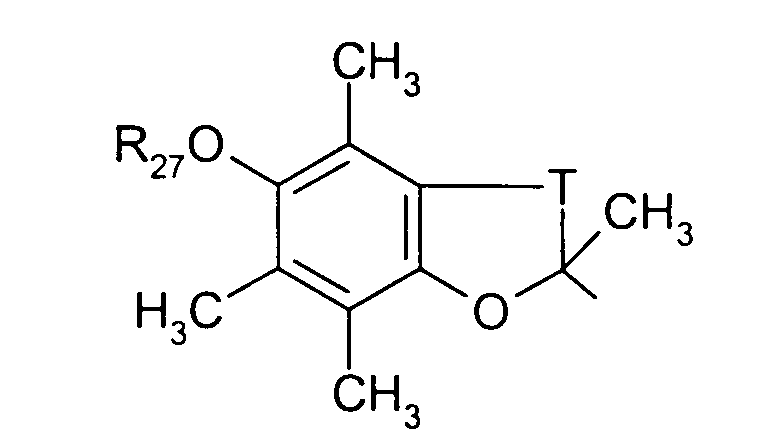
в котором Т представляет радикал -(СН2)k-, где k=2;
R27 представляет атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода;
либо радикал
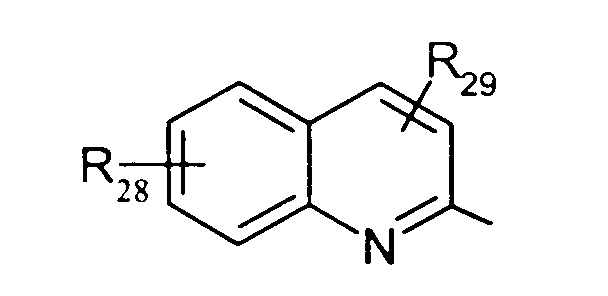
в котором R28 и R29 представляют, независимо, атом водорода или ОН-группу,
либо радикал
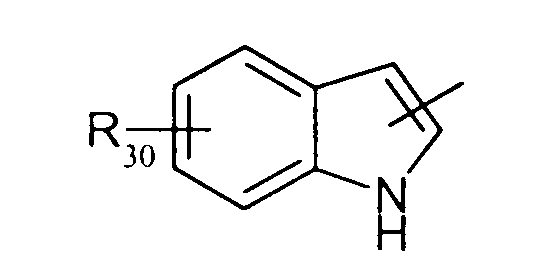
в котором R30 представляет атом водорода или неразветвленный или разветвленный алкоксирадикал, имеющий от 1 до 6 атомов углерода;
либо радикал
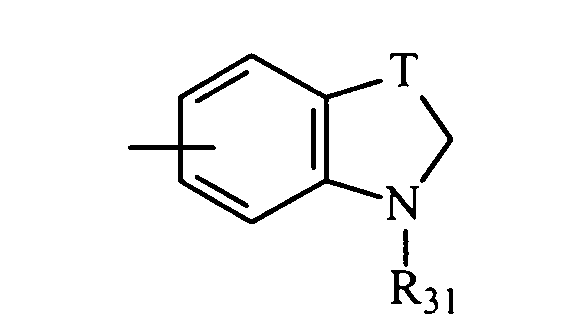
в котором Т представляет радикал -(СН2)k-, где k=1 или 2;
R31 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или арилалкильный, диарилалкильный, бис-арилалкильный, аминоалкильный, алкиламиноалкильный или диалкиламиноалкильный радикал,
либо радикал
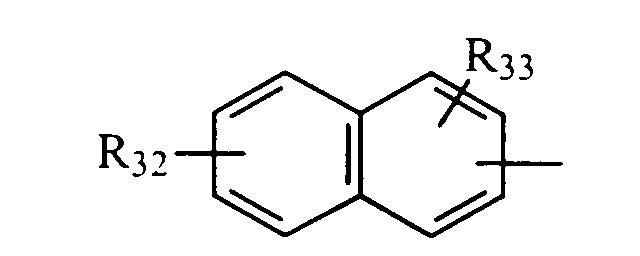
в котором R32 и R33 представляют независимо атом водорода или ОН-группу,
либо радикал
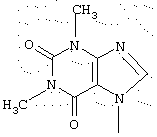
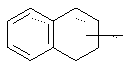
В представляет тиофен,
Х представляет связь или радикал -(СН2)m-, -O-(CH2)m-, -CO-NR36-, -O-(CH2)m-CO-, -S-(CH2)m-CO-, -NR36-(CH2)m-CO-, -(CH2)m-C(OH)(CH3)-CO-, -CH=CH- или -СН=N-;
Y представляет связь или радикал -(CH2)n- или -(CH2)r-Q-(CH2)s-;
Q представляет пиперазиновый, пиперидиновый, азетидиновый или насыщенное углеродное кольцо, имеющее от 3 до 5 членов;
Ф представляет связь или радикал -(CH2)p-O-(CH2)q-, -(CH2)p-NR37-(CH2)q-, -(CH2)p-CO-NR37-(CH2)q-;
Z представляет NO2 или NH2;
R36 и R37 представляют независимо атом водорода или неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -СО-R38,
в котором R38 представляет неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
R39 представляет атом водорода или неразветвленный или разветвленный алкоксирадикал, имеющий от 1 до 6 атомов углерода;
причем m, n, p, q, r и s равны целым числам от 0 до 6,
причем предполагается, что
если А представляет радикал
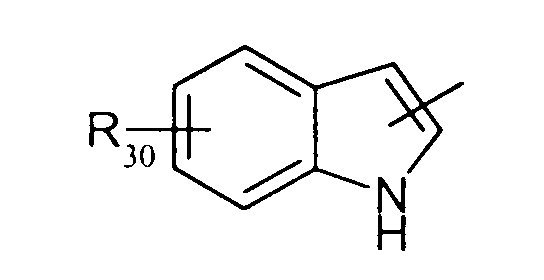
тогда Y представляет пиперидиновый радикал;
если А представляет радикал
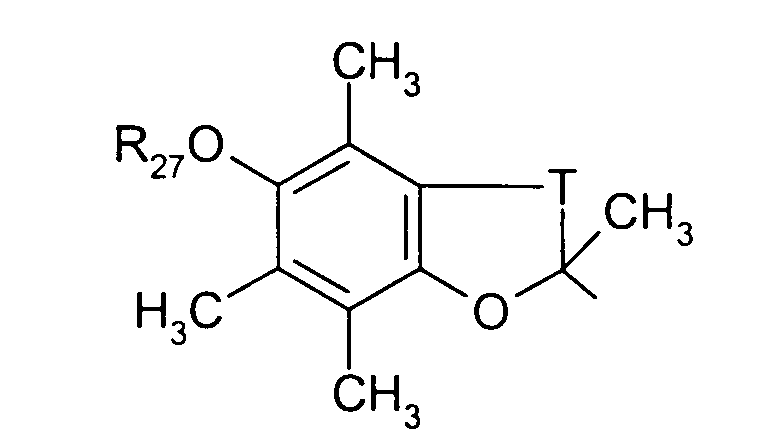
тогда Y представляет радикал -(CH2)r-Q-(CH2)s-, в котором Q представляет насыщенное углеродное кольцо, имеющее от 3 до 5 членов,
в качестве промежуточных продуктов.
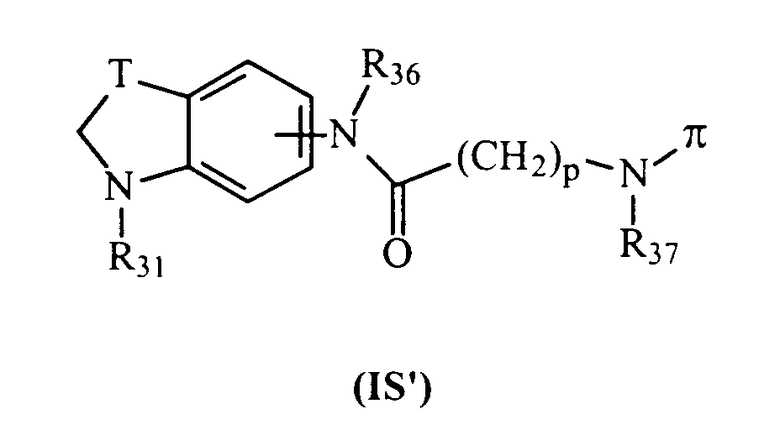
в которой π представляет атом водорода или защитную группу карбаматного типа;
R36 и R37 представляют независимо атом водорода, неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, или радикал -СО-R38, в котором R38 представляет неразветвленный или разветвленный алкильный или алкоксирадикал, имеющий от 1 до 6 атомов углерода;
Т представляет радикал -(СН2)k-, причем k=1;
R31 представляет неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 6 атомов углерода, арилалкильный, диарилалкильный, бис-арилалкильный, аминоалкильный, алкиламиноалкильный или диалкиламиноалкильный радикал;
p равно целому числу от 0 до 6,
в качестве промежуточных продуктов.
| ПРОИЗВОДНЫЕ АМИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ, ОБЛАДАЮЩЕЕ СВОЙСТВОМ ИНГИБИРОВАТЬ АКТИВНОСТЬ СИНТЕТАЗЫ ОКСИДА АЗОТА (У) | 1994 |
|
RU2130017C1 |
Авторы
Даты
2004-10-27—Публикация
1999-09-22—Подача