Родственные заявки
В данной заявке испрашивается приоритет по заявке №20000100102, поданной в патентное ведомство Греции 28 марта 2000 года, и по заявке №09/739089, поданной в патентное ведомство США 15 декабря 2000 года.
Область применения изобретения
Данное изобретение относится к способу неинвазивного in vivo обнаружения и картографирования биохимических и/или функциональных патологических изменений в тканях человека, а также к предназначенному для этого устройству.
Предпосылки изобретения
Предвестники рака, так называемые предраковые состояния, зачастую поддаются лечению на ранней стадии обнаружения. Не подвергавшееся лечению предраковое состояние может развиваться и переходить в инвазивный рак, который впоследствии может дать метастазы. На этой стадии возможности успешной терапии значительно сокращаются. Следовательно, раннее обнаружение и объективная идентификация степени серьезности предракового состояния имеют важнейшее значение.
Возможности традиционных методов по обнаружению раковых и предраковых повреждений ткани, основанных на применении оптических инструментов, сильно ограничены. Это объясняется тем, что структурные и метаболические преобразования, происходящие с развитием заболевания, не вызывают существенного и какого-либо особого изменения спектральных характеристик патологической ткани.
Для получения более точного диагноза из подозрительных зон берут пробы на биопсию, которые подвергают гистологическому анализу. Однако проведение биопсии связано с некоторыми проблемами, такими как: а) возможность возникновения ошибок из-за взятия пробы, обусловленных визуальными ограничениями при обнаружении и локализации подозрительных зон; b) биопсия может влиять на естественное развитие внутриэпителиального изменения; с) картографирование и мониторинг патологических изменений требуют взятия многочисленных проб, что сопряжено с различными опасностями и ограничениями, и d) диагностическая процедура, выполняемая с пробами на биопсию и гистологической оценкой, является субъективной, дорогостоящей и трудоемкой, она должна быть качественной и требует значительных временных затрат.
Для преодоления недостатков традиционных процедур диагностики в последние годы было разработано несколько других способов и систем. Эти способы можно разделить на две категории - а) способы, основанные на спектральном анализе тканей in vivo, чтобы попытаться улучшить диагностическую информацию, и b) способы, основанные на химическом возбуждении тканей посредством специальных агентов, которые могут взаимодействовать с патологической тканью и избирательно изменять ее оптические характеристики, усиливая таким образом контраст между пораженной тканью и здоровой.
В первом случае экспериментальное применение спектроскопических способов обусловлено их способностью обнаруживать изменения в биохимических и/или структурных характеристиках ткани по мере развития болезни. В частности, для разных типов тканей широко применяется флуоресцентная спектроскопия. Сначала ткань возбуждают с помощью источника света (обычно лазера) с малой длиной волны (синий - ультрафиолетовый диапазон). Затем измеряют интенсивность излучаемого тканью флуоресцентного света, представленную в виде функции от длины волны света.
Garfield и Glassman в патенте США №5450857 и Ramanajum и др. в патенте США №5421339 предложили способ, основанный на использовании флуоресцентной спектроскопии и предназначенный для диагностики раковых и предраковых поражений шейки матки. Главный недостаток флуоресцентной спектроскопии заключается в том, что происходящие биохимические преобразования, связанные с развитием болезни, не обнаруживаются непосредственно в виде изменений измеряемых флуоресцентных спектров. Флуоресцентные спектры несут ограниченную диагностическую информацию, и это объясняется двумя основными причинами: а) Ткани содержат нефлуоресцентные хромофоры, например гемоглобин. Поглощение такими хромофорами света, излучаемого от флуорофоров, может привести к образованию искусственных провалов и пиков в флуоресцентных спектрах. Другими словами, спектры несут сложную информацию от нескольких составляющих, и поэтому сложно оценить изменения важных для диагностики показателей ткани; b) Спектры являются широкими, поскольку многочисленные составляющие ткани оптически возбуждены и вносят свой вклад в измеряемый оптический сигнал. В результате, спектры не несут конкретной информации о патологических преобразованиях, а следовательно, имеют ограниченную диагностическую ценность. Короче говоря, недостатками вышеуказанного флуоресцентного метода являются низкие чувствительность и специфичность при обнаружении и классифицировании поражений ткани.
С целью повышения чувствительности и специфичности этого способа, Ramanajum и др. в документе WO 98/24369 предложили способ, основанный на использовании нейронных сетей для анализа спектральных данных. В основе данного способа лежит подготовка компьютерной системы с большим количеством спектральных образцов, взятых от нормальных и патологических тканей. Измеряемый спектр каждый раз сравнивают с хранящимися спектральными данными, что облегчает идентификацию патологии ткани.
R.R.Kortun и др. в патенте США №5697373, направленном на повышение качества получаемой диагностирующей информации, предложил способ, основанный на сочетании флуоресцентной спектроскопии и комбинационного рассеивания. Последнее может обеспечивать получение большей аналитической информации, однако комбинационное рассеивание требует сложного оборудования и идеальных экспериментальных условий, что существенно препятствует его клиническому применению.
Известно, что ткани характеризуются отсутствием пространственной гомогенности. Следовательно, спектральный анализ распределенных пространственных точек является недостаточным для определения их состояния.
Dombrowski в патенте США №5424543 описывает многоволновую систему визуализации, способную фиксировать изображения ткани в различных спектральных диапазонах. С помощью такой системы в общем возможно картографировать важные для диагностики показатели, основанные на их особенных спектральных характеристиках. Однако вследствие незначительной разницы в спектрах нормальной и патологической тканей, которая, как правило, имеет место, исследование в узких спектральных диапазонах не позволяет выдвинуть на первый план эти характеристики, и более того, даже не обеспечивает идентификацию патологической зоны и определение ее стадии.
D.R.Sandison и др. в патенте США №5920399 описывают систему визуализации, разработанную для исследований клеток in vivo и сочетающую многополосную визуализацию и возбуждение ткани светом. Эта система также использует двойной волоконно-оптический пучок для передачи света от источника к ткани, а затем от ткани к оптическому детектору. Такие пучки размещают в контакте с тканью, и, пытаясь усилить разницу в спектральных характеристиках нормальной и патологической тканей, сочетают различные длины волн для возбуждения и формирования изображения.
В патенте США №5921926 J.R.Delfyett и др. предлагают способ диагностирования заболеваний шейки, основанный на сочетании спектральной интерферометрии и оптической когерентной томографии (ОКТ). Такая система объединяет трехмерную визуализацию и спектральный анализ ткани.
Далее, было представлено несколько усовершенствованных вариантов кольпоскопов (D.R.Craine и др., патент США №5791346 и K.L.Blaiz, патент США №5989184), большинство из которых имеют встроенную электронную систему визуализации, предназначенную для фиксации изображения и для анализа изображения ткани, включая количественную оценку размеров поражения. Для усиления оптической дифференциации между нормальной и патологической тканями в разных областях биомедицинской диагностики используют специальные агенты для местного или систематичного введения. Такие агенты включают раствор уксусной кислоты, толуидиновый синий и различные фотосенсибилизаторы (порфирины) (S.Anderson Engles, С.Klinteberg, К.Svanberg, S.Svanberg, In vivo fluorescence imaging for tissue diagnostics, Phys Med. Biol. 42 (1997) 815-24). Избирательное окрашивание патологических тканей происходит из-за свойства этих агентов взаимодействовать с изменившимися метаболическими и структурными характеристиками патологической зоны. Это взаимодействие постепенно и обратимым образом усиливает разницу в спектральных характеристиках отражения и/или флуоресценции нормальной и патологической тканей. Несмотря на то, что избирательное окрашивание патологической ткани представляет собой динамическое явление, в клинической практике интенсивность и пределы окрашивания подвергают качественной и статической оценке. Кроме того, в некоторых случаях ранних состояний патологии явление временного окрашивания после ведения агента является непродолжительным, и поэтому исследователь не может обнаружить изменения и даже оценить их интенсивность и пределы. В других случаях процесс окрашивания ткани протекает очень медленно, что вызывает неудобства для пациента и создает для исследователя проблемы при оценке интенсивности и пределов изменений по причине их постоянного изменения. Непосредственным следствием вышеуказанного обстоятельства является снижение диагностической ценности этих процедур диагностики. Таким образом, их полезность ограничена лишь упрощением локализации подозрительных зон при получении проб на биопсию.
Подытоживая вышесказанное, можно сделать следующие выводы:
а) Для обнаружения изменений структурных характеристик патологической ткани in vivo предложены и экспериментально используются различные традиционные спектроскопические методы (флуоресцентные, упругого/неупругого рассеивания и др.), основанные на рассеивании света. Основной недостаток этих методов заключается в том, что они обеспечивают точечную информацию, которая является недостаточной для анализа пространственно негомогенных тканей. Потенциальными возможностями по решению этой проблемы обладает многополосная визуализация, которая обеспечивает спектральную информацию (как правило, с меньшей разрешающей способностью) в любой пространственной точке исследуемой зоны. Тем не менее, информация, обеспечиваемая этими методами, как формирующими изображение, так и не формирующими его, имеет ограниченную диагностическую ценность, поскольку структурные изменения ткани, сопровождающие развитие болезни, не находят отражения в виде значительных и характерных изменений измеряемых спектров. Следовательно, собранную спектральную информацию нельзя напрямую соотносить с патологией ткани, и данное обстоятельство ограничивает клиническую пригодность этих методов.
b) Традиционные (не спектральные) методы визуализации обеспечивают возможность двух- или трехмерного картографирования важных диагностических характеристик. Их обычно применяют для измерения морфологических характеристик и в качестве клинических средств документирования.
c) Диагностические способы, основанные на избирательном окрашивании патологической ткани специальными агентами, позволяют усилить оптический контраст между нормальной и патологической тканями. Однако они предоставляют ограниченную информацию для идентификации заболевания in vivo и определения его стадии.
Избирательное взаимодействие патологической ткани с агентами, усиливающими ее оптический контраст относительно здоровой ткани, представляет собой динамическое явление. Поэтому резонно предположить, что измерение и анализ кинетических свойств могли бы обеспечить важную информацию для обнаружения in vivo, идентификации и определения стадии тканевых поражений. В предыдущей публикации, соавтором которой является один из изобретателей (С.Balas, A.Dimoka, E.Orfanoudaki, E.Koumandakis, "In vivo assessment of acetic acid-cervical tissue interaction using quantitative imaging of back-scattered light: Its potential use for the in vivo cervical cancer detection grading and mapping", SPIE-Optical Biopsies and Microscopic Techniques, том 3568, стр.31-37, (1998)), измерения изменений характеристик отраженного света представлены как функция длины волны и времени. Эти изменения происходят в шейке под действием местного введения раствора уксусной кислоты. В этом конкретном случае для измерения изменений интенсивности отраженного света как функции времени и длины волны в выбранных пространственных точках использовалась универсальная многоспектральная система визуализации, построенная на перестраиваемом жидкокристаллическом монохроматоре. Было обнаружено, что формы графиков зависимости интенсивности отраженного света от времени дают дополнительную информацию для непосредственной идентификации и определения стадии неоплазии ткани. Неопубликованные результаты, полученные этой научно-исследовательской группой, показывают, что подобные результаты можно получить и с другими агентами, обладающими свойством усиления оптического контраста между нормальной и патологической тканями. Тем не менее, экспериментальный способ, примененный в опубликованной работе, характеризуется несколькими недостатками, например: формирующему изображение монохроматору требуется время для изменения длины волны, следовательно, он не подходит для многоспектральной визуализации и анализа динамических явлений. Его нельзя использовать в качестве способа картографирования степени повреждения ткани, поскольку предложенные графики отражают временное изменение интенсивности отраженного света в выбранных точках. Отсутствие моделирования данных и параметрического анализа кинетических данных в каждой пространственной точке исследуемой зоны ограничивают пригодность этого способа в экспериментальных исследованиях и затрудняют его клиническое применение. Оптические приборы, используемые для визуализации интересующей зоны, являются приборами общего назначения и не отвечают специализированным техническим требованиям, предъявляемым к клиническому применению данного способа. Клиническому применению предложенной системы также препятствует то, что она не имеет соответствующих средств, которые во время процедуры фиксации изображения обеспечивают стабильное положение блока записи изображения относительно поверхности ткани. Указанное обстоятельство является очень важным, поскольку в течение процедуры обследования всегда наблюдаются небольшие движения пациента (т.е. дыхание). Если во время записи изображения после применения агента происходят микродвижения, то пространственные элементы фиксируемого изображения могут быть нечеткими. Это может значительно снизить точность расчета кривых в любой пространственной точке, отражающих кинетику связки маркер-ткань.
Сущность изобретения
В данном изобретении представлен способ мониторинга воздействий различающего патологии агента на образец ткани. Способ включает нанесение различающего патологии агента (например, уксусной кислоты) на пробу ткани и измерение во времени спектрального свойства этой пробы ткани (например, спектра испускания), вследствие чего осуществляется мониторинг воздействий различающего патологии агента на пробу ткани. Пробой ткани может быть проба, взятая из шейки матки, влагалища, кожи, матки, желудочно-кишечного тракта или из дыхательного тракта. Не стремясь ограничиться теорией, считают, что различающий патологии агент вызывает кратковременные изменения светорассеивающих свойств ткани (например, эпителия с отклонениями от нормы).
Согласно другому аспекту данное изобретение характеризует способ диагностирования in vivo отклонения ткани от нормы, например атипии, дисплазии, неоплазии (такой как пришеечная внутриэпителиальная неоплазия, CIN-I, CIN-II, CIN-III), кондилом или рака. Способ включает нанесение на ткань различающего патологии агента, например раствора уксусной кислоты или комбинации растворов, выбранных из множества кислых и щелочных растворов. Способ также включает облучение исследуемой ткани оптическим излучением и мониторинг во времени интенсивности света, излучаемого тканью, в результате чего и происходит диагностика отклонения исследуемой ткани от нормы. Оптическое излучение может быть широкополосным излучением, а в предпочтительном случае поляризованным оптическим излучением.
Предложенные неинвазивные способы пригодны для раннего обнаружения in vivo тканевых анормальностей/изменений. Способы также пригодны для картографирования степени анормальности/изменения эпителиальных тканей при развитии атипии тканей, дисплазий, неоплазий и раковых заболеваний.
В одном из вариантов осуществления изобретения представляющую интерес зону ткани освещают широкополосным оптическим излучением и вводят в контакт с различающим патологии агентом, например с одним агентом или с комбинацией агентов, которые взаимодействуют с зонами патологической ткани, характеризующейся измененной биохимической структурой и/или функциональностью клеток, и вызывают кратковременное изменение характеристик переизлученного от ткани света. Переизлученный тканью свет может представлять собой отражение, диффузное рассеяние, флуоресценцию или их комбинации и субкомбинации. Интенсивность излучаемого тканью света можно измерять (например, одновременно) в каждой пространственной точке представляющей интерес зоны ткани в отдельно взятый момент времени или на протяжении времени (например, за время взаимодействия агента с тканью). На основе количественной оценки пространственного распределения изменений в характеристиках света, переизлученного от ткани в определенные моменты времени перед оптическим и химическим возбуждением ткани и после него, может быть поставлен диагноз. Диагноз может быть также поставлен на основе пространственного распределения параметров, которые рассчитаны по кривым кинетики, полученным от переизлученного тканью света. Измерения этих кривых осуществляют одновременно в каждой пространственной точке исследуемой зоны во время оптического и химического возбуждения ткани.
В одном варианте осуществления изобретения этап освещения ткани включает в себя облучение исследуемой зоны ткани оптическим излучением с более узким спектральным диапазоном, чем спектральный диапазон света, излучаемого источником освещения. В другом варианте этап измерения интенсивности света включает в себя измерение интенсивности переизлученного света в спектральном диапазоне, ширина которого уже ширины спектрального диапазона чувствительности детектора. Еще в одном варианте этап измерения интенсивности света включает в себя одновременное измерение интенсивности переизлученного света во множестве спектральных диапазонов, ширина которых меньше ширины спектрального диапазона чувствительности детектора.
Согласно еще одному аспекту данное изобретение раскрывает устройство, предназначенное для неинвазивного раннего обнаружения in vivo тканевых анормальностей/изменений и для картографирования степени этих тканевых анормальностей/изменений в биохимических и/или функциональных характеристиках эпителиальных тканей при развитии атипий тканей, дисплазий, неоплазий и рака. Устройство содержит оптическую систему для улавливания света, переизлученного исследуемой зоной, избирательного увеличения и фокусирования изображения этой зоны. Устройство также может содержать детектор оптического изображения (детекторы оптических изображений), средства для модуляции, передачи, картографирования и фиксации изображения интересующей зоны ткани. Кроме того, устройство может содержать компьютер, имеющий средства хранения данных, средства для обработки и анализа, монитор для воспроизведения изображений, кривых и числовых данных; оптическую систему для оптического мультиплицирования изображения интересующей зоны ткани и источник света для освещения интересующей зоны. Также устройство может содержать оптические фильтры для выделения спектрального диапазона визуализации и освещения, средства распространения света и освещения интересующей зоны, электронную аппаратуру управления, а также при необходимости программное обеспечение для обработки и анализа данных. Программное обеспечение может помочь фиксировать изображение ткани и сохранять его как в конкретные моменты времени, так и для множества моментов времени, до и после применения различающего патологии агента.
Используя упомянутое выше устройство, можно создавать одно изображение или последовательность изображений, которые отражают пространственное распределение показателей кинетики изменений, вызванных в оптических характеристиках ткани, до и после применения агента. Величины пикселей изображения соответствуют пространственному распределению изменений интенсивности света, излученного тканью, в определенные моменты времени до и после оптического и химического возбуждения ткани. Пространственному распределению параметров можно поставить в соответствие величины яркости пикселя, выраженные в виде функции времени. Упомянутую функцию можно вычислять по измеренным и сохраненным изображениям и для каждого ряда пикселей с одинаковыми пространственными координатами.
В одном варианте осуществления изобретения на этапе оптической фильтрации детектор изображения содержит оптический фильтр, который расположен на оптическом пути лучей, формирующих изображение ткани, для записи последовательных во времени образов в выбранном спектральном диапазоне, ширина которого меньше ширины спектрального диапазона чувствительности детектора.
Еще в одном варианте выполнения изобретения оптическая система мультиплицирования изображения содержит оптику для разделения светового пучка, создающую два одинаковых изображения интересующей зоны. Эти изображения регистрируются двумя детекторами изображения, перед которыми расположены оптические фильтры. Фильтры выполнены с возможностью пропускать свет, ширина спектра которого уже ширины спектра чувствительности детектора, вследствие чего две группы последовательных во времени изображений одной и той же зоны ткани записываются одновременно, при этом каждый из них соответствует отдельному спектральному диапазону.
В другом варианте выполнения изобретения оптическая система мультиплицирования изображения содержит более одного разделителя пучка для создания множества одинаковых изображений интересующей зоны. Изображения регистрируются множеством детекторов изображений, перед которыми расположены оптические фильтры. Эти фильтры имеют различные характеристики пропускания и могут пропускать свет, ширина спектра которого уже ширины спектра чувствительности детектора. Таким образом, одновременно записываются многочисленные группы последовательных во времени изображений одной и той же зоны ткани, при этом каждый из них соответствует отдельному спектральному диапазону.
В дополнительном варианте осуществления изобретения оптическая система мультиплицирования изображения содержит один разделитель пучка для создания множества одинаковых изображений интересующей зоны, регистрируемых множеством детекторов изображений, перед которыми расположены оптические фильтры, в предпочтительном случае обладающие различными характеристиками пропускания и способные пропускать свет, ширина спектра которого уже ширины спектра чувствительности детектора, вследствие чего многочисленные группы последовательных во времени изображений одной и той же зоны ткани записываются одновременно, при этом каждая из них соответствует отдельному спектральному диапазону.
Еще в одном варианте осуществления изобретения оптическая система мультиплицирования изображения содержит один разделитель пучка для создания множества одинаковых изображений интересующей зоны, регистрируемых в различных подзонах одного и того же детектора. Оптические фильтры, имеющие различные характеристики пропускания, размещены на пути распространения расщепленных пучков. Эти фильтры выполнены с возможностью пропускать свет, ширина спектра которого уже ширины спектра чувствительности детектора. Многочисленные группы последовательных во времени изображений одной и той же зоны ткани записывают одновременно в разных зонах детектора, при этом каждая из них соответствует отдельному спектральному диапазону.
В другом варианте осуществления изобретения этап фильтрации источника света содержит оптический фильтр, размещенный на оптическом пути светового пучка освещения, и пропускает свет, ширина спектра которого уже ширины спектра чувствительности используемого детектора.
В дополнительном варианте осуществления изобретения этап фильтрации источника света включает применение ряда оптических фильтров и механизма выбора фильтра, который размещен на пути распространения облучающего света и таким образом обеспечивает возможность перестройки средней длины волны и ширины спектра света, освещающего ткань.
Еще в одном варианте осуществления изобретения в основе картографирования степени изменений, связанных с биохимическими и/или функциональными характеристиками интересующей зоны ткани, лежат пиксельные значения одного изображения из группы записанных последовательных во времени изображений интересующей зоны ткани.
В дополнительном варианте осуществления изобретения в основе этого картографирования лежат пиксельные значения, принадлежащие к ряду изображений, входящих в группу записанных последовательных во времени изображений интересующей зоны ткани.
Еще в одном варианте осуществления изобретения в основе этого картографирования лежат числовые данные, которые получены из пиксельных значений, принадлежащих к ряду изображений, входящих в группу записанных последовательных во времени изображений интересующей зоны ткани.
В дополнительном варианте осуществления изобретения для визуализации картографирования применяют шкалу псевдоцветов, представляющую в разных цветах разные пиксельные значения изображения или изображений, используемые для картографирования анормальных зон ткани.
В одном варианте осуществления изобретения изображение или изображения используют для обнаружения in vivo и идентификации границ эпителиальных поражений.
В другом варианте осуществления изобретения в качестве диагностических показателей для идентификации in vivo и определения стадии эпителиальных поражений используют пиксельные значения изображения или изображений, определяемые для картографирования степени изменений биохимических и/или функциональных характеристик ткани.
Еще в одном варианте осуществления изобретения изображение или изображения можно накладывать на цветное или черно-белое изображение той же самой исследуемой зоны ткани, выведенное на монитор. Зоны анормальной ткани выделяют и очерчивают их границы, упрощая тем самым выбор характерной зоны для взятия пробы на биопсию, избирательное хирургическое удаление анормальной зоны, а также оценку точности выбора и удаления соответствующего участка ткани.
В дополнительном варианте осуществления изобретения изображение или изображения, выбранные для картографирования степени изменений биохимических и/или функциональных характеристик ткани, используют для оценки эффективности различных терапевтических методик, таких как радиотерапия, лечение ядерными лучами, фармакологическая терапия и химиотерапия.
В другом варианте осуществления изобретения оптическая система, собирающая переизлученный исследуемой тканью свет, содержит оптико-механические элементы, которые используются в микроскопах для клинических диагностических обследований, в операционных микроскопах, кольпоскопах и эндоскопах.
В одном варианте выполнения изобретения, относящемся к применениям кольпоскопии, устройство может содержать расширитель и шарнирный кронштейн, к которому присоединена оптическая головка. Оптическая головка содержит лучепреломляющий объектив, оптическую систему фокусирования, механизм для выбора степени увеличения, окуляр, основание для крепления камеры и осветитель. Расширитель присоединен таким образом, что его центральная продольная ось перпендикулярна центральной поверхности объектива. Таким образом, если расширитель помещен во влагалище и закреплен там, то относительное положение оптической системы фиксации изображения и зоны исследуемой ткани поддерживается неизменным независимо от микродвижений шейки матки, которые имеют место быть при обследовании женщины.
В другом варианте выполнения изобретения устройство может дополнительно содержать распылитель для раздачи агента. Распылитель присоединен к шарнирному кронштейну - оптической головке этого устройства перед отверстием влагалища, где можно управлять опрыскиванием ткани и синхронизировать это опрыскивание с процедурой последовательной во времени фиксации изображения с помощью электронных средств управления.
В другом варианте выполнения предложенного устройства детекторные средства фиксации изображения и средства демонстрации изображения включают телевизионную систему. Телевизионная система имеет детектор с пространственной разрешающей способностью более 1000×1000 пикселей, а также монитор с диагональю, равной по меньшей мере 17 дюймам (43,18 см), вследствие чего наряду с большой зоной обзора обеспечивается высокая кратность увеличения, при этом сохраняется качество изображения.
Еще в одном варианте выполнения изобретения, предназначенном для микроскопов, используемых в клинических диагностических обследованиях, операционных микроскопов и кольпоскопов, система содержит шарнирный кронштейн, к которому присоединена оптическая головка. Оптическая головка содержит объектив, оптическую систему фокусирования, механизм задания степени увеличения, окуляр, штатив для крепления камеры, осветитель и два линейных поляризатора. Один линейный поляризатор размещен на оптическом пути светового пучка освещения, а другой - на оптическом пути лучей, формирующих изображение ткани. Плоскости поляризации этих поляризаторов можно вращать. Если эти плоскости перпендикулярны друг другу, то устраняется влияние отражения поверхности ткани на формируемое изображение.
В другом варианте выполнения изобретения, предназначенном для эндоскопии, эндоскоп может содержать оптические средства передачи света от источника света к поверхности ткани. Оптические средства также могут обеспечивать улавливание лучей и их передачу вдоль по существу одной и той же оси. Кроме того, оптические средства обеспечивают фокусировку лучей, формирующих изображение ткани. Эндоскоп также может содержать два линейных поляризатора. Один линейный поляризатор размещен на оптическом пути светового пучка освещения, а другой - на оптическом пути лучей, формирующих изображение ткани. Плоскости поляризации этих поляризаторов можно вращать. Если эти плоскости перпендикулярны друг другу, то устраняется влияние отражения поверхности ткани на формируемое изображение.
В другом варианте выполнения изобретения микроскопы для клинических диагностических исследований, операционные микроскопы и кольпоскопы могут вместо лучепреломляющего объектива содержать объектив-рефлектор. Объектив-рефлектор уменьшен таким образом, что второе отражательное зеркало размещено в центральной части его передней оптической апертуры. В задней, неотражающей части этого зеркала прикреплены средства освещения, испускающие свет в сторону объекта. Независимо от наличия или отсутствия оптической системы масштабирования и фокусирования освещения, центральный луч испускаемого светового конуса является соосным с центральным лучом светового пучка, входящего в линзу формирования изображения. С помощью оптической системы масштабирования и фокусирования освещения, которую можно автоматически подстраивать совместно с механизмом изменения степени увеличения оптической системы визуализации, можно одновременно и пропорционально изменять освещаемую зону и поле зрения системы визуализации. Любое снижение яркости изображения, вызванное повышением степени увеличения, компенсируют одновременным масштабированием и фокусированием пучка освещения.
Другие особенности и преимущества данного изобретения поясняются приведенным ниже подробным описанием, а также формулой изобретения.
Краткое описание чертежей
Фиг.1 схематично поясняет основные принципы предложенного способа.
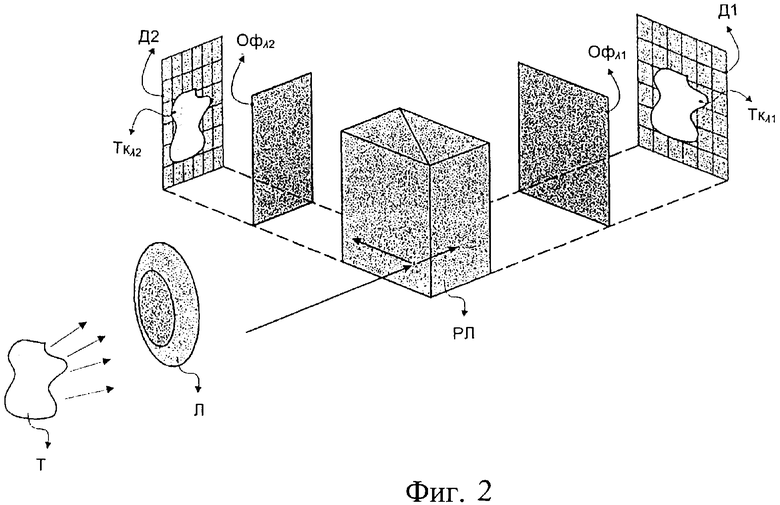
Фиг.2 иллюстрирует вариант изобретения, включающий способ фиксации одновременно в двух спектральных диапазонах и в любой пространственной точке исследуемой зоны, а также кинетику изменений характеристик посылаемого тканью света до и после введения агента усиления контрастности.
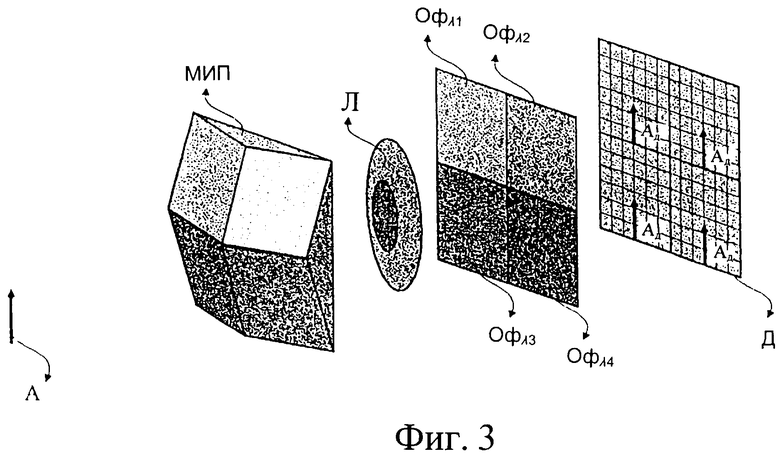
Фиг.3 иллюстрирует другой вариант изобретения, включающий способ фиксации одновременно в различных спектральных диапазонах и в любой пространственной точке исследуемой зоны, а также кинетику изменений характеристик посылаемого тканью света до и после введения агента усиления контрастности.
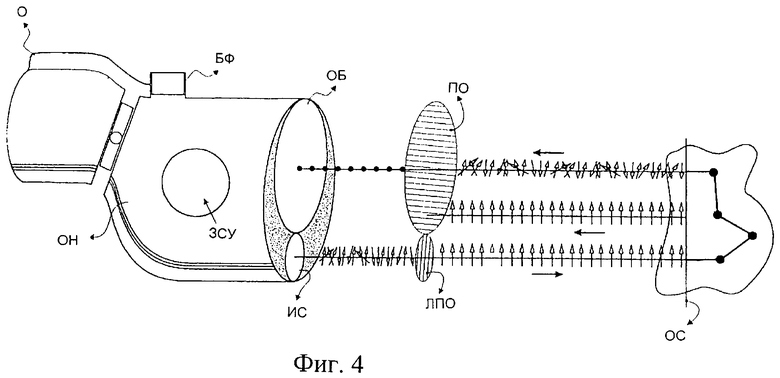
Фиг.4 изображает схему медицинского микроскопа, содержащего источник света (ИС), механизм задания степени увеличения (ЗСУ), окуляр (О) и штатив для крепления блока фиксации (БФ), детектора (детекторов), считывающего электронного оборудования и т.п.
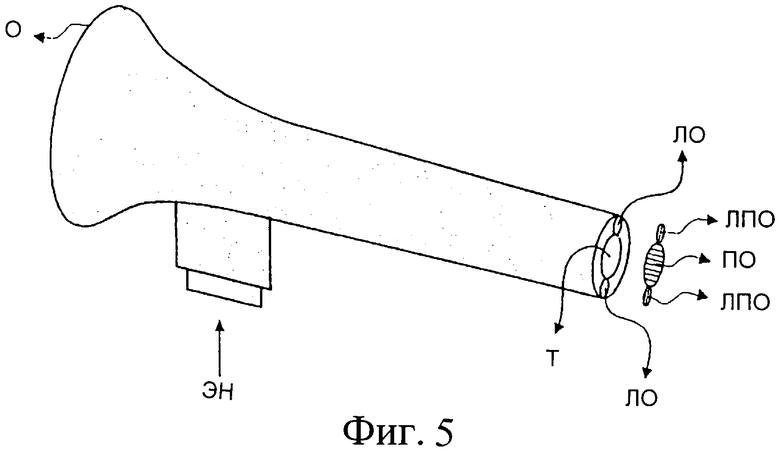
Фиг.5 изображает эндоскоп, содержащий окуляр (О), который можно приспособить к электронной системе визуализации, оптические волокна или кристаллы для передачи лучей освещения и лучей изображения, оптическую систему для линейной поляризации света, одна часть которой размещена на оптическом пути лучей освещения (ЛО), а другая - на пути луча, формирующего оптический образ ткани (Т).
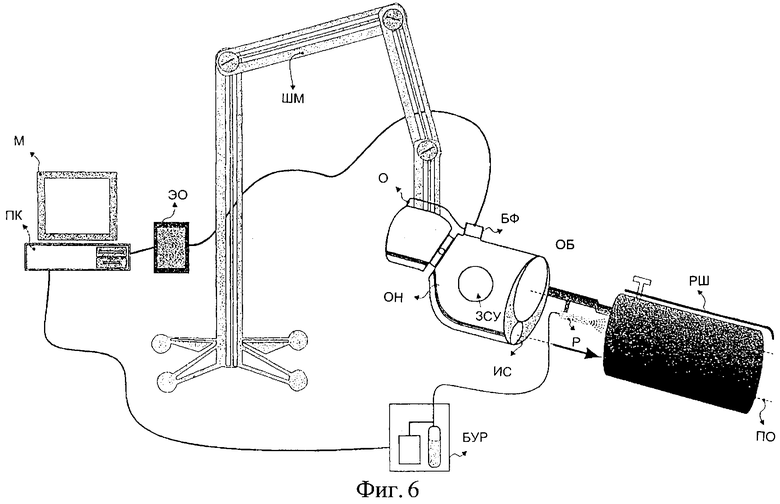
Фиг.6 изображает кольпоскопическое устройство, содержащее шарнирный кронштейн (ШК), на котором закреплена оптическая головка (ОГ), включающая в себя источник (ИС) света, объектив (ОБ), окуляр (О) и оптику для задания степени увеличения (ЗСУ).
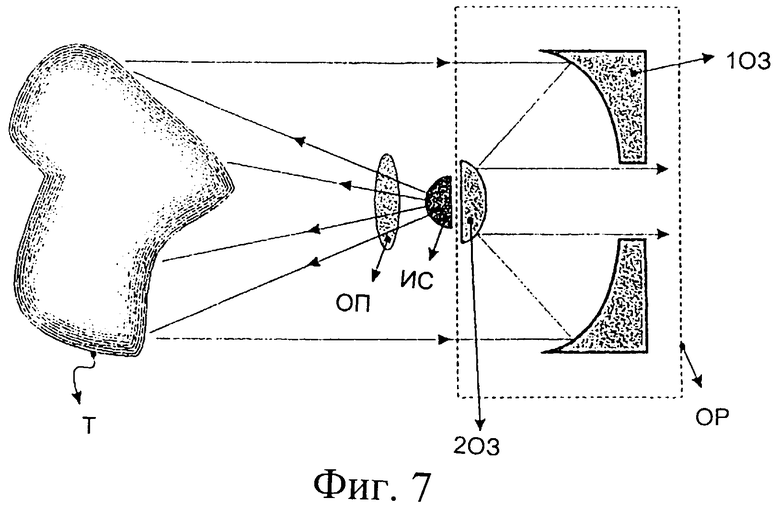
Фиг.7 изображает оптическое устройство визуализации, содержащее источник света, расположенный в центральной части его фронтальной апертуры.
Подробное описание изобретения
Данное изобретение относится к способу неинвазивного in vivo обнаружения и картографирования биохимических и/или функциональных патологических изменений в тканях (например, в ткани человека), а также к предназначенному для этого устройству. После выбора подходящего агента различения патологии, который усиливает оптический контраст между нормальной и патологической тканями (в зависимости от степени поражения ткани), этот агент вводят (например, локально) в ткань.
В качестве агента различения патологии можно использовать любой агент, способный изменять оптические свойства ткани, например агент, способный изменять характеристики отражения или характеристики флуоресценции ткани. Агентом различения патологии может быть кислый раствор, щелочной раствор, раствор порфирина или раствор предшественника порфирина. Предпочтительные примеры агента различения патологии для использования в предложенном способе включают раствор уксусной кислоты, например слабый раствор уксусной кислоты, или 5-амино-левулиновой кислоты.
Показанную на фиг.1 ткань (Т) опрыскивают из распылителя (Р), содержащего агент, например уксусную кислоту. В это же время ткань освещают источником, испускающим свет с характерной спектральной полосой, обусловленной оптическими характеристиками как агента, так и ткани. Характеристики света, излучаемого источником, можно регулировать путем выбора специальных источников (ИС) и оптических фильтров (ОФ). Источники света для освещения ткани включают в себя светодиоды и лазеры.
Для визуализации исследуемой зоны можно использовать светоулавливающую оптику (Л), которая фокусирует изображение на двумерном оптическом детекторе (Д). Выходной сигнал с последнего усиливается, модулируется и оцифровывается посредством соответствующего электронного оборудования (ЭО), в заключении изображение выводится на монитор (М) и заносится в средство хранения данных персонального компьютера (ПК). Между тканью (Т) и детектором (Д) могут быть расположены оптические фильтры (ОФЛ). Такой фильтр можно разместить для визуализации ткани (Т) в выбранных спектральных диапазонах, при которых обеспечивается максимальный контраст между зонами, оптические характеристики которых в различной степени подвержены изменениям, протекающим после введения соответствующего агента.
Перед введением последнего можно получить изображения и использовать их в качестве контрольных изображений. После введения агента детектор (Д) помогает в последовательные моменты времени фиксировать изображения ткани, которые впоследствии сохраняются в компьютерном средстве хранения данных. Частота измерений пропорциональна скорости изменения оптических характеристик ткани после введения агента.
Под используемым здесь термином оптическое свойство (С) подразумевается свойство, проявляющееся в результате взаимодействия электромагнитных волн и образца материала, например ткани, такой как ткань человека. Например, указанным свойством может быть интенсивность света после его взаимодействия с веществом, проявляемого в виде лучепоглощения, лучеиспускания или спектра комбинационного рассеяния. Динамическим оптическим свойством является такое свойство, которое получается из оптического свойства C(t), зависящего от времени, и определяется по измерениям C(t), произведенным более чем за один промежуток времени. Например, динамическим оптическим свойством может быть время релаксации или интеграл по времени от C(t).
На фиг.1 схематично показаны изображения одной и той же тканевой зоны, последовательно сохраненные до и после введения агента (ПМВ). На этих изображениях черные области представляют зоны ткани, не меняющие свои оптические характеристики (НОХ), тогда как бело-серые оттенки представляют зоны, изменяющие свои оптические характеристики (ИОХ) после введения агента. Одновременная фиксация интенсивности света, переизлученного каждой пространственной точкой исследуемой зоны ткани исследуемой зоны ткани в заранее заданные моменты времени, дает возможность расчета кинетики вызванных изменений.
На фиг.1 показаны две кривые, которые отражают пиксельное значение в точке xy, (ППxy) в зависимости от времени t. Кривая ИОХК соответствует зоне, где применение агента вызвало изменения (ИОХ) оптических характеристик ткани. Кривая (НОХК) соответствует зоне, где изменения не происходили (НОХ).
Каждому пикселю (x,y) можно поставить в соответствие некоторое пиксельное значение (например, интенсивности И), обычно зависящее от времени. Например, в момент времени ti и в пикселе (x,y) пиксельное значение можно обозначить как ППxy(ti). Время tрел(x,y) релаксации является одним из полезных динамических спектральных свойств, которое можно получить путем измерения зависящего от времени пиксельного значения в конкретном пикселе (x,y). Если максимальное значение изменяющейся во времени кривой ППxy обозначить как А, то tрел(x,y) будет удовлетворять выражению ППxy(tрел)=А/е, где е является основанием натурального алгоритма. Например, если кривую зависимости пиксельного значения от времени аппроксимировать экспонентой ППxy(t)=Аехр(-rt) с коэффициентом релаксации r, где r>0, то tрел(x,y)=1/r.
Расчет этих параметров (С) в каждой пространственной точке исследуемой зоны обеспечивает получение информации о кинетике (ИК), причем пиксельные значения коррелированы с указанными параметрами. Эти значения можно представить шкалой псевдоцветов (Cmin, Cmax), пространственное распределение которых обеспечивает мгновенную визуальную оценку интенсивности и степени вызванных изменений. В зависимости от степени корреляции интенсивности и степени вызванных изменений с патологией и стадией поражения ткани измеренные количественные данные и полученные параметры позволяют осуществить картографирование, описание и определение границ поражения. Псевдоцветное изображение кинетики (ИК) явления, отражающее пространственное распределение по меньшей мере одного параметра, можно наложить (предварительно рассчитав) на изображение ткани, которое выводится на экран в реальном масштабе времени. Использование наложенного изображения в качестве ориентира облегчает идентификацию границ поражения для успешного осуществления хирургического удаления всего пораженного участка или для определении подозрительных зон при взятии проб на биопсию. Кроме того, на основании корреляции кинетики явления со степенью патологии ткани измеренные количественные данные и полученные из них параметры могут обеспечить получение количественных клинических показателей для определения in vivo стадии поражения или его малых зон.
В некоторых случаях необходимо фиксировать кинетику явления более чем в одном спектральном диапазоне. Это может помочь при определении in vivo спектральных диапазонов освещения и/или визуализации, при которых достигается максимум диагностического сигнала. Кроме того, одновременная визуализация более чем в одном спектральном диапазоне может способствовать минимизации влияний нежелательного эндогенного рассеивания, флуоресценции и отражения ткани, оказываемых на измеряемый детектором оптический сигнал. Измеренный оптический сигнал включает в себя оптический сигнал, получаемый в результате взаимодействия маркера и ткани, а также свет, излучаемый эндогенными компонентами ткани. Во многих случаях записанная реакция компонентов ткани представляет собой шум, поскольку она перекрывает генерируемый оптический сигнал, несущий диагностическую информацию. Таким образом, разделение этих сигналов, основанное на их специфических спектральных характеристиках, приводит к максимизации отношения сигнал/шум, а следовательно, улучшает получаемую диагностическую информацию.
Фиг.2 иллюстрирует способ одновременного измерения кинетики изменения характеристик излученного тканью света в двух спектральных диапазонах и в любой пространственной точке исследуемой зоны, до и после введения агента усиления контраста. Излучаемый тканью свет собирается и фокусируется блоком (Л) оптического формирования изображения и пропускается через оптический элемент разделения луча (РЛ). Таким образом, создают два одинаковых изображения ткани (Т), которые могут фиксироваться двумя детекторами (Д1, Д2). Перед детектором можно разместить подходящие оптические фильтры (Офλ1), (Офλ2), вследствие чего можно фиксировать изображения с разными спектральными характеристиками. Кроме делителей луча для разделения изображения объекта можно использовать оптические фильтры, дихроичные зеркала и т.п. Детекторы (Д1), (Д2) синхронизированы таким образом, что они одновременно и в последовательные временные интервалы фиксируют соответствующие спектральные изображения ткани (Ткλ1), (Ткλ2), сохраняемые в компьютерном средстве хранения данных. Обобщая вышесказанное, можно сделать вывод о том, что многочисленные спектральные изображения можно фиксировать одновременно путем сочетания множества разделяющих элементов, фильтров и источников.
Фиг.3 иллюстрирует другой способ одновременного фиксирования кинетики изменения характеристик излученного тканью света в разных спектральных диапазонах и в любой пространственной точке исследуемой зоны, до и после введения агента усиления контраста. С помощью специальной призмы (МИП) и оптики формирования изображения можно на поверхности одного и того же детектора создавать многочисленные копии одного и того же изображения. На оптическом пути лучей, создающих копии изображения объекта, могут быть размещены различные оптические фильтры (Офλ1), (Офλ2), (Офλ3) и (Офλ4) так, что многочисленные изображения будут соответствовать различным спектральным областям.
При клиническом применении предложенных способов можно сочетать различные варианты осуществления вышеописанной визуализации и стандартные оптические диагностические устройства визуализации. Такими устройствами являются разнообразные медицинские микроскопы, кольпоскопы и эндоскопы, традиционно используемые для диагностических исследований ткани in vivo. Визуализация внутренних тканей тела человека в большинстве случаев требует, чтобы освещающие и формирующие изображение лучи, распространялись по одному и тому же оптическому пути через полости в теле. В результате, в обычных оптических диагностических устройствах отражение от поверхности ткани существенным образом влияет на формируемое изображения. Это ограничивает отображение информации для характеристик подповерхностной ткани, которые обычно имеют более высокую диагностическую ценность. Эта проблема становится особенно серьезной в случае эпителиальных тканей, таких как шейка матки, гортань и полость рта, которые покрыты жидкостью, например слизью и слюной. Поверхностное отражение также затрудняет обнаружение и измерение изменений оптических свойств ткани, возникающих после введения агентов, усиливающих контраст между нормальной и патологической тканями. Более конкретно, когда агент избирательным образом меняет характеристики рассеивания патологической ткани, сильное отражение поверхности, свойственное как патологической зоне ткани (агент реагирует), так и нормальной зоне ткани (агент не реагирует), перекрывает диагностический сигнал, возникающий в результате взаимодействия агента и подповерхностных компонентов ткани. Другими словами, отражение поверхности представляет собой оптический шум в диагностическом сигнале, значительно ослабляющий различаемый контраст между зоной ткани, которая реагирует с агентом, и зоной ткани, которая не реагирует с агентом.
Для точной диагностики с применением вышеуказанных устройств формирования изображения можно использовать соответствующую оптику, исключающую шум от поверхностного отражения. Фиг.4 изображает схему медицинского микроскопа, содержащего источник света (ИС), механизм задания степени увеличения (ЗСУ), окуляр (О) и штатив для крепления блока фиксации (БФ), (детектора (детекторов), считывающего электронного оборудования и т.п.). Для исключения поверхностного отражения используют два линейных поляризатора. Свет от источника проходит через линейный поляризатор (ЛПО), в результате чего на ткань падает линейно поляризованный свет (ЛПС). Отраженный от поверхности свет (ОС) имеет такую же плоскость поляризации, что и падающий свет (отражение Френеля). За счет размещения на пути излучаемого тканью света еще одного поляризатора (ПО), ориентированного под прямым углом к первому, исключается составляющая света, отраженного поверхностью. Не отраженный от поверхности свет проходит в ткань, где поляризация света приобретает случайный характер по причине его многократного рассеивания. Таким образом, часть переизлученного света проходит через поляризационную оптическую систему формирования изображения, неся улучшенную информацию о подповерхностных компонентах.
Фиг.5 изображает эндоскоп, содержащий окуляр (О), который может быть приспособлен к электронной системе визуализации, и оптические волокна или кристаллы для передачи как освещения, так и передающих изображение лучей. Эндоскоп также содержит первый линейный поляризатор (ЛПО), размещенный на оптическом пути лучей освещения (ЛО), и второй поляризатор (ПО), ориентированный под прямым углом к первому и размещенный на пути излучаемого тканью (Т) света. Поляризатор (ЛПО) можно расположить, как показано на чертеже или, как вариант, в месте, где свет входит в эндоскоп (ЭН). В последнем случае эндоскоп следует выполнять с использованием сохраняющих поляризацию кристаллов или оптического волокна для передачи света. При использовании таких сохраняющих поляризацию средств передачи света, на пути распространения передающих изображение лучей размещают для этих лучей поляризаторы, спереди или сзади окуляра (О).
Проблема эффективного клинического осуществления вышеописанного способа связана с микродвижениями пациента во время моментальной визуализации одной и той же зоны ткани. Эта проблема устраняется, если пациент находится под наркозом (открытая операция). Однако в большинстве случаев перемещения ткани относительно блока фиксации изображения, происходящие с течением времени при последовательной фиксации изображения, приводят к появлению пикселей изображения с одинаковыми координатами изображения, которые неточно соответствуют этой же пространственной точке x, y исследуемой тканевой зоны. Эта проблема обычно встречается в кольпоскопии. Способ устранения влияния на измеряемые временные данные, оказываемого относительным взаимным перемещением ткани и блока фиксации изображения, приведен ниже.
Изображенное на фиг.6 кольпоскопическое устройство содержит шарнирный кронштейн (ШМ), на котором закреплена оптическая головка (ОГ). Головка (ОГ) включает в себя источник света (ИС), объектив (ОБ), окуляр (О) и оптику для задания степени увеличения (ЗСУ). Блок фиксации изображения подсоединен к оптической головке (ОГ) через оптико-механический адаптер. Расширитель (РШ), используемый для открывания влагалищного канала при визуализации шейки матки, механически соединен с оптической головкой (ОГ), так что его продольная ось (ПО) симметрии перпендикулярна центральной зоне объектива (ОБ). Расширитель вводят во влагалище и раскрывают его крылья, оказывая давление на боковые стенки влагалища. Расширитель (РШ), механически соединенный с оптической головкой (ОГ), передает этой головке (ОГ) любые микродвижения пациента, при этом головка, установленная на шарнирном кронштейне (ШМ), повторяет указанные движения. Таким образом, относительное положение оптической головки и ткани сохраняется почти постоянным.
Еще одним важным аспектом для успешного клинического осуществления описанного в заявке диагностического способа является синхронизация введения агента различения патологии с началом процедуры моментальной визуализации. Фиг.6 изображает распылитель (Р), присоединенный к оптической головке микроскопа. Блок (БУР) содержит электронную систему для управления распылителем агента, а также может включать в себя емкость для хранения агента. Когда блок (БУР) получает соответствующую команду от компьютера, он распыляет на поверхность ткани предварительно определенное количество агента, причем процедура моментальной фиксации изображения начинается по этой же или по другой команде.
Диагностическое обследование тканей, находящихся вне прямого доступа и расположенных в полостях тела человека (ухо, шейка матки, полость рта, пищевод, ободочная кишка, желудок) осуществляют с помощью обыкновенных клинических микроскопов. В этих устройствах лучи освещения и формирования изображения почти соосны. Более конкретно, линия, перпендикулярная месту выхода света в пространство, и линия, перпендикулярная объективу, образуют угол в несколько градусов. В результате получается, что эти микроскопы функционируют на определенном расстоянии от объекта (на рабочем расстоянии), где освещаемая зона ткани совпадает с полем зрения системы визуализации. Установлено, что эти микроскопы непригодны в случаях, когда требуется осуществлять визуализацию ткани на небольших рабочих расстояниях и через полости тела человека, имеющие малый диаметр. Эти технические ограничения препятствуют успешному клиническому осуществлению описанного в заявке способа. Как сказано выше, устранение поверхностного отражения приводит к существенному улучшению диагностической информации, получаемой из количественной оценки кинетики взаимодействия маркер-ткань. Если в качестве оптического блока визуализации использовать обычный клинический микроскоп, то на стенках полости вследствие вышеуказанной геометрии освещения-визуализации происходят многократные отражения перед тем, как при исследовании свет достигнет исследуемую ткань. Многократные отражения более многочисленны в случае кольпоскопии из-за высокой отражательной способности крыльев расширителя, вставляемого во влагалище для облегчения обследования шейки матки.
Если осветитель устройства визуализации излучает линейно поляризованный свет, то многократные отражения придают случайный характер плоскости поляризации падающего света. Как указано выше, если падающий на ткань свет не является линейно поляризованным, то исключение влияния отражения поверхности на формирование изображения не может быть эффективным.
Фиг.7 изображает оптическое устройство визуализации, содержащее источник света, расположенный в центральной части его передней апертуры. При такой конструкции центральный луч излученного светового конуса является соосным с центральным лучом светового пучка, входящего в устройство визуализации. Это позволяет лучам освещения непосредственным образом достигать поверхности исследуемой ткани до того, как произойдут многократные отражения на стенке полости или расширителя. Используется объектив-рефлектор, содержащий первое отражательное зеркало (1ОЗ) и второе отражательное зеркало (2ОЗ). Источник (ИС) света размещен позади второго отражательного зеркала (2ОЗ), вместе с оптической системой (в случае ее необходимости), предназначенной для управления световым пучком, например для трансфокации и фокусировки (ОП). Объектив-рефлектор (ОР), заменяя обычный лучепреломляющий объектив, используемый в традиционных микроскопах, обеспечивает возможность визуализации полостей малого диаметра со свободой выбора рабочего расстояния. Оптику для трансфокации и фокусировки светового пучка можно настраивать одновременно с механизмом изменения степени увеличения оптической системы визуализации так, что зона освещения и поле зрения системы визуализации изменяются синхронно и пропорционально. Таким образом, яркость изображения сохраняется независимо от степени увеличения объектива. Геометрия освещения-визуализации, реализованная в этом оптическом устройстве визуализации, наряду с возможностями по управлению световым пучком, помогает исключить составляющую поверхностного отражения, влияющую на формирование изображения, а следовательно, способствуют эффективному осуществлению описанного в заявке способа.
Эквиваленты
Специалисты в данной области техники увидят или, применяя стандартные эксперименты, смогут найти многочисленные эквиваленты конкретных вариантов выполнения предложенного изобретения. Приведенная ниже формула изобретения охватывает эти эквиваленты.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТРОЙСТВО И СПОСОБ ИЗМЕРЕНИЯ КРОВЯНОГО ДАВЛЕНИЯ | 2016 |
|
RU2648029C2 |
| СПОСОБ ИНТРАОПЕРАЦИОННОЙ ВИЗУАЛИЗАЦИИ ПАТОЛОГИЧЕСКИХ ОЧАГОВ | 2012 |
|
RU2544094C2 |
| УСТРОЙСТВО И СПОСОБ ОПРЕДЕЛЕНИЯ ПОКАЗАТЕЛЕЙ ЖИЗНЕДЕЯТЕЛЬНОСТИ СУБЪЕКТА | 2014 |
|
RU2669616C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ ХРОМОФОРОВ БИОЛОГИЧЕСКОЙ ТКАНИ | 2012 |
|
RU2506567C1 |
| СПОСОБ МУЛЬТИСПЕКТРАЛЬНОЙ ВИЗУАЛИЗАЦИИ И УСТРОЙСТВО ДЛЯ ИЗМЕРЕНИЯ КРИТИЧЕСКОГО РАЗМЕРА НАНОСТРУКТУР | 2014 |
|
RU2560245C1 |
| СПОСОБ ВИЗУАЛИЗАЦИИ ГЛИМФАТИЧЕСКОЙ СИСТЕМЫ МОЗГА МЕТОДОМ ОПТИЧЕСКОЙ КОГЕРЕНТНОЙ ТОМОГРАФИИ IN VIVO | 2019 |
|
RU2703393C1 |
| СПОСОБ МОНИТОРИНГА НАРУШЕНИЙ МИКРОГЕМОДИНАМИКИ В ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЕ ЛАБОРАТОРНЫХ КРЫС | 2017 |
|
RU2648037C1 |
| ИНТЕЛЛЕКТУАЛЬНАЯ НАСАДКА НА СМАРТФОН ДЛЯ ОПРЕДЕЛЕНИЯ ЧИСТОТЫ, ВЛАЖНОСТИ И ФОТОВОЗРАСТА КОЖИ | 2016 |
|
RU2657377C2 |
| ОПТИЧЕСКОЕ УСТРОЙСТВО ДЛЯ БИОМЕХАНИЧЕСКОЙ ДИАГНОСТИКИ ЗАБОЛЕВАНИЯ ГЛАЗА | 2015 |
|
RU2661730C1 |
| СПЕКТРОМЕТРИЧЕСКОЕ ДИАГНОСТИЧЕСКОЕ УСТРОЙСТВО | 1994 |
|
RU2080815C1 |
Изобретение относится к медицине, а именно к средствам для неинвазивного раннего обнаружения in vivo изменений, происходящих в биохимических и/или функциональных характеристиках эпителиальных тканей, по мере развития атипии, дисплазии, неоплазии и рака, а также для картографирования степени этих изменений. Способ основан на одновременном измерении пространственных, временных и спектральных изменений в характеристиках переизлученного исследуемой тканью света, которые происходят в результате совместного возбуждения ткани светом и специальными химическими агентами. Топическое или систематическое применение таких агентов приводит к недолговечному усилению контраста между нормальной и анормальной тканевыми зонами. Системы для определения параметров и картографирования поражений ткани обеспечивают фиксацию последовательных во времени изображений как в одном спектральном диапазоне, так и одновременно в нескольких спектральных диапазонах. Одна из систем содержит оптическую головку, оптическую систему для фокусировки переизлучаемого тканью света, детекторы изображения, аппликатор для нанесения агента распознавания патологии на образец ткани, источник света для освещения объекта и оптические фильтры. Вторая система дополнительно включает зонд, выполненный с возможностью крепления и устранения движения между тканью и оптической головкой. Использование изобретения позволяет повысить точность диагностирования предраковых состояний на ранней стадии развития. 3 н. и 45 з.п. ф-лы, 7 ил.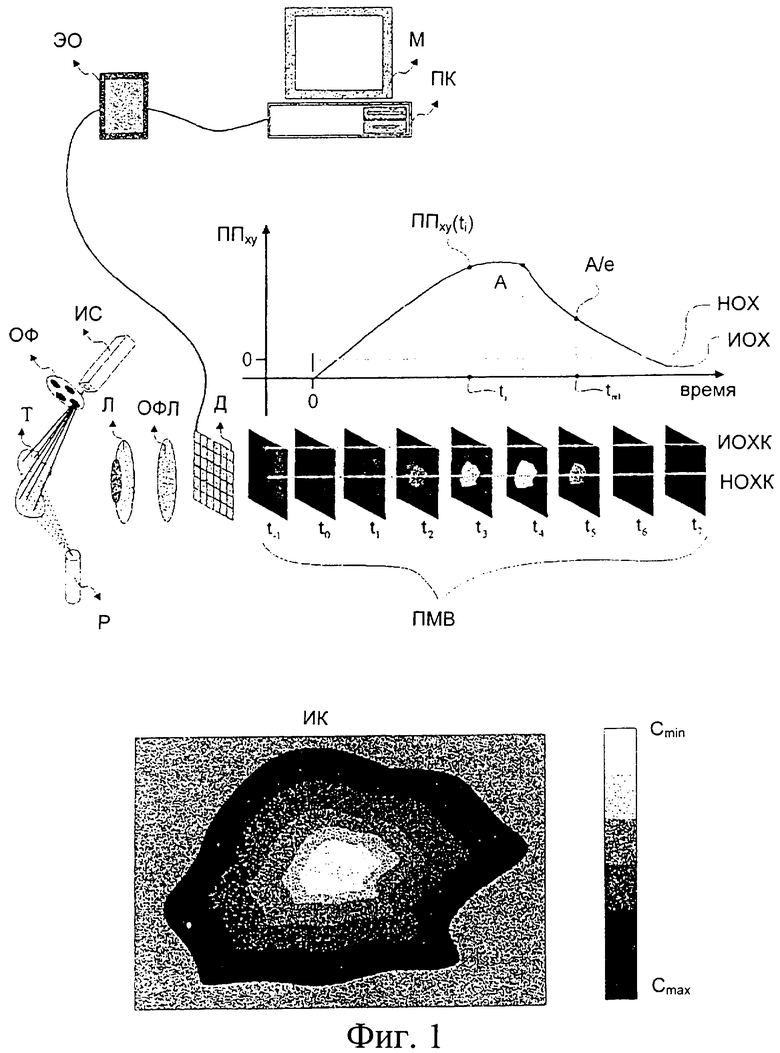
а. оптическую головку для построения изображений, состоящую из:
I. оптической системы для улавливания и фокусирования переизлученного исследуемой тканью света и
II. детектора(ов) изображения, соединенного(ых) с платой для преобразования данных в цифровую форму и компьютером для фиксации множества изображений образца ткани в разные моменты времени, до и после введения указанного агента;
b. аппликатор для нанесения агента распознавания патологии на исследуемый образец ткани;
с. компьютер, содержащий средства хранения, программное обеспечение и аппаратные средства для анализа и обработки;
d. монитор для демонстрации изображений, кривых и числовых данных;
е. источник света для освещения образца ткани широкополосным непрерывным оптическим излучением;
f. оптические фильтры для выделения спектрального диапазона визуализации и освещения,
отличающаяся тем, что указанная система запрограммирована для выполнения моделирования и параметрического анализа кривых изменения пиксельных значений ППXY во времени, полученных, для заданного пространственного положения XY и для любого пространственного положения исследуемого образца живой ткани, из пары пиксельных значений ППXY, расположенных в соответствующей паре пространственных координат XY на указанных изображениях в моменты времени (ti), в которых указанные пиксельные значения были записаны, для вычисления параметров по указанным кривым, выражающих динамическое оптическое свойство, и для создания и отображения одного или более изображений, которые выражают пространственное распределение одного или более указанных параметров, выражающих динамические оптические свойства.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| S.ANDERSON ENGLES et al «In vivo fluorescence imaging for tissue diagnostics» | |||
| Phys, Med | |||
| Biol | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| УСТРОЙСТВО ДЛЯ СПЕКТРАЛЬНОЙ ДИАГНОСТИКИ И ИЗБИРАТЕЛЬНОЙ ФОТОТЕРАПИИ | 1997 |
|
RU2138306C1 |
| US 5989184 A, 23.11.1999 | |||
| ЛЕЧЕБНО-ДИАГНОСТИЧЕСКОЕ УСТРОЙСТВО ДЛЯ ФОТОТЕРАПИИ ПАТОЛОГИЧЕСКИХ НОВООБРАЗОВАНИЙ | 1991 |
|
RU2080893C1 |
| Устройство для диагностики и фотодинамической терапии | 1990 |
|
SU1803154A1 |
Авторы
Даты
2006-12-10—Публикация
2001-03-28—Подача