Изобретение относится к области автоматизированного анализа биологических тканей и медицинского приборостроения.
Оптические способы диагностики состояния тканей организма находят широкое применение в онкологии, хирургии, неонатологии, педиатрии, дерматологии, офтальмологии, косметологии и в ряде других областей. В наиболее простых способах спектроскопии диффузного отражения измеряют спектральные значения коэффициента диффузного отражения (КДО) освещающего излучения от биологической ткани (например, кожи и слизистой оболочки), используя спектрофотометр с интегрирующей сферой [1, 2] или оптоволоконную технику с небольшим пространственным смещением каналов возбуждения и регистрации оптического излучения [3-5]. Измеряемые КДО содержат информацию о биофизических параметрах ткани, таких как плотность и размеры «эффективных» рассеивателей, концентрация меланина, билирубина, гемоглобина, оксигенация венозной и артериальной крови и т.д., что при правильной их интерпретации позволяет выявлять патологические изменения ткани, плохо различимые при визуальном наблюдении.
Основной недостаток отмеченных способов - их локальность, поскольку измерения проводятся только в одной точке ткани. Намного больший объем информации можно получить при определении пространственного распределения биофизических параметров ткани, что важно, например, в онкологии при поиске и локализации злокачественных новообразований [6], а также при оценке метаболизма тканей сетчатки и функционального состояния сосудистого русла глазного дна [7].
Способы мультиспектрального анализа изображений биологических объектов [6, 8-11] обладают более широкими диагностическими возможностями. Здесь результаты измерений при дискретизации и квантовании измеряемых потоков излучения, рассеянных тканью, представляют в виде мультиспектрального изображения - многослойной матрицы V с размерностью j×i×k, где каждый k-ый слой представляет монохромное изображение с размерами j×i, полученное в k-ом участке диапазона спектра, используемого при измерениях. Практическая применимость этой информации при вынесении диагностических заключений может быть обеспечена при построении на ее основе двумерных распределений информативных структурных и биофизических параметров ткани. К сожалению, одновременный анализ пространственной и спектральной составляющих получаемой информации затруднен большой трудоемкостью обратной задачи восстановления параметров биологических тканей в каждой точке j, i полученного мультиспектрального изображения. Для ее решения обычно используют какой-либо инверсный метод, содержащий алгоритм решения обратной задачи и один из методов решения уравнения переноса излучения в среде, моделирующей биологическую ткань. Известные простые численные методы расчета характеристик поля рассеянного излучения не обеспечивают необходимой точности, а более сложные требуют больших затрат машинного времени, что делает невозможным оперативную интерпретацию результатов измерений. К тому же, для устойчивого восстановления определяемых биофизических параметров необходимо, чтобы количество спектральных участков, используемых для регистрации отраженного (рассеянного) тканью излучения, в несколько раз превышало число определяемых параметров.
Известны способы определения содержания меланина, окисленного и неокисленного гемоглобина в коже по ее мультиспектральным изображениям [12-14], основанные на определении значений логарифма коэффициента отражения света А(λ)=ln[I(λ)/I0(λ)] (где λ - длина волны света, I - интенсивность отраженного кожей света, I0 - аналогичная величина для абсолютно белого и плоского диффузного отражателя) в небольшом количестве спектральных участков для каждой точки изображения и процедуре подбора параметров прямой задачи, при которых ее решение будет наиболее близким к результатам измерений А(λ). Для решения прямой задачи используются либо наиболее простые, и, разумеется, наименее точные методы теории переноса излучения (например, закон Ламберта-Бера, теория Кубелки-Мунка и т.д.), либо аналитические зависимости А(λ) в используемых спектральных участках от искомых параметров ткани, полученные путем аппроксимации расчетов А(λ) по методу Монте-Карло.
Эти способы также не обладают оперативностью, поскольку требуют значительных затрат машинного времени на подгонку параметров модели ткани под зарегистрированные значения А(λ) для всех точек изображения. Кроме того, в них не учитываются вариации рассеивающих свойств кожи, диаметра капилляров и показателя преломления кожи.
В [15] описан способ преобразования мультиспектрального изображения кожи в качественную картину двумерного распределения ее хромофоров (пигментов) с использованием предварительно получаемых матриц линейного преобразования мультиспектрального изображения в независимые компоненты измерений, которые далее преобразуются в относительные данные о хромофорах кожи. Этот способ требует предварительного проведения процедуры обучения с использованием набора изображений кожи достаточно большой группы добровольцев с разными типами кожи и подбора их параметров путем моделирования процессов переноса излучения в коже.
К недостаткам этого способа следует отнести сложность процедуры получения матрицы преобразования мультиспектрального изображения в независимые компоненты измерений, поскольку необходима обучающая выборка, невысокую точность линейного преобразования независимых компонент измерений в относительные данные о пигментации кожи из-за сложной и нелинейной зависимости измеряемых сигналов от большого числа структурных и биофизических параметров кожи, влияние на получаемые распределения хромофоров неравномерного освещения кожи, ее рельефа и положения относительно системы регистрации мультиспектрального изображения. Зависимость вышеотмеченных матриц преобразования от спектральных характеристик и конструктивных параметров системы регистрации, используемой для получения базы изображений кожи, которая необходима для процедуры обучения, не позволяет использовать этот способ при других параметрах и характеристиках системы регистрации мультиспектральных изображений.
Наиболее близким к заявляемому изобретению является способ оперативного получения двумерных распределений концентраций хромофоров кожи Cq(x, y) [16], заключающийся в ее равномерном освещении излучением с широким спектром, регистрации мультиспектрального изображения V(x, y, Λk), где х, y - координаты элемента поверхности кожи, Λk - k-ый участок спектра, преобразовании спектральных сигналов каждой точки изображения в проекции на пространство главных компонент спектра диффузного отражения кожи, преобразовании полученных проекций в концентрации хромофоров кожи с использованием соответствующих таблиц.
Последовательность действий при формировании первой таблицы состоит из двух этапов. На первом этапе проводят многочисленные фотометрические измерения спектров отражения образцов кожи с одновременной регистрацией их мультиспектральных изображений, получают регрессии между изображениями с камеры и спектром отражения кожи. На втором этапе с использованием представительной в статистическом плане выборки спектров диффузного отражения кожи определяют их главные компоненты, перебирают всевозможные комбинации спектральных сигналов изображения, конвертируют их в спектры отражения кожи с использованием полученных на первом этапе регрессий и проектируют спектры отражения на пространство из главных компонент. В результате получают таблицу для преобразования спектральных значений пикселей в проекции на пространство главных компонент.
Вторая таблица служит для преобразования проекций спектра диффузного отражения кожи на пространство главных компонент в значения концентраций хромофоров кожи. Эта таблицу получают путем численного моделирования спектров диффузного отражения кожи при различных концентрациях ее хромофоров. Смоделированные спектры отражения проектируют на пространство из главных компонент и таким образом формируют искомую таблицу.
К недостаткам способа относятся необходимость равномерного освещения исследуемого участка кожи, зависимость значений первой таблицы от положения и ориентации ткани относительно объектива камеры, а также спектральных и конструктивных параметров системы регистрации мультиспектральных изображений. В связи с этим при разработке новых систем необходимо каждый раз выполнять длительный, трудоемкий и дорогостоящий этап получения соответствующих им таблиц преобразования. Зависимость же способа от освещения ткани и геометрии схемы измерений затрудняет его использование в тех случаях, когда учет этих факторов не представляется возможным, например при исследовании сетчатки и слизистых оболочек. Кроме того, данный способ теряет оперативность при высоком спектральном разрешении изображений, что связано с большой размерностью таблиц соответствующих преобразований. Поиск нужных значений в таких таблицах не реализуем в реальном масштабе времени даже с использованием современных компьютеров. Поэтому способ не позволяет в полной мере решить задачу оперативной количественной интерпретации изображениях ткани с произвольным количеством спектральных слоев.
Задача предлагаемого изобретения направлена на повышение точности получения двумерных распределений концентрации хромофоров биологических тканей Cq(x, y) (кожи, слизистых оболочек, сетчатки и т.д.) за счет использования высокого спектрального разрешения изображений ткани; устранение зависимости способа от спектральных и конструктивных характеристик измерительного устройства, упрощение и снижение стоимости реализации способа за счет исключения процедуры получения мультиспектральных снимков и спектров отражения ткани для представительной в статистическом плане группы добровольцев, исключение влияния на Cq(x, y) неравномерной освещенности ткани, ее рельефа и ориентации по отношению к измерительной системе и достижение оперативности обработки мультиспектральных изображений за счет использования универсальных для всех точек изображения аналитических выражений, связывающих концентрации хромофоров ткани с нормированными спектральными сигналами изображения r(Λk)=V(Λk)/V(Λ0), где Λ0 - опорный спектральный участок; расширение функциональных возможностей способа за счет возможности определения концентраций хромофоров сетчатки, слизистых оболочек и т.д..
Поставленная задача достигается тем, что в способе определения концентраций хромофоров биологической ткани, заключающемся в освещении ткани излучением с широким спектром, регистрации мультиспектрального изображения V(x, y, Λk), где х, y - координаты элемента поверхности ткани, Λk - k-ый участок спектра, преобразовании мультиспектрального изображения по заранее определенной последовательности действий в распределения концентраций хромофоров Cq(x,y), параметры преобразования для системы регистрации изображений с заданными аппаратурными функциями, включающие главные компоненты нормированных спектральных сигналов r(Λk)=V(Λk)/V(Λ0), где Λ0 - опорный спектральный участок, и коэффициенты нелинейных множественных регрессий между концентрациями хромофоров Cq и нормированными сигналами r(Λk) или их проекциями на пространство главных компонент, определяют путем моделирования переноса излучения в ткани с учетом характеристик используемой системы регистрации и возможных диапазонов вариаций структурных и биохимических параметров ткани, ткань освещают линейно поляризованным излучением, регистрируют мультиспектральное изображение V⊥(x, y, Λk) с поляризацией ортогональной поляризации освещающего излучения, дополнительно регистрируют мультиспектральное поляризованное изображение ν⊥(x, y, Λk) при отсутствии освещения ткани, для каждой точки x, y получают нормированные спектральные сигналы r(Λk) путем нормировки слоев разностного мультиспектрального изображения V⊥(x, y, Λk) - ν⊥(x, y, Λk) на разностный опорный слой V⊥(х, y, Λ0) - ν⊥(х, y, Λ0), а о концентрации хромофоров Cq(x, y) в каждой точке х, y судят по соответствующим ей нормированным спектральным сигналам с использованием нелинейных множественных регрессий между Cq и r(Λk) или между Cq и проекциями r(Λk) на пространство главных компонент.
Свойства, появляющиеся у заявляемого технического решения, следующие:
1) повышение точности получения двумерных распределений концентрации хромофоров биологических тканей Cq(x, y) (кожи, слизистых оболочек, сетчатки и т.д.);
2) устранение зависимости способа от спектральных и конструктивных характеристик измерительного устройства, упрощение и снижение стоимости реализации способа;
3) исключение влияния на Cq(x, y) неравномерной освещенности ткани, ее рельефа и ориентации по отношению к измерительной системе;
4) достижение оперативности обработки мультиспектральных изображений;
5) расширение функциональных возможностей способа;
6) возможность количественной интерпретации цветных изображений кожи.
Сущность данного изобретения поясняется с помощью фиг.1-6.
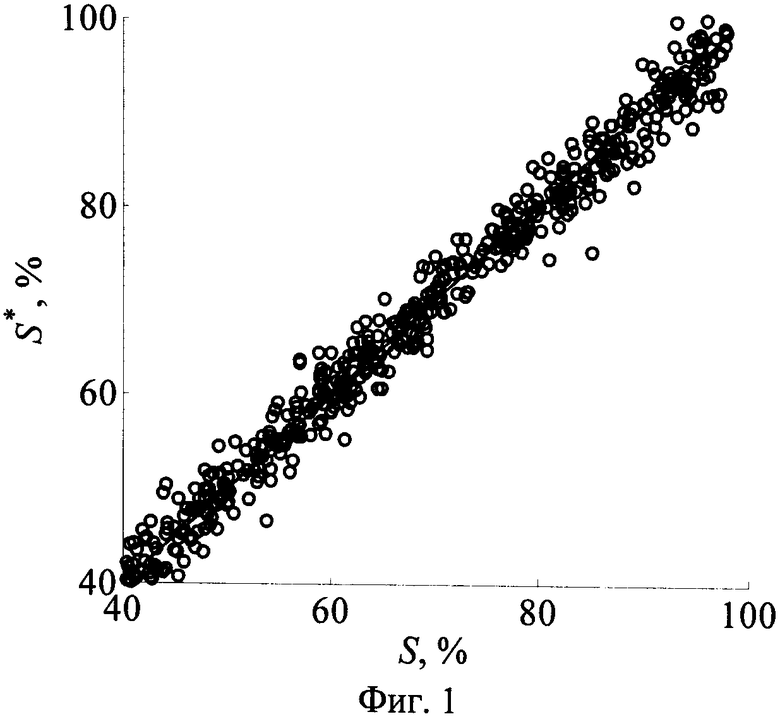
Фиг.1 - Результаты восстановления степени оксигенации венозно-артериальной крови с использованием шести главных компонент r(Λk).
Фиг.2 - Результаты восстановления интегрального содержания меланина в эпидермисе с использованием шести главных компонент r(Λk).
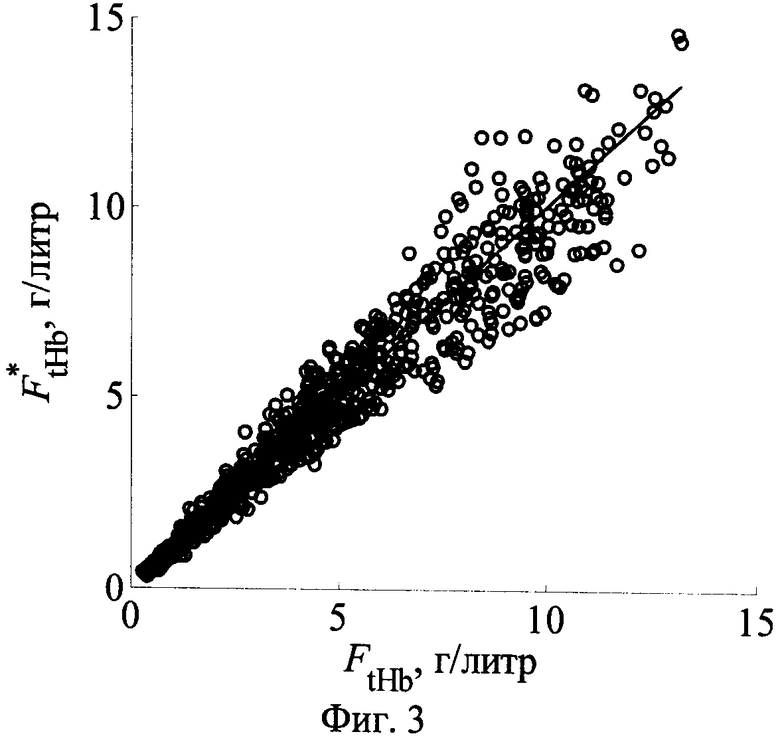
Фиг.3 - Результаты восстановления концентрации общего гемоглобина в дерме с использованием шести главных компонент r(Λk).
Фиг.4 - Сопоставление истинных и предсказанных по коэффициентам r(Λk) концентраций общего гемоглобина у новорожденных
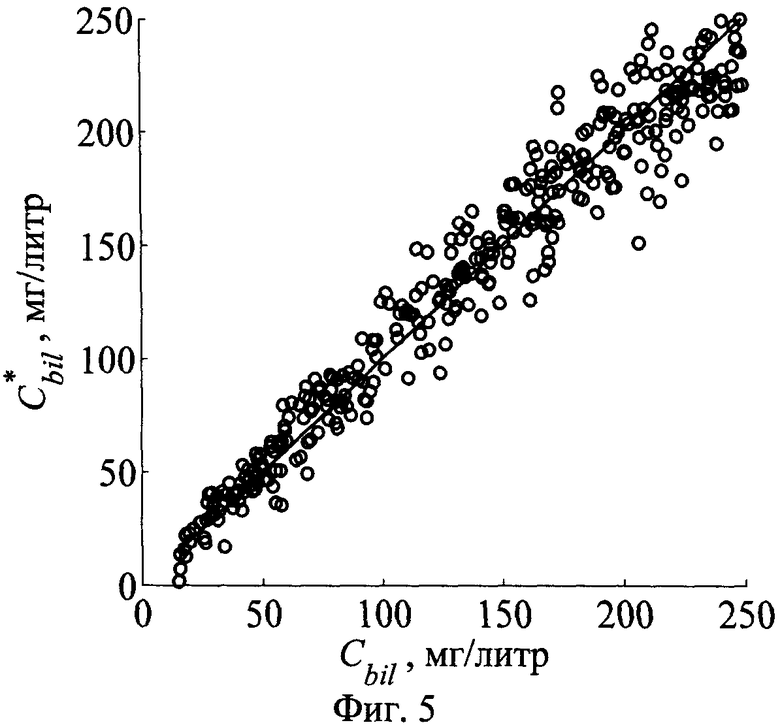
Фиг.5 - Сопоставление истинных и предсказанных по коэффициентам r(Λk) концентраций общего билирубина у новорожденных
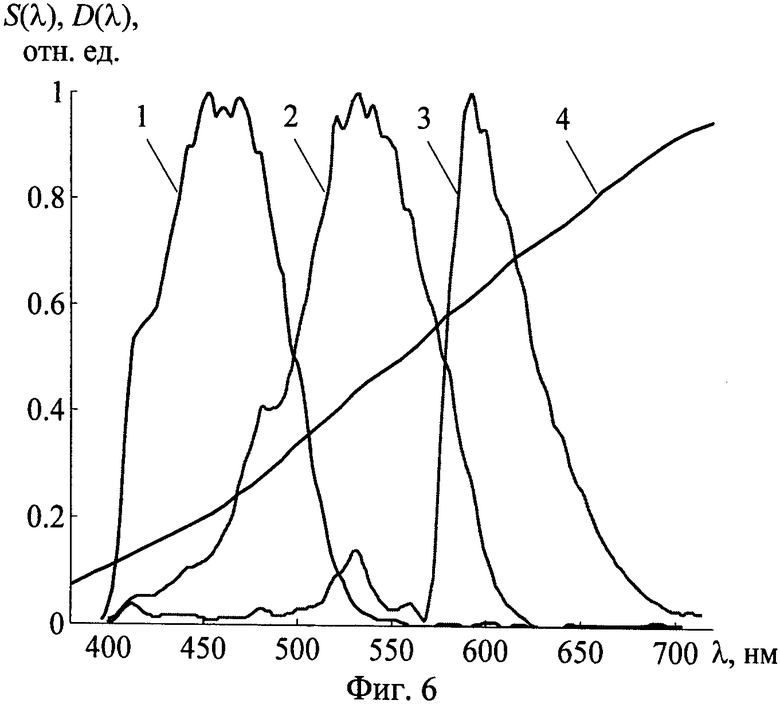
Фиг.6 - Используемые при моделировании профили относительной спектральной чувствительности цветной камеры Di(λ) (кривые 1-3) и мощности лампы S(λ) (кривая 4).
Для пояснения последовательности действий, которые необходимо выполнять при реализации заявляемого способа, рассмотрим вначале преобразование мультиспектральных изображений ткани в распределения концентраций ее хромофоров.
При получении мультиспектрального изображения обычно используют монохромную (черно-белую) матрицу, а спектральную селекцию осуществляют с помощью перестраиваемого оптического фильтра, например, на жидких кристаллах [17-18], который может устанавливаться или перед объективом цифровой камеры или перед источником излучения, освещающего ткань. Для устранения бликов в изображении ткани необходимо дополнительно использовать при освещении ткани и регистрации рассеянного ей излучения поляризаторы, оси которых ориентированы перпендикулярно друг другу. Поскольку излучение, отражаемое поверхностью ткани, сохраняет исходную поляризацию, использование скрещенных поляризаторов позволяет блокировать эту паразитную составляющую. При этом рассеянное обратно излучение частично проходит через поляризатор системы регистрации и попадает на матрицу фотоприемников, на выходе которой последовательно при смене спектрального состава формируются кадры или слои мультиспектрального изображения со значениями сигналов V⊥(x, y, Λk), пропорциональных освещенности изображения ткани.
При освещении ткани линейно поляризованным излучением Е||(х, y, λ) и регистрации ее изображения V⊥(хi, yj, Λk) с поляризацией, ортогональной поляризации освещающего излучения, формируемое мультиспектральное изображение определяется в соответствии с формулой

где xi, yj - координаты элемента поверхности ткани; θij - угол между нормалью к элементу поверхности ткани и направлением на объектив камеры; R(x, y, λ) - спектрально-пространственный профиль КДО ткани; λl и λr - левая и правая границы диапазона спектра, используемого системой регистрации; Fk(λ) - пропускание перестраиваемого оптического фильтра в k-ом спектральном участке Λk; D(λ) - спектральная чувствительность приемника или цифровой камеры.
Карты распределения параметров ткани получают в результате решения обратной задачи по интерпретации зарегистрированного дискретного спектра каждой точки изображения с использованием модели переноса излучения в ткани. Считая, что относительное спектральное распределение освещенности не зависит от координат точки на поверхности ткани, можно выполнить разделение E||(xi, yj, Λk) на спектральную S(λ) и пространственную A(xi, yj) компоненты
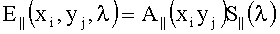
и исключить вклад функций 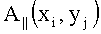
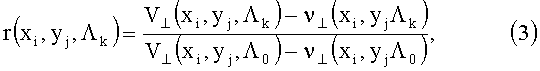
где Λ0 - опорный спектральный слой изображения, ν⊥(xi, yj, Λk) - регистрируемые изображения при выключенном источнике подсветки. Это позволяет устранить влияния неравномерной освещенности ткани E||(хi, yj, Λk) и угла наблюдения θij. Нормированный сигнал является уже функцией длины волны, т.е. r(Λk)=V(Λk)/V(Λ0). При высоком спектральном разрешении изображений используют перестраиваемый фильтр с узкой полосой пропускания Δλ, что позволяет под Λk понимать средние длины волн этих участков - λk.
Алгоритм решения обратной задачи одинаков для всех точек зарегистрированного изображения, поэтому будем вести его дальнейшее изложение без указания зависимости нормированных спектральных сигналов r(хi, yj, Λk) от координат (xi, yj). Спектральные значения r(Λk) или lnr(Λk) удобно представить в виде вектора измерений r из NΛ компонент. С помощью метода главных компонент вектор r разлагается по системе ортогональных векторов спектра диффузного отражения ткани, причем оптимальной аппроксимацией r является разложение по собственным векторам его ковариационной матрицы
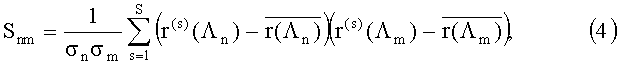
где 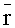

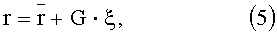
где G=(g1, …, gP) - матрица размером NΛ×P со столбцами из главных компонент gk; Р - число главных компонент; ξ=(ξ1, …, ξP) - коэффициенты разложения (проекции r на пространство из главных компонент), которые находятся по формуле

где индекс T означает операцию транспонирования.
В связи с быстрой сходимостью рассматриваемого разложения на первые собственные векторы матрицы (4), соответствующие наибольшим собственным числам, приходится большая часть изменчивости r(Λk), которая обусловлена вариациями структурных и биохимических параметров ткани. Таким образом, можно значительно уменьшить размерность исходных данных и выделить из них несколько независимых компонент, содержащих в себе столько же информации, сколько ее было в исходных данных. Количество независимых компонент, содержащихся в спектрах r(Λk), определяется путем анализа собственных чисел li(i=1, …, NΛ) матрицы (4). Каждое из собственных чисел характеризует относительный вклад соответствующего ему собственного вектора в вариации r(Λk). Число независимых компонент определяется номером собственного числа, для которого li>δr2, где δr - погрешность измерений r(Λk).
Из вышесказанного следует, что для решения обратной задачи можно использовать не сами нормированные спектральные сигналы r(Λk), а их проекции ξ на пространство главных компонент. При этом для нахождения концентрации хромофоров ткани удобно использовать предварительно полученные аналитические выражения, связывающие данные параметры с проекциями ξ. В качестве таких выражений можно использовать полиномиальные регрессии:
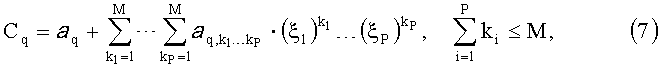
где Cq - концентрация q-то хромофора или ее логарифм; Р - количество главных компонент; a
q и 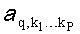
Любую реализацию нормированного спектра r(λ), соответствующего высокому спектральному разрешению системы регистрации, можно с достаточной точностью аппроксимировать при помощи первых Р собственных векторов матрицы (4). При этом коэффициенты разложения r(λ) по собственным векторам можно находить непосредственно из системы уравнений (5), располагая данными измерений для Р спектральных участков - r(Λk), k=1, …, Р. Точность аппроксимации при этом ухудшается, но зато появляется возможность восстановления промежуточных значений спектра r(λ) по нескольким точкам. Что касается концентраций хромофоров ткани Cq, то их в этом случае можно определять как из коэффициентов ξn, так и напрямую из измеряемых коэффициентов r(Λk), например, при помощи полиномиальных регрессий:

Решение обратной задачи, выражающееся регрессионной зависимостью (8), более предпочтительно в практическом плане, чем решение (7), поскольку позволяет определять параметры ткани по ее изображениям в малом количестве спектральных участков.
Таким образом, решение обратной задачи по интерпретации мультиспектральных изображений биологических тканей предлагается осуществлять с использованием аналитических выражений, связывающих искомые параметры ткани с нормированными спектральными сигналами r(Λk) или их проекциями на пространство главных компонент. Главные компоненты и вышеупомянутые аналитические выражения устанавливаются на основе моделирования переноса излучения в ткани и процесса регистрации ее изображения с учетом характеристик используемой системы регистрации и возможных диапазонов вариаций структурных и биохимических параметров ткани, что позволяет исключить дорогостоящий, трудоемкий и длительный этап получения мультиспектральных изображений ткани для представительной в статистическом плане группы добровольцев. Данный метод не имеет ограничений по количеству спектральных участков и позволяет в реальном масштабе времени определять диагностически важные параметры ткани при общей вариативности всех других ее параметров.
Процесс получения главных компонент и аналитических выражений включает следующие этапы: 1) на основе одного из методов решения уравнения переноса излучения и оптико-статистической модели биологической ткани моделируется ансамбль реализаций параметров ткани (в том числе и концентраций ее хромофоров) и соответствующих им сигналов ее изображения в спектральных участках Λk=[λk-Δλk/2; λk+Δλk/2]:
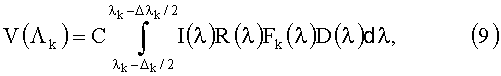
где I(λ), F(λ) и D(λ) - спектральные профили мощности источника излучения, пропускания фильтра и чувствительности камеры используемой системы визуализации, С - масштабный коэффициент, значение которого можно выбрать произвольно; 2) для каждой реализации параметров ткани и соответствующих им спектральных сигналов V(Λk) рассчитываются нормированные спектральные сигналы - r(Λk)=V(Λk)/V(Λ0), где Λ0 - один из спектральных участков; 3) на основе регрессионного метода, метода главных компонент или других математических методов анализа полученного ансамбля реализаций концентраций хромофоров ткани Cq и r(Λк) определяются главные компоненты r(Λk) и параметры аналитических выражений, связывающих Cq с r(Λk) или проекциями r(Λk) на пространство главных компонент.
Рассмотрим более детально процесс получения главных компонент измерений r(Λk и аналитических выражений (7), (8) на примере определения концентраций хромофоров кожи.
Оптико-статистическая модель кожи.
Будем рассматривать кожу как плоскопараллельную, горизонтально-однородную среду, включающую два слоя, принципиально отличающихся по составу и оптическим свойствам. Верхний слой - эпидермис с толщиной Lepi=50-150 мкм [2, 19, 20], нижний - дерма, которая в оптическом плане считается бесконечно толстой. Показатель преломления слоев кожи относительно воздуха считается одинаковым nskin=1.4-1.5, поэтому френелевское отражение излучения имеет место только на границе раздела кожи с внешней средой.
Объемные коэффициенты поглощения эпидермиса kepi и дермы kderm моделируются как линейная комбинация коэффициентов поглощения обескровленной ткани kt [20], воды kw [21], меланина кmе1 [22] и крови kblood:

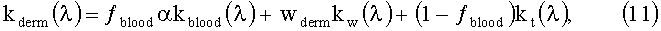
где ƒmеl=0.5-20%, wepi=20-40% - объемное содержание меланина и воды в составе эпидермиса; fblood=0.2-7%, wderm=60-77% - объемные содержания кровеносных сосудов и воды в составе дермы; α - корректирующий фактор, учитывающий эффект локализованного поглощения света кровеносными сосудами [23, 24]. Для хаотически распределенных капилляров с диаметром D=5-30 мкм коэффициент α можно определить на основе следующего выражения [24]:
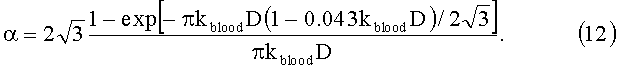
Коэффициент поглощения крови может быть представлен в виде суммы коэффициентов поглощения окси- и деоксигемоглобина:
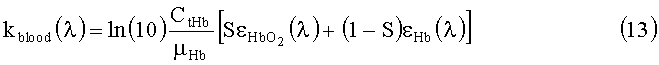
где СtHb=120-190 г/литр - концентрации общего гемоглобина в крови; µHb =64500 г/моль - молярная масса гемоглобина; 
Спектр редуцированного коэффициента рассеяния µs(λ) эпидермиса и дермы моделируется как суперпозиция спектров рассеяния, соответствующих рассеивателям Ми и Рэлея с размерами d<<λ соответственно:
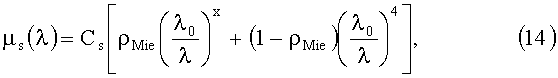
где λ0=632 нм; Cs=0.7-5 мм-1; ρMie=0.1-0.6 - доля рассеяния Ми; х=0.5-1.0 - параметр спектральной зависимости рассеяния Ми. Параметры Cs, ρMie и х зависят от объемного содержания и размера «эффективных» рассеивателей кожи - волокон соединительной ткани [22, 26, 27]. В качестве индикатрисы рассеяния элементарного объема кожи используется функция Хеньи-Гринштейна [28], спектральная зависимость фактора анизотропии которой описывается эмпирическим соотношением [20]:

Для моделирования процесса распространения оптического излучения в коже использовался метод Монте-Карло [28], основанный на прослеживании случайных блужданий большого количества фотонов от точки их влета в среду до их поглощения или вылета из среды. Фонтом кожи представляет собой цилиндр с радиусом 10 мм и высотой 5 мм. Такие размеры выбираются с тем расчетом, чтобы, с одной стороны, устранить эффект границ, а с другой - уменьшить время счета. В расчете принимается, что зондирующее излучение состоит из 5·105 фотонов, вводимых в среду в начале координат в направлении нормали к поверхности цилиндра.
Расчет сигналов r(Λk) осуществлялся по следующей схеме. Случайным образом выбирались значения модельных параметров из вышеуказанных диапазонов их вариаций. Для каждой реализации модельных параметров по формулам (10)-(15) производился расчет оптических параметров g(λ), µs(λ), kepi(λ) и kderm(λ) на 31 Длине волны из диапазона λ=450-800 нм, характеризующих основные особенности спектральных кривых поглощения хромофоров кожи. В соответствии с полученными спектральными значениями оптических параметров методом Монте-Карло моделировался спектр КДО кожи - R(λ) и рассчитывались сигналы r(Λk)=A(λ)[R(λk)/R(λ0)], λk - центральная длина волны спектрального интервала Λk, λ0=610 нм - нормировочная длина волны, A(λ) - аппаратурная функция, учитывающая относительные спектральные зависимости мощности источника света, пропускания фильтров и чувствительность камеры (в расчетах принималась равной единице), k=1, …, 30. Данная процедура повторялась для 103 реализаций r(Λk), что, как будет видно ниже, является достаточным для получения статистически значимых результатов. В результате был сформирован ансамбль реализаций модельных параметров Cq и соответствующих им сигналов r(Λk).
Анализ погрешностей восстановления концентраций хромофоров кожи.
На основе смоделированного ансамбля реализаций r(Λk) рассчитывается средний вектор измерений 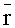
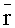
Погрешности восстановления концентраций хромофоров из сигналов r(Λk) оцениваются путем замкнутого численного эксперимента, суть которого состоит в следующем. При каждой реализации модельных параметров и соответствующих им r(Λk) осуществляется расчет концентраций с использованием формул (7), (8) при наложении на r(Λk) случайных отклонений в пределах δr (моделирующих погрешности спектральных измерений). Полученное в результате значение 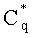
Результаты вышеописанного анализа позволяют сделать следующие выводы. Коэффициенты r(Λk), измеряемые с погрешностью δr=1-2%, обладают невысокой информативностью относительно диаметра капилляров с кровью D, толщины эпидермиса Lepi и параметров, характеризующих относительный спектральный ход редуцированного коэффициента рассеяния (Сs, ρMie и х). Информативность их восстановления, как отношение средних по ансамблю погрешностей восстановления к априорной неопределенности, близка к единице.
Наиболее информативными измерения r(Λk) являются относительно интегрального содержания меланина в эпидермисе ODepi=ƒmelLepi, концентрации общего гемоглобина в дерме FtHb=ƒbloodCtHb и насыщения крови кислородом S. Результаты восстановления этих параметров с использованием аналитических выражений (7) представлены на фиг.1-3. Средние погрешности восстановления ODepi, FtHb, S составляют соответственно 11.2, 10.9, 2.9%. Следует отметить, что наибольшие погрешности восстановления параметра S соответствуют малой концентрации кровеносных сосудов в дерме и высокому содержанию меланина в эпидермисе. Это связано с тем, что спектральные особенности поглощения света гемоглобином в спектрах отражения темной кожи маскируются значительно более сильным поглощением меланина. В связи с этим коэффициенты регрессии (7) для данного параметра получены на основе реализаций r(λ), соответствующих ƒblood>1%. Как видно из фиг.1а, при таких значениях ƒblood параметр S можно определять с достаточно высокой точностью вне зависимости от пигментации кожи.
Определение уровня билирубина и гемоглобина у новорожденных.
Рассматриваемый способ позволяет также определять концентрацию билирубина в тканях кожного покрова. Известно, что анемия и гипербилирубинемия (желтуха) являются наиболее часто встречающимися болезнями новорожденных. Частота встречаемости ранней анемии у недоношенных детей составляет 27,3±3,9%, желтуха проявляется у каждого третьего новорожденного [29]. Возможность опасных последствий этих заболеваний заставляет производить периодический контроль уровня билирубина и гемоглобина у новорожденных. При этом кровопотери при взятиях крови только усугубляют состояние ребенка.
В связи с этим рассмотрим оценки точности определения содержаний гемоглобина FtHb и билирубина Сbil в тканях кожного покрова по мультиспектральным изображениям ткани на 31 длине волны из диапазона 450-800 нм. Для построения регрессионных зависимостей между параметрами FtHb, Сbil и независимыми компонентами спектра диффузного отражения кожи использовалась оптико-статистическая модель кожи новорожденных. Диапазоны вариаций параметров оптической модели кожи приведены в таблице
Анализ собственных чисел ковариационной матрицы r(Λk) позволил выявить, что при δr=1% сигналы r(Λk) содержат 6 независимых компонент. Результаты замкнутых численных экспериментов по восстановлению FtHb и Сbil для ансамбля из 500 реализаций r(Λk) представлены на фиг.4, 5. Как видно, полученные регрессионные зависимости позволяют надежно определять параметры FtHb и Сbil в диапазонах их вариаций, характерных для кожи новорожденных. Коэффициенты корреляции между известными и восстановленными значениями FtHb и Сbil составляют соответственно 0.971 и 0.976 соответственно. Для сравнения следует отметить, что способ [30], положенный в основу транскутанного билирубинометра для новорожденных BiliCheck фирмы Philips Respironics, позволяет измерять уровень билирубина с корреляцией 0.95. Оба способа позволяют определять билирубин независимо от пигментации и зрелости кожи (т.е. образования коллагена в эпидермисе и дерме). Однако предлагаемый способ основан на наиболее точном решении уравнения переноса излучения в коже и использует для определения билирубина нормированные спектры диффузного отражения, что позволяет осуществлять измерения дистанционно и без риска инфицирования новорожденного.
Следует отметить, что, несмотря на то, что транскутанные измерения билирубина характеризуют концентрацию билирубина в тканях кожного покрова, они имеют высокую корреляцию с концентрацией сывороточного билирубина. Для оценки концентрации билирубина в крови достаточно умножить концентрацию билирубина в ткани на 5 [30]. Что касается концентрации гемоглобина в ткани FtHb, то она помимо концентрации гемоглобина в крови СtHb зависит также и от насыщенности ткани кровеносными сосудами ƒbl. Однако для контроля гемоглобина в динамике параметр FtHb равносилен клинически значимой концентрации CtHb. Причем наблюдаемый временной тренд параметра FtHb можно легко перевести в данные о СtHb, основываясь на результатах инвазивного анализа крови до начала наблюдений.
Выбор оптимальных спектральных участков.
Как видно из представленных выше результатов, измерения коэффициентов r(Λk) в спектральном диапазоне 450-800 нм позволяют надежно определять концентрации основных хромофоров кожи - меланина, билирубина, окси- и деоксигемоглобина. Однако использование большого количества спектральных участков требует применения дорогой спектрометрической аппаратуры, например перестраиваемых фильтров на жидких кристаллах [17, 18]. В связи с этим рассмотрим возможность получения карт пространственных распределений концентрации хромофоров кожи по ее изображениям в минимально возможном количестве спектральных участков, позволяющих в достаточной степени учесть вариации всех структурных и биохимических параметров кожи.
Без учета вариаций билирубина спектры r(λ) содержат пять независимых компонент при δr=1-2%. Этот факт говорит о том, что для описания вариаций r(λ), обусловленных изменчивостью структурных и биохимических параметров кожи, достаточно использовать пять первых собственных векторов ковариационной матрицы r(λ), соответствующих наибольшим собственным числам. Таким образом, количество независимых компонент в спектрах r(λ) относительно невелико и использование шести спектральных участков (с учетом нормировочного участка Λ0) позволяет извлечь большую часть информации, содержащейся в r(λ).
Критериями выбора оптимальных спектральных участков Λk являются соответствующая им погрешность восстановления концентраций пигментов кожи и устойчивость соответствующего решения обратной задачи к случайным «возмущениям» r(Λk). Важным условием правильного выбора Λk является отсутствие сильной корреляции между значениями r(Λk). В противном случае система уравнений (5) для вычисления коэффициентов ξ будет являться плохо обусловленной, что приведет к большой чувствительности результатов аппроксимации полного спектра r(λ) и решения обратной задачи к погрешностям измерений опорных значений r(Λk).
Оптимальные значения Λn выбирались путем компьютерного перебора различных комбинаций из 30 длин волн, охватывающих диапазон 450-800 нм, и оценивания соответствующих им погрешностей восстановления параметров ODepi, FtHb и S. Для каждой комбинации Λn вычислялись коэффициенты регрессий (7), соответствующие вышеуказанным параметрам. Далее перебирались все «обучающие» реализации r(Λn) и для каждой из них определялись параметры ODepi, FtHb и S с использованием регрессий (7), в которых на значения r(Λn) накладывались случайные отклонения в пределах 1%. Полученные значения параметров сравнивались с их истинными значениями и вычислялись погрешности их восстановления. Оптимальной комбинацией Λn принята та, которой соответствует наименьшая погрешность δCq=δODepi+δFtHb+4δS, где δODepi, δFtHb и δS - средняя по ансамблю погрешность восстановления ODepi, FtHb и S соответственно (коэффициент 4 предназначен для уравновешивания вкладов всех трех составляющих в суммарную погрешность δСq). Для исходного набора длин волн такой комбинацией является Λ=460, 522, 560, 580, 740 нм и Λ0=610 нм - нормировочная длина волны. Соответствующие погрешности восстановления ODepi, FtHb и S составляют 10.4, 11.4 и 2.3% соответственно, т.е. практически не отличаются от аналогичных погрешностей, соответствующих 31-му спектральному участку.
Полученные результаты дают основание говорить о возможности создания простого и недорогого прибора, позволяющего дистанционно получать карты пространственных распределений основных пигментов кожи в реальном масштабе времени по шести снимкам кожи, сделанным через разные фильтры.
Количественная интерпретация цветных изображений кожи.
В настоящее время на практике большой популярностью пользуются сравнительно простые и не дорогие системы визуализации на основе цветной ПЗС-камеры, позволяющие получать изображение кожи в трех широких спектральных участках (красном R, зеленом G, синем В). В связи с этим представляет большой практический интерес возможность получения простых аналитических выражений, связывающих цветовые координаты каждого пикселя с концентрациями пигментов кожи. Такие выражения позволят в реальном масштабе времени переходить от малоинформативных цветных изображений кожи и к высококонтрастным изображениям ее пигментов.
С точки зрения спектральных измерений цветную ПЗС-камеру можно рассматривать как трехполосовой фильтр, выделяющий из белого света три цветовые составляющие - красную (R), зеленую (G) и синюю (В). Соответствующие им цветовые сигналы Vi(i=R, G, В) на выходе ПЗС-камеры выражаются уравнением [31]
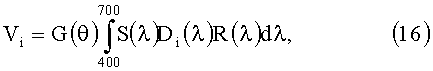
в котором S(λ) - спектральная мощность источника света (лампы), Di(λ) - спектральное пропускание R, G, В фильтров, R(λ) - спектр КДО кожи, G(θ) - геометрический фактор.
Для оперативной интерпретации цветовых координат (RR, RG, RB) и (QBR, QGR) каждого пикселя можно использовать полиномиальные регрессии
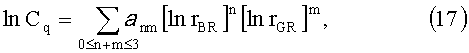
где rBR=VB/VR, rGR=VG/VR, a nm и a nmk - коэффициенты, которые определяются на основе «обучающих» данных. Сами «обучающие» данных могут быть получены на основе вышеописанной оптико-статистической модели кожи, однако малый объем информации, получаемый на основе цветных изображений кожи, не позволяет в достаточной степени учесть вариации всех модельных параметров, поэтому интерпретация соответствующих измерений возможна только в рамках предположения о фиксированном значении некоторых модельных параметров. Наиболее уместным будет зафиксировать значение параметров рассеяния кожи. Так, согласно многочисленным экспериментальным данным, спектр редуцированного коэффициента рассеяния нормальной кожи взрослого человека примерно одинаков для всех типов кожи и анатомических частей тела и достаточно хорошо описывается эмпирической зависимостью [22]:
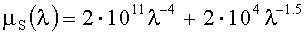
где µs в мм-1, λ в нм. Существенные отклонения от данной зависимости наблюдаются только для опухолевых тканей кожи [27]. Диапазоны вариаций всех других модельных параметров оставим без изменений.
Процесс получения аналитических выражений, связывающих концентрации хромофоров кожи с ее цветовыми координатами, включает следующие этапы. На основе вышеописанной оптико-статистической модели кожи и метода Монте-Карло моделируется ансамбль реализаций концентраций хромофоров кожи и соответствующих им спектров R(λ). Для всех реализаций по формулам рассчитываются нормированные цветовые сигналы (rBR, rGR), соответствующие конкретным аппаратурным функциям S(λ) и Di(λ). Полученные таким образом «обучающие» данные используются для получения вышеотмеченных аналитических выражений. Так, коэффициенты регрессий (17) могут быть легко получены с использованием метода наименьших квадратов.
В качестве примера рассмотрим оценки погрешностей восстановления концентраций меланина и гемоглобина с использованием регрессий (17), соответствующих системе визуализации на основе галогенной лампы LS-1 фирмы «Ocean optics» и цифровой камеры Nicon D70. Относительные спектральные зависимости характеристик рассматриваемой системы приведены на фиг.6. Набор «тестовых» данных состоял из 103 смоделированных реализаций параметров кожи и соответствующих им сигналов (rBR, rGR). Полученные на его основе погрешности восстановления ODepi и FtHb при наложении на значения (rBR, rGR) случайных отклонений в пределах 1% составляют 10.8 и 11.6% соответственно. При этом результаты определения ODepi и FtHb не подвержены искажающему влиянию рельефа поверхности кожи, неоднородности ее освещения и геометрии визуализации, что позволяет выполнять измерения дистанционно.
Таким образом, заявляемый способ в сравнении с прототипом позволяет повышать точность определения двумерных распределений концентрации хромофоров биологических тканей Cq(x, y) (кожи, слизистых оболочек, сетчатки и т.д.); устраняет зависимость от спектральных и конструктивных характеристик измерительного устройства, упрощает и снижает стоимости реализации за счет исключения процедуры получения мультиспектральных снимков и спектров отражения ткани для представительной в статистическом плане группы добровольцев, исключает влияния на Сq(х, y) неравномерной освещенности ткани, ее рельефа и ориентации по отношению к измерительной системе, позволяет оперативно обрабатывать мультиспектральные изображения за счет использования универсальных для всех точек изображения аналитических выражений, связывающих концентрации хромофоров ткани с нормированными спектральными сигналами изображения, расширяет функциональные возможности.
Литература
1. Иванов, А.П. Спектры отражения света как средство диагностики структурных и биофизических параметров кожи / А.П.Иванов, В.В.Барун // Оптика и спектр. - 2008. - Т.104, №2. - С.344-351.
2. Yudovsky, D.Rapid and accurate estimation of blood saturation, melanin content, and epidermis thickness from spectral diffuse reflectance / D.Yudovsky, L.Pilon // Appl. Opt. - 2010. - V.49, №10. - P.1707-1719.
3. Bargo, P.R. In vivo determination of optical properties of normal and tumor tissue with white light reflectance and an empirical light transport model during endoscopy / P.R. Bargo [et. al.] // J.Biomed. Opt. - 2005. - Vol.10, №3. - P.034018-1-15.
4. Zonios, G. Modeling diffuse reflectance from semi-infinite turbid media: application to the study of skin optical properties / G.Zonios, A.Dimou // Optics Express. - 2006. - Vol.14, №19. - P.8661-8674.
5. Palmer, G.M. Monte Carlo-based inverse model for calculating tissue optical properties. Part I: Theory and validation on synthetic phantoms / G.M.Palmer, N.Ramanujam // Appl. Opt. - 2006. - Vol.45, №5. - P.1062-1071.
6. Moncrieff, M. Spectrophotometric intracutaneous analysis: a new technique for imaging pigmented skin lesions/ M.Moncrieff, S.Cotton, E.Claridge, P.Hall // British Journal of Dermatology. - 2002. - Vol.146. - P.448-457.
7. Кубарко, А.И. Нейрофизиология зрительной системы: от теории к клинической практике / А.И.Кубарко // Здравоохранение. - 2009. - №9. - С.13-18.
8. Pham, Т.Н. Quantifying the absorption and reduced scattering coefficients of tissue-like turbid media over a broad spectral range using non-contact Fourier-transform hyperspectral imaging / Т.Н.Pham [et. al.] // Appl. Opt. - 2000. - Vol.39, №34. - P.4939.
9. Hammer, M. Non-invasive measurements of the concentration of melanin, xanthophyll and hemoglobin in single fundus layers in vivo by fundus reflectometry / M.Hammer, D.Schweitzer, E.Thamm, A.Kolb // Int. Ophthalmol. - 2001. - V.23. - P.279-289.
10. Claridge, E. Quantifying mucosal blood volume fraction from multispec-tral images of the colon / E.Claridge, D.Hidovic-Rowea, P.Taniere, T.Ismail // SPIE Proceedings. - 2007. - Vol.6511: Medical Imaging 2007: Physiology, Function, and Structure from Medical Images. - P.65110C.
11. Jacques, S.L. Spectral imaging and analysis to yield tissue optical properties / S.L. Jacques // Journal of Innovative Optical Health Sciences. - 2009. - Vol.2, №2. - P.123-129.
12. Kobayashi, M. Analysis of nonlinear relation for skin hemoglobin imaging / M. Kobayashi [et. al.] // Optics Express. - 2001. - Vol.9, №13. - P.802-812.
13. Klaessens J.H.G.M. Non-invasive skin oxygenation imaging using a multi-spectral camera system: effectiveness of various concentration algorithms applied on human skin / J.H.G.M. Klaessens, H.J. Noordmans, R. de Roode, R.M.Verdaasdonk // IFMBE Proceedings. - 2009. Vol.25/2. - P.725-728.
14. Jakovels, D. 2-D mapping of skin chromophores in the spectral range 500-700 nm / D.Jakovels, J.Spigulis // J.Biophoton. - 2010. - Vol.3, №3. - P.125-129.
15. Reflectance imaging and analysis for evaluating tissue pigmentation // Patent №WO/2011/103576, IPC: G06T 7/00 (2006.01); published 08/25/2011.
16. Okuyama M. Evaluating a Multi-Spectral Imaging System for Mapping Pigments in Human Skin / M.Okuyama, N.Tsumura, Y.Miyake // Opt. Review. - 2003. - Vol.10, №6. - P.580-584.
17. Harvey, A.R. Technology options for hyperspectral imaging / A.R.Harvey [et. al.] // In Proc. SPIE Imaging Spectrometry VI. - 2000. - Vol.4132. - P.13-24.
18. Gat, N. Imaging spectroscopy using tunable filters: A review / N.Gat // In Proc. SPIE Wavelet Applications VII. 2000. - Vol.4056, №1. - P.50-64.
19. Anderson, R.R. The optics of human skin / R.R.Anderson, J.A.Parrish // J. Invest. Dermatol. - 1981. - Vol.77, №1. - P.13-19.
20. Jacques, S.L. Origins of tissue optical properties in the UVA, visible, and NIR regions / S.L.Jacques // Advances in Optical Imaging and Photon Migration. - 1996. - Vol.2. - P.364-369.
21. Hale, G.M. Optical constants of water in the 200-nm to 200-µm wavelength region / G.M.Hale, M.R.Querry // Appl. Opt. - 1973. - Vol.12, №3. - P.555-563.
22. Jacques, S.L. Skin optics / S.L. Jacques // Oregon Medical Laser Center Monthly News [Electronic resource]. - Oregon, 1998. - Mode of access: http://omlc.ogi.edu/news/jan98/skinoptics.html. - Date of access: 10.10.2011.
23. Verkruysse, W. Modelling light distributions of homogeneous versus discrete absorbers in light irradiated turbid media / W.Verkruysse [et. al.] // Phys. Med. Biol. - 1997. - Vol.42, №1. - P.51-65.
24. Барун, B.B. Оценка вклада локализованного поглощения света кровеносными сосудами в оптические свойства биологической ткани / В.В.Барун, А.П.Иванов // Оптика и спектр. - 2004. - Vol.96, №6. - Р.1019-1024.
25. Prahl, S.A. Optical absorption of hemoglobin [Электронный ресурс] / S.A.Prahl, - Режим доступа: . свободный. - Название с экрана.
26. Bashkatov, A.N. Optical properties of human skin, subcutaneous and mucous tissues in the wavelength range from 400 to 2000 nm / A.N.Bashkatov, E.A.Genina, V.I.Kochubey, V.V.Tuchin // J.Phys. D: Appl. Phys. - 2005. - Vol.38. P.2543-2555.
27. Salomatina E. Optical properties of normal and cancerous human skin in the visible and near-infrared spectral range / E.Salomatina [et. al.] // J.Biomed. Opt. - 2006. - Vol.11, №6. - P.064026-1-9.
28. Wang, L. MCML - Monte Carlo modeling of photon transport in multi-layered tissues / L.Wang, S.L.Jacques, L.Zheng // Computers Methods and Programs in Biomedicine. - 1995. - №47. - P.131-146.
29. Сахарова E.C., Кешишян E.C. Современные принципы патогенетического лечения анемии недоношенных детей // Росс. вестн. перинатолог. и педиатрии. - 2004. - №1. - с.16-20.
30. Патент US №5,353,790, МПК А61В 6/00; дата опубликования 11.10.1994.
31. Daisuke N., Norimichi Т., Yoichi М. // Med. Imaging Technol., 2002. Vol.20, №2. P.123-133.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ГЕМОГЛОБИНА И СТЕПЕНИ ОКСИГЕНАЦИИ КРОВИ В СЛИЗИСТЫХ ОБОЛОЧКАХ | 2013 |
|
RU2528087C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОПТИЧЕСКИХ И БИОФИЗИЧЕСКИХ ПАРАМЕТРОВ БИОТКАНИ | 2012 |
|
RU2510506C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ГЕМОГЛОБИНА В БИОЛОГИЧЕСКИХ ТКАНЯХ | 2012 |
|
RU2501522C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФИЗИКО-БИОЛОГИЧЕСКИХ ПАРАМЕТРОВ КОЖИ И КОНЦЕНТРАЦИЙ ПРОИЗВОДНЫХ ГЕМОГЛОБИНА В КРОВИ | 2013 |
|
RU2545814C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЛУБИНЫ ПРОНИКНОВЕНИЯ СВЕТА В КОЖУ И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2012 |
|
RU2521838C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ БИЛИРУБИНА | 2012 |
|
RU2511747C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ ПРОИЗВОДНЫХ ГЕМОГЛОБИНА В БИОЛОГИЧЕСКИХ ТКАНЯХ | 2013 |
|
RU2517155C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2539367C1 |
| ПОРТАТИВНОЕ УСТРОЙСТВО ДЛЯ ИЗМЕРЕНИЯ ХРОМОФОРОВ В КОЖЕ И СПОСОБ ПРИМЕНЕНИЯ УСТРОЙСТВА | 2014 |
|
RU2601678C2 |
| ИНТЕЛЛЕКТУАЛЬНАЯ НАСАДКА НА СМАРТФОН ДЛЯ ОПРЕДЕЛЕНИЯ ЧИСТОТЫ, ВЛАЖНОСТИ И ФОТОВОЗРАСТА КОЖИ | 2016 |
|
RU2657377C2 |


Изобретение относится к области лабораторного медицинского анализа, аналитического приборостроения. Способ заключается в том, что параметры преобразования для системы регистрации изображений с заданными аппаратурными функциями, включающие главные компоненты нормированных спектральных сигналов r(Λk)=V(Λk)/V(Λ0), где Λ0 - опорный спектральный участок, и коэффициенты нелинейных множественных регрессий между концентрациями хромофоров Cq и нормированными сигналами r(Λk) или их проекциями на пространство главных компонент, определяют путем моделирования переноса излучения в ткани с учетом характеристик используемой системы регистрации и возможных диапазонов вариаций структурных и биохимических параметров ткани. При этом ткань освещают линейно поляризованным излучением, регистрируют мультиспектральное изображение V⊥(x, y, Λk) с поляризацией, ортогональной поляризации освещающего излучения, дополнительно регистрируют мультиспектральное поляризованное изображение ν⊥(x, y, Λk) при отсутствии освещения ткани. Для каждой точки х, y получают нормированные спектральные сигналы r(Λk) путем нормировки слоев разностного мультиспектрального изображения V⊥(х, y, Λk)-ν⊥(х, y, Λk) на разностный опорный слой V⊥(х, y, Λ0)-ν⊥(х, y, Λ0), а о концентрации хромофоров Сq(х, y) в каждой точке х, y судят по соответствующим ей нормированным спектральным сигналам с использованием нелинейных множественных регрессий между Cq и r(Λk) или между Сq и проекциями r(Λk) на пространство главных компонент. Изобретение обеспечивает повышение точности получения двумерных распределений концентрации хромофоров биологических тканей. 6 ил., 1 табл.
Способ определения концентраций хромофоров биологической ткани, заключающийся в освещении ткани излучением с широким спектром, регистрации мультиспектрального изображения V(x, y, Λk), где х, y - координаты элемента поверхности ткани, Λk - k-ый участок спектра, преобразовании мультиспектрального изображения по заранее определенной последовательности действий в распределения концентраций хромофоров Cq(x, y), отличающийся тем, что параметры преобразования для системы регистрации изображений с заданными аппаратурными функциями, включающие главные компоненты нормированных спектральных сигналов r(Λk)=V(Λk)/V(Λ0), где Λ0 - опорный спектральный участок, и коэффициенты нелинейных множественных регрессий между концентрациями хромофоров Сq и нормированными сигналами r(Λk) или их проекциями на пространство главных компонент, определяют путем моделирования переноса излучения в ткани с учетом характеристик используемой системы регистрации и возможных диапазонов вариаций структурных и биохимических параметров ткани, ткань освещают линейно поляризованным излучением, регистрируют мультиспектральное изображение V⊥(x, y, Λk) с поляризацией, ортогональной поляризации освещающего излучения, дополнительно регистрируют мультиспектральное поляризованное изображение ν⊥(х, y, Λk) при отсутствии освещения ткани, для каждой точки х, y получают нормированные спектральные сигналы r(Λk) путем нормировки слоев разностного мультиспектрального изображения V⊥(х, y, Λk)-ν⊥(х, y, Λk) на разностный опорный слой V⊥(х, y, Λ0)-ν⊥(х, y, Λ0), а о концентрации хромофоров Cq(x, y) в каждой точке х, y судят по соответствующим ей нормированным спектральным сигналам с использованием нелинейных множественных регрессий между Сq и r(Λk) или между Сq и проекциями r(Λk) на пространство главных компонент.
| OKUYAMA M | |||
| еt al | |||
| Evaluating a Multi-Spectral Imaging System for Mapping Pigments in Human Skin | |||
| Opt | |||
| Review, 2003, v.10, №6, р.580-584 | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| EP 1512372 A1, 09.03.2005 | |||
| US 7920908 B2, 05.04.2011 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| US 7627363 B2, 01.12.2009 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| СПОСОБ НЕИНВАЗИВНОГО ОПРЕДЕЛЕНИЯ КИСЛОРОДНОГО СТАТУСА ТКАНЕЙ | 2010 |
|
RU2437617C1 |
Авторы
Даты
2014-02-10—Публикация
2012-08-01—Подача