Группа изобретений относится к медицинской технике, а именно к флуоресцентной диагностике опухолей и патологий внутриполостных органов, в том числе онкологических, доступных для обследования с использованием эндоскопа или лапароскопа, и может быть использовано в гинекологии, стоматологии и дерматологии.
Методика флуоресцентной диагностики опухолей начинает свою историю с 1924 года, когда Поликард обнаружил, что флуоресценция опухоли при освещении лампой Вуда отличается от флуоресценции нормальной ткани, см. Pollicard A. "Experimental tumors studied by Wood's light, Compt. Rend. Soc. Biol. 91 1423-1424 (1924). Однако уровень техники в то время не позволил реализовать эту идею для клинической практики. Большой прогресс в области технологии за последние два десятилетия особенно в области матричных детекторов и источников света, накопленный объем знаний по спектрально-флуоресцентным свойствам тканей, а также прогресс в создании фотосенсибилизаторов привел к тому, что в настоящее время флуоресцентная диагностика опухолей находит свое достойное применение в клинической практике, в том числе в эндоскопической диагностике.
Имеющиеся методики флуоресцентной диагностики различаются прежде всего на две группы по характеру наблюдаемой флуоресценции: собственная флуоресценция и сенсибилизированная флуоресценции. При диагностике, основанной на собственной флуоресценции, отпадает необходимость в введении пациенту фотосенсибилизатора, что существенно упрощает процедуру. Однако различие во флуоресценции между опухолью и нормальной тканью при таком подходе не во всех случаях позволяет надежно проводить диагностику, и данная методика показала свою надежность лишь для узкоограниченного круга локализаций. Введение фотосенсибилизатора усложняет процесс диагностики, но приводит в ряде случаев к существенному контрасту между опухолью и нормальной тканью. Один из эффективных фотосенсибилизаторов, применяемых для диагностики, является 5-аминолевулиновая кислота (АЛК), которая в организме селективно в опухоли переходит во флуоресцирующий протопорфирин IX. Наиболее широко в настоящее время АЛК используется для диагностики рака мочевого пузыря.
С точки зрения одновременности детектирования видеоизображения флуоресценции и полноценного изображения в белом свете предлагаемые подходы также можно разделить на две группы: одномодовый и совмещенный. В одномодовом режиме врачу предлагается использовать поочередно режим наблюдения в белом свете (обычный режим) либо режим флуоресценции. Пользователь может быстро переключаться из одного видеорежима в другой, но не может одновременно наблюдать в реальном масштабе времени изображение флуоресценции и изображение в белом свете. При этом для того чтобы облегчить врачу навигацию в режиме флуоресценции, изображение флуоресценции может быть наложено на изображение отражения в определенном спектральном диапазоне (но не на полноценное изображение в белом свете). Известен аппарат для фотодинамической диагностики, см., пат.US, №6212425, кл., 2001 г., где в режиме флуоресценции изображение флуоресценции, детектируемое красным и зеленым каналом цветной видеокамеры, накладывается на изображение отражения в синем свете, детектируемое синим каналом той же видеокамеры. При этом пропускание отраженного света в синем канале устанавливается специальным фильтром так, чтобы отраженный сигнал находился в одном динамическом диапазоне с сигналом флуоресценции в зелено-красной области.
Известен флуоресцентный эндоскоп корпорации Olympus - одного из ведущих производителей эндоскопического оборудования, см., пат.US, №6293911, 2001 г., где для диагностики используется фотосенсибилизатор, возбуждаемый и излучающий в ближнем ИК диапазоне (700-1000 нм). В совмещенном режиме пользователь может одновременно наблюдать полноценное видеоизображение в белом свете и флуоресцентное видеоизображение, при этом также возможен режим суперпозиции этих двух изображений. Проблемы совмещения видеорежима в белом свете и видеорежима флуоресценции не возникает, если диапазон возбуждения и регистрации флуоресценции находится за границами видимого диапазона. Достаточно развести с помощью дихроичного зеркала излучение видимого диапазона на цветную камеру, а излучение флуоресценции (вне зоны видимого диапазона) на монохромную чувствительную камеру. В случае же когда диапазон регистрации флуоресценции перекрывается с видимым диапазоном, одновременное детектирование возможно, если для детектирования флуоресценции задействовать относительно узкую спектральную область на границе видимого диапазона или даже внутри него. При этом из белого света необходимо убрать длины волн, используемые для регистрации флуоресценции. Если спектральный участок, где вырезается белый свет из видимого диапазона не очень велик, то при этом удается сохранить цветопередачу при наблюдении в белом свете.
Другой тип систем, которые могут работать в совмещенном режиме, это системы с временной модуляцией, см., пат. US, №5749830, 1998 г. В этом устройстве периодически попеременно на короткий промежуток времени оптический тракт задействуют для наблюдения в белом свете и измерения сигнала флуоресценции. Т.е. происходит периодическая съемка одного кадра в белом свете и одного кадра флуоресценции. Затем эти кадры разделяют в два потока и формируют видеопоток в белом свете и видеопоток флуоресценции либо комбинации флуоресценции и белого света. Для того чтобы сохранить скорость нормального видеорежима (25 кадров в секунду), время для измерения флуоресценции с учетом переключения оптического тракта из режима белого света в режим флуоресценции и обратно составляет порядка десятка миллисекунд, что приводит к необходимости использовать высокочувствительные сенсоры для детектирования слабого сигнала флуоресценции.
Помимо изображения флуоресценции изображение в отраженном свете также может нести в себе некоторую диагностическую информацию. Собственно говоря, когда врач производит обследование в белом свете, диагностика как раз и строится на различии отражения патологии и нормальной ткани в спектральных диапазонах, соответствующих синему, зеленому и красному диапазону рецепторов человеческого глаза. Однако имеются данные, что чувствительность диагностики можно повысить, если использовать более трех спектральных диапазонов, в том числе спектральные диапазоны, лежащие за пределами видимости человеческого глаза. Этот подход может быть особенно перспективен, если для диагностики одновременно использовать изображения в отраженном свете в определенных спектральных диапазонах и изображения во флуоресцентном свете. Эндоскопы такого типа также известны, см., например, пат. US. №5769792, 1998 г., или пат. US. №6821245, 2004 г.
Все описанные выше известные технические решения, как работающие в одномодовом режиме, так и в совмещенном, несмотря на их разнообразие, предполагают наблюдение флуоресценции в видеорежиме. В некоторых случаях это квазивидеорежим, так как ввиду слабого сигнала приходится использовать пониженную частоту кадров вплоть до нескольких герц, тем менее во всех случаях врачу предлагается наблюдение флуоресценции в видеорежиме. Для возбуждения флуоресценции во всех предложенных выше методах используются непрерывные или квазинепрерывные источники света, когда происходит лишь временная модуляция света для возбуждения флуоресценции.
Известен способ флуоресцентной эндоскопии и устройство, его реализующее, см., пат. RU №2197168, Кл. А 61 В 1/045, 2000 г. В соответствии со способом эндоскопию проводят путем облучения излучением определенного спектрального состава биологического объекта и регистрации отраженного излучения с последующим формированием на экране монитора его изображения, при этом в режиме флуоресцентного исследования часть отраженного излучения в виде отраженного возбуждающего света вводят в канал отраженного света, другую часть - в виде света флуоресценции вводят в флуоресцентный канал и регистрируют их соответствующими телекамерами, а введение в каналы осуществляют светоделителем, предварительно эндоскопическую систему калибруют с помощью образца сравнения, обладающего оптическими характеристиками, близкими к биологическому объекту в свете флуоресценции и отраженном возбуждающем свете, используют дихроичный светоделитель, и по усредненному видеосигналу от всего кадра (или его части), формируемого телекамерой в канале отраженного света, изменяют чувствительность телекамеры флуоресцентного канала, а по распределению видеосигнала в кадре телекамеры канала отраженного света проводят посредством процессора коррекцию видеосигналов кадра телекамеры флуоресцентного канала. А флуоресцентный эндоскоп содержит комбинированный осветительный блок, выполненный с возможностью освещения биологического объекта белым светом или коротковолновым возбуждающим флуоресценцию излучением и связанный осветительным жгутом с оптическим каналом эндоскопа, канал передачи изображения эндоскопа, оптический переключатель каналов, светоделитель и каналы отраженного света и флуоресцентный, снабженный телекамерами для приема изображения в отраженном свете и в свете флуоресцентного излучения, соответственно светофильтры, процессор и монитор, при этом светоделитель выполнен дихроичным, а телекамеры с возможностью подачи видеосигнала от цветной телекамеры канала отраженного света на вход схемы автоматической регулировки чувствительной монохроматической телекамеры флуоресцентного канала.
Указанная известная группа изобретений на способ и устройство принята в качестве прототипа, как наиболее близкий по технической сущности и достигаемому результату аналог. Данная группа изобретений позволяет повысить точность диагностики путем снижения зависимости регистрируемых флуоресцентных изображений от дестабилизирующих факторов.
Недостатком прототипов является необходимость наблюдения флуоресценции в видеорежиме реального масштаба времени во время эндоскопического обследования, что затягивает процесс, делает его непривычным для врача, проводившего ранее эндоскопические обследования в белом свете. Кроме того, большая световая экспозиция может привести к выгоранию фотосенсибилизаторов и собственных флуорохромов тканей, что приведет к уменьшению либо исчезновению контраста, а свет короче 370 нм, или сверхмощные лазерные импульсы при больших экспозициях вредны для организма.
Положительные свойства прототипов заслуживают того, чтобы быть максимально сохраненными, вместе с тем указанные недостатки не позволяют использовать известные из уровня техники решения в полной мере для целей заявляемых способа и устройства, что свидетельствует о соответствии группы изобретений критерию «новизна».
Способ флуоресцентной эндоскопии и устройство, его реализующее, в соответствии с настоящим описанием являются группой изобретений, образующих единый изобретательский замысел и направленных на достижение единого технического результата.
В отличие от известных предлагаемая группа изобретений предполагает полностью отказаться от наблюдения флуоресценции в видеорежиме реального масштаба времени во время эндоскопического обследования, а использовать для этого режим фотографии со «со вспышкой». То есть пользователь имеет возможность сделать только отдельные цифровые снимки во флуоресцентном свете, при этом для возбуждения флуоресценции используется источник света, генерирующий мощный одиночный короткий импульс, подобно лампе-вспышке, используемой в фотографии. В целом процедура эндоскопического обследования происходит следующим образом. Врач проводит эндоскопический осмотр в обычном белом свете и делает мгновенные фотографии отдельных участков во флуоресцентном свете.
Одновременно с флуоресцентным изображением фиксируется также одиночный кадр той же области в белом свете. Снимок может быть сразу же проанализирован врачом, скажем, для принятия решения о взятии биопсии или же более детально изучен после окончания эндоскопического обследования для постановки диагноза и планирования последующей процедуры лечения.
Фотографический режим является более привычным для врача, проводившего ранее эндоскопические обследования в белом свете. Фактически данный метод представляет собой обычное обследование в белом свете с фотографированием подозрительных участков в свете флуоресценции.
При работе источника света в импульсном режиме можно обеспечить существенно более высокое отношение сигнала к шуму и соответственно качество изображения, чем при регистрации флуоресценции в непрерывном видеорежиме.
При регистрации единичных изображений можно обеспечить более высокое пространственное разрешение, чем при записи непрерывного видеоизображения. При засветке ткани отдельными импульсами световая экспозиция (произведение интенсивности света на время экспонирования) существенно меньше, чем при засветке в непрерывном режиме. Большая световая экспозиция может привести к выгоранию фотосенсибилизаторов и собственных флуорохромов тканей, что приведет к уменьшению либо исчезновению контраста.
Существенно меньшая экспозиция тканей при работе с одиночными импульсами может позволить использовать для возбуждения флуоресценции спектральные диапазоны и мощности света, которые при больших экспозициях вредны для организма, скажем, свет короче 370 нм, или сверхмощные лазерные импульсы.
В данной методике существует естественная возможность записать кадр флуоресценции с некоторой задержкой по отношению к возбуждающему импульсу (или даже несколько кадров с разной задержкой). При этом можно селектировать флуоресценцию флуорофоров с разным временем жизни, что можно дополнительно использовать для диагностики. В частности, известно, что время жизни собственной флуоресценции в нормальной ткани и в патологии различно.
В конечном итоге указанный технический результат позволяет повысить эффективность диагностики при проведении флуоресцентной эндоскопии.
Указанный положительный результат достигается следующим образом. Согласно способу флуоресцентной эндоскопии, обследование ведут путем облучения белым светом или излучением определенного спектрального состава биологического объекта и регистрации отраженного излучения с последующим формированием на экране монитора его изображения, при этом отраженное излучение разделяют посредством светоделителя на различные каналы. В отличие от прототипа формирование на экране монитора видеоизображения осуществляют только в режиме исследования в белом свете, в режиме флуоресцентного исследования регистрацию изображения осуществляют в виде отдельного кадра с возбуждением от одиночного короткого импульса света, а непосредственно перед этим осуществляют регистрацию изображения того же биологического объекта в виде отдельного кадра в режиме исследования в белом свете, при этом пиковая плотность мощности короткого импульса света на поверхности биологического объекта в несколько раз превышает плотность мощности белого света, затем осуществляют совместную цифровую обработку этих двух кадров.
Положительный результат в части устройства достигается тем, что устройство для флуоресцентной эндоскопии включает флуоресцентный эндоскоп, комбинированный осветительный блок, выполненный с возможностью освещения биологического объекта белым светом и возбуждающим флуоресценцию излучением и связанный осветительным жгутом с оптическим каналом эндоскопа, канал передачи изображения эндоскопа, преимущественно дихроичный светоделитель и каналы отраженного света, снабженные средствами для приема изображения в отраженном свете и в свете флуоресцентного излучения, светофильтры, процессор и монитор. В отличие от прототипа комбинированный осветительный блок выполнен с возможностью генерирования в оптическом канале эндоскопа одиночных световых импульсов определенного спектрального состава, мощности и длительности для возбуждения флуоресценции объекта исследования, при этом средства для приема изображения смонтированы с возможностью непрерывного регистрирования на мониторе изображения объекта в белом свете, а в момент светового импульса - отдельного флуоресцентного снимка, причем процессор оснащен алгоритмом цифровой обработки суперпозиции кадра флуоресценции и кадра в белом свете и вывода результирующего кадра на монитор.
Возможно, что средство для приема изображения выполнено в виде цветной камеры для обеспечения возможности регистрирования излучения флуоресценции в двух или трех спектральных диапазонах.
Возможно также, что средства для приема изображения отраженного видимого света и излучения флуоресценции выполнены в виде цветных камер, установленных с возможностью селектирования на них излучения посредством дихроичного светоделителя.
Во всех частных случаях реализации устройства комбинированный осветительный блок может быть оснащен галогенной или ксеноновой, или металлогалоидной лампой, или белыми светодиодами для освещения биологического объекта белым светом, для освещения биологического объекта в виде одиночного импульса, возбуждающим флуоресценцию могут использоваться импульсные лампы, светоизлучающие диоды, лазерные диоды, другие лазерные источники.
В соответствии со способом пациенту, как правило, за определенный промежуток времени перед стандартным эндоскопическим обследованием системно вводится препарат - фотосенсибилизатор (ФС), избирательно накапливающийся в новообразованиях. Диагностика некоторых патологий возможна и без введения ФС за счет собственной флуоресценции тканей. При проведении эндоскопического обследования в обычном белом свете врач фиксирует положение эндоскопа так, чтобы в зоне видимости оказался участок поверхности ткани, который, по его/ее мнению, кажется подозрительным. Далее при нажатии на кнопку затвора производится моментальная цифровая фотография со «вспышкой» этого участка ткани во флуоресцентном свете. Для этой цели участок ткани освещается коротким световым импульсом определенного спектрального состава. Изображение флуоресценции, возбужденное этим световым импульсом, в определенном спектральном диапазоне или нескольких спектральных диапазонах регистрируется детектором и запоминается в виде одиночного кадра. При этом непосредственно перед записью кадра флуоресценции запоминается также одиночный кадр той же зоны в белом свете. Далее после цифровой обработки на экран монитора выводится суперпозиция этих двух снимков, либо же два отдельных снимка. По характеру распределения интенсивности флуоресценции на фоне снимка в белом свете врач может сделать вывод о наличии и локализации опухоли или иной патологии в исследуемой зоне.
Предложенная методика в некотором смысле аналогична фотографии со вспышкой. Для получения хорошего фото в условиях низкой освещенности нет смысла освещать объект непрерывно интенсивным светом при позиционировании. Вместо этого позиционирование на объект съемки производится в условиях низкой освещенности, а для регистрации снимка используется одиночная короткая интенсивная вспышка. В данном изобретении позиционирование объекта съемки производится в условиях освещения обычным белым светом от эндоскопического осветителя, и производится съемка отдельных участков ткани во флуоресцентном свете при возбуждении флуоресценции коротким одиночным импульсом определенного спектрального состава, генерируемого тем же эндоскопическим осветителем.
При фотографии с лампой-вспышкой в современных цифровых фотоаппаратах мощность вспышки оценивается заранее, исходя из расстояния до объекта и других параметров с тем, чтобы не было переэкспозиции или недоэкспозиции снимка. В данном случае такую поправку на мощность светового импульса также можно сделать, исходя из полученного непосредственно перед флуоресцентной съемкой изображения в белом свете.
В предложенную концепцию укладывается также метод, в котором для диагностики использует информацию как из изображения флуоресценции, так и от изображения в отраженном свете в определенных спектральных диапазонах. Во-первых, последний кадр изображения в отраженном белом свете записанного перед записью флуоресцентного изображения несет в себе информацию об отражении в трех спектральных диапазонах, соответствующих синему, зеленому и красному каналу видеокамеры. То есть этот кадр может совместно с кадром флуоресценции использоваться для увеличения диагностического контраста в окончательном изображении. Во-вторых, непосредственно перед записью кадра флуоресценции мы можем записать кадр в отраженном свете в одном или нескольких специфических спектральных диапазонах, в том числе в инфракрасном. Наконец, мы можем записать кадр в отраженном свете в специфических спектральных диапазонах вместе с кадром флуоресценции, используя часть спектрального диапазона для флуоресценции, а часть - для отражения, и применяя различные схемы деления изображений, в том числе с использованием дихроичных зеркал и фильтров, что будет более подробно рассмотрено ниже.
Отметим, что поскольку кадр в отраженном видимом свете и кадр флуоресценции снимаются последовательно, то возможно небольшое смещение этих кадров относительно друг друга, особенно если для записи кадра флуоресценции требуется механическое перемещение фильтра или заслонки. При простом наложении кадра флуоресценции и кадра в белом свете будет смещение и, возможно, масштабирование, что приведет к ошибке в определении локализации опухоли. Для уменьшения этой ошибки можно реализовать алгоритм, который при анализе двух изображений вычислит величину смещения и масштабирования, и дальнейшее наложение кадров будет уже учитываться с учетом этих величин. Для более эффективной работы этого алгоритма при записи изображения флуоресценции желательно также записать кадр отражения хотя бы в одном из цветовых каналов цветной камеры (предпочтительнее в синем). Тогда, сравнивая синие каналы последнего кадра в белом свете и синего канала записанного вместе с кадром флуоресценции, будет легко определить смещение и масштабирование между этими двумя кадрами. Подобную процедуру коррекции можно также произвести, если перед записью кадра флуоресценции производится запись кадра отражения в специфических спектральных диапазонах.
Заявленная группа изобретений имеет изобретательский уровень, поскольку является результатом глубоких научных исследований и творческой проработки проблемы и даже для высококвалифицированного специалиста явным образом не следует из уровня техники.
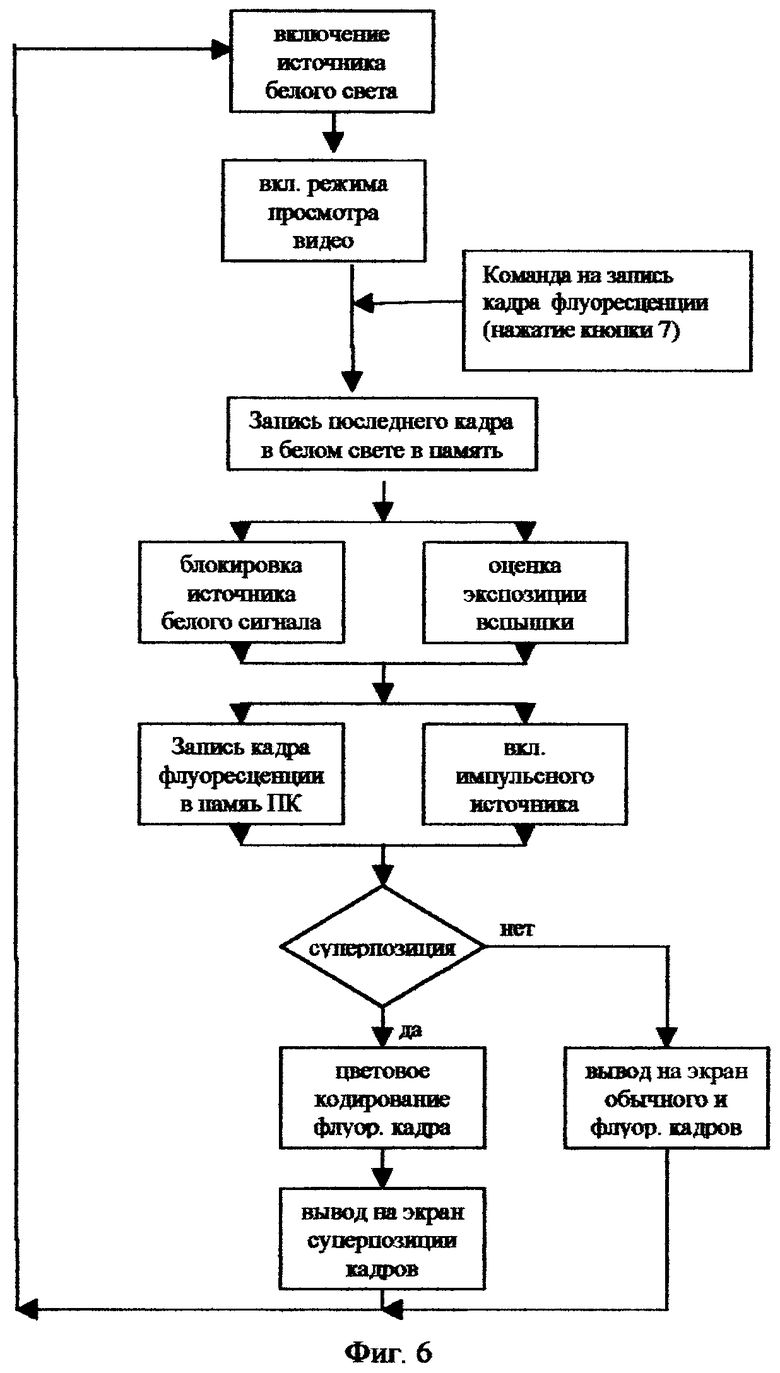
Группа технических решений иллюстрирована чертежами. На фигуре 1 представлена принципиальная схема реализации способа флуоресцентной эндоскопии при эндоскопическом или лапараскопическом обследовании; фиг.2 - устройство блока детектирования; фиг.3 - схема ввода лазерного излучения в осветительный жгут эндоскопа с помощью поворотной призмы; фиг.4 - схема ввода лазерного излучения в осветительный жгут эндоскопа с помощью оптического волокна; фиг.5 - схема ввода света в эндоскопический жгут от двух ламповых источников; фиг.6 - блок-схема программного обеспечения.
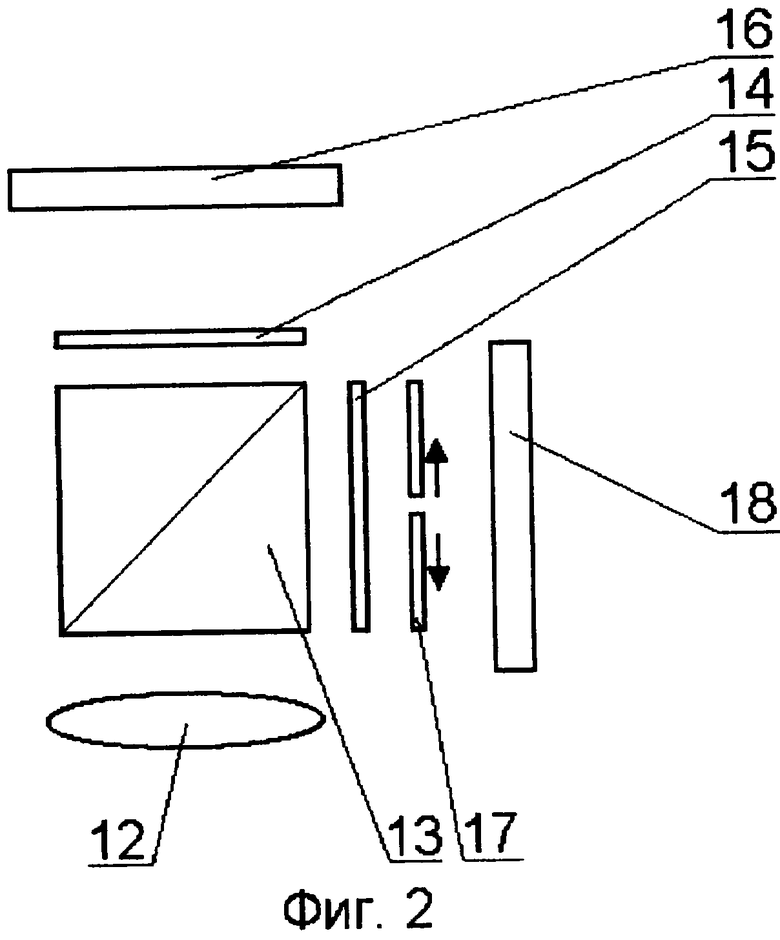
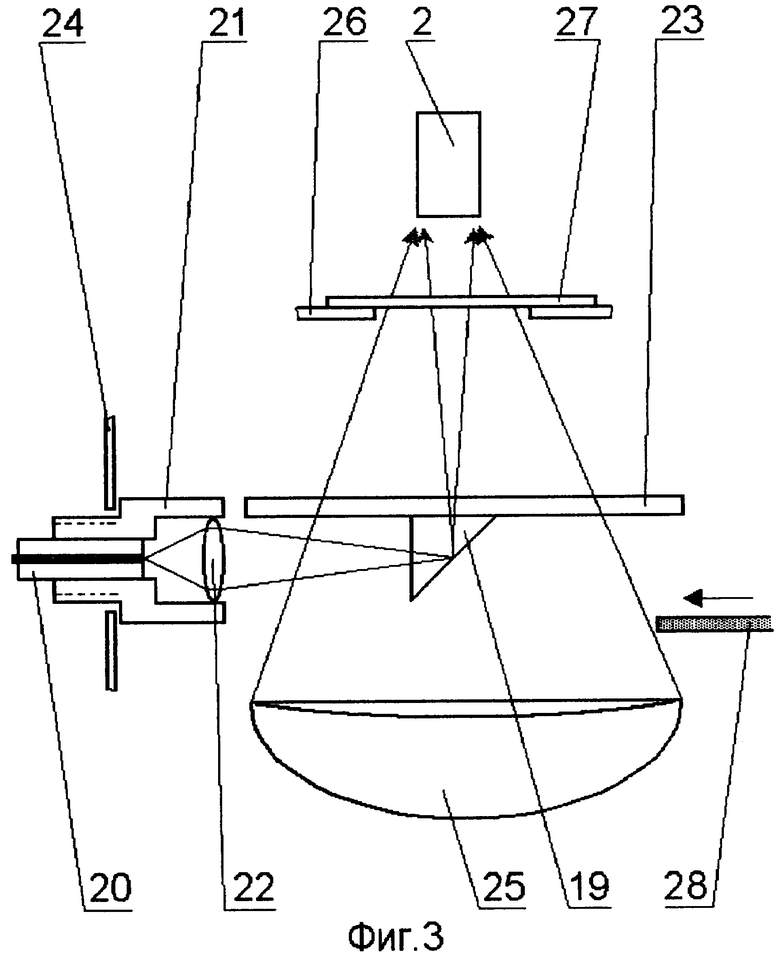
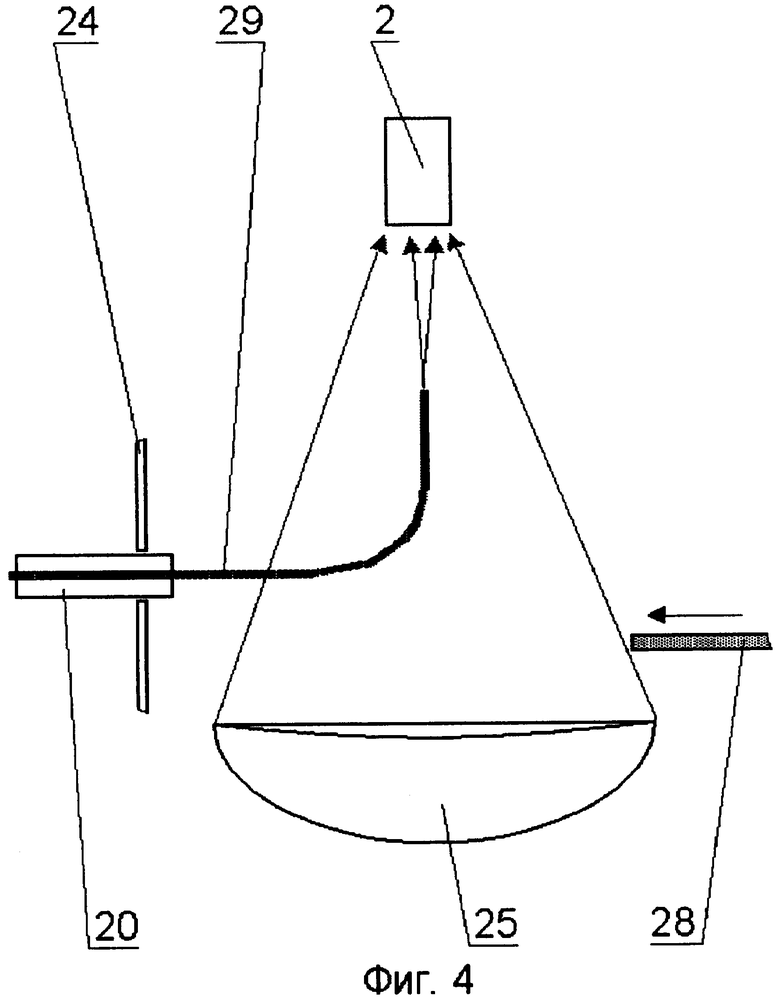
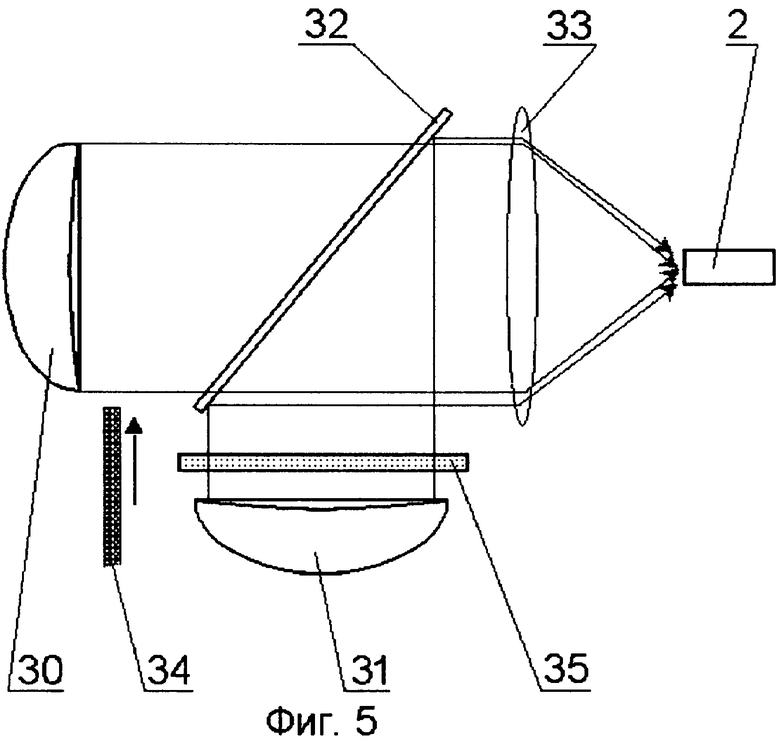
На принципиальной схеме реализации способа представлены комбинированный осветительный блок 1, осветительный жгут 2, флуоресцентный эндоскоп или лапараскоп 3, биологический объект исследования 4, патология 5, блок детектирования 6 с кнопкой съемки 7, блок управления 8, компьютер 9, монитор 10 видеоизображения в белом свете, монитор для фиксирования флуоресцентных снимков 11. Блок детектирования 6 содержит фокусирующий объектив 12, светоделитель 13, блокирующие фильтры 14 и 15, цветную камера 16, затвор 17, высокочувствительная монохромная камера 18. Возможно исполнение устройства, в котором комбинированный осветительный блок 1 лазерного излучения содержит поворотную призму 19, разъем 20 со световодом, доставляющим излучение лазера (SMA или аналогичный разъем), приемный разъем 21, фокусирующий объектив 22, оптическую пластину 23, на которую клеится поворотная призма 19, корпус 24 с отверстием под адаптер, эллиптический рефлектор 25 галогенной лампы, круговую диафрагму 26, фильтр 27, затвор 28, перекрывающий свет лампы во время подачи импульса от лазера. Возможно использование вместо поворотной призмы 18 Г-образного металлического капилляра с оптоволоконным световодом 29 внутри. Возможна конструкция комбинированного осветительного блока 1, содержащая лампу 30 с параболическим рефлектором непрерывного видимого света, импульсную лампу 31 с параболическим рефлектором, дихроичное зеркало 32, фокусирующую линзу 33, заслонку 34, полосовой фильтр (bandpass) 35.
Возможны различные схемы исполнения группы изобретений в зависимости от целевого предназначения. Устройство по способу может быть применено в гинекологии, стоматологии, дерматологии.
В соответствии со схемой, реализация способа флуоресцентной эндоскопии осуществляется следующим образом.
Ключевым элементом данного изобретения является комбинированный импульсно-непрерывный осветительный блок 1, который наряду с излучением непрерывного белого света для освещения способен также излучать короткие мощные одиночные импульсы света определенного спектрального диапазона для возбуждения флуоресценции. В обычном режиме работы свет видимого спектрального диапазона фокусируется на осветительный жгут 2 эндоскопа 3 и доставляется через осветительный канал эндоскопа 3 к объекту исследования 4. Далее изображение в видимом свете регистрируется специальной цветной камерой 16, входящей в состав блока детектирования 6, и передается через блок управления на монитор 10 видеоизображения в белом свете. Собственно говоря так работает обычный эндоскоп с оптическим каналом для передачи изображения на видеокамеру. Проводя обычный осмотр в белом свете, врач может снять флуоресцентную фотографию любого подозрительного участка. Для удобства кнопка съемки 7 располагается непосредственно вблизи блока детектирования 6. Кнопка съемки 7 по своей функции соответствует кнопке спуска затвора фотоаппарата. При нажатии на эту кнопку происходит следующее. Последний полный кадр, полученный в белом свете, запоминается в память компьютера 9. Далее блокируется (полностью или частично) белый свет, а источник света посылает в осветительный канал эндоскопа одиночный световой импульс определенного спектрального диапазона от λ1ex до λ2ех (диапазон возбуждения флуоресценции). В случае, если спектральный диапазон регистрации флуоресценции не перекрывается с видимым светом, используемым для освещения, то блокировать видимый свет на время подачи светового импульса не обязательно, что существенно упростит конструкцию. Сенсор детектора флуоресценции, расположенный в блоке детектирования 6, регистрирует сигнал флуоресценции в определенном спектральном диапазоне от λ1em до λ2еm (диапазон регистрации флуоресценции). Запуск сенсора флуоресценции синхронизирован с подачей светового импульса. Кадр съемки флуоресценции запоминается в памяти компьютера. Далее производится цифровая обработка последнего кадра изображения в белом свете и кадра флуоресценции, и результирующий кадр суперпозиции поступает на монитор флуоресцентной съемки 11. Этот кадр остается замороженным на мониторе до того момента, как будет произведен следующий флуоресцентный снимок. В то же самое время система вновь автоматически переходит в режим видеомониторинга в белом свете, и на видеомонитор 10 продолжает поступать текущее видеоизображение в белом свете. Система готова к следующему снимку. Все флуоресцентные снимки, сделанные в процессе обследования вместе с соответствующими копиями в белом свете, запоминаются в памяти компьютера и могут быть при необходимости детально проанализированы после проведения осмотра. Поскольку время регистрации флуоресценции довольно мало и может быть менее 1/25 секунды, то во время регистрации флуоресценции мы можем потерять всего лишь один или несколько кадров из видеопотока в белом свете, так что пользователь фактически постоянно будет видеть на видеомониторе 10 непрерывное изображение в белом свете в реальном масштабе времени, даже в момент нажатия кнопки 7.
В зависимости от диапазонов возбуждения флуоресценции (от λ1ex до λ2ех) и регистрации флуоресценции (от λ1em до λ2em), а также от требуемой чувствительности и простоты конструкции возможна реализация блока детектирования в различных вариантах.
В одной из конструкций, где диапазон длин волн возбуждения флуоресценции лежит в области короче синей границы регистрируемого видимого света (λblue), предлагается следующее решение. Заметим сразу при этом, что для обеспечения нормальной цветопередачи диапазон регистрации видимого света (λblue; λred) может быть несколько уже границ видимости человеческого глаза (400-700 нм). Вполне приемлемая цветопередача при изображении тканей может быть обеспечена при диапазоне регистрации от λblue=430 нм до λred=645 нм. Блок регистрации в этом случае может содержать одну цветную камеру (здесь и далее под цветной камерой может подразумеваться камера на базе одного CCD или CMOS сенсора с мозаичными фильтрами, или 3-CCD камера) с отрезающим фильтром, блокирующим излучение с длиной волны короче λblue. При освещении белым светом мы регистрируем обычное цветное изображение. При флуоресцентной фотографии белый свет полностью блокируется, а в осветительный канал подается импульс с длинами волн короче λblue. Сигнал флуоресценции от этого импульса регистрируется той же цветной камерой в трех спектральных диапазонах, соответствующих красному, зеленому и синему диапазону регистрации камеры. В этом случае мы фактически имеем три изображения флуоресценции в различных диапазонах регистрации. В этом случае для отображения сигнала можно использовать различные алгоритмы, в частности, отношения красной составляющей к зеленой с тем, чтобы исключить влияние неоднородности освещения. В случае, если для возбуждения флуоресценции необходимо использовать свет с длиной волны более чем λblue, на время регистрации флуоресценции перед камерой устанавливается фильтр, отрезающий излучение короче λ2ex, при этом λ2ex может лежать в зеленом и даже в красном диапазоне спектра. В этом случае мы не сможем зарегистрировать флуоресценцию в синем канале и, возможно, в зеленом канале цветной камеры, так как соответствующие спектральные диапазоны могут быть заблокированы упомянутым выше фильтром. Но мы сможем зарегистрировать на красный канал камеры даже флуоресценцию, лежащую в инфракрасном диапазоне. Еще более оптимальный вариант устройства реализуется, если мы на момент записи флуоресценции не полностью заблокируем свет отражения в синем канале цветной камеры, а частично, так, чтобы он был в одном динамическом диапазоне с интенсивностью флуоресценции. Тогда мы сможем зарегистрировать кадр отражения в синем свете и кадр флуоресценции одновременно, что может быть использовано для корректировки смещения между кадром в белом свете и кадром флуоресценции, как это было отмечено выше. Следует также отметить, что интенсивность флуоресценции обычно на несколько порядков меньше, чем интенсивность отраженного света, используемого для освещения. Применение одной и той же камеры для регистрации сигнала флуоресценции и отраженного излучения будет целесообразно, когда соответствующие сигналы находятся в одном динамическом диапазоне. Использование импульсных источников света для возбуждения флуоресценции как раз и позволяет увеличить пиковую мощность в импульсе на несколько порядков по сравнению с непрерывным режимом, при этом сигнал флуоресценции от импульсного источника и отраженный сигнал от непрерывного источника могут оказаться в одном динамическом диапазоне, что позволяет оптимальным образом использовать одну и ту же камеру для регистрации обоих сигналов.
В случае, когда блок детектирования 6 состоит из цветной 16 и высокочувствительной монохромной камеры 18 для регистрации флуоресценции после выхода из окуляра эндоскопа 2, свет проходит через фокусирующий объектив 12 и попадает на светоделитель 13 изображения. В зависимости от задачи диагональная плоскость светоделителя 13 может представлять полупрозрачный слой либо же дихроичное зеркало, пропускающее коротковолновую часть спектра (область длин волн короче λred) и отражающее красную и ближнюю инфракрасную составляющую (диапазон спектра с длинами волн, превышающим величину λred). Установка дихроичного зеркала особенно целесообразна в случае, если диапазон регистрации флуоресценции (λ1em; λ2em) лежит в области длиннее 640-650 нм. При этом повышается чувствительность регистрации как в белом свете, так и в режиме флуоресценции. Прошедшее излучение регистрируется цветной камерой 16, перед которой может быть установлен фильтр 14, блокирующий излучение возбуждения флуоресценции. Высокочувствительная монохромная камера 18 используется для регистрации флуоресценции. Перед камерой расположен полосовой фильтр 15, пропускающий излучение в диапазоне длин волн от λ1em до λ2em. Кроме того, чтобы избежать засветки камеры при наблюдении в белом свете, перед камерой может быть расположен затвор 17, который открывается только на время регистрации флуоресценции. Работа затвора 17 синхронизована со световым импульсом, подаваемым источником света.
Комбинированный осветительный блок 1, излучающий в осветительный жгут 2 эндоскопа 3 непрерывный видимый свет и короткий одиночный световой импульс для возбуждения флуоресценции, работает следующим образом.
Возможно для генерации видимого непрерывного света и мощного светового импульса использование одного источника света, который может работать как в непрерывном (с относительно небольшой средней мощностью, достаточной для освещения), так и в импульсном (с большой пиковой мощностью) режимах. Роль таких источников света могут играть разрядные лампы, светодиоды или лазерные диоды. При этом для ограничения спектрального диапазона длин волн во время излучения светового импульса перед источником света может устанавливаться специальный полосовой фильтр 35 (bandpass) с интервалом пропускания от λ1ex до λ2ех.
Возможно использовать различные источники, генерирующие непрерывный видимый свет для освещения и световой импульс для возбуждения флуоресценции. При этом свет от обоих источников фокусируется на торец осветительного жгута 2 эндоскопа 3. В качестве источника непрерывного видимого света могут использоваться ксеноновые, галогенные и металлогалоидные лампы, которые используются в настоящее время в эндоскопических осветителях. Кроме того, в качестве непрерывного источника света могут также использоваться светодиоды. В качестве импульсных источников света для возбуждения флуоресценции могут использоваться специальные лампы-вспышки, импульсные светодиоды, импульсные лазерные диоды, а также различные импульсные лазеры, включая твердотельные лазеры с модулируемой добротностью и преобразованием частоты.
Предпочтительной является оптическая схема с двумя источниками света. Лазерное излучение вводят в эндоскопический осветительный канал путем модификации существующих эндоскопических осветителей, где в качестве источников света применяются лампы с эллиптическим рефлектором. Импульсное излучение от лазерного источника доставляется по оптическому волокну малого диаметра, на конце которого расположен стандартный оптический разъем 20. Далее при помощи фокусирующего объектива 22 и поворотной призмы 19 излучение фокусируется на торец осветительного жгута 2 эндоскопа 3. Оптическая пластина 23 с приклеенной к ней поворотной призмой 19 практически не уменьшают количество света от эллиптического рефлектора 25 галогенной лампы. Для блокирования света от лампы в момент подачи импульса от лазера в осветительный жгут 2 эндоскопа 3 используется специальный затвор 28, расположенный между рефлектором 25 галогенной лампы и поворотной призмой 19 Г-образного металлического капилляра с оптоволоконным световодом 29 внутри.
При использовании схемы ввода излучения от лазерного источника в осветительный жгут 2 вместо оптической пластины 23 с поворотной призмой 19 оптического волокна с изгибом под углом, близким 90 градусов, оптоволоконный световод 29 может быть помещен в металлический капилляр Г-образной формы с тем, чтобы придать волокну нужный радиус изгиба. Для разворота излучения в осветительный жгут 2 эндоскопа 3 возможно также использование специальных кварцевых трубок с косым срезом на торце.
Для реализации оптического ввода в эндоскопический осветитель от двух низкоколлимированных источников света, излучение от которых нельзя с высокой эффективностью ввести в оптическое волокно малого диаметра, можно использовать схему ввода в осветительный жгут 2 эндоскопа 3 света от лампы 30 видимого света с параболическим рефлектором и от лампы 31 вспышки с параболическим рефлектором для возбуждения флуоресценции. Вместо лампы-вспышки 31 в этой схеме могут также использоваться импульсные светодиоды с коллимирующей оптикой.
Примером реализации способа является конкретное устройство эндоскопического флуоресцентного фотоаппарата для диагностики с АЛК при возбуждении в красном диапазоне спектра и для диагностики по собственной флуоресценции при возбуждении в красном диапазоне.
Был проведен большой объем спектральных исследований по собственной флуоресценции опухолей при возбуждении в красном диапазоне спектра, в частности при возбуждении на длине волны 633 нм. Результаты спектральных исследований показали, что спектры флуоресценции некоторых типов опухолей отличаются от нормальных тканей. При этом оптимальный спектральный диапазон для детектирования флуоресценции лежит в области 650-900 нм. Такое устройство может также использоваться и с другими ФС второго поколения на основе хлоринов, фталоцианинов, пурпуринов, интенсивно флуоресцирующих при возбуждении в диапазоне 630-670 нм. Наиболее востребованными являются возбуждения флуоресценции в диапазоне 630-640 нм и в диапазоне 660-680 нм.
Диапазон регистрации видимого света справа можно ограничить величиной λred ˜635-640 нм. Источник света для возбуждения флуоресценции имеет большую длину волны λех>λred. Удобно для возбуждения использовать полупроводниковые лазерные диоды или светоизлучающие диоды с длиной волны λех ˜635-670 нм. А диапазон регистрации флуоресценции можно ограничить следующими значениями λ1em ˜650-690 нм, λ2em - 720-900 нм. При этом на источник белого света можно установить отрезающий фильтр, блокирующий излучение с длиной волны больше λ1em. Поскольку диапазоны видимого белого света и регистрации флуоресценции не перекрываются, нет необходимости ставить дополнительный блокирующий фильтр в источник белого света на момент подачи светового импульса с длиной волны λех. Если для регистрации используется одна цветная камера 16, то в момент регистрации флуоресценции перед камерой следует установить фильтр 14, пропускающий излучение флуоресценции от λ1еm до λ2еm. Возможен пример, когда фильтр 14 имеет частичное пропускание в синей и, возможно, зеленой области спектра. При этом одновременно с кадром флуоресценции мы можем записать кадр отражения в двух соответствующих спектральных диапазонах. Если для регистрации используется система на основе светоделителя 13 на каналы отраженного света для средств приема изображения, камер 16 и 18, то фильтр 15, пропускающий только излучение от от λ1em до λ2еm, может постоянно находиться перед монохромной камерой 18. При этом в данной конфигурации отпадает необходимость в затворе 17, так как все остальное излучение в виде непрерывного белого света и импульсный свет блокируются этим фильтром 15. В этом случае одновременно со спектром флуоресценции на синий и зеленый канал цветной камеры 16 запишет изображение в отраженном свете в соответствующих спектральных диапазонах, надо только позаботиться о том, чтобы отраженный свет импульса, возбуждающего флуоресценцию, был бы заблокирован от попадания в цветную камеру 16 дихроичным зеркалом светоделителя 13 и фильтром 14. Преимущество данной конструкции заключается в том, что полностью отпадает необходимость механической быстрой смены фильтра перед камерой в блоке регистрации и в эндоскопическом осветителе для блокировки белого света.
Примером реализации является случай, когда для возбуждения флуоресценции используется импульсный источник света в спектральной области короче диапазона регистрации белого света λех<λblue. В частности, для диагностики с АЛА при возбуждении в фиолетовом диапазоне удобно использовать импульсные источники с длиной волны от λ1ex ˜360 до λ2ех ˜420 нм. Возбуждение флуоресценции в этом диапазоне может оказаться эффективным и для диагностики некоторых типов опухолей по собственной флуоресценции. При этом в случае, если используется система с одной цветной камерой 16, то перед ней постоянно установлен фильтр 14, блокирующий излучение с длиной волны, равной и короче λ2ex. Однако в момент подачи светового импульса для возбуждения флуоресценции белый свет должен быть временно заблокирован. Сигнал флуоресценции в этом случае детектируется в трех спектральных диапазонах, определяющих цветовые характеристики камеры 16. В случае, если используется система регистрации на базе цветной 16 и монохромной 18 камер, а диапазон регистрации флуоресценции не перекрывается с диапазоном регистрации видимого света, то можно, как и в предыдущем случае, сделать систему, где нет необходимости производить быструю смену фильтров как в эндоскопическом осветителе, так и в блоке регистрации.
Существуют конструкции эндоскопов, где матричный сенсор расположен непосредственно на дистальном конце эндоскопа. Кроме того, современная технология позволяет также разместить и на дистальном конце световые источники на основе светодиодов. Соответствующие модификации аппаратуры, реализующие возможность флуоресцентной фотографии, также возможны на базе этих моделей. Если на дистальном конце эндоскопа 3 расположить монохромный сенсор, а излучение подавать по осветительному каналу в виде трех импульсов - синего, зеленого и красного света, то на этой основе из трех соответствующих кадров синтезируется изображение в белом свете. Для реализации метода флуоресцентной фотографии в данной конструкции можно в осветительный канал подать мощный импульс с длинами волны короче диапазона регистрации сенсора. При этом сенсор зарегистрирует интегральную флуоресценцию во всем видимом диапазоне.
Метод флуоресцентной фотографии может быть также использован в гинекологии, стоматологии и дерматологии. Для гинекологии соответствующий прибор может быть сконструирован на базе кольпоскопа. Для стоматологии данный прибор может быть создан на базе появившихся в последнее время стоматологических визуализаторов, которые содержат миниатюрную CCD камеру, окруженную светодиодами для подсветки. Здесь следует предусмотреть возможность размещения вблизи камеры также мощных импульсных светодиодов для возбуждения флуоресценции. Для дерматологии подобный прибор может быть создан путем модификации современного цифрового фотоаппарата.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТРОЙСТВО ДЛЯ ФЛУОРЕСЦЕНТНОЙ НАВИГАЦИИ В НЕЙРОХИРУРГИИ | 2017 |
|
RU2661029C1 |
| СПОСОБ ФЛУОРЕСЦЕНТНОЙ ЭНДОСКОПИИ И УСТРОЙСТВО ЕГО РЕАЛИЗУЮЩЕЕ | 2000 |
|
RU2197168C2 |
| СПОСОБ ИНТРАОПЕРАЦИОННОЙ ДИАГНОСТИКИ ГРАНИЦ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2013 |
|
RU2574793C2 |
| Способ фотодинамической диагностики и терапии центрального рака легкого и устройство его осуществления | 2019 |
|
RU2736909C1 |
| УСТРОЙСТВО ДЛЯ ПРОВЕДЕНИЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ С ВОЗМОЖНОСТЬЮ ОДНОВРЕМЕННОГО СПЕКТРАЛЬНО-ФЛУОРЕСЦЕНТНОГО КОНТРОЛЯ ФОТОБЛИЧИНГА ФОТОСЕНСИБИЛИЗАТОРА | 2021 |
|
RU2777486C1 |
| Видеофлуоресцентное устройство для диагностики в ближнем инфракрасном диапазоне при открытых операциях | 2023 |
|
RU2838390C2 |
| Способ внутрипротоковой фототераностики холангиоцеллюлярного рака | 2021 |
|
RU2767264C1 |
| СПОСОБ ДИАГНОСТИКИ ОБЛАСТЕЙ ПРОЛИФЕРАЦИИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1999 |
|
RU2169922C1 |
| СПОСОБ ПОВЫШЕНИЯ КАЧЕСТВА ИЗОБРАЖЕНИЯ ПРИ ФИБРОЭЗОФАГОГАСТРОДУОДЕНОСКОПИИ И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2007 |
|
RU2358640C2 |
| УСТРОЙСТВО ОБРАБОТКИ СИГНАЛОВ ДЛЯ УСТРОЙСТВА, ПРЕДНАЗНАЧЕННОГО ДЛЯ БИОЛОГИЧЕСКИХ НАБЛЮДЕНИЙ | 2006 |
|
RU2378976C2 |
Группа изобретений относится к медицинской технике, а именно к флуоресцентной диагностике опухолей и патологий внутриполостных органов, и может быть использовано в гинекологии, стоматологии и дерматологии. Данный способ предусматривает облучение белым светом или излучением определенного спектрального состава биологического объекта и регистрацию отраженного излучения с последующим формированием на экране монитора его изображения. При этом отраженное излучение разделяют посредством светоделителя на различные каналы. Формирование на экране монитора видеоизображения осуществляют в режиме исследования в белом свете, в режиме флуоресцентного исследования регистрацию изображения осуществляют в виде отдельного кадра с возбуждением от одиночного короткого импульса света. Непосредственно перед этим осуществляют регистрацию изображения того же биологического объекта в виде отдельного кадра в режиме исследования в белом свете. При этом пиковая плотность мощности короткого импульса света на поверхности биологического объекта превышает плотность мощности белого света. Затем осуществляют совместную цифровую обработку этих двух кадров. Способ осуществляют устройством, которое содержит флуоресцентный эндоскоп, комбинированный осветительный блок, связанный осветительным жгутом с оптическим каналом эндоскопа, каналы отраженного света, снабженные средствами для приема изображения в отраженном свете и в свете флуоресцентного излучения, светофильтры, процессор и монитор. Средства для приема изображения непрерывно регистрируют на мониторе изображения объекта в белом свете, а в момент светового импульса регистрируют отдельный флуоресцентный снимок. При этом процессор оснащен алгоритмом цифровой обработки суперпозиции кадра флуоресценции и кадра в белом свете и вывода результирующего кадра на монитор. Использование данной группы изобретений позволит повысить эффективность диагностики. 2 н. и 6 з.п. ф-лы, 6 ил.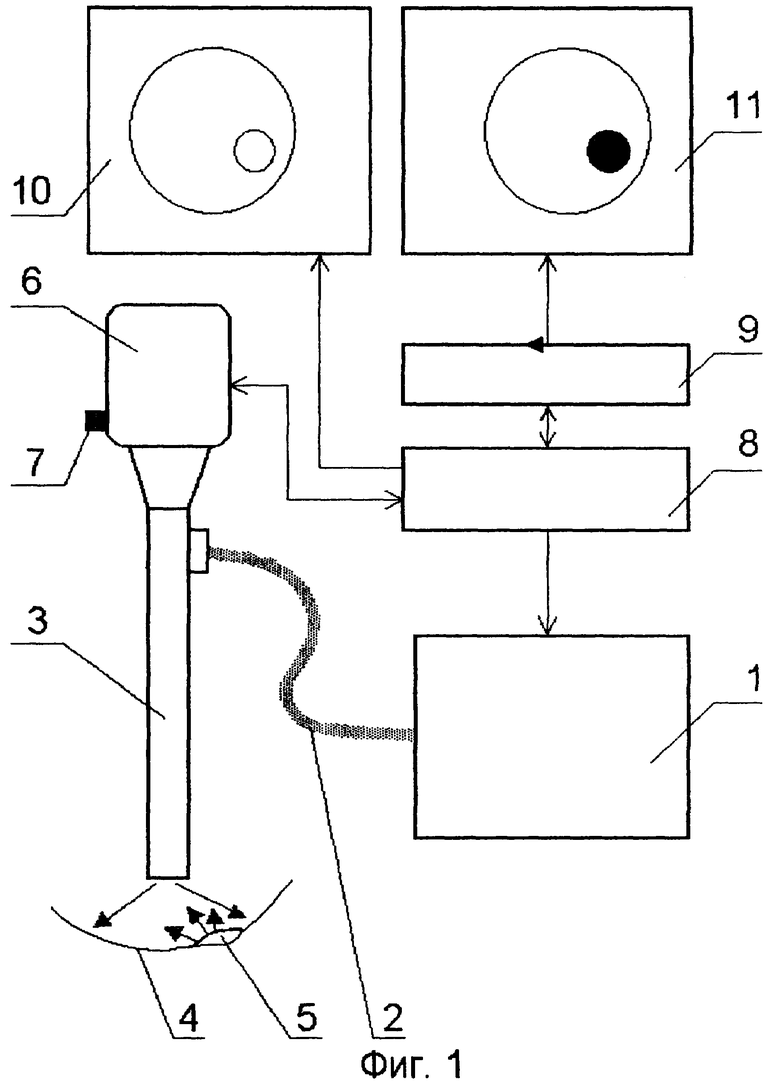
| СПОСОБ ФЛУОРЕСЦЕНТНОЙ ЭНДОСКОПИИ И УСТРОЙСТВО ЕГО РЕАЛИЗУЮЩЕЕ | 2000 |
|
RU2197168C2 |
| RU 94010321 A1, 20.06.1996 | |||
| СПОСОБ ДИАГНОСТИКИ ОБЛАСТЕЙ ПРОЛИФЕРАЦИИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1999 |
|
RU2169922C1 |
| Устройство для контроля электрических цепей | 1975 |
|
SU529432A1 |
| WO 9922814 A, 14.05.1999 | |||
| US 5363854 A, 15.11.1994 | |||
| Gobel W | |||
| et al | |||
| Miniaturized two-photon microscope based on a flexible coherent fiber bundle and a gradient-index lens objective | |||
| Opt Lett | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| (Реферат). | |||
Авторы
Даты
2007-01-10—Публикация
2005-08-10—Подача