ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к медицине и медицинской технике, в частности к диагностической технике, а именно к устройствам флуоресцентной навигации, в частности с применением фотосенсибилизаторов. Изобретение может быть использовано, в частности, при проведении хирургических операций, а именно, нейрохирургических операций по удалению опухолей нервной системы.
УРОВЕНЬ ТЕХНИКИ
Актуальной проблемой современной медицины является разработка и внедрение новых, высокотехнологичных методов ранней диагностики и лечения рака. Одними из таких методов являются флуоресцентная диагностика (ФД) и фотодинамическая терапия (ФДТ), основу которых составляют три компонента: препараты – фотосенсибилизаторы, оптическое излучение и кислород.
Фотосенсибилизаторы – лекарственные препараты способные накапливаться в пораженных тканях в большем количестве по сравнению со здоровыми тканями.
Большинство фотосенсибилизаторов являются люминофорами, поэтому их можно использовать для диагностики. Важным требованием к фотосенсибилизаторам, определяющим его эффективность диагностики, является необходимость стремления к нулю квантового выхода интеркомбинационной конверсии. Селективное накопление фотосенсибилизаторов злокачественными клетками позволяет по характерному флуоресцентному свечению с большой точностью выявить границы и степень ракового поражения.
Особую сложность представляет определение границ первичных внутримозговых опухолей (прежде всего, глиом), что обусловлено особенностями их инфильтративного роста вдоль миелинизированных нервных волокон и сосудов, приводящими к высокой частоте послеоперационных рецидивов. Достоверная информация относительно объема резецированной опухоли может быть получена путем интраоперационной визуализации.
Решение этой проблемы реализуется, в основном, с помощью интраоперационной компьютерной томографии, магнитно-резонансной томографии, УЗ-сканирования и трехмерной безрамной ультразвуковой нейронавигации, нейронавигационных систем и различных комбинаций этих методов.
Для получения эффекта флуоресценции опухоли во время операции используют операционные микроскопы или эндоскопы, оснащенные флуоресцентными модулями.
Принцип флуоресцентной навигации при комбинации с эндоскопической техникой в настоящее время широко используется для диагностики опухолей. Кроме того, благодаря угловому обзору эндоскоп позволяет визуализировать «слепые зоны», которые нередко оказываются за пределами поля зрения операционного микроскопа, и их осмотр требует нежелательной тракции мозга.
В уровне технике известно флуоресцентное эндоскопическое устройство для диагностики различных заболеваний в организме (US 2003078477 A1, опубл. 24.04.2003), включающее источник света, излучающий в диапазоне длин 380–580 нм, эндоскоп, цветную видеокамеру и высокочувствительную монохромную видеокамеру, устройство обработки данных, выполненное с возможностью совмещения двух изображений и устройство вывода диагностических изображений. Использование изобретения позволяет одновременно наблюдать отраженное и флуоресцентное изображения участка исследуемой области, корректировать яркость и неравномерность флуоресцентного излучения.
Аналогичный флуоресцентный эндоскоп известен из US 20140171764 А1, опубл. 19.07.2014. Устройство включает эндоскоп, источник непрерывного белого света, освещающий исследуемый участок, и, по меньшей мере, один лазер с длиной волны, соответствующей пику поглощения фотосенсибилизатора для возбуждения флуоресценции, например, с длиной волны 365 нм и/или 405 нм.. В устройстве используют две видеокамеры с оптическими фильтрами, отрезающими определенный участок спектра, для формирования конечного изображения и устройство обработки полученных изображений.
Также известно устройство флуоресцентной навигации (WO 2008089545 A1, опубл. 31.07.2008), состоящее из источника освещения, эндоскопа, по меньшей мере, одного оптического фильтра, пропускающего излучение, возбуждающее флуоресцентное свечение, например, в диапазоне 390-455 nm, двух цветных видеокамер, устройства обработки и индикации, выполненное с возможностью обработки полученных изображений и вывода суммирующего изображения.
Использование для возбуждения флуоресценции коротковолнового излучения, для которого биологическая ткань является средой с низкой прозрачностью, приводит к флуоресцентному зондированию объема ткани, не превышающего нескольких микрометров, и требует предварительного промывания ткани от крови перед проведением оптического измерения, что усложняет процедуру анализа ткани.
В некоторых случаях использование в решениях эндоскопа при проведении нейрохирургической операции весьма неудобно для хирурга, так как нужно отвлечься от того изображения, которое видно через окуляры оптического микроскопа, поднести оптическую часть эндоскопа тем или иным образом к очагу локализации опухоли, увидеть флуоресцентное свечение, зафиксировать участки, испускающие свечение, затем вернуться к микроскопу и произвести резекцию. Таким образом, известные видеофлуоресцентные эндоскопические устройства не позволяют проводить исследования непосредственно в режиме включенной флуоресцентной навигации.
Из уровня техники также известны решения, которые вместо стандартного эндоскопа используют флуоресцентные модули для операционного микроскопа.
Так, например, известны источники информации WO 2013109966 А1, опубл. 25.07.2013, US 20140276008 A1, опубл. 18.09.2014, в которых раскрыты устройства флуоресцентной навигации, включающие оптический микроскоп, источник излучения с длиной волны, возбуждающей флуоресценцию введенного фотосенсибилизатора, две видеокамеры – монохромную и цветную.
Известен способ интраоперационной диагностики границ злокачественной опухоли (RU 2574793 С2, опубл.10.02.2016), заключающийся в том, что перед операцией вводят фотосенсибилизатор протопорфирин IX, обследование ведут путем последовательного облучения оперируемой зоны и патологической ткани белым светом и лазерным излучением, далее регистрируют отраженное излучения и флуоресценцию с последующей обработкой кадров изображения: цветного кадра, двух черно-белых (фиксирующих естественный фон) кадров в двух различных спектральных интервалах 630-640 нм и 700-710 нм соответственно и двух черно-белых кадров при свете лазера в двух различных спектральных интервалах (фиксирующих флуоресценцию), изображения выводят на монитор. Регистрацию оперируемой зоны и патологической ткани осуществляют последовательно при постоянно присутствующем в помещении свете. Данный способ реализует система флуоресцентной навигации с временным разрешением.
Данные методы используют временное разделение для регистрирующих видеокамер и источников света соответственно. Изображения фонового освещения, диффузного рассеяния и флуоресценции регистрируются последовательно, что требует для проведения измерения всех параметров, необходимых для классификации ткани, около 3 с, и не позволяет проводить измерения в реальном времени и достоверно утверждать, что изображения получены из одной точки в одинаковых условиях. В этом кроется недостаток указанных методов, так как временное разделение кратно понижает чувствительность метода и приводит к эффекту мерцания, который ощутим даже при значительных частотах. Кроме того, большинство сторонних регистрирующих устройств в присутствии работающего устройства с временным разделением с высокой вероятностью корректно функционировать не смогут.
Наиболее близким аналогом заявляемого изобретения является устройство флуоресцентной навигации, реализующее способ интраоперационной диагностики границ опухоли (Jonathan T. Elliott, Alisha V. Dsouza, Kayla Marra, Brian W. Pogue, David W. Roberts, and Keith D. Paulsen, "Microdose fluorescence imaging of ABY-029 on an operating microscope adapted by custom illumination and imaging modules," Biomed. Opt. Express 7, 3280-3288 (2016)), включающее штатный осветитель со светофильтром, который пропускает только видимый свет, отрезая ближнюю инфракрасную компоненту и тем самым оставляя диапазон для возбуждения и наблюдения флуоресценции, инфракрасную и цветную видеокамеры, изображения которых поступают на устройство обработки.
Данный способ флуоресцентной диагностики реализуется с помощью устройства для работы с экспериментальными фотосенсибилизаторами, поглощающими и излучающими в ближнем ИК диапазоне. Эти фототосенсибилизаторы на данный момент не зарегистрированы, то есть не могут быть применены в медицинской практике, и нет исчерпывающих данных об их эффективности. По этой причине в устройстве для флуоресцентной навигации не предусмотрен отдельный источник белого света. Отсутствие отдельного источника белого света приводит к тому, что при такой схеме устройства приходится внедряться в микроскоп, чтобы установить требуемый фильтр, либо пользоваться посадочными гнездами под фильтры, которые не являются универсальными и отличаются в зависимости от микроскопа, а в большинстве случаев отсутствуют вовсе. Таким образом, существует потребность в разработке универсального модуля к операционному микроскопу с оптимальным режимом светового воздействия на операционное поле для регистрации флуоресценции в режиме реального времени в присутствии крови при работе с зарегистрированным в России препаратами, такими как 5-АЛК-индуцированного протопорфирина 9, фталоцианина алюминия и препаратами на основе производных Хлорина-е6, у которых максимально удаленные в красную область пики флуоресценции располагаются в конце красного диапазона видимого спектра.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Техническими проблемами, решаемыми настоящим изобретение, являются невозможность одновременно проводить клиницистом флуоресцентную диагностику и осуществлять визуальный обзор исследуемого участка ткани в привычном режиме цветного изображения; низкая глубина зондирования ткани: невозможность проводить флуоресцентную навигацию в присутствии крови; невозможность работать в режиме двух видеокамер без стробирования с препаратами на базе 5-АЛА или хлорина-е6, полная невозможность всех имеющихся решений визуализировать препараты на базе фталоцианина алюминия.
Техническим результатом заявленного изобретения является возможность проведения флуоресцентной диагностики при одновременном выполнении следующих условий: используются препараты на основе 5-АЛА, или хлорина-е6, или фталоцианина алюминия; исследование проводится в реальном масштабе времени; возбуждение флуоресценции производится в красном диапазоне оптического спектра; источники света излучают непрерывно и клиницист в процессе исследования видит неизмененное цветное изображения исследуемого участка ткани и на мониторе и в окулярах операционного микроскопа, и отдельным графическим слоем карту флуоресценции поверх неизмененного цветного изображения на мониторе, в окулярах микроскопа клиницист также видит равномерно освещенный участок ткани в естественных цветах, что позволяет в целом повысить чувствительность оптической флуоресцентной интраоперационной навигации при удалении злокачественных опухолей головного и спинного мозга.
Технический результат достигается тем, что устройство для флуоресцентной интраоперационной навигации при хирургическом удалении злокачественных опухолей головного и спинного мозга включает источник белого света и монохроматический источник излучения, возбуждающий флуоресценцию фотосенсибилизатора, с длиной волны 638 нм; оптоволоконное устройство доставки излучения к исследуемому участку; средство регистрации обратно рассеянного излучения и флуоресцентного излучения исследуемого участка, содержащее оптический нейрохирургический операционный микроскоп, оптический видеоадаптер, монохромную видеокамеру, цветную видеокамеру; а также блок обработки и индикации, связанный со средством регистрации обратно рассеянного излучения и флуоресцентного излучения исследуемого участка. При этом источник белого света сопряжен с первым входом оптоволоконного устройства доставки излучения через светофильтр, отрезающий длинноволновую часть спектра красного участка видимого диапазона; монохроматический источник излучения сопряжен со вторым входом оптоволоконного устройства доставки излучения через устройства фильтрации и повышения числовой апертуры выходящего пучка излучения; оптический выход микроскопа соединен со входом оптического видеоадаптера, к выходам которого подключены монохромная видеокамера и цветная видеокамера, цифровые выходы которых соединены с блоком обработки и индикации; оптический видеоадаптер выполнен с возможностью передачи флуоресцентного излучения на монохромную видеокамеру, перед которой установлен светофильтр, пропускающий длинноволновую компоненту выше 650 нм, а диффузно отраженного излучения, что составляет коротковолновую часть, – на цветную видеокамеру, перед которой установлен светофильтр, пропускающий коротковолновую составляющую, ниже 625 нм; выход оптоволоконного устройства доставки излучения установлен вплотную к объективу микроскопа и закреплен на оптическом видеоадаптере посредством элемента фиксации.
Кроме того, монохроматический источник излучения обладает мощностью не менее 1,5 Вт.
Кроме того, источник белого света и монохроматический источник излучения выполнены с возможностью одновременной подачи излучения на исследуемый участок.
Кроме того, источником белого света является светодиод, RGB лазер или ксеноновая лампа.
Кроме того, монохроматическим источником излучения является полупроводниковый лазер, работающий в непрерывном режиме.
Кроме того, устройство дополнительно включает подсистему компенсации изображения в красном диапазоне спектра в виде подсветки монохромным источником излучения.
Кроме того, элементом фиксации является кронштейн-держатель.
Кроме того, оптоволоконное устройство доставки излучения выполнено в виде жгутов оптических волокон, разделенных в начале жгута и равномерно перемешанных в конце жгута.
Кроме того, на дистальном конце жгута смонтирована оптическая насадка, разворачивающая излучение на 90 градусов и меняющая расходимость светового пучка так, чтобы световое пятно было сконцентрировано на исследуемом участке.
Кроме того, блок обработки и индикации выполнен с возможностью совмещения полученных изображений от монохромной видеокамеры и цветной видеокамеры.
Кроме того, в качестве фотосенсибилизатора используют: препараты на базе 5-АЛА или хлорина-е6 или фталоцианина алюминия.
Кроме того, оптический видеоадаптер включает фокусирующую линзу, светоделитель, два оптических вывода на разъемы видеокамер, снабженных устройствами крепления светофильтров.
Кроме того, светоделитель выполнен в виде дихроичного зеркала, частично прозрачного зеркала или призмы.
Кроме того, монохромная и цветная видеокамеры выполнены с возможностью синхронизированной или асинхронной работы.
Кроме того, блок обработки и индикации выполнен с возможностью трансформирования аффинным преобразованием изображения, поступающего с монохромной видеокамеры для последующего наложения указанного изображения на изображение, поступающее с цветной видеокамеры, в режиме реального времени, образуя результирующее изображение.
Кроме того, блок обработки и индикации выполнен с возможностью вывода изображения с монохромной видеокамеры, наложенное графическим слоем на изображение с цветной видеокамеры, или вывода неизмененного изображения с цветной видеокамеры, или вывода неизмененного изображения с монохромной видеокамеры.
Кроме того, блок обработки и индикации выполнен с возможностью вывода результирующего изображения в заданном цвете.
Кроме того, блок обработки и индикации выполнен с возможностью предварительного нормирования изображения с монохромной видеокамеры на изображение с цветной видеокамеры перед выводом результирующего изображения.
Кроме того, блок обработки и индикации выполнен с возможностью цифровой обработки изображения с цветной видеокамеры путем усиления красного канала.
Кроме того, блок обработки и индикации выполнен с возможностью вывода результирующего изображения в окуляры микроскопа посредством системы проецирования.
Кроме того, устройство включает второй оптический видеоадаптер и дополнительные цветную и монохромную видеокамеры, входы которых подключены к выходу второго оптического видеоадаптера, а выходы – к блоку обработки и индикации, при этом второй оптический видеоадаптер подключен ко второму оптическому каналу нейрохирургического операционного микроскопа.
Ключевой концепцией, заложенной в основу разрабатываемого устройства, является возможность осуществления видеофлуоресцентной диагностики злокачественных новообразований в фотосенсибилизированных тканях в реальном масштабе времени с возбуждением флуоресценции в «окне прозрачности» биологической ткани, что соответствует красной части диапазона видимого спектра, и, при всем при этом, предоставить клиницисту возможность непосредственно в процессе проведения диагностического исследования видеть на экране привычное изображение в привычной цветовой гамме или, по крайней мере, максимально приближенной к таковой.
При фотодинамическом воздействии выбор источников света зависит от их спектра испускания, который должен соответствовать спектру поглощения фотосенсибилизаторов, кроме того, источник излучения должен располагать достаточной мощности излучения. Идеальным является случай совпадения максимума поглощения фотосенсибилизатора с максимумом спектральной плотности источника света. При флуоресцентной диагностике также желательно регистрировать сигнал в спектральном диапазоне, соответствующем максимуму эмиссии.
Выбор длины волны для возбуждения флуоресценции основан на том, что у всех трех фотосенсибилизаторов: на базе 5-АЛА или на основе производных хлорина е-6 или фталоцианина алюминия – присутствует пик поглощения в диапазоне +/- 5 нм вокруг 638 нм. 638 нм - это широко используемая длина волны в призводстве лазеров на основе лазерных диодов. С точки зрения диагностики, на 630 нм условно приходится начало области прозрачности биологических тканей. В этой области спектр поглощения биологической ткани, где основной вклад вносят спектры поглощения гемоглобина и воды, принимает свои наименьшие значения, что позволяет свету глубже проникать в биологическую ткань, тем самым повышая глубину зондирования. Таким образом, выбор указанной длины излучения позволяет диагностировать опухоли на значительно большем заглублении, нежели при возбуждении в сине-зеленом диапазоне спектра. Кроме того, возбуждение в красном свете позволяет производить диагностику в присутствии крови, которая, как известно, в красном диапазоне спектра поглощает существенно ниже, нежели в сине-зеленом диапазоне.
Возможность предоставления клиницисту привычного изображения в привычной цветовой гамме при видеофлуоресцентном исследовании в целом позволит повысить чувствительность исследования, так как подозрительные участки ткани, по-прежнему, определяются по отраженному цветному изображению, иными словами, «на глаз», а для такого способа наилучшим вариантом является возможность видеть исследуемый участок ткани в привычных цветах, кроме того, это повышает потребительские свойства продукта, а, соответственно, и пригодность для коммерциализации.
Использование операционного микроскопа в заявляемом устройстве в отличие от использования эндоскопа при проведении нейрохирургической операции позволит проводить резекцию непосредственно в режиме включенной флуоресцентной навигации.
Использование в устройстве двух видеокамер позволяет регистрировать отраженный и флуоресцентный сигналы по отдельности, что позволяет монохромной видеокамере всегда находиться в режиме максимальной чувствительности, в то время, как цветная видеокамера находится в комфортном для глаза режиме и с точки зрения коэффициента усиления, и с точки зрения частоты кадров, и с точки зрения гамма-коррекции.
Совмещение изображений, полученных с монохромной и цветной камер непосредственно в блоке обработке данных, а не на оптическом уровне, позволяет упростить юстировку систему и расширить возможности в подборе сенсоров камер, т.е. они могут не совпадать по разрешению, что позволит выводить цветное изображение в высоком разрешении, а для черно-белого изображения использовать сенсор с разрешением ниже, но максимально возможной для неохлаждаемых ПЗС видеокамер чувствительностью.
Использование монохромной и цветной видеокамер в спектрально разрешенном режиме позволяет проводить нормировку флуоресцентного канала на красный канал цветной видеокамеры, визуализировать флуоресцентный слой поверх привычного цветного изображения, проводить мониторинг и дозиметрию фотодинамической терапии.
Выполнение видеоадаптера с кронштейном-держателем для подвода оптоволоконного устройства доставки излучения позволяют использовать заявляемое изобретение в качестве дополнительного встраиваемого модуля для имеющегося оборудования и может быть применено к различным оптическим нейрохирургическим операционным микроскопам.
Выполнение источника белого света с применением светодиода позволяет исключить необходимость периодической замены ламп, что увеличивает эксплуатационный срок службы устройства в рабочем режиме.
Использование в устройстве подсистемы компенсации изображения в красном диапазоне спектра в виде подсветки лазером для работы через окуляры операционного микроскопа позволяет исключить искажения цветопередачи в оптическом канале микроскопа, что позволяет видеть кровь красной, а не темно-бурой, как это было бы в отсутствии системы компенсации и приводило бы к неудобствам и, как следствие, выбору ошибочной тактики ведения операционного вмешательства.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Прилагаемые чертежи, которые включены в состав настоящего описания и являются его частью, иллюстрируют вариант осуществления изобретения и совместно с вышеприведенным общим описанием изобретения и нижеприведенным подробным описанием осуществления служат для пояснения принципов настоящего изобретения.
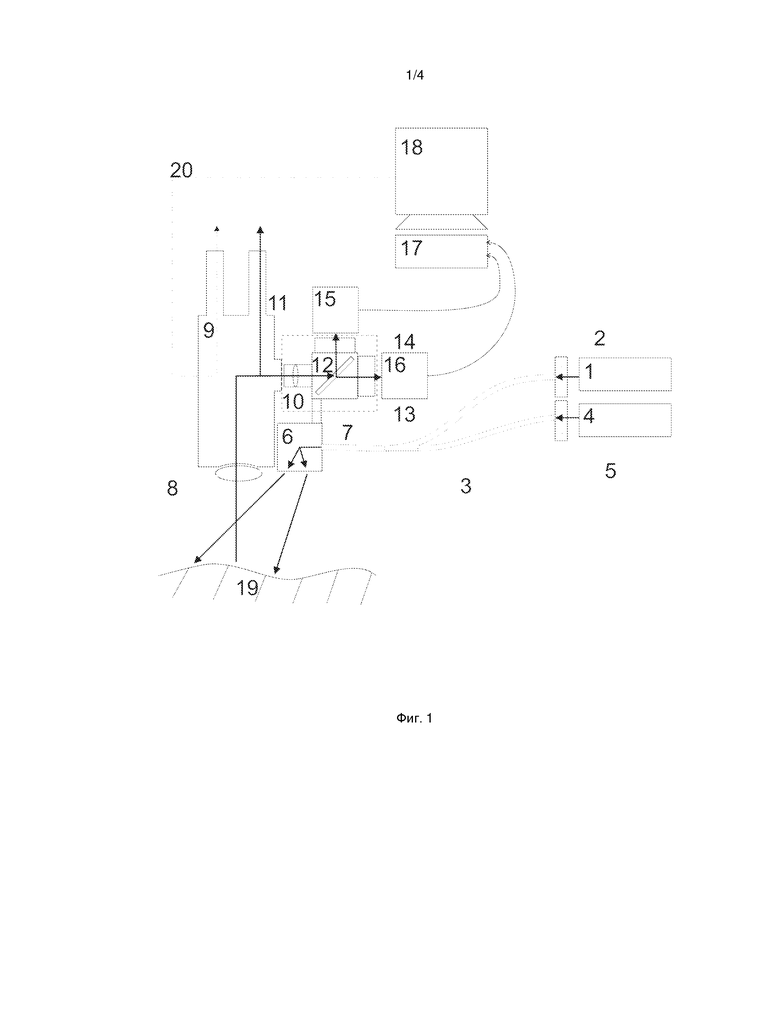
На фиг.1 показана принципиальная схема устройства для интраоперационной навигации злокачественных опухолей нервной ткани.
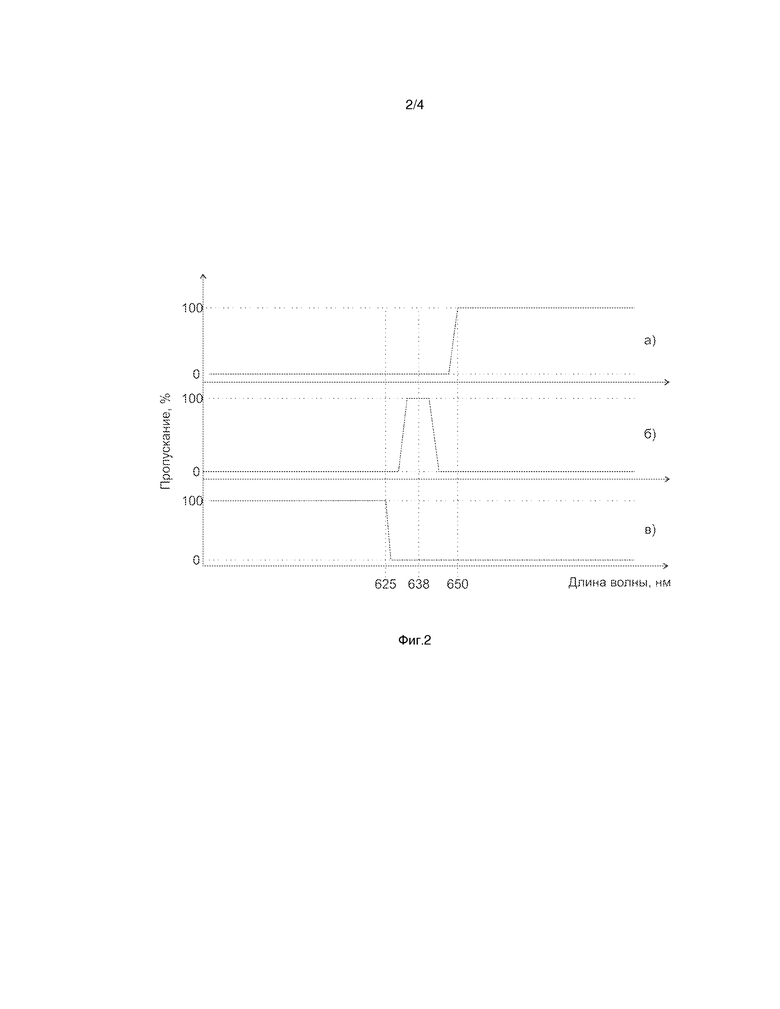
На фиг. 2 представлены схематически спектры пропускания светофильтров, используемых при построении оптической части устройства для интраоперационной навигации злокачественных опухолей: а) фильтр монохромной видеокамеры, б) фильтр лазерного источника, в) фильтр цветной видеокамеры и источника белого света.
На фиг. 3 представлена фотография макета заявляемого устройства.
На фиг. 4 изображен принцип формирования итогового изображения, которое клицинист видит на мониторе устройства при видеофлуоресцентном исследовании, где а) исходное монохромное изображение, б) изображение с монохромной видеокамеры после аффинной трансформации, в) изображение с монохромной видеокамеры после усиления и, опционально, нормировки на красный канал цветной видеокамеры, г) обработанное изображение предыдущим этапом после окрашивания в высококонтрастный по отношению к тканям нервной системы цвет, д) исходное изображение с цветной видеокамеры и е) результирующее изображение, полученное путем наложения обработанного изображения, поступающего с монохромной видеокамеры на изображение с цветной видеокамеры.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
В общем, настоящее изобретение предлагает устройство для интраоперационной флуоресцентной навигации злокачественных опухолей нервной системы человека, позволяющее в режиме включенной флуоресцентной навигации наблюдать привычное клицинисту видеоизображение обследуемого участка ткани. На фиг. 1 представлена блок-схема предлагаемого изобретения.
Устройство может включать в себя два источника излучения: источник белого света (1) и монохроматический источник излучения (4), возбуждающий флуоресценцию фотосенсибилизатора, с длиной волны 638 нм и мощностью не менее 1,5 Вт, оптоволоконное устройство доставки излучения (3) на исследуемый участок операционного поля (19), средство регистрации обратно рассеянного излучения и флуоресцентного излучения исследуемого участка, а также блок обработки (17) и индикации (18), связанный со средством регистрации обратно рассеянного излучения и флуоресцентного излучения исследуемого участка.
Средство регистрации обратно рассеянного излучения и флуоресцентного излучения исследуемого участка включает в себя оптический видеоадаптер (10), подключенный к штатному свeтоделителю оптического нейрохирургического операционного микроскопа (9), двухканальную видеосистему флуоресцентного мониторинга, содержащую монохромную и цветную видеокамеры (15, 16), расположенные каждые в своем канале.
В качестве препаратов-фотосенсибилизаторов используют препараты на базе 5-АЛК, или препарат на основе фталоцианина алюминия, или препарат на основе хлорина-е6. У этих фотосенсибилизаторов максимально удаленные в красную область пики флуоресценции располагаются в конце красного диапазона видимого спектра.
Изобретение будет лучше понятно после ознакомления с нижеследующим свободным описанием работы установки, фактически представляющей собой оптический нейрохирургический операционный микроскоп с флуоресцентным модулем, с использованием ссылок на прилагаемые чертежи.
В качестве источника белого света (1) может быть использован светодиод, RGB лазер или ксеноновая лампа. Источник света (1) в качестве внешнего источника белого света снабжен светофильтром (2) и подключен к первому входу оптоволоконного устройства доставки излучения (3). Светофильтр (2) выполнен с возможностью пропускать почти весь видимый диапазон, кроме дальней красной части видимого диапазона оптического спектра. Спектр пропускания светофильтра (2) схематически представлен на фиг. 2г. Указанный светофильтр (2) несколько искажает визуально воспринимаемый спектр, поэтому для удобства врача возможен вариант осуществления изобретения, когда штатный источник белого света операционного микроскопа (9) оставлен. Таким образом, большая часть операции может быть проведена с использованием полного видимого спектра от штатного источника белого света нейрохирургического операционного микроскопа (9).
Световой выход монохроматического источника излучения (4), возбуждающего флуоресценцию фотосенсибилизатора, подключен к входу устройства фильтрации и повышения числовой апертуры выходящего пучка излучения (5). Выход устройства фильтрации и повышения числовой апертуры (5) подключен ко второму входу оптоволоконного устройства доставки излучения (3). Спектр пропускания устройства фильтрации и повышения числовой апертуры выходящего пучка излучения (5) представлен на фиг. 2б.
Пиковая мощность монохроматического источника излучения (4) должна составлять не менее 1.5 Вт. В качестве монохроматического источника излучения используют полупроводниковый лазер, работающий в непрерывном режиме. Длина волны лазера составляет 638 нм.
Оптоволоконное устройство доставки излучения (3) предпочтительно состоит из двух 5-ти метровых жгутов оптических волокон, разделенных в начале жгута и равномерно перемешанных в конце жгута. На дистальном конце жгута смонтирована оптическая насадка (6), разворачивающая излучение на 90 градусов (вниз) и меняющая расходимость светового пучка так, чтобы световое пятно было сконцентрировано на операционном поле.
Выход оптоволоконного устройства доставки излучения (3) монтируется на элементе фиксации (7), выполненным в виде кронштейна–держателя, вплотную к объективу (8) операционного микроскопа (9), чтобы создавать минимальное количество теней. Сам кронштейн-держатель (7) крепится к оптическому видеоадаптеру (10), тем самым повышая универсальность системы.
Оптический видеоадаптер (10) подключен в свою очередь к штатному оптическому выводу оптического нейрохирургического операционного микроскопа (9) и состоит из: фокусирующей линзы (11), фокусное расстояние которой подбирается для конкретной модели микроскопа (9) и сенсоров видеокамер (15 и 16); светоделителя (12) на основе дихроичного зеркала, частично прозрачного зеркала или призмы; двух выводов света на стандартные разъемы видеокамер, причем оба вывода снабжены устройствами крепления светофильтров, в которые установлены светофильтры (13, 14).
К первому выходу оптического видеоадаптера (10) подключена монохромная видеокамера (15) для регистрации флуоресцентного изображения. Ко второму выходу оптического видеоадаптера (10) подключена цветная видеокамера (16) для регистрации цветного изображения.
Обе видеокамеры (15, 16) подключены своими цифровыми выходами к блоку обработки данных (17), построенному на базе персонального компьютера с графическим ускорителем для аффинного преобразования изображения, который, в свою очередь, подключен к монитору (18) или системе проецирования изображения (20). Подключение видеокамер к блоку обработки данных может быть как проводным, так и беспроводным. Осуществить подключение к блоку обработки данных видеокамер проводного типа можно посредством одного из следующих устройств: преобразователь USB, плата захвата видео, видеорегистратора и других. Беспроводным способом видеокамеры можно подключить к блоку обработки данных, например, через протокол WiFi или Bluetooth.В данном варианте осуществления подключение видеокамер осуществляется посредством проводов со стандартным разъемом USB 3.0.
На входе монохромной видеокамеры (15) установлен светофильтр (14), пропускающий длинноволновую компоненту выше 650 нм с коэффициентом затухания не менее пяти, так как интенсивность флуоресценции при возбуждении фотосенсибилизаторов длиной волны 638 нм ниже интенсивности рассеянного назад возбуждающего излучения на 4 порядка при физиологических концентрациях фотосенсибилизатора. Это позволит не допустить попадания диагностически значимой части лазерного излучения или света источника белого света в диагностический канал, что позволит настроить монохромную видеокамеру (15) на максимальную чувствительность с максимальным коэффициентом усиления сигнала.
На входе цветной видеокамеры (16) устанавливается фильтр (13), пропускающий коротковолновую составляющую, ниже 625 нм. Этот фильтр защищает цветную видеокамеру (16) от высокоинтенсивного излучения лазера (4), что позволяет цветной видеокамере (16) работать в штатном режиме, давая оператору возможность видеть привычное изображение органа, не засвеченное лазерным излучением.
Спектры пропускания светофильтров монохромной и цветной видеокамер представлены на фиг. 2а и 2в соответственно.
Видеокамеры (15, 16) представляют собой цифровые устройства. При этом для достижения максимальной чувствительности в диагностическом канале в качестве монохромной видеокамеры (15) применяется высокочувствительная черно-белая цифровая ПЗС-камера. В навигационном канале в качестве цветной видеокамеры (16) устанавливается цветная чувствительная цифровая КМОС-камера, так как этот класс устройств характеризуется большим динамическим диапазоном и меньшим тепловыделением, что немаловажно с точки зрения эргономики.
Работа устройства, макет которого изображен на фиг. 3, осуществляется следующим образом.
Подают смешанный изотропно световой поток от монохроматического источника излучения (4) и источника белого света (1) через оптоволоконное устройство доставки излучения (3) на операционное поле (19).
Лазерное излучение вводится в оптоволоконное устройство доставки (3) через стандартный оптический разъем SMA905, излучение от источника белого света (1) вводится в стандартный эндоскопический разъем, которым оборудовано оптоволоконное устройство доставки излучения (3). При этом пучок, излучаемый лазерным источником (4), проходит через устройство фильтрации и повышения числовой апертуры (5), сужающей спектр лазерного излучения до 638+/-8 нм, а источник белого света (1) оптически фильтруется так, чтобы излучаемый белый свет имел спектр с длиной волны не более 625нм. Источник белого света (1) и монохроматический источник излучения (4) выполнены с возможностью одновременной подачи излучения на исследуемый участок (19).
Предварительно осуществляют введение фотосенсибилизаторов. Для проведения флуоресцентной диагностики на пациентах был использован фотосенсибилизатор, Аласенс в дозировке 20 мг/кг перорально за три часа до исследования. Исследования на модельных образцах с применением препаратов Аласенс, Радахлорин и Фотосенс дают все основания рассчитывать на применимость фотосенсибилизаторов на основе хлорина-е6 и фталоцианина алюминия. После накопления препарата в областях пролиферации (онкообразования) облучали визуально наблюдаемые области смешанным световым потоком.
Далее излучение взаимодействует с биологической тканью. При этом в местах накопления фотосенсибилизатора происходит излучение флуоресценции. Обратно рассеянное излучение вместе с флуоресцентным излучением попадает в световой канал (8) операционного микроскопа (9). Оптический выход операционного микроскопа (9) соединен с оптическим входом видеоадаптера (10), который длинноволновую часть светового потока, что составляет диагностический канал, передает на монохромную видеокамеру (15), а коротковолновую часть, за вычетом потерь, что составляет наблюдательный канал, - на цветную видеокамеру (16).
Таким образом, подаваемый в биоткань свет не пересекается в терминах длин волн с флуоресцентным свечением, возникающим в диапазоне длин волн от 650 нм и выше. В указанном диапазоне в случае накопления 5-АЛК индуцированного протопорфирина 9, или хлорина-е6, или фталоцианина алюминия будет регистрироваться флуоресцентное свечение. Принимая во внимание тот факт, что фотосенсибилизатор накапливается в опухоли кратно больше, чем в здоровой ткани, флуоресцентное свечение указывает на участки локализации опухолевых клеток.
Излучение лазера не регистрируется ни одной из видеокамер.
Монохромная видеокамера (15) работает в экстремальном режиме с максимальной чувствительностью – с максимальным временем интегрирования и максимальным усилением без гамма-коррекции, цветная видеокамера (16), в свою очередь, работает в нормальном штатном режиме цветной видеокамеры (режим времени интегрирования и коэффициент усиления выбираются автоматически в зависимости от уровня освещенности исследуемого участка).
Монохромная и цветная видеокамеры выполнены с возможностью синхронизированной или асинхронной работы.
В варианте осуществления, когда видеокамеры работают асинхронно, достигается более высокое качество изображения с обеих видеокамер (15, 16) благодаря тому, что у блока обработки данных (17) нет необходимости задерживать изображение с цветной видеокамеры (16) до поступления изображения с монохромной видеокамеры (15), и видеокамеры могут работать на разных временах экспозиции, что приводит к более быстрой смене кадров на изображении с цветной видеокамеры (16) и большей чувствительности монохромной видеокамеры (15) за счет понижения времени экспозиции. Однако, асинхронный режим приведет к отставанию монохромного изображения от цветного и будет полезен в том случае, когда изображение в основном статично.
В варианте осуществления, когда видеокамеры работают синхронизировано, у обеих видеокамер должно быть одинаковое время экспозиции, что ставит в зависимость чувствительность варианта осуществления от желаемой частоты развертки кадров на экране или проекционном устройстве.
Так как результаты сравнения изображений из наблюдательного канала и диагностического канала дают основания полагать, что изображения совпадать не будут в том смысле, что номеру пикселя на матрице монохромной видеокамеры в общем случае не будет соответствовать тот же участок исследуемого участка, что и пикселю с тем же самым номером на цветной видеокамере, то в начальную обработку изображения включено аффинное преобразование изображения по заранее рассчитанной матрице, связанное с его масштабированием, сдвигом и вращением в режиме реального времени.
Для ускорения процедуры обработки изображения используется графический ускоритель, например, от компании NVidia.
Тем самым решается задача простоты юстировки системы и расширения возможностей в подборе сенсоров видеокамер, то есть, они могут не совпадать по разрешению, что позволит выводить цветное изображение в высоком разрешении, а для черно-белого изображения - использовать сенсор с разрешением ниже, но максимально возможной для неохлаждаемых ПЗС видеокамер чувствительностью.
Совмещение и нормировка изображений работает следующим образом (фиг. 3).
На цветное изображение в режиме реального времени накладывается предварительно трансформированное аффинным преобразованием монохромное (флуоресцентное) изображение в режиме реального времени, образуя результирующее изображение.
В одном из вариантов осуществления изображение с монохромной видеокамеры (15) может предварительно нормироваться на изображение красного канала цветной видеокамеры (16), усиливается с коэффициентом усиления, предварительно заданным пользователем, а уже затем выводится на монитор (18) или систему проецирования (20) в виде слоя с заданным пользователем цветом, например, зеленым, бирюзовым или красным, на неизмененное цветное изображение.
Это позволяет кодировать одной и той же интенсивностью одинаковые концентрации фотосенсибилизатора и яркость слоя, кодирующего флуоресцентное свечение, зависит только от концентрации фотосенсибилизатора и введенного пользователем коэффициента усиления и не зависит от расстояния до исследуемого образца.
К моментам, способным ограничить применимость метода, можно отнести потенциальное усиление белого шума флуоресцентного слоя при делении на также низкоинтенсивное изображение красного канала цветной видеокамеры. Для минимизации этого эффекта был применен высокоинтенсивный светодиодный источник холодного свечения.
В процессе исследования клиницист имеет возможность переключаться между режимами наблюдения в окуляры микроскопа через монитор(18) или систему проецирования изображения (20).
Для возможности формирования стереоскопического изображения исследуемого участка (19) ко второму оптическому каналу нейрохирургического операционного микроскопа подключают дополнительный оптический видеоадаптер, к выходам которого подключены дополнительные монохромная видеокамера и цветная видеокамера, цифровые выходы которых соединены с блоком обработки и индикации. Используемая в устройстве подсистема компенсации изображения в красном диапазоне спектра в виде подсветки лазером для работы через окуляры операционного микроскопа позволяют заметно снизить искажения цветопередачи в оптическом канале микроскопа, подаваемом на окуляры врача.
В момент наблюдения исследуемого участка ткани через окуляры микроскопа излучение монохромного источника излучения ослабляют посредством системы управления мощностью источников освещения до такого уровня, что оно компенсирует недостаток красного света от источника белого света, ограниченного фильтром, схематически приведенном на рис. 2(в).
Таким образом, предложено устройство, которое обеспечивает проведение диагностики онкологических заболеваний фотосенсибилизированных органов с применением стандартного нейрохирургического операционного микроскопа, стандартного светодиодного источника света, медицинского лазерного источника света мощностью 1.5 Вт и длиной волны 638 нм и препаратов-фотосенсибилизаторов 5-АЛК, или на основе фталоцианина алюминия, или на основе хлорина-е6, позволяющее осуществлять резекцию опухоли непосредственно в режиме включенной флуоресцентной навигации в режиме наложения изображений, при котором флуоресцентное изображение выводится отдельным слоем поверх цветного изображения в реальном масштабе времени при этом все источники света работают непрерывно, а искажения цветопередачи в оптическом канале микроскопа, подаваемом на окуляры врача компенсируются применяемым в системе лазерным источником излучения, искажения цветопередачи, поступающие на монитор хирурга компенсируются алгоритмом цветокоррекции, суть которого не подлежит защите настоящим патентом.
Флуоресцентная навигация увеличивает точность определения границ опухоли и позволяет проводить быстрый оптический анализ тканей, что позволит с одной стороны избежать излишней резекции окружающих тканей, которая может обуславливать риск послеоперационных осложнений, с другой стороны повышает радикальность иссечения, что улучшает прогноз выживаемости пациента.
Система обладает достаточной чувствительностью для клинической диагностики и распознает концентрации от 0.5 мг/кг препаратов хлоринового ряда, препаратов на основе 5-АЛК и фталоцианина алюминия.
Приведенное описание примерного варианта осуществления дает общее представление о принципах конструирования, функционирования, изготовления и применения устройства, предлагаемого настоящим изобретением. По меньшей мере, один пример из данных вариантов осуществления проиллюстрирован прилагаемыми чертежами. Специалистам в данной области техники очевидно, что объем настоящего изобретения определяется исключительно формулой изобретения. Признаки, проиллюстрированные или описанные в связи с одним примерным вариантом осуществления, можно объединять с признаками других вариантов осуществления. Предполагается, что такие модификации и изменения находятся в пределах объема настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ КОНЦЕНТРАЦИИ ФОТОСЕНСИБИЛИЗАТОРА ПО ВИДЕОИЗОБРАЖЕНИЮ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ ПРИ ПРОВЕДЕНИИ ФЛУОРЕСЦЕНТНОГО ИССЛЕДОВАНИЯ | 2017 |
|
RU2641519C1 |
| Способ внутрипротоковой фототераностики холангиоцеллюлярного рака | 2021 |
|
RU2767264C1 |
| УСТРОЙСТВО ДЛЯ ПРОВЕДЕНИЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ С ВОЗМОЖНОСТЬЮ ОДНОВРЕМЕННОГО СПЕКТРАЛЬНО-ФЛУОРЕСЦЕНТНОГО КОНТРОЛЯ ФОТОБЛИЧИНГА ФОТОСЕНСИБИЛИЗАТОРА | 2021 |
|
RU2777486C1 |
| СПОСОБ ФЛУОРЕСЦЕНТНОЙ ЭНДОСКОПИИ И УСТРОЙСТВО ЕГО РЕАЛИЗУЮЩЕЕ | 2005 |
|
RU2290855C1 |
| УСТРОЙСТВО ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РЕЗИДУАЛЬНЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА С ФЛУОРЕСЦЕНТНЫМ КОНТРОЛЕМ ФОТООБЕСЦВЕЧИВАНИЯ ФОТОСЕНСИБИЛИЗАТОРА | 2021 |
|
RU2801893C2 |
| СПОСОБ ДИАГНОСТИКИ ОБЛАСТЕЙ ПРОЛИФЕРАЦИИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1999 |
|
RU2169922C1 |
| Видеофлуоресцентное устройство для диагностики в ближнем инфракрасном диапазоне при открытых операциях | 2023 |
|
RU2838390C2 |
| УСТРОЙСТВО И СПОСОБ ДИАГНОСТИКИ И ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ЗАБОЛЕВАНИЙ ГЛАЗ | 2003 |
|
RU2258452C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ НОВООБРАЗОВАНИЙ ШЕЙКИ МАТКИ И ВУЛЬВЫ ПОД КОНТРОЛЕМ СОВМЕСТНОЙ ВИДЕО- И СПЕКТРАЛЬНО-ФЛУОРЕСЦЕНТНОЙ ДИАГНОСТИКИ С ПРИМЕНЕНИЕМ ФОТОСЕНСИБИЛИЗАТОРОВ ХЛОРИНОВОГО РЯДА | 2021 |
|
RU2782643C1 |
| Способ фотодинамической диагностики и терапии центрального рака легкого и устройство его осуществления | 2019 |
|
RU2736909C1 |


Изобретение относится к медицинской технике, а именно к устройствам флуоресцентной навигации с применением фотосенсибилизаторов. Модуль содержит источник белого света и монохроматический источник излучения, возбуждающий флуоресценцию фотосенсибилизатора, с длиной волны 638 нм, оптоволоконное устройство доставки излучения к исследуемому участку, средство регистрации обратно рассеянного излучения и флуоресцентного излучения исследуемого участка, содержащее оптический видеоадаптер, монохромную видеокамеру, цветную видеокамеру, а также блок обработки данных, при этом источник белого света сопряжен с первым входом оптоволоконного устройства доставки излучения через светофильтр, отрезающий длинноволновую часть спектра красного участка видимого диапазона, монохроматический источник излучения сопряжен со вторым входом оптоволоконного устройства доставки излучения через устройство фильтрации и повышения числовой апертуры выходящего пучка излучения, вход оптического видеоадаптера соединен с оптическим выходом микроскопа, а к выходам оптического видеоадаптера подключены монохромная видеокамера и цветная видеокамера, цифровые выходы которых соединены с блоком обработки данных, оптический видеоадаптер выполнен с возможностью передачи флуоресцентного излучения на монохромную видеокамеру, перед которой установлен светофильтр, пропускающий длинноволновую компоненту выше 650 нм, а диффузно отраженного излучения - на цветную видеокамеру, перед которой установлен светофильтр, пропускающий коротковолновую составляющую, ниже 625 нм, выход оптоволоконного устройства доставки излучения установлен вплотную к объективу микроскопа и закреплен на оптическом видеоадаптере посредством элемента фиксации. Использование модуля позволяет повысить чувствительность оптической флуоресцентной интраоперационной навигации. 20 з.п. ф-лы, 4 ил.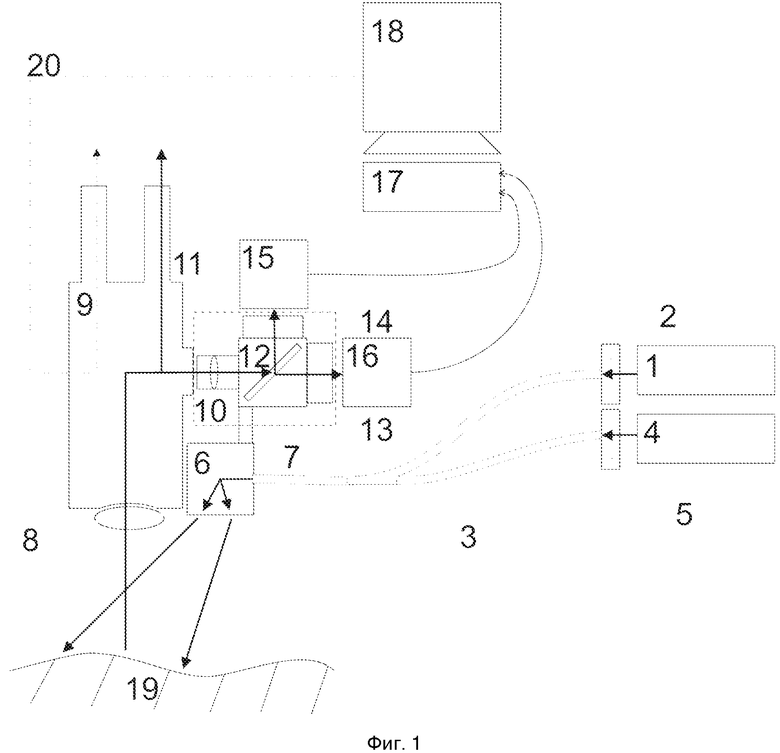
1. Модуль к оптическому нейрохирургическому операционному микроскопу для флуоресцентной интраоперационной навигации при хирургическом удалении злокачественных опухолей головного и спинного мозга, включающий:
- источник белого света и монохроматический источник излучения, возбуждающий флуоресценцию фотосенсибилизатора, с длиной волны 638 нм;
- оптоволоконное устройство доставки излучения к исследуемому участку;
- средство регистрации обратно рассеянного излучения и флуоресцентного излучения исследуемого участка, содержащее оптический видеоадаптер, монохромную видеокамеру, цветную видеокамеру;
- а также блок обработки данных;
при этом источник белого света сопряжен с первым входом оптоволоконного устройства доставки излучения через светофильтр, отрезающий длинноволновую часть спектра красного участка видимого диапазона;
монохроматический источник излучения сопряжен со вторым входом оптоволоконного устройства доставки излучения через устройство фильтрации и повышения числовой апертуры выходящего пучка излучения;
вход оптического видеоадаптера соединен с оптическим выходом микроскопа, а к выходам оптического видеоадаптера подключены монохромная видеокамера и цветная видеокамера, цифровые выходы которых соединены с блоком обработки данных;
оптический видеоадаптер выполнен с возможностью передачи флуоресцентного излучения на монохромную видеокамеру, перед которой установлен светофильтр, пропускающий длинноволновую компоненту выше 650 нм, а диффузно отраженного излучения - на цветную видеокамеру, перед которой установлен светофильтр, пропускающий коротковолновую составляющую, ниже 625 нм;
выход оптоволоконного устройства доставки излучения установлен вплотную к объективу микроскопа и закреплен на оптическом видеоадаптере посредством элемента фиксации.
2. Модуль по п. 1, отличающийся тем, что монохроматический источник излучения обладает мощностью не менее 1,5 Вт.
3. Модуль по п. 1, отличающийся тем, что источник белого света и монохроматический источник излучения выполнены с возможностью одновременной подачи излучения на исследуемый участок.
4. Модуль по п. 1, отличающийся тем, что источником белого света является светодиод, RGB лазер или ксеноновая лампа.
5. Модуль по п. 1, отличающийся тем, что монохроматическим источником излучения является полупроводниковый лазер, работающий в непрерывном режиме.
6. Модуль по п. 1, отличающийся тем, что дополнительно включает подсистему компенсации изображения в красном диапазоне спектра в виде подсветки монохромным источником излучения.
7. Модуль по п. 1, отличающийся тем, что элементом фиксации является кронштейн-держатель.
8. Модуль по п. 1, отличающийся тем, что оптоволоконное устройство доставки излучения выполнено в виде жгутов оптических волокон, разделенных в начале жгута, образуя первый и второй вход, и равномерно перемешанных в конце жгута.
9. Модуль по п. 8, отличающийся тем, что на дистальном конце жгута смонтирована оптическая насадка, разворачивающая излучение на 90 градусов и меняющая расходимость светового пучка так, чтобы световое пятно было сконцентрировано на исследуемом участке.
10. Модуль по п. 1, отличающийся тем, что блок обработки и индикации выполнен с возможностью совмещения полученных изображений от монохромной видеокамеры и цветной видеокамеры.
11. Модуль по п. 1, отличающийся тем, что в качестве фотосенсибилизатора используют: препараты на базе 5-АЛА или хлорина-е6 или фталоцианина алюминия.
12. Модуль по п. 1, отличающийся тем, что оптический видеоадаптер включает фокусирующую линзу, светоделитель, два оптических вывода на разъемы видеокамер, снабженных устройствами крепления светофильтров.
13. Модуль по п. 12, отличающийся тем, что светоделитель выполнен в виде дихроичного зеркала, частично прозрачного зеркала или призмы.
14. Модуль по п. 1, отличающийся тем, что монохромная и цветная видеокамеры выполнены с возможностью синхронизированной или асинхронной работы.
15. Модуль по п. 1, отличающийся тем, что блок обработки данных выполнен с возможностью трансформирования аффинным преобразованием изображения, поступающего с монохромной видеокамеры для последующего наложения указанного изображения на изображение, поступающее с цветной видеокамеры, в режиме реального времени, образуя результирующее изображение.
16. Модуль по п. 1, отличающийся тем, что блок обработки данных выполнен с возможностью или вывода изображения с монохромной видеокамеры, наложенного графическим слоем на изображение с цветной видеокамеры, или вывода неизмененного изображения с цветной видеокамеры, или вывода неизмененного изображения с монохромной видеокамеры.
17. Модуль по п. 15, отличающийся тем, что блок обработки данных выполнен с возможностью вывода результирующего изображения в заданном цвете.
18. Модуль по п. 15, отличающийся тем, что блок обработки данных выполнен с возможностью предварительного нормирования изображения с монохромной видеокамеры на изображение с цветной видеокамеры перед выводом результирующего изображения.
19. Модуль по п. 1, отличающийся тем, что блок обработки данных выполнен с возможностью цифровой обработки изображения с цветной видеокамеры путем усиления красного канала.
20. Модуль по п. 15, отличающийся тем, что блок обработки данных выполнен с возможностью вывода результирующего изображения в окуляры микроскопа посредством системы проецирования.
21. Модуль по любому из пп. 1-20, отличающийся тем, что включает второй оптический видеоадаптер и дополнительные цветную и монохромную видеокамеры, входы которых подключены к выходу второго оптического видеоадаптера, а выходы - к блоку обработки данных, при этом второй оптический видеоадаптер подключен ко второму оптическому каналу нейрохирургического операционного микроскопа.
| JONATAN T.ELLIOTT, ET AL, Microdose fluorescence imaging of ABY-029 on an operating microscope adapted by custom illumination and imaging modules, BIOMEDICAL OPTICS EXPRESS, v.7 No.9, Sep | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| CN 101770141 A, 07.07.2010 | |||
| US 2009234225 А1, 17.09.2009 | |||
| US 2014276008 A1, 18.09.2014 | |||
| US 2014005489 A1, 02.01.2014 | |||
| СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ, СПОСОБ ПОЛУЧЕНИЯ ЛАКТИДА И СПОСОБЫ ПОЛУЧЕНИЯ ПОЛИМОЛОЧНОЙ КИСЛОТЫ | 2009 |
|
RU2574783C2 |
Авторы
Даты
2018-07-11—Публикация
2017-03-17—Подача