Область изобретения
Настоящее изобретение относится к перорально доставляемым, самостоятельно мелко эмульгирующимся фармацевтическим композициям, которые включают препарат с низкой растворимостью в воде, конкретнее к таким композициям, где препарат находится в растворенной форме, и к способу получения таких композиций.
Предпосылки изобретения
Жидкие лекарственные формы, например растворы, подходящие для перорального введения, стали важным способом, посредством которого препараты доставляются индивидуумам, в частности, когда желательно быстрое начало терапевтического эффекта. В качестве альтернативы непосредственно всасываемым жидким композициям препарата известна также инкапсуляция жидких композиций, например, в мягкие и твердые желатиновые капсулы, для создания дискретной лекарственной формы.
К сожалению, многие полезные препараты имеют низкую растворимость в воде, и поэтому трудно получать их композиции в подходящих концентрациях в виде растворов в водном носителе. Даже когда находят подходящий растворитель в качестве носителя для такого препарата, часто наблюдаются, в частности у кристаллического препарата с низкой растворимостью в воде, выпадение в осадок из раствора и/или кристаллизация, когда препарат вступает в контакт с водой, например, в водной среде желудочно-кишечного тракта. После выпадения в осадок и/или кристаллизации препарат может затем агломерироваться с образованием более крупных частиц, что дополнительно задерживает всасывание. Такое выпадение в осадок и/или кристаллизация, особенно если они сопровождаются агломерацией, может свести на нет или снизить потенциальную ценность быстрого начала действия, которое ожидается от композиции препарата в виде раствора.
Предпринимались попытки облегчить всасывание в желудочно-кишечном тракте препаратов, плохо растворимых в воде, из композиции в виде раствора добавлением относительно больших количеств поверхностно-активного вещества; однако успех указанных попыток оказался ограниченным. Кроме того, польза от использования больших количеств поверхностно-активных веществ может быть ограничена такими проблемами, как вспенивание, которое может вызвать захват газа и раздражение желудочно-кишечного тракта.
Известны жидкие лекарственные формы, включающие инкапсулированные жидкие лекарственные формы плохо растворимых в воде препаратов в виде самостоятельно эмульгирующихся композиций. Эти композиции в целом призваны образовывать эмульсии, в некоторых случаях микроэмульсии, при смешивании с жидкостью желудочно-кишечного тракта. Такая самостоятельно эмульгирующаяся композиция может помочь поддерживать препарат в солюбилизированной форме в течение достаточного периода времени для обеспечения усиленного всасывания, но даже в составе такой композиции определенные препараты тем не менее имеют тенденцию к выпадению в осадок и/или кристаллизации в жидкости желудочно-кишечного тракта. Кроме того, высокие нагрузки поверхностно-активными веществами часто необходимы для обеспечения приемлемого поведения самостоятельного эмульгирования, что ведет к указанным выше сопутствующим проблемам.
Поэтому в данной области существует необходимость в усовершенствованных жидких композициях плохо растворимых в воде препаратов, в частности в таких композициях, которые являются мелко самостоятельно эмульгирующимися в жидкости желудочно-кишечного тракта. Термин «мелко самостоятельно эмульгирующиеся» означает здесь способность образовывать эмульсию, где по меньшей мере около 25 об.% частиц эмульсии имеют диаметр не более чем приблизительно 1 мкм. Когда распределение размера частиц эмульсии включает большую пропорцию более крупных частиц, считается, что существует большая тенденция к агрегации частиц препарата и/или снижается возможность быстрого всасывания.
Иллюстративным классом препаратов, для которых очевидна указанная необходимость, является класс селективных ингибиторов циклооксигеназы-2 (СОХ-2), с низкой растворимостью в воде.
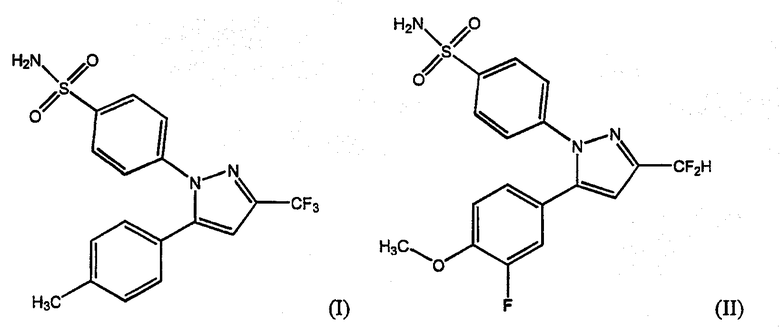
Сообщалось о многочисленных соединениях, обладающих терапевтически и/или профилактически полезным эффектом селективного ингибирования СОХ-2, которые были описаны как средства, которые можно применять при лечении или профилактике определенных расстройств, опосредованных СОХ-2, или таких расстройств в целом. Среди таких соединений находится большое количество замещенных пиразолилбензолсульфонамидов, как сообщено в патенте США № 5466823, выданном Talley et al., включающих, например, соединение 4-[5-(4-метилфенил)-3-(трифторметил)-1Н-пиразол-1-ил]бензолсульфонамид, также именуемый здесь целекоксибом (I), и соединение 4-[5-(3-фтор-4-метоксифенил)-3-дифторметил)-1Н-пиразол-1-ил]бензолсульфонамид, также именуемый здесь деракоксибом (II).
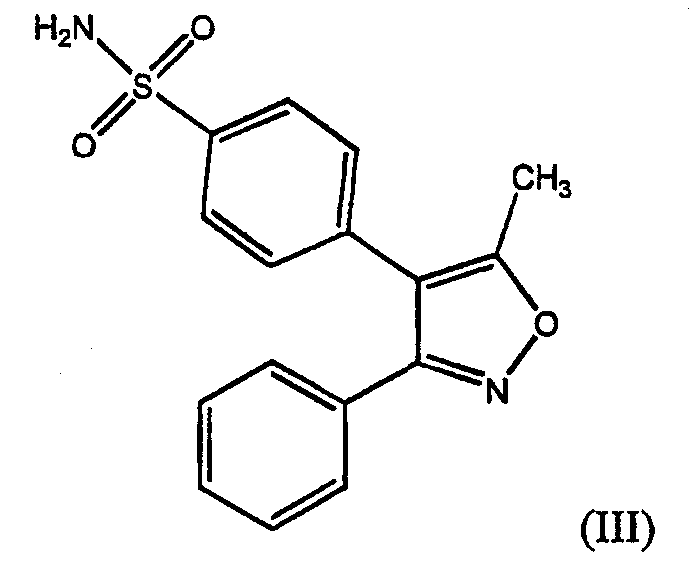
Другие соединения, которые по сообщениям обладают терапевтически и/или профилактически полезным эффектом селективного ингибирования СОХ-2, представляют собой замещенные изоксазолилбензолсульфонамиды, как сообщено в патенте США № 5633272, выданном Talley et al., включая соединение 4-[5-метил-3-фенилизоксазол-4-ил]бензолсульфонамид, также именуемый здесь валдекоксиб (III).
Еще одни соединения, которые по сообщениям обладают терапевтически и/или профилактически полезным эффектом селективного ингибирования СОХ-2, представляют собой замещенные (метилсульфонил)фенилфураноны, как сообщено в патенте США № 5474995, выданном Ducharme et al., включающих соединение 3-фенил-4-[4-(метилсульфонил)фенил]-5Н-фуран-2-он, также именуемый здесь рофекоксиб (IV).

В патенте США № 5981576, выданном Belley et al., раскрыт ряд (метилсульфонил)фенилфуранонов, которые считают полезными в качестве селективных ингибиторов СОХ-2, включая 3-(1-циклопропилметокси)-5,5-диметил-4-[4-(метилсульфонил)фенил]-5Н-фуран-2-он и 3-(1-циклопропилэтокси)-5,5-диметил-4-[4-(метилсульфонил)фенил]-5Н-фуран-2-он.
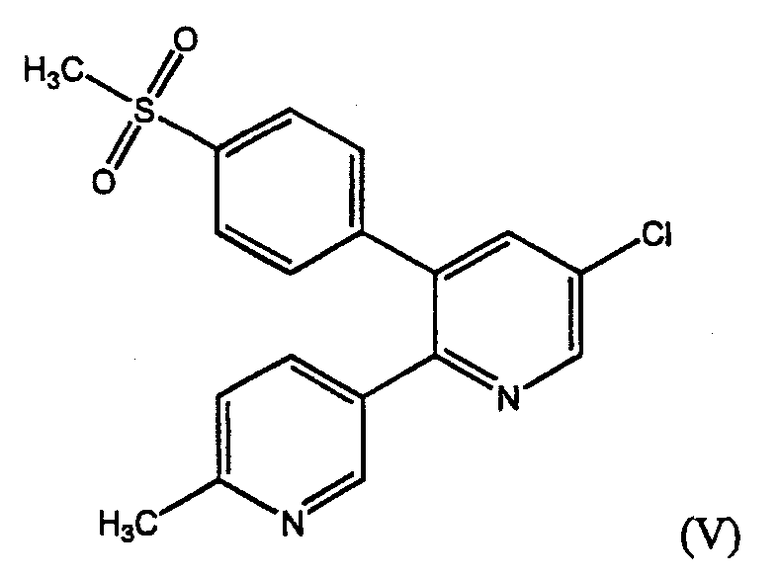
В патенте США № 5861419, выданном Dube et al., раскрыты замещенные пиридины, которые считают полезными в качестве селективных ингибиторов СОХ-2, включая, например, соединение 5-хлор-3-(4-метилсульфонил)фенил-2-(2-метил-5-пиридинил)пиридин, также именуемое здесь эторикоксибом (V).
В заявке на Европейский патент № 0863134 раскрыто соединение 2-(3,5-дифторфенил)-3-[4-(метилсульфонил)фенил]-2-циклопентен-1-он, которое считают полезным в качестве селективного ингибитора СОХ-2.
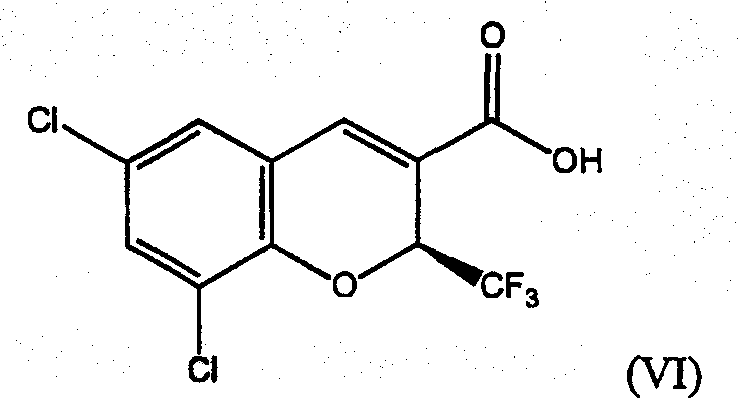
В патенте США № 6034256, выданном Carter et al., раскрыт ряд бензопиранов, которые считают полезными в качестве селективных ингибиторов СОХ-2, включая соединение (S)-6,8-дихлор-2-(трифторметил)-2Н-1-бензопиран-3-карбоновую кислоту (VI).
В международной патентной публикации № 00/24719 раскрыты замещенные пиридазиноны, которые считают полезными в качестве селективных ингибиторов СОХ-2, включая соединение 2-(3,4-дифторфенил)-4-(3-гидрокси-3-метил-1-бутокси)-5-[4-(метилсульфонил)фенил]-3-(2Н)-пиридазинон.
Существует необходимость в композициях препаратов, селективно ингибирующих СОХ-2, в частности композиций таких препаратов с быстрым началом действия. Системы доставки препаратов с быстрым началом действия могут обеспечить много преимуществ по сравнению с обычными лекарственными формами. В целом, препараты с быстрым началом действия обеспечивают более непосредственный терапевтический эффект, чем стандартные лекарственные формы. Например, при лечении острой боли, например при головной боли или мигрени, лекарственные формы с быстрым началом действия могли бы использоваться для обеспечения быстрого облегчения боли.
Заявки на патент Австралии № 200042711, № 200043730 и № 200043736 раскрывают композиции, включающие препарат, селективно ингибирующий СОХ-2, агонист 5НТ1 рецепторов и кофеин, который, как считают, можно использовать для лечения мигрени.
В патенте США № 5993858, выданном Crison & Amidon, раскрыта композиция эксципиента для увеличения биологической доступности плохо растворимого в воде препарата. Считается, что композиция является самостоятельно эмульгирующейся и включает масло или другой липидный материал, поверхностно-активное вещество и гидрофильное совместное поверхностно-активное вещество. Считается, что выбор поверхностно-активного вещества менее существен, чем выбор совместного поверхностно-активного вещества, которое, как сообщается, должно иметь число HLB (гидрофильный-липофильный баланс) больше 8. Считается, что предпочтительным примером такого совместного поверхностно-активного вещества является LabrasolTM Gattefosse, идентифицированный как продукт, «состоящий из среднецепочечных триглицеридов, полученных из кокосового масла», имеющий HLB, равное 14. Полученная композиция, содержащая 15 мг нифедипина в капсуле размера 1 (0,5 мл), т.е. в концентрации 30 мг/мл, описана как «прозрачный раствор» при 70°С, но «полутвердое вещество» при комнатной температуре.
В приведенном выше патенте США № 5993858 имеется ссылка на работу Farah et al., в которой самостоятельно эмульгирующаяся композиция была исследована на улучшение растворения in vitro индометацина. По сообщению, композиция Farah et al. содержала материал масляной фазы GrelecireTM корпорации Gattefosse вместе с продуктом полиэтиленгликолькапринового/каприлового глицерида, имеющим HLB, равное 10, продуктом лаурата пропиленгликоля, имеющим HLB, равное 4, и простым моноэтиловым эфиром диэтиленгликоля.
Препараты с низкой растворимостью в воде иногда вводят перорально в суспензии во всасываемой водной жидкости. Например, суспензия целекоксиба в виде частиц в носителе из яблочного сока раскрыта в являющейся совместной собственностью международной патентной заявке № WO 00/32189, включенной в настоящее описание в качестве ссылки. Здесь также описан разбавленный раствор целекоксиба в смеси PEG-400 (полиэтиленгликоля, имеющего среднюю молекулярную массу приблизительно 400) и воды в соотношении 2:1 по объему.
Композиции в виде суспензии и раствора, раскрытые в WO 00/32189, имеют сравнимую биологическую доступность. Однако после перорального введения собакам время, затрачиваемое для достижения максимального уровня концентрации целекоксиба в сыворотке крови (Tmax), было короче в случае композиции в виде раствора, чем в случае суспензии.
В приведенном выше патенте США № 5760068 указано, что обсуждаемые пиразолилбензолсульфонамидные соединения, примерами которых являются целекоксиб и деракоксиб, можно вводить парентерально в виде изотонических растворов в различных растворителях, включая полиэтиленгликоль и пропиленгликоль. В нем также раскрыто, что обсуждаемые соединения могут альтернативно присутствовать в композиции контролируемого высвобождения в капсуле или таблетке для перорального введения, например такое соединение может быть диспергировано в гидроксипропилметилцеллюлозе (НРМС).
В приведенном выше патенте США № 5633272 указано, что обсуждаемые изоксазолилбензолсульфонамиды, примерами которых является валдекоксиб, можно вводить парентерально в виде изотонических растворов в диапазоне растворителей, включающих полиэтиленгликоль и пропиленгликоль. В нем также раскрыто, что обсуждаемые соединения могут альтернативно присутствовать в композиции контролируемого высвобождения в капсуле или таблетке для перорального введения, например такое соединение может быть диспергировано в НРМС.
В приведенном выше патенте США № 5474995 указано, что обсуждаемые (метилсульфонил)фенилфураноны, примером которых является рофекоксиб, можно вводить парентерально в виде изотонического раствора в 1,3-бутандиоле. Там также раскрыты эмульсии масла в воде, сиропов и эликсиров для перорального введения, составленные с подслащивающими средствами, такими как пропиленгликоль, и водные суспензии, составленные с суспендирующими агентами, включая метилцеллюлозу и НРМС.
В приведенном выше патенте США № 5861419 указано, что обсуждаемые пиридины, примером которых является эторикоксиб, можно вводить парентерально в виде изотонического раствора в 1,3-бутандиоле. Там также раскрыты эмульсии масла в воде, сиропов и эликсиров для перорального введения, составленные с подслащивающими средствами, такими как пропиленгликоль, и водные суспензии, составленные с суспендирующими агентами, включая метилцеллюлозу и НРМС.
Многие соединения, селективно ингибирующие СОХ-2, включая целекоксиб, деракоксиб, валдекоксиб, рофекоксиб и эториксиб, имеют низкую растворимость в водных средах. Кроме того, некоторые из них, например целекоксиб, требуют применения относительно высоких доз. Указанные свойства создают практические проблемы при формировании концентрированных растворов препаратов, являющихся селективными ингибиторами СОХ-2, для быстрого начала действия после перорального введения. В отношении таких препаратов, применяемых в высоких дозах и имеющих низкую растворимость, размер капсулы или объем раствора, требуемый для обеспечения терапевтической дозы, становится ограничивающим фактором. Например, препарат, который имеет растворимость 10 мг/мл в данном растворителе и терапевтическую дозу 400 мг/д, потребовал бы приема внутрь 40 мл раствора. Такой объем может быть неудобным или неприемлемым для композиции во всасываемой форме; данный объем также представляет особые проблемы, когда желательна инкапсулированная лекарственная форма, потому что капсулы, которые содержат более чем от около 1,0 мл до около 1,5 мл жидкости, в целом считаются слишком большими для комфортного глотания. Таким образом, когда раствор вводят в капсульной форме, потребовалось бы принимать внутрь множество капсул для обеспечения требуемой дозы. Во избежание таких проблем необходимо выбрать растворитель, в котором препарат имеет относительно высокую растворимость.
Как описано здесь ниже, лечение препаратами, являющими селективными ингибиторами СОХ-2 с низкой растворимостью в воде, показано при очень широком ряде расстройств и состояний, опосредованных СОХ-2. Поэтому в случае разработки усовершенствованной самостоятельно эмульгирующей композиции, в частности самостоятельно мелко эмульгирующей композиции такого препарата, было бы реализовано значительное продвижение в лечении состояний и расстройств, опосредованных СОХ-2, в частности в лечении острых расстройств, при которых желательно раннее облегчение боли или других симптомов. Это представило бы особенно важное продвижение в данной области для предоставления эффективного способа лечения острой боли, например при головной боли или мигрени с использованием такой композиции.
Сущность изобретения
Настоящее изобретение относится к перорально доставляемой фармацевтической композиции, включающей препарат с низкой растворимостью в воде и растворяющую жидкость, которая включает по меньшей мере один фармацевтически приемлемый растворитель, по меньшей мере одну фармацевтически приемлемую жирную кислоту и по меньшей мере один фармацевтически приемлемый органический амин, где (а) существенная часть, например по меньшей мере 15 мас.%, препарата находится в растворенной или солюбилизированной форме в растворяющей жидкости и (b) жирная кислота и органический амин присутствуют в таких общих и относительных количествах, что композиция самостоятельно мелко эмульгируется в имитированном желудочном соке.
Изобретение относится также к способу получения такой композиции; способ включает стадии (а) получения по меньшей мере одной фармацевтически приемлемой жирной кислоты и по меньшей мере одного фармацевтически приемлемого органического амина; (b) получения фармацевтически приемлемого растворителя по меньшей мере для одной фармацевтически приемлемой жирной кислоты и фармацевтически приемлемого растворителя по меньшей мере для одного органического амина; (с) смешивания по меньшей мере с одной жирной кислотой растворителя по меньшей мере для одной жирной кислоты и растворителя по меньшей мере для одного органического амина для формирования премикса, в котором жирная кислота по существу полностью растворена; (d) смешивания с премиксом по меньшей мере одного органического амина для формирования смеси, в которой органический амин по существу полностью растворен; и (е) смешивания со смесью препарата с низкой растворимостью в воде в растворенной и/или солюбилизированной форме для формирования фармацевтической композиции.
Используемый здесь термин «растворяющая жидкость» охватывает все компоненты жидкой среды, в которой растворен или солюбилизирован определенный препарат. Таким образом, «растворяющая жидкость» включает не только один или более растворителей, жирные кислоты и органические амины, но необязательно дополнительные эксципиенты, такие как совместные растворители, поверхностно-активные вещества, совместные поверхностно-активные вещества, стабилизирующие агенты, ингибиторы кристаллизации, антиоксиданты, подслащивающие вещества, отдушки, красители и т.д.
В предпочтительной в настоящее время композиции по изобретению по существу весь препарат находится в растворенной или солюбилизированной форме в растворяющей жидкости и по существу не содержится препарат в форме твердых частиц. Такая композиция именуется здесь «раствором».
Альтернативная композиция по изобретению включает, в дополнение к первой части препарата в растворенной или солюбилизированной форме, вторую часть препарата в форме частиц, диспергированных в растворяющей жидкости. В данном варианте осуществления часть препарата находится в растворе, а часть находится в суспензии. Такая композиция именуется здесь «раствором/суспензией».
«Имитированный желудочный сок», обозначенный здесь аббревиатурой "SGF", представляет собой водный раствор 0,01М хлористоводородной кислоты и 0,15М хлорида натрия, имеющий рН около 2.
В предпочтительной в настоящее время композиции по изобретению раствор или раствор/суспензия инкапсулирован в одну или более капсул, имеющих стенку, которая разрушается в желудочно-кишечной жидкости для высвобождения препарата в пределах короткого периода времени после попадания в желудочно-кишечный тракт.
Например, можно использовать композиции по изобретению, в которых препарат представляет собой препарат, являющийся селективным ингибитором СОХ-2, и, как было обнаружено, они удивительно эффективным образом разрешают по меньшей мере некоторые из упомянутых выше трудностей. Таким образом, в соответствии с изобретением препарат с низкой растворимостью в воде теперь предоставлен в композиции мелко самостоятельно эмульгирующегося раствора. Предпочтительно, такая композиция представлена в лекарственной форме, которая удобна для перорального введения. Композиции по изобретению имеют особенные преимущества, потому что они обеспечивают возможность высокой концентрации препарата, удобны для инкапсуляции и, после перорального введения, могут обеспечить возможность быстрого всасывания препарата в поток крови посредством образования эмульсии в водной среде желудочно-кишечного тракта. Посредством указанного быстрого всасывания композиции по изобретению могут обеспечить быстрое начало терапевтического действия.
Теоретически можно предположить, что плохо растворимый в воде препарат может обеспечить более быстрое начало терапевтического эффекта при пероральном введении в растворе, в частности в самостоятельно эмульгирующемся растворе, чем в форме частиц, потому что не требуется процесс растворения в желудочно-кишечном тракте. Можно предположить даже большее преимущество по сравнению с твердой композицией, такой как таблетка, потому что в случае композиции в виде растворе не требуется ни распад, ни растворение.
Кроме того, препарат, введенный во впитываемом растворе, может быть доступен для всасывания на более высоком уровне в пищеварительном тракте, например в полости рта и пищеводе, чем препарат, доступный для всасывания только после распада композиции носителя в желудке или кишечнике.
Дополнительное преимущество жидких лекарственных форм, таких как впитываемые растворы и растворы/суспензии, для многих индивидуумов состоит в том, что указанные лекарственные формы легко глотать. Еще одно преимущество впитываемых жидких лекарственных форм состоит в том, что отмериваемые дозы могут непрерывно варьировать, обеспечивая очень большую гибкость дозы. Выгоды легкости глотания и гибкости доз имеют особые преимущества для младенцев, детей и пожилых лиц.
При инкапсуляции раствор или раствор/суспензия может обеспечить индивидууму характеристики благоприятного быстрого всасывания, связанные с жидкими композициями в дополнение к удобству дискретной, легко проглатываемой капсульной формы.
Высококонцентрированные растворы, предоставляемые настоящим изобретением, благоприятны по нескольким причинам. Во-первых, концентрированные растворы дешевле в упаковке и легче в транспортировке и обращении с ними, чем разбавленные растворы. Во-вторых, концентрированные растворы обеспечивают гибкость при введении, поскольку их можно вводить при любой желаемой степени разведения. И в-третьих, концентрированные растворы препарата, особенно при инкапсуляции, не требуют потребления больших объемов жидкости, что может быть неудобным для многих популяций пациентов.
В одном варианте осуществления изобретение относится к способу обезболивания, включающему пероральное введение нуждающемуся в обезболивании индивидууму эффективного облегчающего боль количества композиции препарата, избирательно ингибирующего СОХ-2, по изобретению. В другом варианте осуществления изобретение относится к способу лечения и/или профилактики головной боли или мигрени, включающему пероральное введение индивидууму, нуждающемуся в таком лечении или профилактике, композиции препарата, избирательно ингибирующего СОХ-2, по изобретению и сосудистого модулятора, например метилксантина, причем препарат, избирательно ингибирующий СОХ-2, и сосудистый модулятор вводят в эффективных облегчающих боль общих и относительных количествах. Препарат, избирательно ингибирующий СОХ-2, и сосудистый модулятор можно вводить в виде компонентов отдельных композиций или одной композиции. Такая одна композиция, включающая (а) препарат, избирательно ингибирующий СОХ-2, составленный в композицию, как указано здесь, и (b) сосудистый модулятор, представляет собой еще один вариант осуществления изобретения. Предпочтительным в настоящее время метилксантином является кофеин.
Другие признаки настоящего изобретения будут описаны и объяснены ниже.
Подробное описание изобретения
Новые фармацевтические композиции в соответствии с настоящим изобретением включают одну или более перорально доставляемых стандартных доз. Термин «перорально доставляемая» означает здесь дозу, пригодную для перорального введения. Термин «пероральное введение» здесь включает любую форму доставки терапевтического средства или его композиции индивидууму, при котором средство или композицию помещают в полость рта индивидуума независимо от того, глотает ли он средство или композицию или нет. Таким образом, «пероральное введение» включает введение за щеку, под язык, а также в пищевод. Всасывание средства может происходить в любой части или частях желудочно-кишечного тракта, включая ротовую полость, пищевод, желудок, 12-перстную кишку, тощую кишку, подвздошную кишку и ободочную кишку. Термин «стандартная доза» означает здесь часть фармацевтической композиции, которая содержит количество терапевтического средства, подходящего для однократного перорального введения для обеспечения терапевтического эффекта. Обычно одна стандартная доза или несколько стандартных доз (приблизительно до 4) обеспечивает достаточное количество средства для обеспечения желательного эффекта.
Препарат с низкой растворимостью в воде
Каждая стандартная доза или несколько стандартных доз включает в терапевтически и/или профилактически эффективном количестве препарат с низкой растворимостью в воде. Используемые здесь термины «препарат с низкой растворимостью в воде» или «препарат, плохо растворяющийся в воде», относятся к любому лекарственному соединению, имеющему растворимость в воде, измеренную при 37°С, не более чем приблизительно 10 мг/мл, а предпочтительно не более чем приблизительно 1 мг/мл. Предусмотрено, что композиции по изобретению особенно предпочтительны для препаратов, имеющих растворимость в воде, измеренную при 37°С, не более чем приблизительно 0,1 мг/мл.
Растворимость в воде для многих препаратов можно легко определить из стандартных фармацевтических справочников, например, The Merck Index. 11th ed., 1989 (published by Merck & Co., Inc., Rahway, NJ); the United States Pharmacopoeia. 24th ed. (USP 24), 2000; The Extra Pharmacopoeia. 29th ed., 1989 (published by Pharmaceutical Press, London); и the Physicians Desk Reference (PDR), 2001 ed. (published by Medical Economics Co., Montvale, NJ), каждый из которых отдельно включен в настоящее описание в качестве ссылки.
Например, отдельные препараты с низкой растворимостью, как определено здесь, включают препараты, которые классифицируются как «незначительно растворимые», «очень незначительно растворимые», «практически нерастворимые» и «нерастворимые» в 24-й Фармакопее США, стр. 2254-2298; и препараты, которые классифицируются как требующие 100 мл или более воды для растворения 1 г препарата, как перечислено в Фармакопее США, стр. 2299-2304.
Иллюстративно, подходящие препараты с низкой растворимостью в воде включают, без ограничения, препараты из следующих классов: средства, вызывающие аборт, ингибиторы ацетилхолинэстеразы, α- и β-адренергические агонисты, α- и β-адренергические блокаторы, средства, подавляющие кору надпочечников, адренокортикотропные гормоны, средства, вызывающие отвращение к алкоголю, ингибиторы альдозоредуктазы, антагонисты альдостерона, анаболики, анальгетики (включая наркотические и не наркотические анальгетики), андрогены, антагонисты рецепторов II ангиотензина, средства, снижающие аппетит, антацидные средства, противоглистные средства, средства против угревой сыпи, антиаллергические средства, средства против облысения, антиамебные средства, антиандрогены, средства против стенокардии, антиаритмические средства, антисклеротические средства, средства против артрита/против ревматизма (включая избирательные ингибиторы СОХ-2), антиастматические средства, антибактериальные средства, вспомогательные антибактериальные средства, антихолинергические средства, антикоагулянты, противосудорожные средства, антидепрессанты, антидиабетические средства, средства против диареи, антидиуретические средства, антидоты против яда, средства против дискинезий, средства против экземы, противорвотные средства, антиэстрогены, средства против фиброза, средства против метеоризмов, противогрибковые средства, средства против глаукомы, антигонадотропины, средства против подагры, антигистаминные препараты, средства против гиперактивности, средства против гиперлипопротеинемии, средства против гиперфосфатемии, средства против гипертонии, средства против гипертиреоза, средства против гипотонии, средства против гипотиреоза, противовоспалительные средства, средства против малярии, средства против маниакальных состояний, средства против метгемоглобинемии, средства против мигрени, антимускариновые средства, антимикобактериальные средства, средства и вспомогательные средства против новообразований, средства против нейтропении, средства против остеопороза, средства для лечения болезни Педжета, средства против паркинсонизма, средства против феохромоцитомы, средства против пневмоцистоза, средства против гипертрофии предстательной железы, средства против простейших, средства против зуда, антипсориатические средства, антипсихотические средства, жаропонижающие средства, средства против рикеттсиоза, антисеборрейные средства, антисептики/дезинфицирующие средства, спазмолитические средства, противосифилитические средства, средства против тромбоцитемии, антитромботические средства, средства от кашля, противоязвенные средства, средства против мочекаменной болезни, противоядия, противовирусные средства, анксиолитические средства, ингибиторы ароматазы, вяжущие средства, безодиазепиновые антагонисты, ингибиторы резорбции костей, средства, вызывающие брадикардию, антагонисты брадикинина, бронхолитические средства, блокаторы кальциевых каналов, регуляторы кальция, ингибиторы карбоновой ангидразы, средства, стимулирующие сердечную деятельность, ингибиторы холецистокинина, хелатообразующие средства, средства, растворяющие желчные камни, желчегонные средства, холинергические средства, ингибиторы холинэстеразы, реактиваторы холинэстеразы, стимуляторы ЦНС, противозачаточные средства, средства для очистки раневой поверхности, противоотечные средства, депигментирующие средства, средства, подавляющие герпетиформный дерматит, средства, способствующие пищеварению, диуретики, агонисты допаминовых рецепторов, антагонисты допаминовых рецепторов, средства для уничтожения эктопаразитов, рвотные средства, ингибиторы энкефалиназы, ферменты, ферментные кофакторы, эстрогены, отхаркивающие средства, антагонисты рецепторов фибриногена, добавки фторидов, стимуляторы желудочной и панкреатической секреции, средства защиты желудочных клеток, ингибиторы желудочного протонного насоса, ингибиторы желудочной секреции, гастропрокинетические средства, глюкокортикоиды, ингибиторы α-глюкозидазы, факторы, стимулирующие половые железы, ингибиторы гормона роста, факторы, высвобождающие гормон роста, стимуляторы роста, средства, повышающие уровень гемоглобина в крови, гематопоэтические средства, гемолитические средства, гемостатические средства, антагонисты гепарина, индукторы печеночных ферментов, средства, защищающие печень, антагонисты Н2 рецепторов гистамина, ингибиторы протеазы ВИЧ, ингибиторы HMG CoA редуктазы, иммуномодуляторы, иммуносуппрессанты, инсулиновые сенсибилизаторы, ионообменные смолы, кератолитические средства, гормоны, стимулирующие лактацию, слабительные/очищающие кишечник средства, антагонисты лейкотриена, агонисты люлиберина, липотропные средства, ингибиторы 5-липоксигеназы, средства, подавляющие красную волчанку, ингибиторы матричной металлопротеиназы, минералокортикоиды, миотические средства, ингибиторы моноаминоксидазы, муколитические средства, мышечные релаксанты, средства, расширяющие зрачок, наркотические антагонисты, нейропротективные средства, ноотропные средства, гормоны яичников, средства, стимулирующие родовую деятельность, ингибиторы пепсина, средства, вызывающие пигментацию, средства, увеличивающие объем плазмы, средства, активирующие/открывающие калиевые каналы, прогестогены, ингибиторы пролактина, простагландины, ингибиторы протеазы, радиологические фармацевтические средства, ингибиторы 5α-редуктазы, стимуляторы дыхания, ингибиторы обратной транскриптазы, седативные/снотворные средства, серенические средства, ингибиторы обратного захвата серотонина норадреналина, агонисты рецепторов серотонина, антагонисты рецепторов серотонина, ингибиторы захвата серотонина, аналоги соматостатина, тромболитические средства, антагонисты А2 рецепторов тромбоксана, гормоны щитовидной железы, тиреотропные гормоны, средства, снижающие родовую деятельность, ингибиторы топоизомеразы I и II, урикозурические средства, сосудистые модуляторы, включая сосудорасширяющие и сосудосуживающие средства, средства защиты сосудов, ингибиторы ксантиноксидазы и их комбинации.
Неограничивающие примеры подходящих препаратов с низкой растворимостью в воде включают, например, ацетогексамид, ацетилсалициловую кислоту, алклофенак, аллопуринол, атропин, бензтиазид, карпрофен, целекоксиб, хлордиазэпоксид, хлорпромазин, кломидин, кодеин, кодеин фосфат, кодеин сульфат, деракоксиб, диацереин, диклофенак, дилтиазем, эстрадиол, этодолак, этопозид, эторикоксиб, фенбуфен, фенклофенак, фенпрофен, фентиазак, флурбипрофен, гризеофульвин, галоперидол, ибупрофен, индометацин, индопрофен, кетопрофен, лоразепам, медроксипрогестерон ацетат, мегестрол, метокссален, метилпреднизон, морфин, морфин сульфат, напроксен, ницерголин, нифедипин, нифлумик, оксапрозин, оксазепам, оксифенбутазон, паклитаксел, фениндион, фенобарбитал, пироксикам, пирпрофен, преднизолон, преднизон, прокаин, прогестерон, пириметамин, рофекоксиб, сульфадиазин, сульфамеразин, сульфисоксазол, сулиндак, супрофен, темазепам, тиапрофеновую кислоту, тиломисол, толметик, валдекоксиб, и т.д.
Количество препарата, включенное в лекарственную форму по изобретению, можно выбирать в соответствии с известными принципами фармации. Особенно предпочтительно терапевтически эффективное количество препарата. Используемый здесь термин «терапевтически и/или профилактически эффективное количество» относится к количеству препарата, которое достаточно для того, чтобы вызвать требуемую или желаемую терапевтическую и/или профилактическую реакцию.
В особенно предпочтительном варианте осуществления препарат представляет собой препарат, селективно ингибирующий СОХ-2, с низкой растворимостью в воде. Можно использовать любой такой препарат, селективно ингибирующий СОХ-2, известный в данной области. Композиции по изобретению особенно полезны для соединений формулы (VII)

где:
А представляет собой заместитель, выбранный из частично ненасыщенного или ненасыщенного гетероциклила и частично ненасыщенных или ненасыщенных карбоциклических колец, предпочтительно, гетероциклильную группу, выбранную из пиразолильной, фуранонильной, изоксазолильной, пиридинильной, циклопентенонильной и пиридазинонильной групп;
Х представляет собой O, S или СН2;
n = 0 или 1;
R1 представляет собой по меньшей мере один заместитель, выбранный из гетероциклила, циклоалкила, циклоалкенила или арила, и является необязательно замещенным в замещаемом положении одним или более радикалами, выбранными из алкила, галогеналкила, циано, карбоксила, алкоксикарбонила, гидроксила, гидроксиалкила, галогеналкокси, амино, алкиламино, ариламино, нитро, алкоксиалкила, алкилсульфинила, галогена, алкокси и алкилтио;
R2 представляет собой метил, амино или аминокарбонилалкил;
R3 представляет собой один или более радикалов, выбранных из гидрида, галогена, алкила, алкенила, алкинила, оксо, циано, карбоксила, цианоалкила, гетероциклилокси, алкилокси, алкилтио, алкилкарбонила, циклоалкила, арила, галогеналкила, гетероциклила, циклоалкенила, аралкила, гетероциклилалкила, ацила, алкилтиоалкила, гидроксиалкила, алкоксикарбонила, арилкарбонила, аралкилкарбонила, аралкенила, алкоксиалкила, арилтиоалкила, арилоксиалкила, аралкилтиоалкила, аралкоксиалкила, алкоксиаралкоксиалкила, алкоксикарбонилалкила, аминокарбонила, аминокарбонилалкила, алкиламинокарбонила, N-ариламинокарбонила, N-алкил-N-ариламинокарбонила, алкиламинокарбонилалкила, карбоксиалкила, алкиламино, N-ариламино, N-аралкиламино, N-алкил-N-аралкиламино, N-алкил-N-ариламино, аминоалкила, алкиламиноалкила, N-ариламиноалкила, N-аралкиламиноалкила, N-алкил-N-аралкиламиноалкила, N-алкил-N-ариламиноалкила, арилокси, аралкокси, арилтио, аралкилтио, алкилсульфинила, алкилсульфонила, аминосульфонила, алкиламиносульфонила, N-ариламиносульфонила, арилсульфонила и N-алкил-N-ариламиносульфонила, причем R3 необязательно замещен в замещаемом положении одним или более радикалами, выбранными из алкила, галогеналкила, циано, карбоксила, алкоксикарбонила, гидроксила, гидроксиалкила, галогеналкокси, амино, алкиламино, ариламино, нитро, алкоксиалкила, алкилсульфинила, галогена, алкокси и алкилтио; и
R4 выбран из гидрида и галогена.
Композиции по изобретению особенно полезны для селективных ингибиторов СОХ-2 формулы (VIII)
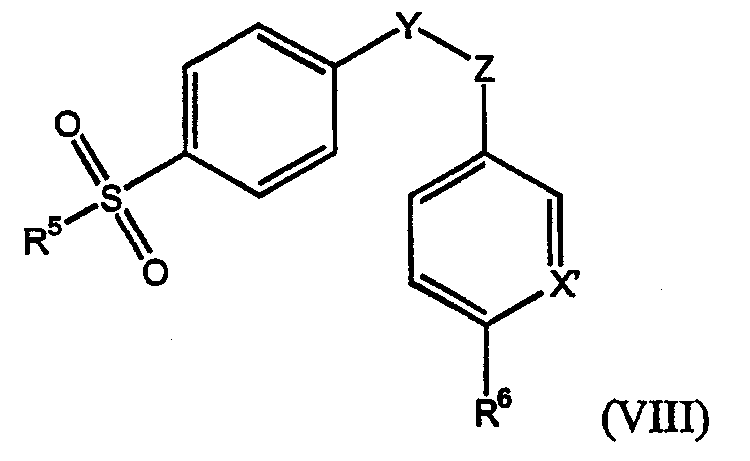
где R5 представляет собой метильную или амино группу, R6 представляет собой водород или С1-4алкильную или алкокси группу, Х1 представляет собой N или CR7, где R7 представляет собой водород или галоген, а Y и Z независимо представляют собой атомы углерода или азота, определяющие соседние атомы пяти- или шестичленного кольца, которое необязательно замещено в одном или более положений оксогруппой, галогеном, метильной или галогенметильной группами, или для их изомера, таутомера, фармацевтически приемлемой соли или пролекарства. Предпочтительными такими пяти- или шестичленными кольцами являются циклопентеноновое, фураноновое, метилпиразольное, изоксазольное и пиридиновое кольца, замещенные не более чем в одном положении.
Иллюстративно, композиции по изобретению подходят для целекоксиба, деракоксиба, валдекоксиба, рофекоксиба, эторикоксиба, 2-(3,5-дифторфенил)-3-[4-(метилсульфонил)фенил]-2-циклопентен-1-она и 2-(3,4-дифторфенил)-4-(3-гидрокси-3-метил-1-бутокси)-5-[4-(метилсульфонил)фенил]-3-(2H)-пиридазинона.
Композиции по изобретению особенно полезны для соединений формулы (IX)
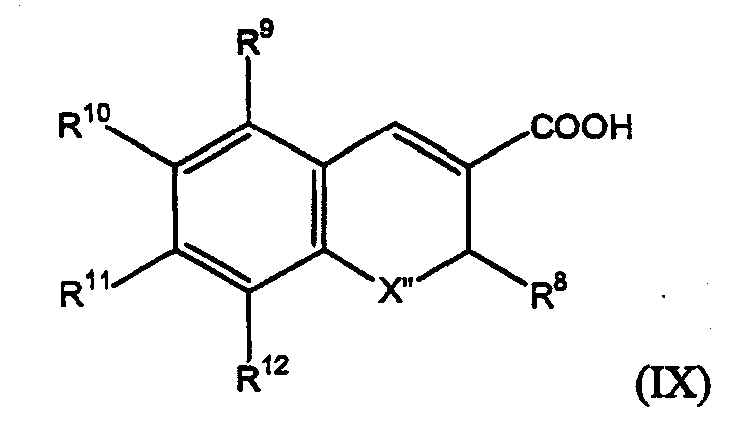
где X" представляет собой O, S или N-низший алкил; R8 представляет собой низший галогеналкил; R9 представляет собой водород или галоген; R10 представляет собой водород, галоген, низший алкил, низший алкокси или галогеналкокси, низший аралкилкарбонил, низший диалкиламиносульфонил, низший алкиламиносульфонил, низший аралкиламиносульфонил, низший гетероаралкиламиносульфонил или 5- или 6-членный содержащий азот гетероциклосульфонил; R11 и R12 независимо представляют собой водород, галоген, низший алкил, низший алкокси или арил; и для их фармацевтически приемлемых солей.
Особенно полезным соединением формулы (IX) является (S)-6,8-дихлор-2-(трифторметил)-2Н-1-бензопиран-3-карбоновая кислота.
Иллюстративно, целекоксиб, деракоксиб, валдекоксиб, рофекоксиб, эторикоксиб, 2-(3,5-дифторфенил)-3-[4-(метилсульфонил)фенил]-2-циклопентен-1-он, (S)-6,8-дихлор-2-(трифторметил)-2Н-1-бензопиран-3-карбоновая кислота и 2-(3,4-дифторфенил)-4-(3-гидрокси-3-метил-1-бутокси)-5-[4-(метилсульфонил)фенил]-3-(2H)-пиридазинон, конкретнее, целекоксиб, валдекоксиб, рофекоксиб и эторикоксиб, и еще конкретнее, целекоксиб и валдекоксиб можно использовать в способе и композиции по изобретению.
Изобретение иллюстрируется здесь с особой ссылкой на целекоксиб, и следует понимать, что любой другой препарат, селективно ингибирующий СОХ-2 с низкой растворимостью в воде, можно, при желании, использовать полностью или частично вместо целекоксиба в описанных здесь композициях. Например, композиции по изобретению подходят для валдекоксиба, отдельно или в комбинации с целекоксибом.
Когда препарат представляет собой целекоксиб, композиция обычно включает целекоксиб в терапевтически и/или профилактически эффективном полном количестве от около 10 мг до около 1000 мг на стандартную дозу. Когда препарат представляет собой препарат, селективно ингибирующий СОХ-2, отличный от целекоксиба, количество препарата на стандартную дозу терапевтически эквивалентно от около 10 мг до около 1000 мг целекоксиба.
Следует понимать, что терапевтически и/или профилактически эффективное количество препарата для индивидуума зависит, наряду с другими факторами, от массы тела индивидуума. Здесь «индивидуум», которому можно вводить терапевтическое средство или его композицию, включает человека-пациента любого пола и любого возраста, а также включает любое животное, кроме человека, в частности сельскохозяйственное или домашнее животное, иллюстративно кошку, собаку или лошадь.
Когда индивидуумом является ребенок или небольшое животное (например, собака), терапевтически эффективным, вероятно, будет относительно низкое количество целекоксиба, например относительно низкое в предпочтительном диапазоне от около 10 мг до около 1000 мг. Когда индивидуумом является взрослый человек или большое животное (например, лошадь), вероятно, что терапевтическая активность потребует стандартные дозы, содержащие относительно большее количество целекоксиба. Для взрослого человека терапевтически эффективное количество целекоксиба на стандартную дозу в композиции согласно настоящему изобретению составляет обычно от около 10 мг до около 400 мг. Особенно предпочтительными дозами целекоксиба на стандартную дозу являются от около 100 мг до около 200 мг, например около 100 мг или около 200 мг.
Для других препаратов, избирательно ингибирующих СОХ-2, количество препарата на стандартную дозу может быть в диапазоне, который известен как терапевтически эффективный для таких препаратов. Предпочтительно, количество на стандартную дозу находится в диапазоне, обеспечивающем терапевтическую эквивалентность целекоксибу в диапазонах доз, указанных непосредственно выше.
Форма композиций по изобретению
Композиции согласно настоящему изобретению находятся предпочтительно в форме концентрированного раствора, который может быть или не быть инкапсулирован в виде дискретного изделия. При инкапсуляции предпочтительно одного или нескольких таких изделий (приблизительно до 10, предпочтительнее не более чем около 4) достаточно для обеспечения суточной дозы. Альтернативно, композиции согласно настоящему изобретению находятся в форме концентрированной впитываемой жидкости. Фраза «впитываемая жидкость» используется здесь для обозначения неинкапсулированной по существу однородной текучей массы, такой как раствор или раствор/суспензия, вводимой перорально и проглатываемой в жидкой форме, и из которой можно отмерить одиночные стандартные дозы. Термин «по существу однородная» со ссылкой на фармацевтическую композицию, которая включает несколько компонентов, означает, что компоненты смешаны так, что отдельные компоненты не присутствуют в дискретных слоях и не образуют градиенты концентрации внутри композиции.
Конкретную стандартную дозу можно выбрать для соответствия желаемой частоте введения, используемой для достижения определенной суточной дозы. Например, суточное количество дозировки 400 мг можно достичь введением одной стандартной дозы 200 мг или двух стандартных доз по 100 мг дважды/д. Количество композиции, которое вводят, и схема дозировки для лечения состояния или расстройства будут зависеть от различных факторов, включая возраст, массу тела, пол и медицинское состояние индивидуума, природы и тяжести состояния или расстройства, пути и частоты введения и конкретного выбранного препарата, и, таким образом, могут широко варьировать. Однако предусматривается, что для большинства целей схема введения 1 раз/д или 2 раза/д обеспечивает желательную терапевтическую эффективность.
Композиция по изобретению включает препарат с низкой растворимостью в воде, по меньшей мере часть которого находится в растворенной или солюбилизированной форме в растворяющей жидкости, подходящей для перорального введения.
Растворяющая жидкость включает по меньшей мере один фармацевтически приемлемый растворитель, по меньшей мере одну фармацевтически приемлемую жирную кислоту и по меньшей мере один фармацевтически приемлемый органический амин и, необязательно, один или более дополнительных компонентов, включая фармацевтически приемлемые эксципиенты. Термин «эксципиент» здесь означает любое вещество, не являющееся терапевтическим средством, используемое в качестве носителя или среды для доставки терапевтического средства индивидууму или добавленное к фармацевтической композиции для улучшения обращения с ним, хранения, разрыхления, дисперсии, растворения, высвобождения или органолептических свойств, или для обеспечения возможности или облегчения формирования стандартной дозы композиции в дискретном изделии, таком как капсула, подходящем для перорального введения. Эксципиенты могут включать, в качестве иллюстрации, а не ограничения, разбавители, разрыхлители, диспергирующие агенты, связывающие агенты, связующие вещества, смачивающие агенты, смазывающие вещества, глянцующие вещества, ингибиторы кристаллизации, стабилизаторы, антиоксиданты, вещества, добавляемые для маскировки или противодействия неприятному вкусу или запаху, отдушки, красители, душистые вещества, консерванты и вещества, добавляемые для улучшения внешнего вида композиции.
Такие необязательные дополнительные компоненты должны быть физически и химически совместимы с другими ингредиентами композиции и не должны быть вредными для реципиента. Важно, что некоторые из перечисленных выше классов эксципиентов перекрывают друг друга. Композиции согласно настоящему изобретению можно приспособить для введения любым пероральным путем выбором соответствующих компонентов растворяющей жидкости и дозировки препарата, эффективной для предполагаемого лечения. Соответственно, компоненты, используемые в растворяющей жидкости, сами могут представлять собой твердые вещества, полутвердые вещества, жидкости или их комбинации.
Всасываемая композиция по изобретению может быть в форме, например, раствора, раствора/суспензии, эликсира, сиропа или любой другой жидкой форме, приспособленной для перорального введения. Такие композиции могут также включать эксципиенты, выбранные, например, из эмульгирующих и суспендирующих агентов, подслащивающих и ароматизирующих агентов, поверхностно-активных веществ и совместных поверхностно-активных веществ.
Альтернативно, как подробно описано ниже, композицию по изобретению можно получить в форме дискретных стандартных доз, например капсул, имеющих стенку, которая иллюстративно включает желатин и/или целлюлозный полимер, такой как НРМС, причем каждая капсула содержит жидкую композицию, включающую предварительно определенное количество препарата в растворяющей жидкости. Жидкая композиция внутри капсулы высвобождается разрушением стенки после контакта с желудочно-кишечной жидкостью. Конкретный механизм разрушения стенки капсулы не важен и может включать такие механизмы, как эрозия, разложение, растворение и т.д.
Композиции по изобретению можно получить любым подходящим способом фармации, который включает этап приведения в ассоциацию препарата и компонентов растворяющей жидкости. В целом, композиции целекоксиба по изобретению получают равномерным и тщательным смешиванием с растворяющей жидкостью таким образом, что по меньшей мере часть, предпочтительно, по существу весь целекоксиб растворен или солюбилизирован в растворяющей жидкости; а затем, при желании, инкапсуляцией полученного раствора или раствора/суспензии, например, в твердые или мягкие капсулы.
Предпочтительный вариант осуществления изобретения представляет собой композицию, включающую терапевтически эффективное количество препарата с низкой растворимостью в воде, например целекоксиба или валдекоксиба, по существу полностью растворенного в фармацевтически приемлемой растворяющей жидкости, включающей по меньшей мере один растворитель, по меньшей мере одну жирную кислоту и по меньшей мере один органический амин. В данном варианте осуществления по существу часть препарата присутствует в форме твердых частиц. Композиции согласно этому варианту осуществления можно составить или во всасываемой, или в дискретной лекарственной форме (например, инкапсулированной). Такие композиции необязательно, кроме того, включают ингибитор кристаллизации, как полнее описано ниже, причем ингибитор кристаллизации присутствует в растворяющей жидкости и/или как компонент стенки капсулы. Предпочтительно, концентрированные растворы этого варианта осуществления имеют концентрацию препарата от около 10% до около 75%, предпочтительнее от около 20% до около 75 мас.% композиции.
Растворитель
Предпочтительным растворителем является гликоль или простой гликолевый эфир. Подходящие гликолевые эфиры включают соединения, соответствующие формуле (Х):
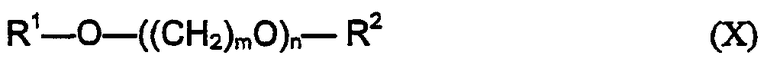
где R1 и R2 независимо представляют собой водород или С1-6-алкильную, С1-6-алкенильную, фенильную или бензильную группы, но не более чем один из R1 и R2 представляет собой водород; m представляет собой целое число от 2 до около 5; и n представляет собой целое число от 1 до около 20. Предпочтительно один из R1 и R2 представляет собой С1-4-алкильную группу; а второй является водородом или С1-4-алкильной группой, более предпочтительно по меньшей мере один из R1 и R2 представляет собой метильную или этильную группу. Предпочтительно m=2. Предпочтительно n представляет собой целое число от 1 до около 4, более предпочтительно 2.
Простые гликолевые эфиры в композициях по настоящему изобретению обычно имеют молекулярную массу от около 75 до около 1000, предпочтительно от около 75 до около 500, более предпочтительно от около 100 до около 300. Важно, чтобы простые гликолевые эфиры, используемые в композициях согласно изобретению, были фармацевтически приемлемыми и соответствовали всем другим предписанным здесь условиям.
Неограничивающие примеры простых гликолевых эфиров, которые могут быть использованы в композициях согласно изобретению, включают простой монометиловый эфир этиленгликоля, простой диметиловый эфир этиленгликоля, простой моноэтиловый эфир этиленгликоля, простой диэтиловый эфир этиленгликоля, простой монобутиловый эфир этиленгликоля, простой дибутиловый эфир этиленгликоля, простой монофениловый эфир этиленгликоля, простой монобензиловый эфир этиленгликоля, простой бутилфениловый эфир этиленгликоля, простой терпиниловый эфир этиленгликоля, простой монометиловый эфир диэтиленгликоля, простой диметиловый эфир диэтиленгликоля, простой монометиловый эфир диэтиленгликоля, простой диэтиловый эфир диэтиленгликоля, простой дивиниловый эфир диэтиленгликоля, простой монобутиловый эфир этиленгликоля, простой дибутиловый эфир диэтиленгликоля, простой моноизобутиловый эфир диэтиленгликоля, простой диметиловый эфир триэтиленгликоля, простой моноэтиловый эфир триэтиленгликоля, простой монобутиловый эфир триэтиленгликоля, простой диметиловый эфир тетраэтиленгликоля и их смеси (см., например, Flick (1998): Industrial Solvents Handbook. 5th ed., Noyes Data Corporation, Westwood, NJ. Особенно подходящим растворителем в виде простого гликолевого эфира является простой моноэтиловый эфир диэтиленгликоля, иногда именуемый в данной области DGME или этоксидигликолем. Он доступен, например, под торговой маркой TranscutolTM корпорации Gattefossè.
Гликоли, подходящие в качестве растворителей в композициях согласно изобретению, включают пропиленгликоль, 1,3-бутандиол и полиэтиленгликоли. Предпочтительным в настоящее время растворителем является полиэтиленгликоль (PEG).
Можно использовать любой фармацевтически приемлемый PEG. Предпочтительно PEG имеет среднюю молекулярную массу от около 100 до около 10000, более предпочтительно от около 100 до около 1000. Еще более предпочтительно PEG имеет жидкий сорт. Неограничивающие примеры PEG, которые можно использовать в растворяющих жидкостях согласно изобретению, включают PEG-200, PEG-350, PEG-400, PEG-540 и PEG-600 (см., например, Flick (1998), op. cit., p. 392). Предпочтительный в настоящее время PEG имеет среднюю молекулярную массу от около 375 до около 450, как проиллюстрировано PEG-400.
PEG, такие как PEG-400, имеют много желательных свойств в качестве растворителей для плохо растворимых в воде препаратов. В случае целекоксиба, например, препарат можно растворить или солюбилизировать в очень высокой концентрации в PEG-400, обеспечивая возможность составления композиции терапевтически эффективной дозы в очень маленьком объеме растворяющей жидкости. Это особенно важно, когда полученный раствор предстоит инкапсулировать, поскольку можно изготовить капсулы размера, удобного для глотания, содержащие терапевтически эффективную дозу даже такого препарата как целекоксиб, имеющего относительно высокую потребность в дозе для эффективности. Важно, чтобы этанол, вода и другие эксципиенты, идентифицированные здесь ниже в качестве совместных растворителей или в других местах, при желании можно было использовать в качестве растворителей в композиции по изобретению. Обычно один или более растворителей присутствуют в композиции по изобретению в общем количестве от около 5% до около 95%, предпочтительно от около 10% до около 90%, более предпочтительно от около 15% до около 85 мас.%. Однако одного растворителя, даже очень хорошего растворителя, такого как PEG, недостаточно для получения самостоятельно мелко эмульгирующейся композиции. В соответствии с настоящим изобретением, и как описано полнее ниже, комбинация жирной кислоты и амина, предпочтительно органического амина, обеспечивает удивительно эффективное решение проблемы получения самостоятельно мелко эмульгирующейся жидкой композиции плохо растворимого в воде препарата. Поэтому в особенно предпочтительном варианте осуществления растворяющая жидкость включает фармацевтически приемлемый растворитель по меньшей мере для одной жирной кислоты и фармацевтически приемлемый растворитель по меньшей мере для одного органического амина. Термин «фармацевтически приемлемый растворитель по меньшей мере для одной жирной кислоты» означает, что растворитель должен быть способен растворить соответствующие количества жирной кислоты, предпочтительно, при умеренном перемешивании при комнатной температуре. Термин «фармацевтически приемлемый растворитель по меньшей мере для одного органического амина» означает, что растворитель должен быть способен растворить соответствующие количества жирной кислоты, предпочтительно, при умеренном перемешивании при комнатной температуре. Техник посредством обычного экспериментирования легко идентифицирует фармацевтически приемлемый растворитель (растворители) для жирной кислоты и органического амина. В некоторых случаях растворитель может представлять собой приемлемый растворитель и для органического амина, и для жирной кислоты, хотя в других случаях будет использоваться несколько растворителей.
Жирная кислота и органический амин
Авторы изобретения обнаружили, что включение комбинации жирной кислоты и органического амина в композицию плохо растворимого в воде препарата в виде раствора или раствора/суспензии может сделать композицию мелко самостоятельно эмульгирующейся в SGF. Поэтому композиция по изобретению включает по меньшей мере одну фармацевтически приемлемую жирную кислоту и по меньшей мере один фармацевтически приемлемый амин, предпочтительно органический амин (также именуемые здесь «пара жирной кислоты/органического амина»). Без связи с теорией, считается, что пара жирной кислоты/органического амина при присутствии в соответствующих общих и относительных количествах в растворяющей жидкости способствует образованию заряженных мелкоэмульсионных капелек после контакта композиции с водной средой, такой как SGF.
То, является ли композиция «мелко самостоятельно эмульгирующейся» в SGF, как определено здесь, можно иллюстративно определить в соответствии с тестом I.
Тест I:
А. Аликвотное количество испытуемой композиции 400 мкл помещают в сосуд с завинчивающейся верхней частью и с боковым патрубком, содержащий 20 мл SGF (поддерживаемый при 37°С в течение всего испытания) для образования испытуемой жидкости.
В. Испытуемую жидкость слегка перемешивали при 75 об/мин в течение 2 мин с использованием орбитального аппарата для встряхивания для обеспечения возможности эмульгирования.
С. Аликвотное количество испытуемой жидкости 5-50 мкл удаляют через боковой патрубок с использованием пипетки и выливают из пипетки в сосуд для взятия проб.
D. Насос (например, модель RH0CKC-LF, Fluid Meterong Inc., Syosset, NY) используют для проталкивания испытуемой жидкости из сосуда для взятия образцов через комбинированный датчик рассеивания/затемнения (например, LE400-0,5, Particle Sizing Systems, Santa Barbara, CA) со скоростью 1 мл/мин в течение периода 1 мин.
Е. Эмульсионные частицы подсчитывают отдельно рассеянием света в диапазоне размера (т.е. диаметра) от 0,5 до 1 мкм и затемнением света в диапазоне размера больше 1 мкм с использованием программного обеспечения продавца (например, версии 1.59).
F. Строят график зависимости количества (т.е. не взвешенных) или объема (т.е. взвешенных) частиц эмульсии от диаметра частиц.
G. Проводят интегрирование графика с учетом всех разведений для оценки общего количества или объема эмульсионных частиц, присутствующих в испытуемой жидкости, достаточно больших для выявления датчиком.
Н. Если тест I приводит приблизительно к 25 об.% эмульсионных частиц или более, имеющих диаметр 1 мкм или менее, испытуемую композицию считают мелко самостоятельно эмульгирующейся.
Предпочтительные жирные кислоты имеют насыщенную или ненасыщенную С6-24 углеродную цепь. Неограничивающие примеры подходящих жирных кислот включают олеиновую кислоту, октановую кислоту, капроновую кислоту, каприловую кислоту, каприновую кислоту, элеостеариновую кислоту, лауриновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, икозановую кислоту, элаидиновую кислоту, линолевую кислоту, линоленовую кислоту, эйкозапентановую кислоту и докозагексановую кислоту. Олеиновая кислота представляет собой особенно предпочтительную жирную кислоту.
Предпочтительные органические амины имеют С2-8 углеродную цепь с одной или двумя аминовыми группами. Предпочтительнее, органические амины можно выбрать из С2-8алкиламинов, алкилендиаминов, алканоламинов, алкилалканоламинов, аминов простого гликолевого эфира и ариламинов. Неограничивающие примеры подходящих органических аминов включают моноэтаноламин, диэтаноламин, триэтаноламин, диметиламиноэтанол, трометамин и т.д. Особенно предпочтительными органическими аминами являются третичные амины, например триэтаноламин и диметиламиноэтанол.
Пару жирной кислоты/органического амина выбирают (в отношении и типа, и количества каждого компонента) так, чтобы, когда композицию по изобретению подвергают тесту I, по меньшей мере около 50%, предпочтительно по меньшей мере около 75 об.%, эмульсионных частиц имели диаметр около 1 мкм или менее. Особенно предпочтительно, чтобы существенная часть подсчитанных по объему эмульсионных частиц, предпочтительно по меньшей мере около 75%, более предпочтительно по меньшей мере около 85%, а наиболее предпочтительно по меньшей мере около 90%, имели диаметр около 0,5 мкм или менее.
Предпочтительное молярное соотношение между жирной кислотой и аминовой группой (группами) в органическом амине составляло от около 5:1 до около 1:100, предпочтительно от около 3:1 до около 1:50, более предпочтительно от около 2:1 до около 1:10, например около 1:1. Предпочтительно, в случае присутствия, жирная кислота и органический амин совместно присутствуют в количестве от около 1% до около 50%, предпочтительно от около 2% до около 30%, более предпочтительно от около 5% до около 15 мас.% композиции.
Считают без связи с теорией, что композиция в виде мелко самостоятельно эмульгирующегося раствора по изобретению, особенно композиция, имеющая пару жирной кислоты/органического амина, как описано выше, может предоставить препарат в форме, которая может особенно быстро всасываться в желудочно-кишечном тракте.
Другие эксципиенты
Композиции по изобретению необязательно содержат фармацевтически приемлемые эксципиенты, отличные от растворителя и ингибитора кристаллизации. Например, в случае композиции в виде раствора такие эксципиенты включают совместные растворители, подслащивающие агенты, антиоксиданты, консерванты, диспергирующие агенты, эмульгирующие агенты и т.д. Посредством отбора и комбинации эксципиентов могут быть получены композиции, проявляющие улучшенную функцию в отношении концентрации препарата, растворения, эмульгирования, эффективности, аромата, выполнения пациентами предписаний по приему и других свойств.
Композиция, особенно композиция в виде раствора, по изобретению необязательно включает один или более фармацевтически приемлемых совместных растворителей. Неограничивающие примеры подходящих совместных растворителей включают дополнительные гликоли, спирты, например этанол и н-бутанол; триглицериды олеиновой и линолевой кислоты, например масло соевых бобов; каприловые/каприновые триглицериды, например MiglyolTM 812 от Huls; каприловые/каприновые моно- и диглицериды, например CapmulTM MCM от Abitec; каприловые/каприновые глицериды полиоксиэтилена, такие как каприловые/каприновые моно- и диглицериды полиоксиэтилена (8), например, LabrasolTM от Gattefosse; сложные эфиры жирных кислот пропиленгликоля, например лаурат пропиленгликоля; касторовое масло полиоксиэтилена (35), например CremophorTM EL от BASF; триолеат полиоксиэтиленглицерила, например TagatTM TO от Goldschmidt; сложные низшие алкиловые эфиры жирных кислот, например этилбутират, этилкаприлат и этилолеат; и воду.
В композиции по изобретению в виде раствора препарат, даже в случае мелкого эмульгирования, может после контакта с водной средой желудочно-кишечного тракта осаждаться и агломерироваться в твердую, обычно кристаллическую, форму частиц. Такое выпадение в осадок и/или кристаллизация может неблагоприятно воздействовать на любые преимущества быстрого начала, полученные введением препарата в растворенной форме, потому что препарат, который превратился в кристаллическую форму, должен подвергнуться процессу растворения перед всасыванием.
Поэтому предпочтительные композиции, кроме того, включают ингибитор кристаллизации, также именуемый здесь полимером, уменьшающим мутность. Авторы изобретения обнаружили, что определенные полимеры могут существенно ингибировать выпадение в осадок и/или кристаллизацию плохо растворимого в воде препарата, когда раствор препарата по существу в неводном растворителе контактирует с SGF. Соответственно, композиции согласно настоящему изобретению предпочтительно включают полимер, уменьшающий мутность. Полимер может представлять собой целлюлозный или нецеллюлозный полимер и предпочтительно является по существу растворимым в воде.
Следует понимать, что определенные полимеры более эффективны при ингибировании осаждения и/или кристаллизации отобранного плохо растворимого в воде препарата, чем другие, и что не все полимеры ингибируют осаждение и/или кристаллизацию, как описано здесь, каждого плохо растворимого в воде препарата. То, можно ли определенный полимер использовать в качестве ингибитора кристаллизации для определенного плохо растворимого в воде препарата в соответствии с настоящим изобретением, может легко определить средний специалист в данной области, например, в соответствии с тестом II.
Тест II:
А. Подходящее количество препарата растворяют в растворителе (например, этаноле, диметилсульфоксиде или, когда препарат представляет собой кислоту или основание, воде) для получения концентрированного раствора препарата.
В. Объем воды или раствора с буфером при фиксированном рН помещают в первый сосуд и поддерживают при комнатной температуре.
С. Аликвотное количество концентрированного раствора препарата добавляют к содержимому первого сосуда для получения первого образца раствора, имеющего желательную целевую концентрацию препарата. Выбранная концентрация препарата должна быть такой, которая вызывает существенное осаждение и, следовательно, более высокую видимую спектральную поглощательную способность (т.е. мутность), чем насыщенный раствор, не имеющий такого осаждения.
D. Выбирают исследуемый полимер и во втором сосуде полимер растворяют в воде или растворе с буфером при фиксированном рН (идентичном по составу, рН и объему раствору, использованному на этапе С) в количестве, достаточном для образования 0,25-2 мас.% раствора полимера.
Е. Для формирования второго образца раствора аликвотное количество концентрированного раствора препарата, полученного на этапе А, добавляют к раствору полимера во втором сосуде для формирования образца раствора, имеющего конечную концентрацию препарата, равную концентрации в первом образце раствора.
F. Через 60 мин после осаждения обоих образцов растворов измеряют видимую спектральную поглощательную способность (т.е. мутность) с использованием света, имеющего длину волн 650 нм.
G. Если мутность второго образца раствора меньше, чем мутность первого образца раствора, испытуемый полимер считают «полимером, уменьшающим мутность» и его можно использовать в качестве ингибитора кристаллизации для испытуемого препарата.
Техник, выполняющий тест II, быстро найдет подходящую концентрацию полимера для испытания в пределах предоставленного выше диапазона концентрации полимера путем обычного экспериментирования. В особенно предпочтительном варианте осуществления концентрацию полимера выбирают так, что когда выполняют тест II, видимая спектральная поглощательная способность второго образца раствора составляет не более чем 50% видимой спектральной поглощательной способности первого образца раствора.
В другом варианте осуществления композиции по изобретению включают ингибитор кристаллизации, включающий по меньшей мере один целлюлозный полимер. Предпочтительные целлюлозные полимеры выбирают из НРМС, метилцеллюлозы, этилцеллюлозы, карбоксиметилцеллюлозы натрия и гидроксипропилцеллюлозы. Предпочтительно, по меньшей мере один целлюлозный полимер выбирают из целлюлозных полимеров, имеющих по меньшей мере часть замещаемых гидроксильных групп, замещенных метокси и/или гидроксипропильными группами. Еще более предпочтительно, по меньшей мере один целлюлозный полимер представляет собой НРМС.
НРМС, который можно использовать в качестве ингибитора кристаллизации в соответствии с изобретением, предпочтительно имеет вязкость при 2% в воде от около 100 до около 20000 сП. Различные НРМС варьируют по степени замещения имеющихся гидроксильных групп на целлюлозном каркасе метоксильными группами и гидроксипропоксильными группами. При увеличивающемся гидроксипропоксильном замещении полученный НРМС становится более гидрофильным по природе. Предпочтительно используют НРМС, имеющий от около 15% до около 35%, предпочтительно от около 19% до около 30%, более предпочтительно от около 19% до около 24% замещения метоксилом и имеющий от около 3% до около 15%, предпочтительно от около 4% до около 12%, более предпочтительно от около 7% до 12% замещения гидроксипропоксилом.
Подходящие НРМС, которые являются относительно гидрофильными по природе, иллюстративно доступны под фабричными марками MethocelTM от Dow Chemical Co. И MetoloseTM от Shin-Etsu Chemical Co.
Иллюстративным в настоящее время предпочтительным НРМС является НРМС с типом замещения 2208, обозначающим метоксильное замещение от около 19% до около 24% и гидроксипропильное замещение от около 7% до около 12% и с номинальной вязкостью 2% раствора в воде около 4000 сП.
К удивлению, было обнаружено, что нет необходимости в том, чтобы ингибитор кристаллизации был компонентом растворяющей жидкости. Необязательно, ингибитор кристаллизации, такой как НРМС, может быть компонентом стенки капсулы, в которую инкапсулирована композиция по изобретению в виде раствора. В одном варианте осуществления по существу в растворяющей жидкости не присутствует НРМС или другой ингибитор кристаллизации, но стенка капсулы включает НРМС. Стенка капсулы может даже состоять преимущественно из НРМС.
В случае присутствия ингибитора кристаллизации он предпочтительно присутствует в общем количестве, достаточном для существенного ингибирования кристаллизации и/или осаждения препарата после разбавления композиции в SGF. Количество, достаточное «существенно ингибировать кристаллизацию и/или осаждение препарата», здесь означает количество, достаточное для предотвращения, замедления, ингибирования или задержки осаждения препарата из раствора и/или предотвращения, замедления, ингибирования или задержки образования кристаллических частиц препарата из растворенных частиц препарата. В практических целях то, является ли количество ингибитора кристаллизации в данной испытуемой композиции достаточным для существенного ингибирования кристаллизации и/или осаждения препарата, можно определить в соответствии с тестом III, который можно также использовать для определения того, можно ли использовать определенный полимерный компонент в качестве ингибитора кристаллизации в определенной композиции по изобретению.
Тест III:
А. Объем испытуемой композиции, в неинкапсулированной или в инкапсулированной форме, имеющей полимерный компонент, помещают в объем SGF для образования смеси, имеющей фиксированное соотношение от около 1 г до около 2 г композиции на 100 мл SGF.
В. Смесь держат при постоянной температуре около 37°С и перемешивают с использованием лопаток II типа (Фармакопея США 24) со скоростью 75 об/мин в течение периода 4 ч.
С. В одну или более точек времени после, по меньшей мере, приблизительно после 15 мин перемешивания, но приблизительно ранее чем после 4 ч перемешивания отбирают аликвотное количество смеси и фильтруют, например, через нестерильный шприцевый фильтр AcrodiscTM с мембраной VersaporTM с размером пор 0,8 мкм.
D. Фильтрат собирают в сосуд.
Е. Концентрацию препарата в фильтрате измеряют с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ).
F. Тест идентично повторяют с контрольной композицией, которая по существу аналогична исследуемой композиции, за исключением того, что в нем нет полимерного компонента. Когда полимерный компонент в исследуемой композиции присутствует в растворяющей жидкости, его замещают в контрольной композиции полиэтиленгликолевым растворителем. Когда полимерный компонент в исследуемой композиции присутствует в стенке капсулы, его замещают в контрольной композиции желатином.
G. Если концентрация препарата в фильтрате, полученном из исследуемой композиции, больше, чем концентрация препарата в фильтрате, полученном из контрольной композиции, считают, что полимерный компонент, присутствующий в исследуемой композиции, существенно ингибирует кристаллизацию и/или осаждение препарата в SGF.
Ингибитор кристаллизации, такой как НРМС, в случае присутствия в растворяющей жидкости, в целом присутствует в общем количестве от около 1% до около 20%, предпочтительно от около 1% до около 15%, а наиболее предпочтительно от около 1% до около 10 мас.% растворяющей жидкости. Обычно, чем выше концентрация препарата в композиции, тем больше целлюлозного полимера потребуется для обеспечения ингибирующего кристаллизацию эффекта. В целом, ингибитор кристаллизации в случае присутствия и препарат присутствуют в соотношении от около 1:100 до около 1:1, предпочтительно от около 1:50 до около 1:1, более предпочтительно от около 1:25 до около 1:1 масс.
Когда определенные плохо растворимые в воде препараты составлены в композицию в растворенной или солюбилизированной форме в PEG, было обнаружено, что примеси могут образовываться во время хранения. Например, в случае композиции целекоксиба в виде раствора в PEG-400, образование примесей было связано с реакцией целекоксиба не с самим PEG-400, а с продуктом распада PEG-400. Не будучи связанными теорией, считают, что продукт распада, который реагирует с целекоксибом, представляет собой окись этилена. Продукты реакции включают продукты присоединения. Предусматривается, что любое лекарственное соединение, имеющее аминосульфонильную функциональную группу, может аналогичным образом вступать в реакцию с продуктом распада полиэтиленгликоля.
Проблему химической неустойчивости такого препарата в полиэтиленгликолевом растворителе, или действительно любого препарата, который может вступать в реакцию с полиэтиленгликолем или продуктом его распада для образования продукта присоединения, можно преодолеть включением гасящего свободные радикалы антиоксиданта в растворяющую жидкость.
Поэтому композиция согласно настоящему изобретению, необязательно, кроме того, включает по меньшей мере один гасящий свободные радикалы антиоксидант. Гасящий свободные радикалы антиоксидант следует отличать от «антиоксиданта, гасящего несвободные радикалы», т.е. антиоксиданта, который не обладает свойства гашения свободных радикалов. Неограничивающие примеры подходящих гасящих свободные радикалы антиоксидантов включают α-токоферол (витамин Е), аскорбиновую кислоту (витамин С) и их соли, включая аскорбат натрия и пальмитат аскорбиновой кислоты, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), фумаровую кислоту и ее соли, гипофосфорную кислоту, яблочную кислоту, алкилгаллаты, например пропилгаллат, октилгаллат и лаурилгаллат, тиосульфат натрия, сульфит натрия, бисульфит натрия и метабисульфит натрия. Предпочтительными гасящими свободные радикалы антиоксидантами являются алкилгаллаты, витамин Е, ВНА и ВНТ. Предпочтительно указанный по меньшей мере один гасящий свободные радикалы антиоксидант представляет собой пропилгаллат.
Один или более гасящих свободные радикалы антиоксидантов необязательно присутствуют в композициях по изобретению в общем количестве, эффективном для существенного снижения образования продукта присоединения, обычно в общем количестве от около 0,01% до около 5%, предпочтительно от около 0,01% до около 2,5%, более предпочтительно от около 0,01% до около 1 мас.% композиции.
Композиция по изобретению необязательно включает один или более фармацевтически приемлемых подслащивающих агентов. Неограничивающие примеры подходящих подслащивающих агентов включают маннит, пропиленгликоль, сахарин натрия, ацесульфам К, неотам и аспартам. Альтернативно или дополнительно можно использовать вязкий подслащивающий агент, такой как раствор сорбита, сироп (раствор сахарозы) или кукурузный сироп с высоким содержанием фруктозы, и, в дополнение к подслащивающим эффектам, их можно также использовать для увеличения вязкости и для замедления осаждения. Применение подслащивающих агентов имеет особенные преимущества во впитываемых композициях по изобретению, поскольку индивидуум может их попробовать перед глотанием. Инкапсулированная композиция обычно не взаимодействует с органами вкуса в ротовой полости, и обычно нет необходимости в применении подслащивающего агента.
Композиция по изобретению необязательно включает один или более фармацевтически приемлемых консервантов, отличных от гасящих свободные радикалы антиоксидантов. Неограничивающие примеры подходящих консервантов включают хлорид бензалкония, хлорид бензетония, бензиловый спирт, хлорбутанол, фенол, фенилэтиловый спирт, фенилнитрат двухвалентной ртути, тимеросал и т.д.
Композиция по изобретению необязательно включает один или более фармацевтически приемлемых смачивающих агентов. Поверхностно-активные вещества, гидрофильные полимеры и определенные глины можно использовать в качестве смачивающих агентов для содействия растворению и/или дисперсии гидрофобного препарата, такого как целекоксиб. Неограничивающие примеры подходящих поверхностно-активных веществ включают хлорид бензалкония, хлорид бензетония, хлорид цетилпиридиния, диоктилсульфосукцинат натрия, ноноксинол 9, ноноксинол 10, октоксинол 9, полоксамеры, полиоксиэтилен (8) каприловые/каприновые моно- и диглицериды (например, LabrasolTM от Gattefosse), касторовое масло с полиоксиэтиленом (35), простой цетостеариловый эфир с полиоксиэтиленом (20), гидрированное касторовое масло с полиоксиэтиленом (40), простой олеиловый эфир с полиоксиэтиленом (10), стеарат полиоксиэтилена (40), полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80 (например, TweenTM 80 от ICI), лаурат пропиленгликоля (например, LauroglycolTM от Gattefosse), лаурилсульфат натрия, монолаурат сорбитана, моноолеат сорбитана, монопальмитат сорбитана, моностеарат сорбитана, тилоксапол и их смеси.
Кроме того, композиция по изобретению необязательно включает один или более фармацевтически приемлемых буферных агентов, отдушек, красителей, стабилизаторов и/или загустителей. Буферы можно использовать для регулировки рН композиции и, посредством этого, модулирования растворимости препарата. Ароматизирующие агенты могут повысить соблюдение пациентами предписанной схемы приема, делая композицию приятной на вкус, в частности в случае всасываемой композиции, а красители могут обеспечить продукт более эстетичным и/или отличительным внешним видом. Неограничивающие примеры подходящих красителей включают D&C Red No. 33, FD&C Red No. 3, FD&C Red No. 40, D&C Yellow No. 10 и Yellow No. 6.
Композиции в виде раствора/суспензии
В одном варианте осуществления растворяющая жидкость, в зависимости от определенных присутствующих в ней компонентов, подходит для удерживания первой части препарата в растворе для обеспечения терапевтически эффективной дозы с быстрым началом действия, в то же самое время удерживая вторую часть препарата нерастворенной, но в суспензии. Суспендированная часть обычно обеспечивает замедление непосредственного высвобождения препарата и, таким образом, может продлить длительность терапевтического эффекта, хотя такая продленная длительность не является требованием данного варианта осуществления изобретения.
Поэтому в соответствии с данным вариантом осуществления изобретение относится к композиции, включающей терапевтически эффективное количество плохо растворимого в воде препарата, частично растворенного и частично диспергированного в фармацевтически приемлемой растворяющей жидкости, которая включает по меньшей мере один растворитель, по меньшей мере одну жирную кислоту и по меньшей мере один органический амин. В данном варианте осуществления часть препарата находится в растворе и часть в суспензии. Композиция, кроме того, включает ингибитор кристаллизации, как описано выше, причем ингибитор кристаллизации присутствует в растворяющей жидкости и/или как компонент стенки капсулы.
Предпочтительно компоненты растворяющей жидкости выбирают таким образом, чтобы по меньшей мере около 15 мас.% препарата находились в растворенной или солюбилизированной форме в растворяющей жидкости. Одним путем модификации растворяющей жидкости для увеличения количества плохо растворимого в воде препарата в суспензии, в отличие от раствора, является добавление воды в количестве, необходимом для придания необходимого снижения растворимости препарата в растворяющей жидкости.
В зависимости от относительной важности быстрого начала и продолжительного действия по показанию, по которому вводят препарат, относительные свойства растворенного и суспендированного препарата могут значимо варьировать. Например, по показаниям острой боли, около 50% препарата может находиться в растворе и около 50% препарата может быть диспергировано в форме частиц. Альтернативно, по показаниям, требующим продолжительнее действующей терапевтической эффективности, иллюстративно около 20% препарата может находиться в растворе и около 80% препарата может быть диспергировано в форме частиц.
Форму препарата в виде частиц можно создать механически, например перемалыванием или дроблением или осаждением из раствора. Частицы, образованные непосредственно в результате таких способов, описаны здесь как «первичные частицы» и могут агломерироваться для образования вторичных агрегатных частиц. До тех пор, пока нет других требований контекста, используемый здесь термин «размер частиц» относится к размеру первичных частиц в самом длинном измерении. Считается, что размер частиц является важным параметром, влияющим на клиническую эффективность целекоксиба и других препаратов с низкой растворимостью в воде.
Размер частиц можно выразить в виде процентной доли всех частиц, которые имеют диаметр, меньший, чем данный эталонный диаметр. Например, полезным параметром является «размер частиц D90». По определению, в партии препарата, который имеет размер частиц D90 60 мкм, 90 об.% частиц имеют диаметр менее чем 60 мкм. В практических целях в целом подходит определение D90 на основе 90 мас.%, а не объема.
Композиции согласно данному варианту осуществления предпочтительно имеют такое распределение суспендированных частиц препарата, что D90 частиц в их самом длинном измерении составляет от около 0,5 мкм до около 200 мкм, предпочтительно от около 0,5 мкм до около 75 мкм, более предпочтительно от около 0,5 мкм до около 25 мкм. Например, когда препарат представляет собой целекоксиб, уменьшение размера частиц в соответствии с данным вариантом осуществления изобретения в целом улучшает биологическую доступность препарата. Кроме того, или альтернативно, суспендированные частицы целекоксиба в композиции по изобретению предпочтительно имеют средний размер частиц менее чем приблизительно 10 мкм, предпочтительно от около 0,1 мкм до около 10 мкм, наиболее предпочтительно от около 0,5 мкм до около 5 мкм, например около 1 мкм.
Композиции согласно данному варианту осуществления могут необязательно включать дополнительные эксципиенты, такие как ингибиторы кристаллизации, диспергирующие агенты, совместные растворители, подслащивающие агенты, консерванты, эмульгирующие агенты и т.д., как описано выше. Кроме того, композиции согласно данному варианту осуществления можно составить или во всасываемой, или в дискретной лекарственной форме.
Кроме того, определенные эксципиенты, такие как суспендирующие агенты, загустители и хлопьеобразующие агенты могут быть особенно полезны, когда желательны суспендированные частицы препарата, например, в композициях в виде раствора/суспензии. Посредством отбора и комбинации эксципиентов можно получить композиции в виде раствора/суспензии, проявляющие улучшенную функцию в отношении концентрации препарата, физической устойчивости, эффективности, аромата и общего соблюдения пациентами предписанной схемы введения.
Композиции в виде раствора/суспензии по изобретению необязательно включают один или более фармацевтически приемлемых суспендирующих агентов. Суспендирующие агенты используются для придания увеличенной вязкости и замедленного осаждения. Суспендирующие агенты относятся к различным классам, включающим производные целлюлозы, глины, естественные смолы, синтетические смолы и прочие смешанные агенты. Неограничивающие примеры суспендирующих агентов, которые можно использовать в композициях согласно настоящему изобретению, включают гуммиарабик, агар, альгиновую кислоту, моностеарат алюминия, аттапульгит, бентонит, кальций карбоксиметилцеллюлозу, натрий карбоксиметилцеллюлозу, каррагенан, карбомер, например, карбомер 910, декстрин, этилметилцеллюлозу, желатин, кизельгуровую смолу, НРМС, метилцеллюлозу, этилцеллюлозу, этилгидроксиэтилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, каолин, силикат магния алюминия, микрокристаллическую целлюлозу с натрий карбоксиметилцеллюлозой, порошкообразную целлюлозу, силикагель, коллоидную двуокись кремния, смолу бобов рабинии, пектин, альгинат натрия, альгинат пропиленгликоля, смолу тамаринда, трагакант, ксантановую смолу, повидон, вигам, глицирризин, предварительно желатинизированный крахмал, гликолат крахмал натрия и их смеси.
В определенных обстоятельствах может быть желательно использовать хлопьеобразующие агенты в композициях в виде раствора/суспензии по изобретению. Хлопьеобразующие агенты обеспечивают возможность соединения частиц вместе в рыхлые агрегаты или хлопья и включают поверхностно-активные вещества, гидрофильные полимеры, клеи и электролиты. Неограничивающие примеры подходящих хлопьеобразующих агентов включают лаурилсульфат натрия, натрийдокузат, хлорид бензалкония, хлорид цетилпиридиния, полисорбат 80, монолаурат сорбитана, натрий карбоксиметилцеллюлозу, ксантановую смолу, трагакант, метилцеллюлозу, PEG, силикат магния алюминия, аттапулгит, бентонит, дигидрофосфат калия, хлорид алюминия, хлорид натрия и их смеси.
Дискретные лекарственные формы
Было обнаружено, что нужда в композиции с быстрым началом действия удивительно хорошо удовлетворяется препаратом, содержащим раствор или раствор/суспензию согласно настоящему изобретению, инкапсулированный в виде изделия в форме дискретной стандартной дозировки. Поэтому другой вариант осуществления настоящего изобретения представляет собой концентрированную композицию, или раствор, или раствор/суспензию, причем композицию составляют в виде одной или более дискретных стандартных доз, например мягких или твердых капсул.
Можно использовать любой подходящий материал для инкапсуляции, например желатин или НРМС. Как указано здесь выше, уменьшающий мутность полимер может представлять собой имеющий преимущества материал для использования в стенке капсул, потому что он может действовать в качестве ингибитора кристаллизации после контакта композиции с жидкостью желудочно-кишечного тракта. Полимерный компонент, такой как НРМС, «присутствует в стенке капсулы» или представляет собой «компонент стенки капсулы», как описано здесь, если полимер (а) диспергирован или смешан вместе с любым другим компонентом (компонентами) стенки капсулы, (b) является единственным компонентом стенки капсулы. Или (с) присутствует в виде покрытия на внешней или внутренней поверхности стенки капсулы.
В предпочтительном в настоящее время варианте осуществления целлюлозный полимер, имеющий метоксильное и/или гидроксипропильное замещение, как описано здесь выше, предпочтительно НРМС, присутствует в стенке капсулы в общем количестве от около 5% по существу до 100%, а предпочтительно от около 15% по существу до 100 мас.% стенки. В дополнение к одному или более таких целлюлозных полимеров подходящая стенка капсулы может включать любой дополнительный компонент, который можно использовать в данной области, такой как желатин, крахмал, каррагенан, альгинат натрия, пластификаторы, хлорид калия, красящие агенты и т.д. Подходящая капсула здесь может иметь твердую или мягкую стенку.
Ингибитор кристаллизации предпочтительно присутствует в стенке в общем количестве, достаточном для существенного ингибирования кристаллизации и/или осаждения препарата после растворения, разбавления и/или разрушения композиции в SGF. В практических целях, то, является ли количество ингибитора кристаллизации, присутствующего в стенке данной испытуемой композиции, достаточно для существенного ингибирования кристаллизации и/или осаждения препарата, можно определить в соответствии с тестом IV, который можно также использовать для определения того, можно ли использовать определенный полимерный компонент в качестве ингибитора кристаллизации при его присутствии в стенке капсулы определенной композиции по изобретению.
Тест IV:
А. Объем раствора или раствора/суспензии, как описано здесь выше, заключают в капсулу, включающую испытуемый полимер, для образования испытуемой композиции и помещают в объем SGF для образования смеси, имеющей фиксированное соотношение от около 1 г до около 2 г композиции на 100 мл SGF.
В. Смесь держат при постоянной температуре около 37°С и перемешивают с использованием лопаток II типа (Фармакопея США 24) со скоростью 75 об/мин в течение периода 4 ч.
С. В одну или более точек времени после, по меньшей мере, приблизительно после 15 мин перемешивания, но приблизительно ранее чем после 4 ч перемешивания, отбирают аликвотное количество смеси и фильтруют, например, через нестерильный шприцевый фильтр AcrodiscTM с мембраной VersaporTM с размером пор 0,8 мкм.
D. Фильтрат собирают в сосуд.
Е. Концентрацию препарата в фильтрате измеряют с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ).
F. Тест идентично повторяют с контрольной композицией, включающей раствор или раствор/суспензию, которая по существу аналогична раствору или раствору/суспензии, использованному на этапе А, но которая заключена в капсулу, не включающую ингибитор кристаллизации (т.е. не включает полимер, или, если полимер присутствует, он представляет собой такой полимер, как желатин, который не ингибирует кристаллизацию и/или осаждение). Полимерный компонент в капсуле, заключающей контрольную композицию, замещен желатином.
G. Если концентрация препарата в фильтрате, полученном из исследуемой композиции, больше, чем концентрация препарата в фильтрате, полученном из контрольной композиции, считают, что полимерный компонент, присутствующий в стенке капсулы исследуемой композиции, присутствует в количестве, достаточном для существенного ингибирования кристаллизации и/или осаждения препарата в SGF.
Когда ингибирующий кристаллизацию целлюлозный полимер присутствует в виде компонента стенки капсулы, содержащийся в ней раствор или раствор/суспензия может дополнительно, но необязательно, содержать дополнительное количество такого целлюлозного полимера.
Предпочтительно от одной до около шести, предпочтительнее от одной до около четырех, а еще предпочтительнее одна или две такие дискретные, стандартные дозы в сутки обеспечивают терапевтически эффективную дозу препарата.
Композиции согласно данному варианту осуществления предпочтительно составляются так, чтобы каждая дискретная стандартная лекарственная форма содержала от около 0,3 до около 1,5 мл, предпочтительнее от около 0,3 до около 1 мл, например от около 0,8 мл до около 0,9 мл раствора или раствора/суспензии.
Концентрированные растворы или растворы/суспензии могут быть инкапсулированы любым способом, известным в данной области, включая способ покрытия, вакуумный способ или способ роторной экструзии (см., например, Ansel et al. (1995) in Pharmaceutical Dosage Forms and Drug Delivery Systems, 6th ed, Williams & Wilkins, Baltimore, MD, pp. 176-182. При способе роторной экструзии жидкий материал для инкапсуляции, например желатин, текущий из подвесного резервуара, формируется в две непрерывные ленты роторным экструдером, и их соединяют сдвоенными вращающимися головками экструдеров. Одновременно отмеренное количество материала наполнителя инъецируют между лентами в тот же момент, когда головки экструдеров формируют карманы лент. Данные карманы из содержащего наполнитель материала инкапсуляции затем запаивают давлением и теплом, и капсулы подаются из станка.
Мягкие капсулы можно изготовить в различных формах, включая, среди других, круглую, овальную, продолговатую и трубчатую форму. Кроме того, путем использования двух различных цветов лент можно изготовить капсулы двух тонов.
Капсулы, которые включают НРМС, известны в данной области, и их можно изготовить, запаять и/или покрыть, в качестве неограничивающей иллюстрации, в соответствии со способами, раскрытыми в патентах и публикациях, перечисленных ниже, каждая из которых отдельно включена сюда в качестве ссылки.
Патент США № 4250997, выданный Bodenmann et al.
Патент США № 5264223, выданный Yamamoto et al.
Патент США № 5756123, выданный Yamamoto et al.
Международная патентная публикация № WO 96/05812.
Международная патентная публикация № WO 97/35537.
Международная патентная публикация № WO 00/18377.
Международная патентная публикация № WO 00/27367.
Международная патентная публикация № WO 00/28976.
Международная патентная публикация № WO 01/03676.
Заявка на Европейский патент № 0211079.
Заявка на Европейский патент № 0919228.
Заявка на Европейский патент № 1029539.
Неограничивающие иллюстративные примеры подходящих капсул, включающих НРМС, включают капсулы XGelTM от Bioprogress и QualicapsTM от Shionogi.
Всасываемые лекарственные формы
Другим вариантом осуществления настоящего изобретения является концентрированная композиция, или концентрированный раствор, или концентрированный раствор/суспензия, которая может непосредственно всасываться или разводиться инертными разбавителями и/или другими носителями и всасываться; такие композиции по изобретению, разбавленные или нет, для удобства именуются здесь «всасываемыми композициями». Всасываемые композиции можно получить любым подходящим способом фармации, который включает этапы приведение в ассоциацию препарата с низкой растворимостью в воде, иллюстративно целекоксиба, и компонентов растворяющей жидкости. Поскольку в данном варианте осуществления нет стенки капсулы, то если желательно включение ингибитора кристаллизации, он должен присутствовать в растворяющей жидкости. Когда препарат представляет собой целекоксиб, композиции согласно данному варианту осуществления предпочтительно содержат от около 40 мг/мл до около 750 мг/мл, предпочтительнее от около 50 мг/мл до около 500 мг/мл, еще предпочтительнее от около 50 мг/мл до около 350 мг/мл, а наиболее предпочтительно от около 100 мг/мл до около 300 мг/мл, например приблизительно 200 мг/мл целекоксиба.
В еще одном варианте осуществления изобретение относится к растворам или растворам/суспензиям по изобретению, которые требуется развести для обеспечения разведения, подходящего для прямого всасываемого введения. В данном варианте осуществления растворы или растворы/суспензии по настоящему изобретению добавляют в количестве терапевтически эффективной дозировки приблизительно к 1 мл до около 20 мл инертной жидкости. Предпочтительно растворы или растворы/суспензии по настоящему изобретению добавляют приблизительно к 2 мл до около 15 мл, а предпочтительнее приблизительно к 5 мл до около 10 мл инертной жидкости. Используемый здесь термин «инертная жидкость» относится к фармацевтически приемлемым, предпочтительно имеющим приятный вкус, жидким носителям. Такие носители обычно являются водными. Примеры включают воду, фруктовые соки, газированные напитки и т.д.
Способ получения композиции по изобретению
Композицию по изобретению можно получить в соответствии с любым подходящим способом смешивания. Иллюстративно, такую композицию можно получить растворением в первом сосуде по меньшей мере одного фармацевтически приемлемого амина, предпочтительно органического амина, в растворителе (например, воде) при нагревании (например, от около 50°С до около 60°С) для образования нагретой смеси. Предпочтительно соотношение между массами органического амина и растворителя в нагретой смеси составляет от около 1:5 до около 5:1, более предпочтительно от около 1:2 до около 2:1, например около 1:1. Во втором сосуде смешивают по меньшей мере одну фармацевтически приемлемую жирную кислоту, любые дополнительные растворители (например, растворитель для жирной кислоты и/или для препарата с низкой растворимостью в воде), по меньшей мере один фармацевтически приемлемый препарат с низкой растворимостью в воде в твердой, растворенной и/или солюбилизированной форме и любые другие желательные эксципиенты для образования вторичной смеси. Нагретую смесь и вторичную смесь затем смешивают вместе. Не будучи связанными с теорией, считают, что нагретую смесь следует держать при повышенной температуре до тех пор, пока она не смешается с вторичной смесью для предотвращения осаждения и/или кристаллизации органического амина из раствора. Считается также, без связи с определенной теорией, что, если органический амин выпадает в осадок из раствора перед смешиванием с вторичной смесью, подходящая пара жирной кислоты/органического амина не будет образована и, менее вероятно, что конечная композиция будет в конечном счете самостоятельно эмульгируемой в имитированной желудочной жидкости.
К сожалению, при выполнении в большем масштабе, например промышленном масштабе, дорого и неэффективно поддерживать органический амин в растворе с использованием тепла, например когда желательна или требуется передача нагретой смеси через большую трубу для дальнейшей обработки. В таком случае труба передачи должна была бы иметь внутренний нагрев и/или термический кожух для предотвращения кристаллизации органического амина. Такое нагревание является дорогим, неэффективным и потенциально повреждающим для других ингредиентов в композиции.
Авторы изобретения также открыли способ получения композиции по изобретению, который имеет особые преимущества для крупномасштабного получения и который преодолевает проблему осаждения органического амина без необходимости в продолжительном и дорогостоящем нагревании смеси органического амина. Способ согласно данному варианту осуществления включает стадии:
(а) получения по меньшей мере одной фармацевтически приемлемой жирной кислоты и по меньшей мере одного фармацевтически приемлемого амина, предпочтительно органического амина;
(b) получения фармацевтически приемлемого растворителя по меньшей мере для одной жирной кислоты и фармацевтически приемлемого растворителя по меньшей мере для одного органического амина;
(с) смешивания по меньшей мере с одной жирной кислотой растворителя по меньшей мере для одной жирной кислоты и растворителя по меньшей мере одного органического амина для формирования премикса, в котором жирная кислота по существу полностью растворена;
(d) смешивания вместе с премиксом по меньшей мере одного органического амина для формирования смеси, в которой органический амин по существу полностью растворен; и
(е) смешивания со смесью препарата с низкой растворимостью в воде в твердой, растворенной и/или солюбилизированной форме для формирования фармацевтической композиции. Предпочтительно, чтобы препарат с низкой растворимостью в воде был в растворенной и/или солюбилизированной форме перед смешиванием препарата со смесью стадии (d). Иллюстративно один или более растворителей можно использовать для солюбилизации препарата перед использованием на стадии (е).
Предпочтительно стадию (с) выполняют перед стадией (d); однако, если желательно, стадию (с) и стадию (d) можно выполнять одновременно. Термин «смешивание» в настоящем контексте означает добавление вместе двух или более компонентов при перемешивании, например при перемешивании с использованием бруска мешалки. При желании тепло можно подавать на любой стадии способа, например, для содействия растворению жирной кислоты и органического амина. Иллюстративно стадии (с) и (d) можно выполнять при температуре от около 40°С до около 60°С, более предпочтительно при температуре от около 45°С до около 55°С.
Однако в соответствии со способом согласно данному варианту осуществления после того как жирная кислота и органический амин находятся в растворе, тепло не требуется для поддержания такого раствора, так как смесь, полученная на стадии (d), физически устойчива при комнатной температуре. Поэтому стадия (е) предпочтительно выполняется при температуре от около 15°С до около 30°С, более предпочтительно при температуре от около 20°С до около 25°С.
Предпочтительно растворитель (растворители), используемый в способе согласно данному варианту осуществления, выбирают так, чтобы он был не только подходящим (по типу и количеству) для растворения и/или солюбилизации жирной кислоты и органического амина, отдельно и/или совместно, но также для растворения любых других возможных выпадающих в осадок веществ, которые могут иметь тенденцию к образованию во время выполнения способа.
К удивлению, авторы изобретения в настоящее время обнаружили, что способ согласно данному варианту осуществления ведет к получению смеси, полученной в результате стадии (d), которая физически устойчива (т.е. по существу не проявляет осаждения или кристаллизации органического амина или других компонентов) даже при комнатной температуре. Как указано выше, это удивительное преимущество делает способ в соответствии с данным вариантом осуществления особенно полезным для крупномасштабного получения, например, когда большой объем такой смеси предстоит передать через трубу для последующей смеси с другими желательными ингредиентами.
В особенно предпочтительном способе согласно данному варианту осуществления, где по меньшей мере один фармацевтически приемлемый органический амин представляет собой трометамин, фармацевтически приемлемым растворителем по меньшей мере для одного органического амина является вода; а когда по меньшей мере одна жирная кислота представляет собой олеиновую кислоту, фармацевтически приемлемым растворителем по меньшей мере для одной жирной кислоты является этанол.
Применимость композиций, которые включают препарат, селективно ингибирующий СОХ-2
В предпочтительном варианте осуществления композиции по изобретению включают содержащий аминосульфонил, селективно ингибирующий СОХ-2 препарат с низкой растворимостью в воде. Композиции согласно данному варианту осуществления можно использовать при лечении и профилактике очень широкого диапазона расстройств, опосредованных СОХ-2, включая, но не ограничиваясь ими, расстройства, характеризуемые воспалением, болью и/или лихорадкой. Такие композиции особенно полезны в качестве противовоспалительных средств, например, для лечения артрита, и их дополнительным преимуществом является наличие значительно меньшего количества вредных побочных эффектов, чем у композиций обычных нестероидных противовоспалительных препаратов (НСПВП), которые лишены избирательности с СОХ-2 в сравнении с СОХ-1. В частности, такие композиции имеют сниженный потенциал токсичности для желудочно-кишечного тракта и раздражения желудочно-кишечного тракта, включая изъязвление и кровотечения из верхнего отдела желудочно-кишечного тракта, сниженный потенциал почечных побочных эффектов, таких как снижение почечной функции, ведущее к задержке жидкости и обострению гипертонии, сниженное воздействие на показатели времени кровотечения, включая ингибирование функции тромбоцитов и, возможно, уменьшенную способность вызывать приступы астмы у чувствительных к аспирину индивидуумов с астмой, по сравнению с композициями обычных НСПВП. Таким образом, композиции по изобретению, включающие препарат, селективно ингибирующий СОХ-2, особенно полезны в качестве альтернативы обычным НСПВП, когда НСПВП противопоказаны, например у пациентов с язвенной болезнью, гастритом, региональным энтеритом, язвенным колитом, дивертикулитом или с анамнезом рецидивирующих желудочно-кишечных поражений; с желудочно-кишечным кровотечением, расстройствами свертываемости, включая анемию, такими как гипопротромбинемия, гемофилия или другие проблемы, связанные с кровотечением; с почечными заболеваниями; или у пациентов перед операцией, или у пациентов, принимающих антикоагулянты.
Такие композиции можно использовать для лечения разнообразных артритных расстройств, включая, но не ограничиваясь ими, ревматоидный артрит, спондилоартропатии, подагрический артрит, остеоартрит, системную красную волчанку и юношеский артрит.
Такие композиции также можно использовать при лечении астмы, бронхита, менструальных судорог, преждевременных родов, тендинита, бурсита, аллергического неврита, цитомегаловирусной инфекции, апоптоза, включая апоптоз, вызванный ВИЧ, люмбаго, печеночных заболеваний, включая гепатит, состояний, связанных с кожей, таких как псориаз, экзема, угревая сыпь, ожоги, дерматит и повреждение ультрафиолетовым излучением, включая солнечную эритему, и послеоперационных воспалений, включая воспаление после офтальмологических операций, таких как операция по поводу катаракты или рефрактивной операции.
Такие композиции можно использовать для лечения желудочно-кишечных состояний, таких как воспалительные кишечные заболевания, болезнь Крона, гастрит, синдром раздражимого кишечника и язвенный колит.
Такие композиции можно использовать при лечении воспаления при таких заболеваниях, как мигреневые головные боли, узелковый периартериит, тироидит, апластическая анемия, болезнь Ходжкина, склеродермия, ревматизм, диабет I типа, заболевания нервно-мышечных синапсов, включая генерализованную миастению, заболевания белого вещества, включая рассеянный склероз, саркоидоз, нефротический синдром, синдром Бехчета, полимиозит, гингивит, нефрит, гиперчувствительность, отек, возникающий после травмы, включая отек мозга, ишемию миокарда и им подобные.
Такие композиции можно использовать при лечении глазных заболеваний, таких как ретинит, конъюнктивит, ретинопатии, увеит, глазная фотофобия и острая травма ткани глаза.
Такие композиции можно использовать при лечении легочного воспаления, такого как воспаление, связанное с вирусными инфекциями, и муковисцидоз, и при резорбции костной ткани, такой как резорбция, связанная с остеопорозом.
Такие композиции можно использовать при лечении определенных расстройств центральной нервной системы, таких как корковые деменции, включая болезнь Альцгеймера, нейродегенерацию и повреждение центральной нервной системы в результате инсульта, ишемии и травмы. Термин «лечение» в настоящем контексте включает частичное или полное ингибирование деменций, включая болезнь Альцгеймера, сосудистую деменцию, деменцию после множественных инфарктов, пресенильную деменцию, алкогольную деменцию и старческую деменцию.
Такие композиции можно использовать при лечении аллергического ринита, синдрома респираторного дистресса, синдром эндотоксинового шока и печеночные заболевания.
Такие композиции можно использовать при лечении боли, включая, но не ограничиваясь ими, послеоперационную боль, зубную боль, мышечную боль и боль вследствие рака. Например, такие композиции можно использовать для облегчения боли, лихорадки и воспаления при разнообразных состояниях, включая ревматизм, грипп и другие вирусные инфекции, включая простуду, боль в области поясницы и шеи, дисменоррею, головную боль, зубную боль, растяжения и судороги, миозит, невралгию, синовит, артрит, включая ревматоидный артрит, дегенеративные заболевания суставов (остеоартрит), подагру и анкилозирующий спондилит, бурсит, ожоги и травму после хирургических и стоматологических процедур.
Такие композиции можно использовать для лечения и профилактики связанных с воспалением сердечно-сосудистых расстройств, включая сосудистые заболевания, заболевания коронарных артерий, аневризмы, отторжение сосудов, артериосклероз, атеросклероз, включая атеросклероз сердечного трансплантата, инфаркт миокарда, эмболию, инсульт, тромбоз, включая венозный тромбоз, стенокардию, включая нестабильную стенокардию, воспаление сердечной бляшки, воспаление, вызванное бактериями, включая воспаление, вызванное Chlamydia, воспаление, вызванное вирусами, и воспаление, связанное с хирургическими процедурами, такими как трансплантация сосудов, включая операцию аорто-коронарного шунтирования, процедуры реваскуляризации, включая ангиопластику, размещение стента, эндартерэктомию или другие инвазивные процедуры, вовлекающие артерии, вены и капилляры.
Такие композиции можно использовать при лечении расстройств, связанных с ангиогенезом у индивидуума, например, для ингибирования опухолевого ангиогенеза. Такие композиции можно использовать при лечении новообразований, включая метастазирование; офтальмологические состояния, такие как отторжение роговичного трансплантата, сосудистая неоваскуляризация, сетчаточная неоваскуляризация, включая неоваскуляризацию после травмы или инфекции, диабетическую ретинопатию, дегенерацию желтого пятна, ретролентальную фиброплазию и неоваскулярную глаукому; язвенных заболеваний, таких как язва желудка; патологических, но не злокачественных состояний, таких как гемангиомы, включая гемангиомы у маленьких детей, ангиофиброму носоглотки и бессосудистый некроз кости; и расстройств женской репродуктивной системы, таких как эндометриоз.
Такие композиции можно использовать при профилактике и лечении доброкачественных и злокачественных опухолей и новообразований, включая рак, такой как рак толстой и прямой кишки, рак мозга, костный рак, новообразований, происходящих из эпителиальных клеток (эпителиальной карциномы), таких как базальноклеточная карцинома, аденокарцинома, рак желудочно-кишечного тракта, такой как рак губ, рак ротовой полости, рак пищевода, рак тонкой кишки, рак желудка, рак толстой кишки, рак печени, рак желчного пузыря, рак поджелудочной железы, рак яичников, рак шейки матки, рак легких, рак молочных желез, рак кожи, такой как плоскоклеточный и базальноклеточный рак, рак предстательной железы, почечноклеточная карцинома и другие известные формы рака, которые поражают эпителиальные клетки во всем организме. Неоплазии, в отношении которых композиции по изобретению особенно полезны, представляют собой рак желудочно-кишечного тракта, пищевод Баррета, рак печени, рак желчного пузыря, рак поджелудочной железы, рак яичников, рак предстательной железы, рак шейки матки, рак легких, рак молочных желез и рак кожи. Такие композиции можно также использовать для лечения фиброза, который возникает при лучевой терапии. Такие композиции можно использовать для лечения индивидуумов, имеющих аденоматозные полипы, включая пациентов с семейным аденоматозным полипозом (САП). Кроме того, такие композиции можно использовать для предотвращения образования полипов у пациентов с риском САП.
Такие композиции ингибируют вызванное простаноидами мышечное сокращение ингибированием синтеза сократительных простаноидов и, следовательно, могут использоваться при лечении дисменорреи, преждевременных родов, астмы и расстройств, связанных с эозинофилами. Их также можно использовать для уменьшения потери костной ткани, особенно у женщин после менопаузы (т.е. лечения остеопороза) и для лечения глаукомы.
Ввиду быстрого начала терапевтического эффекта, который могут проявлять композиции по изобретению, эти композиции имеют особые преимущества перед известными композициями для лечения острых расстройств, опосредованных СОХ-2, особенно для облегчения боли, например при головной боли, включая головную боль, связанную с придаточными пазухами, и мигрень.
Предпочтительными видами применения для композиций согласно настоящему изобретению является лечение ревматоидного артрита и остеоартрита, устранение боли в целом (в частности, боли после операций на ротовой полости, боли после общехирургических операций, боли после ортопедических операций и острых вспышек остеоартрита), профилактика и лечение головной боли и мигрени, лечение болезни Альцгеймера и химиопрофилактика рака толстой кишки.
Для лечения ревматоидного артрита или остеоартрита такие композиции по изобретению можно применять для обеспечения суточной дозировки целекоксиба от около 50 мг до около 1000 мг, предпочтительно от около 100 мг до около 600 мг, более предпочтительно от около 150 мг до около 500 мг, еще более предпочтительно от около 175 мг до около 400 мг, например около 200 мг. Суточная доза целекоксиба от около 0,7 до около 13 мг/кг массы тела, предпочтительно от около 1,3 до около 8 мг/кг массы тела, более предпочтительно от около 2 до около 6,7 мг/кг массы тела, еще более предпочтительно от около 2,3 до около 5,3 мг/кг массы тела, например около 2,7 мг/кг массы тела, в целом целесообразна при введении в составе композиции по изобретению. Суточную дозу можно вводить от одной до около четырех доз/д, предпочтительно в одной или двух дозах/д.
Для лечения болезни Альцгеймера или рака такие композиции по изобретению можно использовать для обеспечения суточной дозировки целекоксиба от около 50 мг до около 1000 мг, предпочтительно от около 100 мг до около 800 мг, более предпочтительно от около 150 мг до около 600 мг, еще более предпочтительно от около 175 мг до около 400 мг, например около 400 мг. Суточная доза от около 0,7 до около 13 мг/кг массы тела, предпочтительно от около 1,3 до около 10,7 мг/кг массы тела, более предпочтительно от около 2 до около 8 мг/кг массы тела, еще более предпочтительно от около 2,3 до около 5,3 мг/кг массы тела, например около 5,3 мг/кг массы тела, в целом целесообразна при введении в составе композиции по изобретению. Суточную дозу можно вводить от одной до около четырех доз/д, предпочтительно, в одной или двух дозах/д.
Для устранения боли вообще и конкретно для лечения и профилактики головной боли и мигрени такие композиции по изобретению можно использовать для обеспечения суточной дозировки целекоксиба от около 50 мг до около 1000 мг, предпочтительно от около 100 мг до около 600 мг, более предпочтительно от около 150 мг до около 500 мг, еще более предпочтительно от около 175 мг до около 400 мг, например около 200 мг. Суточная доза от около 0,7 до около 13 мг/кг массы тела, предпочтительно от около 1,3 до около 8 мг/кг массы тела, более предпочтительно от около 2 до около 6,7 мг/кг массы тела, еще более предпочтительно от около 2,3 до около 5,3 мг/кг массы тела, например около 2,7 мг/кг массы тела, в целом целесообразна при введении в составе композиции по изобретению. Суточную дозу можно вводить от одной до около четырех доз/д. Предпочтительно введение с частотой одной стандартной дозы 50 мг 4 раза/д, одной стандартной дозы 100 мг или двух стандартных доз 50 мг 2 раза/д или одной стандартной дозы 200 мг, двух стандартных доз 100 мг или четырех стандартных доз 50 мг 1 раз/д.
Для препаратов, селективно ингибирующих СОХ-2, отличных от целекоксиба, целесообразные дозы можно выбрать, справившись в приведенной выше патентной литературе.
Кроме возможности использования для лечения людей такие композиции по изобретению можно использовать для ветеринарного лечения домашних животных, экзотических животных, сельскохозяйственных животных и им подобных, предпочтительно млекопитающих. Конкретнее, такие композиции по изобретению можно использовать для лечения расстройств, опосредованных СОХ-2, у лошадей, собак и кошек.
Данный вариант осуществления изобретения, кроме того, направлен на терапевтический способ лечения состояния или расстройства, где показано лечение препаратом, ингибирующим СОХ-2, причем способ включает пероральное введение композиции по изобретению нуждающемуся в ней индивидууму. Схема дозировки для профилактики, обеспечения облегчения или ослабления симптомов состояния или расстройства предпочтительно соответствует лечению 1 раз/д или 2 раза/д, но ее можно модифицировать в соответствии с разнообразными факторами. Они включают тип, возраст, массу тела, пол, рацион питания и медицинское состояние индивидуума, природу и тяжесть расстройства. Так, обычно используемые схемы дозировки могут широко варьировать и поэтому могут отклоняться от предпочтительных схем дозировки, представленных выше.
Исходное лечение можно начать схемой дозировки, как указано выше. Лечение в целом продолжают по необходимости в течение периода от нескольких недель до нескольких месяцев или лет до тех пор, пока состояние или расстройство не будет излечено или устранено. Индивидуумов, подвергаемых лечению композицией по изобретению, можно повседневно контролировать любым из способов, хорошо известных в области определения эффективности терапии. Постоянный анализ данных такого мониторинга обеспечивает возможность модификации схемы лечения во время терапии с тем, чтобы оптимально эффективные дозы вводились в любую точку времени и чтобы можно было определить длительность лечения. Таким образом, режим лечения и схему введения можно рационально модифицировать в течение курса лечения с тем, чтобы вводилось самое низкое количество композиции, проявляющее удовлетворительную эффективность, и с тем, чтобы введение продолжалось лишь в течение периода времени, необходимого для успешного лечения состояния или расстройства.
Композиции согласно настоящему варианту осуществления можно использовать при комбинированных способах лечения среди других средств с опиоидами и другими анальгетиками, включая наркотические анальгетики, антагонисты Мю рецепторов, антагонисты Каппа рецепторов, не наркотические (т.е. не вызывающие зависимость) анальгетики, с ингибиторами захвата моноамина, средствами, регулирующими аденозин, производными каннабиноида, антагонистами субстанции Р, антагонистами рецепторов нейрокинина-1 и блокаторами натриевых каналов. Предпочтительные способы комбинированного лечения включают применение композиции по изобретению с одним или более соединений, выбранных из ацеклофенака, ацеметацина, е-ацетамидокапроновой кислоты, ацетаминофена, ацетаминосалола, ацетанилида, ацетилсалициловой кислоты (аспирина), S-аденозилметионина, алклофенака, алфентанила, аллилпродина, алминопрофена, алоксиприна, алфапродина, бис(ацетилсалицилата) алюминия, амфенак, аминохлортеноксазина, 3-амино-4-гидроксимасляной кислоты, 2-амино-4-пиколина, аминопропилона, аминопирина, амиксетрина, салицилата аммония, ампироксикама, амтолметин гуацила, анилеридина, антипирина, салицилата антипирина, антрафенина, апазона, бендазака, бенорилата, беноксапрофена, бензпиперилона, бензидамина, бензилморфина, бермопрофена, безитрамида, α-бисаболола, бромфенака, пара-бромацетанилида, ацетата 5-бромсалициловой кислоты, бромсалигенина, буцетина, буклоксовой кислоты, буколома, буфексамака, бумадизона, бупренорфина, бутацетина, бутибуфена, бутофанола, ацетилсалицилата кальция, карбамазепина, карбифена, карпрофена, карсалама, хлорбутанола, хлортеноксазина, салицилата холина, цинхофена, цинметацина, цирамадола, клиданака, клометацина, клонитазена, клониксина, клопирака, клова, кодеина, метилбромида кодеина, фосфата кодеина, сульфата кодеина, кропропамида, кротетамида, дезоморфина, дексоксадрола, дектроморамида, дезоцина, диампромида, деклофенака натрия, дифенамизола, дифенпирамида, дифлунизала, дигидрокодеина, энолацетата дигидрокодеинона, дигидроморфина, ацетилсалицилата дигидроксиалюминия, дименоксадола, димефептанола, диметилтиамбутена, бутирата диоксафетила, дипипанона, дипроцетила, дипирона, дитазола, дроксикама, эморфазона, энфенамовой кислоты, эпиризола, эптазоцина, этерсалата, этензамида, этогептазина, этоксазена, этилметилтиамбутена, этилморфина, этодолака, этофенамата, этонитазена, эвгенола, фелбинака, фенбуфена, фенклозовой кислоты, фендосала, фенопрофена, фентанила, фентиазака, фепрадинола, фепразона, флоктафенина, флуфенамовой кислоты, флуноксапрофена, фторесона, флупиртина, флупроквазона, флубипрофена, фосфосала, гентисовой кислоты, глафенина, глукаметацина, салицилата гликоля, гуаиазулена, гидрокодона, гидроморфона, гидроксипетидина, ибуфенака, ибупрофена, ибупроксама, салицилата имидазола, индометацина, индопрофена, изфезолака, изоладола, изометадона, изониксина, изоксепака, изоксикама, кетобемидона, кетопрофена, кеторолака, пара-лактофенетида, лефетамина, леворфанола, лофентанила, лоназолака, лорноксикама, локсопрофена, ацетилсалицилата лизина, ацетилсалицилата магния, меклофенамовой кислоты, мефенамовой кислоты, меперидина, мептазинола, меселамина, метазоцина, гидрохлорида метадона, метотримепразина, метиазиновой кислоты, метофолина, метопона, мофебутазона, мофезолака, моразона, морфина, гидрохлорида морфина, сульфата морфина, салицилата морфолина, мирофина, набуметона, налбуфина, салицилата 1-нафтила, напроксена, нарцеина, нефопама, никоморфина, нифеназона, нифлумовой кислоты, нимезулида, 5'-нитро-2'-пропоксиацетанилида, норлеворфанола, норметадона, норморфина, норпипанона, олсалазина, опия, оксацепрола, оксаметацина, оксапрозина, оксикодона, оксиморфона, оксифенбутазона, папаверетума, паранилина, парсалмида, пентазоцина, перисоксала, фенацетина, фенадоксона, феназоцина, гидрохлорида феназопиридина, феноколла, феноперидина, фенопиразона, фенилацетилсалицилата, фенилбутазона, фенилсалицилата, фенирамидола, пикетопрофена, пиминодина, пипебузона, пиперилона, пипрофена, пиразолака, пиритрамида, пироксикама, пранопрофена, проглуметацина, прогептазина, промедола, пропацетамола, пропирама, пропоксифена, пропифеназона, проквазона, протизиновой кислоты, рамифеназона, ремифентанила, метилсульфата римазолия, салацетамида, салицина, салициламида, салициламид о-уксусной кислоты, салицилсерной кислоты, салсалте, салверина, симетрида, салицилата натрия, суфентанила, сулфасалазина, сулиндака, супероксиддисмутазы, супрофена, суксибузона, талнифлумата, тенидапа, теноксикама, терофенамата, тетрандрина, тиазолинбутазона, тиапрофеновой кислоты, тиарамида, тилидина, тиноридина, толфенамовой кислоты, толметина, трамадола, тропесина, виминола, ксенбуцина, ксимопрофена, залтопрофена и зомепирака (см. указатель лекарственных средств The Merck Index, 12th Edition (1996), Therapeutic Category and Biological Activity Index, перечни в нем, озаглавленные «Анальгетические средства», «Противовоспалительные средства» и «Жаропонижающие средства»).
Особенно предпочтительные способы комбинированного лечения включают применение композиции согласно данному варианту осуществления с опиоидным соединением, конкретнее, где опиоидное соединение представляет собой кодеин, меперидин, морфин или его производное.
Соединение, подлежащее введению в комбинации с препаратом, селективно блокирующим СОХ-2, может быть составлено в композицию отдельно от препарата или совместно с препаратом составлено в композицию по изобретению. Когда препарат, селективно блокирующий СОХ-2, совместно составляют в композицию со вторым препаратом, например опиоидным препаратом, второй препарат можно составить в композицию в форме немедленного высвобождения, быстрого начала действия, пролонгированного высвобождения или двойного высвобождения.
В одном варианте осуществления изобретения, в частности, где опосредованное СОХ-2 состояние представляет собой головную боль или мигрень, настоящую композицию препарата, селективно блокирующего СОХ-2, вводят при комбинированной терапии с вазомодулятором, предпочтительно ксантиновое производное, оказывающее вазомодуляторный эффект, более предпочтительно алкилксантиновое соединение.
Способы комбинированного лечения, при которых алкилксантиновое соединение вводят совместно с композицией препарата, селективно блокирующего СОХ-2, как предоставлено здесь, охватываются настоящим изобретением независимо от того, является ли алкилксантин вазомодулятором или нет, и можно ли терапевтическую эффективность комбинации в какой-либо степени отнести к вазомодуляторному эффекту или нет. Термин «алкилксантин» охватывает здесь ксантиновые производные, имеющие один или более С1-4алкильных, предпочтительно, метильных заместителей, и фармацевтически приемлемые соли таких ксантиновых производных. Особенно предпочтительны диметилксантины и триметилксантины, включая кофеин, теобромин и теофиллин. Наиболее предпочтительно алкилксантиновое соединение представляет собой кофеин.
Общее и относительное количество дозировки препарата, селективно блокирующего СОХ-2, и вазомодулятора или алкилксантина выбирают так, чтобы они были терапевтически и/или профилактически эффективными для облегчения боли, связанной с головной болью или мигренью. Подходящие количества дозировки будут зависеть от конкретного препарата, селективно блокирующего СОХ-2, и конкретного выбранного вазомодулятора или алкилксантина. Например, при комбинированном лечении целекоксибом и кофеином обычно целекоксиб следует вводить в количестве суточной дозировки от около 50 мг до около 1000 мг, предпочтительно от около 100 мг до около 600 мг, и кофеин в количестве суточной дозировки от около 1 мг до около 500 мг, предпочтительно от около 10 мг до около 400 мг, более предпочтительно от около 20 мг до около 300 мг.
Вазомодуляторный или алкилксантиновый компонент комбинированного лечения можно вводить в любой подходящей лекарственной форме любым подходящим путем, предпочтительно перорально. Вазомодулятор или алкилксантин можно необязательно совместно составить в композицию с препаратом, селективно ингибирующим СОХ-2, в одну пероральную лекарственную форму. Так, композиция в виде раствора или раствора/суспензии по изобретению необязательно включает и включающий аминосульфонил препарат, селективно ингибирующий СОХ-2, и вазомодулятор или алкилксантин, такой как кофеин, в общих и относительных количествах, согласующихся с количествами дозировок, представленных выше.
Фраза «в общих и относительных количествах, эффективных для облегчения боли» в отношении количеств препарата, селективно ингибирующего СОХ-2, и вазомодулятора или алкилксантина в композиции согласно настоящему варианту осуществления означает, что эти количества таковы, что (а) вместе указанные соединения эффективны для облегчения боли и (b) каждый компонент способен или должен быть способен внести вклад в облегчающий боль эффект, если другой компонент не присутствует или не присутствовал в таком большом количестве, чтобы избежать такого вклада.
ПРИМЕРЫ
Пример 1
6 композиций целекоксиба в виде раствора SF-1 и SF-6 получают, как показано в таблице 1.
Состав (мг) композиций целекоксиба в виде раствора SF-1 и SF-6
Пример 2
Анализ in vitro выполняли для определения свойств самостоятельного эмульгирования композиций целекоксиба в виде раствора SF-1 и SF-6 следующим образом:
(а) 400 мкл композиции в виде раствора помещают в сосуд с завинчивающейся верхней частью и с боковым патрубком, содержащий 20 мл SGF, поддерживаемый при 37°С в течение всего испытания, для образования испытуемой жидкости;
(b) испытуемую жидкость слегка перемешивают при 75 об/мин в течение 2 мин с использованием орбитального аппарата для встряхивания;
(с) аликвотное количество испытуемой жидкости 5-50 мкл удаляют через боковой патрубок с использованием пипетки и выливают из пипетки в сосуд для взятия проб;
(d) насос (модель RH0CKC-LF, Fluid Metering Inc., Syosset, NY) используют для проталкивания испытуемой жидкости из сосуда для взятия образцов через комбинированный датчик рассеивания/затемнения (LE400-0,5, Particle Sizing Systems, Santa Barbara, CA) со скоростью 1 мл/мин в течение периода 1 мин;
(е) эмульсионные частицы подсчитывают отдельно рассеянием света в диапазоне размера от 0,5 до 1 мкм и затемнением света в диапазоне размера больше 1 мкм с использованием программного обеспечения продавца (Версия 1.59);
(f) строят график зависимости количества (не взвешенных) или объема (взвешенных) частиц эмульсии от диаметра частиц;
(g) проводят интегрирование графика с учетом всех разведений для оценки общего количества или объема эмульсионных частиц, присутствующих в испытуемой жидкости, достаточно больших для выявления датчиком.
Полученные данные, показанные в таблице 2, указывают на то, что при данном уровне олеиновой кислоты присутствие достаточного количества органического амина в композиции изобретения делает композицию в виде раствора мелко самостоятельно эмульгирующейся в имитированном желудочном соке.
Свойства самостоятельного эмульгирования композиций SF-1 и SF-6 в SGF
Пример 3
6 композиций целекоксиба в виде раствора с SF-7 до SF-12 получали, как показано в таблице 3.
Состав (мг) композиций целекоксиба в виде раствора SF-7 и SF-12
Пример 4
Анализ in vitro, как описано в пример 2, выполняли на композициях целекоксиба в виде раствора с SF-7 до SF-12. Данные показаны в таблице 4.
Свойства самостоятельного эмульгирования композиций от SF-7 до SF-12 в SGF
Представленные данные указывают на то, что при данном уровне олеиновой кислоты присутствие достаточного количества органического амина в композиции по изобретению делает композицию в виде раствора мелко самостоятельно эмульгируемой в имитированном желудочном соке.
Пример 5
Композицию целекоксиба в виде раствора SF-13 получали, как показано в таблице 5.
Состав (мг/г) композиций целекоксиба в виде раствора с SF-7
1 г SF-13 отдельно помещали в каждую из нескольких твердых желатиновых капсул (Capsugel) для формирования испытуемой композиции 1.
Пример 6
Композицию целекоксиба в виде суспензии получали в сравнительных целях следующим образом:
(а) 5,0 г TweenTM 80 (полисорбат 80) помещали в мерную колбу;
(b) этанол добавляли (до 100 мл) для формирования смеси и смесь перемешивали вихревой мешалкой для формирования однородного раствора;
(с) 5 мл однородного раствора переносили в свежую колбу объемом 100 мл, содержащую 200 мг целекоксиба, для формирования премикса;
(d) 75 мл яблочного сока добавляли к премиксу для формирования промежуточной суспензии целекоксиба; и
(е) промежуточную суспензию целекоксиба оставляли стоять в течение 5 мин, а затем встряхивали для формирования суспензии целекоксиба.
Показатели биологической доступности для людей в результате введения испытуемой композиции 1 примера 5 по сравнению с контрольной суспензионной композицией целекоксиба примера 6 и с имеющейся в продаже 200 мг капсулой (Celebrex® от Pharmacia) оценивали во включавшем 24 индивидуума рандомизированном четырехпериодном сбалансированном перекрестном исследовании. Четвертую композицию, не относящуюся к настоящему изобретению, также включили в исследование, но данные здесь не представлены. Длительность исследования составила приблизительно 15 д, и индивидуумам методом случайной выборки давали одну из четырех лекарственных форм на 1, 5 и 12 д; введению каждой дозы предшествовал 8-часовой период голодания, и он сопровождался 180 мл воды. Уровни в плазме крови для каждого индивидуума измеряли через 15, 30, 45 мин и 1, 1,5, 2, 3, 4, 6, 8, 12 и 24 ч после введения дозировки. Cmax и площадь под кривой (ППК) рассчитывали по полученным данным в соответствии со стандартной процедурой, принятой в данной области. Как показано в таблице 6, введение внутрь испытуемой композиции 1 привело к Cmax более чем в 2,5 раза большей, чем та, которая возникала в результате употребления внутрь контрольной суспензии целекоксиба или имеющейся в продаже капсулы целекоксиба. Введение внутрь испытуемой композиции 1 привело к ППК, на 43% большей, и к Tmax, по существу аналогичному, полученным в результате употребления внутрь контрольной суспензии целекоксиба.
Биологическая доступность целекоксиба in vivo у людей
Пример 7
Получали 2 композиции целекоксиба в виде раствора SF-14 и SF-15, имеющие составы, показанные в таблице 7.
Состав (мг) композиций целекоксиба в виде раствора SF-14 и SF-15 и композиций плацебо в виде раствора Р-2 и Р-3
Композиции в виде растворов SF-12 и SF-13 в количествах 500 мг и 1000 мг соответственно отдельно помещали в каждую из нескольких желатиновых капсул для формирования испытуемых композиций 2 (100 мг плацебо) и 3 (200 мг целекоксиба) соответственно. Испытуемая композиция 4 состояла из двух капсул испытуемой композиции 3, приводя к дозе целекоксиба 400 мг. Композиции плацебо в виде раствора Р-2 и Р-3 заполняли в мягкие капсулы, соответствующие по размеру капсулам, содержащим соответственно композиции в виде растворов SF-12 и SF-13 для формирования композиции плацебо 2 и композицию плацебо 3.
Рандомизированное, двойное слепое, с контролем по активной композиции и плацебо, однодозовое, параллельное, групповое исследование выполняли для оценки обезболивающей эффективности испытуемых композиций 2, 3 и 4, в сравнении с соответствующим и визуально подобранным плацебо, на модели боли после стоматологических операций у людей.
Для исследования отбирали и распределяли по группам методом случайной выборки пациентов после хирургического вмешательства (после удаления двух или более ретенированных третьих моляров, требующих удаления кости), которые сообщали об умеренной или тяжелой боли после стоматологической операции по делящейся на категории болевой шкале (CPS; 0 = отсутствие боли, 1 = незначительная боль, 2 = умеренная боль и 3 = сильная боль) и исходной интенсивности боли ≥50 мм по визуальной аналоговой шкале (VAS; с помощью которой пациент располагает скользящий брусок, представляющий уровень боли у него или у нее на 100 мм горизонтальной шкале при левом крае (0 мм) «боль отсутствует» и правом крае (100 мм), отмеченным «самая сильная боль») в пределах 6 ч после завершения операции.
Каждого пациента методом случайной выборки включали в одну из четырех групп лечения (приблизительно 55 на группу) и через 6 ч после завершения операции они получали исследуемое лекарственное средство, отнесенное к их группе, и из флакона А, и из флакона В, как показано на схеме введения препарата, показанной в таблице 8. 2 дополнительные композиции, не иллюстрирующие данное изобретение, были также включены в исследование, но данные по ним здесь не представлены.
Схема введения лекарственных средств пациентам в группах лечения 1-4
Боль оценивали на исходном уровне (0 ч), через 0,25, 0,50, 0,75, 1,0, 1,25, 1,50, 1,75, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 16 и 24 ч после введения исследуемого лекарственного средства. Каждый пациент индивидуально определял и регистрировал время до облегчения воспринимаемой боли и время до значительного облегчения боли с использованием двух секундомеров.
Затем подсчитывали время до начала анальгезии для каждого пациента путем выполнения анализа периода времени до наступления явления, объединяя данные оценок с помощью секундомера времени до облегчения воспринимаемой боли и до значительного облегчения боли. Исходная интенсивность боли для каждой группы показана в таблице 9. Медиана времени до начала обезболивания показана в таблице 10.
Исходная интенсивность боли
Указанные данные показывают, что пациенты в каждой испытуемой группе имели сравнимую исходную интенсивность боли.
Медиана времени до начала обезболивания
Как определено в аналогичном исследовании боли, о котором сообщено в Международной патентной публикации № WO 01/91750, включенной сюда в качестве ссылки, капсулы Celebrex® по 200 мг проявляют медиану времени до начала обезболивания 41 мин. Данные в таблице 10 показывают, что пациенты, принимающие испытуемые композиции 2, 3 или 4, испытали относительно быструю медиану времени до начала обезболивания, равную 31 мин или менее.
Изобретение относится к медицине и описывает перорально доставляемую фармацевтическую композицию, включающую препарат с низкой растворимостью в воде и растворяющую жидкость, которая включает по меньшей мере один фармацевтически приемлемый растворитель, по меньшей мере одну фармацевтически приемлемую жирную кислоту и по меньшей мере один фармацевтически приемлемый органический амин, причем (а) существенная часть, например по меньшей мере 15 мас.%, препарата находится в растворенной или солюбилизированной форме в растворяющей жидкости и (b) жирная кислота и органический амин присутствуют в таких общих и относительных количествах, что композиция самостоятельно мелко эмульгируется в имитированном желудочном соке. Изобретение также относится к способу получения такой композиции. Данный способ позволяет получить композиции, содержащие препараты с низкой растворимостью в воде в подходящих концентрациях, без задерживания их всасывания в организме. 2 н. и 22 з.п. ф-лы, 10 табл.
(a) получения по меньшей мере одной фармацевтически приемлемой жирной кислоты и по меньшей мере одного фармацевтически приемлемого органического амина;
(b) получения фармацевтически приемлемого растворителя по меньшей мере для одной фармацевтически приемлемой жирной кислоты и фармацевтически приемлемого растворителя по меньшей мере для одного органического амина;
(c) смешивания по меньшей мере с одной жирной кислотой растворителя по меньшей мере для одной жирной кислоты и растворителя по меньшей мере для одного органического амина для формирования премикса, в котором жирная кислота по существу полностью растворена;
(d) смешивания вместе с премиксом по меньшей мере одного органического амина для формирования смеси, в которой органический амин по существу полностью растворен; и
(e) смешивания со смесью препарата с низкой растворимостью в воде в растворенной и/или солюбилизированной форме для формирования фармацевтической композиции.

где R3 представляет собой метальную или амино группу, R4 представляет собой водород или С1-4алкильную или алкокси группу, Х представляет собой N или CR5, где R5 представляет собой водород или галоген, a Y и Z независимо представляют собой атомы углерода или азота, определяющие соседние атомы от пяти- до шестичленного кольца, которое является незамещенным или замещенным в одном или более положений оксо группой, галогеном, метальной или галогенметильными группами; или пролекарство такого соединения.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| (ЭНДО)-N-{([(8-МЕТИЛ -8-АЗАБИЦИКЛО-(3,2,1) -ОКТАН-3-ИЛ)-АМИНО]-КАРБОНИЛ}) -2- (ЦИКЛОПРОПИЛМЕТОКСИ) -БЕНЗАМИД ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2036923C1 |
Авторы
Даты
2007-05-20—Публикация
2003-04-07—Подача