ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области экспрессии белков. В частности, оно относится к гетерологичной экспрессии белков из Neisseria (например, N. gonorrhoeae или предпочтительно N. meningitidis).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Международные патентные заявки WO 99/24578, WO 99/36544, WO 99/57280 и WO 00/22430 описывают белки из Neisseria meningitidis и Neisseria gonorrhoeae. Эти белки обычно описываются как экспрессируемые в Е. coli (т.е. при гетерологичной экспрессии) в виде либо N-концевых GST-гибридов, либо С-концевых His-меченых-гибридов, хотя описаны также другие экспрессионные системы, в том числе экспрессия в нативной Neisseria.
Целью данного изобретения является обеспечение альтернативных и улучшенных подходов для гетерологичной экспрессии этих белков. Эти подходы обычно влияют на уровень экспрессии, легкость очистки, клеточную локализацию экспрессии и/или иммунологические свойства экспрессируемого белка.
Применяемая здесь номенклатура
2166 последовательностей белков, описанных в WO 99/24578, WO 99/36544 и WO 99/57280, называются здесь следующими SEQ ID NO:
SEQ ID NO:2002-2039
SEQ ID NO:2040-2166
Кроме этой SEQ ID NO: используются также стандартные наименования, используемые в WO 99/24578, WO 99/36544 и WO 99/57280 (например, 'ORF4', 'ORF40', 'ORF40-1' и т.д., которые используются в WO 99/24578 и WO 99/36544; 'm919', 'g919' и 'а919' и т.д., которые используются в WO 99/57280).
2160 белков NMB0001-NMB2160 из Tettelin et al. [Science (2000) 287:1809-1815] называются здесь SEQ ID NO:2167-4326 [см. также WO 00/66791].
Термин "белок данного изобретения" в применении здесь относится к белку, содержащему
(а) одну из последовательностей SEQ ID NO:1-4326; или
(b) последовательность, имеющую идентичность последовательности относительно одной из SEQ ID NO:1-4326; или
(с) фрагмент одной из SEQ ID NO:1-4326.
Степень "идентичности последовательности", упоминаемой в (b), является предпочтительно выше 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или более). Это включает мутанты и аллельные варианты (например, см. WO 00/66741). Идентичность предпочтительно определяют при помощи алгоритма поиска гомологии Smith-Waterman, имеющегося в программе MPSRCH (Oxford Molecular), с использованием поиска аффинного гэпа с параметрами штрафа открывания гэпа=12 и штрафа удлинения гэпа=1. Обычно 50 %-ную или более высокую идентичность между двумя белками считают указанием на функциональную эквивалентность.
"Фрагмент", упоминаемый в (с), должен содержать по меньшей мере n последовательных аминокислот из одной из SEQ ID NO:1-4326 и, в зависимости от конкретной последовательности, n равен 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100 или более). Предпочтительно фрагмент содержит эпитоп из одной из SEQ ID NO:1-4326. Предпочтительными фрагментами являются фрагменты, описанные в WO 00/71574 и WO 01/04316.
Предпочтительные белки данного изобретения обнаружены в серологической группе В N. meningitidis.
Предпочтительными белками для применения в соответствии с данным изобретением являются белки штамма 2996 или штамма 394/98 (Ново-Зеландского штамма) N. meningitidis серологической группы В. Если нет иных указаний, упомянутые здесь белки являются белками из штамма 2996 N. meningitidis. Однако должно быть понятно, что данное изобретение в общем не ограничивается штаммом. Ссылки на конкретный белок (например, '287', '919' и т.д.) могут иметь в виду данный белок из любого штамма.
Не-гибридная экспрессия
В первом подходе к гетерологичной экспрессии не используется гибридный партнер и используется природный лидерный пептид (если он присутствует). Обычно это будет предотвращать "вмешательство" со стороны гибридных партнеров и может изменять клеточную локализацию и/или посттрансляционную модификацию и/или укладку в гетерологичном хозяине.
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором (а) не используется гибридный партнер, и (b) используется природный лидерный пептид (если он присутствует) данного белка.
Способ обычно включает стадию получения вектора для экспрессии белка данного изобретения, так что первой экспрессируемой аминокислотой является первая аминокислота (метионин) указанного белка, а последней экспрессируемой аминокислотой является последняя аминокислота указанного белка (т.е. кодон, предшествующий природному СТОП-кодону).
Этот подход предпочтительно используется для экспрессии следующих белков, использующих природный лидерный пептид: 111, 149, 206, 225-1, 235, 247-1, 274, 283, 286, 292, 401, 406, 502-1, 503, 519-1, 525-1, 552, 556, 557, 570, 576-1, 580, 583, 664, 759, 907, 913, 920-1, 936-1, 953, 961, 983, 989, Orf4, Orf7-1, Orf9-1, Orf23, Orf25, Orf37, Orf38, Orf40, Orf40.1, Orf40.2, Orf72-1, Orf76-1, Orf85-2, Orf91, Orf97-1, Orf119, Orf143.1, NMB0109 и NMB2050. Суффикс "L", используемый здесь в названии белка, указывает, что экспрессия происходит с использованием природного лидерного пептида.
Белки, которые предпочтительно экспрессируются с применением этого подхода, не использующего гибридного партнера, и которые не имеют природного лидерного пептида, включают: 008, 105, 117-1, 121-1, 122-1, 128-1, 148, 216, 243, 308, 593, 652, 726, 926, 982, Orf83-l и Orf143-1.
Преимущественно этот способ используется для экспрессии ORF25 или ORF40, приводящей к получению белка, который индуцирует лучшие бактерицидные антитела, чем GST- или His-гибриды.
Этот подход особенно применим для экспрессии липопротеинов.
Замена лидерного пептида
Во втором подходе к гетерологичной экспрессии природный лидерный пептид белка данного изобретения заменяют лидерным пептидом другого белка. Кроме того, предпочтительно не использовать гибридного партнера. Хотя использование собственного лидерного пептида белка в гетерологичных хозяевах часто может локализовать этот белок в его "природном" клеточном местоположении, в некоторых случаях эта лидерная последовательность не узнается эффективно гетерологичным хозяином. В таких случаях вместо нее может использоваться лидерный пептид, о котором известно, что он может эффективно направлять нацеливание белка.
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором (а) лидерный пептид этого белка заменен лидерным пептидом из другого белка, и, необязательно, (b) не используется гибридный партнер.
Этот способ обычно предусматривает стадии: получения нуклеиновой кислоты, кодирующей белок данного изобретения; манипулирования указанной нуклеиновой кислоты для удаления нуклеотидов, которые кодируют лидерный пептид данного белка, и введения нуклеотидов, которые кодируют лидерный пептид другого белка. Полученная нуклеиновая кислота может быть встроена в экспрессирующий вектор или она может уже быть частью экспрессирующего вектора. Экспрессируемый белок будет состоять из заменяющего лидерного пептида на N-конце, за которым следует белок данного изобретения без его лидерного пептида.
Лидерный пептид предпочтительно является лидерным пептидом другого белка данного изобретения (например, одного из SEQ ID NO:1-4326), но может быть, например, также белком Е. coli (например, лидерным пептидом OmpA) или белком Erwinia carotovora (например, лидерным пептидом PelB).
Особенно применимым заменяющим лидерным пептидом является лидерный пептид ORF4. Этот лидер способен управлять липидированием в Е. coli, улучшая клеточную локализацию, и особенно применим для экспрессии белков 287, 919 и AG287. В частности, применимы также лидерный пептид и N-концевые домены 961.
Другим применимым заменяющим лидерным пептидом является лидерный пептид OmpA E. coli. Этот лидер способен управлять мембранной локализацией E. coli. Он особенно предпочтителен для экспрессии ORF1, приводящей к получению белка, который индуцирует лучшие бактерицидные антитела, чем гибридные белки и белок, экспрессируемый от его собственного лидерного пептида.
Другим применимым заменяющим лидерным пептидом является MKKYLFSAA. Он может направлять секрецию в культуральную среду и является очень коротким и очень активным. Применение этого лидерного пептида не ограничивается экспрессией белков Neisseria - он может быть использован для регуляции экспрессии любого белка (в частности, бактериальных белков).
Делеция лидерного пептида
В третьем подходе к гетерологичной экспрессии природный лидерный пептид белка данного изобретения является делегированным. Кроме того, предпочтительно не используется гибридный партнер.
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором (а) лидерный пептид данного белка является делегированным и, необязательно, (b) не используется гибридный партнер.
Этот способ обычно предусматривает стадии: получения нуклеиновой кислоты, кодирующей белок данного изобретения; манипулирования указанной нуклеиновой кислоты для удаления нуклеотидов, которые кодируют лидерный пептид данного белка. Полученная нуклеиновая кислота может быть встроена в экспрессирующий вектор или она может уже быть частью экспрессирующего вектора. Первая аминокислота экспрессируемого белка будет первой аминокислотой зрелого природного белка.
Этот способ может увеличивать уровни экспрессии. Например, для белка 919 уровни экспрессии в Е. coli являются гораздо более высокими при делеции лидерного пептида. Увеличенная экспрессия может быть обусловлена измененной локализацией в отсутствие лидерного пептида.
Этот способ предпочтительно используют для экспрессии 919, ORF46, 961, 050-1, 760 и 287.
Экспрессия на основе доменов
В четвертом подходе к гетерологичной экспрессии белок экспрессируется в виде доменов. Это может быть использовано в связи с гибридными системами (например, GST- или His-гибридами).
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором (а) по меньшей мере один домен в данном белке делегирован и, необязательно, (b) не используется гибридный партнер.
Этот способ обычно предусматривает стадии: получения нуклеиновой кислоты, кодирующей белок данного изобретения; манипулирования указанной нуклеиновой кислоты для удаления по меньшей мере одного домена из данного белка. Полученная нуклеиновая кислота может быть встроена в экспрессирующий вектор или она может уже быть частью экспрессирующего вектора. Если не используются гибридные партнеры, первая аминокислота экспрессируемого белка будет первой аминокислотой домена данного белка.
Белок обычно делят на теоретические домены сопоставлением его с известными последовательностями в базах данных с последующим определением участков белка, которые обнаруживают отличающиеся друг от друга картины сопоставления.
Этот способ предпочтительно используется для экспрессии белка 287. Этот белок может быть теоретически разделен на три домена, называемые А, В и С (см. фигуру 5). Домен В в значительной степени сопоставляется с IgA-протеазами, домен С в значительной степени сопоставляется с трансферринсвязывающими белками, а домен А не обнаруживает значительного сопоставления с последовательностями баз данных. Сопоставление полиморфных форм 287 описано в WO 00/66741.
После разделения белка на домены, они могут (а) экспрессироваться по отдельности, (b) делегироваться из данного белка, например, белок ABCD→ABD, ACD, BCD и т.д., или (с) перегруппировываться, например, белок АВС→АСВ, CAB и т.д. Эти три стратегии могут комбинироваться, если желательно, с гибридными партнерами.
ORF46 был также теоретически разбит на два домена - первый домен (аминокислоты 1-433), который является в высокой степени консервативным между видами и серологическими группами, и второй домен (аминокислоты 433-608), который не является в большой степени консервативным. Этот второй домен предпочтительно делегируют. Сопоставление полиморфных форм ORF46 описано в WO 00/66741.
Белок 564 также был разделен на домены (фигура 8), так же как и белок 961 (фигура 12) и белок 502 (аминокислоты 28-167 белка МС58).
Гибридные белки
В пятом подходе к гетерологичной экспрессии два или более (например, 3, 4, 5, 6 или более) белков данного изобретения экспрессируются в виде единого гибридного белка. Предпочтительно, чтобы не был использован гибридный партнер, не относящийся к Neisseria (например, GST или поли-His).
Это дает два преимущества. Во-первых, белок, который может быть нестабильным или слабо экспрессируемым в отдельности, может преодолеть эти недостатки при добавлении подходящего гибридного партнера, который преодолевает эту проблему. Во-вторых, упрощается коммерческое получение необходимо использование только одной экспрессии и очистки для получения двух раздельно применимых белков.
Таким образом, данное изобретение обеспечивает способ одновременной гетерологичной экспрессии двух или более белков данного изобретения, в котором гибридизуются указанные два или более белков данного изобретения (т.е. они транслируются в виде единой полипептидной цепи).
Способ обычно включает стадии: получения первой нуклеиновой кислоты, кодирующей первый белок данного изобретения; получения второй нуклеиновой кислоты, кодирующей второй белок данного изобретения; лигирования первой и второй нуклеиновых кислот. Полученная нуклеиновая кислота может быть встроена в экспрессирующий вектор или может уже быть частью экспрессирующего вектора.
Предпочтительно, составляющие белки в гибридном белке данного изобретения являются белками из одного и того же штамма.
Гибридные белки в химере могут быть соединены непосредственно или могут быть соединены через линкерный пептид, например, через полиглициновый линкер (т.е. Gn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более) или через короткую пептидную последовательность, которая облегчает клонирование. Очевидно, что предпочтительно не присоединять ΔG-белок к С-концу полиглицинового линкера.
Гибридные белки могут быть лишены природных лидерных пептидов или могут включать последовательность лидерного пептида N-концевого гибридного партнера.
Этот способ удобен для экспрессии белков orf1, orf4, orf25, orf40, Orf46/46.1, orf 83, 233, 287, 292L, 564, 687, 741, 907, 919, 953, 961 и 983.
Предпочтительными являются 42 гибрида, указанные "X" в следующей таблице, формулы NH2-A-B-COOH:
Таким образом, предпочтительными белками для экспрессии в качестве гибридов являются ORF46.1, 287, 741, 919, 953, 961 и 983. Они могут быть использованы в их по существу полноразмерной форме или могут быть использованы формы с полиглициновой делецией (ΔG) (например, ΔG-287, ΔGTbp2, ΔG741, ΔG983 и т.д.) или могут быть использованы укороченные формы (например, Δ1-287, A2-287 и т.д.) или версии с делегированными доменами (например, 287В, 287С, 287ВС, ORF461-433, ORF46433-608, ORF46, 961с и т.д.).
Особенно предпочтительными являются: (а) гибридный белок, содержащий 919 и 287; (b) гибридный белок, содержащий 953 и 287; (с) гибридный белок, содержащий 287 и ORF46.1; (d) гибридный белок, содержащий ORF1 и ORF46.1; (е) гибридный белок, содержащий 919 и ORF46.1; (f) гибридный белок, содержащий ORF46.1 и 919; (g) гибридный белок, содержащий ORF46.1, 287 и 919; (h) гибридный белок, содержащий 919 и 519; и (i) гибридный белок, содержащий ORF97 и 225. Другие варианты показаны на фигуре 14.
При применении 287 он предпочтительно находится на С-концевой стороне гибрида; если он должен использоваться на N-конце, предпочтительно использовать ΔG-форму 287 (например, в виде N-конца гибрида с ORF46.1, 919, 953 или 961).
При применении 287 он предпочтительно происходит из штамма 2996 или из штамма 394/98.
При применении 961 он предпочтительно находится на N-конце. Могут быть использованы формы доменов 961.
Сопоставления полиморфных форм ORF46, 287, 919 и 953 описаны в WO 00/66741. Любые из этих полиморфных форм могут быть использованы в соответствии с данным изобретением.
Температура
В шестом подходе к гетерологичной экспрессии белки данного изобретения экспрессируются при низкой температуре.
Экспрессируемые белки Neisseria (например, 919) могут быть токсичными для Е. coli, чего можно избежать экспрессией токсичного белка при температуре, при которой его токсичность не проявляется.
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором экспрессию белка данного изобретения проводят при температуре, при которой токсическая активность белка не проявляется.
Предпочтительной температурой является температура около 30°С. Она особенно пригодна для экспрессии 919.
Мутации
Как обсуждалось выше, экспрессируемые белки Neisseria могут быть токсичными для Е. coli. Этой токсичности можно избежать мутированием белка для уменьшения или устранения токсической активности. В частности, для уменьшения или устранения токсической ферментативной активности могут быть использованы мутации, предпочтительно с использованием сайт-направленного мутагенеза.
Таким образом, в седьмом подходе к гетерологичной экспрессии экспрессируемый белок мутируют для уменьшения или устранения токсической активности.
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором белок мутируют для уменьшения или устранения токсической активности.
Этот способ предпочтительно используют для экспрессии белка 907, 919 или 922. Предпочтительной мутацией в 907 является мутация в Glu-117 (например, Glu→Gly); предпочтительные мутации в 919 являются мутациями в Glu-255 (например, Glu→Gly) и/или Glu-323 (например, Glu→Gly); предпочтительные мутации в 992 являются мутациями в Glu-164 (например, Glu→Gly), Ser-213 (например, Ser→Gly) и/или Asn-348 (например, Asn→Gly).
Альтернативные векторы
В восьмом подходе к гетерологичной экспрессии для экспрессии белка используют альтернативный вектор. Это может выполняться, например, для улучшения выходов экспрессии или для использования плазмид, уже подтвержденных для GMP-применения.
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором используют альтернативный вектор. Альтернативным вектором является предпочтительно рSМ214, без гибридных партнеров. Лидерные пептиды могут быть включены или могут не быть включены.
Этот подход применим, в частности, для белка 953. Экспрессия и локализация 953 с его природным лидерным пептидом, экспрессируемого из рSМ214, является гораздо лучшей, чем из вектора рЕТ.
Вектор рSМ214 может быть также использован с: ΔG287, Δ2-287, Δ3-287, Δ4-287, Orf46.1, 961L, 961, 961(МС58), 961с, 961с-L, 919, 953 и ΔG287-Orf46.1.
Другим подходящим вектором является pET-24b (Novagen; использует устойчивость к канамицину), также без применения гибридных партнеров. pET-24b является предпочтительным для применения с: ΔG287K, Δ2-287К, Δ3-287К, Δ4-297К, Orf46.1-K, Orf46A-K, 961-К (МС58), 961а-К, 961b-K, 961c-K, 961с-L-K, 961d-K, ΔG287-919-K, ΔG287-Orf46.1-К и ΔG287-961-K.
Мультимерная форма
В девятом подходе к гетерологичной экспрессии белок экспрессируют или очищают таким образом, что он принимает конкретную мультимерную форму.
Этот подход особенно пригоден для белка 953. Очистка одной конкретной мультимерной формы 953 (мономерной формы) дает белок с более высокой бактерицидной активностью, чем другие формы (димерная форма).
Белок 287 и белок 919 могут быть очищены в димерных формах.
Белок 961 может быть очищен в виде формы из олигомеров 180 кДа (например, в виде тетрамера).
Липидирование
В десятом подходе к гетерологичной экспрессии белок экспрессируется в виде липидированного белка.
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором данный белок экспрессируется в виде липидированного белка.
Этот способ применим, в частности, для экспрессии 919, 287, ORF4, 406, 576-1 и ORF25. Полиморфные формы 919, 287 и ORF4 описаны в WO 00/66741.
Этот способ обычно предусматривает применение подходящего лидерного пептида без применения N-концевого гибридного партнера.
С-концевые делеции
В одиннадцатом подходе к гетерологичной экспрессии С-конец белка данного изобретения является мутированным. Кроме того, предпочтительно не используется гибридный партнер.
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором (а) С-концевой участок является мутированным и, необязательно, (b) не используется гибридный партнер.
Этот способ обычно предусматривает стадии: получения нуклеиновой кислоты, кодирующей белок данного изобретения; манипулирования указанной нуклеиновой кислоты для мутирования нуклеотидов, которые кодируют С-концевую часть данного белка. Полученная нуклеиновая кислота может быть встроена в экспрессирующий вектор, или она может уже быть частью экспрессирующего вектора. Первая аминокислота экспрессируемого белка будет первой аминокислотой зрелого природного белка.
Мутация может быть заменой, инсерцией или, предпочтительно, делецией.
Данный способ может увеличивать уровни экспрессии, в частности, для белков 730, ORF29 и ORF46. Для белка 730, может быть делетирован С-концевой участок около 65 - около 214 аминокислот; для белка ORF46, может быть делегирован С-концевой участок около 175 аминокислот; для белка ORF29, может быть делетирован С-конец с оставлением около 230-370 N-концевых аминокислот.
Мутация лидерного пептида
В двенадцатом подходе к гетерологичной экспрессии лидерный пептид белка является мутированным. Это особенно применимо для экспрессии белка 919.
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором лидерный пептид белка является мутированным.
Этот способ обычно предусматривает стадии: получения нуклеиновой кислоты, кодирующей белок данного изобретения; и манипулирования указанной нуклеиновой кислоты для мутирования нуклеотидов в лидерном пептиде. Полученная нуклеиновая кислота может быть встроена в экспрессирующий вектор, или она может уже быть частью экспрессирующего вектора.
Делеция полиглицина
В тринадцатом подходе к гетерологичной экспрессии полиглициновые участки являются мутированными. Это усиливает экспрессию белка.
Полиглициновый участок имеет последовательность (Gly)n, где n≥4 (например, 5, 6, 7, 8, 9 или более). Этот участок мутируют для разрушения или удаления (Gly)n. Это может быть выполнено делецией (например, CGGGGS→CGGGS, CGGS, CGS или CS), заменой (например, CGGGGS→CGXGGS, CGXXGS, CGXGXS и т.д.) и/или инсерцией (например, CGGGGS→CGGXGGS, CGXGGGS и т.д.).
Этот подход не ограничивается белками Neisseria - он может быть использован для любого белка (в частности, для бактериальных белков) для усиления гетерологичной экспрессии. Однако для белков Neisseria он особенно пригоден для экспрессии 287, 741, 983 и Tbp2. Сопоставление полиморфных форм 287 описано в WO 00/66741.
Таким образом, данное изобретение обеспечивает способ гетерологичной экспрессии белка данного изобретения, в котором (а) полиглициновый участок в данном белке является мутированным.
Этот способ обычно предусматривает стадии: получения нуклеиновой кислоты, кодирующей белок данного изобретения; и манипулирования указанной нуклеиновой кислоты для мутирования нуклеотидов, которые кодируют полиглициновый участок в последовательности данного белка. Полученная нуклеиновая кислота может быть встроена в экспрессирующий вектор, или она может уже быть частью экспрессирующего вектора.
Наоборот, может быть использован противоположный подход (т.е. введение полиглициновых участков) для подавления или уменьшения экспрессии конкретного гетерологичного белка.
Гетерологичный хозяин
Хотя экспрессия белков данного изобретения может происходить в природном хозяине (т.е. в организме, в котором данный белок экспрессируется в природе), данное изобретение использует гетерологичного хозяина. Гетерологичный хозяин может быть прокариотическим или эукариотическим. Предпочтительно он является Е. coli, но другие подходящие хозяева включают Bacillus subtilis. Vibrio cholerae, Salmonella typhi. Salmonella typhimurium, Neisseria meningitidis, Neisseria gonorrhoeae, Neisseria lactamica, Neisseria cinerea, Mycobacteria (например, М. tuberculosis), дрожжи и т.д. Векторы и т.д.
Кроме описанных выше способов данное изобретение обеспечивает (а) нуклеиновую кислоту и векторы, применимые в этих способах; (b) клетки-хозяева, содержащие указанные векторы; (с) белки, экспрессируемые или способные экспрессироваться этими способами; (а) композиции, содержащие эти белки, которые могут быть пригодны, например, в качестве вакцин или в качестве диагностических реагентов, или в качестве иммуногенных композиций; (е) эти композиции для применения в качестве лекарственных средств (например, в качестве вакцин) или в качестве диагностических реагентов; (f) применение этих композиций для производства: (1) лекарственного средства для лечения или профилактики инфекции, вызываемой бактериями Neisseria; (2) диагностического реагента для обнаружения присутствия бактерий Neisseria или антител, индуцированных против бактерий Neisseria, и/или (3) реагента, который может индуцировать антитела против бактерий Neisseria; и (g) способ лечения пациента, включающий введение пациенту терапевтически эффективного количества этих композиций.
Последовательности
Данное изобретение обеспечивает также белок или нуклеиновую кислоту, имеющие любую из последовательностей, представленных в следующих примерах. Оно обеспечивает также белки и нуклеиновые кислоты, имеющие идентичность последовательности в отношении указанных последовательностей. Как описано выше, степень "идентичности последовательности" предпочтительно является более высокой чем 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или более).
Кроме того, данное изобретение обеспечивает нуклеиновую кислоту, которая может гибридизоваться с нуклеиновой кислотой, описанной в примерах, предпочтительно в условиях "высокой строгости" (например, при 65°С в растворе 0,1×SSC, 0,5% ДСН).
Данное изобретение обеспечивает также нуклеиновую кислоту, кодирующую белки в соответствии с данным изобретением.
Должно быть понятно, что данное изобретение обеспечивает нуклеиновую кислоту, содержащую последовательности, комплементарные последовательностям, описанным выше (например, для антисмысловых целей или целей зондирования).
Нуклеиновые кислоты в соответствии с данным изобретением могут быть получены, конечно, различными путями (например, химическим синтезом, из библиотек геномных ДНК или кДНК, из самого организма и т.д.) и могут быть представлены в различных формах (например, одноцепочечных, двухцепочечных, векторов, зондов и т.д.).
Кроме того, термин "нуклеиновая кислота" включает ДНК и РНК, а также их аналоги, такие как содержащие модифицированные скелеты, а также пептиднуклеиновые кислоты (ПНК) и т.д.
Краткое описание чертежей
Фигуры 1 и 2 показывают конструкции, используемые для экспрессии белков с использованием гетерологичных лидерных пептидов.
Фигура 3 показывает данные экспрессии для ORF1, а фигура 4 показывает сходные данные для белка 961.
Фигура 5 показывает домены белка 287, а фигуры 6 и 7 показывают делеции в домене А.
Фигура 8 показывает домены белка 564.
Фигура 9 показывает репортерный ген PhoC, регулируемый лидерным пептидом 919, а фигура 10 показывает результаты, полученные с использованием мутантов этого лидерного пептида.
Фигура 11 показывает инсерционные мутанты белка 730 (А:730-С1; В: 730-С2).
Фигура 12 показывает домены белка 961.
Фигура 13 показывает электрофорез в ДСН-ПААГ ΔG-белков. Точки указывают основной рекомбинантный продукт.
Фигура 14 показывает 26 гибридных белков данного изобретения.
СПОСОБЫ ПРОВЕДЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1-919 и его лидерный пептид
Белок 919 из N. meningitidis (серологическая группа В, штамм 2996) имеет следующую последовательность:

Лидерный пептид подчеркнут.
Последовательности 919 из других штаммов представлены на фигурах 7 и 18 WO 00/66741.
Пример 2 WO 99/57280 описывает экспрессию белка 919 в виде His-гибрида в Е. coli. Этот белок является хорошим экспонированным на поверхности иммуногеном.
Для 919 использовали три альтернативные стратегии:
919 без его лидерного пептида (и без цистеина зрелого N-конца) и без какого-либо гибридного партнера ('919немеченый,):

Лидерный пептид и цистеин удаляли конструированием 5'-концевого амплификационного праймера по ходу транскрипции (справа) от предсказанной лидерной последовательности.
2) 919 с его собственным лидерным пептидом, но без какого-либо гибридного партнера ('919L'); и
919 с лидерным пептидом (MKTFFKTLSAAALALILAA) из ORF4 ('9190rf4').

Для получения этой конструкции полную последовательность, кодирующую лидерный пептид ORF4, включали в 5'-праймер в виде хвоста (праймер 919Lorf4 For (прямой)). Сайт рестрикции NdeI генерировали двойной заменой нуклеотидов в последовательности, кодирующей лидер ORF4 (без изменений аминокислот), чтобы сделать возможным гибридизацию различных генов с последовательностью лидерного пептида ORF4. Стоп-кодон включали во все 3'-концевые праймерные последовательности.
Все три формы этого белка экспрессировали, и они могли быть очищены.
Оба продукта экспрессии '919L' и '919LOrf4' липидировали, как показано включением [3H]-пальмитатной метки. 919немеченый не включал 3H-метку и был локвилизован внутриклеточно.
919LOrf4 мог быть очищен с большей легкостью, чем 919L. Его очищали и использовали для иммунизации мышей. Полученные сыворотки дали превосходные результаты в тестах FACS и ELISA, а также в бактерицидном тесте. Было показано, что этот липопротеин локализован в наружной мембране.
919немеченый давал превосходные титры ELISA и высокую сывороточную бактерицидную активность. Анализ с возбуждением флуоресценции FACS подтвердил его локализацию на клеточной поверхности.
Пример 2 - 919 и температура экспрессии
Рост Е. coli, экспрессирующей белок 919LOrf4 при 37°С, приводил к лизису этих бактерий. Для преодоления этой проблемы рекомбинантные бактерии выращивали при 30°С. Лизис предотвращался без предотвращения экспрессии.
Пример 3 - мутация 907, 919 и 922
Была высказана гипотеза, что белки 907, 919 и 922 являются муреингидролазами и, более конкретно, литическими трансгликозилазами. Муреингидролазы локализованы на наружной мембране и участвуют в деградации пептидогликана.
Таким образом, очищенные белки 919немеченый, 919LOrf4, 919-His (т.е. с His-меткой на С-конце) и 922-His испытывали на муреингидролазную активность [Ursinus and Holtje (1994) J. Bact. 176:338-343]. Использовали два различных анализа, один, определяющий деградацию нерастворимой муреиновой саккулы на растворимые муропептиды, и другой, измеряющий разрушение поли (MurNAc-GlcNAc)n>30-гликановых цепей.
Первый анализ использует муреиновые саккулы, радиоактивно меченые мезо-2,6-диамино-3,4,5- [3H]пимелиновой кислотой, в качестве субстрата. Фермент (всего 3-10 мкг) инкубировали в течение 45 минут при 37°С в общем объеме 100 мкл, содержащем 10 мМ Трис-малеат (рН 5,5), 10 мМ MgCl2, 0,2% об./об. Тритон Х-100 и [3H]А2/мин меченых муреиновых саккул (около 10000 имп/мин). Тест-смесь помещали на лед на 15 минут с 100 мкл 1% об./масса N-ацетил-N,N,N-триметиламмония на 15 минут и осажденный материал собирали центрифугированием при 10000 g в течение 15 минут. Радиоактивность супернатанта измеряли жидкостным сцинтилляционным счетом. Растворимую литическую трансгликолазу Slt70 E. coli использовали в качестве положительного контроля для этого анализа; отрицательный контроль состоял из описанного выше раствора теста без фермента.
Все белки, за исключением 919-His дали положительные результаты в этом первом анализе.
Второй анализ регулирует гидролиз поли(MurNAc-GlcNAc)-гликановых цепей. Очищенные цепи, поли (MurNAc-GlcNAc )n>30, меченые N-ацетил-D-1- [3H]-глюкозамином, инкубировали с 3 мкг 919L в 10 мМ Трис-малеате (рН 5,5), 10 мМ MgCl2 и 0,2% об./об. Тритоне Х-100 в течение 30 минут при 37°С. Реакцию останавливали кипячением в течение 5 минут и рН пробы доводили до приблизительно 3,5 добавлением 10 мкл 20% об./об. фосфорной кислоты. Субстрат и продукт разделяли обращенно-фазовой ВЭЖХ на колонке C18 Nucleosil 300, как описано Harz et al. [Anal. Biochem. (1990) 190:120-128]. Литическую трансгликолазу MItA E. coli использовали в качестве положительного контроля в этом анализе. Отрицательный контроль выполняли в отсутствие фермента.
При помощи этого анализа была продемонстрирована способность 919LOrf4 гидролизовать выделенные цепи гликана, когда ангидродисахаридные субъединицы отделяли от олигосахарида посредством ВЭЖХ.
Белок 919Lorf4 был выбран для кинетических анализов. Активность 919Lorf4 усиливалась в 3,7 раза добавлением 0,2% об./об. Тритона Х-100 в тест-буфер. Присутствие Тритона Х-100 не влияло на активность 919немеченого. Влияние рН на ферментативную активность определяли в Трис-малеатном буфере на протяжении диапазона 5,0-8,0. Было определено, что оптимальный рН для этой реакции был 5,5. На протяжении температурного диапазона 18-42°С максимальную активность наблюдали при 37°С. Действие различных ионов на муреингидролазную активность определяли проведением этой реакции в присутствии различных ионов в конечной концентрации 10 мМ. Максимальная активность была обнаружена с Mg2+, который стимулировал активность в 2,1 раза. Mn2+ и Са2+ также стимулировали ферментативную активность до подобной степени, тогда как Ni2+ и ЭДТА не оказывали значимого действия. В противоположность этому, как Fe2+, так и Zn2+, в значительной степени ингибировали ферментативную активность.
Структуры продуктов реакции, происходящих из расщепления немеченого муреиновой саккулы Е. coli, анализировали обращенно-фазовой ВЭЖХ, как описано Glauner [Anal. Biochem. (1988) 172:451-464]. Муреиновые саккулы, расщепленные мурамидазой Cellosyl, использовали для калибровки и стандартизации колонки Hypersil ODS. Главными продуктами реакции были 1,6-ангидродисахарид-тетра- и три-пептиды, демонстрирующие образование внутримолекулярной связи из 1,6-ангидромураминовой кислоты.
Эти результаты экспериментально демонстрируют, что 919 является муреингидролазой и, в частности, членом семейства ферментов литических трансгликолаз. Кроме того, способность 922-His гидролизовать муреиновые саккулы предполагает, что этот белок также является литической трансгликолазой.
Эта активность может объяснить токсические эффекты 919 при экспрессии в Е. coli.
Для устранения ферментативной активности использовали рациональный мутагенез. 907, 919 и 922 обнаруживают довольно низкую гомологию с тремя мембраносвязанными липидированными литическими муреин-трансгликозилазами из Е. coli:
919 (441 аминокислота) на 27,3% идентичен на протяжении перекрывающихся 440 аминокислот с MLTA Е. coli (P46885);
922 (369 аминокислот) на 38,7% идентичен на протяжении 310 перекрывающихся аминокислот MLTB Е. coli (P41052); и
907-2 (207 аминокислот) на 26,8% идентичен на протяжении 149 перекрывающихся аминокислот MLTC Е. coli (P52066).
907-2 имеет гомологию с MLTD E. coli (P23931) и Slt70 (Р03810), растворимой литической трансгликолазой, которая локализована в периплазматическом пространстве. Не удалось обнаружить значимой гомологии среди 919, 922 и 907-2, и то же самое относится к соответствующим белкам MLTA, MLTB и MLTC.
Кристаллические структуры доступны для Slt70 [1QTEA; 1QTEB; Thunnissen et al. (1995) Biochemistry 34:12729-12737] и для Slt35 [1LTM; 1QUS; 1QUT; van Asselt et al. (1999) Structure Fold Des 7:1167-80], который является растворимой формой MLTB 40 кДа.
Каталитический остаток (глутаминовая кислота) был идентифицирован как для Slt70, так и для MLTB.
В случае Slt70 исследования с использованием мутагенеза показали, что даже консервативная замена каталитического Glu505 глутамином (Gln) вызывает полную потерю ферментативной активности. Хотя Slt35 не имеет явного сходства последовательности с Slt70, их каталитические домены обнаруживают удивительное сходство. Соответствующим каталитическим остатком в MLTB является Glu162.
Другим остатком, который, как считается, играет важную роль в правильной укладке ферментативной щели, является очень консервативный глицин (Gly) справа от глутаминовой кислоты. Недавно Terrak et al. [Mol. Microbiol. (1999) 34:350-64] предположили присутствие другого важного остатка, который является ароматической аминокислотой, расположенной на около 70-75 остатков справа от каталитической глутаминовой кислоты. Сопоставление последовательностей Slt70 с 907-2 и MLTB с 922 выполняли для того, чтобы идентифицировать соответствующие каталитические остатки в антигенах MenB.
Два сопоставления в участке каталитического домена представлены ниже:
907-2/Slt70:

922/MLTB
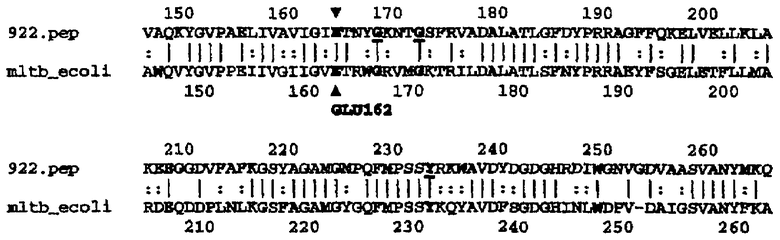
Из этих сопоставлений вытекает, что соответствующий каталитический глутамат в 907-2 является Glu117, тогда как в 922 он является Glu164. Оба антигена имеют также общие глицины справа (по ходу транскрипции), которые могли бы играть структурную роль в укладке ферментативной щели (жирный шрифт), а 922 имеет консервативный ароматический остаток на около 70 аминокислот справа (жирный шрифт).
В случае белка 919 структура 3D является недоступной для его Е. coli-гомологичного MLTA, и ничего неизвестно относительно возможного каталитического остатка. Тем не менее, прогнозируется, что три аминокислоты в 919 являются каталитическими остатками, согласно сопоставлению с MLTA:
919/MLTA

Эти три возможных каталитических остатка показаны символом ▾:
1) Glu255 (Asp в MLTA), затем три консервативных глицина (Gly263, Gly265 и Gly272) и три консервативных ароматических остатка, расположенных на приблизительно 75-77 остатков справа. Эти расположенные справа остатки показаны  .
.
2) Glu323 (консервативные в MLTA), затем 2 консервативных глицина (Gly347 и Gly355) и два консервативных ароматических остатка, расположенных на 84-85 остатков справа (Тyr406 или Phe407). Эти остатки справа показаны ⋄.
3) Asp362 (вместо ожидаемого Glu), затем один глицин (Gly369) и консервативный ароматический остаток (Тrp428). Эти остатки по ходу транскрипции (справа) показаны О.
Сопоставления полиморфных форм 919 описаны в WO 00/66741.
На основе предсказания каталитических остатков были генерированы три мутанта 919 и один мутант 907, содержащие, каждый, единственную замену аминокислоты. Глутаминовые кислоты в положении 255 и 323 и аспарагиновые кислоты в положении 362 белка 919 и глутаминовая кислота в положении 117 белка 907 были заменены остатками глицина при помощи SDM на основе ПЦР. Для этого были сконструированы внутренние праймеры, содержащие замену кодона Glu или Asp на Gly:
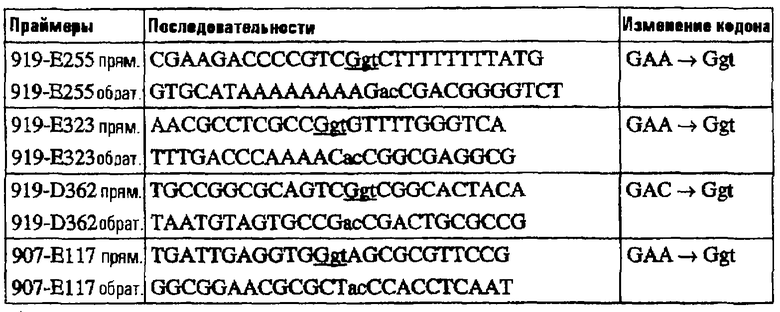
Подчеркнутые нуклеотиды кодируют глицин; мутированные нуклеотиды изображены строчными буквами.
Для получения мутантов 919-Е255, 919-Е323 и 919-Е362 ПЦР выполняли с использованием 20 нг ДНК pET-919LOrf4 в качестве матрицы и следующих пар праймеров:
1) Orf4L прямой/919-Е255 обратный
2) 919-Е255 прямой/919L обратный
3) Orf4L прямой/919-Е323 обратный
4) 919-Е323 прямой/919L обратный
5) Orf4L прямой/919-D362 обратный
6) 919-D362 прямой/919L обратный
Второй раунд ПЦР выполняли с использованием продукта ПЦР 1-2, 3-4 или 5-6 в качестве матрицы и прямого и обратного праймеров "Orf4L прямой" и "919L обратный", соответственно.
Для мутанта 907-Е117 ПЦР выполняли с использованием 200 нг хромосомной ДНК штамма 2996 в качестве матрицы и следующих пар праймеров:
7) 907L прямой/907-Е117 обратный
8) 907-Е117 прямой/907b обратный
Второй раунд ПЦР выполняли с использованием продуктов ПЦР 7 и 8 в качестве матриц и олигонуклеотидов "907L прямой" и "907L обратный" в качестве праймеров.
ПЦР-фрагменты, содержащие каждую мутацию, обрабатывали в соответствии со стандартной процедурой, расщепляли рестриктазами NdeI и XhoI и клонировали в вектор рЕТ-21b+. Присутствие каждой мутации подтверждали секвенированием.
Мутацию Glu117 в Gly в 907 проводили сходным образом с мутацией остатков Glu164, Ser213 и Asn348 в 922.
Мутант E255G 919 обнаруживает 50%-ное уменьшение активности;
мутант E323G обнаруживает 70% уменьшение активности; мутант E362G не обнаруживает уменьшения активности.
Пример 4 - мультимерная форма
287-GST, 919немеченый и 953-His подвергали гель-фильтрации для анализа четвертичной структуры или для препаративных целей. Молекулярную массу природных белков определяли с использованием гель-фильтрационных колонок Суперозы 12 (H/R 10/30) или Супердекса 75 FPLC (жидкостной экспресс-хроматографии белков) (Pharmacia). Буферами, используемыми для хроматографии для 287, 919 и 953 были 50 мМ Трис-HCl (рН 8,0), 20 мМ Бицин (рН 8,5) и 50 мМ Бицин (рН 8,0), соответственно.
Дополнительно каждый буфер содержал 150-200 мМ NaCl и 10% об./об. глицерин. Белки диализовали против подходящего буфера и наносили в объеме 200 мкл. Гель-фильтрацию выполняли с низкой скоростью тока 0,5-2,0 мл/мин и элюат подвергали мониторингу при 280 нм. Фракции собирали и анализировали электрофорезом в ДСН-ПААГ. Краситель декстрановый синий 2000 и стандарты молекулярной массы рибонуклеазу А, химотрипсин А, овальбумин, альбумин (Pharmacia) использовали для калибрования колонки. Молекулярную массу пробы определяли из калибровочной кривой Kav против log Mr стандартов. Перед гель-фильтрацией 287-GST расщепляли тромбином для отщепления GST-части.
Определенные молекулярные массы для 287, 919 и 953-His были равны 73 кДа, 47 кДа и 43 кДа, соответственно. Эти результаты предполагают, что 919 является мономерным, тогда как 287 и 953, каждый, являются димерными по их природе. В случае 953-His, во время гель-фильтрации наблюдали два пика. Основной пик (80%) представлял димерную конформацию 953, тогда как минорный пик (20%) имел ожидаемый размер мономера. Было обнаружено, что мономерная форма 953 имеет более высокую бактерицидную активность, чем димер.
Пример 5 - векторы pSM214 к рЕТ-24b
Белок 953 с его природным лидерным пептидом и без гибридных партнеров экспрессировали из вектора рЕТ, а также из pSM214 [Velati Bellini et al. (1991) J. Biotechnol. 18, 177-192].
Последовательность 953 клонировали в виде полноразмерного гена в рSМ214 с использованием штамма Е. coli ММ294-1 в качестве хозяина. Для этого полную ДНК-последовательность гена 953 (от ATG до СТОП-кодона) амплифицировали при помощи ПЦР с использованием следующих праймеров:
953L прям./2 CCGGAATTCTTATGAAAAAAATCATCTTCGCCGC Eco RI
953L обрат./2 GCCCAAGCTTTTATTGTTTGGCTGCCTCGATT Hind III
которые содержат сайт рестрикции EcoRI и HindIII, соответственно. Амплифицированный фрагмент расщепляли EcoRI и HindIII и лигировали с вектором рSМ214, расщепленным теми же двумя ферментами. Лигированную плазмиду трансформировали в клетки Е. coli MM294-1 (инкубированием на льду в течение 65 минут при 37°С) и бактериальные клетки высевали на LB-агар, содержащий 20 мкг/мл хлорамфеникола.
Рекомбинантные колонии выращивали в течение ночи при 37°С в 4 мл LB-бульона, содержащего 20 мкг/мл хлорамфеникола;
бактериальные клетки центрифугировали и плазмидную ДНК экстрагировали и анализировали рестрикцией EcoRI и HindIII. Для анализа способности рекомбинантных колоний экспрессировать белок их инокулировали в LB-бульон, содержащий 20 мкг/мл хлорамфеникола, и давали им расти в течение 16 часов при 37°С. Бактериальные клетки центрифугировали и ресуспендировали в ЗФР. Экспрессию белка анализировали при помощи электрофореза в ДСН-ПААГ и окрашивания Кумасси синим.
Уровни экспрессии из плазмиды рSМ214 были неожиданно высокими.
Олигонуклеотиды, использованные для клонирования последовательностей в векторы рSМ214, были следующими:

Эти последовательности подвергали манипуляции, клонировали и экспрессировали, как описано для 953L.
Для вектора рЕТ-24 последовательности клонировали и белки экспрессировали в рЕТ-24, как описано ниже для рЕТ21. рЕТ2 имеет такую же последовательность, что и рЕТ-21, но с кассетой устойчивости к канамицину вместо кассеты устойчивости к ампициллину.
Олигонуклеотиды, использованные для клонирования последовательностей в вектор рЕТ-24b, были следующими:

* Этот праймер использовали в качестве обратного праймера для всех форм 287.
§ Прямые праймеры, используемые в комбинации с обратным праймером ΔG278
Пример 6 - ORF1 и его лидерный пептид
Предсказано, что ORF1 из N. meningitidis (серологическая группа В, штамм МС58) является белком наружной мембраны или секретируемым белком. Он имеет следующую последовательность:


Лидерный пептид подчеркнут.
Полиморфная форма ORF1 описана в WO 99/55873.
Три стратегии экспрессии использовали для ORF1:
1) ORF1 с использованием His-метки, согласно WO 99/24578 (ORF1-His);
2) ORF1 с его собственным лидерным пептидом, но без какого-либо гибридного партнера ('ORF1L'); и
ORF1 с лидерным пептидом (MKKTAIAIAVALAGFATVAQA) из OmpA E. coli ('OrflLOmpA'):

Для получения этой конструкции клон pET911LOmpA (см. ниже) расщепляли рестриктазами NheI и XhoI и фрагмент, соответствующий вектору, несущему лидерную последовательность OmpA, очищали (pETLOmpA). Ген ORF1, кодирующий зрелый белок, амплифицировали с использованием олигонуклеотидов ORF1-For (прямой) и ORF1-Rev (обратный) (включающие сайты рестрикции NheI и XhoI, соответственно), расщепляли Nhel и XhoI и лигировали с очищенным фрагментом pETOmpA (см. фигуру 1). С использованием сайта Nhel вводили дополнительный дипептид AS.
Экспрессировали все три формы этого белка. His-меченый белок мог быть очищен, и было подтверждено, что он экспонирован на поверхности и, возможно, является секретируемым (см. фигуру 3). Этот белок использовали для иммунизации мышей, и полученные сыворотки давали превосходные результаты в бактерицидном тесте.
ORF1LOmpA очищали в виде тотальных мембран, и он был локализован как во внутренних, так и в наружных мембранах. Неожиданно, сыворотки, индуцированные против ORF1LOmpA, обнаруживают даже еще более хорошие свойства в ELISA и бактерицидные свойства, чем сыворотки, индуцированные против His-меченого белка.
ORF1L очищали в виде наружных мембран, в которых он локализован.
Пример 7 - белок 911 и его лидерный пептид
Белок 911 из N. meningitidis (серологическая группа В, штамм МС58) имеет следующую последовательность:

Лидерный пептид подчеркнут.
Три стратегии экспрессии использовали для 911:
1) 911 с его собственным лидерным пептидом, но без какого-либо гибридного партнера ('911L');
2) 911 с лидерным пептидом из OmpA Е. coli ('911LOmpA').
Для получения этой конструкции полную последовательность, кодирующую лидерный пептид OmpA, включали в 5'-праймер в виде хвоста (праймер 911LOmpA прямой). Сайт рестрикции NheI встраивали между последовательностью, кодирующей лидерный пептид OmpA, и геном, кодирующим предсказанный зрелый белок (встраивание одной аминокислоты, серина), чтобы эта конструкция могла быть использована для клонирования различных генов, находящихся справа от последовательности лидерного пептида OmpA.
3) 911 с лидерным пептидом (MKYLLPTAAAGLLLAAQPAMA) из PelB Erwinia carotovora ('911LpelB').
Для получения этой конструкции 5'-конец ПЦР-праймера конструировали справа от лидерной последовательности и включали сайт рестрикции NcoI, чтобы иметь 911, гибридизованный непосредственно с лидерной последовательностью PelB; 3'-концевой праймер включал СТОП-кодон. Экспрессирующим вектором был pET22b+ (Novagen), который несет кодирующую последовательность для лидерного пептида PelB. Сайт NotI вводит дополнительный метионин после последовательности PelB.
Экспрессировали все три формы этого белка. Титры ELISA были наивысшими при применении 911L, причем 919LOmpA также давал хорошие результаты.
Пример 8 - ORF46
Полный белок ORF46 из N. meningitidis (серологическая группа В, штамм 2996) имеет следующую последовательность:

Лидерный пептид подчеркнут.
Последовательности ORF46 из других штаммов предсталены в WO 00/66741.
Три стратегии экспрессии использовали для ORF46:
1) ORF46 с его собственным лидерным пептидом, но без какого-либо гибридного партнера ('ORF46-2L');
2) ORF46 без его лидерного пептида и без какого-либо гибридного партнера ('ORF46-2'), причем лидерный пептид исключали конструированием 5'-концевого праймера амплификации справа от предсказанной лидерной последовательности:

3) ORF46 в виде укороченного белка, состоящего из первых 433 аминокислот ('ORF46.1L'), сконструированный образованием ПЦР-праймеров для амплификации частичной последовательности, соответствующей аминокислотам 1-433. В 3'-концевые последовательности праймера включали СТОП-кодон.
ORF46-2L экспрессируется при очень низком уровне в Е. coli. Удаление его лидерного пептида (ORF46-2) не решает этой проблемы. Однако укороченная форма ORF46.1L (первые 433 аминокислоты, которые являются консервативными между серологическими группами и видами) экспрессируется хорошо и дает превосходные результаты в тесте ELISA и в бактерицидном тесте.
ORF46.1 использовали также на основе гибридных белков. Его гибридизовали с 287, 919 и ORF1. Гибридные белки были обычно нерастворимыми, но давали в некоторой степени хорошие результаты в ELISA и в бактерицидном тесте (против гомологичного штамма 2996):
Для сравнения, конструировали "тройные" гибриды ORF46.1, 287 (либо в виде GST-гибрида, либо в форме ΔG287) и 919 и тестировали их против различных штаммов (в том числе гомологичного штамма 2996) в сравнении с простой смесью этих трех антигенов. FCA (полный адъювант Фрейнда) использовали в качестве адъюванта:
И в этом случае эти гибриды обнаруживают эквивалентную или превосходящую иммунологическую активность.
Гибриды двух белков (штамма 2996) сравнивали с индивидуальными белками против различных гетерологичных штаммов:
Опять гибрид обнаруживает эквивалентную или превосходящую иммунологическую активность.
Пример 9 - белок 961
Полный белок 961 из N. meningitidis (серологическая группа В, штамм МС58) имеет следующую последовательность:

Лидерный пептид подчеркнут.
Использовали три подхода к экспрессии 961:
1) 961, использующий GST-гибрид, согласно WO 99/57280 ('GST961');
2) 961 с его собственным лидерным пептидом, но без какого-либо гибридного партнера ('961L'); и
3) 961 без его лидерного пептида и без какого-либо гибридного партнера ('961немеченный'), причем лидерный пептид исключен конструированием 5'-концевого ПЦР-праймера справа от предсказанной лидерной последовательности.
Экспрессировались все три формы белка. GST-гибридный белок мог быть очищен, и с антителами против него было подтверждено, что 961 экспонирован на поверхности (фигура 4). Этот белок использовали для иммунизации мышей, и полученные сыворотки дали превосходные результаты в бактерицидном тесте. 961L мог быть также очищен и давал очень высокие титры ELISA.
Оказалось, что белок 961 является вариабельным в отношении фазы. Кроме того, он обнаруживается не во всех штаммах N. meningitidis.
Пример 10 - белок 287
Белок 287 из N. meningitidis (серологическая группа В, штамм 2996) имеет следующую последовательность:

Лидерный пептид подчеркнут.
Последовательности 287 из других штаммов могут быть найдены на фигурах 5 и 15 WO 00/66741.
Пример 9 WO 99/57280 описывает экспрессию 287 в виде GST-гибрида в Е. coli.
Использовали ряд дополнительных подходов для экспрессии 287 в Е. coli, в том числе:
1) 287 в виде His-меченого гибрида ('287-His');
2) 287 с его собственным лидерным пептидом, но без какого-либо гибридного партнера ('287L');
3) 287 с лидерным пептидом ORF4 и без какого-либо гибридного партнера ('287LOrf4'); и
287 без его лидерного пептида и без какого-либо гибридного партнера ('287немеченый'):

Все эти белки можно было экспрессировать и очистить. '2871' и '287LOrf4' были подтверждены как липопротеины.
Как показано на фигуре 2, '287LOrf4' конструировали расщеплением 919LOrf4 NheI и XhoI. Полный лидерный пептид ORF4 восстанавливали добавлением ДНК-последовательности, кодирующей отсутствующие аминокислоты, в виде хвоста в 5'-концевой праймер (287LOrf4 прямой), гибридизованный с кодирующей 287 последовательностью. Ген 287, кодирующий зрелый белок, амплифицировали с использованием олигонуклеотидов 287LOrf4 (прямого и обратного) (включающих в себя сайты NheI и XhoI, соответственно), расщепляли NheI и XhoI и лигировали с очищенным фрагментом pETOrf4.
Пример 11 - дополнительные негибридные белки с природными лидерными пептидами или без природных лидерных пептидов
Сходный подход использовали для экспрессии в Е. coli дополнительных белков из WO 99/24578, WO 99/36544 и WO 99/57280.
Следующие белки экспрессировали без гибридного партнера: 008, 105, 117-1, 121-1, 122-1, 128-1, 148, 216, 243, 308, 593, 652, 726, 982 и Orf143-1. При помощи FACS было подтверждено, что белок 117-1 экспонирован на поверхности, и он давал высокие титры в ELISA.
Следующие белки экспрессировали с природным лидерным пептидом, но без гибридного партнера: 111, 149, 206, 225-1, 235, 247-1, 274, 283, 286, 292, 401, 406, 502-1, 503, 519-1, 525-1, 552, 556, 557, 570, 576-1, 580, 583, 664, 759, 907, 913, 920-1, 926, 936-1, 953, 961, 983, 989, Orf4, Orf7-1, Orf9-1, Orf23, Orf25, Orf37, Orf38, Orf40, Orf40.1, Orf40.2, Orf72-1, Orf76-1, Orf85-2, Orf91, Orf97-1, Orf119, Orf143.1. Эти белки имеют суффикс 'L'.
His-меченый белок 760 экспрессировали с его лидерным пептидом и без его лидерного пептида. Делеция сигнального пептида значительно увеличивала уровни экспрессии. Этот белок мог быть очищен наиболее легко с использованием 2 М мочевины для солюбилизации.
His-меченый белок 264 хорошо экспрессировался с использованием его собственного сигнального пептида, и белок 30 кДа давал положительные результаты в Вестерн-блот-анализе.
Все белки успешно экспрессировались.
Была подтверждена локализация 593, 121-1, 128-1, 593, 726 и 982 в цитоплазме.
Была подтверждена локализация 920-1L, 953L, ORF9-1L, ORF85-2L, ORF97-1L, 570L, 580L и 664L в периплазме.
Было подтверждено, что ORF40L локализован в наружной мембране, а 008 и 519-1L локализованы во внутренней мембране. Белки ORF25L, ORF4L, 406L, 576-1L, как было подтверждено, локализованы в мембране.
Было обнаружено, что белок 206 не является липопротеином.
ORF25 и ORF40, экспрессированные с их природными лидерными пептидами, но без гибридных партнеров, и белок 593, экспрессированный без его природного лидерного пептида и без гибридного партнера, индуцировали хорошие бактерицидные сыворотки. Неожиданно, формы ORF25 и ORF40, экспрессированные без гибридных партнеров и с использованием их собственных лидерных пептидов (т.е. 'ORF25L' и 'ORF40'), дают лучшие результаты в бактерицидном тесте, чем гибридные белки.
Белки 920L и 953L подвергали N-концевому секвенированию с получением HRVWVETAH и ATYKVDEYHANARFAF, соответственно. Это секвенирование подтверждает, что предсказанные лидерные пептиды отщеплялись, и, при сочетании с периплазматической локализацией, это подтверждает, что эти белки точно процессировались и локализовались Е. coli при экспрессии от их природных лидерных пептидов.
N-концевая последовательность белка 519.1L, локализованная во внутренней мембране, была MEFFIILLA, что указывает на то, что лидерная последовательность не отщеплена. Таким образом, она может функционировать как в виде неотщепленной лидерной последовательности, так и в виде трансмембранного якоря, подобно лидерному пептиду РВР1 из N. gonorrhoeae [Ropp and Nicholas (1997) J. Bact. 179:2783-2787]. Действительно, N-концевой участок проявляет сильный гидрофобный характер и, как предсказано программой Tmpred., является трансмембранным.
Пример 12 - липопротеины
Включение пальмитата в рекомбинантные липопротеины демонстрировали при помощи способа Kraft et al. [J. Bact. (1998) 180:3441-3447]. Отдельные колонии, несущие представляющую интерес плазмиду, выращивали в течение ночи при 37°С в 20 мл жидкой культуры в LB/Амп (100 мкг/мл). Культуру разбавляли до OD550 0,1 в 5,0 мл свежей среды LB/Амп, содержащей 5 мкКи/мл [3H]пальмитата (Amersham). Когда OD550 этой культуры достигала 0,4-0,8, рекомбинантный липопротеин индуцировали в течение 1 часа IPTG (изопропилтиогалактозидом) (конечная концентрация 1,0 мМ). Бактерии собирали центрифугированием в настольной центрифуге при 2700 g в течение 15 минут и промывали дважды 1,0 мл холодного ЗФР. Клетки ресуспендировали в 120 мкл 20 мМ Трис-HCl (рН 8,0), 1 мМ ЭДТА, 1,0% масса/объем ДСН и лизировали кипячением в течение 10 минут. После центрифугирования при 13000 g в течение 10 минут супернатант собирали, белки осаждали добавлением 1,2 мл холодного ацетона и оставляли на 1 час при -20°С. Белок осаждали центрифугированием при 13000 g в течение 10 минут и ресуспендировали в 20-50 мкл (как рассчитано для стандартизации нанесения в отношении конечной OD культуры) 1,0% масса/объем ДСН. Аликвоту 15 мкл кипятили с 5 мкл буфера для проб электрофореза в ДСН-ПААГ и анализировали при помощи электрофореза в ДСН-ПААГ. После электрофореза гели фиксировали в течение 1 часа в 10% об./об. уксусной кислоте и пропитывали в течение 30 минут в растворе Amplify (Amersham). Гель сушили в вакууме при нагревании и экспонировали на пленке Hyperfilm (Kodak) в течение ночи при -80°С.
Включение [3H] пальмитатной метки, подтверждающей липидирование, было обнаружено для следующих белков: Orf4L, Orf25L, 287L, 287LOrf4, 406L, 576L, 926L, 919L и 919LOrf4.
Пример 13 - домены в 287
На основе гомологии различных участков 287 с белками, которые принадлежат к различным функциональнным классам, его делили на три "домена", как показано на фигуре 5. Второй домен обнаруживает гомологию с протеазами IgA, а третий домен обнаруживает гомологию с трансферринсвязывающими белками.
Каждый из трех "доменов" обнаруживает различную степень консервативности последовательности между штаммами N. meningitidis - домен С идентичен на 98%, домен А идентичен на 83%, тогда как домен В идентичен только на 71%. Следует отметить, что белок 287 в штамме МС58 является на 61 аминокислоту более длинным, чем белок 287 штамма 2996. Сопоставление этих двух последовательностей показано на фигуре 7, а сопоставления для различных штаммов описаны в WO 00/66741 (см. фигуры 5 и 15 этой заявки).
Эти три домена экспрессировали индивидуально в виде His-меченых на С-конце белков. Это выполняли для штаммов МС58 и 2996 с использованием следующих конструкций: 287а-МС58 (аа 1-202), 287b-MC58 (aa 203-288), 287с-МС58 (аа 311-488).
287а-2996 (аа 1-139), 287b-2996 (аа 140-225), 287с-299б (аа 250-427), (аа = аминокислоты).
Для получения этих конструкций в 3'-концевом праймере удаляли последовательность стоп-кодона. 5'-праймеры включали сайт рестрикции Nhel, а 3'-праймеры включали XhoI в виде хвоста, для направления клонирования каждого амплифицированного фрагмента в экспрессирующий вектор рЕТ21b+ с использованием сайтов рестрикции NdeI-XhoI, NheI-XhoI или NdeI-HindIII.
Все шесть конструкций могли быть экспрессированы, но конструкция 287b-MC58 требовала денатурации и повторной укладки для солюбилизации.
Делеция домена А описана ниже ('Δ4 287-His').
Иммунологические данные (сывороточный бактерицидный анализ) были также получены с использованием различных доменов из штамма 2996 против гомологичных и гетерологичных штаммов MenB, а также MenA (штамма F6124) и MenC (штамма BZ133):
С использованием доменов штамма МС58 получали следующие результаты:
Пример 14 - делеции в 287
Кроме экспрессии индивидуальных доменов, 287 также экспрессировали (в виде меченого на С-конце His-меткой белка) с получением прогрессирующих делеций в первом домене.
Использовали четыре делеционных мутанта белка 287 из штамма 2996 (фигура 6):
1) '287-His', состоящий из аминокислот 18-427 (т.е. с делегированным лидерным пептидом);
2) 'Δ1 287-His', состоящий из аминокислот 26-427;
3) 'Δ2 287-His', состоящий из аминокислот 70-427;
4) 'Δ3 287-His', состоящий из аминокислот 107-427; и
5) 'Δ4 287-His', состоящий из аминокислот 140-427 (=287-bc).
Белок 'Δ4' получали также для штамма МС58 ('Δ4 287МС58-His"; аминокислоты 203-488).
Эти конструкции получали таким же образом, как 287а/b/с, как описано выше.
Все шесть конструкций могли экспрессироваться и белок мог быть очищен. Однако экспрессия 287-His была очень слабой.
Экспрессия была также высокой при отсутствии С-концевых His-меток.
Иммунологические данные (сывороточный бактерицидный анализ) были также получены с использованием этих делеционных мутантов против гомологичного (2996) и гетерологичных штаммов MenB, а также MenA (штамма F6124) и MenC (штамма BZ133):
Такую же высокую активность для Δ4-делеции наблюдали с использованием последовательности из штамма МС58.
Таким образом, обнаруживая превосходящие характеристики экспрессии, эти мутанты являются также иммунологически эквивалентными или превосходящими.
Пример 15 - полиглициновые делеции
Конструкция 'Δ1 287-His' предыдущего примера отличается от 287-His и от '287немеченого, только короткой N-концевой делецией (GGGGGGS). Однако использование экспрессирующего вектора, который заменяет делегированный серин кодоном, присутствующим в клонирующем сайте NheI, приводит к делеции только (Gly)6. Таким образом, было показано, что эта (Gly)6-последовательность оказывает очень сильное действие на экспрессию белка.
Белок, лишенный N-концевых аминокислот вплоть до GGGGGG, называют "ΔG287". В штамме МС58 его основная последовательность (лидерный пептид подчеркнут) представлена ниже:

ΔG287, с His-меткой или без His-метки ('ΔG287-His' и 'ΔG287K', соответственно), экспрессируется на очень хороших уровнях в сравнении с '287-His' или '287немеченым'.
На основании данных по вариабельности генов, варианты ΔG287-His экспрессировали в Е. coli из ряда штаммов MenB, в частности из штаммов 2996, МС58, 1000 и BZ232. Результаты также были хорошими.
Было сделано предположение, что поли-Gly-делеция может быть основной стратегией для улучшения экспрессии. Таким образом, были идентифицированы другие липопротеины MenB, содержащие подобные (Gly)n-мотивы (вблизи N-конца, справа от цистеина), а именно Tbp2 (NMB0460), 741 (NMB1870) и 983 (NMB1969):

Гены Tbp2 и 741 были из штамма МС58; гены 983 и 287 были из штамма 2996. Их клонировали в вектор рЕТ и экспрессировали в Е. coli без последовательности, кодирующей их лидерные пептиды, или в виде "ΔG-форм", в обоих случаях гибридизованных с С-концевой His-меткой. В каждом случае наблюдали один и тот же эффект - экспрессия была хорошей в клонах, несущих делецию полиглицинового участка, и слабой или отсутствующей, если глицины присутствовали в экспрессируемом белке:
Электрофорез в ДСН-ПААГ показан на фигуре 13.
ΔG287 и гибриды
Белки ΔG287 получали и очищали для штаммов МС58, 1000 и BZ232. Каждый из них давал высокие титры в ELISA, а также сывороточные бактерицидные титры >8192. ΔG287K, экспрессируемый из рЕТ-24b, давал превосходные титры в ELISA и в сывороточном бактерицидном тесте. ΔG287-ORF46.1К может также экспрессироваться в рЕТ-24b.
ΔG287 гибридизовали также в рамке считывания слева (против хода транскрипции) 919, 953, 961 (последовательности, показанные ниже) и ORF46.1:



Бактерицидную эффективность (гомологичного штамма) антител, индуцированных против гибридных белков, сравнивали с антителами, индуцированными против простых смесей составляющих антигенов (с использованием 287-GST) для 919 и ORF46.1:
Получали также данные бактерицидной активности против гетерологичных штаммов MenB и против серотипов А и С:
Таким образом, гибридные белки с ΔG287 на N-конце превосходят иммунологически простые смеси, причем ΔG287-ORF46.1 является особенно эффективным, даже против гетерологичных штаммов. ΔG287-ORF46.1К может экспрессироваться в рЕТ-24b.
Такие же гибридные белки получали с использованием новозеландского штамма 394/98, а не 2996:



ΔG983 и гибриды
Бактерицидные титры, получаемые в ответ на ΔG983 (His-гибрид), измеряли против различных штаммов, в том числе гомологичного штамма 2996:
ΔG983 экспрессировали также в виде гибрида с ORF46.1, 741, 961 или 961с на его С-конце:






ΔG741 и гибриды
Бактерицидные титры, получаемые в ответ на ΔG741 (His-гибрид), измеряли против различных штаммов, в том числе гомологичного штамма 2996:
Как можно видеть, индуцированный ΔG741 бактерицидный титр является особенно высоким против гетерологичного штамма МС58.
ΔG741 гибридизовали также непосредственно в рамке считывания слева с белками 961, 961с, 983 и ORF46.1.




Пример 16 - С-концевые гибриды ('слияния') с 287/ΔG287
Согласно данному исследованию, гибриды двух белков А и В могут быть либо NH2-A-B-COOH, либо NH2-B-A-COOH. Эффект этого различия исследовали с использованием белка 287 либо в виде С-конца (в форме '287-His'), либо в виде N-конца (в форме ΔG287 - последовательности показаны выше) с 919, 953 и ORF46.1. Использовали панель штаммов, в том числе гомологичный штамм 2996. FCA использовали в качестве адъюванта:
Лучшие бактерицидные титры обычно наблюдали с 287 на N-конце (в ΔG-форме).
При гибридизации с белком 961 (NH2-ΔG287-961-COOH - последовательность, показанная выше) полученный белок является нерастворимым и должен денатурироваться и ренатурироваться для очистки. Было обнаружено, что после ренатурации около 50% этого белка оставались нерастворимыми. Растворимые и нерастворимые белки сравнивали и гораздо лучшие бактерицидные титры получали с растворимым белком (с использованием FCA в качестве адъюванта):
Однако титры с нерастворимой формой улучшались с использованием квасцов в качестве адъюванта:
Пример 17 - N-концевые гибриды ('слияния') с 287
Экспрессия белка 287 в виде полноразмерного белка с С-концевой His-меткой или без его лидерного пептида, но с С-концевой His-меткой дает довольно низкие уровни экспрессии. Лучшая экспрессия достигается с использованием N-концевого GST-гибрида.
В качестве альтернативы использованию GST в качестве N-концевого гибридного партнера, 287 помещали на С-конце белка 919 ('919-287'), белка 953 ('953-287') и белков ORF46.1 ('ORF46.1-287'). В обоих случаях лидерные пептиды были делегированы и гибриды были прямыми гибридами в рамке считывания.
Для генерирования гибрида 953-287 лидерные пептиды этих двух белков удаляли конструированием прямого праймера по ходу транскрипции (справа) от лидера каждой последовательности; последовательность стоп-кодона удаляли в обратном праймере 953, но включали в обратный праймер 287. Для гена 953 5' и 3' праймеры, использованные для амплификации, включали сайты рестрикции NdeI и BamHI, соответственно, тогда как для амплификации гена 287 5' и 3' праймеры включали сайты рестрикции BamHI и XhoI, соответственно. Таким путем могло достигаться последовательное направленное клонирование этих двух генов в рЕТ21b+, с использованием NdeI-BamHI (для клонирования первого гена) и затем BamHI-XhoI (для клонирования второго гена).
Гибрид 919-287 получали клонированием последовательности, кодирующей зрелую часть 287, в сайт XhoI на 3'-конце 919-His-клона в рЕТ21b+. Праймеры, используемые для амплификации гена 287, конструировали введением сайта рестрикции SalI при 5'- и сайта XhoI при 3'-конце этого ПЦР-фрагмента. Поскольку липкие концы, продуцируемые рестриктазами SalI и XhoI, являются совместимыми, ПЦР-продукт 287, расщепленный SalI-XhoI, мог быть встроен в клон рЕТ21b-919, расщепленный XhoI.
Гибрид ORF46.1-287 получали сходным образом. Бактерицидную активность (против гомологичного штамма) антител, индуцированных против гибридных белков, сравнивали с антителами, индуцированными против простых смесей составляющих антигенов:
Получали также данные бактерицидной активности против гетерологичных штаммов MenB и против серотипов А и С для 919-287 и 953-287:
Конструировали также гибриды ORF46.1 и 919. Наилучшие результаты (в четыре раза более высокие титры) были достигнуты с 919 на N-конце.
Испытывали также гибриды 919-519His, ORF97-225His и 225-ORF97His. Они дали умеренные титры ELISA и умеренные бактерицидные гуморальные ответы.
Пример 18 - лидерный пептид из OKF4
Как показано выше, лидерный пептид ORF4 может быть гибридизован со зрелой последовательностью других белков (например, белков 287 и 919). Он способен регулировать липидирование в Е. coli.
Пример 19 - домены в 564
Белок '564' является очень большим (2073 аминокислоты), и его трудно клонировать и экспрессировать в его полной форме. Для облегчения экспрессии этот белок делили на четыре домена, как показано на фигуре 8 (в соответствии с последовательностью МС58):
Эти домены обнаруживают следующие гомологии:
- Домен А обнаруживает гомологию с другими бактериальными токсинами:
gb|AAG03431.|АЕ004443_9 предполагаемый гемагглютинин [Pseudomonas aeruginosa] (38%)
gb|AAC31981.1I(139897) HecA [Pectobacterium chrysanthemi] 45% emb|CAA36409.1|(х52156) нитевидный гемагглютинин [Bordetella pertussis] (31%)
gb|AAC79757.1|(AF057695) большой белок 1 супернатанта [Haemophilus ducreyi] (26%)
gb|AAA25657.1 I(M30186) предшественник HpmA [Proteus mirabilis] (29%)
- Домен В не обнаруживает гомологии и является специфическим для 564.
- Домен С обнаруживает гомологию с:
gb|AAF84995.1|АЕ004032 НА-подобный секретируемый белок [Xylella fastidiosa] (33%)
gb|AAG05850.1|AE004673 гипотетический белок [Pseudomonas aeruginosa] (27%)
gb|AAF68414.1 AF237928 предполагаемый FHA [Pasteurella multocisida] (23%)
gb|AAC79757.1|(AF057695) большой белок 1 супернатанта [Haemophilus ducreyi] (23%)
pir||S21010 предшественник FHA В [Bordetella pertussis] (20%)
- Домен D обнаруживает гомологию с другими бактериальными токсинами:
gb|AAF84995.1|АЕ004032 14 НА-подобный секретируемый белок [Xylella fastidiosa] (29%)
С использованием последовательности штамма МС58 получали хорошую внутриклеточную экспрессию белка 564аb в форме GST-гибрида (без очистки) и His-меченого белка; эта пара доменов экспрессировалась также в виде липопротеинов, которые показали умеренную экспрессию во фракции наружных мембран/супернатанта.
Домен b обнаруживал умеренную внутриклеточную экспрессию при экспрессии в виде His-меченого продукта (без очистки) и хорошую экспрессию в виде GST-гибрида.
Домен с обнаруживал хорошую внутриклеточную экспрессию в виде GST-гибрида, но был нерастворимым. Домен d обнаруживал умеренную внутриклеточную экспрессию в виде His-меченого продукта (без очистки). Пара доменов cd обнаруживала умеренную внутриклеточную экспрессию (без очистки) в виде GST-гибрида.
Хорошие титры в бактерицидном анализе наблюдали с использованием домена с и пары доменов bc.
Пример 20 - лидерный пептид 919
20-мерный лидерный пептид из 919 обсуждается в примере 1 выше:
MKKYLFRAAL YGIAAAILAA
Как показано в примере 1, делеция этого лидера улучшает гетерологичную экспрессию, как и замена лидерным пептидом ORF4. Влияние лидера 919 на экспрессию исследовали гибридизацией этой кодирующей последовательности с репортерным геном PhoC из Morganella morganii [Thaller et al. (1994) Microbiology 140:1341-1350]. Эту конструкцию клонировали в плазмиду рЕТ21-b между сайгами NdeI и XhoI (фигура 9):

Уровень экспрессии PhoC из этой плазмиды является более, чем в 200 раз более низким, чем для той же самой конструкции, но содержащей природный сигнальный пептид PhoC. Тот же самый результат получали даже после замены промотора Т7 промотором Plac Е. coli. Это означает, что влияние лидерной последовательности 919 на экспрессию не зависит от используемого промотора.
Для исследования, обусловлены ли наблюдаемые результаты некоторой особенностью нуклеотидной последовательности сигнального пептида 919 (образованием вторичной структуры, чувствительностью к РНКазам и т.д.) или нестабильностью белка, индуцированной присутствием этого сигнального пептида, получали ряд мутантов. Используемым подходом была замена нуклеотидов последовательности сигнального пептида 919 клонированием синтетических линкеров, содержащих вырожденные кодоны. Таким путем получали мутанты с заменами нуклеотидов и/или аминокислот.
Использовали два различных линкера, сконструированных для продуцирования мутаций в двух различных участках последовательности сигнального пептида 919, в первых 19 п.н. (L1) и между основаниями 20-36 (S1).

Сопоставление некоторых полученных мутантов дается ниже.
L1-мутанты:

S1-мутанты:

Как показано в сопоставлениях этих последовательностей, большинство анализируемых мутантов содержат в рамке считывания делеции, которые неожиданно продуцируются клетками-хозяевами.
Отбор мутантов выполняли трансформацией клеток Е. coli BL21(DE3) с использованием ДНК, полученной из смеси мутированных клонов L1 и S1. Отдельные трансформанты подвергали скринингу на высокую активность PhoC, высевая их штрихом на LB-чашки, содержащие 100 мкг/мл ампициллина, 50 мкг/мл метилового зеленого, 1 мг/мл ФДФ (фенолфталеиндифосфата). На этой среде продуцирующие PhoC клетки становились зелеными (фигура 10).
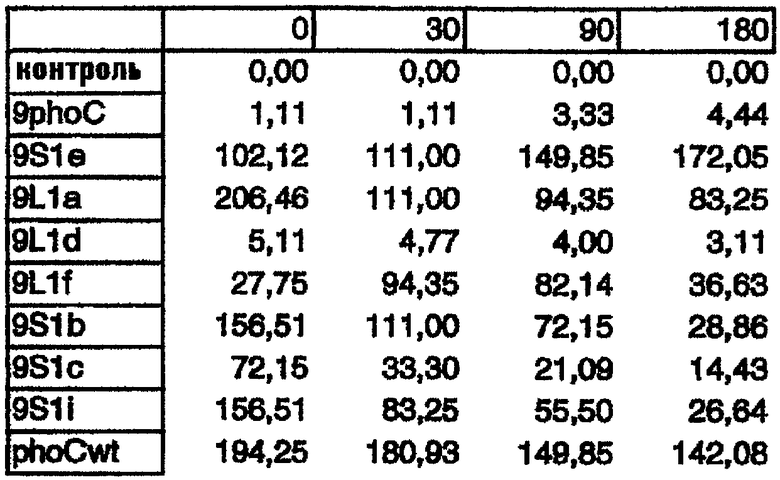
Количественный анализ PhoC, продуцируемого этими мутантами, проводили в жидкой среде с использованием pNPP в качестве субстрата для активности PhoC. Удельные активности, измеренные в клеточных экстрактах и супернатантах мутантов, выращеных в жидкой среде в течение 0, 30, 90, 180 минут были следующими:
КЛЕТОЧНЫЕ ЭКСТРАКТЫ
СУПЕРНАТАНТЫ
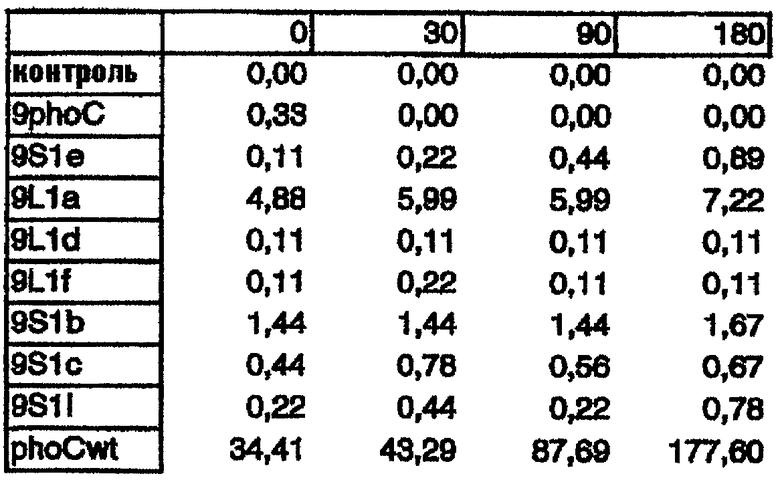
Некоторые из этих мутантов продуцируют высокие количества PhoC, и, в частности, мутант 9L1a может секретировать PhoC в культуральную среду. Это заслуживает внимания, так как последовательность сигнального пептида этого мутанта имеет длину всего лишь 9 аминокислот. Это самый короткий сигнальный пептид, описанный до настоящего времени.
Пример 21 - С-концевые делеции Maf-родственных белков
MafB-родственные белки включают 730, ORF46 и ORF29.
Белок 730 из МС58 имеет следующую последовательность:

Лидерный пептид подчеркнут.
730 обнаруживает свойства, сходные с ORF46 (см. пример 8 выше):
- как и для Orf46, консервативность последовательности 730 среди MenB, MenA и гонококка является высокой (>80%) только для N-концевой части. С-конец, от ˜340, является высокодивергентным
- его предсказанная вторичная структура содержит гидрофобный сегмент, простирающийся на центральный участок молекулы (аминокислоты 227-247).
- экспрессия полноразмерного гена в Е. coli дает очень низкие выходы белка. Экспрессия из меченых или немеченых конструкций, где последовательность сигнального пептида элиминирована, оказывает токсическое действие на клетки-хозяева. Другими словами, присутствие полноразмерного зрелого белка в цитоплазме является высокотоксичным для клетки-хозяина, тогда как его транслокация в перплазму (опосредуемая сигнальным пептидом) не оказывает детектируемого влияния на жизнеспособность клеток. Эта "внутриклеточная токсичность" 730 является особенно высокой, так как клоны для экспрессии безлидерного 730 могут быть получены только при очень низкой частоте с использованием генетического фона recA (штаммы Е. coli: НВ101 для клонирования; HMS174(DE3) для экспрессии).
Для преодоления этой токсичности для 730 использовали подход, сходный с подходом, описанным в примере 8 для.ОRF46. Получали четыре укороченные на С-конце формы, каждая из которых хорошо экспрессировалась. Все эти формы получали из внутриклеточной экспрессии His-меченого безлидерного 730.
Форма А состоит из N-концевого гидрофильного участка зрелого белка (аминокислоты 28-226). Ее очищали в виде растворимого His-меченого продукта, имеющего более высокую молекулярную массу, чем ожидалось.
Форма В простирается до конца участка, консервативного между серологическими группами (аминокислоты 28-340). Ее очищали в виде нерастворимого His-меченого продукта.
Укороченные на С-конце формы, названные С1 и С2, получали после скрининга на клоны, экспрессирующие высокие уровни 730-His-клонов в штамме HMS174(DE3). Вкратце, плазмиду рЕТ21b, содержащую His-меченую последовательность, кодирующую полноразмерный зрелый белок 730, использовали для трансформации штамма recA HMS174(DE3). При низкой частоте получали трансформанты, которые обнаружили два фенотипа: большие колонии и очень мелкие колонии. Несколько больших и малых колоний анализировали на экспрессию клона 730-His. Только клетки из больших колоний сверхэкспрессировали белок, узнаваемый антителами против 730-А. Однако белок, сверхэкспрессируемый в различных клонах, обнаружил различия в молекулярной массе. Секвенирование двух из этих клонов обнаружило, что в обоих случаях происходила интеграция IS-последовательности Е. coli в последовательности, кодирующей С-концевой участок 730. Два события интеграции продуцировали гибридизацию в рамке считывания с 1 дополнительным кодоном в случае С1 и 12 дополнительными кодонами в случае С2 (фигура 11). Полученные "мутантные" формы 730 имеют следующие последовательности:
730-C1 (обусловленная инсерцией IS1 - фигура 11А)

Дополнительная аминокислота, продуцируемая этим встраиванием, подчеркнута.
730-C2 (обусловленная инсерцией IS5 - фигура 11В)

Дополнительные аминокислоты, продуцируемые инсерцией, подчеркнуты.
В заключение можно сказать, что форма 730-С1 дает очень высокий уровень белка и не имеет токсического действия на клетки-хозяева, тогда как присутствие природного С-конца является токсичным. Эти данные предполагают, что "внутриклеточная токсичность" 730 связана с С-концевыми 65 аминокислотами этого белка.
Проводили эквивалентное укорочение ORF29 до первых 231 или 368 аминокислот с использованием экспрессии с лидерным пептидом или без лидерного пептида (аминокислоты 1-26; делеция дает цитоплазматическую экспрессию) и с His-меткой или без His-метки.
Пример 22 - домены в 961
Как описано в примере 9 выше, GST-гибрид 961 лучше всего экспрессировался в Е. coli. Для улучшения экспрессии белок делили на домены (фигура 12).
Домены 961 конструировали на основе YadA (адгезина, продуцируемого Yersinia, который, как было показано, является адгезином, локализованным на бактериальной поверхности, который образует олигомеры, образующие выступ на поверхности [Hoiczyk et al. (2000) EMBO J. 19:5989-99]), и они представляют собой: лидерный пептид, домен головки, сверхскрученный участок (стебель) и мембранный якорный домен.
Эти домены экспрессировали с лидерным пептидом или без лидерного пептида и необязательно гибридизовали либо с С-концевой His-меткой, либо с N-концевой GST. Клоны Е. coli, экспрессирующие различные домены 961, анализировали электрофорезом в ДСН-ПААГ и Вестерн-блоттингом на продуцирование и локализацию экспрессируемого белка из ночной (о/n) культуры или после 3 часов индукции посредством IPTG. Были получены следующие результаты:
961 (IPTG)
+/-
-
-
961-L (IPTG)
+
-
-
+
961C-L (IPTG)
+
+
+
961Δ1-L (IPTG)
+
-
-
Эти результаты показывают, что в Е. coli:
- 961-L является высокоэкспрессируемым и локализован на наружной мембране. Посредством вестерн-блот-анализа были обнаружены две специфические полосы: одна при ˜45 кДа (предсказанная молекулярная масса) и одна при ˜180 кДа, показывающая, что 961-L может образовывать олигомеры. Кроме того, эти агрегаты являются в большей степени экспрессируемыми в ночной культуре (без индукции IPTG). Препараты OMV (пузырьков наружных мембран) этого клона использовали для иммунизации мышей и получали сыворотку. При использовании ночной культуры (преимущественно олигомерной формы) сыворотка была бактерицидной; IPTG-индуцированная культура (преимущественно мономерная) не была бактерицидной.
- 961Δ1-L (с частичной делецией в якорном участке) является высокоэкспрессируемым и локализован на наружной мембране, но не образует олигомеров;
- 961c-L (без якорного участка) продуцируется в растворимой форме и экспортируется в супернатант.
Титры в ELISA и в сывороточном бактерицидном тесте с использованием His-гибридов были следующими:
Клоны Е. coli, экспрессирующие различные формы 961 (961, 961-L, 961Δ1-L и 961c-L), использовали для исследования, является ли 961 адгезином (c.f. YadA). Анализ адгезии выполняли с использованием (а) эпителиальных клеток человека и (b) клонов Е. coli либо после ночного культивирования, либо после трех часов индукции IPTG. 961-L, выращиваемый в течение ночи (961Δ1-L), и IPTG-индуцированный 961c-L (клоны, экспрессирующие белок на поверхности) прикрепляются к эпителиальным клеткам человека.
961с использовали также в гибридных белках (см. выше). Поскольку 961 и его содержащие домены варианты направляют эффективную экспрессию, они являются идеально пригодными в качестве N-концевой части гибридного белка.
Пример 23 - другие гибриды
Другие гибридные белки данного изобретения показаны ниже (см. также фигуру 14). Они обладают преимуществами в сравнении с индивидуальными белками:













Должно быть понятно, что данное изобретение было описано только в виде примера, и могут быть произведены модификации без отклонения от идеи и объема данного изобретения. Например, предполагается применение белков из других штаммов (например, см. WO 00/66741 в отношении полиморфных последовательностей для ORF4, ORF40, ORF46, 225, 235, 287, 519, 726, 919 и 953).
ЭКСПЕРИМЕНТАЛЬНЫЕ ПОДРОБНОСТИ
Очистка белков посредством FPLC (жидкостной экспресс-хроматографии белков)
Следующая таблица суммирует FPLC-очистку белков, которая была использована:
Буферные растворы включали 20-120 мМ NaCl, 5,0 мг/мл CHAPS и 10% об./об. глицерин. Диализат центрифугировали при 13000 g в течение 20 минут и наносили либо на Mono Q, либо на Mono S FPLC-ионообменную смолу. Буфер и ионообменные смолы выбирали в соответствии с pI представляющего интерес белка и с рекомендациями справочника по протоколам FPLC [Pharmacia: FPLC Ion " Exchange and Chromatofocussing; Principles and Methods, Pharmacia Publication]. Белки элюировали с использованием ступенчатого градиента NaCl. Очистку анализировали электрофорезом в ДСН-ПААГ и концентрацию белка определяли по методу Бредфорда.
Буква в колонке "Протокол" относится к следующему: FPLC-А: Клоны 121.1, 128.1, 593, 726, 982, периплазматический белок 920L и гибридные белки 919-287, 953-287 очищали из растворимой фракции Е. coli, полученной после разрушения клеток. Отдельные колонии, несущие представляющую интерес плазмиду, выращивали в течение ночи при 37°С в 20 мл жидкой культуры LB/Амп (100 мкг/мл). Бактерии разбавляли 1:30 в 1,0 л свежей среды и выращивали при 30°С или 37°С до тех пор, пока OD550 не достигала 0,6-0,8. Экспрессию рекомбинантного белка индуцировали IPTG при конечной концентрации 1,0 мМ. После инкубирования в течение 3 часов бактерии собирали центрифугированием при 8000 g в течение 15 минут при 4°С. При необходимости клетки хранили при -20°С. Все последующие процедуры выполняли на льду или при 4°С. Для цитозольных белков (121.1, 128,1, 593, 726 и 982) и периплазматического белка 920L бактерии ресуспендировали в 25 мл ЗФР, содержащего полный протеазный ингибитор (Boehringer Mannheim). Клетки лизировали обработкой ультразвуком с использованием ультразвукового дезинтегратора 450 Бренсона. Разрушенные клетки центрифугировали при 8000 g в течение 30 минут для осаждения неразрушенных клеток и телец включения и супернатант подвергали 35% об./об. насыщению добавлением 3,9 М (NH4)2SO4. Осадок осаждали при 8000 g в течение 30 минут. Супернатант подвергали 70% об./об. насыщению добавлением 3,9 М (NH4)2SO4 и осадок собирали, как описано выше. Осадки, содержащие представляющий интерес белок, идентифицировали электрофорезом в ДСН-ПААГ и диализовали против подходящего ионообменного буфера (см. ниже) в течение 6 часов или в течение ночи. Периплазматическую фракцию из Е. coli, экспрессирующую 953L, получали согласно протоколу Evans et al. [Infect. Iimmun. (1974) 10:1010-1017] и диализовали против подходящего ионообменного буфера. Буфер и ионообменную смолу выбирали в соответствии с pI представляющего интерес белка и рекомендациями справочника по протоколам FPLC (Phamacia). Буферные растворы включали 20 мМ NaCl и 10% (об./об.) глицерин. Диализат центрифугировали при 13000 g в течение 20 минут и наносили либо на Mono Q, либо на Mono S FPLC-ионообменную смолу. Буфер и ионообменные смолы выбирали в соответствии с pI представляющего интерес белка и с рекомендациями справочника по протоколам FPLC (Pharmacia). Белки элюировали с использованием ступенчатого градиента NaCl. Очистку анализировали электрофорезом в ДСН-ПААГ и концентрацию белка определяли по методу Бредфорда. Отщепление лидерного пептида периплазматических белков демонстрировали секвенированием NH2-конца (см. ниже).
FPLC-B: Эти белки очищали из мембранной фракции Е. coli. Отдельные колонии, несущие представляющую интерес плазмиду, выращивали в течение ночи при 37°С в 20 мл жидкой культуры LB/Дмп (100 мкг/мл). Бактерии разбавляли 1:30 в 1,0 л свежей среды. Клоны 406.1L и 919LOrf4 выращивали при 30°С, a Orf25L и 576.1L при 37°С до тех пор, пока OD550 не достигала 0,6-0,8. В случае 919LOrf4 выращивание при 30°С было важным, так как экспрессия рекомбинантного белка при 37°С приводила к лизису этих клеток. Экспрессию рекомбинантного белка индуцировали IPTG при конечной концентрации 1,0 мМ. После инкубирования в течение 3 часов бактерии собирали центрифугированием при 8000 g в течение 15 минут при 4°С. При необходимости клетки хранили при -20°С. Все последующие процедуры выполняли при 4°С. Бактерии ресуспендировали в 25 мл ЗФР, содержащего полный протеазный ингибитор (Boehringer Mannheim), и лизировали осмотическим шоком 2-3-пропусканиями через French-пресс. Неразрушенные клетки удаляли центрифугированием при 5000 g в течение 15 минут и мембраны осаждали центрифугированием при 100000 g (Beckman Ti50, 38000 об/мин) в течение 45 минут. Гомогенизатор Даунса использовали для ресуспендирования осадка мембран в 7,5 мл 20 мМ Трис-HCl (рН 8,0), 1,0 М NaCl и полном протеазном ингибиторе. Суспензию смешивали в течение 2-4 часов, центрифугировали при 100000 g в течение 45 минут и осадок ресуспендировали в 7,5 мл 20 мМ Трис-HCl (рН 8,0), 1,0 М NaCl, 5,0 мг/мл CHAPS, 10% (об./об.) глицерина и полного протеазного ингибитора. Раствор смешивали в течение ночи, центрифугировали при 100000 g в течение 45 минут и супернатант диализовали в течение 6 часов против выбранного подходящим образом буфера. В случае Orf25.L было обнаружено, что осадок, полученный после экстракции CHAPS, содержал рекомбинантный белок. Эту фракцию без дополнительной очистки использовали для иммунизации мышей.
FPLC-C: Идентично FPLC-A, но очистку проводили из растворимой фракции, полученной после достижения проницаемости Е. coli полимиксином В, а не после разрушения клеток.
FPLC-D: Отдельные колонии, несущие представляющую интерес плазмиду, выращивали в течение ночи при 37°С в 20 мл жидкой культуры LB/Амп (100 мкг/мл). Бактерии разбавляли 1:30 в 1,0 л свежей среды и выращивали при 30°С до тех пор, пока OD550 не достигала 0,6-0,8. Экспрессию рекомбинантного белка индуцировали IPTG при конечной концентрации 1,0 мМ. После инкубирования в течение 3 часов бактерии собирали центрифугированием при 8000 g в течение 15 минут при 4°С. При необходимости клетки хранили при -20°С. Все последующие процедуры выполняли на льду или при 4°С. Клетки ресуспендировали в 20 мМ Бицине (рН 8,5), 20 мМ NaCl, 10% (об./об.) глицерине, полном протеазном ингибиторе (Boehringer Mannheim) и разрушали с использованием ультразвукового дезинегратора 450 Бренсона. Разрушенные ультразвуком клетки центрифугировали при 8000 g в течение 30 минут для осаждения неразрушенных клеток и телец включения. Рекомбинантный белок осаждали из раствора между 35% об/об и 70% об./об. насыщением добавлением 3,9 М (NH4)2SO4. Осадок осаждали при 8000 g в течение 30 минут, ресуспендировали в 20 мМ Бицине (рН 8,5), 20 мМ Nad, 10% (об./об.) глицерине и диализовали против этого буфера в течение 6 часов или в течение ночи. Диализат центрифугировали при 13000 g в течение 20 минут и наносили на FPLC-смолу. Белок элюировали из колонки с использованием ступенчатых градиентов NaCl. Очистку анализировали электрофорезом в ДСН-ПААГ и концентрацию белка определяли по методу Бредфорда.
Стратегия клонированная и конструирование олигонуклеотидов
Гены, кодирующие представляющие интерес антигены, амплифицировали при помощи ПЦР с использованием олигонуклеотидов, сконструированных на основе геномной последовательности N. meningitidis В МС58. Геномную ДНК из штамма 2996 использовали всегда в качестве матрицы в ПЦР-реакциях, если нет других указаний, и амплифицированные фрагменты клонировали в экспрессирующий вектор рЕТ21b+ (Novagen) для экспрессии белка в виде His-меченого на С-конце продукта или в pET-24b+ (Novagen) для экспрессии "немеченой" формы (например, ΔG287K).
Когда белок экспрессировали без гибридного партнера и с его собственным лидерным пептидом (если он присутствует), выполняли амплификацию открытой рамки считывания (кодон ATG-СТОП-кодон).
Когда белок экспрессировали в "немеченой" форме, лидерный пептид удаляли конструированием 5'-концевого праймера амплификации справа от предсказанной лидерной последовательности.
Температура плавления праймеров, используемых в ПЦР, зависела от числа и типа гибридизующихся нуклеотидов в целом праймере, и ее определяли с использованием формул:
Tпл1=4(G+C)+2(А+Т) (хвост исключен)
Тпл2=64,9+0,41 (%GC) - 600/N (полный праймер)
Температуры плавления выбранных олигонуклеотидов были обычно 65-70°С для полного олигонуклеотида и 50-60°С только для участка гибридизации.
Олигонуклеотиды синтезировали с использованием ДНК/РНК-синтезатора Perkin. Elmer 394, элюировали из колонок в 2,0 мл NH4OH и освобождали от защитных групп 5-часовой инкубацией при 56°С. Олигонуклеотиды осаждали добавлением 0,3 М Na-ацетата и 2 объемов этанола. Пробы центрифугировали и осадки ресуспендировали в воде.
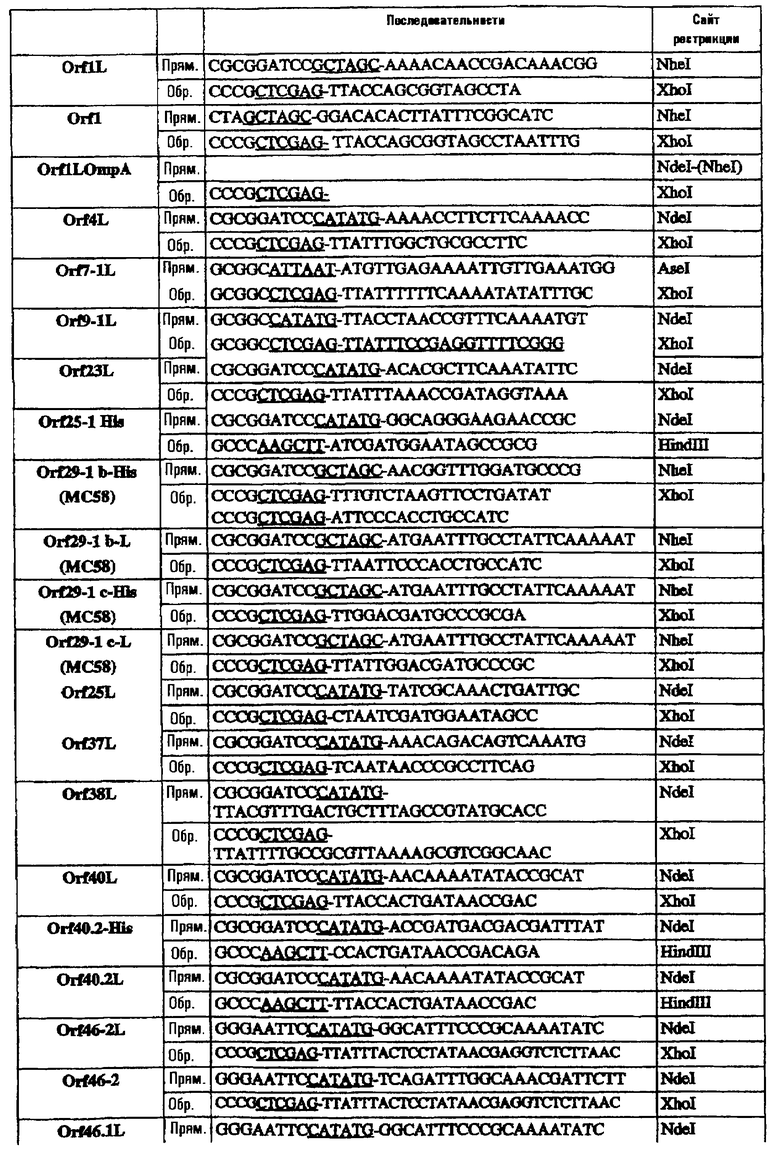
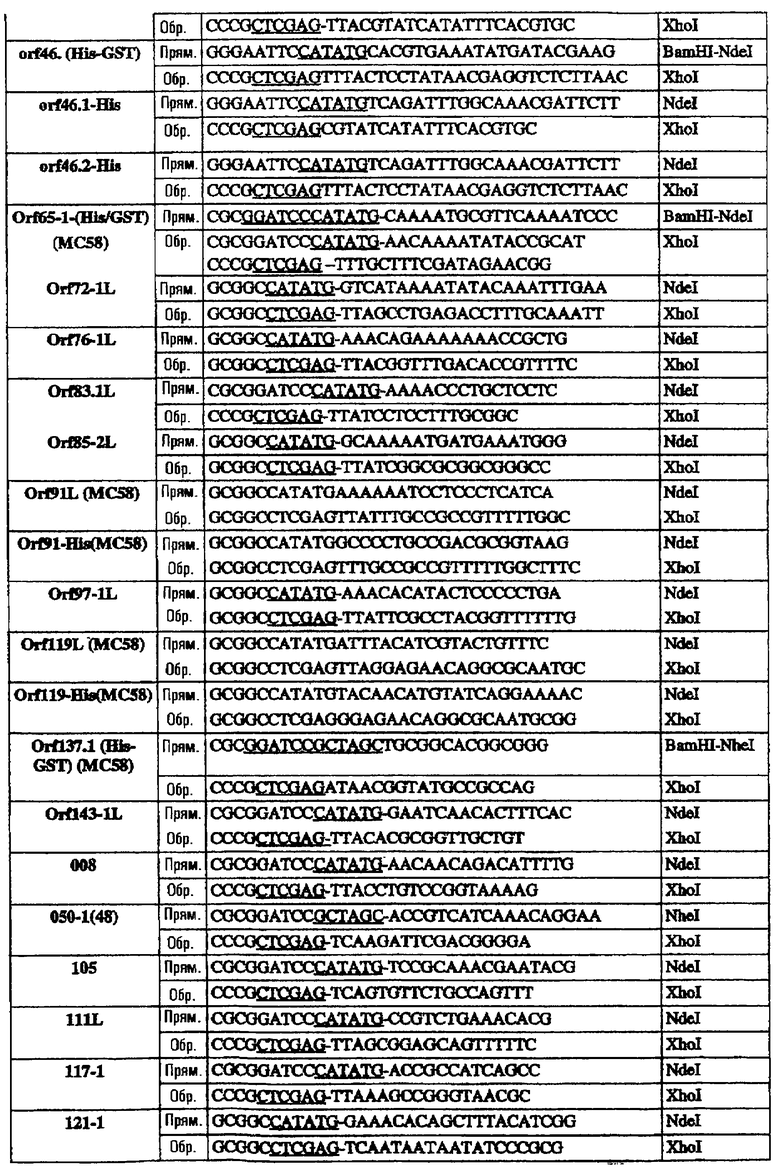
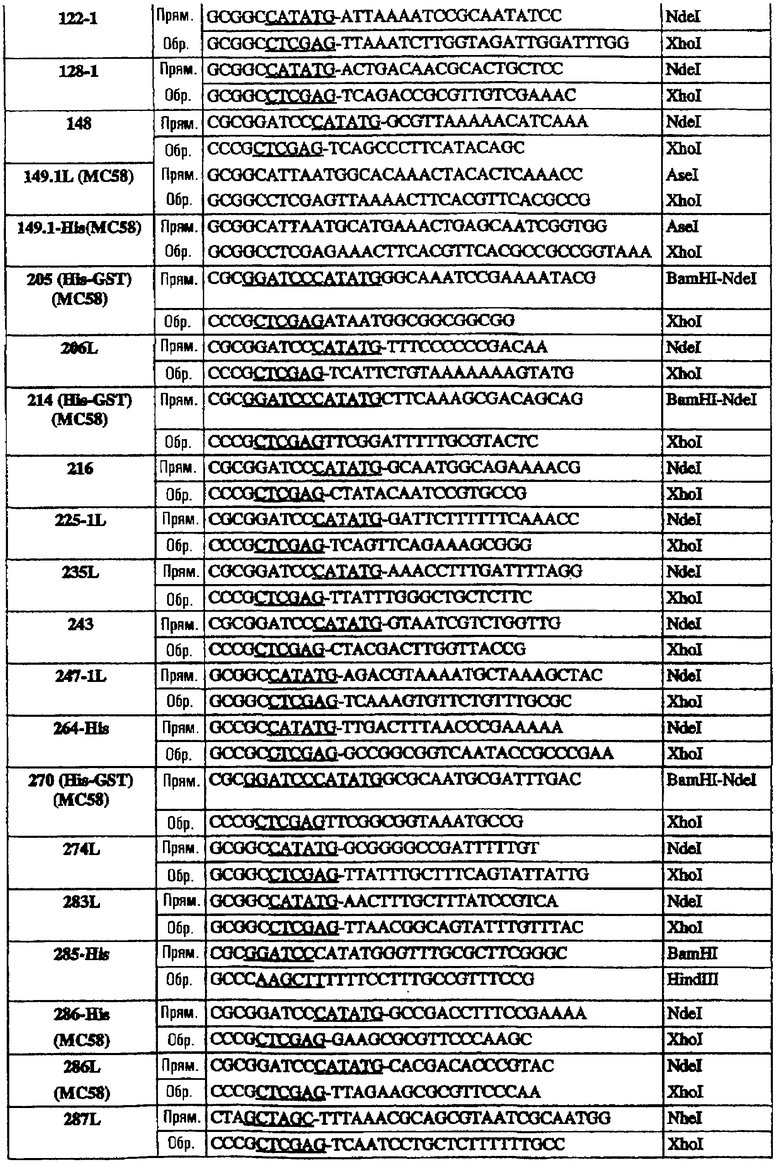

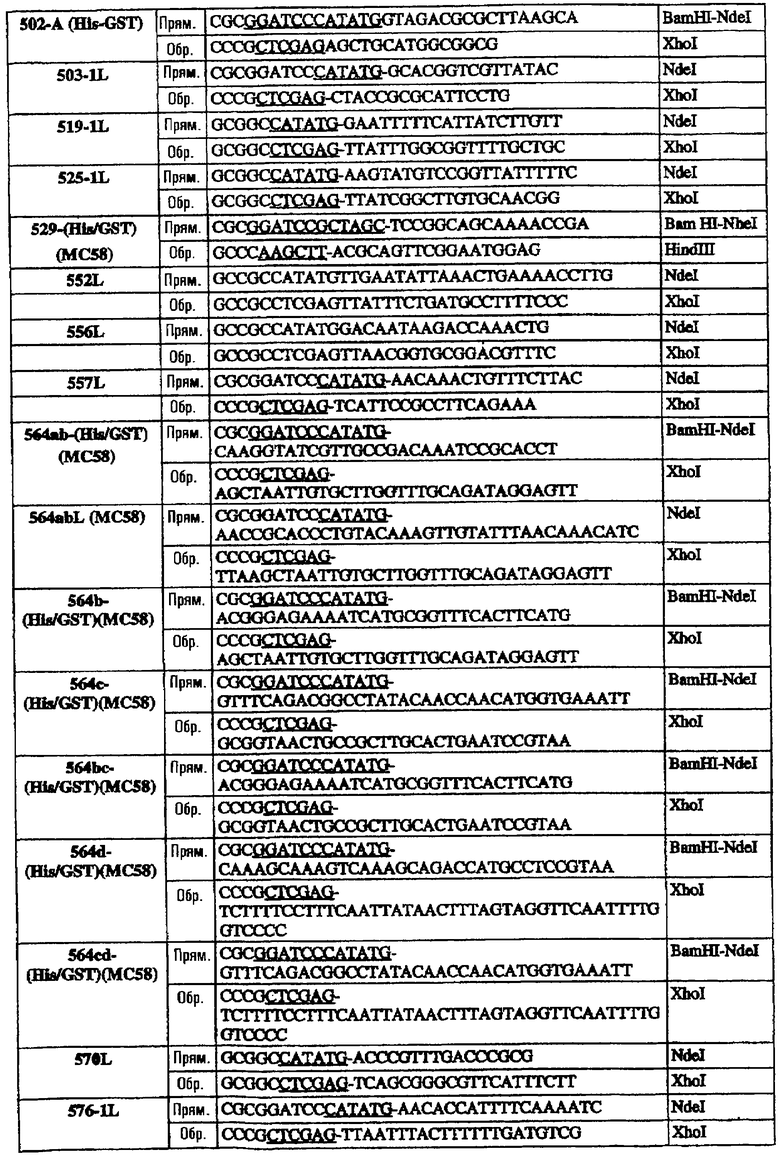
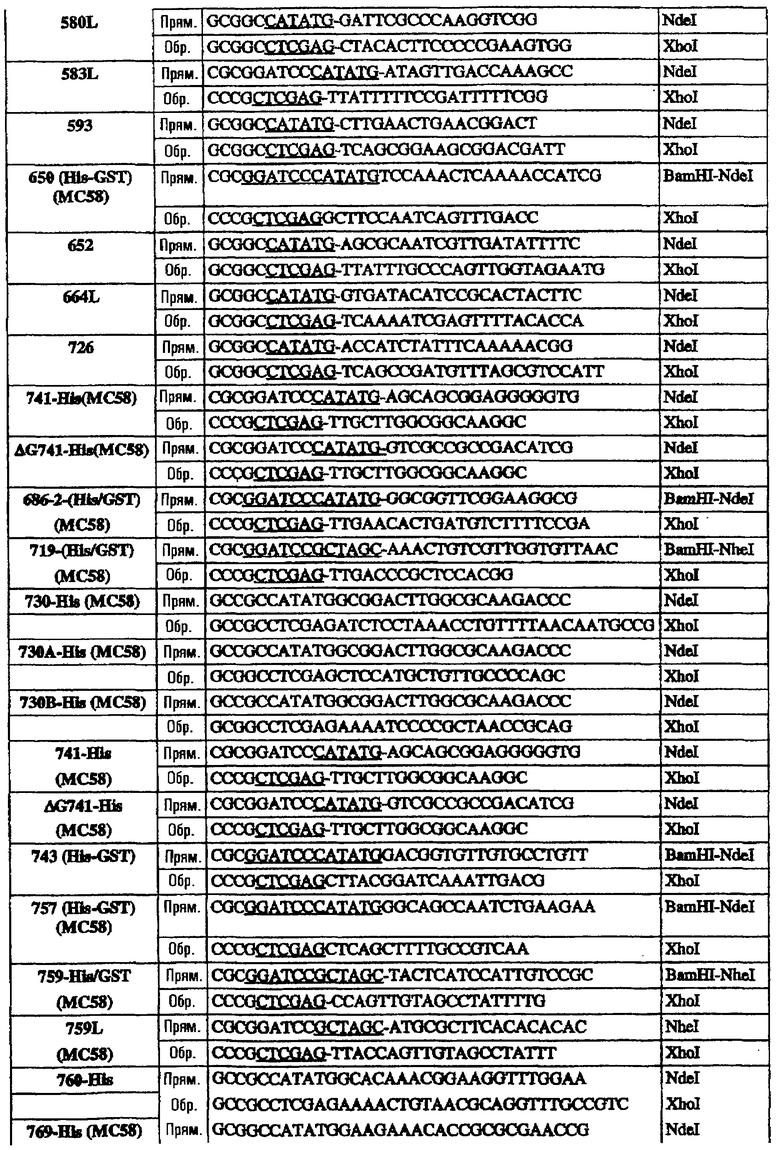
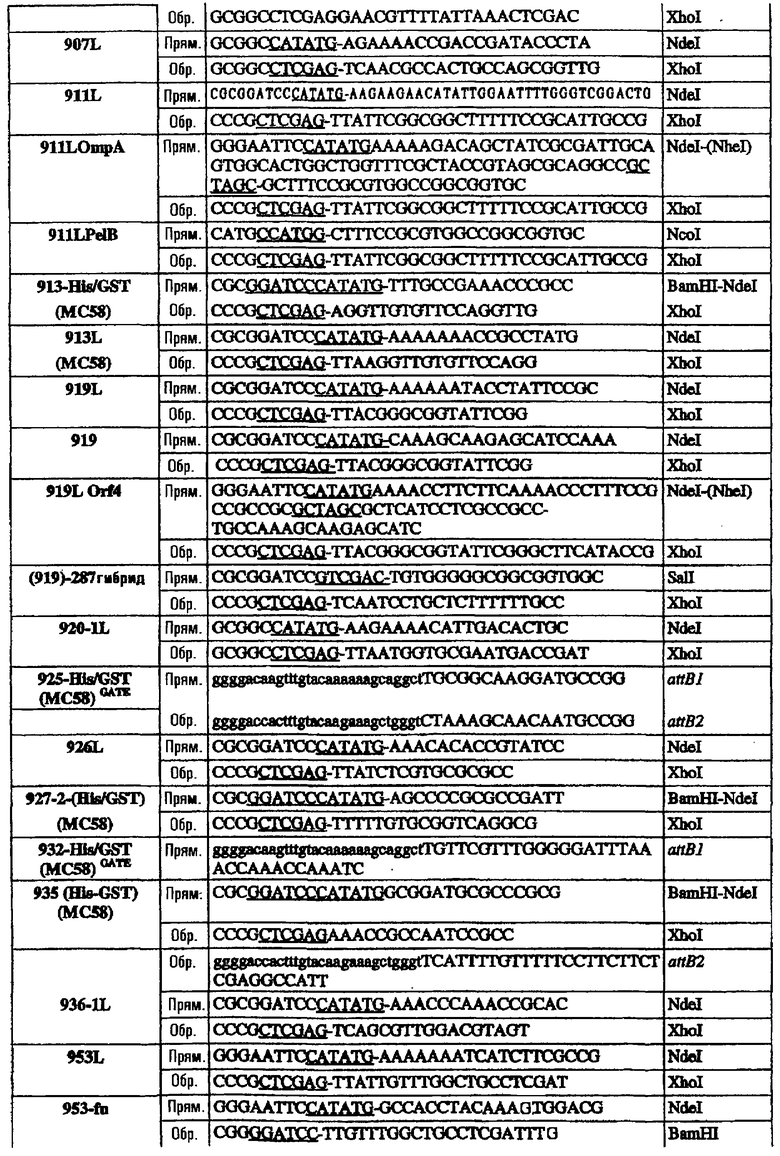
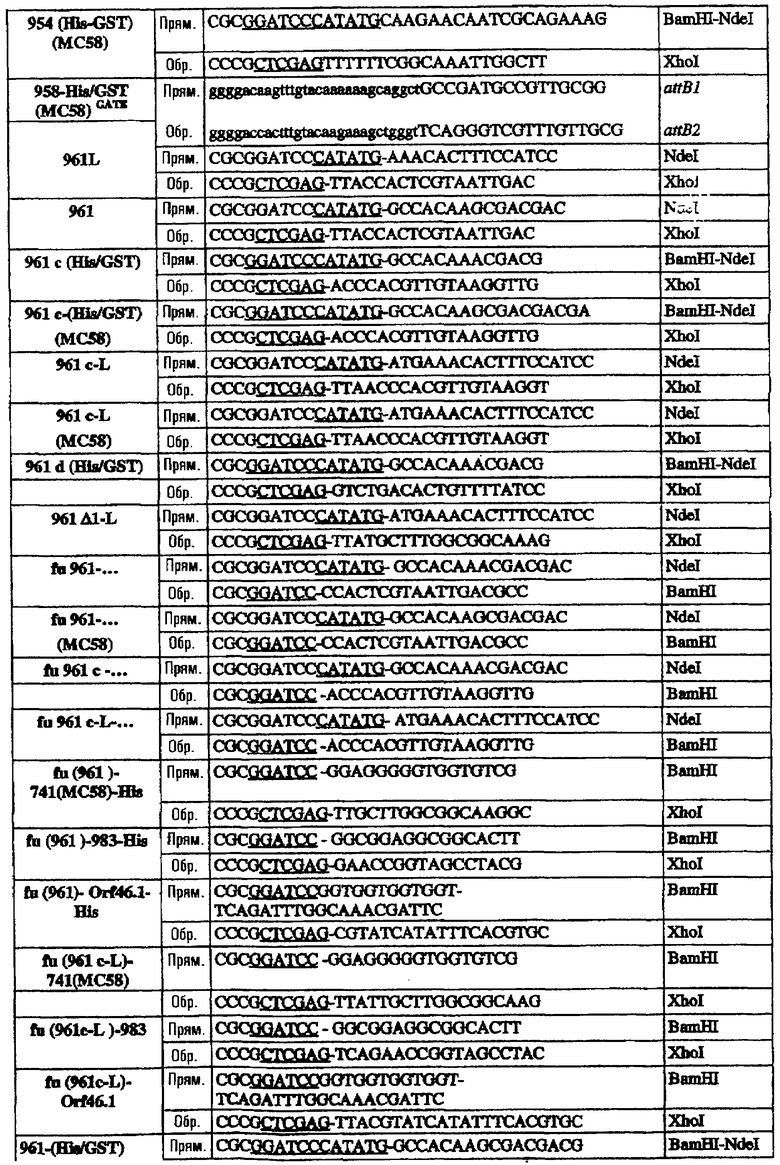


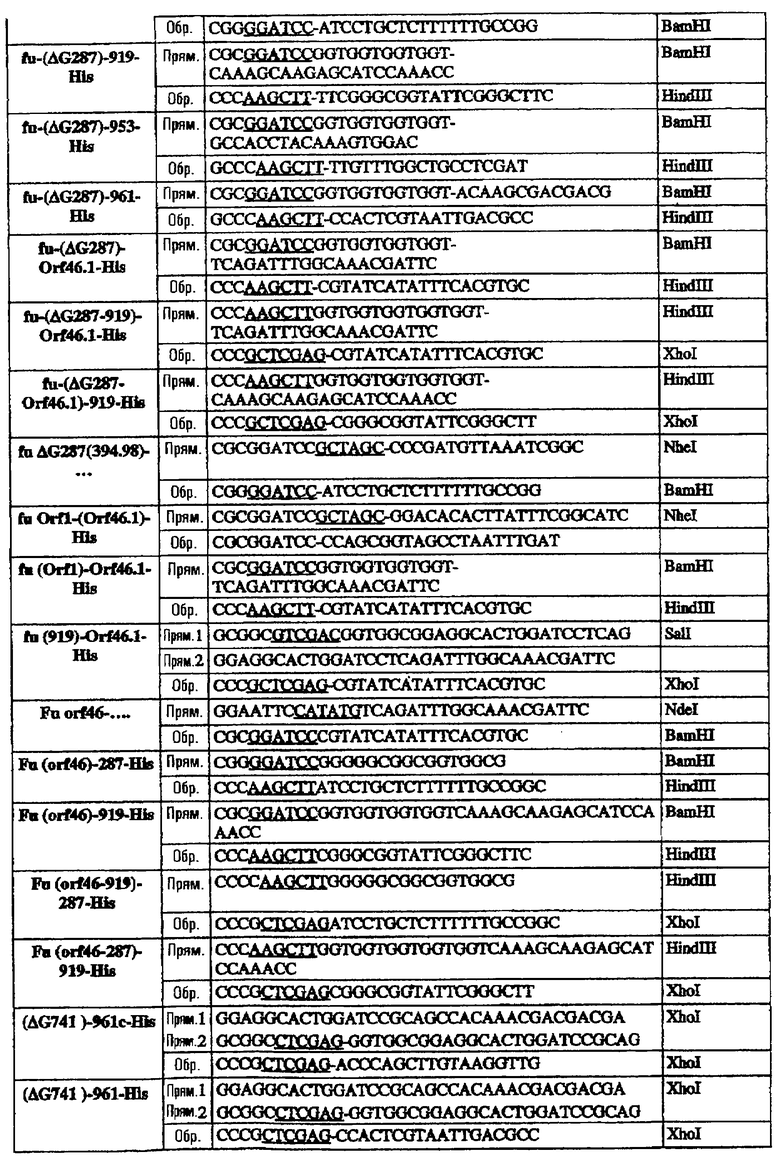
 * Этот праймер использовали в качестве Обратного праймера для всех С-концевых гибридизаций 287 с His-меткой.
* Этот праймер использовали в качестве Обратного праймера для всех С-концевых гибридизаций 287 с His-меткой.
§ Прямые праймеры, используемые в комбинации с Обратным праймером 287-His.
NB - Все ПЦР-реакции используют штамм 2996, если нет других указаний (например, штамм МС58).
Во всех конструкциях, начинающихся с ATG, не сопровождающегося уникальным сайтом NheI, кодон ATG является частью сайта NdeI, используемого для клонирования. Конструкции, приготовленные с использованием NheI в качестве сайта клонирования на 5'-конце (например, все конструкции, содержащие 287 на N-конце), имеют два дополнительных кодона (GCT AGC), гибридизованных с кодирующей последовательностью антигена.
Получение матриц хромосомной ДНК
Штаммы N. meningitidis 2996, МС58, 394.98, 1000 и BZ232 (и другие) выращивали до экспоненциальной фазы в 100 мл GC-среды, собирали центрифугированием и ресуспендировали в 5 мл буфера (20% масса/объем сахароза, 50 мМ Трис-HCl, 50 мМ ЭДТА, рН 8). После 10 минут инкубирования на льду бактерии лиэировали добавлением 10 мл лизисного раствора (50 мМ NaCl, 1% Na-саркозил, 50 мкг/мл Протеиназы К) и суспензию инкубировали при 37°С в течение 2 часов. Выполняли две экстракции фенолом (уравновешенным до рН 8) и одну экстракцию смесью CHCl3/изоамиловый спирт (24:1). ДНК осаждали добавлением 0,3 М ацетата натрия и 2 объемов этанола и собирали центрифугированием. Осадок промывали один раз 70% (об./об.) этанолом и перерастворяли в 4,0 мл ТЭ-буфера (10 мМ Трис-HCl, 1 мМ ЭДТА, рН 8,0). Концентрацию ДНК измеряли считыванием OD260.
ПЦР-амплификация
Стандартный протокол ПЦР был следующим: 200 нг геномной ДНК из штаммов 2996, МС58, 1000 или BZ232 или 10 нг препарата плазмидной ДНК рекомбинантных клонов использовали в качестве матрицы в присутствии 40 мкМ каждого олигонуклеотидного праймера, 400-800 мкМ раствора dNTP, 1×ПЦР-буфера (включающего 1,5 мМ MgCl2), 2,5 единиц ДНК-полимеразы TaqI (с использованием Perkin Elmer AmpliTaQ, Boehringer Mannheim ExpandTM Long Template).
После предварительной 3-минутной инкубации всей смеси при 95°С, каждую пробу подвергали двухстадийной амплификации: первые 5 циклов выполняли с использованием температуры гибридизации, которая исключала хвост рестриктазы праймера (Tпл1). Затем следовали 30 циклов в соответствии с температурой гибридизации, рассчитанной для полноразмерных олигонуклеотидов (Тпл2). Время элонгации, выполняемой при 68°С или 72°С, варьировалось в соответствии с длиной Orf, подлежащего амплификации. В случае Orf1 время элонгации, начинаясь с 3 минут, увеличивалось на 15 секунд с каждым циклом. Циклы завершались 10-минутной стадией удлинения при 72°С. Амплифицированную ДНК наносили непосредственно на 1% агарозный гель. ДНК-фрагмент, соответствующий полосе правильного размера, очищали из геля с использованием набора для экстракции гелей Qiagen Gel Extraction Kit согласно протоколу изготовителя.
Расщепление ПЦР-фрагментов и клонирующих векторов
Очищенную ДНК, соответствующую амплифицированному фрагменту, расщепляли подходящими рестриктазами для клонирования в рЕТ-21b+, рЕТ22b+ или рЕТ-24b+. Расщепленные фрагменты очищали с использованием набора для очистки QIAquick PCR purification kit (согласно инструкциям изготовителя) и элюировали либо H2O, либо 10 мМ Трис, рН 8,5. Плазмидные векторы расщепляли подходящими рестриктазами, наносили на 1,0% агарозный гель и полосу, соответствующую расщепленному вектору, очищали с использованием набора для экстракции гелей Qiagen QIAquick Gel Extraction kit.
Клонирование
Фрагменты, соответствующие каждому гену, предварительно расщепленные и очищенные, лигировали в pET21b+, pET22b+ или рЕТ-24b+. Использовали молярное отношение 3:1 фрагмент/вектор с ДНК-лигазой Т4 в буфере для лигирования, поставляемом изготовителем.
Рекомбинантную плазмиду трансформировали в компетентные клетки Е. coli DH5 или НВ101 инкубированием раствора лигазной реакции и бактерий в течение 40 минут на льду, затем при 37°С в течение 3 минут. Затем следовало добавление 800 мкл LB-бульона и инкубирование при 37°С в течение 20 минут. Клетки центрифугировали при максимальной скорости в микрофуге Эппендорфа, ресуспендировали в приблизительно 200 мкл супернатанта и высевали на содержащий LB-ампициллин (100 мг/мл) агар.
Скрининг на рекомбинантные клоны выполняли выращиванием случайно выбранных колоний в течение ночи при 37°С в 4,0 мл смеси LB-бульон + 100 мкг/мл ампициллин. Клетки осаждали и плазмидную ДНК экстрагировали с использованием набора Qiagen QIAprep Spin Miniprep Kit согласно инструкциям изготовителя. Приблизительно 1 мкг каждого индивидуального минипрепарата расщепляли подходящими рестриктазами и продукт расщепления наносили на 1-1,5% агарозный гель (в зависимости от ожидаемого размера вставки) параллельно с маркером молекулярной массы (1 т.п.н. ДНК-лэддер, GIBCO). Позитивные клоны отбирали на основании размера инсерта.
Экспрессия
После клонирования каждого гена в экспрессирующий вектор рекомбинантные плазмиды трансформировали в штаммы Е. coli, пригодные для экспрессии рекомбинантного белка. 1 мкл каждой конструкции использовали для трансформации Е. coli BL21-DE3, как описано выше. Отдельные рекомбинантные колонии инокулировали в 2 мл LB+Амп (100 мкг/мл), инкубировали при 37°С в течение ночи, затем разводили 1:30 в 20 мл LB+Амп (100 мкг/мл) в колбах на 100 мл с получением OD600 между 0,1 и 0,2. Колбы инкубировали при 30°С или при 37°С во вращательном шейкере с водяной баней до тех пор, пока OD600 не указывала экспоненциальный рост, подходящий для индукции экспрессии (0,4-0,8 OD). Экспрессию белка индуцировали добавлением 1,0 мМ IPTG (изопропилтиогалактозида). После 3 часов инкубирования при 30°С или при 37°С измеряли OD600 и исследовали экспрессию. 1,0 мл каждой пробы центрифугировали в микрофуге, осадок ресуспендировали в ЗФР и анализировали при помощи электрофореза в ДСН-ПААГ и окрашивания Кумасси синим.
Gateway-клонирование и экспрессия
Последовательности, меченые GATE, клонировали и экспрессировали с использованием технологии GATEWAY-клонирования (Gibco-BRL). Рекомбинантное клонирование (РК) основано на реакциях рекомбинации, которые опосредуют интеграцию фага в геном Е. coli и вырезание фага из генома Е. coli. Интеграция включает рекомбинацию сайта attP ДНК фага в сайте attB, расположенном в бактериальном геноме, (ВР-реакцию), и генерирует интегрированный геном фага, фланкированный сайтами attL и attR. Вырезание рекомбинирует сайты attL и attR обратно в сайты attP и attB (LR-реакция). Для реакции интеграции необходимы два фермента [фаговая белковая Интеграза (Int) и бактериальный фактор белковой интеграции хозяина (IHF)] (ВР-клоназы). Для реакции вырезания необходимы Int, IHF и дополнительный фаговый фермент, Эксцизионаза (Xis) (LR-клоназа). Синтетические производные бактериального сайта рекомбинации attB 25 п.н., называемые В1 и В2, добавляли к 5'-концу праймеров, используемых в ПЦР-реакциях для амплификации ORF Neisseria. Полученные продукты ВР-клонировали в "донорский вектор", содержащий комплементарные производные сайта рекомбинации фага attP (P1 и Р2), с использованием ВР-клоназы. Полученные "входные клоны" содержат ORF, фланкированные производными сайта attL (L1 и L2), и они были субклонированы в экспрессирующие "векторы предназначения", которые содержат производные attL-совместимых сайтов attR (R1 и R2), с использованием LR-клоназы. Это приводило к получению "экспрессирующих клонов", в которых ORF фланкированы В1 и В2 и гибридизованы в рамке считывания с N-концевыми метками GST или His.
Штаммом Е. coli, используемым для GATEWAY-экспрессии, является BL21-SI. Клетки этого штамма индуцировали для экспрессии РНК-полимеразы Т7 выращиванием в среде, содержащей соль (0,3 М NaCl).
Следует отметить, что эта система дает N-концевые His-метки.
Получение мембранных белков
Фракции, состоящие в основном либо из внутренних, наружных, или тотальных мембран, выделяли, чтобы получить рекомбинантные белки, экспрессируемые лидерными последовательностями, определяющими мембранную локализацию. Способ получения препарата мембранных фракций, обогащенного рекомбинантыми белками, был заимствован из Filip et al. [J. Bact. (1973) 115:717-722] и Davies et al. [J. Immunol. Meth. (1990) 143:215-225]. Отдельные колонии, несущие представляющую интерес плазмиду, выращивали в течение ночи при 37°С в 20 мл жидкой культуры LB/Амп (100 мкг/мл). Бактерии разводили 1:30 в 1,0 л свежей среды и выращивали при 30°С или 37°С до тех пор, пока OD550 не достигала 0,6-0,8. Экспрессию рекомбинантного белка индуцировали IPTG при конечной концентрации 1,0 мМ. После инкубирования в течение 3 часов бактерии собирали центрифугированием при 8000 g в течение 15 минут при 4°С и ресуспендировали в 20 мл 20 мМ Трис-HCl (рН 7,5) и полных протеазных ингибиторах (Boehringer Mannheim). Все последующие процедуры выполняли при 4°С или на льду.
Клетки разрушали обработкой ультразвуком с использованием ультразвукового дезинегратора 450 Бренсона и центрифугировали при 5000 g в течение 20 минут для осаждения неразрушенных клеток и телец включения. Супернатант, содержащий мембраны и клеточный дебрис, центрифугировали при 50000 g (Beckman Ti50, 29000 об/мин) в течение 75 минут, промывали 20 мМ Бис-трис-пропаном (рН 6,5), 1,0 М NaCl, 10% (об./об.) глицерином и опять осаждали при 50000 g в течение 75 минут. Осадок ресуспендировали в 20 мМ Трис-HCl (рН 7,5), 2,0% (об./об.) Саркозиле, полном протеазном ингибиторе (1,0 мМ ЭДТА, конечная концентрация) и инкубировали в течение 20 минут для растворения внутренней мембраны. Клеточный дебрис осаждали центрифугированием при 5000 g в течение 10 минут и супернатант центрифугировали при 75000 g в течение 75 минут (Beckman Ti50, 33000 об/мин). Белки 008L и 519L были обнаружены в этом супернатанте, что предполагает их локализацию во внутренней мембране. Для этих белков фракции как внутренних мембран, так и тотальных мембран (промытых NaCl, как описано выше) использовали для иммунизации мышей. Везикулы наружных мембран, полученные из осадка 75000 g, промывали 20 мМ Трис-HCl (рН 7,5) и центрифугировали при 75000 g в течение 75 минут или в течение ночи. Наконец, OMV (везикулы наружных мембран) ресуспендировали в 500 мкл 20 мМ Трис-HCl (рН 7,5), 10% об./об. глицерине. Orf1L и Orf40L, оба, были локализованными и обогащенными во фракции наружных мембран, которую использовали для иммунизации мышей. Концентрацию белка определяли по стандартному методу Бредфорда (Bio-Rad) тогда как концентрацию белка фракции внутренних мембран определяли DC-способом определения белка (Bio-Rad). Различные фракции из этой процедуры выделения анализировали при помощи электрофореза в ДСН-ПААГ.
Очистка His-меченых белков
Разные формы 287 клонировали из штаммов 2996 и МС58. Их конструировали с His-меченой гибридизацией на С-конце и они включали в себя зрелую форму (аминокислоты 18-427), конструкции с делениями (Δ1, Δ2, Δ3 и Δ4) и клоны, состоящие либо из. В-, либо из С-доменов. Для каждого клона, очищенного в виде His-гибрида, отдельную колонию высевали штрихом и выращивали в течение ночи при 37°С на чашке с агаром LB/Амп (100 мкг/мл). Выделенную колонию из этой чашки инокулировали в 20 мл жидкой среды LB/Амп (100 мкг/мл) и выращивали в течение ночи при 37°С при встряхивании. Ночную культуру разбавляли 1:30 в 1,0 л жидкой среды LB-Амп (100 мкг/мл) и выращивали при оптимальной температуре (30 или 37°С), пока OD550 не достигала 0,6-0,8. Экспрессию рекомбинантного белка индуцировали добавлением IPTG (конечная концентрация 1,0 мМ) и эту культуру инкубировали еще в течение 3 часов. Бактерии собирали центрифугированием при 8000 g в течение 15 минут при 4°С. Осадок бактерий ресуспендировали в 7,5 мл (i) холодного буфера А (300 мМ NaCl, 50 мМ фосфатный буфер, 10 мМ имидазол, рН 8,0) для растворимых белков или (ii) буфера В (10 мМ Трис-НС1, 100 мМ фосфатный буфер, рН 8,8 и, необязательно, 8 М мочевина) для нерастворимых белков. Белки, очищенные в виде растворимой формы, включали в себя 287-His, Δ1, Δ2, Δ3 и Δ4287-His, Δ4287МС58-His, 287c-His и 287cMC58-His. Белок 287bMC58-His был нерастворимым и его очищали соответствующим образом. Клетки разрушали обработкой ультразвуком на льду четыре раза в течение 30 секунд при 40W с использованием ультразвукового дезинтегратора 450 Бренсона и центрифугировали при 13000×g в течение 30 минут при 4°С. Для нерастворимых белков осадки ресуспендировали в 2,0 мл буфера С (6 М гидрохлорид гуанидина, 100 мМ фосфатный буфер, 10 мМ Трис-HCl, рН 7,5) и обрабатывали 10 активациями гомогенизатора Даунса. Гомогенат центрифугировали при 13000 g в течение 30 минут и супернатант сохраняли. Супернатанты как растворимого, так и нерастворимого препаратов смешивали с 150 мкл Ni2+-смолы (предварительно уравновешенной буфером А или буфером В, как требуется) и инкубировали при комнатной температуре с осторожным перемешиванием в течение 30 минут. Смолой была Хелатирующая Сефароза Fast Flow (Pharmacia), полученная в соответствии с протоколом изготовителя. Получаемый периодически препарат центрифугировали при 700 g в течение 5 минут при 4°С и супернатант отбрасывали. Смолу промывали дважды (при периодическом получении) 10 мл буфера А или В в течение 10 минут, ресуспендировали в 1,0 мл буфера А или В и наносили на одноразовую колонку. Смолу продолжали промывать либо (i) буфером А при 4°С, либо (ii) буфером В при комнатной температуре, пока OD280 протекающего раствора не достигала 0,02-0,01. Смолу дополнительно промывали либо (i) холодным буфером С (300 мМ NaCl, 50 мМ фосфатный буфер, 20 мМ имидазол, рН 8,0), либо (ii) буфером D (10 мМ Трис-HCl, 100 мМ фосфатный буфер, рН 6,3, и, необязательно, 8 М мочевина), пока OD280 протекающего через колонку раствора не достигала 0,02-0,01. His-гибридный белок элюировали добавлением 700 мкл либо (i) холодного буфера для элюции А (300 мМ NaCl, 50 мМ фосфатный буфер, 250 мМ имидазол, рН 8,0), либо (ii) буфера для элюции В (10 мМ Трис-HCl, 100 мМ фосфатный буфер, рН 4,5, и, необязательно, 8 М мочевина) и фракции собирали, пока OD280 не показывала, что получен весь рекомбинантный белок. Аликвоты по 20 мкл каждой фракции элюции анализировали при помощи электрофореза в ДСН-ПААГ. Концентрацию белка определяли по способу Бредфорда.
Ренатурация денатурированных His-гибридных белков
Денатурация требовалась для солюбилизации 287bМС8, поэтому перед иммунизацией применяли стадию ренатурации. К денатурированным фракциям, полученным, как описано выше, добавляли глицерин с получением конечной концентрации 10% (об./об.). Белки разбавляли до 200 мкг/мл с использованием диализного буфера I (10% об./об. глицерин, 0,5 М аргинин, 50 мМ фосфатный буфер, 5,0 мМ восстановленный глутатион, 0,5 мМ окисленный глутатион, 2,0 М мочевина, рН 8,8) и диализовали против того же буфера в течение 12-14 часов при.4°С. Дополнительный диализ проводили с буфером II (10% об./об. глицерин, 0,5 М аргинин, 50 мМ фосфатный буфер, 5,0 мМ восстановленный глутатион, 0,5 мМ окисленный глутатион, рН 8,8) в течение 12-14 часов при 4°С. Концентрацию белка определяли с использованием формулы:
Белок (мг/мл)=(1,55×OD280)-(0,76×OD260)
Аминокислотный анализ
Автоматическое секвенирование NH2-конца белков выполняли на секвенаторе Бекмана (LF 3000), снабженном подключенным к нему анализатором фенилтиогидантоин-аминокислот (System Gold), согласно рекомендациям изготовителя.
Иммунизация
Мышей BALB/c иммунизировали антигенами в дни 0, 21 и 35 и сыворотки анализировали в день 49.
Анализ сывороток - ELISA
Лишенный капсулы MenB M7 и инкапсулированные штаммы высевали на чашки с шоколадным агаром и инкубировали в течение ночи при 37°С с 5% СО2. Колонии бактерий собирали из чашек с агаром с использованием стерильного тампона (dracon swab) и инокулировали в бульон Mueller-Hinton (Difco), содержащий 0,25% глюкозу. Бактериальный рост отслеживали каждые 30 минут определением OD620- Бактерии выращивали, пока OD не достигала величины 0,4-0,5. Культуру центрифугировали в течение 10 минут при 4000 об/мин. Супернатант отбрасывали и бактерии промывали дважды ЗФР, ресуспендировали в ЗФР, содержащем 0,025% формальдегид, и инкубировали в течение 1 часа при 37°С и затем в течение ночи при 4°С при перемешивании. 100 мкл бактериальных клеток добавляли в каждую лунку 96-луночного планшета Greiner и инкубировали в течение ночи при 4°С. Затем лунки промывали три раза ЗФР-буфером для промывок (0,1% Твин-20 в ЗФР). 200 мкл буфера насыщения (2,7% поливинилпирролидон 10 в воде) добавляли в каждую лунку и планшеты инкубировали в течение 2 часов при 37°С. Лунки промывали три раза ЗФР. 200 мкл разбавленных сывороток (буфер для разведения: 1% БСА, 0,1% Твин-20, 0,1% NaN3 в ЗФР) добавляли в каждую лунку и планшеты инкубировали в течение 2 часов при 37°С. Лунки промывали три раза ЗФР. 100 мкл HRP-конъюгированной кроличьей антимышиной сыворотки (Dako), разведенной 1:2000 в буфере для разведения, добавляли в каждую лунку и планшеты инкубировали в течение 90 минут при 37°С. Лунки промывали три раза ЗФР-буфером. 100 мкл субстратного буфера для HRP (25 мл нитратного буфера рН 5, 10 мг O-фенилдиамина и 10 мкл Н2О2) добавляли в каждую лунку и планшеты оставляли при комнатной температуре на 20 минут. 100 мкл 12,5% H2SO4 добавляли в каждую лунку и определяли OD490. Титры ELISA рассчитывали в относительных единицах в виде разведения сывороток, которое давало величину OD490 0,4 над уровнем предымунных сывороток. Анализ ELISA считался позитивным, когда разведение сывороток с OD490 0,4 было больше чем 1:400.
Анализ сывороток - FACS-Scan-анализ связывания бактерии
Лишенный капсулы штамм MenB M7 высевали на чашки с шоколадным агаром и инкубировали в течение ночи при 37°С с 5% CO2. Колонии бактерий собирали из чашек с агаром с использованием стерильного тампона (dracon swab) и инокулировали в 4 пробирки, содержащие каждая 8 мл бульона Mueller-Hinton (Difco), содержащего 0,25% глюкозу. Бактериальный рост отслеживали каждые 30 минут определением OD620. Бактерии выращивали, пока OD не достигала величины 0,35-0,5. Культуру центрифугировали в течение 10 минут при 4000 об/мин. Супернатант отбрасывали и осадок ресуспендировали в блокирующем буфере (1% БСА в ЗФР, 0,4% NaN3) и центрифугировали в течение 5 минут при 4000 об/мин. Клетки ресуспендировали в блокирующем буфере с получением OD620 0,05. 100 мкл бактериальных клеток добавляли в каждую лунку 96-луночного планшета Costar. 100 мкл разведенных (1:100, 1:200, 1:400) сывороток (в блокирующем буфере) добавляли в каждую лунку и планшеты инкубировали в течение 2 часов при 4°С. Клетки центрифугировали в течение 5 минут при 4000 об/мин, супернатант отсасывали и клетки промывали добавлением 200 мкл на лунку блокирующего буфера в каждую лунку. В каждую лунку добавляли 100 мкл конъюгированнных с R-фикоэритрином козьих F(ab)2 против мышиных антител, разведенных 1:100, и планшеты инкубировали в течение 1 часа при 4°С. Клетки откручивали центрифугированием при 4000 об/мин в течение 5 минут и промывали добавлением 200 мкл на лунку блокирующего буфера. Супернатант отсасывали и клетки ресуспендировали в 200 мкл на лунку ЗФР, 0,25% формальдегида. Пробы переносили в пробирки FACScan и считывали показатели. Условия для установки FACScan (мощность лазера 15 мВ) были следующими: FL2 вкл.; порог FSC-H: 92; напряжение FSC РМТ: Е 01; SSC РМТ: 474; коэффициенты усиления 6,1; FL-2 РМТ: 586; величины компенсации: 0.
Анализ сывороток - бактерицидный анализ
Штамм N. meningitidis 2996 выращивали в течение ночи при 37°С на чашках с шоколадным агаром (исходный материал брали из замороженного исходного раствора) с 5% СО2. Колонии бактерий собирали и использовали для инокуляции 7 мл бульона Mueller-Hinton, содержащего 0,25% глюкозу, для получения OD620 0,05-0,08. Культуру инкубировали в течение приблизительно 1,5 часов при 37°С со встряхиванием, пока величина OD620 не достигала 0,23-0,24. Бактерии разбавляли в 50 мМ фосфатном буфере, рН 7,2, содержащем 10 мМ MgCl2, 10 мМ CaCl2 и 0,5% (масса/объем) БСА, (буфере для анализа), при рабочем разведении 105 КОЕ (колониеобразующих единиц) на мл. Общий объем реакционной смеси был 50 мкл с 25 мкл серийных 2-кратных разведении тест-сыворотки, 12,5 мкл бактерий при рабочем разведении, 12,5 мкл комплемента детеныша кролика (конечная концентрация 25%).
Контроли включали бактерии, инкубированные с сывороткой комплемента, иммунные сыворотки, инкубированные с бактериями и с комплементом, инактивированные нагреванием при 56°С в течение 30 минут. Сразу же после добавления комплемента детенышей кролика 10 мкл контролей высевали на чашки с агаром Mueller-Hinton с использованием метода с наклоном (время 0). 96-луночный планшет инкубировали в течение 1 часа при 37°С с вращением. 7 мкл каждой пробы высевали на чашки с агаром Mueller-Hinton в виде пятен, в то время как 10 мкл контролей высевали на чашки с агаром Mueller-Hinton с использованием метода с наклоном (время 1). Чашки с агаром инкубировали в течение 18 часов при 37°С и считали колонии, соответствующие времени 0 и времени 1.
Анализ сывороток - вестерн-блоты
Очищенные белки (500 нг на дорожку), везикулы наружных мембран (5 мкг) и общие клеточные экстракты (25 мкг), полученные из штамма MenB 2996, наносили на 12% ДСН-полиакриламидный гель и переносили на нитроцеллюлозную мембрану. Перенос выполняли в течение 2 часов при 150 мА при 4°С с использованием буфера для переноса (0,3% Трис-основание, 1,44% глицин, 20% (об./об.) метанол). Мембрану насыщали ночным инкубированием при 4°С в буфере для насыщения (10% обезжиренное молоко, 0,1% Тритон Х-100 в ЗФР). Мембрану промывали дважды промывочным буфером (3% обезжиренное молоко, 0,1% Тритон Х-100 в ЗФР) и инкубировали в течение 2 часов при 37°С с мышиными сыворотками, разведенными 1:200 в промывочном буфере. Мембрану промывали дважды и инкубировали в течение 90 минут с разведением 1:2000 меченого пероксидазой хрена антимышиного Ig. Мембрану промывали дважды 0,1% Тритоном Х-100 в ЗФР и проявляли с использованием субстратного набора Opti-4CN Substrate Kit (Bio-Rad). Реакцию останавливали добавлением воды.
OMV (везикулы наружных мембран) получали следующим образом: штамм N. meningitidis 2996 выращивали в течение ночи при 37°С с 5% CO2 на GC-чашках, собирали петлей и ресуспендировали в 10 мл 20 мМ Трис-HCl рН 7,5, 2 мМ ЭДТА. Инактивацию нагреванием выполняли при 56°С в течение 45 минут и бактерии разрушали обработкой ультразвуком в течение 5 минут на льду (50% рабочий цикл, 50% выход, микронаконечник 3 мм ультразвукового дезинтегратора Бренсона). Неразрушенные клетки удаляли центрифугированием при 5000 g в течение 10 минут, супернатант, содержащий тотальную фракцию оболочек клеток, извлекали и дополнительно центрифугировали в течение ночи при 50000 g при температуре 4°С. Осадок, содержащий мембраны, ресуспендировали в 2% саркозиле, 20 мМ Трис-HCl рН 7,5, 2 мМ ЭДТА и инкубировали при комнатной температуре в течение 20 минут для солюбилизации внутренних мембран. Суспензию центрифугировали при 10000 g в течение 10 минут для удаления агрегатов, супернатант дополнительно центрифугировали при 50000 g в течение 3 часов. Осадок, содержащий наружные мембраны, промывали в ЗФР и ресуспендировали в том же самом буфере. Концентрацию белка измеряли по способу D.C. Bio-Rad Protein assay (модифицированному способу Лоури) с использованием БСА в качестве стандарта.
Общие клеточные экстракты получали следующим образом: штамм N. meningitidis 2996 выращивали в течение ночи на GC-чашке, собирали петлей и ресуспендировали в 1 мл 20 мМ Трис-HCl. Инактивацию нагреванием выполняли при 56°С в течение 30 минут.
Исследования доменов 961
Получение клеточных фракций. Общий лизат, периплазму, супернатант и OMV.клонов Е. coli, экспрессирующих различные домены 961, получали с использованием бактерий из ночной культуры или после 3 часов индукции IPTG. Вкратце, периплазму получали суспендированием бактерий в 25% сахарозе и 50 мМ Трисе (рН 8) с полимиксином (100 мкг/мл). После 1 часа при комнатной температуре бактерии центрифугировали при 13000 об/мин и супернатант собирали. Культуральный супернатант фильтровали через фильтр 0,2 мкм и осаждали 50% ТХУ на льду в течение двух часов. После центрифугирования (30 минут при 13000 об/мин) осадки промывали дважды 70% этанолом и суспендировали в ЗФР. Получение OMV выполняли, как описано ранее. Каждую клеточную фракцию анализировали электрофорезом в ДСН-ПДАГ или в Вестерн-блоте с использованием поликлональной антисыворотки, индуцированной против GST-961.
Тест адгезии. Эпителиальные клетки Chang (производное Wong-Kilbourne, клон 1-5с-4, конъюнктива человека) поддерживали в DMEM (Gibco), дополненной 10% инактивированной нагреванием ФТС, 15 мМ L-глутамином и антибиотиками.
Для анализа адгезии субконфлюентную культуру эпителиальных клеток Chang промывали ЗФР и обрабатывали смесью трипсин-ЭДТА (Gibco) для высвобождения их из пластикового носителя. Затем эти клетки суспендировали в ЗФР, считали и разводили в ЗФР до 5×105 клеток/мл.
Бактерии из ночной культуры или после индукции IPTG осаждали и промывали дважды ЗФР центрифугированием при 13000 об/мин в течение 5 минут. Приблизительно 2-3×108 (КОЕ) инкубировали с 0,5 мг/мл FITC (флуоресцеинизотиоцианата, ФИТЦ) (Sigma) в 1 мл буфера, содержащего 50 мМ NaHCO3 и 100 мМ NaCI pH 8, в течение 30 минут при комнатной температуре в темноте. ФИТЦ-меченые бактерии промывали 2-3 раза и суспендировали в ЗФР при 1-1, 5×109/мл. 200 мкл этой суспензии (2-3×108) инкубировали с 200 мкл (1×105) эпителиальных клеток в течение 30 мин при 37°С. Затем клетки центрифугировали при 2000 об/мин в течение 5 минут для удаления неприкрепившихся бактерий, суспендировали в 200 мкл ЗФР, переносили в пробирки FACScan и считывали показатели.

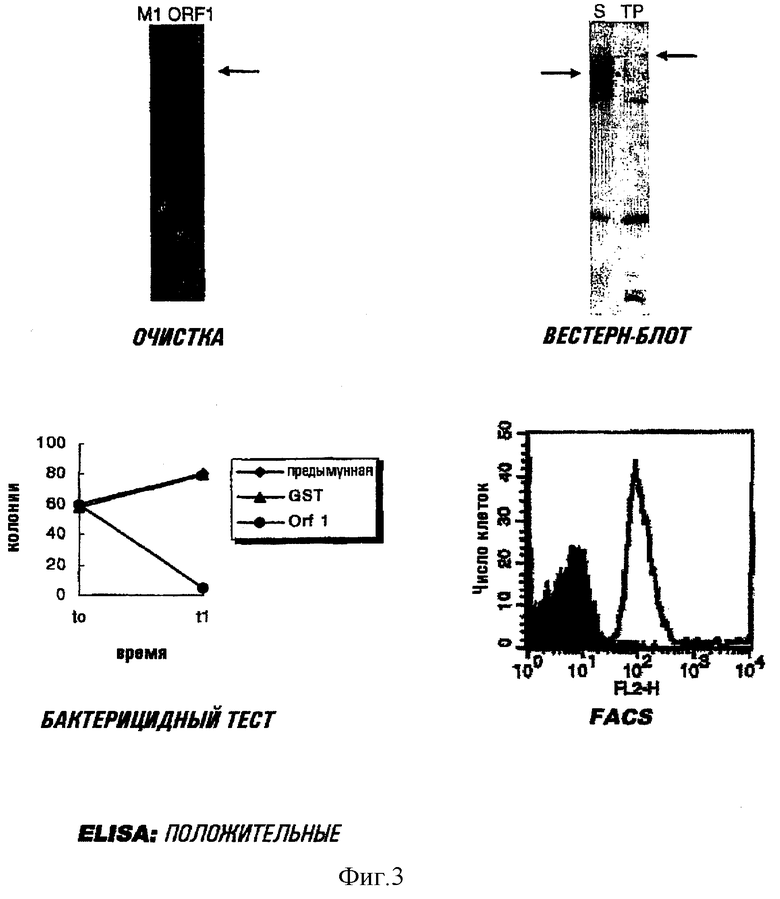


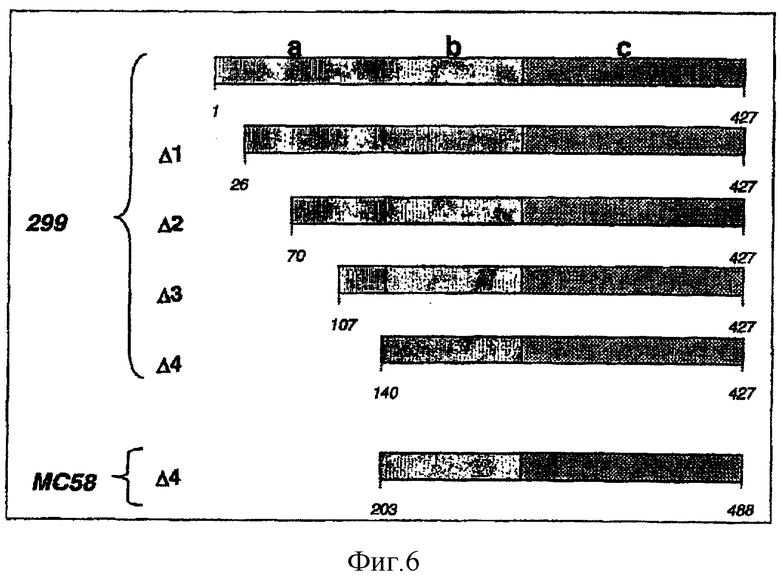
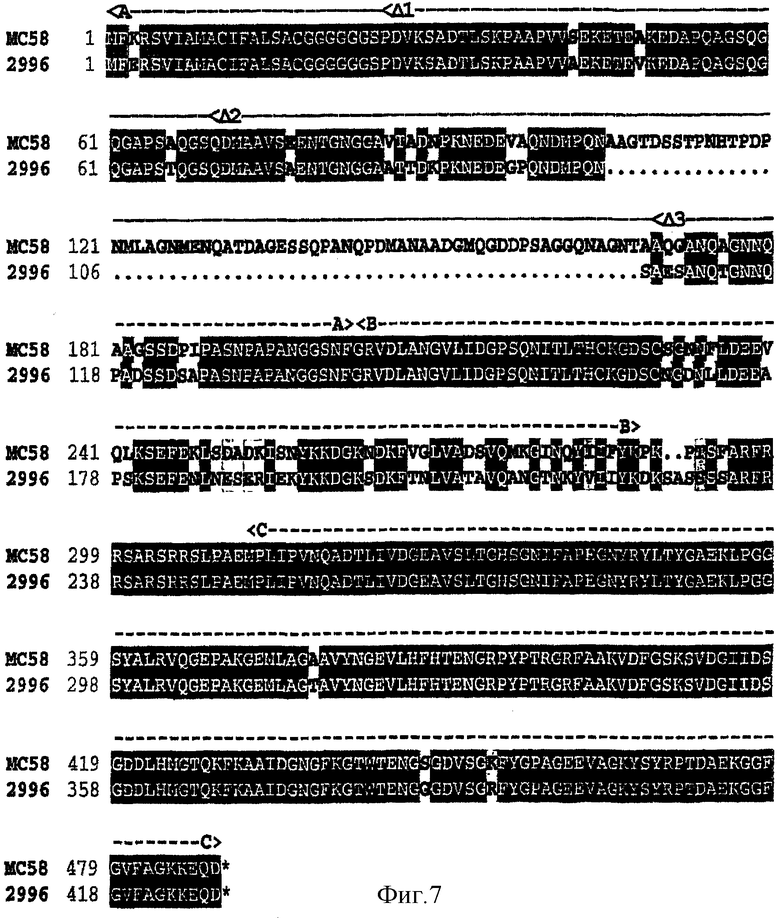
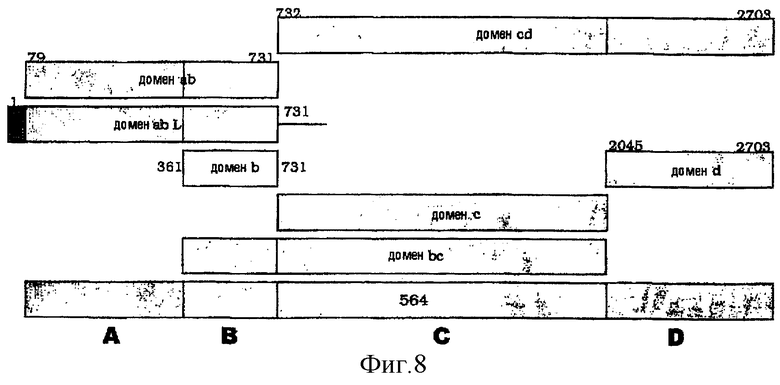

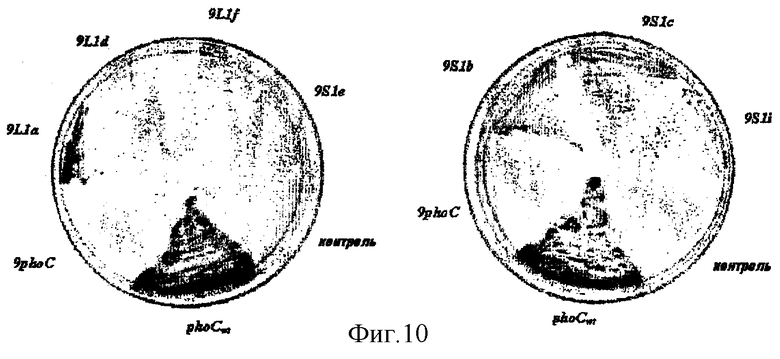

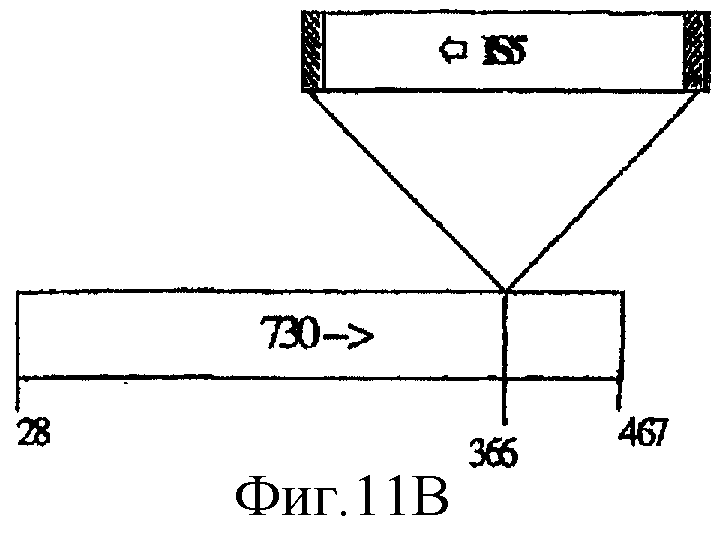
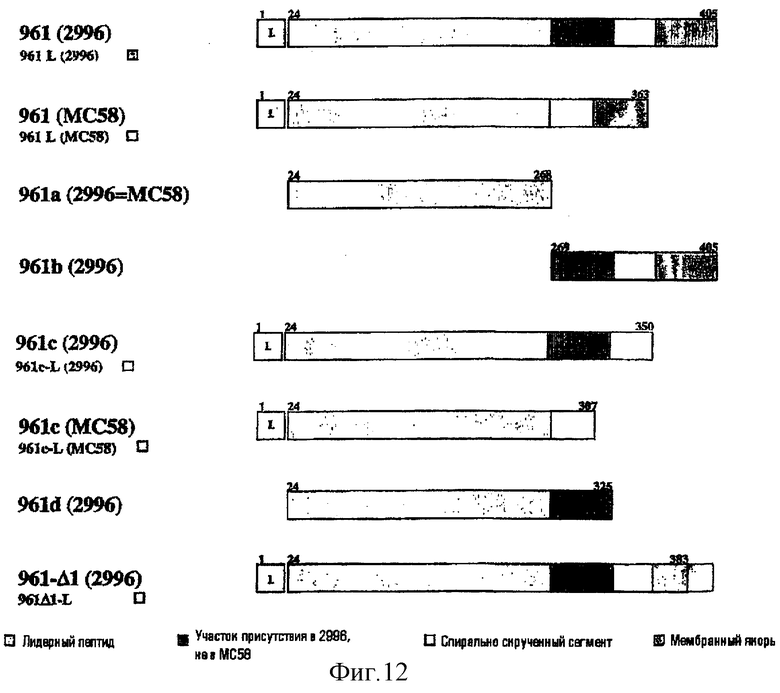
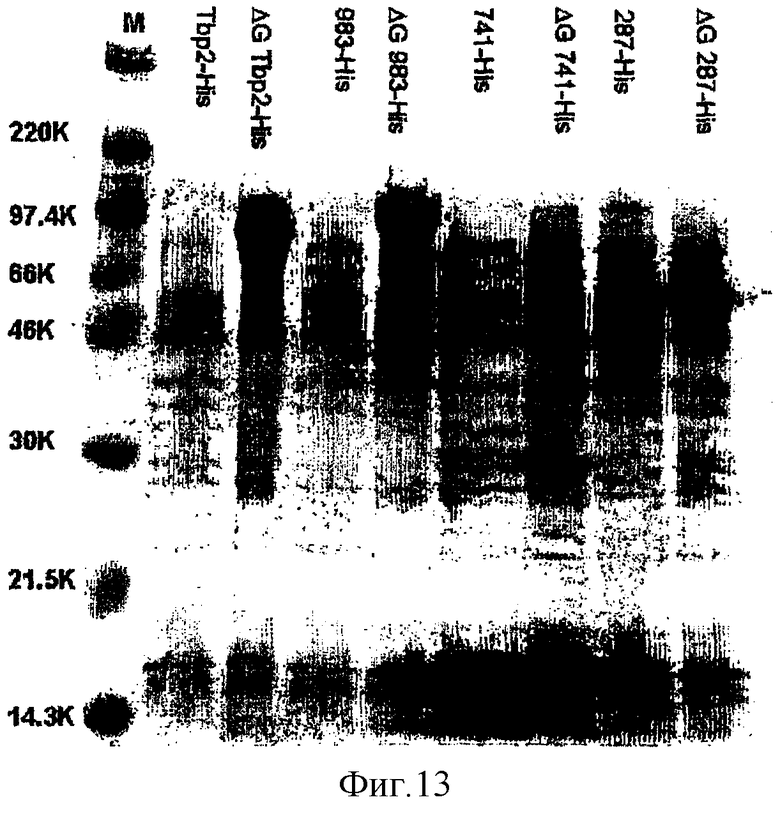
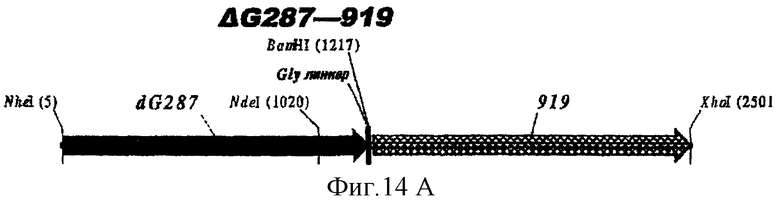
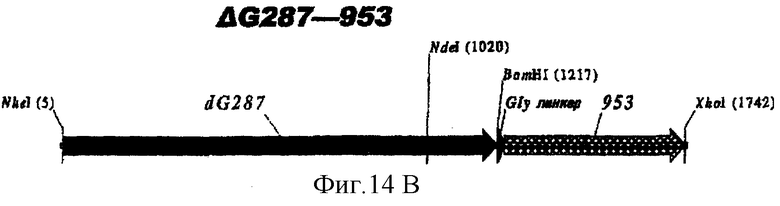
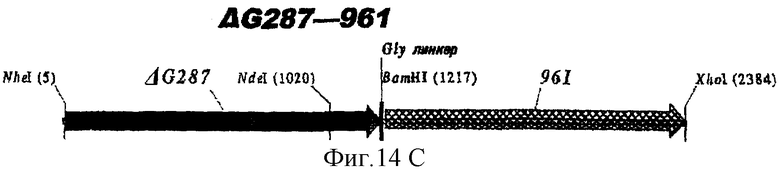
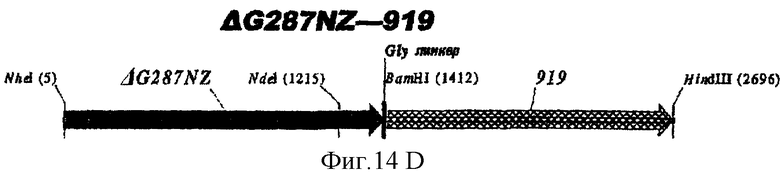

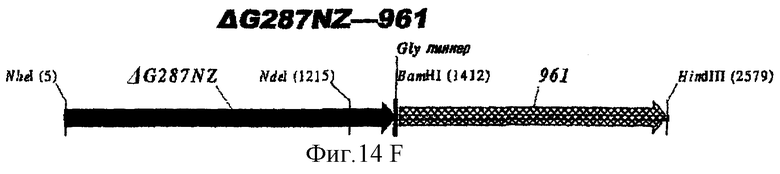








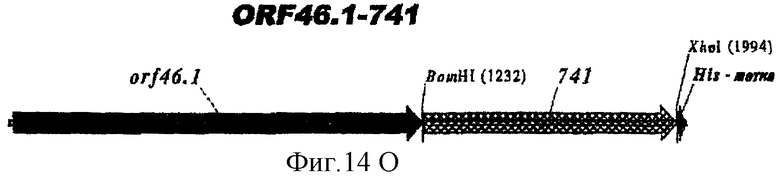

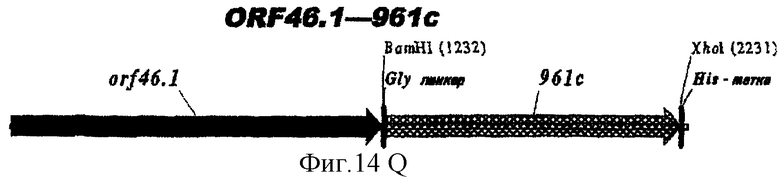
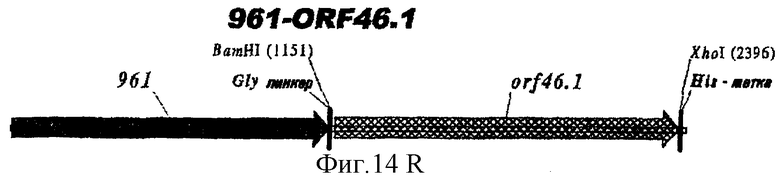

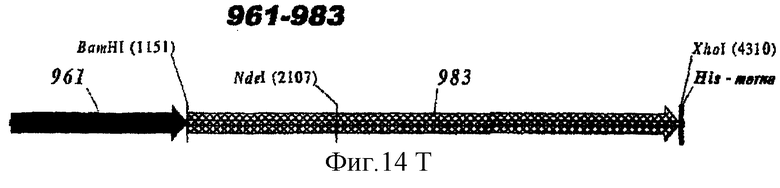

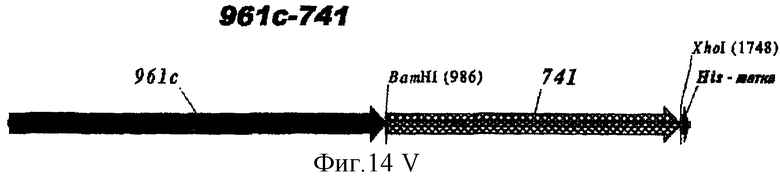
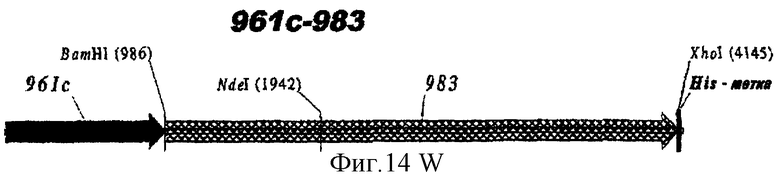
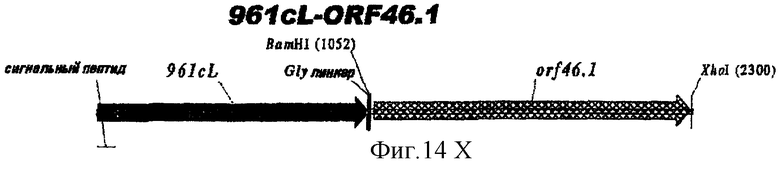
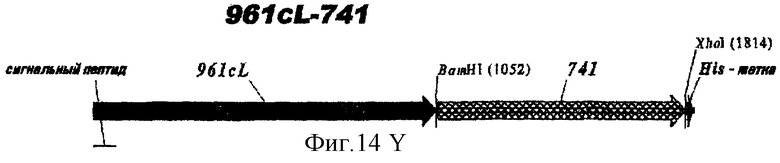

Изобретение относится к биотехнологии и представляет собой способ гетерологичной экспрессии белка Neisseria meningitidis в E.coli. При этом экспрессируемый белок обладает иммуногенной активностью в отношении Neisseria meningitidis. Заявленное изобретение позволяет получать иммуногенные белки с высокой степенью эффективности. 2 н. и 4 з.п. ф-лы, 14 ил.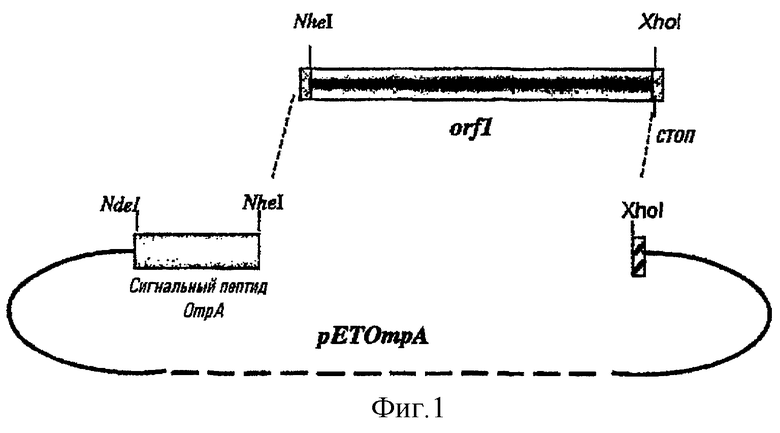
(a) белок 961 имеет аминокислотную последовательность '961' штамма МС58:
MSMKHFPAKV LTTAILATFC SGALAATSDD DVKKAATVAI
VAAYNNGQEI NGFKAGETIY DIGEDGTITQ KDATAADVEA
DDFKGLGLKK VVTNLTKTVN ENKQNVDAKV KAAESEIEKL
TTKLADTDAA LADTDAALDE TTNALNKLGE NITTFAEETK
TNIVKIDEKL EAVADTVDKH AEAFNDIADS LDETNTKADE
AVKTANEAKQ TAEETKQNVD AKVKAAETAA GKAEAAAGTA
NTAADKAEAV AAKVTDIKAD IATNKADIAK NSARIDSLDK
NVANLRKETR QGLAEQAALS GLFQPYNVGR FNVTAAVGGY
KSESAVAIGT GFRFTENFAA KAGVAVGTSS GSSAAYHVGV
NYEW
и где
(b) по крайней мере один домен белка делетирован, где домены '961' штамма МС58 следующие: (1) аминокислоты 1-23; (2) аминокислоты 24-268; (3) аминокислоты 269-307; и (4) аминокислоты 308-364, и где белок '961' экспрессируется в Е. coli.
| WO 9713860 А, 17.04.1997 | |||
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРОВ ATR КИНАЗЫ (ВАРИАНТЫ) | 2014 |
|
RU2720408C2 |
| ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ БЕЛОК ВНЕШНЕЙ МЕМБРАНЫ NEISSERIA MENINGITIDIS ШТАММА В:4:Р1:15, БЕЛОК ВНЕШНЕЙ МЕМБРАНЫ NEISSERIA MENINGITIDIS, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pМ-6, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI НВМ 64, СПОСОБ ПОЛУЧЕНИЯ БЕЛКА ВНЕШНЕЙ МЕМБРАНЫ NEISSERIA MENINGITIDIS, ВАКЦИННАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2132383C1 |
Авторы
Даты
2007-05-27—Публикация
2001-02-28—Подача