ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области экспрессии белков. В частности, оно относится к гетерологичной экспрессии белков из Neisseria (например, N. gonorrhoeae или предпочтительно N. meningitidis).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Международные патентные заявки WO 99/24578, WO 99/36544, WO 99/57280 и WO 00/22430 описывают белки из Neisseria meningitidis и Neisseria gonorrhoeae. Эти белки обычно описываются как экспрессируемые в Е. coli (т.е. при гетерологичной экспрессии) в виде либо N-концевых GST-гибридов, либо С-концевых His-метка-гибридов, хотя описаны также другие экспрессионные системы, в том числе экспрессия в нативной Neisseria.
Целью данного изобретения является обеспечение альтернативных и улучшенных подходов для гетерологичной экспрессии этих белков. Эти подходы обычно влияют на уровень экспрессии, легкость очистки, клеточную локализацию экспрессии и/или иммунологические свойства экспрессируемого белка.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с данным изобретением, два или более (например, 3, 4, 5, 6 или более) белков данного изобретения экспрессируются в виде единого гибридного белка. Предпочтительно, чтобы не был использован гибридный партнер, не относящийся к Neisseria (например, GST или поли-His).
Это дает два преимущества. Во-первых, белок, который может быть нестабильным или слабо экспрессируемым в отдельности, может преодолеть эти недостатки при добавлении подходящего гибридного партнера, который преодолевает эту проблему. Во-вторых, упрощается коммерческое получение - необходимо использование только одной экспрессии и очистки для получения двух раздельно применимых белков.
Таким образом, данное изобретение обеспечивает способ одновременной гетерологичной экспрессии двух или более белков данного изобретения, в котором гибридизуются указанные два или более белков данного изобретения (т.е. они транслируются в виде единой полипептидной цепи).
Способ обычно включает стадии: получения первой нуклеиновой кислоты, кодирующей первый белок данного изобретения; получения второй нуклеиновой кислоты, кодирующей второй белок данного изобретения; лигирования первой и второй нуклеиновых кислот. Полученная нуклеиновая кислота может быть встроена в экспрессирующий вектор или может уже быть частью экспрессирующего вектора.
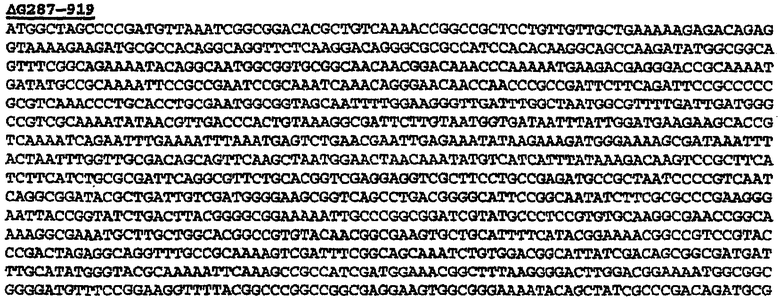
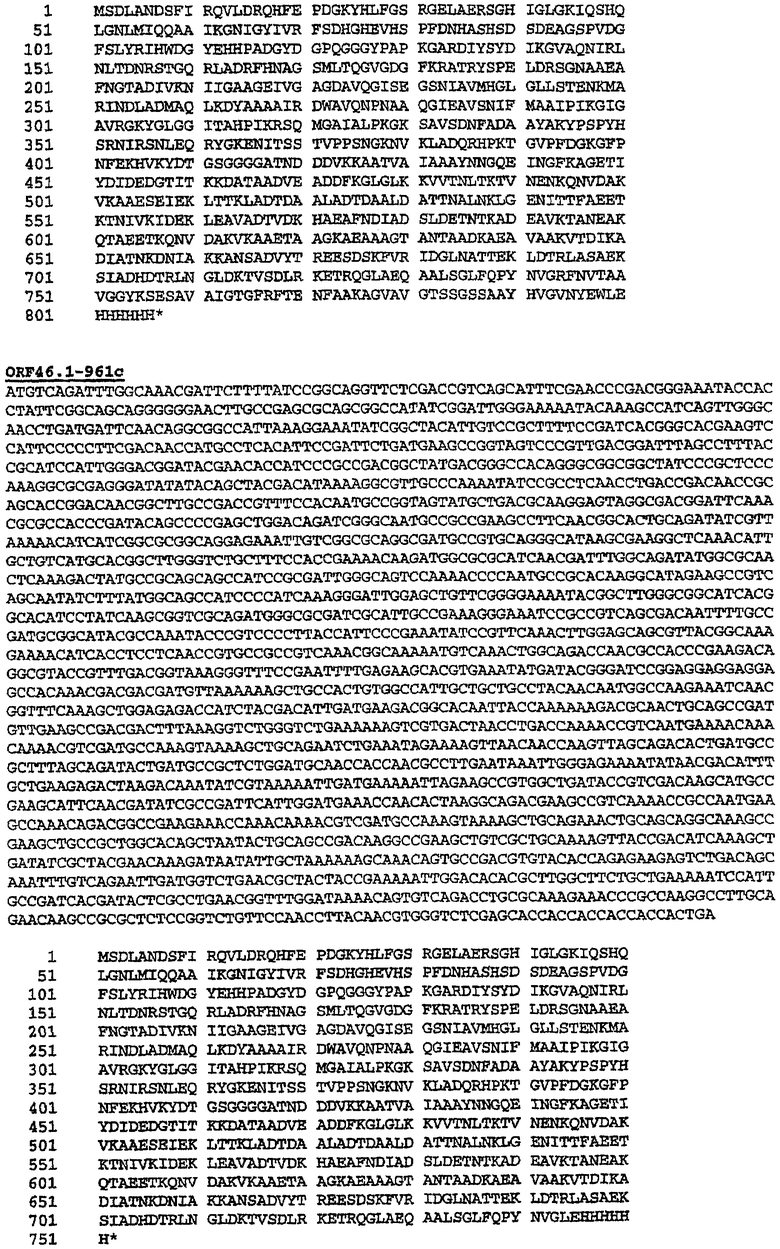
При соединении всего лишь двух белков гибридный белок может быть представлен просто формулой NH2-A-B-COOH. А и В, каждый, могут быть выбраны из любых белков Neisseria и, в частности, белков, представленных SEQ ID NO: 1-4326. Этот способ удобен для экспрессии белков orf1, orf4, orf25, orf40, orf46/46.1, orf83, 233, 287, 292L, 564, 687, 741, 907, 919, 953, 961 и 983.
Предпочтительными являются 42 гибрида, указанные «X» в следующей таблице, формулы NH2-A-B-COOH:
Таким образом, предпочтительными белками для экспрессии в качестве гибридов являются ORF46.1, 287, 741, 919, 953, 961 и 983. Они могут быть использованы в их по существу полноразмерной форме или могут быть использованы формы с полиглициновой делецией (ΔG) (например, ΔG-287, ΔGTbp2, ΔG741, ΔG983 и т.д.) или могут быть использованы укороченные формы (например, Δ1-287, Δ2-287 и т.д.) или версии с делетированными доменами (например, 287В, 287С, 287ВС, ORF461-433, ORF433-608, ORF46, 961с и т.д.) и т.д.
Особенно предпочтительными являются: (а) гибридный белок, содержащий 919 и 287; (b) гибридный белок, содержащий 953 и 287; (с) гибридный белок, содержащий 287 и ORF46.1; (d) гибридный белок, содержащий ORF1 и ORF46.1; (е) гибридный белок, содержащий 919 и ORF46.1; (f) гибридный белок, содержащий ORF46.1 и 919; (g) гибридный белок, содержащий ORF46.1, 287 и 919; (h) гибридный белок, содержащий 919 и 519; и (i) гибридный белок, содержащий ORF97 и 225.
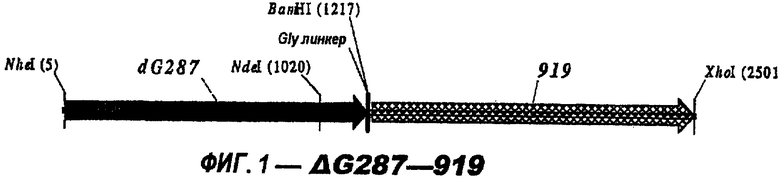
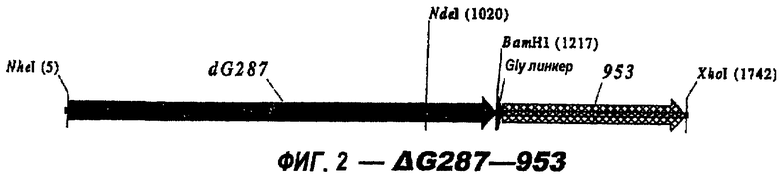
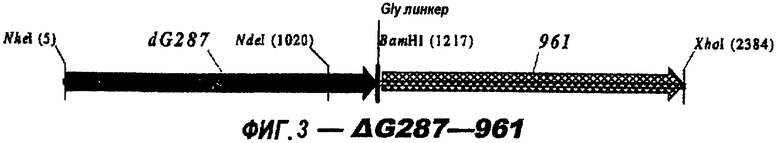
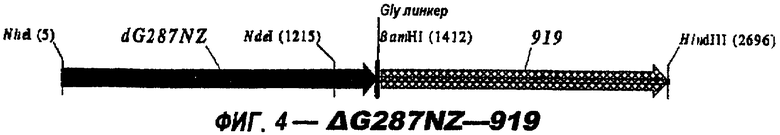
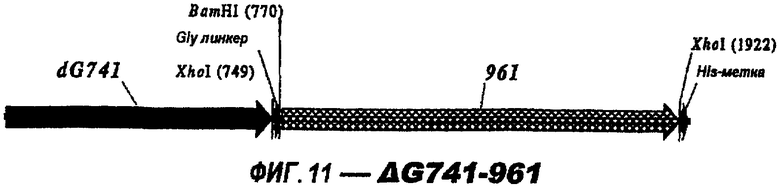
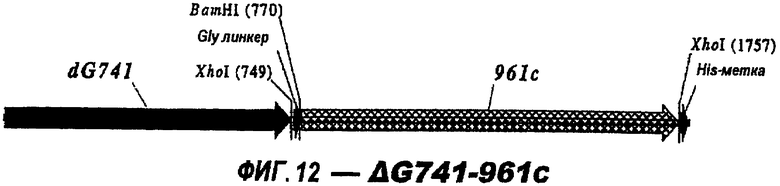
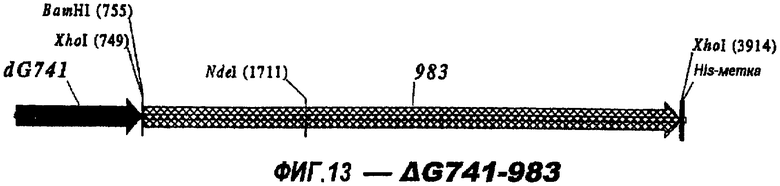
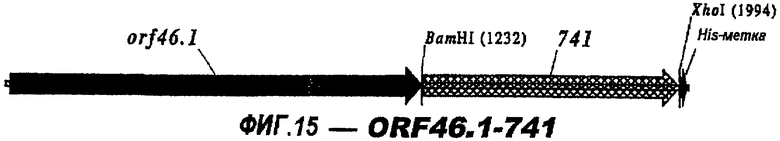
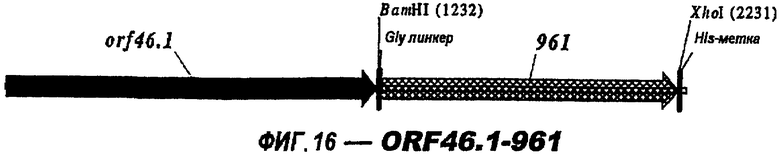
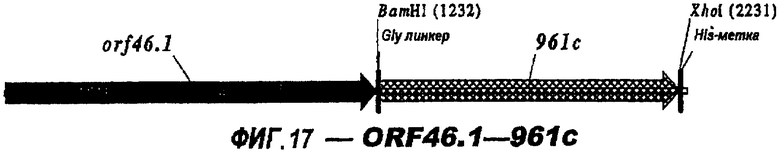
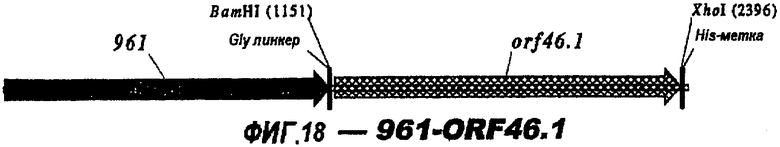
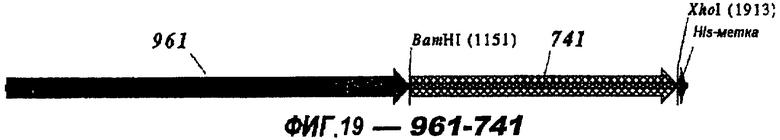
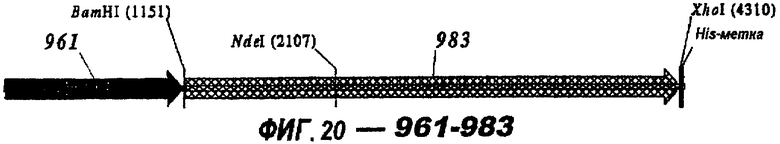
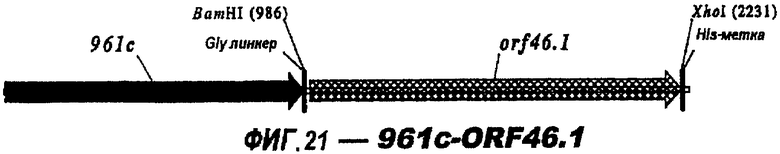
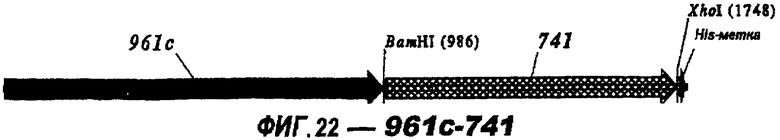
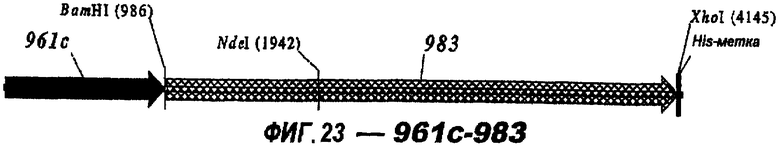
Следующие варианты показаны на рисунках и включают ΔG287-919, ΔG287-953, ΔG287-961, ΔG983-ORF46.1, ΔG983-741, ΔG983-961, ΔG983-961C, ΔG741-961, ΔG741-961C, ΔG741-983, ΔG741-ORF46.1, ORF46.1-741, ORF46.1-961, ORF46.1-961С, 961-ORF46.1, 961-741, 961-983, 961C-ORF46.1, 961С-741, 961С-983, 961CL-ORF46.1, 961CL-741 и 961CL-983.
При применении 287 он предпочтительно находится на С-концевой стороне гибрида; если он должен использоваться на N-конце, предпочтительно использовать форму ΔG287 (например, в виде N-конца гибрида с ORF46.1, 919, 953 или 961).
При применении 287 он предпочтительно происходит из штамма 2996 или из штамма 394/98.
При применении 961 он предпочтительно находится на N-конце. Могут быть использованы формы доменов 961.
Сопоставления полиморфных форм ORF46, 287, 919 и 953 описаны в WO 00/66741. Любые из этих полиморфных форм могут быть использованы в соответствии с данным изобретением.
Предпочтительно составляющие белки (А и В) в гибридном белке в соответствии с данным изобретением происходят из одного и того же штамма.
Гибридные белки в гибриде могут быть соединены непосредственно или могут быть соединены через линкерный пептид, например, через полиглициновый линкер (т.е. Gn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более) или через короткую пептидную последовательность, которая облегчает клонирование. Очевидно, что предпочтительно не присоединять ΔG-белок к С-концу полиглицинового линкера.
Гибридные белки могут быть лишены лидерных пептидов или могут включать в себя последовательность лидерного пептида N-концевого гибридного партнера.
Хозяин
Предпочтительно использовать гетерологичного хозяина. Гетерологичный хозяин может быть прокариотическим или эукариотическим. Предпочтительно он является Е. coli, но другие подходящие хозяева включают Bacillus subtilis. Vibrio cholerae. Salmonella typhi, Salmonella typhimurium, Neisseria meningitidis, Neisseria gonorrhoeae, Neisseria lactamica, Neisseria cinerea, Mycobacteria (например, М. tuberculosis), дрожжи и т.д.
Векторы, хозяева и т.д.
Кроме описанных выше способов, данное изобретение обеспечивает (а) нуклеиновую кислоту и векторы, применимые в этих способах; (b) клетки-хозяева, содержащие указанные векторы; (с) белки, экспрессируемые или способные экспрессироваться этими способами; (d) композиции, содержащие эти белки, которые могут быть пригодны, например, в качестве вакцин или в качестве диагностических реагентов или в качестве иммуногенных композиций; (е) эти композиции для применения в качестве лекарственных средств (например, в качестве вакцин) или в качестве диагностических реагентов; (f) применение этих композиций в приготовлении (1) лекарственного средства для лечения или профилактики инфекции, вызываемой бактериями Neisseria; (2) диагностического реагента для обнаружения присутствия бактерий Neisseria или антител, индуцированных против бактерий Neisseria, и/или (3) реагента, который может индуцировать антитела против бактерий Neisseria; и (g) способ лечения пациента, включающий введение пациенту терапевтически эффективного количества этих композиций.
Последовательности
Данное изобретение обеспечивает также белок или нуклеиновую кислоту, имеющие любую из последовательностей, представленных в следующих примерах. Оно обеспечивает также белки и нуклеиновые кислоты, имеющие идентичность последовательности в отношении указанных последовательностей. Степень "идентичности последовательности" предпочтительно является более высокой, чем 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или более).
Применяемая здесь номенклатура
2166 последовательностей белков, описанных в WO 99/24578, WO 99/36544 и WO 99/57280, называются здесь следующими SEQ ID NO:-номерами:
Кроме этой SEQ ID NO: - нумерации, используются также стандартные наименования, используемые в WO 99/24578, WO 99/36544 и WO 99/57280 (например, 'ORF4', 'ORF40', 'ORF40-1' и т.д., которые используются в WO 99/24578 и WO 99/36544; 'm919', 'g919' и 'а919' и т.д., которые используются в WO 99/57280).
2160 белков NMB0001-NMB2160 из Tettelin et al. [Science (2000) 287:1809-1815] называются здесь SEQ ID NO:2167-4326 [см. также WO 00/66791].
Термин «белок данного изобретения» в применении здесь относится к белку, содержащему
(a) одну из последовательностей SEQ ID NO:1-4326; или
(b) последовательность, имеющую идентичность последовательности относительно одной из SEQ ID NO:1-4326;
или
(c) фрагмент одной из SEQ ID NO: 1-4326.
Степень «идентичности последовательности», упоминаемой в (b), является предпочтительно выше 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или более). Это включает мутанты и аллельные варианты (например, см. WO 00/66741). Идентичность предпочтительно определяют при помощи алгоритма поиска гомологии Smith-Waterman, имеющегося в программе MPSRCH (Oxford Molecular), с использованием поиска аффинного гэпа с параметрами штрафа открывания гэпа=12 и штрафа удлинения гэпа=1. Обычно 50%-ную или более высокую идентичность между двумя белками считают указанием на функциональную эквивалентность.
«Фрагмент», упоминаемый в (с), должен содержать по меньшей мере n последовательных аминокислот из одной из SEQ ID NO:1-4326 и, в зависимости от конкретной последовательности, n равен 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100 или более). Предпочтительный фрагмент содержит эпитоп из одной из SEQ ID NO:1-4326. Предпочтительными фрагментами являются фрагменты, описанные в WO 00/71574 и WO 01/04316.
Предпочтительные белки данного изобретения обнаружены в серологической группе В N. meningitidis.
Предпочтительными белками для применения в соответствии с данным изобретением являются белки штамма 2996 или штамма 394/98 (Ново-Зеландского штамма) N. meningitidis серологической группы В. Если нет иных указаний, упомянутые здесь белки являются белками из штамма 2996 N. meningitidis. Однако должно быть понятно, что данное изобретение в общем не ограничивается штаммом. Ссылки на конкретный белок (например, "287", "919" и т.д.) могут иметь в виду данный белок из любого штамма.
Должно быть понятно, что ссылки на "нуклеиновую кислоту" включают в себя ДНК и РНК, а также их аналоги, такие как содержащие модифицированные скелеты, а также пептиднуклеиновые кислоты (ПНК) и т.д.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигуры 1-26 показывают гибридные белки данного изобретения.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1 гибриды ORF46
Полный белок ORF46 из N. meningitidis (серологическая группа В, штамм 2996) имеет следующую последовательность:

Лидерный пептид подчеркнут.
Последовательности ORF46 из других штаммов могут быть найдены в WO 00/66741.
ORF46 гибридизован на его С-конце и N-конце с 287, 919 и ORF1. Эти гибридные белки были обычно нерастворимыми, но давали некоторые хорошие результаты ELISA и бактерицидные результаты (против гомологичного штамма 2996):
Для сравнения, конструировали «тройные» гибриды ORF46.1, 287 (либо в виде GST-гибрида, либо в форме ΔG287) и 919 и тестировали их против различных штаммов (в том числе гомологичного штамма 2996) в сравнении с простой смесью этих трех антигенов. FCA (полный адъювант Фрейнда) использовали в качестве адъюванта:
И в этом случае эти гибриды обнаруживают эквивалентную или превосходящую иммунологическую активность.
Гибриды двух белков (штамма 2996) сравнивали с индивидуальными белками против различных гетерологичных штаммов:
Опять гибриды обнаруживают эквивалентную или превосходящую иммунологическую активность.
Пример 2 гибриды ΔG287
Было обнаружено, что делеция (Gly)6-последовательности в 287 оказывает сильное действие на экспрессию белка. Белок, лишенный N-концевых аминокислот вплоть до GGGGGG, называют «ΔG287». В штамме МС58 его основная последовательность (лидерный пептид подчеркнут) представлена ниже:

ΔG287, с His-меткой или без His-метки (″ΔG287-His" и «ΔG287K», соответственно), экспрессируется при очень хороших уровнях в сравнении с «287-His» или «287немеченный».
На основании данных по вариабельности генов, варианты ΔG287-His экспрессировали в Е. coli из ряда штаммов MenB, в частности, из штаммов 2996, МС58, 1000 и BZ232. Результаты также были хорошими: каждый из них давал высокие титры ELISA, а также сывороточные бактерицидные титры >8192. ΔС287К, экспрессируемый из плазмиды рЕТ-24b, давал превосходные титры в ELISA и сывороточном бактерицидном анализе.
Делеция поли-Cly-последовательностей также применима к Tbp2 (NMB0460), 741 (NMB 1870) и 983 (NMB1969). При клонировании в вектор рЕТ и экспрессии в Е. coli без последовательности, кодирующей их лидерные пептиды и без поли-Gly (т.е. в виде «ΔG-форм»), наблюдали одно и то же действие - экспрессия была хорошей в клонах, несущих делецию полиглицинового отрезка, и слабой или отсутствующей, если глицины присутствовали в экспрессируемом белке.
ΔG287 гибридизовали непосредственно в рамке считывания против хода транскрипции (слева) 919, 953, 961 (последовательности показаны ниже) и ORF46.1:


Бактерицидная эффективность (гомологичный штамм) антител, индуцированных против гибридных белков, сравнивали с антителами, индуцированными против простых смесей составляющих антигенов (с использованием 287-GST) для 919 и ORF46.1:
Получали также данные бактерицидной активности против гетерологичных штаммов MenB и против серотипов А и С:
Таким образом, гибридные белки с ΔG287 на N-конце превосходят иммунологически простые смеси, причем ΔС287-ORF46.1 является особенно эффективным, даже против гетерологичных штаммов. ΔG287-ORF46.1К может экспрессироваться в рЕТ-24b.
Такие же гибридные белки получали с использованием Ново-Зеландского штамма 394/98, а не 2996:













Пример 5 гибриды 287
Экспрессия 287 в виде полноразмерного белка с С-концевой His-меткой или без его лидерного пептида, но с С-концевой His-меткой дает довольно низкие уровни экспрессии. Лучшая экспрессия достигается с использованием N-концевого GST-гибрида. В качестве альтернативы использованию GST в качестве N-концевого гибридного партнера, 287 помещали на С-конце белка 919 ("919-287"), белка 953 ("953-287") и белков ORF46.1 ("ORF46.1-287"). В обоих случаях лидерные пептиды были делегированы и гибриды были прямыми гибридами в рамке считывания.
Для генерирования гибрида 953-287 лидерные пептиды этих двух белков удаляли конструированием прямого праймера по ходу транскрипции (справа) от лидера каждой последовательности; последовательность стоп-кодона удаляли в обратном праймере 953, но включали в обратный праймер 287. Для гена 953 5' и 3' праймеры, использованные для амплификации, включали в себя сайты рестрикции Ndel и BamHI, соответственно, тогда как для амплификации гена 287 5' и 3' праймеры включали в себя сайты рестрикции BamHI и XhoI, соответственно. Таким путем могло достигаться последовательное направленное клонирование этих двух генов в рЕТ21b+, с использованием NdeI-BamHI (для клонирования первого гена) и затем BamHI-XhoI (для клонирования второго гена).
Гибрид 919-287 получали клонированием последовательности, кодирующей зрелую часть 287 в сайт XhoI на 3'-конце 919-His-клона в рЕТ21b+. Праймеры, используемые для амплификации гена 287, конструировали введением сайта рестрикции Sail при 5'-и сайта XhoI при 3'-конце этого ПЦР-фрагмента. Поскольку липкие концы, продуцируемые рестриктазами SalI и XhoI, являются совместимыми, ПЦР-продукт 287, расщепленный SalI-XhoI, мог быть встроен в клон рЕТ21b-919, расщепленный XhoI.
Гибрид ORF46.1-287 получали сходным образом.
Бактерицидную активность (против гомологичного штамма) антител, индуцированных против гибридных белков, сравнивали с антителами, индуцированными против простых смесей составляющих антигенов:
Получали также данные бактерицидной активности против гетерологичных штаммов MenB и против серотипов А и С для 919-287 и 953-287:
Конструировали также гибриды ORF46.1 и 919. Наилучшие результаты (в четыре раза более высокие титры) были достигнуты с 919 на N-конце.
Испытывали также гибриды 919-519His, ORF97-225His и 225-ORF97His. Они дали умеренные титры ELISA и умеренные реакции в виде бактерицидных антител.
Поскольку гибриды двух белков А и В могут быть либо NH2-A-B-COOH, либо NH2-В-А-СООН, получали также «обращенные» гибриды с 287 на N-конце, но с использованием ΔG287. Использовали панель штаммов, в том числе гомологичный штамм 2996. FCA использовали в качестве адъюванта:
Лучшие бактерицидные титры обычно наблюдали с 287 на N-конце.
При гибридизации с белком 961 (NH2-ΔG287-961-COOH-последовательность, показанная выше) полученный белок является нерастворимым и должен денатурироваться и ренатурироваться для очистки. Было обнаружено, что после ренатурации около 50% этого белка оставались нерастворимыми. Растворимые и нерастворимые белки сравнивали, и гораздо лучшие бактерицидные титры получали с растворимым белком (с использованием FCA в качестве адъюванта):
Однако титры с нерастворимой формой улучшались с использованием квасцов в качестве адъюванта:
961с также использовали в гибридных белках (см. выше). Поскольку 961 и его «доменные» варианты направляют эффективную экспрессию, они идеально пригодны в качестве N-концевой части гибридного белка.
Пример 23 - другие гибриды
Другие гибридные белки данного изобретения показаны на чертежах и имеют представленные ниже последовательности. Они обладают преимуществами в сравнении с индивидуальными белками:









Должно быть понятно, что данное изобретение было описано только в виде примера, и могут быть произведены модификации без отклонения от идеи и объема данного изобретения. Например, предполагается применение белков из других штаммов (например, см. WO 00/66741 в отношении полиморфных последовательностей для ORF4, ORF40, ORF46, 225, 235, 287, 519, 726, 919 и 953).
ЭКСПЕРИМЕНТАЛЬНЫЕ ПОДРОБНОСТИ
Стратегия клонирования и конструирование олигонуклеотидов
Гены, кодирующие представляющие интерес антигены, амплифицировали при помощи ПЦР с использованием олигонуклеотидов, сконструированных на основе геномной последовательности N. meningitidis В МС58. Геномную ДНК из штамма 2996 использовали всегда в качестве матрицы в ПЦР-реакциях, если нет других указаний, и амплифицированные фрагменты клонировали в экспрессирующий вектор рЕТ21b+ (Novagen) для экспрессии белка в виде His-меченого на С-конце продукта или в pET-24b+ (Novagen) для экспрессии «немеченной» формы (например, ΔG287K).
Когда белок экспрессировали без гибридного партнера и с его собственным лидерным пептидом (если он присутствует), выполняли амплификацию открытой рамки считывания (кодоны ATG-СТОП-кодон).
Когда белок экспрессировали в «немеченной» форме, лидерный пептид удаляли конструированием 5'-концевого праймера амплификации справа от предсказанной лидерной последовательности.
Температура плавления праймеров, используемых в ПЦР, зависела от числа и типа гибридизующихся нуклеотидов в целом праймере, и ее определяли с использованием формул:
Температуры плавления выбранных олигонуклеотидов были обычно 65-70°С для полного олигонуклеотида и 50-60°С только для гибридизующегося участка.
Олигонуклеотиды синтезировали с использованием ДНК/РНК-синтезатора Perkin Elmer 394, элюировали из колонок в 2,0 мл NH40H и освобождали от защитных групп 5-часовой инкубацией при 56°С. Олигонуклеотиды осаждали добавлением 0,3 М Na-ацетата и 2 объемов этанола. Пробы центрифугировали и осадки ресуспендировали в воде.
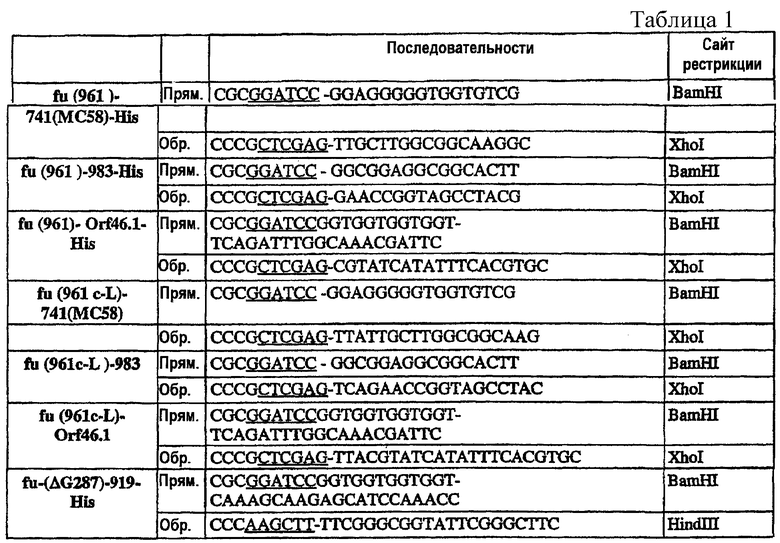
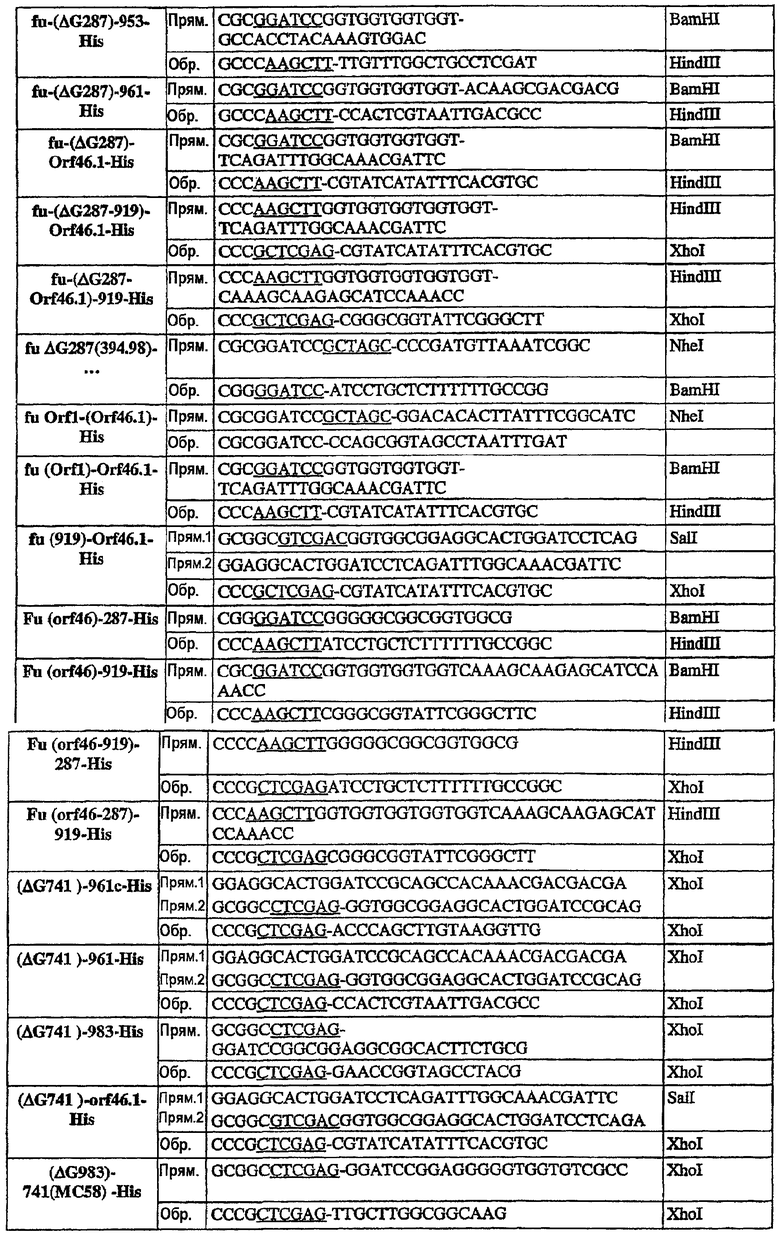

Прямые праймеры использовали в комбинации с Обратным праймером 287-His.
NB - Все ПЦР-реакции используют штамм 2996, если нет других указаний (например, штамм МС58).
Во всех конструкциях, начинающихся с ATG, не сопровождающегося уникальным сайтом NheI, кодон ATG является частью сайта NdeI, используемого для клонирования. Конструкции, приготовленные с использованием NheI в качестве сайта клонирования при 5'-конце (например, все конструкции, содержащие 287 на N-конце), имеют два дополнительных кодона (GCT AGC), гибридизованные с кодирующей последовательностью антигена.
Получение матриц хромосомной ДНК
Штаммы N. meningitidis 2996, МС58, 394.98, 1000 и BZ232 (и другие) выращивали до экспоненциальной фазы в 100 мл GC-среды, собирали центрифугированием и ресуспендировали в 5 мл буфера (20% масса/объем сахароза, 50 мМ Трис-HCl, 50 мМ ЭДТА, рН 8). После 10 минут инкубирования на льду бактерии лизировали добавлением 10 мл лизисного раствора (50 мМ NaCI, 1% Na-саркозил, 50 мкг/мл Протеиназы К) и суспензию инкубировали при 37°С в течение 2 часов. Выполняли две экстракции фенолом (уравновешенным до рН 8) и одну экстракцию смесью CHCl3/изоамиловый спирт (24:1). ДНК осаждали добавлением 0,3 М ацетата натрия и 2 объемов этанола и собирали центрифугированием. Осадок промывали один раз 70% (об./об.) этанолом и перерастворяли в 4,0 мл ТЭ-буфера (10 мМ Трис-HCl, 1 мМ ЭДТА, рН 8,0). Концентрацию ДНК измеряли считыванием OD260.
ПЦР-амплификация
Стандартный протокол ПЦР был следующим: 200 нг геномной ДНК из штаммов 2996, МС58, 1000 или BZ232 или 10 нг препарата плазмидной ДНК рекомбинантных клонов использовали в качестве матрицы в присутствии 40 мкМ каждого олигонуклеотидного праймера, 400-800 мкМ раствора dNTP, 1 x ПЦР-буфера (включающего 1,5 мМ MgCl2), 2,5 единиц ДНК-полимеразы TaqI (с использованием Perkin Elmer AmpliTaQ, Boehringer Mannheim Expand™ Long Template).
После предварительной 3-минутной инкубации всей смеси при 95°С, каждую пробу подвергали двухстадийной амплификации: первые 5 циклов выполняли с использованием температуры гибридизации, которая исключала хвост рестриктазы праймера (Tпл1). Затем следовали 30 циклов в соответствии с температурой гибридизации, рассчитанной для полноразмерных олигонуклеотидов (Тпл2). Время элонгации, выполняемой при 68°С или 72°С, варьировалось в соответствии с длиной Orf, подлежащего амплификации. В случае Orf1 время элонгации, начинаясь с 3 минут, увеличивалось на 15 секунд с каждым циклом. Циклы завершались 10-минутной стадией удлинения при 72°С.
Амплифицированную ДНК наносили непосредственно на 1% агарозный гель. ДНК-фрагмент, соответствующий полосе правильного размера, очищали из геля с использованием набора для экстракции гелей Qiagen Gel Extraction Kit согласно протоколу изготовителя.
Расщепление ПЦР-фрагментов и клонирующих векторов
Очищенную ДНК, соответствующую амплифицированному фрагменту, расщепляли подходящими рестриктазами для клонирования в рЕТ-21b+, рЕТ22b+ или рЕТ-24b+. Расщепленные фрагменты очищали с использованием набора для очистки QIAquick PCR purification kit (согласно инструкциям изготовителя) и элюировали либо Н2O, либо 10 мМ Трисом, рН 8,5. Плазмидные векторы расщепляли подходящими рестриктазами, наносили на 1,0% агарозный гель и полосу, соответствующую расщепленному вектору, очищали с использованием набора для экстракции гелей Qiagen QIAquick Gel Extraction Kit.
Клонирование
Фрагменты, соответствующие каждому гену, предварительно расщепленные и очищенные, лигировали в рЕТ21b+, рЕТ22b+ или рЕТ-24b+. Использовали молярное отношение 3:1 фрагмент/вектор с ДНК-лигазой Т4 в буфере для лигирования, поставляемом изготовителем.
Рекомбинантную плазмиду трансформировали в компетентные клетки Е. coli DH5 или НВ101 инкубированием раствора лигазной реакции и бактерий в течение 40 минут на льду, затем при 37°С в течение 3 минут. Затем следовало добавление 800 мкл LB-бульона и инкубирование при 37°С в течение 20 минут. Клетки центрифугировали при максимальной скорости в микрофуге Эппендорфа, ресуспендировали в приблизительно 200 мкл супернатанта и высевали на содержащем LB-ампициллин (100 мг/мл) агаре.
Скрининг на рекомбинантные клоны выполняли выращиванием случайно выбранных колоний в течение ночи при 37°С в 4,0 мл смеси LB-бульон + 100 мкг/мл ампициллин. Клетки осаждали и плазмидную ДНК экстрагировали с использованием набора Qiagen QIAprep Spin Miniprep Kit согласно инструкциям изготовителя. Приблизительно 1 мкг каждого индивидуального минипрепарата расщепляли подходящими рестриктазами и продукт расщепления наносили на 1-1,5% агарозный гель (в зависимости от ожидаемого размера вставки) параллельно с маркером молекулярной массы (1 т.п.н. ДНК-лэддер, GIBCO). Позитивные клоны отбирали на основании размера вставки.
Экспрессия
После клонирования каждого гена в экспрессирующий вектор рекомбинантные плазмиды трансформировали в штаммы Е. coli, пригодные для экспрессии рекомбинантного белка. 1 мкл каждой конструкции использовали для трансформации Е. coli BL21-DE3, как описано выше. Отдельные рекомбинантные колонии инокулировали в 2 мл LB + Амп (100 мкг/мл), инкубировали при 37°С в течение ночи, затем разводили 1:30 в 20 мл LB + Амп (100 мкг/мл) в колбах на 100 мл с получением OD600 между 0,1 и 0,2. Колбы инкубировали при 30°С или при 37°С во вращательном шейкере с водяной баней до тех пор, пока OD600 не указывал экспоненциальный рост, подходящий для индукции экспрессии (0,4-0,8 OD). Экспрессию белка индуцировали добавлением 1,0 мМ IPTG (изопропилтиогалактозида). После 3 часов инкубирования при 30°С или при 37°С измеряли OD600 и исследовали экспрессию. 1,0 мл каждой пробы центрифугировали в микрофуге, осадок ресуспендировали в ЗФР и анализировали при помощи электрофореза в ДСН/ПААГ и окрашивания Кумасси синим.
Очистка His-меченых белков
Разные формы 287 клонировали из штаммов 2996 и МС58. Их конструировали с His-меченым гибридом на С-конце и они включали зрелую форму (аминокислоты 18-427), конструкции с делециями (Δ1, Δ2, Δ3 и Δ4) и клоны, состоящие либо из В-, либо из С-доменов. Для каждого клона, очищенного в виде His-гибрида, отдельную колонию высевали штрихом и выращивали в течение ночи при 37°С на чашке с агаром LB/Амп (100 мкг/мл). Выделенную колонию из этой чашки инокулировали в 20 мл жидкой среды LB/Амп (100 мкг/мл) и выращивали в течение ночи при 37°С при встряхивании. Ночную культуру разводили 1:30 в 1,0 л жидкой среды LB-Амп (100 мкг/мл) и выращивали при оптимальной температуре (30 или 37°С), пока OD550 не достигала 0,6-0,8. Экспрессию рекомбинантного белка индуцировали добавлением IPTG (конечная концентрация 1,0 мМ) и эту культуру инкубировали еще в течение 3 часов. Бактерии собирали центрифугированием при 8000 g в течение 15 минут при 4°С. Осадок бактерий ресуспендировали в 7,5 мл (i) холодного буфера А (300 мМ NaCl, 50 мМ фосфатный буфер, 10 мМ имидазол, рН 8,0) для растворимых белков или (ii) буфера В (10 мМ Трис-HCl, 100 мМ фосфатный буфер, рН 8,8 и, необязательно, 8 М мочевина) для нерастворимых белков. Белки, очищенные в виде растворимой формы, включали 287-His, Δ1, Δ2, Δ3 и Δ4287-His, Δ4287MC58-His, 287c-His и 287cMC58-His. Белок 287bMC58-His был нерастворимым и его очищали соответствующим образом. Клетки разрушали обработкой ультразвуком на льду четыре раза в течение 30 секунд при 40 W с использованием ультразвукового дезинтегратора 450 Бренсона и центрифугировали при 13000хg в течение 30 минут при 4°С. Для нерастворимых белков осадки ресуспендировали в 2,0 мл буфера С (6 М гидрохлорид гуанидина, 100 мМ фосфатный буфер, 10 мМ Трис-HCl, рН 7,5) и обрабатывали 10 активациями гомогенизатора Даунса. Гомогенат центрифугировали при 13000 g в течение 30 минут и супернатант сохраняли. Супернатанты как растворимого, так и нерастворимого препаратов смешивали с 150 мкл Ni2+-смолы (предварительно уравновешенной буфером А или буфером В, как требуется) и инкубировали при комнатной температуре с осторожным перемешиванием в течение 30 минут. Смолой была хелатирующая Сефароза Fast Flow (Pharmacia), полученная в соответствии с протоколом изготовителя. Получаемый периодически препарат центрифугировали при 700 g в течение 5 минут при 4°С и супернатант отбрасывали. Смолу промывали дважды (при периодическом получении) 10 мл буфера А или В в течение 10 минут, ресуспендировали в 1,0 мл буфера А или В и наносили на одноразовую колонку. Смолу продолжали промывать либо (i) буфером А при 4°С, либо (ii) буфером В при комнатной температуре, пока OD280 протекающего раствора не достигала 0,02-0,01. Смолу дополнительно промывали либо (i) холодным буфером С (300 мМ NaCl, 50 мМ фосфатный буфер, 20 мМ имидазол, рН 8,0), либо (ii) буфером D (10 мМ Трис-HCl, 100 мМ фосфатный буфер, рН 6,3, и, необязательно, 8 М мочевина), пока OD280 протекающего через колонку раствора не достигала 0,02-0,01. His-гибридный белок элюировали добавлением 700 мкл либо (i) холодного буфера для элюции А (300 мМ NaCI, 50 мМ фосфатный буфер, 250 мМ имидазол, рН 8,0), либо (ii) буфера для элюции В (10 мМ Трис-HCl, 100 мМ фосфатный буфер, рН 4,5, и, необязательно, 8 М мочевина) и фракции собирали, пока OD280 не показывала, что получен весь рекомбинантный белок. Аликвоты по 20 мкл каждой фракции элюции анализировали при помощи электрофореза в ДСН-ПААГ. Концентрацию белка определяли по способу Бредфорда.
Ренатурация денатурированных His-гибридных белков
Денатурация требовалась для солюбилизации 287bМС8, поэтому перед иммунизацией применяли стадию ренатурации. К денатурированным фракциям, полученным, как описано выше, добавляли глицерин с получением конечной концентрации 10% (об./об.). Белки разбавляли до 200 мкг/мл с использованием диализного буфера I (10% об./об. глицерин, 0,5 М аргинин, 50 мМ фосфатный буфер, 5,0 мМ восстановленный глутатион, 0,5 мМ окисленный глутатион, 2,0 М мочевина, рН 8,8) и диализовали против того же буфера в течение 12-14 часов при 4°С. Дополнительный диализ проводили с буфером II (10% об./об. глицерин, 0,5 М аргинин, 50 мМ фосфатный буфер, 5,0 мМ восстановленный глутатион, 0,5 мМ окисленный глутатион, рН 8,8) в течение 12-14 часов при 4°С. Концентрацию белка определяли с использованием формулы:
Белок (мг/мл)=(1,55×OD280)-(0,76 ×OD260)
Иммунизация
Мышей BALB/c иммунизировали антигенами в дни 0, 21 и 35 и сыворотки анализировали в день 49.
Анализ сывороток ELISA
Лишенный капсулы MenB M7 и инкапсулированные штаммы высевали на чашки с шоколадным агаром и инкубировали в течение ночи при 37°С с 5% CO2. Колонии бактерий собирали из чашек с агаром с использованием стерильного тампона (dracon swab) и инокулировали в бульон Mueller-Hinton (Difco), содержащий 0,25% глюкозу. Бактериальный рост отслеживали каждые 30 минут определением OD620. Бактерии выращивали, пока OD620 не достигала величины 0,4-0,5. Культуру центрифугировали в течение 10 минут при 4000 об/мин. Супернатант отбрасывали и бактерии промывали дважды ЗФР, ресуспендировали в ЗФР, содержащем 0,025% формальдегид, и инкубировали в течение 1 часа при 37°С и затем в течение ночи при 4°С при перемешивании. 100 мкл бактериальных клеток добавляли в каждую лунку 96-луночного планшета Greiner и инкубировали в течение ночи при 4°С. Затем лунки промывали три раза ЗФР-буфером для промывок (0,1% Твин-20 в ЗФР). 200 мкл буфера насыщения (2,7% поливинилпирролидон 10 в воде) добавляли в каждую лунку и планшеты инкубировали в течение 2 часов при 37°С. Лунки промывали три раза ЗФР. 200 мкл разбавленных сывороток (буфер для разведения: 1% БСА, 0,1% Твин-20, 0,1% NaN3 в ЗФР) добавляли в каждую лунку и планшеты инкубировали в течение 2 часов при 37°С. Лунки промывали три раза ЗФР. 100 мкл HRP-конъюгированной кроличьей антимышиной сыворотки (Dako), разведенной 1:2000 в буфере для разведения, добавляли в каждую лунку и планшеты инкубировали в течение 90 минут при 37°С. Лунки промывали три раза ЗФР-буфером. 100 мкл субстратного буфера для HRP (25 мл цитратного буфера рН 5, 10 мг О-фенилдиамина и 10 мкл Н2О2) добавляли в каждую лунку и планшеты оставляли при комнатной температуре на 20 минут. 100 мкл 12,5% H2SO4 добавляли в каждую лунку и определяли OD490. Титры ELISA рассчитывали в относительных единицах в виде разведения сывороток, которое давало величину OD490 0,4 над уровнем предымунных сывороток. Анализ ELISA считался позитивным, когда разведение сывороток с OD490 0,4 было больше, чем 1:400.
Анализ сывороток FACS-Scan-анализ связывания бактерий
Лишенный капсулы штамм MenB M7 высевали на чашки с шоколадным агаром и инкубировали в течение ночи при 37°С с 5% CO2. Колонии бактерий собирали из чашек с агаром с использованием стерильного тампона (dracon swab) и инокулировали в 4 пробирки, содержащие, каждая, 8 мл бульона Mueller-Hinton (Difco), содержащего 0,25% глюкозу. Бактериальный рост отслеживали каждые 30 минут определением OD620. Бактерии выращивали, пока OD620 не достигала величины 0,35-0,5. Культуру центрифугировали в течение 10 минут при 4000 об/мин. Супернатант отбрасывали и осадок ресуспендировали в блокирующем буфере (1% БСА в ЗФР, 0,4% NaN3) и центрифугировали в течение 5 минут при 4000 об/мин. Клетки ресуспендировали в блокирующем буфере с получением OD620 0,05. 100 мкл бактериальных клеток добавляли в каждую лунку 96-луночного планшета Costar. 100 мкл разведенных (1:100, 1:200, 1:400) сывороток (в блокирующем буфере) добавляли в каждую лунку и планшеты инкубировали в течение 2 часов при 4°С. Клетки центрифугировали в течение 5 минут при 4000 об/мин, супернатант отсасывали и клетки промывали добавлением 200 мкл на лунку блокирующего буфера в каждую лунку. В каждую лунку добавляли 100 мкл конъюгированнных с R-фикоэритрином козьих F(ab)2 против мышиных антител, разведенных 1:100, и планшеты инкубировали в течение 1 часа при 4°С. Клетки откручивали центрифугированием при 4000 об/мин в течение 5 минут и промывали добавлением 200 мкл на лунку блокирующего буфера. Супернатант отсасывали и клетки ресуспендировали в 200 мкл на лунку ЗФР, 0,25% формальдегида. Пробы переносили в пробирки FACScan и считывали показатели. Условия для установки FACScan (мощность лазера 15 мВ) были следующими: FL2 вкл.; порог FSC-H: 92; напряжение FSC РМТ: Е 01; SSC РМТ: 474; коэффициенты усиления 6,1; FL-2 РМТ: 586; величины компенсации: 0.
Анализ сывороток - бактерицидный анализ
Штамм N. meningitidis 2996 выращивали в течение ночи при 37°С на чашках с шоколадным агаром (исходный материал брали из замороженного исходного раствора) с 5% CO2. Колонии бактерий собирали и использовали для инокуляции 7 мл бульона Mueller-Hinton, содержащего 0,25% глюкозу, для получения OD620 0,05-0,08. Культуру инкубировали в течение приблизительно 1,5 часов при 37°С со встряхиванием, пока величина OD620 не достигала 0,23-0,24. Бактерии разбавляли в 50 мМ фосфатном буфере, рН 7,2, содержащем 10 мМ MgCl2, 10 мМ CaCl2 и 0,5% (масса/объем) БСА (буфер для анализа) при рабочем разведении 105 КОЕ (колониеобразующих единиц) на мл. Общий объем реакционной смеси был 50 мкл с 25 мкл серийных 2-кратных разведении тест-сыворотки, 12,5 мкл бактерий при рабочем разведении, 12,5 мкл комплемента детеныша кролика (конечная концентрация 25%).
Контроли включали бактерии, инкубированные с сывороткой комплемента, иммунные сыворотки, инкубированные с бактериями и с комплементом, инактивированные нагреванием при 56°С в течение 30 минут. Сразу же после добавления комплемента детенышей кролика 10 мкл контролей высевали на чашки с агаром Mueller-Hinton с использованием метода с наклоном (время 0). 96-луночный планшет инкубировали в течение 1 часа при 37°С с вращением. 7 мкл каждой пробы высевали на чашки с агаром Mueller-Hinton в виде пятен, в то время как 10 мкл контролей высевали на чашки с агаром Mueller-Hinton с использованием метода с наклоном (время 1). Чашки с агаром инкубировали в течение 18 часов при 37°С и считали колонии, соответствующие времени 0 и времени 1.
Анализ сывороток - вестерн-блоты
Очищенные белки (500 нг на дорожку), пузырьки (везикулы) наружных мембран (5 мкг) и общие клеточные экстракты (25 мкг), полученные из штамма MenB 2996, наносили на 12% ДСН-полиакриламидный гель и переносили на нитрофеллюлозную мембрану. Перенос выполняли в течение 2 часов при 150 мА при 4°С с использованием буфера для переноса (0,3% Трис-основание, 1,44% глицин, 20% (об./об.) метанол). Мембрану насыщали ночным инкубированием при 4°С в буфере для насыщения (10% обезжиренное молоко, 0,1% Тритон Х-100 в ЗФР). Мембрану промывали дважды промывочным буфером (3% обезжиренное молоко, 0/1% Тритон Х-100 в ЗФР) и инкубировали в течение 2 часов при 37°С с мышиными сыворотками, разведенными 1:200 в промывочном буфере. Мембрану промывали дважды и инкубировали в течение 90 минут с разведением 1:2000 меченого пероксидазой хрена антимышиного Tg. Мембрану промывали дважды 0,1% Тритоном Х-100 в ЗФР и проявляли с использованием субстратного набора Opti-4CN Substrate Kit (Bio-Rad). Реакцию останавливали добавлением воды.
OMV (везикулы наружных мембран) получали следующим образом: штамм N. meningitidis 2996 выращивали в течение ночи при 37°С с 5% CO2 на GC-чашках, собирали петлей и ресуспендировали в 10 мл 20 мМ Трис-HCl, рН 7,5, 2 мМ ЭДТА.
Инактивацию нагреванием выполняли при 56°С в течение 45 минут и бактерии разрушали обработкой ультразвуком в течение 5 минут на льду (50% рабочий цикл, 50% выход, микронаконечник 3 мм ультразвукового дезинтегратора Бренсона). Неразрушенные клетки удаляли центрифугированием при 5000 g в течение 10 минут, супернатант, содержащий тотальную фракцию оболочек клеток, извлекали и дополнительно центрифугировали в течение ночи при 50000 g при температуре 4°С. Осадок, содержащий мембраны, ресуспендировали в 2% саркозиле, 20 мМ Трис-HCl, рН 7,5, 2 мМ ЭДТА и инкубировали при комнатной температуре в течение 20 минут для солюбилизации внутренних мембран. Суспензию центрифугировали при 10000 g в течение 10 минут для удаления агрегатов, супернатант дополнительно центрифугировали при 50000 g в течение 3 часов. Осадок, содержащий наружные мембраны, промывали в ЗФР и ресуспендировали в том же самом буфере. Концентрацию белка измеряли по способу D.C. Bio-Rad Protein assay (модифицированному способу Лоури) с использованием БСА в качестве стандарта.
Общие клеточные экстракты получали следующим образом: штамм N. meningitidis 2996 выращивали в течение ночи на GC-чашке, собирали петлей и ресуспендировали в 1 мл 20 мМ Трис-HCl. Инактивацию нагреванием выполняли при 56°С в течение 30 минут.
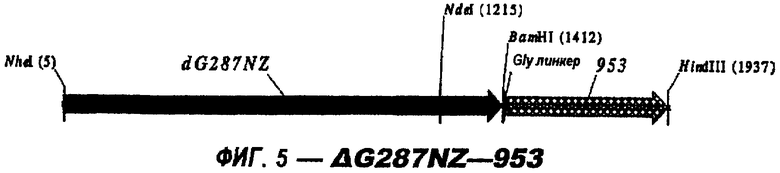
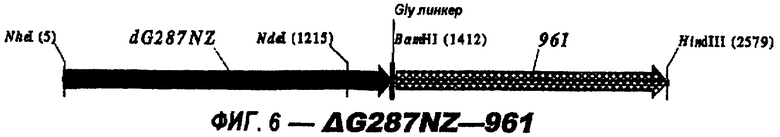
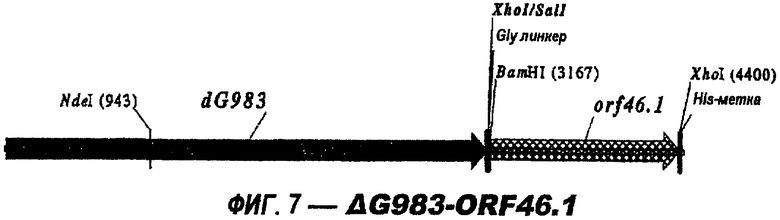

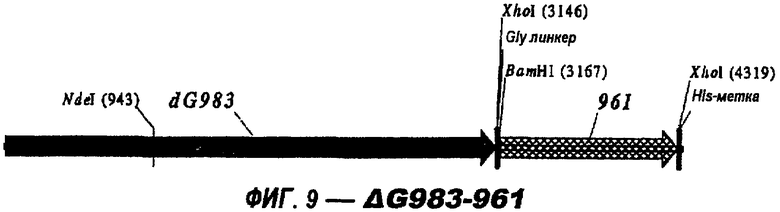


Изобретение относится к биотехнологии и представляет собой способ гетерологичной экспрессии белка Neisseria meningitidis в Е. coli. При этом экспрессируемый белок обладает иммуногенной активностью в отношении Neisseria meningitidis. Изобретение позволяет получать иммуногенные белки с высокой степенью эффективности. 3 н. и 6 з.п. ф-лы, 26 ил., 1 табл.
(a) первый белок и второй белок транслируются в единую полипептидную цепь;
(b) первый белок содержит
аминокислотную последовательность AG287 из Neisseria meningitidis:
SPDVKSADTLSKPAAPVVSEKETEAKEDAPQAGSQGQGAPSAQGSQDMAAVSEENTGNGGAVTA
DNPKNEDEVAQNDMPQNAAGTDSSTPNHTPDPNMLAGNMENQATDAGESSQPANQPDMANAADG
MQGDDPSAGGQNAGNTAAQGANQAGNNQAAGSSDPIPASNPAPANGGSNFGRVDLANGVLIDGP
SQNITLTHCKGDSCSGNNFLDEEVQLKSEFEKLSDADKISNYKKDGKNDKFVGLVADSVQMKGI
NQYIIFYKPKPTSFARFRRSARSRRSLPAEMPLIPVNQADTLIVDGEAVSLTGHSGNIFAPEGN
YRYLTYGAEKLPGGSYALRVQGEPAKGEMLAGAAVYNGEVLHFHTENGRPYPTRGRFAAKVDFG
SKSVDGIIDSGDDLHMGTQKFKAAIDGNGFKGTWTENGSGDVSGKFYGPAGEEVAGKYSYRPTD
AEKGGFGVFAGKKEQD
или последовательность, которая более чем на 80% идентична этой последовательности и сохраняет ее функцию, или иммуногенный фрагмент эпитопа указанного белка с последовательностью, содержащей по меньшей мере 7 последовательных аминокислот; и
(с) второй белок содержит аминокислотную последовательность 953 из Neisseria meningitidis
ATYKVDEYHANARFAIDHFHTSTNVGGFYGLTGSVEFDQAKRDGKIDITIPVANLQSGSQHFTD
HLKSADIFDAAQYPDIRFVSTKFNFNGKKLVSVDGNLTMHGKTAPVKLKAEKFNCYQSPMAKTE
VCGGDFSTTIDRTKWGVDYLVNVGMTKSVRIDIQIEAAKQ
или последовательность, которая более чем на 80% идентична этой последовательности и сохраняет ее функцию, или иммуногенный фрагмент эпитопа указанного белка с последовательностью, содержащей по меньшей мере 7 последовательных аминокислот.
(i) аминокислотную последовательность ΔG287 из Neisseria meningitidis
SPDVKSADTLSKPAAPVVSEKETEAKEDAPQAGSQGQGAPSAQGSQDMAAVSEENTGNGGAVTA
DNPKNEDEVAQNDMPQNAAGTDSSTPNHTPDPNMLAGNMENQATDAGESSQPANQPDMANAADG
MQGDDPSAGGQNAGNTAAQGANQAGNNQAAGSSDPIPASNPAPANGGSNFGRVDLANGVLIDGP
SQNITLTHCKGDSCSGNNFLDEEVQLKSEFEKLSDADKISNYKKDGKNDKFVGLVADSVQMKGI
NQYIIFYKPKPTSFARFRRSARSRRSLPAEMPLIPVNQADTLIVDGEAVSLTGHSGNIFAPEGN
YRYLTYGAEKLPGGSYALRVQGEPAKGEMLAGAAVYNGEVLHFHTENGRPYPTRGRFAAKVDFG
SKSVDGIIDSGDDLHMGTQKFKAAIDGNGFKGTWTENGSGDVSGKFYGPAGEEVAGKYSYRPTD
AEKGGFGVFAGKKEQD
или последовательность, которая более чем на 80% идентична этой последовательности и сохраняет ее функцию, или иммуногенный фрагмент эпитопа указанного белка с последовательностью, содержащей по меньшей мере 7 последовательных аминокислот; и В содержит
(ii) аминокислотную последовательность 953 из Neisseria meningitidis
ATYKVDEYHANARFAIDHFHTSTNVGGFYGLTGSVEFDQAKRDGKIDITIPVANLQSGSQHFTD
HLKSADIFDAAQYPDIRFVSTKFNFNGKKLVSVDGNLTMHGKTAPVKLKAEKFNCYQSPMAKTE
VCGGDFSTTIDRTKWGVDYLVNVGMTKSVRIDIQIEAAKQ
или последовательность, которая более чем на 80% идентична этой последовательности и сохраняет ее функцию, или иммуногенный фрагмент эпитопа указанного белка с последовательностью, содержащей по меньшей мере 7 последовательных аминокислот.
| US 5547670 А, 20.08.1996 | |||
| WO 9936544 А, 22.07.1999 | |||
| ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ БЕЛОК ВНЕШНЕЙ МЕМБРАНЫ NEISSERIA MENINGITIDIS ШТАММА В:4:Р1:15, БЕЛОК ВНЕШНЕЙ МЕМБРАНЫ NEISSERIA MENINGITIDIS, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pМ-6, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI НВМ 64, СПОСОБ ПОЛУЧЕНИЯ БЕЛКА ВНЕШНЕЙ МЕМБРАНЫ NEISSERIA MENINGITIDIS, ВАКЦИННАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2132383C1 |
Авторы
Даты
2007-08-20—Публикация
2001-02-28—Подача