Область техники, к которой относится изобретение
Данное изобретение касается способа быстрого выделения и очистки антител яичного желтка, в частности антитела IgY из яичного желтка птицы отряда гусеобразных, а также полученных таким образом антител яичного желтка. Более конкретно, данное изобретение относится к способу выделения и очистки антител яичного желтка из желтка птиц отряда гусеобразных путем адсорбционной хроматографии при использовании не растворимого в воде незаряженного абсорбента, с целью осуществления желаемого разделения антител яичного желтка, и путем процедуры высаливания, при которой происходит дифференцированное осаждение антител IgY. Данное изобретение касается также применения антител IgY в количественном или качественном анализе или для приготовления фармацевтических композиций, направленных на представляющий интерес этиологический агент.
Уровень техники
Антитела широко используют во многих биологических исследованиях и клинической практике. Сыворотки, полученные от гипериммунизированных млекопитающих, являются наиболее распространенным источником поликлональных антител. Антитела, выделенные из данных иммунных сывороток, принадлежат к группе белков, называемых "иммуноглобулинами", среди которых преобладающим является иммуноглобулин G (IgG). Молекула IgG состоит из трех доменов, а именно: двух участков Fab и одного участка Fc. Участок Fab принимает участие главным образом в связывании антигена. Участок Fc, хотя и не обладает способностью связываться с антигеном, направляет особую биологическую активность антитела, такую как фиксация комплемента и связывание Fc-рецептора.
В области иммунодиагностики интактная молекула IgG не подходит для применения в системах детекции и иммунологических анализах, включающих сыворотку млекопитающих, поскольку участок Fc на молекуле IgG способен связываться с Fc-рецепторами, активирующими систему комплемента и реагирующими с ревматоидным фактором в сыворотке млекопитающих. Удаление участка Fc молекулы IgG часто приводит к снижению интерференции (см. статью Е. Lamoyi, Methods in Enzymology, 121:652-663, (1986)).
Некоторые из предлагаемых вариантов применения антитела в иммунотерапии включают лечение пациентов вызывающими интоксикацию бактериальными токсинами или змеиными ядами (см., например, Патенты США 5340923 и 5601823) и защиту новорожденных поросят против летального кишечного колибациллеза (колибактериоза) (см., например, статьи Н. Brussow и соавт., J. Clin. Microbiol., 25:982, (1987) и С.О.Tacket и соавт., New Eng. J. Med., 318:1240, (1988)). Поскольку, как известно, фрагмент Fc молекулы антитела является наиболее антигенной частью иммуноглобулина (см. статью Е.М. Akita и соавт., J. Immunol. Methods, 162:155-164, (1993)), его отщепление, которое приводит к образованию фрагмента F(ab')2, будет значительно снижать число потенциальных аллергенных центров на молекуле иммуноглобулина и является таким образом полезным для человека или животного, которым вводят иммуноглобулин.
Недавно было показано, что двухвалентный фрагмент антитела F(ab')2 является более эффективным в иммунодиагностических тестах (см. статьи М.Muratsugu и соавт., J. Colloid Interface Sci., 147:378, (1991) и J.L Ortega-Vinuesa и соавт., J. Immunol. Methods, 90:29, (1996)) и более подходящим для разработки иммуноанализов с использованием сыворотки млекопитающих, чем родительское (исходное) IgG.
Однако фрагмент антитела F(ab')2 не нашел широкого применения в клинических иммунодиагностических наборах, как можно было бы предположить. Это может объясняться трудностями и нерентабельностью широкомасштабной продукции фрагментов F(ab')2, которые обыкновенно получают путем разложения IgG пепсином с последующей хроматографической очисткой.
Утки и их филогенетически близкие родственники, а также некоторые рептилии, такие как черепахи, имеют три вида сывороточных иммуноглобулинов: макромолекулярный иммуноглобулин IgM (у уток молекулярной массы 800 кД) и две изоформы низкомолекулярного IgG с коэффициентами седиментации 7,8 S (у уток молекулярной массы 180 кД) и 5,7 S (у уток молекулярной массы 130 кД), соответственно, (см. статьи E.R. Unanue и соавт., J. Exp. Med., 121:697-714, (1965); Н.М. Grey, J. Immunol., 98:811-819, (1967) и В. Zimmerman и соавт., Biochemistry, 10:482-488, (1971)). Птичий IgG часто называют IgY, поскольку кроме сыворотки он присутствует в яичном желтке. IgY 5,7 S, состоящий из более коротких тяжелых цепей, структурно и антигенно близок фрагменту F(ab')2 IgY 7,8 S (см. Фигуру 1), и данный факт приводит к тому, что термин IgY (эквивалент IgY 7,8 S) и IgY(ΔFc) (эквивалент IgY 5,7 S) представляет обе изоформы IgY (см. статью K.Е.Magor и соавт., J. Immunol., 149:2627-2633, (1992)).
Исследования, проведенные на инфицированных или экспериментально иммунизированных птицах, показали, что утиные антитела являются недостаточными по числу биологических эффекторных функций, включая фиксацию комплемента и связывание Fc-рецепторов без сокращения своей активности связывания соответствующих антигенов (см. статьи G.W. Litman и соавт., Immunochemistry, 10:323, (1973) и Т.Е. Toth и соавт., Avian Dis., 25:17-28, (1981)). Это, вероятно, может быть обусловлено явным отсутствием участка, эквивалентного Fc-участку антитела IgY(ΔFc), которое содержит основной по количеству компонент ответа антител птиц отряда гусеобразных. Таким образом, полагают, что антитело IgY(ΔFc), которое, по-видимому, является структурным и функциональным аналогом фрагмента F(ab')2, обеспечивало бы значительные преимущества при иммунологическом применении, если бы можно было разработать перспективный способ получения антитела и если бы были установлены подходящие физические требования к его активности.
Было показано, что антитела яичного желтка птиц, как и антитела млекопитающих, проявляют полезные свойства как при исследовательском, так и при клиническом применении (см., например, Патенты США 5340923, 5585098, 5601823 и 5976519). Яичные желтки, полученные от самок птиц-несушек, являются недорогими и более удобными и безопасными для работы по сравнению с гипериммунизированными сыворотками млекопитающих. Более важно, что антитела яичного желтка соответствуют современным требованиям защиты животных (см. статьи A. Poison и соавт., Immunol. Commun., 9:475, (1980) и В. Gottstein и соавт.). Данные факты позволяют предположить потенциальную возможность применения яичного желтка в качестве промышленного источника антител.
Однако высокий уровень содержания липидных субстанций, таких как жирные кислоты, холестерин и лецитин, в яичном желтке делает выделение антител яичного желтка обременительной трудоемкой задачей. В этом плане было предпринято много попыток. Например, водорастворимые осаждающие агенты, включая агар, пектин (японская заявка Japanese Kokai No. 64-38098, опубликованная 8 февраля 1989), декстран сульфат (см. статью J.C. Jensenius и соавт., J. Immunol. Methods, 46:63, (1981)), природные камеди (см. статью Н.Hatta и соавт., J. Food-Science, 53:425, (1988)) и полиэтиленгликоль (ПЭГ) (см. статью A. Poison и соавт., Immunol. Invest., 14:323, (1985), см. также Патент США 4550019, выданный A.Poison) были использованы для осаждения неводных биомолекул, в основном липидов и гранул яичного желтка, чтобы таким образом собрать водорастворимую фазу, содержащую большую часть всей популяции антител яичного желтка. A. Hassl и соавт. разработали двухстадийный хроматографический способ, предусматривающий проведение хроматографии на основе гидрофобного взаимодействия и вытеснительной хроматографии, для дальнейшего выделения всей популяции антител яичного желтка из фракции, очищенной с помощью ПЭГ (см. статью А. Hassl и Н. Aspock, J. Immunol. Methods, 110:225, (1988)). В работе Akita и соавт. описан усовершенствованный способ выделения IgY, согласно которому антитела яичного желтка экстрагировали из куриных яиц путем разведения яичных желтков большим объемом воды и проведения вытеснительной хроматографии и/или ионообменной хроматографии полученного супернатанта (см. статьи Е.М.Akita и соавт., J. Immunol. Methods, 160:207, (1993) и Е. М. Akita и S.Nakai, J. Food Sci., 57:629, (1993)).
Однако все эти исследования и патенты сосредоточены на выделении всей популяции антител яичного желтка (которая включает в себя по меньшей мере IgY с участком Fc и/или IgY, лишенный участка Fc) из птичьих яиц, а не на избирательной очистке антител lgY(ΔFc) и IgY. Более того, поскольку антитела IgY(ΔFc) имеются только у птиц, принадлежащих к отряду Anseriformes (гусеобразных), включающему в себя уток и гусей, и поскольку описано, что содержание липидов в яичном желтке птиц отряда гусеобразных выше, чем у птиц отряда куриных, таких как курица и индейка, традиционные способы, описанные выше, не дают возможности предположить удачную очистку антитела IgY(ΔFc). Антитело IgY(ΔFc) было очищено только путем соосаждения с IgY из утиной сыворотки (см. статью D.A. Higgins и соавт., Veterinary Immunology and Immunopathology, 41:169-180, (1995)) с использованием сложных и дорогостоящих процедур, но до настоящего времени антитело IgY(ΔFc) отдельно не было селективно выделено из яичного желтка.
Вследствие этого, существует необходимость быстрого рентабельного и высокоэффективного способа, обеспечивающего легкое выделение желательного антитела IgY из набора антител яйца птицы отряда гусеобразных при поддержании активности антитела IgY. Практически чистое антитело IgY(ΔFc) может действовать как антитело F(ab')2 нового типа в различных вариантах применения в иммунодиагностике и иммунотерапии.
Сущность изобретения
Было предпринято широкомасштабное исследование с целью выполнения промышленных требований к антителам яичного желтка, как указано выше. Неожиданно обнаружено, что успешное выделение антител яичного желтка из яичных желтков птиц отряда гусеобразных можно легко осуществить путем адсорбционной хроматографии с использованием не растворимого в воде незаряженного абсорбента и/или путем простой процедуры высаливания, которая позволяет разделить различные изоформы антител яичного желтка. Согласно способу, соответствующему данному изобретению, высокоочищенные антитела яичного желтка, в частности высокоочищенные IgY(ΔFc), можно легко получить с высоким выходом экономически выгодным образом, и они готовы для широкого применения в иммунологии.
В соответствии с этим задачей данного изобретения является разработка способа селективного выделения антител IgY из яичного желтка птиц отряда гусеобразных, который характеризуется:
(а) абсорбцией антител яичного желтка в смешивающейся с водой фракции, полученной из яичного желтка птиц отряда гусеобразных, с помощью не растворимого в воде незаряженного абсорбента, выбранного из группы, состоящей из силиката, соединений кремния, карбоната, сульфата, фосфата, угля, целлюлозы и синтетического волокна, керамики и оксида металла, где не растворимый в воде незаряженный абсорбент находится в количестве, эффективном для отделения антител яичного желтка от смешивающейся с водой фракции, и
(b) промыванием не растворимого в воде незаряженного абсорбента буфером с получением водной фракции, содержащей антитела яичного желтка.
Другим аспектом изобретения является разработка способа селективного выделения антител IgY из яичного желтка птиц отряда гусеобразных, который характеризуется проведением первого высаливания путем высаливания водной фракции, содержащей антитела яичного желтка, с использованием (NH4)2SO4 в первой концентрации, лежащей в интервале от приблизительно 15% (мас./об.) до приблизительно 24% (мас./об.), причем не более чем приблизительно 21% (мас./об.) от объема водной фракции, и затем проводят второе высаливание путем высаливания водной фракции, содержащей антитела яичного желтка, обработанной при первом высаливании, с помощью (NH4)2SO4 второй концентрации, лежащей в интервале от приблизительно 25% (мас./об.) до приблизительно 40% (мас./об.), предпочтительно не более чем приблизительно 31% (мас./об.) от объема водной фракции, обработанной при первом высаливании.
Еще одним аспектом изобретения является разработка способа селективного выделения антител IgY из яичного желтка птиц отряда гусеобразных, который характеризуется:
(а) абсорбцией антител яичного желтка в смешивающейся с водой фракции, полученной из яичного желтка птиц отряда гусеобразных, с помощью не растворимого в воде незаряженного абсорбента, выбранного из группы, состоящей из силиката, соединений кремния, карбоната, сульфата, фосфата, угля, целлюлозы и синтетического волокна, керамики и оксида металла, где не растворимый в воде незаряженный абсорбент находится в количестве, эффективном для отделения антител яичного желтка от смешивающейся с водой фракции,
(b) промыванием не растворимого в воде незаряженного абсорбента буфером с получением водной фракции, содержащей антитела яичного желтка,
(c) высаливанием водной фракции, содержащей антитела яичного желтка, полученной на стадии (b), с использованием (NH4)2SO4 в первой концентрации, лежащей в интервале от приблизительно 15% (мас./об.) до приблизительно 24% (мас./об.), и предпочтительно не более чем приблизительно 21% (мас./об.) от объема водной фракции, и
(d) высаливание водной фракции, содержащей антитела яичного желтка, обработанной на стадии (с), с помощью (NH4)2SO4 второй концентрации, лежащей в интервале от приблизительно 25% (мас./об.) до приблизительно 40% (мас./об.), предпочтительно не более чем приблизительно 31% (мас./об.) от объема водной фракции, обработанной на стадии (с).
Согласно способу, соответствующему данному изобретению, значительное количество выбранной изоформы антител яичного желтка, в частности антитела IgY(ΔFc), пригодной для различных вариантов промышленного применения, можно получить экономически выгодным, эффективным и сберегающим время способом.
Еще одним объектом, соответствующим изобретению, является клиническое применение и применение в исследовательских целях полученного таким образом антитела IgY. Кроме рентабельности и простоты получения антитело IgY(ΔFc), соответствующее данному изобретению, имеет преимущество в том, что оно является неактивным в отношении системы комплемента и ревматоидных факторов в сыворотке млекопитающих и обладает низкой перекрестной реактивностью с IgG млекопитающих, являясь таким образом особенно подходящим для применения в иммунологических анализах, включающих сыворотку млекопитающих при минимальной интерференции. Компетентными специалистами в данной области было бы оценено, что антитело IgY может присутствовать в форме отдельного реагента для клинических, исследовательских и других целей или может быть включено в коммерческий набор в качестве активного компонента.
Другим специфическим объектом изобретения является реагент для иммуноанализа представляющего интерес этиологического агента, который содержит антитело IgY, полученное с помощью способа, соответствующего данному изобретению.
Перечень фигур чертежей и иных материалов
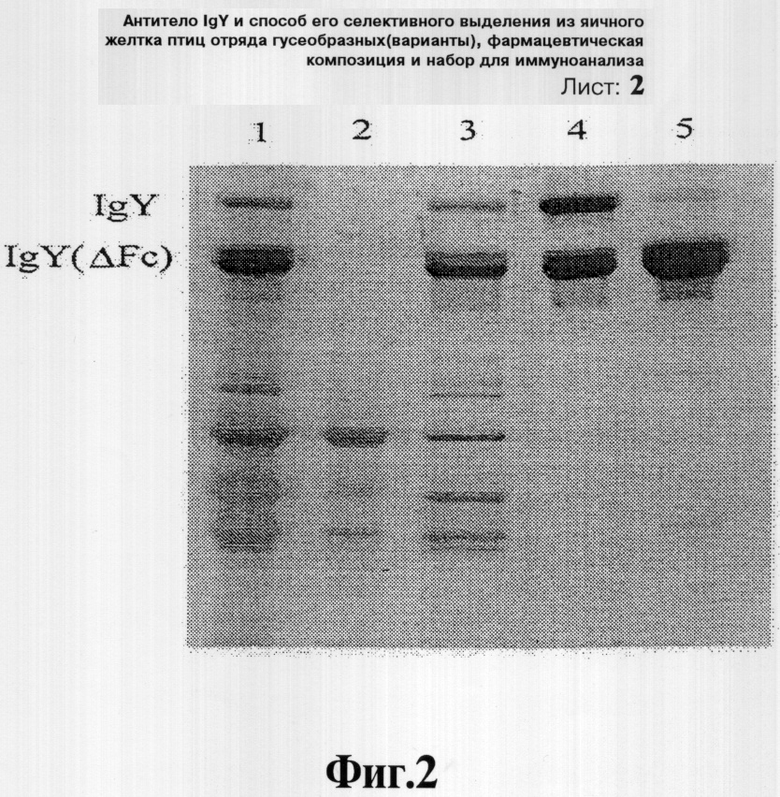
Вышеописанные и иные объекты и признаки данного изобретения станут очевидными со ссылкой на последующее описание предпочтительных вариантов осуществления, взятых в сочетании в сопровождающими рисунками, среди которых Фиг.1 иллюстрирует анализ с помощью SDS-PAGE (элекрофореза в полиакриламидном геле с использованием додецилсульфата натрия) способности захвата антител четырьмя абсорбентами: на дорожке 1 представлен частично очищенный экстракт антител; на дорожке 2 представлен раствор, проходящий через 2% вспененный кремнезем; на дорожке 3 представлен раствор, проходящий через 3% диоксид кремния; на дорожке 4 представлен раствор, проходящий через 3% Celite diatomite (целит диатомит); на дорожке 5 представлен раствор, проходящий через 3% Celite diatomite hyflo-Cel; и на дорожке 6 представлен раствор, проходящий через 5% Celite diatomite hyflo-Cel.
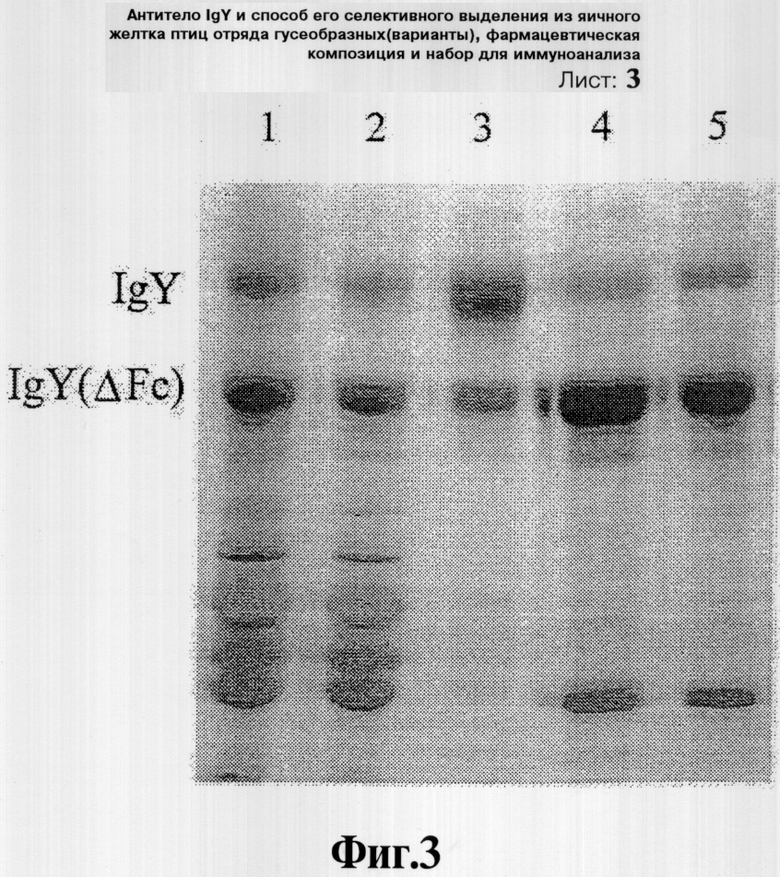
Фиг.2 иллюстрирует результаты электрофореза очищенных антител яичного желтка с использованием вспененного кремния в качестве абсорбента, который проводят в 8% SDS-полиакриламидном геле: на дорожке 1 представлен частично очищенный экстракт антител; на дорожке 2 представлен раствор, проходящий через 2% вспененный кремнезем; на дорожке 3 представлен элюат, полученный из остатка вспененного кремния; на дорожке 4 представлен продукт антител, осажденный 21% (мас./об.) сульфатом аммония на первой стадии осаждения; и на дорожке 5 представлен продукт антител, осажденный 31% (мас./об.) сульфатом аммония на второй стадии осаждения.
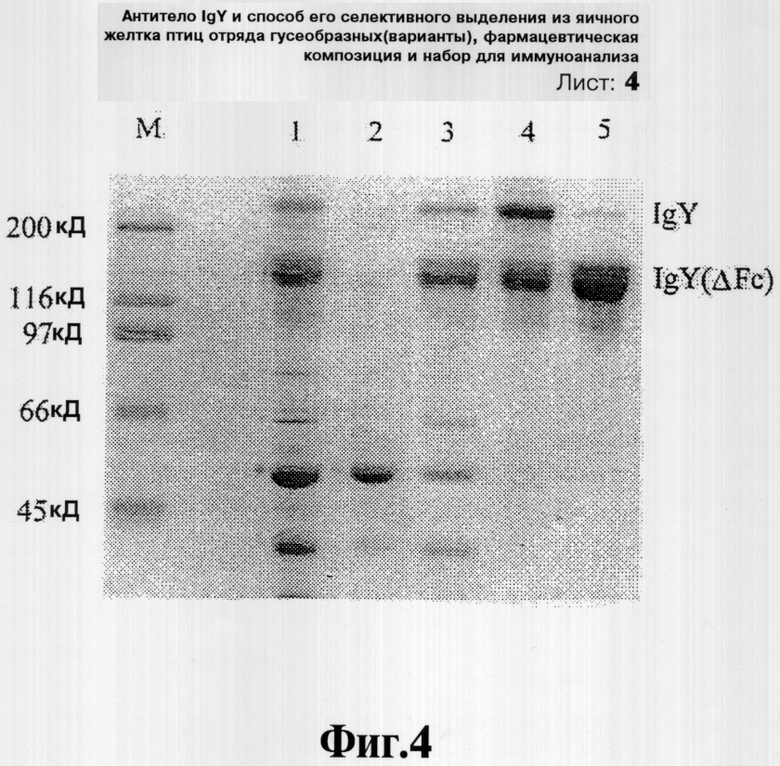
Фиг.3 иллюстрирует результаты электрофореза очищенных антител яичного желтка с использованием Celite diatomite в качестве абсорбента, который проводят в 8% SDS-полиакриламидном геле: на дорожке 1 представлен частично очищенный экстрактантител; на дорожке 2 представлен фильтрат, полученный при использовании Celite diatomite; на дорожке 3 представлен продукт антител, осажденный 21% (мас./об.) сульфатом аммония на первой стадии осаждения; на дорожке 4 представлен продукт антител, осажденный 31% (мас./об.) сульфатом аммония на второй стадии осаждения; и на дорожке 5 представлен продукт антител, осажденный 16% (мас./об.) сульфатом натрия на второй стадии осаждения, и
Фиг.4 иллюстрирует результаты электрофореза очищенных антител яичного желтка с использованием вспененного кремния в качестве абсорбента, который проводят в 8% SDS-полиакриламидном геле: М - маркер молекулярной массы; на дорожке 1 представлен частично очищенный экстракт антител; на дорожке 2 представлен раствор, проходящий через 2% вспененный кремнезем; на дорожке 3 представлен элюат, полученный из остатка вспененного кремния; на дорожке 4 представлен продукт антител, осажденный 21% (мас./об.) сульфатом аммония; и на дорожке 5 представлен продукт антител, очищенный с помощью аффинной хроматографии.
Сведения, подтверждающие возможность осуществления изобретения
Антитела яичного желтка преобладают в птичьей сыворотке и яйцах, откладываемых птицей. Однако, как описано выше, накопление антител из яиц обычно является предпочтительным в плане стоимости. Самки птиц-несушки переносят обе изоформы, IgY и IgY(ΔFc), из сыворотки в яичный желток. В принципе в желтке каждого утиного яйца содержится от приблизительно 1 до приблизительно 4 мг IgY/мл и от приблизительно 3 до приблизительно 12 мг IgY (ΔFc)/мл, и поэтому общее количество антител, содержащихся в одном яйце, оценивается как составляющее 15-80 мг IgY и 45-240 мг IgY(ΔFc). Большой объем полученного яичного желтка значительно превышает объем сыворотки, который можно безопасно получить у птиц в течение любого взятого периода времени. Кроме того, крупномасштабная экстракция антител яичного желтка может быть проведена без больших инвестиций. Предпочтительно, когда антитела, соответствующие данному изобретению, получают из яиц птиц отряда гусеобразных, иммунизированных специфическим антигеном.
В соответствии с данным изобретением представлен способ эффективного выделения антител из яичного желтка, в котором так называемая "адсорбционная хроматография" или "дифференцированное высаливание", которые могут быть использованы отдельно или в комбинации друг с другом, представляют собой важные стадии выделения.
Как используют в данном контексте, термин "адсорбционная хроматография" относится к типу способов разделения, включающих использование стационарной фазы для избирательного поглощения и концентрирования желаемых растворенных веществ из подвижной фазы. Согласно одному из аспектов данного изобретения не растворимый в воде незаряженный абсорбент действует как активный компонент стационарной фазы при отделении антител яичного желтка путем абсорбции антител яичного желтка не растворимым в воде незаряженным абсорбентом, сопровождающейся захватом смешивающихся с водой липидных примесей, в норме присутствующих в яичном желтке.
В предпочтительном варианте осуществления данного изобретения яичный желток сначала отделяют от яичного белка, а затем промывают дистиллированной водой с целью удаления максимально возможного количества альбумина. Желточную оболочку, инкапсулирующую яичный желток, протыкают и выделенную фракцию яичного желтка разводят эффективным количеством водного буфера или воды с образованием суспензии яичного желтка. Предпочтительно, когда собранный яичный желток разводят водным буферным раствором или дистиллированной водой в интервале от приблизительно 2 частей до приблизительно 40 частей по объему, более предпочтительно от приблизительно 5 частей до приблизительно 30 частей по объему/1 часть яичного желтка. Показано, что значение рН является решающим фактором на стадии частичной очистки (см. статью Е.М.Akita и S.Nakai, J. Food Sci., 57: 629. (1993)). Для наилучшего выделения антител яичного желтка предпочтительно, когда рН находится в интервале от приблизительно 5 до приблизительно 7. Желательно, чтобы температура на данной стадии находилась в интервале от приблизительно 0°С до приблизительно 60°С. Суспензию яичного желтка осторожно встряхивают для образования гомогенной смеси, а затем дают ей постоять в течение времени, которое достаточно для образования водной и неводной фаз. Затем не растворимые в воде материалы, включая неводные биомолекулы, такие каклипопротеины, фосфолипиды, стерины и т.п., удаляют из водной суспензии яичного желтка путем центрифугирования. Затем полученный содержащий антитело супернатант можно отделить от вязкого осадка путем декантации, отсасывания или другими подобными способами, известными в области техники.
Вообще содержание липидов в полученной таким образом фракции еще остается настолько высоким, чтобы оказывать вредное воздействие на последующие манипуляции. Согласно данному изобретению стационарную фазу, содержащую не растворимый в воде незаряженный абсорбент, инкубируют со смешивающейся в воде фракцией в достаточном количестве для того, чтобы абсорбировать антитела яичного желтка и адсорбировать большую часть смешивающихся с водой липидных субстанций, остающихся в смешивающейся в воде фракции. Подходящие абсорбенты включают, без ограничения перечисленным, силикат, соединение кремния, карбонат, сульфат, фосфат, уголь, целлюлозу и синтетическое волокно, керамику и оксид металла, где силикат включает в себя синтетические или природные глины, каолин, тальк и силикат кальция; соединение кремния включает в себя вспененный кремнезем, аморфный кремнезем, диоксид кремния, силикагель, силикаты, диатомовую землю и землю Фуллера (Fuller); карбонат включает в себя карбонат кальция и карбонат бария; сульфат включает в себя сульфат кальция; фосфат включает в себя фосфат кальция; уголь включает в себя активированный уголь и угольное волокно, целлюлоза и синтетическое волокно включают в себя порошок целлюлозы; керамика включает в себя пористую керамику, а оксид металла включает в себя оксид алюминия и оксид титана. Особенно предпочтительными абсорбентами являются вспененный кремнезем, диоксид кремния и диатомовая земля. Рабочее соотношение абсорбента и смешивающейся с водой фракции может варьировать в широком диапазоне в зависимости от свойств выбранного абсорбента. При использовании в данном способе вспененного кремнезема предпочтительно, когда его добавляют до получения концентрации, равной или превышающей приблизительно 0,1 мас.% и, что более предпочтительно, находящейся в интервале от приблизительно 0,3 до приблизительно 5,0 мас.% от объема обрабатываемой не смешивающейся с водой фракции. Если абсорбент представлен диоксидом кремния или диатомовой землей, предпочтительно, когда адсорбционную хроматографию, соответствующую данному изобретению, проводят при использовании более чем приблизительно 1 мас.% и, что более предпочтительно, в интервале от приблизительно 3 до приблизительно 20 мас.% абсорбента от объема обрабатываемой не смешивающейся с водой фракции.
Адсорбционную хроматографию в соответствии с данным изобретением осуществляют любым из традиционных способов, таких как обработка порции смешивающейся с водой фракции абсорбентом или пропускание потока смешивающейся с водой фракции через хроматографическую колонку, заполненную абсорбентом до тех пор, пока количество антител яичного желтка, удержанное на поверхностях абсорбента, станет удовлетворительным. Время реакции и температура при обработке не являются решающими для результатов, и обычно процесс осуществляют при температуре реакции от приблизительно 4 до приблизительно 30°С и времени реакции от приблизительно 10 до приблизительно 60 минут. Хотя процедуру адсорбции при необходимости можно повторить несколько раз, каждый раз со свежей загрузкой абсорбента, одной операции обычно бывает достаточно. С помощью данной процедуры липиды и большая часть нелипидных субстанций могут быть успешно разделены на две несмешивающиеся фазы, тогда как антитела яичного желтка также могут быть абсорбированы.
В зависимости от способности выбранного абсорбента улавливать иммуноглобулины, антитела яичного желтка могут быть выделены либо из элюата, полученного при элюции стационарной фазы, либо из "пропускаемого раствора" (термин, который, как используют в данном контексте, предназначен для обозначения раствора, проходящего через стационарную фазу). Как показано в предпочтительных вариантах осуществления, приведенных в тексте, антитела яичного желтка присутствуют главным образом в стационарной фазе при использовании вспененного кремнзема или диоксида кремния в качестве абсорбента, тогда как при использовании диатомовой земли больше, чем приблизительно 60% антител находится в пропускаемом растворе.
Выбор определенного способа получения антител яичного желтка может определяться компетентным специалистом. Как правило, антитела яичного желтка получают в водной фракции путем пропускания буфера через не растворимый в воде незаряженный абсорбент, при этом в данном изобретении может быть использован буфер с рН ниже приблизительно 4 или выше приблизительно 8 или содержащий разобщающий агент для получения антител яичного желтка из стационарной фазы без существенной диссоциации липидных субстанций из стационарной фазы так, что образуется элюат, содержащий антитело.
Как используют в данном контексте, термин "элюат" относится к раствору, содержащему желательные субстанции, отделенные элюентом от стационарной фазы. Термин "разобщающий агент" или "хаотроп" относится к химическому агенту, способному вызывать конформационное изменение в молекуле белка, такой как молекула антитела, который вследствие этого зачастую известен как денатуратор белка. Согласно изобретению большинство из связанных антител можно успешно элюировать любым нейтральным буфером, содержащим среднюю концентрацию (больше 1М) разобщающего агента. В большинстве случаев при удалении хаотропа после элюции нативная структура белка восстанавливается.
Пригодный буфер включает в себя, без ограничения перечисленным, 0,1 М глицин-HCl, рН 2,3; 0,1 М глицин-HCl, рН 10,0; 3 М - 6 М гуанидин-HCl, рН 3,0; 3,0 М хлорид калия; 5 М иодид калия; 3,5 М хлорид магния; 1-3 М тиоцианат аммония/натрия/калия и 6 М мочевину. Однако в плане активности выделенных антител более подходящим для реализации изобретения является буфер средней ионной силы, содержащий хаотроп и имеющий нейтральное значение рН, такой как 3 М тиоцианат натрия, забуференный в 20 мМ буфере MES (рН 5,8) или 20 мМ Трис(гидроксиметил)аминометане (рН 7,5). Активное состояние собранных антител можно легко восстановить, например, обширным диализом против слабокислого буфера низкой ионной силы, не содержащего хаотроп.
Согласно одному из аспектов данного изобретения водная фракция, включающая в себя элюат или пропускаемый раствор, который обогащен антителами, может быть впоследствии подвергнута процедуре дифференцированного высаливания с целью разделения изоформ антитела яичного желтка.
Термин "высаливание", как используют в данном контексте, имеет свое обычное значение в области белковой химии и относится к добавлению неденатурирующей соли или солей к смеси или порции продукта реакции с целью снижения растворимости белков, что приводит к осаждению или коагуляции белков. Термин "дифференцированное высаливание" означает процесс высаливания, при котором происходит дифференцированное осаждение или коагуляция двух или более белков из смеси путем изменения концентрации добавляемой соли или солей. В данном изобретении белки, предназначенные для дифференцированного осаждения, представляют собой изоформы антител яичного белка, т.е. IgY и IgY(ΔFc). Примеры неденатурирующих солей, применяемых для осаждения антител яичного желтка, включают в себя, без ограничения перечисленным, NaCl, Na2SO4, (NH4)2SO4, KCl, CaCl2 и MgSO4. Предпочтительно, когда неденатурирующая соль представлена Na2SO4 или (NH4)2SO4, и (NH4)2SO4 является наиболее предпочтительной. Концентрация соли для дифференцированного осаждения изоформ антитела яичного белка зависит от типа соли и может быть определена компетентным специалистом путем простых экспериментов. Согласно предпочтительному варианту осуществления данного изобретения, в котором используют (NH4)2SO4. сначала высаливают IgY при концентрации, лежащей в интервале от приблизительно 15% (мас./об.) до приблизительно 24% (мас./об.), и которая предпочтительно является равной или более низкой, чем приблизительно 21% (мас./об.) от обрабатываемого объема водной фракции, тогда как IgY(ΔFc) осаждается при концентрации соли, лежащей в интервале от приблизительно 25% (мас./об.) до приблизительно 40% (мас./об.), и которая предпочтительно составляет приблизительно 31% (мас./об.) от обрабатываемого объема водной фракции. Для специалиста будет понятно, что последовательность осаждения двух изоформ антитела также могла бы меняться в зависимости от выбранной соли. Комбинированное использование двух или более солей в данной процедуре, например, вначале осаждение первой изоформы одной солью с последующим осаждением второй изоформы другой солью, также является возможным. Процедура дифференцированного высаливания в соответствии с данным изобретением в значительной степени способствует достижению главной цели данного изобретения, т.е. необходимого селективного разделения желаемого IgY, содержащего антитела IgY и IgY(ΔFc), из целой популяции антител яичного желтка, содержащей как IgY, так и IgY(ΔFc).
Если желательно получение антител более высокой чистоты, осажденные антитела можно повторно растворить в подходящей буферной системе и подвергнуть дополнительным процедурам очистки, таким как вытеснительная хроматография, хроматография на основе гидрофобного взаимодействия, ионообменная хроматография и иммуноаффинная хроматография.
Как используют в данном контексте, термин "иммуноаффинная очистка" или "иммуноаффинная хроматография" относится к типу методов разделения, базирующихся на характеристиках связывания антител со специфическим антигеном. Это означает, что антитела, которые связываются со специфическим антигеном, в определенных условиях отделяют от несвязанных антител при данных условиях. Данное изобретение предусматривает применение иммуноаффинной очистки с целью удаления посторонних белков, в частности, не связывающего антиген иммуноглобулина.
Согласно данному изобретению иммуноаффинную очистку проводят с использованием "антигенного носителя", содержащего антиген, иммобилизованный на нерастворимой основе. Тип основы не является решающим для иммуноаффинной очистки, соответствующей изобретению. Подходящим является любой обычный материал основы, пригодный для ковалентного присоединения антигена и инертный в плане взаимодействия между желаемым антителом и иммобилизованным на нем антигеном. Обычно основу делают из перекрестно-сшитой агарозы или перекрестно-сшитого декстрана, например, CNBr-активированная сефароза 4В, поставляемая в продажу фирмой Pharmacia.
Антитела, очищенные посредством дифференцированного высаливания, растворяют в "связывающем буфере" и наносят на носитель с антигеном так, что образуются иммунокомплексы иммобилизованного антигена и антител яичного желтка. В данном изобретении используют буферную систему, инертную в отношении взаимодействия антигена и антитела и эффективную для поддержания желательных условий связывания. Предпочтительно, когда связывающий буфер выбирают из группы, состоящей из фосфатного буфера, буфера на основе MES (2-[N-морфолино]этансульфоновой кислоты) и бис-Трис-буфера, среди которых буфер MES в концентрации 20 мМ является наиболее предпочтительным.
Предпочтительно, когда иммуноаффинную очистку проводят в среде слабой кислоты при низкой ионной силе, т.е. при значении рН, лежащем в интервале от приблизительно 4 до приблизительно 7 и при ионной силе ниже, чем приблизительно 50 мМ. Более предпочтительно, когда антителам позволяют взаимодействовать с иммобилизованным антигеном при значении рН, лежащем в интервале от приблизительно 5 до приблизительно 6 и наиболее предпочтительно в интервале от приблизительно 5,6 до приблизительно 5,8. Антитела яичного желтка можно диссоциировать с носителя, содержащего антиген, с помощью разобщающей (хаотропной) соли или при рН ниже, чем приблизительно 4 или выше, чем приблизительно 8. Активность собранных антител может быть восстановлена, например, путем обширного диализа против слабокислого буфера низкой ионной силы, не содержащего хаотроп.
IgY(ΔFc), очищенные согласно способу, соответствующему изобретению, не активируют систему комплемента и не связываются с ревматоидным фактором сыворотки млекопитающих. Иммунологическая перекрестная реактивность между (IgGΔFc) и IgG млекопитающих является незначительной. Таким образом, изобретение представляет также новый тип антитела, пригодный для применения в клинических и исследовательских целях.
Изобретение представляет также широкий круг применения для клинических и исследовательских нужд антител IgY, приготовленных согласно изобретению.
Например, данное изобретение представляет фармацевтическую композицию для лечения или профилактики пациентов животных (включая домашнюю птицу, скот и домашних животных типа друзей) или человека, содержащую терапевтическое количество антитела IgY, соответствующего данному изобретению, для их защиты или профилактики у них различных этиологических агентов, включая микроорганизмы, такие как бактерии, нативные, рекомбинантные или пептидные синтетические вирусы, грибы, простейшие, нематоды и т.п., а также белковые и небелковые субстанции, такие как нативные, рекомбинантные или пептидные синтетические аллергены, токсины, яды, гормоны и любые другие иммуногены, способные вызывать иммунный ответ. Предпочтительно, когда очищенные антитела IgY применяют в комбинации с фармацевтически приемлемым носителем, таким как вода, физиологический раствор и т.п. Фармацевтическая композиция может быть доставлена путями, содержащими пероральную доставку, инъекцию, наружное применение и иммунизирующее лечение.
Антитело IgY, соответствующее данному изобретению, используют также для детекции представляющего интерес этиологического агента, включая, например, патогенный или непатогеный организм, такой как Escherichia coli, Salmonella enterititis и другие бактериальные организмы, нативный, рекомбинантный или пептидный синтетический гормон, такой как эстроген, прогестерон, тироксин и т.п., антиген главного комплекса гистосовместимости и т.п., нативный, рекомбинантный или пептидный синтетический маркер опухоли, такой как α-фетопротеин, простата-специфический антиген и т.п.; маркер болезненного состояния, такой как С-реактивный белок, ферритин и т.п.; накопление или остаток чужеродных материалов, таких как лекарственные препараты Теофиллин и дигоксин, в образце тела, таком как жидкость, ткань, экстракт клеток и т.п., который получают от человека или животного. Для получения антител, специфических только в отношении этиологических агентов, этиологический агент может быть инъецирован уткам в качестве антигенов, с целью индуцирования выработки желаемых антител, где антигены включают в себя природные очищенные антигены, рекомбинантные антигены, пептидные синтетические антигены и плазмидную ДНК. Используя антитело IgY, полученное в соответствии с данным изобретением, представляющий интерес этиологический агент можно качественно или количественно определить с помощью любого традиционного метода, известного в области техники, такого как методы Ouchterlony (МО), метод простой (одномерной) радиальной диффузии (SRID), метод иммуноэлектрофореза (IEP), метод радиоиммуноанализа (RIA), метод твердофазного иммуноферментного анализа (ELISA), метод вестернблоттинга (WB), метод турбодиметрического иммуноанализа (TIA), метод турбодиметрического иммуноанализа с латексным усилением, иммуноферментный анализ, нефелометрический иммуноанализ, хемолюминесцентный иммуноанализ, иммуноанализ с использованием золота или иммунохроматографический анализ.
Антитело IgY, соответствующее данному изобретению, также адаптировано для применения в биочипах и биосенсорах.
Следующие Примеры приведены исключительно с целью иллюстрации и не предназначены для ограничения объема притязаний данного изобретения.
Пример 1: Процедура иммунизации для стимуляции выработки специфических антител.
Двенадцать домашних уток (Anas platyrhynchos van domestica) в возрасте 16 недель помещают отдельно для получения антител и яиц. Уткам делают начальную подкожную инъекцию 1-5 мг/мл человеческого С-реактивного белка (CRP; очищен из асцитов человека) в фосфатном буфере, рН 7,5, эмульгированного с равным объемом полного адъюванта Фрейнда. Используемая концентрация антигена обычно находится в интервале 1-5 мг/мл. После начальной инъекции молодым уткам делают три дополнительных инъекции 1-5 мг антигена через каждые две недели. Через одну неделю начинают сбор яиц, которые метят и хранят при 4°С до обработки с целью экстракции и очистки антитела. Процедуру бустерной инъекции повторяют каждые четыре недели в течение эксперимента. Образцы крови берут на седьмые сутки после каждой бустерной инъекции. Каждый образец крови центрифугируют и собирают полученную сыворотку.
Пример 2: Экстракция антител из желтков утиных яиц.
Желтки, собранные из яиц, снесенных гипериммунизированными утками, соответствующими Примеру 1, тщательно промывают слабой струей дистиллированной воды для удаления таким образом альбумина. Объем яичного желтка измеряют, а затем тщательно перемешивают с дистиллированной водой в количестве, которое в десять раз превышает измеренный объем яичного желтка. Затем смесь выдерживают в течение по меньшей мере двух часов при 4°С с последующим центрифугированием при 10000 об/мин на центрифуге Hitachi CR-22F в течение одного часа. В пробирках центрифуги образуется бледный слой супернатанта и полутвердый подвижный слой.
Пример 3: Обработка абсорбентами.
К неочищенному экстракту, приготовленному в Примере 2, добавляют один из абсорбентов: 2% (мас./об.) вспененного кремнезема (приобретенного в фирме Sigma), 3% (мас./об.) диоксида кремния (Sigma), 3% (мас./об.) Celite diatomite (приобретенного в фирме Celite Corporation), и 3 или 5% (мас./об.) Celite diatomite hyflo-Cel (Celite Corporation). Полученные суспензии инкубируют при 4°С в течение 60 минут при осторожном перемешивании. После завершения инкубирования абсорбенты осаждают при 4°С и 20000 об./мин на центрифуге Hitachi CR-22F и раздельно собирают супернатанты и осадки. Образцы по 10 мкл, взятые из каждого супернатанта, подвергают невосстанавливающему гель-электрофорезу в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE).
Как показано на Фиг.1, в плане количества антител, поглощенных абсорбентами, вспененный кремнезем обладает наилучшей адсорбирующей активностью, и в проходящем через него растворе почти не остается антител.
Диоксид кремния проявляет несколько более слабую аффинность к иммуноглобулинам, которая, возможно, обусловлена его более низкой пористостью (и таким образом уменьшенной площадью поверхности), чем у вспененного кремнезема. С другой стороны, диатомовые земли любого типа захватывают меньше, чем 10% антител яичного желтка.
Пример 4: Дифференцированное высаливание антител яичного желтка.
Осадок вспененного кремнезема, полученный в Примере 3, обрабатывают 2,5 М тиоцианатом натрия (рН 7,5), с целью элюции связанных с ним антител. Полученный элюат сначала осаждают сульфатом аммония в концентрации приблизительно 21% (мас./об.) от объема элюата с последующим вторым осаждением путем добавления сульфата аммония до приблизительно 31% (мас./об.). Осажденные продукты антител повторно растворяют в забуференном фосфатом физиологическом растворе (PBS). Аналитический SDS-PAGE проводят через 8% невосстанавливающий акриламидный гель, нагруженный 2237 мкг неочищенного экстракта, соответствующего Примеру 2 (дорожка 1), 10 мкл проведенного через абсорбент раствора, собранного в Примере 3 (дорожка 2), 1122,25 мкг элюата, полученного из осадка вспененного кремнезема (дорожка 3), и 153 мкг и 372,85 мкг продуктов антител, полученных на первой и второй стадиях осаждения (дорожка 4 и дорожка 5 соответственно). Результат показан на Фиг.2. Процент выделения и чистоту определяют путем сканирующей денситометрии геля и суммируют в Таблице 1.
Как показано в Таблице 1, полученные в результате антитела IgY(ΔFc) выделяют с выходом приблизительно 76% (72,05 мг/119,86 мг × 100%) при чистоте более 96%. Более важно то, что данная схема очистки является перспективной для существенного разделения желаемых антител IgY(ΔFc) из целой популяции антител яичного желтка, состоящей главным образом из обоих антител, IgY и IgY(ΔFc).
Пример 5: IgY(ΔFc). частично очищенные с использованием Celite Diatomite.
Учитывая преимущество диатомовой земли в плане способности притягивать липиды и отталкивать антитела, неочищенный экстракт, приготовленный в Примере 2, выливают в фильтрационную колонку, наполненную 10 мас.% Celite diatomite от объема выливаемого экстракта. Раствор, проходящий через колонку, собирают и подвергают первому осаждению 21% (мас./об.) сульфатом аммония от объема потока, прошедшего через колонку. Осажденные антитела собирают, а супернатант делят на две части. Одну часть супернатанта осаждают сульфатом аммония в концентрации приблизительно 31% (мас./об.), тогда как другую часть осаждают 16% (мас./об.) сульфата натрия. Осажденные продукты антител повторно растворяют в PBS. Аналитический SDS-PAGE проводят через 8% невосстанавливающий акриламидный гель, нагруженный 2012,5 мкг неочищенного экстракта, соответствующего Примеру 2 (дорожка 1), 1678 мкг раствора, собранного после фильтрации через Celite diatomite (дорожка 2), 94,9 мкг элюата, полученного на первой стадии осаждения (дорожка 3) и 169,65 мкг и 357,75 мкг продуктов антител, полученных на второй стадии осаждения 31%-ным сульфатом аммония и 16%-ным сульфатом натрия (дорожки 4-5). Результат представлен на Фиг.3. Процент выделения и чистоту определяют путем сканирующей денситометрии геля и суммируют в Таблице 2.
Как показано в Таблице 2, полученные в результате антитела IgY(ΔFc) выделяют с чистотой приблизительно 77% (при использовании сульфата натрия на второй стадии осаждения) и 69% (при использовании сульфата аммония на второй стадии осаждения), соответственно, при высоких выходах.
Пример 6: Иммуноаффинная очистка антител яичного желтка.
Раствор С-реактивного белка (CRP) готовят в 0,1 М карбонатном буфере, рН 8,5 в концентрации 5 мг/мл. CNBr-активированную сефарозу 4В, приобретенную в фирме Pharmacia, изначально промывают 1 мМ холодной HCl, взятой в количестве 10 объемов носителя, и проводят реакцию с раствором CRP, взятом в количестве двух объемов носителя, при 4°С в течение ночи. Носитель с антигеном суспендируют в растворе 0,5 М этаноламина в 20 мМ Трис-HCl (рН 8,5) в соотношении 1:1 (об/об) в течение 2 часов при 4°С, чтобы блокировать оставшиеся реакционные в отношении белка центры. Носитель с антигеном промывают PBS, содержащим 0,02% азида натрия, и хранят при 4°С.
Используют утиные антитела, осажденные 21% (мас./об.) сульфата аммония в Примере 4, и носитель с антигеном, приготовленный, как указано выше. Один мл носителя с антигеном упаковывают в обычную колонку и пропитывают 20 мМ буфера MES (2-[N-морфолино]этансульфоновая кислота) (рН 5,8). Проводят реакцию носителя с антигеном и 0,25 мл антител, приготовленных в таком же буфере для связывания. Носитель с антигеном промывают буфером для связывания до тех пор, пока вытекающий раствор не станет практически свободным от белка. Связанные антитела немедленно элюируют 6 М гуанидином-HCl и измеряют их оптическую плотность при 280 нм после завершения диализа. Результат анализа SDS-PAGE, приведенный на Фиг.4, показывает, что аффинно очищенные антитела состоят в основном из антитела IgY(ΔFc), которое представлено одной полосой в геле.
Все патенты и ссылки на литературные источники, приведенные в данном описании, включены в него таким образом в виде ссылки во всей их полноте. В случае конфликта данное описание, включая определения, будет учитываться в первую очередь. Хотя варианты осуществления данного изобретения были проиллюстрированы и описаны, компетентными специалистами в данной области могут быть сделаны различные модификации и усовершенствования. Варианты осуществления данного изобретения вследствие этого описаны в плане иллюстрации, но не в целях ограничения. Предусмотрено, что данное изобретение не ограничено определенными формами, как оно проиллюстрировано, и все модификации, не выходящие за рамки сущности и объема притязаний, входят в объем притязаний, определенный в прилагаемых пунктах формулы изобретения.
Изобретение относится к области иммунобиотехнологии и может найти применение для количественного и качественного анализа или приготовления фармацевтических композиций, направленных на представляющий интерес этиологический агент. Сущность способа выделения IgY состоит в том, что для выделения антител используют процедуру адсорбционной хроматографии с применением нерастворимого в воде незаряженного адсорбента (1 вариант) либо используют процедуру высаливания антител из водного экстракта яичного желтка, которое дифференцированно осаждает антитела IgY (2 вариант), либо (3 вариант) используют последовательно процедуру адсорбционной хроматографии (по 1 варианту) и процедуру высаливания (по 2 варианту). Изобретение позволяет осуществлять избирательную очистку антител IgY (ΔFc) и IgY от липидов в условиях их повышенного содержания в яичном желтке птиц отряда гусеобразных. 3 н. и 20 з.п. ф-лы, 4 ил., 2 табл.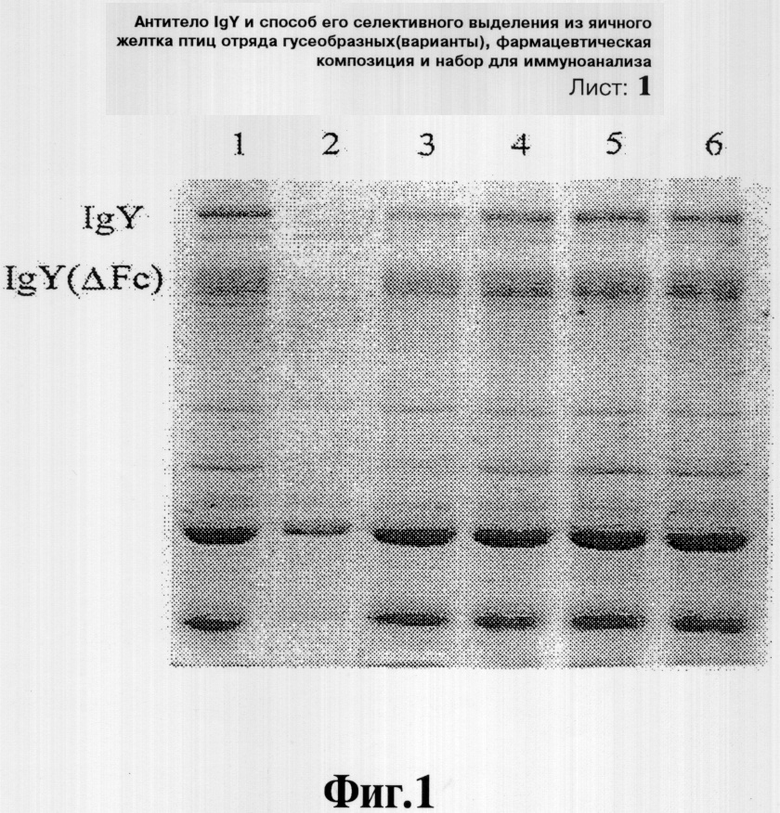
| US 5976519 A, 02.11.1999 | |||
| US 4550019 A, 29.10.1985 | |||
| US 5601823 A, 11.02.1997 | |||
| US 5585098 A, 17.12.1996. |
Авторы
Даты
2007-08-20—Публикация
2002-06-10—Подача