Изобретение относится к медицине, а именно к стоматологии.
Главной причиной развития основных стоматологических заболеваний: кариеса и воспалительных заболеваний пародонта является микрофлора полости рта. Развитие кариеса связано, главным образом, с метаболической активностью кислотопродуцирующих микроорганизмов (Streptococcus mutans и др.), перерабатывающих углеводы в процессе гликолиза в конечные продукты - органические кислоты (лактат, пируват и др.). Их обильное выделение микрофлорой зубного налета смещает его реакцию и реакцию омывающей смешанной слюны в кислую сторону.
Воспалительные заболевания пародонта связаны, в основном, с жизнедеятельностью протеолитической анаэробной микрофлоры (Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia и др). Последняя в процессе метаболизма азотсодержащих веществ (карбамида, L-аргинина, нитратов, амидов аминокислот) продуцирует аммиак, который смещает реакцию в полости рта в щелочную сторону.
Борьба с патогенной микрофлорой является важным звеном профилактики и лечения кариеса и воспалительных заболеваний пародонта. С этой целью используются гигиенические и противомикробные средства. Однако их эффективность у каждого конкретного пациента существенно зависит от индивидуального качественного и количественного состава ротовой микрофлоры с учетом действующих в полости рта собственных факторов защиты организма. Поэтому для проведения оптимальных (наиболее эффективных и безвредных) противомикробных профилактики и лечения основных стоматологических заболеваний требуется индивидуальный выбор того или иного препарата, его минимальной дозы или концентрации, формы и длительности курса применения. Это особенно важно в связи с риском аллергизации организма, развитием дисбактериоза в полости рта и возможными другими побочными действиями противомикробных и гигиенических средств при их применении без учета индивидуальной чувствительности к ним ротовой микрофлоры.
Прототипом заявляемого способа авторы считают бактериологический метод или метод диффузии в агар с использованием бумажных дисков, подразумевающий взятие образцов микрофлоры из полости рта и их посев на питательные среды с последующей инкубацией в присутствии антибиотиков (например: «Лабораторные методы исследования в клинике»: справочник под ред. проф. В.В.Меньшикова. - М.: - Медицина. - 1987. - С.341-342).
Указанный способ заключается в том, что со спинки языка, зубного налета или пародонтальных карманов берут образцы микрофлоры и в виде взвеси в стерильном физиологическом растворе наносят в количестве 1 мл на поверхность плотной питательной среды, предназначенной для культивирования аэробной микрофлоры, в чашке Петри. Взвесь равномерно распределяют по чашке, остатки жидкости отсасывают пипеткой. Чашку подсушивают при комнатной температуре 30-40 мин, после чего на поверхность чашки с помощью пинцета помещают бумажные диски, пропитанные противомикробными средствами. В качестве таких дисков используют изготовленные заводским путем диски, содержащие одну концентрацию антибиотика, соответствующую рекомендациям ВОЗ (диски с противомикробными и гигиеническими средствами не производятся). Чашку инкубируют при 37°С в течение 18 часов в перевернутом вверх дном положении в термостате. Учет результатов производят, измеряя с помощью линейки диаметры зоны задержки роста микробов вокруг дисков, включая диаметр диска.
Недостатками этого метода являются его низкая точность из-за того, что оценка чувствительности проводится вне полости рта, без учета естественных факторов защиты организма, а также без учета функциональной активности микрофлоры. При этом активность анаэробной микрофлоры никак не учитывается, поскольку эта микрофлора не культивируется на указанной питательной среде. Оценка чувствительности микрофлоры возможна только к антибиотикам, поскольку бумажные диски с антисептиками и гигиеническими средствами не производятся.
Длительность метода велика (высушивание - 30-40 мин, инкубация 18 часов). Он также дорог из-за необходимости использования питательных сред, дисков с антибиотиками и лабораторного оборудования (термостат, средства стерилизации и др.) Доступность метода ограничена, так как для его реализации требуется микробиологическая лаборатория.
Для оптимизации воздействия на ротовую микрофлору противомикробных и гигиенических средств и с целью устранения указанных недостатков прототипа предлагаем способ индивидуальной оценки чувствительности ротовой микрофлоры к противомикробным средствам. Техническим результатом предлагаемого способа является оценка действия на кислото- и аммиак-продуцирующую микрофлору полости рта противомикробных и гигиенических средств с учетом количественного и качественного состава этой микрофлоры у индивидуума.
Способ заключается в сравнении амплитуд тестовых кривых рН в средах полости рта до и после применения противомикробного средства. Получают тестовые кривые рН, характеризующие метаболическую активность кислотопродуцирующей и аммиак-продуцирующей микрофлоры. Далее для выявления индивидуальных особенностей чувствительности ротовой микрофлоры к противомикробному средству проводят сравнение полученных значений амплитуд с эталонными значениями для данного средства.
Для реализации способа измеряют рН смешанной слюны (зубного или язычного налета) у пациента любым доступным методом (электрометрический, индикаторный, колориметрический) (начальное значение рН), затем он полощет рот в течение 30 секунд 15 мл 8% раствора карбамида (тестовый раствор карбамида), затем в последующие 15 минут определяют рН смешанной слюны и фиксируют его максимальное значение. По разнице между максимальным и начальным значениями определяют амплитуду первой тестовой карбамидной кривой изменения рН в щелочную сторону (A1k).
После восстановления за счет буферных свойств слюны ее рН к начальному значению (в среднем через 40 мин) пациент полощет рот в течение 30 с 47% раствором сахарозы, затем в последующие 15 минут определяют рН смешанной слюны и фиксируют его минимальное значение. По разнице между минимальным и начальным значениями определяют амплитуду первой тестовой сахарозной кривой изменения рН в кислую сторону (A1c).
Далее пациент использует тестовую дозу противомикробного средства (например, ротовую ванночку с 15 мл метрогила в течение 1 минуты), после чего вновь определяют начальное значение рН и проводят, как и в первом случае, последовательную активацию микрофлоры тестовыми растворами карбамида и сахарозы. Рассчитывают амплитуды вторых тестовых карбамидной и сахарозной кривых рН (А2k и А2с) (см. чертеж).
Рассчитывают разность между первой и второй амплитудами тестовых карбамидных кривых рН:

Индивидуальную оценку чувствительности аммиак-продуцирующей ротовой микрофлоры к противомикробному средству проводят по выраженности (силе) противомикробного действия (по цифровому значению ΔАк). Этот критерий характеризует степень подавления тестовой дозой противомикробного средства метаболической активности аммиак-продуцирующей ротовой микрофлоры у конкретного пациента.
Количество растворов карбамида и сахарозы, активирующих ротовую микрофлору, длительность их экспозиции и концентрации подобраны опытным путем так, чтобы получать наиболее выраженные изменения рН в средах полости рта в щелочную и кислую стороны у пациентов референтной группы (с удовлетворительной гигиеной полости рта, обычным составом ротовой микрофлоры, без патологии со стороны зубов и пародонта). В качестве тестовой дозы противомикробного средства используют дозу, рекомендуемую производителем для клинического применения.
Рассчитывают разность между первой и второй амплитудами тестовых сахарозных кривых рН:

Индивидуальную оценку чувствительности кислотопродуцирующей ротовой микрофлоры к противомикробному средству проводят по выраженности (силе) противомикробного действия (по цифровому значению ΔАс).
Для выявления индивидуальных особенностей чувствительности ротовой микрофлоры по ее качественному составу к противомикробному средству рассчитывают индивидуальный коэффициент асимметрии (Кк), как частное от деления ΔАк и ΔАс:

Сравнение индивидуального коэффициента асимметрии с эталонным его значением (Кэ) для данного противомикробного средства характеризует индивидуальную особенность чувствительности ротовой микрофлоры к противомикробному средству по ее качественному составу (показатель ИЧРМкач):

где ИЧРМкач - качественный показатель индивидуальной чувствительности ротовой микрофлоры к противомикробному средству.
При этом эталонное значение (Кэ) получают заранее в специальном исследовании, как среднее при оценке коэффициента асимметрии для данного противомикробного средства в референтной группе обследуемых, имеющих удовлетворительную гигиену полости рта и обычную (нормальную) микрофлору и не имеющих патологии зубов и пародонта.
Величина показателя ИЧРМкач характеризует индивидуальную качественную особенность чувствительности ротовой микрофлоры к противомикробному средству, которую необходимо учитывать при выборе оптимального противомикробного средства для данного пациента.
Для выявления индивидуальных особенностей чувствительности ротовой микрофлоры по ее количественному составу к противомикробному средству рассчитывают коэффициент его подавляющего действия (Кпд) у индивидуума:
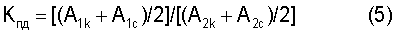
Сравнение индивидуального коэффициента Кпд с его эталонным значением (Кпдэ) для данного противомикробного средства характеризует индивидуальную особенность чувствительности ротовой микрофлоры к противомикробному средству по ее количественному составу (показатель ИЧРМкол):

где ИЧРМкол - количественный показатель индивидуальной чувствительности ротовой микрофлоры к противомикробному средству.
При этом эталонное значение (Кпдэ) получают заранее в отдельном исследовании, как среднее при оценке коэффициента подавляющего действия для данного противомикробного средства в референтной группе обследуемых, имеющих удовлетворительную гигиену полости рта и обычную (нормальную) микрофлору, и не имеющих патологии зубов и пародонта.
Величина показателя ИЧРМкол характеризует индивидуальную количественную особенность чувствительности ротовой микрофлоры к противомикробному средству, которую необходимо учитывать при выборе оптимальной концентрации, дозы и экспозиции конкретного противомикробного средства для данного пациента.
Преимущества предлагаемого способа в сравнении с прототипом.
1. Он более точный за счет комплексной оценки подавления средством метаболической активности ротовой микрофлоры (включая и анаэробную) непосредственно в полости рта, то есть в условиях действия собственных факторов противомикробной защиты организма, а также за счет возможности оценивать чувствительность к любым противомикробным и гигиеническим средствам (включая антисептики, фитопрепараты, бактериофаги и др.).
2. Он позволяет оценивать индивидуальную чувствительность ротовой микрофлоры к противомикробным средствам достаточно быстро (реализуется в течение 3-3,5 часов), что в 6 раз быстрее в сравнении с прототипом.
3. Дифференцировать оценку чувствительности ротовой микрофлоры к противомикробному средству по качественному и количественному показателям, что невозможно с помощью прототипа;
4. Относительно недорогой и более доступный в сравнении с прототипом на клиническом приеме стоматолога - требуется только рН-метр, растворы карбамида и сахарозы.
ПРИМЕР.
Обследуемый в течение суток до определения не использовал никаких противомикробных средств и не принимал еду за 3 часа до обследования.
С помощью рН-метра «Denver Basic» и рН-чувствительного FET-электрода определили начальное значение рН смешанной слюны обследуемого, которую он сплюнул в пробирку в объеме 1 мл. Это значение составило 7,10 ед. рН (pHs). Далее обследуемый набрал в рот 15 мл 8% раствора карбамида и в течение 30 с полоскал им рот (тестовый раствор карбамида), после чего выплюнул. Далее у него тем же способом с интервалом 2-5 мин определяли рН сплевываемой смешанной слюны и на 15 минуте после полоскания раствором карбамида фиксировали его максимальное значение. Это значение составило 7,68 ед. рН (рНmах1). Рассчитали амплитуду первой тестовой карбамидной кривой: A1k=рНmах1-pHs=7,68-7,10=0,58 ед. рН (см. чертеж). Через 35 минут от начала опыта значение рН смешанной слюны за счет ее буферных свойств вернулось к начальному значению (pHs=7,10 ед. рН). Обследуемый в течение 30 с полоскал рот 15 мл 47% раствора сахарозы (тестовый раствор сахарозы), после чего выплюнул. Далее у него тем же способом с интервалом 2-5 мин определяли рН сплевываемой смешанной слюны и на 18 минуте после полоскания раствором сахарозы фиксировали его минимальное значение. Это значение составило 6,51 ед. рН (pHmin1). Рассчитали амплитуду первой тестовой сахарозной кривой: A1c=pHs - pHmin1=7,10-6,51=0,61 ед. рН. Через 85 минут от начала опыта значение рН смешанной слюны за счет ее буферных свойств вернулось к начальному значению (pHs=7,10 ед. рН).
Затем пациент в течение 2 минут полоскал рот 15 мл раствора метрогила (жидкий препарат метронидазола - противомикробного средства, действующего преимущественно на анаэробную уреазопозитивную аммиакпродуцирующую микрофлору). Сразу после выплевывания метрогила обследуемый повторно в течение 30 с полоскал рот 15 мл 8% раствора карбамида (тестовый раствор карбамида). Как и в первом случае, после этого с интервалом 2-5 минут у него определяли рН сплевываемой смешанной слюны. Максимальное значение рН зафиксировали на 12 минуте после повторного полоскания рта тестовым раствором карбамида. Оно составило 7,26 ед. рН (рНmах2). После восстановления через 30 минут после полоскания рта метрогилом рН смешанной слюны к начальному значению (pHs) пациент повторил полоскание рта тестовым раствором сахарозы. Последующее измерение рН смешанной слюны выявило его минимальное значение на 20 минуте после полоскания сахарозой, которое составило 6,63 ед. рН.
Рассчитали амплитуду второй тестовой карбамидной кривой рН смешанной слюны: А2к=рНmах2 - pHs=7,26-7,10=0,16. Разность амплитуд двух тестовых карбамидных кривых рН смешанной слюны (ΔАк) составила:
ΔАк-a1k-А2к=0,58-0,16=0,42 ед. рН.
Полученная величина ΔАк (0,42 ед. рН) характеризовала индивидуальную чувствительность аммиак-продуцирующей ротовой микрофлоры пациента к 2-минутному полосканию рта 15 мл раствора метрогила.
Рассчитали амплитуду второй тестовой сахарозной кривой рН смешанной слюны: A2c=pHs-pHmin2=7,10-6,63=0,47. Разность амплитуд двух тестовых сахарозных кривых рН смешанной слюны (ΔАс) составила: ΔАс=A1c-А2с=0,61-0,47=0,14 ед. рН. Полученная величина ΔАc (0,14 ед. рН) характеризовала индивидуальную чувствительность кислотопродуцирующей ротовой микрофлоры пациента к 2-минутному полосканию рта 15 мл раствора метрогила.
Рассчитали индивидуальный коэффициент асимметрии:
Ка=ΔАк/ΔАс=0,42/0,14=3
Полученное значение Ка свидетельствует, что у конкретного пациента чувствительность аммиак-продуцирующей микрофлоры полости рта к 2-минутному полосканию раствором метрогила в 3 раза выше, чем кислотообразующей.
Рассчитали показатель ИЧРМкач:
ИЧРМкач=Ка/Кэ=3/3,15=0,95
При этом в качестве Кэ использовали его табличное значение (3,15), полученное опытным путем в исследованиях, проведенных в референтной группе пациентов. Полученное значение ИЧРМкач свидетельствует о том, что у конкретного пациента имеется качественное смещение состава ротовой микрофлоры на 5% в сторону преобладания кислотопродуцирующих штаммов микроорганизмов.
Рассчитали показатели Кпд и ИЧРМкол:
Кпд=[(A1k+А1c)/2]/[(А2к+А2с)/2]=[(0,58+0,61)/2]/[(0,16+0,47)]=1,9
ИЧРМкол=Кпд/Кпдэ=1,9/2,2=0,86
Полученное значение показателя Кпд говорит о том, что активность ротовой микрофлоры под влиянием 2-минутного полоскания рта раствором метрогила снизилась в 1,9 раза, а показателя ИЧРМкол - о том, что для этого конкретного пациента 2-минутного полоскания рта противомикробным средством оказалось недостаточно для оптимального подавления микрофлоры и время его экспозиции в полости рта следует увеличить на 13,6%, либо использовать другую форму препарата. При этом в качестве Кпдэ использовали его табличное значение (2,2), полученное опытным путем в исследованиях, проведенных в референтной группе пациентов.
Таким образом, в ходе исследования, длившегося 160 минут, удалось оценить индивидуальную чувствительность ротовой микрофлоры пациента к 2-минутному полосканию рта раствором метрогила и в цифровом выражении оценить индивидуальные качественные и количественные особенности чувствительности ротовой микрофлоры к данному препарату.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ДЕЙСТВИЯ И ЭФФЕКТИВНОСТИ ПРОТИВОМИКРОБНЫХ СРЕДСТВ НА МИКРОФЛОРУ ПОЛОСТИ РТА | 2004 |
|
RU2251693C1 |
| Способ экспресс-диагностики риска развития воспалительных заболеваний пародонта | 2016 |
|
RU2633313C1 |
| Средство индивидуальной гигиены полости рта для детей с подтвержденным диагнозом целиакия и способ его использования | 2022 |
|
RU2803445C1 |
| Способ определения действия противомикробных средств на микрофлору полости рта | 1980 |
|
SU1157021A1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ПАРОДОНТА | 2007 |
|
RU2321863C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НАЧАЛЬНОГО КАРИЕСА ЗУБОВ | 2000 |
|
RU2163114C1 |
| Композиция с пролонгированным биоцидным эффектом и ополаскиватель полости рта на ее основе | 2022 |
|
RU2788728C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОВОСПАЛИТЕЛЬНЫМ И ПРОТИВОМИКРОБНЫМ ДЕЙСТВИЕМ, ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СТОМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ ПОЛОСТИ РТА | 2023 |
|
RU2824364C1 |
| СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИЦИДНОГО СРЕДСТВА НА ОСНОВЕ ГИДРОЛИЗАТОВ КОКОСОВОГО МАСЛА ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА | 2020 |
|
RU2745296C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРЕАЗНОЙ АКТИВНОСТИ РОТОВОЙ ЖИДКОСТИ ДЛЯ СКРИНИНГА ОБСЕМЕНЕННОСТИ ПОЛОСТИ РТА УРЕАЗОПОЗИТИВНОЙ МИКРОБИОТОЙ | 2015 |
|
RU2597777C1 |
Изобретение относится к медицине, а именно к стоматологии. Сущность способа заключается в сравнении амплитуд тестовых сахарных (Ас) и карбамидных (Ак) кривых рН в средах полости рта до и после применения противомикробного средства (ΔAc=A1c-А2с и ΔАк=А1к-А2к). Тестовые сахарные кривые рН получают путем стимуляции кислотопродуцирующей микрофлоры полости рта 47% раствором сахарозы, а карбамидные - в результате стимуляции аммиак-продуцирующей микрофлоры 8% раствором карбамида. При этом определяют индивидуальную особенность чувствительности ротовой микрофлоры к противомикробному средству, обусловленную ее качественным составом, по коэффициенту асимметрии по формуле: Ка=ΔАк/ΔАс; а обусловленную ее количественным составом - по коэффициенту подавляющего действия по формуле: Кпд=[(а1k+А1с)/2] / [(А2к+А2с)/2]. Затем сравнивают значения коэффициентов с величинами эталонных значений, полученных у референтной группы обследованных, и по разности этих значений оценивают индивидуальную чувствительность ротовой микрофлоры к действию противомикробного средства. Использование способа позволяет достаточно быстро оценивать индивидуальную чувствительность ротовой микрофлоры к противомикробным средствам, дифференцировать оценку чувствительности ротовой микрофлоры к противомикробному средству по качественному и количественному показателям. 1 ил.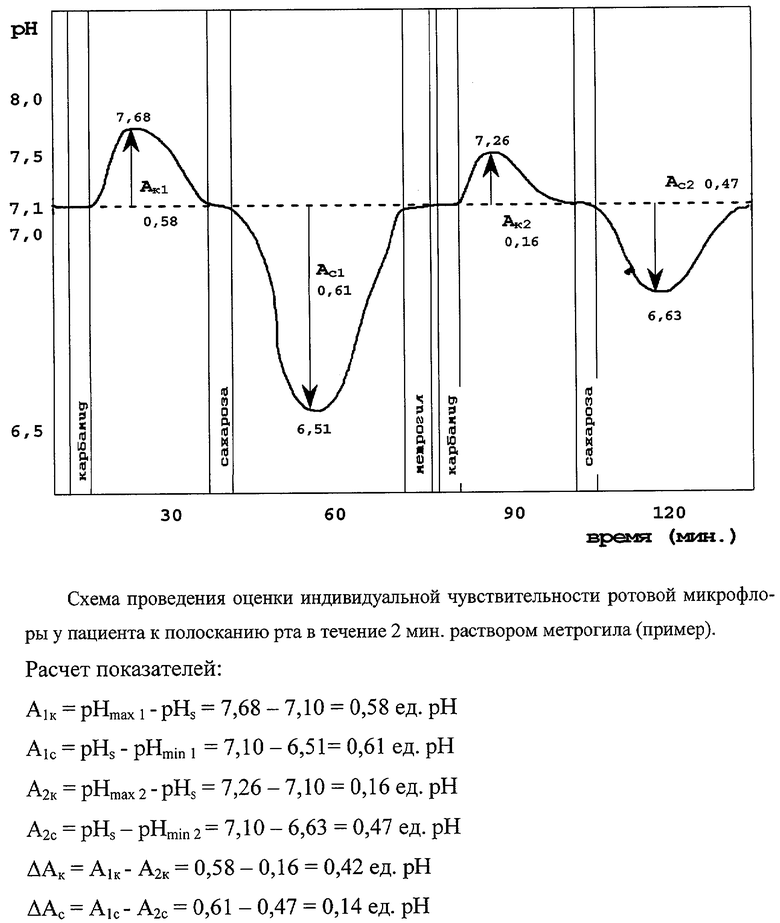
Способ индивидуальной оценки чувствительности ротовой микрофлоры к противомикробным средствам, включающий бактериологическую оценку действия противомикробного средства путем определения степени подавления ее активности этим средством, отличающийся тем, что оценивают действие противомикробного средства на кислото- и аммиак-продуцирующую микрофлору путем сравнения амплитуд тестовых сахарных и карбамидных кривых рН в средах полости рта до и после его применения по формулам
ΔAc=A1c-A2c,
где ΔАс - изменение амплитуд тестовых сахарных кривых рН;
A1c - амплитуда тестовой сахарной кривой до применения противомикробного средства;
А2c - амплитуда тестовой сахарной кривой после применения противомикробного средства;
ΔАк=А1k,-А2к,
где ΔАк - изменение амплитуд тестовых карбамидных кривых рН;
A1k - амплитуда тестовой карбамидной кривой до применения противомикробного средства;
A2k - амплитуда тестовой карбамидной кривой после применения противомикробного средства,
и определяют индивидуальную особенность чувствительности ротовой микрофлоры к противомикробному средству, обусловленную ее качественным составом, по коэффициенту асимметрии по формуле
Ка=ΔАк/ΔАс
где Ка - коэффициент асимметрии;
а обусловленную ее количественным составом - по коэффициенту подавляющего действия по формуле
Кпд=[(А1k+А1с)/2]/[(А2к+А2с)/2],
где Кпд - коэффициент подавляющего действия,
затем сравнивают значения коэффициентов с величинами эталонных значений, и по разности этих значений оценивают индивидуальную чувствительность ротовой микрофлоры к действию противомикробного средства.
| Лабораторные методы исследования в клинике | |||
| Справочник под ред | |||
| проф | |||
| В.В.Меньшикова | |||
| - М.: Медицина | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| СПОСОБ ОЦЕНКИ ДЕЙСТВИЯ И ЭФФЕКТИВНОСТИ ПРОТИВОМИКРОБНЫХ СРЕДСТВ НА МИКРОФЛОРУ ПОЛОСТИ РТА | 2004 |
|
RU2251693C1 |
| Способ контроля зубных гигиенических средств | 1982 |
|
SU1186211A1 |
| Способ определения действия противомикробных средств на микрофлору полости рта | 1980 |
|
SU1157021A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИКРОФЛОРЫ ПОЛОСТИ РТА И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СОПРОВОЖДАЮЩИХСЯ НАРУШЕНИЯМИ МИКРОФЛОРЫ В ПОЛОСТИ РТА | 2002 |
|
RU2229130C1 |
Авторы
Даты
2007-10-10—Публикация
2006-04-18—Подача