Уровень техники
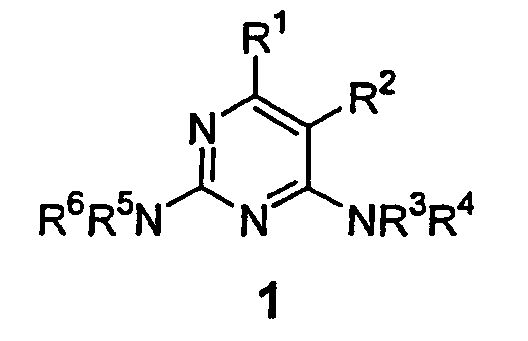
Остаток 2,4-диаминопиримидина формулы (1) является общим компонентом ряда биологически активных молекул, являющихся потенциальными лекарствами. Обнаружено, что производные пиримидина применимы в лечении аномального роста клеток, такого как рак, у млекопитающих. Эти остатки обычно синтезируют из пиримидиновых промежуточных соединений 2 (где Х - уходящая группа, обычно галоген) и эквивалента амина 3, HNR3R4 (см. схему 1). Для громадного большинства реакций, включающих пиримидины формулы 2 и амины формулы 3, хорошо известно, что в первую очередь присоединение амина происходит предпочтительно (или исключительно) в более реакционноспособном положении 4 пиримидина (Chemistry of Heterocyclic Compounds, The Pyrimidines, Volume 52, Wiley, New York 1994, p.371) с получением промежуточного соединения 4. Основные факторы, которые влияют на селективность первоначального присоединения амина, - это стереоэлектронные эффекты, связанные с заместителями, присутствующими как в пиримидине 2, так и в амине 3, и, в меньшей степени, растворителем реакции. Последующее нагревание соединения 4 со вторым амином (5) дает желаемые 2,4-диаминопиримидины 1.
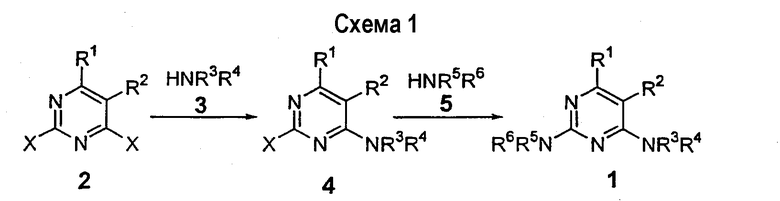
Типичный пример такого превращения может быть найден в WO 0091901 и показан на схеме 2. Другие примеры использования этой общей синтетической схемы включают Montebugnoli et al. Tetrahedron, 2002 (58), р.2147. Chemistry of Heterocyclic Compounds, The Pyrimidines, Volume 52, Wiley, New York 1994, pp.371-417. Селективное присоединение амина к 2,4-дихлор-5-карбоксамидопиримидинам описано в WO 02/04429. Селективное присоединение амина к 2,4-дихлор-5-галогенпиримидинам описано в WO 01/65655.
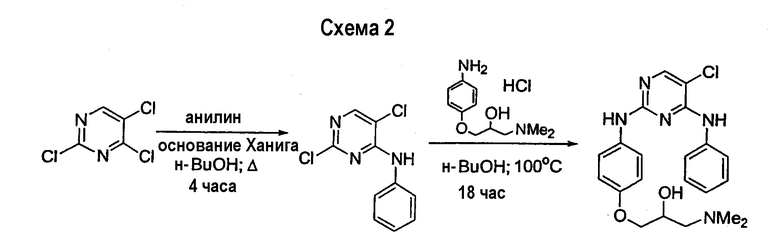
В то время как имеется ряд общих примеров, где конкретные пиримидины (2), амины (3) или реакционные условия дают неселективные смеси 2-хлор-4-аминопиримидина (4) и изомерного 2-амино-4-хлорпиримидина (6) (схема 3), эти реакции имеют ограниченное применение не только вследствие отсутствия селективности (и влияния этого факта на общий выход), но также вследствие чрезвычайно трудного разделения образующихся изомеров. Обычно требуется препаративная ВЭЖХ как средство индивидуального выделения чистых изомеров (4 и 6), которые затем могут быть превращены в соединения, такие как 1 или его изомер 7, соответственно.
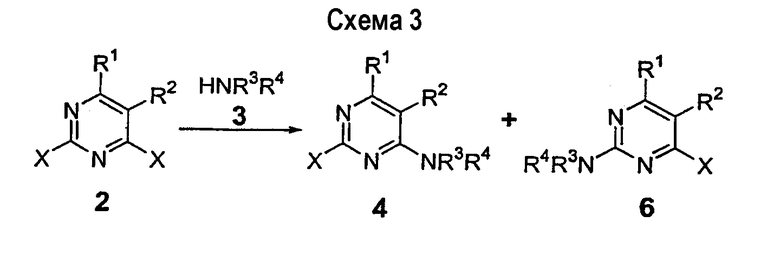
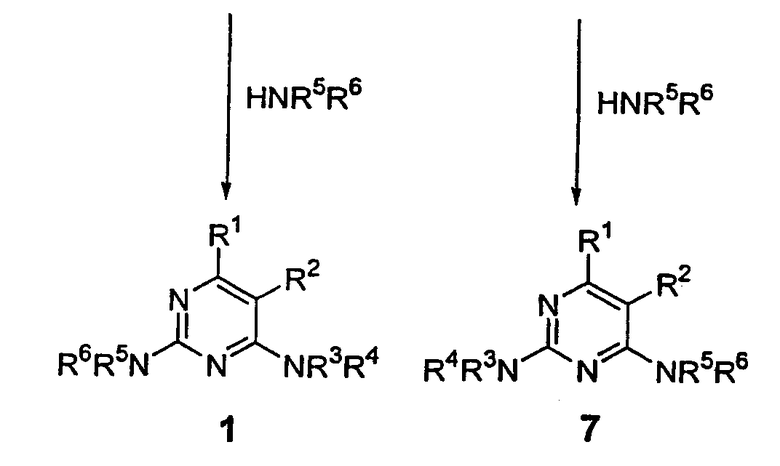
Примером такой реакции, которая приводит к смесям изомеров, является присоединение 4-метиланилина к 2,4-дихлор-5-трифторметилпиримидину (схема 4). Этот электронно-дефицитный пиримидин имеет некоторое предпочтение в присоединении амина в положение 2 пиримидина. ВЭЖХ анализ неочищенной реакционной смеси показывает наличие смеси (4-хлор-5-трифторметилпиримидин-2-ил)-п-толиламина (8) и (2-хлор-5-трифторметилпиримидин-4-ил)-п-толиламина (9) в соотношении 1,4:1. Другие примеры неселективного присоединения амина описаны в Chemistry of Heterocyclic Compounds, The Pyrimidines, Volume 52, Wiley, New York 1994, pp.371-417. Luo et al., Tetrahedron Lett., 2002 (43), p.5739. Yoshida et al., J. Chem. Soc., Perkin Trans. I: Organic and Bioorganic Chemistry, 1992 (7), p.919. EP 647639 описывает присоединение пиперидинов к 2,4-дихлорпиримидину.
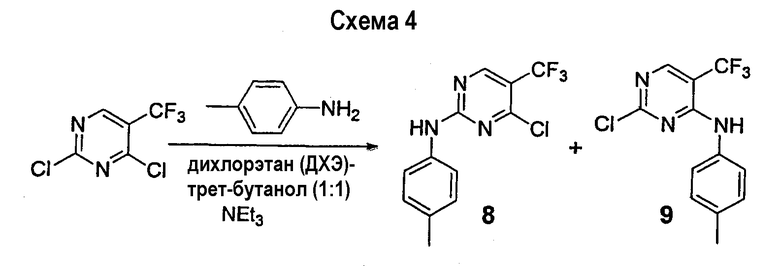
В отличие от реакций, описанных выше, существуют очень мало конкретных примеров, в которых амин (3) селективно присоединяется к пиримидину формулы 2, давая предпочтительно 2-амино-4-хлорпиримидин 6. Наиболее заслуживающим внимания примером реакций этого типа является присоединение N-метилпиперидина к 2,4-дихлор-5-метилпиримидину с получением 4-хор-5-метил-2-пиперидинопиримидина (схема 5), предложенный Yoshida et al., J. Chem. Soc., Perkin Trans. I: Organic and Bioorganic Chemistry, 1992 (7), p.919. В этом случае стерический эффект 5-метильного заместителя в пиримидине в сочетании с тем фактом, что аминный нуклеофил является третичным (предпочтительнее, чем первичным или вторичным) амином, приводит к селективному присоединению пиперидина к пиримидину в положении 2.
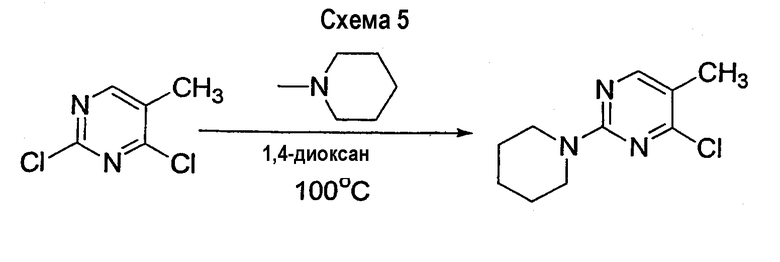
Неожиданно обнаружено, что добавление кислоты Льюиса к реакционной смеси может способствовать селективному присоединению амина в положении С-2 ядра пиримидина, замещенного группой CF3. Таким образом, настоящее изобретение относится к способу получения соединения формулы 11
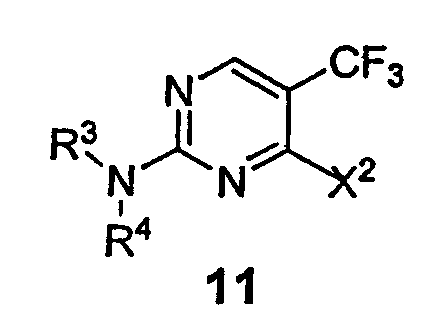
в которой Х2 представляет собой уходящую группу, такую как галогенид, арилсульфонат, алкилсульфонат, перфторалкилсульфонат, арилсульфинат или алкилсульфинат; и R3 и R4 представляют собой заместители, независимо выбранные из группы, состоящей из водорода, ароматической группы и алифатической группы или взятые вместе NR3R4 могут образовывать 4-11-членное ароматическое или алифатическое кольцо; включающему взаимодействие соединения формулы 10
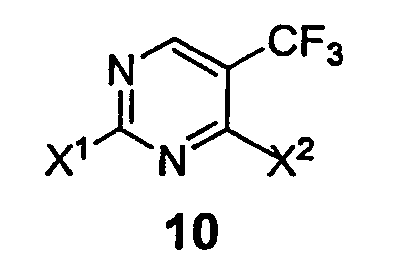
с амином формулы 3 (HNR3R4) в присутствии кислоты Льюиса и ненуклеофильного основания с получением соединения формулы 11, в которой Х1 представляет собой уходящую группу, такую как галогенид, арилсульфонат, алкилсульфонат, перфторалкилсульфонат, арилсульфинат или алкилсульфинат.
В предпочтительном варианте амин 3 является ароматическим амином и применяют 0,25-10 эквивалентов кислоты Льюиса относительно количества пиримидина 10, предпочтительно 0,5-3,0 эквивалентов кислоты Льюиса относительно количества пиримидина 10.
В альтернативном предпочтительном варианте амин 3 является алифатическим амином и применяют 0,5-10 эквивалентов кислоты Льюиса относительно количества пиримидина 10, предпочтительно 1-4 эквивалента кислоты Льюиса относительно количества пиримидина 10.
В другом предпочтительном варианте Х1 и Х2 - одинаковые или разные и каждый независимо - галоген и кислота Льюиса - соль цинка или магния.
В наиболее предпочтительном варианте Х1 и Х2 - хлор и кислота Льюиса - хлорид цинка.
Соединения, полученные способом по настоящему изобретению, включают все стереоизомеры (например, цис- и транс-изомеры) и все оптические изомеры соединений формулы 11 (например, R- и S-энантиомеры) также как рацемические, диастереомерные и другие смеси таких изомеров.
Соединения и соли, полученные способом по настоящему изобретению, могут существовать в нескольких таутомерных формах, включая енольную и иминную форму, и кетонную и енаминную форму, а также геометрические изомеры и их смеси. Получение всех таких таутомерных форм включено в рамки настоящего изобретения. В растворах таутомеры существуют в виде смесей ряда таутомеров. В твердой форме обычно преобладает один таутомер. Даже если может быть описано получение одного таутомера, настоящее изобретение охватывает получение всех таутомеров соединений по изобретению.
Настоящее изобретение также включает получение атропоизомеров по настоящему изобретению. Атропоизомерами считают соединения формулы 11, которые могут быть разделены на изомеры, ограниченные во вращении.
Соединения, полученные способом по изобретению, могут содержать олефиновые двойные связи. Если такие связи присутствуют, соединения существуют как цис- и транс-конфигурации и как их смеси, и настоящее изобретение рассматривает получение таких соединений.
Как применяется здесь, термин «ароматический» и особенно «ароматическая группа» относится к арильному и гетероарильному радикалу, определенным здесь.
Далее, «ароматический амин» или «ароматический аминорадикал» относится к любому амину или аминорадикалу, связанному с по меньшей мере одним sp2 атомом углерода, который является частью арильной или гетероарильной группы. Амин или аминорадикал будут относиться к ароматическому амину или радикалу, даже если аминный азот связан с водородом или sp3 атомом углерода в дополнение к одному sp2 атому углерода. Таким образом, HN(С6-С10)арил и -N((С1-С6)алкил)((С6-С10)арил), каждый относится к ароматическим аминорадикалам, определенным здесь, несмотря на факт, что каждый аминный азот присоединен к неароматическим заместителям.
Термин «арил» относится к ароматическим радикалам, таким как фенил, нафтил, тетрагидронафтил, инданил и им подобным. «Арильная» группа может быть необязательно замещена 1-3 подходящими заместителями, определенными здесь. «Арил» также относится к фенильному радикалу, сконденсированному с неароматическим гетероциклом. Примеры таких групп включают, но не ограничиваются ими, 2-оксоиндолинил, хроманил, индолинил и 2-оксо-3,4-дигидрохинолинил, необязательно замещенные подходящими заместителями.
Как применяется здесь, термин «гетероарил» относится к ароматической гетероциклической группе обычно с одним гетероатомом, выбранным из O, S и N, в кольце, в котором ароматическая гетероциклическая группа может быть замещена подходящими заместителями в количестве до трех, определенными здесь. В дополнение к указанному одному гетероатому ароматическая гетероциклическая группа может необязательно иметь до четырех атомов азота в кольце. Примеры гетероарильных групп включают, но не ограничиваются ими, пиридил, пиразинил, пиримидинил, пиридазинил, тиенил, фурил, имидазолил, пирролил, оксазолил (например, 1,3-оксазолил, 1,2-оксазолил), тиазолил (например, 1,2-тиазолил, 1,3-тиазолил), пиразолил, тетразолил, триазолил (например, 1,2,3-триазолил, 1,2,4-триазолил), оксадиазолил (например, 1,2,3-оксадиазолил), тиадиазолил (например, 1,3,4-тиадиазолил), хинолил, изохинолил, бензтиенил, бензфурил, индолил и им подобные, необязательно замещенные 1-3 подходящими заместителями. Альтернативно, любой кольцевой углерод, -СН-, вышеуказанной гетероарильной группы может быть заменен группой, выбранной из -С=О или -SO2. «Гетероарил» также относится к одной из вышеуказанных гетероарильных групп, сконденсированных с неароматическим гетероциклом. Примеры таких групп включают, но не ограничиваются ими, 1,3-дигидропирроло[2,3-b]пиридин-2-он, 3,4-дигидро-1Н-[1,8]нафтиридин-2-он, 1,3-дигидропирроло[2,3-b]пиридин и 3,4-дигидро-2Н-пирано[2,3-b]пиридин.
«Алифатическая группа» относится к алкильному, циклоалкильному или гетероциклоалкильному радикалу, определенному здесь. Алифатические группы могут быть замещены подходящими заместителями в количестве до трех, определенными здесь.
Как применяется здесь, термин «алифатический амин» или «алифатический аминорадикал» относится к любому амину или аминорадикалу, в котором амин или радикальный атом азота связан с sp3 углеродом, который является частью алкильной, циклоалкильной или гетероциклоалкильной группы. Алифатические аминогруппы могут быть замещены подходящими заместителями в количестве до трех, определенными здесь.
Термин «алкил» относится к линейным или разветвленным С1-С10-алкильным группам (таким как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, и т.д.), необязательно замещенным 1-3 подходящими заместителями, определенными здесь.
Термин «циклоалкил» или «циклил» относится к моно-, би- или трициклическому карбоциклическому С3-С12-кольцу (такому как, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклопентенил, циклогексенил, бицикло[2,2,1]гептанил, бицикло[3,2,1]октанил, бицикло[5,2,0]нонанил и т.д.), который необязательно замещен 1-3 подходящими заместителями, определенными здесь. Бициклические или трициклические радикалы могут быть конденсированными, мостиковыми или спироциклическими. Таким образом, примеры «циклоалкильных» или «циклильных» групп, определенных здесь, включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклогексенил, бицикло[2,2,1]гептанил, бицикло[3,2,1]октанил, бицикло[3,1,0]гексил и спиро[2,4]гептил.
Термин «гетероциклоалкил» или «гетероциклил» или «гетероцикл» относится к моно-, би- или трициклической группе, содержащей 3-9 атомов углерода и 1-4 гетероатома, выбранных из -N, -NR, -O-, -S-, -SO и -SO2, в которой циклический радикал необязательно замещенный 1-3 подходящими заместителями, определенными здесь. Бициклические или трициклические радикалы могут быть конденсированнными, мостиковыми или спироциклическими. Примеры таких групп включают, но не ограничиваются ими, азетидинил, пирролидинил, пиперидинил, морфолинил, пиперазинил, тетрагидрофуранил, оксетанил, тиоморфолинил, хинуклидинил, 5-азаспиро[2,4]гептил и 3-аза-бицикло[3,1,0]гексил.
Как применяется здесь, термин «галоген» включает фтор, хлор, бром или иод или фторид, хлорид, бромид или иодид.
Как применяется здесь, термин «карбонил» или «(С=О)» (используется в фразах, таких как алкилкарбонил, алкил-(С=О)- или алкоксикарбонил) относится к сочетанию остатка С=О со вторым остатком, таким как алкил или аминогруппа (т.е. амидогруппа).
Если -NR3R4 или -NR5R6 вместе образуют циклический амин, то такой амин может быть моно-, би- или трициклической группой, содержащей 3-9 атомов углерода и 0-3 гетероатома, выбранных из -N, -NR, -O-, -S-, -SO и -SO2 (исключая атом азота в -NR3R4 или -NR5R6). Циклический амин может быть необязательно замещен 1-3 подходящими заместителями, определенными здесь. Бициклические или трициклические остатки могут быть конденсированными, мостиковыми или спироциклическими. Примеры таких циклических аминов включают, но не ограничиваются ими, морфолин, азетидин, пиперазин, пиперидин, пирролидин, индолин, тиоморфолин.
Подразумевается, что «подходящий заместитель» обозначает химически и фармацевтически приемлемую функциональную группу. Такие подходящие заместители для вышеуказанных арильных, гетероарильных, алкильных, циклоалкильных и гетероциклоалкильных групп могут быть легко описаны специалистами в этой области техники. Иллюстративные примеры указанных подходящих заместителей включают, но не ограничиваются ими, водород, галоген, перфторалкил, перфторалкокси, алкил, алкенил, алкинил, гидрокси, оксо, алкилтио, арилтио, алкилсульфонил, арилсульфонил, гетероарилсульфонил, алкилсульфонат, арилсульфонат, перфторалкилсульфонат, алкокси, арил или гетероарил, циклоалкил или гетероциклоалкил, арилокси или гетероарилокси, аралкил или гетероаралкил, аралкокси или гетероаралкокси, аралкил или гетероаралкил, аралкокси или гетероаралкокси, карбокси, амино, алкил- и диалкиламино, карбамоил, алкилкарбонил, алкоксикарбонил, алкиламинокарбонил, диалкиламинокарбонил, сульфонамидо, алкилсульфонамидо, диалкилсульфонамидо, амидо, N-ацил, арилкарбонил, арилоксикарбонил и им подобные группы. Метиленовые группы также могут быть заменены карбонильной (С=О) группой. Специалисты в этой области техники должны понимать, что многие заместители могут быть замещены дополнительными заместителями.
«Вариант», как применяется здесь, относится к особенным группам соединений или применениям в отдельных подклассах. Такие подклассы могут отличаться одним особым заместителем, таким как специальная группа R3 или R4. Другие подклассы могут отличаться комбинацией разных заместителей, например, все соединения, в которых R3 - водород и R4 - С1-С6-алкил, возможно замещенный -С3-С10-циклил.
Подробное описание изобретения
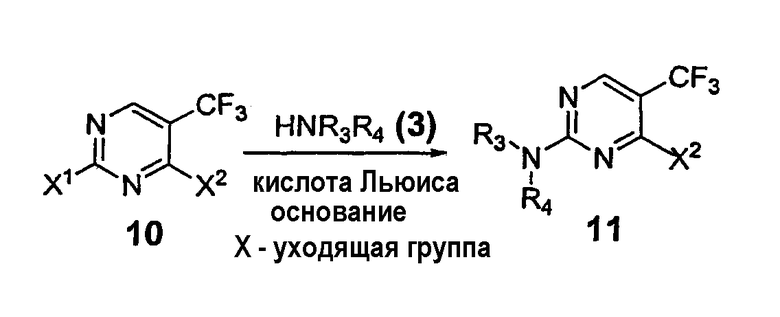
Соединения формулы 11 могут быть получены взаимодействием пиримидина 10 и первичного или вторичного нуклеофильного амина (3) в присутствии кислоты Льюиса и ненуклеофильного основания в органическом растворителе или смеси растворителей. Уходящие группы (Х1 и Х2, которые могут быть одинаковыми или разными) пиримидина 10, пригодные для замещения, включают, но не ограничиваются ими, галогениды, сульфонаты и сульфинаты. Предпочтительно каждая уходящая группа - галогенид. В другом предпочтительном варианте галогенид-хлорид. Подходящие первичные и вторичные нуклеофильные амины включают ароматические, алифатические или циклические амины, описанные выше. Кислоты Льюиса включают, но не ограничиваются ими, соли Zn, Mg, Sn, Ti, Al, B, Li, Ag, Na, K, Ca, V, Cr, Mn, Fe, Co, Ni, In, Zr, Sm и Cu. В предпочтительном варианте предпочитают соли Zn, Mg, Sn, Ti, Al, B, Li, Ag и Cu. Наиболее предпочтительно соли Zn и Mg применяют в качестве кислоты Льюиса. Подходящее число эквивалентов кислоты Льюиса относительно пиримидина 10, необходимых чтобы вызвать селективное присоединение амина, изменяется от 0,25 до 10, предпочтительно от 0,5 до 3 эквивалентов, если нуклеофильный амин является ароматическим, или 0,5-10 эквивалентов, предпочтительно 1-4 эквивалента, если амин - алифатический (или ароматический амин, способный образовывать мультидентатный лиганд с кислотой Льюиса). Подходящие органические растворители включают, но не ограничиваются ими, тетрагидрофуран, 1,2-дихлорэтан, трет-бутанол, эфир, хлористый метилен, ацетонитрил, метанол, этанол, 2-пропанол, диоксан, 1,2-диметоксиэтан, толуол, хлороформ, этилацетат или их смеси, предпочтительно смеси галогенированных и спиртовых растворителей. Подходящие ненуклеофильные основания включают, но не ограничиваются ими, триэтиламин, N,N-дизопропилэтиламин, диазабициклоундецен (ДБУ) или основания, связанные со смолой, такие как МР-Карбонат. Температура этого способа изменяется от -30 до 50°С; предпочтительно реакцию проводят при температуре от 0°С до комнатной.
Реакция может быть проведена в одну стадию или в несколько последовательных стадий без какого-либо неблагоприятного влияния на общий выход или селективность реакции.
Соединения формулы 11 при смешивании с первичным или вторичным амином HNR5R6 (5) применимы при получении соединений формулы 12, где R5 иR6 независимо - водород, ароматическая группа или алифатическая группа, или NR5R6 может образовывать 4-11-членное ароматическое или алифатическое кольцо. Альтернативно, соединения формулы 11 применимы для получения соединений формулы 13а или 13b присоединением кислородо- или серосодержащего нуклеофила, соответственно. Соединения формулы 11 (где Х - галоген или перфторалкилсульфонат) также применимы для получения соединений формулы 14 или 15а/b, в которых R7 - ароматическая или алифатическая группа, реакцией образования углерод-углеродной связи, катализируемой палладием.
Соединения формулы 12-15 применимы, например, для лечения аномального роста клеток, такого как рак, у млекопитающих. Например, соединения 12-15 являются ингибиторами протеинкиназ. В частности, соединения формулы 12 являются селективными ингибиторами определенных рецепторных и нерецепторных тирозинкиназ, например, киназы очаговой адгезии (FAK, focal adhesion kinase). Подобные соединения описаны в заявках США на патент №№ 10/734 039 (регистрационный номер поверенного РС25339) и 10/733 215 (регистрационный номер поверенного РС25937).
ПРИМЕРЫ
Следующие примеры иллюстрируют получение соединений по настоящему изобретению. Данные ЯМР приведены в миллионных долях относительно захваченного сигнала дейтерия из образца растворителя. Коммерческие реагенты применяли без дополнительной очистки. ТГФ - тетрагидрофуран и ДМФ - N,N-диметилформамид. Хроматография относится к колоночной хроматографии, выполненной на силикагеле 0,040 мм в условиях флэш-хроматографии. Масс-спектры низкого разрешения (МСНР) записаны на химической ионизационной платформе при атмосферном давлении (Fisons Instrument, UK), используя смесь ацетонитрил-вода (50:50) с 0,1% муравьиной кислоты в качестве ионизирующего средства. Все неводные реакции проводили в атмосфере азота для удобства и чтобы максимизировать выход. Концентрирование при пониженном давлении означает, что применяли роторный испаритель. Ароматические или алифатические нуклеофильные амины либо приобретали и применяли без дополнительной очистки, либо получали стандартными способами синтеза аминов, известными специалистам в этой области техники.
Когда в методиках и примерах ниже обращаются к аналитической ВЭЖХ-хроматографии (высокоэффективная жидкостная хроматография), то используют следующие общие условия, если не оговорено особо. Используемая колонка - ZORBAX RXC 18 (производитель Hewlett Packard) длиной 150 мм и внутренним диаметром 4,6 мм. Образцы исследовались на приборе Hewlett Packard-1100. Использовали метод градиента растворителя от 100% буфера ацетат аммония/уксусная кислота (0,2 М) до 100% ацетонитрила в течение 10 мин. Затем прибор продолжал работать в промывочном цикле со 100% ацетонитрилом в течение 1,5 мин, затем со 100% буферным раствором в течение 3 мин. Скорость потока в течение этого периода была постоянной, 3 мл/мин.
Пример 1
Получение 2,4-дихлор-5-трифторметилпиримидина
5-трифторметилурацил (250 г, 1,39 моль) и оксихлорид фосфора (655 мл, 6,94 моль, 5 экв.) загружали в трехлитровую четырехгорлую колбу, снабженную мешалкой, обратным холодильником, воронкой для добавления и внутренней термопарой. В колбе поддерживалась азотная атмосфера по мере того как к суспензии добавляли концентрированную фосфорную кислоту в виде одной порции (85 вес.%, 9,5 мл, 0,1 экв.), причем наблюдался умеренный экзотермический эффект. Затем по каплям в течение 15 мин добавляли диизопропилэтиламин (245 мл, 1,39 моль, 1 экв.) с такой скоростью, чтобы внутренняя температура реакции достигала 85-90°С в конце прибавления. После окончания добавления амина реакционная смесь представляла собой гомогенный светло-оранжевый раствор. Оранжевый раствор нагревали 20 ч при 100°С; за это время, по данным ВЭЖХ-анализа реакционной смеси, исходный материал израсходовался. Внешнее нагревание снимали, содержимое колбы охлаждали до 40°С и затем добавляли по каплям к охлажденной смеси 3н. HCl (5 л, 10 экв.) и диэтилового эфира (2 л), поддерживая температуру сосуда для гашения реакции между 10 и 15°С. Слои разделяли и водный слой экстрагировали один раз эфиром (1 л). Органические слои объединяли, промывали водой (5×1,5 л) до нейтральной реакции, сушили MgSO4 и концентрировали с получением 288 г (95% выход) желто-оранжевого масла 96% чистоты (ВЭЖХ). Это вещество далее может быть очищено перегонкой (т.кип. 109°С/79 мм рт. ст.).
Пример 2
Общая методика неселективного присоединения амина
Методика А. Смесь (2-хлор-5-трифторметилпиримидин-4-ил)-п-толиламина (9) и (4-хлор-5-трифторметилпиримидин-2-ил)-п-толиламина (8). К раствору 5-трифторметил-2,4-дихлорпиримидина (500 мг, 2,3 ммоль) в смеси ДХЭ-трет-бутанол (20 мл) добавили 4-метиланилин (247 мг, 1 экв.) и затем по каплям триэтиламин (1,1 экв.). После перемешивания в течение ночи реакционную смесь концентрировали и переводили в этилацетат, промывали насыщенным раствором NaHCO3, сушили Na2SO4 и растворитель удаляли. Анализ ВЭЖХ показал, что неочищенный продукт реакции содержал смесь 8 и 9 в отношении 1,4:1. Образующуюся смесь изомеров разделяли на препаративном ВЭЖХ приборе Shimadzu, используя стандартный градиент (5-м колонка Waters XTerra Prep MS C18, 50×50 мм; 0,1% NH4OH в 40-90% ацетонитрил/вода, 75 мл/мин, градиентное элюирование в течение 15 мин), с получением 2-хлор-5-трифторметилпиримидин-4-ил)-п-толиламина (9) (122 мг): 1Н ЯМР (CDCl3, 400 МГц) δ 2,35 (с, 3H), 6,99 (ушир.с, 1H), 7,19 (д, J=8,3 Гц, 2H), 7,38 (д, J=8,3 Гц, 2H), 8,38 (с, 1H); 13C ЯМР (CDCl3, 100 МГц) δ 163,9, 157,6, 156,0 (кв, J=5 Гц), 136,1, 133,7, 130,0, 123,8 (кв, J=270 Гц), 122,8, 106,6 (кв, J=32 Гц), 21,2; ВЭЖХ, время удерживания: 7,236 мин; МСНР (масс-спектр низкого разрешения) (М+): 288,1, 290,1 и (4-хлор-5-трифторметилпиримидин-2-ил)-п-толиламина (8) (205 мг): 1H ЯМР (CDCl3, 400 МГц) 2,33 (с, 3H), 7,17 (д, J=8,3 Гц, 2H), 7,42 (д, J=8,3 Гц, 2H), 7,46 (ушир.с, 1H), 8,52 (с, 1H); 13C ЯМР (CDCl3, 100 МГц) 160,9, 157,6 (ушир), 134,9, 134,8, 129,9, 122,8 (кв, J=269 Гц), 121,1, 113,7 (кв, J=34 Гц), 21,1; ВЭЖХ, время удерживания: 8,137 мин; МСНР (М+): 288,1, 290,1. Подтверждение структур двух изомеров получали рентгенографическим анализом монокристаллов.
Общие методики селективного присоединения аминов с применением кислоты Льюиса
Методика В: (4-хлор-5-трифторметилпиримидин-2-ил)-п-толиламин (8). К раствору 5-трифторметил-2,4-дихлорпиримидина (2 г, 9,2 ммоль) в смеси 1:1 ДХЭ-трет-бутанол (80 мл) добавили хлорид цинка (11 мл 1 М раствора в эфире, 1,2 экв.) при 0°С. Через 1 ч добавили 4-метиланилин (988 мг, 1 экв.) и затем по каплям раствор триэтиламина (1,03 г, 1,1 экв.) в 10 мл смеси ДХЭ-трет-бутанол. После перемешивания в течение 1,5 ч реакционную смесь концентрировали. Анализ ВЭЖХ показал, что неочищенный продукт реакции содержал меньше 5% изомера 9. Целевой продукт 8 получали кристаллизацией из метанола в виде белого твердого вещества (2,25 г, 85%). ВЭЖХ время удерживания: 8,169 мин. МСНР (М+): 288,2, 290,1.
Применение методики В с рядом других аминов предусматривает получение ряда других 2-амино-4-хлор-5-трифторметилпиримидинов, включая приведенные ниже, но не ограничивается ими.
5-(4-Хлор-5-трифторметилпиримидин-2-иламино)-1,3-дигидроиндол-2-он: 1H ЯМР (ДМСО-d6, 400 МГц) δ 3,29 (с, 2H), 6,76 (д, J=7,9 Гц, 2H), 7,39 (д, J=8,3 Гц), 7,51 (ушир.с, 1H), 8,71 (с, 1H), 10,33 (с, 1H), 10,49 (с, 1H). 13С ЯМР (ДМСО-d6, 100 МГц) δ 177,0, 161,3, 158,7 (ушир), 140,7, 132,8, 126,9, 123,7 (кв, J=268 Гц), 121,0, 118,7, 111,2 (кв, J=32 Гц), 109,6, 36,7; ВЭЖХ, время удерживания: 5,759 мин; МСНР (М+): 329,1, 331,1.
(4-Хлор-5-трифторметилпиримидин-2-ил)-(4-метоксифенил)амин: 1H ЯМР (CDCl3, 400 МГц) δ 3,80 (с, 3H), 6,91 (д, J=9,1 Гц, 2H), 7,38 (ушир.с, 1H), 7,43 (д, J=8,7 Гц, 2H), 8,50 (с, 1Н); 13C ЯМР (CDCl3, 100 МГц) δ 161,1, 157,6 (ушир), 157,2, 130,3, 123,2, 122,9 (кв, J=269 Гц), 114,5, 113,5 (кв, J=34 Гц), 112,5, 55,7; ВЭЖХ, время удерживания: 7,550 мин; МСНР (М+): 304,2, 306,1.
(4-Хлор-5-трифторметилпиримидин-2-ил)-(4-нитрофенил)амин: 1H ЯМР (CDCl3, 400 МГц) δ 7,80 (ушир.с, 1Н), 7,82 (д, J=24 Гц, 2Н), 8,26 (д, J=23 Гц, 2Н), 8,67 (с, 1Н); 13С ЯМР (ДМСО-d6, 100 МГц) δ 160,7, 158,9 (кв, 4,5 Гц), 158,6, 145,7, 142,7, 125,6, 123,3 (кв, J=269 Гц), 120,0, 113,8 (кв, J=34 Гц); ВЭЖХ, время удерживания: 7,720 мин; МСНР (М+): 318,3, 320,3.
(4-Хлор-5-трифторметилпиримидин-2-ил)-(3,4-дихлорфенил)амин: 1H ЯМР (CDCl3, 400 МГц) δ 7,39 (м, 3H), 7,86 (с, 1H), 8,60 (с, 1H); 13С ЯМР (CDCl3, 100 МГц) δ 160,2, 159,8, 157,6 (кв, J=5 Гц), 137,2, 133,2, 130,9, 127,9, 112,6 (кв, J=270 Гц), 121,9, 119,5, 115,0 (кв, J=34 Гц); ВЭЖХ, время удерживания: 8,837 мин; МСНР (М+): 342,1, 344,1.
(4-Хлор-5-трифторметилпиримидин-2-ил)-о-толиламин: 1H ЯМР (CDCl3, 400 МГц) δ 2,30 (с, 3H), 7,15 (м, 2H), 7,26 (м, 3H), 7,35 (д, J=7,5 Гц, 1H), 8,51 (с, 1H); 13С ЯМР (CDCl3, 100 МГц) δ 161,5, 159,7, 157,8 (кв, J=4,5 Гц), 135,4, 131,1, 127,0, 126,3, 124,0, 122,8 (кв, J=270 Гц), 113,8 (кв, J=34 Гц), 18,3; ВЭЖХ, время удерживания: 7,663 мин; МСНР (М+): 288,1, 290,1.
(3-Хлорфенил)-(4-хлор-5-трифторметилпиримидин-2-ил)амин: 1H ЯМР (CDCl3, 400 МГц) δ 7,11 (д, J=9,1 Гц, 1H), 7,28 (т, J=8,1 Гц, 1H), 7,38 (ушир.с, 1H), 7,41 (д, J=9,1 Гц, 1H), 7,75 (с, 1H), 8,59 (с, 1H); 13С ЯМР (CDCl3, 100 МГц) δ 60,4, 159,7, 157,6 (кв, J=4,5 Гц), 138,8, 135,1, 124,6, 122,6 (кв, J=269 Гц), 120,4, 118,3, 114,7 (кв, J=34 Гц); ВЭЖХ, время удерживания: 8,301 мин; МСНР (М+): 308,1, 310,1.
(4-Хлорфенил)-(4-хлор-5-трифторметилпиримидин-2-ил)амин: 1H ЯМР (CDCl3, 400 МГц) δ 7,33 (д, J=9,1 Гц, 2H), 7,42 (с, 1H), 7,53 (д, J=8,7 Гц, 2H), 8,56 (с, 1H); 13С ЯМР (CDCl3, 100 МГц) δ 160,5, 159,7, 157,6 (кв, J=5 Гц), 136,2, 129,8, 129,4 122,7 (кв, J=270 Гц), 118,6, 114,4 (кв, J=34 Гц); ВЭЖХ, время удерживания: 8,316 мин; МСНР (М+): 308,1, 310,0.
(4-Хлор-5-трифторметилпиримидин-2-ил)метил-п-толиламин: 1H ЯМР (CDCl3, 400 МГц) δ 2,36 (с, 3Н), 3,52 (с, 3Н), 7,13 (д, J=8,3 Гц, 2H), 7,23 (д, J=9,1 Гц, 2H), 8,39 (ушир.с, 1H); 13С ЯМР (CDCl3, 100 МГц) δ 162,4, 159,1, 157,2, 141,3, 137,3, 130,4, 126,4, 123,2 (кв, J=269 Гц), 111,7 (кв, J=34 Гц), 39,6, 21,4; ВЭЖХ, время удерживания: 8,708 мин; МСНР (М+): 302,2, 304,1.
(4-Хлор-5-трифторметилпиримидин-2-ил)-(3-оксазол-5-илфенил)амин: 1Н ЯМР (ДМСО-d6, 400 МГц) δ 7,44 (м, 2H), 7,63 (с, 1H), 7,65 (м, 1H), 8,07 (с, 1H), 8,44 (с, 1H), 8,82 (с, 1H), 10,78 (с, 1H); 13С ЯМР (ДМСО-d6, 100 МГц) δ 161,2, 158,9 (ушир), 158,4, 152,6, 151,0, 139,8, 130,2, 128,5, 123,6 (кв, J=269 Гц), 122,9, 121,2, 120,1, 116,4, 112,3 (кв, J=34 Гц); ВЭЖХ, время удерживания: 7,374 мин; МСНР (М+): 341,2, 343,1.
4-(4-Хлор-5-трифторметилпиримидин-2-иламино)бензамид: 1Н ЯМР (ДМСО-d6, 100 МГц) δ 7,26 (с, 1H), 7,74 (д, J=8,7 Гц, 2H), 7,83 (д, J=9,1 Гц, 2H), 8,44 (ушир.с, 1H), 8,84 (с, 1H), 10,87 (с, 1H); 13С ЯМР (ДМСО-d6, 100 МГц) δ 168,0, 161,0, 158,9 (ушир), 158,4, 141,8, 129,6, 129,0, 123,5 (кв, J=268 Гц), 119,9, 112,6 (кв, J=34 Гц); ВЭЖХ, время удерживания: 5,605 мин; МСНР (М+): 317,1, 319,3.
(4-Хлор-5-трифторметилпиримидин-2-ил)-(4-метансульфонилфенил)амин: 1Н ЯМР (ДМСО-d6, 400 МГц) δ 3,15 (с, 3Н), 7,87 (д, J=8,7 Гц, 2H), 7,93 (д, J=8,7 Гц, 2H), 8,89 (с, 1H), 11,10 (с, 1H); 13С ЯМР (ДМСО-d6, 100 МГц) δ 60,9, 158,9 (ушир), 158,5, 143,9, 135,3, 128,8, 123,4 (кв, J=269 Гц), 120,4, 113,3 (кв, J=34 Гц), 44,5; ВЭЖХ, время удерживания: 6,542 мин; МСНР (М+): 352,1, 354,1.
4-(4-Хлор-5-трифторметилпиримидин-2-иламино)бензолсульфонамид: 1Н ЯМР (ДМСО-d6, 400 МГц) δ 7,25 (с, 2H), 7,76 (д, J=9,1 Гц, 2H), 7,83 (д, J=9,1, 2H), 8,85 (с, 1H), 10,98 (с, 1H); 13С ЯМР (ДМСО-d6, 100 МГц) δ 161,0, 158,9 (ушир), 158,5, 142,2, 139,2, 127,3, 123,5 (кв, J=269 Гц), 120,3, 113,0 (кв, J=33 Гц); ВЭЖХ, время удерживания: 5,983 мин; МСНР (М+): 353,2, 355,2.
Для тех случаев, в которых нуклеофильный амин является алифатическим амином или ароматическим амином, способным служить мультидентатным лигандом для кислоты Льюиса, необходимо дополнительное количество эквивалентов кислоты Льюиса, чтобы реакция протекала селективно.
Методика С: N-(4-Хлор-5-трифторметилпиримидин-2-ил)-N',N'-диметилбензол-1,4-диамин: К раствору 5-трифторметил-2,4-дихлорпиримидина (500 мг, 2,3 ммоль) в смеси 1:1 ДХЭ-трет-бутанол (20 мл) добавили хлорид цинка (5,1 мл 1 М раствора в эфире, 2,2 экв.) при 0°С. Через 1 ч добавили N,N-диметил-1,4-фенилендиамин (313 мг, 1 экв.) и затем по каплям раствор триэтиламина (279 мг, 1,1 экв.) в 5 мл смеси ДХЭ-трет-бутанол. После перемешивания в течение 20 ч реакционную смесь концентрировали. Продукт получали кристаллизацией из 25% смеси вода/метанол в виде бледно-зеленого твердого вещества (531 мг, 73%). 1Н ЯМР (ДМСО-d6, 400 МГц) δ 2,83 (с, 6H), 6,69 (м, 2H), 7,39 (м, 2H), 8,65 (с, 1H), 10,32 (с, 1H); 13С ЯМР (CDCl3, 100 МГц) δ 161,3, 158,8 (ушир), 158,5 (ушир), 148,3, 128,2, 123,8 (кв, J=268 Гц), 123,0, 113,1, 110,8 (ушир), 41,0; ВЭЖХ, время удерживания: 7,901 мин; МСНР (М+): 317,3, 319,3.
Применение методики С с рядом других аминов позволяет получить ряд других 2-амино-4-хлор-5-трифторметилпиримидинов, включая приведенные ниже, но не ограничивается ими.
(4-Хлор-5-трифторметилпиримидин-2-ил)-(2-метоксифенил)амин: 1H ЯМР (CDCl3, 400 МГц) δ 3,90 (с, 3H), 6,91 (д, J=8,1 Гц, 1H), 7,01 (м, 1H), 7,07 (м, 1H), 8,09 (с, 1H), 8,38 (д, J=7,9 Гц, 1H), 8,57 (с, 1H); 13С ЯМР (CDCl3, 100 МГц) δ 160,4, 159,3, 157,5 (кв, J=4,5 Гц), 148,6, 127,4, 124,1, 122,9 (кв, J=269 Гц), 121,1, 119,8, 113,7 (кв, J=34 Гц), 110,4, 56,0; ВЭЖХ, время удерживания: 8,151 мин; МСНР (М+): 304,2, 306,2.
(4-Хлор-5-трифторметилпиримидин-2-ил)-(4-метилбензил)амин: 1Н ЯМР (ДМСО-d6, 400 МГц) δ 2,23 (с, 3Н), 4,46 (м, 2Н), 7,09 (м, 2Н), 7,15 (м, 2Н), 8,57 (2с, 1Н), 8,98 (м, 1Н); ВЭЖХ, время удерживания: 8,238 мин; МСНР (М+): 302,0, 304,0.
(4-Хлор-5-трифторметилпиримидин-2-ил)циклогексиламин: 1Н ЯМР (ДМСО-d6, 400 МГц) δ 1,10 (м, 1H), 1,23 (м, 4H), 1,55 (м, 1H), 1,65 (м, 2H), 1,81 (м, 2H), 3,69 (м, 2H), 8,47 (м, 1H), 8,55 (2 ушир.с, 1H); ВЭЖХ, время удерживания: 8,548 мин; МСНР (М+): 280,1, 282,1.
(4-Хлор-5-трифторметилпиримидин-2-ил)циклогексилметиламин: 1Н ЯМР (ДМСО-d6, 400 МГц) δ 0,86 (м, 2H), 1,11 (м, 3H), 1,50 (м, 1H), 1,58 (м, 1H), 1,64 (м, 4H), 3,12 (м, 2H), 8,55 (м, 2H); ВЭЖХ, время удерживания: 9,039 мин; МСНР (М+): 294,1, 296,1.
4-Хлор-2-пиперидин-1-ил-5-трифторметилпиримидин: 1Н ЯМР (CDCl3, 400 МГц) δ 1,60 (м, 4H), 1,68 (м, 2H), 3,82 (м, 4H), 8,36 (с, 1H); 13С ЯМР (ДМСО-d6, 100 МГц) δ 161,5, 159,1, 157,2 (кв, J=4,5 Гц), 123,4 (кв, J=268 Гц), 109,8 (кв, J=34 Гц), 45,4, 25,9, 24,7; ВЭЖХ, время удерживания: 8,915 мин; МСНР (М+): 266,1, 268,2.
Настоящее изобретение не ограничивается объемом определенных вариантов, описанных здесь. Действительно, разные модификации изобретения, в дополнение к описанным здесь, станут очевидными специалистам в этой области техники из предшествующего описания и сопровождающих фигур. Понимают, что такие модификации попадают в объем приложенной формулы изобретения. Все патенты, публикации, методы испытания, литература и другие материалы, цитированные здесь, включаются в изобретение путем ссылок.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АМИНОНИКОТИНОВОЙ КИСЛОТЫ И ИЗОНИКОТИНОВОЙ КИСЛОТЫ КАК ИНГИБИТОРЫ ДГОДГ (ДИГИДРООРОТАТДЕГИДРОГЕНАЗЫ) | 2007 |
|
RU2469024C2 |
| ПИРРОЛОПИРИДИНЫ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2006 |
|
RU2435769C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2528046C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2382779C2 |
| СПОСОБ МОДУЛЯЦИИ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2525115C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ И ПРИМЕНЕНИЕ | 2002 |
|
RU2288227C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2556984C2 |
| ИНГИБИТОРЫ ПРОЛИЛГИДРОКСИЛАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2429226C9 |
| 6-АМИНО-2-ЗАМЕЩЕННЫЕ-5- ВИНИЛСИЛИЛПИРИМИДИН-4-КАРБОНОВЫЕ КИСЛОТЫ И СЛОЖНЫЕ ЭФИРЫ И 4-АМИНО-6-ЗАМЕЩЕННЫЕ-3-ВИНИЛСИЛИЛПИРИДИН-ПИКОЛИНОВЫЕ КИСЛОТЫ И СЛОЖНЫЕ ЭФИРЫ КАК ГЕРБИЦИДЫ | 2012 |
|
RU2556000C2 |
Изобретение относится к способу получения соединения формулы 11,
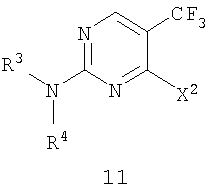
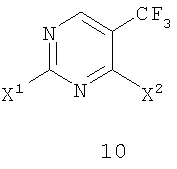
в которой X2 представляет собой уходящую группу и R3 и R4 представляют собой заместители, независимо выбранные из группы, состоящей из водорода, ароматической группы и алифатической группы, или взятые вместе -NR3R4 образуют 4-11-членное алифатическое кольцо, при этом R3 и R4 одновременно не могут обозначать водород, включающий взаимодействие соединения формулы 10, в которой X1 представляет собой уходящую группу, с амином формулы 3 (HNR3R4) в присутствии кислоты Льюиса и ненуклеофильного основания, причем группы X1 и X2 являются одинаковыми. Соединения формулы 11 могут найти применение для лечения аномального роста клеток. 13 з.п. ф-лы.
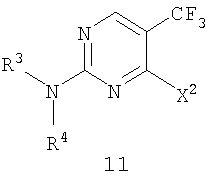
в которой X2 представляет собой уходящую группу и R3 и R4 представляют собой заместители, независимо выбранные из группы, состоящей из водорода, ароматической группы и алифатической группы, или взятые вместе -NR3R4 образуют 4-11-членное алифатическое кольцо, при этом R3 и R4 одновременно не могут обозначать водород, включающий взаимодействие соединения формулы 10
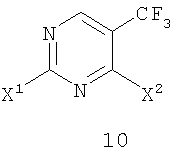
в которой X1 представляет собой уходящую группу, с амином формулы 3 (HNR3R4) в присутствии кислоты Льюиса и ненуклеофильного основания с получением соединения формулы 11, причем группы X1 и X2 являются одинаковыми.
| ПРОИЗВОДНЫЕ ПИРИМИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2129549C1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| DIRINGER et al | |||
| "Fluorinated pyrimidines | |||
| XXXVI | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2008-01-27—Публикация
2004-08-24—Подача