Настоящее изобретение относится к фармацевтическим композициям, предназначенным, например, для лечения патологических состояний, которое предусматривает совместное введение агентов, обладающих фармацевтической активностью. Понятие "лечение" обозначает предупреждение и/или терапевтическое лечение.
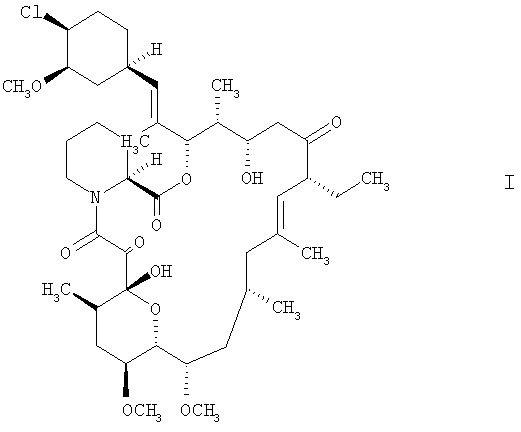
Одним из объектов настоящего изобретения является обладающее фармацевтической активностью соединение формулы

такое как соединение, описанное в ЕР 427680 (33-эпи-33-хлор-FR 520, пример 66а), и 2-амино-1,3-пропандиол в сочетании с одним или несколькими фармацевтически приемлемым(и) эксципиентом(ами).
Фармацевтически приемлемый(е) эксципиент(ы) включает(ют), например, фармацевтически приемлемые вспомогательные вещества, носитель(и), разбавитель(и). 2-амино-1,3-пропандиол может включать один или несколько 2-амино-1,3-пропандиолов.
Известно, что соединение формулы I можно применять для лечения различных нарушений/заболеваний, таких, например, как воспалительные состояния, опосредуемые иммунной системой нарушения, или аутоиммунные заболевания, например васкулитиды, гломерулонефриты, атопический дерматит, аллергии (такие как аллергическая контактная экзема, астма), псориаз, системная красная волчанка, ревматоидный артрит, воспалительные заболевания кишечника (например, болезнь Крона, неспецифический язвенный колит), рассеянный склероз, инсулинзависимый диабет, синдром Шегрена, эндогенный задний увеит (в частности, болезнь Бехчета), тироитид Хашимото, и для предупреждения отторжения ксенотрансплантатов или аллотрансплантатов, включая, например, трансплантаты сердца, почки, печени или костного мозга; заболеваний трансплантированных сосудов или реакций "трансплантат против хозяина".
В контексте настоящего описания 2-амино-1,3-пропандиол обозначает соединение формулы
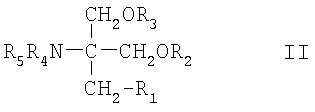
где
R1 обозначает необязательно замещенную линейную или разветвленную С12-С22углеродную цепь, например алкильную цепь, которая необязательно может нести необязательно замещенный фенилен, и где R2, R3, R4 и R5 каждый независимо друг от друга обозначает Н или (низш.)алкил. Если углеродная цепь, представляющая собой R1, является замещенной, то она предпочтительно замещена галогеном, нитро-, амино-, гидрокси- или карбоксигруппой. Если углеродная цепь обрывается необязательно замещенным фенилом, то углеродная цепь предпочтительно является незамещенной. Если фениленовый фрагмент является замещенным, то он предпочтительно замещен галогеном, нитро-, амино-, метокси-, гидрокси- или карбоксигруппой. Понятие "(низш.)алкил" обозначает С1-С4алкил. Такие соединения описаны, например, в ЕР 627406, ЕР 778263, ЕР 1002792 или WO 02/06268, содержание которых, прежде всего касающееся соединений, включено в настоящее описание в качестве ссылки. Предпочтительные соединения включают соединения формулы II, где R1 обозначает линейную или разветвленную, предпочтительно линейную C13-С30углеродную цепь, необязательно замещенную нитрогруппой, галогеном, амино-, гидрокси- или карбоксигруппой, и, более предпочтительно, соединения формулы II, где R1 обозначает фенилалкил, необязательно замещенный галогеном, например, где алкил представляет собой С1-С6алкил, необязательно замещенный гидроксигруппой, и где фенил замещен линейным или разветвленным С6-С14алкилом и необязательно галогеном. Более предпочтительно R1 обозначает фенилС1-С6алкил, где фенильная группа замещена линейным или разветвленным, предпочтительно линейным С6-С14алкилом, такой как С6-С14алкилфенилС1-С6алкил. Если R1 обозначает фенилалкил, где фенил замещен линейным или разветвленным С6-С14алкилом, то фенильная группа может быть замещена алкилом в орто-, мета- или параположении, предпочтительно в параположении. Предпочтительно каждый из радикалов R2-R5 обозначает водород.
Фармацевтическая композиция может содержать соединение формулы I и 2-аминопропанол, например, описанный в ЕР 778263, в сочетании с одним или несколькими фармацевтически приемлемым(ми) эксципиентом(ами).
В другом предпочтительном варианте осуществления изобретения 2-амино-1,3,-пропандиол или 2-аминопропанол представляет собой соединение, способное осуществлять хоминг лимфоцитов. Такие свойства можно выявлять, например, с помощью описанного ниже теста: соединение, подлежащее тестированию, или носитель вводят перорально крысам через желудочный зонд. Образцы крови из хвостовой вены для гематологического анализа отбирают в день 11 для определения базовых индивидуальных уровней и через 2, 6, 24, 48 и 72 ч после введения. Агент хоминга лимфоцитов представляет собой соединение, которое уменьшает количество лимфоцитов в периферической крови более чем на 50% через шесть часов, например, после введения дозы менее 5 мг/кг, предпочтительно менее 3 мг/кг.
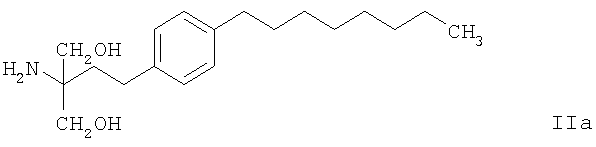
Еще более предпочтительным соединением из класса соединений формулы II является соединение формулы

например, гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола. 2-амино-1,3-пропандиолы, например, соединение формулы II, вследствие их выявленной активности можно применять, например, как описано в ЕР 627406, в качестве иммуномодуляторов, например иммунодепрессантов, например, при лечении отторжений аллотрансплантатов. Как описано, например, в WO 98/22100, 2-амино-1,3-пропандиолы, например, соединения формулы II, могут ингибировать заболевание трансплантатов сосудов и их применяют, в частности, для предупреждения или лечения хронического отторжения трансплантированного органа, кроме того, они могут подавлять отторжение ксенотрансплантата.
Предлагаемый в настоящем изобретении 2-амино-1,3-пропандиол или 2-аминопропанол обладает фармацевтической активностью и является фармацевтически приемлемым.
Соединение формулы I и 2-амино-1,3-пропандиол могут находиться в любой форме, например в свободной форме, в форме соли, в форме сольвата и в форме соли и сольвата, если такие формы существуют. Соединения по настоящему изобретению, находящиеся
- в свободной форме можно превращать в соответствующее соединение в форме соли;
- в свободной форме или в форме соли и в форме сольвата можно превращать в соответствующее соединение в свободной форме или в форме соли, находящееся в несольватированной форме;
и наоборот.
Фармацевтическая активность соединения в свободной форме близка к активности соединения в форме соли/сольвата. Под понятие сольват подпадает гидрат. Соль обозначает фармацевтически приемлемую соль.
Фармацевтически приемлемые соли соединения формулы II представляют собой, например, соли соединения формулы II с кислотой, включая, например, неорганическую кислоту, такую как соляная кислота, бромистоводородная кислота и серная кислота, и неорганическую кислоту, такую как уксусная кислота, фумаровая кислота, малеиновая кислота, бензойная кислота, лимонная кислота, яблочная кислота, метансульфоновая кислота и бензолсульфоновая кислота, и, если присутствует карбоксигруппа, соли с
- металлами, такими как натрий, калий, кальций и алюминий,
- аминами, такими как триэтиламин, и
- двухосновными аминокислотами, такими как лизин.
В предпочтительном варианте осуществления изобретения соединения формулы II или соединения, описанные в ЕР 1002792, включают фосфаты указанных соединений.
Соединение формулы I и соединение формулы II могут существовать в изомерных формах и под объем настоящего изобретения подпадает соединение формулы I и 2-амино-1,3-пропандиол, предлагаемые в настоящем изобретении, в любой изомерной форме и любая смесь изомеров. Например, если соединение формулы I и 2-амино-1,3-пропандиол, предлагаемые в настоящем изобретении, имеют один или несколько асимметричных центров в молекуле, то под объем настоящего изобретения подпадает соединение в форме различных оптических изомеров, а также рацематы, диастереоизомеры и их смеси.
При создании изобретения в опытах на модели экспериментального аутоиммунного увеита (ЭАУ) у животных, где соединение формулы I или 2-амино-1,3-пропандиол обладают фармацевтической активностью, неожиданно было установлено, что при совместном введении соединения формулы I и 2-амино-1,3-пропандиола, например, соединения формулы II, например, в субоптимальных дозах, проявлялась их повышенная активность. Указанная повышенная активность соединений в случае их совместного введения существенно превышала активность каждого тестированного соединения при его индивидуальном введении, например, в субоптимальных дозах. Такой же подход можно применять, по-видимому, для лечения всех заболеваний, в отношении которых либо соединение формулы I, либо 2-амино-1,3-пропандиол обладает фармацевтической активностью, таких, например, как воспалительные состояния, опосредуемые иммунной системой состояния, или аутоиммунные заболевания, например васкулитиды, гломерулонефриты, атопический дерматит, аллергии (такие как аллергическая контактная экзема, астма) псориаз, системная красная волчанка, ревматоидный артрит, воспалительные заболевания кишечника (например, болезнь Крона, неспецифический язвенный колит), рассеянный склероз, инсулинзависимый диабет, синдром Шегрена, эндогенный задний увеит (в частности, болезнь Бехчета), тироитид Хашимото, и для предупреждения отторжения ксенотрансплантатов или аллотрансплантатов, включая, например, трансплантаты сердца, почки, печени или костного мозга; заболеваний трансплантированных сосудов или реакций "трансплантат против хозяина".
Еще одним объектом настоящего изобретения является упаковка, которая содержит фармацевтическую композицию, включающую соединение формулы I и один или несколько фармацевтически приемлемый(х) эксципиент(ов), и инструкции для одновременного или последовательного введения 2-амино-1,3-пропандиола.
Еще одним объектом настоящего изобретения является упаковка, которая содержит фармацевтическую композицию, включающую 2-амино-1,3-пропандиол и один или несколько фармацевтически приемлемый(х) эксципиент(ов), и инструкции для одновременного или последовательного введения соединения формулы I.
Следующим объектом настоящего изобретения является набор, например упаковка, которая содержит фармацевтическую композицию, включающую соединение формулы I и один или несколько фармацевтически приемлемый(х) эксципиент(ов), и фармацевтическую композицию, включающую 2-амино-1,3-пропандиол и один или несколько фармацевтически приемлемый(х) эксципиент(ов) в этой же самой упаковке.
Еще одним объектом настоящего изобретения является способ повышения фармацевтической активности описанного выше соединения формулы I, который предусматривает совместное введение соединения формулы I и 2-амино-1,3-пропандиола индивидууму, нуждающемуся в лечении соединением формулы I и/или 2-амино-1,3-пропандиолом.
Совместное введение соединения формулы I и 2-амино-1,3-пропандиола можно осуществлять различными путями:
а) в форме фиксированных комбинаций соединения формулы I и обладающего фармацевтической активностью 2-амино-1,3-пропандиола, находящихся в составе одной фармацевтической композиции;
б) в форме (фармацевтического) набора, в котором соединение формулы I и 2-амино-1,3-пропандиол присутствуют в виде различных фармацевтических композиций, которые поступают в продажу в одной упаковке, например, вместе с инструкцией по совместному введению;
в) в форме свободных комбинаций, когда соединение формулы I и 2-амино-1,3-пропандиол находятся в различных упаковках, например, в виде фармацевтических композиций, где каждая упаковка содержит инструкцию по одновременному или последовательному применению.
Наиболее эффективное соотношение соединения формулы I и 2-амино-1,3-пропандиола может зависеть, например, от подлежащего лечению состояния. Соответствующие дозы и диапазоны доз, конечно, могут варьироваться в зависимости, например, от используемых действующих веществ, предлагаемых в изобретении, хозяина, пути введения и природы и серьезности состояний, подлежащих лечению. Однако, как правило, для получения удовлетворительных результатов для крупных млекопитающих, например человека, можно применять суточные дозы, которые находятся в диапазоне, принятом для сходного с капролактамом обладающего фармацевтической активностью соединения формулы I и обладающего фармацевтической активностью 2-амино-1,3-пропандиола, например, которые меньше оптимальных доз для указанных соединений и которые вводят, например, в виде разделенных доз, например до 4 раз в день. Как правило, удовлетворительные результаты получают при системном введении соединения формулы I в суточных дозах от приблизительно 0,5 до приблизительно 15 мг/кг, предпочтительно от 1 до приблизительно 15 мг на кг веса тела животного/человека и соединения формулы II в суточных дозах от приблизительно 0,005 до 0,1 мг/кг, предпочтительно от 0,01 до 0,1 мг на кг веса тела животного/человека. Предпочтительно соотношение соединения формулы I и соединения формулы II составляет приблизительно от 3000 до 10, предпочтительно от 500 до 10.
Действующие вещества, предлагаемые в настоящем изобретении, можно вводить любым общепринятым путем, например, системно, например, перорально, например, в форме таблеток или капсул, или парентерально, например, в форме растворов или суспензий для инъекции; и местно, например, путем нанесения на кожу, интраназально, интратрахеально.
Еще одним объектом настоящего изобретения является способ лечения заболеваний, в отношении которых соединение формулы I и/или 2-амино-1,3-пропандиол обладает фармацевтической активностью, таких, например, как воспалительные состояния, опосредуемые иммунной системой состояния, или аутоиммунные заболевания, например васкулитиды, гломерулонефриты, атопический дерматит, аллергии (такие как аллергическая контактная экзема, астма), псориаз, системная красная волчанка, ревматоидный артрит, воспалительные заболевания кишечника (например, болезнь Крона, неспецифический язвенный колит), рассеянный склероз, инсулинзависимый диабет, синдром Шегрена, эндогенный задний увеит (в частности, болезнь Бехчета), тироитид Хашимото, и для предупреждения отторжения ксенотрансплантатов или аллотрансплантатов, включая, например, трансплантаты сердца, почки, печени или костного мозга; заболеваний трансплантированных сосудов или реакций "трансплантат против хозяина", предусматривающий введение индивидууму, нуждающемуся в таком лечении, эффективного количества соединения формулы I и 2-амино-1,3-пропандиола; например, с использованием
- фиксированной комбинации, например, в форме фармацевтической композиции,
- набора, например, в форме фармацевтической композиции соединения формулы I и фармацевтической композиции 2-амино-1,3-пропандиола, находящихся в одной и той же упаковке,
- упаковки, содержащей соединение формулы I или 2-амино-1,3-пропандиол, например, в форме фармацевтических композиций, и инструкции по одновременному или последовательному совместному введению.
В предпочтительном варианте осуществления настоящего изобретения соединение формулы I вводят совместно с соединением формулы IIa.
Соединение формулы I и 2-амино-1,3-пропандиол можно вводить индивидуально или в сочетании с другими лекарственными средствами, применяемыми для иммуномодуляции, или другими противовоспалительными агентами. Например, соединения можно применять в сочетании с циклоспоринами, рапамицинами или другими аскомицинами или их аналогами, обладающими иммунодепрессантной активностью, такими, например, как циклоспорин А, циклоспорин G, FK-506, рапамицин, 40-O-(2-гидрокси)этилрапамицин, и т.д.; кортикостероидами; циклоспоринамидами; азатиопреном; метотрексатом; бреквинаром; лефлуномидом; мизорибином; микофенольной кислотой; мофетилом микофенолята; 15-дезоксиспергуалином; обладающими иммунодепрессантной активностью моноклональными антителами, например, моноклональными антителами к рецепторам лейкоцитов, например к МНС, CD2, CD3, CD4, CD7, CD25, CD28, В7, CD40, CD45 или CD58, или к их лигандам; или другими иммуномодуляторными соединениями, например CTLA4-Ig.
Тесты для оценки активности соединения формулы I и 2-амино-1,3-пропандиолов являются известными. Можно применять модель экспериментального аутоиммунного увеита (ЭАУ), которая описана, например, у McAllister и др., Clin. Immunol. Immunopathol. 39, 1986; cc.329-336.
Еще одним объектом настоящего изобретения является применение в качестве фармацевтического средства соединения формулы I в сочетании с 2-амино-1,3-пропандиолом, который вводят, например, либо одновременно, либо последовательно; и
применение комбинации соединения формулы I и 2-амино-1,3-пропандиола для приготовления лекарственного средства для лечения заболеваний, в отношении которых соединение формулы I или 2-амино-1,3-пропандиол обладают фармацевтической активностью. Лечение включает предупреждение и/или терапевтическое лечение.
Описание чертежей
На чертежах показано:
на фиг.1 - результаты теста на крысах с использованием модели экспериментального аутоиммунного увеита (ЭАУ). Крысам вводили перорально один раз в день в течение 14 дней либо
- -: контроль (плацебо, т.е. носитель, входящий в лекарственное средство/вода),
-: контроль (плацебо, т.е. носитель, входящий в лекарственное средство/вода),
- -: соединение формулы IIa (0,1 мг),
-: соединение формулы IIa (0,1 мг),
- -: соединение формулы I (15 мг), или
-: соединение формулы I (15 мг), или
- -: соединение формулы IIa (0,1 мг)+соединение формулы I (15 мг).
-: соединение формулы IIa (0,1 мг)+соединение формулы I (15 мг).
Массы в мг представляют собой мг/кг веса тела/день. В течение 20 дней после иммунизации с помощью метода, описанного в примерах, оценивали в баллах повреждения обоих глаз;
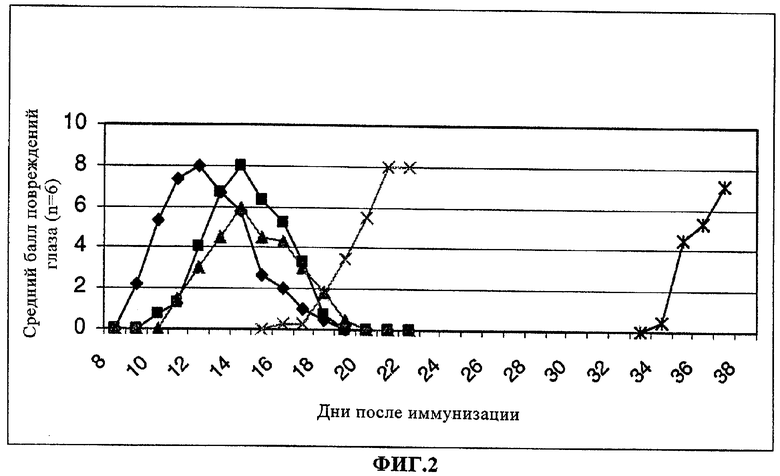
на фиг.2 - результаты теста на крысах с использованием модели экспериментального аутоиммунного увеита (ЭАУ). Крысам вводили перорально один раз в день в течение 14 дней либо
- -: контроль (плацебо, т.е. носитель, входящий в лекарственное средство/вода),
-: контроль (плацебо, т.е. носитель, входящий в лекарственное средство/вода),
- -: соединение формулы IIa (0,1 мг),
-: соединение формулы IIa (0,1 мг),
- -: соединение формулы I (15 мг),
-: соединение формулы I (15 мг),
- -: соединение формулы I (15 мг)+соединение формулы IIa (0,1 мг), 14 дней, или
-: соединение формулы I (15 мг)+соединение формулы IIa (0,1 мг), 14 дней, или
-*-: соединение формулы I (15 мг)+соединение формулы IIa (0,1 мг), 28 дней.
Остальные параметры имеют то же значение, что и для фиг.1.
Примеры
Пример 1: Система тестирования на основе ЭАУ
Экспериментальный аутоиммунный увеит (ЭАУ)
Применяли модель ЭАУ, аналогичную модели, описанной ранее McAllister и др., (1986) (McAllister C.G., Vistica B.P., Sekura R., Kuwabara Т., Gery I., The effects of pertussis toxin on the induction and transfer of experimental autoimmune uveoretinitis. Clin Immunol Immunopathol; 39, 1986, cc.329-336). Крысам (5 особей на группу) в день 1 при анестезии простым эфиром вводили путем инъекции в подушку правой лапы 50 мкг очищенного S-антигена бычьей сетчатки и внутрибрюшинно 1 мкг токсина коклюша (фирма Difco). Антиген разбавляли забуференным фосфатом физиологическим раствором и смешивали в соотношении 1:1 (об./об.) с полным адъювантом Фрейнда и Bacto M Tuberculosis Н37 RA (фирма Difco). Инъецируемый объем составлял 0,1 мл и содержал 50 мкл полного адъюванта и 1,14 мг Mycobacterium tuberculosis. Эта процедура индуцировала указанное заболевание у всех животных, симптомы которого впервые проявлялись через 9-10 дней после иммунизации. Почти у всех животных в группе, которую не подвергали обработке, развивались повреждения глаза, достигая степени серьезности 4 (см. раздел "оценка ЭАУ").
Обработка, дозы
Животным вводили с помощью желудочного зонда соединение формулы I или соединение формулы IIa индивидуально в суточных дозах 15 мг/кг или 0,1 мг/кг соответственно; или комбинацию обоих соединений в тех же дозах. Обработку начинали за 2 ч до иммунизации и проводили один раз в день в течение 14 последовательных дней. Контрольных животных обрабатывали аналогичным образом только плацебо/водой (плацебо: только носитель, входящий в лекарственное средство).
Оценка ЭАУ
Начиная с дня 7 после иммунизации вплоть до дня 20 животных ежедневно обследовали с помощью офтальмоскопа (тип Beta 200, фирма Heine) в отношении изменений, связанных с воспалением. Степень глазного воспаления оценивали полуколичественно с помощью баллов от 0 до 4 (для 1 глаза).
0: норма;
1: гиперемия радужной оболочки;
2: гиперемия радужной оболочки, сопровождающаяся расширением сосудов;
3: ранний фибринозный эксудат в передней камере и средняя степень инфильтрации клеток радужной оболочки; и
4: большой фибриновый сгусток в передней камере или образование фибриновой пробки на зрачке и высокая степень инфильтрации клеток радужной оболочки.
Результаты
Протекание и интенсивность болезни у животных (крысы линии LEWIS), которых обрабатывали перорально либо 0,1 мг/кг соединения формулы IIa, либо 15 мг/кг/день соединения формулы I, и у контрольных животных, которых обрабатывали плацебо, несущественно отличались друг от друга (см., например, таблицу 1 и фиг.1).
В противоположность этому введение обоих соединений в тех же самых дозах приводило к существенному замедлению начала возникновения заболевания (на 6 дней позже, чем в контролях), при этом интенсивность воспаления была существенно меньшей. Наивысший средний балл для обработанных животных составлял 4,4 в день 19 по сравнению с 8,0 в день 11 в контрольных группах.
В таблице 1 в столбцах, обозначенных "EAU POS" и "EAU 10", указаны количество пораженных заболеванием животных / количество животных в группе в конце исследования (EAU POS) и в день 10 (EAU 10) соответственно. Использованы следующие сокращения:
Соед. I: соединение формулы I
Соед. IIa: соединение формулы IIa
контроли: плацебо (носители для лекарственного средства /вода)
доза: перорально, в мг/кг/день
EAU POS: количество ЭАУ-позитивных крыс
EAU 10: количество случаев ЭАУ в день 10
EAU 1-й: день обнаружения первых симптомов ЭАУ (среднее значение ±С.К.О.)
Максимальный балл: максимальный балл (среднее значение для повреждений обоих глаз ±С.К.О.)
Результаты ЭАУ-теста (используемого в качестве примера метода анализа) свидетельствуют о том, что комбинация субоптимальной дозы соединения формулы I и субоптимальной дозы соединения формулы IIa обладает существенно большей активностью в отношении ЭАУ, чем вводимая индивидуально субоптимальная доза соединения формулы I или субоптимальная доза соединения формулы IIa соответственно (таблица 1 и фиг.1). Этот результат дает возможность применять субоптимальную дозу соединения формулы I в сочетании с субоптимальной дозой соединения формулы IIa.
Пример 2:
Крыс (по 6 особей на группу) обрабатывали как описано в примере 1 дозами, указанными в таблице 2. Как следует из данных, представленных в таблице 2 и на фиг.2, лечение с использованием комбинации лекарственных средств дает более высокие результаты по сравнением с лечением, когда соединения вводят индивидуально. Среди животных, которых обрабатывали в течение 14 дней обоими соединениями, первые клинические симптомы были обнаружены у одного животного в день 16. В течение 4-недельного периода обработки наблюдалось также полное подавление симптомов. Симптомы были обнаружены у одного животного в день 34, т.е. через 6 дней после последней обработки.
Использованы те же обозначения, которые указаны в описании таблицы 1.
Результаты ЭАУ-теста (используемого в качестве примера метода анализа) свидетельствуют о том, что развитие заболевания можно предотвращать при лечении с использованием комбинации соединений I и IIa в течение 4 недель после иммунизации.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2493840C2 |
| ЛЕЧЕНИЕ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2424795C2 |
| КОМПОЗИЦИИ НА ОСНОВЕ СОЕДИНЕНИЙ 2-АМИНО-1,3-ПРОПАНДИОЛА | 2010 |
|
RU2468793C2 |
| НОВОЕ ПРИМЕНЕНИЕ 1,3-ПРОПАНДИОЛЬНЫХ ПРОИЗВОДНЫХ | 1997 |
|
RU2217136C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2827865C2 |
| КОМПОЗИЦИИ НА ОСНОВЕ СОЕДИНЕНИЙ 2-АМИНО-1,3-ПРОПАНДИОЛА | 2005 |
|
RU2402324C2 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ АГОНИСТ РЕЦЕПТОРА S1P И ИНГИБИТОР КИНАЗЫ JAK3 | 2005 |
|
RU2415678C2 |
| ПРИМЕНЕНИЕ АГОНИСТА РЕЦЕПТОРА S1P И СПОСОБ ЛЕЧЕНИЯ, ОБЛЕГЧЕНИЯ ИЛИ ЗАДЕРЖКИ ПРОГРЕССИРОВАНИЯ НЕВРИТА ЗРИТЕЛЬНОГО НЕРВА ИЛИ ДЕМИЕЛИНИЗАЦИОННЫХ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2391094C2 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2003 |
|
RU2478378C2 |
| КУРС ЛЕЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ АГОНИСТА РЕЦЕПТОРА S1P | 2005 |
|
RU2478384C2 |

Изобретение относится к области фармакологии и касается фармацевтической композиции, обладающей противовоспалительной активностью и содержащей соединение формулы I и соединение формулы IIa, фармацевтического набора, применения соединения формулы I в сочетании с соединением формулы IIa в качестве фармацевтического средства, применения комбинации указанных соединений формулы I и IIa для приготовления лекарственного средства и способа повышения противовоспалительной активности указанных соединений. 5 н.п. ф-лы, 2 табл., 2 ил.


и соединение формулы
с одним или несколькими фармацевтически приемлемым(и) эксципиентом(ами).
| УСТРОЙСТВО ДЛЯ АЭРАЦИИ ВОДЫ В РЫБОВОДНЫХ ВОДОЕМАХ | 1972 |
|
SU427680A1 |
| Магнитоэлектрический униполярный измерительный механизм | 1975 |
|
SU627406A1 |
| ИМИДАЗОЛИДИЛЬНЫЙ МАКРОЛИД, ИЛИ ЕГО ИЗОМЕРЫ, ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ИММУНОДЕПРЕССИВНОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2108338C1 |
Авторы
Даты
2008-04-10—Публикация
2002-10-22—Подача