Область техники
Изобретение относится к фармацевтике, а именно к созданию средств доставки лекарственных субстанций - носителей фармацевтических препаратов. Более конкретно оно относится к созданию носителей гидрофобных лекарственных и диагностических веществ,
Уровень техники
Доставка лекарственных субстанций и повышение их биодоступности является актуальной проблемой медицинской химии.
Биодоступность - это часть принятой дозы препарата, которая достигла системного кровотока в неизменном виде и в виде метаболитов, образовавшихся в результате так называемого пресистемного метаболизма или "эффекта первичного прохождения". Биодоступность - один из параметров фармакокинетики лекарственной субстанции. Многие биологически активные вещества являются плохо растворимыми, из-за чего возникают проблемы, связанные с их биодоступностью.
Для большинства перорально доставляемых, плохо растворимых в воде соединений скорость абсорбции лимитируется растворением. Скорость растворения гидрофобного лекарства зависит от площади эффективной внешней поверхности, внешней поверхности кристалла и внутреннего энергетического состояния кристаллов - лекарства.
Для увеличения площади эффективной внешней поверхности лекарственной субстанции могут использоваться пористые носители. Их растворимость в воде изменяется от абсолютно гидрофильных носителей, которые мгновенно диспергируются или растворяются в воде до абсолютно гидрофобных носителей, которые плавают в воде часами. Благодаря широкому диапазону полезных свойств, пористые носители используются в фармацевтике для различных целей, включая разработку новых систем доставки лекарств, улучшение растворимости плохо растворимых лекарств и в иммобилизации ферментов. Примерами используемых в фармацевтике пористых носителей могут служить пористый диоксид кремния (Sylysia), твердые полипропиленовые пены (Accurel), пористые силикаты кальция (Florite), алюмосиликаты кальция (Neusilin) и пористая керамика.
Одним из конкретных примеров такого носителя может служить Florite RE (FLR) - пористый силикат кальция. Этот носитель был использован для приготовления нового лекарственного препарата с мелоксикамом, способного конкурировать с современными его аналогами.
Скорость растворения лекарства с поверхности микрочастиц оказалась значительно выше скорости растворения чистого вещества, и скорость растворения увеличивается с увеличением процента содержания носителя.
Также иногда используют размалывание и измельчение твердого материала до частиц нанодиапазона, однако этот процесс очень энергоемок и требует специального оборудования (коллоидные мельницы и т.п.,), кроме того, полученные наночастицы после размалывания агрегируют из-за большой поверхностной энергии.
Различные методики, такие как распылительная сушка, процессы с жидкостями в суперкритическом состоянии и многие полимерные носители, такие как поливинилпиролидон, полиэтиленгликоль также были опробованы для загрузки плохорастворимых лекарств в нано- или микрокристаллическое состояние для улучшения растворимости и биодоступности.
Один из способов увеличения биодоступности гидрофобных веществ - это их солюбилизация, путем приготовления наносуспензий (нанодисперсий). Нанодисперсии - или наносуспензии могут содержать различные наночастицы: нанокристаллы, липосомы, ниосомы, мицеллы, нанодиски, кохлеаты и др.
В качестве наночастиц, используемых для увеличения биодоступности гидрофобных веществ, используются липосомы и ниосомы. Липосомы состоят из природных фосфолипидов и уже широко применяются в косметике и медицине. Ниосомы - аналогичная система, в которой вместо фосфолипидов используются неионные поверхностно-активные вещества. Ниосомы исследовали в качестве средства доставки лекарств через многие пути введения: внутримышечно, внутривенно, подкожно, через глаза и через кожу. Ниосомы являются мультиламелярными структурами, подходят для гидрофобных и амфифильных лекарств. Относительно нерастворимые соединения, такие как химиотерапевтические агенты, обычно загружаемые в липосомы, могут быть доставлены в ниосомах. К примеру, последние исследования показывают сопоставимую эффективность между доксорубицином, включенным в ниосомы, и доксорубицином в растворе при удвоенной дозе. Также загруженный в ниосомы гидрохлорид цитарабина показывает значительную задержку высвобождения по сравнению с лекарством в растворе.
Однако процесс приготовления липосом и подобных им наночастиц сопряжен с большими затратами времени и энергии на упаривание растворителей, разрушение крупных частиц ультразвуком, продавливание и т.д.
Сущность изобретения
Задачей настоящего изобретения является создание нового вида носителя лекарственных и диагностических средств, который обеспечивал бы высокую биодоступность гидрофобных лекарственных средств, не требовал бы для своего изготовления высоких материальных и энергетических затрат.
Авторами настоящего изобретения неожиданно было обнаружено, что таким носителем может быть экстракт бересты - верхней (белой) части коры березы в форме водной нанодисперсии.
Другим, несомненным преимуществом данного носителя является то, что он сам по себе является композицией биологически активных тритерпеновых соединений, что выгодно отличает его от всех известных видов носителей, являющихся биологически инертными.
Раскрытие изобретения
Объективными предпосылками к установлению возможности использования водной нанодисперсии экстракта бересты в качестве носителя лекарственных и диагностических средств явились по меньшей мере 4 установленные авторами особенности этого средства:
1. Возможность и в то же время простота превращения экстракта бересты в водную нанодисперсию.
2. Способность данной нанодисперсии нести в себе большое количество лекарственного средства.
Процент включения лекарственного средства в опытах составил (но не был предельным) 15,5% от массы экстракта. Для сравнения, в липосомы гидрофобных веществ включается не более 10-15% от массы биослоя, который в свою очередь составляет (для липосом диаметром 200 нм) не более 12%, то есть процент включения не превышает 1,8% от массы липосом.
3. Обнаруженная мембранотропность экстракта бересты, то есть сродство его к биологическим мембранам.
4. Установленная стабильность нанодисперсии экстракта бересты. Все исследования проводились авторами настоящего изобретения с экстрактом бересты марки БЭС («Бересты экстракт сухой»), производимым ООО «Березовый мир» и используемым для изготовления биологически активных пищевых добавок. Экстракт изготавливается способом по патенту РФ №2192879, принадлежащему ООО «Березовый мир».
БЭС представляет собой композицию тритерпеновых соединений, таких как: бетулин - свыше 65%, лупеол - до 15%, 3-О-кофеат бетулина - около 10%, бетулиновая кислота и другие сопутствующие вещества - остальное.
I. Получение нанодисперсии экстракта бересты
Пример 1.
В круглодонную колбу с 5 мг БЭС, в 1 мл тетрагидрофурана (5 мг/мл) при сильном перемешивании добавляли пипеткой 25 мл дистиллированной воды. Полученную дисперсию перемешивали еще в течение 5 минут. Растворитель упаривали на роторном испарителе при температуре не выше 40°С. Затем нанодисперсию обрабатывали на ультразвуковой бане и концентрировали на роторном испарителе до 1-1.5 мг/мл. Спектротурбодиметрией оценили средний размер полученных наночастиц, который составил 187 нм. Одну из электронных микрофотографий образца можно видеть на фиг.1. Кроме сферических наночастиц частиц другой формы не наблюдалось.
На основе микрофотографий построена гистограмма (фиг.2), из которой видно, что в нанодисперсии присутствуют частицы от 20 до 200 нм, в наибольшем же количестве частицы размером от 90 до 110 нм.
Пример 2.
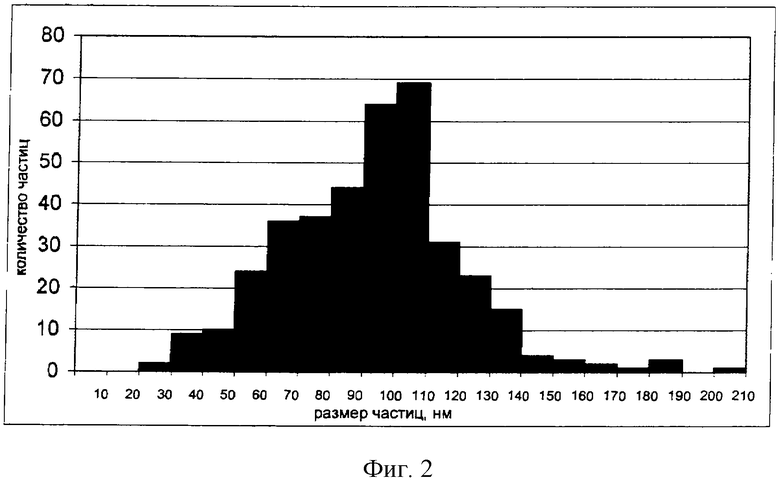
По методике, представленной в примере 1, была приготовлена нанодисперсия содержащегося в БЭС 3-О-кофеата бетулина. На электронной микрофотографии (фиг.3) видны сферические частицы, неотличимые от наночастиц, получаемых из композиции по примеру 1. Это дает основания полагать, что сферическая форма наночастиц обусловлена именно присутствием в экстракте 3-О-кофеата бетулина, поскольку при попытках получить нанодисперсии из бетулина и лупеола, также содержащихся в эстракте, образовывались грубые дисперсии, состоящие из структур, которые проще всего характеризуются как «нанодоски», «наноканаты» и т.п., но сферические частицы обнаружены не были.
II. Определение способности нанодисперсии БЭС к включению лекарственных средств.
В качестве лекарственного средства был взят рифампицин (далее Риф) - вещество, обладающее противотуберкулезной активностью. Выбор именно его был обусловлен в первую очередь тем, что он относится к гидрофобным веществам (коэффициент распределения приблизительно равен 20), и, во-вторых, экстракт бересты сам по себе обладает противотуберкулезной активностью и объединение его с Риф позволяет получить препарат для комплексной терапии туберкулеза.
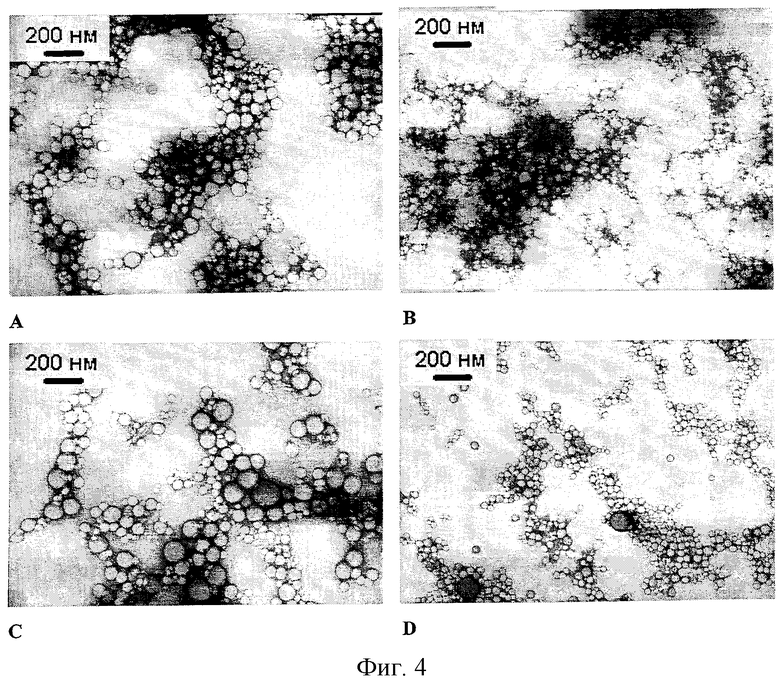
Пример 3. Приготовление наночастиц (НЧ) БЭС с Риф.
Приготавливали раствор Риф в тетрагидрофуране (ТГФ) концентрацией 1,333 мг/мл. К 5 мг БЭС добавляли следующие объемы раствора Риф и ТГФ:
При интенсивном перемешивании пипеткой впрыскивали 25 мл воды. Дисперсию перемешивали еще в течение 5 минут. Растворитель упаривали на роторном испарителе при температуре не выше 40°С. Полученную нанодисперсию обрабатывали на ультразвуковой бане и затем концентрировали на роторном испарителе до 3 мл.
На фиг.4 представлены микрофотографии полученных наночастиц.
Пример 4. Определение степени включения Риф в БЭС с помощью гель-фильтрации
На колонку со слоем сорбента Sephadex высотой 2 см наносили 200 мкл в 3 раза разбавленной дисперсии наночастиц БЭС, загруженных Риф (по примеру 3). Элюировали дистиллированной водой, собирали 8 фракций по 1 мл. Измеряли поглощение/рассеяние каждой фракции, строили профиль элюции.
Объединяли фракции с вышедшим Риф, измеряли их объем и оптическое поглощение в объединенной фракции. Объединяли фракции с вышедшими НЧ БЭС, измеряли их размеры.
Процент включившегося Риф от массы БЭС определяли по формуле:
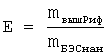 , где
, где
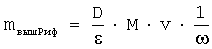
D - оптическая плотность;
ε - коэффициент молярного поглощения;
М - молярная масса Риф;
v - объем объединенных фракций с Риф;
ω - выход Риф с колонки;
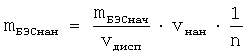 , где
, где
mБэснач - масса БЭС в начальном растворе;
vдисп - конечный объем упаренной дисперсии;
vнан - объем, нанесенный на колонку (200 мкл);
n - коэффициент разбавления.
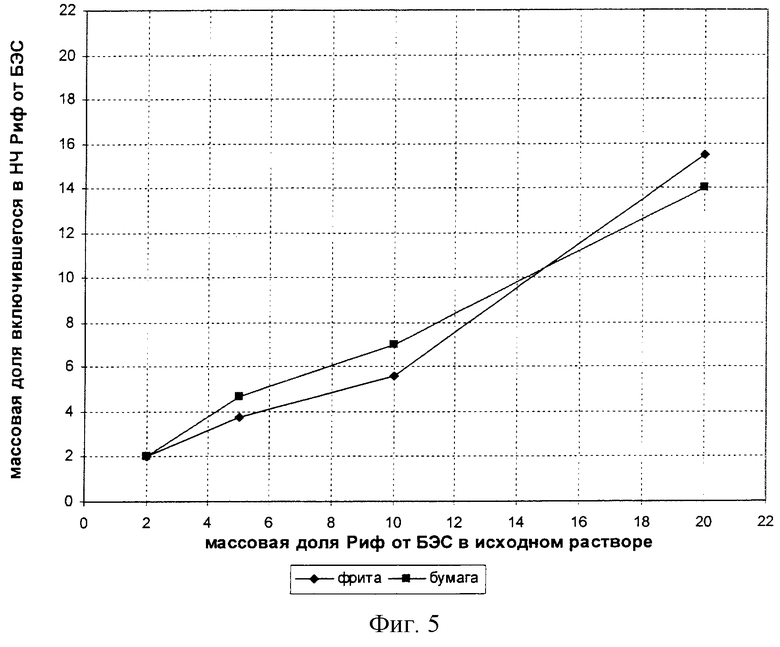
Для того чтобы определить максимальную эффективность включения Риф в НЧ БЭС, необходимо определить эффективность включения для серии образцов с возрастающей концентрацией Риф. Так как Риф может частично сорбироваться на сорбенте, предварительно измерили долю Риф, связывающегося с сорбентом, если загружать его раствор на эту колонку в концентрациях, близких к концентрациям, ожидаемым в дисперсии. Таким образом, определен выход Риф с колонки - 87%. Определена эффективность включения Риф в НЧ БЭС для дисперсий 20, 10, 5 и 2. Результаты исследования представлены в Таблице 1 и на фиг.5.
Как видно из полученных результатов (фиг.5), процент включения Риф в НЧ БЭС увеличивается с увеличением концентрации Риф в начальном растворе, а это значит, что максимальное включение еще не достигнуто. Тем не менее уже достигнутые значения (15,5% от общей массы БЭС) очень высокие. Для сравнения, как указано выше, в липосомы гидрофобных веществ включается не более 10-15% массы биослоя, который, в свою очередь, составляет 12% от общей массы (для липосом диаметром 200 нм).
Пример 4а.
Определение степени включения в БЭС противоопухолевого средства - доксорубицина.
Готовили раствор доксорубицина в ТГФ с концентрацией 3 мг/мл. К 5 мл БЭС добавляли следующие объемы гидрофобного вещества и ТГФ:
При интенсивном перемешивании пипеткой впрыскивали 25 мл воды. Дисперсию перемешивали еще 5 минут. Растворитель упаривали на роторном испарителе при температуре не выше 35-40°С. Полученную нанодисперсию обрабатывали на ультразвуковой бане и затем концентрировали на роторном испарителе до 9 мл.
Степень включения доксорубицина в наночастицы определяли следующим образом.
На колонку со слоем сорбента Sephadex G-75 высотой 2 см наносили 200 мкл дисперсии НЧ БЭС, загруженных РБ. Эллюировали дистиллированной водой, собирали 12 фракций по 0,5 мл. Измеряли оптическую плотность каждой фракции, строили профиль элюции. Объединяли фракции с вышедшим НЧ.
Эффективность включения гидрофобной субстанции определяли по формуле:
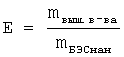 , где
, где
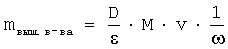
mвыш. в-ва - масса субстанции, вышедшей с колонки, с учетом выхода с колонки;
D - оптическая плотность;
ε - коэффициент молярного поглощения;
М - молярная масса субстанции;
v - объем объединенных фракций с гидрофобной субстанцией;
ω - выход гидрофобной субстанции с колонки;
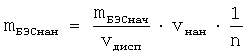 , где
, где
mБЭСнач - масса БЭС в начальном растворе;
vдисп - конечный объем упаренной дисперсии;
vнан - объем, нанесенный на колонку (200 мкл);
n - коэффициент разбавления.
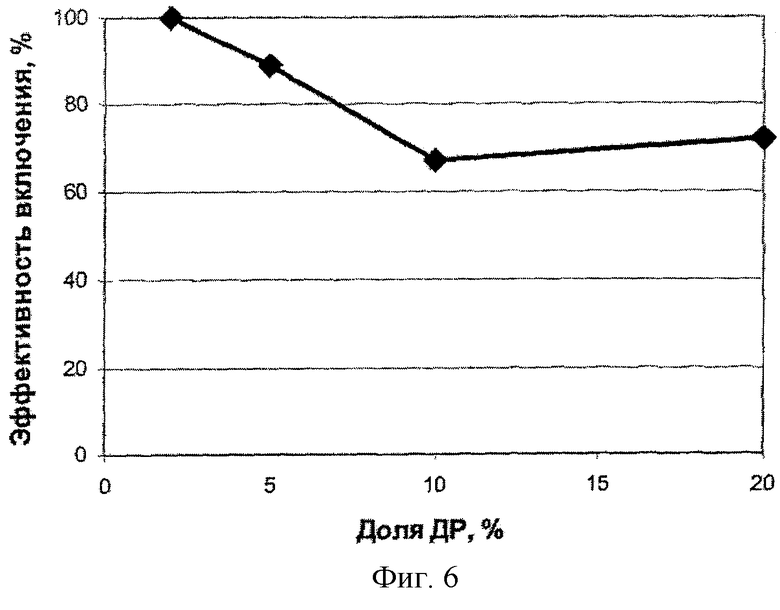
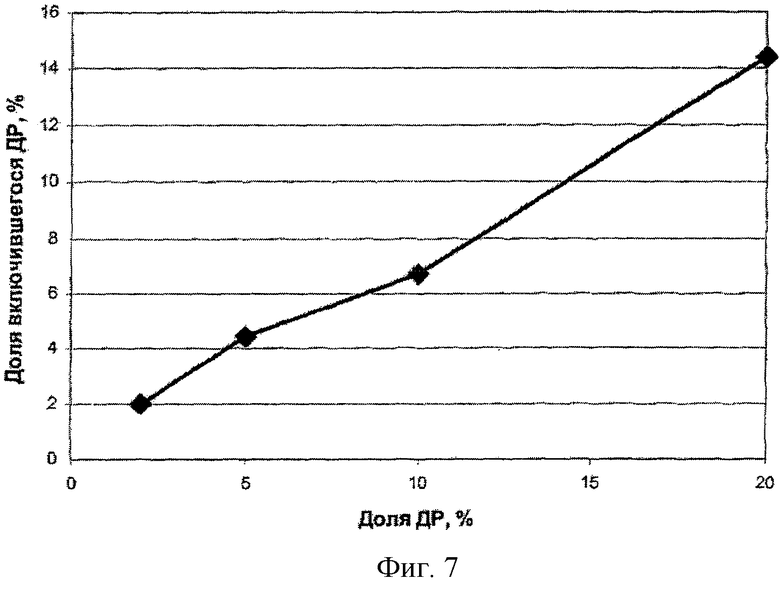
На фиг.6 представлена зависимость эффективности включения доксорубицина в наночастицы БЭС от доли субстанции в исходной смеси. Видно, что при массовой доле 2 и 5% практически вся субстанция оказывается в наночастицах.
Таким образом, для этих дисперсий не нужно отделять невключившийся доксорубицин от наночастиц, что существенно упрощает получение нанодисперсий.
Пример 4б.
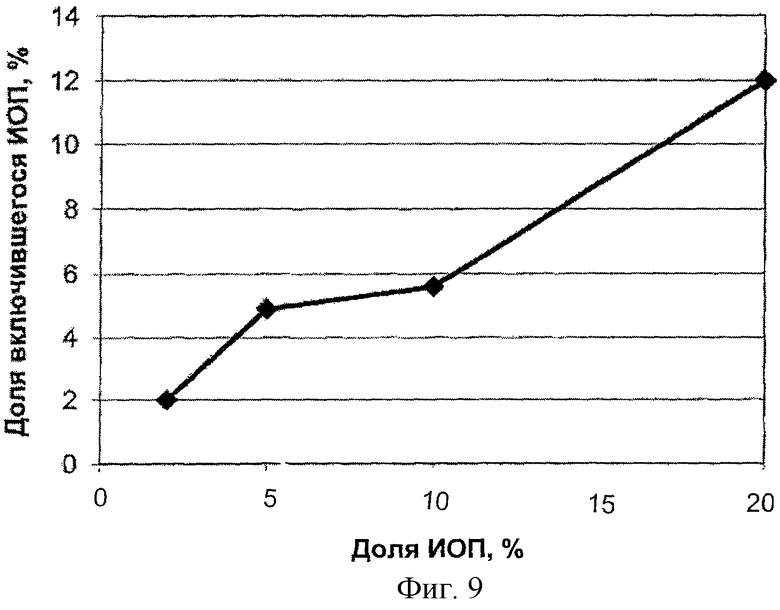
Аналогичная картина наблюдалась при загрузке наночастиц БЭС диагностическим рентгено-контрастным веществом иопогностом (рис.8, рис.9)
III. Исследование мембранотропности экстракта бересты
Целью исследования являлось определение сродства экстракта бересты (БЭС) к биологической мембране. Для этого был использован метод флуоресцентных зондов, широко используемый для анализа связывания с мембраной биологически активных веществ (БАВ). Известно, что связывание БАВ с мембраной, прохождение сквозь нее, а часто и изменение активности систем и ее структуры - важные этапы взаимодействия любого БАВ с клеткой. Флуоресцентные зонды позволяют обнаружить и охарактеризовать действие БАВ на мембрану, включая способность связываться с мембраной.
Пример 5
Был использован специфический незаряженный гидрофобный зонд МБА (3-метоксибензантрон) в исходной концентрации 2 мМ в диметилформамиде. Объектом исследования служили интактные микросомы печени крыс, микросомы, выделенные из печени крыс с хроническим гепатитом, вызванным длительным введением четыреххлористого углерода, и микросомы, выделенные из печени крыс после курсового введения БЭС в дозе 5 и 50 мг/кг на фоне токсического гепатита. Все фракции микросом выделяли из печени по методу дифференциального центрифугирования. Концентрация белка микросом в пробе при исследовании связывания МБА составляла 0,15 мг/мл 0,1 М фосфатного буфера рН 7,4. К микросомам приливали раствор МБА по 1 мкл так, что его концентрация возрастала от 1 до 10 мкМ. Для определения параметров связывания МБА с микросомами измеряли интенсивность флуоресценции при 530 нм (А.эм.), возбуждая ее при 450 нм (Авозб.). Исследования проводили на спектрофлуориметре Shimadzu-RF 540. Аналогичным образом титровали все исследуемые пробы, в опытах in vitro в пробу к микросомам добавляли раствор БЭС в ацетоне в концентрации 5 и 25 мкг/мл. В отдельной серии эксперимента в пробу к микросомам (0,15 мг/мл) приливали 6 н. 1' мкМ раствора МБА и титровали по 5 мкл раствора БЭС в концентрации 1 мг/мл. Определяли флуоресценцию при 530 нм при длине возбуждения 450 нм.
Результаты исследования.
Зонд МБА является липофильным зондом и, попадая в водную среду, не флуоресцирует. Его флуоресценция возрастает при проникновении в мембрану, являющуюся липопротеидным комплексом.
При взаимодействии флуоресцентного зонда с мембраной происходит связывание с определенными участками. Так, специфичность гидрофобного зонда МБА определяется тем, что он проникает в глубокие слои липопротеидной мембраны, а именно в область полярных головок и глицериновых остатков фосфолипидов. Вследствие этого, при изменении полярности окружения зонда, изменении заряда, микровязкости в области расположения зонда могут меняться показатели его взаимодействия с биологической мембраной, а именно - константа диссоциации (Кдисс.), константа связывания (Ксв.), количество мест связывания (if), отношение связанного зонда к свободному (%).
В опытах in vitro изучали параметры связывания зонда МБА с интактной мембраной микросом и влияние на них БЭС в концентрации 5 и 25 мкг/мл. Полученные результаты представлены в таблице 2. Из полученных результатов видно, что БЭС влияет на характеристики связывания зонда. При этом кажущиеся константы связывания (Ксв.) для интактной микросомальной мембраны, рассчитанные по Э.Корниш-Боудену составляли 0,83 и 0,33 мкМ, что свидетельствует о двух центрах связывания зонда с мембраной. При этом максимальная флуоресценция для центра связывания с Ксв.=0,83 мкМ в 1,5 раза меньше, чем максимальная флуоресценция второго центра с Ксв.=0,33 мкМ. В присутствии 5 мкг/мл БЭС Ксв. первого центра связывания снижается до 0,57 мкМ, Fmax возрастает в 1,2 раза. В присутствии 0,25 мкг/мл БЭС Ксв. также снижается до 0,38 мкМ и Fmax возрастает в 1,6 раза. Эти данные дают возможность утверждать, что БЭС, связываясь с мембраной, конкурирует за места связывания с МБА и изменяет прочность его связывания с фосфолипидной компонентой мембраны.
Это наблюдение также подтверждается результатами титрования микросом с встроенным зондом МБА (бмкМ) раствором БЭС в концентрации 1 мг/мл по 5 мкл. Было определено, что в диапазоне концентраций БЭС 5-45 мкг/мл интенсивность флюоресценции зонда при 530 нм не изменялась, а при увеличении концентрации от 45 до 115 мкг/мл флуоресценция возрастала на 20%. Это свидетельствует о повышении проницаемости мембраны для МБА и физико-химических изменениях в фосфолипидном слое микросом.
В другой серии эксперимента определяли параметры связывания МБА с микросомами, выделенными из печени крыс с хроническим гепатитом и после курсового введения БЭС в разных дозах. В таблице 3 представлены полученные результаты. Из данных таблицы 3 видно, что зонд МБА также имеет два центра связывания с мембраной как и интактная, однако константы связывания зонда различаются. Их величина свидетельствует о снижении прочности связи зонда с микросомальной мембраной при токсическом повреждении ее четыреххлористым углеродом. После введения БЭС в дозе 5 мг/кг наблюдается увеличение константы связывания МБА с 0.28 до 0,67 мкМ, то есть практически в 2,4 раза, в тоже время максимальная интенсивность флуоресценции снижается, что может быть вызвано изменением полярного окружения зонда. При введении крысам БЭС в дозе 50 мг/кг величины констант связывания не отличаются от контроля.
Эти результаты коррелируют с результатами определения активности мембраносвязанных ферментов - цитохрома Р-450 и глютатионтрансферазы, полученных на микросомах контрольных образцов печени с хроническим гепатитом и после курсового введения БЭС в разных дозах. Активность ферментов после введения животным БЭС в дозе 5 мг/кг существенно была выше, чем в дозе 50 мг/кг. Это свидетельствует о том, что БЭС в дозе 5 мг/кг, проникая в глубокие слои мембраны, изменяет ее полярность, что способствует активации ферментов детоксикации - цитохрома Р-450 и глютатионтрансферазы.
Таким образом, проведенные исследования свидетельствуют о мембранотропности экстракта бересты по отношению к микросомальной мембране.
Экстракт в опытах in vitro и in vivo является веществом конкурирующим за места связывания с зондом МБА, улучшающим его проницаемость, увеличивающим полярность глубоких слоев мембраны.
IV. Стабильность нанодисперсии БЭС
Проведенные исследования позволили установить, что нанодисперсии экстракта бересты не разрушаются на протяжении длительного времени, по крайней мере, в течение нескольких месяцев. Объясняется это тем, что температура плавления БЭС выше 100°С, то есть при комнатной температуре наночастицы находятся в твердом состоянии. Поэтому при соударении не может произойти их слияние. Из-за того, что все вещества, входящие в состав БЭС, гидрофобны, поверхность наночастиц в основном возможна агломерация (слипание) частиц. Но этот процесс обратим: при сильном встряхивании, при обработке ультразвуком образующиеся агрегаты распадаются на отдельные частицы.
При нагревании нанодисперсий до температуры 100°С вязкость наночастиц резко уменьшается, что приводит к увеличению скорости; диффузии, что в свою очередь приводит к кристаллизации содержащегося в экстракте бересты бетулина. Как правило, размер этих кристаллов существенно больше наносфер, из которых состоит нанодисперсия БЭС.
Промышленная применимость
Полученные данные о возможности включения в состав наночастиц дисперсии экстракта бересты до 15% и более гидрофобных лекарственных средств определяют возможность использования их как нового типа наночастиц (наряду с липосомами, наноэмульсиями, полимерными наносферами, твердыми липидными наночастицами и т.п.) в качестве носителя лекарственных веществ. При этом наночастицы на основе экстракта бересты выгодно отличаются от, например, липосом, величиной эффективности; включения лекарственных средств и биологической активностью (адаптогенной, антиоксидантной, иммуномодуляторной, противовирусной, противобактериальной и др.) самого носителя.
Параметры связывания флюоросцентного зонда МБА с интактными микросомами и влияние экстракта бересты на эти параметры in vitro
Определение параметров связывания флюоросцентного зонда МБА с микросомами печени крыс с хроническим CCl4 - гепатитом и после курсового введения экстракта бересты в разных дозах
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ И СПОСОБ ПОЛУЧЕНИЯ НАНОДИСПЕРСИИ ЕЕ | 2006 |
|
RU2322091C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДЪЮВАНТА ДЛЯ ВАКЦИН | 2014 |
|
RU2545717C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДЪЮВАНТА ДЛЯ ВИРУСНЫХ ВАКЦИН | 2014 |
|
RU2545714C1 |
| МЕТОД ОПРЕДЕЛЕНИЯ РАСПРЕДЕЛЕНИЯ ВЕЩЕСТВ В СФЕРИЧЕСКИХ АМОРФНЫХ НАНОЧАСТИЦАХ | 2009 |
|
RU2424513C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДНЫХ ДИСПЕРСИЙ СФЕРИЧЕСКИХ НАНОЧАСТИЦ ИЗ ТРИТЕРПЕНОИДОВ КОРЫ БЕРЕЗЫ | 2010 |
|
RU2454241C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДНЫХ ДИСПЕРСИЙ НАНОЧАСТИЦ ИЗ СМЕСИ ПРИРОДНЫХ ТРИТЕРПЕНОИДОВ | 2012 |
|
RU2494754C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2006 |
|
RU2324492C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОКОМПОЗИЦИИ НА ОСНОВЕ САХАРОВ | 2009 |
|
RU2410109C1 |
| Способ получения липосомальной формы бетулина, обладающей гепатопротекторной активностью | 2019 |
|
RU2740553C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОСУСПЕНЗИИ БЕТУЛИНА И/ИЛИ ЕГО ПРОИЗВОДНЫХ | 2008 |
|
RU2386446C1 |


Изобретение относится к фармацевтической промышленности, в частности к применению экстракта бересты в форме нанодисперсии в качестве носителя лекарственных и диагностических средств. Применение экстракта бересты в форме водной нанодисперсии в качестве носителя лекарственных и диагностических средств. Носитель лекарственных и диагностических средств, представляющий собой экстракт бересты в форме водной нанодисперсии. Вышеописанный носитель имеет большой процент включения лекарственных и диагностических средств и является биологически активным. 2 н.п. ф-лы, 3 табл., 9 ил.
| ТЕРАПЕВТИЧЕСКАЯ ИЛИ ДИАГНОСТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2114612C1 |
| Способ изготовления челноков для ткацких станков | 1948 |
|
SU74793A1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ДАРИФЕНАЦИН | 1996 |
|
RU2163803C2 |
| US 5648095, 15.07.1997. | |||
Авторы
Даты
2008-04-27—Публикация
2006-11-16—Подача