Область техники, к которой относится изобретение
Изобретение относится к новым водорастворимым анионсодержащим производным бактериохлорофилла, к их получению и к их применению в способах фотодинамической терапии in vivo и диагностики опухолей и различных сосудистых заболеваний, таких как связанная с возрастом дегенерация желтого пятна, а также к способам киллинга in vivo и ex vivo вирусов и микроорганизмов.
Определения и аббревиатуры
AMD: связанная с возрастом дегенерация желтого пятна;
Bchl: бактериохлорофилл а - пентациклический 7,8,17,18-тетрагидропорфирин с 5-м изоциклическим циклом, центральным атомом Mg, фитильной или геранилгеранильной группой в положении 173, группой СООСН3 в положении 132, атомом Н в положении 132, метильными группами в положениях 2, 7, 12, 18, ацетильной группой в положении 3 и этильной группой в положении 8;
Bphe: бактериофеофитин а (Bchl, в котором центральный Mg заменен на два атома Н);
Bpheid: бактериофеофорбид а (свободная карбоновая кислота С-172, производная от Bphe);
Pd-Bpheid: Pd-бактериофеофорбид а;
PDT: фотодинамическая терапия;
Родобактериохлорин: тетрациклический 7,8,17,18-тетрагидропорфирин с группой -СН2СН2СООН в положении 17, -СООН в положении 13, метильными группами в положениях 2, 7, 12, 8 и этильными группами в положениях 3 и 8.
В описании используется номенклатура ИЮПАК для производных бактериохлорофилла. С использованием указанной номенклатуры природные бактериохлорофиллы имеют два положения для эфиров карбоновой кислоты - 132 и 172, однако, они этерифицируются в положениях 133 и 173.
Предпосылки изобретения
Фотодинамическая терапия (PDT) является нехирургическим лечением опухолей, при котором объединяют нетоксичные лекарственные средства и безопасное фотосенсибилизирующее излучение для получения цитотоксичных реакционноспособных кислородных соединений in situ. Такой метод является более избирательным, чем обычно применяемая противоопухолевая химиотерапия и радиотерапия. На сегодняшний день в клиниках в качестве фотосенсибилизаторов используют, главным образом, порфирины. Однако существующие сенсибилизаторы имеют ряд недостатков, ограничивающих их применение, в том числе, в основном, (1) относительно низкое поглощение в видимой области спектра, что ограничивает лечение поверхностных опухолей; (2) накопление и длительное удерживание сенсибилизатора в коже пациента, приводящее к длительной (от дней до месяцев) фототоксичности кожи; и (3) небольшое различие или даже его отсутствие между действием PDT на облученные опухоль и неопухолевые ткани. Недостатки имеющихся лекарственных средств стимулировали широкие исследования в отношении сенсибилизаторов второго поколения, поглощающих в длинноволновой области, которые показывают лучшее различие в удерживании их в опухолевых клетках и коже или других здоровых тканях.
Для того чтобы оптимизировать эффективность порфириновых лекарственных средств при лечении и диагностике, получили ряд производных порфирина, в которых, например, имеется центральный атом металла (иного чем Mg), образующий комплекс с четырьмя пиррольными циклами, и/или модифицированы периферические заместители пиррольного цикла, и/или макроцикл дигидрирован до производных хлорофилла (хлоринов) или тетрагидрирован до производных бактериохлорофилла (бактериохлоринов).
Из-за интенсивного поглощения в благоприятных областях спектра (650-850 нм) и быстрого распада после лечения, производные хлорофилла и бактериохлорофилла идентифицированы как отличные сенсибилизаторы для PDT опухолей и имеющие свойства, превосходящие свойства порфиринов, но они менее доступны, и с ними труднее работать.
Бактериохлорофиллы потенциально выгоднее при сравнении с хлорофиллами, поскольку они показывают интенсивные полосы вблизи инфракрасной области, т.е. при относительно больших длинах волн, чем производные хлорофилла.
Спектральные, фотофизические и фотохимические свойства природных бактериохлорофиллов делают их оптимальными светособирающими молекулами с явными преимуществами перед другими сенсибилизаторами, используемыми в настоящее время при PDT. В частности, такие молекулы имеют очень высокий коэффициент экстинкции при больших длинах волн (lmax=760-780 нм, e=(4-10)х104 М-1см-1), где свет глубоко проникает в ткани. Они также генерируют реакционноспособные кислородные соединения (ROS) с высоким квантовым выходом (в зависимости от центрального атома металла).
В нормальных условиях доставки, т.е. в присутствии кислорода при комнатной температуре и в нормальных условиях освещения, фрагменты BChl являются лабильными и иногда имеют более низкие квантовые выходы для образования триплетного состояния, по сравнению, например, с производным гематопорфирина (HPD). Однако их возможная инициация биологических окислительно-восстановительных реакций, благоприятные спектральные характеристики и их быстрый распад in vivo приводят к потенциальному превосходству бактериохлорофиллов над другими соединениями, например, порфиринами и хлорофиллами, для терапии PDT и диагностики и для киллинга клеток, вирусов и бактерий в образцах и живой ткани. Ожидается, что химическая модификация бактериохлорофиллов еще улучшит их свойства, но такая возможность весьма ограничена из-за отсутствия подходящих способов получения таких модифицированных бактериохлорофиллов.
Исследуется биологическое поглощение и эффективность при PDT производных Bchl, не содержащих металла, с целью управления аффинностью сенсибилизаторов к клеточному компартменту опухоли. Главным в таком подходе является применение высоколипофильных лекарственных средств, которые могут повысить накопление лекарственного средства в ткани в опухолевых клетках, но также усложняется его доставка. Кроме того, имеющиеся данные о биологическом распределении показывают значительные уровни фототоксичного лекарственного средства в неопухолевых тканях в течение длительных периодов времени (по меньшей мере дней) после введения лекарственного средства.
В предшествующем патенте Израиля № 102645 заявителя и соответствующих ЕР 0584552, US 5726169, US 5955585 и US 6147195 авторы предпринимали разный подход. Исследовались высокоэффективные сенсибилизаторы для сосудов, которые не экстравазируются из кровотока после введения и имеют короткий период существования в крови. Ожидалось, что естественное различие между сосудами здоровых и аномальных тканей, таких как опухоли или другие ткани, зависящие от новых сосудов, создаст возможность относительно селективного разрушения аномальной ткани. Поэтому было стремление к синтезу производных Bchl, которые являются более полярными и, следовательно, имеют лучшую возможность оставаться в сосудистом компартменте, где они проявляют основное фотодинамическое действие. С учетом этого, геранилгеранильный остаток в положении С-17 Bchl а (соединение 1, изображено в данном описании на схеме 1) заменяют остатками различных соединений, таких как аминокислоты, пептиды или белки, которые усиливают гидрофильность сенсибилизатора. Обнаружено, что конкретное производное Bchl-Ser (схема 1, соединение 1, где R представляет собой серил) является водорастворимым и высоко фототоксичным в клеточных культурах. После интраперитонеальной инъекции Bchl-Ser удаляется из крови и тканей мыши биэкспоненциально за относительно короткое время (t1/2 ~2 и 16 часов, соответственно). Выведение из кровотока даже более быстрое после внутривенной инъекции. По выбранному протоколу обработки (применение освещения в пределах минут после инъекции лекарственного средства) фототоксичность преимущественно придается сосудистой сети опухоли (Rosenbach-Belkin et al., 1996; Zilberstein et al., 2001 and 1997). Однако, к несчастью, подобно нативному Bchl, производное Bchl-Ser претерпевает быстрое фотоокисление, образуя соответствующий сложный эфир 2-десвинил-2-ацетилхлорофиллид и другие продукты.
Для того чтобы повысить устойчивость производных Bchl, позднее (публикация РСТ WO 00/33833 и US 6569846) проводили замену центрального атома Mg на Pd. Ранее показано, что такой тяжелый атом заметно повышает окислительный потенциал макроцикла Bchl и в то же время существенно усиливает скорость внутрисистемного перехода (ISC) молекулы в ее триплетное состояние. Замену металла осуществляли прямым введением иона Pd2+ в молекулу Bpheid, как описано в WO 00/33833. На основании биораспределения пигмента и фармакокинетики предполагается, что производное Pd-Bpheid остается в кровотоке очень небольшое время, по существу, без экстравазации в другие ткани, и поэтому является хорошим кандидатом для PDT, имеющей целью сосуды, что позволяет избежать фототоксичного действия на кожу. Лечебное действие на кровеносные сосуды показано витальной микроскопией обработанных кровеносных сосудов и окрашиванием синим Эванса. С использованием протокола лечения с минимальным интервалом лекарственное средство - освещение на животных моделях мышей, крыс и других обнаружено, что Pd-Bpheid (также называемый Tookad) является эффективным при уничтожении различных опухолей, и в настоящее время его вводят в фазу I/II клинических испытаний на больных раком предстательной железы, которым не помогла лучевая терапия (Chen et al., 2002; Schreiber et al., 2002; Koudinova et al., 2003).
Из-за низкой растворимости в водных растворах клиническое применение Pd- Bpheid требует использования солюбилизаторов, таких как кремофор, который в высоких дозах может вызывать побочное действие. Весьма желательно придание Pd- Bpheid водорастворимости при сохранении его физико-химических свойств. С другой стороны, было бы желательно получить производные Bpheid, которые являются цитотоксичными и в то же время более водорастворимыми, чем сам Pd- Bpheid. Ожидается, что такая растворимость в воде также повысит удерживание лекарственного средства в кровотоке и, посредством этого, вышеуказанную селективность. Кроме того, при отсутствии необходимости использовать носители, такие как детергенты или липосомы, можно предотвратить побочное действие.
Краткое изложение сущности изобретения
Настоящее изобретение относится к производному бактериохлорофилла, содержащему по меньшей мере одну, предпочтительно, две или три отрицательно заряженные группы и/или кислотные группы, которые превращаются в отрицательно заряженные группы при физиологическом рН, за исключением пентациклических производных бактериохлорофилла, содержащих свободную группу СН2СН2СООН или СН2СН2СОО- в положении 17, и тетрациклических производных бактериохлорофилла, лишенных центрального атома металла и содержащих группу -СН2СН2СООН в положении 17, группу -СН2СООН или -СООН в положении 15, группу -СООН в положении 13, метильные группы в положениях 2, 7, 12, 18 и этильные группы в положениях 3 и 8.
Отрицательно заряженные группы по изобретению включают, но не ограничиваются перечисленным, карбоксилатную (СОО-), тиокарбоксилатную (COS-), сульфонатную (SO3 -) и фосфонатную (РО3 2-) группы и кислотные группы, из которых при физиологическом рН образуются указанные заряженные группы, которыми являются карбоксильная (СООН), тиокарбоксильная (COSH), сульфоновая (SO3H) и фосфоновая (РО3Н2) кислотные группы, соответственно.
В одном воплощении производное бактериохлорофилла имеет формулу I или II
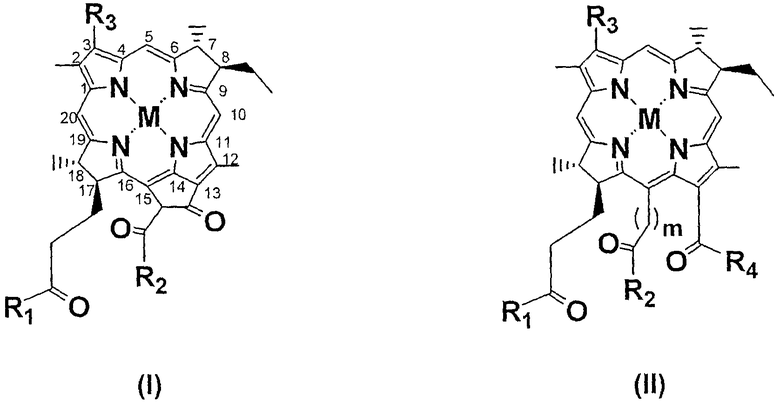
где М представляет 2Н или атом металла, выбранный из группы, состоящей из двухвалентных Pd, Pt, Co, Sn, Ni, Cu, Zn и Mn и трехвалентных Fe, Mn и Cr;
R1, R2 и R4, каждый независимо, представляет собой Y-R5;
Y представляет собой О, S или NR5R6;
R3 выбирают из группы, состоящей из -СН=СН2, -С(=О)-СН3, -С(=О)-Н, -СН=NR7, -С(CH3)=NR7, -CH2-OR7, -CH2-SR7, -CH2-NR7R'7, -CH(CH3)-OR7, -CH(CH3)-SR7, -CH(CH3)-NR7R'7, -CH(CH3)Hal, -CH2-Hal, -CH2-R7, -CH=CR7R'7, -C(CH3)=CR7R'7, -CH=CR7Hal, -C(CH3)=CR7Hal и -C≡CR7;
R5, R6, R7 и R'7, каждый независимо, представляет собой Н или выбран из группы, состоящей из
(а) углеводородного радикала С1-С25, необязательно содержащего один или несколько гетероатомов, карбоциклические или гетероциклические группы, и/или необязательно замещенного одной или несколькими функциональными группами, выбранными из группы, состоящей из галогена, оксо, ОН, SH, СНО, NH2, CONH2, отрицательно заряженной группы и кислотной группы, которая превращается в отрицательно заряженную группу при физиологическом рН;
(b) остатка аминокислоты, пептида или белка и
(с) когда Y представляет собой O или S, R5 также может представлять собой R8 +;
m равен 0 или 1 и
R8 + представляет собой Н+ или катион;
при условии, что
(i) по меньшей мере один, предпочтительно, два, из R5, R6, R7 и R'7 представляют собой углеводородную цепь по определению, данному выше в (а), замещенную отрицательно заряженной группой или кислотной группой, которая превращается в отрицательно заряженную группу при физиологическом рН; или
(ii) по меньшей мере один, предпочтительно, два, из R1, R2 и R4 представляют собой ОН, SH, O-R8 + или S-R8 +;
(iii) по меньшей мере один из R1, R2 и R4 представляет собой ОН, SH, O-R8 + или S-R8 +, и по меньшей мере один из R5, R6, R7 и R'7 представляет собой углеводородную цепь, замещенную отрицательно заряженной группой или кислотной группой, которая превращается в отрицательно заряженную группу при физиологическом рН; или
(iv) по меньшей мере один из R1, R2 и R4 представляет собой ОН, SH, O-R8 + или S-R8 +, и по меньшей мере один из R5, R6, R7 и R'7 представляет собой остаток аминокислоты, пептида или белка; или
(v) по меньшей мере один из R5, R6, R7 и R'7 представляет собой углеводородную цепь, замещенную отрицательно заряженной группой или кислотной группой, которая превращается в отрицательно заряженную группу при физиологическом рН, и по меньшей мере один из R5, R6, R7 и R'7 представляет собой остаток аминокислоты, пептида или белка;
за исключением соединений формулы I, где М имеет указанные значения, R3 представляет собой -С(=О)СН3, R1 представляет собой ОН или OR8 +, и R2 представляет собой -ОСН3, и соединений формулы II, где М представляет собой 2Н, R3 представляет собой -С(=О)СН3, R1, R2 и R4 представляют собой ОН, и m равен 0 или 1.
Изобретение также относится к фармацевтическим композициям, содержащим производное бактериохлорофилла, указанное выше, для фотодинамической терапии (PDT), в частности, для PDT, имеющей целью сосуды, например, для PDT опухолей или связанной с возрастом дегенерации желтого пятна (AMD), или для киллинга in vivo или in vitro клеток или инфекционных факторов, содержащих бактерии и вирусы, а также для целей диагностики.
Изобретение относится к способу фотодинамической терапии с использованием фотосенсибилизатора, где усовершенствование состоит в том, что указанный фотосенсибилизатор представляет собой производное бактериохлорофилла по изобретению. Согласно данному аспекту, изобретение относится к способу лечения методом PDT, включающему введение нуждающемуся в этом индивидууму эффективного количества производного бактериохлорофилла по изобретению с последующим локальным облучением.
Изобретение также относится к способу диагностики опухолей с использованием фотосенсибилизатора, где усовершенствование состоит в том, что указанный фотосенсибилизатор представляет собой производное бактериохлорофилла по изобретению. Согласно данному аспекту, изобретение относится к способу диагностики опухолей, включающему введение индивидууму с подозрением на опухоль эффективного количества производного бактериохлорофилла по изобретению с последующим локальным облучением и измерением флуоресценции в подозрительном участке, где более интенсивная флуоресценция указывает на локализации опухоли.
Изобретение также относится к способу киллинга клеток или инфекционных факторов, содержащих бактерии и вирусы, с использованием фотосенсибилизатора - усовершенствования, где указанный фотосенсибилизатор представляет собой производное бактериохлорофилла по изобретению. Согласно данному аспекту, изобретение относится к способу стерилизации биологических продуктов, например, крови, включающему добавление к указанному биологическому продукту, например, крови, эффективного количества производного бактериохлорофилла по изобретению с последующим локальным облучением.
Краткое описание чертежей
Различные соединения изобретения в последующем описании приводятся под номерами, начерченными жирным шрифтом и подчеркнутыми. Их полная идентификация дается в описании далее в "Списке соединений" в начале "Химического раздела".
Фиг.1А-1В представляют собой графики, показывающие фототоксичность сульфированного соединения 8 на мышиных эндотелиальных клетках H5V (фиг.1А) и клетках меланомы мыши M2R (фиг.1В). Клетки инкубируют с возрастающими концентрациями 8 в течение 4 часов, промывают и освещают (незатемненные значки) или держат в темноте (темновой контроль, затемненные значки). Точки являются средними значениями трехкратных повторов ± STD (стандартное отклонение).
Фиг.2А-2В представляют собой графики, показывающие фототоксичность сульфированного соединения 4 на мышиных эндотелиальных клетках H5V (фиг.2А) и клетках меланомы мыши M2R (фиг.2В). Клетки инкубируют с возрастающими концентрациями соединения 4 в течение 4 часов, промывают и освещают (незатемненные значки) или держат в темноте (темновой контроль, затемненные значки). Точки являются средними значениями трехкратных повторов ± STD.
Фиг.3 представляет собой график, показывающий фототоксичность сульфированного соединения 5 на клетках меланомы мыши M2R. Клетки инкубируют с возрастающими концентрациями соединения 5 в течение 4 часов, промывают и освещают (кружочки) или держат в темноте (темновой контроль, ромбы). Точки являются средними значениями трехкратных повторов.
Фиг.4 представляет собой график, показывающий фототоксичность сульфированного соединения 11 на клетках меланомы мыши M2R. Клетки инкубируют с возрастающими концентрациями соединения 11 в течение 4 часов, промывают и освещают (кружочки) или держат в темноте (темновой контроль, ромбы). Точки являются средними значениями трехкратных повторов.
Фиг.5 представляет собой график, показывающий фармакокинетику соединения 4 в крови голых мышей CD1. После инъекции соединения 4 (6 мг/кг) у той же мыши берут образец крови в указанные моменты времени, и определяют Pd. Каждую временную точку представляет среднее для трех мышей ± STD.
Фиг.6 показывает биораспределение соединения 4 в организме голых мышей CD1. Мышей умерщвляют в определенные моменты времени после инъекции соединения 4 (6 мг/кг), и определяют Pd для указанных органов. Каждую временную точку представляет среднее для трех мышей ± STD.
Фиг.7 показывает PDT ксенотрансплантатов меланомы с соединением 4 . Мышам с ксенотрансплантатами меланомы инъецируют внутривенно соединение 4 (6 мг.кг-1) и освещают в течение 5 минут светом интенсивностью 30 Дж/см2 (n=14, затемненные квадраты), 39 Дж/см2 (n=8, затемненные ромбы) или 45 Дж/см2 (n=10, затемненные треугольники). Мышей, которым инъецировали 9 мг.кг-1 соединения 4 , освещают в течение 5 минут светом интенсивностью 30 Дж/см2 (n=10, затемненные кружочки). Контрольные группы: необработанная (n=4, светлые квадраты), темновой контроль получает 6 мг.кг-1 (n=4, светлые кружочки) или 9 мг.кг-1 (n=5, светлые треугольники) соединения 4 , и световой контроль (n=6, светлые ромбы, 45 Дж/см2.
Фиг.8а-8h представляют собой фотографии, показывающие селективное действие PDT на мышей с ксенотрансплантатами глиомы С6 крысы и обработанных соединением 4 . (a-d) животное, обработанное PDT; (e-h) необработанное животное. (а) до обработки; (b) 3 часа после PDT и инъекции синего Эдванса; (с) полнослойный кожный лоскут обработанного участка, 24 часа после PDT; (d) аксиальный срез обработанной опухоли, 24 после PDT; (е) до инъекции ЕВ; (f) 3 часа после инъекции ЕВ; (g) полнослойный кожный лоскут, 24 часа после инъекции ЕВ; (h) аксиальный срез необработанной опухоли, 24 после инъекции ЕВ. Т - опухоль; S - кожа; М - мышца; Е - отек.
Фиг.9А-9D показывают полутонкие срезы центра повреждения и ТЕМ через 2 часа после окклюзивной PDT на модели кроличьего глаза с соединением 4 (интенсивность светового потока 50 Дж/см2, доза 5 мг/кг и DLI 1 минута). Наблюдают стаз и дилатацию хориоидальных сосудов с относительно хорошо сохранившимися клетками RPE и сетчаткой (9А и 9В). ТЕМ показывает гемолиз красных кровяных клеток в хориокапиллярном просвете (светлые стрелки на 9D) и разрушенные моноциты (стрелка с наконечником). Оболочка Бруха (Bm) интактная, содержащая хорошо идентифицируемые эпителиальные клетки сетчаточного пигмента (RPE). Некоторые хориокапиллярные эндотелиальные клетки заметно изменились, демонстрируя конденсированный хроматин (белая звездочка на 9С). Аббревиатуры: ONL - наружный содержащий ядра слой, ROS - наружные сегменты палочек, СС - хориокапилляры, е - хориокапиллярные эндотелиальные клетки.
Подробное описание изобретения
Настоящее изобретение, в широком аспекте, относится к производным бактериохлорофилла, содержащим по меньшей мере одну, предпочтительно, две или три отрицательно заряженные группы и/или кислотные группы, которые превращаются в отрицательно заряженные группы при физиологическом рН, за исключением производных бактериохлорофилла, содержащих свободную группу -СН2СН2СООН или -СН2СН2СОО- в положении 17, и тетрациклических производных бактериохлорофилла, лишенных центрального атома металла и содержащих группу -СН2СН2СООН в положении 17, группу -СН2СООН или -СООН в положении 15, группу -СООН в положении 13, метильную группу в каждом из положений 2, 7, 12, 18 и этильную группу в каждом положении 3 и 8.
Производные бактериохлорофилла могут быть получены из природного или синтетического производного бактериохлорофилла, включая соединения, в которых центральный атом Mg удален или заменен атомами других металлов, таких как двухвалентные Pd, Pt, Co, Sn, Ni, Cu, Zn и Mn и трехвалентные Fe, Mn и Cr. В предпочтительных воплощениях атом металла отсутствует, или он представляет собой атом Pd, Cu, Zn или Mn. В наиболее предпочтительных воплощениях центральный атом металла представляет собой атом Pd.
В одном предпочтительном воплощении настоящее изобретение относится к производному бактериохлорофилла формулы I или II, приведенных в данном описании выше.
Согласно изобретению, термин "углеводородный радикал", как определение R5, R6, R7 и R'7, обозначает любые линейные или разветвленные, насыщенные или ненасыщенные, ациклические или циклические, включая ароматические, углеводородные радикалы с 1-25 атомами углерода, предпочтительно - с 1-20, предпочтительнее - с 1-6, наиболее предпочтительно - с 2-3 атомами углерода. Углеводородный радикал может представлять собой алкильный радикал, предпочтительно, с 1-4 атомами углерода, например, метил, этил, пропил, бутил или алкенил, алкинил, циклоалкил, арил, такой как фенил, или аралкильную группу, такую как бензил, или в положении 17 он представляет собой радикал, образованный от природных соединений Chl или Bchl, например, геранилгеранил (2,6-диметил-2,6-октадиенил) или фитил (2,6,10,14-тетраметилгексадец-14-ен-16-ил).
Углеводородная цепь R5, R6, R7 и/или R'7, необязательно, может содержать один или несколько гетероатомов, таких как O, S и/или NH, и/или один или несколько карбоциклических циклов, например, фенил, или гетероциклический цикл, например, пиридил. В одном воплощении углеводородная цепь содержит один или несколько атомов О и имеет ОН-концевую группу, когда представлена остатком олигооксиэтиленгликоля с 4-10 атомами углерода, предпочтительно, пентаоксиэтиленгликоля.
R5, R6, R7 и/или R'7 также могут представлять собой углеводородные радикалы, замещенные одной или несколькими функциональными группами, такими как Cl, CHO, OH, SH, NH2, CONH2, COOH, COSH, SO3H, PO3H2, или отрицательно заряженной группой, такой как СОО-, COS-, SO3 - или РО3 2-. В одном предпочтительном воплощении функциональная группа COOH, COSH, SO3H, PO3H2, СОО-, COS-, SO3 - или РО3 2- представляет собой концевую функциональную группу. В наиболее предпочтительных воплощениях углеводородный радикал содержит 2 или 3 атома углерода и концевую группу, выбранную из числа СОО-, РО3 2- или, наиболее предпочтительно, SO3 -.
В другом воплощении R5, R6, R7 или R'7 могут быть замещены несколькими группами ОН и, необязательно, NH2, и могут представлять собой остаток моносахарида, например, глюкозамина.
В другом воплощении R5, R6, R7 или R'7 могут представлять собой остаток аминокислоты, пептида или белка. В одном предпочтительном воплощении R5 в любом из возможных положений, но предпочтительно, в положении 173, представляет собой остаток аминокислоты, пептида или белка. Аминокислота, пептид или белок могут являться источником отрицательно заряженной группы, если они содержат свободную концевую карбоксильную группу и/или остаток аминокислоты, содержащей неконцевую свободную карбоксильную группу, например, аспарагиновой или глутаминовой кислоты.
В одном воплощении R5, R6, R7 или R'7 представляет собой остаток аминокислоты или пептида (олигопептида или полипептида), содержащих гидроксигруппу, таких как серин, треонин и тирозин или пептиды, содержащие их, или производного указанных аминокислоты или пептида, выбранных из числа сложных эфиров, такой как алкиловые, предпочтительно, метиловые, эфиры, и N-защищенных производных, где N-защитная группа представляет собой, например, трет-бутилокси, карбобензокси или тритил, и указанные гидроксилированные аминокислота или пептид или их производное соединяется с группой СОО- производного BChl через его гидроксигруппу. Примерами таких производных аминокислот являются серинметиловый эфир, N-трет-бутилоксикарбонилсерин, N-тритилсеринметиловый эфир, тирозинметиловый эфир и N-трет-бутокситирозинметиловый эфир, и примером такого пептида является N-карбобензоксисерилсеринметиловый эфир, все из которых получают так, как описано в упомянутом выше ЕР 0584552.
В другом воплощении R5, R6, R7 и/или R'7 представляет собой остаток аминокислоты или пептида (олигопептида или полипептида), соединенный с группой -СО через амидную связь (Y представляет собой NH).
В другом воплощении R5, R6, R7 или R'7 представляет собой остаток клеточноспецифического или тканеспецифического лиганда, выбранного из числа пептидов и белков, примерами которого являются пептиды-гормоны, например, меланоцитстимулирующие гормоны, например, a-MSH, и антитела, например, иммуноглобулины и опухолеспецифические антитела, и другие пептиды и белки. Пептид или белок могут соединяться непосредственно с группой -СО через сложноэфирную, тиоэфирную или амидную связь, или они могут соединяться через эфирную или амидную связь с концом функциональной группы углеводородного радикала С1-С25, выбранной из числа ОН, СООН и NH2.
Как описано в упомянутом выше ЕР 0584552, путем конъюгации Bchl с различными аминокислотами и дальнейшей конъюгации конъюгатов Bchl-аминокислота с гормонами, факторами роста или их производными или опухолеспецифическими антителами или любыми другими клеточноспецифическими лигандами, получают подходящие сайт-направленные фотосенсибилизаторы.
В одном воплощении отрицательно заряженная группа СОО-, COS-, SO3 - или РО3 2- по изобретению происходит от функциональной группы СООН, COSH, SO3H или РО3Н2, соответственно, замещенных углеводородных цепей R5, R6, R7 и/или R'7. В другом воплощении группа СООН, COSH, СОО- и/или COS- происходит от R1, R2 и R4, представляющих собой ОН или SH, O-R8 + или S-R8 +, соответственно, т.е., когда карбоксильная или тиокарбоксильная группа или карбоксилат- или тиокарбоксилат-анион присутствует в положении 131, 151 (m равен 0), 152 (m равен 1) и/или 173.
Катион R8 + может представлять собой одновалентный или двухвалентный катион, образованный от щелочного или щелочноземельного металла, такой как K+, Na+, Li+, NH4 +, Ca2+, предпочтительнее, K+; или R8 + представляет собой катион, образованный от амина.
В одном предпочтительном воплощении производное бактериохлорофилла по изобретению имеет формулу I, где
М представляет двухвалентный Pd;
R1 представляет собой -NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-COO-R8 +, -NH-(CH2)n-PO3 2-(R8 +)2;
R2 представляет собой метокси; и
R3 представляет собой -С(=О)-СН3;
R8 + представляет собой одновалентный катион, такой как K+, Na+, Li+, NH4 +; и
n равен целому числу от 1 до 10, предпочтительно, 2 или 3.
Согласно такому воплощению, в соединении формулы I R1 представляет собой, предпочтительно, группу -NH-(CH2)n-SO3 -R8 +, где n равен 3, и R8 + представляет собой K+.
В другом предпочтительном воплощении производное бактериохлорофилла по изобретению имеет формулу II, где
М представляет 2Н, двухвалентный Pd, Cu или Zn или трехвалентный Mn;
R1 представляет собой -O-R8 +, -NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-COO-R8 +, -NH-(CH2)n-PO3 2-(R8 +)2 или Y-R5, где Y представляет собой O, S или NH, и R5 представляет собой остаток аминокислоты, пептида или белка;
R2 представляет собой (С1-С6)-алкокси, такой как метокси, этокси, пропокси, бутокси, предпочтительнее - метокси;
R3 представляет собой -С(=О)-СН3, -СН=N-(CH2)n-SO3 -R8 +, -СН=N-(CH2)n-COO-R8 +, -СН=N-(CH2)n-PO3 2-(R8 +)2, -CH2-NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-COO-R8 + или -NH-(CH2)n-PO3 2-(R8 +)2;
R4 представляет собой -NH-(CH2)n-SO3 -R8 +,-NH-(CH2)n-COO-R8 +, -NH-(CH2)n-PO3 2-(R8 +)2;
R8 + представляет собой одновалентный катион, такой как K+, Na+, Li+, NH4 +, предпочтительнее, K+;
m равен 1, и n равен целому числу от 1 до 10, предпочтительно, 2 или 3.
В более предпочтительном воплощении изобретения производное бактериохлорофилла имеет формулу II, и М представляет собой Pd.
В другом более предпочтительном воплощении изобретение относится к производному бактериохлорофилла формулы II, где
М представляет собой Pd;
R1 представляет собой -O-R8 +, -NH-(CH2)n-SO3 -R8 + или Y-R5, где Y представляет собой O, S или -NH, и R5 представляет собой остаток белка, предпочтительно, иммуноглобулина;
R2 представляет собой (С1-С6)-алкокси, такой как метокси, этокси, пропокси, бутокси, предпочтительнее - метокси;
R3 представляет собой -С(=О)-СН3, -СН=N-(CH2)n-SO3 -R8 + или -CH2-NH-(CH2)n-SO3 -R8 +;
R4 представляет собой -NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-COO-R8 +, -NH-(CH2)n-PO3 2-(R8 +)2;
R8 + представляет собой одновалентный катион, такой как K+, Na+, Li+, NH4 +, предпочтительнее, K+;
и m равен 1, и n равен 2 или 3, предпочтительно, 2.
Пример производного бактериохлорофилла по изобретению, содержащего отрицательно заряженную группу (SO3 -) в положении 17, представляет соединение формулы I, идентифицированное в списке соединений, приведенном в описании далее, как соединение 7 .
Примерами производных бактериохлорофилла по изобретению, содержащих две отрицательно заряженные группы в положениях 13 и 17, являются соединения формулы II, идентифицированные в списке соединений, приведенном в описании далее, как соединения 4, 5 , 8, 10, 11, 12, 13, 14, 15 . В наиболее предпочтительном воплощении соединением по изобретению является соединение 4 .
Примерами производных бактериохлорофилла по изобретению, содержащих три отрицательно заряженные группы в положениях 3, 13 и 17, являются соединения формулы II, идентифицированные в списке соединений, приведенном в описании далее, как соединения 9 и 16 . Соединение 13 содержит одну отрицательно заряженную группу в положении 13 и группу -СООН как часть молекулы белка в положении 173, и соединение 15 содержит одну двухвалентную отрицательно заряженную группу в положении 13 и группу -СОО- как часть молекулы белка в положении 173.
Соединения изобретения можно получить, например, способами, отображенными в данном описании на схеме 1. Для получения соединений, в которых R5 представляет собой остаток аминокислоты, пептида или белка, можно использовать способы, описанные в упомянутом выше ЕР 0584552, особенно, способ каталитической конденсации, показанный на схеме 1 для взаимодействия с аминосульфоновыми кислотами таурином и гомотаурином.
Так, способ получения соединений формулы II, где R1 представляет собой -O-R8 +, R2 представляет собой -ОСН3, R3 представляет собой ацетил, R4 представляет собой группу -NH-(CH2)n-SO3 -R8 +, R8 + представляет собой одновалентный катион, m равен 1, и n равен 1-10, включает (i) взаимодействие соответствующего М-бактериофеофорбида формулы I, где R1 представляет собой ОН, с аминосульфоновой кислотой формулы H2N-(CH2)n-SO3Н в R8 +-буфере, и (ii) выделение нужного соединения формулы II.
Для получения соединения 4 способ включает взаимодействие Pd-бактериофеофорбида а 3 с таурином формулы H2N-(CH2)2-SO3Н в К+-буфере и выделение нужного соединения.
Для получения соединения 5 способ включает взаимодействие бактериофеофорбида а 2 с таурином формулы H2N-(CH2)2-SO3Н в К+-буфере и выделение нужного соединения.
Для получения соединений Cu и Zn 10, 11 способ включает непосредственное встраивание центрального атома Cu или Zn посредством взаимодействия соединения 5 с ацетатом меди или ацетатом цинка, соответственно, в то время как для получения соединения 12 с Mn встраивание центрального атома Mn осуществляют переметаллированием путем взаимодействия соединения 5 сначала с ацетатом кадмия и затем с хлоридом марганца.
Способ получения соединений формулы II, где R1 представляет собой -O-R8 +, R2 представляет собой -ОСН3, R3 представляет собой ацетил, R4 представляет собой группу -NH-(CH2)n-СОО-R8 +, R8 + представляет собой одновалентный катион, m равен 1, и n равен 1-10, включает (i) взаимодействие соответствующего М-бактериофеофорбида формулы I, где R1 представляет собой ОН, с аминокарбоновой кислотой формулы H2N-(CH2)n-СООН в R8 +-буфере и (ii) выделение нужного соединения формулы II.
Так, для получения соединения 14 способ включает взаимодействие Pd-бактериофеофорбида а 3 с b-аланином формулы Н2N-(CH2)2-СООН в К+-буфере и выделение нужного соединения.
Способ получения соединений формулы II, где R1 представляет собой -O-R8 +, R2 представляет собой -ОСН3, R3 представляет собой ацетил, R4 представляет собой группу -NH-(CH2)n-РО3 2-R8 +, R8 + представляет собой одновалентный катион, m равен 1, и n равен 1-10, включает (i) взаимодействие соответствующего М-бактериофеофорбида формулы I, где R1 представляет собой ОН, с аминофосфоновой кислотой формулы H2N-(CH2)n-РО3Н2 в R8-буфере и (ii) выделение нужного соединения формулы II.
Так, для получения соединения 15 способ включает взаимодействие Pd-бактериофеофорбида а 3 с 3-амино-1-пропанфосфоновой кислотой формулы H2N-(CH2)3-РО3Н2 в К+-буфере и выделение нужного соединения.
Для получения соединений, содержащих одинаковые отрицательно заряженные группы в положениях 13 и 17, соответствующий М-бактериофеофорбид можно ввести во взаимодействие с избытком реагента, такого как аминосульфоновая, аминокарбоновая или аминофосфоновая кислота, как описано выше, и выделить нужное 13,17-дизамещенное производное формулы II, или можно следовать другим путем, отображенным в данном описании на схеме 1 и описанным ниже.
Так, способ получения соединений формулы II, где R1 и R4, каждый, представляет собой группу -NH-(CH2)n-SO3 -R8 +, R2 представляет собой -ОСН3, R3 представляет собой ацетил, R8 + представляет собой одновалентный катион, m равен 1, и n равен 1-10, включает (i) сочетание соответствующего М-бактериофеофорбида формулы I, где R1 представляет собой ОН, с N-гидроксисульфосукцинимидом (сульфо-NHS) в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC); (ii) взаимодействие полученного эфира М-бактериофеофорбид-173-N-гидроксисульфосукцинимида с избытком аминосульфоновой кислоты формулы H2N-(CH2)n-SO3Н в R8 +-буфере, причем таким образом получают соединение формулы I, содержащее одну отрицательно заряженную группу в положении 17; (iii) взаимодействие полученного продукта с избытком H2N-(CH2)n-SO3Н в R8 +-буфере; и выделение нужного соединения формулы II.
Для получения соединения 8 взаимодействие осуществляют с избытком гомотаурина формулы H2N-(CH2)3-SO3Н.
Когда аминосульфоновую кислоту заменяют на аминокарбоновую или аминофосфоновую кислоту, получают соответствующие карбоксилатные и фосфонатные производные.
Соединения изобретения, также иногда обозначаемые в данном описании термином "пигменты", имеют достаточно высокую полярность для того, чтобы растворяться в воде и водных растворах для инъекций без добавления поверхностно-активных веществ. В одном воплощении для предпочтительного сульфированного Pd-Bchl соединения 4 также показаны биораспределение и фармакокинетика, и на основании этого предполагается, что данное и другие производные изобретения сохраняются в кровотоке в течение очень короткого времени. Поэтому они являются хорошими сенсибилизаторами для PDT, имеющей целью сосуды. Обработка ксенотрансплантатов меланотической меланомы M2R и карциномы толстой кишки человека НТ-29 на мышах, показанная в данном описании, демонстрирует селективное действие пигмента на сосудистую сеть опухоли. Предлагаемый протокол с сульфированным Pd-Bchl 4 включает короткое время выведения лекарственного средства. Основываясь на таком селективном действии на сосудистую сеть опухоли, такие соединения можно использовать в случае опухоли, а также связанной с возрастом дегенерации желтого пятна и других аномалий, которые зависят от реваскуляризации.
Таким образом, в другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей производное бактериохлорофилла изобретения и фармацевтически приемлемый носитель.
В предпочтительном воплощении фармацевтическая композиция содержит производное бактериохлорофилла формул I или II, описанных выше, предпочтительнее - производное формулы II, наиболее предпочтительно - соединение 4 .
Анионсодержащие производные бактериохлорофилла настоящего изобретения включают в состав конечных фармацевтических композиций для введения пациенту или применяют к объекту-мишени in vitro с использованием методов, хорошо известных в технике, например, суммированных в Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Penna., последнее издание. Композиции можно вводить системно, в частности, инъекцией, или можно вводить местно.
Анионсодержащие соединения Bchl имеют оптическое поглощение и фотофизические характеристики, подобные соответствующим не содержащим анионы Bchl, и поэтому ожидается, что пребывая в обрабатываемой ткани, они являются эффективными фотодинамическими агентами. Таким образом, они могут быть пригодны как фотосенсибилизаторы, как лечебные и диагностические средства, например, для лечения некоторых типов рака, таких как меланома, рак предстательной железы, рак головного мозга, толстой кишки, яичников, молочной железы, кожи, легких, пищевода и мочевого пузыря, других типов рака и других чувствительных к гормонам опухолей, а также для лечения связанной с возрастом дегенерации желтого пятна, и для киллинга клеток, вирусов, грибов и бактерий в образцах и живых тканях, что хорошо известно в технике PDT и других применений фотосенсибилизаторов.
Новые водорастворимые производные Bchl изобретения пригодны, например, при сенсибилизации опухолевых клеток или другой аномальной ткани для разрушения облучением или in vivo или ex vivo с использованием излучения соответствующей длины волны. Полагают, что энергия фотоактивации переносится на эндогенный кислород с превращением его в синглетный кислород и/или реакционноспособные кислородные соединения (ROS), такие как супероксидные или гидроксильные радикалы, которые рассматриваются как ответственные за цитотоксическое действие. Кроме того, фотоактивированные формы Bchl флуоресцируют, и такая флуоресценция может помочь при локализации опухолей или других мест, в которые вводят производное Bchl.
Примеры показаний, известные в технике, при которых возможно лечение производными бактериохлорофилла настоящего изобретения, включают разрушение опухолевой ткани в солидных опухолях и растворение бляшек в кровеносных сосудах (см., например, патент США № 4512762). В частности, такие производные подходят для PDT, имеющей целью сосуды, из-за их минимального удерживания в кровотоке и поскольку они только минимально растворяются в тканях вне кровотока, таких как кожа и мышцы. Таким образом, такие соединения после возбуждения создают возможность образования реакционноспособных кислородных соединений (ROS), ограниченного внутренними сосудами, и посредством этого вызывают селективную реакцию аномальных сосудов, таких как имеющиеся в опухолях и при связанной с возрастом дегенерации желтого пятна. Кроме того, производные бактериохлорофилла пригодны для селективного разрушения при местном лечении таких состояний, как акне, эпидермофития стопы, бородавки, папилломы и псориаз, для лечения доброкачественной гипертрофии предстательной железы и для стерилизации биологических продуктов, таких как кровь для переливания, путем разрушения инфекционных факторов.
Фармацевтические композиции изобретения будут вводиться пациентам стандартными процедурами, используемыми при PDT. Количество анионсодержащего производного Bchl по изобретению, вводимое нуждающемуся в этом индивидууму, и способ введения будут устанавливаться согласно опыту, накопленному с другими порфиринами, используемыми в PDT, и будут изменяться в зависимости от выбора производного, используемого в качестве активного ингредиента, состояния, например, вида опухоли, от которой лечат, стадии заболевания, возраста и состояния здоровья пациента и решения лечащего врача, но количество будет значительно меньше, чем дозировка используемого в настоящее время фотофрина II из расчета примерно 20-40 мг HPD на кг массы тела. Предпочтительными способами введения являются внутривенная инъекция или прямая инъекция в солидную опухоль водного раствора активного соединения, содержащего обычные фармацевтически приемлемые носители и добавки, и местная обработка опухолей кожи подходящими композициями для местного применения.
Длину волны облучающего света выбирают, предпочтительно, как соответствующую максимальному поглощению фотосенсибилизатора бактериохлорофилла. Подходящую длину волны для любого соединения можно легко определить из его спектра поглощения.
Кроме применения in vivo, анионсодержащие производные Bchl изобретения можно использовать при обработке материалов in vitro для уничтожения (киллинга) вредных вирусов или инфекционных факторов, таких как опасные бактерии. Например, кровь и плазму крови, используемые для будущего переливания, можно обработать Bchl по изобретению и облучить для осуществления стерилизации.
Конъюгация белков, например, гормонов, факторов роста или их производных, антител, пептидов, которые специфически связываются с рецепторами клеток-мишеней, и питательных веществ клетки, например, тирозина, с молекулой Bchl предназначена для возрастания удерживания их в опухоли и обрабатываемых участках. Увеличение сдвига в красную область создает возможность для более глубокого проникновения, при общем сохранении природной системы. Замена Mg на другие металлы предполагает оптимизацию присущей устойчивости и устойчивости к метаболизму молекулы Bchl и ее внутрисистемного перехода в возбужденное триплетное состояние, а также открывает возможности для новых диагностических процедур.
Опухолеспецифические антитела и пептиды, имеющие высокую аффинность к неоэндотелиальным клеткам, будут преимущественно локализовать молекулы Bchl в опухоли или обрабатываемом участке, в то время как гормоны и клеточные питательные вещества также могут приниматься здоровыми нетрансформированными аналогами. Однако клетки, выбранные в качестве мишеней для гормонов и клеточных питательных веществ, такие как меланоциты и неоэндотелиальные клетки, в нормальных состояниях рассеяны среди других клеток, а когда трансформируются в злокачественные клетки, группируются в солидные опухоли. В результате, ожидается, что концентрация фотосенсибилизатора в сосудистых и/или клеточных компартментах злокачественной ткани возрастет существенно относительно его концентрации в здоровой ткани, где клетки более рассеяны, обеспечивая амплификацию действия PDT в месте опухоли. Это создает возможность эффективного использования доз излучения меньших, чем порог повреждения здоровой ткани, причем таким образом уменьшается необходимость точного определения дозы со временем. Кроме того, при весьма сильной флуоресценции, можно использовать "сайт-направленный" Bchl для флуоресцентного мечения места(мест) опухоли или других мишеней.
В одном из наиболее предпочтительных воплощений настоящего изобретения мишенью для обработки сенсибилизаторами изобретения являются аномальные кровеносные сосуды, в частности, кровеносные сосуды солидных опухолей и при связанной с возрастом дегенерации желтого пятна, из-за действительного различия в чувствительности здоровых и аномальных кровеносных сосудов к предлагаемым протоколам PDT, раскрытым в данном описании.
Изобретение также относится к способу фотодинамической терапии, включающему введение нуждающемуся в этом индивидууму эффективного количества производного Bchl по изобретению с последующим локальным облучением.
В одном воплощении способ PDT изобретения применяют для лечения рака, и он включает введение пациенту, пораженному солидной раковой опухолью, терапевтически эффективного количества производного Bchl по изобретению и последующее облучение места опухоли сильными источниками света при 670-780 нм.
Производные Bchl изобретения также пригодны для фотодеструкции здоровых или злокачественных клеток животного, а также микроорганизмов в культуре, создавая возможность селективной фотодеструкции некоторых типов клеток в культуре или инфекционных факторов; для локализации частицы порфирина в выбранных клетках путем присоединения к специфическим полипептидам, таким как гормоны, или другим рецепторным лигандам, к клеточно- или тканеспецифическим антителам или другим лигандам, например, лектинам; для флуоресцентного мечения молекул для аналитических целей в лабораторных, диагностических и промышленных применениях; и для флуоресцентного мечения клеток животных или микроорганизмов или частиц для лабораторных, диагностических и промышленных применений. Они могут заменить некоторые используемые в настоящее время флуоресцентные метки, такие как флуоресцеин изотиоцианат (FITC) или фикоэритрин, благодаря их превосходным коэффициентам экстинкции и более высокому выходу флуоресценции.
Для целей диагностики производные Bchl изобретения можно использовать одни, или их можно метить радиоизотопом или другими средствами для детекции, известными в технике. Например, производное Bchl можно пометить радиоизотопами стандартными процедурами, например, пометить 67Ga, 111In, 201Tl, 99mTc, и такое радиодиагностическое средство вводят пациенту, предпочтительно, внутривенной инъекцией. Через несколько часов можно получить изображение локуса ракового заболевания стандартными процедурами.
Изобретение также относится к применению производных Bchl изобретения для киллинга ex vivo и in vivo клеток инфекционных факторов, таких как бактерии, вирусы, паразиты и грибы, в биологическом продукте, например, крови, которое включает обработку инфицированного образца соединением изобретения с последующим освещением образца.
Теперь изобретение будет иллюстрироваться приведенными далее примерами, не являющимися ограничительными.
Примеры
Для удобства и для лучшего понимания, раздел примеров делится на два подраздела: (I) химический раздел, где описывается синтез водорастворимых производных и промежуточных соединений 4-16, и (II) биологический раздел, где описывается биологическая активность новых производных Bchl.
I. Химический раздел
В приведенных здесь примерах производные по изобретению (4-5, 7-9 и 10-16) и промежуточные соединения (1-3 и 6) будут представлены под соответствующими им арабскими цифрами, выделенными жирным шрифтом и подчеркнутыми, согласно приведенному далее списку соединений. Соответствующие формулы указываются на схеме в конце описания непосредственно перед формулой изобретения.
Список соединений
1 . Бактериохлорофилл а (Bchl a)
2 . Бактериофеофорбид а (Bpheid a)
3 . Pd-Бактериофеофорбид а (Pd-Bpheid a)
4 . Дикалиевая соль палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида [пример 1]
5 . Дикалиевая соль 31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида [пример 2]
6 . Натриевая соль эфира 173-(3-сульфо-1-оксисукцинимида) палладий-бактериофеофорбида а [пример 6]
7 . Калиевая соль 173-(3-сульфопропил)амида палладий-бактериофеофорбида а [пример 7]
8 . Дикалиевая соль палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131,171-ди(3-сульфопропил)амида [пример 8]
9 . Трикалиевая соль палладий-31-(3-сульфопропилимино)-15-метоксикарбонилметилродобактериохлорин-131,173-ди(3-сульфопропил)амида [пример 9]
10 . Дикалиевая соль медь(II)-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида [пример 3]
11 . Дикалиевая соль цинк-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида [пример 4]
12 . Дикалиевая соль марганец(III)-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида [пример 3]
13 . Калиевая соль палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амид-173-(N-иммуноглобулин G)амида [пример 10]
14 . Дикалиевая соль палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-карбоксиэтил)амида [пример 11]
15 . Трикалиевая соль палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(3-фосфопропил)амида [пример 12]
16 . Трикалиевая соль палладий-31-(сульфопропиламино)-15-метоксикарбонилметилродобактериохлорин-131,173-ди(3-сульфопропил)амида [пример 13]
Материалы и методы
(i) Bchl а ( 1 ) экстрагируют и выделяют в чистом виде из лиофилизованных клеток Rhodovolum Sulsidophilum, как описано ранее (WO 00/33833).
(ii) Палладий-бактериофеофорбид (Pd-Bpheid, 2 ) или получают так, как описано ранее (WO 00/33833), или его получают от Steba Biotech Ltd. через Negma-Lerads, Франция.
(iii) 3-Амино-1-пропансульфоновую кислоту (гомотаурин) и 3-амино-1-пропанфосфоновую кислоту закупают у Aldrich (США), а 2-аминоэтансульфоновую кислоту (таурин) и 3-аминопропионовую кислоту (b-аланин) закупают у Sigma (США), 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) закупают у Fluka (Швейцария).
(iv) Как правило, используют химикаты и растворители чистые для анализа, за исключением осуществления ВЭЖХ, где применяют растворители для ВЭЖХ.
(v) ТСХ: пластинки с диоксидом кремния (Kieselgel-60, Merck, Германия); смесь хлороформ/метанол (4:1, об./об.).
(vi) Спектры 1Н ядерного магнитного резонанса (ЯМР) записывают на приборе Avance DPX 250 (Bruker, Франция) и приводят в м.д. (d) от тетраметилсилана с пиками остаточного растворителя в качестве внутренних стандартов.
(vii) Коэффициенты экстинкции Pd-производных определяют корреляцией концентрации палладия (с использованием пламенной фотометрии с PdCl2 в качестве стандарта) с оптической плотностью проверенного раствора при определенной длине волны.
(viii) Масс-спектры с ионизацией распылением электронов (ESI-MS) записывают на спектрометре, платформа LCZ (Micromass, Англия).
(ix) Масс-спектрометрию с ионизацией в индуктивно связанной плазме (ICP-MS) для определения концентраций Pd осуществляют с использованием прибора ELAN-6000 (Perkin Elmer, CT).
(х) Оптическое поглощение различных комплексов записывают на спектрофотометрах Genesis-2 (Milton Roy, Англия) и V-570 (JASCO, Япония).
(xi) ВЭЖХ осуществляют с использованием прибора LC-900 (JASCO, Япония), снабженного детектором с диодной матрицей UV-915.
Химические примеры
Пример 1
Дикалиевая соль палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида (соединение 4 )
В 1-л круглодонной колбе растворяют девятьсот тридцать пять (935) мг Pd-Bpheid ( 3 ) в 120 мл ДМСО при перемешивании и в атмосфере аргона (барботирование через раствор). Таурин (1288-мг) растворяют в 40 мл буфера 1 М К2НРО4, и рН раствора доводят до 8,2 (HCl). Полученный водный раствор добавляют при перемешивании к ДМСО-раствору, и через раствор еще в течение 20 минут барботируют аргон. Затем реакционную смесь упаривают при 30оС в течение 3,5 часов при ~2 мбар и затем еще в течение 2 часов при 37оС до полного высыхания. Сухое твердое вещество растворяют в 300 мл МеОН, окрашенный раствор фильтруют через хлопковую вату, и получают буферные соли и избыток таурина.
Развитие реакции определяют ТСХ (Rf не прореагировавшего Pd-Bpheid равен 0,8-0,85, а продукта реакции (аминолиза) 0,08-0,1) и затем по спектру оптического поглощения реакционной смеси после лиофилизации и повторного растворения в МеОН. Спектр поглощения характеризуется сдвигом перехода Qy от 756 нм (для Pd-Bpheid) к 747 нм (для продукта 4 ), и сдвигом Qх от 534 нм для Pd-Bpheid к 519 нм (для продукта 4 ). МеОН выпаривают, и продукт реакции 4 очищают ВЭЖХ на колонке ODS-A 250X20 S10P мкм (YMC, Япония). Растворитель А: 95% 0,005 М фосфатного буфера, рН 8,0, и 5% МеОН. Растворитель В: 100% МеОН. Сухое твердое вещество растворяют в 42 мл дистиллированной воды и инъецируют частями по 1,5 мл каждая.
Профиль элюирования приводится в табл.1. Продукт реакции 4 (схема 1, см. ниже) элюируют и собирают при ~ 9-11 минутах. Основные примеси, собираемые после ~ 4-7 мин (ок. 5-10%), соответствуют бипродукту(ам) с предполагаемой структурой 7 . Пики при 22-25 мин (ок. 2-5%), возможно, соответствуют изоформе основного продукта 4 и остаткам не прореагировавшего Pd-Bpheid.
Растворитель (водный метанол) выпаривают при пониженном давлении. Затем очищенный продукт 4 снова растворяют в ~150 мл МеОН и фильтруют через хлопковую вату. Растворитель снова выпаривают, и твердый пигмент 4 хранят в атмосфере Ar в темноте при -20оС. Выход реакции ~90% (по массе относительно 3 ).
Структуру продукта 4 подтверждают масс-спектрометрией с ионизацией распылением электронов (ESI-MS, отрицательный тип, фиг.2) (пики при 875 (M--K-H), 859 (M--2K-H+Na), 837 (M--2K), 805 (M2K-H-OMe), 719) и спектром 1Н-ЯМР (фиг.4, в МеОН-d4). В табл.4 приводятся сдвиги (в единицах м.д.) основных пиков ЯМР.
Спектр оптического поглощения (UV-VIS) (MeOH): l, 747 (1,00), 516 (0,13), 384 (0,41), 330 (0,50); e747 (МеОН) равен 1,2 х 105 моль-1.см-1.

Отношение распределения октанол/вода равно 40:60.
Пример 2
Получение дикалиевой соли 31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида (соединение 5 )
Растворяют сто шестьдесят (160) мг таурина в 5 мл 1 М К2НРО4 буфера, и рН раствора доводят до 8,2. Полученный раствор добавляют к 120 мг соединения 2 , растворенного в 15 мл ДМСО, и проводят реакцию и последующую очистку аналогично описанным в предыдущем примере.
Спектр поглощения (МеОН): l, 750 (1,00), 519 (0,30), 354 (1,18) нм.
ESI-МС:734(М-2К).

Отношение распределения октанол/вода равно 60:40.
Пример 3
Получение дикалиевой соли медь(II)-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида (соединение 10 )
Растворяют пятьдесят (50) мг соединения 5 примера 2 и 35 мг ацетата меди(II) в 40 мл метанола, и через раствор в течение 10 минут барботируют аргон. Затем добавляют 500 мг пальмитоиласкорбата, и раствор перемешивают в течение 30 мин. Спектр поглощения характеризуется сдвигом перехода Qy от 750 нм (для 5 ) к 768 нм (для продукта 10 ), и сдвига Qx от 519 нм для 5 к 537 (для продукта 10 ). Затем реакционную смесь упаривают, остаток снова растворяют в ацетоне, фильтруют через хлопковую вату, и получают избыток соли ацетата. Ацетон выпаривают, и продукт реакции очищают дополнительно ВЭЖХ в условиях, указанных выше, с профилем элюирования, описанным в табл.2.
Растворитель (водный метанол) выпаривают при пониженном давлении. Затем очищенный пигмент 10 снова растворяют в метаноле и фильтруют через хлопковую вату. Растворитель снова выпаривают, и твердый пигмент 10 хранят в атмосфере Ar в темноте при -20оС. Выход реакции ~90%.
Спектр поглощения (МеОН): l, 768 (1,00), 537 (0,22), 387 (0,71) и 342 (0,79) нм.
ESI-MS (-): 795 (M--2K).
Отношение распределения октанол/вода равно 40:60.
Пример 4
Получение дикалиевой соли цинк-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида (соединение 11 )
Введение Zn в соединение 5 осуществляют с ацетатом Zn в уксусной кислоте, как описано ранее (патент США № 5726169). Конечную очистку осуществляют ВЭЖХ в тех же условиях, что и для соединения 5 , описанных выше в примере 2.
Спектр поглощения (МеОН): l, 762 (1,00), 558 (0,26), 390 (0,62) и 355 (0,84) нм.
Отношение распределения октанол/вода равно 50:50.
Пример 5
Получение дикалиевой соли марганец(III)-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида (соединение 12 )
Введение Mn в соединение 5 осуществляют с ацетатом Cd в уксусной кислоте, как описано ранее (WO 97/19081; US 6333319), с некоторыми изменениями. Так, пятьдесят (50) мг соединения 5 в 10 мл ДМФА перемешивают с 220 мг ацетата кадмия и греют в атмосфере аргона при 110оС примерно 15 мин (образование комплекса Cd контролируют по сдвигу полосы поглощения перехода Qx от 519 к 585 нм в ацетоне). Затем реакционную смесь охлаждают и упаривают. Сухой остаток снова растворяют в 15 мл ацетона и перемешивают с хлоридом марганца(II) с образованием Mn(III)-продукта 12 . Образование продукта контролируют по сдвигу полосы перехода Qx от 585 к 600 нм и полосы перехода Qу от 768 к 828 нм в ацетоне. Ацетон выпаривают, и продукт 12 дополнительно очищают ВЭЖХ в условиях, указанных выше в примере 2, с профилем элюирования, описанным ниже в табл.3, где система растворителей состоит из А - 5% водный метанол и В - метанол.
Растворитель (водный метанол) выпаривают при пониженном давлении, и твердый пигмент 12 хранят в атмосфере Ar в темноте при -20оС.
Спектр поглощения (МеОН): l, 828 (1,00), 588 (0,32) и 372 (0,80) нм.
Отношение распределения октанол/вода равно 5:95.
Пример 6
Получение натриевой соли эфира 173-(3-сульфо-1-оксисукцинимида) палладий-бактериофеофорбида а (соединение 6 )
Смешивают пятьдесят (50) мг Pd-Bphied (соединение 2 ), 80 мг N-гидроксисульфосукцинимида (сульфо-NHS) и 65 мг 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) в 7 мл сухого ДМСО в течение ночи при комнатной температуре. Затем растворитель удаляют при пониженном давлении. Сухой остаток снова растворяют в хлороформе (ок. 50 мл), раствор фильтруют от нерастворимого вещества и упаривают. Конверсия составляет прим. 95% (ТСХ). Продукт 6 используют в дальнейшем без дополнительной хроматографической очистки. ESI-MS (-): 890 (M--Na).

Пример 7
Получение калиевой соли 173-(3-сульфопропил)амида палладий-бактериофеофорбида а (соединение 7 )
Смешивают в течение ночи десять (10) мг соединения 6 в 1 мл ДМСО с 20 мг гомотаурина (3-амино-1-пропансульфоновая кислота) в 1 мл 0,1 М К-фосфатного буфера, рН 8,0. Затем реакционную смесь обрабатывают смесью хлороформ/вода. Органический слой сушат над безводным сульфатом натрия и упаривают. Сухой остаток снова растворяют в смеси хлороформ-метанол (19:1) и вносят в хроматографическую колонку с диоксидом кремния. Продукт 7 получают элюированием смесью хлороформ-метанол (4:1). Выход составляет примерно 80-90%.
ESI-МС(-):834 (М-К) m/z

Пример 8
Получение дикалиевой соли палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131,171-ди(3-сульфопропил)амида (соединение 8 )
Растворяют десять (10) мг соединения 6 или 7 в 3 мл ДМСО, смешивают со 100 мг гомотаурина в 1 мл 0,5 М К-фосфатного буфера, рН 8,2, и инкубируют в течение ночи при комнатной температуре. Затем растворитель удаляют при пониженном давлении, как описано выше, и продукт 8 очищают ВЭЖХ. Выход 83%.
Спектр поглощения (МеОН): 747 (1,00), 516 (0,13), 384 (0,41), 330 (0,50). e747 = 1,3 х 105 моль-1см-1.
ESI-МС(-):1011 (М--К), 994 (М--2К+Na), 972 (M--2К), 775 (М--2К-СО2Ме-гомотаурин NHCH2СН2СН2SO3), 486([М-2К]/2)

Пример 9
Получение трикалиевой соли палладий-31-(3-сульфопропилимино)-15-метоксикарбонилметилродобактериохлорин-131,173-ди(3-сульфопропил)амида (соединение 9 )
Соединение 9 получают после ВЭЖХ как второстепенный продукт во время синтеза 8 .
Спектр поглощения (МеОН): 729 (1,00), 502 (0,10), 380 (0,69), 328 (0,57).
ESI-МС(30.4.2000): 1171 (М-К+Н), 1153 (М--2К-Н+Na), 1131 (М-2К), 566 ([М-К]/2), 364 ([М-3К]/3).

Пример 10
Получение калиевой соли палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амид-173-(N-иммуноглобулин G)амида (соединение 13 )
Вводят во взаимодействие десять (10) мг соединения 4 с 20 мг сульфо-NHS и 15 мг EDC в 1 мл сухого ДМСО в течение 1 часа при комнатной температуре, затем добавляют кроличий IgG (0,6 мг) в PBS (2,5 мл), и затем смесь инкубируют в течение ночи при комнатной температуре. Смесь упаривают досуха, затем остаток снова растворяют в 1 мл PBS, и раствор загружают в колонку с сефадексом G-25, уравновешенную PBS. Окрашенную полосу элюируют 4-5 мл PBS. Отношение пигмент/белок в полученном конъюгате 13 определяют по оптической плотности при 753 и 280 нм, соответственно, и оно - пигмент 13 /белок - изменяется от 0,5/1 до 1/1.
Пример 11
Получение дикалиевой соли палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-карбоксиэтил)амида (соединение 14 )
Получение и очистку названного в заголовке соединения осуществляют так, как описано в примере 2, но при взаимодействии соединения 2 с 3-аминопропионовой кислотой (b-аланин) (150 мг) вместо таурина. Выход 85%.
Пример 12
Получение трикалиевой соли палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(3-фосфопропил)амида (соединение 15 )
Получение и очистку названного в заголовке соединения 15 осуществляют так, как описано в примере 2, но при взаимодействии соединения 2 с 3-амино-1-пропанфосфоновой кислотой (180 мг) вместо таурина. Выход 68%.
Пример 13
Получение трикалиевой соли палладий-31-(сульфопропиламино)-15-метоксикарбонилметилродобактериохлорин-131,173-ди(3-сульфопропил)амида (соединение 16 )
Для восстановления иминной группы в 31-(сульфопропилимино) до соответствующей группы в 31-(сульфопропиламино) соединение 9 (8 мг) вводят во взаимодействие, перемешивая с цианоборогидридом натрия (15 мг) в 5 мл метанола в течение ночи при комнатной температуре. Затем реакционную смесь обрабатывают 0,05 М HCl (5 мл), нейтрализуют 0,01 М КОН и упаривают. Названный в заголовке продукт реакции 16 очищают с использованием условий ВЭЖХ, описанных в примере 2. Выход 80-90%.
II. Биологический раздел
Материалы и методы
Исследования in vitro
(i) Выращивание клеток. Клетки меланомы мыши M2R, мышиные эндотелиальные клетки H5V и клетки глиомы крысы С6 культивируют как монослои в модифицированной по Дульбекко среде Игла (DMEM)/F12, содержащей 25 мМ HEPES, рН 7,4, 10% фетальной телячьей сыворотки (FBS), глутамин (2 мМ), пенициллин (0,06 мг/мл) и стрептомицин (0,1 мг/мл) (называемой далее в описании "культуральной средой"). Клетки выращивают при 37°С в увлажненной атмосфере с 8% СО2.
(ii) Анализ на фототоксичность. Для того чтобы определить фотодинамическую эффективность, клетки предварительно инкубируют с возрастающими концентрациями пигментов в темноте в течение времени и в условиях, указанных для отдельных экспериментов. Несвязанный сенсибилизатор удаляют промыванием клеток один раз культуральной средой, и планшеты освещают при комнатной температуре со дна (l>650 нм, 12 Дж/см2). Источником света является 100-Вт галогеновая лампа (Osram, Германия), снабженная 4-см водяным фильтром. Культуры помещают в термостат, и через 24 часа после освещения выживаемость клеток определяют анализом на жизнеспособность с нейтральным красным. Используют три вида контроля: (i) световой контроль - клетки освещают в отсутствие пигментов; (ii) темновой контроль - клетки обрабатывают пигментами, но держат в темноте; и (iii) необработанные клетки, которые держат в темноте.
Исследования in vivo
(iii) Имплантация опухоли. Клетки M2R или С6 (2х106) имплантируют подкожно на спину мышам; опухоли развиваются до размера для обработки (6-8 мм) в пределах 2-3 недель.
(iv) Получение сенсибилизатора. Исходные растворы соединений изобретения получают перед применением, растворяя сухой пигмент непосредственно в PBS до концентрации, нужной для инъекции.
(v) Биораспределение и фармакокинетика. Пигмент 4 изобретения (6 мг/кг) инъецируют голым мышам CD1 в хвостовую вену. Мышей умерщвляют в указанное время, и образцы показательных органов или тканей помещают в предварительно взвешенные флаконы, взвешивают и сразу же замораживают на сухом льду. Для проверки каждый образец оттаивают и гомогенизируют (1:10, об./об.) в бидистиллированной воде. Аликвоты гомогената (0,5 мл) лиофилизуют в пробирках Эппендорфа. Затем к каждому сухому образцу добавляют 0,2 мл HNO3 (70%, TraceSelect, Fluka), инкубируют в течение 1 часа при 90оС и разводят в бидистиллированной воде до 10 мл. Концентрации палладия определяют с помощью ICP-MS. Определяют фон для каждого органа/ткани на идентичных образцах, взятых от необработанных мышей, и, соответственно вычитают величины.
(vi) Протокол PDT. Мышам с опухолью M2R дают наркоз, и пигмент инъецируют внутривенно (i.v.) через хвостовую вену. Опухоли сразу же освещают чрезкожно в течение 5 мин диодным лазером 755 нм (CermanOptec, Германия) световой дозой 30 Дж/см2 (100 мВт/см2), 39 Дж/см2 (130 мВт/см2) или 45 Дж/см2 (150 мВт/см2). После обработки мышей возвращают в клетку. В группе темнового контроля мышам инъецируют i.v. сенсибилизатор и помещают в темную клетку на 24 часа. В группе светового контроля мышей освещают дозой 45 Дж/см2.
(vii) Закрытие и проницаемость сосудов. Мышей с ксенотрансплантатами опухоли глиомы С6 обрабатывают пигментом 4 (9 мг/кг) и светом (100 мВт/см2 в течение 5 мин). Сразу же после обработки инъецируют (0,5 мл, i.p.) синий Эванса (ЕВ; 1% в PBS). Мышей фотографируют через 3 и 24 часа после обработки. Мышей умерщвляют через 24 часа после обработки, и получают полнослойный кожный лоскут для каждой мыши и фотографируют. Затем опухоль удаляют с кожей над ней, замораживают в течение 1 часа при -20оС, затем получают аксиальный срез, и срез фотографируют. Контрольным мышам инъецируют синий Эванса в то же время, что и обработанным мышам, и протокол продолжают так, как описано выше, для всех мышей вместе.
Пример 14
Цитотоксичность сульфированных производных бактериохлорофилла против культур опухолевых клеток
Фототоксичность соединений 4 и 8 определяют так, как описано выше в (ii), в клетках меланомы мыши M2R и мышиных эндотелиальных клетках H5V. Клетки предварительно инкубируют с возрастающими концентрациями соединений в течение 4 часов, промывают и освещают или держат в темноте.
Результаты приводятся на фиг.1А-1В для бисульфированного соединения 8 в клетках H5V и MR2, соответственно, и на фиг.1А-2В для моносульфированного соединения 4 (сравнение) в клетках H5V и MR2, соответственно. Как можно видеть, фототоксичность обоих пигментов 4 и 8 зависит от концентрации и освещенности, без признаков токсичности в темноте в испытываемом интервале. LD50 обоих пигментов одинаковая (~2 мкМ) и является схожей в обеих клеточных линиях.
Фототоксичность сульфированных пигментов 5 и 11 определяют на клетках меланомы мыши M2R. Как можно видеть на фиг.3 и 4, фототоксичность пигментов 5 и 11 зависит от концентрации и освещенности, и LD50 обоих пигментов одинаковая (~5 мкМ). Нет признаков токсичности в темноте в испытываемом интервале.
Пример 15
Фармакокинетика и биораспределение соединения 4
Первой стадией перед испытанием на фототоксичность 4 в PDT ксенотрансплантатов солидной меланомы должно быть определение фармакокинетики и биораспределения in vivo, как описано выше в разделе (vi). Как можно видеть на фиг.5, примерно 90% пигмента 4 выводится в пределах первых 10 мин после i.v. инъекции с картиной однофазной кинетики с t0,5 1,65 мин (табл.4). Быстрое выведение 4 из крови может означать, что только небольшая часть (или никакая) связывается с компонентами плазмы, иначе выведение могло происходить медленнее.
Kel - скорость удаления; Vd - объем распределения; CL- выведение
Биораспределение соединения 4 показывает, что в большинстве проверенных органов мыши уровни пигмента высокие сразу после инъекции и падают до почти уровней фона за 20-30 мин, подобно скоростям их выведения из крови (фиг.6). Такие результаты, вероятно, представляют уровень пигмента в крови, захваченного сосудистой сетью органов, как видно в селезенке, легких и сердце. Кроме того, результаты тоже наводят на мысль, что диффузия пигмента в органы ничтожна. Пигмент 4 быстро выводится из организма мыши, и в пределах 30 мин после инъекции его уровень находится на уровне фона во всех тканях. Скорость выведения 4 из организма мыши значительно выше, чем для Pd-Bpheid (3), который достигает уровней фона только через 48 часов после инъекции (не показано).
Пример 16
Фотодинамическая обработка ксенотрансплантатов меланомы M2R в голых мышах CD1 сульфированным пигментом 4
На основании результатов по фармакокинетике, полученных выше в примере 15, протокол обработки для соединения 4 устанавливает 5-мин освещение сразу же после инъекции пигмента. В этих экспериментах (см. выше раздел (vii)) используют специальный медицинский лазер, соответствующий пику поглощения 4 (CeramOptec, Германия, 755 нм). Для того чтобы определить протокол оптимального соотношения лекарственное средство/свет, мышей обрабатывают дозой лекарственного средства 6 мг/кг и светом возрастающей интенсивности (фиг.7). Как можно видеть на кривой выживаемости Kaplan-Meier, повышение интенсивности света улучшает показатель эффективности лечения с 43% до 60% при 30 и 45 Дж/см2, соответственно. Когда дозу лекарственного средства повышают до 9 мг/кг при интенсивности света 30 Дж/см2, имеет место существенное повышение выживаемости - до 70% (фиг.7). Токсичности в темноте у животных, обработанных 6 или 9 мг/кг и содержащихся в темноте, не наблюдают.
Пример 17
Селективное действие фотодинамической обработки соединением 4
Данный эксперимент осуществляют так, как описано выше в разделе (vii). Фиг.8 иллюстрирует действие фотодинамической обработки на перфузию крови в ксенотрансплантатах С6 у мышей (а, е). Обработанное животное, которому вводят синий Эванса сразу же после PDT, показывает отек и усиленное просачивание ЕВ в сосуды интерстиция, что показывает синий цвет (из-за просачивания синего Эванса с альбумином) в освещенных участках при сравнении с неосвещенным участком у того же животного и у не обработанного животного (b, f). Через двадцать четыре часа можно видеть, что у обработанной мыши имеется интенсивное синее окрашивание тканей вокруг опухоли (отек; с), в то время как опухоль остается белой (нет окрашивания ЕВ) из-за закрытия сосудов, которое происходит сразу же после PDT (d). Мышечная ткань под опухолью, так же как и кожа над и вокруг опухоли (но в пределах обработанного участка) синяя, что показывает, что закрытия сосудов не происходит (c, d). У необработанного животного опухоль окрашивается в синий цвет подобно другим тканям (g, h). Селективное отгораживание новых сосудов в опухоли показывает, что соединения изобретения можно использовать для селективной обработки аномальной сосудистой сети как в случае связанной с возрастом дегенерации желтого пятна (AMD).
Пример 18
Лечение PDT с соединением 4 на животной модели AMD
Фотодинамическая терапия (PDT) разработана в стремлении вызвать локализованную окклюзию сосудов вновь образовавшихся оболочек, выделяющихся из собственно сосудистой оболочки (хориоидальная реваскуляризация - CNV). При связанной с возрастом дегенерации желтого пятна (AMD) PDT с использованием вертепорфина снижает опасность потери зрения вторично к CNV. Полагают, что механизм действия PDT включает высвобождение реакционноспособных кислородных частиц, повреждающих эндотелиальные клетки и активирующих субэндотелиальный каскад свертывания крови. Такие события ведут к образованию тромбов в просвете сосуда.
Для лечения хориоидальной реваскуляризации установлены высокоэффективные параметры (плотность энергии лазерного излучения или флюенс, доза фотосенсибилизатора и промежуток до облучения светом (DLI)), создающие возможность точного фокусирования и локализации патологических сосудов и минимального вторичного повреждающего действия на здоровую сетчатку и ткани собственно сосудистой оболочки. Однако, с использованием только фотосенсибилизатора (вертепорфина), доступного в настоящее время для клинического применения, как правило, требуются повторные обработки для достижения нужного окклюзивного действия на CNV. Таким образом, опасность для коллатеральной ткани усиливается и может стать существенным побочным действием лечения.
В данном эксперименте оценивается возможность фотодинамического лечения (PDT) с водорастворимым фотосенсибилизатором, называемым в данном случае WST11 или соединением 4 , и сравниваются его характеристики с характеристиками вертепорфина.
Соединение 4 является чистым и устойчивым производным бактериохролофилла, выделенным в виде черно-фиолетового кристаллического порошка. Оно имеет молекулярную массу 916 и растворяется в водном растворе. Оно характеризуется следующими свойствами: (а) 4 основных пика поглощения (750, 530, 385 и 330 нм), наибольшее поглощение света имеет место вблизи инфракрасной области (≈750 нм), где коэффициент пропускания ткани наивысший; (b) весьма низкая цитотоксичность в темноте; таким образом, повреждение ткани можно регулировать дозой излучения и длиной экспозиции; (с) оно очень быстро выводится из организма после введения, следовательно, возможность повреждения кожи за счет фотосенсибилизации при воздействии окружающего света или солнечного излучения минимальна; (d) генерация реакционноспособных кислородных соединений (ROS) высока из-за эффективного внутрисистемного перехода (ISC).
Порошок WST11 разводят в свободной от эндотоксинов стерильной воде в концентрации 10 мг/мл и встряхивают до полного растворения. Такая композиция сохраняет устойчивость в течение 24 часов при 4°С будучи защищенной от света. Для того чтобы вычислить объем для инъекции, учитывают массу кролика. Подходящий объем раствора инъецируют внутривенно в виде болюса в маргинальную ушную вену.
Потенциал соединения 4 для PDT, связанной с возрастом дегенерации желтого пятна (AMD), сравнивают с вертепорфином (Visudyneâ, Novartis, Швейцария) с использованием модели глаза кролика. Используют пигментированных кроликов (136 кроликов "Fauve de Bourgogne", возраст 10-12 недель, 2,5-3 кг; Elevage des Pins, Epigne-sur-Dême, Франция). Быстрое и длительное действие на глаз кролика исследуют при следующих параметрах: 1) лазер 753 нм, флюенс (25 и 50 Дж/см2), дозы соединения 4 (также называемого WST11) (2,5 и 5 мг/кг) и промежуток до освещения светом (DLI) 1, 5, 10 и 15 минут); 2) лазер 689 нм, флюенс (10, 50, 100 Дж/см2), дозы вертепорфина (3, 6 и 12 мг/м2) и постоянный DLI 5 мин. Указанные параметры PDT, охватывающие совокупность действий на собственно сосудистую оболочку и сетчатку над ней, применяют в течение 83 секунд для того, чтобы вызвать в сосудах события окклюзии, субпорога окклюзии или события без окклюзии. Обработанные глаза кроликов проверяют методом обратной офтальмоскопии, флуоресцентной ангиографии (FA) и гистологии в разные моменты времени после PDT. PDT с WST11 с использованием флюенса 50 Дж/см2, дозы лекарственного средства 5 мг/кг и DLI 1 минута вызывает полную хориоидальную окклюзию, связанную со структурными повреждениями вышележащего RPE и сетчатки в 100% обработанных глаз (фиг.9А-9D). Более слабые неокклюзивные параметры (25 Дж/см2, доза лекарственного средства 5 мг/кг и DLI 10 минут) не вызывают ни окклюзии хориокапилляров, ни повреждений сетчатки. PDT с вертепорфином с использованием дозы лекарственного средства 12 мг/м2 при флюенсе 100 Дж/см2 и DLI 15 минут вызывает окклюзивные события (наблюдаемые методом FA) в 89% глаз и гистологическое повреждение вышележащей сетчатки и слоя RPE во всех глазах. Более слабые неокклюзивные параметры PDT с использованием дозы лекарственного средства 3 мг/м2, флюенса 10 Дж/см2 и DLI 5 минут не вызывают какой-либо окклюзии хориокапилляров по FA. Однако в глазах, обработанных таким образом, по гистологии наблюдают определенные структурные повреждения сетчатки и тканей собственно сосудистой оболочки. Подобно вертепорфину, PDT с WST11 вызывает временную окклюзию хориокапилляров, наблюдаемую до одной недели после обработки. В отличие от вертепорфина, параметры PDT с WST11, не вызывающей окклюзии сосудов, не вызывают структурного повреждения RPE или сетчатки. Таким образом, несмотря на ее способность индуцировать закупорку сосудов, PDT с WST11 не вызывает повреждения RPE и вышележащей сетчатки, когда не происходит окклюзии хориокапилляров. Преимущества приведенных характеристик показывают, что WST11 является подходящим кандидатом для лечения CNV методом PDT при связанной с возрастом дегенерации желтого пятна.
Для гистологии энуклеированные глаза иссекают под бинокулярным микроскопом. Используют 4-мм дерматом для иссечения обработанных зон на всю толщину. Полученные ткани фиксируют в глутаровом альдегиде, обрабатывают в какодилатном буфере и заделывают в пластик. Полутонкие срезы получают с использованием микротома и контрастного окрашивания гематоксилином-эозином. Полученные срезы анализируют с использованием фазово-контрастной микроскопии. Специфические участки, представляющие интерес, затем обрабатывают для ТЕМ. Ультратонкие срезы получают с использованием ультрамикротома и контрастного окрашивания уранилацетатом.
Пример 19.
Получение палладий-31оксо-15-метоксикарбонилметилродобактериохлорин-131, 173-ди (3-пропионил) амида (соединение 17)
Pd-Bpheide-сульфо-NHS (соединение 6, 10 мг) вводят во взаимодействие с трет-бутиловым эфиром β-аланина (60 мг) в ацетонитриле (10 мл) при кипячении с обратным холодильником в атмосфере Ar в течение 1 часа. Полученный диамид трет-бутилового эфира β-аланина очищают на колонке с диоксидом кремния с помощью смеси хлороформ-ацетон (5:1, об.). После удаления защитной группы 5% трифторуксусной кислотой в хлороформе в течение 10 мин получают Pd-бикарбоксилатное производное 17 с выходом 84%. Синтез и структура 17 отображены на схеме 2.
ESI-MC(-):895 (M+Na-H), 873 (М-Н) m/z.
Пример 20.
Получение дикалиевой соли палладий-31ксо-15-метоксикарбонилметилродобактериохлорин-131, 173-ди(3-пропионил)амида (соединение 18)
Соединение 17 (10 мг), полученное выше в примере 19, активируют сульфо-NHS (60 мг) и 1-(3-диметиламинопропил)-3-этилкарбодиимидом (EDC) (45 мг) в ДМСО (3 мл), как описано в примере 6, и затем вводят во взаимодействие в течение ночи с 20 мг таурина в 1 мл 0,1 М К-фосфатного буфера, рН 8,0. Продукт реакции - соединение 18 очищают ВЭЖХ. Синтез и структура 18 отображены на схеме 2.
Выход 81%. ESI-MC(-):1086 (M-2K) m/z.
Пример 21.
Получение дикалиевой соли палладий-31оксо-15-метоксикарбонилметилродобактериохлорин-131, 173-ди(3-пропионил)амида (соединение 19)
Соединение 17 (10 мг), полученное выше в примере 19, активируют сульфо-NHS (60 мг) и EDC (45 мг) в ДМСО (3 мл), как описано в примере 6, и затем вводят во взаимодействие в течение ночи с 20 мг 3-амино-1-пропанфосфорной кислоты в 1 мл 0, 1 М К-фосфатного буфера, рН 8,0. Продукт реакции - соединение 19 очищают ВЭЖХ. Синтез и структура 19 отображены на схеме 2.
Выход 77%. ESI-MC(-):1116 (М-2К).
Пример 22.
Получение дикалиевой соли палладий-31оксо-15-метоксикарбонилметилродобактериохлорин-131, l73-ди(3-пропионил)амида (соединение 20)
Соединение 17 (10 мг) из примера 19 обрабатывают тионилхлоридом (2 мл). Полученный раствор сушат выпариванием после 15-мин перемешивания при комнатной температуре, и получают активированное производное хлорангидрида. Добавление NaSH (20 мг) в ДМСО приводит к продукту реакции - соединению 20, содержащему тиокарбоксильные остатки (см. схему 2). Продукт реакции очищают ВЭЖХ.
ESI-MC(-):927(M+Na-H), 905 (М-Н) m/z.
Пример 23.
Получение 31 гидрокси-31дезоксобактериофеофорбида а (соединение 21)
Получение соединения 21 отображено на схеме 3.
К Bpheid (соединение 2) (30 мг) в хлороформе (3 мл) при 5°С добавляют борогидрид натрия (20 мг) в этаноле (0,5 мл). Реакционную смесь перемешивают, и реакцию контролируют ТСХ на диоксиде кремния. По завершении реакции смесь промывают смесью хлороформ/вода. Собранный органический слой промывают дважды водой, сушат над сульфатом натрия, фильтруют и упаривают. Затем продукт реакции, соединение 21 (31-гидрокси-31-дезоксо-Bpheid), очищают на колонке с диоксидом кремния с помощью смеси хлороформ-метанол.
Спектр поглощения в хлороформе (относ. погл.) 727 (1,00), 663 (0,30), 602 (0,17), 518 (0,60), 486 (0,17), 356 (2,02) нм.
Металлированные производные соединения 21, в которых центральным атомом металла является атом Pd, Cu, Zn, Ni, Co, Pt, Fe или Mn, получают аналогичными процедурами исходя из соответствующего M-Bpheid. С другой стороны, в особенности что касается Mn-31-гидрокси-31-дезоксобактериофеофорбида а, соответствующее металлированное производное получают, внедряя атом металла в названное в заголовке соединение с использованием известных процедур металлирования, например, описанных в WO 9719081 и WO 0033833.
Пример 24.
Получение 31-(пирилин-4-илокси)-31-дезоксобактериофеофорбида а (соединение 22)
Для получения соединения 22 из Bpheid (соединение 2), карбоксигруппу в положении 173 сначала защищают этерификацией (2,6-дихлор-4-метоксифенил)(2,4-дихлорфенил)метанолом (DDM) согласно процедуре, описанной в Kurosu et al. (Kurosu M., Biswas К., Narayanasami P. and Crick B.C., Acid- and Base-Stable Esters: A New Protecting Group for Carboxilyc Acids (2007), Synthesis, pp.2513-2516). Затем положение 31 активируют трифторуксусным ангидридом. Итак, сначала синтезируют 173-защищенные промежуточные соединения 23 и 24 и 173-защищенное 31-активированное промежуточное соединение 25, как отображено на схеме 3, следующим образом.
(i) Синтез 173-[(2,6-дихлор-4-метоксифенил)(2,4-дихлорфенил)]метилового эфира бактериофеофорбида а (промежуточное соединение 23)
Bpheid 2 (30 мг) смешивают с (2,6-дихлор-4-метоксифенил) (2,4-дихлорфенил)метанолом (DDM, 90 мг), дициклокарбодиимидом (DCC, 90 мг) и диметиламинопиридином (DMAP, 100 мг) в хлороформе (10 мл) в атмосфере азота. После 3 час при комнатной температуре реакцию гасят, встряхивая смесь с 0,5 N HCl (10 мл). Смесь нейтрализуют водным раствором NaHCO3, сушат над сульфатом натрия и упаривают. Очистка хроматографией на силикагеле дает эфир DDM -промежуточное соединение 23 с выходом 91%. ESI-MC(+):962 (M+Na) m/z.
(ii) Синтез 173-[(2,6-дихлор-4-метоксифенил) (2,4-дихлорфенил)]метилового эфира 31-гидрокси-31-дезоксобактериофеофорбида а (промежуточное соединение 24}
К 23 (30 мг) в хлороформе (3 мл) при 5°С добавляют борогидрид натрия (20 мг) в этаноле (0,5 мл). Реакционную смесь перемешивают, и реакцию контролируют ТСХ на диоксиде кремния. По завершении реакции смесь промывают смесью хлороформ/вода. Собранный органический слой промывают дважды водой, сушат над сульфатом натрия, фильтруют и упаривают. Затем продукт реакции - промежуточное соединение 24 очищают на колонке с силикагелем с помощью смеси хлороформ-метанол.
(iii) Синтез 173-[(2,6-дихлор-4-метоксифенил)(2,4-дихлорфенил)]метилового эфира 31-трифторацетокси-31-дезоксобактериофеофорбида а (промежуточное соединение 25)
К 24 (5 мг) добавляют для растворения трифторуксусный ангидрид (1 мл). Сразу же после растворения полученный раствор сушат выпариванием, и получают активированное промежуточное 31-трифторацетоксисоединение 25.
(iv) Синтез соединения 22
4-Пиридилкарбинол (20 мг, Aldrich) в ДМФА (1 мл) добавляют к высушенному промежуточному соединению 25 (5 мг). Смесь перемешивают в атмосфере аргона при комнатной температуре. Через 1 час реакцию прекращают, обрабатывая смесь хлороформом и водой. Органический слой промывают дважды водой и затем упаривают. Конечный продукт 22 получают, удаляя защитную группу (удаление DDM из положения 173) 30% ТФК в хлороформе (1 час при комнатной температуре и в атмосфере аргона), с последующей очисткой на колонке с силикагелем с помощью смеси хлороформ-метанол (9:1, об.).
Спектр поглощения в хлороформе (относ. погл.) 723 (1,00), 604 (0,13), 516 (0,66), 486 (0,19), 354 (2,09) нм. ESI-MC(+): 705 (М+2Н) m/z.
Металлированные производные соединения 22, в которых центральным атомом металла является атом Pd, Cu, Zn, Ni, Co, Pt, Fe или Mn, получают или аналогичными процедурами исходя из соответствующего M-Bpheid, или металлированием деметаллированного указанного в заголовке соединения с использованием известных процедур, например, раскрытых в WO 9719081 и WO 0033833.
Пример 25.
Получение 31-бром-31-дезоксобактериофеофорбида а (соединение 26)
Соединение 21, полученное выше в примере 23, растворяют в смеси 33% HBr/уксусная кислота (Fluka, Швейцария). Полученный раствор сушат выпариванием сразу же после растворения и затем снова растворяют в хлороформе с молекулярными ситами (свежевысушенными, размер пор 4 Å), и получают 31-бромпроизводное 26. Синтез 26 отображен на схеме 3.
Металлированные производные соединения 26, в которых центральным атомом металла является атом Pd, Cu, Zn, Ni, Со, Pt, Fe или Mn, получают или аналогичными процедурами исходя из соответствующего М-31-гидрокси-31-дезоксобактериофеофорбида а, который, в свою очередь, можно получить так, как описано выше в примере 23, или металлированием деметаллированного названного в заголовке соединения с использованием известных процедур, например, раскрытых в WO 9719081 и WO 0033833.
Пример 26.
Получение 3-винил-3-деацетилбактериофеофорбида а (соединение 27)
Соединение 26 (10 мг) из примера 25 кипятят с обратным холодильником в толуоле (4 мл) в присутствии следового количества трифторуксусной кислоты (10 мл), и получают 3-виниловое производное Bpheid 27 (см. схему 3).
Спектр поглощения в хлороформе (относ. погл.) 732 (1,00), 600 (0,11), 527 (0,60), 354 (1,85) нм. ESI-MC(+):594 (M) m/z.
Металлированные производные соединения 27, в которых центральным атомом металла является атом Pd, Cu, Zn, Ni, Co, Pt, Fe или Mn, получают или аналогичными процедурами исходя из соответствующего М-31-бром-31-дезоксобактериофеофорбида а, который, в свою очередь, можно получить так, как описано выше в примере 25, или металлированием деметаллированного указанного в заголовке соединения с использованием известных процедур, например, раскрытых в WO 9719081 и WO 0033833.
Пример 27.
Получение 31-(2-гидроксиэтокси)-31-дезоксобактериофеофорбида а (соединение 28)
Активированное промежуточное соединение 25 (~10 мг), полученное выше в примере 25(iii), вводят во взаимодействие с этиленгликолем (0,2 мл) в хлороформе в течение 1 часа при комнатной температуре. Продукт реакции простой 31-гидроксиэтиловый эфир Bpheid 28 выделяют, удаляя защитную группу 30% ТФК в хлороформе (1 час при комнатной температуре и в атмосфере аргона) и очисткой на колонке с диоксидом кремния (см. схему 3).
ESI-MC(+):678 (M+Na) m/z.
Металлированные производные соединения 28, в которых центральным атомом металла является атом Pd, Cu, Zn, Ni, Co, Pt, Fe или Mn, получают или аналогичными процедурами исходя из соответствующего M-Bpheid с получением металлированного промежуточного соединения 25, или металлированием деметаллированного указанного в заголовке соединения с использованием известных процедур, например, раскрытых в WO 9719081 и WO 0033833.
Пример 28.
Получение 31-(2,2,2-трифторэтокси)-31-дезоксобактериофеофорбида а (соединение 29)
Активированное 25 (~10 г) вводят во взаимодействие с трифторэтанолом (0,2 мл) в хлороформе в течение 1 часа при комнатной температуре. Продукт реакции простой 31-трифторэтиловый эфир Bpheid 29 получают после удаления защитной группы 30% ТФК в хлороформе (1 час при комнатной температуре и в атмосфере аргона) и очистки на колонке с диоксидом кремния (схема 3).
ESI-MC(+):716 (M+Na) m/z.
Металлированные производные соединения 29, в которых центральным атомом металла является атом Pd, Cu, Zn, Ni, Со, Pt, Fe или Mn, получают или аналогичными процедурами исходя из соответствующего M-Bpheid с получением металлированного промежуточного соединения 25, или металлированием деметаллированного указанного в заголовке соединения с использованием известных процедур, например, раскрытых в WO 9719081 и WO 0033833.
Пример 29.
Получение 31-(2-меркаптоэтилсульфонил)-31-дезоксобактериофеофорбида а (соединение 30)
Активированное промежуточное соединение 25 (~10 г), полученное выше в примере 25(iii), вводят во взаимодействие с дитиогликолем (0,2 мл) в хлороформе в течение 1 часа при комнатной температуре. Продукт реакции простой 31-меркаптоэтиловый тиоэфир Bpheid 30 получают удалением защитной группы 30% ТФК в хлороформе (1 час при комнатной температуре и в атмосфере аргона) и очисткой на колонке с диоксидом кремния (схема 3).
ESI-MC(+):710 (M+Na) m/z.
Металлированные производные соединения 30, в которых центральным атомом металла является атом Pd, Cu, Zn, Ni, Со, Pt, Fe или Mn, получают или аналогичными процедурами исходя из соответствующего M-Bpheid с получением металлированного промежуточного соединения 25, или металлированием деметаллированного указанного в заголовке соединения с использованием известных процедур, например, раскрытых в WO 9719081 и WO 0033833.
Пример 30.
Получение 31-(2-гидроксиэтиламино)-31-дезоксобактериофеофорбида а (соединение 31)
Активированное 25 (~10 г) вводят во взаимодействие с 2-аминоэтанолом (0,2 мл) в хлороформе в течение 1 часа при комнатной температуре. После удаления защитной группы 30% ТФК в хлороформе (1 час при комнатной температуре и в атмосфере аргона) и очистки на колонке с диоксидом кремния получают продукт реакции 31-гидроксиэтиламин-Bpheid, 31 (схема 3).
ESI-MC(+):678 (M+Na) m/z.
Металлированные производные соединения 31, в которых центральным атомом металла является атом Pd, Cu, Zn, Ni, Co, Pt, Fe или Mn, получают или аналогичными процедурами исходя из соответствующего M-Bpheid с получением металлированного промежуточного соединения 25, или металлированием деметаллированного указанного в заголовке соединения с использованием известных процедур, например, раскрытых в WO 9719081 и WO 0033833.
Пример 31.
Получение дикалиевой соли кобальт (III)-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида (соединение 32)
Названное в заголовке соединение получают внедрением кобальта (III) в соединение 5 (полученное согласно примеру 2 описания) с использованием ацетата Со в уксусной кислоте (аналогично синтезу в WO 9719081; US 6333319).
Пятьдесят (50) мг соединения 5 в 10 мл ДМФА перемешивают с 220 мг ацетата кадмия и греют в атмосфере аргона при 110°С примерно 15 мин (образование комплекса Со. проверяют по сдвигу полосы перехода с поглощением Qx от 519 к 585 нм в ацетоне). Затем реакционную смесь охлаждают и упаривают. Сухой остаток снова растворяют в 15 мл ацетона и перемешивают с хлоридом кобальта(II) с образованием Со(III)-продукта 32. Ацетон выпаривают, и 32 дополнительно очищают ВЭЖХ.
Продукт характеризуют ESI-MC(-):791 (М-2К) m/z, и по его спектру поглощения в метаноле (относ. погл.):765 (1,00), 525 (0,36), 388 (0,50) и 334 (0,72) нм.
Пример 32.
Получение дикалиевой соли железо (III) -31-оксо-31-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида (соединение 33)
Соединение 5 (10 мг) греют при 105°С со свежеприготовленным раствором ацетата железа (II) в уксусной кислоте (2 мл) в атмосфере аргона в течение 2,5 час. По завершении реакции добавляют дубильную кислоту (200 мг) в воде (2 мл) для захвата избыточных ионов железа. Реакционную смесь центрифугируют с мембраной Omega (10K, Macrosep, Pall, США; 60 мин, 5000 g). Полученный фильтрат упаривают, снова растворяют в воде и хроматографируют ВЭЖХ, как описано в примере 1 описания, с использованием в качестве элюента смеси с градиентом 15-25% ацетонитрила в воде.
ESI-MC(-):1592 (Мµ-оксо-4К), 788 (М-2К) m/z. Спектр поглощения в метаноле: 825, 592, 390, 345 нм (µ-оксодимер); 711, 520, 335, 390 (форма CI).
Пример 33.
Получение никель(II)-бактериофеофорбида а (соединение 34)
К Bpheid 2 (20 мг) в ДМФА (8 мл) добавляют ацетат кадмия (85 мг), и реакционную смесь нагревают до 110°С в атмосфере аргона. Как только температура достигнет 110°С, развитие реакции контролируют по спектрам (в ацетоне). По завершении реакции реакционную смесь охлаждают и переносят в делительную воронку с водой (100 мл) и хлороформом (100 мл). Продукт реакции Cd-Bpheid экстрагируют хлороформом (добавляют NaCl для улучшения разделения). Органическую фазу промывают схожим объемом воды, и затем хлороформ выпаривают. Промежуточное соединение продукт Cd-Bpheid растворяют в 100 мл ацетона, затем добавляют при перемешивании NiCl2 (60 мг), и смесь кипятят с обратным холодильником в атмосфере аргона. Спектры регистрируют каждые 20 минут до тех пор, пока реакция не завершится (пик при 777 нм, в целом ~120 минут). Ацетон выпаривают, твердый остаток снова растворяют в хлороформе, и продукт очищают на колонке с диоксидом кремния с элюентом, содержащим возрастающее количество метанола в хлороформе.
ESI-MC(+):667 (М+Н) m/z. Оптическое поглощение в ацетоне: 777, 531, 390 и 335.
Пример 34.
Получение платина(II)-бактериофеофорбида а (соединение 35)
Bpheid a 2 (10 мг) кипятят с обратным холодильником с PtCl2COD (20 мг, COD-1, 5-циклооктадиан) в 1,4-диоксане (4 мл) в атмосфере аргона в течение 3 час, и затем реакционную смесь упаривают и хроматографируют на колонке с диоксидом кремния с помощью смеси хлороформ-метанол (8:2, об.). Очищенный продукт характеризуют ESI-MC(+):803 (М) m/z и спектром поглощения в ацетоне: 741, 523, 389 и 333 нм.
Пример 35.
Фототоксичность соединения 7
Фототоксичность 7 определяют в культивированных клетках меланомы M2R так, как описано в разделе "Биологический раздел. Материалы и методы (ii)" описания. Клетки инкубируют с возрастающими концентрациями 7 в течение 4 часов, промывают и освещают или держат в темноте.
Результаты показаны на фиг.10: освещенные клетки представлены заштрихованными квадратами, а темновые контрольные клетки не заштрихованными квадратами. Точки являются средними из трех повторов. Как можно видеть, фототоксичность 7 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале. LD50 пигмента составляет ~0,7 мкМ.
Пример 36.
Фототоксичность соединения 9
Фототоксичность 9 оценивают в культивированных клетках меланомы M2R, и результаты получают и представляют так, как описано выше в примере 35 для соединения 7.
Результаты показаны на фиг.11 (освещенные - светлые квадраты; темновые контрольные - темные квадраты). Точки являются средними из трех повторов. Как можно видеть, фототоксичность 9 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 100 мкМ). LD50 пигмента составляет ~8 мкМ.
Пример 37.
Фототоксичность соединения 14
Фототоксичность 14 оценивают в культивированных клетках меланомы M2R, и результаты получают и представляют так, как описано выше для соединения 7.
Результаты показаны на фиг.12 (освещенные - светлые квадраты; темновые контрольные - темные квадраты). Точки являются средними из трех повторов. Как можно видеть, фототоксичность 14 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 100 мкМ). LD50 пигмента составляет ~8-9 мкМ.
Пример 38.
Фототоксичность соединения 15
Фототоксичность 15 оценивают в культивированных клетках меланомы M2R, и результаты получают и представляют так, как описано выше для соединения 7.
Как видно на фиг.13, фототоксичность 15 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). LD50 пигмента составляет ~8 мкМ.
Пример 39.
Фототоксичность соединения 16
Фототоксичность 16 оценивают в культивированных клетках меланомы M2R, и результаты получают и представляют так, как описано выше для соединения 7.
Как видно на фиг.14, фототоксичность 16 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). LD50 пигмента составляет - 8-9 мкМ.
Пример 40.
Фототоксичность соединения 17
Фототоксичность 17 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше в примере 35 для соединения 7.
Как видно на фиг.15, фототоксичность 17 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). LD50 пигмента составляет -8-9 мкМ.
Пример 41.
Фототоксичность соединения 18
Фототоксичность 18 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения J.
Как видно на фиг.16, фототоксичность 18 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 100 мкМ). LD50 пигмента составляет ~4 мкМ.
Пример 42.
Фототоксичность соединения 19
Фототоксичность 19 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения J.
Как видно на фиг.17, фототоксичность 19 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 100 мкМ). LD50 пигмента составляет ~2 мкМ.
Пример 43.
Фототоксичность соединения 20
Фототоксичность 20 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.18, фототоксичность 20 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). LD50 пигмента составляет ~2 мкМ.
Пример 44.
Фототоксичность соединения 21
Фототоксичность 21 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.19, фототоксичность 21 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). Соединение 21 является высокофототоксичным, показывая LD50 ~0,2 мкМ.
Пример 45.
Фототоксичность соединения 22
Фототоксичность 22 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.20, соединение 22 является высокофототоксичным, показывая LD50 ~0,2 мкМ. Фототоксичность 22 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ).
Пример 46.
Фототоксичность соединения 27
Фототоксичность 27 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.21, фототоксичность 27 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). Данный пигмент является высокофототоксичным, показывая LD50 ~0,1 мкМ.
Пример 47.
Фототоксичность соединения 28
Фототоксичность 28 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.22, фототоксичность 28 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). Данный пигмент является особенно фототоксичным, показывая LD50 ~0,08 мкМ.
Пример 48.
Фототоксичность соединения 29
Фототоксичность 29 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.23, фототоксичность 29 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). Данный пигмент является особенно фототоксичным, показывая LD50 ~0,08 мкМ.
Пример 49.
Фототоксичность соединения 30
Фототоксичность 30 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.24, фототоксичность 30 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). Данный пигмент является особенно фототоксичным, показывая LD50 ~0,07 мкМ.
Пример 50.
Фототоксичность соединения 31
Фототоксичность 31 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения J.
Как видно на фиг.25, фототоксичность 31 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). Данный пигмент является высокофототоксичным, показывая LD50 ~0,09 мкМ.
Пример 51.
Фототоксичность соединения 32
Фототоксичность 32 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.26, фототоксичность 32 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). LD50 пигмента составляет ~3-4 мкМ.
Пример 52.
Фототоксичность соединения 33
Фототоксичность 33 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.27, фототоксичность 33 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). LD50 пигмента составляет ~1-2 мкМ.
Пример 53.
Фототоксичность соединения 34
Фототоксичность 34 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.28, фототоксичность 34 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). Данный пигмент является высокофототоксичным, показывая LD50 ~0,09 мкМ.
Пример 55.
Фототоксичность соединения 35
Фототоксичность 35 оценивают в культивированных клетках меланомы M2R и представляют так, как описано выше для соединения 7.
Как видно на фиг.29, фототоксичность 35 зависит от концентрации и освещенности, без какой-либо темновой токсичности в испытываемом интервале (до 10 мкМ). Данный пигмент является высокофототоксичным, показывая LD50 ~0,09 мкМ.
Пример 56.
Фотодинамическая обработка ксенотрансплантатов меланомы M2R у голых мышей CD1 с различными анионными производными Bchi
Протокол фотодинамической обработки с различными производными по изобретению осуществляют на основе раскрытия в разделе "Материалы и методы (vi)" в описании. Коротко, мышам с ксенотрансплантатами меланомы M2R инъецируют внутривенно анионное производное Bchi (10 мг.кг-1), и освещают их в течение 10 мин светом лазера/лампы. Результаты суммируют в таблице 5, где "Т" обозначает группу обработки, "U" представляет собой контроль без обработки, "D" представляет собой темновой контроль, и "L" обозначает световой контроль.
Результаты PTD in vivo, полученные для анионных производных Bchi
b Ксеноновая лампа LS3-PDT (Biospec, Россия) со спектральным окном 650-800 нм и гидрофильтром; с дозой светового излучения 360 Дж/см2.
(+) - некроз и полное возобновление роста; (++) некроз и возобновление роста >50%; (+++) - некроз и возобновление роста <50%.
Как видно из таблицы 5, анионные производные 7, 14, 15, IP-22, 27-29, 34 и 35 являются высокоэффективными в качестве средств для PDT при обработке ксенотрансплантатов меланомы M2R. Указанные пигменты улучшают показатель эффективности лечения более чем на 50%.
Пример 57.
Биораспределение соединений 18 и 19
Биораспределение in vivo определяют так, как описано в разделе "Материалы и методы (v) " описания. Коротко, пигмент 18 или 19 (6 мг/кг) инъецируют крысам в хвостовую вену. Крыс умерщвляют в указанное время, и образцы указанных органов или тканей помещают и взвешивают и сразу же замораживают на сухом льду. Для проверки каждый образец оттаивают и гомогенизируют (1:10, мас./об.), аликвоты гомогената лиофилизуют, и затем к каждому сухому образцу добавляют HNO3 (70%, TraceSelect, Fluka) и инкубируют в течение 1 часа при 90°С. Концентрации палладия определяют при помощи ICP-MS. Определяют фон для каждого органа/ткани на идентичных образцах, взятых от необработанных мышей, и соответственно вычитают эти величины.
Биораспределение, полученное для соединений 18 и 19 после болюсной инъекции крысе, показано на фиг.30 и 31, соответственно (величина в каждый момент времени представляет собой среднее измерений, взятых для 2-3 животных). Результаты сравнивают с биораспределением соединения 4, описанным в примере 15 и на фиг.6. Соединение 18 выводится подобно соединению 4, вероятно, отражая сходство молекулярных структур (сульфонат). Так, в большинстве органов крысы уровни пигмента высокие сразу же после инъекции и падают почти до фоновых уровней в пределах 20-30 мин, подобно скоростям его выведения из крови (фиг.30). Таким образом, скорость клиренса 18 из крови достаточно высокая (t1/2 ~20 мин). Некоторые уровни пигмента в крови являются результатом захвата пигмента сосудистой сетью органа, что видно в селезенке, легких и сердце. Результаты также предполагают, что диффузия пигмента в органы является незначительной, в то время как имеется тенденция накапливания его в опухоли с очень невысокой скоростью клиренса, что делает его представляющим интерес кандидатом для дальнейшего исследования.
Соединение 19, которое содержит две фосфоновые группы, выводится из крови со значительно меньшей скоростью (фиг.31).
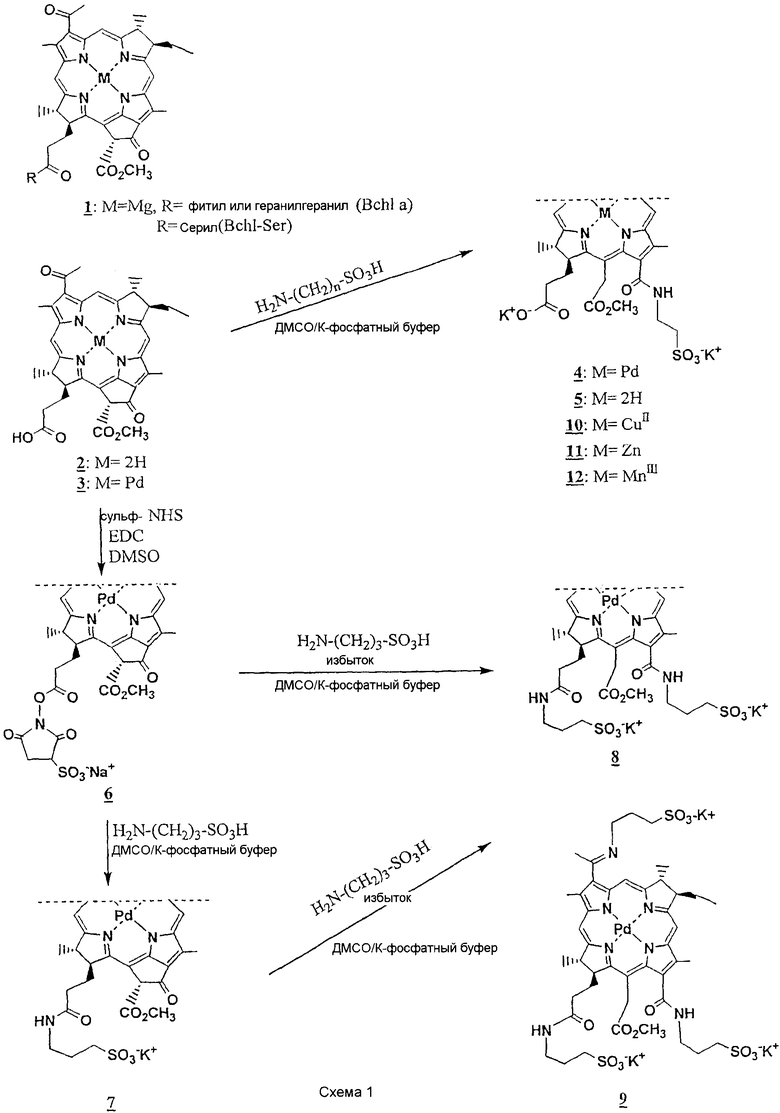
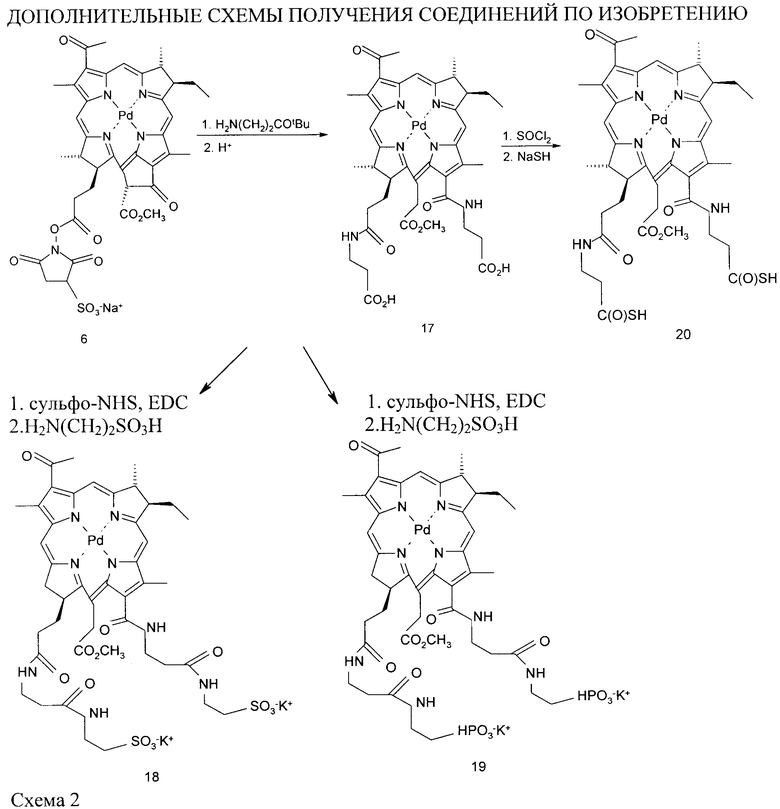
ССЫЛКИ
Chen О, Huang Z, Luck D, Beckers J, Brun PH, Wilson ВС, Scherz A, Salomon Y, Hetzel FW. (2002) Preclinical studies in normal canine prostate of a novel palladium-bacteriopheophorbide (WST09) photosensitizer for photodynamic therapy of prostate cancers. Photochem Photobiol. 76(4): 438-45.
Koudinova NV, Pinthus JH, Brandis A, Bremier O, Bendel P, Ramon J, Eshhar Z, Scherz A, Salomon Y. (2003) Photodynamic therapy with Pd-Bacteriopheophorbide (TOOKAD): successful in vivo treatment of human prostatic small cell carcinoma xenografts. Lit J Cancer 104(6): 782-9.
Rosenbach-Belkin, V., Chen, L., Fiedor, L., Tregub, I., Pavlotsky, P., Brumfeld, V., Salomon, Y., Scherz, A. (1996) Serine conjugates of chlorophyll and bacteriochlorophyll: Photocytotoxicity in vitro and tissue distribution in mice bearing melanoma tumors. Photochem. Photobiol. 64: 174-181.
Schreiber S, Gross S, Brandis A, Harmelin A, Rosenbach-Belkin V, Scherz A, Salomon Y. (2002) Local photodynamic therapy (PDT) of rat C6 glioma xenografts with Pd-bacteriopheophorbide leads to decreased metastases and increase of animal cure compared with surgery, bit J Cancer. 99(2): 279-85.
Zilberstein, J., Schreiber, S., Bloemers, MCWM, Bendel, P., Neeman, M., Schechtman, E., Kohen, F., Scherz, A. Salomon, Y. (2001) Antivascular treatment of solid melanoma tumors with bacteriochlorophyll-serine-based photodynamic therapy. Photochem. Photobiol. 73: 257-266.
Zilberstein, J., Bromberg, A., Franz, A., RosenbachBelkin, V., Kritzmann, A., Pfefermann, R., Salomon, Y., Scherz, A. (1997) Light-dependent oxygen consumption in bacteriochlorophyll-serine-treated melanoma tumors: On-line determination using a tissue-inserted oxygen microsensor. Photochem. Photobiol. 65: 1012-1019.
Изобретение относится к области биотехнологии, конкретно к производным бактериохлорофилла, и может быть использовано в медицинских и диагностических целях. Анионсодержащие водорастворимые тетрациклические и пентациклические производные бактериохлорофилла (Bchl) содержат одну, две или три отрицательно заряженные группы и/или кислотные группы, которые превращаются в отрицательно заряженные группы при физиологическом рН. Полученные производные используют для фотодинамической терапии и для диагностики опухолей, а также для киллинга клеток или инфекционных агентов. Изобретение позволяет повысить избирательность связывания с мишенью в фотодинамической терапии и диагностике. 7 н. и 18 з.п. ф-лы, 43 ил., 5 табл.
1. Производное бактериохлорофилла, являющееся высоко водорастворимым, содержащее по меньшей мере одну, предпочтительно две или три отрицательно заряженные группы, выбранные из COO-, COS-, SO3 - и/или -РО3 2-, и/или кислотные группы, которые превращаются в отрицательно заряженные группы при физиологическом рН, выбранные из СООН, COSH, SO3Н и/или РО3Н2, формулы I или II
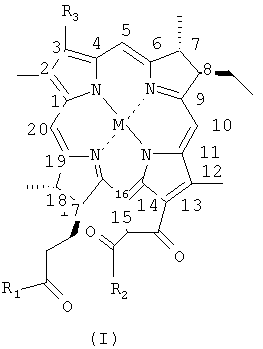

где М представляет 2Н или атом металла, выбранный из двухвалентных Pd, Pt, Со, Ni, Cu, Zn и Mn и трехвалентных Fe и Mn;
R1, R2 и R4, каждый независимо, представляет собой Y-R5;
Y представляет собой О, S или -NR6-;
R3 выбирают из -СН=СН2, -С(=O)-СН3, -С(СН3)=NR7, -СН(СН3)-OR7, -CH(CH2)-SR7, -CH(CH3)-NR7R'7, -С(СН3)Hal;
R5, R6, R7 и R'7, каждый независимо, представляет собой Н или выбран из группы, состоящей из
(a) углеводородного радикала C1-C25, необязательно содержащего один или несколько гетероатомов, карбоциклические или гетероциклические группы, и/или необязательно замещенного одной или несколькими функциональными группами, выбранными из группы, состоящей из галогена, ОН, SH, отрицательно заряженной группы и кислотной группы, которая превращается в отрицательно заряженную группу при физиологическом рН;
(b) остатка аминокислоты, пептида или белка; и
(c) когда Y представляет собой О или S, R5 также может представлять собой R8 +;
m равен 0 или 1; и
R8 + представляет собой Н+ или катион;
при условии, что
(i) по меньшей мере один, предпочтительно два, из R5, R6, R7 и R'7 представляют собой углеводородную цепь, имеющую значения, указанные в (а), замещенную отрицательно заряженной группой или кислотной группой, которая превращается в отрицательно заряженную группу при физиологическом рН; или
(ii) по меньшей мере один, предпочтительно два, из R1, R2 и R4 представляют собой ОН, SH, O-R8 +или S-R8 +; или
(iii) по меньшей мере один из R1, R2 и R4 представляет собой ОН, SH, O-R8 + или S-R8 +, и по меньшей мере один из R5, R6, R7 и R'7 представляет собой углеводородную цепь, замещенную отрицательно заряженной группой или кислотной группой, которая превращается в отрицательно заряженную группу при физиологическом рН; или
(iv) по меньшей мере один из R1, R2 и R4 представляет собой ОН, SH, O-R8 + или S-R8 +, и по меньшей мере один из R5, R6, R7 и R'7 представляет собой остаток аминокислоты, пептида или белка; или
(v) по меньшей мере один из R5, R6, R7 и R'7 представляет собой углеводородную цепь, замещенную отрицательно заряженной группой или кислотной группой, которая превращается в отрицательно заряженную группу при физиологическом рН, и по меньшей мере один из R5, R6, R7 и R'7 представляет собой остаток аминокислоты, пептида или белка;
где указанные отрицательно заряженная группа и кислотная группа, которая превращается в отрицательно заряженную группу при физиологическом рН, имеют значения, указанные выше;
за исключением соединений формулы I, где М имеет указанные значения, R3 представляет собой -С(=O)СН3, R1 представляет собой ОН или OR8 + и R2 представляет собой -ОСН3, и соединения формулы II, где М представляет собой 2Н, R3 представляет собой -С(=O)СН3, R1, R2 и R4 представляют собой ОН, и m равен 0 или 1.
2. Производное бактериохлорофилла по п.1, содержащее две отрицательно заряженные группы.
3. Производное бактериохлорофилла по п.1, содержащее три отрицательно заряженные группы.
4. Производное бактериохлорофилла формулы I или II по п.1, где R1 представляет собой Y-R5, Y представляет собой О, S или NH; и R5 представляет собой углеводородную цепь, замещенную функциональными группами, выбранными из ОН, SH, SO3Н, СООН, COSH, РО3Н2.
5. Производное бактериохлорофилла формулы I или II по п.1, где R5 представляет собой остаток аминокислоты, пептида или белка.
6. Производное бактериохлорофилла формулы I или II по п.1, содержащее центральный атом металла Pd.
7. Производное бактериохлорофилла формулы I по п.1, где М представляет собой Pd или 2Н;
R1 представляет собой -NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-COO-R8 +, -NH- (CH2)n-РО3 2-(R8 +)2;
R2 представляет собой метокси;
R3 представляет собой С(=O)-СН3, -СН=СН2, -СН(СН3)Hal, -СН(СН3)-ОН, -СН(СН3)-O-(СН2)n-пиридин, -СН(СН3)-O-(СН2)n-ОН, -СН(СН3)-O-(СН3)n-SH, -СН(СН3)-O-(СН2)n-CF3 или -СН(СН3)-NH-(СН2)n-ОН;
R8 + представляет собой одновалентный катион, такой как К+, Na+, Li+, NH4 +; и
n равен целому числу от 1 до 10, предпочтительно 2 или 3.
8. Производное бактериохлорофилла формулы II по п.1, где М представляет 2Н, двухвалентный Pd, Cu, Ni, Pt, Co или Zn или трехвалентный Mn или Fe;
R1 представляет собой -O-R8 +, -NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-COO-R8 +, -NH-(CH2)n-PO3 2-(R8 +)2, -NH-(CH2)n-COS-R8 +, -NH-(CH2)n-CO-NH-(CH2)n-COO-R8 +, -NH-(CH2)n-CO-NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-CO-NH-(CH2)n-PO3 2-(R8 +)2 или Y-R5, где Y представляет собой О, S или NH, и R5 представляет собой остаток аминокислоты, пептида или белка;
R2 представляет собой (С1-С6)-алкокси, выбранный из числа метокси, этокси, пропокси, бутокси, предпочтительно метокси;
R3 представляет собой -С(=O)-СН3, -C(CH3)=N-(CH2)n-SO3 -R8 +, -C(CH3)=N-(CH2)n-COO-R8 +,-C(CH3)=N-(CH2)n-PO3 2-(R8 +)2;
R4 представляет собой -NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-COO-R8 +, -NH-(CH2)n-PO3 2-(R8 +)2, -NH-(CH2)n-COS-R8 +, -NH-(CH2)n-CO-NH-(CH2)n-COO-R8 +, -NH-(CH2)n-CO-NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-CO-NH-(CH2)n-PO3 2-(R8 +)2;
R8 + представляет собой одновалентный катион, выбранный из K+Na+, Li+, NH4 +, предпочтительнее К+; и
m равен 1, и n равен целому числу от 1 до 10, предпочтительно 2 или 3.
9. Производное бактериохлорофилла формулы II по п.8,
где М представляет собой двухвалентный Pd;
R1 представляет собой -O-R8 +, -NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-COO-R8 +, -NH-(CH2)n-PO3 2-(R8 +)2, -NH-(CH2)n-COS-R8 +, -NH-(CH2)n-CO-NH-(CH2)n-COO-R8 +, -NH-(CH2)n-CO-NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-CO-NH-(CH2)n-PO3 2-(R8 +)2 или Y-R5, где Y представляет собой О или NH, и R5 представляет собой остаток аминокислоты, пептида или белка;
R2 представляет собой (С1-С6)-алкокси, предпочтительно, метокси;
R3 представляет собой -С(=O)-СН3, -C(CH3)=N-(CH2)n-SO3 -R8 +, -C(CH3)=N-(CH2)n-COO-R8 +, -C(CH3)=N-(CH2)n-PO3 2-(R8 +)2;
R4 представляет собой -NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-COO-R8 +, -NH-(CH2)n-PO3 2-(R8 +)2, -NH-(CH2)n-COS-R8 +, -NH-(CH2)n-CO-NH-(CH2)n-COO-R8 +, -NH-(CH2)n-CO-NH-(CH2)n-SO3 -R8 +, -NH-(CH2)n-CO-NH-(CH2)n-PO3 2-(R8 +)2;
R8 + представляет собой одновалентный катион, предпочтительно К+;
m равен 1, и n равен 2 или 3.
10. Производное бактериохлорофилла формулы I по п.7, представляющее собой соединение, выбранное из группы, в которую входят калиевая соль 173-(3-сульфопропил)амида палладий-бактериофеофорбида а;
31-гидрокси-31-дезоксобактериофеофорбид а;
31-(пиридин-4-илметокси-31-дезоксобактериофеофорбид а;
31-бром-31-дезоксобактериофеофорбид а;
31-винил-3-деацетилбактериофеофорбид а;
31-(2-гидроксиэтокси)-31-дезоксобактериофеофорбид а;
31-(2,2,2-трифторэтокси-31-дезоксобактериофеофорбид а;
31-(2-меркаптоэтилсульфанил)-31-дезоксобактериофеофорбид а и
31-(2-гидроксиэтиламино)-31-дезоксобактериофеофорбид а.
11. Производное бактериохлорофилла формулы II по п.8, представляющее собой соединение, выбранное из группы, в которую входят дикалиевая соль палладий-31-оксо-15-метоксикарбонилметил-родобактериохлорин-13l-(2-сульфоэтил)амида;
дикалиевая соль 31-оксо-15-метоксикарбонилметил-родобактериохлорин-13l-(2-сульфоэтил)амида;
дикалиевая соль палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-13l, 171-ди(3-сульфопропил)амида;
трикалиевая соль палладий-31-(3-сульфопропилимино)-15-метокси-карбонилметилродобактериохлорин-131, 173-ди(3-сульфопропил)амида;
дикалиевая соль медь(II)-31-оксо-15-метоксикарбонил-метилродобактериохлорин-13l-(2-сульфоэтил)амида;
дикалиевая соль цинк-31-оксо-15-метоксикарбонил-метилродобактериохлорин-13l-(2-сульфоэтил)амида;
дикалиевая соль марганец(III)-31-оксо-15-метоксикарбонил-метилродобактериохлорин-131-(2-сульфоэтил)амида;
калиевая соль палладий-31-оксо-15-метоксикарбонил-метилродо-бактериохлорин-131-(2-сульфоэтил)амид-173-(N-иммуноглобулин G)амида;
дикалиевая соль палладий-31-оксо-15-метоксикарбонил-метилродобактериохлорин-13l-(2-карбоксиэтил)амида;
трикалиевая соль палладий-31-оксо-15-метоксикарбонил-метилродобактериохлорин-131-(3-фосфопропил)амида;
трикалиевая соль палладий-31-(сульфопропиламино)-15-метокси-карбонилметилродобактериохлорин-131, 173-ди(3-сульфопропил)амида;
палладий-31-оксо-15-метоксикарбонил-метилродобактериохлорин-131, 173-ди(3-пропионил)амид;
дикалиевая соль палладий-31-оксо-15-метоксикарбонилметил-родобактериохлорин-131, 173-ди[2-(3-пропиониламино)сульфоэтил]амида;
дикалиевая соль палладий-31-оксо-15-метоксикарбонилметил-родобактериохлорин-131, 173-ди[2-(3-пропиониламино)сульфоэтил]амида;
дикалиевая соль палладий-31-оксо-15-метоксикарбонилметил-родобактериохлорин-131, 173-ди(3-тиопропионил)амида;
дикалиевая соль кобальт(III)-31-оксо-15-метоксикарбонилметил-родобактериохлорин-13l-(2-сульфоэтил)амида;
дикалиевая соль железо(III)-31-оксо-15-метоксикарбонилметил-родобактериохлорин-13l-(2-сульфоэтил)амида;
никель(II)бактериофеофорбид а и
платина(II)бактериофеофорбид а.
12. Производное бактериохлорофилла формулы II по п.11, представляющее собой дикалиевую соль палладий-31-оксо-15-метоксикарбонилметилродобактериохлорин-131-(2-сульфоэтил)амида.
13. Фармацевтическая композиция для фотодинамической терапии, содержащая эффективное количество производного бактериохлорофилла по любому из пп.1-12 и фармацевтически приемлемый носитель.
14. Фармацевтическая композиция по п.13, для фотодинамической терапии, имеющей целью сосуды.
15. Фармацевтическая композиция по п.13 или 14 для фотодинамической терапии опухолей, включая метастатические опухоли.
16. Фармацевтическая композиция по п.15 для фотодинамической терапии меланомы, рака толстой кишки, молочной железы, легких или предстательной железы.
17. Фармацевтическая композиция по п.13 или 14, для фотодинамической терапии связанной с возрастом дегенерации желтого пятна.
18. Фармацевтическая композиция по п.13 или 14, для фотодинамической терапии доброкачественной гипертрофии предстательной железы.
19. Композиция для диагностики опухолей, содержащая эффективное количество производного бактериохлорофилла по любому из пп.1-12 и фармацевтически приемлемый носитель.
20. Композиция для киллинга клеток или инфекционных факторов, содержащих бактерии и вирусы, содержащая эффективное количество производного бактериохлорофилла по любому из пп.1-12 и фармацевтически приемлемый носитель.
21. Композиция по п.20 для киллинга in vitro клеток или инфекционных факторов, содержащих бактерии и вирусы, в биологическом продукте после освещения указанного продукта.
22. Композиция по п.21, где указанный биологический продукт представляет собой кровь.
23. Способ фотодинамической терапии опухолей, включающий
(a) введение нуждающемуся в этом индивидууму соединения по любому из пп.1-12 и
(b) облучение локализации опухоли.
24. Способ фотодинамической терапии связанной с возрастом дегенерации желтого пятна, включающий,
(a) введение нуждающемуся в этом индивидууму соединения по любому из пп.1-12 и
(b) облучение локализации дегенерации желтого пятна.
25. Способ диагностики опухолей, включающий
(a) введение субъекту с подозрением на опухоль соединения по любому из пп.1-12 и
(b) облучение субъекта стандартными процедурами и измерение флуоресценции в подозрительной области, где более сильная флуоресценция указывает места локализации опухоли.
| US 6147195 A, 14.11.2000 | |||
| US 5955585 A, 21.09.1999 | |||
| WO 9719181, 29.05.1997 | |||
| Способ передачи на расстояние показаний измерительных приборов | 1932 |
|
SU33833A1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРАСТВОРИМЫХ ХЛОРИНОВ | 1998 |
|
RU2144538C1 |
Авторы
Даты
2009-04-27—Публикация
2003-11-17—Подача