Заявляемое изобретение относится к фармацевтике и медицине, конкретно к регенерирующему средству на основе коменовой кислоты и способу лечения хориоретинальных дистрофий с помощью этого средства.
Заявляемое изобретение может быть использовано для производства высокоэффективных синтетических не пептидной природы регенерирующих противовоспалительных препаратов, которые, в свою очередь, могут быть применены в медицине и ветеринарии для лечения хориоретинальных дистрофий различного генеза, в том числе туберкулезного характера.
Регенерирующие средства объединяют лекарственные препараты различных фармакологических групп, способные направленно влиять на процессы пролиферации, регенерации и уровень метаболизма.
Нормальная жизнедеятельность организма сопровождается непрерывным процессом замены отмирающих клеток и тканей, получившим название физиологической регенерации. Разные ткани отличаются по способности к восстановлению (регенерации), которая тем выше, чем большую роль играет физиологическая регенерация в структуре и функционировании ткани. Клетки крови, слизистых оболочек желудочно-кишечного тракта, покровного эпителия кожи и др. быстро обновляются и поэтому ткани, которые они формируют, характеризуются высоким потенциалом регенерации. Напротив, у нейронов и мышечных клеток потенциал регенерации минимален (приближается к нулевому). Под влиянием возраста, сопутствующих заболеваний, токсических и экологических факторов, радиации процесс физиологической регенерации может затормаживаться. Аналогичным эффектом обладают некоторые лекарственные средства, в т.ч. иммунодепрессанты, противоопухолевые препараты, кортикостероиды, некоторые антибиотики и НПВС и др. Угнетение процесса физиологической регенерации сопровождается развитием нарушений обменных процессов, возникновением лейко- и тромбоцитопении, анемии, поражением слизистых оболочек, в т.ч. желудочно-кишечного тракта и др. Лекарственные средства, способные увеличивать скорость и интенсивность физиологической регенерации получили название стимуляторов регенерации, или регенерантов.
Восстановление участков тканей и органов, погибших в результате травм, повреждений или дистрофии (интоксикации, гипоксия, инфекции и др.) представляет собой процесс репаративной регенерации. Соответственно, препараты, обладающие способностью стимулировать репаративную регенерацию - репарантами (Машковский М.Д. Лекарственные средства. 14 издание. М.: Новая волна, 2003, т.1, с.145). В итоге репарации происходит замещение очагов некроза специфической и/или соединительной (имеет самый высокий потенциал регенерации) тканью.
Общий механизм регенеративного действия включает усиление биосинтеза пуриновых и пиримидиновых оснований, РНК, функциональных и ферментативных клеточных элементов, в т.ч. фосфолипидов мембран, а также стимуляцию редупликации ДНК и деления клеток. Следует заметить, что процесс биосинтеза в ходе как физиологической, так и репаративной регенерации нуждается в субстратном обеспечении (незаменимые амино- и жирные кислоты, микроэлементы, витамины). Кроме этого, процесс биосинтеза белков и фосфолипидов отличается высокой энергоемкостью и его стимуляция требует соответствующего энергообеспечения (энергетические материалы). К таким средствам, субстратно и энергетически обеспечивающим протекание процессов регенерации, относятся актовегин, солкосерил и др. Эффект этих препаратов и собственно регенерирующего процесса зачастую трудно дифференцировать.
В соответствии с локализацией действия (и задачами фармакотерапии) стимуляторы регенерации и репарации условно подразделяются на общеклеточные (универсальные) и тканеспецифические. К общеклеточным стимуляторам, действующим на любую регенерирующую ткань, относятся анаболические стероиды, нестероидные анаболики - натрия дезоксирибонуклеат (Деринат), метилурацил, инозин и др. и витамины пластического обмена Тканеспецифические стимуляторы процесса регенерации представляют собой препараты с разным механизмом действия, объединенные в подгруппы по избирательному действию на ту или другую ткань или систему органов (Машковский М.Д. Лекарственные средства. 14 издание. М.: Новая волна, 2003, т.1, т.2). Наиболее известными препаратами для лечения хориоретинальных дистрофий являются глутоксим, кортексин, фезам, эмоксипин. все они имеют ряд ограничений в применении из-за аллергических реакций.
Ряд заболеваний, в частности, в офтальмологической практике, приводит к инвалидизации большого числа пациентов, а лечение остается чисто симптоматическим. Повышение эффективности лечения больных с патологией сетчатки является одной из основных задач современной офтальмологии и требует поиска и разработки новых медикаментозных препаратов. В последние годы большое внимание уделяется биорегулирующей терапии, обладающей органотропностью и патогенетической направленностью действия. Свойства данной группы препаратов обусловлены участием пептидов в белковом синтезе, регуляции клеточного метаболизма в пептидном процессинге (отщепление необходимых аминокислотных последовательностей). Множественность регуляторных систем организма предполагает наличие универсальных посредников - регуляторных пептидов. Они необходимы для передачи информационных сигналов между клетками и участвуют в поддержании структурного и функционального гомеостаза клеточных популяций. В основу функционирования биологической регуляции положен принцип пептидного каскада. Одним из наиболее эффективных препаратов данной группы является зарегистрированный в 1999 году регенерант и репарант сетчатки - ретиналамин. Ретиналамин (комплекс полипептидных фракций из сетчатки глаз крупного рогатого скота или свиней) оказывает тканеспецифическое регенерирующее действие на сетчатку глаза (И.Б.Максимов, Л.К.Мошетова, С.А.Савостьянова. Ретиналамин в комплексном лечении инволюционных центральных хориоретинальных дистрофий. СПб., 2006, 96 с.). Известный препарат выбран в качестве прототипа для заявляемого регенерирующего средства. Он представляет собой комплекс пептидов пара- и аутокринной природы размером от 1000 до 10000 Да, выполняющий функцию внутри- и межклеточного мессенджера. Относится к группе цитомединов. Выпускается в форме лиофилизированного порошка во флаконах по 5 мг ретиналамина в каждом. Используется ретиналамин в разведенном виде как прозрачный бесцветный водный раствор для парабульбарных и внутримышечных инъекций. Сложный состав ретиналамина не позволяет произвести обычный фармакокинетический анализ отдельных компонентов. Таким образом, фармакокинетическое исследование ретиналамина не проведено, что является явным недостатком препарата. Специфическое действие известного препарата направлено на стимуляцию фоторецепторов и клеточных элементов сетчатки, улучшение функционального взаимодействия пигментного эпителия и наружных сегментов фоторецепторов, ускорение восстановления световой чувствительности сетчатки. Неспецифическое действие ретиналамина проявляется в нормализации проницаемости сосудов, уменьшении различных проявлений воспалительной реакции, стимуляции репаративных процессов в сетчатке глаза. Ретиналамин обладает метаболическим и ретинопротективным действием, оказывает биорегулирующее влияние на орган зрения и тканеспецифичное действие на сетчатку глаза. Препарат противопоказан при индивидуальной непереносимости и беременности. При применении по показаниям в рекомендуемых дозах побочное действие не выявлено. Лекарственное взаимодействие препарата ретиналамин с другими лекарственными средствами не описано. Ретиналамин хранят в сухом, защищенном от света месте, при температуре от 2° до 20°С. Срок годности - 2 года. В растворе препарат не стабилен, поэтому его хранят в виде порошка и разводят непосредственно перед инъекцией. Это существенный недостаток известного препарата. Препарат отпускается по рецепту врача.
Способ лечения с использованием ретиналамина выбран в качестве способа-прототипа. Ретиналамин применяют для лечения центральной хориоретинальной дистрофии сетчатки глаза (ЦХРД), диабетической ретинопатии, тапеторетанальной абиотрофии. В постоперационном периоде ретиналамин примененяется у пациентов с отслойкой сетчатки, при лазерной гиперкоагуляции, у пациентов с инволюционной ЦХРД. Рекомендовано использование препарата при лечении тромбоза центральной вены сетчатки и профилактике ретромбоза, а также хориоретинитах различной этиологии. Препарат вводят взрослым (для детей рекомендации относительно использования препарата пока не имеется) парабульбарно или внутримышечно однократно ежедневно (содержимое флакона растворяют в 1-2 мл 0,5%-ного раствора новокаина или воды для инъекций, или изотонического раствора натрия хлорида) - по 5-10 мг в сутки в течение 5-10 дней (при необходимости повторный курс через 3-6 мес.). Несколько отсроченный эффект терапии и стойкость результата обусловлены эффектом пептидного каскада. Известный препарат, как установили авторы изобретения в ходе специально поставленных опытов, не влияет на эффективность комплексной противотуберкулезной терапии при лечении хориоретинитов туберкулезного характера.
Общим недостатком известных методов является то, что они вызывают серию побочных эффектов в отношении сердечно-сосудистой, иммунной, дыхательной, репродуктивной систем и отрицательно влияют на печень и почки пациентов.
Из приведенного выше анализа следует, что из-за сложности механизма процесса регенерации в организме и неочевидности регуляции действия компонентов известных препаратов, прежде всего пептидных, вызываемых ими побочных эффектов, проблема разработки универсальных синтетических регенерирующих препаратов остается актуальной.
Задачей настоящего изобретения является создание высокоэффективного синтетического регенерирующего средства, не пептидной природы, не имеющего негативных побочных фармакологических эффектов, присущих известным аналогам, и способов лечения хориоретинальной дистрофии различной этиологии с использованием этого средства.
Эта задача решается заявляемой группой из трех изобретений, объединенных единым изобретательским замыслом, - регенерирующим средством на основе коменовой кислоты и двумя способами лечения с помощью этого средства.
Заявляемая композиция характеризуется следующей совокупностью существенных признаков:
1. Регенерирующее противовоспалительное средство, представляющее собой водный раствор активного начала - коменовой кислоты и вспомогательного вещества - натрия гидрокарбоната, при следующем соотношении компонентов, в мас.%:
вода для инъекций - до 100.
2. Регенерирующее противовоспалительное средство по п.1, отличающееся тем, что оно дополнительно содержит примесь коменовой кислоты бензилкоменовую кислоту - в количестве не более 2,5% в пересчете на коменовую кислоту.
Совокупность существенных признаков заявляемого изобретения обеспечивает получение технического результата: созданное регенерирующее противовоспалительное средство предназначено для стимуляции гуморального иммунитета, повышающего фагоцитарную активность макрофагов на фоне эмоционального стресса, проявляет противовоспалительные и антиоксидантные свойства, повышает эффективность стандартной противотуберкулезной терапии, проявляет нейроретинопротекторные и ретиностимулирующие свойства и блокирует токсические эффекты препаратов группы сердечных гликозидов, нейротрофические и трофические свойства препарата тканеспецифичны. Согласно данным доклинических исследований и экспертной оценке у него отсутствуют негативные побочные эффекты. Заявляемое средство в терапевтических дозах не влияет на сердечно-сосудистую систему, формулу крови, дыхательную систему, эмбриогенез, не стимулирует терратогенез, не вызывает аллергии, не влияет на репродуктивную функцию, не стимулирует опухолевый рост. Нейротоксические эффекты у заявляемого средства отсутствуют. Высокие значения таких показателей, как клиренс (450-500 мл/кг/ч) и стационарный объем распределения (2.5 л/кг) свидетельствуют о том, что заявляемое средство очень активно распределяется из системного кровотока. Большая часть препарата, не выводится, а подвергается метаболизму и утилизируется в самом организме. Последнее дает возможность рекомендовать использование заявляемого средства у пациентов с почечной и печеночной недостаточностью. Фармакокинетическое исследование заявляемого средства, проведенное авторами, делает использование заявляемого средства, более предпочтительным, поскольку фармакокинетический анализ препарата-прототипа ретиналамина не проведен. Специфические фармакологические свойства заявляемого средства реализуются после внутривенного, или парабульбарного (при лечении ретинопатий различного генеза) введения через 5-7 мин. Действующая субстанция - коменовая кислота - технологически доступна. Исследование острой и подострой токсичности показали, что средство (лекарственная форма в виде 1 и 2% растворов для инъекций в ампулах 1, 2, 5 мл) относится к V классу практически нетоксичных соединений. Заявляемое средство не вызывает привыкания и зависимости, проникает через гематоэнцефалический барьер. Заявляемое средство является стабильным в виде раствора для инъекций. При хранении в естественных условиях степень его разложения составляет около 1% в год. На основании этих данных срок годности установлен на 2 года.
Создание заявляемого средства стало возможным, благодаря изучению авторами изобретения элементов тонкого механизма воздействия веществ, способных образовывать хелатные комплексы с ионами кальция и магния, проявляющих протвовоспалительные свойства, тканеспецифичные трофические и нейротрофические свойства, направленно регулирующие процессы кодирования ноцицептивной информации в центральной нервной системе, не имеющих побочных эффектов в отношении жизненно важных функций организма, и тщательному исследованию пути мембранной сигнализации, через который происходит активация Na/K-АТФазы в качестве трансдуктора сигнала при регуляции синтетических процессов в тканях разных типов (Лопатина Е.В., Пеннияйнен В.А., Зайка А.А. Исследования участия Na+, К+-АТФазы в регуляции роста эксплантатов ткани сердца в органотипической культуре. Бюллетень экспериментальной биологии и медицины. 2005, т. 140, №8, с.150-153; Пеннияйнен В.А., Лопатина Е.В. Исследование роли Na+, К+-АТФазы в регуляции роста нейритов сенсорных нейронов. Бюллетень экспериментальной биологии и медицины. 2005.Т. 139, №2. С.147-160; Лопатина Е.В., Пеннияйнен В.А., Цырлин В.А. Сравнительный анализ действия сердечных гликозидов на рост эксплантатов ткани сердца. Физиологич. журнал им. Сеченова, 2005. Т. 91. №11. С.1299-1304; Karetsky A.V., Lopatina E.V., Penniyaynen V.A. а3-izoform of Na+, K+-ATPase modulates process of cells growth in the chicken retina. Humboldt-Kolleg Conference "Technologies of the 21st century: biological, physical, informational and social aspects" Saint-Petersburg. 2005. P.30). Аналогичную функцию - функцию трансдуктора Na/K-АТФаза выполняет при модуляции кодирования ноцицептивного сигнала (Крылов Б.В., Дербенев А.В., Подзорова С.А., Людыно М.И., Кузьмин А.В., Изварина Н.Л. Морфин уменьшает потенциалочувствительность медленных натриевых каналов // Российский физиол. журн. 1999, т. 85, №2, с.225-236). В результате этого исследования авторами заявляемого изобретения было предсказано, что коменовая кислота может быть использована в качестве действующей субстанции при изготовлении противовоспалительного синтетического регенерирующего средства, проявляющего иммуномодуляторные, антиоксидантные и другие эффекты, описанные выше. Перечисленные свойства заявляемое средство реализует благодаря способности образовывать хелатные комплексы с ионами кальция и магния с последующей активацией специфического молекулярного механизма мембранной сигнализации, включающего альфа три изоформу Na/K-АТФазы в качестве трансдуктора сигнала. Механизм реализации эффектов заявляемого средства был открыт авторами заявляемого изобретения.
Заявляемая композиция отличается от препарата-прототипа рядом существенных признаков: качественным составом, прежде всего использованием другой действующей субстанции - коменовой кислоты, соответствующими количественными характеристиками, тем, что заявляется готовый для инъекций раствор. Предлагаемое лекарственное средство отличается тем, что является синтетическим средством, препарат в отличие от препарата-прототипа и известных аналогов, не является пептидным соединением, лекарственный эффект которых трудно прогнозировать и регулировать, лекарственная форма препарата производится в виде готового стабильного, стерильного раствора для инъекций.
Анализ известного уровня техники не позволил обнаружить решение, полностью совпадающее по совокупности существенных признаков с заявляемым. Ранее авторами изобретения было показано, что коменовая кислота обладает седативным действием, в дозах, превышающих значения заявляемого изобретения (патент РФ №2209062 «Вещество, обладающее седативным действием» от 19.03.02, опубл. 27.07.03), что не порочит новизну заявляемого изобретения. Таким образом, можно предполагать, что заявляемое средство обладает новизной.
Только совокупность существенных признаков заявляемого регенерирующего средства позволяет достичь указанного технического результата. Способность композиции веществ, составляющих основу заявляемого средства, проявлять стабильную регенерирующую активность была открыта авторами изобретения, как было указано выше, случайно, при исследовании роли Na/K-АТФазы в качестве трансдуктора сигнала при регуляции синтетических процессов в тканях разных типов.
Следует подчеркнуть, что до сих пор не созданы не имеющие негативных побочных эффектов регенерирующие средства, сопоставимые по степени регенерации с анаболиками.
Таким образом, предлагаемое регенерирующее средство может соответствовать условию охраноспособности «изобретательский уровень» («неочевидность»).
Заявляемые способы лечения представляют собой следующую совокупность существенных признаков:
Способ 1
1(3). Способ лечения хориоретинальных дистрофий различной этиологии, заключающийся в том, что пациенту вводят регенерирующее средство по пп.1-2 парабульбарно в дозе от 10 до 20 мг (в пересчете на коменовую кислоту) один раз в сутки в течение 10 дней.
2(4). Способ лечения по п.3, отличающийся тем, что курс лечения повторяют 2-3 раза в год.
3(5). Способ лечения по п.3, отличающийся тем, что в офтальмологии пациенту вводят регенерирующее средство в один или оба глаза.
Способ 2
4(6). Способ повышения противотуберкулезной терапии, заключающийся в том, что пациенту вводят регенерирующее средство по пп.1-2 внутривенно в дозе до 350 мг в сутки (в пересчете на коменовую кислоту) в течение 10 дней.
5(7). Способ лечения по п.4(6), отличающийся тем, что курс лечения проводят 1-3 раза в год с перерывом в 3-6 мес.
Заявляемое средство не вызывает зависимости и привыкания, следовательно доза препарата, используемая при лечения хориоретинальных дистрофий и в комплексной противотуберкулезной терапии - остается неизменной в ходе лечения даже при длительном применении.
Введение заявляемого регенерирующего средства парабульбарно в дозе, большей чем 20 мг в сутки (в пересчете на действующую субстанцию - коменовую кислоту) нецелесообразно, так как регенерирующий и противовоспалительный эффект не увеличивается.
Введение заявляемого средства внутривенно в дозе большей чем 350 мг в сутки (5 мг/кг) (в пересчете на действующую субстанцию - коменовую кислоту) при включении в комплексную противотуберкулезную терапию нецелесообразно, так как противовоспалительный эффект не увеличивается.
Совокупность существенных признаков каждого из предлагаемых способов лечения позволяет достичь технического результата, заключающегося в эффективном лечении ретинопатий, в том числе туберкулезного характера, улучшении эффективности комплексного лечения туберкулеза и ряда дегенеративных заболеваний, что позволяет качественно осуществлять терапию по лечению основного заболевания и существенно улучшить качество жизни пациентов. В ходе лечения не возникает привыкания к препарату, что позволяет осуществлять продолжительное лечение, не меняя препарат, достигать устойчивого эффекта.
В отличие от способа лечения с помощью прототипа-ретиналамина предлагаемые способы лечения не имеют побочных эффектов, характерных для препаратов пептидной природы, а именно: развитие аллергических реакций, головокружения. Механизм действия заявляемого средства сугубо избирателен. Это особенно ценно при хирургических офтальмологических вмешательствах. Таким образом, заявляемый способ лечения является щадящим. Способы лечения с помощью заявляемого средства являются более удобными для медицинского персонала, поскольку не требует дополнительных манипуляций, связанных с его приготовлением (растворением), следовательно, сокращается время работы персонала с каждым пациентом.
Следует подчеркнуть, что прототип-ретиналамин не применяется при лечении туберкулеза.
Заявляемые способы лечения отличаются от способа-прототипа с использованием ретиналамина рядом существенных признаков: использованием другой действующей субстанции - заявляемого регенерирующего противовоспалительного средства на основе коменовой кислоты в определенных дозе и сроках лечения. Способ-прототип в отличие от заявляемых включает предварительную стадию подготовки - приготовления раствора ретиналамина. Ретиналамин вводится внутримышечно и парабульбарно, заявляемое средство - парабульбарно и внутривенно.
Полностью совпадающего с заявляемыми по совокупности существенных признаков способа лечения хориоретинальных дистрофий не обнаружено, это может служит доказательством новизны заявляемых способов.
Только совокупность существенных признаков каждого из заявляемых способов лечения позволяет достичь указанного технического результата - проведения эффективной комплексной патогенетической противотуберкулезной терапии за счет повышения гуморального иммунитета и фагоцитарной активности макрофагов; направленной модуляции процесса пролиферации клеток сетчатки и кардиомиоцитов, стимуляции роста нейритов. Действительно, до сих пор не известен способ комплексного патогенетического лечения туберкулеза, при реализации которого происходит направленное воздействие на стимуляцию гуморального иммунитета, в результате чего повышается фагоцитарная активность макрофагов и потенцирование действия препаратов используемых в стандартной противотуберкулезной терапии. При лечении дистрофии сетчатки, возникшей как осложнение при развившемся туберкулезе глаза, обнаружено достоверное уменьшение площади фиброзных очагов при включении в комплексную терапию заявляемого средства. Это происходит за счет того, последний реализует свои свойства при образовании хелатных комплексов с ионами кальция (магния) и активирует функцию Na/K-АТФазы как трансдуктора сигнала, стимулирующего процесс пролиферации без интоксикации, привыкания и рецидивов. Специальные исследования показали, что при наличии у заявляемого средства мощных тканеспецифичных трофических, ретинопротекторных и нейротрофических свойств, препарат не стимулирует возникновение и рост новообразований. Заявляемое средство может быть рекомендовано больным с почечной и печеночной недостаточностью, поскольку не выводится печенью и почками, а метаболизируется в самом организме, образуя глюкуроновые конъюгаты или комплексные соединения с катионами металлов кальция и магния. Все это свидетельствует о неочевидности заявляемых способов.
Таким образом, исходя из сказанного выше, заявляемая группа изобретений в целом может претендовать на соответствие критериям охраноспособности «новизна» и «неочевидность».
Для подтверждения соответствия заявляемого решения требованию «промышленная применимость», а также для лучшего понимания сущности изобретения приводим примеры его конкретной реализации.
Прототип
Ретаналамин использован продажный (фирма Герофарм).
Реагенты, использованные для приготовления заявляемого регенерирующего средства:
Активное начало средства - коменовая кислота (5-гидрокси-4-оксопирон-2-карбоновая кислота) синтезирована по методике (Гаркуша Ж.А. Ж. общей химии. 1961, т.31, с.2573). Температура плавления (261-267°С) и спектральный анализ соответствуют литературным данным. В качестве примеси коменовой кислоты может присутствовать бензилкоменовая кислота - в количестве не более 2,5% в пересчете на коменовую кислоту.
В качестве вспомогательного вещества в состав заявляемого средства включен натрия гидрокарбонат (ГОСТ 4201-79; ФС 42-0324-4716-03) с целью создания оптимального значения рН, способствующего диссоциации коменовой кислоты и увеличению ее растворимости.
Вода для инъекций соответствовала требованиям ФС 42-2620-97. Стерилизацию средства проводят методом мембранной фильтрации в асептических условиях. Фильтрат разливают в ампулы нейтрального стекла и запаивают.
Состав заявляемого средства
Положительный заявляемый эффект средства проявляется для 1-2%-ного водного раствора. Преимущественная форма заявляемого средства (лекарственная форма) представляет собой 1% или 2% водный раствор для инъекций в ампулах по 1, 2 и 5 мл. Действующее вещество - коменовая кислота, концентрация которой составляет 10 мг в 1 мл (1% раствор анальгетического средства), либо 20 мг в 1 мл (2% раствор). В состав лекарственной формы заявляемого средства в пересчете на 100% вещество входят натрия гидрокарбонат 5,5 г (1% раствор), либо 11 г (2% раствор), вода для инъекций до 1 л (или 1-2 г коменовой кислоты, 0,55-1,1 г натрия гидрокарбоната и вода до 100 мл). Заявляемое средство является прозрачной жидкостью от желтоватого до желтого (10 мг/мл), от желтовато-зеленоватого до желто-зеленого (20 мг/мл) цвета без запаха, рН - от 4,1 до 5,6 (потенциометрически). Среди посторонних примесей идентифицирована бензилкоменовая кислота, которая является промежуточным продуктом синтеза коменовой кислоты. Норматив совокупного содержания посторонних примесей установлен на основании данных по хранению и с учетом допустимого уровня примесей в субстанции коменовой кислоты: не более 5% (содержание бензилкоменовой кислоты - не более 2,5%) в пересчете на коменовую кислоту. Заявляемое средство является стабильным соединением. При его хранении в естественных условиях: степень его разложения составляет около 1% в год. Срок годности стерильного препарата в защищенном от света месте при температуре не выше +25°С - 2 года. Средство является апиро генным. Тест-доза 10 мг на кг массы животного, в объеме 0,5 мл и 1 мл, соответственно, для препаратов с концентрацией 20 мг/мл и 10 мг/мл. Средство является нетоксичным, относится к V классу практически нетоксичных лекарственных веществ (по коменовой кислоте) (Н. Hodge et al.. Clinical Toxicology of Commercial Products. Acute Poisoning. Ed. IV, Baltimore, 1975,427 p.).
Пример 1. Фармакокинетика заявляемого средства
При внутривенном введении заявляемого средства (преимущественно в виде 1 и 2% раствора для инъекций) собакам фармакокинетика действующей субстанции препарата - коменовой кислоты - в плазме крови описывается 3-частевой зависимостью. Первая фаза распределения протекает стремительно - характерное время на этом участке составляет 1,5 мин. За первые 10 мин из плазмы крови уходит около 95% коменовой кислоты (действующая субстанция препарата), при этом ее концентрация снижается от 50-60 мкг/кг до 3 мкг/кг, т.е. почти в 20 раз. Следующая фаза длится с 10-ой минуты и до начала 2-го часа; характерное время составляет порядка 30 мин, и концентрация коменовой кислоты снижается с 3 до 0.6 мкг/мл, т.е. в 5 раз. После 2-го часа наступает, по-видимому, фаза истинной элиминации с временем T1/2 порядка 5,5 ч. Среднее время присутствия препарата в организме - показатель MRT - составляет 5,5-6 ч.
Высокие значения таких показателей, как клиренс (450-500 мл/кг/ч) и стационарный объем распределения (2,5 л/кг) свидетельствуют о том, что заявляемое средство очень активно распределяется из системного кровотока. Этот факт является неожиданным, поскольку коменовая кислота относится к ряду гидрофильных соединений. Отсюда следует, что большая часть средства, вероятно, не выводится, а подвергается метаболизму и утилизируется в самом организме. Это дает возможность рекомендовать использование заявляемого средства у пациентов с почечной и печеночной недостаточностью. Учитывая химическую природу коменовой кислоты (т.е. наличие в ее структуре гидроксильной и карбоксильной групп), возможными ее метаболитами могут быть глюкоронидные конъюгаты или комплексные соединения с катионами металлов.
Положительная динамика после парабульбарного приема заявляемого регенерирующего средства, обладающего противовоспалительными эффектами, проявляется через 10-14 дней от начала использования. Для закрепления положительного результата при необходимости курс лечения повторяют до 3 раз в году.
При включении препарата в стандартную комплексную противотуберкулезную терапию положительный эффект от 10-дневного курса внутривенных инъекций наблюдается через 14 дней от начала использования препарата. Положительный эффект является стойким. При необходимости курс лечения заявляемым препаратом повторяют до 3 раз в году.
Заявляемое средство не вызывает зависимости и привыкания, следовательно, доза препарата, необходимая для достижения регенерирующего эффекта, остается неизменной в ходе лечения даже при длительном применении. В терапевтической дозе средство не влияет на формулу крови, сердечно-сосудистую и дыхательную системы, не вызывает аллергические реакции, не провоцирует терратогенез, не влияет на репродуктивную функцию и эмбриогенез.
Пример 2. Специфическая фармакологическая активность
2.1. Предлагаемый механизм действия. Нейротрофическая и трофическая активность. Опыты in vitro
Нейротрофические и трофические свойства заявляемого средства исследовали при помощи метода органотипического культивирования ткани. Эксперименты осуществляли на эксплантатах ткани сердца, сетчатки и нейронах спинальных ганглиев 10-12 дневных куриных эмбрионов. Исследовано 400 эксплантатов ткани сердца, 500 эксплантатов ткани сетчатки и 400 эксплантатов спинальных ганглиев. Питательная среда, в которой осуществляли культивирование эксплантатов, имела рН 7,2 и следующий состав: 40% - раствор Хенкса; 40% - среда Игла; 15% - фетальная сыворотка коровы; 5% - куриный эмбриональный экстракт; с добавлением глюкозы (0,6%), инсулина (0,5 ед/мл), гентамицина (100 ед/мл), глютамина (0,35%). Эксплантаты помещали на коллагенновую подложку и культивировали в питательной среде в чашках Петри при температуре 37°С в СO2 инкубаторе (Sanyo), при концентрации О2 95% и СO2 5% (Пеннияйнен В.А., Лопатина Е.В. Исследование роли Na+, К+-АТФазы в регуляции роста нейритов сенсорных нейронов. Бюллетень экспериментальной биологии и медицины. 2005, т. 139, №2, с.147-160; Лопатина Е.В., Пеннияйнен В.А., Цырлин В.А. Сравнительный анализ действия сердечных гликозидов на роста эксплантатов ткани сердца. Физиологич. журнал им. Сеченова, 2005, Т.91, №11, с.1299-1304. Karetsky A.V., Lopatina E.V., Penniyaynen V.A. α3-izoform of Na+, K+-ATPase modulates process of cells growth in the chicken retina. Humboldt-Kolleg Conference "Technologies of the 21st century: biological, physical, informational and social aspects" Saint-Petersburg, 2005, p.30).
Контрольными служили эксплантаты, культивируемые только в условиях питательной среды. Заявляемое средство добавляли в питательную среду в концентрациях: 10-6 М, 10-7 М, 10-8 М, 10-9 М (в пересчете на действующую субстанцию - коменовую кислоту). Контрольное значение ИП принимали за 100%, достоверность различий в ИП оценивали с помощью t-критерия Стъюдента. В части экспериментов в питательную среду добавляли сердечный гликозид, блокатор Na/K-АТФазы оуабаин (Sigma). Оуабаин добавляли в концентрации 10-8 М, в этой концентрации препарат блокирует обе функции Na/K-АТФазы - функцию помпы и функцию трансдуктора сигнала и полностью блокирует рост эксплантатов ткани сердца, сетчатки и спинальных ганглиев [там же].
Проведенные исследования показали, что заявляемое средство обладает нейротрофическими и трофическими свойствами. Действие препарата является дозозависимым и тканеспецифичным.
При введении в питательную среду заявляемого средства в концентрации 10-6 М (в пересчете на действующую субстанцию - коменовую кислоту) наблюдали достоверное угнетение роста эксплантатов ткани сетчатки на 24%по сравнению с контролем. Аналогичное действие оказывала эта концентрация на рост нейритов, ИП был на 20% ниже контрольного значения. В то время как влияние заявляемого средства в дозе 10-6 М на рост эксплантатов ткани сердца оказалось противоположным. В этой концентрации препарат достоверно стимулировал рост эксплантатов ткани сердца на 40% по отношению к контролю. В концентрации 10-7 М степень угнетения роста эксплантатов ткани сетчатки и нейритов сенсорных нейронов препаратом была значительно меньше. ИП эксплантатов ткани сетчатки был ниже контрольного значения на 17,5%. ИП нейритов сенсорных нейронов был ниже контрольного значения на 5%. Величина ИП эксплантатов ткани сердца в аналогичных условиях культивации была выше контрольного значения на 23%. Добавление препарата в концентрации 10-8 М приводило к достоверной стимуляции роста эксплантатов ткани сетчатки и нейритов сенсорных нейронов на 18% и 24%, соответственно. На рост эксплантатов ткани сердца препарат в этой концентрации не влиял. Данные не отличались от контрольных. При введении в питательную среду препарата в концентрации 10-9 М наблюдали достоверную стимуляцию роста эксплантатов ткани сетчатки. ИП был выше контрольного значения на 50%. Рост нейритов сенсорных нейронов сохранялся на прежнем уровне. На рост эксплантатов ткани сердца препарат в этой концентрации не влиял.
В части экспериментов в питательную среду вместе с заявляемым средством в эффективной для каждого типа ткани концентрации добавляли оуабаин в концентрации 10-8 М. Именно в этой концентрации оуабаин полностью угнетал рост эксплантатов ткани сетчатки, нейритов сенсорных нейронов и эксплантатов ткани сердца. При совместном культивировании эксплантатов ткани сетчатки в среде, содержащей заявляемое средство в концентрации 10-9 М и оуабаин в концентрации 10-8 М оказалось, что ИП экспериментальных эксплантатов ничем не отличался от контрольного значения. Аноцептин в концентрации 10-8 М устранял блокирующий эффект оуабаина по отношению к нейритам сенсорных нейронов, ИП экспериментальных эксплантатов ничем не отличался от контрольного значения. Токсический эффект оуабаина по отношению к эксплантатам ткани сердца заявляемое средство устраняло в концентрации 10-6 М. Степень роста эксплантатов ткани сердца, культивируемых в среде, содержащей заявляемое средство (10-6 М) и оуабаин (10-8 М) соответствовала контрольному значению -ИП эксплантатов ткани сердца, культивируемых только в условиях питательной среды. Таким образом, тканеспецифичное нейротрофическое и трофическое действие, которое оказывает заявляемое средство реализуется благодаря его непосредственному влиянию на Na/K-АТФазу, скорее всего ее альфа три изоформу. Усиление процессов роста и пролиферации в тканях разных типов в этом случае связано с активацией функции Na/K-АТФазы как трансдуктора сигнала. В этом качестве Na/K-АТФаза может принимать участие в регуляции синтетических процессов (пролиферации и роста) в тканях разного типа [там же]
Цитологические исследования препаратов ткани сетчатки, окрашенных гематоксилинэозином позволили обнаружить, что в зоне роста контрольных и экспериментальных эксплантатов, культивируемых в течение 3-х суток в питательной среде, содержащей заявляемое средство (10-9 М) присутствовали клетки пигментного эпителия сетчатки, палочки, колбочки, ганглиозные клетки. На фиксированных препаратах ткани сердца, окрашенных гематокилинэозином, обнаружено, что зона роста контрольных эксплантатов и эксплантатов, культивируемых в среде, содержащей заявляемое средство (10-6 М), содержала кардиомиоциты и небольшое количество фибробластов. В зоне роста эксплантатов сенсорных нейронов, окрашенных серебром по Бильшовскому-Гросс, находились нейриты как в контроле, так и в случае предварительного культивирования эксплантатов в питательной среде, содержащей заявляемое средство (10-8 М). Таким образом, получено дополнительное подтверждение, того факта, что заявляемое средство стимулирует естественный цикл пролиферации и роста.
Заявляемое средство в своем составе не содержит ионов кальция и магния, но они в достаточном количестве присутствовали в питательной среде, в которой осуществлялась культивирование. Питательная среда в экспериментах in vitro воспроизводит состав внутренней среды организма (кровь, межтканевая жидкость и т.п.).
Эксперименты по изучению подострой и хронической токсичности заявляемого средства (лекарственная форма в виде 1 и 2% раствора для инъекций), проведенные in vivo на крысах и собаках подтвердили, что препарат в системном кровотоке может находиться в виде хелатного комплекса с ионами кальция и магния. Необходимо отметить, что от концентрации именно этих ионов в примембранном клеточном пространстве зависит активность Na/K-АТФазы в норме и при патологии (Schonner Endogenous cardiac glycosides, a new class steroid hormones, Eur. J. Biochem. 2002. V.269. 2440-2448).
Исследование биохимического анализа крови у самцов и у самок опытных групп, получавших заявляемое средство в дозе 100 и 300 мг/кг (в пересчете на действующую субстанцию коменовую кислоту) позволило обнаружить достоверное снижение уровня кальция на максимальной дозе (300 мг/кг) через 90 дней непрерывного применения препарата. Через 2-3 недели после отмены препарата данный показатель возвращался к нормальному уровню. В экспериментах на собаках обнаружено, что наблюдаемое у крыс достоверное снижение уровня кальция на максимальной дозе заявляемого средства (300 мг/кг), у собак, получавших препарат в максимальной дозе 50 мг/кг, носило характер недостоверной тенденции. Разница в тестируемых максимальных дозах препарата для разных видовых групп животных объясняется тем, что собакам технически не возможно ввести препарат в таком большом объеме внутривенно.
Предлагаемый препарат и способ лечения основываются на углубленном понимании физиологической роли открытого авторами изобретения молекулярного механизма модуляции процесса пролиферации за счет активации Na/K-АТФазы в качестве трансдуктора сигнала и способности действующей субстанции препарата коменовой кислоты образовывать хелатные комплексы с ионами кальция и магния [там же].
В этот механизм G-белки не вовлечены (именно поэтому заявляемое средство не вызывает привыкания уже на молекулярном и клеточном уровнях и не стимулирует рост новообразований). В экспериментах in vivo на мышах и крысах с перивитыми опухолями карциномой Эрлиха и саркомой Плиса показано, что препарат не стимулирует опухолевый рост. Данных о наличии непосредственной связи между G-белками и активностью Na/K-АТФазы в качестве трансдуктора сигнала нет. Вещества, которые активируют G-белки, не устраняют токсические эффекты препаратов группы сердечных гликозидов и не повышают эффективность препаратов, используемых в комплексной противотуберкулезной терапии.
Известные аналоги, используемые при лечении хориоретинальных дистрофий - ретиналамин, глутоксим, кортексин, фезам, эмоксипин, объективно не способны проявлять свойства заявляемого препарата, поскольку не содержат в своем составе коменовую кислоту, не создают хелатные комплексы с двухвалентными ионами кальцием и возможно магнием и не активируют механизм, который запускает Na/K-АТФаза как трунсдуктор сигнала.
Способность препарата формировать хелатные комплексы при использовании его в терапевтической дозе не оказывает влияния на жизненно важные константы организма.
В итоге, в основе настоящего изобретения лежит идея активации принципиального иного, чем классический, пути активации метаболических процессов в организме. Существование этого механизма лишь подтверждает теорию наличия в организме человека и животных нескольких параллельных путей защиты своей целостности от сверхмощных повреждающих стимулов.
Привыкание к заявляемому средству на молекулярном уровне отсутствует.
2.2. Исследование нейротрофических и противовоспалительных свойств в экспериментах in vivo.
2.2.1. Методика определения вирулентности микобактерий туберкулеза
Вирулентность микобактерий туберкулеза (МБТ) определяли перед каждым заражением кроликов путем введения 0,001 мг культуры в паховую область морских свинок. Учет производили по продолжительности жизни свинок. Всего для этих целей было использовано 16 морских свинок, продолжительность жизни которых после заражения составила 4-5 месяцев (культура МВТ ЛИХТ-320, маловирулентная).
2.2.2. Исследование антимикробного действия на М. Tuberculosis
Исследование антимикробного действия заявляемого средства проводили стандартным методом двукратных серийных разведении на культурах Н37 RwM и ЛИХТ-98 М. Tuberculosis. Суспензии М. Tuberculosis готовили по стандарту мутности 5 ЕД (что соответствует пятистам миллионам микробных тел в 1 мл суспензии) и разводили в 10 раз, как для постановки лекарственной устойчивости. Засевали в объеме 0,2 мл (10 миллионов микробных тел) методом поверхностного наслоения.
В качестве питательной среды использовали модифицированную жидкую среду Сотона с добавлением 0,35% питательного агара и 0,25% лошадиной сыворотки.
Начальная концентрация заявляемого средства составляла 200 мкг (в пересчете на действующую субстанцию коменовую кислоту) на 1 мл среды (т.е. 1-200 мкг/мл; 2-100 мкг/мл; 3-50 мкг/мл; 4-25 мкг/мл; 5-12,5 мкг/мл; 6-6,25 мкг/мл; 7-3,125 мкг/мл; 8-1,56 мкг/мл).
Одновременно проводили посев используемых штаммов М. Tuberculosis. В качестве контроля культуры без применения исследуемого препарата на модифицированную агаризованную среду Сотона и для контроля среды - на плотную среду Левенштейна-Йенсена.
Инкубацию посевов проводили при 37°С в течение 7 суток. Результат учитывали визуально. По истечении данного срока во всех пробирках наблюдали идентичный рост культур М. Tuberculosis (на среде Левенштейна-Йенсена- инициальный рост). Это говорит о том, что заявляемое средство не обладает антимикробным действием на М. Tuberculosis в исследуемых концентрациях.
2.2.3. Моделирование туберкулезного очагового хориоретинита
Нейротрофические ретинопротекторные и противовоспалительные свойства заявляемого средства исследовали на модели туберкулезного очагового хориоретинита. Операцию моделирования туберкулезного хориоретинита проводили на 40 глазах 20 половозрелых самцов кроликов породы «Шиншилла», весом 3,3-3,8 кг. Эта модель была выбрана, потому что является достаточно жесткой экспериментальной моделью формирования вторичных дистрофических изменений ткани сетчатки.
Предварительно на 6 здоровых глазах 3 кроликов породы Шиншилла было изучено влияние 2%-ного раствора заявляемого средства при парабульбарном его введении с целью исключения токсического влияния на ткани глаза. Офтальмологическое исследование глазного дна кроликов, а затем исследование макропрепарата - «глаз + парабульбарная клетчатка» показало, что каких-либо изменений на глазном дне и в параорбитальной клетчатке обнаружено не было. Таким образом, можно заключить, что введение препарата само по себе не оказывает токсического влияния на ткани здорового глаза и не стимулирует развитие патологических процессов.
Моделирование туберкулезного очагового хориоретинита было выполнено по методике, разработанной Э.Н.Беллендиром и соавт.(Э.Н.Беллендир, А.А.Суконщикова, Г.Д.Наконечный, И.Н.Песчанская. Влияние неспецифической и специфической сенсибилизации организма на развитие экспериментального туберкулеза глаз. Проблемы туберкулеза, 1972, Т.7, С.68-73; И.Н.Песчанская. Экспериментальное моделирование туберкулезных поражений глаза. Проблемы туберкулеза, 1973, т, 12, с.65-70; И.Н.Песчанская. Оценка и сравнительная характеристика способов моделирования туберкулеза глаза. Автореф.канд.дис. Л. 1977, с.17).
После формирования хориоретинального очага проводили антибактериальную терапию (АБТ) до стабилизации процесса по стандартной схеме.
2.2.4. Способ стандартного лечения туберкулезных хориоретинитов в активной стадии
В активной стадии лечения туберкулезных хориоретинитов применялись противотуберкулезные препараты:
- парабульбарно (3% раствор тубазида - 0,5 мл),
- внутримышечно 10% раствор тубазида из расчета 10 мг на 1 кг массы,
- внутримышечно по 40000 ЕД стрептомицина из расчета на 1 кг массы животного один раз в сутки.
Под стабилизацией процесса подразумевали отсутствие динамики клинических изменений в очаге воспаления и перифокальной зоне на фоне АБТ в течение 7-10 дней. До начала эксперимента животные были разделены на основную и контрольную группу. В основную группу вошли 10 кроликов (20 глаз), контрольную группу составили 10 кроликов (20 глаз).
Хориоретинальные очаги представляли собой округлые гранулемы желтоватого цвета, с нечеткими границами, которые проминировали в стекловидное тело, с экссудацией в перифокальной области.
Степень выраженности экссудативных изменений в зоне хориоретинальных очагов условно выражали в баллах (О перспективах изучения лечебного дествия лазера с использованием экспериментальной модели туберкулезного хориоидита. Хокканен В.М., Беллендир Э.Н., Балашевич Л.И., Устинова Е.И. Экспериментальная патология и терапия легочного и внелегочного туберкулеза. - М., 1985, с.60-65. 1990).
0 - отсутствие признаков экссудации, 1 - экссудативные изменения имелись только в зоне очага, 2 - экссудативные изменения отмечались в зоне очага воспаления и в прилежащих слоях стекловидного тела, 3 - экссудативные изменения отмечались в зоне очага воспаления и во всех слоях стекловидного тела.
В большинстве случаев (65,0%) степень выраженности воспаления была незначительной. На 14 глазах (35%) - течение очагового туберкулезного хориоретинита было средней степени тяжести, с вовлечением в воспалительный процесс средних и задних слоев стекловидного тела.
Размер хориоретинальных очагов соотносили с размером ДЗН и фиксировали наибольший размер (обозначение DD)
Хориоретинальные очаги в большинстве своем (90% - 36 глаз) были размером от 1 до 3 диаметров ДЗН, на 2 глазах (5%) размер хориоретинальных туберкулезных очагов превышал размеры диска в 3 и более раз, и в двух случаях размер очага был менее 1 DD. Выстояние в стекловидное тело (проминенцию) хориоретинальных очагов измеряли скиаскопическими линейками, оценивали в диоптриях по максимальному выстоянию в сравнении с неповрежденной тканью.
В большинстве случаев, на 21 глазе (77,5%) уровень проминенции у экспериментальных животных не превышал 2 диоптрий, на 9 глазах (23,4%) он составил 2-3 диоптрии.
Для изучения эффективности лечения туберкулезных хориоретинитов при включении в стандартную терапию заявляемого средства (2% раствор для инъекций) кролики были разделены на 2 группы контрольную и основную:
1. В основную группу вошли экспериментальные животные, которым на фоне стандартной противотуберкулезной терапии проводился курс парабульбарного введения 0,5 мл 2% раствора заявляемого средства в течение 10 дней
2. В контрольную группу вошли экспериментальные животные, которым проводилась стандартная противотуберкулезная терапия.
Распределение животных основной и контрольной групп по размеру очагов было равным, размер очага колебался от 1 до 3 диаметров диска зрительного нерва. По уровню проминенции достоверных различий между животными основной и контрольной группы не обнаружено.
Проведенные исследования показали, что по параметрам экссудации экспериментальные животные основной группы практически не отличались от животных контрольной.
Исследования, проведенные до включения заявляемого средства в комплексную противотуберкулезную терапию, показали, что экспериментальные животные основной группы и контрольной группы по таким показателям как размер очага, проминенция и экссудация, достоверно не отличались.
На протяжении всего исследования экспериментальные животные основной и контрольной группы получали стандартную противотуберкулезную терапию. На 10-й день от момента начала лечения животные основной группы помимо стандартной терапии стали получать по 0,5 мл 2% раствора заявляемого средства в каждый глаз парабульбарно. Курс инъекций заявляемого средства составил 10 дней.
Инъекции заявляемого средства (0,5 мл 2% раствора в каждый глаз) экспериментальные животные переносили хорошо, участков некроза в месте инъекций, аллергических и токсических реакций не отмечалось.
В ходе терапии заявляемым средством у животных основной и контрольной группы каждые два дня оценивали офтальмоскопическую картину глазного дна. На вторые сутки офтальмоскопическая картина глазного дна в обеих группах была без изменений. На 6-е сутки обнаружили усиление пигментации дистрофических очагов глазного дна кроликов основной группы. Очаги на глазном дне кроликов контрольной группы были без существенной динамики. У кроликов основной группы параллельно было отмечено частичное рассасывание кровоизлияний сетчатки. В контрольной группе подобные изменения не наблюдались. На 10-е сутки терапии отмечали достоверное уменьшение площади очагов в основной группе животных. Уменьшение площади происходило за счет усиления пигментации от периферии очага к его центру. У животных контрольной группы на глазном дне подобную офтальмоскопическую картину не наблюдали. Таким образом, у животных основной группы было зарегистрировано достоверное уменьшение площади фиброзных очагов, которое связано с включением в комплексную противотуберкулезную терапию заявляемого средства.
Ни одно животное основной группы не умерло до окончания эксперимента. Общее время эксперимента 90-120 дней.
Экспериментальные животные выводились из опыта путем внутривенного введения 5,0 мл тиопентала натрия через 12 недель от начала лечения. Энуклеацию глаз осуществляли по традиционной в офтальмологии методике. В стерильных условиях глазные яблоки животных фиксировали в 2,5% растворе глютаральдегида на фосфатном буфере (рН=7,4). Затем выделяли заднюю стенку глаза, которую в последующем заливали парафином под вакуумом. Из парафиновых блоков изготавливали гистотопографические срезы толщиной 8-10 мкм и окрашивали гемотоксилин-эозином.
Гистологические исследования подтвердили данные офтальмоскопического исследования in vivo. На препаратах отмечено увеличение пигментного эпителия, гипертрофия внутреннего ядерного слоя, уменьшение числа и площади лакун между ганглиозными клетками.
2.2.5. Результаты экспериментального исследования туберкулезных хориоретинитов по офтальмоскопическим признакам.
Животным контрольной и основной групп проводилось офтальмоскопическое исследование глазного дна каждые 3-4 дня. Данные динамического наблюдения за офтальмологическими критериями до и через 30 дней от начала проведения эксперимента представлены в таблице 1.
В обеих группах животных наблюдали положительную динамику лечения туберкулезных хориоретинитов. Однако результаты лечения экспериментальных животных основной группы, которые наряду со стандартной противотуберкулезной терапией получали в течение 10 дней 0, 5 мл 2% раствора заявляемого средства парабульбарно превосходили таковые у животных контрольной группы (табл.1).
Размер очага достоверно уменьшился на 20% по сравнению с исходным уровнем (1,98±0,12 до- и 1,59±0,13 после опыта). В контрольной группе мы также отмечали положительную динамику, однако размер очага в этой серии уменьшился только на 4% (2,03±0,14/1,95±0,14).
Уровень проминенции хориоретинальных очагов в основной группе, в которой заявляемое средство вводилось парабульбарно, снизился на 66% - 1,27±0,14/0,43±0,12 по сравнению с исходным уровнем, а в трех случаях - проминенции вообще отсутствовали. В контрольной группе, где заявляемое средство не применяли, уровень проминенции снизился на 39% - 1,2±0,15/0,73±0,13.
Экссудативные проявления достоверно уменьшились в большей степени при парабульбарном введении заявляемого средства (на 70%) по сравнению с исходными цифрами. В контрольной группе на 63%, при этом сохранялись помутнения и инфильтрация в стекловидном теле.
Таким образом, заявляемое средство в отношении этого критерия действовало на 7% эффективнее, чем препараты стандартной терапии.
Таким образом, использование 2% раствора заявляемого средства в комплексном лечении туберкулезных хориоретинитов позволяет достоверно уменьшить очаги в размере, сократить уровень промененции и экссудации в большем объеме и уже через 1 месяц остановить развитие воспаления туберкулезного процесса на глазном дне качественно лучше по сравнению с контрольной группой. Последнее является свидетельством высокой эффективности заявляемого средства при включении его в комплексную противотуберкулезную терапию. Схема исследований является классической для изучения фармакологической активности препаратов, потенцирующих эффективность противотуберкулезной терапии, и позволяет рекомендовать заявляемое средство для включения в комплексную патогенетическую противотуберкулезную терапию.
Данная экспериментальная модель является моделью поствоспалительных ретинопатий и используется для исследования фармакологической активности препаратов группы регенерантов и метаболитов, обладающих противовоспалительными свойствами. Критерии, выбранные авторами, являются адекватными для подобного рода исследований. Они позволяют корректно оценить свойства заявляемого средства как регенерирующего и противовоспалительного, так как изменения ткани сетчатки при развитии туберкулезного хориоретинита происходят как вторичные при развитии острого воспалительного процесса.
2.2.6. Результаты гистоморфологических исследований тканей глазного дна экспериментальных животных с туберкулезными хориоретинитами
После выведения кроликов из опыта нами были обследованы все срезы глазного яблока экспериментальных животных. Анализ 224 гистоморфологических срезов, полученных с 40 глаз 2-х экспериментальных групп (опытной и контрольной), показал, что во всех глазах присутствовали туберкулезные гранулемы в хориоидее, которые располагались рядом с диском зрительного нерва или миелиновым волокном. В 14 случаях очаги находились только в хориоидее (в основном в слое средних сосудов), в 10 случаях фокусы туберкулезного поражения располагались в хориоидее и сетчатке под слоем пигментного эпителия. На 2-х глазах очаги кроме хориоидеи имбибировали все слои сетчатки, с вовлечением диска зрительного нерва, в одном случае туберкулезный очаг затрагивал небольшую часть сетчатки, а основной массой выступал в полость глаза в виде гриба в капсуле. Во всех срезах определялась лимфоидная инфильтрация близлежащих участков хориоидеи. В большинстве случаев в перифокальной области сосуды хориоидеи были в спавшемся состоянии за счет отека, в 6-ти случаях - расширены и полнокровны, с утолщенными стенками за счет лейкоцитарной инфильтрации. На всех срезах глаз была видна экссудация в перифокальной области либо над сетчаткой.
Изменения сетчатки просматривались на препаратах всех глаз; основные изменения касались вершины очага, где сетчатка была разрушена полностью, с деструкцией пигментного эпителия (ПЭ). Однако в 40% случаев в основной группе исследования ПЭ имел свою нормальную структуру вблизи очага. В контрольной группе деструкция пигментного эпителия с выходом пигмента из клеток распространялась вплоть до зубчатой линии, расположенной на периферии сетчатки.
2.2.7. Методика моделирования травматической дистрофии сетчатки у кроликов
Методика моделирования травматической дистрофии сетчатки у кроликов разработана автором Карецким А.В. Эксперименты проводили на 20 кроликах породы Шиншилла. Использовали самцов весом 3- 3, 5 кг. Для моделирования травматической дистрофии сетчатки применяли инструменты для микрохирургии глаза. Животных наркотизировали 1% раствором промедола (1-2 мл в зависимости от массы тела). Промедол вводили внутримышечно за 10-15 минут до начала операции.
Веки прошивали шелком и разводили, в верхней половине глазного яблока по лимбу делали разрез конъюнктивы, которую затем отсепаровывали, на верхнюю прямую мышцу накладывали шов и глазное яблоко ротировали максимально книзу. Кнутри от верхней прямой мышцы послойно надсекали склеру до сосудистой оболочки. В супрахориоидальное пространство в направлении кзади и кнаружи вводили иглу с зашлифованным концом, которой механически наносили травматические повреждения, затем иглу извлекали. Швы ни на склеру, ни на конъюнктиву не накладывали. Формирование травматической дистрофии сетчатки оценивали по данным офтальмоскопического обследования глазного дна при помощи ручного зеркального офтальмоскопа ОР-2 (производство Россия). На 2-3-и сутки после операции на глазном дне кроликов обнаруживали наличие плоских дистрофических очагов белого цвета, площадью 0,5-1,5 PD с кровоизлияниями в сетчатку глаза. На 7-е сутки после оперативного вмешательства начинали лечение заявляемым препаратом. Препарат в виде 2% раствора для инъекций животным основной группы вводили парабульбарно по 0,5 мл на каждый глаз один раз в сутки. Курс лечения составил 10 дней. Животным контрольной группы парабульбарно вводили физиологический раствор по 0,5 мл в каждый глаз в течение 10 дней. Данная модель является адекватной для исследования действия препаратов, используемых при лечении посттравматических дистрофий сетчатки (травмы, осложнения после хирургических вмешательств и т.п.).
2.2.8. Результаты лечения экспериментальных посттравматических дистрофий.
Для изучения экспериментального материала использовались общие клинические наблюдения (поведение, аппетит, изменения в весе), стандартные офтальмоскопические методы исследования, которые проводились в динамике и включали: исследование в проходящем свете, тонометрию, офтальмобиомикроскопию глазного дна. За время проведения опыта животные набрали в весе 400-500 граммов, изменений в поведении и нарушения аппетита не выявлено. Заявляемое средство вводили животным основной группы по 0,5 мл в каждый глаз парабульбарно, начиная с 5 дня эксперимента в течение 10 дней. Животным контрольной группы вводили физраствор по той же схеме.
В ходе терапии заявляемым средством у животных основной и контрольной группы каждые два дня оценивали офтальмоскопическую картину глазного дна. На вторые сутки офтальмоскопическая картина глазного дна в обеих группах была без изменений. На 6-е сутки обнаружили усиление пигментации дистрофических очагов глазного дна кроликов основной группы. Очаги на глазном дне кроликов контрольной группы были без существенной динамики. У кроликов основной группы параллельно было отмечено частичное рассасывание кровоизлияний сетчатки. В контрольной группе подобные изменения не наблюдались. На 10-е сутки терапии отмечали достоверное уменьшение площади очагов в основной группе животных. Уменьшение площади происходило за счет усиления пигментации от периферии очага к его центру. У животных контрольной группы на глазном дне подобная офтальмоскопическая картина отсутствовала (табл.2). Окончательные результаты в обеих группах животных оценивали на 10 сутки после завершения лечения.
Размер очага в основной группе достоверно уменьшился на 19% по сравнению с исходным уровнем (1,19±0,40 до- и 0,96±0,11 после опыта). В контрольной группе мы также отмечали положительную динамику, однако размер очага в этой серии уменьшился только на 3% (1,225±0,30/1,2±0,13) (табл.2).
Экспериментальные животные выводились из опыта путем внутривенного введения 5,0 мл тиопентала натрия через 12 недель от начала лечения. Энуклеацию глаз осуществляли по традиционной в офтальмологии методике. В стерильных условиях глазные яблоки животных фиксировали в 2,5% растворе глютаральдегида на фосфатном буфере (рН=7,4). Затем выделяли заднюю стенку глаза, которую в последующем заливали парафином под вакуумом. Из парафиновых блоков изготавливали гистотопографические срезы толщиной 8-10 мкм и окрашивали гемотоксилин-эозином. Динамика офтальмологических показателей у экспериментальных животных в процессе лечения посттравматических дистрофий сетчатки отражена в таблице 2
Гистологические исследования подтвердили результаты экспериментов in vivo. У животных, получавших терапию заявляемым препаратом наблюдали нарастание валика пигментного эпителия, уменьшение вакуализации.
Количество глаз
М±m
Гипотезу о том, что лечение с помощью заявляемого средства туберкулезных хориоретинитов (модель поствоспалительной дистрофии сетчатки) и посттравматических дистрофий сетчатки является эффективным проверяли с помощью пакета StatGraphics. Использовали три теста: t-тест Стъюдента, знаковый тест и знаковый ранговый тест. t-Тест основан на распределении Стъюдента и имеет наибольшую мощность в том случае, когда выборка извлечена из нормальной генеральной совокупности. В нашем случае t-тест Стъюдента проверяет основную гипотезу о том, что математическое ожидание равно нулю (нулевая эффективность лечения) против альтернативной гипотезы, что эффективность подтверждается с доверительной вероятностью 95%.
Знаковый тест и знаковый ранговый тест проверяют гипотезу о том, что медиана равна нулю (нулевая эффективность) против альтернативы, что эффективность положительна. Знаковый тест и знаковый ранговый тест эффективны даже в тех случаях, когда в выборке имеются аномальные наблюдения. Знаковый тест базируется на подсчете числа наблюдений в выборке, которые расположены выше и ниже гипотетической медианы (нулевой в нашем случае). Соответственно, знаковый ранговый тест основан на вычислении среднего числа рангов больших и меньших гипотетической медианы.
Как показали расчеты в пакете StatGraphics, для всех четырех параметров - размер очага, проминенция, эксудация в случае туберкулезных хориоретинитов и размер очага в случае посттравматической дистрофии сетчатки по всем трем тестам вычисленный уровень значимости не превышал величины 0,001. Это означает, что для всех четырех параметров при использовании обеих экспериментальных моделей с доверительной вероятностью не меньшей 99,9% подтверждается наличие положительной эффективности от проведенных авторами лечебных мероприятий.
2.3. Изучение влияния на иммунную систему. Эксперименты in vivo
Из заявляемого средства готовили 0,1% раствор, который не оказывал направленного воздействия на число АОК в селезенке мышей, реакцию ГЗТ, РТПХ (реакция трансплантат против хозяина), фагоцитоз, но вызывал незначительную стимуляцию продукции антител (индекс действия 1, 2). Экспериментальные животные - мыши линии C57BI/6, СВА и FI (СВАхС57 В1).
В работе использованы следующие методы исследования влияния заявляемого средства на иммунную систему животных.
1. Определение числа АОК в селезенке мышей на 7 день после иммунизации оптимальной (1×108 кл) и субоптимальной (2×107 кл) дозами ЭБ (эритротциты барана) (Jeme N. - K.., Nordin A.A. Plague formation in agar antibody-producting cells/ - Science, 1963, v. 140, N 3565, p.405).
2. Определение титров ГА (гемагглютинации) и ЭБ (эритроцитов барана) проводили на 7 и 14 дни после иммунизации оптимальной и субоптимальной дозами антигена в 96-луночных круглодонных планшетах. Результаты учитывали макроскопически. Схемы введения препарата аналогичны схемам при определении числа АОК (Зигль Э. Реакция гемагглютинации. - В кн.:
Иммунологические методы (под. ред. X.Фримеля). М., 1979, 108-112 с.).
3. Определение реакции ГЗТ проводили с использованием внутривенной иммунизации мышей ЭБ в дозе 2×105 кл разрешающую дозу ЭБ (1×108 кл в 0,04 мл физиологического раствора) вводили в подушечку задней лапы на 7 сутки после иммунизации. Местную воспалительную реакцию учитывали через 24 часа по разнице массы опытной (Ро) и контрольной (Рк) лапок.
4. Индекс реакции (ИР) вычисляли для каждой мыши по формуле [Kimatura К. A food weight assay method to avaluate DTH in the mice. - J.Immunol.Meth., 1980, v. 39, N2, p.277-283]:
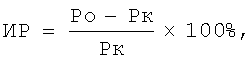
5. Определение реакции «трансплантант против хозяина». Развитие РТПХ вызывали введением в подушечку правой задней лапы мышей FI (СВАхС57 В1) подкожно 2×106 кл лимфатических узлов родительского генотипа (СВА). В левую лапу вводили сингенные лимфоциты. На 9 сутки определяли число клеток в 5 мл гомогената левого (контроль) и правого (опыт) лимфоузла.
6. Фагоцитарную активность перитонеальных макрофагов мышей оценивали, используя в качестве объекта фагоцитоза опсонизированные JgG3B (Argyris B.F. Role of macrophages in antibody production,- J.Immunol., 1967, v. 99, N 4, p.744-750). Макрофаги привлекали в брюшную полость раствором гидролизованного крахмала. На 3-4 сутки подкожно вводили 0,5 мл 5% взвеси ЭБ. Отмывали взвесь клеток. В окрашенном по Романовскому-Гимзе препарате определяли процент фагоцитирующих клеток. Для определения фагоцитарного индекса (ФИО, число захваченных ЭБ высчитывали спектрофотометрически по концентрации гемоглобина с использованием калибровочной кривой. Через 3 часа инкубации при 37°С вновь определяли фагоцитарный индекс (ФИ2). Индекс завершенности фагоцитоза (ИЗФ) определяли по формуле:
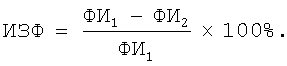
7. При определении фагоцитарной активности in vivo мышам внутривенно вводили 25% раствор туши в объеме 0,5 мл затем в течение 15 минут через каждые 3 минуты брали кровь из орбитального синуса (0,02 мл) и вносили в 1 мл 3% уксусной кислоты. После взятия крови животное забивали, определяли вес тела, печени и селезенки. Оптическую плотность гемолизированной крови определяли на СФ-26 при длине волны 610 нм и строили график f(D). Находили точку lg 0′ (нулевого времени) и lg 10′ (по графику). Высчитывали константу (К) фагоцитоза по формуле:
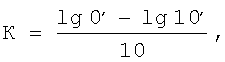
а затем вычисляли истинный показатель фагоцитоза (α) по формуле:
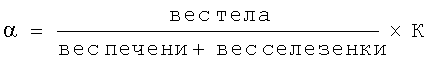
8. Активность комплемента определяли методом титрования с использованием для прямого пути активации эритроцитов кролика (ЭК), обработанных гипериммунной антисывороткой морской свинки (Tanaka S., Suzuki Т., Nishioka К. Assay of classical and alternative pathway activities of murine complement using antibody sensitized rabbit erythrocytes. J.Immunol. Meth., 1986, v. 86, p.161-170), а для альтернативного пути активации - ЭК, обработанные раствором иодида калия (Van Dijk H., Pietenel M., Klerx J., Willers J. Study of the optimal reaction condition for assay of the mouse alternative complement pathway activities. J.Immunol. Meth., 1985, v. 85, p.233-243). Активность выражали в единицах 50% лизиса на мл сыворотки (СН50).
9. Статистическая обработка результатов исследований проведена с помощью пакета прикладных программ. Использовали критерий Стьюдента и метод Уилкоксона-Манна-Уитни. При обработке результатов определения числа АОК и титров ГА оперировали логарифмическими показателями.
В части экспериментов экспериментальный эмоциональный стресс вызывали скученностью (40 мышей в клетке размером 17×25×8 см) в течение 10 дней. Контрольные животные в течение эксперимента получали ежедневно в/в 1.1% раствор соды, опытные - заявляемое средство в дозе 50 мг/кг.
2.3.1 Влияние на развитие гуморального иммунного ответа
Результаты исследования влияния заявляемого средства на формирование антителобразующих клеток (АОК) в селезенке мышей и титры гемагглютининов (ГА) в сыворотке различных линий мышей, иммунизированных оптимальной и субоптимальной дозой эритроцитов барана (ЭБ), показали следующее. При в/в введении заявляемого средства стимулирует примерно в 2 раза формирование АОК в селезенке и на титр (т.е. в 2 раза) уровень ГА в сыворотке мышей линии C57BI/6, слабоотвечающих на ЭБ, как при иммунизации оптимальной, так и субоптимальной дозой антигена. Стимуляция образования АОК у сильноотвечающих мышей FI при иммунизации субоптимальной дозой ЭБ, вызываемая исследуемым препаратом в дозах 5 и 50 мг/кг, и повышение титра ГА при введении 50 мг/кг заявляемого средства, свидетельствует о наличии адьювантных свойств.
При 7-дневном в/в введении препарата в дозе 50 мг/кг отмечено увеличение числа АОК в селезенке мышей C57BI/6 при оптимальном и субоптимальном режиме иммунизации, а титры ГА возрастали лишь при введении оптимальной дозы антигена.
Представляет интерес факт дозозависимого угнетения образования АОК в селезенке мышей FI, при введении оптимальной дозы ЭБ и снижение титра ГА в сыворотке при в/в введении препарата в дозе 50 мг/кг. Это явление может быть связано с тем, что при одновременном введении значительного количества ЭБ и анальгетика «Аноцептина» происходит активация как цепи дыхательных ферментов (Бландова З.К., Душкин В.А., Малашенко A.M., Шмидт Е.Ф. Линии лабораторных животных для медико-биологических исследований. - М.: Наука, 1983, 190 с.), так и активности монооксигеназ, в частности, цитохрома Р-450 (Ожерелков С. В., Варгин В.В., Семенов Б.Ф. Влияние экспериментального информационного и эмоционального стресса на первичный иммунный ответ мышей разных линий. - Журн. микробиол., эпидемиол. и иммунобиологии, 1985, №8, с.43-46). Последнее обстоятельство, связанное с функциональной сопряженностью иммунной системы с метаболизмом, приводит к ускорению деградации эритроцитов в фагоцитирующих клетках, уменьшению антигенных свойств ЭБ и, как следствие, к уменьшению выраженности гуморального иммунного ответа у интактных животных, полноценных по всем физиологическим параметрам.
Снижение титров ГА носит фазовый характер, и к 14 дню после иммунизации показатели опытных и контрольных групп достоверно не различаются.
Таким образом, заявляемое средство незначительно стимулирует развитие гуморального иммунного ответа, обладает адьювантными свойствами и модулирует выраженность гуморального иммунного ответа у сильноотвечающих на ЭБ линий мышей.
2.3.2. Влияние на фагоцитарную активность макрофагов
Результаты исследования влияния заявляемого средства на клиренс туши и фагоцитарную активность перитонеальных макрофагов показали, что заявляемое средство при однократном в/в введении не изменяет ни числа фагоцитирующих клеток в перитонеальном экссудате, ни способности фагоцитов к захвату опсонизированных ЭБ, однако в 1.5-2 раза увеличивает переваривающую способность макрофагов. При в/в введении в дозе 50 мг/кг препарат увеличивает содержание фагоцитирующих клеток в экссудате, но не изменяет фагоцитарный индекс (ФИ) и индекс завершенности фагоцитоза (ИЗФ). При в/в введении заявляемое средство не изменяет интенсивности захвата инертных частиц туши и не влияет на скорость очищения крови.
2.3.3. Влияние на иммунную систему стрессированных животных
Исследования влияния заявляемого средства на выраженность иммунодефицитного состояния, индуцированного эмоциональным стрессом, осуществляли по стандратной схеме. Скученность животных в течение 10 дней приводит к подавлению гуморального иммунного ответа (числа АОК и титра ГА), подавлению завершенности фагоцитоза и скорости очищения крови от инертных частиц туши. Все перечисленные нарушения, за исключением последнего, индуцированы стрессом. 10-дневное в/в введение заявляемого средства в дозе 50 мг/кг эти нарушения предотвращает (табл.3).
Таким образом, внутривенное введение заявляемого средства защищает иммунную систему от депрессивных эффектов эмоционального стресса.
Пример 3. Исследование противовоспалительных свойств заявляемого средства
Заявляемое средство стимулирует развитие гуморального иммунного ответа у слабоотвечающих мышей линии С57 В1/6 в дозах 5 и 50 мг/кг и у сильноотвечающих мышей линии F1(CBA×C57B1), иммунизированных субоптимальной дозой антигена. В дозах 5 и 50 мг/кг при в/в введении у мышей F1(CBA×C57B1), иммунизированных оптимальной дозой антигена, препарат подавляет развитие гуморального иммунного ответа.
Заявляемое средство при однократном в/в введении не влияет на выраженность реакции ГЗТ, а при 7-дневном в/в введении в дозе 50 мг/кг подавляет развитие ГЗТ у сильно реагирующей линии мышей С57 В1/6.
Препарат не влияет на развитие реакции РТПХ.
Выявлена способность препарата стимулировать завершенность фагоцитоза перитонеальных макрофагов при однократном в/в введении в дозах 5 и 50 мг/кг, а при в/в введении в дозе 50 мг/кг в течение 7 дней - способность увеличивать число фагоцитирующих клеток в перитонеальном экссудате.
Заявляемое средство не оказывает влияния на скорость очищения крови от частиц туши и активность комплемента сыворотки крови мышей.
Препарат при 10-дневном в/в введении в дозе 50 мг/кг предотвращает снижение гуморального иммунного ответа и нарушение функции макрофагов, вызываемые эмоциональным стрессом.
Пример 4. Исследование безопасности использования заявленного средства
4.1. Исследование пирогенности
Пирогенный эффект препарата изучали на кроликах массой 2.0-3.5 кг в соответствии с требованиями ГФ XI, вып.2, с.183. При введении препарата в дозе 10 мг на 1 кг массы тела животного повышение температуры у животных более чем на 0.3 С не наблюдалось. Проведенные исследования показали, что заявляемое средство (лекарственная форма в виде 1% и 2% раствора для инъекций) является апирогенным.
4.2. Исследование острой токсичности на грызунах
Для определения показателей острой токсичности заявляемое средство вводили белым мышам и крысам обоего пола внутривенно (в/в) в хвостовую вену в возрастающих дозах по Литчфилду-Уилкоксону. Расчеты средних летальных доз проводили по В.Б.Прозоровскому (Прозоровский, 1978). Для достижения больших доз препарата введение осуществляли повторно с интервалом 20-30 мин в течение 4 ч. Контрольные животные получали аналогичные по объемам введения растворителя - 1.1% раствора бикарбоната натрия (соды).
Для исследования каждой дозы препарата использовались группы по 5-6 животных одного пола. Кроме того, имелись аналогичные по численности группы контрольных животных каждого пола, которым теми же способами вводили эквивалентные объемы растворителя.
Животные распределялись по группам случайным образом методом рандомизации. В качестве критериев приемлемости рандомизации считали отсутствие внешних признаков заболеваний и гомогенность групп по весу тела (±10%).
Дозирование осуществляли на содержание действующего начала. Период наблюдения составлял 14 дней. Регистрируемые показатели: летальность, время гибели, симптоматика отравления, ежедневное наблюдение общего состояния и поведения, взвешивание до введения, на 7 и 14 дни наблюдения, объемы потребления корма и воды (для этого животные помещались в обменные клетки итальянской фирмы «Texnoplast»), вскрытие и макроскопическое исследование всех погибавших и выживших животных в конце исследования (эвтаназия у грызунов осуществлялась передозировкой эфира), определение массовых коэффициентов внутренних органов.
Результаты токсикометрии, данные наблюдений за экспериментальными животными в постинтоксикационном периоде острого отравления, а также данные некропсии позволили отнести лекарственную форму заявляемого средства к V классу практически нетоксичных лекарственных веществ (Н.Hodge et al. Clinical Toxicology of Commercial Products. Acute Poisoning. Ed. IV, Baltimore, 1975, 427 p.). ЛД50 заявляемого средства составляет 1300 мг/кг.
Состояние переживших острую интоксикацию животных свидетельствует о хорошей переносимости и безвредности препарата в дозах, превышающих максимальные терапевтические для человека в сотни раз.
Данные экспериментов на собаках подтвердили, что препарат при остром введении почти не оказывает токсического действия. Максимальная терапевтическая доза препарата для человека составляет около 5 мг/кг веса, то есть 350 мг в сутки при среднем весе 70 кг.
Доклинические исследования препарата Аноцептин (лекарственная форма в виде раствора для инъекций) на мышах, крысах, собаках, морских свинках показали, что препарат не вызывает аллергических реакций, не влияет на репродуктивную функцию, эмбриогенез, не стимулирует мутагенез и терратогенез, не оказывает негативного влияния на сердечно-сосудистую и нервную системы.
Пример 5. Использование заявляемого средства при лечении осттуберкулезных хориоретинальных дистрофий
В исследовании принимали участие 10 пациентов с диагнозом посттуберкулезная хориоретинальная дистрофия. До начала исследования все пациенты подписали форму информированного согласия. Курс лечения заявляемым средством составил 10 дней. Все пациенты получали ежедневные инъекции препарата парабульбарно по 0,5 мл 1% или 2% раствора (доза действующей субстанции коменовой кислоты составила в первом случае 10 мг в сутки во втором - 20 мг в сутки). В офтальмологии препарат вводили в один или оба глаза. Дозу препарата подбирали в зависимости от выраженности посттуберкулезных изменений. В зависимости от локализации дистрофического очага больные были разделены на группы с центральной и периферической локализацией очага. По данным экспериментального исследования выявлено, что 1% и 2% раствор заявляемого средства положительно влияет на сохранность пигментного эпителия. Для оценки эффективности действия препарата до начала лечения и по его окончании были исследованы острота зрения и поле зрения, электрофизиологическое исследование (ЭФИ) позволило оценить влияние препарата на функциональную активность клеток сетчатки. После курса лечения препаратом большинство пациентов отмечали положительную динамику. Острота зрения повысилась в среднем на 10-15%. Оценку поля зрения проводили через месяц после окончания курса лечения. Поле зрения у больных, получавших инъекции заявляемого средства, в среднем увеличилось на 4%. Изменения в поле зрения произошли на количественном и качественном уровнях. Улучшение зрительных функций соответствовало динамике показателей ЭФИ. Использование заявляемого средства при лечении дистрофии сетчатки различного генеза позволяет улучшить или нормализовать электрофизиологическую активность клеток сетчатки как по амплитуде, так по времени проведения импульса в рецепторных слоях, что способствует улучшению зрительных функций. Рекомендуемые дозы препарата - 10 мг либо 20 мг (в пересчете на действующую субстанцию коменовую кислоту) в сутки парабульбарно, в зависимости от тяжести заболевания. Курс лечения необходимо повторять два раза в год.
Эффективность использования препарата при лечении посттуберкулезных хориоретинальных дистрофий позволяет рекомендовать его для лечения хориоретинальных дистрофий различной этиологии, поскольку данная «модель исследования» объединяет дистрофические изменения ткани сетчатки поствоспалительного характера и заболевания, возникающие как осложнения после травматических явлений (ишемия, хирургические вмешательства, травмы глаза). Увеличение дозы препарата более 20 мг парабульбарно в каждый глаз технически невозможно и нецелесообразно.
Регенерирующие и противовоспалительные свойства препарата проявляются при внутривенном введении в дозе до 350 мг в сутки, дальнейшее увеличение дозы не вызывает усиления противовоспалительного эффекта, препарат начинает проявлять мягкие седативные свойства.
Реализация заявляемого изобретения не ограничивается приведенными выше примерами.
Таким образом, экспериментальные результаты, приведенные в примерах, свидетельствуют о том, что заявляемое средство обладает выраженным регенерирующим действием, обладает мощными противовоспалительными свойствами. Обнаруженные свойства препарата позволяют отнести его к широкому классу репарантов, регенерантов, метаболитов, объединяющему препараты различного происхождения и типа воздействия. Механизм действия заявляемого средства принципиально отличается от известных аналогов, т.к. оно не является пептидным и не имеет растительного происхождения. Заявляемое средство не дает аллергических реакций и не вызывает привыкания. Заявляемое средство удобно в использовании, т.к., в отличие от препарата-прототипа, является готовым раствором для инъекций. Заявляемый способ лечения с использованием указанного средства предназначен для терапии хориоретинальных дистрофий различной этиологии, является более эффективным и щадящим по сравнению с известными. Средство может быть включено в комплексную противотуберкулезную терапию для повышения эффективности используемых в ней препаратов.
Выход за рамки заявленных интервальных параметров в нижней границе приводит к невозможности реализации изобретения, в верхней границе - нецелесообразен, т.к. технически не возможен и не увеличивает регенерирующую активность.
серии
Стандартная ХТ
+ заявл. ср.
парабульбарно
N=20
группа
Стандартная
химиотерапия
N=20
(1122÷324)
398 (490÷324)
891 (933÷851)
Р2 - достоверность различий с показателями стрессированных животных
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗНЫХ УВЕИТОВ | 2006 |
|
RU2318534C2 |
| СПОСОБ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗНЫХ УВЕИТОВ | 2004 |
|
RU2290191C2 |
| АНАЛЬГЕТИЧЕСКОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ БОЛЕВОГО СИНДРОМА РАЗЛИЧНОЙ ЭТИОЛОГИИ С ПОМОЩЬЮ ЭТОГО СРЕДСТВА | 2007 |
|
RU2367432C2 |
| СРЕДСТВО, ИНГИБИРУЮЩЕЕ АНГИОГЕНЕЗ ПРИ ЗАБОЛЕВАНИЯХ ОРГАНА ЗРЕНИЯ | 2001 |
|
RU2177801C1 |
| СПОСОБ ЛЕЧЕНИЯ ХОРИОРЕТИНАЛЬНЫХ ДИСТРОФИЙ ПОСЛЕ ПЕРЕНЕСЕННОГО ТУБЕРКУЛЕЗНОГО ХОРИОРЕТИНИТА | 2009 |
|
RU2463998C2 |
| СИНТЕТИЧЕСКОЕ АНАЛЬГЕТИЧЕСКОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ НА ОСНОВЕ ЭТОГО СРЕДСТВА | 2006 |
|
RU2322977C1 |
| СПОСОБ ЛЕЧЕНИЯ ДИСТРОФИЧЕСКИХ ЗАБОЛЕВАНИЙ ГЛАЗ | 2000 |
|
RU2195297C2 |
| СРЕДСТВО, ВОССТАНАВЛИВАЮЩЕЕ ФУНКЦИЮ СЕТЧАТОЙ ОБОЛОЧКИ ГЛАЗА | 1993 |
|
RU2073518C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ВЯЛОТЕКУЩИХ ТУБЕРКУЛЕЗНЫХ УВЕИТОВ | 2004 |
|
RU2283132C2 |
| ТЕТРАПЕПТИД, СТИМУЛИРУЮЩИЙ ФУНКЦИЮ СЕТЧАТОЙ ОБОЛОЧКИ ГЛАЗА, ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2000 |
|
RU2161982C1 |
Изобретение относится к химико-фармацевтической промышленности и медицине и касается высокоэффективных синтетических регенерирующих противовоспалительных препаратов не пептидной природы, которые могут применяться в медицине для лечения хориоретинальных дистрофий различной этиологии, в том числе туберкулезного характера. Регенерирующее противовоспалительное средство представляет собой водный раствор коменовой кислоты и вспомогательного вещества - натрия гидрокарбоната, при следующем соотношении компонентов, в мас.%: коменовая кислота - 1-2, натрия гидрокарбонат - 0,55-1,1, вода для инъекций - до 100. Средство не вызывает зависимости и привыкания, интоксикации. Способ лечения хориоретинальных дистрофий различной этиологии заключается в том, что пациенту вводят регенерирующее средство парабульбарно в дозе от 10 до 20 мг (в пересчете на коменовую кислоту) один раз в сутки в течение 10 дней. При включении в комплексную противотуберкулезную терапию способ лечения заключается в том, что пациенту вводят регенерирующее средство внутривенно в дозе до 350 мг в сутки (в пересчете на коменовую кислоту) в течение 10 дней. 3 н. и 4 з.п. ф-лы, 3 табл.
1. Регенерирующее противовоспалительное средство, представляющее собой водный раствор активного начала - коменовой кислоты и вспомогательного вещества - натрия гидрокарбоната, при следующем соотношении компонентов, мас.%:
2. Регенерирующее противовоспалительное средство по п.1, отличающееся тем, что оно дополнительно содержит примесь коменовой кислоты - бензилкоменовую кислоту - в количестве не более 2,5% в пересчете на коменовую кислоту.
3. Способ лечения хориоретинальных дистрофий различной этиологии, заключающийся в том, что пациенту вводят регенерирующее средство по пп.1 и 2 парабульбарно в дозе от 10 до 20 мг (в пересчете на коменовую кислоту) один раз в сутки в течение 10 дней.
4. Способ лечения по п.3, отличающийся тем, что курс лечения повторяют 2-3 раза в год.
5. Способ лечения по п.3, отличающийся тем, что пациенту вводят регенерирующее средство в один или оба глаза.
6. Способ повышения эффективности противотуберкулезной терапии, заключающийся в том, что пациенту вводят регенерирующее средство по пп.1 и 2 внутривенно в дозе до 350 мг в сутки (в пересчете на коменовую кислоту) в течение 10 дней.
7. Способ лечения по п.6, отличающийся тем, что курс лечения проводят 1-3 раза в год с перерывом в 3-6 мес.
| ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ СЕДАТИВНЫМ ДЕЙСТВИЕМ | 2002 |
|
RU2209062C1 |
| САНИ | 1927 |
|
SU9609A1 |
| Пюпитр для пишущей машины | 1927 |
|
SU9430A1 |
| СПОСОБ ЛЕЧЕНИЯ ЦЕНТРАЛЬНОЙ ХОРИОРЕТИНАЛЬНОЙ ДИСТРОФИИ | 2001 |
|
RU2217112C2 |
| Способ хирургического лечения хориоретинальных дистрофий | 1986 |
|
SU1388032A1 |
Авторы
Даты
2009-07-27—Публикация
2007-09-27—Подача