ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым бактериальным изолятам, идентифицированным по их ДНК 16S pPHK и вызывающим пародонтоз у животных-компаньонов; к полинуклеотидным последовательностям, содержащимся в этих изолятах; к полипептидам, кодируемым такими полинуклеотидными последовательностями; и к вакцинам, содержащим указанные бактериальные изоляты, которые были инактивированы или аттенуированы, а также к их полинуклеотидам или полипептидам. Настоящее изобретение также относится к способам лечения и предупреждения пародонтоза и к наборам для диагностики, лечения и предупреждения пародонтоза. Кроме того, настоящее изобретение относится к способам оценки эффективности вакцины против пародонтозов у животного.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В результате обследования людей или исследования бактерий, выделенных у этих людей, было получено большое число экспериментальных данных, относящихся к пародонтозам. О пародонтозе у животных, не являющихся человеком, таких как домашние питомцы, а в частности собаки и кошки, имеется относительно мало данных.
Пародонтоз представляет собой группу инфекций, поражающих опорные ткани зубов. Такие поражения могут быть как легкими, так и тяжелыми и могут проявляться обратимым воспалением десны (gingiva), хронической деструкцией тканей периодонта (десны, периодантальной связки и альвеолярного отростка) и, в конечном счете, выпадением зубов.
Некоторые признаки этого заболевания представляют интерес с микробиологической точки зрения. Бактериальная этиология этого заболевания является сложной, поскольку за развитие и прогрессирования этого заболевания у человека ответственны многие микроорганизмы. Многие из этих организмов, если не все, могут также присутствовать у человека со здоровыми зубами и могут существовать в гармоничном симбиозе с хозяином. Так, например, признаки такого заболевания могут возникать в результате смещения экологического баланса между бактериальным и хозяйским факторами, например в результате изменения абсолютного или относительного числа некоторых микроорганизмов, изменения патогенного потенциала или модуляции конкретных факторов хозяина. Локальное микроокружение накладывает ряд уникальных ограничений на компоненты микробиоты наддесневой поверхности зуба и поддесневой борозды (канала между корнем зуба и десной, который при прогрессировании заболевания распространяется на зубодесневой карман).
Обызвествленные твердые ткани зуба и эпителиальные клетки десны являются доступными для колонизации бактериями. Эти ткани подвергаются воздействию выделяющейся слюны и жидкости десневой борозды (экссудата сыворотки), которые оба содержат молекулы, непосредственно взаимодействующие с бактериями и значительно изменяющие условия окружающей микросреды. Кроме того, известно, что у человека микроорганизмы, которые успешно колонизируют зубную ткань и поддесневую область, должны сосуществовать со множеством (свыше 600) бактерий других видов, которые обитают на этих участках. Таким образом, исследование патогенеза пародонтозов у человека представляет определенные трудности из-за сложности экологического микроокружения.
Классификация различных манифестаций пародонтоза у человека постоянно меняется, однако достаточно упомянуть, что эти заболевания отличаются по степени тяжести, скорости прогрессирования и числу пораженных зубов и что после прорезывания молочных зубов люди различных возрастных групп могут быть восприимчивыми к этому заболеванию. При заболеваниях такого рода природа патогенных агентов варьируется у различных пациентов и даже у одного пациента на различных участках поражения тела этого пациента. Однако обычно тяжелые формы этого заболевания ассоциируются с рядом грамотрицательных анаэробных бактерий. Существует множество данных, свидетельствующих о том, что из этой группы бактерий, поражающих человека, определенную роль играет бактерия Porphyromonas gingivalis (ранее называемая Bacteroides). Присутствие этого микроорганизма, действующего отдельно или в совокупности с другими инвазивными бактериями, а возможно, в отсутствие полезных видов бактерий и некоторых иммунологических ответов у хозяина, очевидно, играет главную роль в развитии данного заболевания.
Для колонизации ротовой полости необходимо, чтобы бактерии сначала проникали в рот, а затем локализовались в ротовой полости и заселяли доступные поверхности. Защитными факторами хозяина, действие которых направлено на предупреждение бактериальной колонизации, являются механические сдвигающие силы, возникающие при движения языка вместе с потоком слюны и жидкости десневой борозды. Поэтому успешная колонизация ротовой полости имеет ряд характерных признаков, позволяющих преодолеть защитные механизмы хозяина. Биопленка, состоящая из “сидячих” бляшек, которая затем аккумулируется на твердых и мягких тканях ротовой полости, представляет собой динамическую систему, состоящую из различных микробиологических видов. У человека P. gingivalis являются поздними или вторичными инвазивными микроорганизмами, колонизирующими ротовую полость, и требуют присутствия микроорганизмов-предшественников для создания необходимых условий окружающей среды.
Считается, что начальное внедрение бактерии P. gingivalis в ротовую полость человека происходит путем ее передачи от инфицированного человека. Поэтому очевидно, что должны действовать и другие переносчики инфекции. Эти исследования показали, что некоторые индивидуумы заражаются микроорганизмом одного (или, по меньшей мере, преобладающего) генотипа независимо от участка колонизации или клинического статуса. В противоположность этому, у других индивидуумов присутствуют штаммы, происходящие от многих других клональных видов бактерий. Это подтверждает существующее мнение, что P. gingivalis является в основном условно-патогенным микроорганизмом, вирулентность которого не ограничена конкретным клональным типом.
Ротовая полость человека имеет множество поверхностей, которые могут быть заселены P. gingivalis. Такими поверхностями являются минерализованные твердые ткани зубов и поверхности слизистой, включая поверхности десны, щеки и языка.
Хотя о пародонтозе человека имеется много данных, описанных выше, однако о таком заболевании у домашних животных известно очень мало. В работе Foumier D. et al. “Porphorymonas gulae sp., nov., an Anaerobic, Gram-negative, Coccibacillus from the Gingival Sulcus of Various Animal Hosts”, International Journal of a Systematic and Evolutionary Microbiology (2001), 51, 1179-1189, описано несколько штаммов, выделенных у различных животных-хозяев, включая штамм P.gulae spp.nov., имеющий регистрационный номер АТСС 57100, Авторами настоящего изобретения была выдвинута гипотеза, что штаммы биотипа P. gingivalis, поражающие животных, представляют собой виды Porphyromonas, которые отличаются от P. gingivalis. При этом в данной работе нет каких-либо упоминаний о вакцине, которая может быть использована для лечения пародонтоза у животных-компаньонов. В работе Hirasawa и Takada “Porphyromonas gingivicanis sp.nov. and Porphyromonas crevioricanis sp. nov., Isolated from Beagles”, International Journal of Systemic Bacteriology, pp.637-640 (1994) описаны два вида бактерий, выделенных из жидкости десневой борозды коротконогих гончих. Эти виды бактерий описаны в патентах США № 5710039 и 5563063. Авторы указанных работ не высказывают каких-либо предположений об использовании этих видов бактерий в вакцине против пародонтоза. В международной заявке РСТ/AU98/01023, опубликованной под номером WO 99/19870, описаны различные полипептиды и нуклеотиды P. gingivalis. Однако в этой работе отсутствуют какие-либо упоминания о вакцинах, эффективных для предупреждения пародонтоза у животных-компаньонов. Хотя имеется большое количество информации об этом заболевании у человека, однако было предпринято очень мало мер по предупреждению или лечению такого заболевания даже у человека.
Поэтому необходимость в разработке надежной и эффективной вакцины для лечения и предупреждения пародонтоза у животных-компаньонов остается актуальной.
В работе Genco et al. (Trends in Microbiology 6:444-449, 1998) описана крысиная модель для исследования пародонтоза, опосредуемого Porphyromonas gingivicanis. В работе Grecca et al. (J. Endodontics 27: 610, 2001) описано рентгенографическое исследование восстановления околокорневой части зуба после лечения эндодонта зубов у собак с индуцированным периодонтитом околокорневой части зуба.
В работах, предшествующих настоящему изобретению, отсутствуют какие-либо упоминания о животном-модели, подходящем для оценки эффективности вакцины против одной или нескольких периопатогенных бактерий описательным или количественным методом.
ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к выделенным пигментированным анаэробным бактериям, имеющим последовательность ДНК для 16S рРНК, включающую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 86-94, при условии что указанная бактерия не является собачьим штаммом Porphyromonas gingivalis, обозначенным 20В.
В одном из вариантов изобретения данная бактерия выбрана из группы, состоящей из Porphyromonas gulae B43, P. cansulci B46, P. circumdentaria B52, P. gulae В69, P. circumdentaria B97, P. cangingivalis B98, P. salivosa В104, O. denticanis B106 и P. endodontalis В114, при условии что указанные бактерии не являются собачьим штаммом Porphyromonas gingivalis, обозначенным 20В.
В другом своем варианте настоящее изобретение относится к выделенной пигментированной анаэробной бактерии, которая вызывает либо непосредственно, либо в комбинации с другими патогенными агентами пародонтоз у животных-компаньонов, где указанная бактерия может быть использована в целях приготовления вакцины для лечения или предупреждения пародонтоза у животных-компаньонов, где указанная вакцина содержит иммунологически эффективное количество, по меньшей мере, одной бактерии, которая была инактивирована или аттенуирована, при условии что такая бактерия не является штаммом P. gulae sp. nov., имеющим регистрационный номер АТСС 51700. Предпочтительно указанная бактерия имеет последовательность ДНК 16S pPHK, которая, по меньшей мере, примерно на 95% гомологична любой из последовательностей, представленных в SEQ ID NO: 86-94. Более предпочтительно указанная бактерия имеет последовательность ДНК 16S pPHK, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 86-94.
В другом своем варианте настоящее изобретение относится к выделенной пигментированной анаэробной бактерии, которая вызывает либо непосредственно, либо в комбинации с другими патогенными агентами пародонтоз у животных-компаньонов, где указанная бактерия может быть использована в целях приготовления вакцины для лечения или предупреждения пародонтоза у животных-компаньонов, где указанная вакцина содержит выделенный полипептид в количестве, иммунологически эффективном для предупреждения или лечения пародонтоза у животных-компаньонов, где указанный полипептид кодируется полинуклеотидной молекулой, выделенной из указанной бактерии, при условии что указанная бактерия не является штаммом P. gulae sp. nov., имеющим регистрационный номер АТСС 51700. Предпочтительно указанная бактерия имеет последовательность ДНК 16S pPHK, которая, по меньшей мере, примерно на 95% гомологична любой из последовательностей, представленных в SEQ ID NO: 86-94. Более предпочтительно указанная бактерия имеет последовательность ДНК 16S pPHK, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 86-94.
В другом своем варианте настоящее изобретение относится к выделенной пигментированной анаэробной бактерии, которая вызывает либо непосредственно, либо в комбинации с другими патогенными агентами пародонтоз у животных-компаньонов, где указанная бактерия может быть использована в целях приготовления вакцины для лечения или предупреждения пародонтоза у животных-компаньонов, где указанная вакцина содержит выделенную полинуклеотидную молекулу, кодирующую полипептид в количестве, иммунологически эффективном для предупреждения или лечения пародонтоза у животных-компаньонов, где указанная полинуклеотидная молекула выделена из указанной бактерии, при условии что указанная бактерия не является штаммом P. gulae sp. nov., имеющим регистрационный номер АТСС 51700. Предпочтительно указанная бактерия имеет последовательность ДНК 16S pPHK, которая, по меньшей мере, примерно на 95% гомологична любой из последовательностей, представленных в SEQ ID NO: 86-94. Более предпочтительно указанная бактерия имеет последовательность ДНК 16S pPHK, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 86-94.
Предпочтительным животным-компаньоном является собака или кошка.
В другом своем аспекте настоящее изобретение относится к выделенной полинуклеотидной молекуле, содержащей нуклеотидную последовательность, выделенную из бактерий, выбранных из группы, состоящей из бактерий, имеющих идентифицирующие признаки Porphyromonas gulae B43, P. cansulci B46, P. circumdentaria B52, P. gulae В69, P. circumdentaria B97, P. cangingivalis B98, P. salivosa В104, O. denticanis B106 и P. endodontalis В114, при условии что указанные бактерии не являются штаммом P.gulae sp. nov., имеющим регистрационный номер АТСС 51700.
В одном из вариантов изобретения указанная выделенная полинуклеотидная молекула выделена из бактерии, выбранной из группы, состоящей из Porphyromonas gulae B43, P. cansulci B46, P. circumdentaria B52, P. gulae В69, P. circumdentaria B97, P. cangingivalis B98, P. salivosa В104, O. denticanis B106 и P. endodontalis В114.
В другом варианте изобретения выделенный полинуклеотид кодирует полипептид.
В еще одном варианте изобретения выделенный полинуклеотид кодирует рибосомную РНК или транспортную РНК.
В другом своем варианте настоящее изобретение относится к выделенной полинуклеотидной молекуле, содержащей любую из нуклеотидных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 86-94 и их гомологов, имеющих, по меньшей мере, 95% гомологию, при условии что указанная нуклеотидная последовательность не является последовательностью ДНК 16S pPHK, происходящей от бактерии P. gulae sp. nov., имеющей регистрационный номер АТСС 51700.
Предпочтительно выделенная полинуклеотидая молекула, содержащая любую из нуклеотидных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 95-102 и 111-119 (fimA или oprF соответственно), где указанная последовательность кодирует полипептид или комплементарные ему последовательности, обладающие иммунологической эффективностью в качестве вакцины для предупреждения или лечения пародонтоза у животных-компаньонов.
Также предпочтительным является выделенная полинуклеотидная молекула, содержащая любую из нуклеотидных последовательностей, представленных SEQ ID NO: 95-102 и 111-119, их гомологов, которые, по меньшей мере, на 95% гомологичны этим последовательностям, где указанная последовательность кодирует полипептид или комплементарные ему последовательности, обладающие иммунологической эффективностью в качестве вакцины для предупреждения или лечения пародонтоза у животных-компаньонов.
В другом варианте изобретения выделенная полинуклеотидная молекула содержит любую из нуклеотидных последовательностей, представленных в SEQ ID NO: 95-102 и 111-119 или их фрагментов или вариантов, где указанная последовательность кодирует полипептид или комплементарные ему последовательности, обладающие иммунологической эффективностью в качестве вакцины для предупреждения или лечения пародонтоза у животных-компаньонов.
В еще одном варианте изобретения выделенная полинуклеотидная молекула содержит нуклеотидную последовательность, которая гибридизуется в условиях высокой жесткости с любой из последовательностей, представленных в SEQ ID NO: 95-102 и 111-119 или с их комплементарной ей последовательностью. Предпочтительно указанная выделенная полинуклеотидная последовательность содержит последовательность fimA, выбранную из любых последовательностей, представленных в SEQ ID NO: 95-102, ее фрагмента или варианта, где указанный фрагмент или вариант имеет последовательность, которая, по меньшей мере, примерно на 95%, 98% или 99% идентична указанной последовательности. Также предпочтительной является выделенная полинуклеотидная молекула, последовательность которой содержит последовательность oprF, выбранную из любых последовательностей, представленных в SEQ ID NO: 111-119, ее фрагмента или варианта, где указанный фрагмент или вариант имеет последовательность, которая, по меньшей мере, примерно на 95%, 98% или 99% идентична указанной последовательности.
Предпочтительно указанный фрагмент или вариант полинуклеотидной последовательности согласно изобретению, по меньшей мере, примерно на 98% гомологичен этой последовательности.
В другом своем варианте настоящее изобретение относится к выделенной полинуклеотидной молекуле, содержащей нуклеотидную последовательность, которая гибридизуется в условиях высокой жесткости с последовательностью fimA, выбранной из любых последовательностей, представленных в SEQ ID NO: 95-102, или с комплементарными ей последовательностями.
В еще одном своем варианте настоящее изобретение относится к выделенной полинуклеотидной молекуле, содержащей нуклеотидную последовательность, которая гибридизуется в условиях высокой жесткости с последовательностью oprF, выбранной из любых последовательностей, представленных в SEQ ID NO: 111-119, или с комплементарными ей последовательностями.
Настоящее изобретение также относится к выделенной полинуклеотидной молекуле, содержащей нуклеотидную последовательность примерно из 30 нуклеотидов, которая гибридизуется в условиях высокой жесткости с молекулой ДНК, имеющей нуклеотидную последовательность, кодирующую полипептид, имеющий, по меньшей мере, примерно 10 смежных аминокислот любого из полипептидов, кодируемых любыми из нуклеотидных последовательностей SEQ ID NO: 95-102 и 109-119, или комплементарными последовательностями. Предпочтительно указанная выделенная полинуклеотидная молекула содержит, по меньшей мере, примерно 90 нуклеотидов, которые гибридизуются в условиях высокой жесткости с молекулой ДНК, имеющей нуклеотидную последовательность, кодирующую полипептид, имеющий последовательность, которая состоит, по меньшей мере, примерно из 30 смежных аминокислот любого из полипептидов, кодируемых любой из нуклеотидных последовательностей, представленных в SEQ ID NO: 95-102 и 111-119, или комплементарными последовательностями.
В другом своем аспекте настоящее изобретение относится к выделенному полинуклеотиду согласно изобретению, функционально присоединенному к гетерологичному промотору. Такой выделенный полинуклеотид может также содержать ориджин репликации, обладающий активностью в прокариотической или в эукариотической клетке.
В другом своем аспекте настоящее изобретение относится к рекомбинантному экспрессионному вектору, содержащему полинуклеотид, выбранный из группы, состоящей из любой нуклеотидной последовательности SEQ ID NO: 95-102 и 111-119, их фрагментов или вариантов, функционально присоединенных к промоторной последовательности.
В еще одном своем аспекте настоящее изобретение относится к плазмиде, содержащей полинуклеотид, выбранный из группы, состоящей из любой нуклеотидной последовательности SEQ ID NO: 95-102 и 111-119, их фрагментов или вариантов, функционально присоединенных к промоторной последовательности.
В другом своем аспекте настоящее изобретение относится к клетке-хозяину, содержащей выделенную полинуклеотидную последовательность, вектор или плазмиду согласно изобретению.
Предпочтительно указанной клеткой-хозяином является BL21 E.coli, а указанный полинуклеотид дополнительно содержит экспрессионный вектор pBAD/HisA или экспрессионную плазмиду λ.
В другом своем аспекте настоящее изобретение относится к способу продуцирования рекомбинантного FimA или OprF, выбранного из любых последовательностей, представленных в SEQ ID NO: 103-110 или 120-128, или их фрагментов или вариантов, где указанный способ включает (1) культивирование клеток по пункту 36 формулы изобретения в условиях, при которых экспрессируется полипептид, содержащий FimA, OprF или их фрагменты или варианты, и (2) выделение указанного полипептида. Такой полипептид может быть выделен в растворимой или в нерастворимой форме.
В другом аспекте изобретения выделенный полипептид согласно изобретению является иммунологически эффективным при его использовании в качестве вакцины для предупреждения или лечения пародонтоза у животных-компаньонов и содержит аминокислотную последовательность, представленную в SEQ ID NO: 103-110 и 120-128.
В одном из вариантов изобретения указанный выделенный полипептид является иммунологически эффективным при его использовании в качестве вакцины для предупреждения или лечения пародонтоза у животных-компаньонов и содержит аминокислотную последовательность, представленную в SEQ ID NO: 103-110 и 120-128, и ее гомологи, имеющие последовательность, по меньшей мере, на 95%, 98% или на 99% идентичную этой последовательности.
В другом варианте изобретения указанный выделенный полипептид является иммунологически эффективным при его использовании в качестве вакцины для предупреждения или лечения пародонтоза у животных-компаньонов и содержит аминокислотную последовательность, представленную в SEQ ID NO: 103-110 и 120-128, или ее фрагменты или варианты.
В еще одном варианте изобретения указанный выделенный полипептид является иммунологически эффективным при его использовании в качестве вакцины для предупреждения или лечения пародонтоза у животных-компаньонов и содержит аминокислотную последовательность, кодируемую молекулой ДНК, включающей нуклеотидную последовательность, которая гибридизуется в условиях высокой жесткости с любой из последовательностей, представленных в SEQ ID NO: 95-102 и 111-119.
В еще одном варианте изобретения указанный выделенный полипептид является иммунологически эффективным при его использовании в качестве вакцины для предупреждения или лечения пародонтоза у животных-компаньонов, где указанный полипептид содержит, по меньшей мере, примерно 10 смежных аминокислот, составляющих фрагмент любой из полипептидных последовательностей SEQ ID NO: 103-110 и 120-128, и где указанный полипептид является иммунологически эффективным при его использовании либо отдельно, либо в сочетании с носителем, в качестве вакцины для предупреждения или лечения пародонтоза у животных-компаньонов. Такой выделенный полипептид предпочтительно содержит, по меньшей мере, примерно 25 аминокислот.
Предпочтительно выделенный полипептид, предназначенный для предупреждения или лечения пародонтоза у животных-компаньонов, кодируется молекулой ДНК, содержащей нуклеотидную последовательность, включающую последовательность fimA (SEQ ID NO: 95-102).
Предпочтительным также является выделенный полипептид, предназначенный для предупреждения или лечения пародонтоза у животных-компаньонов и кодируемый молекулой ДНК, содержащей нуклеотидную последовательность, включающую последовательность oprF (SEQ ID NO: 111-119).
В предпочтительном варианте изобретения указанным выделенным полипептидом является рекомбинантно экспрессируемый полипептид, выбранный из группы, состоящей из FimA (SEQ ID NO: 103-110) и OprF (SEQ ID NO: 120-128).
В другом варианте изобретения указанный рекомбинантно экспрессируемый полипептид присоединен к полипептиду-носителю. Предпочтительно указанный гибридный полипептид, по существу, имеет полигистидиновую или политреониновую последовательность.
В другом своем аспекте настоящее изобретение относится к вакцине для лечения или предупреждения пародонтоза у животных-компаньонов, содержащей иммунологически эффективное количество, по меньшей мере, одной инактивированной пигментированной анаэробной бактерии согласно изобретению и фармацевтически приемлемый носитель.
В другом своем варианте настоящее изобретение относится к вакцине для лечения или предупреждения пародонтоза у животных-компаньонов, содержащей иммунологически эффективное количество, по меньшей мере, одной инактивированной пигментированной анаэробной бактерии; и, по меньшей мере, одной другой бактерии или вируса; и фармацевтически приемлемый носитель.
В предпочтительном варианте изобретения указанная вакцина содержит иммунологически эффективное количество, по меньшей мере, одной инактивированной пигментированной анаэробной бактерии; по меньшей мере, одного вируса чумы собак (CDV), собачьего аденовируса-2 (CAV-2), собачьего парвовируса (CPV), вируса собачьего парагриппа (CPI) или собачьего коронавируса (CCV) и фармацевтически приемлемый носитель.
В другом своем аспекте настоящее изобретение относится к вакцине для лечения или предупреждения пародонтоза у животных-компаньонов, содержащей иммунологически эффективное количество, по меньшей мере, одного полинуклеотида согласно изобретению и фармацевтически приемлемый носитель.
В другом своем аспекте настоящее изобретение относится к вакцине для лечения или предупреждения пародонтоза у животных-компаньонов, содержащей иммунологически эффективное количество, по меньшей мере, одного полипептида согласно изобретению и фармацевтически приемлемый носитель.
Предпочтительно указанная вакцина для лечения или предупреждения пародонтоза у животных-компаньонов содержит иммунологически эффективное количество FimA и фармацевтически приемлемый носитель.
Предпочтительной также является вакцина для лечения или предупреждения пародонтоза у животных-компаньонов, содержащая иммунологически эффективное количество OprF и фармацевтически приемлемый носитель.
Бактерия, предназначенная для использования в вакцинах согласно изобретению, может быть выбрана из группы, состоящей из Porphyromonas gulae B43, P. cansulci В46, P. circumdentaria В52, P. gulae В69, P. circumdentaria В97, P. cangingivalis В98, P. salivosa В104, O. denticanis В106 и P. endodontalis В114.
В предпочтительном варианте изобретения пигментированными анаэробными бактериями являются P. gulae В43, P. salivosa В104 и O. denticanis В106.
В еще одном своем варианте настоящее изобретение относится к вакцинной композиции для лечения или предупреждения пародонтоза у животных-компаньонов, содержащей иммунологически эффективное количество, по меньшей мере, одной инактивированной выделенной пигментированной анаэробной бактерии согласно изобретению, фармацевтически приемлемый носитель и, необязательно, адъювант.
В еще одном своем варианте настоящее изобретение относится к вакцинной композиции для лечения или предупреждения пародонтоза у животных-компаньонов, содержащей иммунологически эффективное количество, по меньшей мере, одной полинуклеотидной молекулы согласно изобретению, фармацевтически приемлемый носитель и, необязательно, адъювант.
В другом своем варианте настоящее изобретение относится к вакцинной композиции для лечения или предупреждения пародонтоза у животных-компаньонов, содержащей иммунологически эффективное количество, по меньшей мере, одного полипептида согласно изобретению, фармацевтически приемлемый носитель и, необязательно, адъювант.
В другом своем аспекте настоящее изобретение относится к способу лечения или предупреждения пародонтоза у животных-компаньонов, включающему введение указанному животному-компаньону, нуждающемуся в этом, вакцинной композиции согласно изобретению.
В другом своем аспекте настоящее изобретение относится к способу диагностики пародонтоза у животных-компаньонов, проводимой путем анализа образца на присутствие бактерий, полипептидов или полинуклеотидов согласно изобретению, где такое присутствие бактерий, полипептидов или полинуклеотидов согласно изобретению является показателем заболевания. Предпочтительно стадия анализа включает оценку образца методом, выбранным из группы, состоящей из ПЦР, гибридизации и детекции антитела.
В еще одном своем аспекте настоящее изобретение относится к набору, включающему, по меньшей мере, в одном контейнере, композицию, предназначенную для лечения и предупреждения пародонтоза у животных-компаньонов и содержащую эффективное количество, по меньшей мере, одной инактивированной выделенной пигментированной анаэробной бактерии, полипептида или полинуклеотида согласно изобретению и фармацевтически приемлемый носитель, где указанный набор дополнительно содержит отпечатанные инструкции по применению данного набора для лечения или предупреждения пародонтоза у животных-компаньонов. Такой набор может также содержать средство для введения указанной композиции.
В другом своем аспекте настоящее изобретение относится к набору, содержащему, по меньшей мере, в одном контейнере, выделенную молекулу ДНК, включающую нуклеотидную последовательность, состоящую, по меньшей мере, примерно из 15 смежных нуклеотидов, выбранных из любых последовательностей SEQ ID NO: 86-94, 95-102 и 111-119, которые гибридизуются в условиях высокой жесткости с последовательностью, комплементарной любой из нуклеотидных последовательностей, представленных в SEQ ID NO: 86-94, 95-102 и 111-119, и вторую выделенную молекулу ДНК, включающую нуклеотидную последовательность, содержащуюся во втором контейнере и включающую нуклеотидную последовательность, состоящую, по меньшей мере, примерно из 15 смежных нуклеотидов и выбранную из последовательностей, комплементарных любой из нуклеотидных последовательностей, представленных в SEQ ID NO: 86-94, 95-102 и 111-119, которые гибридизуются в условиях высокой жесткости с любой из нуклеотидных последовательностей, представленных в SEQ ID NO: 86-94, 95-102 и 111-119, где указанный набор дополнительно включает инструкции по его применению для детекции Porphyromonas spp. Указанный метод может быть применен, по существу, для всех млекопитающих включая человека.
В еще одном своем аспекте настоящее изобретение относится к набору, содержащему, по меньшей мере, в одном контейнере, белок, имеющий аминокислотную последовательность, содержащую, по меньшей мере, 30 смежных аминокислот, где указанный полипептид кодируется любой из нуклеотидных последовательностей SEQ ID NO: 95-102 и 111-119, и рекомендации по применению данного набора для детекции Porphyromonas spp. Этот набор может дополнительно включать второй полипептид, который представляет собой антитело, конъюгированное с ферментом, катализирующим колориметрические или хемилюминесцентные реакции. Такой фермент предпочтительно выбран из группы, состоящей из щелочной фосфатазы и пероксидазы хрена. Указанный набор может дополнительно содержать реагенты для колориметрического или хемилюминесцентного анализа.
В другом своем аспекте настоящее изобретение относится к набору для гибридизации, содержащему, по меньшей мере, в одном контейнере, выделенную молекулу ДНК, включающую нуклеотидную последовательность, состоящую, по меньшей мере, примерно из 15 смежных нуклеотидов и выбранную из любых последовательностей SEQ ID NO: 86-94, 95-102 и 111-119, или комплементарных ей последовательностей, где указанная гибридизация является специфической по отношению к Porphyromonas spp. и где указанный набор дополнительно содержит инструкции по его применению для детекции Porphyromonas spp. Такую гибридизацию предпочтительно осуществляют в условиях высокой жесткости.
В еще одном своем аспекте настоящее изобретение относится к способам оценки эффективности вакцины против одной или нескольких периопатогенных бактерий у животного, а в частности у собак.
В еще одном своем аспекте настоящее изобретение относится к способам оценки эффективности вакцины против одной или нескольких периопатогенных бактерий, где клиническими признаками, диагностированными у животного, являются повышенные уровни одного или нескольких периопатогенных бактерий в жидкости десневого кармана, в бляшках, в инфицированной кости или в зубодесневом кармане, или изменения количества альвеолярного отростка, определенные посредством рентгенографических измерений.
Бактерии, полинуклеотиды, полипептиды, вакцины, вакцинные композиции или наборы согласно изобретению не включают ни одну из бактерий и ни один из полинуклеотидов или пептидов, описанных в публикации Fournier D. et al., “Porphyromonas gulae sp. nov., an Anaerobic, Gram-negative, Coccibacillus from the Gingical Sulcus of Various Animal Hosts”, International Journal of a Systematic and Evolutionary Microbiology (2001), 51, 1179-1189, включая штамм P. gulae sp. nov., имеющий регистрационный номер АТСС 51700; и в публикации Hirasawa and Takada, “Porphyromonas gingivicanis sp. nov. and Porphyromonas crevioricanis sp. nov., Isolated from Beagles”, International Journal of Systemic Bacteriology, pp.637-640 (1994), в патентах США № 5710039 или 5563063, или в международной заявке РСТ/AU98/01023, опубликованной под регистрационным номером WO 99/29870.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
На фиг.1 представлено филогенетическое дерево, построенное методом “ближайшего соседа” (neighbor-joining) для репрезентативных бактерий класса Bacteroidetes. Это филогенетическое дерево было построено с использованием компьютерных программ CLUSTAL Х, версия 1,81, и NJ Plot (обе эти программы можно найти на сайте ftp://ftp-igbmc.u-strasbg.fr/pub/ClustalXJ). Указанное дерево было укоренено, и его основанием (корнем) является последовательность гена 16S pPHK Esсherichia coli (регистрационный номер J01695; данные не приводятся). “Бутстреп”-анализ осуществляли с использованием 1000 копий. Бутстреп-величины представлены графически (● - >950; ■ - >850; ○ - >700; □ - >500; не обозначено - <500). Отрезок на графике, 0,01, представляет масштаб замен на одно положение нуклеотида. Стрелки указывают на локализацию O.denticanis B106T. Регистрационные номера: P. gingivalis ATCC 33277, J01695; P. gulae B243, AF285874; P. cansulci VPB 4875, X76260; P. salivosa NCTC 11632, L26103; P. endodontalis ATCC 35406, AY253728; T. forsythensis ATCC 43037, AB035460; Bacteroides cf. forsythus, клон BU45, выделенный из ротовой полости, AF385565; B. merdae ATCC 43184T, X83954; B. distasonis ATCC 8503, M86695; бактерия лошадиных фекалий, 118ds10, AY212569; D. shahii, штамм CCUG 43457, AJ319867; клон некультивированной бактерии Bacteroideceae: Rs-P82, AB088919; некультивированная бактерия cadhufec 059h7, AF530302; B. splanchnicus NCTC 10825, L16496; O. denticanis B106T, AY560020; Bacteroidetes sp., клон ротовой полости FX069, AY134906; некультивированная бактерия SHA-38, AJ249105; A. putredinis ATCC 29800, L16497; R. microfusus ATCC 29728, L16498; B. denticanium B78, AY549431; B. fragilis ATCC 25285T, X83935; B. thetaiotaomicron, штамм 17.4, AY319392; B. acidofaciens, штамм А37, AB021163; P. bivia ATCC 29303, L16475; P. nigrescens ATCC 25261, L16479; P. intermedia ATCC 25611, L16468; P. denticola ATCC 35308, L16467 и P. buccae ATCC 33690, L16478.
На фиг.2 представлено филогенетическое дерево, построенное методом “ближайшего соседа” для клинических изолятов бактерий Odoribacter denticanis. Это филогенетическое дерево было построено, как показано на фиг.1. Указанное дерево было укоренено, и его основанием является последовательность гена 16S pPHK Porphyromonas gingivalis ATCC 53977 (регистрационный номер L16492; данные не приводятся). Отрезок на графике, 0,01, представляет масштаб замен на одно положение нуклеотида. Регистрационные номера: O.denticanis B106T, AY560020; O.denticanis B113, AY560022; O.denticanis B150, AY560027; O.denticanis B155, AY560030; O.denticanis B172, AY560033; O.denticanis B183, AY560035; Bacteroidetes sp., клон FX069, выделенный из ротовой полости, AY134906; некультивированная бактерия cadufec 059h7, AF530302; B. splanchnicus NCTC 10825 и клон некультивированной бактерии Bacteroideceae: Rs-P82, AB088919.
На фиг.3 представлено филогенетическое дерево, построенное методом “ближайшего соседа” для репрезентативных белков семейства FimA Porphyromonas gingivalis (классы I-V). Это филогенетическое дерево было построено с использованием компьютерных программ CLUSTAL Х, версия 1.81, и NJ Plot. Это дерево было укоренено, и его основанием является белок фимбриллин CFT073 Esсherichia coli (регистрационный номер NP_757241; данные не приводятся). Бутстреп-анализ осуществляли с использованием 1000 копий. Бутстреп-величины представлены графически (● - >950; ■ - >850; ○ - >700; □ - >500; не обозначено, - <500). Отрезок на графике, 0,05, представляет масштаб замен на одно положение аминокислоты. Регистрационные номера FimA: O.denticanis B106T, AY573801; P.gingivalis HG1691, Q93R80; P.gingivalis BH18/10, JN0915; P.gingivalis ATCC 33277, Р13793; P.gingivalis OMZ314, BAA04624; P.gingivalis OMZ409, Q51822; P.gingivalis 6/26, Q51826; P.gingivalis ATCC 49417, Q51825; P.gingivalis W83, AAQ67087; P.gingivalis HG564, Q51827 и P.gingivalis HNA-99, Q9S0W8.
На фиг.4 представлены фотографии (А) P.gulae B43 и (В) O.denticanis B106T, полученные на сканирующем электронном микроскопе. Указанный отрезок означает масштаб размера - 1000 нм.
На фиг.5 графически представлены результаты исследования, проводимого путем культивирования, в котором была идентифицирована “не содержащая продуктов животного происхождения” среда, поддерживающая рост штамма Porphyromonas gulae B43. Были протестированы следующие среды: полная среда МЕ, среда МЕ с гемином, среда МЕ с витамином К, среда МЕ с гемином и витамином К, полная среда PYG, среда PYG с гемином, среда PYG с витамином K, среда PYG с гемином и витамином К и среда BHI.
На фиг.6 графически представлена средняя степень разрежения кости у мышей после суперинфицирования бактериями указанных видов. Мышей подвергали ложному инфицированию или подвергали инфицированию указанными бактериями. “Суммарное разрежение кости” представляет собой описанное выше разрежение кости и более позднее разрежение кости, которое наблюдалось у ложно инфицированной группы. Пунктирная линия означает суммарное разрежение кости позитивной контрольной группы. Указаны также стандартные ошибки.
На фиг.7 графически представлен процент разрежения кости у мышей после суперинфицирования бактериями указанных видов. Мышей подвергали ложному инфицированию или подвергали инфицированию указанными бактериями. Процент разрежения кости вычисляют по отношению к суммарному разрежению кости у позитивной контрольной группы, принятому за 100%.
На фиг.8А и В представлены фотографии, где на фиг.8А представлен ДСН-ПААГ-анализ, а на фиг.8В проиллюстрирован Вестерн-блот-анализ, проводимый с использованием сыворотки против эпитопа XpressTM (Invitrogen) рекомбинантного белка FimA P.gulae B43, экспрессируемого в BL21 E.coli из pBAD-HisA. Приведенные там сокращения означают: Std. (в кДа) - стандарты; Ind - индуцированный; Sol - растворимая фракция и Insol - нерастворимая фракция. Стрелки указывают на локализацию rFimA.
На фиг.9 представлена фотография, иллюстрирующая ДСН-ПААГ-анализ рекомбинантного гена oprF P.gulae В43, экспрессируемого в клетках BL21 E.coli из экспрессионной плазмиды. Символ Т означает время после повышения температуры культивирования с 30°С до 42°С. Стандарты молекулярной массы приводятся в кДа. Стрелки указывают на локализацию rOprF.
На фиг.10 представлен график, построенный по результатам исследования эффективности гомологичной вакцины, исходя из суммарного разрежения кости. Исследования эффективности гомологичной вакцины проводили исходя из суммарного разрежения кости. Мышей вакцинировали нижеследующими вакцинными антигенами и адъювантом RIBI MPL + TDM (за исключением группы С, которой вводили полный и неполный адъювант Фрейнда): группы А, В и Е - только PBS; группы C и D - инактивированный формалином штамм P.gingivalis 53977; группа F - инактивированный формалином штамм P.gulae В43; группа G - BEI-инактивированный штамм P.gulae В43; группа Н - термоинактивированный штамм P.gulae В43, а группа I - инактивированный аэрацией штамм P.gulae В43. Мышей подвергали ложному инфицированию (группа А), инфицированию штаммом P.gingivalis 53977 (заштрихованные столбцы) или инфицированию штаммом P.gulae В43 (черные столбцы) в 1% карбоксиметилцеллюлозе. Указаны также величины стандартных ошибок.
На фиг.11 представлен график, построенный по результатам исследования эффективности гомологичной вакцины P.gingivalis 53977, исходя из процента разрежения кости. Мышей вакцинировали нижеследующими вакцинными антигенами и адъювантом RIBI MPL + TDM (за исключением группы С, которой вводили полный и неполный адъювант Фрейнда): группы А, В и Е - только PBS; группы C и D - инактивированный формалином штамм P.gingivalis 53977. Мышам группы А вводили PBS, а мышей группы B-D инфицировали штаммом Р. gingivalis 53977 в 1% карбоксиметилцеллюлозе.
На фиг.12 представлен график, построенный по результатам исследования эффективности гомологичной вакцины P.gulae В43, исходя из процента разрежения кости. Мышей вакцинировали нижеследующими вакцинными антигенами и адъювантом RIBI MPL + TDM: группы А-В - только PBS; группа C - инактивированный формалином штамм P.gulae В43; группа D - BEI-инактивированный штамм P.gulae В43; группа Е - термоинактивированный штамм P.gulae В43, а группа F - инактивированный аэрацией штамм P.gulae В43. Мышам группы А вводили PBS либо мышей группы B-F инфицировали штаммом P.gulae В43 в 1% карбоксиметилцеллюлозе.
На фиг.13 представлен график, построенный по результатам исследования эффективности гетерологичной вакцины, исходя из суммарного разрежения кости. Мышей вакцинировали нижеследующими вакцинными антигенами и адъювантом RIBI MPL + TDM: группа А-Е - только PBS; группа F-I - инактивированный формалином штамм P.gulae В43; группа J - инактивированный формалином штамм P. salivosa B104 и инактивированный формалином штамм O.denticanis В106. Мышам вводили PBS (A), P.gulae В43 (B и F; черные столбцы), P.gulae В69 (С, G и J; заштрихованные столбцы), P.salivosa В104 (D и Н; полосатые столбцы) или O.denticanis В106 (Е и I; столбцы, заштрихованные точками) в 1% карбоксиметилцеллюлозе. Также указаны величины стандартных ошибок.
На фиг.14 представлен график, построенный по результатам, полученным для групп, инфицированных P.gulae В43 и протестированных на эффективность гетерологичной вакцины, исходя из процента разрежения кости. Мыши были вакцинированы нижеследующими вакцинными антигенами и адъювантом RIBI MPL + TDM: группы А-В - только PBS; группа С - инактивированный формалином P.gulae В43. Мышам группы А вводили PBS; а мышей В-С инфицировали P.gulae В43 в 1% карбоксиметилцеллюлозе.
На фиг.15 представлен график, построенный по результатам, полученным для групп, инфицированных P. gulae В69 и протестированных на эффективность гетерологичной вакцины, исходя из процента разрежения кости. Мыши были вакцинированы нижеследующими вакцинными антигенами и адъювантом RIBI MPL + TDM: группы А-В - только PBS; группа С - инактивированный формалином штамм P. gulae В43, а группа D - инактивированный формалином штамм P. salivosa В104 и инактивированный формалином штамм O. denticanis В106. Мышам группы А вводили PBS; а мышей групп В-D инфицировали P.gulae В69 в 1% карбоксиметилцеллюлозе.
На фиг.16 представлен график, построенный по результатам, полученным для групп, инфицированных P.salivosa В104 и протестированных на эффективность гетерологичной вакцины исходя из процента разрежения кости. Мыши были вакцинированы нижеследующими вакцинными антигенами и адъювантом RIBI MPL + TDM: группы А-В - только PBS; группа С - инактивированный формалином штаммом P.gulae В43. Мышам группы А вводили PBS, а мышей групп В-С инфицировали P.salivosa В104 в 1% карбоксиметилцеллюлозе.
На фиг.17 представлен график, построенный по результатам, полученным для групп, инфицированных штаммом O.denticanis В106 и протестированных на эффективность гетерологичной вакцины, исходя из процента разрежения кости. Исследование эффективности гетерологичной вакцины проводили исходя из процента разрежения кости для групп, инфицированных O.denticanis В106. Мыши были вакцинированы нижеследующими вакцинными антигенами и адъювантом RIBI MPL + TDM: группы А-В - только PBS; группа С - инактивированный формалином штамм P.gulae В43. Мышам группы А вводили PBS; а мышей групп В-С инфицировали O.denticanis В106 в 1% карбоксиметилцеллюлозе.
На фиг.18 представлен график, построенный по результатам серологического исследования мышей, вакцинированных рекомбинантным FimA P.gulae В43 или физиологическим раствором с помощью FimA-специфического ELISA. Каждую из шестнадцати мышей вакцинировали либо физиологическим раствором (А), либо смесью rFimА/QuilA/холестерин (В). Собранную сыворотку тестировали на FimA-специфические антитела посредством FimA-специфического ELISA. Минимальное тестируемое разведение составляло 1:100. При этом разведении любой образец с титром 50 давал отрицательный результат.
На фиг.19 представлен график, построенный по результатам серологического исследования мышей, вакцинированных рекомбинантным OprF P.gulae В43 или физиологическим раствором с применением ОprF-специфического ELISA. Каждую из шестнадцати мышей вакцинировали либо физиологическим раствором (А), либо смесью rOprF/QuilA/холестерин (В). Собранную сыворотку тестировали на OprF-специфические антитела посредством OprF-специфического ELISA. Минимальное тестируемое разведение составляло 1:100. При этом разведении любой образец с титром 50 давал отрицательный результат.
На фиг.20 представлен график разрежения кости через 0, 6 и 12 недель после инфицирования. Группа собак Т01 представлена собаками 3559424, 3592669, 3672859, 3673375 и 3691926; а группа собак Т02 представлена собаками 3389600, 3628884, 3653552, 3657396, 3690164.
На фиг.21 представлен график оценок реактивности кости для группы Т01 (вакцинированной и инфицированной или Vx/Ch), группы Т02 (ложновакцинированной и инфицированной или не-Vx/Ch) и группы Т03 (ложновакцинированной и ложноинфицированной или не-Vx/не-Ch) через 0, 3, 6, 9 и 12 недель после инфицирования. Также показана статистическая значимость эффектов лечения.
На фиг.22 представлен график оценок реактивности кости для группы Т01 (Vx/Ch), группы Т02 (не-Vx/Ch) и группы Т03 (не-Vx/не-Ch) через 0, 3, 6 и 9 недель после инфицирования. Также показана статистическая значимость отличий между группами Т01 и Т02.
На фиг.23А-23D представлены рентгенограммы, полученные от одной собаки в группе Т01 (Vx/Ch) через 0 (23А), 3 (23В), 6 (23С) и 9 (23D) недель после инфицирования. На фиг.23Е-23Н представлены рентгенограммы, полученные от одной собаки в группе Т02 (не-Vx/Ch) через 0 (23Е), 3 (23F), 6 (23G) и 9 (23Н) недель после инфицирования.
На фиг.24А-24С представлены графики, иллюстрирующие средние оценки системных реакций для групп Т01 (Vx/Ch) и Т02 (не-Vx/Ch); указанные оценки были получены путем последовательного определения уровней физической активности всех собак в каждой из соответствующих групп. На фиг.24D-24F представлены графики, иллюстрирующие средние оценки локальных реакций для групп Т01 (Vx/Ch) и Т02 (не-Vx/Ch); указанные оценки были получены путем последовательного определения уровней локальной отечности, наблюдаемого в месте инъекции у всех собак в каждой из соответствующих групп.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
БАКТЕРИАЛЬНЫЕ ИЗОЛЯТЫ
Настоящее изобретение относится к выделенным анаэробным бактериям, которые были идентифицированы по их последовательностям ДНК 16S pPHK и которые вызывают пародонтоз и различные другие заболевания и клинические манифестации у животных-компаньонов. Более конкретно, указанные бактерии выбраны из бактерий рода Porphyromonas.
Предпочтительными выделенными бактериями согласно изобретению являются P.gulae B43, P.cansulci B46, P.circumdentaria B52, P.gulae B69, P.circumdentaria B97, P.cangingivalis B98, P. salivosa B104, O. denticanis B106 и P.endodontalis В114, хотя в объем настоящего изобретения входят и другие виды или штаммы. В предпочтительном варианте изобретения выделенные бактерии согласно изобретению могут быть идентифицированы по их последовательностям ДНК 16S pPHK, представленным в SEQ ID NO: 86-94.
Инфекционными заболеваниями, вызываемыми бактериями согласно изобретению, являются, но не ограничиваются ими, пародонтоз у домашних питомцев, неприятный запах изо рта животных-компаньонов (галитоз), копытная гниль коров, ишемическая болезнь сердца у собак и системные инфекционные заболевания у собак. Бактерии, принадлежащие к роду Porphyromonas, также связаны с различными заболеваниями человека, включая ишемическую болезнь сердца, паротит, неприятный запах изо рта, гингивит, периодонтит, инсульт, атеросклероз, гиперлипидемию, бактериальный вагиноз, замедление внутриутробного развития (IUGR) и повышенную вероятность преждевременных родов с последующим рождением детей с пониженной массой.
Настоящее изобретение относится к выделенным полинуклеотидным и к выделенным полипептидным молекулам Porphyromonas spp. Более конкретно настоящее изобретение относится к выделенным полинуклеотидным молекулам, имеющим нуклеотидную последовательность генов fimA и oprF бактерий Porphyromonas spp. или их вырожденных вариантов, и к выделенным полипептидным молекулам, имеющим аминокислотные последовательности белков FimA и OprF, кодируемых такими генами, соответственно.
Настоящее изобретение также относится к полинуклеотидным последовательностям, которые, по меньшей мере, примерно на 90%, предпочтительно, по меньшей мере, примерно на 95%, а наиболее предпочтительно, по меньшей мере, на 99% гомологичны любой из последовательностей SEQ ID NO: 95-102 и 111-119, как было определено с использованием любого известного стандартного алгоритма идентичности. Кроме того, настоящее изобретение относится к полинуклеотидным последовательностям, которые гибридизуются в жестких условиях с последовательностью, комплементарной любой из нуклеотидных последовательностей, представленных в SEQ ID NO: 95-102 и 111-119.
В другом своем конкретном варианте настоящее изобретение относится к нуклеиновой кислоте, которая гибридизуется с любой из полинуклеотидных последовательностей, представленных в SEQ ID NO: 86-102 и 111-119, или с комплементарными последовательностями в условиях высокой жесткости. Процедурами, проводимыми в таких условиях высокой жесткости, являются, например, но не ограничиваются ими, процедуры проведения гибридизации областей, содержащих свыше 90 нуклеотидов, в условиях высокой жесткости. Предварительную гибридизацию фильтров, содержащих ДНК, проводят в течение 8 часов или в течение ночи при 65°С в буфере, состоящем из 6× SSC, 50 мМ трис-HCl (pH 7,5), 1 мМ EDTA, 0,02% PVP, 0,02% фиколла, 0,02% BSA и 500 мкг/мл ДНК денатурированной спермы лосося. Фильтры гибридизуют в течение 48 часов при 65°С в смеси для предварительной гибридизации, содержащей 100 мкг/мл ДНК денатурированной спермы лосося и 5-20 × 106 имп./мин 32Р-меченного зонда. Промывку фильтров проводят при 37°С в течение 1 часа в растворе, содержащем 2 × SSC, 0,01% PVP, 0,01% фиколла и 0,01% BSA. Затем проводят промывку в 0,1 × SSС при 50°С в течение 45 минут, после чего осуществляют авторадиографию.
Другие условия высокой жесткости, которые могут быть использованы, зависят от природы нуклеиновой кислоты (например, от длины, содержания GC и т.п.) и цели гибридизации (детекции, амплификации и т.п.), и хорошо известны специалистам. Так, например, гибридизацию в жестких условиях олигонуклеотида, состоящего приблизительно из 15-40 нуклеотидов, с комплементарной последовательностью, проводимую с помощью полимеразной цепной реакции (ПЦР), осуществляют в следующих условиях жесткости: концентрация соли - 50 мМ KCl, концентрация буфера - 10 мМ Трис-HCl, концентрация Mg2+ - 1,5 мМ, рН 7-7,5 и температура отжига 55-60°С.
В конкретном предпочтительном варианте изобретения после гибридизации проводят промывку в описанных ниже условиях. Каждую мембрану два раза промывают в течение 30 минут при 45°С в 40 мМ фосфате натрия, рН 7,2, 5% ДСН, 1 мМ EDTA и 0,5% альбумине бычьей сыворотки, а затем каждую мембрану четыре раза промывают в течение 30 минут в фосфате натрия, рН 7,2, 1% ДСН, 1 мМ EDTA. Для гибридизации в условиях высокой жесткости каждую мембрану дополнительно промывают четыре раза в течение 30 минут в 40 мМ фосфате натрия, рН 7,2, 1% ДСН, 1 мМ EDTA при 55°С, а затем каждую мембрану четыре раза промывают в течение 30 минут в фосфате натрия, рН 7,2, 1% ДСН, 1 мМ EDTA при 65°С.
Настоящее изобретение также относится к вакцинам и к вакцинным композициям, которые при их введении животному-компаньону в терапевтически эффективном количестве могут быть использованы для лечения или предупреждения пародонтоза (то есть сообщения резистентности к пародонтозу) у животного-компаньона.
В одном из своих вариантов настоящее изобретение относится к вакцине, которая содержит препарат, полученный на основе, по меньшей мере, целых клеток аттенуированной (модифицированной живой) или инактивированной бактерии Porphyromonas spp. одного вида (бактерин). В своем предпочтительном варианте настоящее изобретение относится к вакцине, которая содержит препарат, полученный на основе инактивированных целых клеток, по меньшей мере, трех видов Porphyromonas spp., например комбинации P.gulae В43, P. salivosa B104 и O. denticanis B106. Эти бактериальные клетки могут быть инактивированы различными агентами, такими как формалин, бинарный этиленимин (ВЕI) или бета-пропиолактон. В качестве инактивирующего агента предпочтительно использовать формалин.
В другом варианте изобретения указанная вакцина содержит субъединичную фракцию Porphyromonas spp., способную индуцировать иммунный ответ.
В предпочтительном варианте изобретения вакцина согласно изобретению содержит один или несколько субъединичных полипептидов или их фрагментов или вариантов либо одну или несколько выделенных полинуклеотидных последовательностей, или их фрагменты или варианты.
Аттенуированные (модифицированные живые) или инактивированные вакцины (бактерины), либо выделенные субъединичные полипептиды, либо выделенные полинуклеотиды могут присутствовать в комбинации с другими известными компонентами вакцинной композиции, такими как совместимые адъюванты, разбавители или носители.
ОПРЕДЕЛЕНИЯ И СОКРАЩЕНИЯ
Термин “ORF” (“ОРС”) означает “открытую рамку считывания”, т.е. кодирующую область гена.
Термин “процент идентичности последовательностей” для нуклеотидных последовательностей и полипептидных последовательностей означает процент, определенный путем сравнения двух оптимально выровненных последовательностей в окне сравнения, где оптимальное выравнивание дает наибольшее соответствие с тестируемой или известной последовательностью, и позволяет вводить в тестируемую или известную последовательность дополнительные нуклеотиды или аминокислоты для придания наибольшего соответствия. Процент идентичности определяют путем вычисления процента нуклеотидов, которые идентичны нуклеотидам тестируемой и известной последовательности в каждом положении по всей длине последовательности. Оптимальное сопоставление путем выравнивания последовательностей и процент идентичности могут быть определены вручную либо, что более предпочтительно, с помощью компьютерных алгоритмов, включая, но не ограничиваясь ими, TBLASTN, BLASTР, FASTA, ТFASTA, GАР, BESTFIT и CLUSTALW (Altschul et al., 1990, J. Mol. Biol. 215(3):403-10; Pearson & Lipman, 1988, Proc. Natl. Acad. Sci., USA, 85(8):2444-8; Thompson et al., 1994, Nucleic Acids Res. 22(22):4673-80; Devereux et al., 1984, Nuc. Acids. Res. 12:387-395); Higgins et al., 1996, Methods Enzymol. 266:383-402). Для поиска множества баз данных для гомологичных последовательностей предпочтительно можно использовать сервер NCBI Blast (http://www.ncbi.nlm.nih.gov) с установленными параметрами по умолчанию.
Используемый здесь термин “гетерологичный” относится к бактерии, происходящей от различных видов или штаммов.
Используемые здесь термины “гомология”, “гомологичный” и т.п. означают степень идентичности между полинуклеотидными или полипептидными последовательностями.
Используемый здесь термин “гомологичный”, если он относится к бактериям, указывает на бактерии одного и того же вида или штамма.
Используемый здесь термин “клетка-хозяин” означает бактерию или эукариотическую клетку, содержащую плазмиду, вирус или другой вектор.
Используемый здесь термин “выделенный” означает удаленный из его природного окружения либо отдельный, либо присутствующий в гетерологичной клетке-хозяине, в хромосоме или векторе (например, в плазмиде, фаге и т.п.).
Термины “выделенная анаэробная бактерия”, “выделенная бактерия”, “выделенный бактериальный штамм” и т.п. означают композицию, в которой данная бактерия является, по существу, свободным микроорганизмом, не связанным с другими микроорганизмами, например, в культуре, в которой этот микроорганизм отделен от его природного окружения.
Термин “выделенный полинуклеотид” означает композицию, в которой указанный выделенный нуклеотид составляет, по меньшей мере, 50% от всей массы композиции. Более предпочтительно указанный выделенный полинуклеотид составляет примерно 95% от всей массы композиции, а наиболее предпочтительно 99% от всей массы композиции.
Термин “выделенный полипептид” означает композицию, в которой указанный выделенный полипептид составляет, по меньшей мере, 50% от всей массы композиции. Более предпочтительно указанный выделенный полипептид составляет по меньшей мере, 95% и наиболее предпочтительно 99% от всей массы композиции.
Используемый здесь термин “функционально эквивалентный” относится к рекомбинантному полипептиду, который может распознаваться антителом, специфичным к нативному полипептиду, продуцируемому бактерией, вызывающей пародонтоз у животных-компаньонов, либо к рекомбинантному полипептиду, который способен вырабатывать или продуцировать иммунный ответ, по существу, аналогичный иммунному ответу, вырабатываемому нативным белком, являющимся эндогенным белком бактерии. Так, например, антитело, вырабатываемое против функционально эквивалентного полипептида, также способно распознавать нативный полипептид, продуцируемый бактерией, вызывающей пародонтоз у животных-компаньонов.
Термин “иммуногенность” означает способность белка или полипептида вырабатывать иммунный ответ, специфически направленный против бактерии, вызывающей пародонтоз у животных-компаньонов.
Термин “антигенность” означает способность белка или полипептида иммуноспецифически связываться с антителом, вырабатываемым против указанного белка или полипептида.
Используемый здесь термин “антитело” означает молекулу иммуноглобулина, способную связываться с антигеном. Антителами могут быть смеси поликлональных антител или моноклональные антитела. Антитела могут быть интактными иммуноглобулинами, происходящими от природных источников или от рекомбинантных источников, либо они могут быть иммунореактивными частями интактных иммуноглобулинов. Антитела могут существовать в различных формах, включая, например, Fv, Fab', F(ab')2, а также одноцепочечные антитела.
Используемый здесь термин “животное-компаньон” означает любое животное, не являющееся человеком, живущее в неволе и рассматриваемое как домашний питомец. Такими животными могут быть, но не ограничиваются ими, собаки, кошки, лошади, овцы, кролики, обезьяны и грызуны, включая, мышей, крыс, хомячков, песчанок и хорьков.
Термины “защита”, “предохранение” и т.п., используемые здесь по отношению к вакцине, означают, что указанная вакцина предупреждает возникновение симптомов или ослабляет симптомы заболевания, вызываемого микроорганизмом, ангиген(ы) которого используется(ются) для получения данной вакцины. Термины “защита”, “предохранение” и т.п. также означают, что данная вакцина может быть использована для “лечения” заболевания или ослабления одного или несколько симптомов заболевания, которое уже диагностировано у индивидуума.
Термин “терапевтически эффективное количество” означает количество бактерий или субъединицы (например, полипептидов, полинуклеотидных последовательностей) и их комбинаций, достаточное для вырабатывания иммунного ответа у индивидуума, которому оно было введено. Такой иммунный ответ может включать, но не ограничивается ими, индуцирование клеточного и/или гуморального иммунитета.
Термин “предупреждение инфекции” означает предупреждение или ингибирование репликации бактерии, вызывающей пародонтоз у животных-компаньонов, ингибирование переноса бактериальной инфекции, или предотвращение внедрения этой бактерии в организм хозяина, или ослабление симптомов заболевания, вызываемого инфекцией. Лечение считается терапевтическим, если оно приводит к снижению бактериальной нагрузки.
Термин “фармацевтически приемлемый носитель” означает среду-носитель, которая не влияет на эффективность биологической активности активного ингредиента и не является токсичной для индивидуума, которому ее вводят.
Термин “терапевтическое средство” означает любую молекулу, соединение или лечение, а предпочтительно антибактериальную молекулу или соединение, которые повышают эффективность устранения бактериальной инфекции или лечения заболевания или состояния, вызываемого такой инфекцией.
Термин “фрагмент или вариант” означает неполные нуклеотидные или аминокислотные последовательности согласно изобретению. Предпочтительными являются фрагменты или варианты полипептидов, полученные в соответствии с настоящим изобретением и обладающие способностью вырабатывать гуморальный и/или клеточный иммунный ответ у животного-компаньона. Термин “фрагмент или вариант” также охватывает их аналоги. Термин “фрагмент или вариант” также включает мутантные полинуклеотиды, которые могут иметь одну или несколько мутаций, а именно делеции, инсерции или замены нуклеотидных остатков. Термин “фрагмент или вариант” также охватывает их аллельные варианты.
Выделение и характеризация Porphyromonas spp.
Бактерии согласно изобретению могут быть получены известными методами, включающими взятие образцов, культивирование и выделение. Так, например, микробные образцы могут быть получены у группы животных-компаньонов, таких как собаки и кошки, страдающие пародонтозом. Симптомы пародонтоза могут быть диагностированы по таким известным параметрам, как наличие у собак зубодесневых карманов >3 мм и наличие у кошек зубодесневых карманов >2 мм. Известные параметры для характеризации пародонтоза, такие как дентальные индексы (десневой индекс и периодонтальный индекс) и глубина зубодесневого кармана, могут быть определены в образцах, взятых у группы животных-компаньонов. Отдельные образцы могут быть получены из периодонтального кармана конкретного животного, положены на хранение в анаэробных условиях и культивированы в различных известных культуральных средах.
Клинические изоляты могут быть охарактеризованы известными методами, такими как различные биохимические тесты и анализ последовательности ДНК 16S pPHK для определения рода и вида этих изолятов. Отдельные изоляты могут быть перенесены в планшеты и на диски с антибиотиками (анаэробные системы) и помещены на агаровую поверхность для определения профиля резистентности каждого изолята к антибиотикам. Очищенные колонии могут быть также проанализированы в тестах на индол и каталазу (анаэробные системы). Для отдельных изолятов может быть определен уровень продуцирования липазы и лецитиназы.
Эти изоляты могут быть типированы по их последовательности ДНК 16S pPHK. Отдельные хорошо очищенные колонии могут быть использованы в качестве матрицы для амплификации области 16S pPHK с помощью полимеразной цепной реакции (ПЦР), например с применением праймеров D0056 и D0057 (SEQ ID NO: 1 и SEQ ID NO: 2; таблица 1). Полученные ПЦР-продукты могут быть очищены с использованием коммерчески доступных препаративных ПЦР-наборов (Promega Corp., Madison, WI), выделены и объединены в пул. Затем очищенные ПЦР-продукты могут быть обессолены и подвергнуты ДНК-секвенированию. Полученные последовательности ДНК могут быть использованы для поиска в доступных базах данных ДНК. Бактериальные изоляты могут быть типированы на наилучшее соответствие, идентифицированное путем поиска в базах данных.





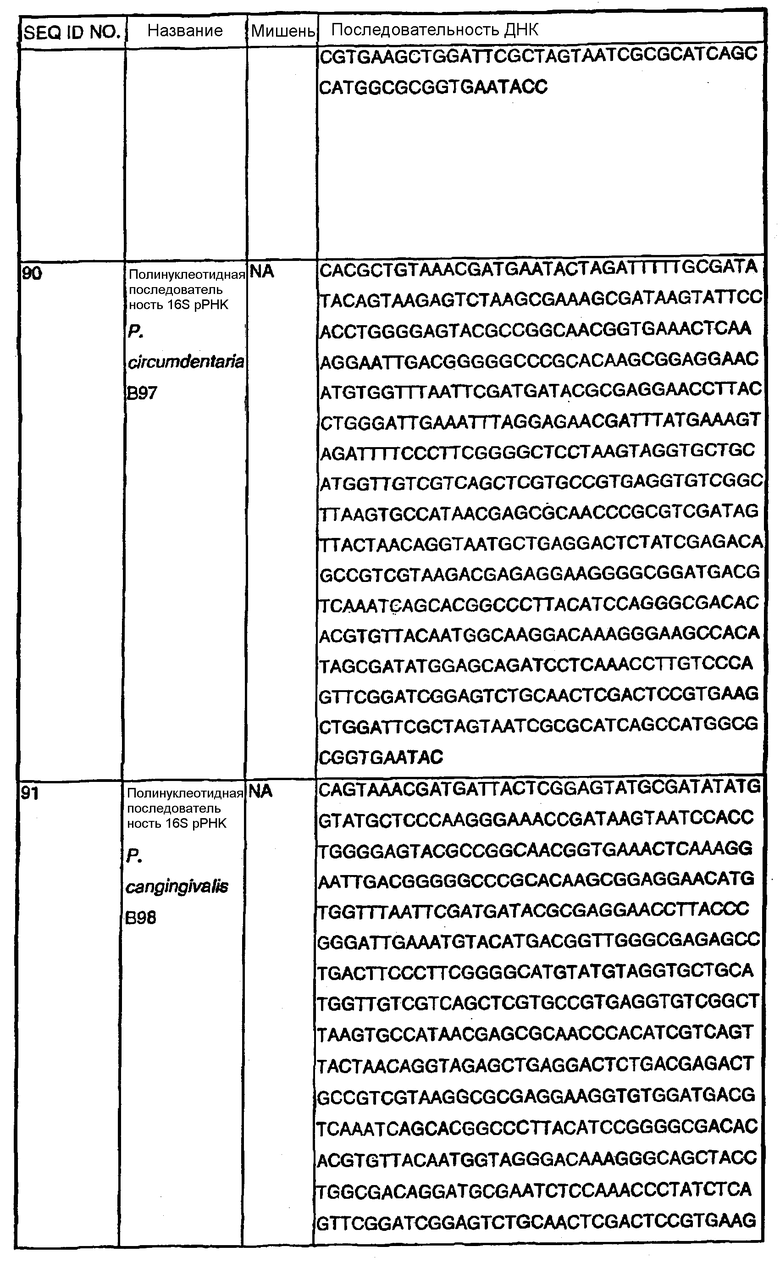
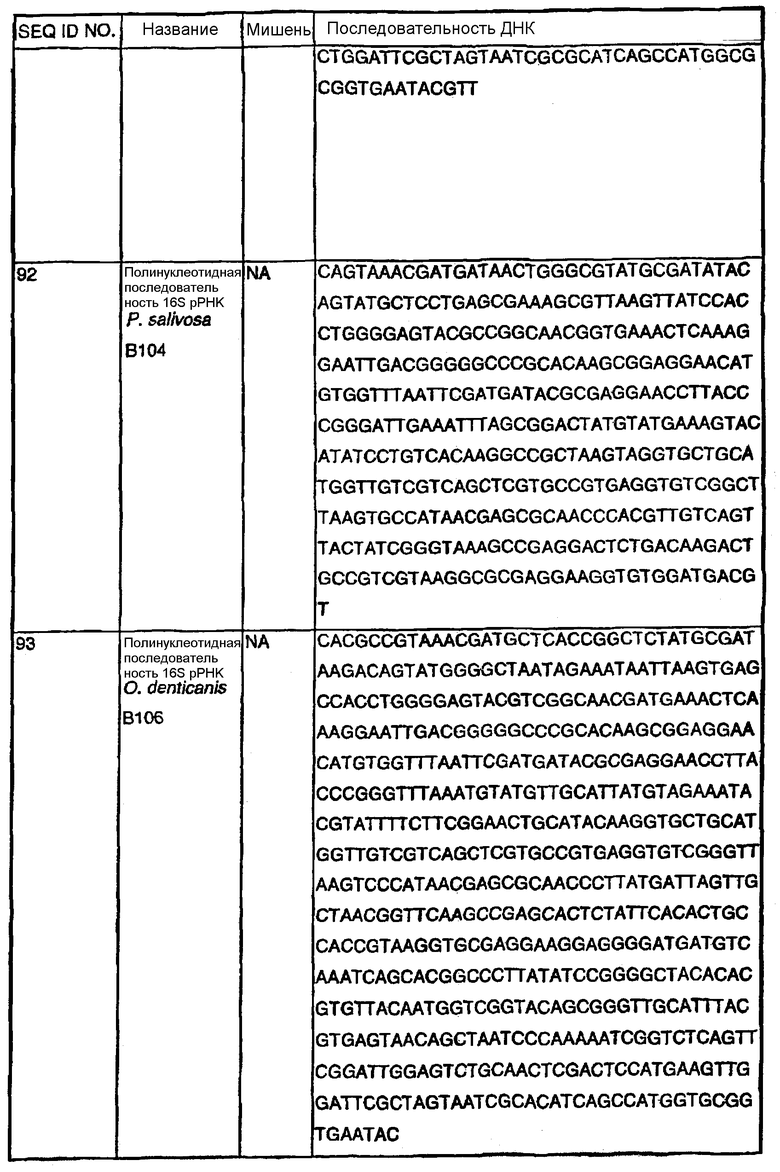
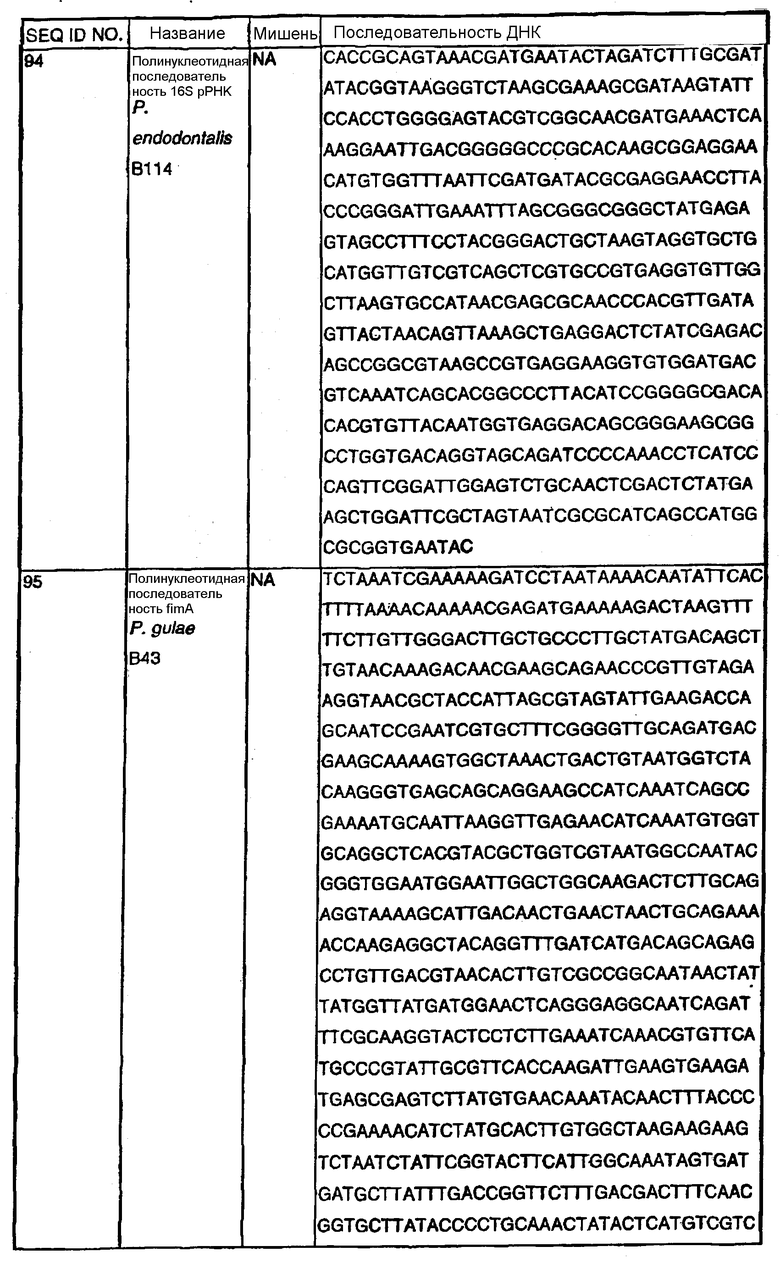
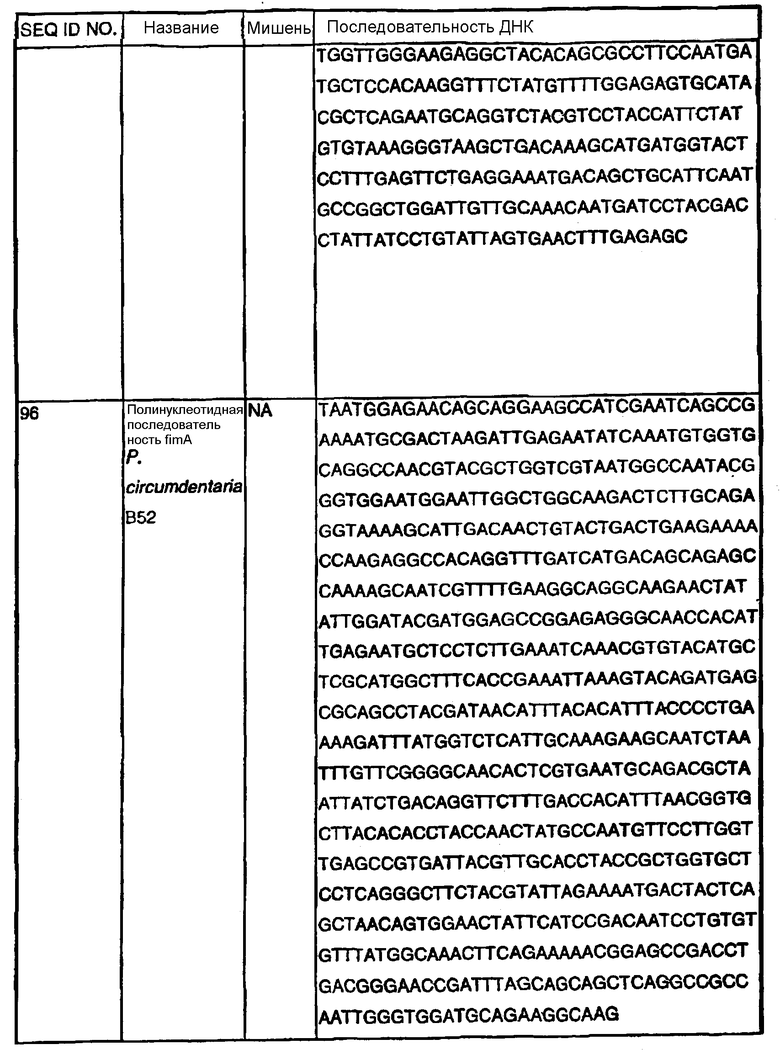





















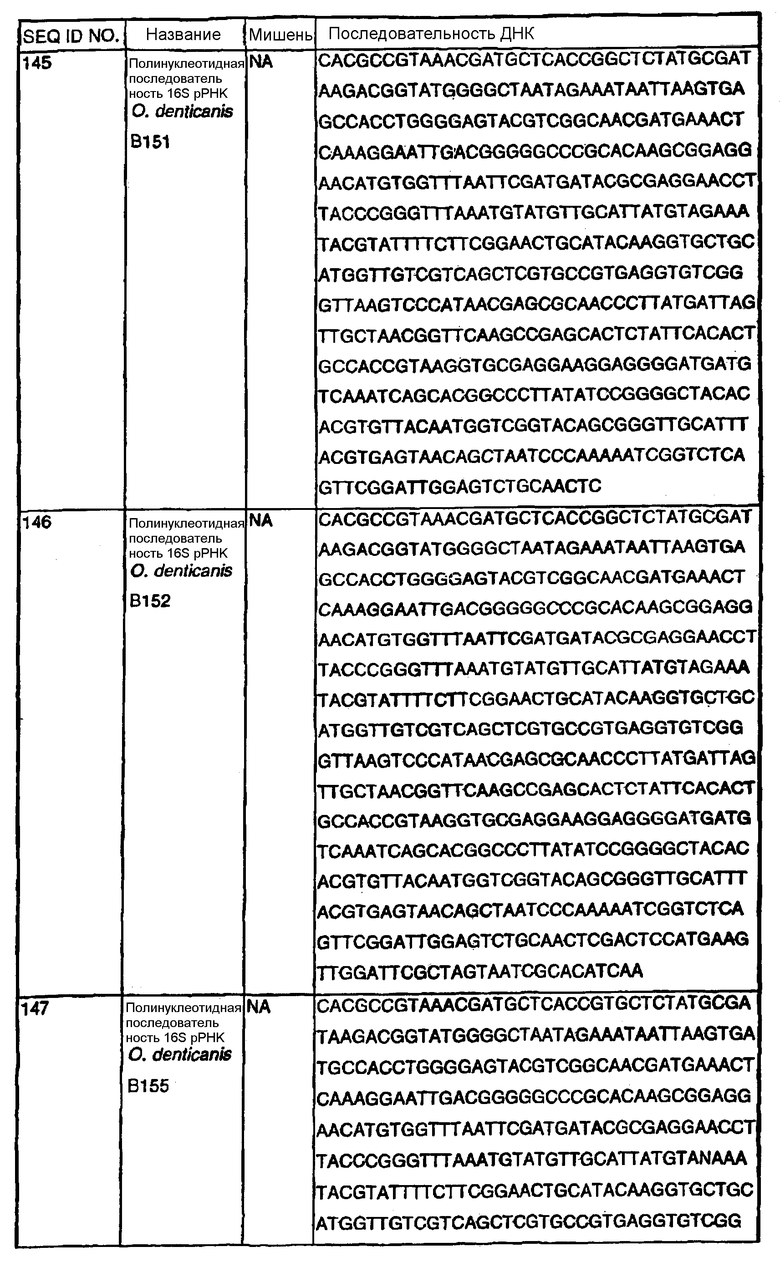

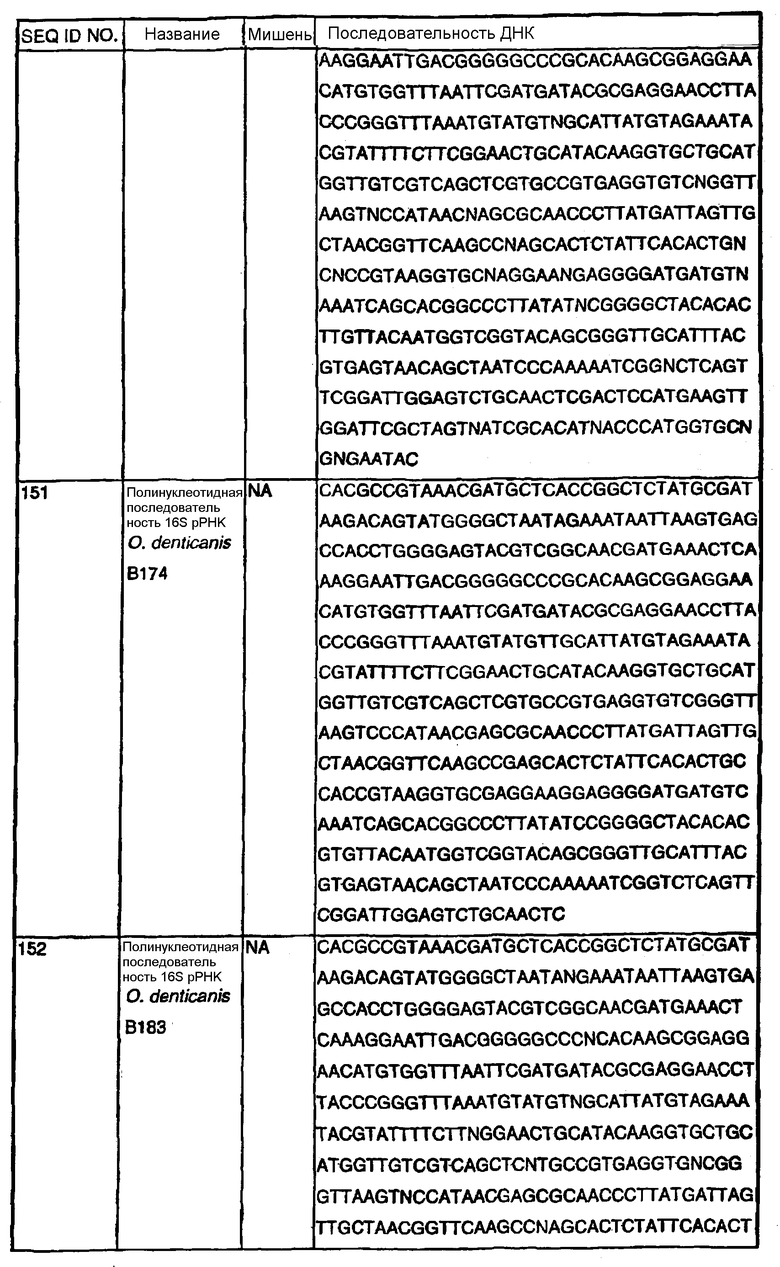





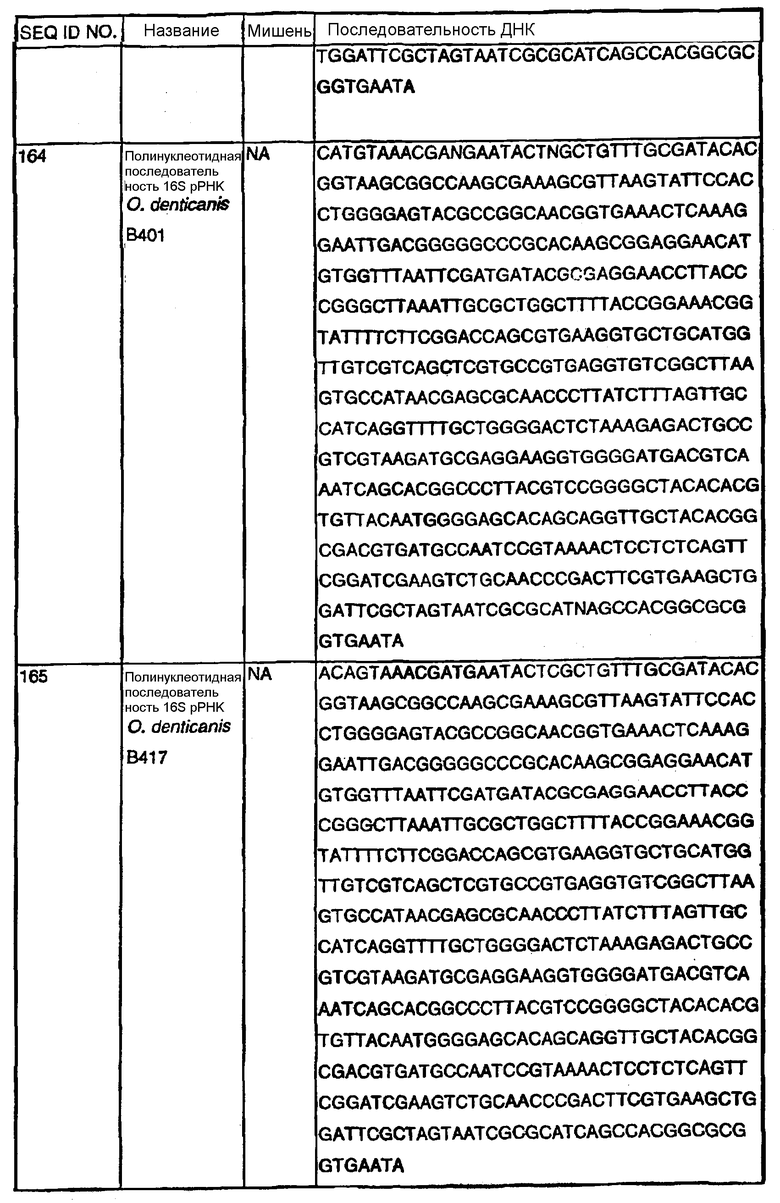


Примечание: Нуклеотиды, показанные строчными буквами, отсутствуют в последовательности ДНК-мишени. Они добавлены к 5'-области праймера для облегчения клонирования. NА - не применялись.
В Американской коллекции типовых культур (АТСС) (10801 University Blvd., Manassas, VA, 20110, USA, August 9, 2001) были депонированы нижеследующие периодонтальные изоляты, взятые у животных-компаньонов: P.gulae B43 (РТА-3618), P.cansulci B46 (РТА-3619), P.circumdentaria B52 (РТА-3620), P.gulae B69 (РТА-3621), P.circumdentaria B97 (РТА-3622), P.cangingivalis B98 (РТА-3623), P. salivosa B104 (РТА-3624), O. denticanis B106 (РТА-3625) и P.endodontalis В114 (РТА-3626). В предпочтительном варианте изобретения выделенная полинуклеотидная молекула согласно изобретению имеет нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 86-102 и 111-119. Предпочтительные полипептиды согласно изобретению имеют аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 103-110 и 120-128.
Клонирование нуклеотидных последовательностей Porphyromonas
Существует несколько известных методов или средств, которые могут быть использованы для клонирования нуклеотидных последовательностей Porphyromonas согласно изобретению. Так, например, указанные последовательности могут быть выделены в виде отдельных рестрикционных фрагментов и клонированы в клонирующие и/или экспрессионные векторы, либо указанные последовательности могут быть подвергнуты ПЦР-амплификации и клонированы в клонирующие и/или экспрессионные векторы, либо указанные последовательности могут быть клонированы с применением комбинации этих двух методов.
Стандартные методы молекулярной биологии, известные специалистам и конкретно не описанные в настоящей заявке, в общих чертах, могут быть осуществлены, как описано в руководствах Sambrook et al. Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York (1989); Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Baltimore, Maryland (1989); Perbal, A Practical Guide to Molecular Cloning, John Wiley & Sons, New York (1988); Watson et al., Recombinant DNA, Scientific American Books, New York; Birren et al. (eds) Genome Analysis: A Laboratory Manual Series, Vols. 1-4 Cold Spring Harbor Laboratory Press, New York (1998); и в соответствии с методикой, описанной в патентах США № 4666828, 4683202, 4801531, 5192659 и 5272057. Полимеразную цепную реакцию (ПЦР) осуществляют в основном, как описано в ПЦР-протоколах: A Guide To Methods And Applications, Academic Press, San Diego, CA (1990).
Репрезентативные методы, применяемые для клонирования и секвенирования полинуклеотидов согласно изобретению, приводятся в примерах.
Полипептиды и белки, кодируемые генами fimA и oprF
Настоящее изобретение относится к применению прокариотических и эукариотических экспрессионных систем, включая векторы и клетки-хозяева, которые могут быть использованы для экспрессии как усеченных, так и полноразмерных (нативных белковых) форм рекомбинантных полипептидов, экспрессируемых нуклеотидными последовательностями согласно изобретению.
В предпочтительном варианте изобретения выделенная полинуклеотидная молекула согласно изобретению имеет нуклеотидную последовательность, выбранную из последовательностей SEQ ID NO: 95-102 и 111-119 или их вырожденных вариантов, и кодирующую соответствующий полипептид, выбранный из аминокислотных последовательностей SEQ ID NO: 103-110 и 120-128 соответственно.
Для экспрессии полипептидов согласно изобретению могут быть использованы различные системы “хозяин - экспрессионный вектор”. Такие системы “хозяин - экспрессионный вектор” также представляют собой носители, посредством которых представляющие интерес кодирующие последовательности могут быть клонированы, а затем очищены. Настоящее изобретение также относится к клеткам-хозяевам, которые при их трансформации или трансфекции соответствующим вектором или нуклеотидной последовательностью могут экспрессировать генный продукт кодируемого полипептида согласно изобретению. Такими клетками-хозяевами являются, но не ограничиваются ими, микроорганизмы, такие как бактерии (например, E.coli, B. subtilis), трансформированные рекомбинантной ДНК бактериофага и экспрессионными векторами в виде плазмидной или космидной ДНК, содержащими кодирующие последовательности; дрожжи (например, Saccharomyces, Pichia), трансформированные рекомбинантными дрожжевыми экспрессионными векторами, содержащими кодирующие последовательности генного продукта; клеточные системы насекомых, инфицированные рекомбинантными вирусными (например, бакуловирусными) экспрессионными векторами, содержащими кодирующие последовательности; клеточные системы растений, инфицированные рекомбинантными вирусными экспрессионными векторами (например, вирусом мозаики цветной капусты, СаМV; вирусом мозаики табака, ТМV) или трансформированные рекомбинантными плазмидными экспрессионными векторами (например, плазмидой Тi), содержащими кодирующие последовательности; или клеточные системы млекопитающих (например, СОS, СНО, ВНК, 293, 3Т3), содержащие рекомбинантные экспрессионные конструкции, включающие промоторы, происходящие от генома клеток млекопитающих (например, промотор гена металлотионеина) или от вирусов млекопитающих (например, поздний промотор аденовируса; промотор 7.5К вируса коровьей оспы).
В предпочтительном варианте изобретения экспрессионной системой является бактериальная система. В зависимости от цели применения экспрессируемого продукта могут быть выбраны различные подходящие экспрессионные векторы. Так, например, если для получения вакцинных композиций или для продуцирования антител необходимо продуцировать большое количество такого полипептида, то может оказаться желательным использовать, например, векторы, регулирующие экспрессию высоких уровней гибридных белковых продуктов, которые могут быть легко очищены. При этом предпочтительно использовать векторы, содержащие промоторы, которые регулируют индуцибельную экспрессию генов. Подходящими векторами являются, но не ограничиваются ими, экспрессионные векторы рЕТ E.coli (Studier & Moffatt, 1986, J. Mol. Biol. 189: 113; Rosenberg et al., 1987, Gene 56: 125-135; Novagen, Madison, Wisconsin), в которых кодирующая последовательность может быть присоединена, с сохранением рамки считывания, к последовательности, кодирующей множество (например, 6) гистидиновых остатков; векторы рВАD (Guzman et al., 1995, J. Bact. 177: 4121-4130), из которых может экспрессироваться гетерологичный белок под контролем арабинозного индуцибельного белка; и векторы рGEX (Pharmacia, Biotech, USA), используемые для экспрессии гетерологичных полипептидов в виде гибридных белков с глутатион-S-трансферазой (GST). Последовательности fimA или oprF согласно изобретению могут быть клонированы в экспрессионный вектор λ и экспрессированы в бактериальных штаммах λ-. В предпочтительном варианте бактериальным штаммом является ВL21 E.coli (Gibco ВRL, USA). Предпочтительными векторами, которые могут быть использованы, являются, но не ограничиваются ими, экспрессионные векторы рLEX (LaVallie et al., 1992, Bio/Technology 11: 187-193; Mieschendahl et al., 1986, Bio/Technology 4: 802-808; Invitrogen) и экспрессионные векторы рRIT2T (Nilsson et al., 1985, EMBO 4: 1075; Zabeau & Stanley, 1982, EMBO 1: 1217; Pharmacia Biotech). Могут быть также использованы и другие векторы и бактериальные штаммы, известные специалистам.
Продуцирование антител
Антитела могут быть моноклональными, поликлональными или рекомбинантными. Обычно могут быть получены антитела против иммуногена или его части, например, с использованием последовательности синтетического пептида, либо они могут быть получены рекомбинантными методами путем клонирования, либо может быть выделен природный генный продукт и/или его части, которые могут быть использованы в качестве иммуногена. Иммуногены могут быть использованы для продуцирования антител стандартными методами, хорошо известными специалистам и, по существу, описанными в руководстве Harlow & Lane, Antibodies: А Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1988 и Borrebaeck, Antibody Engineering - A Practical Guide, W.H. Freeman & Co., 1992. Из этих антител могут быть также получены фрагменты антител, например Fab, F(ab')2 и Fv, в соответствии с известными методами.
При продуцировании антител может быть проведен скрининг на нужное антитело стандартными методами, обычно используемыми в иммунологии. Эти методы конкретно не описаны в настоящей заявке, но они могут быть применены, в общих чертах, как описано в публикации Stites et al. (eds.), Basic & Clinical Immunology (8th Edition), Appleton & Lange, Norwalk CT (1994) и Mischell and Shiigi (eds), Selected Methods in Cellular Immunology, W.H. Freeman and Co., New York (1980). Предпочтительными типами иммуноанализов в основном являются ELISA и Вестерн-блоттинг. Оба эти анализа хорошо известны специалистам. В таких анализах могут быть использованы как поликлональные, так и моноклональные антитела. Антитело может быть связано с твердым субстратом-носителем или конъюгировано с детектируемой молекулой, либо оно может быть связано и конъюгировано в соответствии с хорошо известной методикой (общее обсуждение конъюгирования флуоресцентных или ферментных молекул можно найти в публикации Johnstone & Thorpe, Immunochemistry in Practice, Blackwell Scientific Publications, Oxford, 1982). Связывание антител с твердым субстратом-носителем также хорошо известно специалистам (общее обсуждение можно найти в руководстве Harlow & Lane, Antibodies: А Laboratory Manual, Cold Spring Harbor Laboratory, Publication, Cold Spring Harbor, New York, 1988 и Borrebaeck, Antibody Engineering - A Practical Guide, W.H. Freeman and Co., 1992). Детектируемыми молекулами, рассматриваемыми в настоящем изобретении, могут быть, но не ограничиваются ими, флуоресцентные, металлические, ферментные и радиоактивные маркеры, такие как биотин, золото, ферритин, щелочная фосфатаза, β-галактозидаза, пероксидаза, уреаза, флуоресцеин, родамин, тритий, 13С и йод.
Если это необходимо, то могут быть использованы и другие иммуноанализы, такие как радиоиммуноанализы (РИА), известные специалистам. Существующие иммуноанализы подробно описаны в патентной и в научной литературе. См., например, патенты США № 3791932, 3839153, 3850752, 3850578, 3853987, 3867517, 3879262, 3901654, 3935074, 3984533, 3996345, 4034074, 4098876, 4879219, 5011771 и 5281521, а также в руководстве Sambrook et al. Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, New York, 1989.
Наборы для детекции, диагностики и предупреждения заболевания
Настоящее изобретение также относится к наборам для детекции Porphyromonas spp. Такой набор включает реагенты для анализа образца на присутствие микроорганизмов Porphyromonas, полипептидов или нуклеотидных последовательностей Porphyromonas согласно изобретению, где присутствие нуклеотидной последовательности является показателем присутствия указанного микроорганизма. Этот способ является эффективным, поскольку он позволяет диагностировать заболевание еще до появления его симптомов, а поэтому он позволяет предотвращать развитие заболевания еще до возникновения патологий у пациента. Присутствие бактерий Porphyromonas spp., а также их полипептидов или нуклеотидных последовательностей может быть определено с помощью антител посредством ПЦР, гибридизации и других методов детекции, известных специалистам.
В одном из вариантов изобретения указанный набор содержит реагенты для детекции антител против Porphyromonas. В некоторых вариантах изобретения данный набор может включать отпечатанные инструкции или этикетку, содержащие информацию по применению данного набора для детекции Porphyromonas spp. Указанный набор, как минимум, содержит, по меньшей мере, в одном контейнере, белок, имеющий аминокислотную последовательность, содержащую, по меньшей мере, 30 смежных аминокислот любого из полипептидов SEQ ID NO: 103-110 и 120-128. В одном из вариантов изобретения указанный набор дополнительно содержит второе антитело. В предпочтительном варианте изобретения указанное второе антитело конъюгировано с детектируемой молекулой, такой как, например, фермент, который катализирует колориметрическую или хемилюминесцентную реакцию, например щелочная фосфатаза или пероксидаза хрена. В другом варианте изобретения указанный набор содержит реагенты для проведения колориметрического или хемилюминесцентного анализа.
В другом варианте изобретения указанный набор включает реагенты для детекции нуклеиновых кислот Porphyromonas. В одном из вариантов изобретения указанный набор включает реагенты для ПЦР-детекции нуклеиновых кислот Porphyromonas и включает, по меньшей мере, в одном контейнере, первую выделенную молекулу ДНК, содержащую фрагмент, состоящий, по меньшей мере, примерно из 15, 20, 25 или 30 нуклеотидов, где указанный фрагмент гибридизуется в жестких условиях с молекулой ДНК, кодирующей полипептид, содержащий последовательность, по меньшей мере, из 5, 10, 15, 20, 25 или 30 смежных аминокислот, или полноразмерную аминокислотную последовательность любых полипептидов SEQ ID NO: 103-110 или 120-128; и вторую выделенную молекулу ДНК, содержащую фрагмент, состоящий, по меньшей мере, из 15, 20, 25 или 30 нуклеотидов, где указанный фрагмент гибридизуется в жестких условиях с молекулой ДНК, комплементарной молекуле ДНК, кодирующей полипептид, содержащий последовательность, по меньшей мере, из 5, 10, 15, 20, 25 или 30 смежных аминокислот, или полноразмерную аминокислотную последовательность любых полипептидов SEQ ID NO: 103-110 или 120-128, где указанные первая и вторая молекулы ДНК могут быть использованы для специфической амплификации нуклеиновой кислоты Porphyromonas spp., кодирующей 16S pPHK, и где указанная 16S pPHK кодируется молекулой ДНК, выбранной из группы, состоящей из SEQ ID NO: 1-9.
В другом своем варианте настоящее изобретение также относится к набору, содержащему, по меньшей мере, в одном контейнере, первую выделенную молекулу ДНК, содержащую нуклеотидную последовательность, состоящую, по меньшей мере, примерно из 15 смежных нуклеотидов, и выбранную из любых последовательностей SEQ ID NO: 86-94, 95-102 и 111-119, которые гибридизуются в условиях высокой жесткости с последовательностью, комплементарной любой из нуклеотидных последовательностей, представленных в SEQ ID NO: 86-94, 95-102 и 111-119; и вторую выделенную молекулу ДНК во втором контейнере, содержащую нуклеотидную последовательность, состоящую, по меньшей мере, примерно из 15 смежных нуклеотидов и выбранную из последовательностей, комплементарных любой из нуклеотидных последовательностей, представленных в SEQ ID NO: 86-94, 95-102 и 111-119, которые гибридизуются в условиях высокой жесткости с любой из нуклеотидных последовательностей, представленных в SEQ ID NO: 86-94, 95-102 и 111-119, где указанный набор также содержит инструкции по применению этого набора для детекции Porphyromonas spp.
Вакцинная композиция и способ ее введения
Вакцина согласно изобретению может быть введена животному-компаньону в количестве, эффективном для терапевтического лечения пародонтоза у животного компаньона, либо для сообщения резистентности к пародонтозу, либо для его предупреждения. Вакцина согласно изобретению может быть использована для уничтожения бактерий, вызывающих пародонтоз. Вакцины согласно изобретению могут быть, в частности, использованы в ветеринарии для лечения животных-компаньонов и в медицине для борьбы с описанными здесь бактериальными инфекциями, которые, как известно вызывают пародонтоз.
Вакцины согласно изобретению являются эффективными для уничтожения бактерий, которые являются патогенными для человека и животных-компаньонов либо которые распространяются на человека и животных-компаньонов или действуют как переносчики заболевания человеку и животным-компаньонам, например описанным здесь животным. Вакцины согласно изобретению являются особенно эффективными для уничтожения бактерий, присутствующих у животных-компаньонов, где указанные вакцины могут быть введены любыми известными методами, включая, но не ограничиваясь ими, пероральное, парентеральное, интраназальное, подкожное или местное введение.
В соответствии с другим своим аспектом настоящее изобретение относится к композиции, содержащей вакцину согласно изобретению в смеси с совместимым адъювантом, разбавителем или носителем. В предпочтительном варианте изобретения вакцинная композиция согласно изобретению состоит из водной суспензии или раствора, содержащего, по меньшей мере, одну бактерию согласно изобретению, и/или, по меньшей мере, один субъединичный белок, предпочтительно забуференные до физиологического рН, в форме, готовой для инъекции. В другом предпочтительном варианте изобретения вакцинная композиция согласно изобретению состоит из инактивированных препаратов целых клеток, по меньшей мере, трех бактерий Porphyromonas spp. например P.gulae В43, P. salivosa B104 и O. denticanis B106.
Настоящее изобретение также относится к способу лечения или предупреждения бактериальной инфекции, включающему лечение эффективным количеством вакцины или вакцинной композиции согласно изобретению. При этом следует отметить, что термин “лечение” включает профилактику, а также ослабление диагностированных симптомов бактериальной инфекции.
Вакцины и вакцинные композиции согласно изобретению могут быть использованы для индуцирования ответа, который предотвращает патологические изменения, характерные для пародонтоза, вызываемого бактериями-возбудителями пародонтоза. В целях приготовления вакцинной композиции для введения млекопитающему желательно использовать смесь иммуногенного количества бактерий, очищенного белка, нуклеиновой кислоты или их комбинаций с подходящими стандартными вакцинными адъювантами и физиологическими носителями.
Вакцинная композиция для предупреждения пародонтоза у животных-компаньонов может быть получена с использованием, по меньшей мере, одной из выделенных и очищенных инактивированных или аттенуированных бактерий, очищенных полипептидов (таких как нативные белки, субъединичные белки или полипептиды), где один или несколько указанных компонентов смешивают с совместимым адъювантом, разбавителем или носителем. Предпочтительными полипептидными последовательностями являются субъединичные белки, выбранные из группы, состоящей из FimA (SEQ ID NO: 103-110) и ОprF (SEQ ID NO: 120-128).
Примерами фрагментов FimA и ОprF, которые могут быть использованы для получения диагностических полипептидов или вакцинных препаратов, являются, но не ограничиваются ими, ACNKDNEAEPVV, YPVLVNFESNNYTYTGDAVEK, TGPGTNNPENPITESA, NDNNNKDFVDRLGA, DLNGQINRLRREVEELSKRPVSCPECPDV и ADPTGDTQYNERLSERRAKAV (SEQ ID NO: 129-134). Субъединичный белок может быть рекомбинантно экспрессирован либо отдельно, либо в виде гибрида с другой полипептидной последовательностью или белком. Другими полипептидными последовательностями или белками могут быть, но не ограничиваются ими, например, поли-His-метка, МВР, тиоредоксин или GST. Настоящее изобретение также относится к полинуклеотидным последовательностям или генам, кодирующим любой из вышеупомянутых субъединичных белков. Полинуклеотидная последовательность бактерий может быть выбрана из fimA и oprF или их фрагментов или вариантов, где указанный фрагмент или вариант, по меньшей мере, примерно на 90%, 95% или 99% гомологичен этой последовательности или комплементарной ей полинуклеотидной последовательности, которая гибридизуется в условиях высокой жесткости, или из их комбинаций. Предпочтительно полинуклеотидные последовательности согласно изобретению могут быть использованы для амплификации молекулы ДНК fimA или oprF согласно изобретению, либо может быть использован аминокислотный фрагмент, кодируемый указанными последовательностями, для вырабатывания антител против FimA или ОprF.
Для ДНК-терапии может быть использован вектор, способный доставлять или переносить гетерологичную нуклеиновую кислоту в клетку-хозяина. Такой экспрессионный вектор может включать элементы для селективной регуляции нацеливания, экспрессии и транскрипции нуклеиновой кислоты в клетке, как известно специалистам. Указанный экспрессионный вектор может включать промотор для регуляции транскрипции гетерологичного материала и может представлять собой конститутивный или индуцибельный промотор, обеспечивающий селективную транскрипцию. Для обеспечения необходимых уровней транскрипции могут, но необязательно, потребоваться энхансеры.
Векторы могут быть введены в клетки или ткани любым одним из ряда известных методов. Эти методы, по существу, описаны в руководстве Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor Laboratory, New York (1989, 1992); Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Maryland (1989); Chang et al., Somatic Gene Therapy, CRC Press, Ann Arbor, MI (1995); Vega et al., Gene Targeting, CRC Press, Ann Arbor, MI (1995); R.L. Rodriguez Vectors: A Survey of Molecular Cloning Vectors and Their Uses, Butterworths, Boston MA (1988), и такими методами являются, например, стабильная или временная трансфекция, липофекция, электропорация и инфицирование рекомбинантными вирусными векторами.
Настоящее изобретение также относится к комбинированным вакцинам, содержащим, по меньшей мере, одну из инактивированных или аттенуированных бактерий, нуклеотидных последовательностей или полипептидных последовательностей согласно изобретению в комбинации с одним или несколькими дополнительными иммуногенными компонентами. При этом неожиданно было установлено, что такая комбинированная вакцина может стимулировать у вакцинированного животного лучший эффект, чем эффект, ожидаемый от простой суммы эффектов, достигаемых при введении каждого компонента в отдельности. Таким образом, комбинированная вакцина может стимулировать синергическое продуцирование антитела у животных.
В предпочтительном варианте изобретения комбинированная вакцина согласно изобретению состоит из инактивированных препаратов целых клеток, по меньшей мере, трех бактерий Porphyromonas spp., например P.gulae В43, P. salivosa B104 и O. denticanis B106, в комбинации с одним или несколькими дополнительными бактериальными или вирусными иммуногенными компонентами. Дополнительными иммуногенными компонентами, которые могут быть использованы в комбинированных вакцинах согласно изобретению, являются, но не ограничиваются ими, вирус чумы собак (CDV), собачий аденовирус-2 (CAV-2), собачий парвовирус (CPV), вирус собачьего парагриппа (CPI) и собачий коронавирус (CCV).
Вакцины согласно изобретению могут быть получены путем комбинирования, по меньшей мере, одной из инактивированных или аттенуированных бактерий, нуклеотидных последовательностей или полипептидных последовательностей согласно изобретению с фармацевтически приемлемым носителем, а предпочтительно адъювантом.
Подходящими вакцинными препаратами согласно изобретению являются препараты для инъекций, приготовленные в виде жидких растворов или суспензий. Могут быть также получены твердые формы, которые перед их введением могут быть растворены или суспендированы в жидком фармацевтически приемлемом носителе. Указанный вакцинный препарат может быть эмульгированным. Активный иммуногенный компонент предпочтительно смешивают с адъювантом, который является фармацевтически приемлемым и совместимым с активным иммуногенным компонентом. Подходящими адъювантами являются, но не ограничиваются ими, минеральные гели, например гидроксид алюминия; поверхностно-активные вещества, такие как лизолецитин; гликозиды, например производные сапонина, такие как Quil A или GPI-0100 (патент США № 5977081); катионогенные поверхностно-активные вещества, такие как DDA, полиолы плуроники; полианионы; неионогенные блок-сополимеры, например Pluronic F-127 (BASF, USA); пептиды; минеральные масла, например Монтанид ISA-50 (Seppic, Paris, France); карбопол, Амфиген (Hydronics, Omaha, NE USA), альгидрогель (Alhydrogel) (Superfos Biosector, Frederikssund, Denmark), масляные эмульсии, например эмульсия минерального масла, такая как BayolF/Arlacel A и вода, или эмульсия, состоящая из растительного масла, воды и эмульгатора, такого как лецитин; квасцы, холестерин, rmLT, цитокины и их комбинации. Иммуногенный компонент может быть также включен в липосомы, либо он может быть конъюгирован с полисахаридами и/или с другими полимерами, используемыми в вакцинной композиции. Вспомогательными веществами, которые могут быть включены в продукт, используемый в способах согласно изобретению, являются, но не ограничиваются ими, один или несколько консервантов, таких как динатриевая или тетранатриевая соль этилендиаминтетрауксусной кислоты (EDTA), метиолат и т.п.
Индивидуумом, которому вводят указанную вакцину, предпочтительно является животное-компаньон, а наиболее предпочтительно собака или кошка.
При этом предпочтительно, чтобы вакцина согласно изобретению при ее использовании в вакцинной композиции присутствовала в единичной дозированной форме. В соответствии с настоящим изобретением иммуногенное количество инактивированных бактериальных клеток составляет примерно 1×104-1×1013; иммуногенное количество очищенного белка составляет 0,1 мкг - 1 мг или иммуногенное количество нуклеиновой кислоты составляет 0,1 мкг - 10 мг. В вакцинной композиции, содержащей множество компонентов, может быть с успехом использовано то же самое или меньшее иммуногенное количество этих компонентов.
Соответствующие терапевтически эффективные дозы могут быть легко определены специалистом в зависимости от вышеуказанных иммуногенных количеств, состояния, подвергаемого лечению, и физиологических особенностей животного. В соответствии с этим вакцинный препарат содержит определенную дозу стерильного препарата с иммуногенным количеством активного(ых) ингредиента(ов), где указанным активным ингредиентом является, по меньшей мере, один из таких компонентов, как бактерия, белок, нуклеиновая кислота или любые их комбинации. В присутствии дополнительных активных агентов эти единичные дозы могут быть легко скорректированы самим специалистом.
Желательная схема введения доз включает введение, по меньшей мере, одной дозы нужной вакцинной композиции, где содержание антигена в каждой фракции указано выше. Эффективные дозы (иммунизирующее количество) вакцин согласно изобретению могут быть также экстраполированы исходя из кривых “доза - ответ”, построенных по данным, полученным для систем тест-моделей. Введение вакцин согласно изобретению может быть осуществлено любым способом, подходящим для доставки вакцины хозяину. Такими способами являются, но не ограничиваются ими, чрескожное, внутримышечное, внутрибрюшинное, подкожное и интраназальное введение, а также скарификация (через царапины, нанесенные на верхнем слое кожи, например, с помощью иглы-вилки). Однако предпочтительным введением является подкожная или внутримышечная инъекция. Другими способами введения могут быть также, если это необходимо, внутрикожное, внутривенное, интраназальное или внутритонзиллярное введение.
Исследования показали, что первичную иммунизацию животного каждой из вышеописанных вакцинных композиций желательно начинать в молодом возрасте (в возрасте 8 недель и более), а повторную иммунизацию можно проводить в возрасте 12 и 16 недель. Рекомендуется также проводить ежегодную повторную вакцинацию.
Вакцину согласно изобретению приготавливают и вводят в соответствии с обычной медицинской практикой с учетом клинического состояния отдельного индивидуума, места и метода введения, схемы введения, возраста индивидуума, его пола, массы тела и других факторов, известных практикующим врачам.
Настоящее изобретение также относится к наборам для предупреждения пародонтоза у животных-компаньонов. В одном из вариантов изобретения указанный набор включает контейнер, содержащий терапевтически эффективное количество композиции для предотвращения пародонтоза у животных-компаньонов. В другом варианте указанный набор содержит в том же самом или другом контейнере фармацевтически приемлемый носитель, который может быть использован в данной композиции. Указанный набор может дополнительно включать адъювант, который может быть использован в целях стимуляции вырабатывания ответа на введение композиции согласно изобретению. Кроме того, указанный набор может включать мерное устройство для введения данной композиции, предпочтительно в единичной дозированной форме. Указанное мерное устройство для введения может, например, включать металлическую фольгу или пластиковую пленку, такую как блистерная упаковка. Этот набор может быть снабжен этикеткой или отпечатанными инструкциями с описанием способа введения данной композиции, предназначенной для предупреждения пародонтоза у животного-компаньона. Могут быть также получены композиции, содержащие вакцинную композицию согласно изобретению в сочетании с фармацевтически приемлемым носителем, помещенным в соответствующий контейнер с этикеткой, содержащей информацию о показаниях для лечения периодотоза.
Определение эффективности вакцины
Специфическим механизмом выработки иммунитета, индуцированного указанными вакцинами и вакцинными композициями согласно изобретению, является индуцирование выработки антитела и/или клеточного иммунного ответа у вакцинированных животных в соответствии с описанными ниже in vivo тестами на животных.
Бактерии, полинуклеотиды, полипептиды, вакцины и вакцинные композиции согласно изобретению могут быть использованы для лечения или предупреждения пародонтоза у животных-компаньонов, копытной гнили у коров, ишемической болезни сердца (у собак) или системных инфекционных заболеваний (у собак). Кроме того, композиции согласно изобретению могут быть также использованы для лечения или предупреждения некоторых заболеваний у животных-компаньонов, соответствующих аналогичным заболеваниям у человека, таким как ишемическая болезнь сердца (сосудистая или артериальная), паротит, неприятный запах изо рта, гингивит, периодонтит, инсульт, атеросклероз, гиперлипидемия, повышенная вероятность преждевременных родов с последующим рождением детей с пониженной массой, бактериальный вагиноз и замедление внутриутробного развития (IUGR).
В другом своем аспекте настоящее изобретение относится к способам оценки эффективности вакцины против одной или нескольких периопатогенных бактерий у животных. В настоящем изобретении показано, что действие вакцины против одной или нескольких периопатогенных бактерий может быть проанализировано у таких животных, как мышь или собака, а предпочтительно собака.
В соответствии с настоящим изобретением действие вакцин против различных периопатогенных бактерий, включая, но не ограничиваясь ими, Porphyromonas, Bacteriodes, Prevotella, Tannerella (Tanerella forsythensis, ранее называемая Bacteroides forsythus) и Treponema, может быть проанализировано вышеописанными методами, разработанными для лечения или предупреждения пародонтоза у человека или животных-компаньонов, вызываемого этими бактериями. Указанные вакцины могут содержать инактивированные или аттенуированные бактерии, полипептиды или полинуклеотиды, происходящие от любых видов бактерий.
Эффективность вакцины может оценена путем контрольного заражения бактериальной культурой отдельно вакцинированного животного и невакцинированного животного и сравнения клинических симптомов у двух животных. Культура для контрольного заражения может состоять из таких же периопатогенных бактерий, как и вакцина. Однако такая культура может содержать бактерии, отличающиеся от бактерий, имеющихся в вакцине, что позволяет проводить оценку любого перекрестного иммунитета, вызываемого вакциной против других бактериальных штаммов.
В соответствии с настоящим изобретением культуру для контрольного заражения предпочтительно вводить в корневой канал зуба животного, у которого из корня зуба был удален корневой материал с последующим пломбированием этого зуба. Культура для контрольного заражения обычно содержит от примерно 1×102 до примерно 1×1012 колониеобразующих единиц (КОЕ) на дозу заражения; предпочтительно от примерно 1×105 до примерно 1×1011 колониеобразующих единиц (КОЕ) на дозу заражения; а наиболее предпочтительно от примерно 5×107 до примерно 5×1011 колониеобразующих единиц (КОЕ) на дозу заражения.
Клиническими признаками заболевания, которые могут быть оценены, являются повышенные уровни одной или нескольких периопатогенных бактерий в жидкости десневой борозды, в бляшках, в инфицированной кости или в зубодесневом кармане или изменения количества альвеолярного отростка, в частности в периапикальной области альвеолярного отростка. Изменения в кости могут быть количественно оценены, например, путем рентгенографических измерений.
Настоящее изобретение также проиллюстрировано в нижеследующих неограничивающих примерах и в прилагаемом графическом материале.
Пример 1
Образец жидкости десневой борозды животного-компаньона
Микробиологические образцы были взяты у собак и кошек, обследованных в ветеринарных клиниках в целях лечения пародонтоза, или у собак, обследованных в отделениях Pfizer Terre Haute или Pfizer Sandwich для обследования здоровых животных. В эти исследования были включены собаки с зубодесневыми карманами >3 мм и кошки с зубодесневыми карманами >2 мм. Были зарегистрированы дентальные индексы (десневой индекс и периодонтальный индекс) и глубина периодонтального кармана. В периодонтальный карман в асептических условиях были введены штифты из специальной крупнопористой абсорбентной бумаги (Henry Schein; Melville, NY). После удаления эти бумажные штифты были сразу введены в сосуды, содержащие предварительно восстановленную анаэробно стерилизованную (PRAS) среду для анаэробного переноса дентального материала (ADT) (анаэробные системы; Morgan Hills, CA).
Сосуды были перенесены в анаэробную камеру Bactron IV (Sheldon Manufacturing, Cornelius, OR) и обработаны в атмосфере 90% N2, 5% H2, 5% СО2. Указанные бумажные штифты в асептических условиях помещали в 50 мкл PRAS-среды с сердечно-мозговым экстрактом (ВНI) (анаэробные системы) и перемешивали в течение 30 секунд. Были получены разведения 1:100 и 1:1000 в среде ВНI. Аликвоты 100 мкл разведений 1:100 и 1:1000 распределяли по планшетам с кровяным PRAS-агаром Burcella (BRU) (анаэробные системы). Планшеты инкубировали при 37°С в анаэробной камере в течение 5-7 дней. Затем подсчитывали общее число бактериальных колоний и число колоний черных пигментированных анаэробных бактерий (ВРАВ). Отдельные ВРАВ-колонии переносили на новые ВRU-планшеты и повторно инкубировали, как описано выше.
Характеризация клинических изолятов
Каждый клинический изолят подвергали различным биохимическим анализам и анализу последовательности ДНК 16S pPHK с использованием праймеров D0056 и D0057 (SEQ ID NO: 1 и SEQ ID NO: 2; таблица 1) для определения рода и вида бактерий. Отдельные изоляты высевали штрихом на ВRU-планшеты. На агаровую поверхность наносили канамицин, ванкомицин и колистиновые диски (анаэробные системы) для определения профилей резистентности каждого изолята к КVС. Очищенные колонии также тестировали на индол и каталазу (анаэробные системы). Отдельные изоляты переносили на агаровые планшеты с яичным желтком (EYA) (анаэробные системы) для определения профиля продуцирования липазы и лецитиназы. Эти данные приводятся в таблице 2.
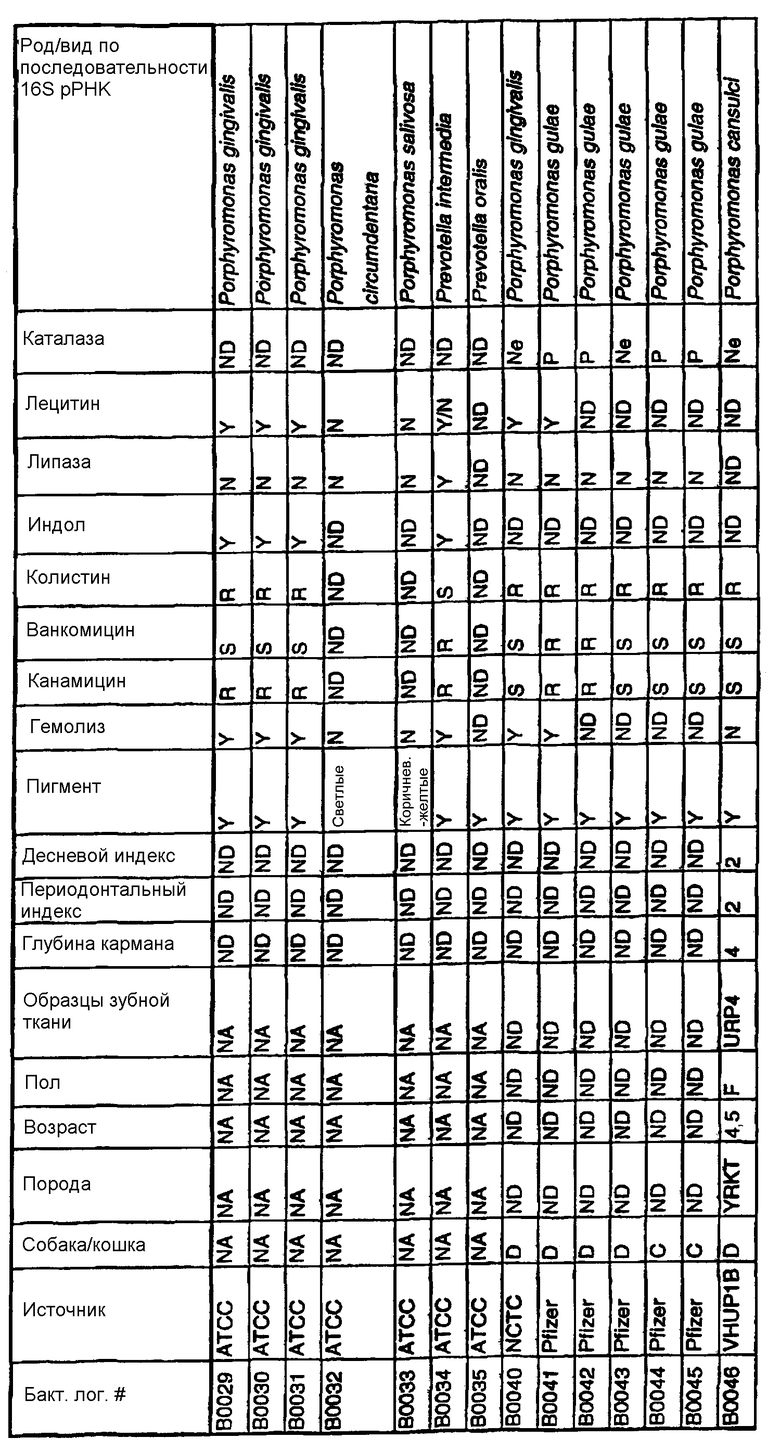
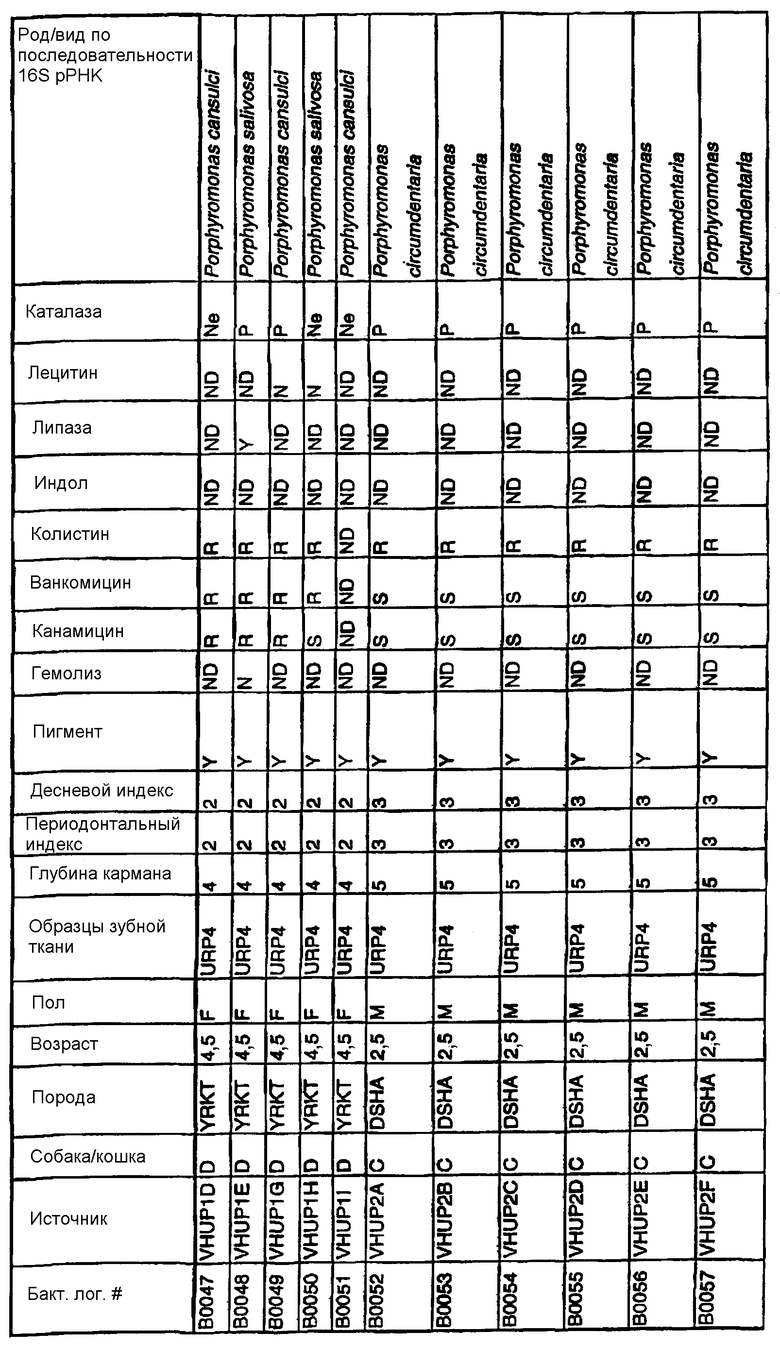
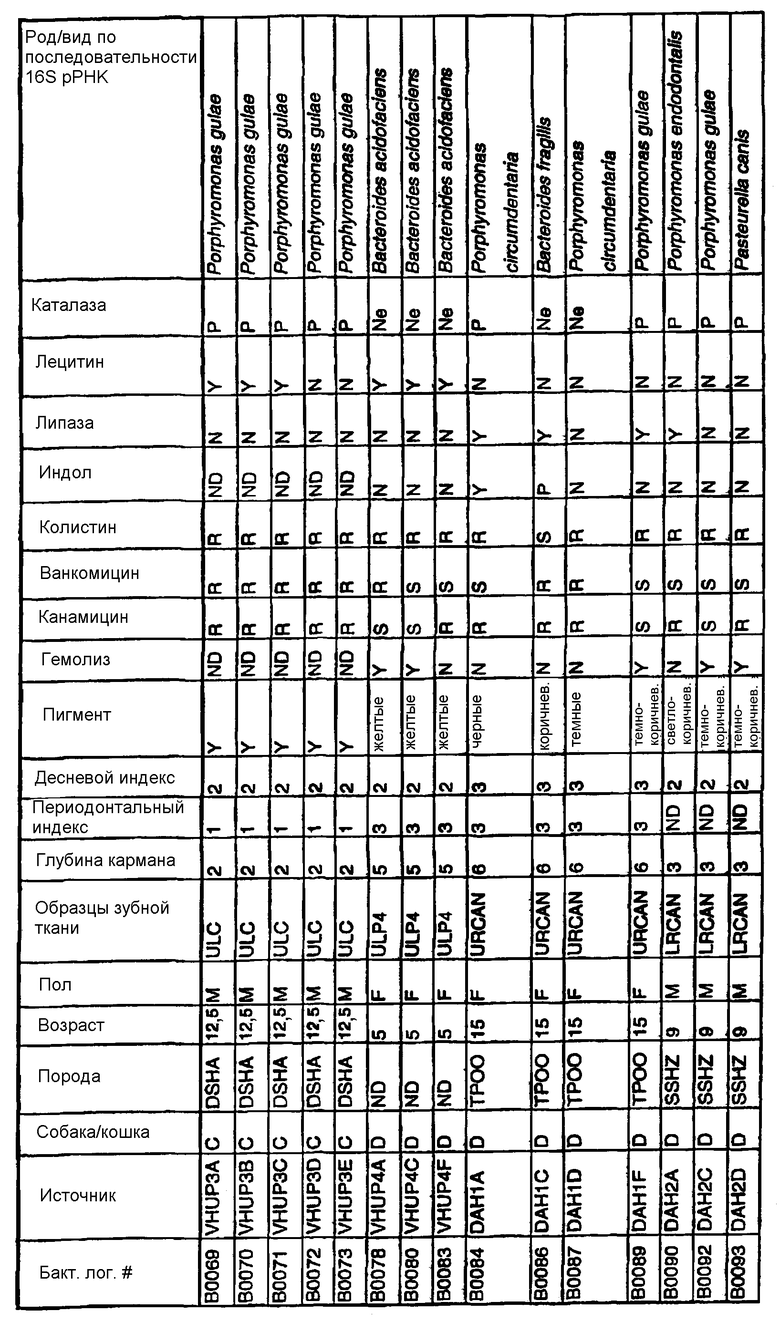
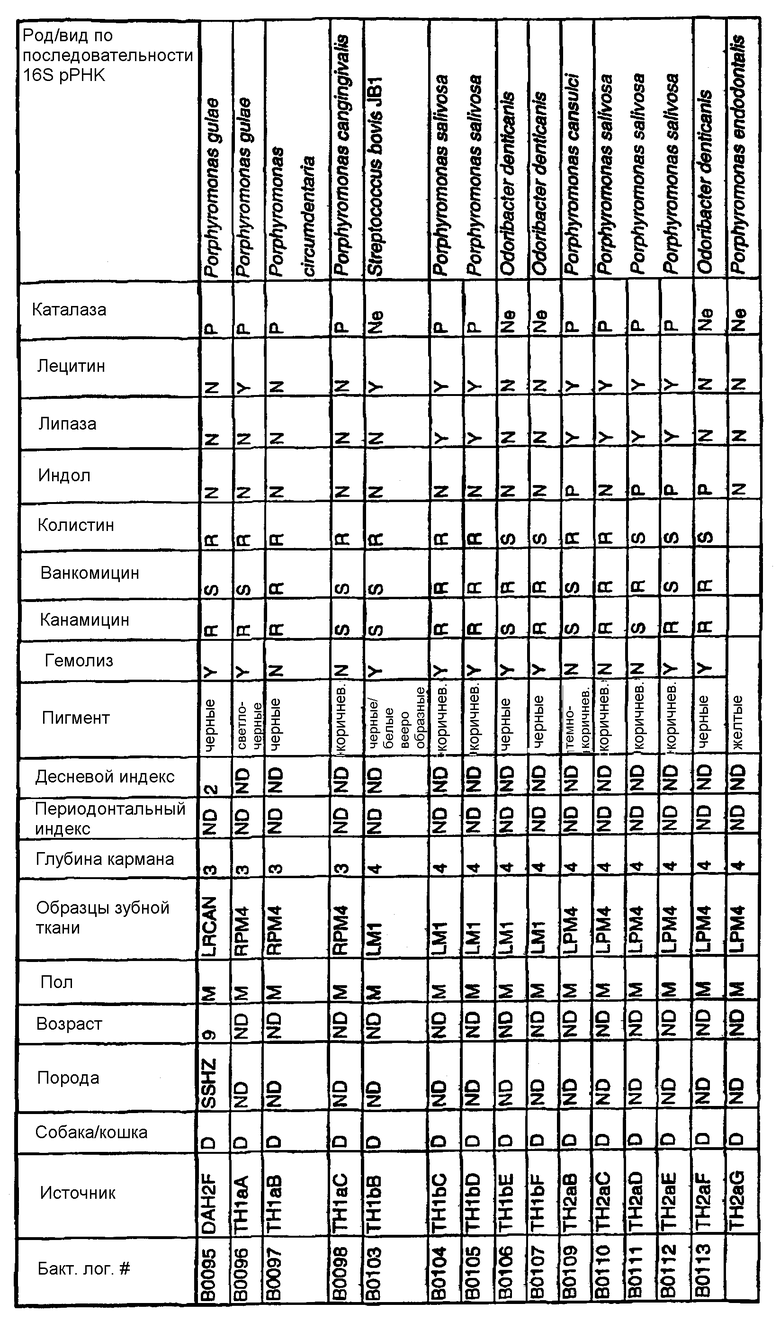
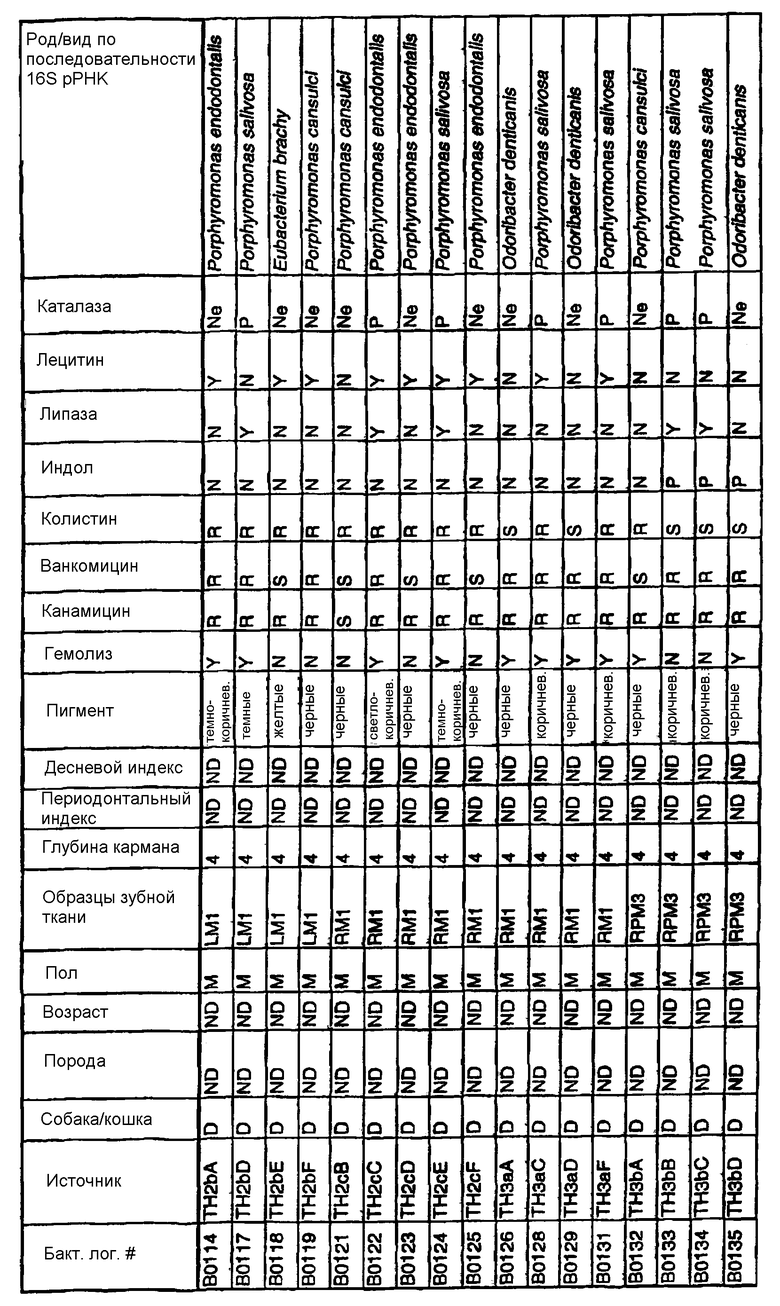
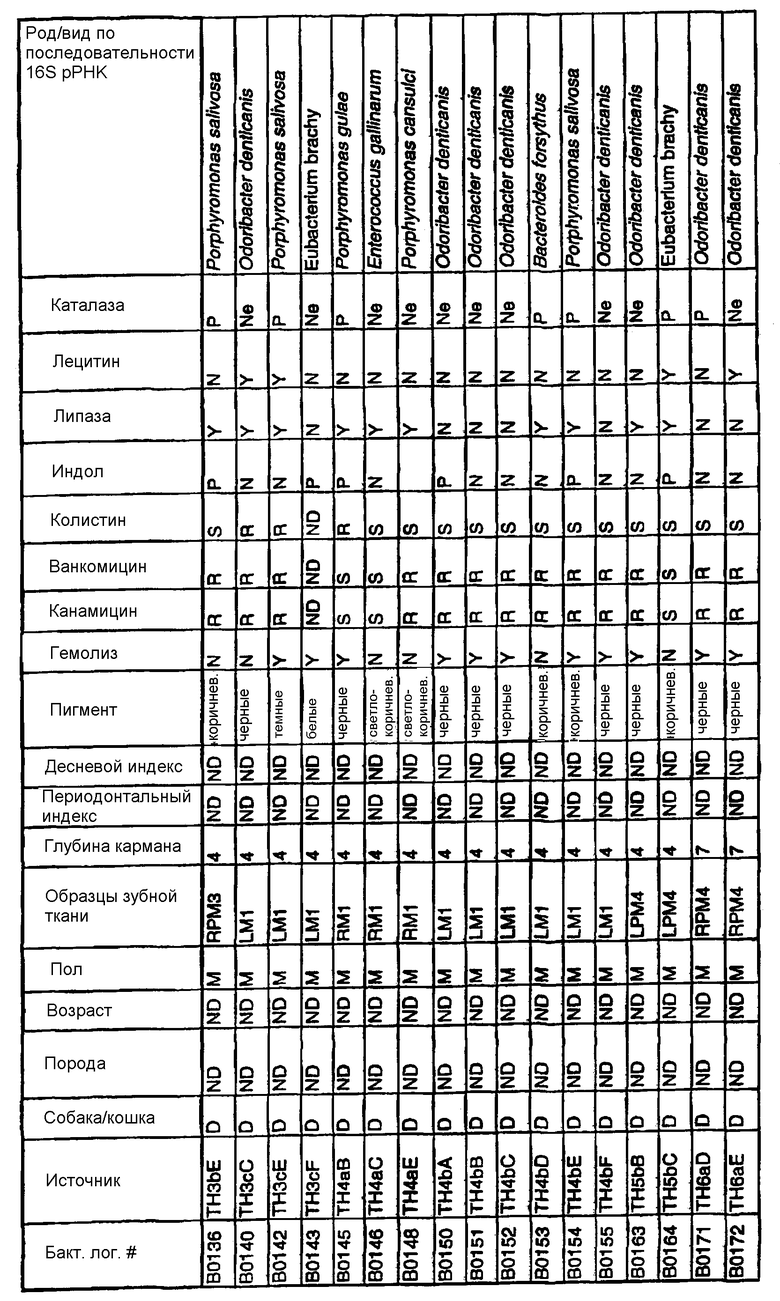
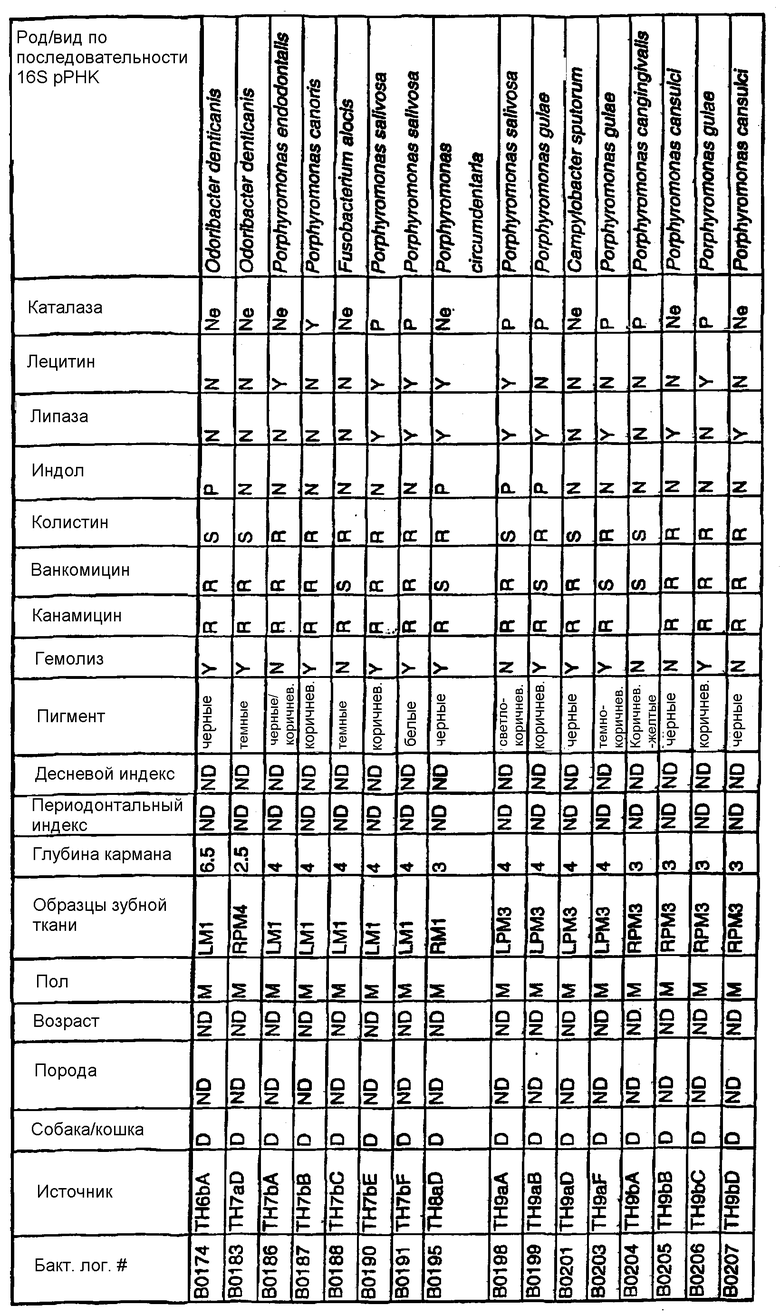
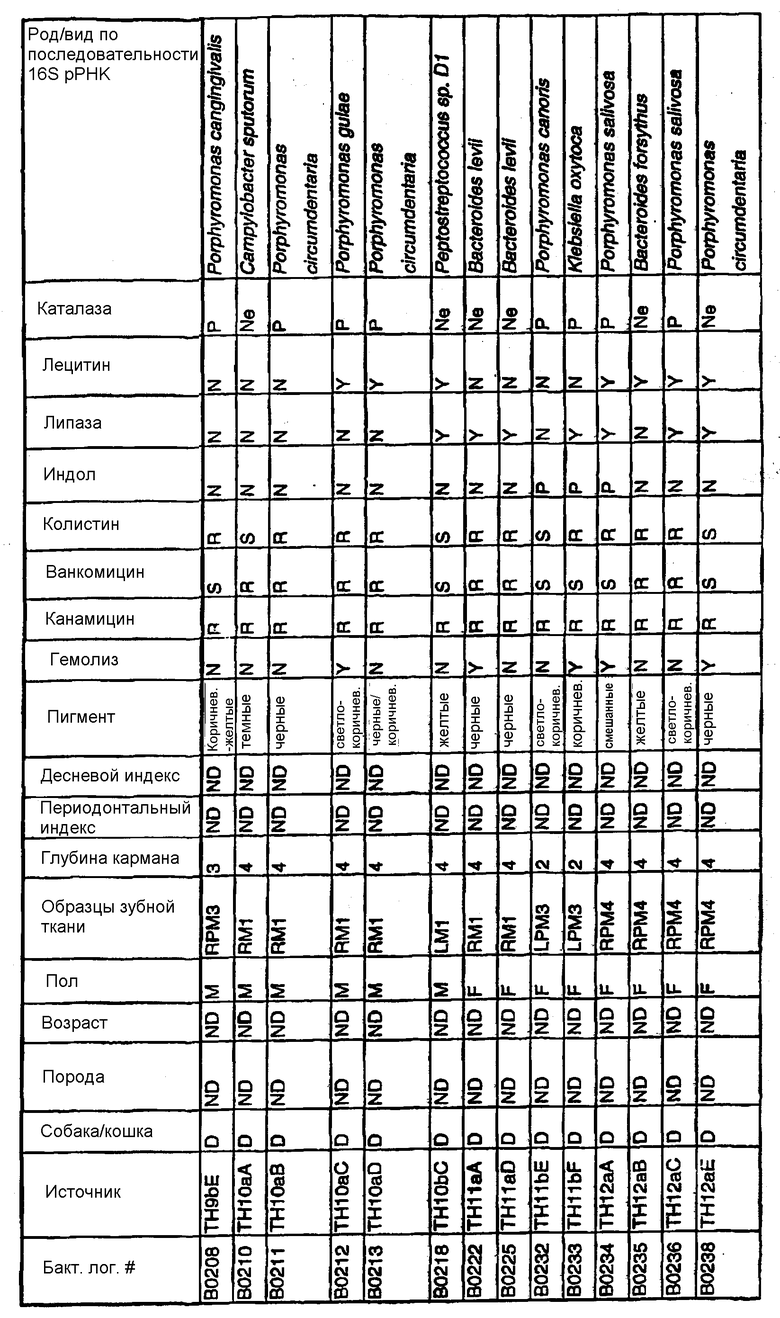
,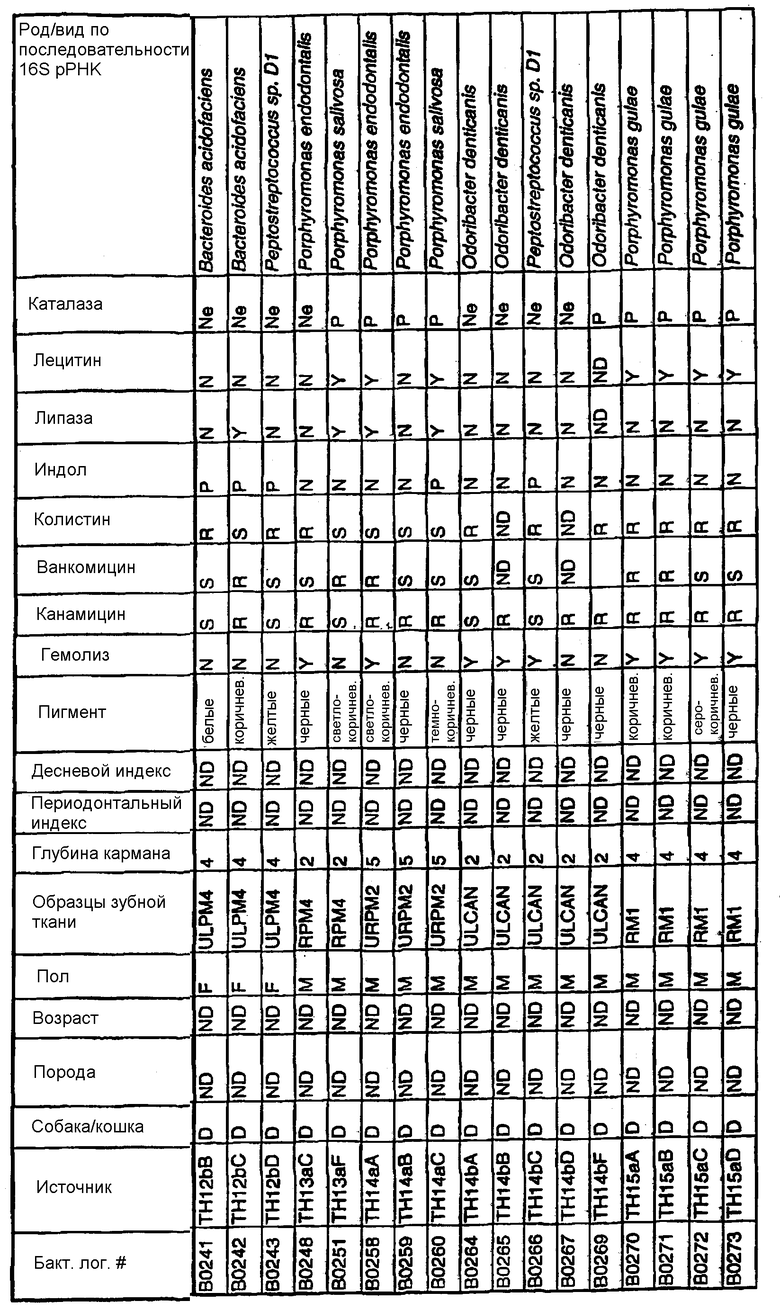
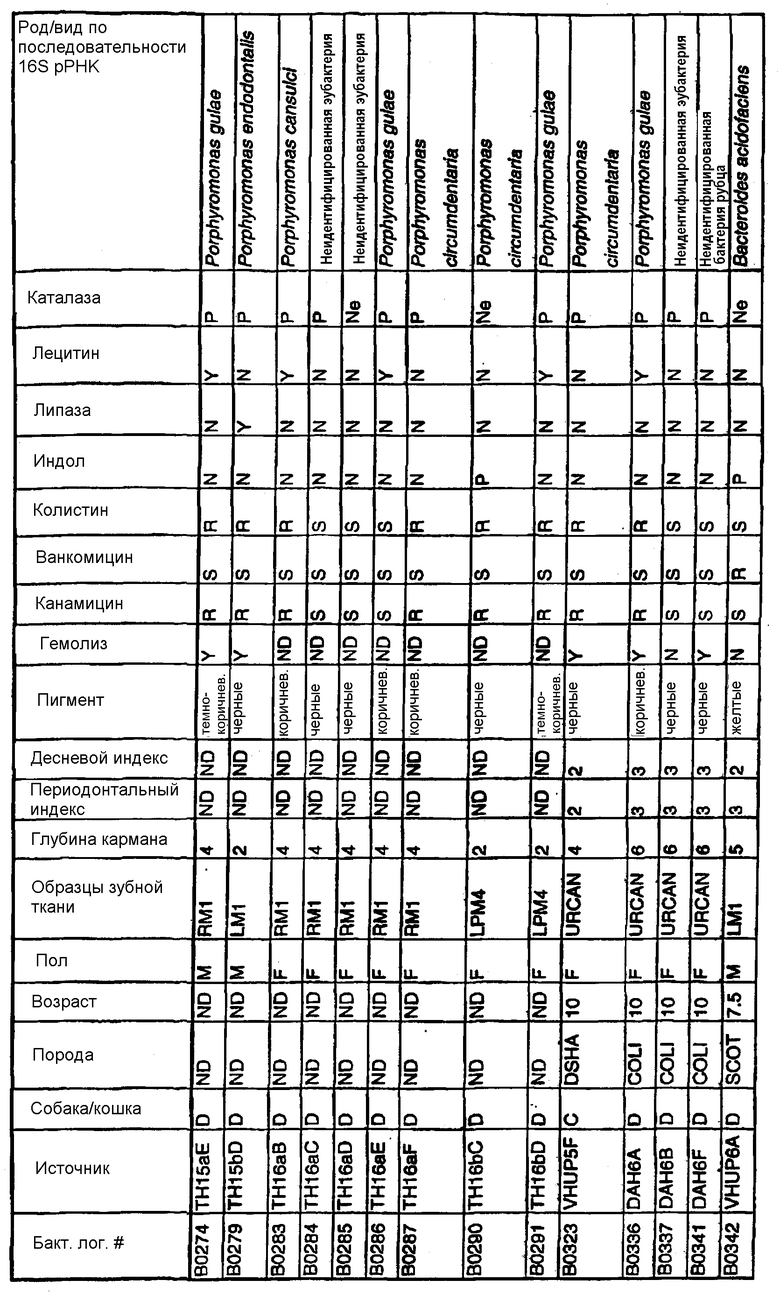
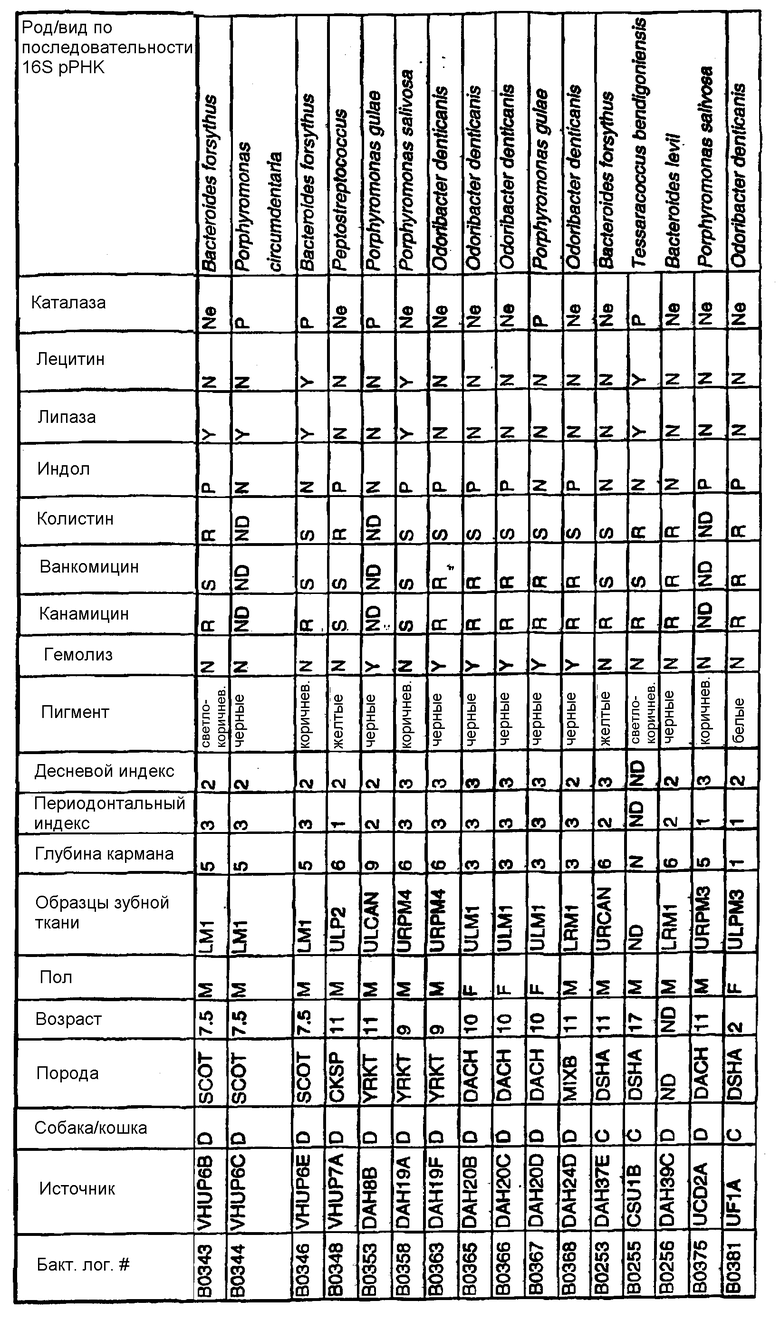
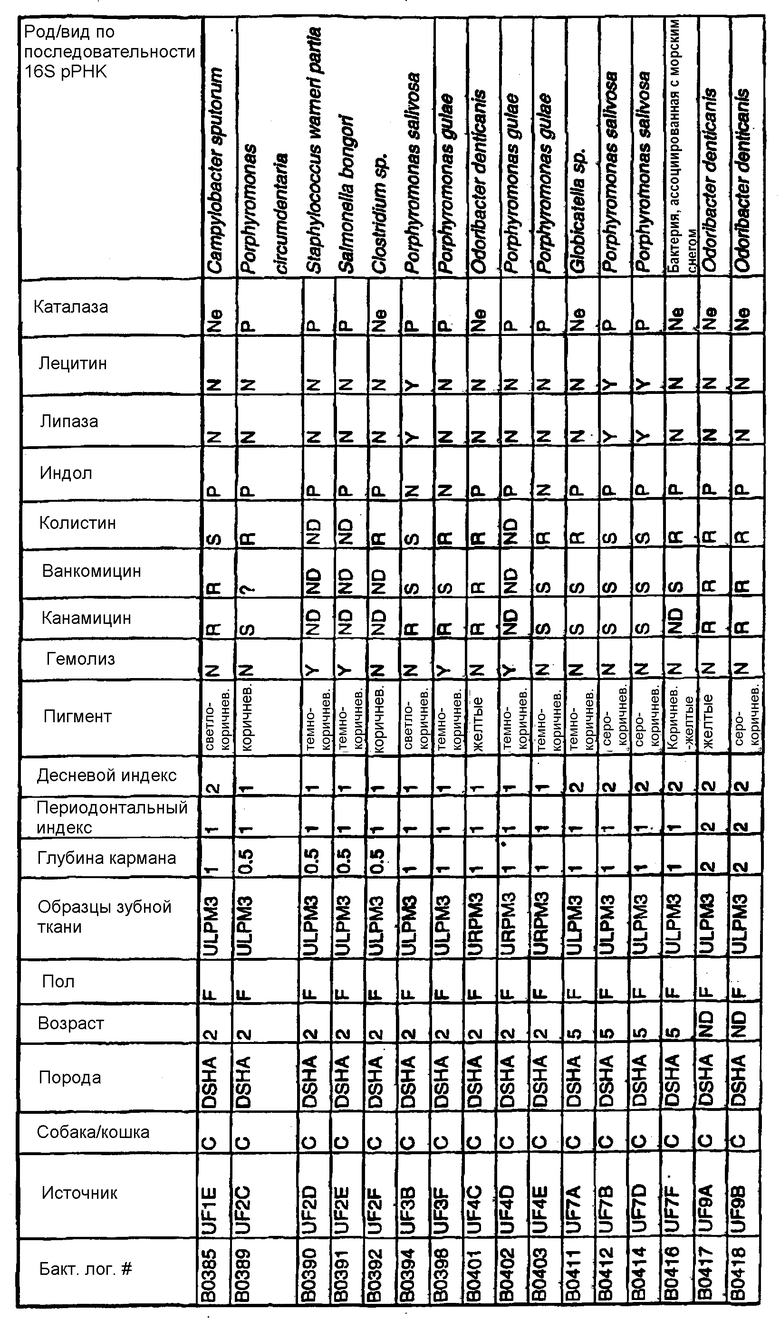
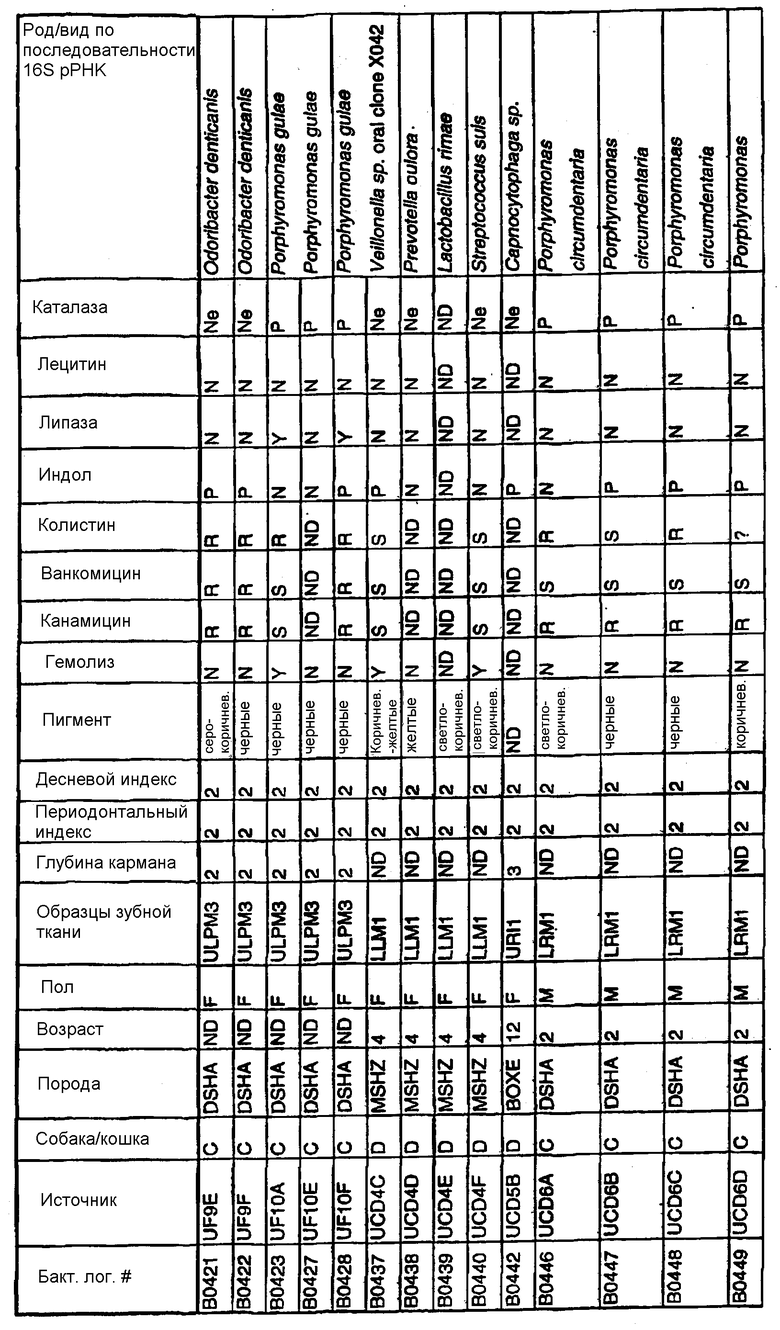
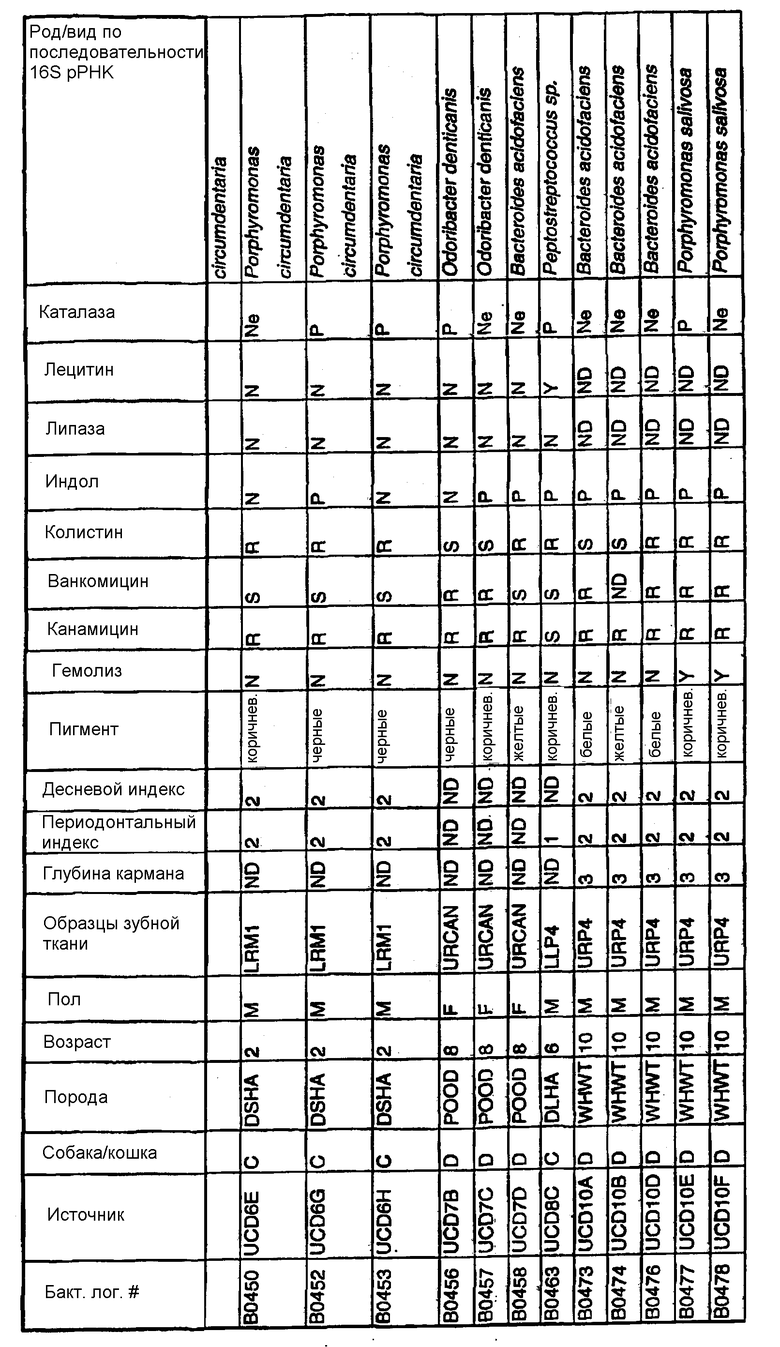
Сокращения: D - собака; С -кошка; NА - не применяли, ND - не определяли; М - самец; F - самка; Y - да; N - нет; Р - положительная, Nе - отрицательная.
Изоляты типировали по их последовательностям ДНК 16S pPHK. Отдельные хорошо очищенные колонии использовали в качестве матрицы для амплификации области 16S pPHK посредством полимеразной цепной реакции (ПЦР) с применением праймеров D0056 и D0057 (SEQ ID NO: 1 и SEQ ID NO:2; таблица 1) с тремя повторностями. ПЦР осуществляли в реакционной смеси объемом 50 мкл, содержащей 1 × ПЦР-буфер (Life Technologies; Rockville, MD), 1,0 мМ MgCl2, 1,25 мкМ каждого праймера, 300 мкМ каждого дезокси-NTP и 2,5 ед. ДНК-полимеразы Platinum Pfx (Life Technologies). Затем проводили ПЦР-циклы в следующем режиме: стадия денатурации в течение двух минут при 94°С; 30 циклов денатурации при 94°С в течение 40 секунд, отжиг при 60°С в течение 40 секунд и удлинение при 72°С в течение одной минуты; конечная стадия удлинения при 72°С в течение двух минут и конечная стадия охлаждения до 4°С. Во всех реакциях ПЦР-амплификации использовали термоциклер GeneAmp 9700 (Perkin Elmer Applied Biosystems; Foster City, CA).
Полученные ПЦР-продукты очищали с использованием наборов для препаративной ПЦР (Promega Corp.; Madison, WI), выделяли и объединяли в пул. Затем очищенные ПЦР-продукты обессоливали путем проведения капельного диализа против 25 мл стерильной воды с использованием нитроцеллюлозного 0,025 мкм-фильтра (Millipore Corp.; Bedford, MA). Очищенные и обессоленные ПЦР-продукты подвергали анализу последовательности ДНК путем проведения реакции дезокси-терминации цепи красителем на автоматическом ДНК-секвенаторе ABI (University of Texas Genetics Core Facility, Houston, TX and Lark Technologies Inc., Houston, TX). Для получения двухцепочечной ДНК-последовательности использовали синтетические олигонуклеотидные праймеры D0056, D0057, PFZ175-АP1, PFZ175-AP2 и PFZ175-AP3 (SEQ ID NO: 1-5 соответственно; таблица 1). Полученные ДНК-последовательности использовали для поиска в общедоступных базах данных ДНК с использованием программы BLAST-N, которая может быть получена из Национального центра биотехнологической информации, США.
Бактериальные изоляты типировали по наиболее близкому соответствию, идентифицированному путем поиска в базах данных. Изолят В106 не имел точного соответствия, что дает основание предполагать, что он может представлять собой изолят бактерии нового вида/рода (см. ниже). Полный список всех изолятов и их соответствующие характеристики приводятся в таблице 2. Девять наиболее часто встречающихся выделенных штаммов представлены следующими изолятами: P.gulae B43 (cобачий образец Sandwich 4), P.cansulci B46 (cобачий образец VHUP 1B), P.circumdentaria B52 (кошачий образец VHUP 2А), P.gulae B69 (кошачий образец VHUP 3А), P.circumdentaria B97 (cобачий образец ТН 1bC), P.cangingivalis B98 (cобачий образец ТН 1аС), P. salivosa B104 (cобачий образец ТН 1bС), O. denticanis B106 (cобачий образец ТН 1bЕ) и P.endodontalis В114 (cобачий образец ТН 2bА).
Распределение изолятов показано в таблице 3.
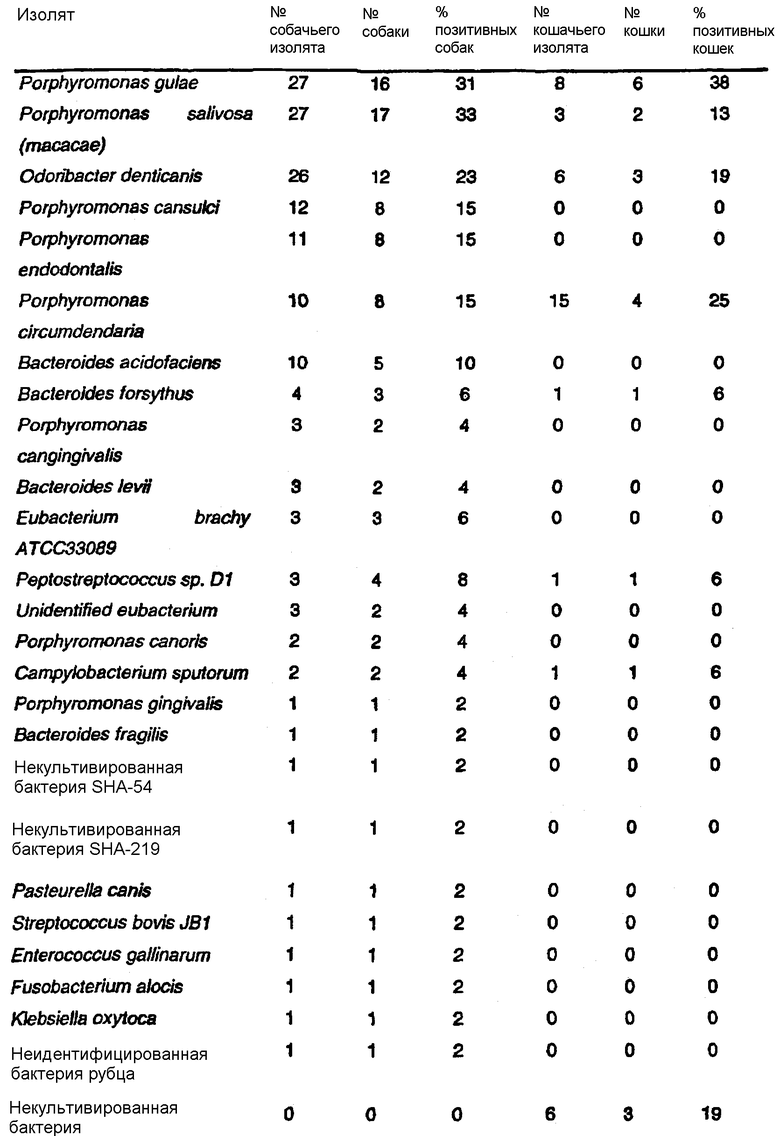
Перечисленные выше изоляты представляют собой изоляты наиболее часто встречающихся видов бактерий, которые присутствуют у собак или кошек в наиболее высоком процентном соотношении.
В Американской коллекции типовых культур (АТСС) (10801 University Blvd., Manassas, VA, 20110, USA, August 9, 2001) были депонированы нижеследующие периодонтальные изоляты, взятые у животных-компаньонов: P.gulae B43 (РТА-3618), P.cansulci B46 (РТА-3619), P.circumdentaria B52 (РТА-3620), P.gulae B69 (РТА-3621), P.circumdentaria B97 (РТА-3622), P.cangingivalis B98 (РТА-3623), P. salivosa B104 (РТА-3624), O. denticanis B106 (РТА-3625) и P.endodontalis В114 (РТА-3626).
Идентификация бактерий нового рода/вида (Odoribacter denticanis)
В процессе исследований авторами настоящего изобретения были идентифицированы различные клинические изоляты, имеющие последовательности 16S pPHK, которые не обнаруживали высокой степени соответствия с последовательностями в доступных базах данных, что указывало на то, что такие бактерии могут представлять собой новые изоляты. Одна из групп этих изолятов, очевидно, представляет собой изолят нового вида. На основе имеющихся данных авторы настоящего изобретения высказали предположение, что этот новый вид принадлежит к новому роду, названному Odoribacter gen. nov. Указанный штамм Odoribacter denticanis представляет собой штамм В106Т (=АТСС РТА-3625Т; =CNCM I-3225Т).
Odoribacter denticanis В106Т был выделен у взрослых самцов собак смешанной породы неизвестного возраста, страдающих пародонтозом. Образец на бумажных штифтах брали из первого моляра нижней челюсти, который имел зубодесневой карман глубиной 4 мм и десневой индекс 1. Этот образец обрабатывали, как описано выше. Очищенные клетки подвергали биохимическому анализу с использованием набора для клинического теста RapID ANA II (Remel; Lenexa, KS) и системы карт для идентификации анаэробов Vitek (ANI) (BioMerieux Inc.; Durham, NC). Вкратце, бактериальные клетки, культивированные до конфлюентности на планшетах с кровяным агаром Brucella, ресуспендировали до эквивалентности McFarland #3. Эту суспензию добавляли в тест-лунки RapID ANA II или на карту Vitek ANI и инкубировали в течение 4 часов при 37°С. После инкубирования регистрировали данные биохимических тестов.
В таблице 4 представлены результаты теста RapID ANA II на O. denticanis B106Т, а также на 6 родственных бактерий. Из 18 тестов, проведенных с использованием набора RapID ANA II, только два теста (LGY и IND) были положительными на O. denticanis B106Т. В отличие от этого Porphyromonas gingivalis АТСС 33277, Prevotella intermedia ATCC 25611, Tannerella forsythensis АТСС 43037, Bacteroides thetaiotaomicron АТСС 29148, Bacteroides fragilis АТСС 25285 и Bacteroides splanchnicus АТСС 29572 давали положительные результаты в 5, 4, 10, 12, 9 и 8 тестах соответственно.
штаммы проводили с использованием RapID ANA II
 * В каждом тесте использовали следующие реактивные ингредиенты: URE, мочевина; BLTS, п-нитрофенил-β,D-дисахарид; αARA, п-нитрофенил-α,L-арабинозид; ONPG, о-нитрофенил-β,D-галактозид; αGLU, п-нитрофенил-α,D-глюкозид; βGLU, п-нитрофенил-β,D-глюкозид; αGAL, п-нитрофенил-α,D-галактозид; αFUC, п-нитрофенил-α,L-фукозид; NAG, п-нитрофенил-N-ацетил-α,D-глюкозаминид; РO4, п-нитрофенилфосфат; LGY, лейцин-глицин-β-нафтиламид; GLY, глицин-β-нафтиламид; PRO, пролин-β-нафтиламид; PAL, фенилаланин-β-нафтиламид; ARG, аргинин-β-нафтиламид; SER, серин-β-нафтиламид; PYR, пирролидонил-β-нафтиламид и IND, триптофан.
* В каждом тесте использовали следующие реактивные ингредиенты: URE, мочевина; BLTS, п-нитрофенил-β,D-дисахарид; αARA, п-нитрофенил-α,L-арабинозид; ONPG, о-нитрофенил-β,D-галактозид; αGLU, п-нитрофенил-α,D-глюкозид; βGLU, п-нитрофенил-β,D-глюкозид; αGAL, п-нитрофенил-α,D-галактозид; αFUC, п-нитрофенил-α,L-фукозид; NAG, п-нитрофенил-N-ацетил-α,D-глюкозаминид; РO4, п-нитрофенилфосфат; LGY, лейцин-глицин-β-нафтиламид; GLY, глицин-β-нафтиламид; PRO, пролин-β-нафтиламид; PAL, фенилаланин-β-нафтиламид; ARG, аргинин-β-нафтиламид; SER, серин-β-нафтиламид; PYR, пирролидонил-β-нафтиламид и IND, триптофан.
Сокращения: Р, положительная; N, отрицательная; V, изменчивая.
Характер биохимических реакций для O. denticanis B106Т, P.gingivalis ATCC 53977 и Fusobacterium nucleatum, подвида nucleatum ATCC 23726, определяли с использованием карты Vitek ANI (таблица 5). Штамм O. denticanis В106Т давал положительный результат только в 2 тестах (на индол и TTZ), а штамм P. gingivalis АТСС 53977 давал положительный результат в 5 тестах (на индол, PO4, NAG, BANA и TTZ). Из 12 тестов, которые были проведены как с использованием набора RapID ANA II, так и с использованием карты Vitek ANI, все тесты давали аналогичные результаты. С использованием базы данных, предоставленной Vitek, было обнаружено, что изолят O. denticanis B106Т был неправильно идентифицирован как F. nucleatum с доверительным уровнем 63% (данные не приводятся). Такая неправильная идентификация может быть обусловлена отсутствием ветеринарных РАВ-изолятов в базе данных Vitek.
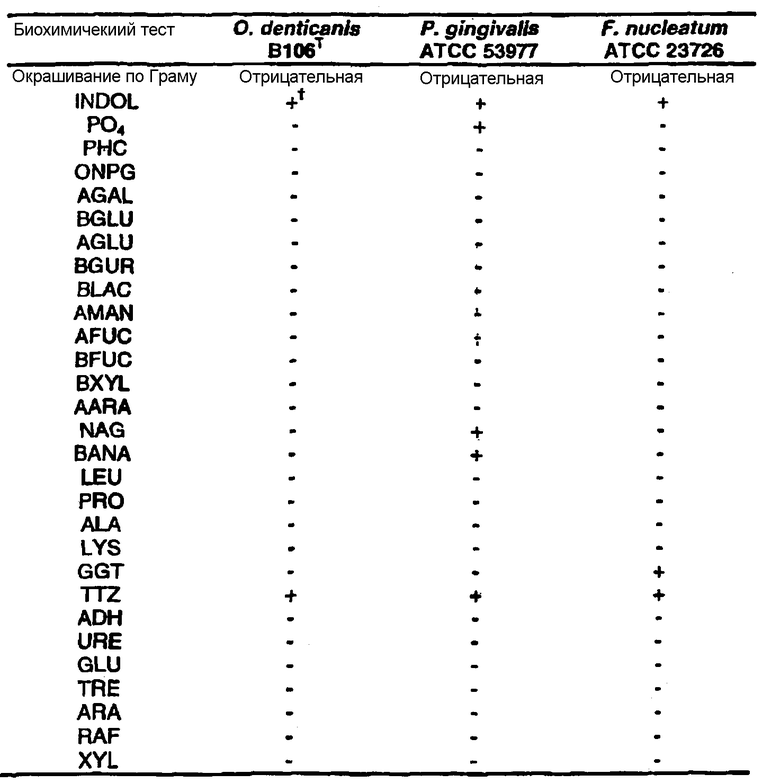
*В каждом тесте использовали следующие реактивные ингредиенты: IND, триптофан; РO4, п-нитрофенилфосфат; РНС, п-нитрофенилфосфатхолин; ONPG, о-нитрофенил-β,D-галактопиранозид; AGAL, п-нитрофенил-α,D-галактопиранозид; BGLU, п-нитрофенил-β, D-глюкопиранозид; AGLU, п-нитрофенил-α,D-глюкопиранозид; BGUR, п-нитрофенил-β,D-глюкуронид; BLAC, п-нитрофенил-β,D-лактозид; AMAN, п-нитрофенил-α,D-маннопиранозид; AFUC, п-нитрофенил-α,L-фукопиранозид; BFUC, п-нитрофенил-β,D-фукопиранозид; BXYL, п-нитрофенил-β,D-ксилопиранозид; AARA, п-нитрофенил-α,L-арабинофуранозид; NAG, п-нитрофенил-N-ацетилглюкозаминид; BANA, п-нитроанилид N-бензил-DL-аргинина; LEU, п-нитроанилид L-лейцина; PRO, п-нитроанилид L-пролина; ALA, п-нитроанилид L-аланина; LYS, п-нитроанилид L-лизина; GGT, п-нитроанилид гамма-глутамина; TTZ, трифенилтетразолий; ADH, аргинин; URE, мочевина; GLU, глюкоза; TRE, трегалоза; ARA, арабиноза; RAF, раффиноза; XYL, ксилоза.
† Сокращения: + положительная; - отрицательная.
Ген 16S pPHK O. denticanis B106Т подвергали ПЦР-амплификации с тремя повторностями с использованием праймеров D134 (SEQ ID NO: 169) и D57 (SEQ ID NO: 2). ПЦР-продукты объединяли, очищали, обессоливали и подвергали прямому анализу последовательности ДНК. Поиск в неизбыточной базе данных нуклеотидов Национального центра биотехнологической информации с использованием последовательности гена 16S pPHK для O. denticanis B106Т с помощью программы BLAST-N (Altschul et al., 1990) показал, что изолят O. denticanis B106Т является родственным изолятом рода Bacteroides. Генная последовательность 16S pPHK O. denticanis B106Т имела наибольшее сходство с генной последовательностью 16S pPHK клона FХ069 Bacteroidetes spp., выделенного из ротовой полости (регистрационный номер AY134906), и обнаруживала 96,3%-ную идентичность по 1465 п.н. Выделенный из ротовой полости клон Bacteroidetes spp. FХ069 был взят в процессе исследований у человека с некрозирующим язвенным периодонтитом (NUP) для определения вида бактерий, ассоциированных с NUP у ВИЧ-положительных пациентов (Paster B.J. et al., “Phylogeny of Bacteroides, Prevotella and Porphyromonas spp. and related bacteria”, J. Bacteriol. (1994), 176:725-732).
Филогенетический анализ на основе генных последовательностей 16S pPHK осуществляли с использованием компьютерной программы CLUSTAL Х, версии 1.81 (Thompson, J.D. et al., “CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, positions-specific gap penalties and weight matrix choices”, Nucleic Acids Res. (1994) 22: 4673-4680). Построение филогенетических деревьев осуществляли методом “ближайшего соседа” (Saitou N. & Nei, M. “The neighbor-joining method: a new method for reconstructing phylogenetics trees” Mol. Biol. Evol. (1987) 4: 406-425). Бутстреп-величины получали с использованием 1000 копий. На фиг.1 представлены результаты филогенетического анализа на изолят O. denticanis B106Т. Положения бактерий основных родов (Porphyromonas, Bacteroides, Prevotella, Tannerella и т.п.) соответствуют ранее опубликованным данным представления филогенетических деревьев для бактерий группы cytophaga-flavobacter-bacteroides (CFB)(Paster et al., 1994; Sakamoto M., et al., “Reclassification of Bacteroides forsythus (Tanner et al., 1986) as Tannerella forsythensis corrig., gen. nov., comb.nov.” Int. J. Syst. Evol. Microbiol. (2002) 52: 841-849; Shah H.N. & Collins, D. “Proposal for reclassification of Bacteroides asaccharolyticus, Bacteroides gingivalis and Bacteroides endodontalis in a new genus, Porphyromonas” Int. J. Syst. Bacteriol. (1998) 38: 128-131).
Штамм O. denticanis B106Т был отнесен к группе, не принадлежащей к Bacteroides и включающей B. splanchnicus (Werner H. et al., “A new butyric acid-producing Bacteroides species: B. splanchnicus n. sp”. Zentrabl. Bakteriol. (1975) 231:133-144), несколько изолятов, выделенных из ротовой полости, и множество некультивированных штаммов. 71,0% доверительного интервала бутстреп-величин в точке ветвей O. denticanis B106Т и B. splanchnicus указывает на относительно высокую степень достоверности того, что эти два микроорганизма являются родственными. Однако уже давно ведется дискуссия по поводу принадлежности бактерии B. splanchnicus к роду Bacteroides (Paster et al., 1994; Shah et al., 1998). Пастер и др. высказали предположение, что бактерия B. splanchnicus может принадлежать к новому роду. Shah и др. показали, что бактерия B. splanchnicus обладает многими общими хемотаксономическими свойствами с членами рода Porphyromonas. Представленные авторами данные подтверждают эту гипотезу, поскольку ветви группы B. splanchnicus/O. denticanis B106Т являются более близкими к роду Porphyromonas, чем к роду Bacteroides (фиг.1).
Область гена 16S pPHK, состоящую приблизительно из 580 п.н. и выделенную из 25 дополнительных собачьих клинических изолятов O. denticanis (таблица 1), подвергали ПЦР-амплификации с использованием праймеров D56 и D57, описанных выше. ПЦР-продукты очищали и обессоливали. Затем определяли ДНК-последовательность ПЦР-продуктов. Было обнаружено, что неполные последовательности 16S pPHK от изолятов O. denticanis (SEQ ID NO: 138-162) все вместе входят в группы идентичных или высококонсервативных последовательностей, при этом, как показал анализ, при наибольшем расхождении между этими группами в данной области, идентичность составляла 97%. На фиг.2 представлены результаты филогенетического анализа неполных генных последовательностей 16S pPHK изолятов O. denticanis, при этом для анализов был выбран репрезентативный изолят от каждой группы родственных последовательностей. Исходя из этих наблюдений можно сделать вывод, что все эти изоляты представляют собой различные штаммы одного и того же вида.
Были также получены клинические изоляты O. denticanis от кошек (таблица 1). Ту же самую область гена 16S pPHK, состоящую приблизительно из 580 п.н. и описанную выше, амплифицировали из этих изолятов посредством ПЦР с использованием праймеров D56 и D57. ДНК-последовательности, полученные из очищенных ПЦР-продуктов (SEQ ID NO: 163-168), сопоставляли путем выравнивания с последовательностями, полученными из собачьих изолятов. Результаты выравнивания показали, что кошачьи изоляты O. denticanis представляют собой различные штаммы бактерий того же вида, что и бактерии, обнаруженные у собак.
Для дополнительного анализа сходства O. denticanis B106Т с родом Porphyromonas авторами настоящего изобретения была проведена ПЦР-амплификация гена fimA (с тремя повторностями) с использованием вырожденных ПЦР-праймеров D122 (SEQ ID NO: 84) и D123 (SEQ ID NO: 85) (Invitrogen Соrp.). ПЦР-продукты очищали, обессоливали, объединяли и подвергали прямому анализу последовательности ДНК. Поиск в неизбыточной базе данных полипептидов Национального центра биотехнологической информации, осуществляемый с помощью программы BLAST-Р (Altschul et al., 1990) и с использованием аминокислотной последовательности FimA, выявил, что белок FimA O.denticanis B106Т был родственным белку FimA членов рода Porphyromonas. На фиг.3 проиллюстрировано филогенетическое сходство различных последовательностей белков FimA. Существует очень близкое сходство (бутстреп-величина 100%) между белком O. denticanis B106Т и несколькими белками фимбриллина типа I Porphyromonas spp.
Бактерии O. denticanis B106Т и Porphyromonas gulae В43 подвергали сканирующей электронной микроскопии для определения морфологии клетки. Вкратце, 36-часовые жидкие культуры в модифицированной среде PYG центрифугировали при 1800 × g. Эту среду заменяли 3% глутаральдегидом ЭМ-чистоты (Polyscience, Inc., Warrington, PA) в 0,1 М фосфатном буфере (рН 7,3) и инкубировали при 4°С в течение 1 часа. Затем клетки два раза промывали в 0,1 М фосфатном буфере (рН 7,3) и суспендировали в забуференном 1% тетроксиде осмия (Polyscience, Inc., Warrington, PA) в течение 1 часа при комнатной температуре. Образцы дегидратировали в этаноле высокой чистоты, при этом конечную дегидратацию проводили путем погружения образца в гексаметилдисилазан на 15 минут с последующей сушкой воздухом в течение 1 часа. Образцы переносили на алюминиевые штифты и покрывали 200Å-слоем золота в устройстве для автоматического нанесения покрытий Polaron SEM (Polaron Instruments, Inc., Hatfield, PA). Каждый образец оценивали на сканирующем электронном микроскопе ISI, DS-130 (ISI, Inc. Tokyo, Japan). Изображения фиксировали с помощью цифрового интерфейса с наведением луча Noran 4485 (Noran Instruments., Inc., USA). На фиг.4 показаны фотографии P.gulae В43 и O. denticanis B106Т, сделанные на сканирующем электронном микроскопе. Такие морфологические признаки штамма P.gulae В43 (фиг.4А), как короткие палочки (средней длины 1,25 мкм), являются типичными для членов рода Porphyromonas. В противоположность этому, O. denticanis B106Т имеет веретенообразную форму с усеченными концами и со средней длиной клеток 5,9 мкм (фиг.4В). Морфология O. denticanis B106Т в данных условиях культивирования аналогична морфологии Tannerella forsythensis (Tanner et al., 1986). Морфологическое отличие бактерий P.gulae и O. denticanis также подтверждает то, что бактерия O. denticanis не принадлежит к роду Porphyromonas.
Условия культивирования Porphyromonas spp.
Поскольку стандартная среда для культивирования Porphyromonas sp. (бульон с сердечно-мозговым экстрактом, ВНI) и углеводная среда с мясным фаршем (СМС) содержит продукт животного происхождения, который является неподходящим для приготовления вакцины, то была разработана культуральная среда, не содержащая этих ингредиентов. Различные составы сред с добавлением и без добавления гемина и витамина К были протестированы на их способность поддерживать рост бактерий, эквивалентный росту бактерий на среде ВНI или СМС. Полная среда PYG и полная среда МЕ поддерживали рост P.gulae В43 (РТА-3618) до уровня, эквивалентного уровню роста на ВНI (фиг.5). Полная среда PYG для культивирвоания P.gulae В43 (РТА-3618) была выбрана благодаря ее способности образовывать культуры с высокой плотностью в процессе ферментации. Эта среда содержит следующие ингредиенты: 3% фитон (Becton Dickinson, Cockeysville, MD), 0,3% дрожжевой экстракт (Becton Dickinson), 0,3% глюкозу (Sigma Corp., St. Louis, MO), 0,05% тиолгиколят натрия (Becton Dickinson), 0,5% хлорид натрия (Sigma Corp.), 5 мкг/мл гемина (Sigma Corp.) (добавленного после автоклавирования), 0,5 мкг/мл менадиона (Sigma Corp.) (добавленного после автоклавирования) и 0,2% бикарбонат натрия (Sigma Corp.), рН 7,0.
Бактерию P.gulae В43 (РТА-3618) культивировали рутинным способом в планшетах с кровяным агаром Brucella (анаэробные системы) или в полной среде РYG или ВНI при 37°С в анаэробной камере Bactron IV (Shel Labs.; Cornelius, OR) в атмосфере 90% N2, 5% СО2 в течение 3-5 дней (в планшетах) или в течение 24-48 часов (в жидких культурах). Для приготовления бактеринового препарата из целых клеток бактерий P.gulae В43 (РТА-3618) культивировали в биореакторе BioFlo 3000 с использованием 5 литров полной среды PYG. Культуральную среду в сосуде делали анаэробной путем продувки 95-99,5% N2 и 0,5-5% CO2 сразу после автоклавирования. Восстановленную культуральную среду засевали маточным раствором 0,02% P.gulae В43 (РТА-3618) и культивировали при 37°С со скоростью перемешивания 100 об/мин, поддерживая рН 7,0 путем автоматического добавления NаОН. Во время культивирования сосуд периодически продували N2 и CO2. Бактериальные клетки собирали через 36-48 часов при OD600 = 2,0-3,5, когда клетки еще находились в стадии логарифмического роста.
Тест на патогенность клинических изолятов у мышей
Девять изолятов (P.gulae B43, P.cansulci B46, P. circumdentaria B52, P.gulae В69, P. circumdentaria B97, P. cangingivalis B98, P.salivosa В104, O.denticanis B106 и P.endodontalis В114) тестировали на их патогенность у мышей с моделью разрежения периодонтальной кости. В этом исследовании использовали самцов мышей Balb/с СуJ (Jackson Laboratories; Bar Harbor, ME) в возрасте трех недель и массой 14-15 граммов. Животных содержали в клетках с перегородками при положительным давлении. Во время проведения эксперимента животные получали стандартный гранулированный корм, предназначенный для животных этого вида, и воду ad libitum. Для минимизации нагрузки на десневые ткани использовали мягкий гранулированный корм Bed O'Cobbs. В соответствии с протоколом эксперимента всех животных оставляли для акклиматизации на 5-7 дней. Для снижения уровня другой микрофлоры, присутствующей в ротовой полости, животным давали смесь сульфаметоксазола и триметоприма (10 мл питьевой воды, приблизительно 2 мг и 0,4 мг/мл соответственно) в течение десяти дней с последующим 5-дневным периодом промывания. Пробы сыворотки брали из крови хвостовой вены каждой мыши. Животных через желудочный зонд инфицировали 0,5 мл суспензии, содержащей приблизительно 1×1010 КОЕ/мл соответствующего бактериального штамма в 1% карбоксиметилцеллюлозе. Затем в ротовую полость вводили дополнительные капли этой суспензии. Инфицирование повторяли еще два раза, то есть всего три раза (понедельник, среда и пятница).
Первым днем (день 1) эксперимента после первого инфицирования был выбран вторник. Всех животных умерщвляли на день 2. После инфицирования сыворотку собирали в качестве микробных образцов. Челюсти каждой мыши освобождали от мышечной ткани, окрашивали и анализировали под микроскопом на горизонтальное разрежение кости. Оценку проводили три раза для минимизации ошибки экспериментатора. Среднюю величину разрежения кости выражали как среднее разрежение кости/участок/челюсть в мм. Статистический анализ полученных данных проводили с использованием программ Systat (версия 9), SigmaStat (версия 2) и SigmaPlot (версия 2000), поставляемых SPSS Science Inc. (Chicago, IL). В таблице 6 представлены численные значения для наилучших девяти изолятов.
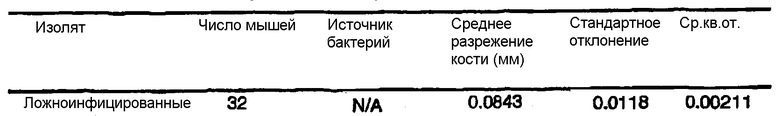
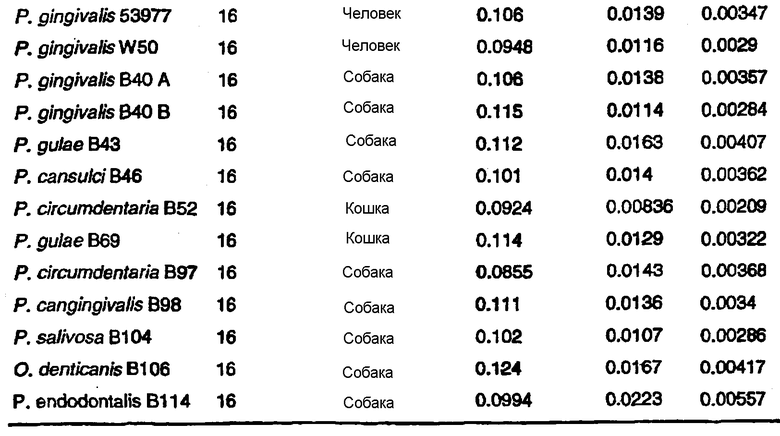
Каждая из этих моделей обнаруживала статистически значимое разрежение кости.
На фиг.6 графически проиллюстрировано суммарное разрежение кости. Средние уровни альвеолярных отростков (цементоэмалевая граница - верхушка альвеолярного отростка) определяли в мм на 14 участках верхней челюсти и вычисляли среднее значение для каждой челюсти. Для каждой экспериментальной группы средние значения для каждой челюсти суммировали и среднее для каждой группы получали путем деления на общее число животных в этой группе.
На фиг.7 графически проиллюстрировано сравнение величин суммарного разрежения кости. Средние уровни альвеолярных отростков (цементоэмалевая граница - верхушка альвеолярного отростка) определяли в мм на 14 участках верхней челюсти и вычисляли среднее значение для каждой челюсти. Для каждой экспериментальной группы средние значения для каждой челюсти суммировали и среднее для каждой группы получали путем деления на общее число животных в этой группе. Суммарное разрежение кости определяли путем вычитания средних величин для ложноинфицированной группы из средних величин для каждой экспериментальной группы. Данные представлены как процент от величины, полученной для группы позитивного контроля (P. gingivalis 53977), которая принималась за 100%. P. gingivalis W50 представляет собой штамм, имеющий низкое содержание фимбрина и пониженную вирулентность для этих животных-моделей.
Эти данные показали, что нижеследующие клинические изоляты P. gulae B43 (РТА-3618), P.gulae B69 (РТА-3621), P.cangingivalis B98 (РТА-3623) и O. denticanis B106 (РТА-3625) способны продуцировать высокие уровни разрежения кости у мышей с моделью пародонтоза. Нижеследующие клинические изоляты P.cansulci B46 (РТА-3619), P. salivosa B104 (РТА-3624) и P.endodontalis В114 (РТА-3626) вызывали умеренное разрежение кости у мышей с моделью пародонтоза. Нижеследующие клинические изоляты P.circumdentaria B52 (РТА-3620) и P.circumdentaria B97 (РТА-3622) вызывали минимальное разрежение кости у мышей с моделью пародонтоза. Хотя различные клинические изоляты давали различные уровни разрежения кости, однако следует отметить, что в каждом случае уровень наблюдаемого разрежения кости был значительно выше уровня разрежения кости, наблюдаемого у ложноинфицированных мышей. Исходя из этих данных можно сделать вывод, что каждый из наилучших девяти клинических изолятов, отдельно или в комбинации с другими бактериями, способен вызывать пародонтоз.
Получение бактериальных клеток и геномной ДНК
Бактерии различных видов подвергали анаэробному культивированию в ВНI или в полной среде PYG при 37°С в течение 48 часов. Клетки, взятые из 1-3 мл культуры, осаждали путем центрифугирования, один раз промывали в равном объеме анаэробного PBS, а затем снова центрифугировали и ресуспендировали в 1/10 объема анаэробного PBS.
Геномную ДНК выделяли из 5 мл культуры бактерий различных видов, которые были подвергнуты анаэробному культивированию в ВНI или в полной среде PYG при 37°С в течение 48 часов. Для получения всех геномных ДНК-препаратов использовали набор для экстракции геномной ДНК Wizard (Promega Corp.).
Клонирование гена фимбрий из клинических изолятов
Ген fimA подвергали ПЦР-амплификации из геномной ДНК, выделенной из десяти наилучших клинических изолятов, с использованием комбинаций нижеследующих ПЦР-праймеров: D0067 (прямого; SEQ ID NO: 6), D0078 (прямого; SEQ ID NO: 8), D0097 (прямого; SEQ ID NO: 9), D0068 (обратного; SEQ ID NO: 7) и D0098 (обратного; SEQ ID NO: 10). ПЦР осуществляли в реакционной смеси объемом 50 мкл, содержащей 1 × ПЦР-буфер (Life Technologies), 1,0 мМ MgCl2, 1,25 мкМ каждого праймера, 300 М каждого дезокси-NTP и 2,5 ед. ДНК-полимеразы Platinum Pfx (Life Technologies). Затем проводили ПЦР-циклы в следующем режиме: стадия денатурации в течение двух минут при 94°С; 30 циклов денатурации при 94°С в течение 40 секунд, отжиг при 60°С в течение 40 секунд и удлинение при 72°С в течение 1,5 минут; конечная стадия удлинения при 72°С в течение пяти минут и конечная стадия охлаждения до 4°С. Во всех реакциях ПЦР-амплификации использовали термоциклер GeneAmp 9700 (Perkin Elmer Applied Biosystems; Foster City, CA). Амплифицированные продукты визуализировали на 1,2% Е-геле (Invitrogen; Carlsbad, CA).
Полученные ПЦР-продукты обрезали по А-хвосту с использованием 10 единиц полимеразы KlenTaq (пептиды Ab, Inc.; St. Louis, MO.) в течение 5 минут при 72°С. Полученные продукты сразу клонировали по Т-хвосту в вектор рСR2.1-ТОРО (Invitrogen) в соответствии с протоколом производителя и трансформировали в Тор10F' E.coli (Novagen; Madison, WI). Трансформанты, содержащие рекомбинантные плазмиды с нужной ДНК-вставкой, идентифицировали с помощью комбинации таких методов, как ПЦР колоний, гидролиз рестриктирующими ферментами и анализ ДНК-последовательности посредством реакций дезокситерминации цепи красителем на автоматическом секвенаторе ДНК АВI (Lark Technologies Inc.). Для получения двухцепочечной последовательности ДНК использовали синтетические олигонуклеотидные праймеры (SEQ ID NO: 6, 7, 8, 11-42).
Клонирование гена fimA P.gulae В43 в экспрессионные плазмиды
Для экспрессии высоких уровней белка ген fimA P.gulae В43 (РТА-3618) клонировали в экспрессионный вектор рВAD/HisА (Invitrogen). Геномную ДНК выделяли из 5 мл культуры P.gulae В43, инкубированной в ВНI при 37°С в течение двух дней в анаэробных условиях с использованием набора для экстракции геномной ДНК (Promega Corp.). Ген fimA подвергали ПЦР-амплификации с использованием ПЦР-праймеров: D0097 и D0098 (SEQ ID NO: 9 и SEQ ID NO: 10) с тремя повторностями. ПЦР осуществляли в реакционной смеси объемом 50 мкл, содержащей 1 × ПЦР-буфер (Life Technologies), 50 нг геномной ДНК P.gulae В43, 1,0 мМ MgCl2, 1,25 мкМ каждого праймера, 300 мкМ каждого дезокси-NTP и 2,5 ед. ДНК-полимеразы Platinum Pfx (Life Technologies, USA).
Затем проводили ПЦР-циклы в следующем режиме: стадия денатурации в течение двух минут при 94°С; пять циклов денатурации при 94°С в течение 40 секунд, отжиг при 58°С в течение 40 секунд и удлинение при 72°С в течение 1,5 минут; 30 циклов денатурации при 94°С в течение 40 секунд, отжиг при 65°С в течение 40 секунд и удлинение при 72°С в течение 1,5 минут; конечная стадия удлинения при 72°С в течение пяти минут и конечная стадия охлаждения до 4°С. Во всех реакциях ПЦР-амплификации использовали термоциклер GeneAmp 9700 (Perkin Elmer Applied Biosystems). ПЦР-продукты очищали с использованием наборов для препаративной ПЦР (Promega Corp.). Очищенные ПЦР-продукты и рBAD/HisА подвергали двойному гидролизу ферментами HindIII и XhoI в течение трех часов при 37°С. В середине процесса гидролиза в гидролизуемый вектор добавляли пять единиц щелочной фосфатазы креветки (SАР) (Amersham Pharmacia Biotech Piscataway, NJ). Гидролизованную ДНК очищали с использованием набора для очистки ДНК (Promega Corp.). Очищенные HindIII/XhoI-гидролизованные ПЦР-продукты лигировали с HindIII/XhoI-гидролизованным SАР-обработанным вектором рBAD/HisА с использованием ДНК-лигазы Т4 (Life Technologies) в присутствии 1 × буфера, содержащего ДНК-лигазу Т4, при 16°С в течение 18 часов. Часть полученной лигированной смеси переносили в компетентные клетки Тор10F' E.coli (Novagen). Было обнаружено, что рекомбинантная плазмида рBAD:В43fimA4 содержала ген fimA в правильной ориентации. Полученный рекомбинантный FimA содержит концевую кодируемую вектором последовательность (MGGSHHHHHHGMASMTGGQMGRDLYDDDDKDRWGSELEICSQYHMGI, SEQ ID NO: 135), за которой следует зрелая часть FimA, начинающаяся с аспарагина-20. Эту плазмиду переносили в компетентные клетки ВL21 E.coli (Novagen) для проведения дополнительного анализа на экспрессии белка.
Экспрессия и очистка рекомбинантного белка FimA
Замороженный рабочий маточный раствор ВL21/рBAD:В43fimA4 E.coli оттаивали, высевали при разведении 1:5000 в бульон Луриа, содержащий 100 мкг/мл ампициллина (1% триптона, 0,5% дрожжевого экстракта, 0,5% NаСl), и культивировали в биореакторе BioFlo 3000 с рабочим объемом в 5 литров (New Brunswick Scientific; Edison, NJ) при 37°С со скоростью перемешивания 100 об/мин до достижения А625=2,5-3,5. Затем в культуру добавляли L-арабинозу при конечной концентрации 0,1% для индуцирования экспрессии FimA. После этого культуру инкубировали еще три часа. Экспрессию рекомбинантного FimA детектировали с помощью электрофореза в ДСН-ПААГ и Вестерн-блот-анализа с использованием сыворотки Anti-Express (Invitrogen) (фиг.8). Рекомбинантный белок FimA имел предсказанную молекулярную массу 45 кДа.
Сырые клетки-трансформанты E.coli BL21, экспрессирующие рекомбинантный FimA, собирали из 5-литрового ферментера путем центрифугирования и ресуспендировали в забуференном фосфатом физиологическом растворе. Эти клетки подвергали механическому лизису. После центрифугирования осадок отбрасывали. Супернатант пропускали через аффинную колонку с Ni2+ и элюировали в градиенте имидазола. Фракции, содержащие рекомбинантный белок, объединяли, диализовали для удаления имидазола и подвергали стерильной фильтрации через 0,2-мкм фильтр.
Клонирование гена oprF из клинических изолятов
Исходя из последовательностей гомолога oprF штамма P. gingivalis W50 были сконструированы и синтезированы ген PG32 (регистрационный номер Genbank AF175714), олигонуклеотидные праймеры D0086 (SEQ ID NO: 43) и D0087 (SEQ ID NO: 44), и KWK-Pg-03 (SEQ ID NO:45)(Life Technologies). Для проведения ПЦР использовали праймер D0086 (SEQ ID NO: 43) в комбинации либо с D0087 (SEQ ID NO: 44), либо с KWK-Pg-03 (SEQ ID NO: 45) в 1 × буфере PC2 (пептиды Ab), 200 мкМ каждого dNTP, 7,5 единиц полимеразы KlenTaq1 (пептиды Ab) и 0,15 единиц клонированных термостабильных полимераз Pfu (Stratagene; La Jolla, CA) в конечном объеме образца 50 мкл. Реакции проводили с тремя повторностями с использованием промытой клеточной суспензии или очищенной геномной ДНК, используемой в качестве матрицы и происходящей от P. gulae B43, P.cansulci B46, P. circumdentaria B52, P.gulae В69, P. circumdentaria B97, P. cangingivalis B98, P.salivosa В104, O.denticanis B106 и P.endodontalis В114. Амплификацию проводили в следующем режиме: денатурация (94°С, 9 минут); 30-40 циклов денатурации (94°С, 30 секунд), отжиг (55-60°С, 30 секунд) и полимеризация (72°С, 1,5 минут), с последующим конечным удлинением при 72°С в течение семи минут.
Для ПЦР-амплификации гомолога oprF из P.cangingivalis В98 использовали комбинацию праймеров KWK-Ps-04b (SEQ ID NO: 81) и KWK-Ps-06b (SEQ ID NO: 83). Для амплификации указанного гомолога из P.salivosa В104 использовали комбинацию праймеров KWK-Ps-04b (SEQ ID NO: 81) и KWK-Ps-05b (SEQ ID NO: 82). Для амплификации указанного гена из O. denticanis B106 использовали комбинацию праймеров KWK-Ps-02 (SEQ ID NO: 79) и KWK-Ps-03 (SEQ ID NO: 80). Реакции проводили с тремя повторностями с использованием очищенной хромосомной ДНК в качестве матрицы, выделенной из штаммов P. cangingivalis B98, P.salivosa В104 и O.denticanis B106. Амплификацию проводили в следующем режиме: денатурация (94°С, 9 минут); 30-35 циклов денатурации (94°С, 30 секунд), отжиг (61-72°С, 30 секунд) и полимеризация (72°С, 1,5 минут), с последующим конечным удлинением при 72°С в течение 7 минут.
ПЦР-амплифицированные генные продукты визуализировали путем разделения на 1,0% агарозном геле (Sigma). ПЦР-продукты очищали с использованием набора для ПЦР-очистки QIAquickТМ (Qiagen; Valancia, CA) и каждую серию образцов с тремя повторностями объединяли. Затем эти фрагменты подвергали прямому секвенированию во избежание включения в эту последовательность артефактов в результате мутаций, образующихся в процессе ПЦР-амплификации и последующих стадий клонирования. Затем объединенные смеси подвергали прямому секвенированию посредством реакций дезокси-терминации цепи красителем на автоматическом секвенаторе ДНК АВI (Lark Technologies). Для секвенирования обеих ДНК-цепей амплифицированных продуктов использовали синтетические олигонуклеотидные праймеры (SEQ ID NO: 46-75).
Нуклеотидные последовательности, кодирующие гомолог ОprF, происходящий от P. gulae B43, P.cansulci B46, P. circumdentaria B52, P.gulae В69, P. circumdentaria B97, P. cangingivalis B98, P.salivosa В104, O.denticanis B106, P. cangingivalis B98, P.salivosa В104, O.denticanis B106 и P.endodontalis В114, представлены в SEQ ID NO: 111-119. Последовательность, соответствующую 5'- и 3'-праймерам, используемым для ПЦР-амплификации каждого гена, удаляли, поскольку она фактически не может быть последовательностью гена в каждом соответствующем штамме. ОРС, кодируемые SEQ ID NO: 111-119, представлены в SEQ ID NO: 120-128 соответственно. Амино-концевая последовательность каждой кодируемой ОРС, даже если была исключена последовательность, кодируемая 5'-праймером, все еще сохраняла свойства прокариотической сигнальной последовательности (von Heijne, 1985, J. Mol. Biol. 184:99-105; Nielsen, H., Engelbrecht, J., Brunak S. and von Heijne, G. 1997 Protein Engineering 10:1-6). Каждую ОРС сравнивали с ОРС нуклеотидных последовательностей и последовательностей белков, имеющихся в базах данных с помощью компьютерных программ Basis Local Align Search Tool (BLAST) (Altschul S.F., Gish, W. Miller, W., Myers, E.W., Lipman, D.J., 1990, J. Mol. Biol. 215:403-410). Вводимой последовательностью, с которой каждая из последовательностей вышеуказанных бактерий имела наибольшую гомологию, была последовательность PG32 P. gingivalis.
Клонирование гена oprF P.gulae В43 в экспрессионные плазмиды
Для экспрессии рекомбинантного белка ген, кодирующий ОprF, клонировали вместе с последовательностью, кодирующей его сигнальный пептид. OprF амплифицировали из P.gulae В43 с использованием олигонуклеотидных праймеров KWK-Pg-06 (SEQ ID NO: 76) и KWK-Pg-03 (SEQ ID NO: 45). Для ПЦР-амплификации были взяты 50 мкл реакционной смеси в дубликатах, содержащей хромосомную ДНК в качестве матрицы, 1 × буфер PC2, 200 мкМ каждого dNTP, 50 пмоль каждого праймера, 7,5 единиц полимеразы KlenTaq1 и 0,15 единиц клонированных термостабильных полимераз Pfu. Амплификацию проводили в следующем режиме: денатурация (94°С, 9 минут); 30 циклов денатурации (94°С, 30 секунд), отжиг (60°С, 30 секунд) и полимеризация (72°С, 1,5 минут) с последующим конечным удлинением при 72°С в течение 7 минут. После амплификации образцы очищали (с использованием набора для ПЦР-очистки QIAquickТМ) и объединяли. Очищенный ПЦР-продукт непосредственно клонировали в ТА-клонирующий сайт рBAD-ТОРО и рBAD/Thio-ТОРО (Invitrogen). Лигандные продукты переносили в клетки DH5α E.coli Max Efficiency. Предсказанная амино-концевая последовательность кодируемого белка, экспрессированного из pBAD-TOPO:OprF, состоит из кодируемой вектором последовательности MGSGSGDDDDKLALM (SEQ ID NO: 136), непосредственно за которой расположена последовательность OprF, начинающаяся с глутамина-13 (SEQ ID NO: 120). Клон, содержащий соответствующую плазмиду, идентифицировали и очищенную плазмиду выделяли из лабораторной бульонной культуры с использованием набора для культивирования центрифужных минипрепаратов QIAprep (Qiagen). Эту плазмиду переносили в клетки BL21 E.coli (Novagen) и идентифицировали клон, содержащий соответствующую плазмиду.
Предсказанная амино-концевая последовательность кодируемого гибридного белка, экспрессированного из рBAD/Thio-ТОРО:оprF, должна состоять из белка тиоредоксина и линкера из 14 аминокислотных остатков, за которыми непосредственно следует последовательность OprF, начинающаяся с глутамина-13 (SEQ ID NO: 120). Клон, содержащий соответствующую плазмиду, идентифицировали и очищенную плазмиду выделяли из лабораторной бульонной культуры с использованием набора для культивирования центрифужных минипрепаратов QIAprep. Эту плазмиду переносили в клетки BL21 E.coli и идентифицировали клон, содержащий соответствующую плазмиду.
Ген oprF, не содержащий последовательности, кодирующей сигнальный пептид, также клонировали в две различные экспрессионные плазмиды λ. Обе эти плазмиды кодировали термочувствительный репрессор λ cI857, который ингибирует экспрессию с промоторов λ при 30°С. При 42°С этот репрессор инактивируется, что позволяет осуществлять экспрессию с промотора λ с высокими уровнями транскрипции и трансляции. Для клонирования в эти векторы oprF амплифицировали из P.gulae В43 с использованием олигонуклеотидных праймеров KWK-Pgu-14 (SEQ ID NO: 77) KWK-Pgu-15 (SEQ ID NO: 78). Для ПЦР-амплификации были взяты 50 мкл реакционной смеси в дубликатах, содержащей промытые клетки P.gulae В43 в качестве матрицы, 1 × буфер PC2, 200 мкМ каждого dNTP, 50 пмоль каждого праймера, 7,5 единиц полимеразы KlenTaq1 и 0,15 единиц клонированных термостабильных полимераз Pfu. Амплификацию проводили в следующем режиме: денатурация (94°С, 9 минут); 45 циклов денатурации (94°С, 30 секунд), отжиг (55°С, 30 секунд) и полимеризация (72°С, 1,5 минут), с последующим конечным удлинением при 72°С в течение 7 минут. После амплификации образцы объединяли и гидролизовали рестриктирующими ферментами с образованием выступающих концов, совместимых с плазмидами, которые были также линеаризованы с использованием тех же самых ферментов. После гидролиза рестриктирующими ферментами ПЦР-фрагмент и плазмиды очищали (с использованием набора для ПЦР-очистки QIAquickТМ; Qiagen Corp.), лигировали и переносили в клетки DH5α E.coli (Novagen). Предсказанная амино-концевая последовательность состояла из кодируемой вектором последовательности MGTTTTTTSLHM (SEQ ID NO: 137), непосредственно за которой расположена последовательность OprF, начинающаяся с глутамина-13 (SEQ ID NO: 120). Белок, экспрессируемый из второй плазмиды, должен состоять только из Met, кодируемого вектором, за которым расположен глутамин-13 последовательности ОprF (SEQ ID NO: 120). Клоны, содержащие соответствующую плазмиду, идентифицировали и полученные плазмиды выделяли из лабораторной бульонной культуры с использованием набора для культивирования центрифужных минипрепаратов QIAprep (Qiagen, Corp.). Эти плазмиды переносили в клетки BL21 E.coli и отдельные клоны, содержащие соответствующие плазмиды, идентифицировали.
Экспрессия и очистка рекомбинантного белка ОprF
Для исследований экспрессии использовали клетки BL21 E.coli, которые экспрессировали рекомбинантный ОprF (присоединенный своим N-концом к последовательности SEQ ID NO: 137). Замороженный маточный раствор оттаивали, высевали при разведении 1:5000 в среду 2 × YТ, содержащую 50 мкг/мл сульфата канамицина (1,6% триптона, 1% дрожжевого экстракта, 0,5% NаСl), и культивировали в биореакторе BioFlo 3000 с рабочим объемом в 5 литров (New Brunswick Scientific; Edison, NJ) при 29°С со скоростью перемешивания 100 об/мин до достижения А625=2,5-3,5. Затем культуру доводили до 42°С для индуцирования экспрессии ОprF. После этого культуру инкубировали еще 3 часа. Через различные интервалы времени брали аликвоты, затем центрифугировали и ресуспендировали в восстанавливающем буфере для образцов. Все образцы анализировали на 10% Nu-ПААР-геле (Invitrogen, USA) (фиг.9).
Сырые клетки-трасформанты BL21 E.coli, экспрессирующие рекомбинантный ОprF, собирали из 5-литрового ферментера путем центрифугирования и ресуспендировали в забуференном фосфатом физиологическом растворе. Эти клетки подвергали механическому лизису. После центрифугирования осадок отбрасывали. Супернатант пропускали через ионообменную колонку и элюировали в градиенте NаСl. Фракции, содержащие рекомбинантный белок, объединяли, диализовали для удаления NаСl и подвергали стерильной фильтрации через фильтр размером 0,2 мкм.
Получение бактерина из целых клеток
5-литровую партию P.gulae В43 культивировали в ферментере, как описано выше, и разделяли на 1-литровые порции. Клетки в каждой 1-литровой фракции (всего 4,4×1012 клеток P.gulae В43) инактивировали следующим образом: сначала обрабатывали 0,4% формалином в течение 24 часов при 23°С, а затем 10 мМ бинарным этиленимином (ВЕI) при рН 8,5 в течение 48 часов при 37°С, и нагревали до 60°С в течение 30 минут, затем выдерживали в течение 2 дней, после чего оставляли на воздухе на 48 часов. После ВЕI-обработки ВЕI инактивировали путем обработки 50 мМ тиосульфатом натрия. Клетки собирали центрифугированием. Полученный клеточный осадок ресуспендировали в 220 мл PBS с получением конечной концентрации 2×1010 клеток/мл. 7 мл инактивированных клеток каждого вида смешивали с 7 мл адъюванта МPL + TDM (Sigma Corp.) до достижения концентрации 1,0 × 1010 клеток/мл.
Бактериновые препараты целых клеток от других восьми наилучших клинических изолятов (P.cansulci B46, P. circumdentaria B52, P.gulae В69, P. circumdentaria B97, P. cangingivalis B98, P.salivosa В104, O.denticanis B106 и P.endodontalis В114) или других пигментированных анаэробных бактерий могут быть получены аналогичным образом.
Эффективность гомологичных вакцин у мышей
Для исследований эффективности гомологичных вакцин каждую мышь иммунизировали двумя инъекциями по 0,2 мл каждая вышеупомянутых инактивированных клеток P.gulae В43 в адъюванте МPL + TDM с интервалом в три недели. Мышей инфицировали P.gulae В43, как описано выше, через две недели после повторной иммунизации. Через 42 дня после инфицирования мышей умерщвляли и обрабатывали, как описано ранее. В таблице 7 представлены численные результаты определения уровней разрежения кости.
(а) Процент, вычисленный исходя из группы В, служащей группой позитивного контроля
(b) Процент, вычисленный исходя из группы С, служащей группой позитивного контроля
(с) NА = не использовали
Эти результаты графически представлены на фиг.10, 11 и 12. На фиг.11 представлены проценты разрежения кости для контрольного эксперимента. Вакцины, содержащие инактивированный формалином P. gingivalis 53977 и либо полный/неполный адъювант Фрейнда, либо адъюванты MPL + TDM, способствовали снижению степени разрежения кости, индуцированного инфекцией P. gingivalis 53977, примерно на 32% и 43% соответственно. На фиг.12 представлены проценты разрежения кости для тест-эксперимента. Вакцины, содержащие инактивированный формалином, термоинактивированный или инактивированный аэрацией P.gulae В43 и адъювант MPL + TDM, способствовали снижению степени разрежения кости, индуцированного инфекцией P.gulae В43, примерно на 45%, 35% и 75% соответственно. Исходя из этих данных можно сделать вывод, что вакцины, полученные на основе инактивированной формалином, инактивированной аэрацией и термоинактивированной P.gulae В43 способны эффективно снижать степень разрежения кости, индуцированного в этой модели суперинфицирования. При экстраполяции этих данных на клинические параметры можно предположить, что эти три вакцины должны быть также эффективными для профилактического предупреждения пародонтоза и могут оказаться в высокой степени эффективными для терапевтического лечения пародонтоза.
Исследования эффективности гетерологической вакцины у мышей
В исследованиях на эффективность гетерологичной вакцины мышей иммунизировали двумя инъекциями, по 0,2 мл каждая, инактивированных формалином клеток P.gulae В43, либо инактивированных формалином клеток P.salivosa В104 и O.denticanis B106 в адъюванте МPL + TDM с интервалом в три недели. Мышей инфицировали P.gulae В43, P.gulae В69, P.salivosa В104 и O.denticanis B106, как описано выше, через две недели после повторной иммунизации. Через 42 дня после инфицирования мышей умерщвляли и обрабатывали, как описано выше. В таблице 8 представлены численные результаты определения уровней разрежения кости.
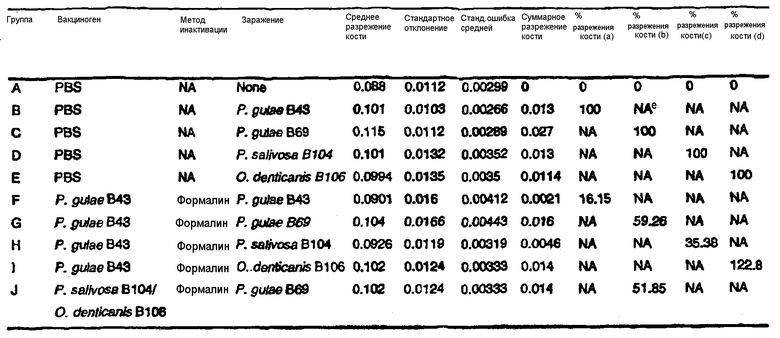
(а) Процент разрежения кости, вычисленный для мышей, инфицированных P.gulae В43.
(b) Процент разрежения кости, вычисленный для мышей, инфицированных P.gulae В69.
(с) Процент разрежения кости, вычисленный для мышей, инфицированных P.salivosa В104.
(d) Процент разрежения кости, вычисленный для мышей, инфицированных O.denticanis B106.
(е) NА = не использовали
Эти результаты графически представлены на фиг.13, 14, 15, 16 и 17. На фиг.9 представлены величины суммарного разрежения кости для этих экспериментов. На фиг.14 представлен процент разрежения кости для групп, инфицированных P.gulae В43. Вакцина, содержащая инактивированный формалином штамм P.gulae В43 и адъювант MPL + TDM, снижала степень разрежения кости, индуцированного инфекцией P.gulae В43, примерно на 84%. На фиг.15 представлены проценты разрежения кости для групп, инфицированных P.gulae В69. Вакцины, содержащие инактивированный формалином P.gulae В43 и инактивированный формалином P. salivosa B104/O. denticanis B106 и адъювант MPL + TDM, способствовали снижению разрежения кости, индуцированного инфекцией P.gulae В69, примерно на 40% и 49% соответственно. На фиг.16 представлены проценты разрежения кости для групп, инфицированных P. salivosa B104. Вакцины, содержащие инактивированный формалином P.gulae В43 и адъювант MPL + TDM, способствовали снижению разрежения кости, индуцированного инфекцией P. salivosa B104, примерно на 65%. На фиг.17 представлен процент разрежения кости для групп, инфицированных O. denticanis B106. Вакцины, содержащие инактивированный формалином P.gulae В43 и адъювант MPL + TDM, не обеспечивали перекрестную защиту против O. denticanis B106. Исходя из этих данных можно сделать вывод, что вакцина, содержащая формалинактивированную P.gulae В43 и адъювант MPL + TDM, обладала способностью обеспечивать защиту не только от заражения гомологичным микроорганизмом, но также от заражения гетерологичным микроорганизмом P.gulae В69. Кроме того, поскольку вакцина, содержащая P.gulae В43, обеспечивала защиту от заражения микроорганизмом P. salivosa B104, то очевидно, что в данном случае обеспечивалась защита от бактерий двух видов Porphyromonas spp. При экстраполяции этих данных на клинические параметры можно предположить, что эти поливалентные вакцины должны быть также эффективными для профилактического предупреждения пародонтоза и могут оказаться в высокой степени эффективными для терапевтического лечения пародонтоза.
Серологические исследования на мышах, иммунизованных
рекомбинантным FimA и ОprF
В серологических исследованиях субъединичной вакцины мышей иммунизовали двумя инъекциями, по 0,2 мл каждая, рекомбинантно экспрессированного очищенного FimA P.gulae В43 или рекомбинантно экспрессированного очищенного ОprF P.gulae В43 в адъюванте QuilA/холестерин с интервалом в три недели. У мышей брали кровь перед первой вакцинацией и через две недели после повторной иммунизации. В таблице 9 представлены численные результаты, а на фиг.18 и 19 приводятся графические результаты.
Пример 2
Периопатогенность у собак с модельным заражением
В этом исследовании использовали десять собак породы коротконогая гончая, имеющих зубной ряд взрослых животных. Этих животных анестезировали и обеспечивали доступ к корневому каналу нижнечелюстных премоляров и к первому моляру с помощью грушевидного бора (Mildwest Dental Products Corp; Des Plaines, IL) в стоматологической установке Schein Ultima 2000, снабженной наконечником для высокоскоростной бормашины (Henry Schein Inc.; Melville, NY). Доступ к корневому каналу подтверждали путем введения ветеринарного пульпоэкстрактора (21 мм, размер #5; Roydent Dental Products; Johnson City, TN) в канал на глубину, которая примерно соответствует глубине корневого канала. Соединительную ткань, сосуды и нервную ткань удаляли путем повторного пропускания в канал пульпоэкстрактора. Кровотечение было незначительным, гемостаз достигался путем введения в канал стерильных бумажных штифтов (Henry Schein Inc.). На этом этапе важно не допустить какого-либо случайного загрязнения канала в процессе сверления и очищения канала. Поэтому канал промывали 10% раствором хлорной извести. Для создания соответствующей поверхности для наложения пломбы эмаль, окружающую входное отверстие, отслаивали с использованием геля, содержащего 40% серную кислоту (Scotchbond Etching Gel, 3M; St. Paul, MN). Для предупреждения какого-либо воздействия остаточного раствора хлорной извести или кислотного геля на жизнеспособность инфекционного материала корневой канал промывали изнутри с помощью эндодонтальной иглы (калибр 27, Dentsply Pharmaceutical; York, PA) и обильным количеством стерильного физиологического раствора. Доступные поверхности и канал осушали стерильными бумажными штифтами.
Инфекционный материал получали путем культивирования штамма P.gulae В69 на кровяном агаре Brucella (Anaerobe Systems; Morgan Hill, CA) и инкубирования при 37°С в анаэробных условиях (5% H2, 5% СО2, 90% N2). Клетки собирали и ресуспендировали в стерильной среде SSYG. Затем в обработанную полость корневого канала выбранного зуба с помощью эндодонтальной иглы вводили инфекционный материал в дозе приблизительно 7,5×108 колониеобразующих единиц (КОЕ). Пяти животным вводили инфекционный материал (Т01), а других пяти животных подвергали ложному заражению стерильной средой SSYG (Т02). Затем входное отверстие пломбировали материалом, содержащим комбинацию из стеклянного иономера и зубного композита, отвержденного облучением светом (Вращение 3; 3М).
Периопатогенность инфекционных микроорганизмов определяли исходя из изменений плотности периодонтальной кости, окружающей зуб. Эту оценку проводили на 0-й, 3-й, 6-й, 9-й и 12-й неделе исследования путем измерения интенсивности пикселей на цифровых рентгенограммах с использованием сенсоров для компьютерной стоматологической рентгенографии (Schick Computed Dental Radiography) (CDR®) и компьютерных программ. Для каждого животного получали рентгенограммы шестого-восьмого зубов. Для измерения фоновых величин получали также рентгенограммы непосредственно перед проведением процедур. После заражения рентгенограммы получали через каждые три недели в течение 12 недель после заражения. Рентгенограммы анализировали двумя различными методами. Первый метод заключается в субъективной оценке рентгенограмм ветеринаром-специалистом по проведению анализов стоматологических рентгенограмм. Вкратце, этот метод заключается в оценке рентгенограмм ветеринаром-специалистом, выявлении патологий и анализа степени этих патологий у каждой собаки визуальным методом Visual Analog Scale. Затем площади пораженных костей, наблюдаемые в рентгенограммах, полученных через 0, 6 и 12 недель после заражения, измеряли с помощью инструментального средства для измерения таких площадей, имеющегося в компьютерной программе для исследования рентгенограмм. Этот метод также заключается в определении приблизительного диаметра области видимых поражений на рентгенограммах с использованием программы для измерения в стационарном режиме, имеющейся в пакете компьютерных программ Schick CDR. Исходя из полученного расстояния определяли приблизительную площадь поражения. Эти площади вычисляли для каждой собаки и представляли в виде таблицы.
Анализы рентгенограмм обоими методами дают основание предположить, что у группы Т01 наблюдалась большая степень разрежения периодонтальной кости, чем у группы Т02 (фиг.20). Исходя из этих исследований можно сделать вывод, что была разработана подходящая модель заражения. Однако поскольку проведение в двухмерном измерении (на рентгенограммах) количественной оценки изменений, которые происходят в трехмерном пространстве (в периодонтальной кости), является трудной задачей, то необходимо разработать более усовершенствованные методы количественной оценки.
Пример 3
Оценка эффективности трехвалентной вакцины
в модели заражения собак
В соответствии с разработанной моделью проводили исследования на собаках для оценки эффективности трехвалентного вакцинного препарата. Трехвалентный бактерин содержал штаммы P.gulae (В43), P. salivosa (B104) и O. denticanis (B106), инактивированные формалином, и адъювант, содержащий 50 мкг Quil A и 50 мкг холестерина на дозу. Каждый штамм бактерина был приготовлен при концентрации приблизительно 1×1010 КОЕ/дозы вакцины. В этом исследовании использовали три группы из восьми животных с зубным рядом взрослого животного. Собак в первой группе (Т01) внутримышечно вакцинировали (i.m., в.м.) 1 мл трехвалентной вакцины. Вторую (Т02) и третью (Т03) группы подвергали ложному вакцинированию 1 мл стерильного физиологического раствора. Всем собакам делали три внутримышечных (в.м.) инъекции с интервалами в три недели. Через три недели после последнего введения животных анестезировали, как описано выше, и после удаления корневого вещества в корневой канал нижнечелюстных премоляров и первого моляра вводили инфекционный материал. Собак в группах Т01 и Т02 заражали 1×1010 КОЕ гетерологичного штамма P.gulae (В69), полученного, как описано в примере 1. Для оценки эффектов проведения такой процедуры собакам в группе Т03 вводили стерильную среду.
Рентгенограммы регистрировали через три, шесть, девять и двенадцать недель после заражения на стоматологическом рентгеновском аппарате Heliodont с использованием системы сбора данных Schick® CDR (компьютизированной цифровой рентгенографии) и стандартной техники. Для этого исследования после получения цифровых рентгенограмм последующие снимки для каждой собаки сначала просматривали путем их наложения друг на друга с помощью устройства ImageJ (v1.28, NIH; Bethesda, MD) со встроенным TurboReg® методом масштабного вращения. Затем серию зарегистрированных изображений калибровали с использованием растянутой серой шкалы с полиномиальной функцией 3-й степени. После этого вычерчивали площадь кости, окружающей обработанный зуб, за исключением самого зуба и воздуха, и для каждого изображения регистрировали среднюю плотность этой поверхности. Таким образом, показатель, представляющий “белизну” кости, окружающей корни зуба, является объективным параметром. Этот параметр называется “оценкой реактивности кости” и является показателем средней плотности кости.
Результаты этого исследования представлены на фиг.21. Средние оценки, полученные для животных в группе Т02, снижались или приобретали более высокий показатель “белизны” через 12 недель после заражения, а затем они возвращались на уровни до заражения. Средние оценки реактивности кости для групп Т01 и Т03 сначала также снижались, а затем они изменялись и через 12 недель после заражения восстанавливались почти до нормальных значений. Оценки для группы экспериментального контроля Т03 давали более высокие показатели “белизны”, тогда как вакцинированные животные в группе Т01 сохраняли среднее значение, аналогичное уровням, наблюдаемым до заражения. Таким образом, у собак, которым вводили вакцину, наблюдалось более быстрое восстановление плотности кости, чем у невакцинированных собак перед эндодонтальным заражением. Кроме того, анализ сыворотки, собранной на каждой стадии наблюдения, показал, что у животных, которым вводили вакцину, обнаруживались высокие титры антител против вакцинных штаммов и наблюдалось повышенная перекрестная реактивность антител против инфекционного штамма (данные не приводятся).
После заражения рентгенограммы давали более высокие показатели “белизны”, в отличие от более “темных” значений, которые более часто наблюдались в случае инфицирования кости. Кость реагировала на воспаление и инфекцию двояким образом, а именно потерей костного матрикса и увеличением плотности окружающей кости для “установления барьера” на пути распространения инфекции. Смешанные литическо-склеротические поражения были типичными для тех животных, у которых наблюдалось несколько костных инфекций, и эти поражения зависели от 1) вирулентности патогена, 2) возраста животного, 3) генетического статуса животного и 4) количества травм, ассоциированных с инициацией воспаления. Животные, используемые в данном исследовании, были молодыми (в возрасте 10-14 месяцев) и имели значительные повреждения зубов и окружающей их кости, индуцированные процедурой заражения. Эти факторы наряду с известными фактами о механизме реакции кости на инфицирование и воспаление могут служить объяснением причины увеличения плотности окружающей кости.
Пример 4
Эффективность вакцины в модели заражения собак
Это исследование эффективности вакцины было аналогично эксперименту, описанному в примере 3. Каждая группа обоаботки содержала десять животных. Собаки в группе Т01 были вакцинированы и подвергнуты заражению; собаки в группе Т02 были подвергнуты ложной вакцинации до заражения, а собаки группы Т03 были подвергнуты ложной вакцинации и ложному заражению. Каждая вакцина содержала инактивированный формалином штамм P.gulae В43, штамм P. salivosa B104 и штамм O. denticanis B106 в концентрации 1×107 КОЕ каждого штамма на дозу. Схема вакцинации была идентична схеме, описанной в примере 3. Инфекционным инокулятом служил штамм P.gulae В69, который вводили через 3 недели после третьей вакцинации. В этом эксперименте снова получали рентгенограммы через интервалы в 3 недели за исключением того, что эти рентгенограммы получали только в течение девяти недель после заражения, после чего их анализировали способом, аналогичным описанному в примере 2. На фиг.22 представлены результаты анализа на реактивность кости.
В данном исследовании животные реагировали на заражение увеличением средней оценки реактивности кости. Это означает, что рентгенограммы становились более “темными”, что соответствовало уменьшению плотности кости (фиг.23). Хотя рентгенограммы указывали на значительные поражения у собак групп Т01 и Т02, однако кость у невакцинированных животных в целом была гораздо менее плотной, чем кость у вакцинированных животных. Через девять недель средняя оценка реактивности кости у невакцинированных собак группы Т02 значимо отличалась от оценки реактивности у собак вакцинированной группы Т01 (р=0,05). В этом исследовании в отличие от собак, описанных в примере 2, участвовали только старые собаки, а специалист, проводивший исследования, имел гораздо более высокую квалификацию. Это дает основание предположить, что указанные факторы имеют важное значение для оценки реакций, которые являются наиболее типичными реакциями, ассоциированными с инфекциями кости, то есть реакциями, приводящими к уменьшению плотности кости. Таким образом, эндодонтальная модель пародонтоза у собак является новой и может быть использована как инструмент для исследования периодонтита. Эта модель может быть использована не только в исследованиях по вакцинации/заражению с оценкой эффективности вакцины, но также и в исследованиях по антимикробной и местной терапии.
Пример 5
Оценка системной и локальной реактивности на действие вакцины
Была проведена оценка системных и локальных реакций ткани на трехвалентную вакцину, используемую в комбинации с другими вакцинами, вводимыми собакам. Две группы по 5 собак, которые в начале исследования имели возраст приблизительно 6 недель, были вакцинированы в/м в возрасте 6, 9 и 12 недель. Перед каждой вакцинацией брали пробы крови. Через 1 неделю после каждой вакцинации всех собак ежедневно осматривали для оценки системной и локальной реакции. В эти дни также измеряли и регистрировали температуру тела. Собак группы Т01 вакцинировали комбинацией трехвалентного бактерина (полученного, как описано в примерах 3 и 4) при концентрации 3×108 КОЕ всего антигена и адъюванта, содержащего 50 мкг Quil A и 50 мкг холестерина на дозу, и следующими модифицированными живыми и убитыми вирусными компонентами: вирусом чумы собак (CDV), собачьим аденовирусом-2 (CAV-2), собачьим парвовирусом (CPV), вирусом собачьего парагриппа (CPI) и собачьим коронавирусом (CCV). Собакам группы Т02 вводили трехвалентный бактерин при концентрации 3×106 КОЕ и ту же комбинацию вирусных компонентов. Результаты, представленные на фиг.24, показали, что трехвалентная вакцина, при ее добавлении к комбинации вирусных компонентов, обычно вводимых щенкам, не вызывала негативных системных или местных реакций у собак тест-групп.
В описании настоящей заявки авторами цитируются различные патенты и научные публикации, включая патенты США, с указанием фамилии автора, года выдачи и номера патента. Для более полного описания предшествующего уровня техники, к которому относится изобретение, эти публикации и патенты во всей своей полноте вводятся в настоящую заявку посредством ссылки.







































































| название | год | авторы | номер документа |
|---|---|---|---|
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2006 |
|
RU2520081C2 |
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2711807C2 |
| PCV2B ДИВЕРГЕНТНАЯ ВАКЦИННАЯ КОМПОЗИЦИЯ И СПОСОБЫ ЕЁ ПРИМЕНЕНИЯ | 2014 |
|
RU2662685C2 |
| РЕКОМБИНАНТНЫЕ АТТЕНУИРОВАННЫЕ МИКРООРГАНИЗМЫ CLOSTRIDIUM И ВАКЦИНА | 2007 |
|
RU2445364C2 |
| ПО СУЩЕСТВУ НЕТОКСИЧНЫЙ МУТЕИН АЛЬФА-ТОКСИНА Clostridium perfringens И КОДИРУЮЩАЯ ЕГО МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ | 2007 |
|
RU2593945C2 |
| ХИМЕРНЫЕ ГЕНЫ OSPA, БЕЛКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2583289C2 |
| ПРОБИОТИЧЕСКИЙ ШТАММ Bifidobacterium longum, ПРОБИОТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЯ ШТАММА Bifidobacterium longum | 2008 |
|
RU2466185C2 |
| КОМБИНИРОВАННАЯ ВАКЦИНА PCV/MYCOPLASMA HYOPNEUMONIAE/PRRS (PCV/MYCOPLASMA HYOPNEUMONIAE/PRRS COMBINATION VACCINE) | 2013 |
|
RU2644256C2 |
| КЛОСТРИДИАЛЬНЫЙ ТОКСИН NetB | 2008 |
|
RU2474587C2 |
| ВАКЦИНА MYCOPLASMA HYOPNEUMONIAE | 2013 |
|
RU2644254C2 |
Изобретение относится к области микробиологии и ветеринарии. Вакцина включает препараты инактивированных целых клеток P.gulae B43, Р.salivosa В 104 и О.denticanis В 106 и фармацевтически приемлемый носитель. Вакцина является эффективной против пародонтозов у животного. Также раскрыты способ лечения или предупреждения парадонтоза у животных-компаньонов с помощью такой вакцины и набор ее содержащий. 5 н. и 10 з.п. ф-лы, 24 ил., 9 табл.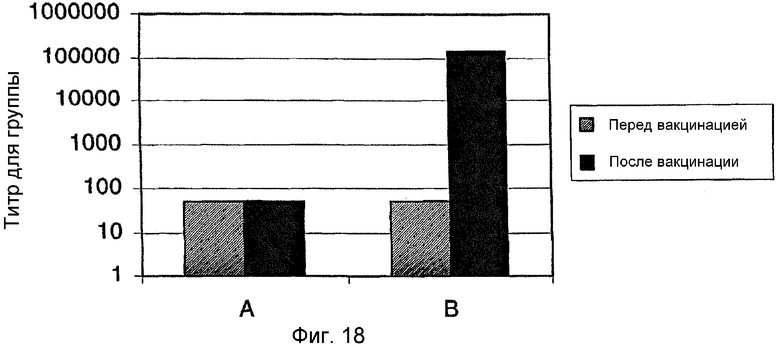
1. Вакцина для лечения или предупреждения пародонтоза у животных-компаньонов, включающая препараты инактивированных целых клеток P.gulae B43, P.salivosa В 104 и O.denticanis В 106 и фармацевтически приемлемый носитель.
2. Вакцина по п.1, где указанные бактерии инактивированы формалином.
3. Вакцина по п.1, дополнительно содержащая, по меньшей мере, один из следующих компонентов: вирус чумы собак (CDV), собачий аденовирус-2 (CAV-2), собачий парвовирус (CPV), вирус собачьего парагриппа (CPI) и собачий коронавирус (CCV).
4. Способ лечения или предупреждения пародонтоза у животных-компаньонов, включающий введение животному-компаньону, нуждающемуся в этом, вакцины по любому из пп.1-3 в эффективном количестве.
5. Способ по п.4, отличающийся тем, что доза вакцины, вводимая животному-компаньону, составляет 1·10
10
КОЕ из расчета на каждый штамм бактерина.
6. Способ по п.4, отличающийся тем, что доза вакцины, вводимая животному-компаньону, составляет 1·10
7
КОЕ из расчета на каждый штамм бактерина.
7. Набор, включающий, по меньшей мере, в одном контейнере, композицию для лечения и предупреждения пародонтоза у животных-компаньонов, содержащую фармацевтически приемлемый носитель и препараты инактивированных целых клеток P.gulae B43, Р.salivosa В 104 и O.denticanis В 106, где указанный набор дополнительно содержит отпечатанные инструкции по применению данного набора для лечения или предупреждения пародонтоза у животных-компаньонов.
8. Вакцина для лечения или предупреждения пародонтоза у животных-компаньонов, включающая иммунологически эффективное количество, по меньшей мере, трех инактивированных пигментированных анаэробных бактерий и фармацевтически приемлемый носитель, где указанная пигментированная анаэробная бактерия способна колонизировать ротовую полость животного-компаньона и вызывать непосредственно или в комбинации с другими патогенами пародонтоз у животных-компаньонов, и где одна бактерия имеет часть своей ДНК 16S рРНК, которая, по меньшей мере, примерно на 95% идентична полноразмерной последовательности SEQ ID NO: 86, одна бактерия имеет часть своей ДНК 16S рРНК, которая, по меньшей мере, примерно на 95% идентична полноразмерной последовательности SEQ ID NO: 92, и одна бактерия имеет часть своей ДНК 16S рРНК, которая, по меньшей мере, примерно на 95% идентична полноразмерной последовательности SEQ ID NO: 93.
9. Вакцина по п.8 для лечения или предупреждения пародонтоза у животных-компаньонов, включающая иммунологически эффективное количество, по меньшей мере, трех инактивированных пигментированных анаэробных бактерий и фармацевтически приемлемый носитель, где указанная пигментированная анаэробная бактерия способна колонизировать ротовую полость животного-компаньона и вызывать непосредственно или в комбинации с другими патогенами пародонтоз у животных-компаньонов, и где одна бактерия представляет собой P.gulae, одна бактерия представляет собой Р.salivosa, и одна бактерия представляет собой О.denticanis.
10. Вакцина по п.8 для лечения или предупреждения пародонтоза у животных-компаньонов, включающая иммунологически эффективное количество, по меньшей мере, трех инактивированных пигментированных анаэробных бактерий и фармацевтически приемлемый носитель, где указанная пигментированная анаэробная бактерия способна колонизировать ротовую полость животного-компаньона и вызывать непосредственно или в комбинации с другими патогенами пародонтоз у животных-компаньонов, и где одна бактерия имеет часть своей ДНК 16S рРНК такую же, как полноразмерная последовательность SEQ ID NO: 86 из P.gulae B43, одна бактерия имеет часть своей ДНК 16S рРНК такую же, как полноразмерная последовательность SEQ ID NO: 92 из P.salivosa В 104, и одна бактерия имеет часть своей ДНК 16S рРНК такую же, как полноразмерная последовательность SEQ ID NO: 93 из О.denticanis В 106.
11. Вакцина по любому из пп.8-10, где животное-компаньон представляет собой собаку или кошку.
12. Вакцина по любому из пп.8-10, где бактерия инактивирована формалином.
13. Вакцина по любому из пп.8-10, дополнительно содержащая, по меньшей мере, один из следующих компонентов: вирус чумы собак (CDV), собачий аденовирус-2 (CAV-2), собачий парвовирус (CPV), вирус собачьего парагриппа (CPI) и собачий коронавирус (CCV).
14. Вакцина по любому из пп.8-13, дополнительно содержащая адъювант.
15. Способ лечения или предупреждения пародонтоза у животных-компаньонов, включающий введение животному-компаньону, нуждающемуся в этом, вакцины по любому из пп.8-14 в эффективном количестве.
| WO 03054755, 03.07.2003 | |||
| FOURNIER D | |||
| et al | |||
| "Porphyromonas gulae sp.nov., an anaerobic, gram-negative coccobacillus from the gingival sulcus of various animal hosts", Int J Syst Evol Microbiol | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| NORRIS J.M | |||
| et al | |||
| "Serum antibody responses of cats to soluble whole cell antigens and isolated fimbriae of feline | |||
Авторы
Даты
2009-08-20—Публикация
2005-03-21—Подача