Область техники, к которой относится изобретение
Настоящее изобретение относится к новым алкилзамещенным индолхиноксалинам общей формулы (I)
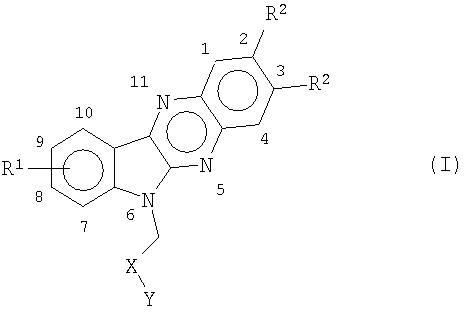
где R1 представляет собой водород или представляет собой один или большее количество одинаковых или различных заместителей в положениях с 7 по 10, выбранных из группы галогена, например хлора, фтора, брома, низшего алкила/алкокси, гидрокси, трифторметила, трихлорметила, трифторметокси,
R2 представляет собой одинаковые или различные C1-C4 алкильные заместители,
Х представляет собой СО или СН2,
Y представляет собой ОН, NH2, NH-(CH2)n-R3, где R3 представляет собой низший алкил, ОН, NH2, NHR4 или NR5R6, где R4, R5 и R6 независимо представляют собой низший алкил или циклоалкил и n представляет собой целое число от 2 до 4,
при условии, что когда Х представляет собой СН2, Y представляет собой ОН или NH-(CH2)n-OH,
и их фармацевтически приемлемых солям.
Подробное описание изобретения
Новые алкилзамещенные индолхиноксалины по настоящему изобретению применимы в качестве лекарственных средств и, в особенности, для профилактики и/или лечения аутоиммунных заболеваний, например для профилактики и/или лечения ревматоидного артрита (RA) и рассеянного склероза (MS).
В этом описании термин галоген означает хлор, фтор или бром.
Термин низший алкил означает линейные или разветвленные алкильные группы, содержащие от 1 до 4 атомов углерода, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, предпочтительно метил или этил.
Термин алкокси означает линейные или разветвленные алкоксигруппы, содержащие от 1 до 4 атомов углерода, такие как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси.
Термин циклоалкил означает C5-C7 циклоалкильные группы, такие как циклопентил, циклогексил, циклогептил.
Подходящей группой соединений являются соединения формулы (I), где оба R2 представляют собой метильные группы.
Другой подходящей группой соединений являются соединения формулы (I), где R1 представляет собой галогеновую группу и оба R2 представляют собой метильные группы.
Предпочтительной группой соединений являются соединения формулы (I), где R1 представляет собой группу хлора или фтора.
Другой предпочтительной группой соединений являются соединения формулы (I), где Y представляет собой NR5R6, в особенности, когда R5 и R6 представляют собой сходные или несходные низшие алкильные группы.
Объектом изобретения также являются соединения формулы (I) для применения в качестве лекарственных средств.
Другим объектом изобретения является применение соединений формулы (I) для профилактики и/или лечения аутоиммунных заболеваний, в особенности, для профилактики и лечения ревматоидного артрита (RA) и рассеянного склероза (MS).
Изобретение также относится к способам получения новых алкилзамещенных индолхиноксалинов.
В определенных условиях, включая ряд болезненных состояний, иммунная система идивидуума воспринимает свой собственный материал как «не свой» и запускает иммунный ответ против «собственного составляющего», временами вызывая большее повреждение и недомогание, чем инфекционный агент или инородное тело, и вызывает серьезное заболевание указанного индивидуума. Аутоиммунное заболевание развивается, когда иммунная система индивидуума атакует его или ее собственные органы и ткани, вызывая клиническую картину, связанную с разрушением этой ткани, примером чего являются ревматоидный артрит (RA), инсулинзависимый сахарный диабет, астма, воспалительные заболевания кишечника, болезнь Паркинсона, злокачественная миастения, анемия, склеродермия, Аддисонова болезнь, псориаз, рассеянный склероз (MS), системная красная волчанка (SLE) и т.д. Следовательно, блокирование, нейтрализация или ингибирование иммунного ответа, противодействующие последствиям иммунной активности, или удаление ее причины в этих случаях являются желательными.
Предполагается, что ревматоидный артрит развивается на фоне представления релевантного антигена иммуногенетически восприимчивому организму. Антигены, которые потенциально могут запускать иммунный ответ, приводящий к развитию ревматоидного артрита, могут быть эндогенными или экзогенными. Возможные эндогенные антигены включают коллаген, мукополисахариды и ревматоидные факторы. Экзогенные антигены включают, например, микоплазмы, микобактерии, спирохеты и вирусы. Промежуточные продукты (например, простагландины и радикалы кислорода) иммунной реакции вызывают воспаление синовиальной оболочки и запускают деструктивные изменения в суставе (например, при участии коллагеназы). Ревматоидный артрит (включающий деструкцию тканей выстилки сустава) характеризуется преобладанием клеточно-опосредованного аутоиммунного ответа и бывает обусловлен, главным образом, деятельностью Т-клеток (см. Sinha et al., Science 248:1380 (1990)).
Тяжесть заболевания может широко варьироваться, но у многих пациентов течение болезни характеризуется сменой рецидивов и ремиссий с общей тенденцией медленного прогрессирования деструкции и деформации суставов. Клинические проявления могут включать симметричный полиартрит периферических суставов, сопровождающийся болью, хрупкостью, отеком и потерей функции пораженных суставов, утренней скованностью, а также разрушением хряща, эрозией костного вещества и подвывихом суставов после длительного воспаления. Внесуставные проявления включают ревматоидные узелки, ревматоидный васкулит, воспаление плевры и легких, склерит, синдром Шегрена, синдром Фелти (спленомегалия и нейтропения), остеопороз и потерю массы тела (Katz (1985), Am. J. Med., 79:24, и Krane and Simon (1986), Advances in Rheumatology, Synderman (ed.), 70(2):263-284). Клинические проявления выражаются в существенной болезненности, что приводит к нарушению повседневной жизни пациента. К сожалению, несмотря на значительные исследовательские усилия, лекарства от ревматоидного артрита не существует.
Принятое лечение РА направлено на подавление либо конечного звена патогенеза воспаления, либо иммунных медиаторов. Оба подхода являются неспецифическими и поэтому связаны с серьезными побочными эффектами. Кортикостероиды оказывают многообразное действие на иммунную систему и другие ткани. Их использование сопровождается весьма высокой частотой возникновения побочных эффектов со стороны костно-мышечной системы, обмена веществ, нервной системы и соединительной ткани, также как и иммуносупрессии, которая может привести к жизнеопасным инфекциям. По этой причине стараются избегать применения кортикостероидов, пока все другие виды лечения не оказались безуспешными. См., главным образом, R. Million et al., "Long-Term Study of Management of rheumatoid Arthritis", Lancet 1:812 (1984).
Цитотоксичные лекарства и антиметаболиты, такие как метотрексат, азатиоприн и циклофосфамид, неспецифично повреждают все быстроделящиеся клетки и поэтому связаны с костномозговой и желудочно-кишечной токсичностью, а также с увеличением заболеваемости злокачественными болезнями. Кроме того, лечение RA метотрексатом, как сообщается, индуцирует повреждение печени и легких, которые могут быть фатальными. См. J.A.Engelbrecht et al., "Methotrexate Pneumonitis After Low-Dose Therapy for Rheumatoid Arthritis", Arthritis and Rheumatism 26:1275 (1983), и G.W.Cannon et al., "Acute Lung Disease Associated With Low-Dose Pulse Methotrexate Therapy In Patients With Rheumatoid Arthritis", Arthritis and Rheumatism 26:1269 (1983).
Большинство нестероидных противовоспалительных средств (NSAIDSs), применяемых в настоящее время, нацелено на неспецифическое подавление синтеза простагландинов. Применяемые в настоящее время NSAIDSs модифицируют или уменьшают, но не останавливают воспалительный ответ. Ацетилсалициловая кислота остается наиболее часто используемым NSAIDSs. Токсичность ацетилсалициловой кислоты принимает многообразные формы, включая реакции гиперчувствительности, глухоту, желудочно-кишечную и почечную токсичность. См., главным образом, Simon and Mills, "Nonsteroidal Antiinflammatory Drugs", N. Eng. J. Med. 302:1179 (1980).
Соединения золота и пеницилламин также используются в лечении RA. Эти препараты связаны с высокой частотой костномозговых, почечных и слизисто-кожных токсических реакций. Препараты золота, в частности, связаны с нейропатией, W.Katz et al., "Proteinuria in Gold-Treated Rheumatoid Arthritis", Ann. Int. Med. 101:176 (1984). Пеницилламин, обладая сомнительной эффективностью, токсичен даже в относительно низких дозах. См. W.F.Kean et al., "The Toxicity Pattern of D-Penicillamine Therapy", Arthritis and Rheumatism 23:158 (1980). Эти проблемы привели к практически полному отказу от этих лекарств в терапии RA.
Другим признанным лечением является терапия циклоспорином и анти-TNF-альфа-антителами. Однако серьезная почечная токсичность и неспецифическая иммуносупрессия значительно ограничивают применение циклоспорина. Благодаря своей универсальной роли во многих клеточных функциях анти-TNF лечение может быть небезопасной терапевтической стратегией в отношении RA. В ряде случаев отмечается развитие волчаночно-подобного синдрома. Однако данные о клинической эффективности демонстрируют обнадеживающие результаты применения анти-TNF подхода к лечению.
Таким образом, современное лечение RA связано с высокой частотой возникновения серьезных побочных эффектов. Более того, хотя некоторые препараты могут обеспечивать облегчение симптомов, во многих случаях они значимо не замедляют прогрессирование разрушения суставов. Необходим эффективный терапевтический подход с низкой токсичностью с условием, что такое лечение лучше бы переносилось и было более приемлемо для терапии RA.
В настоящем изобретении рассматривается новый класс лекарств для лечения ревматоидного артрита, а именно соединения, которые приводят к уменьшению клинических проявлений и симптомов болезни.
Рассеянный склероз (MS) является заболеванием центральной нервной системы, которое повреждает головной и спинной мозг. От этого заболевания страдают примерно 2,5 миллиона людей по всему миру, MS является важнейшим приобретенным неврологическим заболеванием среди молодых пациентов. При разрушении защитной миелиновой оболочки проведение нервных импульсов прерывается, что приводит к множеству неврологических симптомов. Обычные признаки и симптомы MS включают утомление, психологические и когнитивные изменения, слабость или паралич конечностей, оцепенение, расстройства зрения, нарушения речи, мышечную спастичность, нарушение равновесия при ходьбе и стоя, дисфункцию кишечника и мочевого пузыря, а также сексуальную дисфункцию.
Приблизительно половина пациентов с этим заболеванием страдает рецидивно-ремиссионным MS, при котором отмечаются непредсказуемые атаки, когда клинические симптомы становятся сильнее (обострение), чередующиеся с периодами ремиссий, когда симптомы стабилизируются или уменьшаются. У другой половины больных имеется хронический прогрессирующий MS без периодов ремиссии.
В настоящее время не существует лекарства от MS. Многие препараты могут облегчить симптомы при прогрессирующем MS. Например, кортикостероиды применяют для уменьшения воспаления в нервной ткани и укорочения продолжительности приступов; миорелаксанты, такие как тизанидин (Занафлекс) и баклофен (Лиоресал) являются пероральными препаратами для лечения мышечной спастичности; антидепрессант флуоксетин (Прозак), противовирусный препарат амантадин (Симметрел) или препарат для нарколепсии, называемый модафинил (Провигил), используют для уменьшения утомляемости.
Для лечения рассеянного склероза подходят некоторые другие препараты, которые не связаны непосредственно с симптоматическим лечением, а могут своим воздействием изменять течение заболевания. Эти лекарства включают β-интерфероны (Бетаферон, Авонекс, Ребиф) и ацетат глатирамера (Копаксон). Эти лекарства могут оказывать влияние на частоту и тяжесть рецидивов заболевания, а также на число поражений, выявляемых при МРТ. Некоторые из этих лекарств обладают эффектом замедления прогрессирования инвалидизации. US 4617319 раскрывает способ лечения рассеянного склероза с помощью 1,4-дигидрокси-5,8-бис[[(2-гидроксиэтиламино)этил]амино]антрахинона, который также известен по названию дженерика - митоксантрон (Новантрон).
Не один из существующих способов лечения полностью не удовлетворяет потребности, из-за ограниченной эффективности и/или значительной токсичности. Кроме того, многие из этих препаратов требуют частого введения, а некоторые являются очень дорогими. Таким образом, очевидна необходимость в новых и эффективных способах лечения рассеянного склероза.
Соединения настоящего изобретения могут быть изготовлены для перорального, парентерального (например, внутривенного, внутримышечного или подкожного), накожного, буккального, интраназального или ректального введения или могут быть изготовлены для введения посредством ингаляции или инсуффляции. Кроме того, соединения согласно настоящему изобретению могут также быть изготовлены в виде препаратов с замедленным высвобождением.
Наиболее близкими к заявленному изобретению являются соединения, описанные в ЕР 238459 и соответствующим ему US 4990510, а также применение указанных соединений, описанное в ЕР 799038 и ЕР 1261344, а также в соответствующих им US 6248742, US 6465466 и US 6333327. Среди соединений, раскрытых в указанных патентах, например соединение 2,3-диметил-6-(N,N-диметиламиноэтил)-6Н-индоло(2,3-b)хиноксалин (В 220), показало себя перспективным средством для лечения ревматоидного артрита и рассеянного склероза в стандартных тестах, а именно в модели с коллаген-индуцированным артритом (CIA) и в модели ЕАЕ соответственно. Однако соединения согласно настоящему изобретению имеют неожиданно более высокую эффективность в отношении ревматоидного артрита и рассеянного склероза в сравнении с соединением В220.
Новые соединения согласно настоящему изобретению могут быть получены с использованием ниже приведенных стандартных способов.
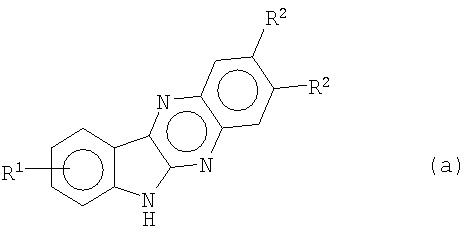
Анионы индол[2,3-b]хиноксалинов формулы (а), полученные путем обработки подходящим основанием, таким как гидрид натрия (NaH), трет-бутоксид калия или гидроксид калия в двухфазной системе
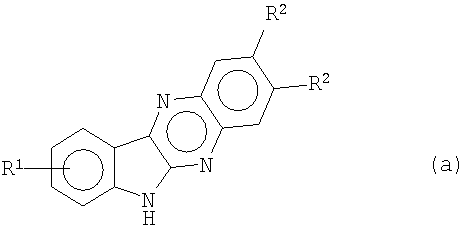
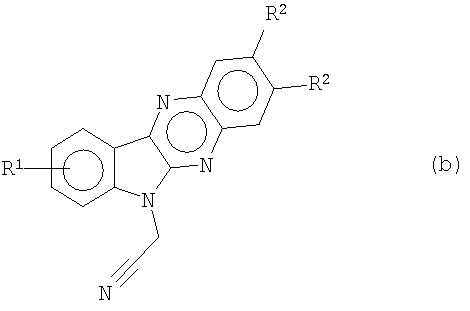
алкилируют с помощью α-галогенированных алкилнитрилов или α-галогенированных алкилэфиров, например хлорацетонитрила и метил- или этилбромацетата соответственно, получая при этом 6-цианометилиндол[2,3-b]хиноксалины формулы (b)
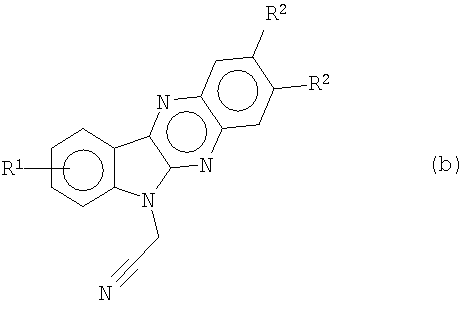
и индол[2,3-b]хиноксалин-6-илуксусную кислоту (с; R7=H) или их соли (например, Na) и алкилиндол[2,3-b]хиноксалин-6-илацетаты формулы (с)
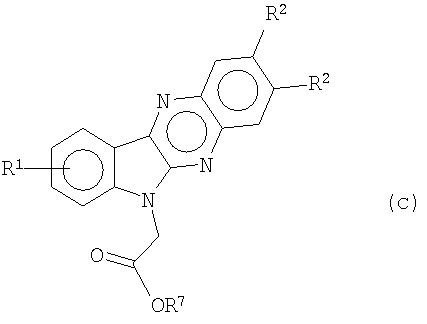
где R7 представляет собой метил или этил. Первичные амиды, индол[2,3-b]хиноксалин-6-илацетамиды формулы (II)
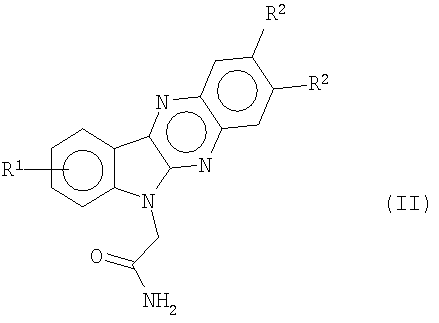
соответственно получают с помощью кислотного гидролиза соединений формулы (b) в сильной кислоте, такой как серная кислота. Вторичные амиды формулы (III)
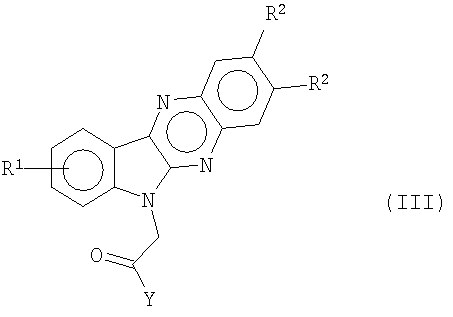
получают путем конденсации алкилэфиров формулы (с) с избытком подходящего амина с растворителем или без.
Примеры
Следующие экспериментальные измерения осуществляют с помощью следующих средств, методов и условий.
ЯМР-спектр регистрируют в DMSO-d6 растворах при комнатной температуре, используя сигнал от DMSO-d6 (1Н: δ=2.50 част. на млн.; 13С: δ=39.5) в качестве внутреннего стандарта, на спектрометре Bruker DPX 300 (300 МГц). Значения δ определяют в частях на миллион. Температуры плавления определяют на приборе Biichi Melting Point B-545 и не корректируют. Растворители имеют аналитический класс и используются в том виде как получены.
Индол[2,3-b]хиноксалиновое производное формулы (а) (1 экв.) добавляют порциями к суспензии NaH (1.1 экв.) в N,N-диметилацетамиде (DMA), N,N-диметилформамиде (ДМФА)или DMSO (5 мл/1 ммоль соединения а) при температуре 30°С в инертной атмосфере (Аr или N2) и перемешивают в течение 30 минут. Хлорацетонитрил (1.1 экв.) добавляют одной порцией. Полученную реакционную смесь перемешивают в течение 20 часов при комнатной температуре. Реакционную смесь в конце выливают в воду, фильтруют, промывают водой и сушат, что дает соединение формулы (b).
Когда R1 представляет собой хлор в формуле (а), получают следующее соединение формулы (b), то есть продукт 9-хлор-2,3-диметил-6-цианометил-6H-индол[2,3-b]хиноксалин. Выход 98%; т. плавления 286-288°С. 1Н ЯМР δ: 8.36 (д, 1Н), 8.04 (с, 1Н), 7.99-9.94 (м, 2Н), 7.86 (дд, 1Н), 5.75 (с, 2Н), 2.53 (с, 6Н).
Новые соединения в соответствии с настоящим изобретением, представляющие собой первичные амиды формулы (II)

могут быть получены в соответствии со следующим способом.
Соединение формулы b растворяют в H2SO4 (конц., 10 мл/1 г b), затем его выливают на воду со льдом и перемешивают в течение 5 минут. Твердое вещество, полученное таким образом, собирают и промывают водой. Высушенное твердое вещество обрабатывают горячим СН2Сl2, фильтруют и промывают дополнительно
СН2Сl2 и сушат, что дает соединение формулы (II).
Следующие соединения получают в соответствии со способом, аналогичным способу, указанному выше.
Соединение А
2,3-Диметилиндол[2,3-b]хиноксалин-6-илацетамид (R1=Н, R2=СН3, Х=СО, Y=NH2)
Выход 72%. 1H-ЯМР δ: 8.38 (д, 1Н), 8.16 (с, 1Н), 8.05 (с, 1Н), 7.70 (м, 2Н), 7.59 (д, 1Н), 7.40 (t, 1Н), 7.16 (с, 1Н), 5.08 (с, 2Н), 2.50 (с, 6Н).
Соединение В
9-Хлор-2,3-диметилиндол[2,3-b]хиноксалин-6-илацетамид (R1=Сl, R2=СН3, Х=CO, Y=NH2)
Выход 66%. 1H ЯМР δ: 8.29 (с, 1Н), 7.99 (с, 1Н), 7.90 (с, 1Н), 7.65-7.50 (м, 3Н), 7.07 (уширенный с, 1Н), 5.06 (с, 2Н), 2.48 (с, 6Н).
Соединение С
2,3-Диметил-9-фториндол[2,3-b]хиноксалин-6-илацетамид (R1=F, R2=СН3, Х=CO, Y=NH2)
Выход 32%; т. плавления 316-319°С. 1Н ЯМР δ: 8.11 (дд, 1Н), 8.01 (с, 1Н). 7.86 (с, 1Н), 7.70 (с, 1Н), 7.65-7.55 (м, 2Н), 7.29 (с, 1Н), 5.05 (с, 2Н), 2.50 (с, 6Н).
Новые вторичные амиды формулы (III) в соответствии с настоящим изобретением

могут быть получены с помощью следующего способа.
Индол[2,3-b]хиноксалиновое производное формулы а (1 экв.) добавляют по капле к суспензии NaH (1.1 экв.) в DMA, ДМФА или DMSO (5 мл/1 ммоль а) при температуре 30°С в инертной атмосфере (Аr или N2) и перемешивают в течение 30 минут. Добавляют одной порцией алкилбромацетат (1.1 экв.). Полученную реакционную смесь перемешивают в течение 20 часов при комнатной температуре. Реакционную смесь затем выливают в воду, фильтруют, промывают водой и сушат, что дает продукт формулы (с).
Когда метилбромацетат используют в качестве алкилбромацетата и R1 представляет собой 9-фтор и R2 представляет собой метил, получают следующий продукт формулы (с):
метил-2,3-диметил-9-фториндол[2,3-b]хиноксалин-6-илацетат. Выход 74%; т. плавления 257-259°С. 1Н ЯМР δ: 8.16 (дд, 1Н), 8.05 (с, 1Н), 7.91 (с, 1Н), 7.82 (дд, 1Н), 7.62 (дт, 1Н), 5.41 (с, 2Н), 3.65 (с, 3Н), 2.50 (с, 6Н).
Вторичные амиды формулы (III) затем получают с помощью следующего способа.
Соединение формулы с добавляют к подходящему амину (10 мл/0.5 г с) при температуре кипения с обратным холодильником и в конце кипятят в течение 4-15 минут. Реакционной смеси дают возможность остыть до комнатной температуры, после чего добавляют воду. Полученное твердое вещество отфильтровывают и промывают водой, сушат и обрабатывают горячим этанолом и фильтруют, и снова промывают этанолом и сушат, что дает продукт формулы (III).
Следующие соединения получают в соответствии со способом, аналогичным способу, указанному выше.
Соединение D
2,3-Диметил-6-
(N,N)-диметиламиноэтиламино-2-оксоэтил)-6Н-индол[2,3-b]хиноксалин (R1=Н, R2=СН3, Х=СО, Y=NH-CH2-CH2-R3; R3=NR5R6; R5=R6=СН3)
Выход 63%; 1H-ЯМР δ: 8.33 (д, 1Н), 8.27 (t, 1Н), 8.02 (с, 1Н), 7.85 (с, 1Н), 7.70 (т, 1Н), 7.58 (д, 1Н), 7.39 (т, 1Н), 5.09 (с, 2Н), 3.17 (q, 2Н), 2.49 (с, 6Н), 2,32 (т, 2Н), 2.14 (с, 6Н).
Соединение Е
9-Хлор-2,3-диметил-6-
(N,N)-диметиламиноэтиламино-2-оксоэтил)-6Н-индол[2,3-b]хиноксалин (R1=Cl, R2=СН3, Х=СО, Y=NН-CH2-CH2-R3; R3=NR5R6; R5=R6=СН3)
Выход 58%. 1H ЯМР δ: 8.29 (д, 1Н), 8.23 (т, 1Н), 7.98 (с, 1Н), 7.82 (с, 1Н), 7.71 (дд, 1Н), 7.61 (д, 1Н), 5.09 (с, 2Н), 3,16 (q, 2Н), 2.47 (с, 6Н), 2.28 (т, 2Н), 2,12 (с, 6Н).
Соединение F
9-Хлор-2,3-диметил-6-(аминоэтиламино-2-оксоэтил)-6Н-индол[2,3-b]хиноксалин (R1=Cl, R2=СН3, Х=СО, Y=NH-CH2-CH2-NH2)
Выход 71%. 1H-ЯМР δ: 8.32 (д, 1Н), 8.27 (т, 1Н), 8.01 (с, 1Н), 7.85 (с, 1Н), 7.73 (дд, 1Н), 7.66 (д, 1Н), 5.11 (с, 1Н), 3.17 (с, 2Н), 3.07 (q, 2Н), 2.57 (т, 2Н), 2.49 (с, 6Н).
Соединение G
2,3-Диметил-6-(N,N-диметиламиноэтиламино-2-оксоэтил)-9-фтор-6Н-индол[2,3-b]хиноксалин (R1=F, R2=СН3, Х=СО, Y=NH-CH2-CH2-R3; R3=NR5R6, R5=R6=СН3)
Выход 51%; т. плавления 241-242°С. 1Н-ЯМР δ: 8.10-8.00 (м, 3Н), 7.84 (с, 1Н), 7.59-7.53 (м, 2Н), 5.09 (с, 2Н), 3.19 (кв, 2Н), 2.94 (с, 1Н), 2.79 (с, 1Н), 2.50 (с, 6Н). 2,31 (т, 2Н), 2.14 (с,6Н).
Соединение Н
2,3-Диметил-6-(аминоэтиламино-2-оксоэтил)-9-фтор-6Н-индол[2,3-b]хиноксалин (R1=F, R2=СН3, Х=СО, Y=NH-CH2-CH2-NH2)
Выход 88%; т. плавления 269-271°С. 1Н ЯМР δ: 8.26 (т, 1Н), 8.13 (дд, 1Н), 8.04 (с, 1Н), 7.88 (с, 1Н), 7.68-7.56 (м, 2Н), 5.12 (с, 2Н), 3.07 (кв, 2Н), 2.57 (т, 2Н), 2.50 (с, 6Н).
Новые вторичные амиды формулы (IV)
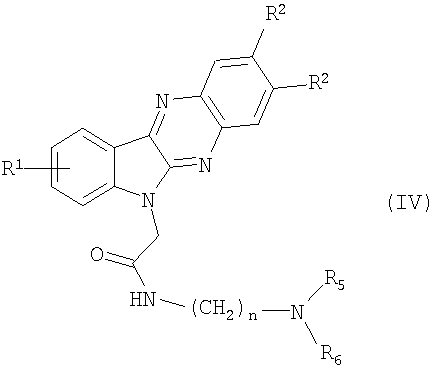
где R1, R2, R3, R5 и R6 и n являются теми, как определено в формуле (I), могут также быть получены с помощью следующего альтернативного способа, как представлено в следующих примерах.
Соответствующее индол[2,3-b]хиноксалиновое производное (формулы а) (1 экв.) добавляют по капле к суспензии NaH (3 экв.) в DMA или DMSO (5 мл/1 ммоль формула а) при температуре 30°С в инертной атмосфере (Аr или N2) и перемешивают в течение 30 минут. Добавляют одной порцией гидрохлорид 2-хлор-N-(2-диметиламиноэтил)ацетамида (1.5 экв.) (этот реагент алкилирования получают, как описано у Sanchez et al., J. Heterocycl. Chem., 31: 297-304 (1994)). Полученную реакционную смесь перемешивают в течение 20 часов при температуре 40°С и затем выливают в воду, фильтруют, промывают водой и сушат. Твердое вещество подкисляют путем обработки соляной кислотой и после этого фильтруют. Фильтрат подщелачивают путем обработки гидроксидом натрия и полученное твердое вещество выделяют фильтрованием, промывают водой и сушат.
Соединение J
2,3-Диметил-6-(N,N-диметиламиноэтиламино-2-оксоэтил)-9-фтор-6Н-индол[2,3-b]хиноксалин
Выход 89%; т. плавления 242-243°С.
Новая карбоновая кислота формулы (V)
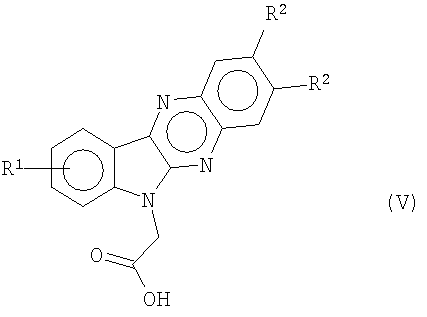
где R1 и R2 являются теми, как определено в формуле (I),
может быть получена в соответствии со следующим способом.
Общий способ
Подходящее индол[2,3-b]хиноксалиновое производное формулы (а) (1 экв.) добавляют порциями к суспензии NaH (1.1 экв.) в DMA или DMSO (5 мл/1 ммоль а) при температуре 30°С в инертной атмосфере (Аr или N2) и перемешивают в течение 30 минут, после чего добавляют одной порцией хлорацетат натрия (1.1 экв.). Полученную реакционную смесь перемешивают в течение 20 часов при комнатной температуре и в конце выливают в воду, подкисляют НСl, фильтруют, промывают водой, сушат и повторно кристаллизуют (ДМФА).
Соединение K
2,3-Диметил-9-хлориндол[2,3-b]хиноксалин-6-илуксусная кислота
Выход 0.77 г (45%). 1Н ЯМР δ: 13.29 (уширенный с, 1Н), 8.34 (с, 1Н), 8.03 (с, 1Н), 7.89 (с, 1Н), 7.83-7.75 (м, 2Н), 5.26 (с, 2Н), 2.50 (с, 6Н). Т. плавления 331-332°С.
Новая карбоновая кислота формулы (V), где R1 и R2 являются теми, как определено в формуле (I), может также быть получена с помощью общего альтернативного способа, как представлено в следующем примере.
Метил-2,3-диметил-9-фториндол[2,3-b]хиноксалин-6-илацетат (1.65 г) перемешивают в этаноле (30 мл) с водным раствором NaOH (5%; 30 мл) в течение 24 часов. Реакционную смесь подкисляют водным раствором НСl (1M). Твердое вещество, полученное таким образом, фильтруют, промывают водой и сушат.
Соединение L
2,3-Диметил-9-фториндол[2,3-b]хиноксалин-6-илуксусная кислота Выход 1.54 г (97%). 1Н ЯМР δ: 14-13 (уширенный с, 1Н), 8,06 (дд, 1Н), 7,93 (с, 1Н), 7,80 (с, 1Н), 7,75 (дд, 1Н), 7,56 (м, 1Н), 5,21 (с, 2Н), 2,43 (с, 6Н). Т. плавления 317-318°С.
Соединения по настоящему изобретению были протестированы в соответствии с нижеприведенными моделями для оценки эффекта в отношении ревматоидного артрита и в отношении рассеянного склероза.
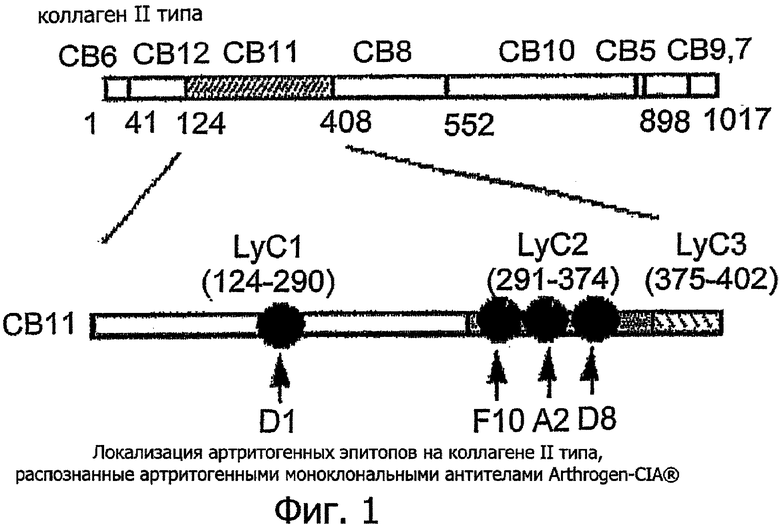
Коллаген-индуцированный артрит (CIA) у мышей широко используется в качестве экспериментальной модели ревматоидного артрита (РА) людей. CIA опосредуется антителами, которые связываются с конкретной областью коллагена II типа, такой как СВ11 (CNBr-расщепленный фрагмент коллагена II типа).
Антитело-опосредованный CIA может быть индуцирован внутривенной инъекцией комбинации 4 различных моноклональных антител (Arthrogen-CIA® mAb), полученных с помощью мышиной В-гибридомной клеточной линии Arthrogen-CIA®.
Три из mAb распознают аутоантигенные эпитопы, кластеризованные с фрагментом из 84 аминокислотных остатков, LyC2 (наименьший артритогенный фрагмент коллагена II типа) СВ11 и четвертое mAb вступает во взаимодействие с LyC1 (фиг.1). Важно, что все 4 mAb распознают консервативные эпитопы, одинаковые у различных видов коллагена II типа, и перекрестно реагируют с гомологичным и гетерологичным коллагеном II типа.
Применяют коктейль из 4 моноклональных антител. Эти артритогенные mAb в чистом виде или в комбинации с бактериальным липополисахаридом могут вызывать тяжелый артрит в течение нескольких дней вместо нескольких недель (классическая модель с CIA).
Ссылка сделана на фиг.1
1. Преимущества модели антительно-индуцированного артрита:
- артрит развивается у мышей в течение 24-48 ч после внутривенной инъекции артритогенных mAb в чистом виде или после инъекции липополисахарида с последующей субартритогенной дозой mAb. В обоих случаях артрит длится в течение 2-3 недель или более и приводит к анкилозу;
- артрит вызывается не только в CIA-чувствительных мышах DBA/1 и В10.RIII, но также и в некоторых CIA-резистентных мышах, таких как Balb/c;
- эта модель идеальна для скрининга противовоспалительных терапевтических агентов.
Эта модель идеальна для изучения медиаторов воспаления, таких как цитокины, хемокины и металлопротеазы и другие факторы, такие как влияние бактериальной флоры и ее промежуточных продуктов в запуске и обострении артрита.
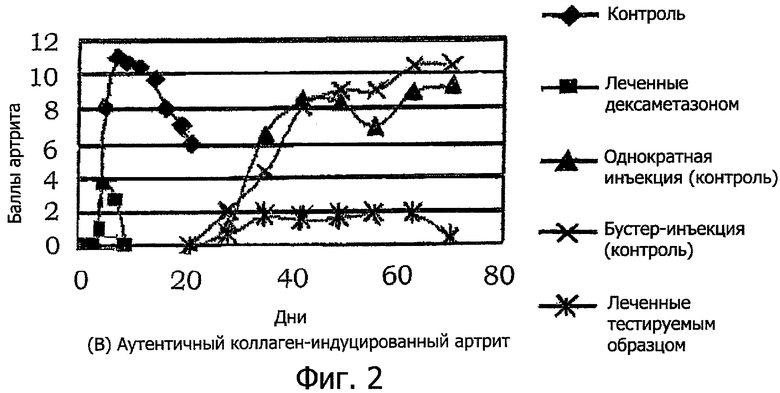
Сравнение аутентичного CIA и mAb-LPS индуцированного артрита.
(А) Коктейль из 4 моноклональных антител к коллагену II типа (2 мг) вводят внутривенно в день 0, после чего на день 3 интраперитонеально вводят липополисахарид (50 мкг). Артрит развивается на день 4 и достигает своего пика на день 7-8. Терапевтические эффекты тестируемых соединений определяют на день 7. Образование остеобластов и деградация кости более значительны на день 14 и день 21 (данные не представлены).
(В) Аутентичный коллаген-индуцированный артрит
Ссылка сделана на фиг.2
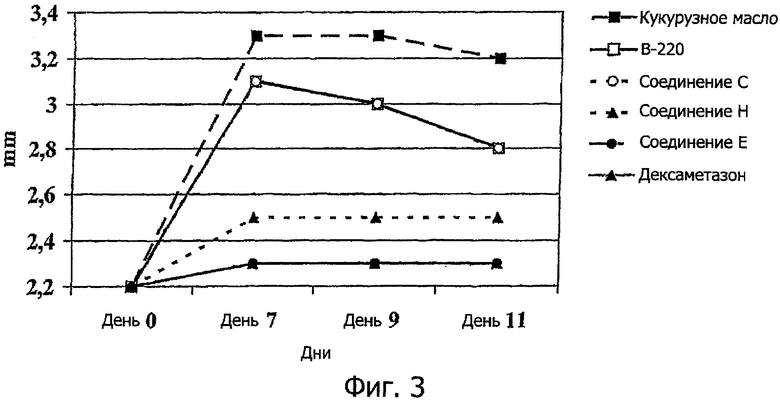
Количественная оценка артрита. Толщину задней лапы, левой и правой, у каждого животного (9 особей в каждой группе) измеряли в миллиметрах в день 0 исследования (исходный уровень), дни 7, 9 и 11 с помощью устройства Mitutoyo Electronic Digital Caliper. Толщина задних лап у животных после введения соединения Н, соединения Е и дексаметазона (положительный контроль) была значительно ниже по сравнению с носителем в качестве контроля (кукурузное масло). Дексаметазон является кортизоном, который подавляет воспаление и нормальный иммунный ответ, и используется системно или местно для лечения воспалительных расстройств. Пациенты по причине безопасности получили короткие курсы кортизонов для приведения воспаления под контроль в пределах между началом DMARD или комбинации DMARD и вероятным временем реакции.
Ссылка сделана на фиг.3
Примечание: кривые для соединения Е и дексаметазона (Dexa) и кривые для В-220 и соединения С, соответственно накладываются друг на друга.
Фиг.3. Средние значения толщины задней лапы в группе (мм) измеряют на протяжении всего 11-дневного периода наблюдения у мышей с mAB/LPS-индуцированным артритом, которым повторно 1 раз в день (дни 0-5) подкожно вводят аналоги В-220, дексаметазон (положительный контроль) или кукурузное масло (отрицательный контроль).
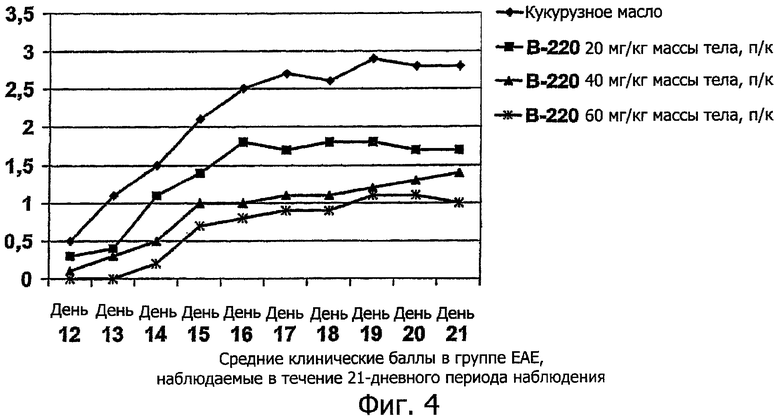
Исследования, использующие мышиную модель MS, экспериментальный аллергический энцефаломиелит (ЕАЕ) (Alvord, E.G., et al., Prog. Clin. Biol. Res. 146:1-8 (1984); Swanborg, R.H., Сlin. Immunol. Immunopathol. 77:4-13 (1995); Martin, R. and McFarland, H.F., Grit. Rev. Clin. Lab. Sciences 32:121-182 (1995)), пригодны для описания иммунного ответа при заболеваниях, схожих с RA. ЕАЕ может быть вызван у некоторых пород мышей путем подкожного (п/к) введения миелиновых белков, таких как основной миелиновый белок (МВР) или протеолипидный белок (PLP) в присутствии адъюванта Фрейнда. Исследования адаптивного переноса с ЕАЕ моделью показали, что CD4+ Т-клетки мышей, иммунизированных МВР или PLP, могут передавать болезнь интактным мышам, что предполагает тот факт, что ЕАЕ является Т-клеточно опосредованным заболеванием.
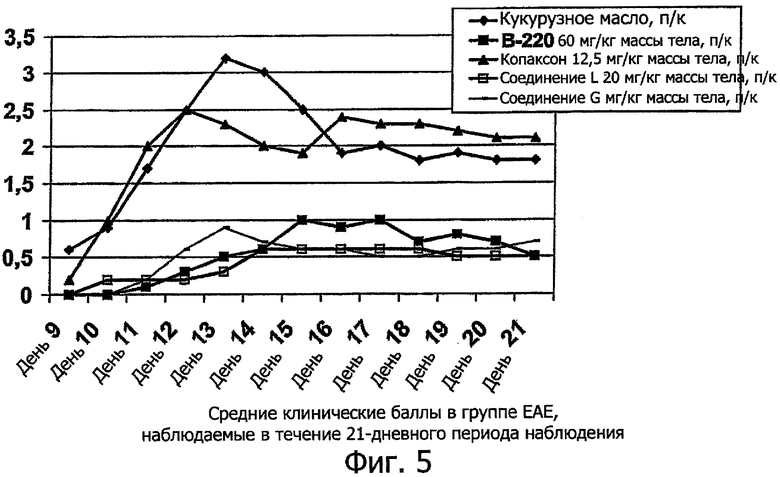
Представленные результаты получены с использованием ЕАЕ модели следующим образом. Модель состоит из периода сенсибилизации, вызванного однократной подкожной (п/к) инъекцией PLP, эмульгированного в полном адъюванте Фрейнда (CFA) в день 0 исследования, после чего проводят дополнительную интраперитонеальную иммуностимуляцию коклюшным токсином в день 0 и через 48 часов. Тестируемые образцы вводят путем однократных ежедневных повторных сеансов на протяжении 10 последовательных дней (дни 0-9). В то же время Копаксон вводят через день с дня 0 до дня 18, т.е. 10 введений, сравн. фиг.5. Все животные (10 в каждой группе) были обследованы на признаки каких-либо неврологических реакций и симптомов перед индукцией ЕАЕ (день 0) и впоследствии ежедневно на протяжении 21-дневного периода наблюдения. ЕАЕ реакции были подсчитаны и записаны в соответствии со стандартной шкалой 0-5 в порядке возрастания тяжести (от 0 баллов - норма, до 5 баллов - умирание и/или гибель).
Ссылка сделана на фиг.4
Фиг.4. Средние клинические баллы в группе ЕАЕ, наблюдаемые в течение 21-дневного периода наблюдения.
Ссылка сделана на фиг.5
Фиг.5. Средние клинические баллы в группе ЕАЕ, наблюдаемые в течение 21-дневного периода наблюдения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТАГОНИСТЫ ПЕПТИДНОГО РЕЦЕПТОРА, СВЯЗАННОГО С ГЕНОМ КАЛЬЦИТОНИНА | 2003 |
|
RU2341526C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИНДОЛИНОНА | 2003 |
|
RU2299209C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИЛИ ИХ СОЛИ С КИСЛОТАМИ ИЛИ ОСНОВАНИЯМИ | 1990 |
|
RU2049784C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ КОНДЕНСИРОВАННЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ АНТИДИУРЕТИЧЕСКИХ АГЕНТОВ | 2005 |
|
RU2359969C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2294326C2 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2013 |
|
RU2530881C1 |
| НОВЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ, И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2001 |
|
RU2288225C2 |
| Гетероциклические соединения в качестве ингибиторов PAD | 2018 |
|
RU2764243C2 |
| Необязательно конденсированные гетероциклил-замещенные производные пиримидина, пригодные для лечения воспалительных, метаболических, онкологических и аутоиммунных заболеваний | 2015 |
|
RU2815636C1 |
| ПРОИЗВОДНЫЕ 5-АМИНО-4, 6-ДИЗАМЕЩЕННОГО ИНДОЛА И 5-АМИНО-4, 6-ДИЗАМЕЩЕННОГО ИНДОЛИНА КАК МОДУЛЯТОРЫ КАЛИЕВЫХ КАНАЛОВ | 2008 |
|
RU2483060C2 |
Описаны новые замещенные индолхиноксалины формулы (I), где R1 представляет собой водород или представляет собой один или большее количество одинаковых или различных заместителей в положениях с 7 по 10, выбранных из группы галогена, низшего алкил/алкокси, гидрокси, трифторметила, трихлорметила, трифторметокси, R2 представляет собой одинаковые или различные C1-C4 алкильные заместители, Х представляет собой СО или СН2, Y представляет собой ОН, NH2, NH-(CH2)n-R3, где R3 представляет собой низший алкил, ОН, NH2, NHR4 или NR5R6,
где R4, R5 и R6 независимо представляют собой низший алкил или циклоалкил и n представляет собой целое число от 2 до 4, при условии, что когда Х представляет собой СН2, Y представляет собой ОН или NH-(CH2)n-OH, и их фармацевтически приемлемые соли. Соединения применимы в качестве лекарственных средств для лечения и/или предотвращения аутоиммунных заболеваний. Описаны также фармацевтическая композиция, содержащая эти соединения, и способы получения соединений формулы (I). 5 н. и 10 з.п. ф-лы, 5 ил.
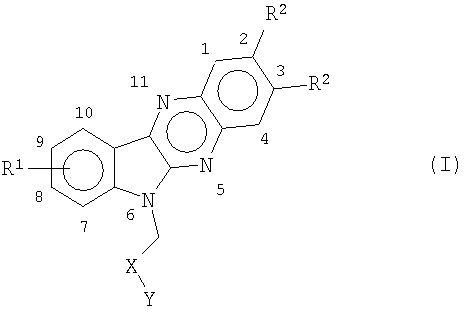
1. Производное индолхиноксалина формулы (I)

где R
1
представляет собой водород или представляет собой один или большее количество одинаковых или различных заместителей в положениях с 7 по 10, выбранных из группы галогена, например хлора, фтора, брома, низшего алкила/алкокси, гидрокси, трифторметила, трихлорметила, трифторметокси,
R
2
представляет собой одинаковые или различные C
1
-C
4
алкильные заместители,
Х представляет собой СО или СН
2
,
Y представляет собой ОН, NH
2
, NH-(CH
2
)
n
-R
3
, где R
3
представляет собой низший алкил, ОН, NH
2
, NHR
4
или NR
5
R
6
, где R
4
, R
5
и R
6
независимо представляют собой низший алкил или циклоалкил, и n представляет собой целое число от 2 до 4,
при условии, что когда Х представляет собой СН
2
, Y представляет собой ОН или NH-(CH
2
)
n
-OH,
и его фармацевтически приемлемые соли.
2. Соединение по п.1, где Х представляет собой СО, и Y представляет собой ОН или NH
2
, и R
1
представляет собой атом галогена.
3. Соединение по п.1 или 2, где R
1
представляет собой атом хлора или атом фтора.
4. Соединение по п.1, где Х представляет собой СО, и Y представляет собой NH-CH
2
-CH
2
-R
3
, где R
3
представляет собой NH
2
или N(CH
3
)
2
.
5. Соединение по любому из пп.1, 2 и 4, где R
2
представляет собой метил в положениях 2 и 3.
6. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль для применения в качестве лекарственного средства для лечения и/или предотвращения аутоиммунного заболевания.
7. Фармацевтическая композиция для лечения и/или предотвращения аутоиммунного заболевания, содержащая эффективное количество соединения по любому из пп.1-5, или его фармацевтически приемлемой соли и, при необходимости, растворитель, носитель или адьювант.
8. Соединение формулы (I) по любому из пп.1, 2, 4 и 6 для профилактики и/или лечения аутоиммунных заболеваний.
9. Соединение по п.8 для профилактики и/или лечения ревматоидного артрита.
10. Соединение по п.8 для профилактики и/или лечения рассеянного склероза.
11. Способ получения соединений общей формулы (I), где R
1
, R
2
, R
3
, R
4
, R
5
, R
6
, Х и Y являются теми, как определено в п.1, заключающийся в том, что анионы соединения формулы (а)
алкилируют с помощью α-галогенированных алкилнитрилов или α-галогенированных алкилэфиров соответственно, получая при этом 6-цианометилиндол[2,3-b]хиноксалины формулы (b)
и индол[2,3-b]хиноксалин-6-илуксусную кислоту (с; R
7
=Н) или ее соли (например, Na) и алкилиндол[2,3-b]хиноксалин-6-илацетаты формулы (с)
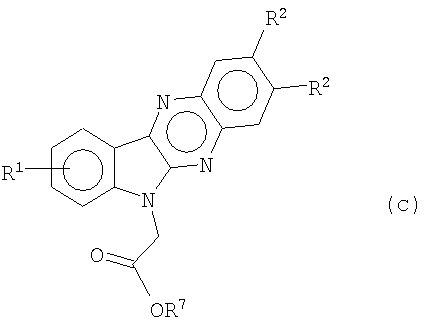
где R
7
представляет собой метил или этил,
соответственно полученные таким образом соединения формулы (b) дают первичные амиды, т.е. индол[2,3-b]хиноксалин-6-илацетамиды формулы (II)
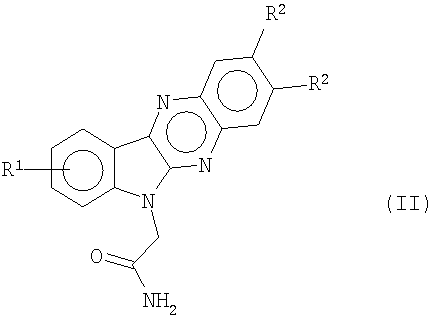
путем кислотного гидролиза в сильной кислоте, такой как серная кислота, и соединения формулы (с) дают вторичные амиды формулы (III)
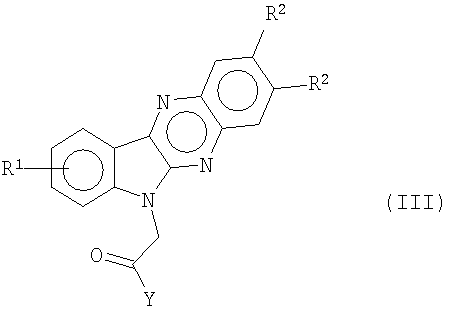
путем конденсации алкилэфиров формулы (с) с избытком подходящего амина в присутствии или в отсутствие растворителя.
12. Способ получения соединений общей формулы (IV)
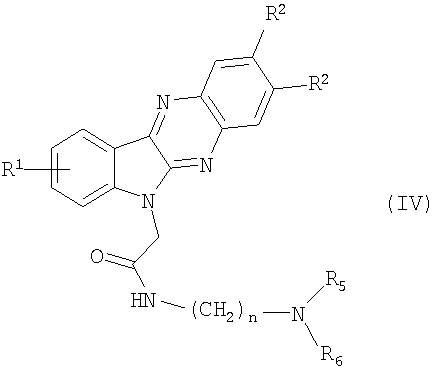
где R
1
R
2
, R
3
, R
5
и R
6
и n являются теми, как определено в п.1, где анионы соединения формулы (а) взаимодействуют с агентом алкилирования формулы (VI)
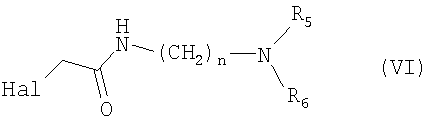
где Hal представляет собой атом галогена,
и полученное таким образом твердое вещество подкисляют, фильтруют и полученный фильтрат подщелачивают, что дает соединение формулы (IV).
13. Соединение по п.1, выбранное из:
2,3-диметилиндоло[2,3-b]хиноксалин-6-ил-ацетамида;
9-хлор-2,3-диметилиндоло[2,3-b]хиноксалин-6-илацетамида;
2,3-диметил-9-фториндоло[2,3-b]хиноксалин-6-илацетамида;
2,3-диметил-6-(N,N-диметиламиноэтиламино-2-оксоэтил)-6Н-индоло[2,3-b]хиноксалина;
9-хлор-2,3-диметил-6-(N,N-диметиламиноэтиламино-2-оксоэтил)-6Н-индоло[2,3-b]хиноксалина;
9-хлор-2,3-диметил-6-(аминоэтиламино-2-оксоэтил)-6Н-индоло[2,3-b]хиноксалина;
2,3-диметил-6-(N,N-диметиламиноэтиламино-2-оксиэтил)-9-фтор-6Н-индоло[2,3-b]хиноксалин;
2,3-диметил-6-(аминоэтиламино-2-оксиэтил)-9-фтор-6Н-индоло[2,3-b]хиноксалин;
2,3-диметил-9-хлориндоло[2,3-b]хиноксалин-6-илуксусная кислота; и
2,3-диметил-9-фториндоло[2,3-b]хиноксалин-6-илуксусная кислота или их фармацевтически приемлемые соли.
14. Соединение по п.1, представляющее собой 9-хлор-2,3-диметил-6-(N,N-диметиламиноэтиламино-2-оксоэтил)-6Н-индоло[2,3-b]хиноксалин или его фармацевтически приемлемая соль.
15. Фармацевтическая композиция для лечения или предотвращения ревматоидного артрита, содержащая эффективное количество 9-хлор-2,3-диметил-6-(N,N-диметиламиноэтиламино-2-оксоэтил)-6Н-индоло[2,3-b]хиноксалина или его фармацевтически приемлемой соли и, при необходимости, растворитель, носитель или адьювант.
| US 6248742 B1, 19.06.2001 | |||
| US 6333327 B2, 25.12.2002 | |||
| 0 |
|
SU160371A1 | |
Авторы
Даты
2009-10-10—Публикация
2005-05-18—Подача