Область техники, к которой относится изобретение
Настоящее изобретение относится к новому блок-сополимеру, мицеллярному препарату, в котором используется блок-сополимер, и к противораковому средству, включающему мицеллярный препарат в качестве активного ингредиента.
Уровень техники
Многие лекарства, в частности противораковые средства, представляют собой труднорастворимые в воде гидрофобные соединения. При использовании указанных лекарств с целью получения требуемого терапевтического эффекта лекарство обычно солюбилизуют и затем вводят пациенту. Таким образом, солюбилизация труднорастворимых в воде лекарств, в частности труднорастворимых в воде противораковых средств, важна для пероральных или парентеральных фармацевтических препаратов, в частности препаратов, предназначенных для внутривенного введения.
В качестве одного из способов солюбилизации труднорастворимого в воде противоракового средства известен способ, который заключается в добавлении поверхностно-активного вещества, в частности, для солюбилизации паклитакселя известно использование, например, полиоксиэтиленсодержащего производного касторового масла (Cremophor). В другом способе известно, например, использование мицеллообразующего блок-сополимера в качестве носителя лекарства, которое описано, например, в патентах Японии JP-A-6-107565 (патентный документ 1), JP-A-6-206815 (патентный документ 2), JP-A-11-335267 (патентный документ 3), а применение инкапсулированного в мицеллах паклитакселя описано в патенте Японии JP-A-2201-226294 (патентный документ 4).
Сущность изобретения
При использовании вышеуказанного способа солюбилизации с помощью поверхностно-активного вещества проблема заключается в том, что в некоторых случаях наблюдаются вредные побочные эффекты, такие как аллергическая реакция, возникновение которых относят к поверхностно-активному веществу, а стабильность препарата снижается, и если содержащий лекарство раствор хранят или на время оставляют, то лекарство выпадает в виде осадка, что затрудняет применение лекарственного средства.
При внутривенном введении фармацевтического препарата, включающего труднорастворимый в воде противораковый агент, такой как таксановое противораковое средство, вместе с блок-сополимером в качестве носителя лекарства, ни разу не удавалось добиться более высокого значения поддерживаемой в крови концентрации лекарства, обеспечить накопление лекарства в опухолевой ткани с более высокой концентрацией или добиться большего фармакологического эффекта и меньших побочных эффектов по сравнению с применением индивидуального лекарства.
Таким образом, существует потребность в медицинском препарате, который не имеет вредных побочных эффектов, таких как аллергическая реакция, повышает растворимость в воде труднорастворимого в воде противоракового агента, поддерживает высокую концентрацию лекарства в крови, накапливает большие концентрации лекарства в опухолевой ткани, усиливает фармакологическое действие труднорастворимого в воде противоракового средства и снижает побочные эффекты противоракового средства.
С целью решения вышеуказанной проблемы авторы настоящего изобретения провели интенсивные исследования и в результате обнаружили новый блок-сополимер, мицеллярный препарат, в котором используется указанный полимер, и противораковое средство, включающее мицеллярный препарат в качестве активного ингредиента, и, таким образом, было осуществлено настоящее изобретение.
Таким образом, настоящее изобретение относится к:
1) блок-сополимеру, который получают взаимодействием соединения, представленного следующей общей формулой (1):
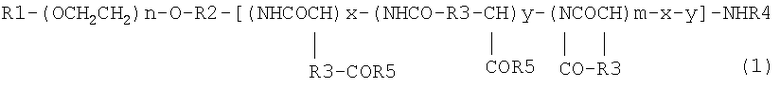
где R1 означает атом водорода или (С1-С5)алкильную группу, R2 означает (С1-С5)алкиленовую группу, R3 означает метиленовую группу или этиленовую группу, R4 означает атом водорода или (С1-С4)ацильную группу, R5 означает гидроксильную группу, необязательно замещенную арил(С1-С8)алкоксигруппу или группу -N(R6)-CO-NHR7, где R6 или R7 могут быть одинаковыми или различными и каждый из них означает (С3-С6)циклическую алкильную группу или (С1-С5)алкильную группу, необязательно замещенную третичной аминогруппой; n имеет значения от 5 до 1000, m имеет значения от 2 до 300, х имеет значения от 0 до 300 и y имеет значения от 0 до 300 при условии, что сумма x и y составляет от 1 или более до m или меньшей, чем m величины; R5 обозначает гидроксильную группу с отношением 1-99% к m, необязательно замещенную арил(С1-С8)алкоксигруппу с отношением 1-99% к m и группу -N(R6)-CO-NHR7 с отношением 0-10% к m с производным карбодиимида в количестве от m до 5m эквивалентов по отношению к соединению, представленному общей формулой (1), в растворителе при температуре от 30 до 60°С в течение 2-48 ч;
2) блок-сополимеру, который получают взаимодействием соединения, представленного следующей общей формулой (2):
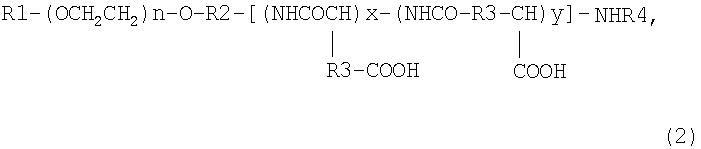
где R1 означает атом водорода или (С1-С5)алкильную группу, R2 означает (С1-С5)алкиленовую группу, R3 означает метиленовую группу или этиленовую группу, R4 означает атом водорода или (С1-С4)ацильную группу, n имеет значения от 5 до 1000, х имеет значения от 0 до 300 и y имеет значения от 0 до 300 при условии, что сумма x и y составляет от 2 до 300, с необязательно замещенным арил(С1-С8)алкилспиртом или необязательно замещенным арил(С1-С8)алкилгалогенидом с получением продукта, который частично этерифицирован по карбоксильным группам в боковых цепях, с последующим взаимодействием продукта с производным карбодиимида в количестве от (x+y) до 5(x+y) эквивалентов по отношению к соединению, представленному общей формулой (2), в растворителе при температуре от 30 до 60°С в течение 2-48 ч;
3) блок-сополимеру в соответствии с вышеуказанными пп.1) или 2), где R1 означает метильную группу, R2 означает триметиленовую группу, R3 означает метиленовую группу, R4 является ацетильной группой, n имеет значения от 20 до 500, m имеет значения от 10 до 100, х имеет значения от 0 до 100 и y имеет значения от 0 до 100;
4) блок-сополимеру в соответствии с любым из вышеуказанных пп.1)-3), где производным карбодиимида является диэтилкарбодиимид, диизопропилкарбодиимид, дициклогексилкарбодиимид или 1-этил-3-(3-диметиламинопропил)карбодиимид или его неорганическая соль;
5) блок-сополимеру в соответствии с любым из вышеуказанных пп.1)-3), где производным карбодиимида является диизопропилкарбодиимид;
6) блок-сополимеру, представленному следующей общей формулой (3):
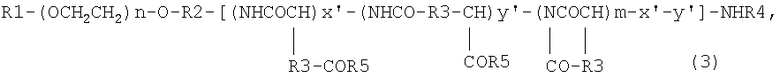
где R1 означает атом водорода или (С1-С5)алкильную группу, R2 означает (С1-С5)алкиленовую группу, R3 означает метиленовую группу или этиленовую группу, R4 означает атом водорода или (С1-С4)ацильную группу, R5 означает гидроксильную группу, необязательно замещенную арил(С1-С8)алкоксигруппу или группу -N(R6)-CO-NHR7, где R6 или R7 могут быть одинаковыми или группу или (С1-С5)алкильную группу, необязательно замещенную третичной аминогруппой; n имеет значения от 5 до 1000, m имеет значения от 2 до 300, х' имеет значения от 0 до 300 и у' имеет значения от 0 до 300 при условии, что сумма х' и у' составляет от 1 или более до m или меньшей чем m величины; R5 означает гидроксильную группу с отношением 0-88% к m, необязательно замещенную арил(С1-С8)алкоксигруппу с отношением 1-89% к m и группу -N(R6)-CO-NHR7 с отношением 11-30% к m;
7) блок-сополимеру в соответствии с вышеуказанным п.6), где R1 означает метильную группу, R2 означает триметиленовую группу, R3 означает метиленовую группу, R4 является ацетильной группой, необязательно замещенная арил(С1-С8)алкоксигруппа, обозначенная как R5, представляет собой бензилоксигруппу или 4-фенил-1-бутоксигруппу, каждый R6 и R7 означает изопропильную группу, n имеет значения от 20 до 500, m имеет значения от 10 до 100, х' имеет значения от 0 до 100 и у' имеет значения от 0 до 100;
8) блок-сополимеру в соответствии с вышеуказанными пп.6) или 7), где R5 означает гидроксильную группу с отношением 0-75% к m, необязательно замещенную арил(С1-С8)алкоксигруппу с отношением 10-80% к m и группу -N(R6)-CO-NHR7 с отношением 11-30% к m;
9) блок-сополимеру в соответствии с вышеуказанным п.8), где R5 означает гидроксильную группу с отношением 0% к m;
10) мицеллярный препарат, полученный из блок-сополимера по любому из вышеуказанных пп.1)-9) и труднорастворимого в воде противоракового агента;
11) мицеллярный препарат в соответствии с вышеуказанным п.10), где труднорастворимым в воде противораковым агентом является противораковый агент на основе таксана;
12) мицеллярный препарат в соответствии с вышеуказанным п.11), где противораковым агентом на основе таксана является паклитаксель;
13) противораковое средство, включающее мицеллярный препарат по любому из пп.10)-12) в качестве активного ингредиента.
Полезность изобретения
Новый блок-сополимер по настоящему изобретению может служить в качестве носителя для лекарства, обладающего меньшей токсичностью и не оказывающего вредные побочные эффекты, такие как аллергическая реакция. Блок-сополимер может образовывать мицеллы в водной среде и включать труднорастворимое в воде противораковое средство, в частности паклитаксель, в мицеллы в количестве, необходимом для лечения заболевания, при этом противораковое средство не связывается с блок-сополимером, и тем самым повышать растворимость лекарства в воде. В том случае, когда водный раствор мицеллярного препарата по настоящему изобретению, содержащий включенное в него лекарство вместе с блок-сополимером, оставляют при комнатной температуре, мицеллярный препарат, содержащий труднорастворимое в воде противораковое средство, стабилен в водной среде и не наблюдается агрегация мицелл или высвобождение лекарства из мицелл, по крайней мере, в течение нескольких часов. Мицеллярный препарат может быть пригоден для клинического применения в качестве противоракового средства, поскольку он поддерживает более высокую концентрацию лекарства в крови и обладает более действенной активностью с меньшими побочными эффектами, чем назначаемое индивидуально противораковое средство или чем назначаемое противораковое средство, солюбилизованное с помощью обычного поверхностно-активного вещества.
Наиболее предпочтительный вариант осуществления настоящего изобретения
Блок-сополимер по настоящему изобретению получают взаимодействием соединения, содержащего структурный фрагмент полиэтиленгликоля (PEG) и структурный фрагмент полиаминокислоты, которое представлено общей формулой (1), где R1 означает атом водорода или (С1-С5)алкильную группу, R2 означает (С1-С5)алкиленовую группу, R3 означает метиленовую группу или этиленовую группу, R4 означает атом водорода или (С1-С4)ацильную группу, R5 означает гидроксильную группу, необязательно замещенную арил(С1-С8)алкоксигруппу или группу -N(R6)-CO-NHR7, где R6 или R7 могут быть одинаковыми или различными и каждый из них означает (С3-С6)циклическую алкильную группу или (С1-С5)алкильную группу, необязательно замещенную третичной аминогруппой; n составляет от 5 до 1000, m составляет от 2 до 300, х составляет от 0 до 300 и y составляет от 0 до 300 при условии, что сумма x и y составляет от 1 или более до m или меньшей чем m величины; R5 означает гидроксильную группу с отношением 1-99% к m; необязательно замещенную арил(С1-С8)алкоксигруппу с отношением 1-99% к m и группу -N(R6)-CO-NHR7 с отношением 0-10% к m с производным карбодиимида в количестве от m до 5m эквивалентов по отношению к соединению, представленному общей формулой (1), в растворителе при температуре от 30 до 60°С в течение 2-48 ч.
R1 в соединении, представленном общей формулой (1), которое применяют по настоящему изобретению, означает атом водорода или (С1-С5)алкильную группу, при этом (С1-С5)алкильная группа является предпочтительной. Конкретные примеры (С1-С5)алкильной группы включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу и т.д., при этом наиболее предпочтительной является метильная группа.
(С1-С5)алкиленовая группа, представленная радикалом R2, в частности, включает метиленовую группу, этиленовую группу, триметиленовую группу, тетраметиленовую группу и т.д., и предпочтительной является этиленовая группа или триметиленовая группа.
R3 означает метиленовую группу или этиленовую группу, предпочтительно метиленовую группу.
R4 означает атом водорода или (С1-С4)ацильную группу, предпочтительно (С1-С4)ацильную группу, и конкретные примеры включают формильную группу, ацетильную группу, пропионильную группу, бутироильную группу и т.д., при этом наиболее предпочтительной является ацетильная группа.
Арил(С1-С8)алкоксигруппа, представленная радикалом R5, включает линейную или разветвленную (С1-С8)алкоксигруппу, к которой присоединена ароматическая углеводородная группа, такая как фенильная группа или нафтильная группа, и конкретные примеры включают бензилоксигруппу, фенетилоксигруппу, фенилпропоксигруппу, фенилбутоксигруппу, фенилпентилоксигруппу, фенилгексилоксигруппу, фенилгептилоксигруппу, фенилоктилоксигруппу, нафтилэтоксигруппу, нафтилпропоксигруппу, нафтилбутоксигруппу и нафтилпентилоксигруппу и т.д.
Заместитель в необязательно замещенной арил(С1-С8)алкоксигруппе включает низшую алкоксигруппу, такую как метоксигруппа, этоксигруппа, изопропоксигруппа, н-бутоксигруппа и трет-бутоксигруппа, атом галогена, такой как атом фтора, атом хлора и атом брома, нитрогруппу, цианогруппу и т.п. Хотя количество заместителей может составлять от 1 до максимального количества заместителей, которые занимают все возможные для замещения позиции, необязательно замещенная арил(С1-С8)алкоксигруппа предпочтительно не содержит заместителей.
Необязательно замещенная арил(С1-С8)алкоксигруппа предпочтительно представляет собой незамещенную фенил(С1-С6)алкоксигруппу, и ее примеры включают незамещенную бензилоксигруппу, незамещенную фенетилоксигруппу, незамещенную фенилпропоксигруппу, незамещенную фенилбутоксигруппу, незамещенную фенилпентилоксигруппу, незамещенную фенилгексилоксигруппу и т.д., из которых незамещенная бензилоксигруппа и незамещенная фенилбутоксигруппа являются наиболее предпочтительными.
Конкретные примеры (С3-С6)циклической алкильной группы или (С1-С5)алкильной группы, необязательно замещенной третичной аминогруппой, которая представлена радикалом R6 или R7, включают циклопропильную группу, циклопентильную группу, циклогексильную группу, метильную группу, этильную группу, изопропильную группу, н-бутильную группу, 3-диметиламинопропильную группу, 5-диметиламинопентильную группу и т.д., предпочтительно этильную группу, изопропильную группу, циклогексильную группу и 3-диметиламинопропильную группу, а наиболее предпочтительной является изопропильная группа.
В общей формуле (1), m означает количество полимеризованных структурных аминокислотных единиц в полиаминокислотном структурном фрагменте. Каждый полиаминокислотный структурный фрагмент содержит структурную единицу, где R5 в общей формуле (1) означает гидроксильную группу, необязательно замещенную арил(С1-С8)алкоксигруппу или группу -N(R6)-CO-NHR7, и структурная единица имеет структуру циклического имида.
Отношение, с которым R5 в общей формуле (1) означает гидроксильную группу, составляет от 1 до 99%, предпочтительно составляет от 10 до 90%, более предпочтительно составляет от 20 до 80% по отношению к m, отношение, с которым R5 означает необязательно замещенную арил(С1-С8)алкоксигруппу, составляет от 1 до 99%, предпочтительно составляет от 10 до 90%, более предпочтительно составляет от 20 до 80% по отношению к m, а отношение, с которым R5 означает группу -N(R6)-CO-NHR7, составляет от 0 до 10% по отношению к m.
В соединении, представленном общей формулой (1), которое применяют в настоящем изобретении, n составляет от 5 до 1000, предпочтительно составляет от 20 до 500, более предпочтительно составляет от 80 до 400, m составляет от 2 до 300, предпочтительно составляет от 10 до 100, более предпочтительно составляет от 15 до 60, х составляет от 0 до 300, предпочтительно составляет от 0 до 100, более предпочтительно составляет от 5 до 60, y составляет от 0 до 300, предпочтительно составляет от 0 до 100, более предпочтительно составляет от 5 до 60, и сумма х и y составляет от 1 или более до m или меньшей чем m величины.
В полиаминокислотном структурном фрагменте соединения, представленного общей формулой (1), которое применяют в настоящем изобретении, соответствующие аминокислотные структурные единицы могут быть связаны статистически или в форме блок-сополимера.
Далее подробно рассматривается взаимодействие соединения, представленного общей формулой (1), с производным карбодиимида.
Указанную реакцию проводят в растворителе, и примеры применяемых растворителей включают, однако этим не ограничиваясь, полярные растворители, такие как диметилформамид (ДМФА), диметилсульфоксид (ДМСО), ацетонитрил, тетрагидрофуран и диоксан, неполярные растворители, такие как бензол, н-гексан и диэтиловый эфир, и воду и смеси указанных растворителей. Количество используемого растворителя обычно составляет от 1 до 500 весовых частей на одну часть исходных соединений.
Производное карбодиимида, которое используют в вышеуказанной реакции, включает производные карбодиимида, содержащие (С3-С6)циклическую алкильную группу или (С1-С5)алкильную группу, которая может быть замещена третичной аминогруппой, и конкретные примеры включают диэтилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC·HCl), дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIPCI) и т.п., предпочтительно DCC или DIPCI и наиболее предпочтительно DIPCI.
Количество производного карбодиимида, которое используют в указанной реакции, с точки зрения количества (m) полимеризованных аминокислотных структурных единиц, составляет от m до 5 m эквивалентов, предпочтительно от m до 3m эквивалентов по отношению к соединению, представленному общей формулой (1). Таким образом, производное карбодиимида может использоваться в от m- до 5m-кратном молярном избытке, предпочтительно от m- до 3m-кратном молярном избытке по отношению к соединению, представленному общей формулой (1).
В реакции допускается участие вспомогательных реагентов, таких как N-гидроксисукцинимид, 1-гидроксибензотриазол (HOBt), имид N-гидрокси-5-норборнен-2,3-дикарбоновой кислоты (HOBN), 4-диметиламинопиридин (DMAP), N,N-диизопропилэтиламин или триэтиламин, из которых DMAP является предпочтительным. Если используют вспомогательный реагент, то его количество составляет от приблизительно 0,1m до 5m эквивалентов, предпочтительно от приблизительно 0,2m до 2m эквивалентов по отношению к соединению, представленному общей формулой (1).
Температура реакции предпочтительно составляет от 30 до 60°С, наиболее предпочтительно от 30 до 40°С. Время проведения реакции составляет от 2 до 48 ч, предпочтительно от 6 до 36 ч.
Способ получения соединения, представленного общей формулой (1), специально не ограничивается; например, существует способ, в котором соединение, где R5 означает необязательно замещенную арил(С1-С8)алкоксигруппу, частично гидролизуют с помощью кислоты или щелочи в соответствии со способом, описанным в приведенных выше JP-A-11-335267 (патентный документ 3) или JP-A-2001-226294 (патентный документ 4).
Соединение, представленное общей формулой (1), может быть также получено взаимодействием соединения, представленного общей формулой (2), где R1 означает атом водорода или (С1-С5)алкильную группу, R2 означает (С1-С5)алкиленовую группу, R3 означает метиленовую группу или этиленовую группу, R4 означает атом водорода или (С1-С4)ацильную группу, n составляет от 5 до 1000, х составляет от 0 до 300 и y составляет от 0 до 300 при условии, что сумма x и y составляет от 2 до 300 с необязательно замещенным арил(С1-С8)алкилспиртом или необязательно замещенным арил(С1-С8)алкилгалогенидом.
В соединении общей формулы (2) R1, R2, R3 и R4 каждый означает ту же самую группу, что и в общей формуле (1), а предпочтительными группами также являются те же самые группы, что и в общей формуле (1).
В соединении общей формулы (2) значения n, x и y предпочтительно также являются теми же самыми, что и в общей формуле (1).
Взаимодействие соединения, представленного общей формулой (2), с необязательно замещенным арил(С1-С8)алкилспиртом представляет собой, в частности, сопровождающуюся дегидратацией реакцию конденсации в присутствии производного карбодиимида в растворителе.
Необязательно замещенный арил(С1-С8)алкилспирт представляет собой спирт, соответствующий необязательно замещенной арил(С1-С8)алкоксигруппе.
Количество арил(С1-С8)алкилспирта, который используют в указанной реакции, составляет от 0,01 до 5 эквивалентов, предпочтительно от 0,1 до 3 эквивалентов, еще более предпочтительно от 0,15 до 2 эквивалентов относительно количества карбоксильных групп (т.е. суммы x и y) в соединении общей формулы (2).
Растворитель, который используют в указанной реакции, является тем же самым растворителем, который используют для проведения реакции соединения, представленного общей формулой (1), с производным карбодиимида, и количество используемого растворителя такое же, как и указанное выше.
Производное карбодиимида, которое используют для проведения указанной реакции, также может быть таким же, как указано выше, а количество используемого производного карбодиимида может быть таким же, как и указанное выше количество. Используемый вспомогательный реагент может быть таким же, как указано выше, а количество используемого вспомогательного реагента может быть таким же, как и указанное выше количество.
Температура реакции составляет предпочтительно от 5 до 30°С, наиболее предпочтительно от 15 до 30°С. Время проведения реакции составляет от 2 до 48 ч, предпочтительно от 6 до 36 ч.
Взаимодействие соединения, представленного общей формулой (2), с необязательно замещенным арил(С1-С8)алкилгалогенидом включает реакцию алкилирования за счет нуклеофильного замещения в присутствии основания в растворителе.
Необязательно замещенный арил(С1-С8)алкилгалогенид аналогичен приведенному выше необязательно замещенному арил(С1-С8)алкилспирту, за исключением того, что место гидроксильной группы, которая присутствует в последнем соединении, занято атомом галогена.
Атом галогена в необязательно замещенном арил(С1-С8)алкилгалогениде включает атом фтора, атом хлора, атом брома и атом иода, предпочтительно атом брома или атом иода.
Количество арил(С1-С8)алкилгалогенида, который используют в указанной реакции, составляет от 0,01 до 5 эквивалентов, предпочтительно от 0,1 до 3 эквивалентов, еще более предпочтительно от 0,15 до 2 эквивалентов относительно количества (суммы x и y) карбоксильных групп в соединении общей формулы (2).
Растворитель, который используют в указанной реакции, является тем же самым растворителем, который используют для проведения реакции соединения, представленного общей формулой (1), с производным карбодиимида, и количество используемого растворителя такое же, как и указанное выше.
Основание, которое используют в указанной реакции, включает, например, третичные амины, такие как триэтиламин, N,N-диизопропилэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), среди которых наиболее предпочтительными являются N,N-диизопропилэтиламин и DBU.
Количество используемого основания составляет от приблизительно 0,1 до 5 эквивалентов, более предпочтительно от 0,2 до 2 эквивалентов относительно количества (суммы x и y) карбоксильных групп в соединении общей формулы (2).
Указанную реакцию проводят при температуре предпочтительно от 5 до 60°С, более предпочтительно, от 15 до 40°С.
Время проведения реакции составляет от 2 до 48 ч, предпочтительно от 6 до 36 ч.
Необязательно замещенный арил(С1-С8)алкилспирт или необязательно замещенный арил(С1-С8)алкилгалогенид может быть коммерчески доступным соединением, или соединением, которое получают по известному органическому синтетическому способу, или соединением, которое получают по известной химической реакции.
Необязательно замещенный арил(С1-С8)алкилспирт или необязательно замещенный арил(С1-С8)алкилгалогенид включает такие соединения, которые соответствуют вышеуказанной необязательно замещенной арил(С1-С8)алкоксигруппе, и предпочтительными соединениями также являются те же самые соединения.
Предпочтительные примеры необязательно замещенного арил(С1-С8)алкилспирта или необязательно замещенного арил(С1-С8)алкилгалогенида включают незамещенный бензиловый спирт, незамещенный фенетиловый спирт, незамещенный фенилпропанол, незамещенный фенилбутанол, незамещенный фенилпентанол, незамещенный фенилгексанол, незамещенный бензилбромид, незамещенный фенетилбромид, незамещенный фенилпропилбромид, незамещенный фенилбутилбромид, незамещенный фенилпентилбромид и т.д., и наиболее предпочтительные примеры включают незамещенный бензиловый спирт, незамещенный фенилбутанол и незамещенный бензилбромид.
Блок-сополимер, получаемый взаимодействием соединения, представленного общей формулой (2), с необязательно замещенным арил(С1-С8)алкилспиртом или необязательно замещенным арил(С1-С8)алкилгалогенидом с образованием продукта, который частично этерифицирован по карбоксильным группам в боковых цепях, с последующим взаимодействием полученного продукта с производным карбодиимида в количестве от (x+y) до 5(x+y) эквивалентов по отношению к соединению, представленному общей формулой (2), в растворителе при температуре от 30 до 60°С, предпочтительно от 30 до 40°С, в течение от 2 до 48 ч, т.е. блок-сополимер, получаемый по 2-стадийной реакции из соединения, представленного общей формулой (2), также входит в объем настоящего изобретения.
Реакцию можно проводить в том же самом растворителе и в тех же самых условиях, что и реакцию соединения, представленного общей формулой (1), с производным карбодиимида, и предпочтительные условия проведения реакции такие же, как и указанные в данном описании. Таким образом, количество производного карбодиимида составляет от (x+y) до 5(x+y) эквивалентов, предпочтительно от (x+y) до 3(x+y) эквивалентов по отношению к соединению, представленному общей формулой (2).
Способ получения соединения общей формулой (2) включает, например, способ, описанный в приведенном выше JP-A-6-206815 (патентный документ 2).
Настоящее изобретение включает также блок-сополимер, представленный общей формулой (3), где R1 означает атом водорода или (С1-С5)алкильную группу, R2 означает (С1-С5)алкиленовую группу, R3 означает метиленовую группу или этиленовую группу, R4 означает атом водорода или (С1-С4)ацильную группу, R5 означает гидроксильную группу, необязательно замещенную арил(С1-С8)алкоксигруппу или группу -N(R6)-CO-NHR7, где R6 или R7 могут быть одинаковыми или различными и каждый из них означает (С3-С6)циклическую алкильную группу или (С1-С5)алкильную группу, необязательно замещенную третичной аминогруппой; n составляет от 5 до 1000, m составляет от 2 до 300, х' составляет от 0 до 300 и y' составляет от 0 до 300 при условии, что сумма x' и y' составляет от 1 или более до m или меньшей чем m величины; R5 означает гидроксильную группу с отношением 0-88% к m, необязательно замещенную арил(С1-С8)алкоксигруппу с отношением 1-89% к m и группу -N(R6)-CO-NHR7 с отношением 11-30% к m. Соединение, представленное общей формулой (3), включает также блок-сополимер, полученный взаимодействием соединения, представленного общей формулой (1), с производным карбодиимида.
R1, R2, R3, R4, R5, R6 и R7 в соединении общей формулой (3) являются теми же, что и в общей формуле (1), а предпочтительные группы являются теми же, что и указанные в данном описании. Таким образом, соединение общей формулы (3) предпочтительно представляет собой блок-сополимер, где R1 означает метильную группу, R2 означает триметиленовую группу, R3 означает метиленовую группу, R4 означает ацетильную группу, необязательно замещенная арил(С1-С8)алкоксигруппа, обозначенная как R5, представляет собой бензилоксигруппу или 4-фенил-1-бутоксигруппу, а R6 и R7 каждый означает изопропильную группу.
В соединении общей формулы (3) m имеет то же самое значение, что и определенное в общей формуле (1), каждый из n и m предпочтительно имеет тот же самый диапазон значений, что и определенный в общей формуле (1), х' составляет от 0 до 300, предпочтительно от 0 до 100, наиболее предпочтительно от 5 до 40, y' составляет от 0 до 300, предпочтительно от 0 до 100, наиболее предпочтительно от 5 до 40 при условии, что сумма x' и y' составляет от 1 или более до m или меньшей чем m величины.
В соединении общей формулы (3) отношение, с которым R5 означает гидроксильную группу, составляет от 0 до 88%, предпочтительно от 0 до 75%, более предпочтительно от 0 до 50% относительно m, отношение, с которым R5 означает арил(С1-С8)алкоксигруппу, составляет от 1 до 89%, предпочтительно от 10 до 80%, более предпочтительно от 20 до 70% относительно m, а отношение, с которым R5 означает группу -N(R6)-CO-NHR7, составляет от 11 до 30% относительно m.
В соединении общей формулы (3) отношение, с которым R5 означает гидроксильную группу, наиболее предпочтительно составляет 0% по отношению к m. Тот факт, что отношение, с которым R5 означает гидроксильную группу, составляет 0% по отношению к m, означает, что соединение общей формулы (3) не имеет свойств карбоновой кислоты, и это конкретно выявляется тем, что при проведении анализа методом высокоэффективной жидкостной хроматографии на анионообменной колонке соединение не удерживается в колонке.
Настоящее изобретение охватывает также мицеллярный препарат, полученный из блок-сополимера и труднорастворимого в воде противоракового средства.
В том случае, когда блок-сополимер содержит карбоксильные группы, блок-сополимер, содержащийся в мицеллярном препарате, может быть в форме соли, которая образована за счет диссоциацией на ионы части или всех карбоксильных групп. Соль включает соль щелочного металла, соль щелочноземельного металла, соль аммония, органическую аммонийную соль и т.д., и конкретные примеры включают натриевую соль, калиевую соль, кальциевую соль, соль аммония и соль триэтиламмония и т.п.
Труднорастворимое в воде противораковое средство относится к противораковому средству, которое практически не растворяется в эквивалентном количестве воды в обычных условиях при комнатной температуре, обычном давлении и т.д. или же преимущественно перераспределяется в хлороформенной фазе системы растворителей, включающей воду и хлороформ в равных количествах. Подобное противораковое средство может включать, например, противораковые средства на основе антрациклина, такие как адриамицин, противораковые средства на основе таксана, такие как паклитаксель или доцетаксель, противораковые средства на основе алкалоидов винка, такие как винкристин, метотрексат или его производные; особо следует упомянуть противораковые средства на основе таксана, в частности паклитаксель. Растворимость в воде паклитакселя составляет не более чем 1 мкг/мл.
В мицеллярном препарате по настоящему изобретению весовое отношение блок-сополимер:труднорастворимое в воде противораковое средство составляет от 1000:1 до 1:1, предпочтительно от 100:1 до 1,5:1, более предпочтительно от 20:1 до 2:1. Однако в том случае, когда мицеллярный препарат растворим в воде, труднорастворимое в воде противораковое средство может содержаться в максимально возможном количестве.
Мицеллярный препарат может, например, быть получен любым из следующих способов.
Способ а: Способ инкапсулирования лекарства путем смешивания
Труднорастворимое в воде противораковое средство, если необходимо, растворяют в смешивающемся с водой органическом растворителе, а затем смешивают при перемешивании с водной дисперсией блок-сополимера. Смешивание смеси при перемешивании можно проводить при нагревании.
Способ b: Способ испарения растворителя
Раствор труднорастворимого в воде противоракового средства растворяют в несмешивающемся с водой органическом растворителе, смешивают с водной дисперсией блок-сополимера, а затем испаряют органический растворитель при перемешивании.
Способ с: Диализный способ
Труднорастворимое в воде противораковое средство и блок-сополимер растворяют в смешивающемся с водой органическом растворителе и полученный раствор подвергают диализу через мембрану диализатора против буферного раствора и/или воды.
Способ d: Другой способ
Труднорастворимое в воде противораковое средство и блок-сополимер растворяют в несмешивающемся с водой органическом растворителе и полученный раствор смешивают с водой и перемешивают для получения эмульсии масло-в-воде (O/W) с последующим испарением растворителя.
В частности, способ получения мицелл по Методу с описан, например, в приведенном выше JP-A-6-107565 (патентный документ 1).
Далее более подробно рассматриваются способы b и d, которые включают испарение растворителя. Смешивающийся с водой органический растворитель в общем случае относится к растворителям, таким как ДМФА, ДМСО, ацетонитрил и т.п., которые практически неограниченно смешиваются с водой и которые используют для получения мицелл полимера в приведенном выше JP-A-11-335267 (патентный документ 3), а не ограничивающие настоящее изобретение примеры несмешивающегося с водой органического растворителя могут включать хлороформ, метиленхлорид, толуол, ксилол, н-гексан и т.п. или смеси указанных растворителей.
Несмешивающийся с водой органический растворитель смешивают с водной средой, т.е. водой (в том числе очищенной водой или деионизованной водой) или изотоническим или буферным водным раствором, содержащим сахара, стабилизатор, обычную соль, буфер и т.п. В этом случае могут содержаться небольшое количество смешивающегося с водой органического растворителя и другие неорганические соли (например, сульфат натрия и т.п.) при условии, что они не оказывают вредного воздействия на образования O/W эмульсии.
Как правило, несмешивающийся с водой органический растворитель и водная среда смешиваются в объемном соотношении 1:100, предпочтительно 1:10. Указанное смешивание можно осуществить с помощью любых обычных средств формирования различных эмульсий, таких как механическое перемешивание, смешивание на механической качалке или ультразвуковое излучение. Температура проведения операции не ограничена, однако с учетом температурной стабильности лекарства, температуры кипения растворителя и т.п. температуру обычно поддерживают от приблизительно -5°С до приблизительно 40°С.
Затем смешивание продолжают в открытой системе или же органический растворитель отгоняют (или удаляют за счет испарения) при перемешивании при пониженном давлении.
Водный раствор мицеллярного препарата может использоваться сам по себе или же, в том случае, когда мицеллярный препарат ассоциирован или агрегирован, препарат может быть подвергнут ультразвуковой обработке, а затем отфильтрован для удаления нерастворимых веществ или осадков. Используемый в этом случае мембранный фильтр специально не ограничивают, и предпочтительно мембрана имеет размер пор от приблизительно 0,1 до 1 мкм.
Мицеллярный препарат по настоящему изобретению устойчив в водной среде, а лечебная концентрация противоракового средства в водной среде за счет применения настоящего изобретения может быть повышена.
С целью дальнейшего повышения концентрации мицеллярного препарата в водной среде препарат можно концентрировать при пониженном давлении или же подвергнуть ультрафильтрации или лиофилизации.
Концентрация труднорастворимого в воде противоракового средства в мицеллярном препарате составляет от 0,1 до 50 мас.%, предпочтительно от 1 до 40 мас.%, более предпочтительно от 5 до 35 мас.% относительно общей массы труднорастворимого в воде противоракового средства и блок-сополимера, а количество лекарства может составлять приблизительно 0,01 мг или больше, предпочтительно приблизительно 0,1 мг или больше, более предпочтительно приблизительно 1 мг или больше на литр водного раствора мицеллярного препарата.
Мицеллярный препарат по настоящему изобретению представляет собой мицеллы, содержащие полиэтиленгликолевые структурные фрагменты, которые направлены в сторону водной фазы, включающие труднорастворимое в воде противораковое средство в гидрофобных фрагментах внутри мицелл. Размер частиц мицелл можно определить с помощью коммерческого устройства для измерения размеров частиц по рассеянию света, и средний диаметр частиц предпочтительно составляет от 10 до 200 нм, наиболее предпочтительно составляет от 20 до 120 нм.
Настоящее изобретение охватывает также противораковое средство, которое представляет собой мицеллярный препарат, содержащий труднорастворимое в воде противораковое средство в качестве активного ингредиента. В том случае, когда мицеллярный препарат вводят в качестве фармацевтического препарата, доза варьирует в зависимости от возраста, веса, медицинского состояния пациента, терапевтического назначения и т.д. и приблизительно составляет от 10 до 500 мг в день на человека. Предназначенный для введения фармацевтический препарат может содержать фармакологически приемлемую добавку и может быть перед введением растворен в фармацевтически приемлемом растворителе. Настоящее изобретение охватывает также и лиофилизованный продукт мицеллярного препарата.
Примеры
Далее настоящее изобретение описывается более подробно со ссылкой на примеры, однако настоящее изобретение не лимитируется приведенными ниже примерами. В примерах ЖХВР означает жидкостную хроматографию высокого разрешения, ЯМР означает ядерный магнитный резонанс на ядрах водорода, и спектры ЯМР измеряют, используя 2,2,3,3-дейтерированный-3-(триметилсилил)пропионат натрия в качестве внутреннего стандарта в указанном ниже растворителе с помощью спектрометра (400 МГц), выпускаемого компанией Bruker.
Пример 1. Получение блок-сополимера 2
ДМФА (630 мл) добавляют к 42,00 г PEG(средняя молекулярная масса 12000)-pAsp(полиаспарагиновая кислота; средняя степень полимеризации 40)-Ас (представлен общей формулой (2), где R1 означает метильную группу, R2 означает триметиленовую группу, R3 означает метиленовую группу, R4 означает ацетильную группу, n равно приблизительно 272, х равно приблизительно 10, y равно приблизительно 30; далее кратко обозначают как PEG-pAsp-Ac), который получают по способу, описанному в приведенном выше JP-А-6-206815 (патентный документ 2), растворяют PEG-pAsp-Ac при 25°С, к полученному раствору добавляют DMAP (9,90 г), 4-фенил-1-бутанол (10,93 мл) и DIPCI (15,86 мл) и дают прореагировать при указанной температуре в течение 24 ч. К реакционной смеси добавляют 1,58 л этилацетата и затем 4,73 л гексана, образовавшийся осадок собирают фильтрованием и сушат при пониженном давлении, получая 49,56 г неочищенных кристаллов. Неочищенные кристаллы растворяют в ацетонитриле, содержащем 50% воды (далее обозначают как «50%-ный водный ацетонитрил»), пропускают через 300 мл катионообменной смолы Dowex 50w8 (изготовитель Dow Chemical Company) и промывают 50%-ным водным ацетонитрилом. Элюент концентрируют при пониженном давлении и лиофилизуют, получая 48,25 г блок-сополимера 1.
Блок-сополимер 1 (19,5 мг) растворяют в 2 мл ацетонитрила, к полученному раствору добавляют 2 мл 0,5N водного раствора гидроксида натрия, раствор перемешивают при комнатной температуре в течение 20 мин, чтобы гидролизовать сложноэфирную связь, затем нейтрализуют с помощью 0,5 мл уксусной кислоты и доводят до нужного объема, добавив 25 мл 50%-ного водного ацетонитрила. В полученном растворе количество свободного 4-фенил-1-бутанола оценивают с помощью обращенной ЖХВР. Результат показывает, что количество связанного сложноэфирной связью 4-фенил-1-бутанола составляет 54% по отношению к m (количество структурных единиц полимеризованной аспарагиновой кислоты в структурных фрагментах полиаспарагиновой кислоты блок-сополимера) в общей формуле (1).
Когда блок-сополимер 1 исследуют методом анионообменной ЖХВР в описанных ниже условиях, детектируют пик с временем удерживания 17,4 мин.
Условия проведения измерений для анионообменной ЖХВР:
Колонка: TSKgel DEAE-5PW (изготовитель Tosoh Corporation)
Концентрация образца: 10 мг/мл
Инжектируемый объем: 20 мкл
Температура колонки: 40°С
Подвижные фазы
(А) 20 мМ буфера Tris-HCl (рН 8,0):ацетонитрил=80:20
(В) 20 мМ буфера Tris-HCl+1М водного раствора хлорид натрия (рН 8,0):ацетонитрил = 80:20
Скорость подачи: 1 мл/мин
Условия градиентного элюирования В% (мин): 10 (0), 10 (5), 100 (40), 10 (40,1), окончание (50,1).
Детектор: спектрофотометрический детектор в УФ-видимом диапазоне (длина волны детектирования 260 нм).
Блок-сополимер 1 растворяют в смешанном растворе дейтерированный гидроксид натрия (NaOD)-тяжелая вода (D2О)-дейтерированный ацетонитрил (CD3CN) и проводят измерения методом ЯМР, которые показывают, что частичная структура -N(i-Pr)-CO-NH(i-Pr) (т.е. структура -N(R6)-CO-NHR7 в общей формуле (1), где каждый из R6 и R7 означает изопропильную группу) составляет 6% относительно m.
К полученному выше блок-сополимеру 1 (47,37 г) добавляют 946 мл ДМФА и растворяют полимер при 35°С, к полученному раствору добавляют DMAP (7,23 г) и DIPCI (14,37 мл) и проводят реакцию при указанной температуре в течение 20 ч. К реакционной смеси добавляют 2,4 л этилацетата, а затем 7,1 л гексана, осадок отделяют фильтрованием и сушат при пониженном давлении, получая 44,89 г неочищенных кристаллов. Неочищенные кристаллы растворяют в 50%-ном водном ацетонитриле, пропускают через катионообменную смолу Dowex 50w8 (300 мл) и промывают 50%-ным водным ацетонитрилом. Элюент концентрируют при пониженном давлении и лиофилизуют, получая 43,54 г блок-сополимера 2 по настоящему изобретению.
Блок-сополимер 2 (27,6 мг) гидролизуют тем же самым способом, что и описанный ранее, и проводят измерения методом ЖХВР с обращенной фазой, которые показывают, что количество связанного сложноэфирной связью 4-фенил-1-бутанола составляет 49% по отношению к m.
Когда проводят изучение блок-сополимера 2 методом анионообменной ЖХВР в тех же условиях, что и приведенные ранее, никакого пика на колонке не обнаруживают.
Проводят исследование блок-сополимера 2 методом ЯМР в тех же самых условиях, что и описанные ранее, и определяют, что частичная структура -N(i-Pr)-CO-NH(i-Pr) составляет 14% по отношению к m.
Сравнительный пример 1. Получение блок-сополимера 3
200 мл ДМФА добавляют к PEG-pAsp-Ac (10,00 г), который получают по способу, описанному в JP-А-6-206815 (патентный документ 2), растворяют полимер при 35°С, к полученному раствору добавляют DMAP (2,20 г), 4-фенил-1-бутанол (3,47 мл) и DIPCI (3,70 мл) и дают прореагировать при указанной температуре в течение 20 ч. К реакционной среде добавляют 0,5 л этилацетата, а затем 1,5 л гексана, образовавшийся осадок собирают фильтрованием и сушат при пониженном давлении, получая 11,67 г неочищенных кристаллов. Неочищенные кристаллы растворяют в 50%-ном водном ацетонитриле, затем пропускают через катионообменную смолу Dowex 50w8 (100 мл) для удаления DMAP и т.д. и промывают 50%-ным водным ацетонитрилом. Элюент концентрируют при пониженном давлении и лиофилизуют, получая 11,35 г блок-сополимера 3.
Блок-сополимер 3 (29,7 мг) гидролизуют тем же самым способом, что и описанный в примере 1, и проводят измерения методом ЖХВР с обращенной фазой, которые показывают, что количество 4-фенил-1-бутанола, связанного сложноэфирной связью, составляет 49% по отношению к m.
Когда проводят изучение блок-сополимера 3 методом анионообменной ЖХВР в тех же условиях, что и приведенные в примере 1, детектируют пик с временем удерживания 13,8 мин.
Когда проводят исследование блок-сополимера 3 методом ЯМР в тех же самых условиях, что и описанные в примере 1, определяют, что частичная структура -N(i-Pr)-CO-NH(i-Pr) составляет 7% по отношению к m.
Пример 2. Получение блок-сополимера 5
PEG-pAsp-Ac (3,0 г), который получают по способу, описанному в JP-А-6-206815 (патентный документ 2), растворяют в ДМФА (120 мл), к полученному раствору добавляют бензилбромид (0,60 мл) и 1,8-диазабицикло[5.4.0]ундец-7-ен (0,75 мл) и проводят реакцию при температуре 35°С в течение 17 ч. Реакционную смесь по каплям добавляют к смеси растворителей (1,2 л), содержащей диизопропиловый эфир:этанол (4:1), образовавшийся осадок отделяют фильтрованием и сушат при пониженном давлении, получая 3,17 г неочищенных кристаллов. Неочищенные кристаллы растворяют в 30%-ном водном ацетонитриле, затем пропускают через катионообменную смолу Dowex 50w8 (40 мл) и промывают 30%-ным водным ацетонитрилом. Элюент концентрируют при пониженном давлении и лиофилизуют, получая 2,99 г блок-сополимера 4.
Блок-сополимер 4 (19,5 мг) гидролизуют тем же самым способом, что и описанный в примере 1, и проводят измерения методом ЖХВР с обращенной фазой, которые показывают, что количество бензилового спирта, связанного сложноэфирной связью, составляет 32% по отношению к m.
Когда проводят изучение блок-сополимера 4 методом анионообменной ЖХВР в тех же условиях, что и приведенные в примере 1, детектируют пик с временем удерживания 22,9 мин.
Когда проводят изучение блок-сополимера 4 методом ЯМР в тех же самых условиях, что и описанные в примере 1, частичная структура -N(i-Pr)-CO-NH(i-Pr) не обнаруживается.
К полученному блок-сополимеру 4 (300 мг) добавляют ДМФА (6 мл) и растворяют при 35°С, к полученному раствору добавляют DMAP (63,9 мг) и DIPCI (102 мкл) и проводят реакцию при той же температуре в течение 24 ч. К реакционной смеси добавляют 30 мл этилацетата, а затем 90 мл гексана, осадок отделяют фильтрованием и сушат при пониженном давлении, получая 299 мг неочищенных кристаллов. Неочищенные кристаллы растворяют в 50%-ном водном ацетонитриле, пропускают через катионообменную смолу Dowex 50w8 (15 мл) и промывают 50%-ным водным ацетонитрилом. Элюент концентрируют при пониженном давлении и лиофилизуют, получая 284 мг блок-сополимера 5 по настоящему изобретению.
Блок-сополимер 5 (19,8 мг) гидролизуют тем же самым способом, что и описанный в примере 1, и проводят измерения методом ЖХВР с обращенной фазой, которые показывают, что количество бензилового спирта, связанного сложноэфирной связью, составляет 21% по отношению к m.
Когда проводят изучение блок-сополимера 5 методом анионообменной ЖХВР в тех же условиях, что и приведенные в примере 1, никакого пика, который задерживается на колонке, не обнаруживают.
Когда проводят изучение блок-сополимера 5 методом ЯМР в тех же самых условиях, что и приведенные в примере 1, определяют, что частичная структура -N(i-Pr)-CO-NH(i-Pr) составляет 15% по отношению к m.
Пример 3. Получение блок-сополимера 7
ДМФА (30 мл) добавляют к PEG-pAsp-Ac (2,0 г), который получают по способу, описанному в JP-А-6-206815 (патентный документ 2) при 25°С, к полученному раствору добавляют DMAP (0,472 г), бензиловый спирт (499 мкл) и DIPCI (755 мкл) и проводят реакцию при той же температуре в течение 21 ч. К реакционной среде добавляют 75 мл этилацетата, а затем 255 мл гексана, образовавшийся осадок собирают фильтрованием и сушат при пониженном давлении, получая 2,28 г неочищенных кристаллов. Неочищенные кристаллы растворяют в 50%-ном водном ацетонитриле, затем пропускают через катионообменную смолу Dowex 50w8 (30 мл) и промывают 50%-ным водным ацетонитрилом. Элюент концентрируют при пониженном давлении и лиофилизуют, получая 2,10 г блок-сополимера 6.
Блок-сополимер 6 (35,5 мг) гидролизуют тем же самым способом, что и описанный в примере 1, и проводят измерения методом ЖХВР с обращенной фазой, которые показывают, что количество бензилового спирта, связанного сложноэфирной связью, составляет 60% по отношению к m.
Когда проводят изучение блок-сополимера 6 методом анионообменной ЖХВР в тех же условиях, что и приведенные в примере 1, детектируют пик с временем удерживания 17,2 мин.
Когда проводят измерения блок-сополимера 6 методом ЯМР в тех же самых условиях, что и приведенные в примере 1, определяют, что частичная структура -N(i-Pr)-CO-NH(i-Pr) составляет 5% по отношению к m.
К полученному выше блок-сополимеру 6 (300 мг) добавляют ДМФА (6 мл), при температуре 35°С добавляют DMAP (60,9 мг) и DIPCI (97,6 мкл) и проводят реакцию в течение 18 ч. К реакционной смеси добавляют 30 мл этилацетата, а затем 90 мл гексана, осадок отделяют фильтрованием и сушат при пониженном давлении, получая 290 мг неочищенных кристаллов. Неочищенные кристаллы растворяют в 50%-ном водном ацетонитриле, пропускают через катионообменную смолу Dowex 50w8 (5 мл) и промывают 50%-ным водным ацетонитрилом. Элюент концентрируют при пониженном давлении и лиофилизуют, получая 282,5 мг блок-сополимера 7 по настоящему изобретению.
Блок-сополимер 7 (36,1 мг) гидролизуют тем же самым способом, что и описанный в примере 1, и проводят измерения методом ЖХВР с обращенной фазой, которые показывают, что количество бензилового спирта, связанного сложноэфирной связью, составляет 37% по отношению к m.
Когда проводят изучение блок-сополимера 7 методом анионообменной ЖХВР в тех же условиях, что и приведенные в примере 1, никакого пика, который задерживается на колонке, не обнаруживают.
Когда проводят изучение блок-сополимера 7 методом ЯМР в тех же самых условиях, что и приведенные в примере 1, определяют, что частичная структура -N(i-Pr)-CO-NH(i-Pr) составляет 12% по отношению к m.
Результаты для блок-сополимеров, полученных в примерах 1-3 и в сравнительном примере 1, суммированы в таблице 1.
Как указано в таблице 1, процент сложноэфирной связи в блок-сополимерах 2, 5 и 7 меньше, чем в блок-сополимерах 1, 4 и 6, и при проведении измерений методом анионообменной ЖХВР указанные сополимеры не удерживаются в колонке. С другой стороны, блок-сополимер 3 (сравнительный пример 1) показывает пик, удерживаемый в колонке при проведении измерений методом анионообменной ЖХВР. Тот факт, что блок-сополимеры 2, 5 и 7 не удерживаются в колонке при проведении измерений в анионообменной ЖХВР, указывает на практически полное отсутствие в указанных сополимерах фрагментов карбоновой кислоты. Результаты измерений методом ЯМР показывают, что процент частичной структуры -N(i-Pr)-CO-NH(i-Pr) в блок-сополимерах 2, 5 и 7 выше, чем в блок-сополимерах 1, 4 и 6, а процент частичной структуры -N(i-Pr)-CO-NH(i-Pr) в блок-сополимере 2 в примере 1 на 7% выше, чем в сравнительном примере 1.
Пример 4. Получение мицеллярного препарата (лекарство: паклитаксель)
Взвешивают 300 г блок-сополимера 2 из примера 1 и помещают в пробирку с завинчивающейся пробкой, туда же добавляют 30 мл водного раствора, содержащего 40 мг/мл мальтозы и перемешивают для получения дисперсии, которую затем при перемешивании охлаждают до 4°С. В пробирку помещают 3 мл дихлорметанового раствора, содержащего 30 мг/мл паклитакселя, и перемешивают, не закрывая пробирку крышкой, в холодильнике в течение 16 ч, а затем подвергают воздействию ультразвука (130 Вт, 10 мин) и получают мицеллярный препарат. Концентрация паклитакселя составляет 2,2 мг/мл. Средний диаметр частиц, который определяют с помощью устройства измерения по рассеиванию света (изготовитель Particle Sizing System), составляет 57,8 нм.
Тестовый пример 1. Колебания массы тела мыши при введении блок-сополимера
Блок-сополимер 1 или блок-сополимер 2 растворяют в 5%-ном растворе глюкозы для инъекции, вводят самкам мышей CDF1 в хвостовую вену с дозой 333 мг/кг и определяют изменения массы тела в день 1 после введения. Что касается контрольной группы, то ей вводят такое же количество физиологического солевого раствора. Полученные результаты представлены в таблице 2.
Изменения массы тела мыши в день 1 после введения
Как видно из таблицы 2, масса тела в группе, которая получала блок-сополимер 1, понижается на 5% или больше в день 1 после введения, в то время как в группе, которая получала блок-сополимер 2, масса тела возросла по аналогии с группой, которая получала физиологический солевой раствор. Из полученного результата следует, что блок-сополимер по настоящему изобретению обладает пониженной токсичностью для мышей.
Тестовый пример 2. In vivo противоопухолевое действие на клетки Colon 26
Клетки Colon 26 рака толстой кишки мыши трансплантируют в спину самкам мышей CDF1 и после того, как объем опухоли достигнет приблизительно 100 мм3, мышам через хвостовую вену 3 раза с 4-дневными интервалами вводят мицеллярный препарат по примеру 4 или один лишь паклитаксель в качестве контрольного лекарства с целью исследования влияния инъекций на развившийся рак. Мицеллярный препарат разбавляют 5%-ным водным раствором глюкозы и получают раствор, содержащий паклитаксель с концентрацией 3 мг/мл. Паклитаксель, который вводят по схеме индивидуального лекарственного средства, растворяют в этаноле, смешивают с равным объемом Cremophor (изготовитель Sigma) с целью получения раствора, содержащего паклитаксель с концентрацией 30 мг/мл и полученный препарат непосредственно перед введением разбавляют физиологическим солевым раствором до концентрации 3 мг/мл. Противоопухолевое действие каждого из лекарств оценивают в процентах (Т/С%) как отношение величины среднего объема опухоли для группы, которой давали лекарство, на день 11 после введения к величине среднего объема опухоли для группы, которой не давали лекарство. Меньшие числовые значения указывают на больший эффект. Полученные результаты представлены в таблице 3.
Как видно из таблицы 3, группы, которым давали один лишь паклитаксель с дневными дозами 100 и 50 мг/кг, показывают в день 11 после введения объемы опухолей 52,6 и 81,6% соответственно по сравнению с группой, которая не получала лекарство, в то время как группы, которым давали мицеллярный препарат по настоящему изобретению с дневными дозами 100, 75 и 50 мг/кг, показывают объемы опухолей 8,4, 22,1 и 30,7% соответственно, указывая на то, что мицеллярный препарат по настоящему изобретению обладает высоким противоопухолевым действием.
Тестовый пример 3. Колебания титров паклитакселя в плазме и опухоли мыши
Каждое лекарство готовят тем же способом, что и в Тестовом примере 2 (in vivo противоопухолевое действие на клетки Colon 26). Мицеллярный препарат, содержащий паклитаксель, или один лишь паклитаксель, каждый с уровнем дозы 50 мг/кг, вводят через хвостовую вену самкам мышей CDF1, которым в спину трансплантировали клетки Colon 26 рака толстой кишки мыши, и через определенное время из подмышечной артерии берут цельную кровь. 0,01 мл плазмы, полученной центрифугированием, освобождают от белка (3 раза), добавляя 0,2 мл воды и 1 мл ацетонитрила, а затем подвергают экстракции типа жидкость/жидкость, добавив 2 мл трет-бутилметилового эфира. Органический слой отделяют, упаривают досуха, растворяют в 0,4 мл растворяющей жидкости для ЖХВР и методом ЖХВР определяют в ней концентрацию паклитакселя. Отдельно гомогенизуют опухоль с помощью 0,5%-ной уксусной кислоты и получают 1%-ный гомогенат опухоли, затем 0,1 мл 1%-ного гомогената опухоли освобождают от белка (3 раза), добавляя 0,1 мл воды и 1 мл ацетонитрила, и подвергают экстракции типа жидкость/жидкость, добавив 2 мл трет-бутилметилового эфира. Органический слой концентрируют и растворяют в 0,4 мл растворяющей жидкости для ЖХВР и методом ЖХВР определяют в ней концентрацию паклитакселя. Полученные результаты приведены в таблицах 4 и 5.
Концентрация паклитакселя в плазме мыши (мкг/мл)
Концентрация паклитакселя в опухоли мыши (мкг/мл)
Как видно из таблицы 4, мицеллярный препарат по настоящему изобретению поддерживает более высокие концентрации лекарства в плазме в течение более длительного времени, чем назначаемый один лишь паклитаксель.
Как видно из таблицы 5, концентрация паклитакселя в опухоли поддерживается на более высоком уровне в течение более длительного времени при введении мицеллярного препарата по настоящему изобретению, чем при введении одного лишь паклитакселя, указывая на то, что паклитаксель накапливается в опухоли с помощью мицеллярного препарата по настоящему изобретению.
Тестовый пример 4. Наблюдение за повреждением периферических нервов у мышей (рефлекс растяжения мышцы)
Мицеллярный препарат по настоящему изобретению или один лишь паклитаксель вводят через хвостовую вену самкам мышей CDF1 в течение 5 последовательных дней и наблюдают рефлекс растяжения мышцы задних конечностей в качестве индикатора вызванного паклитакселем повреждения периферических нервов. Каждое из лекарств готовят так же, как в тестовом примере 2 (in vivo противоопухолевое действие на клетки Colon 26). Доза составляет 30 мг/кг в пересчете на паклитаксель. Результаты представлены в таблице 6.
Наблюдение за повреждением периферических нервов у мышей (рефлекс растяжения мышцы)
Как следует из таблицы 6, в группе, которой вводили один лишь паклитаксель с дозой 30 мг/кг, обнаружена потеря рефлекса растяжения мышцы у каждой мыши. С другой стороны, в группе, которой вводили мицеллярный препарат с дозой 30 мг/кг, ни у одной из мышей не обнаружена потеря рефлекса растяжения мышцы. Мицеллярный препарат по настоящему изобретению по сравнению с паклитакселем, применяемым по схеме введения индивидуального лекарственного средства, снижает токсичность по отношению к периферическим нервам, которая является побочным действием паклитакселя.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БЛОК-СОПОЛИМЕРА | 2012 |
|
RU2623426C2 |
| МИЦЕЛЛЯРНЫЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ МАЛОРАСТВОРИМЫЙ В ВОДЕ ПРОТИВОРАКОВЫЙ АГЕНТ, СОДЕРЖАЩЕЕ ЕГО ПРОТИВОРАКОВОЕ СРЕДСТВО И НОВЫЙ БЛОК-СОПОЛИМЕР | 2004 |
|
RU2324701C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ 8-ГЕТЕРОАРИЛКСАНТИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2004 |
|
RU2357969C2 |
| ВЫСОКОМОЛЕКУЛЯРНЫЙ КОНЪЮГАТ ПОДОФИЛЛОТОКСИНОВ | 2007 |
|
RU2447095C2 |
| НОВЫЕ ЦИКЛОАЛКИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕЗОРБЦИИ КОСТИ И АНТАГОНИСТОВ РЕЦЕПТОРА ВИТРОНЕКТИНА | 1997 |
|
RU2180331C2 |
| СТИМУЛИРУЮЩАЯ ИММУННУЮ СИСТЕМУ МИЦЕЛЛЯРНАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2832220C1 |
| НОСИТЕЛЬ ДЛЯ КАТАЛИЗАТОРА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ПОЛИМЕРИЗАЦИИ ОЛЕФИНА, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2804799C2 |
| ПИРИДИЛДИАМИДНЫЕ КОМПЛЕКСЫ ПЕРЕХОДНЫХ МЕТАЛЛОВ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2009 |
|
RU2514405C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРИРОВАННОГО НИТРИЛЬНОГО КАУЧУКА, ОБЛАДАЮЩЕГО НИЗКОЙ МОЛЕКУЛЯРНОЙ МАССОЙ | 2010 |
|
RU2548681C9 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПУРИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1997 |
|
RU2228335C2 |
Изобретение относится к получению блок-сополимера и его использованию в лекарственных средствах, в частности противораковых. Блок-сополимер получают взаимодействием соединения, содержащего структурный фрагмент полиэтиленгликоля и структурный фрагмент полиаминокислоты, в растворителе при температуре от 30 до 60°С в течение 2-48 час. Полученный блок-сополимер используют в качестве носителя для противоракового лекарственного средства на основе такстана, в частности паклитакселя, в мицелярном препарате в количестве, необходимом для лечения заболевания. Обеспечивается отсутствие аллергической реакции, повышение растворимости труднорастворимого в воде противоракового средства, поддерживание высокой концентрации лекарства в крови, накапливание больших концентраций лекарства в опухолевой ткани, усиление фармакологического действия и снижение побочных эффектов. 5 н. и 8 з.п. ф-лы, 6 табл.
1. Блок-сополимер, полученный взаимодействием соединения, представленного общей формулой (1):

где R1 означает атом водорода или (С1-С5)алкильную группу, R2 означает (С1-С5)алкиленовую группу, R3 означает метиленовую группу или этиленовую группу, R4 означает атом водорода или (С1-С4)ацильную группу, R5 означает гидроксильную группу, необязательно замещенную арил(С1-С8)алкоксигруппу или группу -N(R6)-CO-NHR7, где R6 или R7 могут быть одинаковыми или различными и каждый из них означает (С3-С6)циклическую алкильную группу или (С1-С5)алкильную группу, необязательно замещенную третичной аминогруппой, n составляет от 5 до 1000, m составляет от 2 до 300, х составляет от 0 до 300 и у составляет от 0 до 300, при условии, что сумма х и у составляет от 1 или более до m или меньшей чем m величины, и R5 означает гидроксильную группу с отношением 1-99% к m, с необязательно замещенной арил(С1-С8)алкоксигруппой с отношением 1-99% к m и группой -N(R6)-CO-NHR7 с отношением 0-10% к m, с производным карбодиимида в количестве от m до 5m эквивалентов по отношению к соединению, представленному общей формулой (1), в растворителе при температуре от 30 до 60°С в течение 2-48 ч.
2. Блок-сополимер, полученный взаимодействием соединения, представленного общей формулой (2):
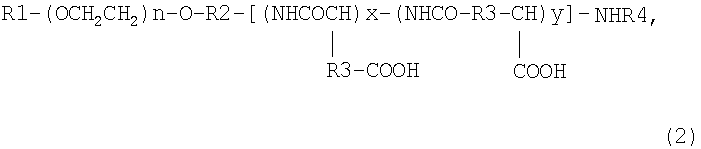
где R1 означает атом водорода или (С1-С5)алкильную группу, R2 означает (С1-С5)алкиленовую группу, R3 означает метиленовую группу или этиленовую группу, R4 означает атом водорода или (С1-С4)ацильную группу, n составляет от 5 до 1000, х составляет от 0 до 300 и у составляет от 0 до 300, при условии, что сумма х и у составляет от 2 до 300, с необязательно замещенным арил(С1-С8)алкилспиртом или необязательно замещенным арил(С1-С8)алкилгалогенидом с получением продукта, который частично этерифицирован по карбоксильным группам в боковых цепях,
с последующим взаимодействием продукта с производным карбодиимида в количестве от (х+у) до 5(х+у) эквивалентов по отношению к соединению, представленному общей формулой (2), в растворителе при температуре от 30 до 60°С в течение 2-48 ч.
3. Блок-сополимер по п.1 или 2, в котором R1 означает метальную группу, R2 означает триметиленовую группу, R3 означает метиленовую группу, R4 является ацетильной группой, n составляет от 20 до 500, m составляет от 10 до 100, х составляет от 0 до 100 и у составляет от 0 до 100.
4. Блок-сополимер по п.1 или 2, в котором производным карбодиимида является диэтилкарбодиимид, диизопропилкарбодиимид, дициклогексил-карбодиимид или 1-этил-3-(3-диметиламинопропил)карбодиимид или их неорганическая соль.
5. Блок-сополимер по п.1 или 2, в котором производным карбодиимида является диизопропилкарбодиимид.
6. Блок-сополимер, представленный общей формулой (3):
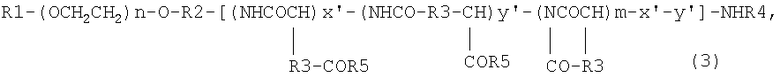
где R1 означает атом водорода или (С1-С5)алкильную группу, R2 означает (С1-С5)алкиленовую группу, R3 означает метиленовую группу или этиленовую группу, R4 означает атом водорода или (С1-С4)ацильную группу, R5 означает гидроксильную группу, необязательно замещенную арил(С1-С8)алкоксигруппу или группу -N(R6)-CO-NHR7, где R6 или R7 могут быть одинаковыми или различными и каждый из них означает (С3-С6)циклическую алкильную группу или (С1-С5)алкильную группу, необязательно замещенную третичной аминогруппой, n составляет от 5 до 1000, m составляет от 2 до 300, х' составляет от 0 до 300 и у' составляет от 0 до 300, при условии, что сумма х' и у' составляет от 1 или более до m или меньшей чем m величины, и R5 означает гидроксильную группу с отношением 0-88% к m, с необязательно замещенной арил(С1-С8)алкоксигруппой с отношением 1-89% к m и группу -N(R6)-CO-NHR7 с отношением 11-30% к m.
7. Блок-сополимер по п.6, в котором R1 означает метильную группу, R2 означает триметиленовую группу, R3 означает метиленовую группу, R4 является ацетильной группой, необязательно замещенная арил(С1-С8)алкоксигруппа, обозначенная как R5, представляет собой бензилоксигруппу или 4-фенил-1-бутоксигруппу, каждый R6 и R7 означает изопропильную группу, n составляет от 20 до 500, m составляет от 10 до 100, х' составляет от 0 до 100 и у' составляет от 0 до 100.
8. Блок-сополимер по п.6 или 7, в котором R5 означает гидроксильную группу с отношением 0-75% к m, необязательно замещенную арил(С1-С8)алкоксигруппу с отношением 10-80% к m и группу -N(R6)-CO-NHR7 с отношением 11-30% к m.
9. Блок-сополимер по п.8, в котором R5 означает гидроксильную группу с отношением 0% к m.
10. Мицеллярный препарат, полученный из блок-сополимера по любому из пп.1-9 и трудно растворимого в воде противоракового агента.
11. Мицеллярный препарат по п.10, в котором трудно растворимым в воде противораковым агентом является противораковый агент на основе таксана.
12. Мицеллярный препарат по п.11, в котором противораковым агентом на основе таксана является паклитаксель.
13. Противораковое средство, включающее мицеллярный препарат по любому из пп.10-12 в качестве активного ингредиента.
| WO 03000771 A1, 03.01.2003 | |||
| JP 6206832 A, 26.07.1994 | |||
| УСТРОЙСТВО СЕЛЕКЦИИ МИНИМАЛЬНОГО ИЗ ДВУХ ДВОИЧНЫХ ЧИСЕЛ | 2005 |
|
RU2300133C1 |
| МИКРОШАРИКИ МИКРОННОГО ИЛИ СУБМИКРОННОГО РАЗМЕРА С ПОЛИМЕРНОЙ ОБОЛОЧКОЙ И СПОСОБ ИХ ИЗГОТОВЛЕНИЯ | 1991 |
|
RU2110991C1 |
Авторы
Даты
2009-12-10—Публикация
2005-09-16—Подача