Группа заявляемых изобретений относится к биотехнологии, в частности к производству н-бутанола путем ферментации углеводосодержащего сырья микроорганизмами, и представляет собой рекомбинантные плазмидные ДНК, включающие гены синтеза бутанола из Clostridium acetobutylicum (С.acetobutylicum), рекомбинантные штаммы бактерий Lactobacillus brevis (L. brevis), содержащие эти плазмиды и сочетающие способность синтезировать н-бутанол с устойчивостью к его повышенным концентрациям, а также способ микробиологического синтеза н-бутанола.
н-Бутанол (бутанол) - четырехуглеродный спирт, широко используемый в различных отраслях промышленности. Он применяется для производства красок, нитроэмалей, пластификаторов, бутилацетата, фенолоформальдегидных смол и присадок к смазочным маслам, используется в качестве растворителя, является экстрагентом для жиров. Благодаря высокому содержанию энергии, низкой летучести, хорошей смешиваемости, высокому октановому числу бутанол рассматривают в качестве перспективного топлива в двигателях внутреннего сгорания.
В промышленности бутанол получают химическим синтезом из пропилена или ацетальдегида, а также путем ферментации углеводосодержащего сырья бактериями рода Clostridium.
Получение бутанола и ацетона с помощью анаэробных бактерий Clostridium acetobutylicum, разработанное Вайцманом в первой половине XX века [1], стало к середине века одним из крупнейших биотехнологических процессов. В настоящее время производство бутанола ферментативным путем с использованием существующих промышленных штаммов бактерий рода Clostridium экономически невыгодно. Одной из главных причин этого является невысокая производительность штаммов, обусловленная их чувствительностью к конечному продукту ферментации - бутанолу.
В источниках информации имеются сведения об устойчивых к бутанолу микроорганизмах, представляющих собой природные, либо полученные методами селекции или генной инженерии штаммы. Это бутанол-устойчивые штаммы клостридий, лактобацилл, энтеробактерий [2, 3, 4, 5, 6, 7, 8, 9, 10, 11]. Во всех перечисленных случаях штаммы устойчивы к концентрации бутанола в среде, не превышающей 2,5 мас.%. Среди них нет штаммов, синтезирующих бутанол за счет гетерологичной экспрессии генов метаболического пути синтеза бутанола из других организмов. У природных штаммов Clostridium уровень синтеза бутанола не превышает 1,5 мас.%, после чего происходит ингибирование дальнейшего синтеза конечным продуктом - бутанолом. Штаммы, уровень устойчивости которых к бутанолу не превышает 1,5 мас.%, считают чувствительными к бутанолу.
Ближайшим аналогом заявляемых штаммов является штамм Lactobacillus plantarum PN 0512 [8], который не синтезирует бутанол, но устойчив к концентрации 2 мас.% бутанола в жидкой среде.
Известны способы микробиологического синтеза бутанола с использованием рекомбинантных штаммов-продуцентов бутанола, полученных на основе бактерий Escherichia coli (E.coli.).
Гены тиолазы (thiL), альдегид-алкоголь дегидрогеназы (adhe) и bcs-oпepoна (кротоназы (crt), бутирил-СоА-дегидрогеназы (bcd), субъединиц флавопротеина ETF (etfB и etfA), 3-гидроксибутирил-СоА-дегидрогеназы (hbd)) из С.acetobutylicum клонированы в E.coli с использованием экспрессионного вектора рКК223-3 под контролем конституитивного tac-промотора (Ptac) [12]. Максимальный уровень синтеза бутанола-1200 мг/л, достигают путем анаэробной 60-часовой инкубации предварительно выращенной и сконцентрированной до плотности 20 ОЕ клеточной биомассы в ферментационной среде, содержащей глюкозу. Пределы устойчивости к бутанолу в данной работе не исследованы.
В другой работе [13] гены из С.acetobutylicum, существенные для синтеза бутанола, клонированы и экспрессированы в E.coli с использованием совместимых плазмидных векторов pZE12-luc [14] и pACYC184 (New England Biolabs). Сконструированная на основе вектора pZE12-luc плазмида pJCL50 содержит гены тиолазы и алкоголь-альдегид дегидрогеназы под контролем ИПТГ-индуцибельного промотора PLlacO1 бактериальный участок инициации репликации для E. coli ColEl и ген устойчивости к ампициллину. Сконструированная на основе вектора pACYC184 плазмида pJCL60 содержит гены кротоназы, бутирил-КоА-дегидрогеназы, субъединиц флавопротеина ETF и гидроксибутирил-КоА-дегидрогеназы под контролем ИПТГ-индуцибельного промотора PLlacO1 бактериальный участок инициации репликации для E.coli р15А и гены устойчивости к тетрациклину и хлорамфениколу. Благодаря совместимости ColEl и р15А, плазмиды pJCL50 и pJCL60 сосуществуют в клетках Е. coli и обеспечивают синтез бутанола. Плазмида pJCL60 является ближайшим аналогом заявляемых плазмид, но она способна реплицироваться только в E.coli.
Ближайшим аналогом заявляемого способа является способ микробиологического синтеза бутанола с использованием рекомбинантного штамма Е. coli JCL198, трансформированного плазмидами pJCL50 и pJCL60 (т.е. содержащего гены тиолазы, алкоголь-альдегид дегидрогеназы, кротоназы, бутирил-КоА-дегидрогеназы, субъединиц флавопротеина ETF и гидроксибутирил-КоА-дегидрогеназы из С.acetobutylicum, ответственные за синтез бутанола) и выращенного в микроаэрофильных условиях на среде, содержащей глюкозу. Уровень синтеза бутанола в этом случае не превышает 20 мг/л. Предел устойчивости штамма Е. coli JCL198 к бутанолу - 1,5% [13].
Более высокий уровень синтеза бутанола (552 мг/л) получен с использованием рекомбинантного штамма Е. coli JCL187, трансформированного плазмидами pJCL60 и pJCL17 (производная плазмиды pJCL50, в которой ген тиолазы из С.acetobutylicum замещен на ген atoQ, кодирующий тиолазу в Е. coli) и дополнительно содержащего делеции собственных генов альдегид-алкоголь дегидрогеназы (adhE), лактат дегидрогеназы (ldhA), фумарат редуктазы (frdBC), анаэробного репрессора пируват декарбоксилазы (fnr) и фосфотрансацетилазы (pta). В качестве субстрата для ферментации использован глицерин [13].
Задача заявляемой группы изобретений состоит в разработке способа микробиологического синтеза бутанола на основе рекомбинантных бактерий, совмещающих способность синтезировать бутанол с устойчивостью к его повышенным концентрациям.
Задачу решают путем:
- конструирования рекомбинантной плазмидной ДНК (плазмиды) pBCS, способной реплицироваться как в грамотрицательных (E.coli), так и в грамположительных (L.brevis) бактериях и содержащей гены биосинтеза бутанола (crt, bcd, et/fB, etfA и hbd) из С.acetobutylicum, контролируемые их собственными регуляторными элементами;
- конструирования рекомбинантной плазмидной ДНК (плазмиды) pTHL-BCS, способной реплицироваться как в грамотрицательных (E.coli), так и в грамположительных (L.brevis) бактериях и содержащей гены биосинтеза бутанола (thl, crt, bcd, etfB, etfA и hbd) из С.acetobutylicum, контролируемые их собственными регуляторными элементами;
- конструирования рекомбинантного штамма бактерий L.brevis ВКПМ 5563/pBCS, способного синтезировать бутанол и устойчивого к его концентрации 2,0 мас.% в жидкой среде;
- конструирования рекомбинантного штамма бактерий L.brevis ВКПМ 5563/pTHL-BCS, способного синтезировать бутанол и устойчивого к его концентрации 2,8 мас.% в жидкой среде;
- разработки способа микробиологического синтеза бутанола на основе рекомбинантных бактерий L.brevis, совмещающих способность синтезировать бутанол с устойчивостью к его концентрациям в жидкой среде не менее 2,0 мас.%.
Процесс получения заявляемых штаммов состоит из несколько этапов.
Этап 1. Конструирование рекомбинантных плазмидных ДНК pBCS и pTHL-BCS, содержащих гены из С.acetobutylicum, ответственные за синтез бутанола.
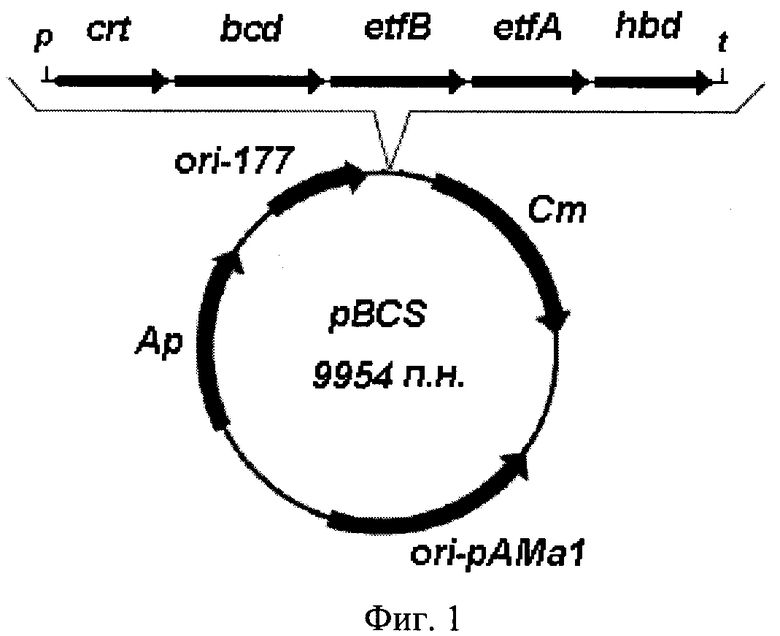
Плазмиду pBCS конструируют на основе шаттл-вектора pHYc, способного реплицироваться в широком круге грамположительных и грамотрицательных бактерий [15]. Вектор pHYc содержит ген bla, обеспечивающий устойчивость штаммов Е. coli к ампициллину; ген cmr, обеспечивающий устойчивость лактобацилл к хлорамфениколу; участки инициации репликации для грамотрицательных (ori-177) и грамположительных (ori-pAMal) бактерий.
Плазмида pBCS наряду с генами вектора pHYc содержит промотор, кодирующую область и терминатор транскрипции bcs-оперона из С.acetobutylicum. Кодирующая область bcs-оперона включает следующие гены, ответственные за синтез бутанола: кротоназы (crt), бутирил-СоА-дегидрогеназы (bcd), субъединиц флавопротеина ETF (etfB и etfA) и 3-гидроксибутирил-СоА-дегидрогеназы (hbd).
Плазмида pTHL-BCS сконструирована на основе плазмиды pBCS и содержит помимо ранее перечисленных генов ген тиолазы (thl) из С.acetobutylicum.
Этап 2. Трансформация плазмидами pBCS или pTHL-BCS штамма-реципиента.
В качестве штамма-реципиента выбран штамм ВКПМ 5563, относящийся к виду бактерий L. brevis, природные представители этого вида не синтезируют бутанол, но способны синтезировать другой спирт - этанол. В отличие от остальных лактобацилл бактерии L.brevis способны утилизировать не только глюкозу, но и ксилозу, то есть имеют более широкий спектр ферментируемых субстратов [16].
Процесс трансформации осуществляют методом электропорации [16]. В результате получают рекомбинантные штаммы L.brevis ВКПМ 5563/pBCS и L.brevis ВКПМ 5563/pTHL-BCS, способные синтезировать бутанол.
Этап 3. Адаптация штаммов L.brevis к повышенным концентрациям бутанола.
Штаммы L. brevis адаптируют к повышенным концентрациям бутанола путем ряда последовательных пересевов с постепенным увеличением концентрации бутанола в среде.
Клетки выращивают в течение 2-3 дней при 25°С на среде MRS следующего состава, мас.%:
дополнительно содержащей бутанол. Начальная концентрация бутанола в среде - 0,4 мас.%. С каждым последующим пересевом концентрацию бутанола увеличивают на 0,4 мас.%.
В результате проведения работы в соответствии с перечисленными этапами получены два устойчивых к бутанолу штамма, каждый из которых содержит один из двух наборов генов биосинтеза бутанола из С.acetobutylicum:
L.brevis ВКПМ 5563/pBCS депонирован во Всероссийской коллекции промышленных микроорганизмов как Lactobacillus brevis ВКПМ В-10044;
L.brevis ВКПМ 5563/pTHL-BCS депонирован во Всероссийской коллекции промышленных микроорганизмов как Lactobacillus brevis ВКПМ В-10043.
Заявляемые штаммы ВКПМ В-10043 и ВКПМ В-10044 имеют общие морфологические и физиолого-биохимические признаки, но различаются генотипически.
Морфологические признаки.
Клетки прямые, палочковидные, подвижные, грамположительные, неспорообразующие. При выращивании в течение 24-72 час при температуре 25-30°С на агаризованных средах (MRS, MSS и молочной) колонии шероховатые, круглые, матовые, творожисто-белые, край неровный.
Состав среды MSS, мас.%:
Состав молочной среды, мас.%:
Физиолого-биохимические признаки
Оба штамма растут при температуре от 20 до 40°С (оптимум 30°С, рН 4.0-6.0) В качестве источника углерода утилизируют глюкозу, фруктозу, ксилозу и арабинозу. Плохо растут на мальтозе и галактозе. Не усваивают сахарозу и целлобиозу. В качестве источника азота используют минеральный азот в аммонийной форме, а также органический азот в виде пептона, аминокислот.
Принадлежность заявляемых штаммов к виду L.brevis подтверждена на основе анализа нуклеотидной последовательности 16S рДНК.
Штамм L.brevis ВКПМ В-10044 синтезирует бутанол и устойчив к концентрациям бутанола 2,0 мас.% в жидкой среде.
Штамм L.brevis ВКПМ В-10043 синтезирует бутанол и устойчив к концентрациям бутанола 2,8 мас.% в жидкой среде.
Генотипические признаки
Оба штамма устойчивы к хлорамфениколу и канамицину.
Штамм L.brevis ВКПМ В-10044 содержит на плазмиде pBCS гены биосинтеза бутанола (crt, bсd, etfB, etfA и hbd) из С.acetobutylicum
Штамм L.brevis ВКПМ В-10043 содержит на плазмиде pTHL-BCS гены биосинтеза бутанола (thl, crt, bcd, etfB, etfA и hbd) из С.acetobutylicum.
Способ в общем виде
Посевной материал, представляющий собой клетки рекомбинантного штамма-продуцента, подготавливают путем инкубации в течение 24-48 час при температуре 20-30°С на среде MRS, содержащей 10 мг/мл хлорамфеникола и 12,5 мг/мл канамицина. Затем выросшую культуру переносят в соотношении 1:50 (по объему) в модифицированную среду MRS, содержащую 4% глюкозы, 10 мг/мл хлорамфеникола и 12,5 мг/мл канамицина.
Процесс культивирования ведут в 50 мл флаконах в течение 24-48 час при температуре 20-30°С, в микроаэрофильных условиях, которые достигают за счет заполнения флаконов доверху средой. Количество синтезированного бутанола определяют методом газовой хроматографии в пробах, отобранных из культуральной жидкости после удаления клеток центрифугированием при 5000g. Уровень синтеза бутанола заявляемым способом достигает 300 мг/л, что в 10-15 раз превышает таковой у ближайшего аналога.
Изобретение проиллюстрировано следующими фигурами графических изображений.
Фиг.1. Схема рекомбинантной плазмидной ДНК pBCS.
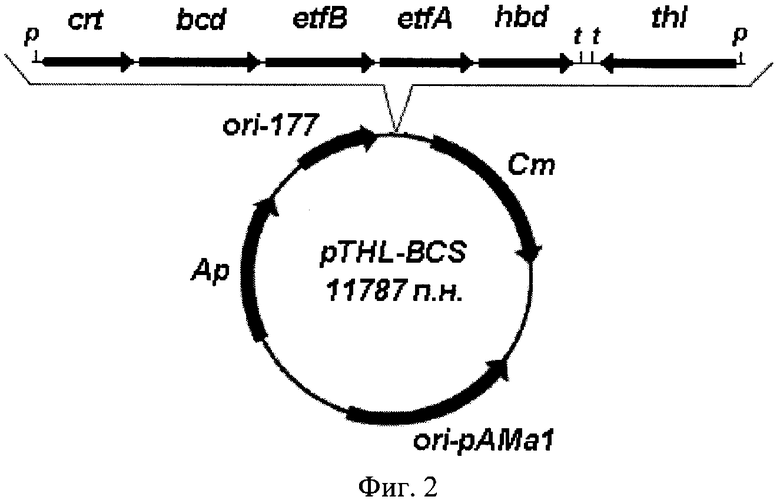
Фиг.2. Схема рекомбинантной плазмидной ДНК pTHL-BCS.
Изобретение подтверждено следующими примерами.
Пример 1. Клонирование генов бактерий С.acetobutylicum, ответственных за синтез бутанола
В синтезе бутанола бактериями С.acetobutylicum принимают участие следующие ферменты:
1. Тиолаза катализирует превращение двух молекул ацетил-КоА в ацетоацетил-КоА и КоА.
2. 3-Гидроксибутирил-КоА-дегидрогеназа катализирует превращение ацетоацетил-КоА в 3-гидроксибутирил-КоА с использованием NADH (NADH-никотинамидадениндинуклеотид, восстановленная форма) в качестве кофактора.
3. Кротоназа катализирует превращение 3-гидроксибутирил-КоА в кротонил-КоА с высвобождением Н2О.
4. Бутирил-КоА дегидрогеназа с помощью состоящего из двух субъединиц белка электронного транспорта ETF катализирует превращение кротонил-КоА в бутирил-КоА.
5. Бутиральдегид дегидрогеназа осуществляет превращение бутирил-КоА в бутиральдегид и КоА, реакция является NADH-зависимой.
6. Бутанол дегидрогеназа катализирует превращение бутиральдегида в бутанол с использованием NADH в качестве кофактора.
Гены C.acetobutylicum, кодирующие кротоназу, бутирил-КоА-дегидрогеназу, субъединицы флавопротеина ETF и 3-гидроксибутирил-КоА-дегидрогеназу организованы в bcs-оперон.
Праймеры для амплификации генов тиолазы и bcs-оперона конструируют на основе анализа полного генома С.acetobutylicum ATCC 824 (Табл.1).
Таблица 1
Последовательности праймеров для амплификации генов тиолазы и bcs-оперона из С.acetobutylicum.
Bcs_rev
AGCCGAGATTAGTACGGTAATG
Thl_rev
TTAGCCTCATAATCTTTCAAATG
Все стандартные генно-инженерные и микробиологические манипуляции проводят по известным методикам [17, 18,19].
Штамм С.acetobutylicum 7 (Прикладная биохимия и микробиология. 2008. Т. 44, №1, с.49-55) получен из музея Московского государственного университета. Штамм хранят и поддерживают путем периодического пересева в среде MSS.
Среду MSS с внесенным посевным материалом штамма С.acetobutylicum 7 в соотношении 50:1 (по объему) пастеризуют в водяной бане в течение 20 мин при 80°С и инкубируют анаэробно при 37°С в течение 24 час. Клетки отделяют центрифугированием при 5000g. Из полученной биомассы выделяют геномную ДНК.
Гены тиолазы и bcs оперона амплифицируют с использованием специфических праймеров (табл.1), геномной ДНК С.acetobutylicum 7 и KOD - полимеразы повышенной точности (Novagen). В результате получают ПЦР-фрагменты: THL, содержащий ген тиолазы и на 99% гомологичный фрагменту полного генома С.acetobutylicum ATCC 824, расположенному между 3005706 и 3007561 п.н. и BCS, содержащий гены bcs-оперона и на 99% гомологичный фрагменту полного генома С.acetobutylicum ATCC 824, расположенному между 2831629 и 2836638 п.н. (http://www.ncbi.nlm.nih.gov). Полученные ПЦР-фрагменты клонируют в ТОРО-вектор (Invitrogen). Правильность клонирования подтверждают секвенированием каждой из рекомбинантных вставок. В конечном итоге получают рекомбинантные плазмиды: pTOPO-THL, содержащую ген тиолазы, и рТОРО-BCS, содержащую гены bcs оперона. Активности ферментов синтеза бутанола определяют общепринятыми методами [20, 21, 22]. Уровни удельной активности нативных ферментов, ответственных за синтез бутанола у С.acetobutylicum, и соответствующих ферментов у рекомбинантных штаммов E.coli подтверждают экспрессию генов из C.acetobutylicum в E.coli (Табл.2).
Таблица 2
Удельная активность (Ед/мг белка, мин) нативных ферментов, ответственных за синтез бутанола у C.acetobutylicum, и соответствующих ферментов у рекомбинантных штаммов
дрогеназа
Пример 2. Конструирование рекомбинантной плазмидной ДНК pBCS
С целью экспрессии генов синтеза бутанола из бактерий C.acetobutylicum в бактериях L.brevis конструируют плазмиду pBCS (содержит bcs-оперон) на основе шаттл-вектора pHYc.
Вектор pHYc и плазмиду pTOPO-BCS (пример 1) обрабатывают рестриктазами BamHI и XbaI. Фрагмент плазмиды pTOPO-BCS, содержащий bcs-оперон, лигируют с более крупным XbaI/BamHI фрагментом вектора pHYc, полученной лигазной смесью трансформируют клетки E.coli. В результате получают рекомбинантный штамм Е. coli/pBCS, содержащий плазмиду pBCS. Первичную структуру плазмиды pBCS подтверждают секвенированием. Штамм Е. coli/pBCS не синтезирует бутанол, несмотря на активность ферментов bсs-оперона.
Рекомбинантная плазмидная ДНК pBCS (SEQ ID NO 1) имеет размер 9954 пары нуклеотидов (п.н.) и содержит гены биосинтеза бутанола (crt, bcd, etfB, etfA и hbd) из С.acetobutylicum, регулируемые их собственными промотором (р) и терминатором (t); ген bla, обеспечивающий устойчивость Е. coli к ампициллину (Ар); ген cmr, обеспечивающий устойчивость L.brevis к хлорамфениколу (Cm); участки инициации репликации для грамотрицательных (ori-177) и грамположительных (ori-pAMa1) бактерий (фиг.1).
Пример 3. Конструирование рекомбинантной плазмидной ДНК pTHL-BCS
С целью экспрессии расширенного набора генов синтеза бутанола из бактерий C.acetobutylicum в бактериях L.brevis на основе шаттл-вектора pHYc конструируют плазмиду pTHL-BCS, содержащую bcs-оперон и ген тиолазы.
Плазмиду pTOPO-THL (пример 1) обрабатывают рестриктазой EcoRI. Фрагмент ДНК, содержащий ген тиолазы, обрабатывают фрагментом Кленова и лигируют с плазмидой pBCS, предварительно линеаризованной по сайту рестриктазы SmaI. Лигазной смесью трансформируют клетки E.coli. В результате получают рекомбинантный штамм Е. coli/pTHL-BCS, содержащий плазмиду pTHL-BCS и синтезирующий бутанол в количестве 10 мг/л. Первичную структуру плазмиды pTHL-BCS подтверждают секвенированием.
Рекомбинантная плазмидная ДНК pTHL-BCS (SEQ ID NO 2) имеет размер 11787 п.н. и содержит гены биосинтеза бутанола (crt, bcd, etfB, etfA и hbd) из С.acetobutylicum, регулируемые их собственными промотором (р) и терминатором (t); ген тиолазы из С acetobutylicum, регулируемый собственными промотором (р) и терминатором (t); ген bla, обеспечивающий устойчивость Е. coli к ампициллину (Ар); ген cmr, обеспечивающий устойчивость L.brevis к хлорамфениколу (Cm); участки инициации репликации для грамотрицательных (ori-177) и грамположительных (ori-pAMal)
бактерий (фиг.2).
Пример 4. Получение заявляемого штамма L.brevis ВКПМ В-10044
Штамм L.brevis ВКПМ 5563 (не синтезирующий бутанол) получен из Всероссийской коллекции промышленных микроорганизмов. Чувствительность штамма ВКПМ 5563 к действию хлорамфеникола в концентрациях, превышающих 5 мг/л, и устойчивость к действию канамицина в концентрациях, не превышающих 15 мг/л, установлены с помощью тестирования на MRS-агаре, содержащем соответствующие антибиотики.
С целью получения рекомбинантного штамма клетки L.brevis ВКПМ 5563 трансформируют плазмидой pBCS методом электропорации. Селекцию трансформантов проводят на MRS-агаре, содержащем одновременно хлорамфеникол (10 мг/л) и канамицин (12,5 мг/л). Наличие плазмиды подтверждают методом полимеразной цепной реакции. Затем рекомбинантный штамм L.brevis ВКПМ 5563/pBCS модифицируют путем адаптации к повышенным концентрациям бутанола в среде. В результате получают заявляемый штамм L.brevis ВКПМ В-10044, способный синтезировать бутанол (примеры 6,7) и устойчивый к концентрации 2 мас.% бутанола в жидкой среде, что соответствует уровню устойчивости к бутанолу ближайшего аналога.
Пример 5. Получение заявляемого штамма L.brevis ВКПМ В-10043
Получение штамма осуществляют, как в примере 4, но вместо плазмиды pBCS используют плазмиду pTHL-BCS. В результате трансформации с последующей модификацией получают заявляемый штамм L.brevis ВКПМ В-10043, способный синтезировать бутанол (пример 8) и устойчивый к концентрации 2,8 мас.% бутанола в жидкой среде, что в 1,4 раза превышает уровень устойчивости к бутанолу ближайшего аналога.
Пример 6. Синтез бутанола с использованием штамма L.brevis ВКПМ В-10044 на среде с глюкозой
Посевной материал выращивают путем инкубации клеток штамма L.brevis ВКПМ В-10044 при температуре 25°С в течение 48 час на среде MRS, содержащей 10 мг/мл хлорамфеникола и 12,5 мг/мл канамицина.
Модифицированную среду MRS, содержащую 4% глюкозы, 10 мг/мл хлорамфеникола и 12,5 мг/мл канамицина, засевают подготовленным посевным материалом и ведут процесс ферментации в микроаэрофильных условиях, в течение 48 час при температуре 25°С. Уровень синтеза бутанола составляет 300 мг/л.
Пример 7. Синтез бутанола с использованием штамма L.brevis ВКПМ В-10044 на среде с ксилозой
Процесс ведут, как в примере 6, но с использованием модифицированной среды MRS, содержащей 4% ксилозы. Уровень синтеза бутанола составляет 100 мг/л.
Пример 8. Синтез бутанола с использованием штамма L.brevis ВКПМ В-10043 на среде с глюкозой
Процесс ведут, как в примере 6, но с использованием штамма L.brevis ВКПМ В-10043.
Уровень синтеза бутанола на среде MRS, содержащей 4% глюкозы, составляет 200 мг/л.
Таким образом, в заявляемых результатах впервые продемонстрирована возможность получения бактерий Lactobacillus brevis, синтезирующих бутанол, устойчивых к его повышенным концентрациям, а в средах для культивирования в качестве источников углерода использующих как глюкозу, так и ксилозу.
Штаммы L. brevis/pBCS и L. brevis/pTHL-BCS получены путем комбинации генно-инженерных и адаптационных методов. Для синтеза бутанола бактериями L.brevis достаточно экспрессии следующего набора генов из C.acetobutylicum: crt (кротоназы), bcd (бутирил-СоА-дегидрогеназы), etfA, etfB (субъединиц флавопротеина ETF) и hbd(3-гидроксибутирил-СоА-дегидрогеназы). Вероятно, в этом случае часть реакций биосинтеза бутанола (синтез бутиральдегида и бутанола) выполняется за счет собственных ферментов клетки-хозяина. Экспрессия гена тиолазы в штамме L. brevis/pTHL-BCS наряду с вышеперечисленными генами не приводит к повышению уровня синтеза бутанола.
Уровень синтеза бутанола у заявляемых рекомбинантных штаммов лактобацилл значительно превосходит таковой у ближайшего аналога в сходных условиях культивирования, а устойчивость их к бутанолу сопоставима с результатами, экспериментально подтвержденными на лактобациллах и других бактериях.
Способность заявляемых штаммов синтезировать бутанол путем ферментации как глюкозы, так и ксилозы, позволяет использовать в качестве субстратов для ферментации гидролизаты растительной биомассы, представляющие собой дешевое непищевое сырье.
Заявляемые рекомбинантные штаммы-продуценты бутанола относятся к виду L.brevis, природные представители которого не способны синтезировать бутанол. Введение нового вида бактерий в число продуцентов бутанола дает дополнительные возможности для разработки более эффективных путей его биосинтеза.
Источники информации


| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕРМЕНТАТИВНОЕ ПОЛУЧЕНИЕ 1-БУТАНОЛА | 2006 |
|
RU2429295C2 |
| СПОСОБ БИОЛОГИЧЕСКОГО ПРОИЗВОДСТВА н-БУТАНОЛА | 2007 |
|
RU2461627C2 |
| Штаммы Lactobacillus brevis и Lactobacillus rhamnosus с установленной последовательностью генома, синтезирующие глутатион и комплекс внутриклеточных антиоксидантов | 2015 |
|
RU2617946C1 |
| СПОСОБ КОНСТРУИРОВАНИЯ РЕКОМБИНАНТНОГО ШТАММА Staphylococcus carnosus | 2007 |
|
RU2333957C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ESCHERICHIA COLI-ПРОДУЦЕНТ L-ТРЕОНИНА | 2013 |
|
RU2546237C1 |
| РЕКОМБИНАТНАЯ ПЛАЗМИДНАЯ ДНК PPR - TGATG - HIL - 1 BETA - TSR, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО ИНТЕРЛЕЙКИНА-1 И ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИНТЕРЛЕЙКИНА-1 БЕТА ЧЕЛОВЕКА | 1992 |
|
RU2045575C1 |
| ШТАММЫ Lactobacillus plantarum И Lactobacillus brevis, СИНТЕЗИРУЮЩИЕ ГАММА-АМИНОМАСЛЯНУЮ КИСЛОТУ | 2014 |
|
RU2575625C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА Н-БУТАНОЛА | 2009 |
|
RU2406763C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ СИНТЕЗ РЕКОМБИНАНТНОГО БЕЛКА TUL4spCBD, ШТАММ ESCHERICHIA COLI M15 [pREP4, pTUL4spCBD] - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО БЕЛКА TUL4spCBD, РЕКОМБИНАНТНЫЙ БЕЛОК TUL4spCBD И СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К БЕЛКУ TUL4spCBD | 2004 |
|
RU2270249C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА МОЛОЧНОЙ КИСЛОТЫ И РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ SCHIZOSACCHAROMYCES POMBE ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2004 |
|
RU2268304C1 |












Изобретение относится к биотехнологии, в частности к производству н-бутанола путем ферментации углеводосодержащего сырья рекомбинантными бактериями. Сконструированы рекомбинантные плазмидные ДНК: pBCS, содержащая гены биосинтеза бутанола crt, bcd, etfB, etfA и hbd из C.acetobutylicum и pTHL-BCS, содержащая помимо ранее перечисленных ген thi из C.acetobutylicum. Плазмиды способны реплицироваться как в грамотрицательных (Е.соli), так и в грамположительных (L.brevis) бактериях. Получены рекомбинантные штаммы-продуценты н-бутанола на основе бактерий Lactobacillus brevis: штамм Lactobacillus brevis ВКПМ В-10044, содержащий плазмиду pBCS; штамм Lactobacillus brevis ВКПМ В-10043, содержащий плазмиду pTHL-BCS, способные синтезировать бутанол и устойчивые к его концентрации 2,0-2,8 мас.% в жидкой среде. Разработан способ микробиологического синтеза бутанола на основе рекомбинантных бактерий L.brevis, совмещающих способность синтезировать бутанол с устойчивостью к его концентрациям в жидкой среде не менее 2,0 мас.%, позволяющий получать бутанол при использовании в качестве источника углерода в средах для культивирования как глюкозы, так и ксилозы. Изобретение позволяет повысить эффективность синтеза. 5 н.п. ф-лы, 2 табл., 2 ил.
1. Рекомбинантная плазмидная ДНК pBCS, предназначенная для трансформации бактерий Lactobacillus brevis, имеющая размер 9954 п.н., содержащая промоторную, кодирующую и терминирующую области bcs-оперона из Clostridium acetobutylicum, включающего гены биосинтеза бутанола: crt, bcd, etfB, etfA. и hbd, а также ген устойчивости к ампициллину bla, ген устойчивости к хлорамфениколу cmr и участки инициации репликации ori-177 для грамотрицательных и ori-pAMal для грамположительных бактерий, соответствующая нуклеотидной последовательности SEQ ID NO I.
2. Рекомбинантная плазмидная ДНК pTHL-BCS, предназначенная для трансформации бактерий Lactobacillus brevis, имеющая размер 11787 п.н., содержащая промоторную, кодирующую и терминирующую области bcs-оперона из Clostridium acetobutylicum, включающего гены биосинтеза бутанола: crt, bcd, etfB, etfA. и hbd, промоторную, кодирующую и терминирующую области гена ml из Clostridium acetobutylicum, а также ген устойчивости к ампициллину bla, ген устойчивости к хлорамфениколу cmr и участки инициации репликации ori-177 для грамотрицательных бактерий и ori-pAMal для грамположительных бактерий, соответствующая нуклеотидной последовательности SEQ ID NO 2.
3. Рекомбинантный штамм Lactobacillus brevis ВКПМ В-10044 - продуцент н-бутанола, полученный трансформацией штамма Lactobacillus brevis ВКПМ 5563 плазмидной ДНК по п.1.
4. Рекомбинантный штамм Lactobacillus brevis ВКПМ В-10043 - продуцент н-бутанола, полученный трансформацией штамма Lactobacillus brevis ВКПМ 5563 плазмидной ДНК по п.2.
5. Способ микробиологического синтеза н-бутанола, предусматривающий культивирование рекомбинантных бактерий, содержащих гены биосинтеза н-бутанола из Clostridium acetobutylicum, в микроаэрофильных условиях в питательной среде, включающей источники углерода, азота и минеральные добавки до максимального накопления целевого продукта, отличающийся тем, что в качестве продуцентов, содержащих гены биосинтеза н-бутанола из Clostridium acetobutylicum, используют рекомбинантные бактерии Lactobacillus brevis, полученные трансформацией бактерий Lactobacillus brevis плазмидной ДНК по п.1 или 2 и совмещающие способность синтезировать н-бутанол с устойчивостью к концентрации н-бутанола в жидкой среде от 2,0 мас.% и выше, а в качестве углерода в средах для культивирования используют глюкозу и/или ксилозу.
| WO 2007146377, 21.12.2007 | |||
| FLIOCCO D | |||
| Improved adaptation to heat, cold and solvent tolerance in Lactobacillus plantarum, Appl | |||
| Microbiol | |||
| Biotechnol, 2007, dec, 77(4), 909-15 | |||
| ШТАММ БАКТЕРИЙ CLOSTRIDIUM ACETOBUTYLICUM-ПРОДУЦЕНТ Н-БУТИЛОВОГО СПИРТА И АЦЕТОНА | 1995 |
|
RU2080382C1 |
Авторы
Даты
2009-12-10—Публикация
2008-06-10—Подача