Изобретение относится к биотехнологии, в частности к микробиологическому синтезу L-треонина с использованием рекомбинантного штамма рода Escherichia, в котором гены sstT и poxB инактивированы, а экспрессия гена galP и оперона thrABC усилена.
L-треонин является незаменимой аминокислотой, которую широко используют в качестве фуражной, кормовой добавки и стимулятора роста животного, а также в качестве компонента в лекарственных водных растворах и дополнительного сырья в медицинских продуктах. В настоящее время в развитых странах L-треонин производят всего пять компаний.
Традиционно L-аминокислоты в промышленном масштабе могут быть получены методом ферментации с использованием штаммов микроорганизмов, выделенных из природных источников, или их мутантов, специально модифицированных для того, чтобы увеличить продукцию L-аминокислот.
Описано множество методов увеличения продукции L-аминокислот, например, путем трансформации микроорганизма рекомбинантной ДНК (см., например, патент США 4278765). Указанные методы основаны на повышении активности ферментов, вовлеченных в биосинтез аминокислот и/или уменьшении чувствительности целевого фермента к обратному ингибированию продуцируемой L-аминокислотой (JP56-18596 (1981), WO 95/16042, US 5661012 и US 6040160).
Известный штамм - продуцент L-треонина Escherichia coli ВКПМ B-3996 (US 5175107 и US 5705371) является лучшим на сегодняшний день штаммом - продуцентом L-треонина. Для создания штамма ВКПМ B-3996 несколько мутаций и плазмида, описанная ниже, были введены в родительский штамм E.coli K-12 (ВКПМ B-7). Мутантный ген thrA (мутация thrA442) кодирует белок аспартокиназа-гомосериндегидрогеназу I, который устойчив к ингибированию треонином по типу обратной связи. Мутантный ген ilvA (мутация ilvA442) кодирует белок треониндеаминазу, обладающую пониженной активностью, которая выражается в пониженном уровне биосинтеза изолейцина и в фенотипе с недостатком по изолейцину типа "leaky". В бактерии с мутацией ilvA442 транскрипция оперона thrABC не репрессируется изолейцином, что дает положительный эффект на продукцию треонина. Инактивация гена tdh приводит к предотвращению деградации треонина. В указанный штамм была введена генетическая детерминанта ассимиляции сахарозы (гены scrKYABR). Для увеличения экспрессии генов, контролирующих биосинтез треонина, в промежуточный штамм TDH6 была введена плазмида pVIC40, содержащая мутантный треониновый оперон thrA442 BC.
Общий подход к повышению уровня экспрессии конкретного гена предусматривает использование плазмиды, увеличивающей число копий гена с целью увеличения соответствующей информационной РНК (Sambrook et al., Molecular cloning, Second Edition, 1989, 1.3-1.5). Ген-мишень интегрируют в плазмиду, а микроорганизм-хозяин трансформируют рекомбинантной плазмидой с целью увеличения числа генов в микроорганизме-хозяине в соответствии с копийностью плазмиды. Об определенном успехе в подходе такого типа, предпринятом для увеличения продуктивности треонина, сообщается в патенте US 5538873. Однако большинство методов, использующих такие рекомбинантные плазмиды, характеризуются сверхпродукцией конкретного гена, что нежелательно для микроорганизма-хозяина и создает проблемы, связанные с неустойчивостью плазмиды, вследствие чего может происходить потеря плазмиды в ходе культивирования рекомбинантного штамма.
В качестве альтернативы данному подходу на сегодняшний день наиболее часто рассматривают интеграцию дополнительных копий целевого гена в хромосому микроорганизма-хозяина или замена промотора целевого гена на промотор, обеспечивающий более высокий уровень экспрессии.
Инактивация хромосомных генов путем замены соответствующей открытой рамки считывания (далее ORF) последовательностью селективного маркера, может быть произведена с помощью трансформации штамма ПЦР-продуктом, содержащим последовательность маркера, фланкированную короткими (36-50 п.н.) участками, гомологичными хромосомальной последовательности выше и ниже целевого гена. В данном случае рекомбинацию осуществляет рекомбинационная система Red фага λ. Экспрессия генов рекомбинационной системы обеспечивается плазмидой pKD46, содержащей фрагмент ДНК фага, кодирующий гены gam, bet и exo под контролем промотора ParaBAD. Продукт гена exo - ингибирует активность внутриклеточной эндонуклеазы, таким образом, становится возможна трансформация Е.coli линейным фрагментом ДНК. В свою очередь продукты генов gam и bet позволяют осуществлять рекомбинацию по коротким участкам гомологии (Datsenko, Wanner, PNAS vol. 97 no. 12 6640-6645, 2000)
В условиях, когда главный путь биосинтеза L-треонина изучен и достаточно хорошо оптимизирован, дальнейшее улучшение существующего штамма-продуцента L-треонина может быть достигнуто путем ослабления метаболических путей, не приводящих к синтезу целевого продукта, а также ослаблению обратного транспорта уже синтезированного продукта в клетку. Кроме того, штамм, модифицированный таким образом для осуществления сверхсинтеза какого-то одного соединения, может испытывать дефицит глюкозы. Как следствие, усиление транспорта глюкозы в клетку может благоприятно сказаться на уровне продукции.
Показано, что наряду с такими транспортерами L-треонина как livJ и tdcC в клетках Е.coli функционирует транспортер, осуществляющий транспорт L-треонина в клетку в симпорте с катионом натрия. Позже был идентифицирован ген, кодирующий указанный транспортер - ygjU, в настоящее время называемый sstT. В работе по изучению метаболизма штаммов Е.coli с минимизированным геномом показано, что делеция по гену sstT увеличивает накопление L-треонина в культуральной жидкости (Lee, J.H. et al. Microb Cell Fact 8,2; 2009).
Продукт гена poxB - пируватоксидаза катализирует окислительное декарбоксилирование пирувата с образованием ацетата, при котором акцептором электронов является убихинон. Несмотря на то, что в данном случае окисление сопряжено с работой электрон-транспортной цепи (далее ЭТЦ), такой путь метаболизма пирувата является менее энергетически выгодным, чем путь с участием пируватдегидрогеназного комплекса. Кроме того, образование ацетата не только замедляет рост культуры и снижает конверсию, но и затрудняет очистку конечного продукта. Ранее на Corynebacterium glutamicum было показано, что инактивация гена poxB приводит увеличению продукции лизина как минимум на 15% (RU 2000126983 и US 2005196848).
Как отмечалось выше, для эффективного биосинтеза любого соединения необходимо достаточное поступление продуктов гликолиза, а следовательно, и эффективный транспорт глюкозы в клетку. Известно, что основной системой транспорта глюкозы в клетках Е.coli является фосфотрансферазная система (ФТС). Компоненты этой системы используют энергию макроэргической связи в молекуле фосфоенолпирувата (ФЕП) для транспорта глюкозы через цитоплазматическую мембрану с ее одновременным фосфорилированием. Показано, что на долю ФТС приходится около половины всего ФЕП. В тоже время, именно реакция карбоксилирования ФЕП с образованием оксалоацетата является основной реакцией восполнения интермедиатов цикла Кребса в метаболизме Е.coli. Таким образом, дальнейшее увеличение активности ФТС, например, за счет ее дерепрессии путем инактивации гена mlc, приведет, с одной стороны к усилению транспорта глюкозы, но с другой стороны негативно скажется на синтезе оксалоацетата - важного предшественника в пути биосинтеза треонина. Альтернативой такому подходу может быть активация ФЕП-независимых транспортных систем, например, galP. Будучи транспортером галактозы, продукт гена galP демонстрирует достаточно высокое сродство к глюкозе. Как было показано, эффективность ФЕП-независимых транспортных систем достаточно высока, и даже достаточна, чтобы скомпенсировать отсутствие ФТС (Slivinskaya E.A. et al. Biotechnology (Moscow) 5, 24-37; 2007).
Ближайший аналог заявляемого штамма - известный продуцент L-тренина штамм Escherichia coli ВКПМ B-3996 (US 5175107)
Задача настоящего изобретения
Расширение ассортимента рекомбинантных штаммов Escherichia coli, способных продуцировать L-треонин.
Задача решена путем конструирования штамма Escherichia coli ВКПМ B-11820.
В основу конструирования положено установление того факта, что совместная инактивация генов poxB и sstT на фоне увеличенной экспрессии гена galP и генов оперона thrABC приводит к увеличеню продукции L-треонина у заявляемого штамма.
Характеристика заявляемого штамма Escherichia coli ВКПМ B-11820
Морфологические признаки.
Грамотрицательные слабо подвижные тонкие палочки с закругленными концами, размером 1,5-2 мкм в длину.
Культурально-физиологические признаки.
Мясо-пептонный агар. Через 24 ч роста при 37°C образует круглые, беловатые, полупрозрачные на свет колонии, диаметром 2-3 мм, поверхность колонки гладкая, края ровные или слегка волнистые, центр колоний приподнят, структура однородная, консистенция пастообразная, легко эмульгируется.
Агаризованная минимальная среда (Адамса) с глюкозой и изолейцином. Через 2-е сут роста при 37°C образует колонии диаметром 1-1,5 мм, серовато-белые, круглые с равными краями, слегка выпуклые, внутренняя структура однородная, поверхность блестящая, через 4-5 сут колонии приобретают слизистую (мукоидную) консистенцию.
Рост в мясо-пептонном бульоне.
После 24 ч роста при 37°C наблюдается сильное помутнение, небольшой осадок, запах характерный.
Рост в жидкой минимальной среде Адамса с изолейцином.
Через двое суток роста при 37°C аэрацией наблюдается сильное равномерное помутнение, запах отсутствует.
Рост по уколу в мясо-пептонном агаре
Хороший рост по всему уколу.
Рост на среде с желатином
Желатин - не разжижает.
Рост на срде с молоком
Рост хороший с коагуляцией молока.
Индол не образует.
Рост на различных углеводах.
Хорошо растет на глюкозе, лактозе, маннозе, галактозе, ксилозе, фруктозе, глицероле и маннитоле с образованием кислоты и газа.
Устойчивость к антибиотикам.
Устойчив к канамицину.
Штамм не патогенен.
Потребность в факторах роста.
Ауксотроф по изолейцину.
Пример 1. Замена природного промотора гена galP.
В настоящем примере последовательно описаны этапы сверхэкспрессии гена galP путем замены природного промотора на синтетический промотор Ptac3.
ДНК плазмиды pMWPlaclacI-118-attL-Cm-attR (Katashkina Zh et al., Mol Biol (Mosk). 2005; 39(5): 823-31) обрабатывают эндонуклеазами рестрикции BglII. и XbaI. Электрофоретическое разделение двух полученных фрагментов ДНК проводят в 1% агарозном геле. Фрагмент ДНК размером 1671 п.н., содержащий селективный маркер -ген устойчивости к хлроамфениколу, фланкированный последовательностями λattL и λattR (сайтами узнавания рекомбиназами Int/Xis) очищают методом экстракции из агарозного геля. Полученную ДНК обрабатывают Pfu-полимеразой в течение 2 часов при 72°C, в результате 5′-выступающие концы достраиваются.
ДНК фрагмент, содержащий кассету λattL-Cm-λattR лигируют с плазмидной ДНК pMW118 (Nippon Gene Co, GenBank AB005475.2), предварительно линеаризованной эндонуклеазой рестрикции SalI и обработанной Pfu-полимеразой. Полученной плазмидой трансформируют штамм Е.coli XL1 (Blue) методом электропорации. Клоны, содержащие необходимую вставку амплифицированной ДНК, отбирают на чашках с агаризованной средой LA по устойчивости к хлорамфениколу. Плазмидную ДНК, выделенную из отобранных клонов, проверяют рестрикционным анализом, используя эндонуклеазы рестрикции AatII и BglII, сайт узнавания последней восстанавливается при лигировании. Полученная плазмида, размером 5853 п.н. названа pMW-attL-Cm-attR.
ПЦР продукт, содержащий ген Bacillus subtilis SacB, амплифицируют с использованием Pfu-полимеразы (Ferments) и синтетических олигонуклеотидов:
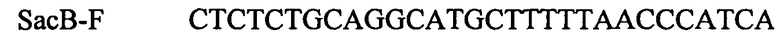 и
и
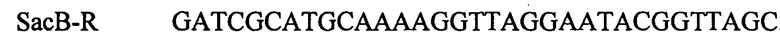 ,
,
Матрицей для ПЦР служит тотальная геномная ДНК Bacillus subtilis 168 ВКПМ B-1727. ПЦР продукт обрабатывают эндонуклеазой рестрикции PaeI. Проводят электрофорез и методом экстракции из агарозного геля выделяют фрагмент размером 2008 п.н., содержащий ген SacB. Около 0,2 мкг полученной ДНК лидируют с 0,1 мкг ДНК плазмиды pUC19, предварительно линеаризованной эндонуклеазой рестрикции PaeI. Полученной плазмидой трансформируют штамм Е.coli XL1 (Blue) методом электропорации. Клоны, содержащие необходимую вставку амплифицированной ДНК, отбирают на чашках с агаризованной средой LA (триптон 10 г/л, дрожжевой экстракт 5 г/л, натрия хлорид 10 г/л, агар бактериологический 20 г/л) по устойчивости к ампициллину и стандартному тесту на отсутствие активности β-галактозидазы. Двенадцать отобранных клонов пересевают на агаризованную среду LA с добавлением сахарозы (100 г/л). На среде с сахарозой у всех клонов наблюдается снижение жизнеспособности, образуются колонии значительно меньшие в размере, нежели чем на среде без сахарозы, что свидетельствует о токсичном действии SacB. Данный признак позволяет проводить негативную селекцию с используемым маркером SacB. Плазмидную ДНК, выделенную из отобранных клонов, проверяют рестрикционным анализом. Полученная плазмида, размером 4694 п.н. названа pUC19-SacB.
Далее в ДНК последовательность плазмиды pUC19-SacB вводят дополнительный селективный маркер - ген kan, кодирующий аминогликозид-3′-фосфотрансферазу, обеспечивающий устойчивость к антибиотику канамицину. Для этого плазмиду pUC4K (Amersham, GE Healtcare, USA) обрабатывают эндонуклеазой рестрикции PstI и проводят электрофоретическое разделение фрагментов расщепленной плазмидной ДНК. Фрагмент длиной 1240 п.н., содержащий ген kan, выделяют методом экстракции из 1%-го агарозного геля. Около 0,25 мкг полученной ДНК лигируют с 0,1 мкг ДНК плазмиды pUC19-SacB, обработанной сходным образом. Полученной плазмидой трансформируют штамм Е.coli XL1 (Blue) методом электропорации. Клоны, содержащие необходимую вставку амплифицированной ДНК, отбирают на чашках с агаризованной средой LA по устойчивости к канамицину (здесь и далее канамицина 0,1 г/л). Плазмидную ДНК, выделенную из отобранных клонов, проверяют рестрикционным анализом. Полученная плазмида, размером 5934 п.н. названа pSacB-Kan.
ДНК плазмиды pSacB-Kan обрабатывают эндонуклеазой рестрикции PaeI. Полученные фрагменты размерами 2008 п.н. и 3926 п.н. разделяют электрофоретически в 1% агарозном геле. Фрагмент ДНК длиной 2008 п.н., содержащий ген SacB, экстрагируют из геля и лигируют с ДНК плазмиды pMW-attL-Cm-attR, предварительно линеаризованной эндонуклеазой рестрикции NheI и обработанной Pfu-полимеразой.
Полученным лигатом трансформирюут штамм Е.coli XL1 (Blue) методом электропорации. Трансформанты отбирают на чашках с агаризованной средой LA с добавлением хлорамфеникола. Далее устойчивые к хлорамфениколу клоны проверяют на способность расти на среде LA с добавлением 10% сахарозы. Чувствительные к сахарозе клоны пересевают в жидкую LB среду (триптон 10 г/л, дрожжевой экстракт 5 г/л, натрия хлорид 10 г/л). Выделенную плазмидную ДНК проверяют рестрикционным анализом. Полученная матричная плазмида была названа pMW-attL-SacB-Cm-attR.
В качестве исходного вектора для конструирования матрицы для получения интегративных кассет используют вектор pKK223-3 (Pharmacia, Milano, Italy). Вектор pKK223-3 обрабатывают эндонуклеазой рестрикции EcoRI с последующей обработкой Pfu-полимеразой для «затупливания» липких концов. Далее линеаризованную ДНК обрабатывают эндонуклеазой рестрикции PaeI, после чего методом экстракции из геля выделяют фрагмент 4400 п.н. Плазмиду pMW-attL-SacB-Cm-attR обрабатывают эндонуклеазами рестрикции MbiI и PaeI. После экстракции из геля получают фрагмент 3770 п.н. Фрагменты 4400 п.н. и 3770 п.н. после реакции лигирования используют для трансформации штамма XL1-Blue методом электропорации. Трансформанты отбирают на среде LA с ампициллином, хлорамфениколом и тетрациклином (здесь и далее ампициллина 0,125 г/л, хлорамфеникола 0,01 г/л, тетрациклина 0,0125 г/л). Наличие корректной вставки подтверждают методом рестрикционного анализа. Полученная плазмида размером 8170 п.н. названа pKK-cs-Ptrc.
В качестве матрицы для амплификации промотора Ptac3 используют коммерчески доступную плазмида pDR540. ДНК-фрагмент, содержащий промотор Ptac3, амплифицируют с использованием Pfu-полимеразы и синтетических олигонуклеотидов:
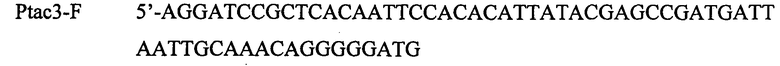 и
и
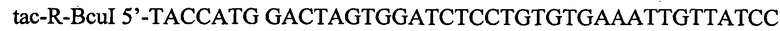 .
.
ПЦР продукт очищают методом экстракции из геля и после обработки эндонуклеазой рестрикции NcoI экстрагируют повторно. В результате получают фрагмент размером 126 п.о.
Для конструирования матричной плазмиды используют описанную выше плазмиду pKK-cs-Ptrc. После обработки плазмиды pKK-cs-Ptrc эндонуклеазой рестрикции Ecl136II, проводят неполную рестрикция с использованием эндонуклеазы NcoI. В результате получают набор фрагментов следующих размеров: 326 п.о., 3241 п.о., 4929 п.о., 7844 п.о. Фрагмент размером 7844 п.о. очищают методом экстракции из агарозного геля. Далее ДНК-фрагмент обрабатывают щелочной фосфатазой FastAP с последующей экстракцией из геля.
Полученные фрагменты лигируют, после чего штамм XL1-Blue трансформируют полученной лигазной смесью. Клоны отобрают на среде LA с добавлением тетрациклина (12,5 мкг/мл) и хлорамфеникола (10 мкг/мл). Корректность последовательности клонированного фрагмента подтверждают методом секвенирования по Сэнгеру. Полученная плазмида размером 7970 п.н. названа pKK-cs-Ptac3.
В качестве матрицы для синтеза используют плазмиду pKK-cs-Ptac3. Для специфической амплификации используют синтетические олигонуклеотиды:
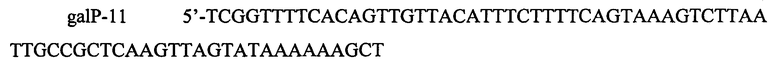 и
и
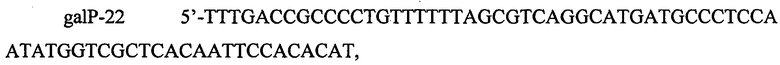
содержащие участки по 48 п.н. (левый фланг) и 50 п.н. (правый фланг), гомологичные участкам, расположенным выше и ниже промотора PgalP на хромосоме. ПЦР амплификацию проводят с использованием полимеразы Pfu. Полученный ПЦР продукт размером 3891 п.н., содержит ген устойчивости к хлорамфениколу, ген контрселекции SacB, фланкированный последовательностями фага λ attL и attR (сайтами узнавания системы рекомбинации Int/Xis) и гомологичными участками выше и ниже нативного промотора PgalP. Фрагмент очищают методом экстракции из агарозного геля и далее используют для трансформации штамма TDH-6 (представляющего собой бесплазмидный вариант штамма Escherichia coli ВКПМ В-3996), несущего вспомогательную плазмиду pKD46. Трансформанты отбирают на среде LA с хлорамфениколом. Корректность последовательности вставки подтверждают методом секвенирования по Сэнгеру. Полученный штамм назван TDH-6-galP-tac3-cs.
Кассету att-Cm-SacB-att удаляют посредством трасформации штамма TDH-6-galP-tac3-cs ПЦР продуктом, две части которого гомологичны областям на хромосоме выше и ниже указанной кассеты. ПЦР продукт получают с использованием олигонуклеотидов
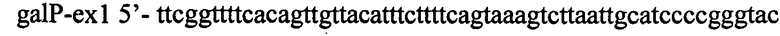 и
и
 . Праймеры содержат области гомологичные хромосомальным участкам выше и ниже инсерции, соответственно. Амплификацию проводят без добавления хромосомальной ДНК в качестве матрицы поскольку олгонуклеотиды имеют область гомологии между собой. Полученный ПЦР продукт размером 98 п.н. очищают методом экстракции из геля и используют для трансформации штамма TDH-6-galP-tac3-cs. Отбирают трансформанты способные к росту на среде LA с, сахарозой и чувствительные к хлорамфениколу. Полученный штамм назван TDH-6-galP-tac3.
. Праймеры содержат области гомологичные хромосомальным участкам выше и ниже инсерции, соответственно. Амплификацию проводят без добавления хромосомальной ДНК в качестве матрицы поскольку олгонуклеотиды имеют область гомологии между собой. Полученный ПЦР продукт размером 98 п.н. очищают методом экстракции из геля и используют для трансформации штамма TDH-6-galP-tac3-cs. Отбирают трансформанты способные к росту на среде LA с, сахарозой и чувствительные к хлорамфениколу. Полученный штамм назван TDH-6-galP-tac3.
Пример 2. Инактивация гена sstT
В данном примере описана инактивация гена sstT путем замены его ORF последовательностью, несущей селективный маркер устойчивости к хлорамфениколу. Данную конструкцию получают методом ПЦР с использованием следующих олигонуклеотидов:
 и
и
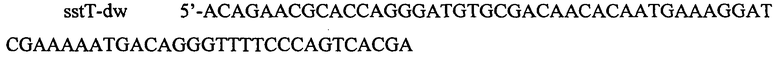 .
.
Олигонуклеотиды подбирают таким образом, чтобы после удаления маркера оставить делению in-frame, и таким образом не изменить уровень экспрессии нижележащих генов.
В качестве матрицы для синтеза используют плазмиду pMW-attL-SacB-Cm-attR (см. пример 1). ПЦР проводят с использованием полимеразы Pfu для того, чтобы избежать ошибок в последовательности. Полученный ПЦР продукт размером 3944 п.н., содержащий гены cat и sacB, фланкированные последовательностями фага λ attL и attR (сайтами узнавания системы рекомбинации Int/Xis) и гомологичными участками выше и ниже гена sstT, очищают методом экстракции из агарозного геля и далее используют для трансформации штамма TDH-6, несущего вспомогательную плазмиду pKD46. Отбор трансформантов проводят на среде LA с хлорамфениолом. Отобранные клоны далее проверяют методом ПЦР на наличие инсерции в локусе sstT. Для амплификации фрагмента используют следующие олигонуклеотиды:
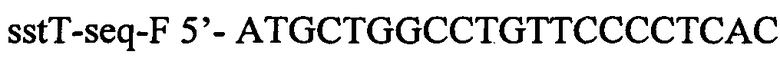 и
и
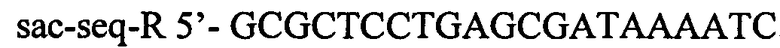 .
.
Наличие продукта размером 4413 п.н. интерпретируют как интеграцию кассеты в целевой локус. Полученный штамм назван TDH-6-ΔsstT::att-Cm-SacB-att.
Пример 3. Инактивация гена poxB
В данном примере описана инактивация гена рохВ путем замены его ORF последовательностью, несущей селективный маркер устойчивости к хлорамфениколу. Данную конструкцию получают методом ПЦР с использованием следующих олигонуклеотидов:
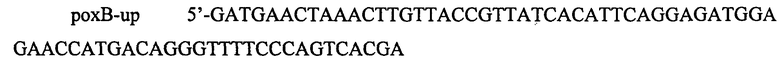 и
и
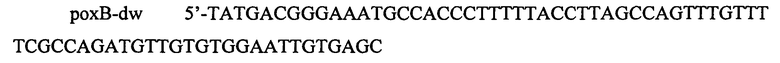 .
.
Олигонуклеотиды подбирают таким образом, чтобы после удаления маркера оставить делению in-frame, и таким образом не изменить уровень экспрессии нижележащих генов.
В качестве матрицы для синтеза используют плазмиду pMW-attL-SacB-Cm-attR (см. пример 1). ПЦР проводят с использованием полимеразы Pfu для того, чтобы избежать ошибок в последовательности. Полученный ПЦР продукт размером 3944 п.н., содержащий гены cat и sacB, фланкированные последовательностями фага λ attL и attR (сайтами узнавания системы рекомбинации Int/Xis) и гомологичными участками выше и ниже гена poxB, очищают методом экстракции из агарозного геля и далее используют для трансформации штамма TDH-6, несущего вспомогательную плазмиду pKD46. Отбор трансформантов проводят на среде LA с хлорамфениколом. Отобранные клоны далее проверяют методом ПЦР на наличие инсерции в локусе poxB. Для амплификации фрагмента используют следующие олигонуклеотиды:
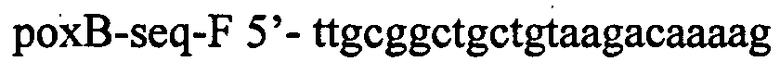 и
и
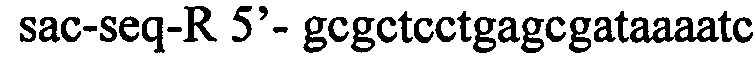 .
.
Наличие продукта размером 4413 п.н. интерпретируют как интеграцию кассеты в целевой локус. Полученный штамм назван TDH-6-ΔpoxB::att-Cm-SacB-att
Пример 4. Получение штамма TDH-6-galP-tac3-ΔsstT-ΔpoxB
На первом этапе фаг P1 выращивают на штамме TDH-6-ΔsstT::att-Cm-SacB-att устойчивом к хлорамфениколу. Реципиентом в этом случае выступает штамм TDH-6-galP-tac3, обладающий устойчивостью к канамицину. После проведения трансдукции отбирают клоны, содержащие оба генетических маркера на агаризованной среде LA с хлорамфениколом и канамицином. Полученный штамм, содержащий инсерцию ΔsstT::att-Cm-SacB-att и промотор Ptac3 перед геном galP назван TDH-6-galP-tac3-ΔsstT-cs.
Затем кассету, содержащую гены cat и sacB, фланкированные att-последовательностями, удаляют посредством трансформации указанного штамма плазмидой pMW-intxis-ts (Katashkina et al., Mol Biol (Mosk) 39, 823-831; 2005), несущей гены Int и Xis фага λ, кодирующие систему сайт-специфической рекомбинации. Отбор трансформантов проводят на агаризованной среде LA с сахарозой и по потере устойчивости к хлорамфениколу. Полученный штамм назван TDH-6-galP-tac3-ΔsstT.
Для переноса ΔpoxB::att-Cm-SacB-att в полученный штамм, фаг P1 выращивают на штамме TDH-6-ΔpoxB::att-Cm-SacB-att устойчивом к хлорамфениколу. Реципиентом в этом случае выступает штамм TDH-6-galP-tac3-ΔsstT, обладающий устойчивостью к канамицину. После проведения трансдукции отбирают клоны, содержащие оба генетических маркера на агаризованной среде LA с хлорамфениколом и канамицином. Полученный штамм, содержащий инсерцию ΔpoxB::Sitt-Cm-SacB-att, делецию ΔsstT и промотор Ptac3 перед геном galP был назван TDH-6-galP-tac3-ΔsstT-ΔpoxB-cs.
На финальном этапе кассету, содержащую гены cat и sacB, вновь удаляют с помощью плазмиды pMW-intxis-ts. В результате получают штамм TDH-6-galP-tac3-ΔsstT-ΔpoxB.
Пример 5. Модификация оперона thrABC.
В данном примере описано введение интегративной конструкции в хромосому штамма TDH-6-galP-tac3-ΔsstT-Δpox. Данная конструкция заменят природный промотор оперона thrABC на фаговый промотор PA1, удаляет последовательность регуляторного пептида thrL, вводит точечную мутацию, вызывающую замену Gly433Arg в аминокислотной последовательности ThrA и заменяет природный. терминатор оперона терминатором TrrnB.
Фрагмент ДНК длиной 240 п.н. гомологичный хромосомальной последовательности выше треонинового оперона получают в ПЦР с Pfu-полимеразой. В качестве матрицы для синтеза используют препарат хромосомой ДНК штамма Е.coli MG1655. Для специфической амплификации используют синтетические олигонуклеотиды:
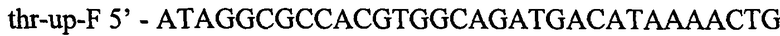 и
и
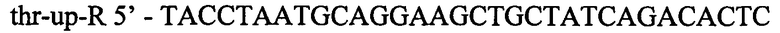
Полученый фрагмент очищают методом экстракции из агарозного геля и после обработки эндонуклеазами EheI и XagI экстрагируют повторно. В результате этого, получают фрагмент размером 226 п.н.
Векторную часть получают после обработки плазмиды pKK-cs-Ptrc (см. пример 1) эндонуклеазами EheI, XagI, щелочной фосфатазой FastAP и последующей экстракции из агарозного геля. Фрагменты лигируют и затем используют для трансформации штамма XL1-Blue. Клоны отбирают на среде LA с добавлением ампициллина, тетрациклина и хлорамфеникола. Корректность последовательности клонированного фрагмента подтверждают методом секвенирования по Сэнгеру. Полученная плазмида обозначена как pKK-up-cs и имеет размер 7816 п.н.
Фрагмент ДНК длиной 219 п.н. гомологичный хромосомальной последовательности, расположенной ниже треонинового оперона, получают в ПЦР с Pfu-полимеразой. В качестве матрицы для синтеза используют препарат хромосомой ДНК штамма Е.coli MG1655. Для специфической амплификации используют синтетические олигонуклеотиды:
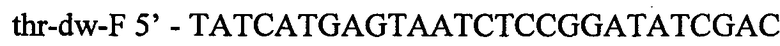 и
и
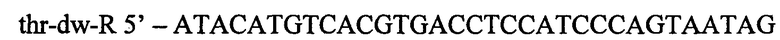
Полученый фрагмент длиной 219 п.н. очищают методом экстракции из агарозного геля и после обработки эндонуклеазами PscI и PagI экстрагируют повторно. В результате получают фрагмент размером 209 п.н.
Векторную часть получают после обработки плазмиды pKK-up-cs эндонуклеазой рестрикции PagI, щелочной фосфатазой FastAP и последующей экстракции из геля. Фрагменты лигируют и используют для трансформации штамма XL1-Blue. Клоны отбирают на среде LA с добавлением тетрациклина и хлорамфеникола. Корректность последовательности клонированного фрагмента подтверждают методом секвенирования по Сэнгеру. Полученная плазмида обозначена как pKK-up-cs-dw и имеет размер 7017 п.н.
ПЦР продукт, содержащий гены Е.coli thrBC, амплифицируют с использованием Pfu-полимеразы и синтетических олигонуклеотидов:
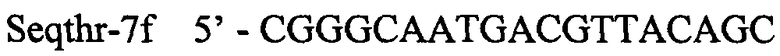
 .
.
Матрицей для ПЦР служит суммарная геномная ДНК Е.coli MG1655. ПЦР продукт длиной 2457 п.н. очищают методом экстракции ДНК из агарозного геля и обрабатывают эндонуклеазами рестрикции HindIII, Eco105I и Pfu-полимеразой для достройки 5′-выступающих концов. Около 0,2 мкг полученной ДНК лигируют с 0,1 мкг ДНК плазмиды pKK223-3, обработанной эндонуклеазой рестрикции HindIII. и Pfu-полимеразой. Методом электропорации полученной плазмидой трансформируют штамм Е.coli XL1 (Blue). Клоны, содержащие необходимую вставку амплифицированной ДНК, отбирают на чашках с агаризованной средой LA по устойчивости к ампициллину. Рестрикционным анализом подтверждают наличие вставки. Корректность последовательности клонированного фрагмента подтверждают методом секвенирования по Сэнгеру. Полученная плазмида размером 7049 п.н. названа pKK-thrBC.
Фрагмент ДНК размером 522 п.н. получают в процессе ПЦР с Pfu-полимеразой и вектором pKK233-2 в качестве матрицы, используя для специфической амплификации олигонуклеотиды:
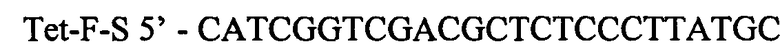 и
и

Полученный фрагмент очищают методом экстракции из агарозного геля и используют в качестве матрицы в следующей ПЦР.
Во второй ПЦР также применяют Pfu-полимеразу и синтетические олигонуклеотиды:
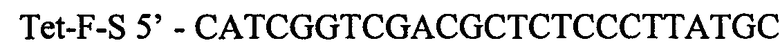 и
и
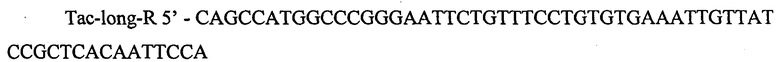
Продукт размером 560 п.н. также очищают методом экстракции из агарозного геля и используют как матрицу в третей ПЦР с Pfu-полимеразой. Для третьей ПЦР применяют синтетические олигонуклеотиды:
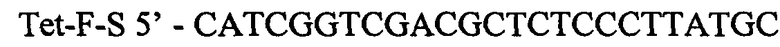 и
и
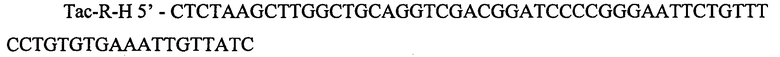
Фрагмент 580 п.н. после очистки методом экстракции из агарозного геля обрабатывают эндонуклеазами рестрикции PaeI и PstI и повторно очищают. Полученный фрагмент размером 487 п.н. лигируют с фрагментом 6578 п.н., полученным после обработки плазмиды pKK-thrBC эндонуклеазами PaeI, PstI, щелочной фосфатазой. Лигазную смесь используют для трансформации штамма MG1655ΔppcF′ методом электропорации. Трансформанты отбирают на среде LA с ампициллином, канамицином и тетрациклином. Наличие корректной вставки подтверждают методом рестрикционного анализа и последующего секвенирования. Полученная плазмида размером 7065 п.н. названа pKK2233-Ptac-thrBC.
Фрагмент ДНК, содержащий мутантный вариант гена thrA, получают следующим обрзом. Проводят две ПЦР, используя Pfu-полимеразу и хромосому штамма MG1655 в качестве матрицы. Для специфической амплификации используют две пары синтетических олигонуклеотидов:
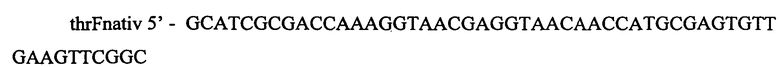 и
и
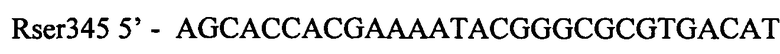 ,
,
или
 и
и
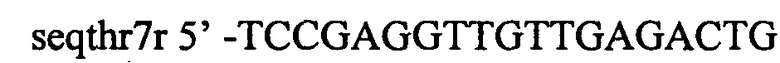
Полученные продукты длиной 1075 и 1591 п.н. очищают методом экстракции из агарозного геля и используют в качестве матрицы в третей ПЦР с Pfu-полимеразой и синтетическими олигонуклеотидами thrFnativ и seqthr7r. Продукт 2646 п.н. после экстракции из агарозного геля лигируют с вектором pUC19, линеаризованным эндонуклеазой рестрикции HincII (2686 п.н.). Лигазную смесь используют для трансформации штамма XL1-Blue. Клоны, содержащие необходимую вставку, отбирают на чашках с агаризованной средой LA, содержащей X-Gal (0,0008%) и IPTG (0,0008%), по устойчивости к ампициллину и стандартному тесту на отсутствие активности β-галактозидазы. Наличие правильной вставки подтверждают методом рестрикционного анализа. Корректность последовательности клонированного фрагмента подтверждают методом секвенирования по Сэнгеру. Полученная плазмида обозначена pUC19-thrA-345 и имеет размер 5332 п.н.
Плазмиду pKK2233-Ptac-thrBC обрабатывают эндонуклеазами рестрикции SmaI, Eco105I и щелочной фосфатазой FastAP, после чего фрагмент 6996 п.н. очищают методом экстракции из агарозного геля. Плазмиду pUC19-thrA-345 обрабатывают эндонуклеазами рестрикции Bsp68I и Eco105I После экстракции из агарозного геля получают фрагмент 2460 п.н. Фрагменты 6996 п.н. и 2460 п.н. лигируют и затем используют для трансформации штамма MG1655ΔppcF′ методом электропорации. Трансформанты отбирают на среде LA с ампициллином, канамицином и тетрациклином. Наличие корректной вставки подтверждают методом рестрикционного анализа. Корректность последовательности клонированного фрагмента подтверждают методом секвенирования по Сэнгеру. Полученная плазмида размером 9456 п.н. названа pKK2233-thrABC-345.
ПЦР продукт, содержащий ген E.coli rhtA, амплифицируют с использованием Pfu-полимеразы и синтетических олигонуклеотидов:
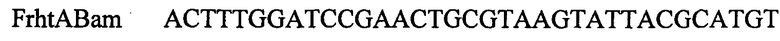 ,
,
 ,
,
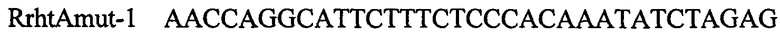 и
и
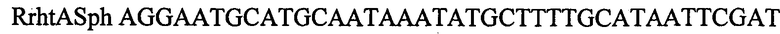 .
.
В качестве матрицы для ПЦР используют препарат хромосомной ДНК Е.coli MG1655. ПЦР продукты, полученные с использованием пар олигонуклеотидов FrhtABam и RrhtAmut-1 или FrhtAmut-1 и RrhtASph затем очищают методом экстракции из агарозного геля. Полученные фрагменты используют в качестве матриц при проведении амплификации с олигонуклеотидами FrhtABam и RrhtASph. Конечный ПЦР продукт длиной 1184 п.н. очищают методом экстракции из агарозного геля и обрабатывают эндонуклеазами рестрикции BamHI. и SphI. Около 0,2 мкг полученной ДНК лигируют с 0,1 мкг ДНК плазмиды pBR322, обработанной аналогичным образом. Полученной плазмидой трансформируют штамм Е.coli XL1 (Blue) методом электропорации. Клоны, содержащие необходимую вставку амплифицированной ДНК, отбирают на чашках с агаризованной средой LA по устойчивости к ампициллину с последующим пересевом на среду с тетрациклином. Клоны, чувствительные к тектрациклину, несут плазмиду с амплифицированной вставкой. Плазмидную ДНК, выделенную из отобранных клонов, проверяют рестрикционным анализом. Полученная плазмида размером 5364 п.н. названа pBR-rhtA.
Плазмиды pKK2233-thrABC-345 и pBR-rht последовательно обрабатывают эндонуклеазами рестрикции PaeI и BamHI. После этого, методом экстракции из агарозного геля выделяют фрагменты размером 9269 и 1373 п.н., соответственно. Далее, фрагменты объединяют в реакции лигирования и используют для трансформации штамма MG1655ΔppcF′ методом электропорации. Трансформанты отбирают на среде LA с ампициллином, канамицином и тетрациклином. Наличие корректной вставки подтверждают методом рестрикционного анализа. Полученная плазмида названа pKK-rhtA-thrABC-345 и имеет размер 10642 п.н.
Плазмиду pKK-up-cs-dw обрабатывают эндонуклеазами рестрикции VspI и PagI с последующей обработкой щелочной фосфатазой FastAP. Далее, методом экстракции из агарозного геля очищают фрагмент длиной 6466 п.н. Плазмиду pKK-rhtA-thrABC-345 также обрабатывают эндонуклеазами рестрикции VspI и PagI. После экстракции из геля получают фрагмент 5415 п.н. Фрагменты 6466 п.н. и 5415 п.н. после реакции лигирования используют для трансформации штамма MG1655ΔppcF′ методом электропорации. Трансформанты отбирают на среде LA с канамицином, хлорамфениколом и тетрациклином. Наличие корректной вставки подтверждают методом рестрикционного анализа. Полученная плазмида размером 11881 п.н. была названа pKK-up-cs-dw-thrABC-345.
Фрагмент ДНК содержащий мутантный вариант гена thrA433 получают в результате двух раундов ПЦР. Первоначально амплифицируют фрагмент размером 1457 п.н. В качестве матрицы используют препарат хромосомной ДНК штамма MG1655. Для специфической амплификации используют синтетические олигонуклеотиды:
 и
и
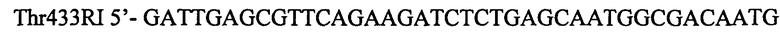
Полученый фрагмент очищают методом экстракции из агарозного геля и используют как матрицу для второго раунда ПЦР. Во втором раунде ПЦР получают фрагмент ДНК размером 1491 п.н. с использованием синтетических олигонуклеотидов:
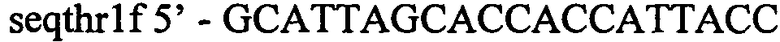 и
и

Полученый фрагмент очищают методом экстракции из агарозного геля и затем обрабатывают эндонуклеазой MunI. После очистки в агарозном геле получают фрагмент ДНК размером 1086 п.н., который используют для клонирования.
Плазмиду pKK-up-cs-dw-thrABC-345 последовательно обрабатывают эндонуклеазами рестрикции MunI и OliI, а затем очищают методом экстракции из агарозного геля фрагмент размером 10795 п.н., который используют в качестве вектора. Указанный выше фрагмент размером 1086 п.н., содержащий мутантный вариант гена thrA433 и вектор размером 10795 п.н. лигируют с помощью фермента T4 ДНК лигазы. Лигазную смесь используют для трансформации штамма MG1655ΔppcF′. Трансформанты отбирают на среде LA с хлорамфениколом и тетрациклином. Наличие корректной вставки подтверждают методом рестрикционного анализа. Полученную плазмиду размером 11881 п.н. назвали pKK-up-cs-dw-thrABC-433.
Плазмиду pKK-up-cs-dw-thrABC-433 обрабатывают эндонуклеазой рестрикции Eco72I. Продукты рестрикции разделяют электрофоретически и фрагмент ДНК размером 9882 п.н. очищают методом экстракции из агарозного геля. Полученный фрагмент используют для трансформации штамма TDH-6-galP-tac3-ΔsstT-Δpox методом электоропорации. Трансформантов отбирают на чашках с агаризованной средой LA по устойчивости к хлорамфениколу. Интеграцию вставки в целевой локус подтверждают методом ПЦР. Полученный штамм был назван TDH-G-galP-tac3-ΔsstT-Δpox-thrA-433-CS.
Фрагмент ДНК содержащий последовательность промотора PA1 фага T7 получают в ПЦР с Pfu-полимеразой и препаратом геномной ДНК фага T7 в качестве матрицы. Для специфической амплификации используют синтетические олигонуклеотиды:
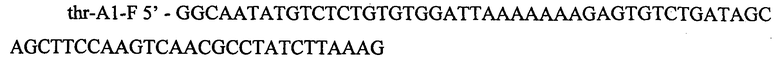

Полученный ПЦР продукт очищают методом экстракции из агарозного геля после чего используют для трансформации штамма TDH-6-galP-tac3-ΔsstT-Δpox-thrA-433-CS методом электропорации. Трансформантов отбирают на агаризованной среде LA с добавлением сахарозы до конечной концентрации 10%. Способные к росту на среде с сахарозой клоны затем проверяют на чувствительность к хлорамфениколу. Корректность последовательности вставки подтверждают методом секвенирования по Сэнгеру. Полученный в результате штамм назван TDH-6-galP-tac3-ΔsstT-Δpox-thrA-433. Во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) указанный штамм депонирован как Е.coli ВКПМ B-11820. Полученный штамм является сутью настоящего изобретения.
Пример 6. Продукция L-треонина штаммом ВКПМ B-11820
Для проверки эффекта введенных модификаций на продукцию L-треонина, полученный штамм ВКПМ В-11820 сравнивают по продуктивности с известным штаммом-продуцентом L-треонина Е.coli ВКПМ B-3996, который может быть получен путем трансформации штамма TDH-6 плазмидой pVIC40, описанной выше.
Для получения посевной культуры каждый из штаммов культивируют на роторной качалке (250 об/мин) при 32°C в течение 18 часов в пробирках 20×200 мм, содержащих 2 мл L-бульона с 2% глюкозы. Затем в ферментационную среду вносят 0.21 мл (10%) посевного материала. Ферментацию проводят в 2 мл минимальной ферментационной среды в пробирках 20×200 мм. Клетки культивируют в течение 24 часов при 32°C на роторной качалке - 250 об/мин.
Состав ферментационной среды (мас.%):
Глюкозу и сульфат марганца стерилизуют отдельно. CaCO3 стерилизуют сухим жаром при 180°C в течение 2 часов. pH доводят до 7.0. Антибиотик стрептомицин (100 мг/л) добавляют в среду после стерилизации (только для штамма ВКПМ B-3996).
После выращивания количество накопленного в среде L-треонина определяют с помощью бумажной хроматографии, при этом используют следующий состав подвижной фазы: бутанол : уксусная кислота : вода = 4:1:1 (v/v). Раствор (2%) нингидрина в ацетоне используют для визуализации. Пятна, содержащие L-треонин, вырезают, L-треонин элюируют 0.5% водным раствором CdC12, после чего количество L-треонина оценивают спектрофотометрическим методом при длине волны 540 нм.
Результаты пяти независимых пробирочных ферментации приведены в Таблице 1.
В результате установлено, что заявляемый штамм Escherichia coli ВКПМ В-11820 способен эффективно продуцировать L-треонин.
Заявляемый штамм превосходит штамм - ближайший аналог Escherichia coli ВКПМ В-3996:
1) по продуктивности при культивировании в пробирках,
2) не нуждается в добавлении стрептомицина при культивировании.
Источники научно-технической информации
1. Datsenko, Wanner, PNAS vol. 97 no. 12 6640-6645, 2000.
One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products.
2. Lee, J.H. et al. Microb Cell Fact 8, 2; 2009.
Systems metabolic engineering, industrial biotechnology and microbial cell factories.
3. Katashkina et al., Mol Biol (Mosk) 39, 823-831; 2005.
Application of the bacteriophage Mu-driven system for the integration/amplification of target genes in the chromosomes of engineered Gram-negative bacteria-mini review.
4. Sambrook et al., 1989, 1.3-1.5.
Molecular cloning, Second Edition.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм Escherichia coli - продуцент L-треонина | 2019 |
|
RU2728242C1 |
| Рекомбинантный штамм бактерии Escherichia coli - продуцент L-треонина | 2018 |
|
RU2697219C1 |
| Бактерия вида Escherichia coli - продуцент L-треонина, способ микробиологического синтеза L-треонина с ее использованием. | 2018 |
|
RU2697499C1 |
| Штамм Escherichia coli с инактивированным геном yhjE - продуцент L-треонина | 2022 |
|
RU2787585C1 |
| ДРОЖЖИ РОДА YARROWIA, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ ВНУТРИКЛЕТОЧНО НАКАПЛИВАТЬ СЛОЖНЫЕ ЭФИРЫ ЖИРНЫХ КИСЛОТ, И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ТАКИХ ЭФИРОВ | 2013 |
|
RU2539744C1 |
| Штамм Escherichia coli с инактивированным геном ttdT - продуцент L-треонина | 2019 |
|
RU2731282C1 |
| Штамм Escherichia coli - продуцент L-треонина | 2023 |
|
RU2817252C1 |
| Генотерапевтический ДНК-вектор GDTT1.8NAS12, способ его получения, штамм Escherichia coli JM110-NAS, способ его получения, штамм Escherichia coli JM110-NAS/GDTT1.8NAS12, несущий генотерапевтический ДНК-вектор GDTT1.8NAS12, способ его получения, способ производства в промышленных масштабах генотерапевтического ДНК-вектора | 2018 |
|
RU2712838C1 |
| Штамм Escherichia coli с инактивированным геном ychE - продуцент L-треонина | 2019 |
|
RU2728251C1 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ПОЛУЧЕНИЯ СТАБИЛЬНЫХ ТРАНСФОРМАНТОВ ГРИБОВ РОДА Rhizopus | 2009 |
|
RU2439157C2 |
Изобретение относится к биотехнологии, в частности к штамму - продуценту треонина. Штамм Escherichia coli ВКПМ В-11820 получен путем инактивации у штамма Escherichia coli ВКПМ В-3996 генов poxB и sstT на фоне увеличенной экспрессии гена galP за счет замены его природного промотора на синтетический промотор Ptac3 и увеличенной экспрессии генов оперона thrABC за счет замены его природного промотора на фаговый промотор PA1, удаления последовательности регуляторного пептида thrL и введения десенсибилизирующей мутации thrA433. Полученный штамм позволяет получать L-треонин с высокой эффективностью. 1 табл., 6 пр.
Штамм Escherichia coli ВКПМ В-11820 - продуцент аминокислоты L-треонина, полученный путем инактивации у штамма Escherichia coli ВКПМ В-3996 генов poxB и sstT на фоне увеличенной экспрессии гена galP за счет замены его природного промотора на синтетический промотор Ptac3 и увеличенной экспрессии генов оперона thrABC за счет замены его природного промотора на фаговый промотор PA1, удаления последовательности регуляторного пептида thrL и введения десенсибилизирующей мутации thrA433.
| US 5175107, 29.12.1992 | |||
| LEE JH Metabolic engineering of a reduced-genome strain of Escherichia coli for L-threonine production, Microb Cell Fact | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА | 2006 |
|
RU2402610C2 |
| RU 2006130318 A, 27.02.2008 | |||
| СПОСОБ ПРОДУКЦИИ ПОЛЕЗНОГО МЕТАБОЛИТА | 2008 |
|
RU2408731C2 |
Авторы
Даты
2015-04-10—Публикация
2013-11-07—Подача