Изобретение относится к биотехнологии, конкретно к процессам, связанным с получением вирусов, а именно к способу их размножения. Изобретение может быть использовано в прикладной вирусологии, производстве вакцин, нанобиотехнологии, молекулярной биологии и других областях науки и техники, где существует необходимость получения препаративных количеств вирусного материала.
Традиционные способы получения вирусов включают следующие основные операции: культивирование пермиссивной для данного вируса клеточной линии, инфицирование вирусом клеточной культуры, размножение вируса в организмах клеток-хозяев, сбор урожая вирусного материала вместе с клеточной культурой и культуральной средой [Вирусология в 3-х томах. / Под ред. Б.Филдс, Д.Найп. Москва, «Мир», 1989]. В результате этой последовательности операций получают вирусный материал, имеющий тот или иной титр, зависящий от эффективности процесса размножения вируса.
Известен способ размножения вируса [J.Vorlop, С.Frech, H.Lubben, J.-P. Gregersen. Multiplication of viruses in a cell culture. // WO: US 2005118698], включающий инфицирование пермиссивных клеток (в частности, клеток линий Vero) вирусом (например, полиомиелита или бешенства) с последующим культивированием клеток в условиях, обеспечивающих размножение вируса внутри клеток с одновременным по крайней мере двукратным размножением самих клеток. Данное техническое решение предусматривает либо суспензионное культивирование соответствующих клеток, либо их культивирование в прикрепленном (к стенкам сосуда) состоянии. В результате роста клеток и одновременного размножения в них вируса достигается более высокий удельный выход вирусного материала по сравнению с системами, где нет размножения клеток, как, например, при препаративном размножении вирусов внутри куриных яиц. Однако данному техническому решению присущи и некоторые недостатки. В частности, суспензионное культивирование пермиссивных клеток возможно лишь для очень ограниченного круга типов клеток животных, человека или растений, поскольку большинству из них для роста требуется прикрепление к какой-либо поверхности (твердому субстрату), т.е. в этом случае этот способ размножения вируса не обладает достаточной универсальностью. С дугой стороны, культивирование пермиссивных клеток в прикрепленном к стенкам сосуда состоянии не позволяет получить большого их количества, т.к. рост клеток ограничен площадью стенок культивационного сосуда, т.е. продуктивность такой системы как в отношении клеточной биомассы, так и соответственно развивающихся там вирусов невысока.
В определенной степени преодолеть этот недостаток позволяет использование так называемых микроносителей - небольших сферических частиц нерастворимого носителя, к поверхности которого прикрепляются соответствующие пермиссивные клетки, поэтому доступная для адгезии клеток площадь многократно увеличивается по сравнению с системами, где клеточная биомасса с вирусами в ней культивируется на стенках сосуда. Например, известен способ размножения вируса, используемого затем для получения антирабической вакцины, где перевиваемые клетки ВНК-21 инфицируют вирусом, размножают в течение 36-70 ч в суспензионной культуре, а затем высевают на микроносители и далее культивируют в биореакторе в течение 5-6 суток (120-144 часов) с ежедневным отбором вирусосодержащий культуральной жидкости [Н.В.Мельник, Н.И.Зенов, СВ.Крюков, А.В.Спиридонов, В.С.Иванов, С.Н.Красуткин, И.Ю.Литенкова, А.К.Елисеев, Е.В.Маслов, Л.С.Хайкина. Способ получения антирабической вакцины. // Пат. РФ №2287343; Б.И. №32 (2006)]. Применение этого известного способа позволяет повысить продуктивность биотехнологической системы в отношении целевого вируса, что после его очистки и инактивации обработкой пропиолактоном в результате приводит к более активной антирабической вакцине. Тем не менее, данное техническое решение тоже имеет определенные недостатки. Прежде всего, культивирование пермиссивных клеток на микроносителях возможно не для всех, а только для отдельных линий субстрат-зависимых клеток животных, человека или растений, т.е. этот способ не обладает достаточной универсальностью. Во-вторых, при перемешивании суспензии микроносителя с клетками, адгезионно-прикрепленными к поверхности его частиц, недостаточно прочно адсорбировавшаяся часть клеток смывается в культуральную среду, что снижает эффективность процесса в целом и загрязняет целевую вирусосодержащую жидкость посторонним биологическим материалом. В-третьих, при соударениях частиц микроносителя, а также в результате сдвиговых гидродинамических напряжений при перемешивании возможно разрушение осмотически слабых клеток, всегда присутствующих в составе популяции, что приводит прекращению размножения вируса в этих клетках (т.е. снижается выход вирусного материала) и к попаданию компонентов цитозоля и клеточного дебриса в культуральную жидкость, тем самым загрязняя ее нецелевыми ингредиентами.
В этой связи наиболее щадящим в отношении инфицированной вирусом клеточной биомассы при ее культивировании с целью размножения вируса являются методы (способы), предусматривающие стационарное состояние клеток (без движения при перемешивании суспензии самих клеток или клеток, прикрепившихся к частицам микроносителя) в ходе их культивирования и протекающего при этом размножения целевого вируса внутри таких клеток. В частности, известен способ размножения вируса в процессе культивирования пермиссивных клеток, которые адгезированы на внешней поверхности полых пористых волокон в специальном реакторе [M.J.Ford, P.H.Hissey, T.J.Pateman. Methods for the propagation of lytic organisms. // US Pat. 6780612 (2004)]. В этом случае клетки находятся в стационарном состоянии и не подвержены нежелательным механическим воздействиям, а для размножения вируса используют биореактор, содержащий полые пористые волокна из ацетилцеллюлозы, на внешней поверхности которых производят культивирование соответствующих пермиссивных клеток и вируса в них (т.е. такие пористые полые волокна выполняют роль носителя для адгезионно-прикрепляющихся к ним клеток). При этом внутреннее пространство волокон служит для прокачивания питательной среды, обеспечивающей поступление через поры носителя к клеткам всех необходимых веществ. В процессе культивирования клеток в биореакторе осуществляют замену отработанной среды на свежую в процессе ее рециркуляции. После достижения клетками определенной массы (в течение 20-80 дней) производят их инфицирование вирусом. Процесс развития вирусной инфекции отслеживают путем отбора из данного биореактора образцов культуральной среды с вирусом. Через 7-10 дней после начала вирусной инфекции производят сбор наработанного вируса. Так, для размножения аденовируса в этом способе используют клетки линии PerC6, которые сначала выращивают в культуральных флаконах в среде DMEM с добавлением 2 mM glutamax ТМ и 5% фетальной бычьей сыворотки FCS. Далее клетки помещают в биореактор с ацетилцеллюлозными полыми волокнами, имеющими поры с пределом отсечения 10 кДа (что отвечает диаметру пор не более 10 Å, или 0,001 мкм). Через внутреннее пространство полых волокон постоянно со скоростью 100-500 мл/мин прокачивают ту же питательную среду, но без добавления сыворотки; при этом прокачиваемую жидкость с помощью оксигенизационного картриджа насыщают газовой смесью 95% воздуха +5% СО2. Клетки выращивают до состояния видимой глазом конфлюентности (обычно между 20 и 80 днями), причем в ходе культивирования биомасса получает регулярное питание посредством замены части отработанной среды на свежую среду с периодичностью не менее одного раза в неделю. Добавление свежей среды и удаление отработанной производят через специализированное отверстие биореактора (отверстие для подкормки и очистки). Вирус для инфицирования пермиссивных клеток вводится через то же отверстие. Сначала для оценки развития инфекции из биореактора отбирают образцы, а через 7-10 дней после инокуляции вируса отбирают размножившийся вирусный материал. Эту операцию осуществляют путем тщательного двукратного промывания клеток на мембране культуральной средой и далее пропусканием среды через мембрану, после чего продукт сохраняют для дальнейшего анализа. В результате получают препарат, представляющий собой культуральную среду, содержащую клеточный дебрис и вирус, титр которого составляет 2×107 БОЕ/мл.
Для этого способа размножения вируса характерны достаточная защищенность пермиссивных клеток от внешних воздействий и технологичность самого процесса культивирования, позволяющая четко контролировать и поддерживать оптимальные параметры биотехнологической системы (рН и состав среды, температуру в биореакторе, концентрацию кислорода и др.), хорошие количественные показатели накопления клеточной биомассы и выхода продукта (высокий титр вирусного препарата), а также технологичность процесса сбора продукта (вирусного препарата).
Данное техническое решение как наиболее близкое к заявляемому по состоянию клеточной биомассы при размножении в ней вируса (пермиссивные клетки адсорбированы на материале пористого полимерного носителя) выбрано нами за прототип.
Недостатками способа-прототипа являются:
1) всем носителям, выполненным в виде пористых полых волокон, свойствен такой общий недостаток, как постепенное «забивание» пор носителя растущей культурой и клеточным дебрисом, образующимся при отмирании части популяции внутри биореактора [А.П.Синицын, Е.И.Райнина, В.И.Лозинский, С.Д.Спасов. Иммобилизованные клетки микроорганизмов. М.: Изд. МГУ. 1994. С.47]. Это приводит к постепенному нежелательному ухудшению гидродинамических характеристик материальных потоков в биотехнологической системе.
2) Универсальность способа-прототипа в отношении типов пермиссивных клеток также ограничена, поскольку многим субстрат-зависимым клеткам животных, человека или растений для прикрепления (адгезии) к материалу носителя необходима довольно ровная площадка для так называемого «распластывания», поэтому такие клетки не способны эффективно прикрепляться (а значит, и нормально функционировать) к сильно искривленной поверхности пористых полых волокон. Кроме того, для адгезии клеток к такому носителю используется только внешняя поверхность волокон, а большая площадь их пор клеткам не доступна вследствие микропористости материала носителя (размер пор не превышает 10 Å, или 0,001 мкм, при размерах клеток в единицы микрометров, т.е. в 10000 и более раз крупнее).
3) Выбор полимеров, из которых изготавливают подобные волокна, обычно используемые в модулях для ультрафильтрации и обратного осмоса, весьма ограничен (некоторые эфиры целлюлозы, поливинсульфон, полиамиды типа найлона), поэтому культивирование клеток, которым для адгезии на нерастворимом носителе нужны специфические «якорные» группировки, в случае реализации способа-прототипа малоэффективно, т.к. материал пористых полых волокон химически инертен и крайне сложно поддается модификации с целью введения таких группировок.
4) Оптимальный уровень работы биотехнологической системы, предусматриваемой в способе-прототипе, зависит от таких параметров, как концентрация клеток, рН среды, температура, насыщенность кислородом и др., контроль которых осуществляется не напрямую путем забора контрольных образцов (что требует разгерметизации соответствующего биореактора и сильно повышает опасность нарушения стерильности), а лишь косвенно через визуальные наблюдения и подбор оптимальных условий работы системы по выходу целевого вируса.
5) В способе-прототипе используется дорогостоящее оборудование, что существенно увеличивает себестоимость целевого продукта. Кроме того, после каждого цикла культивирования сам биореактор и его «обвязку» необходимо тщательно промывать и стерилизовать, что снижает технологичность системы в целом, особенно это касается нерастворимого носителя - блока используемых пористых полых волокон, промывка и стерилизация которых являются достаточно сложными технологическими операциями.
Задачей предлагаемого изобретения является разработка более эффективного и универсального способа размножения вируса.
Указанная задача решается тем, что размножение вируса включает культивирование пермиссивных клеток на нерастворимом пористом носителе, их дальнейшее инфицирование вирусом с последующим его размножением внутри клеток, прикрепленных к носителю, причем в качестве пермиссивных клеток используют клетки человека или животных, функцию инфицирующего вируса выполняет вирус, способный к репродукции в таких клетках, а в качестве нерастворимого пористого носителя применяют полимерный криогель с сообщающимися порами сечением 50-500 мкм. При этом в качестве инфицирующего вируса, помимо природного вируса, может быть использован и рекомбинантный вирус или соответствующая генетическая конструкция, а нерастворимый пористый носитель может содержать якорные группировки или молекулы, обеспечивающие специфическое прикрепление пермиссивных клеток к поверхности стенок пор полимерного криогеля.
Выбор путей и режимов реализации, а также характеристик используемых материалов заявляемого способа обусловлен следующими факторами:
1) предлагаемое техническое решение предусматривает культивирование пермиссивных клеток, адгезионно-прикрепленных к нерастворимому пористому носителю, и при этом в качестве носителя используется такой макропористый материал, как полимерный криогель [В.И.Лозинский. Криогели на основе природных и синтетических полимеров: получение, свойства и области применения. // Успехи химии, т.71, №6, с.559-585 (2002)], имеющий губчатую, с сообщающимися порами, морфологию, предоставляющую возможность для колонизации внутренней поверхности макропор. Это, с одной стороны, позволяет проводить объемное культивирование пермиссивных клеток (т.е. более эффективно использовать объем биореактора и дорогую питательную среду в нем), а с другой стороны, обеспечивает необходимые щадящие в отношении клеток условия их стационарного состояния во время культивирования. Хотя такой подход к культивированию некоторых типов клеток известен из уровня техники [K.Bloch, V.I.Lozinsky, I.Yu.Galaev, К. Yavriyanz, M.Vorobeychik, D.Azarov, L.G.Damshkaln, B.Mattiasson, P.Vardi. Functional activity of insulinoma cells (INS-IE) and pancreatic islets cultured in agarose cryogel sponges. // J.Biomed. Mater. Res. V.75A, №4, p.802-809 (2005)], в отношении клеток, в которых протекают процессы размножения вируса, подобное (т.е. предлагаемое) техническое решение ранее не было описано.
2) В качестве клеток, в которых проводится размножение вируса, заявляемый способ предусматривает использование клеток человека или животных, являющихся пермиссивными для каждого конкретного вируса. К таким клеткам, как известно [Вирусология. Методы. // Под ред. Б.Мейхи, «Мир», 1988], относятся клетки линий 293НЕК, CV-1, LMH, DK, 293Т, MDCK, CEF и любых других, в которых возможна репродукция вируса, необходимого в каждом частном случае.
3) В качестве инфицирующего агента, который затем размножают согласно предлагаемому техническому решению, в заявляемом способе предусматривается использование как вируса человека или животных, способного инфицировать соответствующие пермиссивные клетки и далее размножаться в них (см. предыдущий пункт), так и использование рекомбинантных вирусов или соответствующих генетических конструкций, включающих полную нуклеотидную последовательность генома рекомбинантного вируса или ее фрагменты, также способных к генерации вирусных частиц с их последующим размножением в пермиссивной культуре клеток. В частности, изобретением предусматривается использование ДНК-содержащих рекомбинантных вирусов, таких как аденовирус человека или животных (например, аденовирус человека 5-го серотипа, аденовирус человека 35-го серотипа, аденовирус птиц FAV-1 (CELO), аденовирус собак 2-го серотипа CAV и др.), поксвирус (вирус осповакцины, вирус оспы канареек), и РНК-содержащих рекомбинантных вирусов, таких как ретровирус человека или животных и др.
4) Принципиальным моментом предлагаемого изобретения является использование полимерного криогеля с сообщающимися порами сечением 50-500 мкм в качестве нерастворимого пористого носителя при культивировании пермиссивных клеток и размножении вируса в них. Указанные полимерные материалы получают приемами так называемого криотропного гелеобразования согласно известным способам [В.И.Лозинский, Е.С.Вайнерман, С.В.Рогожин. Способ получения макропористых полимерных материалов. // А.с. СССР №1008214 (1982), Б.И. №12 (1983); В.И.Лозинский, И.А.Сименел, А.В.Чебышев. Способ получения пористого материала. // Пат. РФ №2035476 (1994), Б.И. №14 (1995); В.И.Лозинский, Т.В.Гнездилова. Способ получения губчатого материала. // Пат. РФ №2053796 (1992), Б.И. №4 (1996); В.И.Лозинский, А.Л.Зубов. Способ получения макропористого полимерного материала. // Пат. РФ №2078099 (1994); Б.И. №12 (1997); В.И.Лозинский, Л.Г.Дамшкалн, Ф.М.Плиева, И.Ю.Галаев, Б.Маттиассон. Полимерная композиция для получения макропористого агарозного геля и способ его получения. // Пат. РФ №2220987 (2001); Б.И. №1 (2004)] либо из низкомолекулярных (мономерных), либо из высокомолекулярных (полимерных) предшественников. В зависимости от природы предшественников, их начальной концентрации и режимов криогенной обработки гелеобразующей системы можно получать либо макропористые криогели с сечением от долей до примерно 10 мкм, либо сверхмакропористые (губчатые) гелевые материалы с сечением пор в десятки и сотни мкм. Причем характер пористости у обоих типов криогелей сходный: все эти гелевые матрицы имеют сообщающиеся крупные поры [V.I.Lozinsky, I.Yu.Galaev, F.M.Plieva, I.N.Savina, H.Jungvid, B.Mattiasson. Polymeric cryogels as promising materials of biotechnological interest. // Trends in Biotechnol. V.21, №10, p.445-451 (2003)]. Предлагаемое изобретение предусматривает использование второго из указанных типов криогелей в качестве носителей для культивирования пермиссивных клеток при размножении целевого вируса; при этом именно благодаря взаимосвязанной системе таких макропор появляется возможность колонизации (заселения) клеточной биомассой всего объема нерастворимого носителя. Заявляемый диапазон сечения пор выбран на основании экспериментов таковым, чтобы обеспечить условия свободного проникновения соответствующих пермиссивных клеток в объем пористого носителя, прикрепления клеток к стенкам макропор и последующего роста биомассы. При сечении пор менее примерно 50 мкм возникают стерические затруднения для указанных процессов, особенно в случае крупных пермиссивных клеток, а при сечении пор более примерно 500 мкм дальнейшее улучшение процесса заселения носителя уже не достигается, а площадь поверхности стенок макропор, доступная для прикрепления клеток, заметно уменьшается, что снижает эффективность биотехнологического процесса в целом.
5) Предлагаемое техническое решение не конкретизирует химическую природу используемого нерастворимого пористого носителя - полимерного криогеля, к внутренней поверхности стенок макропор которого прикрепляются пермиссивные клетки, применяемые затем для размножения целевого вируса, поскольку для каждой из культур клеток разные вещества, входящие в состав стенок макропор того или иного криогеля, могут быть подходящим или неподходящим субстратом для адгезионного прикрепления таких клеток. В то же время теория, позволяющая предсказать заранее подобное соответствие культуры клеток и природы нерастворимого носителя, к которому конкретные клетки проявляют сродство для эффективного прикрепления и «распластывания», в настоящее время отсутствует. Существуют лишь некоторые общие представления, основанные на эмпирических наблюдениях [Animal Cell Biotechnology: Methods and Protocols. // 2nd edn., R.Portner ed., Humana Press, 2007]. В этой связи предлагаемым изобретением предусматривается, что нерастворимый пористый носитель содержит якорные группировки или молекулы, обеспечивающие специфическое прикрепление соответствующих пермиссивных клеток к поверхности пор полимерного криогеля. При этом сам криогель может быть приготовлен на основе как природных, так и синтетических полимеров, биосовместимых с конкретными клетками и размножаемым вирусом, а вышеуказанные якорные группировки или молекулы могут входить как в состав собственно полимерного вещества, из которого приготовлен криогель, так и быть введены в криогель после его формирования, что достигается известными способами, например химической прививкой.
Такое сочетание признаков, как совокупность используемых в заявляемом техническом решении операций процесса размножения вируса и применяемых для этого нерастворимых пористых носителей - полимерных криогелей, ранее известно не было, поэтому предлагаемое изобретение отвечает критерию «новизна».
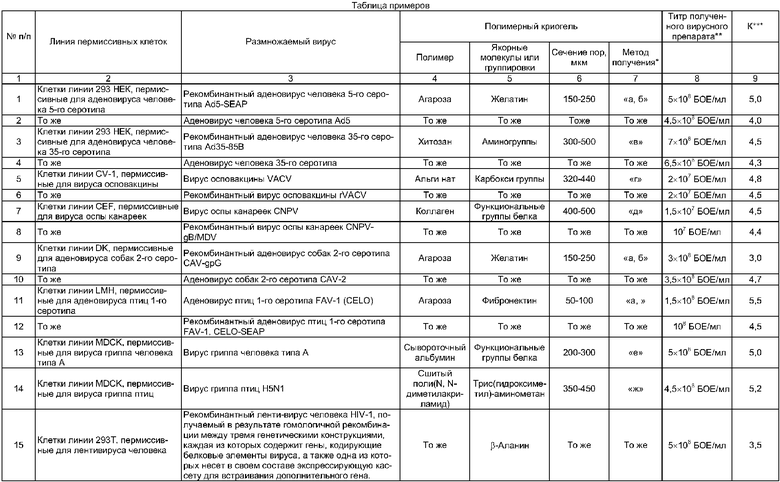
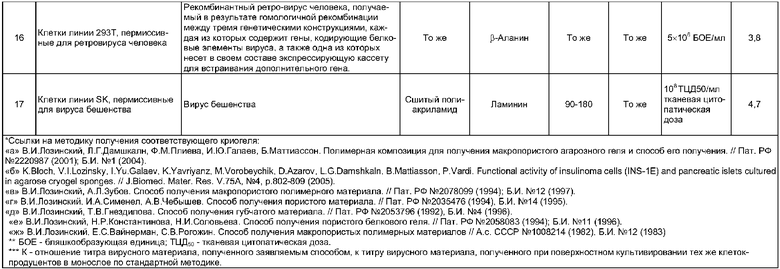
Ниже приводится конкретный типичный пример реализации предлагаемого способа; остальные примеры, подтверждающие широту заявляемых его диапазонов, сведены в таблицу.
Пример. Размножение аденовируса Ad5-SEAP
а) Размножение вируса по стандартной методике (контроль)
Пермиссивные для аденовируса человека 5-го серотипа клетки линии 293 культивируют в 162 см2-культуральном флаконе в среде DMEM с добавлением 5% фетальной бычьей сыворотки. Затем 104 клеток данной культуры, содержащиеся в объеме культуральной среды, равном 0,5 мл, вносят в культуральную пластиковую чашку диаметром 3 см, затем добавляют 1,5 мл питательной среды DMEM с 5% фетальной бычьей сыворотки. Клетки инкубируют в течение 24 часов при 37°С и 5% СО2, после чего их инфицируют вирусом Ad5-SEAP в количестве 150 БОЕ/кл. Через 48 ч после инфекции, после наступления цитопатического действия вируса (данные микроскопирования), клетки с культуральной средой трехкратно перемораживают для разрушения клеток и выхода вируса. Титр вируса Ad5-SEAP, содержащегося в культуральной среде, составляет 108 БОЕ/мл.
б) Размножение вируса заявляемым способом
Пермиссивные для аденовируса человека 5-го серотипа клетки линии 293 культивируют в 162 см2-культуральном флаконе в среде DMEM с добавлением 5% фетальной бычьей сыворотки. Затем 5×104 клеток данной культуры, содержащиеся в объеме культуральной среды, равном 0,5 мл, наносят на поверхность диска агарозного криогеля, приготовленного известным способом [В.И.Лозинский, Л.Г.Дамшкалн, Ф.М.Плиева, И.Ю.Галаев, Б.Маттиассон. Полимерная композиция для получения макропористого агарозного геля и способ его получения. // Пат. РФ №2220987 (2001); Б.И. №1 (2004)] и имеющего сообщающиеся поры сечением 150-250 мкм, причем к поверхности пор полимерного криогеля известным способом присоединены якорные молекулы желатина [K.Bloch, V.I.Lozinsky, I.Yu.Galaev, К.Yavriyanz, M.Vorobeychik, D.Azarov, L.G.Damshkaln, B.Mattiasson, P.Vardi. Functional activity of insulinoma cells (INS-1E) and pancreatic islets cultured in agarose cryogel sponges. // J.Biomed. Mater. Res. V.75A, №4, P.802-809 (2005)]. Диаметр диска 3 см; его помещают в чашку Петри того же диаметра. Для адгезии клеток на носителе производят их инкубацию в течение 4 ч при 37°С и 5% CO2. По истечении срока инкубации добавляют 1,5 мл питательной среды DMEM с 5% фетальной бычьей сыворотки (общий конечный объем среды составляет 2 мл). Затем клетки инкубируют в течение 6 дней при 37°С и 5% СО2, производя ежедневный контроль динамики роста биомассы путем микроскопирования. На 6-й день инкубации клетки инфицируют вирусом Ad5-SEAP в количестве 150 БОЕ/кл. Через 48-96 ч после инфекции, после наступления цитопатического действия вируса (данные микроскопирования), криогель с клетками и культуральной средой трехкратно перемораживают для разрушения клеток и выхода вируса. В качестве стандарта при титровании используют культуральный препарат вируса Ad5-SEAP, полученный при инфекции того же количества клеток такой же дозой вируса. Титр вируса, полученного заявляемым способом и содержащегося в культуральной среде, составляет 5×108 БОЕ/мл вируса Ad5-SEAP, что в 5 раз выше стандартной методики (см. 1а).
Таким образом, заявляемый способ имеет следующие преимущества по сравнению с аналогами и прототипом:
1) в противоположность способу-прототипу заявляемое техническое решение избавлено от нежелательного эффекта постепенного «забивания» пор носителя растущей культурой и клеточным дебрисом. Это обусловлено как крупнопористостью используемого носителя (полимерный криогель с сообщающимися порами сечением 50-500 мкм), так и стационарным режимом культивирования пермиссивных для конкретного вируса клеток (т.е. отсутствием потоков жидкой среды в системе).
2) Поскольку развитая поверхность стенок макропор в полимерных криогелях имеет большую площадь участков малой степени кривизны, то заявляемый способ обладает существенно большей по сравнению с прототипом универсальностью в отношении типов пермиссивных клеток, т.к. в таком носителе имеются благоприятные условия (ровные площадки) для прикрепления (адгезии) субстрат-зависимых клеток к материалу носителя и их «распластывания». Кроме того, в заявляемом способе для адгезии клеток к такому носителю используется не только внешняя поверхность носителя, как в способе-прототипе, а большая площадь стенок макропор полимерного криогеля, т.е. более эффективно используется весь объем носителя и, как следствие, дорогая культуральная среда.
3) Выбор полимеров, из которых изготовлен тот или иной криогель, используемый в заявляемом техническом решении, практически неограничен [В.И.Лозинский. Криогели на основе природных и синтетических полимеров: получение, свойства и области применения. // Успехи химии, т.71, №6, с.559-585 (2002)], так же как и очень широк известный набор методов введения туда необходимых якорных группировок, что также дополнительно повышает универсальность предлагаемого способа.
4) В отличие от прототипа, где контроль процесса культивирования клеток осуществляется не напрямую, а путем забора контрольных образцов (что требует разгерметизации соответствующего биореактора и сильно повышает опасность нарушения стерильности), в заявляемом техническом решении благодаря достаточной прозрачности носителя - полимерного криогеля - имеется возможность прямого наблюдения за ростом пермиссивных клеток простым методом оптической микроскопии.
5) Заявляемый способ не требует использования дорогостоящего оборудования, что существенно снижает себестоимость целевого продукта.
6) Универсальность заявляемого способа также подтверждается существенным увеличением в 3-5 и более раз выхода целевого вируса по сравнению со стандартным методом поверхностного культивирования пермиссивных клеток и размножаемого вируса в них (коэффициент К в таблице примеров) вне зависимости от типов клеток и вирусов (или генетических конструкций, включающих полную нуклеотидную последовательность генома рекомбинантного вируса или ее фрагменты).
7) К преимуществам предлагаемого технического решения также относится уменьшение (по сравнению с аналогами и прототипом) затрат на культуральную посуду и вещества, обеспечивающие клеточный рост и питание (в 3-5 раз снижаются затраты на вещества, обеспечивающие клеточный рост и питание, и до 5 раз на культуральную посуду).
8) Также оказалось, что при использовании заявляемого технического решения существенно (в 4-8 раз) сокращается срок получения вирусного препарата по сравнению с размножением вируса в клетках, культивируемых на пористых волокнах по способу-прототипу.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММОБИЛИЗОВАННЫЙ БИОКАТАЛИЗАТОР ДЛЯ МИКРОБИОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ ПЕКТИНАЗ | 2008 |
|
RU2383618C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА РЕКОМБИНАНТНОГО АДЕНОВИРУСА, ХАРАКТЕРИЗУЮЩЕГОСЯ СНИЖЕННЫМ КОЭФФИЦИЕНТОМ СООТНОШЕНИЯ ФИЗИЧЕСКИХ И ИНФЕКЦИОННЫХ ВИРУСНЫХ ЧАСТИЦ, И ГЕННО-ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ, ПОЛУЧЕННЫЙ ТАКИМ СПОСОБОМ | 2009 |
|
RU2443779C2 |
| КОМПОЗИЦИЯ ДЛЯ ФОРМИРОВАНИЯ МАКРОПОРИСТОГО НОСИТЕЛЯ, ИСПОЛЬЗУЕМОГО ПРИ ТРЕХМЕРНОМ КУЛЬТИВИРОВАНИИ КЛЕТОК ЖИВОТНЫХ ИЛИ ЧЕЛОВЕКА, И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО НОСИТЕЛЯ | 2015 |
|
RU2594427C1 |
| БИОПОЛИМЕРНЫЙ МАТЕРИАЛ ДЛЯ КЛЕТОЧНО-ИНЖЕНЕРНЫХ И/ИЛИ ТКАНЕИНЖЕНЕРНЫХ КОНСТРУКЦИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2021 |
|
RU2774947C1 |
| ИММОБИЛИЗОВАННЫЙ БИОКАТАЛИЗАТОР ДЛЯ МИКРОБНОЙ БИОТРАНСФОРМАЦИИ СТЕРОИДНЫХ СОЕДИНЕНИЙ | 2013 |
|
RU2524434C1 |
| СПОСОБ ОЧИСТКИ РЕКОМБИНАНТНЫХ АДЕНОВИРУСОВ МЛЕКОПИТАЮЩИХ И ЧЕЛОВЕКА | 2011 |
|
RU2465327C1 |
| СПОСОБ КРИОКОНСЕРВАЦИИ КЛЕТОК ФОТОТРОФНЫХ МИКРООРГАНИЗМОВ | 2012 |
|
RU2508397C1 |
| ИММОБИЛИЗОВАННЫЙ БИОКАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ ФУМАРОВОЙ КИСЛОТЫ | 2015 |
|
RU2626528C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИРАБИЧЕСКОЙ ВАКЦИНЫ | 2005 |
|
RU2287343C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ТРЕХМЕРНЫХ КОМПЛЕКСОВ КЛЕТОК И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2006 |
|
RU2323971C1 |
Изобретение относится к биотехнологии и вирусологии. Способ размножения вируса предусматривает культивирование пермиссивных клеток на нерастворимом пористом носителе, их дальнейшее инфицирование вирусом с последующим его размножением внутри клеток, прикрепленных к носителю. При этом в качестве пермиссивных клеток используют клетки человека или животных, функцию инфицирующего вируса выполняет вирус, способный к репродукции в таких клетках, а в качестве нерастворимого пористого носителя применяют полимерный криогель с сообщающимися порами сечением 50-500 мкм. В результате реализации предлагаемого изобретения достигается эффект исключения нежелательного «забивания» пор носителя растущей культурой и клеточным дебрисом, обеспечивается большая универсальность способа в отношении типов пермиссивных клеток, более эффективно используются весь объем носителя и культуральная среда, снижается опасность нарушения стерильности, снижается себестоимость целевого продукта, повышается выход целевого вируса. Изобретение может быть использовано в прикладной вирусологии, производстве вакцин, нанобиотехнологии, молекулярной биологии и других областях науки и техники, где существует необходимость получения препаративных количеств вирусного материала. 2 з.п. ф-лы, 1 табл.
1. Способ размножения вируса, включающий культивирование пермиссивных клеток на нерастворимом пористом носителе, их дальнейшее инфицирование вирусом с последующим его размножением внутри клеток, прикрепленных к носителю, отличающийся тем, что в качестве пермиссивных клеток используют клетки человека или животных, функцию инфицирующего вируса выполняет вирус, способный к репродукции в таких клетках, а в качестве нерастворимого пористого носителя применяют полимерный криогель с сообщающимися порами сечением 50-500 мкм, культивирование клеток в матрице которого осуществляют в течение 5-6 суток, при этом инфицирующий вирус вносится в систему в количестве до 150 БОЕ/кл., а при снятии размножившегося вируса с носителя используют трехкратное перемораживание системы «вирус + клетка + криогель».
2. Способ по п.1, отличающийся тем, что функцию инфицирующего вируса выполняет рекомбинатный вирус или соответствующая генетическая конструкция.
3. Способ по п.1, отличающийся тем, что нерастворимый пористый носитель содержит якорные группировки или молекулы, обеспечивающие специфическое прикрепление пермиссивных клеток к поверхности стенок пор полимерного криогеля.
| US 6780612, 24.08.2004 | |||
| BLOCH K | |||
| et al., "Functional activity of insulinoma cells (INS-1E) and pancreatic islets cultured in agarose cryogel sponges", J Biomed Mater Res A | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| NILSANG S | |||
| et al., "Monoclonal antibody production using a new supermacroporous cryogel bioreactor", Biotechnol Prog | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2010-02-10—Публикация
2008-03-04—Подача