Изобретение относится к биотехнологии, в частности к генетической инженерии, и позволяет получать микробиологическим синтезом по упрощенной технологии новый гибридный полипептид GST-CFP10 со свойствами видоспецифичного белка-антигена Mycobacterium tuberculosis CFP10, который может быть использован для ранней видоспецифичной диагностики туберкулезной инфекции.
Разнообразие форм туберкулеза, распространение стертой картины заболевания, а также индивидуальная реакция организма на инфекцию представляют собой серьезную проблему для диагностики туберкулезной инфекции вообще и для ранней диагностики в частности.
Классическая методология диагностики туберкулеза связана с применением кожных реакций на введение туберкулина (PPD) - очищенного деривата протеина [1]. Однако проблема специфичности и чувствительности кожных тестов в случае лиц, вакцинированных BCG, не позволяет отличить их от индивидуумов, инфицированных патогенными микобактериями туберкулеза, в данном тесте [2]. Одна из причин получения ложноположительных результатов в реакции Манту связана с проявлением кросс-реактивности к нетуберкулезным микобактериям. Около 10% лиц проявляют реактивность к нетуберкулезным микобактериям, из которых 30% оказываются позитивными в кожном тесте.
Среди классических методов диагностики туберкулеза наибольшей специфичностью обладает метод идентификации культуры возбудителя в посеве исследуемого образца. Широкое распространение получили также цитологические (микроскопические) методы определения микобактерий в мазках после окраски красителем. Однако оба этих метода оказываются малопригодными при небациллярных формах туберкулеза, когда микобактерии отсутствуют в биопробах. Кроме того, культивирование микобактерии ввиду их медленного роста является длительной процедурой, а цитологическая идентификация не обладает достаточной чувствительностью, чревата ошибками и в значительной степени зависит от квалификации персонала.
Методы серодиагностики, основанные на определении антител к антигенам микобактерий, в настоящее время нашли широкое применение для скрининговых исследований благодаря относительно невысокой стоимости, быстроте постановки используемых процедур, высокой чувствительности и специфичности среди инфицированных лиц [3]. Серологические методы отличаются большим разнообразием. Чувствительность и специфичность тестов, использующих технологию иммуноферментного анализа (ИФА), варьируется в довольно широком диапазоне и составляет 40-85% и 67-100% соответственно. С одной стороны, это связано с тем, что зачастую показатели гуморального иммунного ответа при туберкулезе снижены, и это, в свою очередь, приводит к тому, что антитела, полученные в организме человека, к вирулентным микобактериям, вызывающим туберкулез у человека, перекрестно реагируют с набором антигенов непатогенных микобактерий и многих возбудителей других болезней. С другой стороны, антимикобактериальная и гормональная терапия оказывают супрессирующее влияние на продукцию антител при туберкулезе. Именно последний фактор является основным при выявлении маркеров гуморального иммунитета у больных туберкулезом, поскольку снижение уровня антител влечет за собой и снижение доли позитивных результатов в ИФА, которая оказывается сравнительно невысокой [4].
В литературе описано большое количество новых белков (полипептидов) микобактерий туберкулезного комплекса, которые могут быть использованы в диагностических тестах. Известны и нуклеотидные последовательности, кодирующие эти белки. Большая часть этой коллекции имеет сходства с белками других видов рода Mycobacterium и даже бактерий других родов. Некоторое количество белков культурального фильтрата, секретируемых микобактериями М. tuberculosis и обладающих иммуногенной и ферментативной активностью, ассоциированы с патогенезом. Однако полный анализ белковой композиции (состава) в этих фракциях остается до конца не изученным [5].
При развитии туберкулезной инфекции важная роль принадлежит Т-лимфоцитам и другим Т-клеткам или Т-клеточным эффекторам (например, CD4, CD8) [6]. Так, например, СВ4-Т-клетки продуцируют иммунный интерферон (гамма-интерферон, IFN-γ), который является стимулятором выработки в инфицированном организме антимикобактериальных макрофагов, как показано на мышиных моделях [7], а также активатором макрофагов человека при подавлении инфекции М.tuberculosis [8].
Сопоставление характера изменения Т-клеточного и В-клеточного звеньев иммунитета позволяет выявить уровень защитной реакции иммунной системы организма, направленной на синтез антител к бактериальным антигенам. Изучение состояния внутриклеточной функциональной активности иммунокомпетентных клеток позволяет получить сведения о патологическом процессе [9].
Высокий уровень продукции γ-IFN стимулирует Т-клеточную активацию, характеризуя клеточный иммунитет при туберкулезной инвазии. Выбор в качестве прогностического фактора в диагностике туберкулеза γ-интерферона является не случайным. Нарушение функционирования в цепи IFN является отражением нарушения функции иммунной системы [10].
γ-IFN-анализ основывается на количественном определении уровня γ-IFN при стимуляции лимфоцитов цельной клеточной крови, инкубированных в течение 16-20 часов с белковыми антигенами М. tuberculosis и контрольными антигенами. В результате стимуляции эффекторов Т-клеток в крови происходит быстрая секреция цитокинов, ответственных за эффекторные функции клеточного иммунного ответа, при этом IFN-γ является одним из немногих цитокинов, который продуцируется в этом процессе и служит специфическим маркером для клеточных медиаторов иммунного ответа.
В качестве комплекса микобактериальных антигенов для такого рода диагностических исследований могут быть использованы туберкулин (PPD) или культуральные фильтраты (CF) М.tuberculosis H37Rv. В отличие от кожного теста γ-IFN-анализ позволяет проводить дифференцирование между BCG-вакцинированными и инфицированными пациентами. Как правило, результаты исследования клинических изолятов с использованием гамма-интерферонового анализа выявляют более низкий процент вакцинированных, имеющих позитивный результат на наличие туберкулезной инфекции, чем данные кожного теста. Такое различие указывает на то, что результаты кожной пробы с использованием PPD имеют низкую специфичность в случае BCG-вакцинированных пациентов.
Наиболее подходящими полипептидами, играющими роль микобактериальных антигенов в гамма-интерфероновом анализе, являются белки, высокоспецифичные для вирулентных штаммов возбудителей туберкулеза и одновременно отсутствующие в вакцинных штаммах BCG.
Применение видоспецифичных белков позволяет дифференцировать различные фазы развития туберкулезной инфекции в отличие от других белков М.tuberculosis, например, использование белка с молекулярной массой 19 кДа, а высокий уровень Т-клеточного ответа на видоспецифичные антигены коррелирует с протективным иммунитетом при туберкулезе и с риском развития активной формы туберкулеза.
Известен белок CFP10, впервые идентифицированный Berthet FX с соавторами [11], как высокоспецифичный именно для вирулентных видов возбудителей туберкулеза. В виде нативного белка CFP10 был обнаружен в цитозольной фракции и клеточной стенке микобактерий, а также в культуральной жидкости. Молекулярная масса очищенного нативного белка равна 14 кДа. Основное преимущество этого белка в том, что в геномах вакцинных штаммов BCG отсутствует нуклеотидная последовательность, кодирующая его [12]. CFP10 является основным антигеном, вызывающим развитие раннего Т-клеточного ответа. Этот процесс сопровождается повышенной продукцией γ-IFN. Ген белка CFP10 входит в состав геномного фрагмента RD1 размером 9,5 тыс. п.н., присутствующего в геномах штаммов М. tuberculosis и М. bovis, в том числе и в лабораторных штаммах М. tuberculosis (H37Rv, H37Ra). Но эта нуклеотидная последовательность (RD1-область) отсутствует во всех вакцинных штаммах М. bovis BCG, а это означает, что CFP10 также отсутствует в вакцинных препаратах, что и позволяет использовать его в диагностических целях [12].
Выделение и очистка белка CFP10 из культурального фильтрата микобактерий является дорогостоящей и сложной процедурой, выход продукта при этом оказывается чрезвычайно низким. Именно поэтому применение техники рекомбинантных ДНК для получения указанного белка для практических целей диагностики является экономически более целесообразным.
Известен генно-инженерный способ получения рекомбинантного полипептида со свойствами микобактериального антигена CFP10, используемого для диагностических целей [11]. В этом случае получают целевой белок с 6-ю гистидиновыми (6 His) аминокислотными остатками на N-конце.
Наиболее близким аналогом (прототипом) является изобретение по патенту РФ №2277540, в котором объектами патентования являются:
- гибридный белок, содержащий полный белок CFP10 из M.tuberculosis, слитый с полным белком ESAT6 из M.tuberculosis через линкерную аминокислотную последовательность;
- рекомбинантная плазмидная ДНК pTBD16 для экспрессии гибридного белка CFP10-ESAT6.
- штамм E.coli DLT1270, трансформированный полученной рекомбинантной плазмидной ДНК pTBD16 - продуцент гибридного белка CFP10-ESAT6 [14].
Однако предлагаемая конструкция не позволяет нарабатывать препаративные количества этого полипептида. Кроме того, в процессе биотехнологической очистки полученного рекомбинантного полипептида CFP10 последний претерпевает значительную деградацию, что сказывается на его иммуногенных свойствах.
Техническим результатом изобретения является создание рекомбинантного штамма бактерий Escherichia coli - продуцента гибридного полипептида со свойствами видоспецифичного микобактериального антигена CFP10, имеющего такую конструкцию, которая бы позволяла нарабатывать целевой высокоочищенный полипептид в препаративных количествах при сохранении иммуногенных свойств последнего.
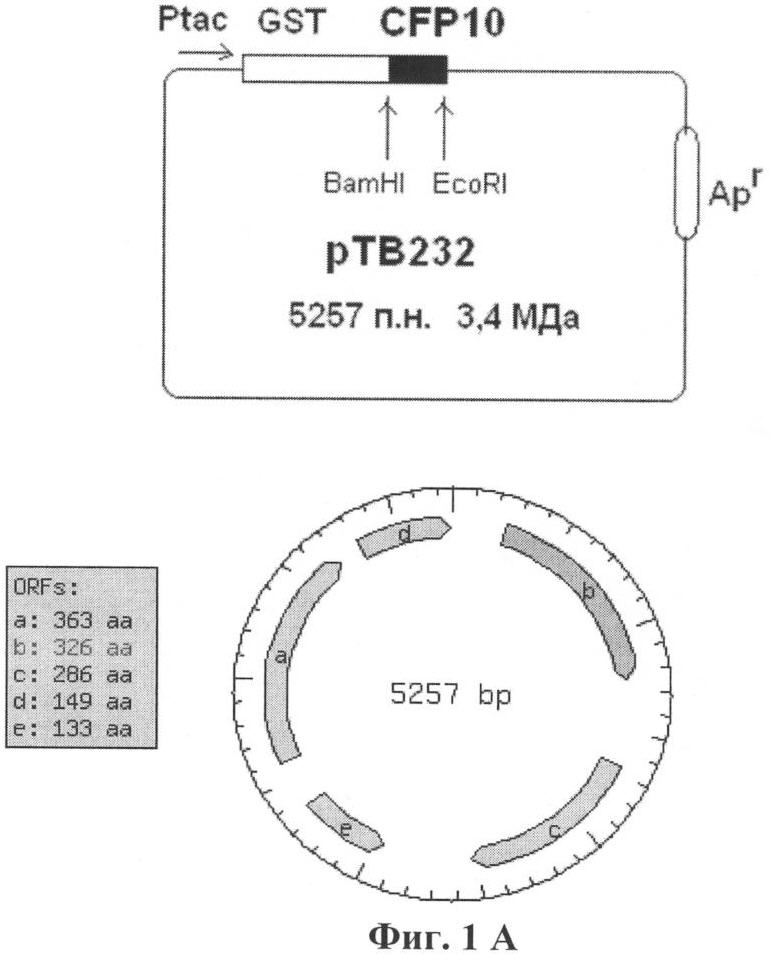
Указанный результат достигается путем конструирования рекомбинантной плазмидной ДНК рТВ232, кодирующей химерный полипептид: глутатион-S-трансфераза (GST)+CFP10 (далее rCFP10). При этом ген, кодирующий полипептид со свойствами микобактериального антигена CFP10, находится в одной рамке считывания с геном глутатион-S-трансферазы из Schistosoma japonicum (GST S.j.) (Фиг.1А и Б).
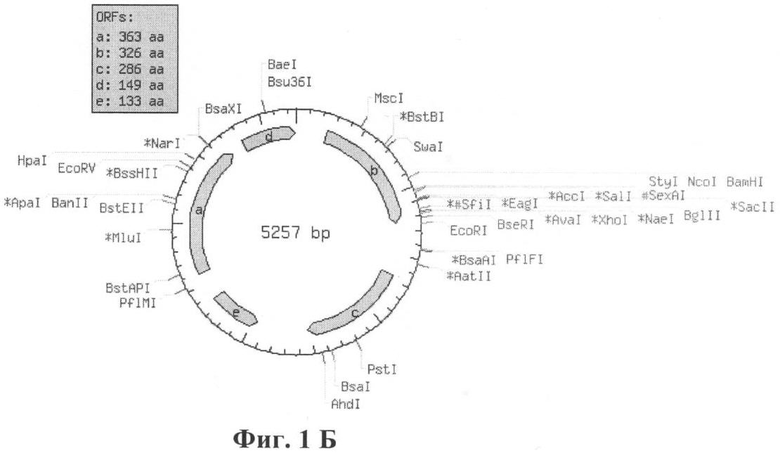
Рекомбинантная плазмидная ДНК рТВ232 (Фиг.1А и 1Б) со средней молекулярной массой 3,4 МДа имеет размер 5257 п.н. (изображения конструкции плазмиды, рестриктной карты, расчет размера выполнены с помощью программы NEBcutter V2.0 (UK) в режиме on-line (http://tools.neb.com/NEBcutter2/index.php)) и состоит из следующих элементов:
- EcoRI-BamHI-фрагмента векторной плазмиды pGEX-2T (Pharmacia Biotech) размером 4938 п.н., содержащего ген β-лактамазы, индуцируемый tac-промотор, внутренний ген lacIq, кодирующий белок-репрессор лактозного оперона, фрагмент гена глутатион-S-трансферазы из S. japonicum с множественным сайтом для клонирования (МСК) генов в 3'-концевой части этого гена и нуклеотидной последовательностью, кодирующей сайт протеолиза тромбина и располагающейся перед МСК;
- EcoRI-BamHI-фрагмента размером 319 п.н., содержащего фланкированный сайтами для эндонуклеаз рестрикции EcoRI и BamHI полный ген белка CFP10, полученный амплификацией соответствующего гену фрагмента с геномной ДНК М. tuberculosis;
содержит:
- в качестве генетического маркера ген β-лактамазы, детерминирующий устойчивость трансформированных плазмидой рТВ232 клеток Е.coli к антибиотику ампициллину;
- уникальные сайты рестрикции: BamHI - 930/934, EcoRI - 1249/1253 (указаны позиции расщепления соответствующими эндонуклеазами рестрикции по обеим цепям, нумерация при этом проводится по одной цепи).
Наличие в составе рекомбинантного полипептида rCFP10 GST-фрагмента позволяет нарабатывать препаративные количества целевого белка с использованием аффинной хроматографии. Данные свойства конструкции важны для биотехнологического цикла, связанного в выделением рекомбинантного белка. Именно наличие GST-фрагмента позволяет облегчить процесс очистки рекомбинантного полипептида и получать высокоочищенный белок со свойствами микобактериального антигена CFP10. В виде рекомбинантного слитного белка rCFP10 не подвергается деградации и оказывается существенно устойчивее аналогичного, содержащего в С-концевой части ESAT-6, ранее нами полученного (патент РФ №2282661). По-видимому, присутствие GST-фрагмента в составе химерного белка позволяет защитить его от воздействия ферментов крови при стимуляции цельной клеточной культуры крови в процессе диагностического анализа. Пролонгирование его действия при стимуляции цельной крови или мононуклеарных клеток цельной крови с использованием такого рода структур относится к важным факторам стабильности таких белков. При этом иммуногенные свойства предлагаемой химерной структуры полипептида не утрачиваются. Принципиальным отличием предлагаемого химерного полипептида от исходного в прототипе CFP10 является то, что рекомбинантный белок, полученный в результате экспрессии, является единым образованием, включающим иммунодоминантные видоспецифические структурные эпитопы нативного белка CFP10 и не обладающим функциональной активностью GST-фрагмента. Расположенный между полипептидными фрагментами GST и CFP10 (Фиг.2) сайт гидролиза тромбина позволяет при необходимости получать микобактериальный антиген CFP10, свободный от N-концевого полипептидного фрагмента GST. Рекомбинантный антиген CFP10 на N-конце после расщепления тромбином будет содержать только два дополнительных аминокислотных остатка: глицин является N-концевым, серин - вторым аминокислотным остатком, далее следует аминокислотная последовательность, строго соответствующая целевому белку CFP10.
Для получения бактериального штамма-продуцента химерного белка rCFP10 компетентные клетки Е.coli BL21 трансформируют сконструированной целевой плазмидой рТВ232. Полученный штамм бактерий Е.coli BL21/pTB232 характеризуется следующими признаками:
Морфологические признаки. По морфологическим признакам штамм-продуцент рекомбинантного белка rCFP10 не отличается от исходного штамма Е.coli BL21, не содержащего целевую плазмиду.
Культуральные признаки. По культуральным признакам штамм-продуцент рекомбинантного белка rCFP10 не отличается от исходного штамма Е.coli BL21, не содержащего целевую плазмиду.
Устойчивость к антибиотикам. Клетки штамма-продуцента рекомбинантного белка rCFP10 проявляют устойчивость к ампициллину, обусловленную наличием целевой плазмиды.
Существенным отличием штамма Е.coli BL21/pTB232 является то, что он обеспечивает синтез химерного полипептида rCFP10 (GST-CFP10) со свойствами микобактериального антигена CFP10 с уровнем экспрессии 1,8-12 мг/мл белка.
Полученный штамм депонирован в Коллекции культур микроорганизмов (ККМ) ФГУН ГНЦ ВБ "Вектор" Роспотребнадзора под номером В-1027.
Химерный полипептид rCFP10 (GST-CFP10) (Фиг.2), продуцируемый рекомбинантным штаммом BL21/pTB232 Е.coli, содержит в качестве белка-носителя N-концевой полипептидный фрагмент глутатион-S-трансферазы S.j. (226 а.о. с молекулярной массой 26,3 кДа; расчет проведен с использованием программы Compute pl/Mw tool (Switzerland) в режиме on-line (http://cn.expasy.org/tools/pi tool.html), соединенный через свой концевой сайт гидролиза тромбина (LVPR^GS) с С-концевым полипептидным фрагментом видоспецифичного микобактериального антигена CFP10 (100 а.о. с молекулярной массой 10,8 кДа; расчет проведен с использованием программы Compute pl/Mw tool), и имеет полную аминокислотную последовательность (326 а.о., 37,1 кДа; расчет проведен с использованием программы Compute pl/Mw tool), приведенную на Фиг.3.
Изобретение иллюстрируется следующими графическими материалами.
Фиг.1А. Схема организации рекомбинантной плазмиды рТВ232, где GST - ген белка глутатион-3-трансферазы; CFP10 - клонированный фрагмент, полученный амплификацией с помощью ПЦР и включающий полный ген белка CFP10; уникальные BamHI- и EcoRI-сайты эндонуклеаз рестрикции, использованные при создании данной конструкции; ptac - синтетический промотор, присутствующий в векторной (pGEX-2T) и рекомбинантной плазмидах; ApR - ген β-лактамазы (bla-ген), обеспечивающий трансформированным бактериальным клеткам устойчивость к ампициллину.
Фиг.1Б. Рестрикционная карта целевой плазмиды рТВ232. Изображение конструкции плазмиды рТВ232 (5257 п.н.). b - слитный рекомбинантный белок GST-CFP10 размером 326 а.о. Изображения построены с помощью программы NEBcutter V2.0 (UK) (http://tools.neb.com/NEBcutter2/index.php) [Vincze, Т., Posfai, J. and Roberts, R.J. NEBcutter: a program to cleave DNA with restriction enzymes. Nucleic Acids Res. 31: 3688-3691 (2003)], доступной в режиме online.
Фиг.2. Участки стыковки при внедрении гена esxB плазмиды рТВ232 в ген глутатион-S-трансферазы (gst) в сравнении с аналогичным участком в исходной (векторной) плазмиде pGEX-2T. НП - нуклеотидная последовательность, АП - аминокислотная последовательность. Первый кодон белка-встройки показан после нуклеотидной последовательности сайта протеолиза тромбина, стоп-кодон - в конце гена-встройки подчеркнут.
Фиг.3А и Б. Полная нуклеотидная и аминокислотная последовательность рекомбинантного полипептида GST-CFP10, где  - аминокислотная последовательность сайта узнавания и гидролиза протеазы тромбин (выделен цветом).
- аминокислотная последовательность сайта узнавания и гидролиза протеазы тромбин (выделен цветом).
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения.
Пример 1. Конструирование рекомбинантной плазмиды рТВ232
В работе использовали в качестве вектора плазмиду pGEX-2T (Pharmacia) и штаммы: JM103 Е.coli {Δ(lac-proAB), thi, strA, supE, endA, sbcB, hsdR-, [F' traD36, proAB, lacIq, ZΔM15]}; BL21 Е.coli В {F-, dcm, ompT, hsdS (rB- mB-), gal}.
В качестве источника нуклеотидного материала (матрицы) для получения с помощью полимеразной цепной реакции (ПЦР) клонируемого амплифицируемого фрагмента используют геномную ДНК М.tuberculosis H37Rv, выделенную из инактивированных клеток микобактерий. Ген, кодирующий белок CFP10, амплифицируют с помощью праймеров:
5'-GAGGATCCATGGCAGAGATGAAGACC-3' (прямой праймер для гена esxB); 5'-GCGAATTCTATTAGCGGGTCAGAAGC-3' (обратный праймер для гена esxS). ПЦР проводят в объеме 50 мкл на амплификаторе «Терцик» ("ДНК-технология", Москва) с температурно-временным профилем: 94°С - 3 мин; 5 циклов [94°С - 30 с, 45°С - 20 с, 72°С - 40 с], 30 циклов [94°С - 30 с, 58°С - 20 с, 72°С - 40 с], 72°С - 3 мин. Полную нуклеотидную последовательность клонируемого гена (esxB) для подбора первичной нуклеотидной последовательности праймеров извлекали из базы данных (БД) Института Пастера (http://genolist.pasteur.fr/TubercuList/) (Франция). Температуры плавления праймеров выбирают на основе полученной из БД расширенной нуклеотидной последовательности, включающей полный ген esxB, с помощью программы NTI Suite 8. Отжиг праймеров в первых 5 циклах ведут при пониженной температуре отжига (45°С), поскольку 5'-концевая нуклеотидная последовательность из 8 н.о., в структуре которой заложен сайт рестрикции (в данном случае BamHI или EcoRI), не может образовать с ДНК-матрицей (М. tuberculosis) совершенный гибридный дуплекс в начальный момент протекания ПЦР после того, как более протяженная 3'-концевая часть праймера образовала его. В этом случае расчет температур плавления каждого праймера ведут только с полностью гибридизующейся последовательностью, отбросив первые 8 н.о. из структуры праймера. Расчеты температур плавления для праймеров проводили с помощью программы NTI Suite 8 или Oligonucleotide Properties Calculator (http://www.basic.northwestern.edu/biotools/oligocalc.html) (USA). 5'-концевая последовательность 8 н.о. является дополнительной к основной нуклеотидной последовательности каждого праймера и предназначена для создания сайта узнавания для эндонуклеаз рестрикции BamHI и EcoRI соответственно с целью облегчения последующей стадии клонирования.
Реакционная смесь включает полимеразный буфер, содержащий 60 мМ трис-HCl, рН 8,5; 25 мМ KCl; 1,5 мМ MgCl2; 10 мМ 2-меркаптоэтанол; 0,1% тритон X-100; 4 дезоксинуклеозидтрифосфата - дАТФ, дГТФ, дЦТФ и ТТФ - с конечной концентрацией каждого 0,2 мМ; праймеры с концентрацией каждого 0,15-0,25 мкМ и 5 ед. Taq-ДНК-полимеразы («Сибэнзим», г.Новосибирск, Россия). Выход составляет около 2 мкг (8 пмоль) ПЦР-фрагмента. Полученный ПЦР-фрагмент (ампликон) длиной 329 п.н. очищают переосаждением этанолом в присутствии ацетата натрия, рН 4,8, и тРНК в качестве носителя [14]. Очищенный препарат ампликона растворяют в 80 мкл ТЕ-буфера и затем проводят совместный гидролиз в EcoRI-буфере («Сибэнзим») эндонуклеазами рестрикции BamHI и EcoRI при 37°С в течение 3-5 ч. Полученный из ампликона целевой рестриктный фрагмент с двумя липкими концами переосаждают, как описано выше, растворяют в 40 мкл ТЕ-буфера или бидистиллированной воды и без дополнительной очистки используют в реакции лигирования с расщепленной векторной молекулой (pGEX-2Т) с помощью эндонуклеаз рестрикции BamHI и EcoRI, также содержащей два липких конца - BamHI и EcoRI. Смешивают 2-5 мкл рестрикта-ампликона (0,5 пмоль) с 500 нг (0,15 пмоль) векторной ДНК pGEX-2T/BamHI/EcoRI в 20 мкл лигазного буфера («Сибэнзим»), прогревают при 65°С в течение 3-5 мин, резко охлаждают во льду, добавляют 20 ед. ДНК-лигазы фага Т4 и реакционную смесь переносят в термостат, где выдерживают в течение ночи при 16°С. Аликвоту лигазной смеси (1-2 мкл) используют для трансформации компетентных клеток Е.coli штамма JM103, приготовленных по методике с использованием раствора хлористого кальция [14], которые высевают на чашки с агаризованной средой, содержащей ампициллин в концентрации 50 мкг/мл. Чашки инкубируют при 37°С в течение ночи. Поиск клонов, содержащих искомую встройку, проводят непосредственно из колоний с помощью ПЦР-анализа, использующего в качестве амплимеров олигонуклеотиды, комплементарные разным цепям векторной молекулы и располагающиеся по обе стороны от места клонирования фрагмента. При этом клоны, содержащие встройку полного гена esxB (cfp10), после разделения амплификата электрофорезом в геле агарозы (1,2%) в присутствии бромистого этидия показывают окрашенную под ультрафиолетовым светом полосу, соответствующую длине 489 п.н., что превышает длину клонируемого фрагмента, так как этот фрагмент содержит часть нуклеотидной последовательности исходной векторной молекулы. После отбора целевые плазмиды нарабатывают в аналитических количествах и проводят необходимый рестрикционный анализ (выявление наличия сайтов рестрикции BamHI и EcoRI). Полученную целевую плазмиду обозначили как рТВ232. Схема плазмидной ДНК представлена на Фиг.1А и 1Б.
Пример 2. Получение штамма-продуцента, при культивировании клеток которого осуществляется продукция химерного белка GST-CFP10
Трансформацию клеток штамма Е.coli BL21 проводят введением ДНК целевой плазмиды рТВ232 в компетентные клетки, приготовленные по методике с использованием раствора хлористого кальция [14], после чего высевают на чашки с агаризованной средой, содержащей ампициллин в концентрации 50 мкг/мл. Чашки инкубируют при 37°С в течение ночи. Появившиеся колонии представляют собой клоны штамма-продуцента.
Клетки из каждого отобранного клона (обычно не более 10) высевают в 1 мл жидкой среды YT с ампициллином в концентрации 50 мкг/мл для получения ночных культур клеток и инкубируют при 37°С без качания. На следующий день засевают ночной культурой каждого клона в отношении 1:100 2 мл свежей среды YT с ампициллином в концентрации 50 мкг/мл и инкубируют при 37°С со скоростью качания 160 об./мин до плотности D550=0,5-0,8. Экспрессию гена esxB индуцируют добавлением изопропил-β-D-галактопиранозида (ИПТГ) до конечной концентрации 0,5-1,0 мМ, инкубируют при 37°С при интенсивной аэрации (160-170 об./мин) в течение 3-5 ч, после чего отбирают аликвоты суспензии клеток каждого клона и полученные из культур клеток лизаты анализируют электрофорезом в 10%-ном ПААГ в денатурирующих условиях по Лэммли. Окончательный отбор клонов проводят по способности культуры клеток каждого отдельного клона продуцировать в максимально возможных количествах (после проведения индукции) рекомбинантный белок rCFP10, количество и концентрацию которого оценивают по электрофоретической картине (в нашем случае это 37°С и 1,0 мМ ИПТГ).
Пример 3. Выделение рекомбинантного белка GST-CFP10
Клетки штамма BL21 Е.coli, трансформированные плазмидой рТВ232, выращивают в среде LB с ампициллином (50 мкг/мл) течение ночи при 37°С. Ночную культуру (1:100) засевают в 150 мл среды LB с ампициллином (50 мкг/мл) и подращивают до плотности D550=0,8 в течение 3 ч. Далее индуцируют экспрессию целевого белка GST-CFP10 добавлением ИПТГ до концентрации 1,0 мМ. Индуцированные клетки растят при 37°С в течение 5 ч, после чего культуру клеток охлаждают до 0°С, и клетки собирают центрифугированием при 5000g в течение 15 мин при 4°С. Экспрессию целевого белка GST-CFP10 анализируют электрофорезом по Лэммли в 12%-ном полиакриламидном геле и иммуноблотингом с моноклональными антителами к белку-носителю GST. Результаты этого анализа показывают наличие в индуцированной культуре клеток Е.coli штамма BL21/pTB232 при обработке клеточных осадков лизирующим буфером GST-CFP10 белка с молекулярной массой около 37 кДа, что соответствует расчетной молекулярной массе. В контрольных лизатах клеток BL21 Е.coli и BL21/pGEX-2T Е.coli белок с этой молекулярной массой отсутствует (по данным электрофореза). Данный белок окрашивается в иммуноблотинге с моноклональными антителами к белку-носителю GST.
Для дальнейших анализов клетки ресуспендируют в 8 мл холодного (0°С) PBS-буфера, содержащего 140 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4, 1,8 мМ KH2PO4, рН 7,3, 1 мМ PMSF (ингибитор протеаз), и разрушают ультразвуком на ультразвуковом дезинтеграторе (Ultrasonic processor Cole Parmer) 3×30 c с интервалом 1 мин между обработками при амплитуде 50 А. К ультразвуковому дезинтеграту добавляют тритон Х-100 до 1%, инкубируют 30 мин при 0°С и отделяют фракцию растворимых белков от дебриса центрифугированием при 12000g в течение 40 мин. Далее смешивают супернатант с 200 мкл глутатион-сефарозы (Glutathione Sepharose 4B Amersham, Biosciences AB) и инкубируют 30 мин с низкой скоростью перемешивания при комнатной температуре для аффинного связывания белка GST-CFP10. Затем смесь переносят в микроколонку путем многократного центрифугирования при 600g, несколько раз промывают колонку ФСБ- (PBS)-буфером и проводят элюцию рекомбинантного целевого белка буфером для элюции, содержащим 10 мМ восстановленный глутатион в 50 мМ трис-HCl, рН 8,0. В результате получают препарат очищенного рекомбинантного белка с концентрацией 1,5 мг/мл.
Пример 4. Проведение IFN-γ-анализа
1-я стадия (стимуляция цельной клеточной культуры крови целевым антигеном) Образцы гепаринизированной венозной крови пациентов перемешивают осторожно круговыми движениями в течение 20 мин. Распределяют по 100 мкл в 96-луночные планшеты (Nunc, USA), содержащие по 150 мкл/лунке полной среды RPMI 1640 с L-глутамином. Тщательно перемешивают и вносят антиген GST-CFP10 в концентрации 10 мкг/мл на лунку. Отдельно вносят по 100 мкл буферного раствора в лунки с нулевым контролем (без добавления антигена) и митоген РНА в концентрации 5 мкг/мл на лунку. Осторожно перемешивают. Инкубируют планшеты 24-48 ч при 37°С во влажной атмосфере, содержащей 5% СО2
2-я стадия. Для проведения IFN-γ-анализа в контрольные лунки планшет с сорбированными моноклональными антителами к гамма-интерферону производства BD Biosciences вносят по 100 мкл стандартных образцов гамма-интерферона в разных концентрациях (от 300-150-75-37,5-18,8-9,4-4,7 пк/мл). В остальные лунки планшет вносят по 100 мкл исследуемых образцов цельной крови после стимуляции, помещают в шейкер и инкубируют 2 ч при комнатной температуре. После окончания инкубации лунки планшет промывают 3 раза промывочным буферным раствором (ФСБ-Т). После промывки в каждую лунку планшета вносят по 100 мкл конъюгата биотинилированных антител к IFN-γ производства BD Biosciences и инкубируют 60 мин при комнатной температуре. По окончании инкубации промывают планшеты 3 раза буферным раствором ФСБ-Т, после чего в каждую лунку планшета добавляют по 100 мкл конъюгата авидин-пероксидазы хрена производства BD Biosciences в рабочем разведении. Инкубируют 60 мин при комнатной температуре. После окончания инкубации планшеты промывают 5 раз промывочным буферным раствором (ФСБ-Т) и 3 раза H2O дистиллированной. Затем вносят в каждую лунку планшета по 100 мкл раствора ТМБ (3,3',5,5'-тетраметилбензидина), помещают планшеты в защищенное от света место и выдерживают при комнатной температуре 30 мин. Реакцию терминируют добавлением в каждую лунку планшета по 50 мкл стоп-реагента (0,9 N раствор H2SO4). Измеряют оптическую плотность на автоматическом спектрофотометре типа «Мультискан» при длине волны 450 нм.
Для оценки концентрации IFN-γ в исследуемых образцах строят калибровочную кривую в логарифмических координатах: ось абсцисс - концентрация IFN-γ (пг/мл), ось ординат - значение оптической плотности образца. По полученным значениям проводят калибровочную кривую и рассчитывают количественное содержание IFN-γ в пг/мл или МЕ/мл в исследуемых и контрольных образцах. Результаты подсчитывают из среднего значения ОП в трех лунках (p<0,05). Значения Cutoff для IFN-γ>300 пг считают позитивными.
Пример 5. Мононуклеары цельной клеточной культуры крови (2×105 клеток/лунка), выделенные по стандартной процедуре с использованием градиентного центрифугирования в присутствии реагентов Фиколл-Гипак, суспендируют в 50 мкл полной клеточной культуральной среды RPMI 1640 и распределяют в 96-луночные планшеты (Nunc, MaxiSorb, USA), содержащие по 150 мкл/лунка полной среды RPMI 1640 производства ГНЦ ВБ "Вектор". Затем в каждую лунку планшет вносят химерный антиген GST-CFP10 в концентрации 5-10 мкг/мл; в контрольные лунки планшет вносят митоген (Con А или РНА) в концентрации 4 мкг/мл в трипликатах. Конечный объем реакционной среды в лунке планшета составляет 250 мкл. Инкубируют планшеты 16-24 ч при 37°С во влажной атмосфере, содержащей 5% СО2.
Для проведения IFN-γ-анализа в контрольные лунки планшет с сорбированными моноклональными антителами к гамма-интерферону вносят по 100 мкл стандартных и контрольных образцов. В остальные лунки планшет вносят по 100 мкл исследуемых образцов плазмы крови после стимуляции. Помещают в шейкер и инкубируют 2 ч при комнатной температуре. После окончания инкубации планшеты промывают 3 раза промывочным буферным раствором (ФСБ-Т). После промывки в каждую лунку планшета вносят по 100 мкл конъюгата биотинилированных антител к IFN-γ и инкубируют 60 мин при комнатной температуре. По окончании инкубации промывают планшеты 3 раза буферным раствором ФСБ-Т, после чего в каждую лунку планшета добавляют по 100 мкл конъюгата авидин-пероксидазы хрена в рабочем разведении и инкубируют 60 мин при комнатной температуре. После окончания инкубации планшеты промывают 5 раз промывочным буферным раствором (ФСБ-Т) и 3 раза дистиллированной водой. Затем в каждую лунку планшета вносят по 100 мкл раствора ТМБ (3,3',5,5'-тетраметилбензидина), помещают планшеты в защищенное от света место и выдерживают при комнатной температуре 30 мин. Реакцию терминируют добавлением в каждую лунку планшета по 50 мкл стоп-реагента (0,9 N раствор H2SO4). Оптическую плотность образцов измеряют на автоматическом спектрофотометре типа «Мультискан» при длине волны 450 нм.
Для оценки концентрации IFN-γ в исследуемых образцах строят калибровочную кривую в логарифмических координатах: ось абсцисс - концентрация IFN-γ (пкг/мл), ось ординат - значение оптической плотности образца. По полученным значениям проводят калибровочную кривую и рассчитывают количественное содержание IFN-γ в пг/мл или МЕ/мл в исследуемых и контрольных образцах. Результаты подсчитывают из среднего значения ОП в трех лунках (p<0,05). Значения Cutoff для IFN-γ>300 пг/мл считают позитивными.
Пример 6. Сорбцию МКА к IFN-γ производства BD OptEIA Reagent проводят с использованием 0,1 М карбонатного буфера, рН 9,6 в течение 16 ч при 4°С на планшетах (Nunc, MaxiSorb, USA). После отмывки планшет промывочным буферным раствором (ФСБ, рН 7,0) 3 раза по 300 мкл/лунку проводят блокировку поверхности лунок блокировочным буферным раствором ФСБ, рН 7,0, содержащим 10% фетальной сыворотки, в течение 60 мин при комнатной температуре, после чего проводят отмывку планшет, как указано выше.
Подготовленный планшет с сорбированными МКА к IFN-γ используют при проведении IFN-γ-анализа. Для этого в каждую лунку планшета вносят по 150 мкл полной среды RPMI 1640. Образцы гепаринизированной венозной крови пациентов осторожно перемешивают и затем распределяют по 100 мкл в 96-луночные планшеты (Nunc, USA). Тщательно перемешивают и вносят раствор антигена GST-CFP10 в RPMI 1640 с 0,2 мМ глутамина в концентрации 10 мкг/мл на лунку. В лунки А-1, В-1 и С-1 вносят митоген (РНА), в лунки D-1, E-1 добавляют по 100 мкл разводящего буферного раствора (нулевой контроль). Осторожно перемешивают, инкубируют планшеты 24-48 ч при 37°С во влажной атмосфере, содержащей 5% СО2, при перемешивании. После окончания инкубации планшеты промывают 5×300 мкл/лунку дистиллированной водой и 5×300 мкл ФСБ-Т буферным раствором. С целью построения калибровочного графика при проведения IFN-γ анализа предварительно проводят инкубацию со стандартными калибровочными образцами IFN-γ. Для этого в контрольные лунки планшет с сорбированными моноклональными антителами к гамма-интерферону производства BD Biosciences вносят по 100 мкл стандартных образцов гамма-интерферона в разных концентрациях (от 300-150-75-37,5-18,8-9,4-4,7 пг/мл) -производства BD Biosciences или по 100 мкл стандартных калибровочных образцов, содержащих IFN-γ (2000-1000-500-300-100-50-0 пг/мл) и контрольный образец (330 пг/мл IFN-γ) производства «Вектор-Бест». Инкубируют согласно инструкции по применению наборов. После окончания инкубации стрипы планшет промывают 3 раза промывочным буферным раствором (ФСБ-Т). После промывки в каждую лунку планшета вносят по 100 мкл конъюгата биотинилированных антител к IFN-γ и инкубируют 60 мин при комнатной температуре. По окончании инкубации планшеты промывают 3 раза буферным раствором ФСБ-Т, в каждую лунку планшета добавляют по 100 мкл конъюгата авидин-пероксидазы или стрептавидин-пероксидазы хрена в рабочем разведении и инкубируют 60 мин при комнатной температуре. После окончания инкубации планшеты промывают 5 раз промывочным буферным раствором (ФСБ-Т), 3 раза дистиллированной водой, после чего вносят в каждую лунку планшета по 100 мкл раствора ТМБ (3,3',5,5'-тетраметилбензидина). Планшеты помещают в защищенное от света место и выдерживают при комнатной температуре 30 мин. Реакцию терминируют добавлением в каждую лунку планшета по 50 мкл стоп-реагента (0,9 N раствор H2SO4) и измеряют оптическую плотность на автоматическом спектрофотометре типа «Мультискан» при длине волны 450 нм. Результаты анализа представляют в значениях Cutoff, которые получают по построенным калибровочным кривым, как описано выше.
Туберкулезный контроль проводится для выявления активного туберкулеза и скрининга лиц, имеющих контакт с использованием туберкулиновой пробы. Быстрый путь раннего выявления инфекции в крови с использованием рекомбинантных белков является альтернативным кожному тесту. Выявление уровня IFN-γ коррелирует со стадией и степенью туберкулезной инфекции, уровнем иммунного ответа и вероятностью прогрессирования активной формы туберкулеза. В таблице 1 представлены результаты выявления активного туберкулеза легких с использованием IFN-γ-анализа, а также среди здорового контингента. Как показывают проведенные исследования, полученный рекомбинантный белок позволяет выявлять активный туберкулезный процесс среди больных туберкулезом легких. Уровень IFN-γ среди здорового контингента не превышает предельные значения (>300 пг/мл IFN-γ), соответствующие группе риска или больных туберкулезом. Эти данные свидетельствуют о специфичности метода. Клинический статус больных с разной формой туберкулезной инфекции, выявленных с использованием гибридного белка rCFP10, представлен в таблице 3. В таблице 4 представлены результаты сравнительного изучения специфичности и чувствительности рекомбинантного белка rCFP10 в сравнении с PPD-туберкулином при стимуляции цельной клеточной культуры крови. Специфичность рекомбинантного белка в IFN-γ-анализе туберкулеза оказывается выше, чем PPD-туберкулина.
Для другой группы пациентов с туберкулезной инфекцией результаты продукции IFN-γ выражали в МЕ/мл с применением калибровочного графика. Аналитическая чувствительность теста составила 1,2-1,7 МЕ/мл IFN-γ для отрицательного (нулевого) контрольного образца из плазмы крови исследуемых (результаты представлены в таблице 2).
Некоторые формы туберкулеза (остро прогрессирующие) не могут быть выявлены при проведении профилактических обследований. Больные с такими процессами попадают в основном в больницы общего профиля, где диагностика их бывает часто затруднена из-за схожести рентгенологической картины с неспецифическими заболеваниями легких. Единственным методом достоверной диагностики в таких случаях является прямая бактериоскопия мокроты или применение IFN-γ-анализа. Все исследованные группы больных туберкулезом легких имели положительную реакцию с использованием микроскопических методов, культуральных, рентгеноскопии и молекулярно-биологических (ПЦР-анализ).
Значения Cutoff для IFN-γ>300 пг/мл считали положительными, результаты подсчитывали из среднего значения трех лунок (ρ≤0,01)и выражали в пг/мл, используя калибровочный график.






Изобретение касается получения микробиологическим синтезом нового гибридного полипептида GST-CFP10 со свойствами видоспецифичного белка-антигена CFP10 Mycobacterium tuberculosis, который может быть использован для ранней видоспецифичной диагностики туберкулезной инфекции. Сконструирована рекомбинантная плазмидная ДНК рТВ232, кодирующая гибридный полипептид GST-CFP10 со свойствами микобактериального антигена CFP10, со средней молекулярной массой (м.м.) 3,4 МДа и имеющая размер 5257 п.н. Рекомбинантный штамм бактерий Е.coli BL21/pTB232 содержит рекомбинантную плазмидную ДНК рТВ232, является продуцентом гибридного полипептида GST-CFP10 со свойствами микобактериального антигена CFP10 и депонирован в КМ ГНЦ ВБ "Вектор" под номером В-1027. Рекомбинантный полипептид GST-CFP10, продуцируемый штаммом бактерий Е. coli BL21/pTB232, содержит в качестве белка-носителя N-концевой полипептидный фрагмент глутатион-S-трансферазы S.j. (226 а.о. с м.м. 26,3 кДа), соединенный через концевой сайт гидролиза тромбина (LVPR^GS) с С-концевым полипептидным фрагментом антигена CFP10 (100 а.о. с м.м. 10,8 кДа) и имеет полную аминокислотную последовательность длиною 326 а.о. и м.м. 37,1 кДа, приведенную в тексте описания. Использование изобретения обеспечивает возможность получать целевой высокоочищенный гибридный полипептид GST-CFP10 в препаративных количествах при сохранении иммуногенных свойств последнего. 3 н.п.ф-лы, 4 табл., 3 ил.
1. Рекомбинантная плазмидная ДНК рТВ232, кодирующая гибридный полипептид GST-CFP10 со свойствами микобактериального антигена CFP10, со средней молекулярной массой 3,4 МДа, имеет размер 5257 п.н. и состоит из следующих элементов:
EcoRI-BamHI-фрагмента векторной плазмиды pGEX-2T (Pharmacia Biotech) размером 4938 п.н., содержащего ген β-лактамазы, индуцируемый tac-промотор, внутренний ген lacIq, кодирующий белок-репрессор лактозного оперона, фрагмент гена глутатион-3-трансферазы из S.japonicum с множественным сайтом для клонирования генов в 3'-концевой части этого гена и нуклеотидной последовательностью для сайта протеолиза тромбина, располагающейся перед множественным сайтом для клонирования;
EcoRI-BamHI-фрагмента размером 319 п.н., содержащего фланкированный сайтами для эндонуклеаз рестрикции EcoRI и BarnHI полный ген белка CFP10, полученный амплификацией соответствующего гену фрагмента с геномной ДНК М.tuberculosis;
содержит:
в качестве генетического маркера ген β-лактамазы, детерминирующий устойчивость трансформированных плазмидой рТВ232 клеток E.coli к антибиотику ампициллину;
уникальные сайты рестрикции: BamHI - 930/934, EcoRI - 1249/1253.
2. Рекомбинантный штамм бактерий Escherichia coli BL21/pTB232, содержащий рекомбинантную плазмидную ДНК рТВ232, согласно п.1, и депонированный в Коллекции микроорганизмов ФГУН ГНЦ ВБ "Вектор" Роспотребнадзора под номером В-1027, продуцент гибридного полипептида GST-CFP10 со свойствами микобактериального антигена CFP10.
3. Рекомбинантный полипептид GST-CFP10, продуцируемый рекомбинантным штаммом E.coli BL21/pTB232, по п.2, содержит в качестве белка-носителя N-концевой полипептидный фрагмент глутатион-S-трансферазы S.j. (226 а.о. с молекулярной массой 26,3 кДа), соединенный через концевой сайт гидролиза тромбином (LVPR^GS) с С-концевым полипептидным фрагментом видоспецифичного микобактериального антигена CFP10 (100 а.о. с молекулярной массой 10,8 кДа), и имеет полную аминокислотную последовательность (326 а.о., 37,1 кДа), приведенную на фиг.3.
| CN 1869239 А, 29.11.2006 | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Способ преобразования напряжения в частоту | 1974 |
|
SU860305A1 |
| RU 2200323 С1, 10.03.2003. | |||
Авторы
Даты
2010-02-10—Публикация
2008-02-26—Подача