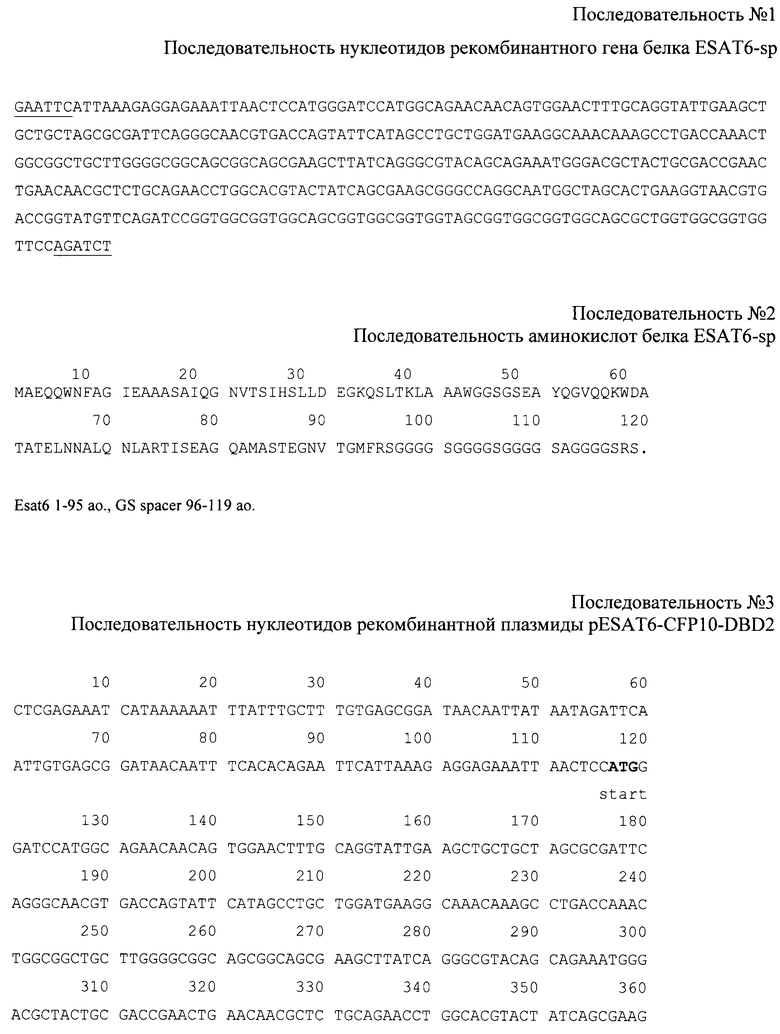
Известно изобретение [US 20110206713 A1, C07K 7/06, 25.08.2011], которое описывает иммуногенную композицию или лекарственные средства, состоящие из одного антигена ESAT-6, Ag85A, Ag85B, ТВ 10.4 Mycobacterium tuberculosis, сочетания различных химерных белков на основе этих антигенов, использование гибридных (fusion) белков в разных сочетаниях с вакциной BCG.
Однако это решение обладает относительно узкой областью применения.
Известно также изобретение [US 20120039925 A1, A61K 39/00, 16.02.2012], в котором описана иммуногенная композиция для предотвращения реактивации латентного туберкулеза в активную форму одним из антигенов, в составе которой может быть гибридный белок ESAT6-CFP10.
Это изобретение также имеет относительно узкую область применения.
В изобретении [US 2011/0027349 A1, A61K 39/00, 03.02.2011] описывается состав иммуногенной композиции, предназначенной для борьбы с латентными формами инфекции и предупреждения развития активного ТБ на основе белков семейства ESX1 и ESAT6.
Это изобретение характеризуется относительно узкой областью применения.
К известным относится изобретение [US 8293250 В2, A61K 39/00, 03.02.2011], которое описывает иммуногенную композицию для профилактики и лечения заболеваний, вызванных микобактериями (М. tuberculosis, М. Bovis, М. africanum, М. microti). В основе иммуногенных композиций лежат гибридные (fusion) белки, в том числе ESAT6.
Это изобретение обладает относительно узкой областью применения.
Изобретение [ЕР 1200466 А2, A61K 39/00, 02.05.2002] предполагает создание вакцинных композиций для профилактики туберкулеза на основе белков семейства, к которому принадлежит ESAT6 и CFP10.
Это решение обладает недостатком, связанным с относительно узкой областью применения.
Целью приведенных выше изобретений является создание иммуногенных композиций на основе белков микобактерий, включая ESAT6. Однако во всех этих изобретениях не описан способ получения белков, что также сужает область их применения.
Известно изобретение [RU 2277540 С2, A61K 39/04, l0.06.2006], в котором предложен гибридный белок CFP10-ESAT6, способный индуцировать специфическую в отношении M. tuberculosis реакцию гиперчувствительности замедленного типа, содержащий полный белок CFP10 из M. tuberculosis, слитый с полным белком ESAT6 из M. tuberculosis через линкерную аминокислотную последовательность. Кроме того, в нем предложено применение гибридного белка CFP10-ESAT6, содержащего полный белок CFP10 из M. tuberculosis, слитый с полным белком ESAT6 из M. tuberculosis через линкерную аминокислотную последовательность, в качестве диагностикума туберкулезной инфекции у млекопитающих и человека. Дополнительно к этому предложено применение гибридного белка CFP10-ESAT6, отличающееся тем, что в качестве линкерной последовательности гибридный белок CFP10-ESAT6 содержит сайт гидролиза энтерокиназой. Кроме того, в нем описан способ диагностики туберкулезной инфекции путем индукции реакции гиперчувствительности замедленного типа при подкожном введении антигенов CFP10 и ESAT6, специфичных в отношении M. tuberculosis, с последующей положительной оценкой туберкулезного процесса визуально по диаметру эритемы в 10-15 мм, причем антигены CFP10 и ESAT6 пациенту вводят в эффективной дозе в виде водного раствора гибридного белка CFP10-ESAT6, который специфичен в отношении M. tuberculosis и содержит полный белок CFP10 из M. tuberculosis, слитый с полным белком ESAT6 из M. tuberculosis через линкерную аминокислотную последовательность. Помимо этого предложена рекомбинантная плазмидная ДНК pTBD16 для экспрессии гибридного белка CFP10-ESAT6 M. tuberculosis, представляющая собой векторную плазмиду pQE30, содержащую репликон ColE, lac промотор, ген устойчивости к ампициллину, инициирующий кодон ATG, последовательность из 18 нуклеотидов, кодирующих 6-гистидиновых остатков, в которую оперативно встроен участок ДНК, кодирующий белки CFP10 и ESAT6, фланкированный сайтами для рестрикции BamHI и KpnI и содержащий между генами CFP10 и ESAT6 последовательность нуклеотидов, кодирующую сайт гидролиза энтерокиназой. Предложен также способ получения гибридного белка CFP10-ESAT6 для диагностики туберкулезной инфекции, включающий культивирование штамма E. coli DLT1270, трансформированного рекомбинантной плазмидной ДНК pTBD16 для экспрессии гибридного белка CFP10-ESAT6, разрушение клеток штамма E. coli DLT1270 в буферном растворе ультразвуком и выделение белка из очищенных телец включения и из промывок телец включения методом лигандообменной хроматографии.
Недостатком этого комплексного решения является относительно узкая область применения, поскольку, в частности, отсутствует возможность использования рекомбинантного белка, плазмиды и штамма для получения компонентов противотуберкулезной вакцины.
Известно изобретение [US 6174700 B1, C07K 1/14, 16.01.2001], которое описывает способ очистки полипептидов, несущих в своем составе карбогидратсвязывающий домен, в качестве которого предложен целлюлозосвязывающий домен.
Недостатком изобретения также является относительно узкая область применения, поскольку метод очистки белков, приведенный в качестве примера, не может быть применен для фармацевтического применения вследствие загрязнения конечного продукта эндотоксинами E. coli и сложности удаления карбогидратсвязывающего домена из белковой молекулы.
В изобретении [WO 2009143413 A1, A61K 39/00, 26.11.2009], которое описывает использование гибридного белка pneumolysin и микобактериальных белков ESAT6, mtb или Ag85, конъюгированных с полисахаридами, в том числе декстраном, не используются карбогидратсвязывающие домены, специфически взаимодействующие с полисахаридом, поэтому препараты, полученные описанным в изобретении способом, относятся к классическим конъюгированным вакцинам.
Это также сужает его область применения.
Известны также технические решения, в которых описывается использование декстрансвязывающего домена из микроорганизма Leuconostoc mesenteroides в качестве домена, взаимодействующего с декстраном. В частности, известно изобретение [RU 2428477 С2, C12N 9/38, 10.09.2011], в котором предложена рекомбинантная белковая конструкция ДСД-сп-β-ГАЛ, обладающая активностью фермента термостабильной бета-галактозидазы (лактазы) и способностью аффинно связываться с декстраном, представляющая собой декстрансвязывающий домен ДСД из микроорганизма Leuconostoc mesenteroides с аминокислотной последовательностью, приведенной в виде SEQ ID NO:2, который генно-инженерным путем объединен через глицин-сериновый спейсер (GSGSGSGSGSGA) с термостабильной бета-галактозидазой из термофильного микроорганизма Thermoanaerobacter ethanolicus с аминокислотной последовательностью, приведенной в виде SEQ ID NO:3. При этом плазмидная ДНК pGD-10, определяющая биосинтез белка ДСД-сп-β-ГАЛ и характеризующаяся последовательностью нуклеотидов, приведенной в виде SEQ ID NO:1. В этом техрническом решении предложен также штамм Escherichia coli DH5α/pGD-10 - продуцент рекомбинантной белковой конструкции ДСД-сп-β-ГАЛ, полученный путем трансформации клеток материнского штамма E. coli DH5α плазмидной ДНК pGD-10.
Однако отсутствие отработанного способа очистки рекомбинантного белка с использованием декстрана в качестве сорбента существенно сужает область применения этого технического решения, как и то, что, приводимый в описании к этому изобретению пример по определению декстрансвязывающих свойств у химерного белка, который может быть использован только для очистки термостабильных рекомбинантных белков, а использовать этот метод для получения иммуногенных компонентов медицинских иммунобиологических препаратов невозможно по причине термолабильности антигенов.
Наиболее близким к предложенному является техническое решение [RU 2422525 C1, C12N 15/00, 27.06.2011], в котором предложена рекомбинантная плазмида pESAT6-CBD, представленная нуклеотидной а последовательностью №1, обеспечивающая экспрессию рекомбинантного белка ESAT6-CBD, состоящего из полноразмерного белка ESAT6 M. tuberculosis, Gly-Ser спейсера, целлюлозосвязывающего домена гена эндоглюканазы CelD из A. thermophilum, размером 4282 п.н., состоящая из следующих структурных элементов:
- искусственный бактериальный оперон рекомбинантного белка ESAT6-CBD, включающий: промоторную область раннего промотора бактериофага Т5 (7-87 п.н.), ген рекомбинантного белка ESAT6-CBD (117-1007 п.н.), нетранслируемую область терминации транскрипции (1047-1141 п.н.);
- бактериальный оперон бета-лактамазы, обеспечивающий устойчивость к ампициллину (3217-4067 п.н.);
- бактериальный участок инициации репликации типа ColE1 (2474-2485 п.н.), обеспечивающий репликацию плазмиды в штаммах E. coli.
Кроме того, в наиболее близком техническом решении предложен рекомбинантный штамм E. coli M15 [pREP4, pESAT6-CBD], полученный трансформацией штамма E. coli M15 [pREP4] полученной плазмидой, продуцент белка ESAT6-CBD.
Предложен также способ получения, иммобилизации, концентрирования и очистки рекомбинантного белка ESAT6-CBD на целлюлозе, включающий:
- выращивание клеток штамма E. coli M15 [pREP4, pESAT6-CBD];
- иммобилизацию белка ESAT6-CBD в составе клеточных экстрактов штамма E. coli M15 [pREP4, pESAT6-CBD] на целлюлозном сорбенте за счет аффинного взаимодействия при процедуре инкубации с последующей отмывкой от несвязавшихся бактериальных белков, при этом происходит концентрирование целевого продукта и его очистка, выделение целевого продукта.
Кроме того, предложен рекомбинантный белок ESAT6-CBD с молекулярной массой 32,0 кДа (р1 5,05), включающий полноразмерный белок ESAT6 с последовательностью №2, Gly-Ser спейсер с последовательностью №3, целлюлозосвязывающий домен гена эндоглюканазы CelD из и A. thermophilum с последовательностью №4, а также иммуногенная композиция, содержащая белок по п.4 ESAT6-CBD, иммобилизованный на целлюлозе, в эффективном количестве, специфически активирующая Т-лимфоциты, синтезирующие ИФН-гамма при стимуляции антигенами микобактерий, и способ проверки протективных свойств иммуногенной композиции по п.5 в отношении туберкулезной инфекции в модели туберкулеза у мышей, включающий:
а) вакцинацию мышей инбредной линии C57B L/6 дважды, подкожно, с интервалом 2 недели препаратами: иммуногенная композиция по п.5 из расчета 10 мкг на мышь по содержанию действующего вещества; CBD-целлюлоза из расчета 10 мкг на мышь по содержанию CBD - отрицательный контроль 1; физиологическим раствором - отрицательный контроль 2;
в) заражение через 5 нед. после второй вакцинации мышей внутривенно в дозе 5·106 КОЕ вирулентным штаммом M. tuberculosis H37Rv;
c) умерщвление через 4 нед. после заражения из каждой группы по 4 мыши и проведение оценки размножения микобактерий в легких и селезенке методом посева гомогенатов органов на агар Дюбо с последующим подсчетом колоний;
d) построение кривых выживания при проведении наблюдений за оставшимися мышами (8 в каждой группе), при этом о протективных свойствах иммуногенной композиции по п.5 судят по результатам стадий с) и d).
Изобретение позволяет получать штамм-продуцент, обеспечивающий высокий уровень продукции устойчивых иммуногенных белков, которые могут быть получены, иммобилизованы и очищены в одну стадию, а также получать эффективные иммуногенные композиции против туберкулеза.
Недостатком данного изобретения является относительно узкая область применения, вызванная низкой биодеградируемостью целлюлозы. Это приводит к появлению в месте введения препарата длительного очага стерильного воспаления в форме «холодного абсцесса», что затрудняет переход от доклинических к клиническим испытаниям вакцин-кандидатов.
Задача, на решение которой направлено предложенная группа изобретений, направлена на расширение области применения наиболее близкого технического решения.
Требуемый технический результат заключается в расширении области применения, в частности создание штамма E. coli, обеспечивающего высокий уровень продукции рекомбинантного белка, содержащего белок M. tuberculosis ESAT6-CFP10, получение простой и эффективной схемы очистки рекомбинантного белка, специфически и эффективно индуцирующего иммунный ответ на антиген микобактерий, в том числе синтез ИФН-гамма, необходимый для противотуберкулезной защиты, создание иммуногенной композиции на основе рекомбинантных белков на декстрановом носителе (биодеградируемый адъювант).
Поставленная задача решается, а требуемый технический результат достигается тем, что разработаны следующие объекты, составляющие группу изобретений.
Рекомбинантная плазмида pESAT6-CFP10-DBD, представленная нуклеотидной последовательностью №1, обеспечивающая экспрессию рекомбинантного белка ESAT6-CFP10-DBD, состоящего из полноразмерного белка ESAT6-CFP10 Mycobacterium. tuberculosis, Gly-Ser спейсера, декстрансвязывающего домена декстрансукразы Leuconostoc citreum KM20 размером 4128 п.н., состоящая из следующих структурных элементов:
- искусственный бактериальный оперон рекомбинантного белкаЕ8АТ-CFP-DBD, включающий: промоторную область бактериофага Т5 (7-87 п.н.), ген рекомбинантного белка ESAT-CFP-DBD (117-1226 п.н), нетранслируемую область терминации транскрипции (1256-1350 п.н.);
- бактериальный оперон бета-лактамазы, обеспечивающий устойчивость к ампициллину (3063-3923 п.н.);
- бактериальный участок инициации репликации типа ColE1 (2295-2305 п.н.), обеспечивающий репликацию плазмиды в штаммах E. coli.
Рекомбинантный штамм Escherichia coli M15 [pREP4, pESAT6-CFP10-DBD], полученный трансформацией штамма E. coli M15 [pREP4] плазмидой по п.1, продуцент белка ESAT6-CFP10-DBD.
Способ получения, иммобилизации, концентрирования и очистки рекомбинантного белка ESAT6-CFP10-DBD на декстране, включающий:
- выращивание клеток штамма Е. coli M15 [pREP4, pESAT6-CFP10-DBD] по п.2;
- иммобилизацию белка ESAT6-CFP10-DBD в составе клеточных экстрактов штамма E. coli M15 [pREP4, pESAT6-CFP10-DBD] на декстрановом сорбенте за счет аффинного взаимодействия при процедуре инкубации с последующей отмывкой от несвязавшихся бактериальных белков, при этом происходит концентрирование целевого продукта и его очистка;
- выделение целевого продукта.
Рекомбинантный белок ESAT6-CFP10-DBD с молекулярной массой 26,4 кДа, включающий полноразмерный белок ESAT6-CFP10 с последовательностью №2, Gly-Ser спейсер с последовательностью №3, декстрансвязывающий домен декстрансукразы из L. citreum KM20 с последовательностью №4.
Иммуногенная композиция, содержащая белок по п.4 ESAT6-CFP10-DBD, иммобилизованный на декстране, специфически активирующая Т-лимфоциты, синтезирующие ИФН-гамма при стимуляции антигенами микобактерий.
Группа изобретений характеризуется чертежами:
на фиг.1 представлена схема строения экспрессионной генетической конструкции pESAT6-CFP10-DBD;
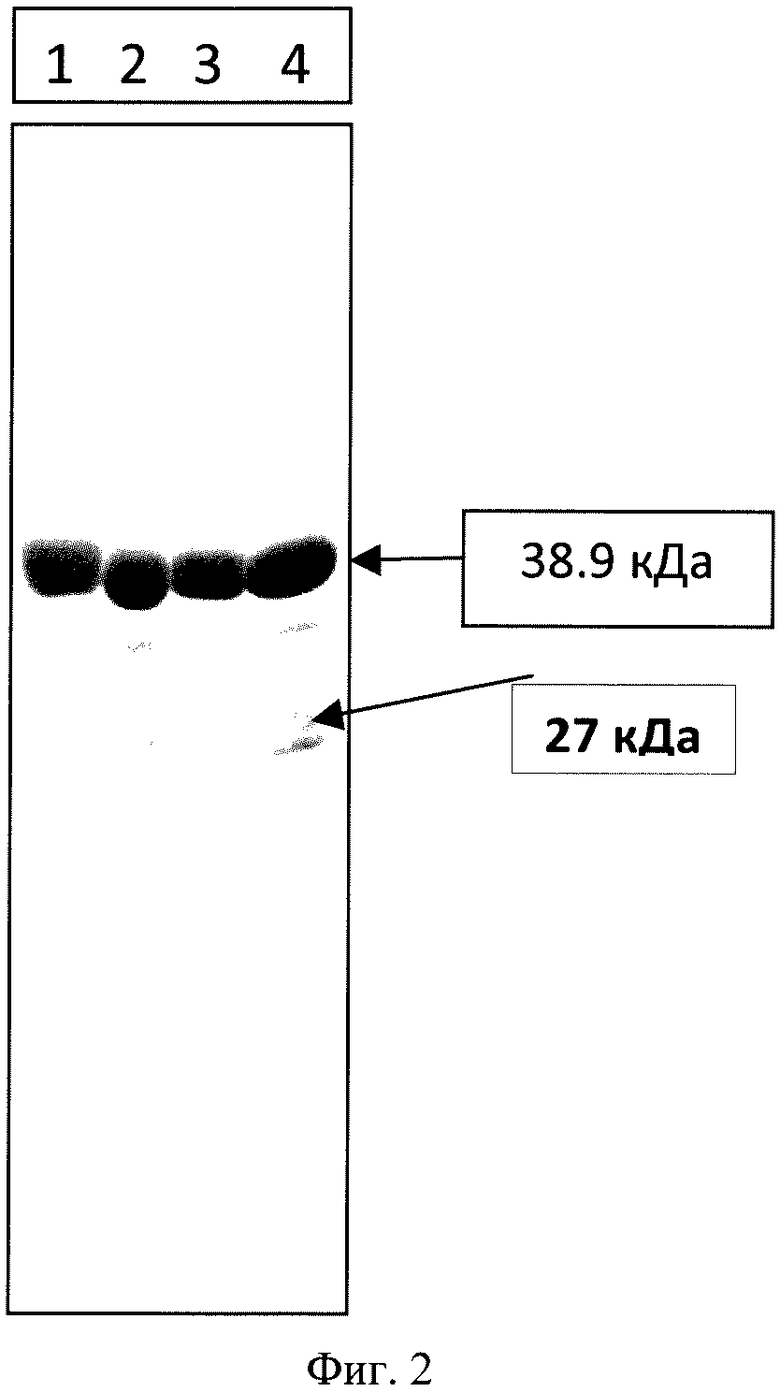
на фиг.2 представлены результаты электрофоретического анализа стабильности рекомбинантных белков CFP10-DBD L. citreum и CFP10-DBD L. mesenteroides в 12% ПААГ в течение 6 и 12 месяцев с момента лиофилизации препаратов, где обозначены:
1 - рекомбинантный белок ESAT6-CFP10-DBD L. citreum после 6 месяцев хранения;
2 - рекомбинантный белок ESAT6-CFP10-DBD L.mesenteroides после 6 месяцев хранения;
3 - рекомбинантный белок ESAT6-CFP10-DBD L. citreum после 12 месяцев хранения;
4 - рекомбинантный белок ESAT6-CFP10-DBD L.mesenteroides после 12 месяцев хранения;
- стрелкой отмечена деградация рекомбинантного белка.
Для решения поставленной задачи используется декстрансвязывающий домен из микроорганизма Leuconostoc citreum для получения стабильной в течение продолжительного времени (не менее года) иммуногенной композиции путем объединения последовательности, кодирующей DBD, с последовательностью микобактериального белка (антигена) и иммобилизации полученного в экспрессионной системе E. coli химерного антигена на молекуле полисахарида декстран, который применяется в качестве адъюванта.
При использовании этого подхода был получен двухкомпонентный рекомбинантный белок. Последовательность гена M. tuberculosis esat6 кодирует полноразмерный белок, который формирует первый белковый домен, определяющий функциональные иммунологические свойства комплексной молекулы. Далее следует соединяющая (спейсерная) аминокислотная последовательность из нескольких чередующихся остатков глицина и серина (Gly-Ser). Второй белковый домен кодируется последовательностью гена декстрансукразы Leuconostoc citreum KM20. Он определяет способность продукта взаимодействовать с декстрановым сорбентом. Белковые продукты нарабатываются в непатогенных лабораторных штаммах Escherichia coli. Иммобилизованный на декстране антиген представляет собой суспензию сорбента с адсорбированным на нем белке. Декстрановый носитель выступает в роли адъюванта при иммунизации, так как обеспечивает укрупнение и полимеризацию антигена. Отличительной особенностью декстрана в качестве адъюванта является его биодеградируемость. Антигены в свободном состоянии представляют собой растворы с определенной ионной силой, свободные от примесей липополисахаридов и ДНК штамма-продуцента.
При этом очистка конечных продуктов от высокотоксичных для организма липополисахаридов, балластных белков, ДНК и РНК штаммов-продуцентов является важной проблемой.
Использование декстрансвязывающего домена декстрансукразы Leuconostoc citreum определяется тем, что он обеспечивает большую стабильность рекомбинантных белков, чем описанные в литературе последовательности из микроорганизмов Leuconostoc mesenteroides и Streptococcus sobrinus (S. Suwannarangsee, С. Moulis, G. Potocki-Veronese, P. Monsan, M. Remaud-Simeon, and W. Chulalaksananukul, "Search for a dextransucrase minimal motif involved in dextran binding", FEBS letters, vol.581, no.24, pp.4675-80, oct. 2007).
Таким образом, заявляемая группа изобретений позволяет создавать штамм E. coli, обеспечивающий высокий уровень продукции рекомбинантного белка, содержащего белок M. tuberculosis ESAT6-CFP10, получить простую и эффективную схему очистки рекомбинантного белка, специфически и эффективно индуцирующего иммунный ответ на антиген микобактерий, в том числе синтез ИФН-гамма, необходимый для противотуберкулезной защиты, создать иммуногенную композицию на основе рекомбинантных белков на декстрановом носителе (биодеградируемый адъювант).
Указанный результат достигается за счет синтеза рекомбинантного белка ESAT6-CFP10-DBD в клетках рекомбинантного штамма Е. coli M15 [pREP4, pESAT6-CFP10-DBD], несущего рекомбинантную плазмиду pESAT6-CFP10-DBD. Также за счет создания комплексного препарата ESAT6-CFP10-DBD-декстран, в котором рекомбинантный белок ESAT6-CFP10-DBD (концентрация 3,5 мг/мл) иммобилизован на декстране (концентрация декстрана 500 50 мг/мл) и ресуспендирован в 1×PBS буфере рН 7,2-7,4.
Требуемый технический результат достигается следующим образом.
Mycobacterium tuberculosis - это внутриклеточный патоген, и основная роль в адаптивном иммунитете к ТБ принадлежит клеточным, а не гуморальным факторам защиты. Разные группы антигенов микобактерий, например белки теплового шока, липропротеины, секреторные белки, ферменты, изучены достаточно хорошо. По мнению многих авторов, основными мишенями (иммунодоминатными антигенами) протективного иммунитета являются секреторные белки, присутствующие в культуральном фильтрате М. tuberculosis. Среди них наиболее полно охарактеризованы близкородственные белки комплекса Ag85 (Ag85A, В и С), ESAT-6 (Early Secret Antigen Target) и CFP-10 (Culture-Filtrate Protein).
Для достижения требуемого технического результата создана рекомбинантная плазмида pESAT6-CFP10-DBD (4128 п.н.), кодирующая бифункциональный рекомбинантный белок ESAT6-CFP10-DBD, обладающий способностью самопроизвольно связываться с декстрансодержащим сорбентом. Плазмида pESAT6-CFP10-DBD содержит следующие существенные для ее функционирования структурные элементы:
- искусственный бактериальный оперон рекомбинантного белка ESAT-CFP-DBD, включающий: промоторную область бактериофага Т5 (7-87 п.н.), ген рекомбинантного белка ESAT-CFP-DBD (117-1226 п.н), нетранслируемую область терминации транскрипции (1256-1350 п.н.);
- бактериальный оперон бета-лактамазы, обеспечивающий устойчивость к ампициллину (3063-3923 п.н.);
- бактериальный участок инициации репликации типа ColE1 (2295-2305 п.н.), обеспечивающий репликацию плазмиды в штаммах Е. coli.
Штамм-продуцент рекомбинантного белка ESAT-CFP-DBD получают трансформацией клеток E. coli штамма M15 [pREP4] плазмидой pESAT-CFP-DBD. Штамм обеспечивает продукцию рекомбинантного белка ESAT-CFP-DBD после проведения процедуры индукции изопропил-β-D-тио-галактопиранозидом (ИПТГ) до 25-30% от тотального белка клетки.
Штамм E. coli M15 [pREP4], несущий плазмиду pESAT-CFP-DBD - продуцент бифункционального рекомбинантного белка ESAT-CFP-DBD, - характеризуется следующими признаками.
Культурально-морфологические признаки. Клетки прямые, палочковидные, неподвижные, грамотрицательные. При рассеве на чашке с 2,0% агаризованной средой LB рост в виде отдельных колоний, иногда в R-форме с неровными краями. Хорошо растет на плотных и жидких питательных средах (LB-бульон, LB-агар, МПА, МПБ).
Физиолого-биохимические признаки. Клетки растут при температуре от +4°С до +42°С, при оптимуме рН=6,8-7,5. Штамм разлагает глюкозу, маннит с образованием кислоты, не разлагает сахарозу, арабинозу, галактозу, сбраживает мальтозу, ксилозу, сорбит, рамнозу. Существенным при использовании данного штамма является чувствительность к налидиксовой кислоте (25 мг/мл), стрептомицину (20 мг/мл) и рифампицину (25 мг/мл). Проявляет устойчивость к ампициллину (до 300 мкг/мл), обусловленную наличием плазмиды pESAT6-CFP10-DBD, и к канамицину (до 50 мкг/мл), обусловленную наличием плазмиды pREP4.
По созданию комплексного препарата рекомбинантного белка и декстрана 500 технический результат достигается за счет создания двухкомпонентного рекомбинантного белка, состоящего из белка ESAT6-CFP10 M. tuberculosis и гена декстрансукразы Leuconostoc citreum KM20, также за счет получения комплексного препарата (иммунологической композиции), в которой рекомбинантный белок (ESAT6-CFP10-DBD), иммобилизован на декстране (ESAT6-CFP10-DBD-neKCTpaH).
Рекомбинантный белок ESAT6-CFP10-DBD имеет в своем составе домен, определяющий его способность связываться с декстраном, что позволяет проводить в одну стадию концентрирование, очистку и иммобилизацию белкового продукта на декстране. Иммобилизация на декстране обеспечивается за счет присутствия в рекомбинантном белке декстрансвязывающего домена декстрансукразы из микроорганизма Leuconostoc citreum KM20.
Поскольку в E. coli отсутствуют белки, связывающиеся с декстраном, то синтезируемый в клетках E. coli, трансформированных плазмидой pESAT6-CFP10-DBD, рекомбинантный белок ESAT6-CFP10-DBD является единственным белком штамма-продуцента, прочно связывающимся с декстраном. Это обеспечивает возможность одностадийного получения высокоочищенного препарата белка, иммобилизованного на сорбенте. На чертеже приведена схема плазмиды pESAT6-CFP10-DBD.
Сравнение стабильности рекомбинантных микобактериальных белков, слитых с декстрансвязывающими доменами из L. mesenteroides и L. Citreum, выявило, что белки, слитые с декстрансвязывающим доменом из L. Mesenteroides, являются нестабильными и склонны к деградации при хранении свыше полугода, что не позволяет использовать вышеупомянутый домен для очистки этих рекомбинантных белков. Использование DBD L. citreum в качестве субъединицы, которая связывается с декстраном, позволяет получать более стабильные иммуногенные композиции.
Была исследована иммуногенность комплексного препарата ESAT6-CFP10-DBD - декстран на мышах линии C57bl. Животных иммунизировали под кожу спины 2-кратно с 2-недельным интервалом иммуногенным (рекомбинантный белок ESAT6-CFP10-DBD на декстране) и контрольным препаратом (физиологический раствор). Через 5 недель был исследован пролиферативный ответ Т-клеток и количество Т-клеток, продуцирующих ИФН-гамма. Был выявлен прирост ИФН-гамма-положительных Т-клеток и усиление пролиферации в присутствии соответствующего антигена в культуре клеток по сравнению с контрольными животными.
Техническим результатом, достигаемым при осуществлении изобретения, является получение штамма-продуцента, обеспечивающего высокий уровень продукции устойчивого иммуногенного белка, который может быть получен, иммобилизован и очищен в одну стадию. Нековалентное взаимодействие декстрансвязывающего домена с декстраном обеспечивает постоянный, но медленный выход антигена из комплекса с субстратом за счет естественной диссоциации, тем самым обеспечивая пролонгированное взаимодействие компонентов вакцины с иммунной системой организма (депонирование), достаточное для индукции сильного и продолжительного иммунного ответа. Тем самым достигается получение эффективной иммуногенной композиции против туберкулеза, стабильной в течение продолжительного времени.
Изобретение проиллюстрировано следующими примерами, приведенными ниже. Генно-инженерные и микробиологические манипуляции, амплификацию и секвенирование ДНК проводили по стандартным методикам (T. Parish, N.G. Stoker. Mycobacterium tuberculosis protocols., Humana Press Inc., 2001, Methods in molecular Medicine, 54; Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование, М.: Мир, 1984; Клонирование ДНК. Методы. Под ред. Д. Гловера, Пер. с англ., Москва, Мир, 1988; Saiki R.K., Gelfand D.H., Stoffel S. et al. Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science, 1988, vol.239, No. 4839, pp.487-491; Sanger F., Nicklen S., Coulson A.R. DNAsequencing with chain-terminating inhibitors (DNA polymerase/nucleotide sequences/bacteriophage 4Х174). Proc. Nat. Acad. Sci. USA, 1977, vol.74, No.12, pp.5463-5467).
Пример 1. Получение экспрессионной генетической конструкции pESAT6-CFP10-DBD
а) Получение фрагмента гена белка sp-DBD с последующим его клонированием в вектор pQE6.
Фрагмент гена белка sp-DBD, содержащий Gly-Ser спейсер и последовательность декстрансвязывающего домена DBD из Leuconostoc citreum KM20, получали синтетическим путем в фирме Евроген. Нуклеотидная последовательность, кодирующая белок sp-DBD, была спланирована с использованием оптимальных кодонов для экспрессии в E. coli с учетом отсутствия выраженной вторичной структуры мРНК.
Для клонирования гена белка sp-DBD плазмидный вектор pQE6 и синтезированную в фирме Евроген плазмиду рАТ-sp-DBD гидролизовали эндонуклеазами рестрикции NcoI и Kpn2I при 37°С в буфере, содержащем 33 мМ Трис-ацетата (рН 7,9 при 37°С), 10 мМ ацетата магния, 66 мМ ацетата калия и 0,1 мг/мл BSA в течение 1 ч. В 1,2% агарозном геле проводили разделение продуктов рестрикции. Выделенный из агарозного геля фрагмент вектора pQE6 (размером 3016 п.н.) объединяли с фрагментом плазмиды рАТ-sp-DBD (464 п.н.). Далее фрагменты лигировали при 25°С в буфере, содержащем 40 мМ Трис-HCl, 10 мМ MgCl2, 10 мМ DTT, 0,5 мМ АТФ (рН 7,8 при 37°С), с помощью ДНК лигазы бактериофага Т4 в течение 1 ч. Продукты реакции переосаждали при -20°С 96% этиловым спиртом с добавлением ацетата аммония в течение 1,5 ч. После переосаждения смесь растворяли в деионизированной воде. Методом электропорации полученной лигазной смесью трансформировали компетентные клетки E. coli штамма M15 [pREP4] (NalS, StrS, rifS, lac-, ara-, gal-, mtl-, F-, recA-, uvr+). После трансформации клоны отбирали на агаризованной среде LB, содержащей антибиотики ампициллин (50 мг/мл) и канамицин (25 мг/мл). Плазмидную ДНК из колоний выделяли методом щелочного лизиса; анализировали методом рестрикционного картирования эндонуклеазами рестрикции BglI, BglII, BspMII и NcoI. Отбирали клоны плазмидной ДНК psp-DBD (3480 п.н.), содержащие в своем составе последовательность гена белка sp-DBD. Первичную структуру полученных генно-инженерных конструкций подтверждали секвенированием.
б) Получение рекомбинантной плазмиды pESAT6-CFP10-DBD.
Фрагмент гена белка ESAT6 из М. tuberculosis получали синтетическим путем в фирме Евроген. Нуклеотидная последовательность, кодирующая белок ESAT6, была спланирована с использованием оптимальных кодонов для экспрессии в E. coli с учетом отсутствия выраженной вторичной структуры мРНК.
Для клонирования гена белка ESAT6-sp-DBD плазмиду psp-DBD и синтезированную в фирме Евроген плазмиду pAT-ESAT6 гидролизовали эндонуклеазами рестрикции NcoI-BamHI и NcoI-BglII, соответственно, при 37°С в буфере, содержащем 33 мМ Трис-ацетата (рН 7,9 при 37°С), 10 мМ ацетата магния, 66 мМ ацетата калия и 0,1 мг/мл BSA в течение 1 ч. В 1,2% агарозном геле проводили разделение продуктов рестрикции. Выделенный из агарозного геля фрагмент вектора psp-DBD (размером 3469 п.н.) объединяли с фрагментом плазмиды pAT-ESAT6 (284 п.н.). Далее фрагменты лигировали при 25°С в буфере, содержащем 40 мМ Трис-HCl, 10 мМ MgCl2, 10 мМ DTT, 0,5 мМ АТФ (рН 7,8 при 37°С), с помощью ДНК лигазы бактериофага Т4 в течение 1 ч. Продукты реакции переосаждали при -20°С 96% этиловым спиртом с добавлением ацетата аммония в течение 1,5 ч. После переосаждения смесь растворяли в деионизированной воде. Методом электропорации полученной лигазной смесью трансформировали компетентные клетки E. coli штамма M15 [pREP4] (NalS, StrS, rifS, lac-, ara-, gal-, mtl-, F-, recA-, uvr-. После трансформации клоны отбирали на агаризованной среде LB, содержащей антибиотики ампициллин (50 мг/мл) и канамицин (25 мг/мл). Плазмидную ДНК из колоний выделяли методом щелочного лизиса; анализировали методом рестрикционного картирования эндонуклеазами рестрикции BglI, BglII, BspMII и NcoI. Отбирали клоны плазмидной ДНК pESAT6-sp-DBD (3753 п.н.), содержащие в своем составе последовательность гена белка ESAT6-sp-DBD. Первичную структуру полученных конструкций подтверждали секвенированием.
Плазмиду pCFP10-DBD2 (последовательность №6) рекстрицировали по сайтам EcoRI и BamHI, фрагмент, кодирующий белок CFP10-DBD, и регуляторные последовательности (3739 нп) объединяли с помощью лигирования лигазой Т4 с фрагментом, кодирующим белок ESAT6 (389 нп), рестрицированным по сайтам EcoRI и BglII. Таким образом получали плазмиду pESAT-CFP-DBD (4128 нп, последовательность №3), кодирующую рекомбинантный белок ESAT6-CFP10-DBD.
Пример 2. Конструирование штамма E. coli - продуцента антигена М. tuberculosis, соединенного с декстрансвязывающим доменом
Для получения штамма E. coli - продуцента рекомбинантного белка ESAT6-CFP10-DBD, клетки штамма E. coli M15 [pREP4] трансформировали плазмидой pESAT6-CFP10-DBD. Трансформированные клетки выращивали в 3,5 мл среды LB с ампициллином и канамицином при 37°С до оптической плотности, соответствующей 1 ед. поглощения при длине волны 550 нм (около 2,5 ч). В культуру добавляли 3 мкл 0,1 М раствора ИПТГ и выращивали в течение 3 ч. Для контроля продукции рекомбинантных белков в штамме E. coli M15 [pREP4, pESAT6-CFP10-DBD] применяли метод электрофореза по Лэммли в присутствии додецилсульфата натрия (ДСН). Разделение белков проводили в 12% полиакриламидном геле (ПААГ) в стандартной системе буферов (электродный буфер: 25 мМ Tris-HCl, 192 мМ глицин, 0,1% додецилсульфат натрия, рН 8,3; буфер для геля: 375 мМ Трис-HCl, рН 8,8). По окончании электрофореза гели окрашивали 0,15% раствором Кумасси G250 в 25% изопропаноле и 10% уксусной кислоте и отмывали в 10% уксусной кислоте.
При сравнении спектра белков в штаммах E. coli Ml 5 [pREP4] и E. coli Ml 5 [pREP4, pESAT6-CFP10-DBD] обнаруживали появление дополнительной белковой полосы. Молекулярная масса дополнительной полосы 26,4 кДа соответствовала расчетной для белка ESAT6-DBD. Уровень синтеза белков в E. coli определяли, сравнивая интенсивность окрашивания полосы рекомбинантного белка с полосой соответствующего белка-стандарта Unstained Protein Molecular Weight Marker (Предприятие «Fermentas», Литва).
Для проверки растворимости синтезируемого белка биомассу выращенного штамма (E. coli M15 [pREP4, pESAT6-CFP10-DBD]) подвергали разрушению в 1% TES буфере (25 мМ Трис-HCl, 5 мМ ЭДТА, 50 мМ NaCl, 1% Тритон Х-100, 5 мг/мл лизоцим) при соотношении биомасса-буфер 1:2 и гомогенизировали до однородной массы. После центрифугирования пробы разделяли на 2 фракции: растворимых клеточных белков (надосад очная жидкость) и нерастворимых (осадок). Обе фракции подвергали разрушению в лизирующем буфере (0,05 М Трис-HCl, рН 6.8, 0,5% Triton X-100, 0,5 М NaCl, 0,25 М MgCl2, 5 мг/мл лизоцим, 10 мг/мл PMSF, 20 мг/мл ДНКаза) в соотношении 1:1; гомогенизировали до однородной массы; прогревали при +95°С 15 мин. Результаты контролировали с помощью электрофореза по Лэммли. Было показано, что рекомбинантный белок ESAT6-CFP10-DBD синтезируется в клетках E. coli как в растворимой фракции, так и виде телец-включений.
Пример 3. Получение рекомбинантного белка ESAT6-CFP10-DBD в свободном состоянии и в виде белка, иммобилизованного на декстране
Для получения рекомбинантного белка культуру штамма E. coli M15 [pREP4, pESAT6-CFP10-DBD] выращивали в 1000 мл среды LB с ампициллином и канамицином при 37°С до оптической плотности, соответствующей 1 ед. поглощения при длине волны 550 нм. В среду добавляли 100 мкл 0,1 М раствора ИПТГ и выращивали в течение 3 ч. Клетки осаждали центрифугированием при 5500 об/мин в течение 15 мин.
Осадок ресуспендировали в лизирующем буфере, содержащем 50 мМ Трис-HCl (рН 8,0), 0,25 мМ NaCl, 5 мМ MgCl2, 0,15 мМ PMSF, 0,1% Тритон-X100, 0,5 мг/мл лизоцима, 20 мг/мл ДНКазы; из расчета 1 г биомассы на 4 мл буфера. Дополнительно суспензию обрабатывали ультразвуком 3 раза по 20 с. После центрифугирования при 16000 об/мин в течение 30 мин фракция нерастворимых клеточных белков оставалась в осадке, растворимых - в надосадочной жидкости.
Осадок (нерастворимая фракция) суспендировали в лизирующем буфере (50 мМ Трис-HCl (рН 8,0), 10 мМ ЭДТА, 0,002 объема β-меркаптанола) и добавляли равный (по массе) объем мочевины. После перемешивания выдерживали на водяной бане при +37°С до полного растворения мочевины. Центрифугировали при 12000 об/мин 30 мин и отбирали надосадочную жидкость. Для очистки рекомбинантного белка надосадочную жидкость переносили на колонку с Sephadex G200 (декстран со сшивками). Элюцию белков с декстрана проводили градиентным раствором (8-2 М) мочевины и 50 мМ Трис-HCl (рН 8,0). Для удаления мочевины образцы диализовали против PBS буфера при 25°С в течение ночи.
Растворимую фракцию белков использовали для иммобилизации на декстране. К надосадочной жидкости добавляли раствор декстрана 500 с концентрацией 50 мг/мл в физиологическом растворе; инкубировали при 25°С 1 ч. В иммобилизованном на сорбенте состоянии белки представляют собой суспензию.
Концентрацию белков в свободной и иммобилизованной форме определяли по Бредфорду при длине волны 595 нм. Образцы подвергали лиофилизации. Таким образом, были получены следующие комплексные препараты (иммуногенные композиции) (антиген-DBD, антиген-DBD-декстран), степень чистоты которых составила не менее 95%.
Пример 4. Оценка стабильности очищенного рекомбинантного белка
Оценка стабильности рекомбинантных белков, полученных путем слияния последовательности микобактериального белка ESAT6-CFP10 и DBD Leuconostoc citreum или DBD Leuconostoc mesenteroides, проводилась с помощью электрофореза в 12% ПААГ. Препараты химерных белков ESAT6-CFP10-DBD Leuconostoc citreum и ESAT6-CFP10-DBD Leuconostoc mesenteroides хранились при температуре 0-4°С в течение 6 и 12 месяцев с даты лиофилизации. Исследования выявили, что белок ESAT6-CFP10-DBD Leuconostoc mesenteroides менее стабилен, чем ESAT6-CFP10-DBD Leuconostoc citreum, и после 6 месяцев хранения начинается его денатурация (см. фиг.1).
Пример 5. Способ проверки иммуногенности комплексных препаратов aHTHreH-DBD-декстран на мышах
Самкам мышей инбредной линии С57В16 вводили подкожно с двухнедельным интервалом следующие препараты: 1) ESAT6-CFP10-DBD-декстран (10 мкг на мышь по содержанию ESAT-6-CFP10); 2) DBD-декстран (10 мкг на мышь по содержанию DBD) - отрицательный контроль; 3) однократно вакцина BCG (106 КОЕ на мышь) - положительный контроль. Через 5 недель оценивали содержание в селезенках Т-лимфоцитов, продуцирующих ИФН-гамма в присутствии соответствующих антигенов в культуральной жидкости методом ELISPOT, с подсчетом клеток, реагирующих с антителами анти-ИФН-гамма, через 60 часов после начала культивирования. Результаты приведены в таблице:
Результаты показывают, что вакцинация моноантигенами, связанными с декстраном через DBD-домен, приводит к специфической активации продуцентов ИФН-гамма. Вакцинация теми же антигенами, в тех же количествах, но без адсорбции на декстране не вызывает иммунного ответа.
Техническим результатом, достигнутым при осуществлении изобретения, является расширение области применения группы изобретений, поскольку разработаны способ получения штамма-продуцента, обеспечивающего высокий уровень продукции устойчивого иммуногенного белка, который может быть получен, иммобилизован и очищен в одну стадию. При этом нековалентное взаимодействие декстрансвязывающего домена с декстраном обеспечивает постоянный, но медленный выход антигена из комплекса с субстратом за счет естественной диссоциации, тем самым обеспечивая пролонгированное взаимодействие компонентов вакцины с иммунной системой организма (депонирование), достаточное для индукции сильного и продолжительного иммунного ответа. Тем самым достигается получение эффективной иммуногенной композиции против туберкулеза, стабильной в течение продолжительного времени.



| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГИБРИДНОГО БЕЛКА CFP10-DBD И ДЕКСТРАНА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА pCFP10-DBD, ШТАММ Escherichia coli [pREP4, pCFP10-DBD], ХИМЕРНЫЙ БЕЛОК CFP10-DBD И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2546875C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГИБРИДНОГО БЕЛКА pESAT6-DBD И ДЕКСТРАНА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА pESAT6-DBD, ШТАММ Escherichia coli, ХИМЕРНЫЙ БЕЛОК ESAT6-DBD И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2520737C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГИБРИДНОГО БЕЛКА Ag85A-DBD И ДЕКСТРАНА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА pAg85A-DBD, ШТАММ Escherichia coli [pREP4, pAg85A-DBD], ХИМЕРНЫЙ БЕЛОК Ag85A-DBD | 2013 |
|
RU2520078C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ШТАММ Escherichia coli, ХИМЕРНЫЙ БЕЛОК И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2422525C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ШТАММ Escherichia coli, ХИМЕРНЫЙ БЕЛОК И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2422524C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pAg85A-CBD, ШТАММ Escherichia coli [pREP4, pAg85A-CBD], ХИМЕРНЫЙ БЕЛОК Ag85A-CBD И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2429292C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ТРЕХ ГИБРИДНЫХ БЕЛКОВ ОБОЛОЧКИ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, ОПРЕДЕЛЯЮЩИХ ПРИНАДЛЕЖНОСТЬ К СИБИРСКОМУ (DBD2-D3S), ЕВРОПЕЙСКОМУ (DBD2-D3E) И ДАЛЬНЕВОСТОЧНОМУ (DBD2-D3D) ПОДТИПАМ ВИРУСА; РЕКОМБИНАНТНЫЕ ПЛАЗМИДЫ pDBD2-D3S, pDBD2-D3E И pDBD2-D3D; ШТАММЫ-ПРОДУЦЕНТЫ Escherichia coli M15 [pREP4]; ХИМЕРНЫЕ БЕЛКИ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2560588C1 |
| Иммуногенная композиция на основе рекомбинантных псевдоаденовирусных частиц, а также на основе белковых антигенов и способ получения иммуногенной композиции | 2018 |
|
RU2691302C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, РЕКОМБИНАНТНЫЙ ШТАММ, РЕКОМБИНАНТНЫЙ БЕЛОК ВМР-7 И СПОСОБ ВЫДЕЛЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА В ДИМЕРНОЙ ФОРМЕ | 2012 |
|
RU2499047C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, РЕКОМБИНАНТНЫЙ ШТАММ, РЕКОМБИНАНТНЫЙ БЕЛОК ВМР-2 И СПОСОБ ВЫДЕЛЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА В ДИМЕРНОЙ ФОРМЕ | 2012 |
|
RU2499048C1 |

Группа изобретений относится к генной инженерии, биохимии, биотехнологии и иммунологии и представляет собой рекомбинантную плазмиду pESAT6-CFP10-DBD, рекомбинантный штамм Escherichia coli M15 [pREP4, pESAT6-CFP10-DBD], способ получения, иммобилизации, концентрирования и очистки рекомбинантного белка ESAT6-CFP10-DBD на декстране, рекомбинантный белок ESAT6-CFP10-DBD с молекулярной массой 26,4 кДа, иммуногенную композицию, содержащую белок ESAT6-CFP10-DBD, иммобилизованный на декстране, специфически активирующую Т-лимфоциты, синтезирующие ИФН-гамма при стимуляции антигенами микобактерий. Изобретение позволяет получить высокий уровень экспрессии белка, который эффективно индуцирует иммунный ответ на антиген микобактерий. 5 н.п. ф-лы, 2 ил., 1 табл., 5 пр.
1. Рекомбинантная плазмида pESAT6-CFP10-DBD, представленная нуклеотидной последовательностью №1, обеспечивающая экспрессию рекомбинантного белка ESAT6-CFP10-DBD, состоящего из полноразмерного белка ESAT6-CFP10 Mycobacterium. tuberculosis, Gly-Ser спейсера, декстрансвязывающего домена декстрансукразы Leuconostoc citreum KM20, размером 4128 п.н., состоящая из следующих структурных элементов:
- искусственный бактериальный оперон рекомбинантного белка Е8АТCFP-DBD, включающий: промоторную область бактериофага Т5 (7-87 п.н.), ген рекомбинантного белка ESAT-CFP-DBD (117-1226 п.н), нетранслируемую область терминации транскрипции (1256-1350 п.н.);
- бактериальный оперон бета-лактамазы, обеспечивающий устойчивость к ампициллину (3063-3923 п.н.);
- бактериальный участок инициации репликации типа ColEl (2295-2305 п.н.), обеспечивающий репликацию плазмиды в штаммах E.coli.
2. Рекомбинантный штамм Escherichia coli Ml5 [pREP4, pESAT6CFP10-DBD], полученный трансформацией штамма E.coli Ml5 [pREP4] плазмидой по п.1, продуцент белка ESAT6-CFP10-DBD.
3. Способ получения, иммобилизации, концентрирования и очистки рекомбинантного белка ESAT6-CFP10-DBD на декстране, включающий:
- выращивание клеток штамма Е. coli M15 [pREP4, pESAT6-CFP10DBD] по п.2;
- иммобилизацию белка ESAT6-CFP10-DBD в составе клеточных экстрактов штамма E.coli Ml 5 [pREP4, pESAT6-CFP10-DBD] на декстрановом сорбенте за счет аффинного взаимодействия при процедуре инкубации с последующей отмывкой от несвязавшихся бактериальных белков, при этом происходит концентрирование целевого продукта и его очистка;
- выделение целевого продукта.
4. Рекомбинантный белок ESAT6-CFP10-DBD с молекулярной массой 26,4 кДа, включающий полноразмерный белок ESAT6-CFP10 с последовательностью № 2, Gly-Ser спейсер с последовательностью № 3, декстрансвязывающий домен декстрансукразы из L. citreum KM20 с последовательностью № 4.
5. Иммуногенная композиция, содержащая белок по п.4 ESAT6-CFP10DBD, иммобилизованный на декстране, специфически активирующая Т-лимфоциты, синтезирующие ИФН-гамма при стимуляции антигенами микобактерий.
Авторы
Даты
2015-01-10—Публикация
2013-06-11—Подача