Изобретение относится к медицине, а именно к сердечно-сосудистой хирургии.
Известен способ обработки биологических протезов из ксеноперикарда (Патент РФ, № 2120212, 20.10.1998), включающий обработку биоткани (ксеноперикард теленка) в растворе 0,625% глутарового альдегида и поверхностно-активного вещества (ПАВ) в режиме интенсивного встряхивания при многократной смене рабочего раствора. В качестве ПАВ используют, например, 1% раствор додецилсульфата натрия.
Недостатком данного способа является недолговечность биологических протезов из ксеноперикарда, а именно кальцификация к 6-8 году после имплантации. Кроме того, в результате химической обработки ксеноперикарда глутаровым альдегидом и додецилсульфатом снижаются гидрофильность и, соответственно, биосовместимость ксеноперикарда и возрастает его цитотоксичность за счет содержания в нем остаточных альдегидных групп, провоцирующих отложение кальцификатов.
Техническим результатом предлагаемого способа химической обработки ксеноперикарда является увеличение долговечности и биосовместимости биопротезов, изготовленных из такого ксеноперикарда, за счет повышения их гидрофильности, понижения цитотоксичности и склонности к кальцификации.Технический результат достигается за счет нейтрализации остаточных альдегидных групп ксеноперикарда благодаря образованию альдиминных связей с аминогруппами хитозана и формированию на поверхности ксеноперикарда гидрофильного бислойного покрытия из противоположно заряженных производных хитозана.
Способ осуществляется следующим образом. Ксеноперикард стабилизируют 0,625% раствором глутарового альдегида с последующей обработкой 1% раствором додецилсульфата натрия. Полученный химически стабилизированный ксеноперикард дополнительно обрабатывают 0,05÷0,25% водным раствором хитозана или металлсодержащего хитозана со степенью деацетилирования (СД) 50÷98% и молекулярной массой (ММ) 4÷140·103 при рН 3÷5 в течение 20÷60 мин при 20÷30°С. По окончании обработки ксеноперикард фиксируют в 70% водном растворе этанола и затем ксеноперикард с фиксированным первичным хитозановым покрытием выдерживают в 0,10÷0,50% водном растворе N-сульфосукцината хитозана с ММ 10÷166·103 или 3,6-О-дисульфата хитозана с ММ 7÷180·103 при рН 4÷8 в течение 20÷60 мин при 20÷30°С с последующей фиксацией полученного покрытия в абсолютном этаноле. Модифицированный ксеноперикард хранят в стерильном физиологическом растворе при 6-8°С.
В результате обработки ксеноперикарда, стабилизированного глутаровым альдегидом, водным раствором хитозана или металлсодержащего хитозана, происходит связывание последнего с биологической тканью с образованием альдиминных связей за счет взаимодействия аминогрупп полимера с остаточными альдегидными группами стабилизированного глутаровым альдегидом ксеноперикарда. Выбранный для этого интервал рН 3-5 растворов хитозана обеспечивает, во-первых, протонирование необходимого количества аминогрупп хитозана для полного его растворения и, во-вторых, делает возможным их связывание с остаточными альдегидными группами ксеноперикарда. Для формирования прочного гидрофильного покрытия модифицированный хитозаном ксеноперикард дополнительно обрабатывают противоположно заряженными производными хитозана, например N-сульфосукцинатхитозаном (ССХ) и 3,6-О-дисульфатхитозаном (OCX) с образованием полиэлектролитного комплекса (ПЭК). Выбранный при этом интервал рН 4-8 растворов сульфатов хитозана обеспечивает эффективное электростатическое взаимодействие как карбоксильных, так и сульфатных групп используемых производных с аминогруппами хитозана, покрывающего первым слоем ксеноперикард. По окончании обработки ксеноперикард выдерживают в абсолютном этаноле для перевода образовавшегося покрытия в нерастворимую в воде форму, что позволяет длительно хранить модифицированный ксеноперикард в стерильном физиологическом растворе при температуре 6-8°С.
В таблице 1 приведены используемые в предлагаемом способе химической обработки ксеноперикарда производные хитозана с наиболее существенными характеристиками, такими как: степень деацетилирования (СД), молекулярная масса (ММ) и содержание серы.
Ниже приведены конкретные примеры осуществления предлагаемого способа.
Пример 1
Ксеноперикард теленка подвергают стабилизации 0,625% раствором глутарового альдегида с последующей обработкой 1% раствором додецилсульфата натрия и изготавливают из него биопротезы в виде пластин.
Ксеноперикард в виде пластин площадью 30 см2 и толщиной 0,4-0,5 мм несколько раз тщательно промывают стерильным физиологическим раствором с 6-кратной сменой раствора из расчета 500 мл на 100 г биоткани, отмытый ксеноперикард помещают в 50 мл (10 г/50 мл) 0,05% водного раствора Хит-1 с ММ 140·103 г/моль и рН 3, интенсивно перемешивают на шейкере в течение 30 мин при 20°С. По окончании обработки ксеноперикард погружают в 70% водный раствор этанола и затем ксеноперикард с фиксированным первичным хитозановым покрытием помещают в 50 мл 0,10% водного раствора ССХ-3 с MM 128·103 г/моль и рН 8, интенсивно перемешивают на шейкере в течениие 30 мин при 20°С. По окончании обработки двойной полимерный слой на поверхности ксеноперикарда фиксируют абсолютным этанолом, после чего модифицированный ксеноперикард помещают в стерильный физиологический раствор и хранят при температуре 6-8°С. Достижение технического результата подтверждается биомедицинскими доклиническими исследованиями, результаты которых в сравнении со способом-прототипом приведены в таблицах 2-5.
Пример 2
Ксеноперикард теленка подвергают стабилизации 0,625% раствором глутарового альдегида с последующей обработкой 1% раствором додецилсульфата натрия и изготавливают из него биопротезы в виде пластин.
Ксеноперикард в виде пластин площадью 30 см2 и толщиной 0,4-0,5 мм несколько раз тщательно промывают стерильным физиологическим раствором с 6-кратной сменой раствора из расчета 500 мл на 100 г биоткани, отмытый ксеноперикард помещают в 50 мл (10 г/50 мл) 0,25% водного раствора Хит-Cu с ММ 100·103 г/моль с рН 4 в течение 60 мин при 30°С. По окончании обработки ксеноперикард погружают в 70% водный раствор этанола и затем ксеноперикард с фиксированным первичным хитозановым покрытием помещают в 50 мл 0,25% водного раствора ССХ-5 с ММ 37·103 г/моль и рН 5 в течение 60 мин при 30°С. По окончании обработки двойной полимерный слой на поверхности ксеноперикарда фиксируют абсолютным этанолом, после чего модифицированный ксеноперикард помещают в стерильный физиологический раствор и хранят при температуре 6-8°С. Достижение технического результата подтверждается биомедицинскими доклиническими исследованиями, результаты которых в сравнении со способом-прототипом приведены в таблицах 2-5.
Пример 3
Ксеноперикард теленка подвергают стабилизации 0,625% раствором глутарового альдегида с последующей обработкой 1% раствором додецилсульфата натрия и изготавливают из него биопротезы в виде пластин.
Ксеноперикард в виде пластин площадью 30 см2 и толщиной 0,4-0,5 мм несколько раз тщательно промывают стерильным физиологическим раствором с 6-кратной сменой раствора из расчета 500 мл на 100 г биоткани, отмытый ксеноперикард помещают в 50 мл (10 г/50 мл) 0,25% водного раствора Хит-3 с ММ 4·103 г/моль и рН 5 в течение 20 мин при 25°С. По окончании обработки ксеноперикард погружают в 70% водный раствор этанола и затем ксеноперикард с фиксированным первичным хитозановым покрытием помещают в 50 мл 0,30% водного раствора ОСХ-2 с ММ 21·103 г/моль и рН 7 в течение 60 мин при 25°С. По окончании обработки двойной полимерный слой на поверхности ксеноперикарда фиксируют абсолютным этанолом, после чего модифицированный ксеноперикард помещают в стерильный физиологический раствор и хранят при температуре 6-8°С. Достижение технического результата подтверждается биомедицинскими доклиническими исследованиями, результаты которых приведены в таблицах 2-5, где представлены преимущества предлагаемого способа в сравнении со способом-прототипом.
мый способ
Представленные данные свидетельствуют о том, что модификация ксеноперикарда Хит-1 и затем ССХ-3, как описано в примере 1, либо Хит-Cu и затем ССХ-5, как описано в примере 2, либо Хит-3 и затем ОСХ-2, как описано в примере 3, значительно снижает цитотоксичность биологических протезов, изготовленных из модифицированного ксеноперикарда.
Представленные данные свидетельствуют о том, что модификация ксеноперикарда Хит-1 и затем ССХ-3, как описано в примере 1, либо Хит-Cu и затем ССХ-5, как описано в примере 2, либо Хит-3 и затем OCX-2, как описано в примере 3, позволяет существенно уменьшить кальцификацию биологических протезов, изготовленных из модифицированного ксеноперикарда, на модели подкожной имплантации крысам.
Представленные данные свидетельствуют о том, что модификация ксеноперикарда Хит-1 и затем ССХ-3, как описано в примере 1, либо Хит-Cu и затем ССХ-5, как описано в примере 2, либо Хит-3 и затем ОСХ-2, как описано в примере 3, придает биологическим протезам, изготовленным из модифицированного ксеноперикарда, антимикробные свойства.
Представленные данные свидетельствуют о том, что модификация ксеноперикарда Хит-1 и затем ССХ-3, как описано в примере 1, либо Хит-Cu и затем ССХ-5, как описано в примере 2, либо Хит-3 и затем OCX-2, как описано в примере 3, не снижает механической прочности ксеноперикарда.
Остальные конкретные примеры, раскрывающие сущность предлагаемого изобретения, приведены в таблице 6.
В примерах, описанных в таблице 6, количество покрывного вещества (иммобилизованного ПЭК) на поверхности ксеноперикарда определяли по цветной реакции с фенол-серной кислотой спектрофотометрически при длине волны 492 нм.
Толщину образующейся пленки на ксеноперикарде определяли на основании количества покрывного вещества (m), определяемого по содержанию серы рентгенофлуоресцентным методом, по формуле:
h=m/r·S,
где: h - толщина пленки (см); m - масса пленки (г); r - плотность полимера (г/см3); S - площадь образца (см2).
При использовании ОСХ-4 для получения покрытия содержание серы на поверхности ксеноперикарда составляло 0,25%. На основании этих данных расчет толщины (h) пленки, образующейся по примеру 9 (табл.6), представляет:
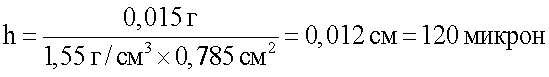
Краевой угол смачивания, а также скорость сорбции капли воды ксеноперикардом (табл.7), отражающие степень гидрофильности поверхности ксеноперикарда, оценивали с помощью стандартизованной методики регистрации динамики изменения формы адсорбированной капли и фиксации ее геометрии в течение некоторого промежутка времени с помощью цифровой камеры установки Фемтоскан Радиан (ЦПТ, Россия).
Содержание остаточных альдегидных групп после обработки ксеноперикарда хитозаном определяли по цветной реакции с 2,4-динитрофенилгидразином спектрофотометрически при длинах волн 460 нм и 525 нм. Проведенные измерения показали практически полное отсутствие свободных альдегидных групп после обработки ксеноперикарда растворами хитозана.
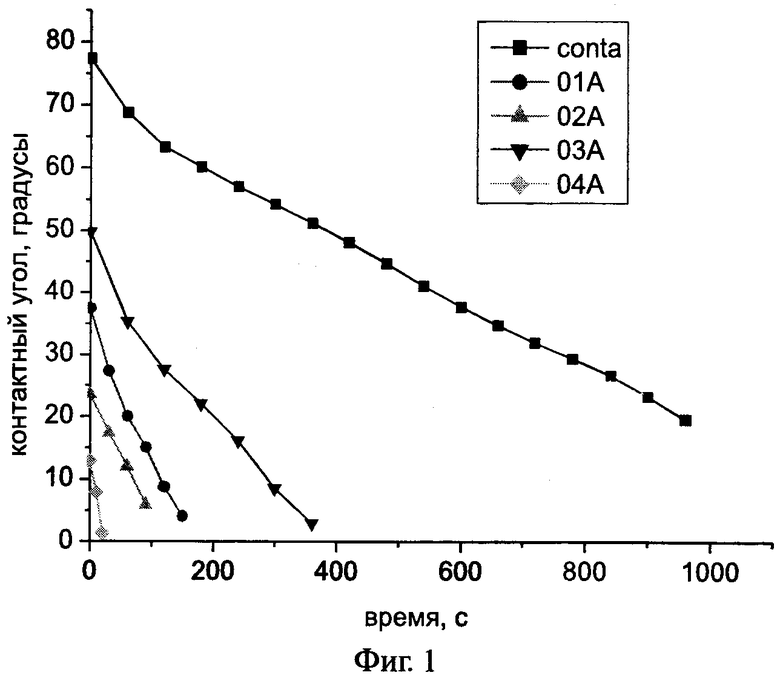
На фиг.1 показана зависимость контактного угла смачивания подложки ксеноперикарда для капли воды от времени с однослойным (образцы 01А и 03А) и двухслойным (образцы 02А и 04А) покрытиями. Обозначения:
1. conta - без покрытия (прототип);
2. 01А - однослойное покрытие Хит-3;
3. 02А - двухслойное покрытие Хит-3 + ССХ-1;
4. 03А - однослойное покрытие Хит-Cu;
5. 04А - двухслойное покрытие Хит-Cu + ССХ-5.
Представленные на фиг.1 данные свидетельствуют об увеличении гидрофильности поверхности ксеноперикарда в результате первичной обработки (01А и 03А), которая дополнительно повышается после вторичной обработки сульфопроизводным хитозана (ССХ-1 и ССХ-5). При этом, как видно из таблицы 7, скорость впитывания капли для образцов, покрытых OCX, с высоким содержанием сульфатных групп заметно выше (примеры 6-8), чем для образцов, покрытых ССХ, в качестве контроля взяты образцы пластин, полученные по способу, указанному в прототипе.
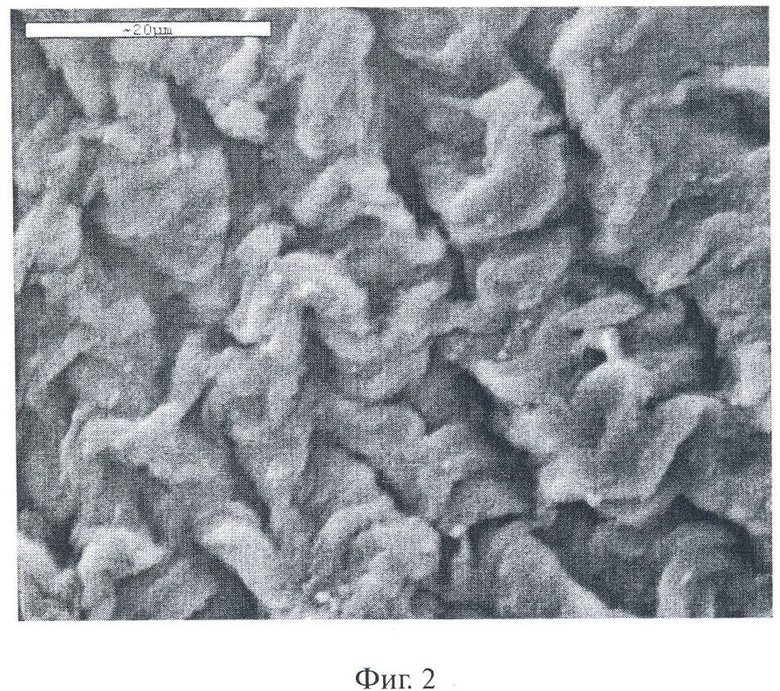
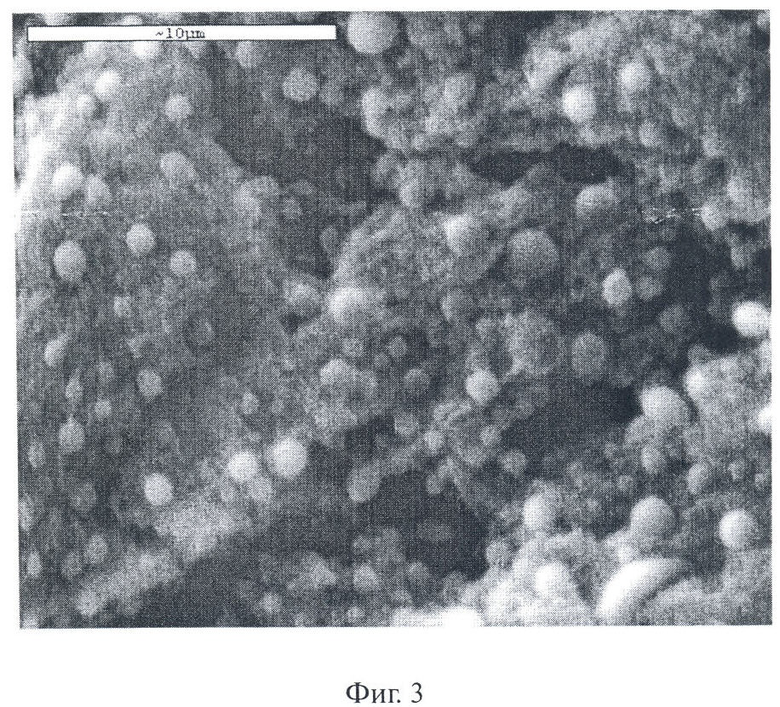
Для характеристики степени молекулярной дисперсности исследуемых растворов использовали метод динамического светорассеяния. Измерения размеров частиц этих растворов показали, что водные растворы сульфатированных производных хитозана содержат, в основном, частицы двух типов с радиусом R1(0)=3,5±1 нм и R2(0)=123,6±8 нм для ССХ и R1(0)=5,5±1 нм и R2(0)=175,4±7,4 нм для OCX. Между тем, слабокислые водные растворы хитозана содержат небольшое количество надмолекулярных частиц, размеры которых в некоторых случаях превосходят предел исключения применяемых для стерилизации мембран (0,22 мкм). Очевидно, это связано с различной формой агрегированных макромолекул в используемых растворителях. При обработке ксеноперикарда согласно предлагаемому способу первоначально растворами хитозана (см. п/п 1-5, табл.1), фиксацией в 70% водном растворе этанола, а затем растворами ССХ или OCX с последующим осаждением абсолютным этанолом, очевидно, могут образовываться более крупные комплексные надмолекулярные частицы. На фиг.2 и 3 представлены результаты исследования методом электронной сканирующей микроскопии морфологии поверхности химически стабилизированного ксеноперикарда до обработки растворами производных хитозана (фиг.2) и ксеноперикарда, модифицированного хитозаном (п/п 1-5, табл.1) и 3,6-О-дисульфатом хитозана (фиг.3). Таким образом, изобретение в представленной совокупности признаков очевидным образом обеспечивает достижение технического результата, а именно снижает степень кальцификации и цитотоксичности биопротезов, придает им антимикробные свойства, что, безусловно, увеличивает их долговечность и снижает риск повторных операций.
Перспективы клинического применения биологических протезов из ксеноперикарда, обработанного по предлагаемому способу путем его предимплантационной модификации производными хитозана, предполагают создание нового поколения биологических протезов, отличающихся высокой биологической совместимостью, резистентностью к развитию инфекции, кальцификации и, как следствие, большей безопасностью и эффективностью функционирования в организме.
Разрабатываемые новые биологические протезы из ксеноперикарда, отличающиеся высокой биологической совместимостью, смогут найти широкое применение в кардиохирургических клиниках Российской Федерации и за рубежом.
Внедрение предлагаемого способа обработки ксеноперикарда производными хитозана в производство биопротезов будет иметь позитивный социально-экономический эффект при использовании этого вида протезов в клинической практике за счет сокращения числа повторных дорогостоящих кардиохирургических вмешательств по замене биологических протезов клапанов сердца.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРЕДИМПЛАНТАЦИОННОЙ ОБРАБОТКИ БИОПРОТЕЗОВ | 2007 |
|
RU2384309C2 |
| Способ химической обработки ксеноперикарда | 2023 |
|
RU2836928C1 |
| БИОЛОГИЧЕСКИЙ ПЕРИКАРДИАЛЬНЫЙ ПРОТЕЗ КЛАПАНА СЕРДЦА С ХИТОЗАНОВЫМ ПОКРЫТИЕМ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2519219C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БИОПРОТЕЗА КЛАПАНА СЕРДЦА | 2003 |
|
RU2238061C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БИОПРОТЕЗА КЛАПАНА СЕРДЦА НА ГИБКОМ ОПОРНОМ КАРКАСЕ С НИЗКИМ ПРОФИЛЕМ | 2017 |
|
RU2698983C2 |
| Способ обработки биопротезов клапанов сердца | 1988 |
|
SU1651890A1 |
| Способ обработки трансплантатов для сердечно-сосудистой хирургии с использованием суб- и сверхкритического диоксида углерода | 2022 |
|
RU2796364C1 |
| СПОСОБ ПРЕДИМПЛАНТАЦИОННОЙ ОБРАБОТКИ БИОЛОГИЧЕСКИХ ПРОТЕЗОВ СОСУДОВ И КЛАПАНОВ СЕРДЦА | 1996 |
|
RU2120212C1 |
| СПОСОБ МОДИФИКАЦИИ БИОТКАНИ ДЛЯ ПРОТЕЗИРОВАНИЯ | 2012 |
|
RU2523879C2 |
| БИОЛОГИЧЕСКИЙ МАТЕРИАЛ ДЛЯ ПРОТЕЗОВ | 2009 |
|
RU2418607C1 |
Изобретение относится к медицине, а именно к сердечно-сосудистой хирургии. Предложен способ химической обработки ксеноперикарда, включающий химическую стабилизацию ксеноперикарда 0,625% раствором глутарового альдегида и последующую обработку 1% раствором додецилсульфата натрия, при этом химически стабилизированный ксеноперикард дополнительно обрабатывают 0,05÷0,25% водным раствором хитозана или металлсодержащего хитозана со степенью деацетилирования 50÷98% и с молекулярной массой 4÷140·103 при рН 3÷5, по окончании обработки ксеноперикард фиксируют в 70% водном растворе этанола, затем модифицированный ксеноперикард выдерживают в 0,10÷0,50% водном растворе N-сульфосукцината хитозана с молекулярной массой 10÷166·103 или 3,6-O-дисульфата хитозана с молекулярной массой 7÷180·103 при рН 4÷8 в течение 20÷60 мин при температуре 20÷30°С с последующей фиксацией в абсолютном этаноле. Изобретение обеспечивает увеличение долговечности и биосовместимости биопротезов. 3 ил., 7 табл.
Способ химической обработки ксеноперикарда, включающий химическую стабилизацию ксеноперикарда 0,625%-ным раствором глутарового альдегида и последующую обработку 1%-ным раствором додецилсульфата натрия, отличающийся тем что химически стабилизированный ксеноперикард дополнительно обрабатывают 0,05÷0,25%-ным водным раствором хитозана или металлсодержащего хитозана со степенью деацетилирования 50÷98% и с молекулярной массой 4÷140·103 при рН 3÷5, по окончании обработки ксеноперикард фиксируют в 70%-ном водном растворе этанола, затем модифицированный ксеноперикард выдерживают в 0,10÷0,50%-ном водном растворе N-сульфосукцината хитозана с молекулярной массой 10÷166·103 или 3,6-О-дисульфата хитозана с молекулярной массой 7÷180·103 при рН 4÷8 в течение 20÷60 мин при температуре 20÷30°С с последующей фиксацией в абсолютном этаноле.
| СПОСОБ ПРЕДИМПЛАНТАЦИОННОЙ ОБРАБОТКИ БИОЛОГИЧЕСКИХ ПРОТЕЗОВ СОСУДОВ И КЛАПАНОВ СЕРДЦА | 1996 |
|
RU2120212C1 |
| Способ изготовления биопротеза клапана сердца из аортальных ксеноклапанов | 1983 |
|
SU1398855A1 |
| SHANTHI C | |||
| et al | |||
| Chitosan-modified poly(glycidyl methacrylate-butyl acrylate) copolymer grafted bovine pericardial tissue - anticalcification properties., Carbohydrate Polymers, 2001, 44(2), 123-321 | |||
| KURIBAYASHI R | |||
| et al., Efficacy of the chitosan posttreatment in calcification prevention on the | |||
Авторы
Даты
2010-03-20—Публикация
2008-04-07—Подача