Изобретение относится к медицине, а именно к сердечно-сосудистой хирургии, и может найти применение при операциях на аорте и иных кардиохирургических вмешательствах.
Ксеноперикард используется в качестве пластического материала при различных способах коррекции клапанной патологии миокарда, корня аорты, дефектов стенки миокарда, перегородок сердца, пластики сосудистой стенки.
Нативный необработанный ксеноперикард не может использоваться для этих задач, так как является иммунологически чужеродным материалом, который будет приводить к воспалительному ответу организма и как следствие кальцификации и биодеградации материала. Кроме того, необработанный перикард не обладает необходимой прочностью и жесткостью для применения его в качестве пластического материала. Таким образом, перед клиническим применением, должна быть проведена его обработка.
Главная задача существующих методик обработки ксеноперикарда состоит в том, чтобы добиться полного удаления из материала клеточных элементов, так как они являются основными антигенами, но при этом сохранить коллаген и эластин, которые определяют механические характеристики перикарда. [Иванов А.С., Балоян Г.М., Тараян М.В., Лебедева А.В., Рудаков А.С. Непрямая истмопластика коарктации аорты ксеноперикардом. Ближайшие и отдаленные результаты хирургической коррекции // Кардиология и сердечно сосудистая хирургия. 2007. №1. С. 73-77].
При использовании ксеноперикарда в сердечно-сосудистой хирургии необходимо биомеханическое соответствие ксеноперикарда с аортой, которая подвергаются пластике или протезированию. Жесткость ксеноперикарда в этом случае должна быть сопоставимой с жесткостью аорты. Также, чтобы использовать ксеноперикард в качестве пластического материала, он должен обладать достаточной жесткостью на изгиб, чтобы им было удобно манипулировать при проведении хирургического вмешательства: формировать из него необходимые конструкции и прошивать его хирургическими нитями.
Существуют разные способы обработки ксеноперикарда.
В патенте РФ №2008767 С1 описан способ, включающий в себя обработку биоткани 2-5% раствором диглицидилового эфира этиленгликоля с дальнейшей обработкой гепарином с концентрацией не менее 100 МЕ/мл. Достоинствами данного способа является то, что с его помощью можно достичь высокий уровень прочности биоткани, так как при обработке ксеноперикарда раствором диглицидилового эфира этиленгликоля, на поверхности биоткани создается защитная пленка, при этом не затрагивая его естественную пластичность и биосовместимость [Изучение биохимических показателей крови при имплантации модифицированного ксеноматериала на основе перикарда., бакалаврская работа по специальности 06.03.01 биология, Капустина О.А., г. Пенза, 2020 г.]. Однако во время имплантации ксеноперикарда, при его механической фиксации (прошивании), защитная пленка повреждается, вследствие чего снижается прочность всей биоткани, что приводит к дальнейшей кальцификации.
Из патента РФ №2197818 С1 известен способ, в котором биоткань для ксенопротезирования перед ферментативной обработкой выдерживают в течение 15-72 ч в гипертоническом растворе хлорида натрия 1-10%-ной концентрации, обрабатывают ферментом в боратном буферном растворе при 32-37°С, отмывают сначала в 0,6-6%-ном растворе уксусной кислоты, затем в растворе гидрокарбоната натрия и растворах хлорида натрия, выдерживают в многократно заменяемом растворе глутарового альдегида в буферном растворе с возрастающей концентрацией и стерилизуют.
Недостатками данного способа являются высокая концентрация используемого фермента и длительная ферментативная обработка, а также использование в качестве растворителя террилитина боратного буферного раствора, что может привести к разрушению коллагеново-эластической структуры биоткани в ходе обработки, а также повышению степени ее минерализации [патент РФ №2523879 C2]. Также недостатком данного способа является выдерживание биоткани в возрастающих концентрациях глутарового альдегида.
Частично вышеуказанные недостатки предложенного способа скорректированы в патенте РФ №2523879 «Способ модификации биоткани для протезирования», в котором биоткань перед ферментативной обработкой помещают в гипертонические растворы хлорида натрия и подвергают воздействию ультразвука в течение 20-300 минут. Затем обрабатывают ферментом террилитином в концентрации 0,1-10 ПЕ на 1 грамм ткани, отмывают в растворе уксусной кислоты и гидрокарбонате натрия, выдерживают в растворах глутарового альдегида с возрастающей концентраций и стерилизуют. Использование физического (ультразвукового) способа децеллюляризации позволяет уменьшить степень повреждения внеклеточного коллагенового матрикса за счет смягчения режима химической обработки. Недостатком данного способа также является выдерживание биоткани в растворах глутарового альдегида с возрастающей концентрацией.
Глутаровый альдегид является наиболее популярным сшивающим агентом, применяемым для обработки биологических тканей при создании биопротезов. Глутаровый альдегид представляет собой небольшие молекулы, каждая из которых содержит две альдегидные группы, разделенные гибкой цепью из трех метиленовых групп. В водных растворах глутаральдегид присутствует в виде мономеров и полимеров переменного размера. Альдегидные группы глутарового альдегида взаимодействуют с аминогруппами белков, что приводит к образованию большого количества поперечных связей между полипептидными цепями [патент РФ №2741224 C1].
Основным недостатком при сшивании глутаровым альдегидом является цитотоксичность, опосредованная химизмом реакции, при которой глутаровый альдегид сам участвует в реакции и не может быть впоследствии устранен путем отмывания. Это приводит к тому, что свободные альдегидные группы, не вступившие в реакцию, приводят к кальцификации биоткани.
В патенте РФ №2384348 С2 предложен способ химической обработки ксеноперикарда, включающий химическую стабилизацию ксеноперикарда 0,625% раствором глутарового альдегида и последующую обработку 1% раствором додецилсульфата натрия, при этом химически стабилизированный ксеноперикард дополнительно обрабатывают 0,05÷0,25% водным раствором хитозана или металлсодержащего хитозана.
Данный способ уменьшает цитотоксичность и степень кальцификации ткани вследствие связывания остаточных альдегидных групп хитозаном. К недостаткам этого способа относятся: невысокая эффективность децеллюляризации, осуществляемая только лишь за счет действия 1% додецилсульфат натрия; стабилизация глутаровым альдегидом, который является цитотоксичным; обработка возрастающими концентрациями этанола, приводящая к увеличению жесткости биоткани.
Для устранения вышеуказанных недостатков и применения в области хирургии аорты ксеноперикард должен пройти полноценную стадию децеллюляризации, приводящую к минимальному снижению механических свойств биоткани, а также стадию химической стабилизации, не повышающую цитотоксичность материала и обеспечивающую нужные деформационно-прочностные характеристики.
Наиболее близким к предлагаемому способу является способ обработки перикарда, описанный в статье Li N., Li Y., Gong D., Xia C, Liu X., Xu Z. Efficient decellularization for bovine pericardium with extracellular matrix preservation and good biocompatibility // Interact Cardiovasc Thorac Surg. - 2018. - T. 26, №5. - C. 768-776. Данный способ выбран нами в качестве прототипа.
Согласно способу-прототипу, после забора ксеноперикард отмывают в фосфатно-солевом буфере от крови, далее осуществляют 5 последовательных циклов заморозки-разморозки. Заморозку проводят в жидком азоте при температуре -196°С в течение 10 минут, а разморозку в термостате при 37°С в течение 10 минут. Далее образцы промывают деионизованной водой. Затем куски перикарда обрабатывают 1% додецилсульфатом натрия и 0,5% дезоксихолатом натрия в Трис буффере (10 мМ, рН 7,6) на протяжении 48 часов при 40°С. После децеллюляризации биоткань промывают дистилированной водой в течение 12 часов при 4°С. На последнем этапе обработки ксеноперикард промывают в фосфатно-солевом буфере 72 часа со сменой раствора каждые 8 часов для удаления остаточных детергентов из тканей.
Такой способ позволяет эффективно проводить децеллюляризацию, а полученная таким образом биоткань устойчива к кальцификации в условиях in vivo. Однако данный способ также имеет недостатки. Во-первых, предварительная отмывка биоткани от остатков крови в фосфатно-солевом буфере, согласно предложенной методике, недостаточно эффективна. В результате такой отмывки на биоткани могут оставаться форменные элементы крови, которые впоследствии могут снижать эффективность последующей децеллюляризации. Во-вторых, высокая температура децеллюляризации (40°С) и отсутствие ингибиторов протеаз в децеллюляризовочном растворе, способствует аутолизу биоткани. Температура 37-40°С является температурным оптимумом большинства ферментов. В отсутствии ингибиторов протеаз выдерживание биоткани при данной температуре приводит к повреждению ее структуры и ухудшению механических свойств, что для использования полученного материала в сердечно-сосудистой хирургии крайне нежелательно. В-третьих, в указанном способе отсутствует этап сшивки коллагена после децеллюляризации. Это означает, что снижение прочности материала вследствие обесклечивания биоткани не будет компенсировано путем сшивания коллагена, а полученный материал не будет обладать достаточной прочностью для его применения в сердечно-сосудистой хирургии.
Предлагаемый способ позволит устранить эти недостатки.
Техническим результатом предлагаемого способа химической обработки ксеноперикарда является повышение его прочности и, как следствие, увеличение его долговечности.
Технический результат настоящего изобретения достигается тем, что в известном способе химической обработки ксеноперикарда, включающем отмывку его от крови в фосфатно-солевом буфере, 5 последовательных циклов заморозки ксеноперикарда при температере -196°С, с последующий разморозкой в термостате при температуре 37°С до полного размораживания, промывку деионизированной водой, децеллюляризацию ксеноперикарда раствором 1% додецилсульфата натрия и 0,5% дезоксихолата натрия в Трис буффере (10 мМ, рН 7,6) на протяжении 48 часов с последующей промывкой дистилированной водой в течение 12 часов при 4°С и обработкой фосфатно-солевым буфером на протяжении 72 часов, согласно изобретению, дополнительно отмывку ксеноперикарда выполняли цитратом натрия 0,01-0,1М, заморозку ксеноперикарда осуществляли при температуре -80°С в морозильной камере с экспозицией от 1 до 5 часов, децеллюляризацию проводили в растворе содержащем 1% додецилсульфата натрия и 0,5% дезоксихолата натрия в Трис буффере (10 мМ, рН 7,6) с добавлением 0,01-0,1М этилендиаминтетрауксусной кислоты в течение 48 часов при температуре 4-20°С на шейкере, промывку децеллюляризованного ксеноперикарда проводили деионизованной водой в течение 12 часов при 4°С с трехкратной сменой раствора, и фосфатно-солевым буфером в течение 72 часов с восьмикратной сменой раствора, затем ксеноперикард обрабатывали сшивающим раствором, содержащим 0,01-0,05 М 1-Этил-3-(3-диметиламинопропил)карбодиимид (EDC), 0,004-0,02 М N-гидроксисукцинимидом (NHS) и 0,05 М MES буфер при 4-25°С на шейкере от 2 до 24 часов, после чего его промывали в растворе 0,1 М гидрофосфата натрия (Na2HPO4) в течение 1-2 часов, затем три раза в деионизованной воде в течение 30-120 минут.
Способ осуществляли следующим образом.
Ксеноперикардиальную ткань, изъятую у здоровых свиней, замораживали в течение 4 часов после смерти животного до температуры -80°С. В таком виде ткань доставляли в лабораторию. В лаборатории ткань размораживали, удаляли жир и аккуратно отсепаровывали париетальный лист перикарда, не повреждая его целостность. При наличии поврежденных участков (царапины, дефекты, жировые включения, гофры), а также неравномерной толщине -фрагменты отбраковывались. Для дальнейшей обработки отбирали участки передней поверхности сердечной сумки, покрывающие желудочки сердца, как наиболее утолщенные. Связки перикарда и соединительнотканные сращения разделяли исключительно острым способом во избежание микроразрывов, нарушающих целостность ткани. Затем ксеноперикард отмывали от крови в фосфатно-солевом буфере с добавлением цитрата натрия, что обеспечивало полную отмывку его от форменных элементов крови. Далее образцы подвергали 5 циклам заморозки-разморозки в морозильной камере. Заморозка осуществлялась до -80°С с экспозицией 1-5 часов, разморозка в термостате при температуре 37°С до полного размораживания. На этом этапе достигалось нарушение целостности клеток физическим способом за счет неравномерной кристаллизации воды внутри клеток. После крайнего цикла, образцы промывали деионизованной водой. Затем образцы помещали в децеллюляризовочный раствор, содержащий 1% раствор додецилсульфата натрия, 0,5% раствор дезоксихолата натрия, Трис буффер (10 мМ, рН 7,6) и 0,01-0,1М этилендиаминтетрауксусную кислоту (ЭДТА). Образцы инкубировали в указанном растворе на протяжении 48 часов при температуре 4-20°С на шейкере.
Использование такой стадийной обработки, добавление ингибиторов металлопротеиназ, а также снижение температуры при которой производятся все манипуляции, позволяет избежать факторов повреждения, описанных выше, без ущерба эффективности децеллюляризации. Эффективность децеллюляризации данным способом подтверждена с помощью флуоресцентной микроскопии гистологических срезов с использованием 4',6-диамидино-2-фенилиндола (DAPI) (Фиг 1, 2). На Фиг. 1 - нативный ксеноперикард с сохраненными клеточными структурами после проведения флуоресцентной микроскопии. На Фиг. 2 - ксеноперикард, после децеллюляризации по предлагаемой методике.
Для повышения механических свойств и устойчивости к деградации ксеноперикард обрабатывали сшивающим раствором, содержащим 0,01-0,05 М 1-Этил-3-(3-диметиламинопропил)карбодиимид (EDC), 0,004-0,02 М N-гидроксисукцинимидом (NHS) и 0,05 М MES буфер при 20°С на шейкере от 2 до 24 часов, после чего его промывали в растворе 0,1 М гидрофосфата натрия (Na2HPO4) в течение 1-2 часов, а затем три раза в деионизованной воде в течение 30-120 минут. EDC в сочетании с NHS представляет собой сшивающий агент «нулевой длины», который химически активирует молекулы и конъюгирует их с образованием ковалентных связей между боковыми группами молекулярных цепей коллагена. При сшивании коллагена EDC активирует карбоксильные группы аспарагиновой и глутаминовой кислот, которые легко реагируют с амино-группами боковых цепей коллагена, что приводит к формированию межмолекулярных ковалентных связей. NHS предупреждает преждевременный гидролиз образованных соединений, путем формирования NHS-активированных карбоксильных групп, которые впоследствии также вступают в реакцию с аминогруппами. Такая обработка проявляет низкую цитотоксичность, так как данный сшивающий агент может быть удален из структуры материала, путем промывки в воде и/или гидрофосфате натрия. Учитывая особенности химизма реакции, сшивание коллагена происходит преимущественно интрафибриллярно, но существуют данные? что этот агент формирует и межфибриллярные связи (М. Nair, Y. Calahorra, S. Kar -Narayan, S. Best and R. Cameron, Self-assembly of collagen bundles and enhanced piezoelectricity induced by chemical crosslinking // Nanoscale - 2019. - T. 11, №32. - C. 15120-15130).
Сущность способа поясняется примерами.
Пример 1
Ксеноперикард отмывали от крови в фосфатно-солевом буфере с добавлением 0,01М цитрата натрия, затем выполняли 5 последовательных циклов заморозки ксеноперикарда с его последующей разморозкой в термостате при температуре 37°С до полного размораживания осуществляли при температуре -80°С в морозильной камере, при этом время экспозиции каждого цикла составляло 1 час, после чего ксеноперикард промывали деионизированной водой и помещали в децеллюляризовочный раствор 1% додецилсульфата натрия и 0,5% дезоксихолата натрия, растворенными в Трис буффере (10 мМ, рН 7,6) и 0,01 М этилендиаминтетрауксусной кислоты на 48 часов в условиях постоянного перемешивания при температуре 4°С. После этого ксеноперикард промывали дистилированной водой в течение 12 часов при 4°С, 3 раза меняя раствор, и, дополнительно, его промывали фосфатно-солевым буфером в течение 72 часов с восьмикратной сменой раствора. Затем осуществляли его обработку сшивающим раствором содержащим 0,01 М 1-Этил-3-(3-диметиламинопропил)карбодиимид, 0,004 М N-гидроксисукцинимид и 0,05 М MES буфер при 4°С, в условиях постоянного перемешивания на протяжении 2 часов, после чего ксеноперикард промывали в растворе 0,1 М гидрофосфата натрия (Na2HPO4) в течение 1 часа, затем три раза в деионизованной воде в течение 30 минут.
Пример 2
Ксеноперикард отмывали от крови в фосфатно-солевом буфере с добавлением 0,05 М цитрата натрия, затем выполняли 5 последовательных циклов заморозки ксеноперикарда с его последующей разморозкой в термостате при температуре 37°С до полного размораживания осуществляли при температуре -80°С в морозильной камере, при этом время экспозиции каждого цикла составляло 3 часа, промывали деионизированной водой и помещали в децеллюляризовочный раствор 1% додецилсульфата натрия и 0,5% дезоксихолата натрия, растворенными в Трис буффере (10 мМ, рН 7,6) и 0,05 М этилендиаминтетрауксусной кислоты на 48 часов в условиях постоянного перемешивания при температуре 12°С. После этого ксеноперикард промывали дистилированной водой в течение 12 часов при 4°С, 3 раза меняя раствор, и, дополнительно, его промывали фосфатно-солевым буфером в течение 72 часов с восьмикратной сменой раствора. Затем осуществляли обработка сшивающим раствором содержащим 0,025 М 1-Этил-3-(3-диметиламинопропил)карбодиимид,0,01М N-гидроксисукцинимид и 0,05 М MES буфер при 15°С, в условиях постоянного перемешивания на протяжении 12 часов, после чего ксеноперикард промывали в растворе 0,1 М гидрофосфата натрия (Na2HPO4) в течение 1,5 часов, затем три раза в деионизованной воде в течение 70 минут.
Пример 3
Ксеноперикард отмывали от крови в фосфатно-солевом буфере с добавлением 0,1М цитрата натрия, затем выполняли 5 последовательных циклов заморозки ксеноперикарда с его последующей разморозкой в термостате при температуре 37°С до полного размораживания осуществляли при температуре -80°С в морозильной камере, при этом время экспозиции каждого цикла составляло 5 часов, промывали деионизированной водой и помещали в децеллюляризовочный раствор 1% додецилсульфата натрия и 0,5% дезоксихолата натрия, растворенными в Трис буффере (10 мМ, рН 7,6) и 0,1М этилендиаминтетрауксусной кислоты на 48 часов в условиях постоянного перемешивания при температуре 12°С. После этого ксеноперикард промывали дистилированной водой в течение 12 часов при 4°С, 3 раза меняя раствор, и, дополнительно, его промывали фосфатно-солевым буфером в течение 72 часов с восьмикратной сменой раствора. Затем осуществляли обработку сшивающим раствором, содержащим 0,05 М 1-Этил-3-(3-диметиламинопропил)карбодиимид, 0,02 М N-гидроксисукцинимид и 0,05 М MES буфер при 25°С, в условиях постоянного перемешивания на протяжении 24 часов, после чего ксеноперикард промывали в растворе 0,1 М гидрофосфата натрия (Na2HPO4) в течение 2 часов, затем три раза в деионизованной воде в течение 120 минут.
Образцы ксеноперикарда, обработанные по методике, описанной в прототипе, а также образцы, обработанные по методике, описанной в 1, 2 и 3 примерах подвергались изучению на механическую прочность.
Испытание не изгиб. Суть метода заключается в определении угла отклонения от горизонтали свободного края образца биоткани. Образцы представляли собой полоски кеноперикарда длиной 5 см и шириной 2 см. При испытании их укладывали на стальную пластину шириной 2 см таким образом, чтобы один край располагался на пластине, а другой - свободный край свисал с нее, изгибаясь при этом под действием силы тяжести. Длина свободного края составляла 2 см. Для каждого образца измеряли угол отклонения образца от горизонтали.
Результаты испытаний ксеноперикарда на изгиб консольным методом, по методике прототипа, а также полученных образцов по предлагаемому способу (примеры 1, пример 2, пример 3) отражены в таблице 1.

По результатам испытания установлено, что ксеноперикард, обработанный по методике, указанной в примере №1, примере №2 и примере №3, имеет большую жесткость на изгиб по сравнению с прототипом, что облегчает работу с таким материалом при его использовании в кардиохирургии. Такой материал хорошо удерживает форму, что облегчает процесс наложения швов при формировании анастомозов с его участием.
Испытания деформационно-прочностных свойств ксеноперикарда, экспериментально установленных в режиме одноосного растяжения были проведены на разрывной установке Instron 1122. Результаты представлены в таблице 2.
К основным показателям деформационно-прочностных свойств были отнесены αmax (МПа) - разрывное напряжение, εmax (%) - разрывное удлинение и начальный модуль жесткости Енач (МПа).
Расчет проводился по следующим формулам:
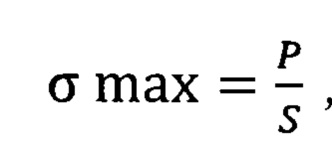 где Р - разрывная нагрузка, выраженная в Ньютонах, S - площадь поперечного сечения образца, полученная умножением ширины на толщину, выраженное в м2,
где Р - разрывная нагрузка, выраженная в Ньютонах, S - площадь поперечного сечения образца, полученная умножением ширины на толщину, выраженное в м2,
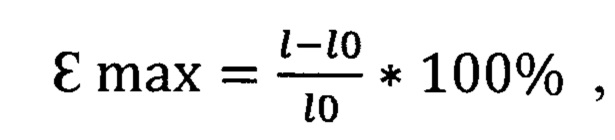 где 1 -длина образца после растяжения, а l0 - исходная длина образца, мм,
где 1 -длина образца после растяжения, а l0 - исходная длина образца, мм,
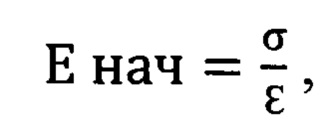 где σ - напряжение в МПа, а ε - деформация образца в точке,
где σ - напряжение в МПа, а ε - деформация образца в точке,
соответствующей концу первого прямолинейного участка диаграммы растяжения.

По результатам испытаний установлено, что ксеноперикард, полученный в результате обработки по методике, указанной в примере №1, примере №2 и примере №3 имеет большую прочность, чем ксеноперикард, полученный в результате обработки по прототипной технологии.
Таким образом, изобретение в представленной совокупности признаков очевидным образом обеспечивает достижение заявленного технического результата и позволяет создать ксеноперикард, который обладает повышенной прочностью и, как следствие, долговечностью по сравнению с описанными в литературе известными методами, что снижает риск повторных операций. Биологические протезы из ксеноперикарда, обработанного по предлагаемому способу, могут найти широкое применение в кардиохирургических клиниках Российской Федерации.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ децеллюризации легкого для получения внеклеточного матрикса | 2019 |
|
RU2713803C1 |
| Способ получения биоинженерного трансплантата для пластики дефекта передней брюшной стенки | 2022 |
|
RU2792542C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕЛЛЮЛЯРНОГО ДЕРМАЛЬНОГО МАТРИКСА | 2019 |
|
RU2717088C1 |
| СПОСОБ УСКОРЕННОЙ ДЕЦЕЛЛЮЛЯРИЗАЦИИ БИОЛОГИЧЕСКОЙ ТКАНИ ИЛИ ОРГАНА | 2019 |
|
RU2714327C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ БИОИНЖЕНЕРНОГО КАРКАСА СЕРДЦА В ЭКСПЕРИМЕНТЕ НА КРЫСЕ | 2014 |
|
RU2550286C1 |
| СПОСОБ ДЕЦЕЛЛЮЛЯРИЗАЦИИ КРОВЕНОСНЫХ СОСУДОВ МАЛОГО КАЛИБРА | 2012 |
|
RU2504334C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРИСТЫХ МАТЕРИАЛОВ НА ОСНОВЕ ХИТОЗАНА | 2019 |
|
RU2699562C1 |
| СПОСОБ ДЕЦЕЛЛЮЛЯРИЗАЦИИ ДЕРМЫ СВИНЬИ ДЛЯ РЕКОНСТРУКТИВНОЙ ПЛАСТИЧЕСКОЙ ХИРУРГИИ | 2022 |
|
RU2791987C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕЦЕЛЛЮЛЯРИЗИРОВАННЫХ МАТРИКСОВ ПАРЕНХИМАТОЗНЫХ ОРГАНОВ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2016 |
|
RU2653489C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕРМАЛЬНОГО МАТРИКСА | 2018 |
|
RU2694543C1 |


Изобретение относится к области химии и медицины, а именно к способу обработки ксеноперикарда, включающему отмывку его от крови в фосфатно-солевом буфере, 5 последовательных циклов заморозки ксеноперикарда с последующей разморозкой в термостате при температуре 37°С до полного размораживания, промывку деионизированной водой, обработку ксеноперикарда децеллюляризовочным раствором додецилсульфата натрия, дезоксихолата натрия и этилендиаминтетрауксусной кислоты, растворенных в Трис буфере, с последующей промывкой дистилированной водой и обработкой фосфатно-солевым буфером, а также обработку сшивающим раствором, содержащим 1-Этил-3-(3-диметиламинопропил)карбодиимид, N-гидроксисукцинимид и MES буфер. Технический результат заключается в повышении прочности и увеличении долговечности ксеноперикарда. 2 ил., 2 табл., 3 пр.
Способ обработки ксеноперикарда, включающий отмывку его от крови в фосфатно-солевом буфере, 5 последовательных циклов заморозки ксеноперикарда с последующей разморозкой в термостате при температуре 37°С до полного размораживания, промывку деионизированной водой, обработку ксеноперикарда децеллюляризовочным раствором 1% додецилсульфата натрия и 0,5% дезоксихолата натрия, растворенных в 10 мМ Трис буфере с рН 7,6, на протяжении 48 часов с последующей промывкой дистилированной водой в течение 12 часов при 4°С и обработкой фосфатно-солевым буфером на протяжении 72 часов, отличающийся тем, что дополнительно отмывку ксеноперикарда выполняют 0,01-0,1 М цитратом натрия, 5 последовательных циклов заморозки ксеноперикарда с его последующей разморозкой в термостате при температуре 37°С до полного размораживания осуществляют при температуре -80°С в морозильной камере, при этом время экспозиции каждого цикла составляет от 1 до 5 часов, в децеллюляризовочный раствор додецилсульфата натрия и дезоксихолата натрия, растворенных в Трис буфере, дополнительно добавляют 0,01-0,1 М этилендиаминтетрауксусной кислоты и в полученном растворе выдерживают ксеноперикард на протяжении 48 часов при температуре 4-20°С на шейкере, промывку ксеноперикарда дистилированной водой в течение 12 часов при 4°С выполняют с трехкратной сменой воды, и дополнительно его промывают фосфатно-солевым буфером в течение 72 часов с восьмикратной сменой буфера, затем ксеноперикард обрабатывают сшивающим раствором, содержащим 0,01-0,05 М 1-Этил-3-(3-диметиламинопропил)карбодиимид, 0,004-0,02 М N-гидроксисукцинимид и 0,05 М MES буфер, при 4-25°С на шейкере от 2 до 24 часов, после чего его промывают в растворе 0,1 М гидрофосфата натрия (Na2HPO4) в течение 1-2 часов, затем три раза в деионизованной воде в течение 30-120 минут.
| LI N | |||
| et al | |||
| Efficient decellularization for bovine pericardium with extracellular matrix preservation and good biocompatibility // Interactive cardiovascular and thoracic surgery | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| - Vol | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| - No | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| - P | |||
| Снегоочиститель для городских железных дорог | 1924 |
|
SU768A1 |
| YAO Q | |||
| et al | |||
| Recent development and biomedical applications of decellularized extracellular matrix biomaterials // Materials | |||
Авторы
Даты
2025-03-24—Публикация
2023-12-04—Подача