Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет предварительной патентной заявки США номер 60/606675, поданной 1 сентября 2004, описание которой приведено в данном документе в качестве ссылки в полном объеме.
Область изобретения
Настоящая заявка относится к способам заживления ран с применением антагонистов аденозинового рецептора A2B. Изобретение также относится к способам получения таких соединений и к содержащим их фармацевтическим композициям.
Уровень техники
Аденозин является природным нуклеотидом, который оказывает свое биологическое действие путем взаимодействия с семейством аденозиновых рецепторов, называемых A1, A2A, A2B и A3, которые модулируют важные физиологические процессы. Например, аденозиновые рецепторы A2A модулируют коронарную вазодилятацию, рецепторы A2B вовлечены в активацию тучных клеток, патогенез астмы, вазодилятацию, регуляцию клеточного роста, функционирование желудочно-кишечного тракта и модуляцию нейросекреции (смотри Adenosine A2B Receptors as Therapeutic Targets, Drug Dev Res 45:198; Feoktistov et al., Trends Pharmacol Sci 19:148-153), а аденозиновые рецепторы A3 модулируют процессы клеточной пролиферации.
Аденозиновые рецепторы A2B широко распространены и регулируют большое число биологических функций. Например, аденозин связывается с рецепторами A2B на эндотелиальных клетках, стимулируя, таким образом, ангиогенез. Аденозин также регулирует рост популяции гладкомышечных клеток в кровеносных сосудах. Аденозин стимулирует рецепторы A2B на тучных клетках, модулируя, таким образом, реакцию гиперчувствительности по типу I. Аденозин также стимулирует желудочную секрецию, активируя A2B в желудочно-кишечном тракте.
Как указано выше, связывание с рецепторами A2B стимулирует ангиогенез, активируя рост эндотелиальных клеток. Уже давно существует предположение о том, что если активность рецептора A2B необходима для заживления ран, то его агонисты могут использоваться для заживления ран. Неожиданно было обнаружено, что антагонисты рецептора A2B также могут эффективно применяться для заживления ран.
Таким образом, существует необходимость в способе, улучшающем заживление ран за счет введения соединений, которые являются сильными антагонистами рецептора A2B (то есть соединений, которые ингибируют аденозиновый рецептор A2B), с абсолютной или частичной селективностью в отношении рецептора A2B.
Краткое описание изобретения
В одном из вариантов осуществления настоящее изобретение относится к способу, улучшающему заживление ран за счет введения терапевтически эффективного количества антагониста рецептора A2B. Антагонист рецептора A2B может применяться местно или может вводится непосредственно в рану.
Обрабатываемая рана может быть вызвана механическим, химическим или термическим путем и может иметь вид закрытой травмы, резаной или рваной раны. Рана может быть результатом хирургического вмешательства или может быть связана с заболеванием или нарушением, таким как диабет. В частности, рана может быть диабетической язвой.
В еще одном варианте осуществления настоящее изобретение относится к фармацевтическим композициям, подходящим для местного применения, содержащим терапевтически эффективное количество антагониста рецептора A2B и по меньшей мере один фармацевтически приемлемый носитель. В одном из вариантов осуществления фармацевтическая композиция может быть мазью, лосьоном, кремом, микроэмульсией, гелем, маслом, раствором или тому подобное. В еще одном варианте осуществления фармацевтическая композиция подходит для системной доставки.
Композиция может содержать один или несколько дополнительных активных агентов и/или добавок, таких как солюбилизаторы, агенты, усиливающие проникновение через кожу, замутнители, консерванты (например, антиоксиданты), желатинирующие средства, буферные вещества, поверхностно-активные вещества, эмульгаторы, смягчающие вещества, загустители, стабилизирующие средства, увлажнители, красители, ароматизирующие вещества и тому подобное.
В некоторых вариантах осуществления настоящего изобретения антагонист рецептора A2B, который вводят, имеет структуру, представленную формулой I или формулой II:
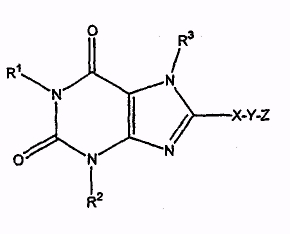
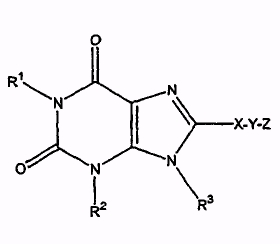
где R1 и R2 независимо выбраны из водорода, необязательно замещенного алкила или группы -D-E, в которой D представляет собой ковалентную связь или алкилен и E представляет собой необязательно замещенный алкокси, необязательно замещенный циклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный гетероциклил, необязательно замещенный алкенил или необязательно замещенный алкинил, при условии, что, если D представляет собой ковалентную связь, то E не может быть алкокси;
R3 представляет собой водород, необязательно замещенный алкил или необязательно замещенный циклоалкил;
X представляет собой необязательно замещенный арилен или необязательно замещенный гетероарилен;
Y представляет собой ковалентную связь или алкилен, в котором один атом углерода может быть необязательно замещен -O-, -S- или -NH- и необязательно замещен гидрокси, алкокси, необязательно замещенным амино или -COR, в котором R представляет собой гидрокси, алкокси или амино; и
Z представляет собой необязательно замещенный моноциклический арил или необязательно замещенный моноциклический гетероарил; или
Z представляет собой водород, если X представляет собой необязательно замещенный гетероарилен, а Y представляет собой ковалентную связь.
Одной из предпочтительных групп соединений формулы I и II является группа соединений, в которых R1 и R2 независимо представляют собой водород, необязательно замещенный низший алкил или группу -D-E, в которой D представляет собой ковалентную связь или алкилен и E представляет собой необязательно замещенный фенил, необязательно замещенный циклоалкил, необязательно замещенный алкенил или необязательно замещенный алкинил, в частности группа соединений, в которых R3 представляет собой водород.
В этой группе первый класс соединений включает соединения, в которых X необязательно представляет собой замещенный фенилен и Y представляет собой ковалентную связь или низший алкилен, в котором один атом углерода может быть необязательно замещен -O-, -S- или -NH-. В одной из подгрупп этой категории R1 и R2 независимо представляют собой низший алкил, необязательно замещенный циклоалкилом, и в еще одной подгруппе R1 и R2 представляют собой н-пропил, Y представляет собой -OCH2- и Z представляет собой необязательно замещенный оксадиазол, в частности необязательно замещенный [1,2,4]-оксадиазол-3-ил, особенно [1,2,4]-оксадиазол-3-ил, замещенный необязательно замещенным фенилом или необязательно замещенным пиридилом.
Второй класс соединений в этой группе включает соединения, в которых X представляет собой необязательно замещенный пиразолен. Из этого класса может быть выделен подкласс, в котором Y представляет собой ковалентную связь, низший алкилен, необязательно замещенный гидрокси, алкокси, необязательно замещенным амино или -COR, в котором R представляет собой гидрокси, алкокси или амино; и Z представляет собой водород, необязательно замещенный фенил, необязательно замещенный оксадиазолил, необязательно замещенный изоксазолил или необязательно замещенный пиридил.
Также может быть выделен особый подкласс, в котором X представляет собой необязательно замещенный 1,4-пиразолен и Z представляет собой необязательно замещенный фенил. В некоторых вариантах осуществления этого подкласса R1 представляет собой низший алкил, необязательно замещенный циклоалкилом, R2 представляет собой водород и Y представляет собой -CH2- или -CH(CH3). В другом варианте осуществления этого подкласса R1 и R2 независимо представляют собой метил, этил, н-пропил или циклопропилметил и Y представляет собой метилен или этилен, который может быть необязательно замещен гидрокси, алкокси, необязательно замещенным амино или -COR, в котором R представляет собой гидрокси, алкокси или амино.
Может быть выделен еще один особый класс, в котором Z представляет собой необязательно замещенный оксадиазол, Y представляет собой -CH2- или -CH(CH3)- и R1 представляет собой низший алкил, необязательно замещенный циклоалкилом, и R2 представляет собой H, или R1 и R2 независимо представляют собой низший алкил, необязательно замещенный циклоалкилом. Может быть выделен еще один особый подкласс, в котором R1 и R2 независимо представляют собой низший алкил, необязательно замещенный циклоалкилом, и Y представляет собой -CH2-, -CH(CH3)- или ковалентную связь, и Z представляет собой водород, необязательно замещенный изоксазолил или пиридил.
В настоящее время предпочтительные соединения для применения по настоящему изобретению включают, но ими не ограничиваются:
1-пропил-8-(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1-пропил-8-[1-бензилпиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
1-бутил-8-(1-{[3-фторфенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1-пропил-8-[1-(фенилэтил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
8-(1-{[5-(4-хлорфенил)(1,2,4-оксадиазол-3-ил)]метил}пиразол-4-ил)-1-пропил-1,3,7-тригидропурин-2,6-дион;
8-(1-{[5-(4-хлорфенил)(1,2,4-оксадиазол-3-ил)]метил}пиразол-4-ил)-1-бутил-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-пиразол-4-ил-1,3,7-тригидропурин-2,6-дион;
1-метил-3-втор-бутил-8-пиразол-4-ил-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-метил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1,3-диметил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
3-метил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-этил-3-метил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-{1-[(2-метоксифенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-(1-{[3-(трифторметил)фенил]этил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-{1-[(4-карбоксифенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
2-[4-(2,6-диоксо-1,3-дипропил(1,3,7-тригидропурин-8-ил))пиразолил]-2-фенилуксусную кислоту;
8-{4-[5-(2-метоксифенил)-[1,2,4]оксадиазол-3-илметокси]фенил}-1,3-дипропил-1,3,7-тригидропурин-2,6-дион;
8-{4-[5-(3-метоксифенил)-[1,2,4]оксадиазол-3-илметокси]фенил}-1,3-дипропил-1,3,7-тригидропурин-2,6-дион;
8-{4-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-илметокси]фенил}-1,3-дипропил-1,3,7-тригидропурин-2,6-дион;
1-(циклопропилметил)-8-[1-(2-пиридилметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
1-н-бутил-8-[1-(6-трифторметилпиридин-3-илметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
8-(1-{[3-(4-хлорфенил)(1,2,4-оксадиазол-5-ил)]метил}пиразол-4-ил)-1,3-дипропил-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-[1-({5-[4-(трифторметил)фенил]изоксазол-3-ил}метил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-[1-(2-пиридилметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
3-{[4-(2,6-диоксо-1,3-дипропил-1,3,7-тригидропурин-8-ил)пиразолил]метил}бензойную кислоту;
1,3-дипропил-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-{1-[(3-(1H-1,2,3,4-тетразол-5-ил)фенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
6-{[4-(2,6-диоксо-1,3-дипропил-1,3,7-тригидропурин-8-ил)пиразолил]метил}пиридин-2-карбоновую кислоту;
3-этил-1-пропил-8-[1-(2-пиридилметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
8-(1-{[5-(4-хлорфенил)изоксазол-3-ил]метил}пиразол-4-ил)-3-этил-1-пропил-1,3,7-тригидропурин-2,6-дион;
8-(1-{[3-(4-хлорфенил)(1,2,4-оксадиазол-5-ил)]метил}пиразол-4-ил)-3-этил-1-пропил-1,3,7-тригидропурин-2,6-дион;
3-этил-1-пропил-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1-(циклопропилметил)-3-этил-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион и
3-этил-1-(2-метилпропил)-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион.
Краткое описание фигур
На фигуре 1 графически отображены результаты применения антагониста аденозинового рецептора A2B на сплошную грануляционную ткань, как описано в примере 22.
Подробное описание изобретения
Определения и основные параметры
Как использовано в настоящем описании, предполагается, что следующие слова и фразы в основном имеют значения, указанные далее, за исключением случаев, когда контекст, в котором их используют, не оговорен особым образом.
Термин "алкил" относится к монорадикальной разветвленной или неразветвленной насыщенной углеводородной цепи, содержащей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 атомов углерода. Этот термин проиллюстрирован группами, такими как метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, трет-бутил, н-гексил, н-децил, тетрадецил и тому подобное.
Термин "замещенный алкил" относится к:
1) алкильной группе, как указано выше, содержащей 1, 2, 3, 4 или 5 заместителей, предпочтительно от 1 до 3 заместителей, выбранных из группы, состоящей из алкенила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, амино, аминокарбонила, алкоксикарбониламино, азидо, циано, галогена, гидрокси, кето, тиокарбонила, карбокси, карбоксиалкила, арилтио, гетероарилтио, гетероциклилтио, тиола, алкилтио, арила, арилокси, гетероарила, аминосульфонила, аминокарбониламино, гетероарилокси, гетероциклила, гетероциклоокси, гидроксиамино, алкоксиамино, нитро, -SO-алкила, -SO-арила, -SO-гетероарила, -SO2-алкила, SO2-арила и -SO2-гетероарила. Если не указано иного, все заместители необязательно могут быть, в свою очередь, замещены 1, 2 или 3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2; или
2) алкильной группе, как указано выше, которая прервана 1-10 атомами, независимо выбранными из кислорода, серы и NRa-, где Ra выбран из водорода, алкила, циклоалкила, алкенила, циклоалкенила, алкинила, арила, гетероарила и гетероциклила. Все заместители могут быть необязательно, в свою очередь, замещены алкилом, алкокси, галогеном, CF3, амино, замещенным амино, циано, или -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2; или
3) алкильной группе, как указано выше, которая одновременно содержит 1, 2, 3, 4 или 5 заместителей, как указано выше, и прервана 1-10 атомами, как указано выше.
Термин "низший алкил" относится к монорадикальной разветвленной или неразветвленной насыщенной углеводородной цепи, содержащей 1, 2, 3, 4, 5 или 6 атомов углерода. Этот термин проиллюстрирован группами, такими как метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, трет-бутил, н-гексил и тому подобное.
Термин "замещенный низший алкил" относится к низшему алкилу, как указано выше, содержащему от 1 до 5 заместителей, предпочтительно 1, 2 или 3 заместителя, как указано для замещенного алкила или низшей алкильной группе, как указано выше, которая прервана 1, 2, 3, 4 или 5 атомами, как указано для замещенного алкила, или низшей алкильной группе, как указано выше, которая одновременно содержит 1, 2, 3, 4 или 5 заместителей, как указано выше, и прервана 1, 2, 3, 4 или 5 атомами, как указано выше.
Термин "алкилен" относится к дирадикальной разветвленной или неразветвленной насыщенной углеводородной цепи, содержащей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 атомов углерода, предпочтительно 1-10 атомов углерода, более предпочтительно 1, 2, 3, 4, 5 или 6 атомов углерода. Этот термин проиллюстрирован группами, такими как метилен (-CH2-), этилен (-CH2CH2-), изомеры пропилена (например, -CH2CH2CH2- и -CH(CH3)CH2-) и тому подобное.
Термин "низший алкилен" относится к дирадикальной разветвленной или неразветвленной насыщенной углеводородной цепи, содержащей 1, 2, 3, 4, 5 или 6 атомов углерода.
Термин "замещенный алкилен" относится к:
(1) алкиленильной группе, как указано выше, содержащей 1, 2, 3, 4 или 5 заместителей, выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, амино, аминокарбонила, алкоксикарбониламино, азидо, циано, галогена, гидрокси, кето, тиокарбонила, карбокси, карбоксиалкила, арилтио, гетероарилтио, гетероциклилтио, тиола, алкилтио, арила, арилокси, гетероарила, аминосульфонила, аминокарбониламино, гетероарилокси, гетероциклила, гетероциклоокси, гидроксиамино, алкоксиамино, нитро, -SO-алкила, -SO-арила, -SO-гетероарила, -SO2-алкила, SO2-арила и -SO2-гетероарила. Если не указано иного, все заместители необязательно могут быть, в свою очередь, замещены 1, 2 или 3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2; или
(2) алкиленильной группе, как указано выше, которая прервана 1-20 атомами, независимо выбранными из кислорода, серы и NRa-, где Ra выбран из водорода, необязательно замещенного алкила, циклоалкила, циклоалкенила, арила, гетероарила и гетероциклила, или группы, выбранной из карбонила, карбоксиэфира, карбоксиамида и сульфонила; или
(3) алкиленильной группе, как указано выше, которая одновременно содержит 1, 2, 3, 4 или 5 заместителей, как указано выше, и прервана 1-20 атомами, как указано выше. Примерами замещенных алкиленов являются хлорметилен (-CH(Cl)-), аминоэтилен (-CH(NH2)CH2-), метиламиноэтилен (-CH(NHMe)CH2-), изомеры 2-карбоксипропилен (-CH2CH(CO2H)CH2-), этоксиэтил (-CH2CH2O-CH2CH2-), этилметиламиноэтил (-CH2CH2N(CH3)CH2CH2-); 1-этокси-2-(2-этокси-этокси)этан (-CH2CH2O-CH2CH2-OCH2CH2-OCH2CH2-) и тому подобное.
Термин "аралкил" относится к арильной группе, ковалентно связанной с алкиленовой группой, где арил и алкилен являются такими, как указано в данном документе. "Необязательно замещенный аралкил" относится к необязательно замещенной арильной группе, ковалентно связанной с необязательно замещенной алкиленовой группой. Примерами таких аралкильных групп являются бензил, фенилэтил, 3-(4-метоксифенил)пропил и тому подобное.
Термин "алкокси" относится к группе R-O-, где R представляет собой необязательно замещенный алкил или необязательно замещенный циклоалкил, или R представляет собой группу -Y-Z, в которой Y необязательно представляет собой замещенный алкилен и Z представляет собой необязательно замещенный алкенил, необязательно замещенный алкинил; или необязательно замещенный циклоалкенил, где алкил, алкенил, алкинил, циклоалкил и циклоалкенил такие, как определено в данном документе. Предпочтительные алкокси группы представляют собой необязательно замещенный алкил-O- и включают в качестве примера метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси, 1,2-диметилбутокси, трифторметокси и тому подобное.
Термин "алкилтио" относится к группе R-S-, где R такой, как определено для алкокси.
Термин "алкенил" относится к монорадикальной разветвленной или неразветвленной ненасыщенной углеводородной группе, предпочтительно содержащей от 2 до 20 атомов углерода, более предпочтительно от 2 до 10 атомов углерода, и еще более предпочтительно от 2 до 6 атомов углерода, и содержащей 1-6, предпочтительно 1, двойных связей (винил). Предпочтительные алкенильный группы включают этенил или винил (-CH=CH2), 1-пропилен или аллил (-CH2CH=CH2), изопропилен (-C(CH3)=CH2), бицикло[2.2.1]гептен и тому подобное. В том случае, когда алкенил присоединен к азоту, двойная связь не может находиться в положении альфа относительно азота.
Термин "низший алкенил" относится к алкенилу, как определено выше, содержащему от 2 до 6 атомов углерода.
Термин "замещенный алкенил" относится к алкенильной группе, как определено выше, содержащей 1, 2, 3, 4 или 5 заместителей и предпочтительно 1, 2 или 3 заместителя, выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, амино, аминокарбонила, алкоксикарбониламино, азидо, циано, галогена, гидрокси, кето, тиокарбонила, карбокси, карбоксиалкила, арилтио, гетероарилтио, гетероциклилтио, тиола, алкилтио, арила, арилокси, гетероарила, аминосульфонила, аминокарбониламино, гетероарилокси, гетероциклила, гетероциклоокси, гидроксиамино, алкоксиамино, нитро, -SO-алкила, -SO-арил-SO-гетероарила, -SO2-алкила, SO2-арила и -SO2-гетероарила. Если не указано иного, все заместители, необязательно, могут быть, в свою очередь, замещены 1, 2 или 3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "алкинил" относится к монорадикальной ненасыщенной углеводородной группе, предпочтительно содержащей от 2 до 20 атомов углерода, более предпочтительно от 2 до 10 атомов углерода, и еще более предпочтительно от 2 до 6 атомов углерода, и содержащей по меньшей мере 1 и предпочтительно 1-6 участков ацетиленовой (тройная связь) ненасыщенности. Предпочтительные алкинильные группы включают этинил (-C≡CH), пропаргил (или проп-1-ин-3-ил, -CH2C≡CH) и тому подобное. В том случае, когда алкинил присоединен к азоту, тройная связь не может находиться в положении альфа относительно азота.
Термин "замещенный алкинил" относится к алкинильной группе, как указано выше, содержащей 1, 2, 3, 4 или 5 заместителей, предпочтительно 1, 2 или 3 заместителей, выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, амино, аминокарбонила, алкоксикарбониламино, азидо, циано, галогена, гидрокси, кето, тиокарбонила, карбокси, карбоксиалкила, арилтио, гетероарилтио, гетероциклилтио, тиола, алкилтио, арила, арилокси, гетероарила, аминосульфонила, аминокарбониламино, гетероарилокси, гетероциклила, гетероциклоокси, гидроксиамино, алкоксиамино, нитро, -SO-алкила, -SO-арила, -SO-гетероарила, -SO2-алкила, SO2-арила и -SO2-гетероарила. Если не указано иного, все заместители, необязательно, могут быть, в свою очередь, замещены 1, 2 или 3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "аминокарбонил" относится к группе -C(O)NRR, где каждый R независимо представляет собой водород, алкил, арил, гетероарил, гетероциклил, или где обе группы R соединены с образованием гетероциклической группы (например, морфолино). Если не указано иного, все заместители необязательно могут быть, в свою очередь, замещены 1-3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "ациламино" относится к группе -NRC(O)R, где каждый R независимо представляет собой водород, алкил, арил, гетероарил или гетероциклил. Если не указано иного, все заместители, необязательно, могут быть, в свою очередь, замещены 1-3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "ацилокси" относится к группам -O(O)C-алкил, -O(O)C-циклоалкил, -O(O)C-арил, -O(O)C-гетероарил и -O(O)C-гетероциклил. Если не указано иного, все заместители, необязательно, могут быть, в свою очередь, замещены алкилом, карбокси, карбоксиалкилом, аминокарбонилом, гидрокси, алкокси, галогеном, CF3, амино, замещенным амино, циано или -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "арил" относится к ароматической карбоциклической группе, имеющей от 6 до 20 атомов углерода, содержащей единственное кольцо (например, фенил) или несколько колец (например, бифенил), или несколько конденсированных колец (например, нафтил или антрил). Предпочтительные арилы включают фенил, нафтил и тому подобное.
Термин "арилен" относится к дирадикалу арильной группы, как указано выше. Этот термин проиллюстрирован группами, такими как 1,4-фенилен, 1,3-фенилен, 1,2-фенилен, 1,4'-бифенилен и тому подобное.
Если не указано иного для арильного или ариленового заместителя, такие арильные или ариленовые группы, необязательно, могут быть замещены от 1 до 5 заместителями, предпочтительно от 1 до 3 заместителями, выбранными из группы, состоящей из алкила, алкенила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, амино, аминокарбонила, алкоксикарбониламино, азидо, циано, галогена, гидрокси, кето, тиокарбонила, карбокси, карбоксиалкила, арилтио, гетероарилтио, гетероциклилтио, тиола, алкилтио, арила, арилокси, гетероарила, аминосульфонила, аминокарбониламино, гетероарилокси, гетероциклила, гетероциклоокси, гидроксиамино, алкоксиамино, нитро, -SO-алкила, -SO-арила, -SO-гетероарила, -SO2-алкила, SO2-арила и -SO2-гетероарила. Если не указано иного, все заместители необязательно могут быть, в свою очередь, замещены 1-3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "арилокси" относится к группе арил-O-, где арильная группа такая, как определено выше, и включает необязательно замещенные арильные группы, которые также определены выше. Термин "арилтио" относится к группе R-S-, где R такой, как определено для арила.
Термин "амино" относится к группе -NH2.
Термин "замещенный амино" относится к группе -NRR, где каждый R независимо выбран из группы, состоящей из водорода, алкила, циклоалкила, карбоксиалкила (например, бензилоксикарбонила), арила, гетероарила и гетероциклила, при условии, что обе группы R не являются водородом, или группе -Y-Z, в которой Y представляет собой необязательно замещенный алкилен и Z представляет собой алкенил, циклоалкенил или алкинил. Если не указано иного, все заместители необязательно могут быть, в свою очередь, замещены 1-3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "карбоксиалкил" относится к группам -C(O)O-алкил или -C(O)O-циклоалкил, где алкил и циклоалкил такие, как определено в данном документе, и, необязательно, могут быть, в свою очередь, замещены алкилом, алкенилом, алкинилом, алкокси, галогеном, CF3, амино, замещенным амино, циано или -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "циклоалкил" относится к карбоциклическим группам, состоящим из 3-20 атомов углерода, содержащим единственное циклическое кольцо или несколько конденсированных колец. Такие циклоалкильные группы в качестве примера включают однокольцевые структуры, такие как циклопропил, циклобутил, циклопентил, циклооктил, и тому подобное, или поликольцевые структуры, такие как адамантил, бицикло[2.2.1]гептан, 1,3,3-триметилбицикло[2.2.1]гепт-2-ил, (2,3,3-триметилбицикло[2.2.1]гепт-2-ил), или карбоциклические группы, с которыми конденсирована арильная группа, например индан, и тому подобное.
Термин "замещенный циклоалкил" относится к циклоалкильным группам, содержащим 1, 2, 3, 4 или 5 заместителей, предпочтительно 1, 2 или 3 заместителя, выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, амино, аминокарбонила, алкоксикарбониламино, азидо, циано, галогена, гидрокси, кето, тиокарбонила, карбокси, карбоксиалкила, арилтио, гетероарилтио, гетероциклилтио, тиола, алкилтио, арила, арилокси, гетероарила, аминосульфонила, аминокарбониламино, гетероарилокси, гетероциклила, гетероциклоокси, гидроксиамино, алкоксиамино, нитро, -SO- алкила, -SO-арила, -SO-гетероарила, -SO2-алкила, -SO2-арила и -SO2-гетероарила. Если не указано иного, все заместители, необязательно, могут быть, в свою очередь, замещены 1, 2 или 3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "галоген" относится к фтору, брому, хлору и йоду.
Термин "ацил" обозначает группу -C(O)R, где R представляет собой водород, необязательно замещенный алкил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклил, необязательно замещенный арил и необязательно замещенный гетероарил.
Термин "гетероарил" относится к радикалу, производному ароматической циклической группы (то есть полностью ненасыщенной), содержащей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 атомов углерода и 1, 2, 3 или 4 гетероатома, выбранных из кислорода, азота и серы, по меньшей мере в одном кольце. Такие гетероарильные группы могут иметь единственное кольцо (например, пиридил или фурил) или несколько конденсированных колец (например, индолизинил, бензотиазолил или бензоитиенил). Примеры гетероарилов включают, но ими не ограничиваются, [1,2,4]оксадиазол, [1,3,4]оксадиазол, [1,2,4]тиадиазол, [1,3,4]тиадиазол, пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, индолизин, изоиндол, индол, индазол, пурин, хиназолин, изохинолин, хинолин, фталазин, нафтилпиридин, хиноксалин, хиназолин, циннолин, птеридин, карбазол, карболин, фенантридин, акридин, фенантролин, изотиазол, феназин, изоксазол, феноксазин, фенотиазин, имидазолидин, имидазолин и тому подобное, а также N-оксидные и N-алкокси производные азотсодержащих гетероарильных соединений, например пиридин-N-оксидные производные.
Термин "гетероарилен" относится к дирадикалу гетероарильной группы, определенной выше. Этот термин проиллюстрирован группами, такими как 2,5-имидазолен, 3,5-[1,2,4]оксадиазолен, 2,4-оксазолен, 1,4-пиразолен и тому подобное. Например, 1,4-пиразолен представляет собой:
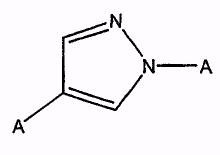
где A представляет собой точку присоединения.
Если только не оговорено иного для гетероарильного или гетероариленового заместителя, такие гетероарильные или гетероариленовые группы могут быть необязательно замещены от 1 до 5 заместителями, предпочтительно от 1 до 3 заместителями, выбранными из группы, состоящей из алкила, алкенила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, амино, аминокарбонила, алкоксикарбониламино, азидо, циано, галогена, гидрокси, кето, тиокарбонила, карбокси, карбоксиалкила, арилтио, гетероарилтио, гетероциклилтио, тиола, алкилтио, арила, арилокси, гетероарила, аминосульфонила, аминокарбониламино, гетероарилокси, гетероциклила, гетероциклоокси, гидроксиамино, алкоксиамино, нитро, -SO-алкила, -SO-арила, -SO-гетероарила, -SO2-алкила, SO2-арила и -SO2-гетероарила. Если не указано иного, все заместители, необязательно, могут быть, в свою очередь, замещены 1-3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "гетероаралкил" относится к гетероарильной группе, ковалентно связанной с алкиленовой группой, где гетероарил и алкилен такие, как определено в данном документе. "Необязательно замещенный гетероаралкил" относится к необязательно замещенной гетероарильной группе, ковалентно связанной с необязательно замещенной алкиленовой группой. Примерами таких гетероаралкильных групп являются 3-пиридилметил, хинолин-8-илэтил, 4-метокситиазол-2-илпропил и тому подобное.
Термин "гетероарилокси" относится к группе гетероарил-O-.
Термин "гетероциклил" относится к монорадикальной насыщенной или частично ненасыщенной группе, содержащей единственное кольцо или несколько конденсированных колец, содержащих от 1 до 40 атомов углерода и от 1 до 10 гетероатомов, предпочтительно 1, 2, 3 или 4 гетероатомов, выбранных из азота, серы, фосфора и/или кислорода, входящих в состав кольца. Гетероциклические группы могут иметь одно кольцо или несколько конденсированных колец и включают тетрагидрофуранил, морфолино, пиперидинил, пиперазино, дигидропиридинo и тому подобное.
Если не указано иного для гетероциклического заместителя, такие гетероциклические группы могут быть необязательно замещены 1, 2, 3, 4 или 5, предпочтительно 1, 2 или 3 заместителями, выбранными из группы, состоящей из алкила, алкенила, алкинила, алкокси, циклоалкила, циклоалкенила, ацила, ациламино, ацилокси, амино, аминокарбонила, алкоксикарбониламино, азидо, циано, галогена, гидрокси, кето, тиокарбонила, карбокси, карбоксиалкила, арилтио, гетероарилтио, гетероциклилтио, тиола, алкилтио, арила, арилокси, гетероарила, аминосульфонила, аминокарбониламино, гетероарилокси, гетероциклила, гетероциклоокси, гидроксиамино, алкоксиамино, нитро, -SO-алкила, -SO-арила, -SO-гетероарила, -SO2-алкила, SO2-арила и -SO2-гетероарила. Если не указано иного, все заместители, необязательно, могут быть, в свою очередь, замещены 1-3 заместителями, выбранными из алкила, карбокси, карбоксиалкила, аминокарбонила, гидрокси, алкокси, галогена, CF3, амино, замещенного амино, циано и -S(O)nR, где R представляет собой алкил, арил или гетероарил и n равно 0, 1 или 2.
Термин "тиол" относится к группе -SH.
Термин "замещенный алкилтио" относится к группе -S-замещенный алкил.
Термин "гетероарилтиол" относится к группе -S-гетероарил, где гетероарильная группа такая, как определено выше, включая необязательно замещенные гетероарильные группы, также определенные выше.
Термин "сульфоксид" относится к группе -S(O)R, в которой R представляет собой алкил, арил или гетероарил. "Замещенный сульфоксид" относится к группе -S(O)R, в которой R представляет собой замещенный алкил, замещенный арил или замещенный гетероарил, как определено в данном документе.
Термин "сульфон" относится к группе -S(O)2R, в которой R представляет собой алкил, арил или гетероарил. "Замещенный сульфон" относится к группе -S(O)2R, в которой R представляет собой замещенный алкил, замещенный арил или замещенный гетероарил, как определено в данном документе.
Термин "кето" относится к группе -C(O)-.
Термин "тиокарбонил" относится к группе -C(S)-.
Термин "карбокси" относится к группе -C(O)-OH.
"Необязательный" или "необязательно" означает, что описанные далее факт или случай могут иметь место или могут не иметь места, и что описание включает варианты, когда указанные факт или случай встречаются, и варианты, когда указанные действие или факт не встречаются.
Термин "соединение формулы I и формулы II" охватывает соединения по изобретению, описанные в данном документе, и фармацевтически приемлемые соли, фармацевтически приемлемые сложные эфиры, пролекарства, гидраты и полиморфы таких соединений. Кроме того, соединения по изобретению могут обладать одним или несколькими центрами асимметрии и могут быть получены в виде рацемической смеси или в виде отдельных энантиомеров или диастереоизомеров. Число стереоизомеров, присущих какому-либо данному соединению формулы I, зависит от числа имеющихся центров асимметрии (возможны 2n стереоизомеров, где n равно числу центров асимметрии). Отдельные стереоизомеры могут быть получены путем разделения рацемической или не-рацемической смеси промежуточного продукта на некой подходящей стадии синтеза или путем разделения соединения формулы I общеизвестными методами. Отдельные стереоизомеры (включая отдельные энантиомеры и диастереоизомеры), а также рацемические или нерацемические смеси стереоизомеров входят в объем настоящего изобретения, и все они представлены структурами данного описания, если конкретно не указано иного.
"Изомеры" представляют собой разные соединения, которые обладают одной и той же молекулярной формулой.
"Стереоизомеры" представляют собой изомеры, которые отличаются только пространственным расположением атомов.
"Энантиомеры" представляют собой пару стереоизомеров, которые представляют собой неналагающиеся зеркальные изображения друг друга. Смесь 1:1 пары энантиомеров представляет собой "рацемическую" смесь. Термин "(±)" используют для обозначения рацемической смеси, где это требуется.
"Диастереоизомеры" представляют собой стереоизомеры, которые имеют по меньшей мере два асимметрических атома, но которые не являются зеркальным отражением друг друга.
Абсолютная стереохимия выражается в соответствии с R-S системой Кана-Ингольда-Прелога (Cahn-Ingold-Prelog). Когда соединение представляет собой чистый энантиомер, то стереохимия каждого хирального атома углерода может быть указана как R или S. Разделенные соединения, абсолютная конфигурация которых неизвестна, обозначаются (+) или (-), в зависимости от направления (право- или левовращающий), в котором они вращают плоскость поляризации света при длине волны натрия D.
Термин "местное применение" определено как нанесение терапевтического средства на поверхность раны и прилегающего эпителия.
Термин "парентеральное введение" обозначает системную доставку терапевтического средства пациенту путем инъекции.
Термин "терапевтически эффективное количество" относится к такому количеству соединения формулы I, которое является достаточным для эффективного лечения, как определено ниже, при введении млекопитающему, при необходимости такого лечения. Терапевтически эффективное количество будет изменяться в зависимости от конкретной активности используемого лекарственного средства, типа ранения (механического или термического, частичного или полного проникновения и так далее), размера раны, глубины раны (если затронуты все слои), наличия или отсутствия инфекции, времени, прошедшего с момента получения травмы, а также возраста, физического состояния, наличия других заболеваний и состояния алиментарного статуса пациента. Кроме того, другие лекарственные средства, принимаемые пациентом, могут оказывать влияние на определение терапевтически эффективного количества лекарственного средства для введения.
Термин "лечение" обозначает любое лечение заболевания млекопитающего, включая:
(i) профилактику заболевания, то есть профилактику возникновения клинических симптомов заболевания;
(ii) предотвращение развития заболевания, то есть предотвращение развития клинических симптомов заболевания; и/или
(iii) ослабление заболевания, то есть регрессию клинических симптомов заболевания.
Во многих случаях соединения по настоящему изобретению могут образовывать соли с кислотами и/или основаниями благодаря наличию амино и/или карбоксильных групп или групп, подобных им. Термин "фармацевтически приемлемая соль" относится к соли, которая сохраняет биологическую эффективность и свойства соединений формулы I и которая не является биологически или каким-либо иным образом нежелательной. Фармацевтически приемлемые соли добавления оснований могут быть получены из неорганических и органических оснований. В качестве примеров соли, производные неорганических оснований, включают соли натрия, калия, лития, аммония, кальция и магния. Соли, производные органических оснований, включают, но ими не ограничиваются, соли первичных, вторичных и третичных аминов, таких как алкиламинов, диалкиламинов, триалкиламинов, замещенных алкиламинов, ди(замещенных алкил)аминов, три(замещенных алкил)аминов, алкениламинов, диалкениламинов, триалкениламинов, замещенных алкениламины, ди(замещенных алкенил)аминов, три(замещенных алкенил)аминов, циклоалкиламинов, ди(циклоалкил)аминов, три(циклоалкил)аминов, замещенных циклоалкиламинов, дизамещенных циклоалкиламин, тризамещенных циклоалкиламинов, циклоалкениламинов, ди(циклоалкенил)аминов, три(циклоалкенил)аминов, замещенных циклоалкениламинов, дизамещенных циклоалкениламин, тризамещенных циклоалкениламинов, ариламинов, диариламинов, триариламинов, гетероариламинов, дигетероариламинов, тригетероариламинов, гетероциклических аминов, дигетероциклических аминов, тригетероциклических аминов, смешанных ди- и три-аминов, где по меньшей мере два заместителя на амине являются различными и выбраны из группы, состоящей из алкила, замещенного алкила, алкенила, замещенного алкенила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, арила, гетероарила, гетероциклила и тому подобное. Также включены амины, в котором два или три заместителя, вместе с азотом амина, образуют гетероциклическую или гетероарильную группу.
Конкретные примеры подходящих аминов включают, только в качестве примера, изопропиламин, триметиламин, диэтиламин, три(изо-пропил)амин, три(н-пропил)амин, этаноламин, 2-диметиламиноэтанол, трометамин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, N-алкилглюкамины, теобромин, пурины, пиперазин, пиперидин, морфолин, N-этилпиперидин и тому подобное.
Фармацевтически приемлемые соли добавления кислот могут быть получены из неорганических и органических кислот. Соли, производные неорганических кислот, включают соли хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, азотной кислоты, фосфорной кислоты и тому подобное. Соли, производные органических кислот, включают соли уксусной кислоты, пропионовой кислоты, гликолевой кислоты, пировиноградной кислоты, щавелевой кислоты, яблочной кислоты, малоновой кислоты, янтарной кислоты, малеиновой кислоты, фумаровой кислоты, винной кислоты, лимонной кислоты, бензойной кислоты, коричной кислоты, миндальной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, п-толуолсульфоновой кислоты, салициловой кислоты и тому подобное.
Как используется в данном документе, "фармацевтически приемлемый носитель" включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, агенты, придающие изотоничность, и агенты, пролонгирующие абсорбцию, агенты и тому подобное. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области. Предполагается использование обычно применяемых сред или агентов, за исключением тех случаев, когда они являются несовместимыми с активным ингредиентом. В композиции также могут быть включены дополнительные активные ингредиенты.
Номенклатура
Название и нумерация соединений по изобретению проиллюстрированы характерным соединением формулы I, где R представляет собой н-пропил, R представляет собой н-пропил, R3 представляет собой водород, X представляет собой фенилен, Y представляет собой -O-(CH2) и Z представляет собой 5-(2-метоксифенил)-[1,2,4]-оксадиазол-3-ил,
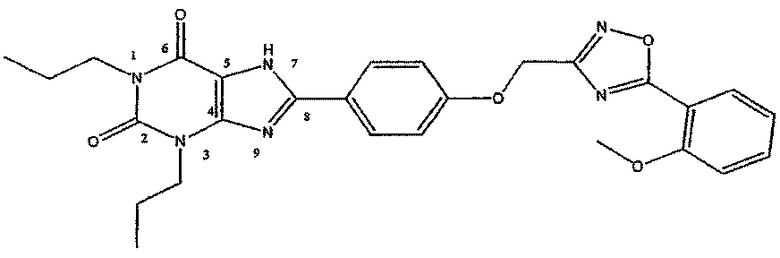
которое называется:
8-{4-[5-(2-метоксифенил)-[1,2,4]-оксадиазол-3-илметокси]фенил}-1,3-дипропил-1,3,7-тригидропурин-2,6-дион.
Способ по изобретению
Настоящее изобретение относится к способам ускорения заживления ран путем введения терапевтически эффективного количества соответствующего антагониста аденозинового рецептора A2B. Обрабатываемая рана может быть получена механическим, химическим или термическим способом. Рана может представлять собой закрытую травму, рассечение или разрыв. Также рана может быть получена в результате хирургического рассечения. Альтернативно, рана может быть связана с заболеванием или расстройством, таким как диабет, где рана может принимать форму диабетической язвы.
Антагонист аденозинового рецептора A2B может применяться местно или системно, но обычно он наносится местно на участок раны. Такое местное применение может быть в виде однократной дозы или повторяющихся доз с определенными интервалами. Специалисты в данной области высоко оценят тот факт, что предпочтительный режим нанесения будет изменяться в зависимости от типа и тяжести обрабатываемой раны.
При системном введении терапевтически эффективное количество антагониста аденозинового рецептора A2B доставляется парентеральным способом, то есть подкожной, внутривенной, внутримышечной или внутрибрюшинной инъекцией. Лечение раны путем парентеральной инъекции может включать или однократное, множественное, или непрерывное введение терапевтического агента, в зависимости от различных факторов, включая тип травмы, тяжесть и локализацию.
Фармацевтические композиции
В предпочтительном варианте осуществления изобретения антагонист аденозинового рецептора A2B находится в составе в фармацевтической композиции, содержащей фармацевтически приемлемый носитель, который подходит для местного применения лекарственного препарата, и содержащей любое такое вещество, известное в данной области. Подходящие носители, хорошо известные специалистам в данной области, и выбор носителя будут зависеть от формы предполагаемой фармацевтической композиции, например, такой как мазь, лосьон, крем, пена, микроэмульсия, гель, масло, раствор, спрей, бальзам или тому подобное, и могут содержать либо природные, либо синтетические вещества. Понятно, что выбранные вещества не должны оказывать негативный эффект на антагонист аденозинового рецептора A2B или другие компоненты фармацевтической композиции.
Подходящие носители для таких типов композиций включают, но ими не ограничиваются, наполнители, включая крем Shephard™, Aquaphor™ и лосьон Cetaphil™. Другие предпочтительные носители включают мазевые основы, например полиэтиленгликоль-1000 (ПЭГ-1000), обычные кремы, такие как крем HEB, гели, а также вазелиновое масло и тому подобное. Примеры подходящих носителей для использования в данном случае включают воду, спирты и другие нетоксичные органические растворители, глицерин, минеральное масло, силикон, вазелиновое масло, ланолин, жирные кислоты, растительные масла, парабены, воска и тому подобное. Особенно предпочтительными композициями в данном случае являются бесцветные и без запаха мази, лосьоны, кремы, микроэмульсии и гели.
Мази представляют собой полутвердые препараты, которые обычно основаны на вазелине или других производных вазелина. Конкретная используемая основа мази, что хорошо известна специалистам в данной области, представляет собой основу, которая будет обеспечивать оптимальную доставку лекарственного препарата, а также предпочтительно будет обеспечивать другие желаемые характеристики, например смягчение или тому подобное. В отношении других носителей или наполнителей, основа мази должна быть инертной, стабильной, не вызывающей раздражение и сенсибилизацию. Как указывается в Remington's Parmaceutical Sciences, 20th Ed. (Easton, Pa.: Mack Publishing Company, 2000), мазевые основы могут быть сгруппированы в четыре класса: маслянистые основы; эмульгирующиеся основы; эмульсионные основы и водорастворимые основы. Маслянистые мазевые основы включают, например, растительные масла, жиры животного происхождения и полутвердые углеводороды, полученные из нефти. Эмульгирующиеся мазевые основы, также известные как абсорбирующие мазевые основы, содержат немного воды или вообще не содержат воду и включают, например, гидроксистеарин сульфат, безводный ланолин и гидрофильный вазелин. Эмульсионными мазевыми основами являются либо эмульсии вода-в-масле (В/М), либо эмульсии масло-в-воде (М/В) и включают, например, цетиловый спирт, глицерил моностеарат, ланолин и стеариновую кислоту. Предпочтительные водорастворимые мазевые основы получены из полиэтиленгликолей (ПЭГ), изменяя их молекулярную массу; для дополнительной информации опять дать ссылка на Remington, приведенная выше.
Лосьоны представляют собой препараты для нанесения на кожную поверхность без растирания и являются в основном жидкими или полужидкими препаратами, в которых твердые частицы, включая активное вещество, присутствуют в водной или спиртовой основе. Обычно лосьоны представляют собой суспензии твердых веществ и предпочтительно для цели настоящего изобретения содержат жидкую маслянистую эмульсию по типу “масло-в-воде”. Из-за простоты нанесения более жидкой композиции, для обработки обширных участков поверхности тела, предпочтительными препаратами в данном документе являются лосьоны. Обычно необходимо, чтобы нерастворимое вещество в лосьоне было мелкоизмельченным. Для лучшей дисперсии лосьоны обычно содержат суспендирующие агенты, а также соединения, используемые для локализации и удержания активного вещества в контакте с кожным покровом, например метилцеллюлозу, натрий карбоксиметилцеллюлозу или тому подобным. Особенно предпочтительная композиция лосьона для применения по настоящему изобретению содержит пропиленгликоль, смешанный с гидрофильным вазелином, например, таким, который может быть приобретен у Beiersdorf, Inc. (Norwalk, Conn.) под товарным знаком Aquaphor™.
Крема, содержащие активное вещество, представляют собой, как известно в данной области, вязкую жидкость или полутвердые эмульсии, либо “масло-в-воде”, либо “вода-в-масле”. Основы крема смываются водой и содержат масляную фазу, эмульгатор и водную фазу. Масляная фаза обычно содержит вазелин и жирный спирт, такой как цетиловый или стеариловый спирт; водная фаза обычно, хотя необязательно, превышает масляную фазу в объеме и обычно содержит увлажнитель. Эмульгатор в композиции крема, как указано в Remington's, цитированном выше, обычно представляет собой неионное, анионное, катионное или амфотерное поверхностно-активное вещество.
Микроэмульсии представляют собой термодинамически стабильные изотропно чистые дисперсии двух несмешивающихся жидкостей, таких как масло и вода, стабилизируемых межфазной пленкой молекул поверхностно-активного вещества (Encyclopedia of Pharmaceutical Technology (New York: Marcel Dekker, 1992), volume 9). Для получения микроэмульсий необходимы поверхностно-активное вещество (эмульгатор), вспомогательное поверхностно-активное вещество (вспомогательный эмульгатор), масляная фаза и водная фаза. Подходящие поверхностно-активные вещества включают любые поверхностно-активные вещества, которые используют для получения эмульсий, например эмульгаторы, которые обычно используют для получения кремов. Вспомогательное поверхностно-активное вещество (или "вспомогательный эмульгатор") обычно выбрано из группы производных полиглицерина, производных глицерина и жирных спиртов. Обычно предпочтительные комбинации эмульгатор/вспомогательный эмульгатор, хотя не обязательно, выбраны из группы, состоящей из глицерил моностеарата и полиоксиэтилен стеарата; полиэтиленгликоля и этиленгликоля палмитостеарата и каприловых и каприновых триглицеридов и олеил макроголглицеридов. Водная фаза включает не только воду, но также, обычно, буферные вещества, глюкозу, пропиленгликоль, полиэтиленгликоли, предпочтительно низшие полиэтиленгликоли (например, ПЭГ 300 и ПЭГ 400) и/или глицерин, и тому подобное, тогда как масляная фаза обычно содержит, например, сложные эфиры жирных кислот, модифицированные растительные масла, силиконовые масла, смеси моно-, ди- и триглицеридов, моно- и ди-сложные эфиры ПЭГ (например, олеоил макрогол глицериды) и так далее.
Гелевые композиции представляют собой полутвердые системы, содержащие либо суспензии с небольшими неорганическими частицами (двухфазные системы), либо большие органические молекулы, распределенные в основном однородно по всему объему жидкости-носителя (однофазные гели). Однофазные гели могут быть получены, например, путем объединения активного вещества, жидкости-носителя и подходящего желирующего агента, например трагаканта (при 2-5%), альгитната натрия (при 2-10%), желатина (при 2-15%), метилцеллюлозы (при 3-5%), карбоксиметилцеллюлозы натрия (при 2-5%), карбомера (при 0,3-5%) или поливинилового спирта (при 10-20%), и смешивания до получения характерного полутвердого продукта. Другие подходящие желирующие агенты включают метилгидроксицеллюлозу, полиоксиэтилен-полиоксипропилен, гидроксиэтилцеллюлозу и желатин. Хотя в гелях обычно в качестве жидкого носителя воду, спирты и масла также могут использоваться в качестве жидкого носителя.
В композиции для местного применения по изобретению могут быть включены различные добавки, известные специалистам в данной области. Примеры добавок включают, но ими не ограничиваются, солюбилизаторы, усилители кожного проникновения, замутнители, консерванты (например, антиоксиданты), желирующие агенты, буферные агенты, поверхностно-активные вещества (в частности, неионные и амфотерные поверхностно-активные вещества), эмульгаторы, смягчители, загустители, стабилизаторы, увлажнители, красители, ароматизирующие вещества и тому подобное. Особенно предпочтительно включение солюбилизаторов и/или усилителей кожного проникновения, а также эмульгаторов, смягчителей и консервантов.
Примеры солюбилизаторов включают, но ими не ограничиваются, следующие: гидрофильные простые эфиры, такие как моноэтиловый эфир диэтиленгликоля (этоксидигликоль, коммерчески доступный как Transcutol™) и олеат моноэтилового эфира диэтиленгликоля (коммерчески доступный как Softcutol); полиэтиленовые производные касторового масла, такие как полиокси 35 касторовое масло, полиокси 40 гидрированное касторовое масло и так далее; полиэтиленгликоль, особенно полиэтиленгликоли с низкой молекулярной массой, такие как ПЭГ 300 и ПЭГ 400, и производные полиэтиленгликоля, такие как каприловые/каприновые глицериды ПЭГ-8 (коммерчески доступный как Labrasol™); алкилметилсульфоксиды, такие как ДМСО; пирролидоны, такие как 2-пирролидон и N-метил-2-пирролидон; и DMA. Также, большое количество солюбилизаторов могут действовать в качестве усилителей абсорбции. В препарат может быть включен один солюбилизатор или смесь солюбилизаторов.
Подходящие эмульгаторы и вспомогательные эмульгаторы включают, но ими не ограничиваются, те эмульгаторы и вспомогательные эмульгаторы, которые описаны для микроэмульсионных препаратов. Смягчающие вещества включают, например, пропиленгликоль, глицерин, изопропилмиристат, пропионат миристилового эфира полипропиленгликоля-2 (ППГ-2) и тому подобное.
В препарат также могут быть включены другие активные агенты, например противовоспалительные агенты, анальгетики, противомикробные агенты, противогрибковые агенты, антибиотики, витамины, антиоксиданты и агенты для защиты от солнечных лучей, обычно встречающиеся в солнцезащитных препаратах, включая, но ими не ограничиваясь, антранилаты, бензофеноны (в частности, бензофенон-3), производные камфоры, циннаматы (например, октил метоксиуиннамат), дибензоилметаны (например, бутил метоксидибензоилметан), п-аминобензойную кислоту (PABA) и ее производные, и салицилаты (например, октил салицилат).
В предпочтительных препаратах для местого применения по изобретению присутствует активное вещество в количестве в пределах приблизительно от 0,25 мас.% до 75 мас.% композиции, предпочтительно в пределах приблизительно от 0,25 мас.% до 30 мас.% композиции, более предпочтительно в пределах приблизительно от 0,5 мас.% до 15 мас.% композиции, наиболее предпочтительно в пределах приблизительно от 1,0 мас.% до 10 мас.% композиции.
Также фармацевтическая композиция может быть стерилизована или смешана со вспомогательными агентами, например консервантами, стабилизаторами, увлажнителями, буферами или солями для воздействия на осмотическое давление и тому подобное. Стерильные растворы для инъекции получают путем введения соединения формулы I или формулы II в необходимом количестве в соответствующий растворитель с различными другими компонентами, перечисленными выше, затем, при необходимости, стерилизацией фильтрованием. Обычно, дисперсии получают включением различных стерилизованных активных компонентов в стерильный носитель, который содержит основную дисперсную среду и другие необходимые компоненты, перечисленные выше. В случае стерильных порошков, для получения стерильных растворов для инъекции предпочтительными способами получения являются способы вакуумной сушки и сублимационной сушки, с помощью которых получают порошок из активного компонента, плюс любой дополнительный желаемый компонент из его предварительно стерилизованного фильтрованием раствора.
Антагонисты аденозинового рецептора A 2B
В способе по изобретению может быть использован любой антагонист аденозинового рецептора A2B. В данной области известны многочисленные соединения с активностью антагонистов рецептора A2B, а также способы определения обладает ли конкретное соединение такой активностью. Например, в обзоре статьи Feoktistov и Baggioni (Pharmacological Reviews 49, 381-402 (1997)), описана аффинность связывания восьми агонистов аденозиновых рецепторов и восьми антагонистов всех четырех подтипов аденозиновых рецепторов. В ссылках, приведенных в данном документе, дано подробное описание используемых способов (Robeva A. S., Woodward R. L., Jin X. and Gao Z., Linden J. Drug Dev. Res 39:243-252 (1996); Jacobson K. A. and Suzuki F. Drag Dev. Res. 39, 289-300, (1996); Feoktistov, I. and Baggioni, I. Molecular Pharmacology 43, 909-914 (1993)). В эффективных способах определения аффинности связывания соединения и рецептора используют меченный радиоактивным изотопом агонист или антагонист и корреляцию связывания этого соединения с мембранной фракцией, которая, как известно, содержит этот рецептор; например, для определения того, является ли соединение антагонистом A2B, мембранная фракция должна содержать аденозиновый рецептор A2B. В частности, другой эффективный способ определения того, является ли соединение антагонистом A2B, описан в патенте США № 5854081.
Таким образом, селективные соединения подтипа рецептора A2B являются предпочтительными в настоящих способах. Примером такого соединения является, но им не ограничено, 3-н-пропилксантин (энпрофиллин). Также подходящие соединения описаны в патенте США № 6545002. Соединения, которые вызывают антагонизм других рецепторов, исключая рецептор A2B, также являются подходящими для применения в настоящем изобретении. Одним из примеров такого соединения является 1,3-дипропил-8-(п-акриловый)фенилксантин.
В частности, один из особенно предпочтительных классов антагонистов аденозинового рецептора A2B описан в одновременно рассмотриваемой патентной заявке США с серийным номером 10/290,921, опубликованной как патентная заявка США 20030139428. Соединения, описанные в этой заявке, имеют структуру формулы I и формулы II, представленную выше в кратком изложении изобретения, и могут быть синтезированы способом, описанным в ссылке, или подробно описано ниже.
Параметры реакций синтеза
Термины "растворитель", "инертный органический растворитель" или "инертный растворитель" означают растворитель, инертный в условиях соответствующей описанной реакции [включая, например, бензол, толуол, ацетонитрил, тетрагидрофуран ("ТГФ"), диметилформамид ("ДМФ"), хлороформ, метиленхлорид (или дихлорметан), диэтиловый эфир, метанол, пиридин и тому подобное]. Если не указано иного, растворители, используемые в реакциях по настоящему изобретению, являются инертными органическими растворителями, и реакции проводят в атмосфере инертного газа, предпочтительно азота.
Термин "q.s. (лат.quantum sufficiat)" означает добавление количества, достаточного для достижения поставленной задачи, например для доведения раствора до желаемого объема (т.е. 100%).
Синтез соединений формулы I и II
Один из предпочтительных способов получения соединений формулы I или II, где R3 представляет собой водород, показан на схеме реакции I.
СХЕМА РЕАКЦИИ I
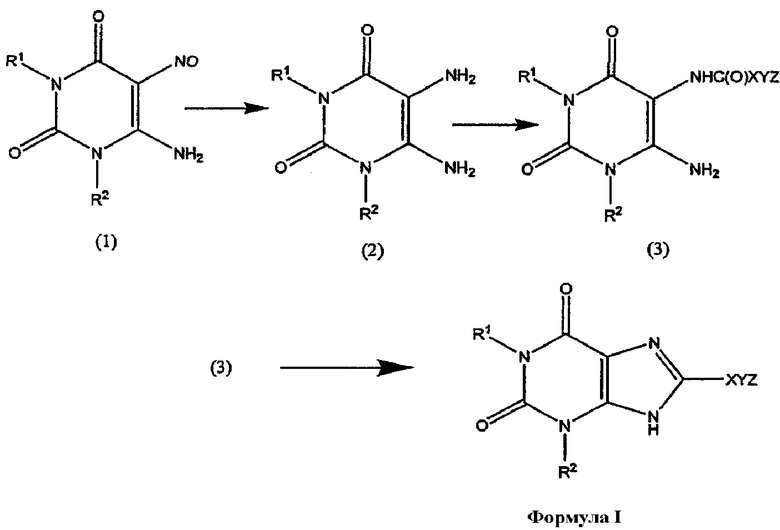
Стадия 1. Получение соединения формулы (2)
Соединение формулы (2) получают из соединения формулы (1) посредством стадии восстановления. Могут быть использованы общеизвестные методы восстановления, например с использованием дитионита натрия в водном растворе аммиака; предпочтительно восстановление осуществляют с помощью водорода и катализатора на основе металла. Взаимодействие осуществляют в инертном растворителе, например метаноле, в присутствии катализатора, например катализатора 10%-ного палладия на углероде, в атмосфере водорода, предпочтительно при давлении, например, около 30 фунт на кв.дюйм, в течение около 2 часов. Когда реакция по существу завершена, продукт формулы (2) выделяют с помощью общеизвестных средств с получением соединения формулы (2).
Стадия 2. Получение соединения формулы (3)
Соединение формулы (2) затем подвергают взаимодействию с карбоновой кислотой формулы Z-Y-X-CO2H в присутствии карбодиимида, например гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. Реакцию проводят в протонном растворителе, например метаноле, этаноле, пропаноле и тому подобное, предпочтительно метаноле, при температуре около 20-30°C, предпочтительно при около комнатной температуре, приблизительно 12-48 часов, предпочтительно, около 16 часов. Когда реакция по существу завершена, продукт формулы (3) выделяют обычным способом, например путем удаления растворителя при пониженном давлении и промывания продукта. Альтернативно, следующая стадия может быть проведена без дополнительной очистки.
Альтернативный способ получения соединения формулы (3)
Альтернативно, карбоновую кислоту формулы Z-Y-X-CO2H сначала преобразуют в галогенангидрид кислоты формулы Z-Y-X-C(O)L, где L представляет собой хлор или бром, путем взаимодействия с галогенирующим агентом, например тионилхлоридом или тионилбромидом, предпочтительно тионилхлоридом. Альтернативно, могут быть использованы оксалилхлорид, пентахлорид фосфора или оксихлорид фосфора. Реакцию предпочтительно проводят в отсутствие растворителя, используя избыток галогенирующего агента, например, при температуре приблизительно 60-80°C, предпочтительно около 70°C, в течение 1-8 часов, предпочтительно около 4 часов. Когда реакция по существу завершена, продукт формулы Z-Y-X-C(O)L выделяют обычным способом, например путем удаления избытка галогенирующего агента при пониженном давлении.
Продукт затем подвергают взаимодействию с соединением формулы (2) в инертном растворителе, например ацетонитриле, в присутствии третичного основания, например триэтиламина. Реакцию проводят при начальной температуре около 0°C и затем оставляют нагреваться до 20-30°C, предпочтительно приблизительно до комнатной температуры, в течение 12-48 часов, предпочтительно около 16 часов. Когда реакция по существу завершена, продукт формулы (3) выделяют обычным способом, например, путем разбавления реакционной смеси водой, фильтрования продукта и промывания продукта водой и затем эфиром.
Стадия 3. Получение соединения формулы I
Соединение формулы (3) затем преобразуют в соединение формулы I путем реакции циклизации. Реакцию проводят в протонном растворителе, например метаноле, этаноле, пропаноле и тому подобное, предпочтительно метаноле, в присутствии основания, например гидроксида калия, гидроксида натрия, метоксида натрия, этоксида натрия, трет-бутоксида калия, предпочтительно водного гидроксида натрия, при температуре около 50-80°C, предпочтительно около 80°C, в течение 1-8 часов, предпочтительно около 3 часов. Когда реакция по существу завершена, продукт формулы I выделяют обычным образом, например, удаляя растворитель при пониженном давлении, подкисляя остаток водной кислотой, фильтруя продукт, затем промывая и высушивая продукт.
Соединение формулы (1) могут быть получены различными способами. Один из предпочтительных способов показан на схеме реакции II.
СХЕМА РЕАКЦИИ II
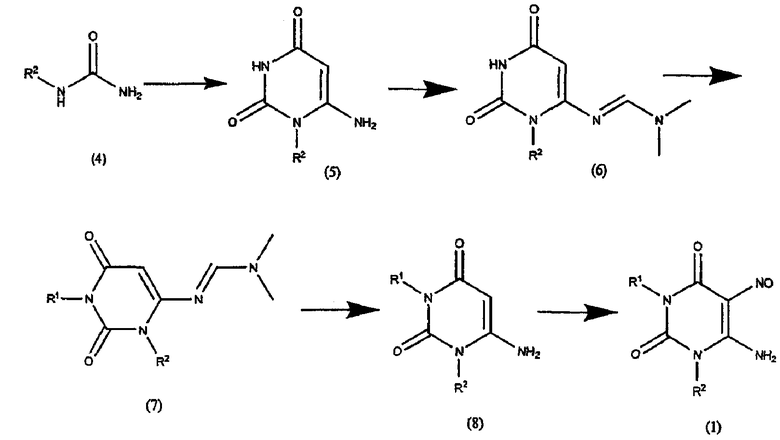
Стадия 1. Получение соединения формулы (5)
Соединение формулы (4) является либо коммерчески доступным, либо его получают с помощью средств, хорошо известных в данной области. Соединения подвергают взаимодействию с этил цианоацетатом в протонном растворителе, например этаноле, в присутствии сильного основания, например этоксида натрия. Взаимодействие осуществляют при температуре кипения в сосуде с обратным холодильником в течение от 4 до около 24 часов. Когда реакция по существу завершена, полученное таким образом соединение формулы (5) выделяют обычным образом.
Стадия 2 и 3. Получение соединения формулы (7)
Соединение формулы (5) подвергают взаимодействию с диметилацеталью N,N-диметилформамида в полярном растворителе, например N,N-диметилформамиде. Взаимодействие осуществляют при около 40°C в течение около 1 часа. Когда реакция по существу завершена, полученное таким образом соединение формулы (6) подвергают взаимодействию с соединением формулы R1Hal, где Hal представляет собой хлор, бром или йод, в присутствии основания, например карбоната калия. Взаимодействие осуществляют при температуре около 80°C, в течение около 4-24 часов. Когда реакция по существу завершена, продукт формулы (7) выделяют обычным образом, например, упаривая растворители при пониженном давлении, и остаток используют в следующей реакции без дополнительной очистки.
Стадия 4. Получение соединения формулы (8)
Соединение формулы (7) подвергают взаимодействию с водным аммиаком в полярном растворителе, например, суспендированным в метаноле. Взаимодействие осуществляют при около комнатной температуре в течение 1-3 дней. Когда реакция по существу завершена, продукт формулы (8) выделяют обычным образом например с помощью хроматографии на колонке с силикагелем, элюируя, например, смесью дихлорметан/метанол.
Стадия 5. Получение соединения формулы (1)
Соединение формулы (8) затем смешивают с нитритом натрия в водном кислотном растворителе, предпочтительно в уксусной кислоте и воде, например смесь 50%-ная уксусная кислота/вода. Взаимодействие осуществляют при температуре приблизительно 50-90°C, предпочтительно около 70°C, в течение 1 часа. Когда реакция по существу завершена, продукт формулы (1) выделяют с помощью общеизвестных средств.
Альтернативно, реакция может быть проведена в водном растворителе, например, диметилформамиде и воде, и подвергнута взаимодействию с сильной кислотой, например хлористо-водородной кислотой.
Соединение формулы (8) может быть получено исходя из соединения формулы (10), используя способ, подобный тому, который показан на схеме реакции IIA.
СХЕМА РЕАКЦИИ IIA
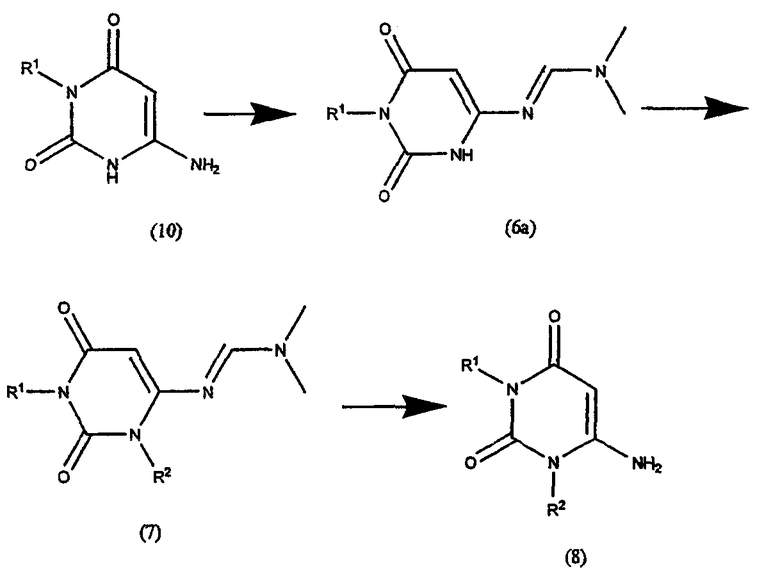
Стадия 2 и 3. Получение соединения формулы (7)
Соединение формулы (10) подвергают взаимодействию с диметилацеталью N,N-диметилформамида в полярном растворителе, например N,N-диметилформамиде. Взаимодействие осуществляют при около 40°C в течение около 1 часа. Когда реакция по существу завершена, полученное таким образом соединение формулы (6a) подвергают взаимодействию с соединением формулы R2Hal, где Hal представляет собой хлор, бром или йод, в присутствии основания, например карбоната калия. Взаимодействие осуществляют при около 80°C в течение 4-24 часов. Когда реакция по существу завершена, продукт формулы (7) выделяют обычным образом, например упариванием растворители при пониженном давлении, и остаток используют в следующей реакции без дополнительной очистки.
Стадия 4. Получение соединения формулы (8)
Соединение формулы (7) подвергают взаимодействию с водным аммиаком в полярном растворителе, например, суспендированным в метаноле. Взаимодействие осуществляют при приблизительно комнатной температуре в течение 1-3 дней. Когда реакция по существу завершена, продукт формулы (8) выделяют обычным образом, например с помощью хроматографии на колонке с силикагелем, элюируя, например, смесью дихлорметан/метанол.
Соединение формулы (3) также может быть получено различными способами. Один из предпочтительных способов показан на схеме реакции III.
СХЕМА РЕАКЦИИ III
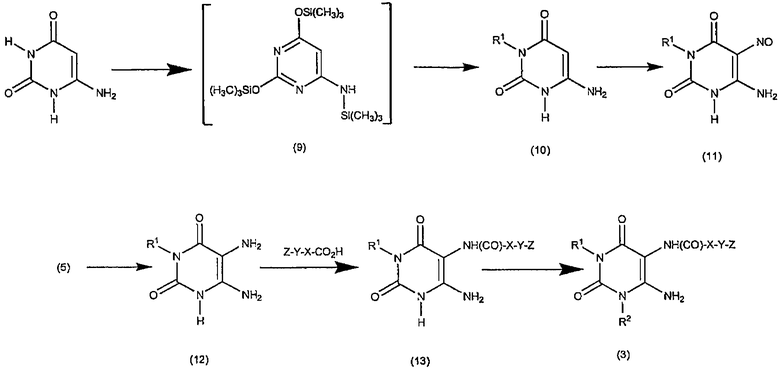
Стадия 1. Получение соединения формулы (10)
Коммерчески доступное соединение 6-аминоурацил сначала силилируют, например, путем взаимодействия с избытком гексаметилдисилазана в качестве растворителя в присутствии катализатора, например сульфата аммония. Взаимодействие осуществляют при приблизительно температуре кипения в сосуде с обратным холодильником в течение около 1-10 часов. Когда реакция по существу завершена, полученное таким образом силилированное соединение выделяют обычным образом, и затем подвергают взаимодействию с соединением формулы R1Hal, где Hal представляет собой хлор, бром или йод, предпочтительно в отсутствие растворителя. Взаимодействие осуществляют при приблизительно температуре кипения в сосуде с обратным холодильником в течение около 4-48 часов, предпочтительно около 12-16 часов. Когда реакция по существу завершена, продукт формулы (10) выделяют с помощью общеизвестных средств.
Стадия 2. Получение соединения формулы (11)
Соединение формулы (10) затем растворяют в водном растворе кислоты, например в водном растворе уксусной кислоты, и подвергают взаимодействию с нитритом натрия. Взаимодействие осуществляют при температуре около 20-50°C, предпочтительно около 30°C, в течение приблизительно 30 минут. Когда реакция по существу завершена, продукт формулы (11) выделяют с помощью общеизвестных средств, например фильтрованием.
Стадия 3. Получение соединения формулы (12)
Соединение формулы (11) затем восстанавливают до диамино производного. Обычно, соединение формулы (11) растворяют в водном аммиаке и затем добавляют восстановитель, например гидросульфит натрия. Реакцию проводят при температуре около 70°C. Когда реакция по существу завершена, продукт формулы (12) выделяют обычным образом, например фильтрованием охлажденной реакционной смеси.
Стадия 4. Получение соединения формулы (13)
Соединение формулы (12) затем подвергают взаимодействию с карбоновой кислотой формулы Z-Y-X-CO2H в присутствии карбодиимида, например гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. Реакцию проводят при температуре около 20-30°C в течение около 12-48 часов. Когда реакция по существу завершена, продукт формулы (13) выделяют обычным образом, например фильтрованием охлажденной реакционной смеси.
Альтернативно, карбоновую кислоту формулы Z-Y-X-CO2H преобразуют в галогенангидрид кислоты формулы Z-Y-X-C(O)L, где L представляет собой хлор или бром, путем взаимодействия с галогенирующим агентом, например тионилхлоридом или тионилбромидом; альтернативно, могут быть использованы пентахлорид фосфора или оксихлорид фосфора. Реакцию предпочтительно проводят в отсутствие растворителя, используя избыток галогенирующего агента, например, при температуре приблизительно 60-80°C, предпочтительно около 70°C, в течение 1-8 часов, предпочтительно около 4 часов. Когда реакция по существу завершена, продукт формулы Z-Y-X-C(O)L выделяют обычным способом, например путем удаления избытка галогенирующего агента при пониженном давлении.
Продукт формулы Z-Y-X-C(O)L затем подвергают взаимодействию с соединением формулы (12) в инертном растворителе, например ацетонитриле, в присутствии третичного основания, например триэтиламина. Реакцию проводят при начальной температуре около 0°C и затем оставляют нагреваться до 20-30°C, предпочтительно до приблизительно комнатной температуры, в течение 12-48 часов, предпочтительно около 16 часов. Когда реакция по существу завершена, продукт формулы (13) выделяют обычным способом, например путем разбавления реакционной смеси водой, фильтрования продукта и промывания продукта водой и затем эфиром.
Стадия 5. Получение соединения формулы (3)
Соединение формулы (13) подвергают взаимодействию с соединение формулы R2Hal, где Hal представляет собой хлор, бром или йод, в присутствии основания, например карбоната калия. Взаимодействие осуществляют при приблизительно комнатной температуре в течение около 4-24 часов, предпочтительно около 16 часов. Когда реакция по существу завершена, продукт формулы (3) выделяют обычным образом, например упариванием растворителей при пониженном давлении, и остаток может быть очищен обычным образом, или может быть использован в следующей реакции без дополнительной очистки.
Другой способ получения соединения формулы (3) показан на схеме реакции IV.
СХЕМА РЕАКЦИИ IV
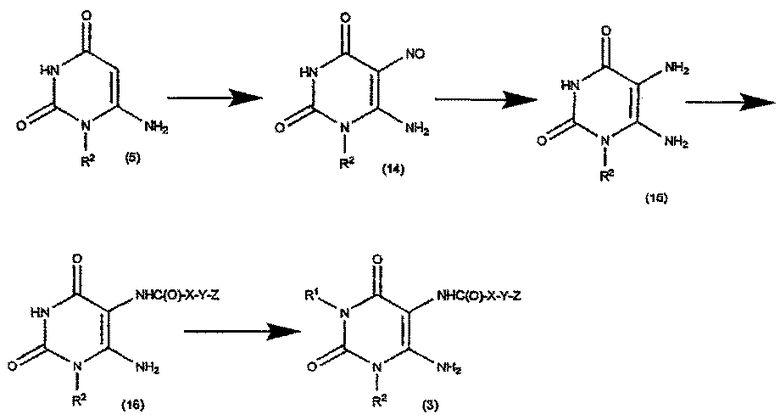
Стадия 1. Получение соединения формулы (14)
Соединение формулы (5) затем смешивают с нитритом натрия в водном кислотном растворителе, предпочтительно в уксусной кислоте и воде, например смеси 50%-ной уксусной кислоты/воды. Взаимодействие осуществляют при температуре около 50-90°C, предпочтительно около 70°C, в течение около 1 часа. Когда реакция по существу завершена, продукт формулы (14) выделяют с помощью общеизвестных средств.
Альтернативно, реакция может быть проведена в водном растворителе, например диметилформамиде и воде, и подвергнута взаимодействию сильной кислоты, например хлористо-водородной кислоты.
Стадия 3. Получение соединения формулы (15)
Соединение формулы (14) затем восстанавливают до диамино производного. Обычно, соединение формулы (14) растворяют в водном аммиаке и затем добавляют восстановитель, например гидросульфит натрия. Реакцию проводят при температуре около 70°C. Когда реакция по существу завершена, продукт формулы (15) выделяют обычным образом, например фильтрованием охлажденной реакционной смеси.
Стадия 4. Получение соединения формулы (16)
Соединение формулы (15) затем подвергают взаимодействию с карбоновой кислотой формулы Z-Y-X-CO2H в присутствии карбодиимида, например гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. Реакцию проводят при температуре около 20-30°C в течение около 12-48 часов, в инертном растворителе, например метаноле. Когда реакция по существу завершена, продукт формулы (16) выделяют обычным образом, например фильтрованием охлажденной реакционной смеси.
Альтернативно, карбоновую кислоту формулы Z-Y-X-CO2H преобразуют в галогенангидрид кислоты формулы Z-Y-X-C(O)L, где L представляет собой хлор или бром, путем взаимодействия с галогенирующим агентом, например тионилхлоридом или тионилбромидом; альтернативно, могут быть использованы пентахлорид фосфора или оксихлорид фосфора. Реакцию предпочтительно проводят в отсутствие растворителя, используя избыток галогенирующего агента, например, при температуре приблизительно 60-80°C, предпочтительно около 70°C, в течение 1-8 часов, предпочтительно около 4 часов. Когда реакция по существу завершена, продукт формулы Z-Y-X-C(O)L выделяют обычным способом, например путем удаления избытка галогенирующего агента при пониженном давлении.
Затем продукт формулы Z-Y-X-C(O)L подвергают взаимодействию с соединением формулы (15) в инертном растворителе, например ацетонитриле, в присутствии третичного основания, например триэтиламина. Реакцию проводят при начальной температуре около 0°C и затем оставляют нагреваться до 20-30°C, предпочтительно до приблизительно комнатной температуры, в течение 12-48 часов, предпочтительно около 16 часов. Когда реакция по существу завершена, продукт формулы (16) выделяют обычным способом, например путем разбавления реакционной смеси водой, фильтрования продукта и промывания продукта водой и затем эфиром.
Стадия 5. Получение соединения формулы (3)
Соединение формулы (16) подвергают взаимодействию с соединением формулы R1Hal, где Hal представляет собой хлор, бром или йод, в присутствии основания, например карбоната калия. Взаимодействие осуществляют при температуре около 80°C в течение около 4-24 часов, предпочтительно около 16 часов. Когда реакция по существу завершена, продукт формулы (3) выделяют обычным образом, например упариванием растворителей при пониженном давлении, и остаток может быть очищен обычным образом, или может быть использован в следующей реакции без дополнительной очистки.
Пример синтеза соединения Z-Y-X-CO2H, в котором X представляет собой пиразол-1,4-ил, Y представляет собой метилен и Z представляет собой 3-трифторметилфенил, показан на схеме реакции V.
СХЕМА РЕАКЦИИ V
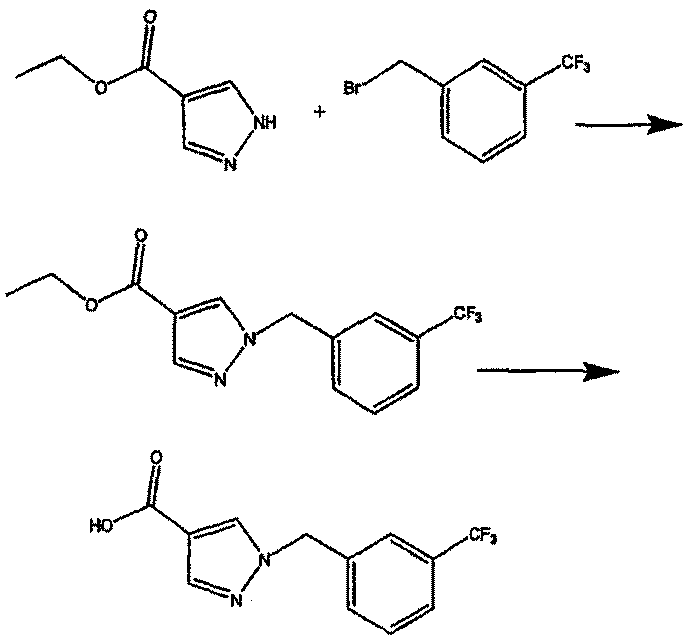
Этил пиразол-4-карбоксилат подвергают взаимодействию с 1-(бромметил)-3-(трифторметил)бензолом в ацетоне в присутствии карбоната калия. Продукт, этил 1-{[3-(трифторметил)фенил]-метил}пиразол-4-карбоксилат, затем подвергают гидролизу гидроксидом калия в метаноле с получением 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновой кислоты.
Эффективность, исследование и введение
Общая эффективность
Способ и фармацевтические композиции по изобретению являются эффективными для ускорения аугментации заживления ран.
Исследование
Исследование активности проводили способом, описанным в указанных выше патентах и патентных заявках и в примерах далее, и способами, очевидными специалисту в данной области.
Следующие примеры включены для демонстрации предпочтительных вариантов осуществления изобретения. Специалистам в данной области будет понятно, что способы, описанные авторами в следующих примерах, эффективно работают при практическом применении изобретения и, таким образом, могут рассматриваться для составления предпочтительных вариантов их практического применения. Однако специалистам в данной области будет понятно, в свете настоящего описания, что в конкретных описанных вариантах осуществления могут быть сделаны различные изменения, при которых тем не менее, будет похожий или аналогичный результат, не выходя за рамки описания изобретения.
ПРИМЕР 1
Получение соединения формулы (5)
A. Получение соединения формулы (5), где R 2 представляет собой этил
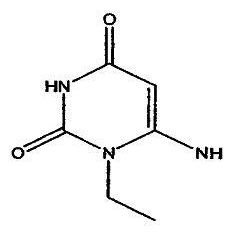
Раствор этоксида натрия был получен из натрия (4,8 г, 226 ммоль) и сухого этанола (150 мл). К раствору добавляли амино-N-этиламид (10 г, 113 ммоль) и этил цианоацетат (12,8 г, 113 ммоль). Эту реакционную смесь перемешивали при кипячении в сосуде с обратным холодильником в течение 6 часов, охлаждали и растворитель удаляли из реакционной смеси при пониженном давлении. Остаток растворяли в воде (50 мл) и значение устанавливали pH, равным 7, с помощью хлористо-водородной кислоты. Смесь оставляли на ночь при 0°C и выпавший осадок отфильтровывали, промывали водой и сушили на воздухе с получением 6-амино-1-этил-1,3-дигидропиримидин-2,4-диона, соединения формулы (5).
1H-ЯМР (ДМСО-d6) δ 10,29 (c, 1H), 6,79 (c, 2H), 4,51 (c, 1H), 3,74-3,79 (м, 2H), 1,07 (т, 3H, J=7,03 Гц); MS m/z 155,98 (M+), 177,99 (M++Na).
B. Получение соединения формулы (5), где R 2 представляет собой метил
Подобным образом, в соответствии со способом, описанным в примере 1A, но заменяя амино-N-этиламид на амино-N-метиламид, был получен 6-амино-1-метил-1,3-дигидропиримидин-2,4-дион.
C. Получение соединения формулы (5), изменяя R 2
Подобным образом, в соответствии со способом, описанным в примере 1A, но заменяя амино-N-этиламид на другие соединения формулы (4), были получены другие соединения формулы (5).
ПРИМЕР 2
Получение соединения формулы (6)
A. Получение соединения формулы (6), где R 2 представляет собой этил
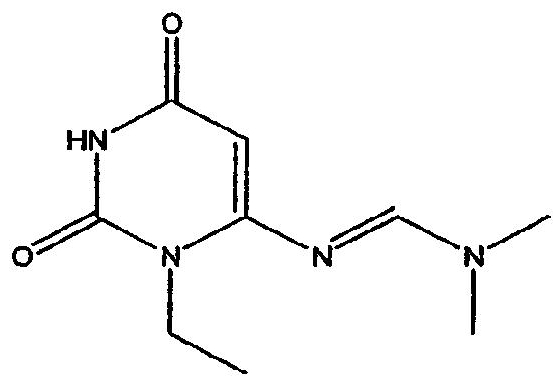
Суспендировали 6-амино-1-этил-1,3-дигидропиримидин-2,4-дион (0,77 г, 5 ммоль) в безводном N,N-диметилацетамиде (25 мл) и диметилацетале N,N-диметилформамида (2,7 мл, 20 ммоль) и нагревали при 40°C в течение 90 минут. Растворитель затем удаляли при пониженном давлении и остаток растирали в этаноле, фильтровывали и промывали этанолом с получением 6-[2-(диметиламино)-1-азавинил]-1-этил-1,3-дигидропиримидин-2,4-диона, соединения формулы (6).
1H-ЯМР (ДМСО-d6) δ 10,62 (c, 1H), 8,08 (c, 1H), 4,99 (c, 1H), 3,88-3,95 (м, 2H), 3,13 (c, 3H), 2,99 (c, 3H), 1,07 (т, 3H, J=7,03 Гц); MS m/z 210,86 (M+), 232,87 (M++Na).
B. Получение соединения формулы (6), где R 2 представляет собой метил
Подобным образом, в соответствии со способом, описанным в примере 2A, но заменяя 6-амино-1-этил-1,3-дигидропиримидин-2,4-дион на 6-амино-1-метил-1,3-дигидропиримидин-2,4-дион, был получен 6-[2-(диметиламино)-1-азавинил]-1-метил-1,3-дигидропиримидин-2,4-дион.
C. Получение соединения формулы (6), изменяя R 2
Подобным образом, в соответствии со способом, описанным в примере 2A, но заменяя 6-амино-1-этил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (5), были получены другие соединения формулы (6).
ПРИМЕР 3
Получение соединения формулы (7)
A. Получение соединения формулы (7), где R 1 представляет собой н-пропил и R 2 представляет собой этил
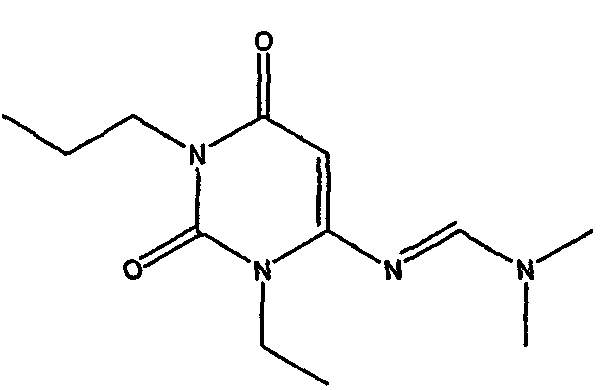
Смесь раствора 6-[2-(диметиламино)-1-азавинил]-1-этил-1,3-дигидропиримидин-2,4-диона (1,5 г, 7,1 ммоль) в диметилформамиде (25 мл), карбонат калия (1,5 г, 11 ммоль) и н-пропилйодид (1,54 г, 11 ммоль) перемешивали при 80°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровывали, растворители упаривали и продукт формулы (7), 6-[2-(диметиламино)-1-азавинил]-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион, использовали как таковой в следующей реакции.
B. Получение соединения формулы (7), изменяя R 1 и R 2
Подобным образом, в соответствии со способом, описанным в примере 3A, но заменяя 6-[2-(диметиламино)-1-азавинил]-1-этил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (6), были получены следующие соединения формулы (7):
6-[2-(диметиламино)-1-азавинил]-1-метил-3-пропил-1,3-дигидропиримидин-2,4-дион;
6-[2-(диметиламино)-1-азавинил]-1-метил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
6-[2-(диметиламино)-1-азавинил]-1-этил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
6-[2-(диметиламино)-1-азавинил]-1-метил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион и
6-[2-(диметиламино)-1-азавинил]-1-этил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
C. Получение соединения формулы (7), изменяя R 1 и R 2
Подобным образом, в соответствии со способом, описанным в примере 3A, но заменяя 6-[2-(диметиламино)-1-азавинил]-1-этил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (6), были получены другие соединения формулы (7).
ПРИМЕР 4
Получение соединения формулы (8)
A. Получение соединения формулы (8), где R 1 представляет собой н-пропил и R 2 представляет собой этил
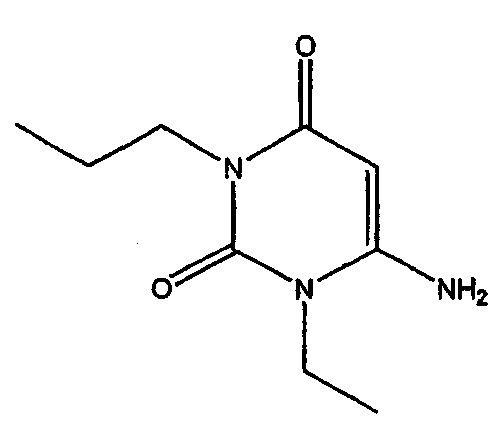
Раствор 6-[2-(диметиламино)-1-азавинил]-1-этил-3-пропил-1,3-дигидропиримидин-2,4-диона (2,1 г) растворяли в смеси метанола (10 мл) и 28%-ного водного раствора аммиака (20 мл) и перемешивали в течение 72 часов при комнатной температуре. Растворитель затем удаляли при пониженном давлении и остаток очищали с помощью хроматографии на колонке с силикагелем, элюируя смесью дихлорметан/метанол (15/1), с получением 6-амино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (8).
1H-ЯМР (ДМСО-d6) δ 6,80 (c, 2H), 4,64 (c, 1H), 3,79-3,84 (м, 2H), 3,63-3,67 (м, 2H), 1,41-1,51 (м, 2H), 1,09 (т, 3H, J=7,03 Гц), 0,80 (т, 3H, J=7,42 Гц); MS m/z 197,82 (M+).
B. Получение соединения формулы (8), изменяя R 1 и R 2
Подобным образом, в соответствии со способом, описанным в примере 4A, но заменяя 6-[2-(диметиламино)-1-азавинил]-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (7), были получены следующие соединения формулы (8):
6-амино-1-метил-3-пропил-1,3-дигидропиримидин-2,4-дион;
6-амино-1-метил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
6-амино-1-этил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
6-амино-1-метил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион и
6-амино-1-этил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
C. Получение соединения формулы (7), изменяя R 1 и R 2
Подобным образом, в соответствии со способом, описанным в примере 4A, но заменяя 6-[2-(диметиламино)-1-азавинил]-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (7), были получены другие соединения формулы (8).
ПРИМЕР 5
Получение соединения формулы (1)
A. Получение соединения формулы (1), где R 1 представляет собой н-пропил и R 2 представляет собой этил
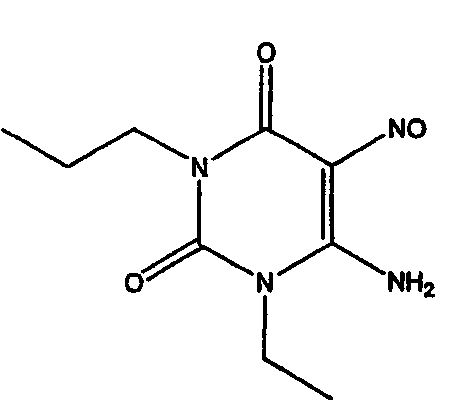
К раствору 6-амино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-диона (1,4 г, 7,1 ммоль) в смеси 50%-ная уксусная кислота/вода (35 мл) порциями добавляли нитрит натрия (2 г, 28,4 ммоль) в течение периода 10 минут. Смесь перемешивали при 70°C в течение 1 часа, затем реакционную смесь упаривали до небольшого объема при пониженном давлении. Твердый продукт отфильтровывали и промывали водой с получением 6-амино-1-этил-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (1).
MS m/z 227,05 (M+), 249,08 (M++Na).
B. Получение соединения формулы (1), изменяя R 1 и R 2
Подобным образом, в соответствии со способом, описанным в примере 5A, но заменяя 6-амино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (8), были получены следующие соединения формулы (1):
6-амино-1-метил-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-дион;
6-амино-1-метил-3-циклопропилметил-5-нитрозо-1,3-дигидропиримидин-2,4-дион;
6-амино-1-этил-3-циклопропилметил-5-нитрозо-1,3-дигидропиримидин-2,4-дион;
6-амино-1-метил-3-(2-метилпропил)-5-нитрозо-1,3-дигидропиримидин-2,4-дион и
6-амино-1-этил-3-(2-метилпропил)-5-нитрозо-1,3-дигидропиримидин-2,4-дион.
C. Получение соединения формулы (1), изменяя R 1 и R 2
Подобным образом, в соответствии со способом, описанным в примере 5A, но заменяя 6-амино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (8), были получены другие соединения формулы (1).
ПРИМЕР 6
Получение соединения формулы (2)
A. Получение соединения формулы (2), где R 1 представляет собой н-пропил и R 2 представляет собой этил
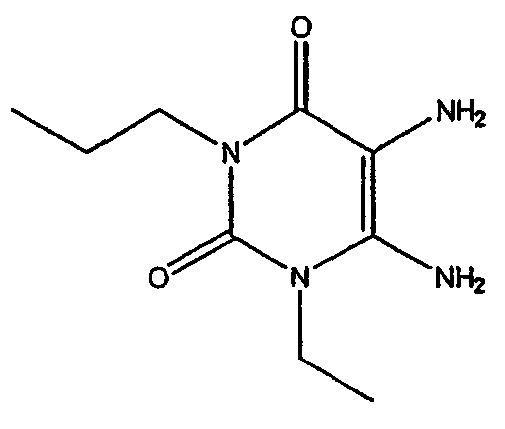
К раствору 6-амино-1-этил-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-диона (300 мг) в метаноле (10 мл) добавляли катализатор 10%-ный палладий на углероде (50 мг) и смесь гидрировали водородом при 30 фунт на кв.дюйм в течение 2 часов. Смесь фильтровали через целит и растворитель удаляли из фильтрата при пониженном давлении, с получением 5,6-диамино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (2).
MS m/z 213,03 (M+), 235,06 (M++Na).
B. Получение соединения формулы (2), изменяя R 1 и R 2
Подобным образом, в соответствии со способом, описанным в примере 6A, но заменяя 6-амино-1-этил-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (1), были получены следующие соединения формулы (2):
5,6-диамино-1-метил-3-пропил-1,3-дигидропиримидин-2,4-дион;
5,6-диамино-1-метил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
5,6-диамино-1-этил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
5,6-амино-1-метил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион и
5,6-диамино-1-этил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
C. Получение соединения формулы (2), изменяя R 1 и R 2
Подобным образом, в соответствии со способом, описанным в примере 6A, но заменяя 6-амино-1-этил-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (1), были получены другие соединения формулы (2).
ПРИМЕР 7
Получение соединения формулы (3)
A. Получение соединения формулы (3), где R 1 представляет собой н-пропил, R 2 представляет собой этил, X представляет собой 1,4-пиразолил, Y представляет собой метилен и Z представляет собой 3-трифторметилфенил
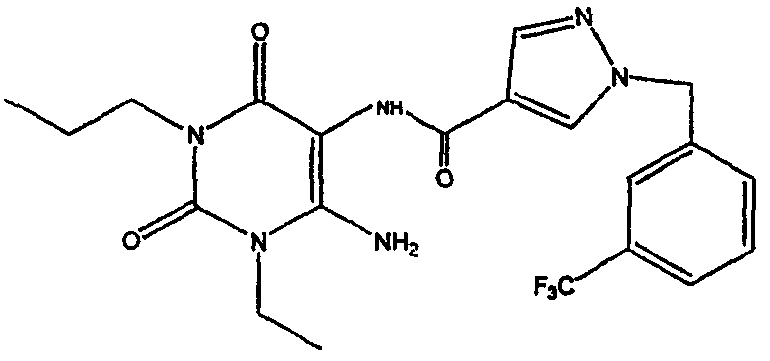
К смеси 5,6-диамино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-диона (100 мг, 0,47 ммоль) и 1-{[3-(трифторметил)фенил]-метил}пиразол-4-карбоновой кислоты (0,151 г, 0,56 ммоль) в метаноле (10 мл) добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,135 г, 0,7 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении и остаток очищали с помощью Bistag, элюируя смесью 10% метанол/метиленхлорид, с получением N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиридин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида.
1H-ЯМР (ДМСО-d6) δ 8,59 (c, 1H), 8,02 (c, 1H), 7,59-7,71 (м, 4H), 6,71 (c, 2H), 5,51 (c, 2H), 3,91-3,96 (м, 2H), 3,70-3,75 (м, 2H), 1,47-1,55 (м, 2H), 1,14 (т, 3H, J=7,03 Гц), 0,85 (т, 3H, J=7,42 Гц).
B. Получение соединения формулы (3), изменяя R 1 , R 2 , X, Y и Z
Подобным образом, в соответствии со способом, описанным в примере 7A или 7B, но, необязательно, заменяя 5,6-диамино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (2) и, необязательно, заменяя 1-{[3-(трифторметил)-фенил]метил}пиразол-4-карбоновую кислоту на другие соединения формулы Z-Y-X-CO2H, были получены следующие соединения формулы (3):
N-(6-амино-1-метил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}-пиразол-4-ил)карбоксамид;
N-(6-амино-1-этил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}-пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-этил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-этил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-[6-амино-3-(циклопропилметил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-бензилпиразол-4-ил]карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-цианофенил]метил}пиразол-4-ил)карбоксамид;
[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил]-N-[6-амино-3-(циклопропилметил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)]карбоксамид;
N-[6-амино-3-(циклопропилметил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид;
N-[6-амино-3-пропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{(2-пиридил)]метил}пиразол-4-ил)карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-бензилпиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-фторфенил]метил}пиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-фторфенил]метил}пиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-(трифторметил)фенил]метил}пиразол-4-ил]карбоксамид и
N-[6-амино-3-(2-метилпропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид.
C. Получение соединения формулы (2), изменяя R 1 и R 2
Подобным образом, в соответствии со способом, описанным в примере 7A, но, необязательно, заменяя 5,6-диамино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (2) и, необязательно, заменяя 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновую кислоту на другие соединения формулы Z-Y-X-CO2H, были получены другие соединения формулы (3).
ПРИМЕР 8
Получение соединения формулы I
A. Получение соединения формулы I, где R 1 представляет собой н-пропил, R 2 представляет собой этил, X представляет собой 1,4-пиразолил, Y представляет собой метилен и Z представляет собой 3-трифторметилфенил
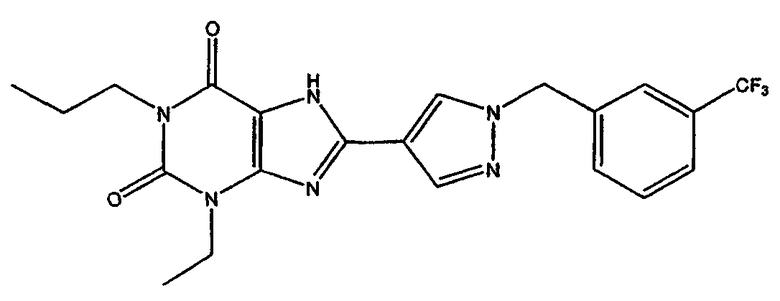
Смесь N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамида (80 мг, 0,17 ммоль), 10%-ного водного раствора гидроксида натрия (5 мл) и метанола (5 мл) перемешивали при 100°C в течение 2 часов. Смесь охлаждали, метанол удаляли при пониженном давлении и остаток разбавляли водой и подкисляли хлористо-водородной кислотой. Выпавший осадок отфильтровывали, промывали водой, затем метанолом с получением 3-этил-1-пропил-8-(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-диона, соединения формулы I.
1H-ЯМР (ДМСО-d6) δ 8,57 (c, 1H), 8,15 (c, 1H), 7,60-7,75 (м, 4H), 5,54 (c, 2H), 4,05-4,50 (м, 2H), 3,87-3,91 (м, 2H), 1,55-1,64 (м, 2H), 1,25 (т, 3H, J=7,03 Гц), 0,90 (т, 3H, J=7,42 Гц); MS m/z 447,2 (M+).
B. Получение соединения формулы I, изменяя R 1 , R 2 , X, Y и Z
Подобным образом, в соответствии со способом, описанным в примере 8A, но заменяя N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]-метил}пиразол-3-ил)карбоксамид на другие соединения формулы (3), были получены следующие соединения формулы I:
1-циклопропилметил-3-метил-8-[1-(фенилметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-метил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-этил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-метил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-этил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-этил-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)- 1,3,7-тригидропурин-2,6-дион;
3-({4-[1-(циклопропилметил)-3-метил-2,6-диоксо-1,3,7-тригидропурин-8-ил]пиразолил}метил)бензолкарбонитрил;
8-[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил]-3-метил-1-циклопропилметил-1,3,7-тригидропурин-2,6-дион;
1-(2-метилпропил)-3-метил-8-[1-бензилпиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
1-(2-метилпропил)-3-этил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-(2-метилпропил)-3-метил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-(2-метилпропил)-3-метил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
3-этил-1-(2-метилпропил)-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1-этил-3-метил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион и
3-этил-1-пропил-8-[1-(2-пиридилметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион.
C. Получение соединения формулы I, изменяя R 1 , R 2 , X, Y и Z
Подобным образом, в соответствии со способом, описанным в примере 8A, но заменяя N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиридин-5-ил))(1-{[3-(трифторметил)фенил]-метил}пиразол-3-ил)карбоксамид на другие соединения формулы (3), были получены другие соединения формулы I.
ПРИМЕР 9
Получение соединения формулы (10)
A. Получение соединения формулы (10), где R 1 представляет собой н-пропил
Смесь 6-аминоурацила (5,08 г, 40 ммоль), гексаметилдисилазана (50 мл) и сульфата аммония (260 мг, 1,96 ммоль) кипятили в сосуде с обратным холодильником в течение 12 часов. После охлаждения твердый продукт отфильтровывали и растворитель удаляли из фильтрата при пониженном давлении с получением триметилсилилированного производного 6-аминоурацила.
Продукт растворяли в толуоле (1,5 мл) и йодпропане (7,8 мл, 80 ммоль) и нагревали на масляной бане при 120°C в течение 2 часов. Реакционную смесь затем охлаждали до 0°C и медленно добавляли насыщенный водный раствор бикарбоната натрия. Образовавшийся осадок отфильтровывали и промывали последовательно водой, толуолом и эфиром с получением 6-амино-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (10), которое использовали в следующей реакции без дополнительной очистки.
1H-ЯМР (ДМСО-d6) δ 10,34 (c, 1H), 6,16 (c, 2H), 4,54 (c, 1H), 3,57-3,62 (м, 2H), 1,41-1,51 (м, 2H), 0,80 (т, 3H, J=7,43 Гц).
B. Получение соединения формулы (10), изменяя R 1
Подобным образом, в соответствии со способом, описанным в примере 9A, но заменяя йодпропан на другие алкилгалогениды формулы R1Hal, были получены другие соединения формулы (10), включая:
6-амино-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион и
6-амино-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
ПРИМЕР 10
Получение соединения формулы (11)
A. Получение соединения формулы (10), где R 1 представляет собой н-пропил
К раствору 6-амино-3-пропил-1,3-дигидропиримидин-2,4-диона (5,6 г) в смеси 50%-ной уксусной кислоты/воды (160 мл) при 70°C порциями в течение 15 минут добавляли нитрит натрия (4,5 г). Смесь перемешивали при 70°C в течение 45 минут, затем реакционную смесь упаривали до небольшого объема при пониженном давлении. Твердый продукт отфильтровывали и промывали водой с получением 6-амино-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (11).
1H-ЯМР (ДМСО-d6) δ 11,42 (c, 1H), 7,98 (c, 1H), 3,77-3,81 (м, 2H), 3,33 (c, 1H), 1,55-1,64 (м, 2H), 0,89 (т, 3H, J=7,43 Гц); MS m/z 198,78 (M+), 220,78 (M++Na).
B. Получение соединения формулы (11), изменяя R 1
Подобным образом, в соответствии со способом, описанным в примере 10A, но заменяя 6-амино-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (10), были получены другие соединения формулы (11), включая:
6-амино-5-нитрозо-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион и
6-амино-5-нитрозо-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
ПРИМЕР 11
Получение соединения формулы (12)
A. Получение соединения формулы (12), где R 1 представляет собой н-пропил
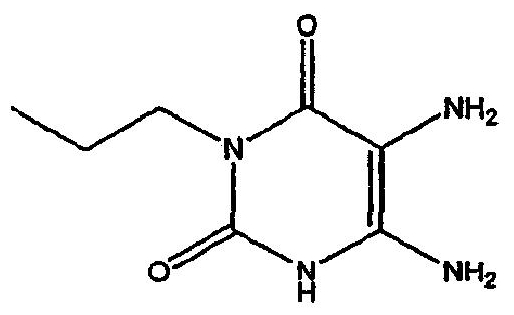
К раствору 6-амино-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-диона (5,4 г, 27 ммоль) в 12,5%-ном водном растворе аммиака (135 мл) при 70°C порциями в течение 15 минут добавляли дитионит натрия (Na2S2O4, 9,45 г, 54 ммоль) и смесь перемешивали в течение 20 минут. Раствор концентрировали при пониженном давлении, охлаждали до 5°C, выпавший осадок отфильтровывали и промывали холодной водой с получением 5,6-диамино-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (12).
1H-ЯМР (ДМСО-d6) δ 0,81 (т, 3H, J=7,43 Гц), 1,43-1,52 (м, 2H), 3,63-3,67 (м, 2H), 5,56 (c, 2H); MS m/z 184,95 (M+), 206,96 (M++Na).
B. Получение соединения формулы (12), изменяя R 1
Подобным образом, в соответствии со способом, описанным в примере 11A, но заменяя 6-амино-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (11), были получены другие соединения формулы (12), включая:
5,6-диамино-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион и
5,6-диамино-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
ПРИМЕР 12
Получение соединения формулы (13)
A. Получение соединения формулы (13), где R 1 представляет собой н-пропил, X представляет собой 1,4-пиразолил, Y представляет собой метилен и Z представляет собой 3-трифторметифенил
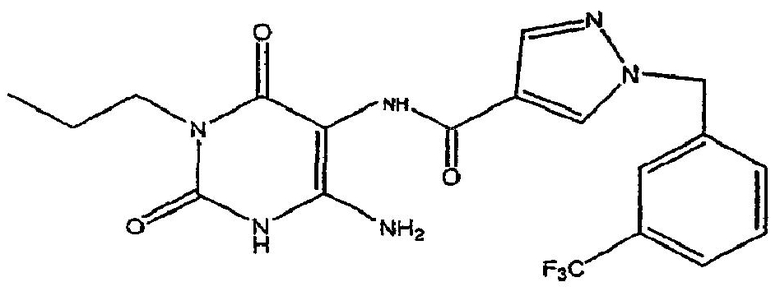
К смеси 5,6-диамино-3-пропил-1,3-дигидропиримидин-2,4-диона (2,3 г, 126 ммоль) и 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновой кислоты (3,79 г, 14 ммоль) в метаноле (50 мл) добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимиды (2,67 г, 14 ммоль) и реакционную смесь перемешивали в течение 3 дней при комнатной температуре (хотя достаточно и меньшего времени). Выпавший осадок отфильтровывали и промывали последовательно водой и метанолом. Продукт сушили в вакууме с получением N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида, соединения формулы (13).
1H-ЯМР (ДМСО-d6) δ 10,44 (c, 1H), 8,56 (c, 1H), 8,37 (c, 1H), 8,00 (c, 1H), 7,56-7,71 (м, 3H), 6,02 (c, 1H), 5,49 (c, 2H), 3,62-3,66 (м, 2H), 1,44-1,53 (м, 2H), 0,82 (т, 3H, J=7,43 Гц); MS m/z 458,92 (M++Na).
B. Альтернативное получение соединения формулы (3), где R 1 представляет собой н-пропил, X представляет собой 1,4-пиразолил, Y представляет собой метилен и Z представляет собой 3-трифторметилфенил
Раствор 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновой кислоты (1 г, 3,7 ммоль) в тионилхлориде (1 мл) нагревали при 70°C в течение 4 часов. Избыток тионилхлорид отгоняли и остаток обрабатывали смесью метиленхлорид/гексан. Растворитель удаляли при пониженном давлении и остаток растворяли в ацетонитриле. Этот раствор добавляли к суспензии 5,6-диамино-3-пропил-1,3-дигидропиримидин-2,4-диона (2,3 г, 126 ммоль) и триэтиламина (1 мл) в ацетонитриле (20 мл) при 0°C и перемешивали в течение 16 часов. Реакционную смесь гасили водой (5 мл), подкисляли хлористо-водородной кислотой, перемешивали в течение 30 минут и выпавший осадок отфильтровывали. Продукт промывали эфиром с получением N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида, соединения формулы (13).
C. Получение соединения формулы (13), изменяя R 1 , X, Y и Z
Подобным образом, в соответствии со способом, описанным в примере 12A или 12B, но, необязательно, заменяя 6-амино-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (12) и, необязательно, заменяя 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновую кислоту на другие соединения формулы Z-Y-X-CO2H, были получены другие соединения формулы (13), включая:
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-[1-бензил]пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-[1-бензил]пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-[1-бензил]пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-цианофенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-цианофенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-{[3-цианофенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил}карбоксамид;
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиридин-5-ил))(1-{[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид; и
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид.
ПРИМЕР 13
Получение соединения формулы (3)
A. Получение соединения формулы (3), где R 1 представляет собой н-пропил, R 2 представляет собой этил, X представляет собой 1,4-пиразолил, Y представляет собой метилен и Z представляет собой 3-трифторметилфенил
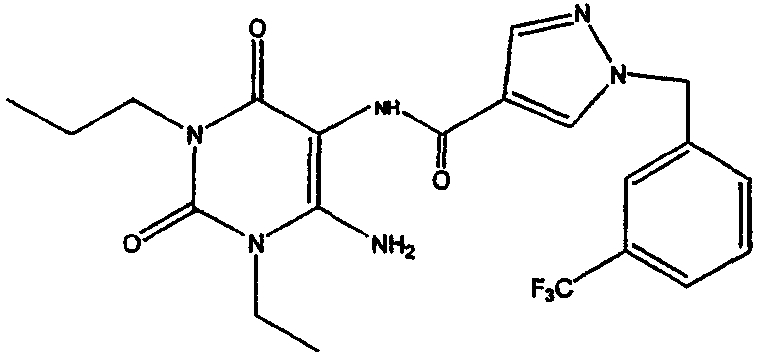
Смесь раствора N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}-пиразол-3-ил)карбоксамида (872 мг, 2 ммоль) в диметилформамиде (10 мл), карбоната калия (552 мг, 4 ммоль) и этилйодиде (0,24 мл, 3 ммоль) перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и растворитель упаривали из фильтрата при пониженном давлении. Остаток перемешивали с водой в течение двух часов при комнатной температуре и выпавший осадок отфильтровывали, промывали водой и затем растворяли в метаноле. Растворитель затем удаляли при пониженном давлении с получением N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида, соединения формулы (3).
1H-ЯМР (ДМСО-d6): δ 8,58 (c, 1H), 8,39 (c, 1H), 8,01 (c, IH), 7,72-7,50 (м, 4H), 6,71 (c, 2H), 5,51 (c, 2H), 4,0 - 3,82 (м, 2H), 3,77 - 3,65 (м, 2H), 1,60-1,50 (м, 2H), 1,13 (т, 3H, J=6,8 Гц), 0,84 (т, 3H, J=7,2 Гц); MS m/z 462,9 (M-).
B. Получение соединения формулы (13), изменяя R 1 , X, Y и Z
Подобным образом, в соответствии со способом, описанным в примере 13A, но заменяя N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)-фенил]метил}пиразол-3-ил)карбоксамид на другие соединения формулы (13), были получены другие соединения формулы (3), включая:
N-(6-амино-1-метил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}-пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}-пиразол-4-ил)карбоксамид;
N-(6-амино-1-этил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}-пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-этил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}-пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}-пиразол-4-ил)карбоксамид;
N-(6-амино-1-этил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}-пиразол-4-ил)карбоксамид;
N-[6-амино-3-(циклопропилметил)-1-метил-2,4-диоксо(1,3-дигидропиридин-5-ил)][1-бензилпиразол-4-ил]карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-цианофенил]метил}-пиразол-4-ил)карбоксамид;
[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил]-N-[6-амино-3-(циклопропилметил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)]карбоксамид;
N-[6-амино-3-(циклопропилметил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид;
N-[6-амино-3-пропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{(2-пиридил)]метил}пиразол-4-ил)карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-бензилпиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-фторфенил]метил}пиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-фторфенил]метил}пиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-(трифторметил)фенил]метил}пиразол-4-ил]карбоксамид и
N-[6-амино-3-(2-метилпропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид.
ПРИМЕР 14
Получение соединения формулы I
A. Получение соединения формулы I, где R 1 представляет собой н-пропил, R 2 представляет собой этил, X представляет собой 1,4-пиразолил, Y представляет собой метилен и Z представляет собой 3-трифторметилфенил

Смесь N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамида (850 мг, 2,34 ммоль), 10%-ного водного раствора гидроксида натрия (10 мл) и метанола (10 мл) перемешивали при 100°C в течение 18 часов. Смесь охлаждали, метанол удаляли при пониженном давлении и оставшуюся смесь подкисляли хлористо-водородной кислотой до pH 2. Выпавший осадок отфильтровывали, промывали смесью вода/метанол с получением 3-этил-1-пропил-8-(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-диона, соединения формулы I.
1H-ЯМР (ДМСО-d6) δ 8,57 (c, 1H), 8,15 (c, 1H), 7,60-7,75 (м, 4H), 5,54 (c, 2H), 4,05-4,50 (м, 2H), 3,87-3,91 (м, 2H), 1,55-1,64 (м, 2H), 1,25 (т, 3H, J=7,03 Гц), 0,90 (т, 3H, J=7,42 Гц); MS m/z 447,2 (M+).
B. Получение соединения формулы I, изменяя R 1 , R 2 , X, Y и Z
Подобным образом, в соответствии со способом, описанным в примере 14A, но заменяя N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]-метил}пиразол-3-ил)карбоксамид на другие соединения формулы (13), были получены другие соединения формулы I, включая перечисленные в примере 8.
ПРИМЕР 15
Получение соединения формулы (14)
A. Получение соединения формулы (14), где R 2 представляет собой этил
К раствору 6-амино-1-этил-1,3-дигидропиримидин-2,4-диона (5,0 г, 32,3 ммоль) в смеси 50%-ной уксусной кислоты/воды (50 мл) при 70°C порциями в течение 30 минут добавляли нитрит натрия (4,45 г, 64,5 ммоль). Смесь перемешивали при 70°C в течение еще 30 минут. Реакционную смесь охлаждали и выпавший осадок отфильтровывали и промывали водой, затем метанолом с получением 6-амино-1-этил-5-нитрозо-1,3-дигидропиримидин-2,4-диона, соединения формулы (14).
1H-ЯМР (ДМСО-d6): δ 11,52 (c, 1H), 9,16 (c, 1H), 3,83 (кв., 2H, J=7,0 Гц), 1,11 (т, 3H, J=7,0 Гц). MS m/z 184,8 (M+), 206,80 (M++Na).
B. Получение соединения формулы (14), изменяя R 2
Подобным образом, в соответствии со способом, описанным в примере 15A, но заменяя 6-амино-1-этил-1,3-дигидропиримидин-2,4-дион на 6-амино-1-метил-1,3-дигидропиримидин-2,4-дион, был получен 6-амино-1-метил-5-нитрозо-1,3-дигидропиримидин-2,4-дион.
C. Получение соединения формулы (14), изменяя R 2
Подобным образом, в соответствии со способом, описанным в примере 15A, но заменяя 6-амино-1-этил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (5), были получены другие соединения формулы (14).
ПРИМЕР 16
Получение соединения формулы (15)
A. Получение соединения формулы (15), где R 2 представляет собой этил
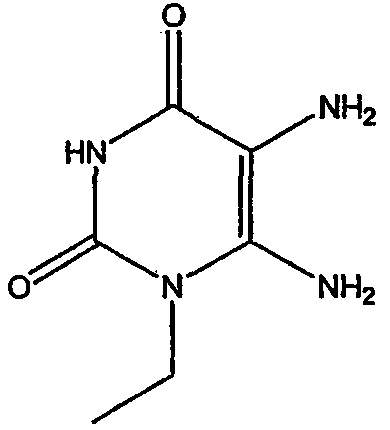
К раствору 6-амино-1-этил-5-нитрозо-1,3-дигидропиримидин-2,4-диона (3,9 г, 21,2 ммоль) в 14,5%-ном водном аммиаке (50 мл) при 50°C порциями в течение 15 минут добавляли дитионит натрия (Na2S2O4, 7,37 г, 42,4 ммоль) и смесь перемешивали в течение 20 минут. Раствор концентрировали при пониженном давлении до объема 30 мл, охлаждали до 5°C, выпавший осадок отфильтровывали и промывали холодной водой с получением 5,6-диамино-1-этил-1,3-дигидропиримидин-2,4-диона, соединения формулы (15).
1H-ЯМР (ДМСО-d6): δ 10,58 (c, 1H), 6,18 (c, 2H), 3,83 (кв., 2H, J=7,2 Гц), 2,82 (c, 2H), 1,10 (т, 3H, J=7,2 Гц).
B. Получение соединения формулы (15), изменяя R 2
Подобным образом, в соответствии со способом, описанным в примере 16A, но заменяя 6-амино-1-этил-5-нитрозо-1,3-дигидропиримидин-2,4-дион на 6-амино-1-метил-5-нитрозо-1,3-дигидропиримидин-2,4-дион, был получен 5,6-диамино-1-метил-1,3-дигидропиримидин-2,4-дион.
C. Получение соединения формулы (15), изменяя R 2
Подобным образом, в соответствии со способом, описанным в примере 16A, но заменяя 6-амино-1-этил-5-нитрозо-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (14), были получены другие соединения формулы (15).
ПРИМЕР 17
Получение соединения формулы (16)
A. Получение соединения формулы (16), где R 2 представляет собой этил, X представляет собой 1,4-пиразолил, Y представляет собой метилен и Z представляет собой 3-трифторметилфенил
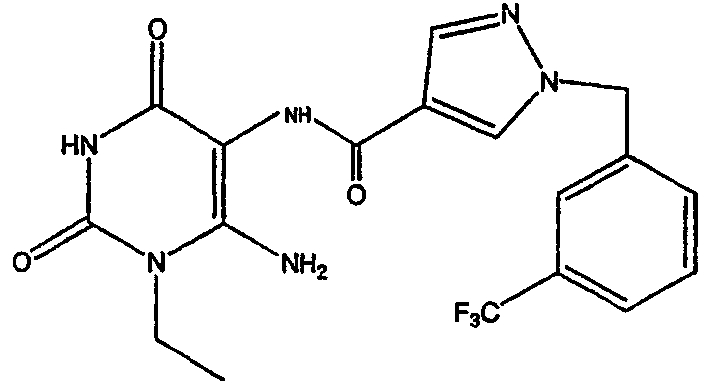
К смеси 5,6-диамино-1-этил-1,3-дигидропиримидин-2,4-диона (2 г, 11,76 ммоль) и 1-{[3-(трифторметил)фенил]}пиразол-4-карбоновой кислоты (3,5 г, 12,94 ммоль) в метаноле (50 мл) добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (2,47 г, 12,94 ммоль) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Растворитель удаляли при пониженном давлении и остаток промывали водой и метанолом. Продукт сушили в вакууме с получением N-(6-амино-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида, соединения формулы (16).
1H-ЯМР (ДМСО-d6): δ 10,60 (c, 1H), 8,50 (c, 1H), 8,39 (c, 1H), 8,01 (c, 1H), 7,72-7,50 (м, 4H), 6,69 (c, 2H), 5,50 (c, 2H), 3,87 (кв., 2H, J=7,2 Гц), 1,11 (т, 3H, 7,2 Гц); MS m/z 421 (M-).
B. Получение соединения формулы (16), изменяя R 2 , X, Y и Z
Подобным образом, в соответствии со способом, описанным в примере 17A, но заменяя 5,6-диамино-1-этил-1,3-дигидропиримидин-2,4-дион на 5,6-диамино-1-метил-1,3-дигидропиримидин-2,4-дион, был получен N-(6-амино-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид.
C. Получение соединения формулы (16), изменяя R, X, Y и Z
Подобным образом, в соответствии со способом, описанным в примере 16A, но заменяя 5,6-диамино-1-этил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (14), были получены другие соединения формулы (15).
ПРИМЕР 18
Получение соединения формулы (3)
A. Получение соединения формулы (3), где R 1 представляет собой н-пропил, R 2 представляет собой этил, X представляет собой 1,4-пиразолил, Y представляет собой метилен и Z представляет собой 3-трифторметилфенил
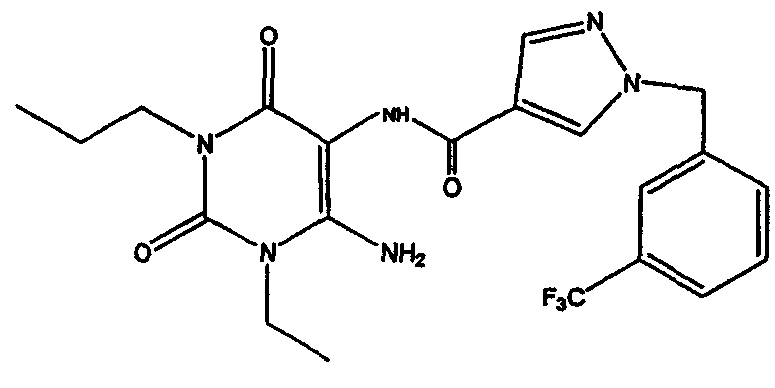
Смесь раствора N-(6-амино-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамида (1,5 г, 3,55 ммоль) в диметилформамиде (30 мл), карбоната калия (980 мг, 7,1 ммоль) и пропилйодида (724 мг, 4,26 ммоль) перемешивали при комнатной температуре в течение ночи. Добавляли воду и выпавший осадок отфильтровывали с получением N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида, соединение формулы (3), которое использовали в следующей реакции без дополнительной очистки.
1H-ЯМР (ДМСО-d6): δ 8,58 (c, 1H), 8,39 (c, 1H), 8,01 (c, 1H), 7,72-7,50 (м, 4H), 6,71 (c, 2H), 5,51 (c, 2H), 4,0-3,82 (м, 2H), 3,77-3,65 (м, 2H), 1,60-1,50 (м, 2H), 1,13 (т, 3H, J=6,8 Гц), 0,84 (т, 3H, J=7,2 Гц); MS m/z 462,9 (M-).
B. Получение соединения формулы (3), изменяя R, R, X, Y и Z
Подобным образом, в соответствии со способом, описанным в примере 18A, но заменяя N-(6-амино-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]-метил}пиразол-3-ил)карбоксамид на N-(6-амино-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)), был получен N-(6-амино-1-метил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид.
C. Получение соединения формулы (3), изменяя R 1 , R 2 , X, Y и Z
Подобным образом, в соответствии со способом, описанным в примере 18A, но, необязательно, заменяя N-(6-амино-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]-метил}пиразол-3-ил)карбоксамид на другие соединения формулы (15) и, необязательно, заменяя пропилйодид на другие соединения формулы R1Hal, были получены другие соединения формулы (3).
ПРИМЕР 19
Получение соединения формулы I
A. Получение соединения формулы I, где R 1 представляет собой н-пропил, R 2 представляет собой этил, X представляет собой 1,4-пиразолил, Y представляет собой метилен и Z представляет собой 3-трифторметилфенил
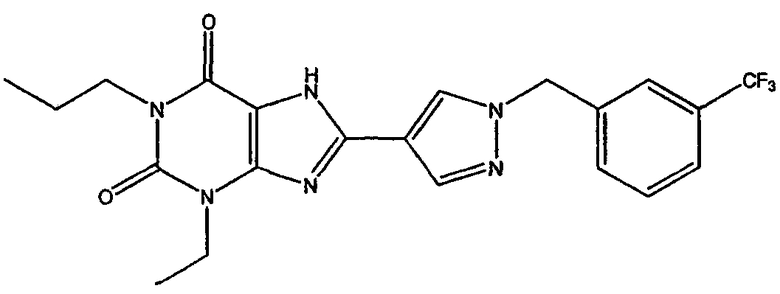
Смесь N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамида (300 мг, 464 ммоль), 20%-ного водного раствора гидроксида натрия (5 мл) и метанола (10 мл) перемешивали при 80°C в течение 3 часов. Смесь охлаждали, метанол удаляли при пониженном давлении, и оставшуюся смесь подкисляли хлористо-водородной кислотой до pH 2. Выпавший осадок отфильтровывали, промывали водой и метанолом с получением 3-этил-1-пропил-8-(1-{[3-(трифторметил)фенил]-метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-диона, соединения формулы I.
1H-ЯМР (ДМСО-d6) δ 8,57 (c, 1H), 8,15 (c, 1H), 7,60-7,75 (м, 4H), 5,54 (c, 2H), 4,05-4,50 (м, 2H), 3,87-3,91 (м, 2H), 1,55-1,64 (м, 2H), 1,25 (т, 3H, J=7,03 Гц), 0,90 (т, 3H, J=7,42 Гц); MS m/z 447,2 (M+).
ПРИМЕР 20
Исследование антагонистов A 2B
Радиолигандное связывание аденозинового рецептора A 2B
кДНК аденозинового рецептора A2B человека стабильно трансфецировали в клетки HEK-293 (обозначенные как клетки HEK-A2B). Монослои клеток HEK-A2B промывали один раз PBS и собирали в буфер, содержащий 10 мM HEPES (pH 7,4), 10 мM EDTA и ингибиторы протеазы. Эти клетки гомогенизировали в polytron в течение 1 минуты, установив на 4, и центрифугировали при 29000 g в течение 15 минут при 4°C. Клеточный осадок промывали один раз буфером, содержащим 10 мM HEPES (pH 7,4), 1 мM EDTA и ингибиторы протеаз, и ресуспендировали в том же буфере с добавлением 10% сахарозы. Замороженные аликвоты хранили при температуре -80°C.
Конкурентные анализы начинали со смешивания 14 нM 3H-ZM214385 (Tocris Cookson) с различными концентрациями исследуемых соединений и 50 мкг мембранных белков в буфере TE (50 мM Трис и 1 мM EDTA) с добавлением 1 Ед./мл аденозиндезаминазы. Образцы инкубировали в течение 90 минут, реакцию останавливали фильтрованием, используя Packard Harvester и промывали четыре раза охлажденным на льду буфером TM (10 мM Трис, 1 мM MgCl2, pH 7,4). Неспецифическое связывание определяли в присутствии 10 мкМ ZM214385. Аффинность соединений (то есть значение Ki) рассчитывали, используя программу GraphPad.
Радиолигандное связывание других аденозиновых рецепторов
кДНК аденозиновых рецепторов A1, A2A, A3 человека стабильно трансфецировали либо в клетки CHO, либо в клетки HEK-293 (обозначенные как CHO-A1, HEK-A2A, CHO-A3). Мембраны получали из тех же клеток, используя тот же протокол, как описано выше. Конкурентные анализы начинали со смешивания 0,5 нM 3H-CPX (для CHO-A1), 2 нM 3H-ZM214385 (HEK-A2A) или 0,1 нM 125I-AB-MECA (CHO-A3) с различными концентрациями исследуемых соединений и перспективных мембран в буфере TE (50 мM Трис и 1 мM EDTA CHO-A1 и HEK-A2A) или буфере TEM (50 мM Трис, 1 мM EDTA и 10 мМ MgCl2 для CHO-A3) с добавлением 1 Ед./мл аденозиндезаминазы. Образцы инкубировали в течение 90 минут, реакцию останавливали фильтрованием, используя Packard Harvester, и промывали четыре раза охлажденным на льду буфером TM (10 мМ Трис, 1 мМ MgCl2, pH 7,4). Неспецифическое связывание определяли в присутствии 1 мкМ CPX (CHO-A1), 1 мкМ ZM214385 (HEK-A2A) и 1 мкМ IB-MECA (CHO-A3). Вычисляли аффинность соединений (то есть значение Ki), используя программу GraphPad™.
Измерение cAMP
Монослой трансфецированных клеток собирали в PBS, содержащий 5 мМ EDTA. Клетки промывали один раз DMEM и ресуспендировали в DMEM, содержащем 1 Ед./мл аденозиндезаминазы, с плотностью 100000-500000 клеток/мл. Клеточную суспензию в количестве 100 мкл смешивали с 25 мкл, содержащими различные агонисты и/или антагонисты, и реакционную смесь оставляли при 37°C в течение 15 минут. Через 15 минут реакцию останавливали, добавляя 125 мкл 0,2 н HCl. Клетки центрифугировали в течение 10 минут при 1000 оборотов в минуту. Супернатант в количестве 100 мкл удаляли и ацетилировали. Измеряли концентрации cAMP в супернатантах, используя прямой анализ cAMP от Assay Design. Аденозиновые рецепторы A2A и A2B связывались с белками Gs и, таким образом, агонисты аденозинового рецептора A2A (например, CGS21680) или аденозинового рецептора A2B (например, NECA) увеличивают накопления cAMP, тогда как антагонисты этих рецепторов препятствовали увеличению накопления cAMP, вызванного агонистами. Аденозиновые рецепторы A1 и A3 связывались с белками Gi и, таким образом, агонисты аденозинового рецептора A1 (например, CPA) или аденозинового рецептора A3 (например, IB-MECA) ингибируют повышение накопления cAMP, вызванное форсколином. Антагонисты рецепторов A1 и A3 предотвращают накопление cAMP.
ПРИМЕР 21
Эффект антагониста A 2B на заживление раны на модели мыши
Использовали группы самцов мышей полученных ICR (вес 24 ±2 г) по 5 в каждой группе. В процессе исследования животных помещали по одному в каждую клетку. Под действием гексобарбитальной анастезии (90 мг/кг, IP) брили область лопатки и спины каждого животного. Для удаления кожы, включая panniculus carnosus и прилегающие ткани, использовали острый дырокол (ID 12 мм). Область раны, которую копировали на чистые пластиковые пластинки в 1, 3, 5, 7, 9 и 11 день, измеряли, используя анализатор изображений (Life Science Resources Vista, Version 3.0). Исследуемые вещества наносили местно сразу после нанесения ранения один раз в день в течение всех 10 последующих дней. Заживление раны (%) и время заживления раны наполовину (CT50) определяли путем линейной регрессии, используя Graph-Pad Prism™ (Graph Pad Software USA), и для сравнения между обработанной и группами, у которых использовали только носитель, применяли неспаренный t тест Стьюдента в каждый момент измерения на 3, 5, 7, 9 и 11 день. Различия считали статистически значимыми при уровне P<0,05.
В таблице 1 представлены данные исследования, полученные для соединения 3-этил-1-пропил-8-(1-{[3-(трифторметил)фенил]метил}-пиразол-4-ил)-1,3,7-тригидропурин-2,6-диона, используя модель мыши, рассмотренную выше. В таблице 2 представлены данные исследования, полученные используя 1,3-дипропил-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион. В каждом случае носителем для сравнения была 1,5% карбоксиметилцеллюлоза в фосфатно-солевом буфере при pH 7.
1
2
3
4
5
6
7
8
9
10
11
мкл/мышь
SEM
3,2
3,0
2,1
3,1
2,9
2,7
1,6
1,5
0,8
1,6
0,3
мкл/мышь
SEM
4,1
3,5
2,5
1,3
1,3
1,0
1,2
1,5
2,8
2,4
0,2
мкл/мышь
SEM
3,1
3,4
1,8
2,0
1,1
0,9
1,6
1,2
1,3
0,8
0,2
мкл/мышь
SEM
2,2
2,1
2,9
2,2
0,7
0,2
мкл/мышь
SEM
1,4
2,7
1,9
1,7
1,1
0,1
ПРИМЕР 22
Действие антагониста A 2B на заживление раны на модели свиньи
Заживление кожи свиньи наиболее сходно с заживлением кожи человека, и поэтому исследование, проводимое на этом животном, дает оптимальную модель для изучения механизмов заживления кожы. В этом примере действие антагониста A2B на заживление раны исследовали на трех свиньях. В качестве положительного контроля использовали PDGF (REGRANEX® (бекаплермин) в виде геля 0,01%, Ortho-McNeil Pharmaceutical, Inc., Raritan, NJ). Носителем для доставки лекарственного средства был 1,5% гель метилцеллюлозы (гель KY). Контрольные раны обрабатывали только носителем. Исследовали 3 различные дозы антагониста A2B 3-этил-1-пропил-8-(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-диона, 1 мкг/40 мкл, 4 мкг/40 мкл и 20 мкг/40 мкл.
Способ: исследование проводили на трех Йоркширских свиньях (~75-90 фунтов). В день хирургической операции делали серии резекции по всей глубине вдоль паравертебральной области на одном боку свиньи. В конце 10 дня свиней умерщвляли и все раны отделяли для гистологического и иммуногистохимического анализов.
Эффект общего стимулирования заживления в дерме (грануляционная ткань)
Как показано на фигуре 1, антагонист аденозинового рецептора A2B стимулирует образование сплошной грануляционной ткани дозозависимым образом. Существует статистическая разница между композицией плацебо и самой высокой дозой 20 мкг/40 мкл (p=0,035), между самой низкой дозой 1 мкг/40 мкл и самой высокой дозой 20 мкг/40 мкл (p=0,047) и между композицией плацебо и положительным контролем PDGF (p=0,034). Таким образом, данные исследования показывают, что дозирование композиции для нанесения с антагонистом аденозинового рецептора A2B дает желаемый биологический ответ на модели свиньи.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРЕДУПРЕЖДЕНИЯ И ЛЕЧЕНИЯ РЕМОДЕЛИРОВАНИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ И ВОСПАЛЕНИЯ ЛЕГКИХ С ПРИМЕНЕНИЕМ АНТАГОНИСТОВ АДЕНОЗИНОВЫХ РЕЦЕПТОРОВ A | 2005 |
|
RU2391103C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНТАГОНИСТОВ АДЕНОЗИНОВЫХ РЕЦЕПТОРОВ A И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2004 |
|
RU2374247C2 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ И ЛЕЧЕНИЯ БОЛЕЗНИ ПЕЧЕНИ С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ РЕЦЕПТОРА АДЕНОЗИНА A | 2007 |
|
RU2457842C2 |
| АНТАГОНИСТЫ РЕЦЕПТОРА АДЕНОЗИНА A, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2318824C2 |
| ПРОИЗВОДНЫЕ КСАНТИНА В КАЧЕСТВЕ АНТАГОНИСТОВ A АДЕНОЗИНОВОГО РЕЦЕПТОРА | 2003 |
|
RU2318825C2 |
| ПРОЛЕКАРСТВА АНТАГОНИСТОВ A РЕЦЕПТОРА АДЕНОЗИНА | 2006 |
|
RU2415858C2 |
| ПИРАЗОЛОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ-ИНГИБИТОРЫ JAK И СПОСОБЫ | 2009 |
|
RU2539568C2 |
| ФОСФОР(N)АМИДАТАЦЕТАЛЬНЫЕ И ФОСФ(ОН)АТАЦЕТАЛЬНЫЕ СОЕДИНЕНИЯ | 2019 |
|
RU2796403C2 |
| ПИРАЗОЛОПИРИДИНОВЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ НАДФН-ОКСИДАЗЫ | 2009 |
|
RU2538041C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИМИДОНА ИЛИ ПИРРОЛОТРИАЗОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2014 |
|
RU2674977C2 |
Изобретение относится к способу ускорения заживления ран у млекопитающего, включающему введение млекопитающему терапевтически эффективного количества соединения, обладающего свойствами антагониста рецептора А2B, следующей формулы:
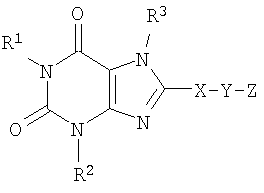 , где R1 и R2 независимо представляют собой низший алкил, R3 представляет собой водород, Х представляет собой пиразолен, Y представляет собой низший алкилен и Z представляет собой фенил или пиридил, которые могут быть замещены трифторметилом. Изобретение также относится к фармацевтической композиции. 2 н. и 5 з.п. ф-лы, 2 табл.
, где R1 и R2 независимо представляют собой низший алкил, R3 представляет собой водород, Х представляет собой пиразолен, Y представляет собой низший алкилен и Z представляет собой фенил или пиридил, которые могут быть замещены трифторметилом. Изобретение также относится к фармацевтической композиции. 2 н. и 5 з.п. ф-лы, 2 табл.
1. Способ ускорения заживления ран у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества соединения, обладающего свойствами антагониста рецептора А2B, следующей формулы:
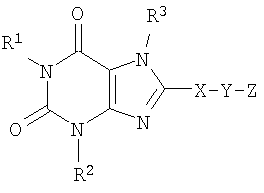
где R1 и R2 независимо представляют собой низший алкил,
R3 представляет собой водород,
Х представляет собой пиразолен,
Y представляет собой низший алкилен, и
Z представляет собой фенил или пиридил, которые могут быть замещены трифторметилом.
2. Способ по п.1, где применение является местным.
3. Способ по п.1, где рана является результатом хирургического рассечения.
4. Способ по п.1, где R1 представляет собой н-пропил, R2 представляет собой этил, Y представляет собой -СН2-, и Z представляет собой 3-(трифторметил)фенил, а именно 3-этил-1 -пропил-8-{1-[(3-трифторметил)фенил]метил}пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион.
5. Фармацевтическая композиция для ускорения заживления ран, подходящая для местного применения, содержащая терапевтически эффективное количество антагониста рецептора А2B со следующей структурой:
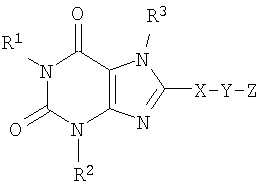
где R1 и R2 независимо представляют собой низший алкил,
R3 представляет собой водород,
Х представляет собой пиразолен,
Y представляет собой низший алкилен, и
Z представляет собой фенил или пиридил, которые могут быть замещены трифторметилом;
и фармацевтически приемлемый носитель.
6. Фармацевтическая композиция по п.5, которая представляет собой мазь, крем или гель.
7. Фармацевтическая композиция по п.5, где R1 представляет собой н-пропил, R2 представляет собой этил, Y представляет собой -СН2-, и Z представляет собой 3-(трифторметил)фенил, а именно 3-этил-1-пропил-8-{1-[(3-трифторметил)фенил]метил}пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион.
| US 2003229106 A1, 11.12.2003 | |||
| ROHOVSKY S | |||
| AND D'AMORE P | |||
| A., GROWTH FACTORS WOUND HEALING, 1997, Page(s): 8-26 | |||
| US 5932558 A, 03.08.1999 | |||
| RU 94028283 A1, 27.08.1996 | |||
| FEOKTISTOV I.; ET AL, PHARMACOLOGICAL REVIEWS, 1997 | |||
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| Feoktistov I.; Biaggioni I.; Polosa R.; Holgate S | |||
| Т., TRENDS IN PHARMACOLOGICAL SCIENCES, 1998, Vol:19, Nr:4, Page(s): 148-153. | |||
Авторы
Даты
2010-03-27—Публикация
2005-08-30—Подача