Область техники, к которой относится изобретение
Пиразолопиримидиновые соединения, ингибиторы JAK киназ, а также композиции, содержащие такие соединения, и способы их применения, включая, но не ограничиваясь этим, in vitro, in situ и in vivo диагностику или лечение клеток млекопитающих.
Предпосылки изобретения
Цитокиновые пути опосредуют широкий ряд биологических функций, включая многие аспекты воспаления и иммунитета. Janus киназы (JAK), включая JAK1, JAK2, JAK3 и TYK2, представляют собой цитоплазматические протеинкиназы, которые ассоциированы с цитокиновыми рецепторыми типа I и типа II и регулируют сигнальную трансдукцию цитокинов. Связывание цитокинов с родственными рецепторами запускает активацию связанных с рецепторами JAKs, и это приводит к JAK-опосредованному фосфорилированию тирозина белков сигнального трансдуктора и активатора транскрипции (STAT) и, в конечном счете, к транскрипционной активации специфических наборов генов (Schindler et al., 2007, J Biol. Chem. 282:20059-63). JAK1, JAK2 и TYK2 демонстрируют широкое разнообразие генной экспрессии, тогда как экспрессия JAK3 ограничена лейкоцитами. Рецепторы цитокинов типично являются функциональными в виде гетеродимеров, и, как результат, более чем один тип JAK киназ обычно связывается с комплексами цитокиновых рецепторов. Специфические JAKs, связанные с различными комплексами цитокиновых рецепторов, были определены во многих случаях через генетические исследования и подтверждены другими экспериментальными данными.
JAK1 изначально была идентифицирована в скрининговом анализе на новые киназы (Wilks A.F., 1989, Proc. Natl. Acad. Sci. U.S.A. 86:1603-1607). Генетические и биохимические исследования показали, что JAK1 функционально и физически связана с комплексами рецепторов интерферона типа I (например, IFNальфа), интерферона типа II (например, IFNгамма), IL-2 и IL-6 цитокина (Kisseleva et al., 2002, gene 285:1-24; Levy et al., 2005, Nat. Rev. Mol. Cell Biol. 3:651-662; O'Shea et al., 2002, Cell, 109 (suppl):S121-S131). Мыши с JAK1-“нокаутом” умирают перинатально из-за дефектов сигнала LIF рецептора (Kisseleva et al., 2002, gene 285:1-24; O'Shea et al., 2002, Cell, 109 (suppl.):S121-S131). Анализ тканей, полученных от мышей с JAK1-“нокаутом”, показал критическую роль этих киназ в IFN, IL-10, IL-2/IL-4 и IL-6 путях. Гуманизированное моноклональное антитело, мишенью которого является IL-6 путь (Тоцилизумаб), недавно было одобрено Европейской Комиссией для лечения ревматоидного артрита от умеренной до тяжелой формы (Scheinecker et al., 2009, Nat. Rev. Drug Discov. 8:273-274).
Миелопролиферативные расстройства (MPD) происходят из гематопоэтических стволовых клеток и первоначально проявляются в повышенных уровнях в основном нормальных клеток миелоидной линии. Может быть сделано основное разграничение между Philadelphia хромосома-положительными (Ph+) и Philadelphia хромосома-отрицательными (Ph-) расстройствами. Ph+ MPD приводит к хроническому миелогенному лейкозу и приводится в действие bcr-abl гибридным белком, который управляет пролиферацией гематопоэтических клеток. Ph-MPD далее можно подразделить на три отдельных расстройства по соответствующим разновидностям, в именно, истинную полицитемию (PV), эссенциальную тромбоцитемию (ET) и идиопатический миелофиброз (IMF). Dameshek, W., Blood 6(4):372-375 (1951). Пациенты с PV страдают от большого количества эритроцитов, тогда как пациенты с ET имеют высокие уровни циркулирующих тромбоцитов. Если их не лечить, оба заболевания могут привести к угрожающим жизни тромботическим событиям. Пациенты с IMF страдают фиброзом костного мозга с последующим смещением гематопоэза в селезенку и печень. Это, прежде всего, приводит к спленомегалии, с последующей анемией на поздних стадиях этого заболевания, поскольку гематопоэз становится непродуктивным. Эти пациенты имеют плохой прогноз, хотя в определенных условиях их можно вылечить при помощи аллогенного трансплантата костного мозга. Нет никакого известного лечения для Ph-MPD заболеваний.
Активирующую мутацию в тирозиновой киназе JAK2 связывают с с PV, ET, IMF и другими заболеваниями. Практически все пациенты с PV и около 50% пациентов с ET и IMF имеют эту мутацию. Morgan, K.J. and Gilliland, D.G., Ann. Rev. Med. 59:213-222 (2008). Такая мутация представляет собой замену валина фенилаланином в положении 617 в зрелом человеческом JAK2 белке (V617F). Дополнительные мутации в JAK2, обычно присутствующие в экзоне 12 и называемые экзон 12 мутациями, также имеют активирующий эффект и могут приводить к MPD. Кроме того, T875N мутацию связывают с мегакариобластным лейкозом. Наконец, JAK2 гибридные белки были идентифицированы в острых лейкозах.
V617F мутация имеет функциию активации JAK2, что приводит к MPD. В не-мутированной форме, JAK2 связывается с цитокиновыми рецепторами (т.е. EPO-R, TPO-R и другие) и становится активированным только в том случае, когда сам рецептор активируется путем стимуляции родственным цитокиновым лигандом. Гематопоэз в целом затем регулируется через присутствие лигандов. Например, цитокин эритропоэтин (EPO) стимулирует гематопоэтические клетки-предшественники, приводя к образованию эритроцитов. Мутация, которая разобщает JAK2 активацию от EPO, поэтому приводит к повышенным уровням эритроцитов. Аналогично этому, тромбопоэтин (TPO) регулирует рост тромбоцитов путем связывания с TPO-R, который, в свою очередь, также осуществляет передачу сигнала через JAK2. Таким образом, повышенные уровни тромбоцитов также могут быть результатом аберрантной активации JAK2.
Необходимы соединения, которые ингибируют JAK2, что могло бы быть благоприятным для пациентов с JAK2-управляемыми миелопролиферативными расстройствами, а также другими заболеваниями, которые реагируют на ингибирование JAK2. Такие заболевания включают заболевания, при которых JAK2 активируется посредством мутации или амплификации, а также заболевания, при которых активация JAK2 является частью онкогенного каскада. Множество различных линий опухолевых клеток и образцов опухолей имеют высокие уровни фосфо-STAT3, который является геном-мишенью для JAK2.
JAK3 связывается исключительно с гамма цепью, общей для цитокиновых рецепторов, которая присутствует в IL-2, IL-4, IL-7, IL-9, IL-15 и IL-21 комплексах цитокиновых рецепторов. JAK3 является критической для развития и пролиферации лимфоидных клеток, и мутации в JAK3 приводят к тяжелому комбинированному иммунодефициту (SCID) (O'Shea et al, 2002, Cell, 109 (suppl):S121-S131). На основании ее роли в регуляции лимфоцитов, JAK3 и JAK3-опосредованные пути являются мишенью при иммуносупрессивных показаниях (например, отторжение трансплантата и ревматоидный артрит) (Baslund et al., 2005, Arthritis & Rheumatism 52:2686-2692; Changelian et al., 2003, Science 302:875-878).
TYK2 связывается с комплексами цитокиновых рецепторов интерферона типа I (например, IFNальфа), IL-6, IL-10, IL-12 и IL-23 (Kisseleva et al., 2002, Gene 285:1-24; Watford, W.T. & O'Shea, J.J., 2006, Immunity 25:695-697). Соответственно этому, первичные клетки, выделенные у человека с дефицитом TYK2, являются дефектными в том, что касается передачи сигналов интерферона типа I, IL-6, IL-10, IL-12 и IL-23. Полностью человеческое моноклональное антитело, мишенью которого является общая p40 субъединица IL-12 и IL-23 цитокинов (Ustekinumab), недавно было одобрено Европейской Комиссией для лечения умеренной до тяжелой формы бляшковидного псориаза (Krueger et al., 2007, N. Engl. J. Med. 356:580-92; Reich et al., 2009, Nat. Rev. Drug Discov. 8:355-356). Кроме того, антитело, прицельно направленное на IL-12 и IL-23 пути, находится в стадии клинических испытаний для лечения болезни Крона (Mannon et al., 2004, N. Engl. J. Med. 351:2069-79).
Сущность изобретения
Один вариант осуществления включает соединение формулы I:
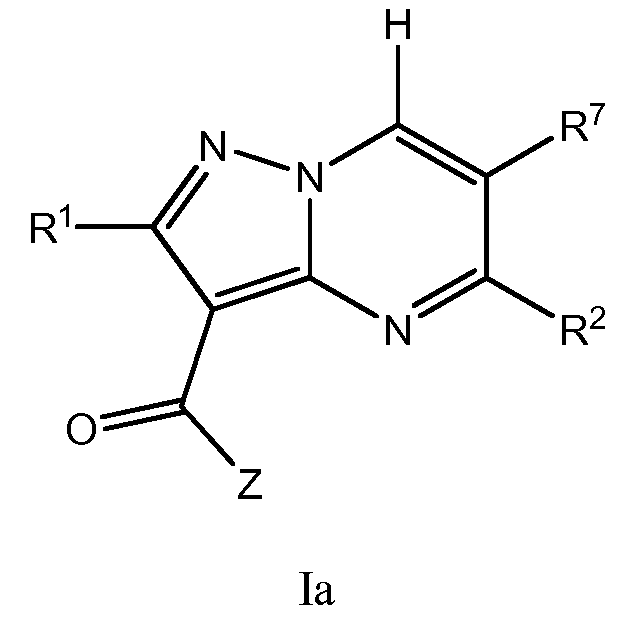
его энантиомеры, диастереомеры или фармацевтически приемлемые соли, где R1, R2, R7 и Z имеют значения, определенные в настоящей заявке.
Один вариант осуществления включает соединение формулы I:
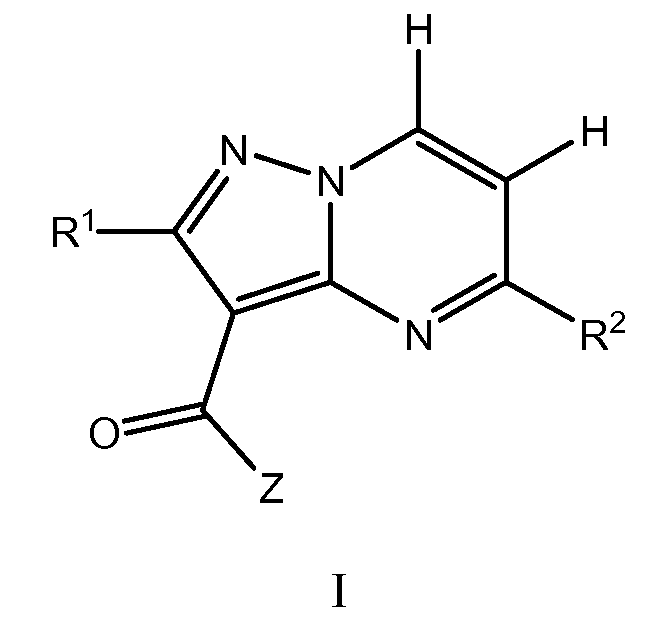
его энантиомеры, диастереомеры или фармацевтически приемлемые соли, где R1, R2, и Z имеют значения, определенные в настоящей заявке.
Другой вариант осуществления включает фармацевтическую композицию, которая включает соединение формулы Ia и фармацевтически приемлемый носитель, адъювант или наполнитель.
Другой вариант осуществления включает фармацевтическую композицию, которая включает соединение формулы I и фармацевтически приемлемый носитель, адъювант или наполнитель.
Другой вариант осуществления включает способ лечения или уменьшения тяжести заболевания или состояния, реагирующего на ингибирование активности JAK киназы у пациента, включающий введение пациенту терапевтически эффективного количества соединения формулы Ia.
Другой вариант осуществления включает способ лечения или уменьшения тяжести заболевания или состояния, реагирующего на ингибирование активности JAK киназы у пациента. Способ включает введение пациенту терапевтически эффективного количества соединения формулы I.
Другой вариант осуществления включает набор для лечения заболевания или расстройства, реагирующего на ингибирование JAK киназы. Набор включает первую фармацевтическую композицию, включающую соединение формулы I, и инструкции по применению. В другом варианте осуществления, набор включает первую фармацевтическую композицию, включающую соединение формулы Ia, и инструкции по применению.
Подробное описание изобретения
Далее делается подробная ссылка на некоторые варианты осуществления, примеры которых проиллюстрированы в сопровождающих их структурах и формулах. Хотя настоящее изобретение будет описано в связи с различными вариантами осуществления, предполагается, что настоящее изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения, определяемый формулой изобретения. Специалистам в данной области должны быть известны способы и вещества, подобные или эквивалентные тем, которые описаны в настоящей заявке, которые можно было бы использовать при практическом осуществлении настоящего изобретения.
Термин "алкил" относится к насыщенному линейному или разветвленному одновалентному углеводородному радикалу, при этом алкильный радикал, необязательно, может быть замещен независимо одним или несколькими заместителями, описанными в настоящей заявке. В одном примере, алкильный радикал включает от одного до восемнадцати атомов углерода (C1-C18). В других примерах, алкильный радикал представляет собой C0-C6, C0-C5, C0-C3, C1-C12, C1-C1O, C1-C8, C1-C6, C1-C5, C1-C4, или C1-C3. Примеры алкильных групп включают метил (Me, -CH3), этил (Et, -CH2CH3), 1-пропил (n-Pr, н-пропил, -CH2CH2CH3), 2-пропил (i-Pr, изопропил, -CH(CH3)2), 1-бутил (n-Bu, н-бутил, -CH2CH2CH2CH3), 2-метил-1-пропил (i-Bu, изобутил, -CH2CH(CH3)2), 2-бутил (s-Bu, втор-бутил, -CH(CH3)CH2CH3), 2-метил-2-пропил (t-Bu, трет-бутил, -C(CH3)3), 1-пентил (н-пентил, -CH2CH2CH2CH2CH3), 2-пентил (-CH(CH3)CH2CH2CH3), 3-пентил (-CH(CH2CH3)2), 2-метил-2-бутил (-C(CH3)2CH2CH3), 3-метил-2-бутил (-CH(CH3)CH(CH3)2), 3-метил-1-бутил (-CH2CH2CH(CH3)2), 2-метил-1-бутил (-CH2CH(CH3)CH2CH3), 1-гексил (-CH2CH2CH2CH2CH2CH3), 2-гексил (-CH(CH3)CH2CH2CH2CH3), 3-гексил (-CH(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентил (-C(CH3)2CH2CH2CH3), 3-метил-2-пентил (-CH(CH3)CH(CH3)CH2CH3), 4-метил-2-пентил (-CH(CH3)CH2CH(CH3)2), 3-метил-3-пентил (-C(CH3)(CH2CH3)2), 2-метил-3-пентил (-CH(CH2CH3)CH(CH3)2), 2,3-диметил-2-бутил (-C(CH3)2CH(CH3)2), 3,3-диметил-2-бутил (-CH(CH3)C(CH3)3, 1-гептил и 1-октил.
Термин "алкенил" относится к линейному или разветвленному одновалентному углеводородному радикалу, по меньшей мере, с одним участком ненасыщенности, т.е. углерод-углеродной двойной связью, при этом алкенильный радикал, необязательно, может быть замещен независимо одним или несколькими заместителями, описанными в настоящей заявке, и включает радикалы, имеющие "цис" и "транс" ориентации или, альтернативно, "E" и "Z" ориентации. В одном примере, алкенильный радикал включает от двух до восемнадцати атомов углерода (C2-C18). В других примерах, алкенильный радикал представляет собой C2-C12, C2-C1O, C2-C8, C2-C6 или C2-C3. Примеры включают, но не ограничиваются этим, этенил или винил (-CH=CH2), проп-1-енил (-CH=CHCH3), проп-2-енил (-CH2CH=CH2), 2-метилпроп-1-енил, бут-1-енил, бут-2-енил, бут-3-енил, бута-1,3-диенил, 2-метилбута-1,3-диен, гекс-1-енил, гекс-2-енил, гекс-3-енил, гекс-4-енил и гекс-1,3-диенил.
Термин "алкинил" относится к линейному или разветвленному одновалентному углеводородному радикалу, по меньшей мере, с одним участком ненасыщенности, т.е. углерод-углеродной тройной связью, при этом алкинильный радикал, необязательно, может быть замещен независимо одним или несколькими заместителями, описанными в настоящей заявке. В одном примере, алкинильный радикал включает от двух до восемнадцати атомов углерода (C2-C18). В других примерах, алкинильный радикал представляет собой C2-C12, C2-C10, C2-C8, C2-C6 или C2-C3. Примеры включают, но не ограничиваются этим, этинил (-C≡CH), проп-1-инил (-C≡CCH3), проп-2-инил (пропаргил, -CH2C≡CH), бут-1-инил, бут-2-инил и бут-3-инил.
"Циклоалкил" относится к неароматической насыщенной или частично ненасыщенной углеводородной кольцевой группе, при этом циклоалкильная группа, необязательно, может быть замещена независимо одним или несколькими заместителями, описанными в настоящей заявке. В одном примере циклоалкильная группа включает от 3 до 12 атомов углерода (C3-C12). В других примерах циклоалкил представляет собой C3-C8, C3-C1O или C5-C10. В других примерах, циклоалкильная группа, в качестве моноцикла, представляет собой C3-C9, C3-C6 или C5-C6. В другом примере циклоалкильная группа, в качестве бицикла, представляет собой C7-C12. В другом примере циклоалкильная группа, в качестве спиросистемы, представляет собой C5-C12. Примеры моноциклического циклоалкила включают циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил и циклододецил. Иллюстративные структуры бициклических циклоалкилов, содержащих от 7 до 12 кольцевых атомов, включают, но не ограничиваются этим, [4,4], [4,5], [5,5], [5,6] или [6,6] кольцевые системы. Иллюстративные примеры связанных мостиковой связью бициклических циклоалкилов включают, но не ограничиваются этим, бицикло[2.2.1]гептан, бицикло[2.2.2]октан и бицикло[3.2.2]нонан. Примеры спироциклоалкила включают, спиро[2.2]пентан, спиро[2.3]гексан, спиро[2.4]гептан, спиро[2.5]октан и спиро[4.5]декан.
"Арил" относится к циклической ароматической углеводородной группе, необязательно замещенной независимо одним или несколькими заместителями, описанными в настоящей заявке. В одном примере арильная группа включает 6-20 атомов углерода (C6-C20). В другом примере арильная группа представляет собой C6-C10. В другом примере, арильная группа представляет собой C6-C9. В другом примере арильная группа представляет собой C6 арильную группу. Арил включает бициклические группы, включающие ароматическое кольцо с конденсированным не-ароматическим или частично насыщенным кольцом. Бициклические арильные группы могут быть присоединены через ароматическое, не-ароматическое или частично насыщенное кольцо, например, как показано ниже:
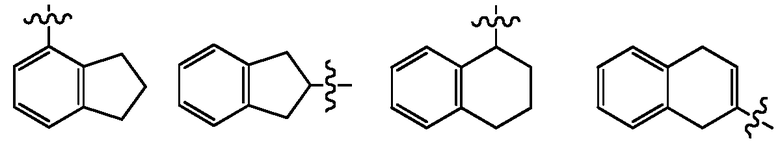
Примеры арильных групп включают, но не ограничиваются этим, фенил, нафталинил, антраценил, инденил, инданил, 1,2-дигидронафталинил и 1,2,3,4-тетрагидронафтил. В одном примере, арил включает фенил.
"Галоген" относится к F, Cl, Br или I.
"Гетероциклил" относится к насыщенной, частично ненасыщенной (т.е. содержащей один или несколько двойных и/или тройных связей в кольце) или ароматической (гетероарил) циклической группе, в которой, по меньшей мере, один кольцевой атом представляет собой гетероатом, независимо выбранный из азота, кислорода, фосфора и серы, при этом остальные кольцевые атомы представляют собой атомы углерода. Гетероциклильная группа, необязательно, может быть замещена одним или несколькими заместителями, описанными ниже. В одном варианте осуществления гетероциклил включает моноциклы или бициклы, содержащие от 1 до 9 углеродных кольцевых атомов (C1-C9), при этом остальные кольцевые атомы представляют собой гетероатомы, выбранные из N, O, S и P. В других примерах гетероциклил включает моноциклы или бициклы, содержащие C1-C5, C3-C5, C3-C9 или C4-C5, при этом остальные кольцевые атомы представляют собой гетероатомы, выбранные из N, O, S и P. В другом варианте осуществления, гетероциклил включает моноциклические 3-, 4-, 5-, 6- и 7-членные кольца, содержащие один или несколько гетероатомов, независимо выбранных из N, O и S, при этом остальные кольцевые атомы представляют собой атомы углерода. В другом варианте осуществления гетероциклил включает моноциклические 5-, 6- и 7-членные кольца, содержащие один или несколько гетероатомов, независимо выбранных из N, O, S и P. Примеры бициклических систем включают, но не ограничиваются этим, [3,5], [4,5], [5,5], [3,6], [4,6], [5,6], или [6,6] системы. В другом варианте осуществления гетероциклил включает связанные мостиковой связью кольцевые системы, имеющие [2.2.1], [2.2.2], [3.2.2] и [4.1.0] структуры и содержащие от 1 до 3 гетероатомов, выбранных из N, O, S и P. В другом варианте осуществления гетероциклил включает спирогруппы, содержащие от 1 до 3 гетероатомов, выбранных из N, O, S и P. Гетероциклильная группа может быть связанной по углероду группой или связанной по гетероатому группой. "Гетероциклил" включает гетероциклильную группу, конденсированную с циклоалкилом. "Гетероциклил" также включает гетероциклильную группу, конденсированную с арильной или гетероарильной группой. Дополнительные примеры гетероциклильных групп включают 2,3-дигидробензофуранил, октагидробензофуранил, 1,3-дигидроизобензофуран, хроманил, изохроманил, тиохроманил, изотиохроманил, 2,3-дигидробензо[b]тиофен, 2,3-дигидробензо[b]тиофен 1,1-диоксид, 1,3-дигидробензо[c]тиофен, 1,3-дигидробензо[c]тиофен 2,2-диоксид, изоиндолинил, индолинил и 2,3-дигидро-1Н-пирроло[2,3-b]пиридин.
Иллюстративные гетероциклильные группы включают, но не ограничиваются этим, оксиранил, азиридинил, тииранил, азетидинил, оксетанил, тиетанил, 1,2-дитиетанил, 1,3-дитиетанил, пирролидинил, пиперидинил, морфолинил, тиоморфолинил, тиоксанил, пиперазинил, гомопиперазинил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, дигидротиенил, дигидропиранил, дигидрофуранил, тетрагидрофуранил, тетрагидротиенил, тетрагидротиенил 1,1-диоксид, тетрагидротиенил 1-оксид, тетрагидропиранил, тетрагидротиопиранил, 1-пирролинил, 2-пирролинил, 3-пирролинил, индолинил, 2H-пиранил, 4H-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, пиразолидинил, дитианил, дитиоланил, пиразолидинилимидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил и азабицикло[2.2.2]гексанил. Примерами гетероциклильной группы, где кольцевой атом замещен оксо (=О), являются пиримидинонил и 1,1-диоксо-тиоморфолинил. Гетероциклильные группы в настоящей заявке необязательно замещены независимо одним или несколькими заместителями, описанными в настоящей заявке. Гетероциклы описаны в Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W. A. Benjamin, New York, 1968), в частности, главы 1, 3, 4, 6, 7 и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 to present), в частности, тома 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. (1960) 82:5566.
Термин "гетероарил" относится к ароматическому карбоциклическому радикалу, в котором, по меньшей мере, один кольцевой атом представляет собой гетероатом, независимо выбранный из азота, кислорода и серы, при этом остальные кольцевые атомы представляют собой атомы углерода. Гетероарильные группы, необязательно, могут быть замещены одним или несколькими заместителями, описанными в настоящей заявке. В одном примере, гетероарильная группа содержит от 1 до 9 углеродных кольцевых атомов (C1-C9). В других примерах, гетероарильная группа представляет собой C1-C5, C3-C5 или C4-C5. В одном варианте осуществления иллюстративные гетероарильные группы включают моноциклические ароматические 5-, 6- и 7-членные кольца, содержащие один или несколько гетероатомов, независимо выбранных из азота, кислорода и серы. В другом варианте осуществления иллюстративные гетероарильные группы включают конденсированные кольцевые системы, включающие до 9 атомов углерода, где, по меньшей мере, одно ароматическое кольцо содержит один или несколько гетероатомов, независимо выбранных из азота, кислород и серы. "Гетероарил" включает гетероарильные группы, конденсированные с арильной, циклоалкильной или другой гетероциклильной группой. Примеры гетероарильных групп включают, но не ограничиваются этим, пиридинил, имидазолил, имидазопиридинил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил.
В некоторых вариантах осуществления, гетероциклильная или гетероарильная группа является C-присоединенной. В качестве примера, а не ограничения, связанные по углероду гетероциклилы включают связывающиеся структуры в положении 2, 3, 4, 5 или 6 пиридина, положении 3, 4, 5 или 6 пиридазина, положении 2, 4, 5 или 6 пиримидина, положении 2, 3, 5 или 6 пиразина, положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, положении 2, 4 или 5 оксазола, имидазола или тиазола, положении 3, 4 или 5 изоксазола, пиразола или изотиазола, положении 2 или 3 азиридина, положении 2, 3 или 4 азетидина, положении 2, 3, 4, 5, 6, 7 или 8 хинолина или положении 1, 3, 4, 5, 6, 7 или 8 изохинолина. (2-пиридил, 3-пиридил, 4-пиридил, 5-пиридил, 6-пиридил).
В некоторых вариантах осуществления, гетероциклильная или гетероарильная группа является N-присоединенной. В качестве примера, а не ограничения, связанная по азоту гетероциклильная или гетероарильная группа включает связывающиеся структуры в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1H-индазола, положении 2 изоиндола или изоиндолина, положении 4 морфолина и положении 9 карбазола или β-карболина.
"Лечить" и "лечение" включает как терапевтическое лечение, так и профилактические или превентивные меры, где целью является предотвращение или замедление (уменьшение) нежелательного физиологического изменения или расстройства, такого как развитие или распространение рака. Для целей настоящего изобретения, благоприятные или желательные клинические результаты включают, но не ограничиваются этим, облегчение симптомов, уменьшение степени заболевания, стабилизация (т.е. не ухудшение) состояния заболевания, отсрочка или замедление прогрессирования заболевания, облегчение или временное облегчение болезненного состояния и ремиссию (частичную или полную), независимо от того, являются они определяемые или неопределяемыми. "Лечение" также может означать продление периода выживания по сравнению с ожидаемым периодом выживания, если не принимать лечение. Нуждающиеся в лечении включают тех, у которых уже имеется состояние или расстройство, а также тех, которые предрасположены к развитию такого состояния или расстройства (например, через генетическую мутацию), или тех, у которых следует предотвратить такое состояние или расстройство.
Фраза "терапевтически эффективное количество" означает такое количество соединения по настоящему изобретению, которое (i) лечит или предотвращает конкретное заболевание, состояние или расстройство, (ii) облегчает, уменьшает или устраняет один или несколько симптомов конкретного заболевания, состояния или расстройства или (iii) предотвращает или замедляет возникновение одного или нескольких симптомов конкретного заболевания, состояния или расстройства, описанного в настоящей заявке. В одном варианте осуществления терапевтически эффективное количество представляет собой количество, достаточное для уменьшения или облегчения симптомов расстройства, реагирующего на модуляцию JAK2 киназы. В случае рака, терапевтически эффективное количество лекарственного средства может уменьшать количество раковых клеток; уменьшать размер опухоли; ингибировать (т.е. замедлять до определенной степени и, предпочтительно, останавливать) инфильтрацию раковых клеток в периферийные органы; ингибировать (т.е. замедлять до определенной степени и, предпочтительно, останавливать) метастазы опухоли; ингибировать, до определенной степени, рост опухоли; и/или облегчать до определенной степени один или несколько симптомов, связанных с раком. В той степени, в которой лекарственное средство может предотвращать рост и/или убивать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксичным. Для терапии рака, эффективность можно измерить, например, путем определения времени до прогрессирования заболевания (TTP) и/или определения скорости ответа (RR). В одном варианте осуществления терапевтически эффективное количество представляет собой количество, достаточное для уменьшения или облегчения симптомов расстройства, реагирующего на модуляцию JAK1 TYK2 или JAK3 киназы. В случае иммунологических расстройств, терапевтически эффективное количество представляет собой количество, достаточное для уменьшения или облегчения аллергического расстройства, симптомов аутоиммунного и/или воспалительного заболевания или симптомов острой воспалительной реакции (например, астмы). В некоторых вариантах осуществления, терапевтически эффективное количество представляет собой количество химической структуры, описанной в настоящей заявке, достаточное для существенного снижения активности или количества B-клеток.
Термин "ингибирование" указывает существенное снижение базовой линии биологической активности или процесса. "Ингибирование активности JAK киназы" относится к снижению активности JAK1, JAK2, JAK3 или TYK2 киназы в ответ на присутствие, по меньшей мере, одной химической структуры, описанной в настоящей заявке, по сравнению с активностью JAK1, JAK2, JAK3 или TYK2 киназы в отсутствие, по меньшей мере, одной химической структуры. Ингибирование активности JAK киназы также относится к наблюдаемому ингибированию активности JAK киназы в биохимическом анализе определения активности JAK киназы, таком как анализы, описанные в настоящей заявке.
Термин "биодоступность" относится к системной доступности (т.е. уровням в крови/плазме) данного количества лекарственного средства, вводимого пациенту. Биодоступность является абсолютным термином, который указывает измерение как времени (скорость), так и общего количества (уровень) лекарственного средства, которое достигает общего кровотока из вводимой лекарственной формы.
Термины "рак" и "раковый" относятся к, или описывают, физиологическому состоянию у млекопитающих, которое типично характеризуется нерегулируемым клеточным ростом. "Опухоль" включает одну или несколько раковых клеток. Примеры рака включают, но не ограничиваются этим, карциному, лимфому, бластому, саркому и лейкоз или лимфоидные опухоли. Более конкретные примеры таких типов рака включают сквамозно-клеточный рак (например, эпителиальный сквамозно-клеточный рак), рак легкого, включая мелкоклеточный рак легкого, не-мелкоклеточный рак легкого (“NSCLC”), аденокарциному легкого и сквамозную карциному легкого, рак брюшной полости, гепатоклеточный рак, желудочный рак или рак желудка, включая желудочно-кишечный рак, рак поджелудочной железы, глиобластому, цервикальный рак, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, ректальный рак, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки или почечный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, анальную карциному, карциному полового члена, а также рак головы и шеи.
"Химиотерапевтическое средство" представляет собой химическое соединение, полезное для лечения рака. Примеры химиотерапевтических средств включают Эрлотиниб (TARCEVA®, Genentech, Inc/OSI Pharm.), Трастузумаб (HERCEPTIN®, Genentech, Inc.); бевацизумаб (AVASTIN®, Genentech, Inc.); Ритуксимаб (RITUXAN®, Genentech, Inc./Biogen Idee, Inc.), Бортезомиб (VELCADE®, Millennium Pharm.), Фулвестрант (FASLODEX®, AstraZeneca), Сутент (SU11248, Pfizer), Летрозол (FEMARA®, Novartis), Иматиниб мезилат (GLEEVEC®, Novartis), PTK787/ZK 222584 (Novartis), Оксалиплатин (Eloxatin®, Sanofi), 5-FU (5-фторурацил), Лейковорин, Рапамицин (Sirolimus, RAPAMUNE®, Wyeth), Лапатиниб (GSK572016, Glaxo Smith Kline), Лонафарниб (SCH 66336), Сорафениб (BAY43-9006, Bayer Labs) и Гефитиниб (IRESSA®, AstraZeneca), AG1478, AG1571 (SU 5271; Sugen), алкилирующие средства, такие как тиотепа и CYTOXAN® циклосфосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогенины (в частности, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адоцелезин, карцелезин и бицелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотные иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, мехлоретамин оксид гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацилиприт; нитромечевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности, калихеамицин гамма1I и калихеамицин omegaI1 (Angew Chem. Intl. Ed. Engl. (1994) 33:183-186); динемицин, включая динемицин A; бисфосфонаты, такие как клодронат; эсперамицин; а также неокарциностатин хромофор и родственные хромопротеин-энедииновые антибиотические хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицинис, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-1-норлейцин, АДРИАМИЦИН® (доксорубицин), морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и деоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; анти-метаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; анти-адреналовые средства, такие как аминоглутетимид, митотан, трилостан; средство, восполняющее недостаток фолиевой кислоты, такое как фролиниловая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиниум ацетат; эпотилон; этоглуцид; галлий нитрат; гидроксимочевину; лентинан; лонидаинин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лосоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (в частности, Т-2 токсин, верракурин A, роридин A и ангвидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксоиды, например, TAXOL® (паклитаксел; Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE® (без Кремофора), полученные инженерным путем на основе альбумина композиции наночастиц паклитаксела (American Pharmaceutical Partners, Schaumberg, Illinois) и ТАКСОТЕР® (доксетаксел; Rhόne-Poulenc Rorer, Antony, France); хлоранбуцил; ГЕМЗАР® (гемцитабин); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; НАВЕЛБИН® (винорелбин); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; CPT-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; и фармацевтически приемлемые соли, кислоты и производные любого из перечисленных выше.
Также включены в определение "химиотерапевтическое средство" следующие:(i) анти-гормональные средства, которые действуют как регулирующие или ингибирующие действие гормонов на опухоли, такие как анти-эстрогены и селективные модуляторы рецепторов эстрогена (SERMs), включая, например, тамоксифен (включая NOLVADEX®; тамоксифен цитрат), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и ФАРЕСТОН® (торемифин цитрат); (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует продукцию эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, MEGASE® (мегестрол ацетат), АРОМАЗИН® (эксеместан; Pfizer), форместание, фадрозол, РИВИЗОР® (ворозол), ФЕМАРА® (летрозол; Novartis) и АРИМИДЕКС® (анастрозол; AstraZeneca); (iii) анти-адрогены, такие как флутамид, нилутамид, бекалутамид, леупролид и госерелин; а также троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); (iv) ингибиторы протеинкиназы; (v) ингибиторы липид-киназы; (vi) антисмысловые олигонуклеотиды, в частности, те, которые ингибируют экспрессию генов в сигнальных путях, вовлеченных в аберрантную клеточную пролиферацию, такие как, например, PKC-альфа, Raf и H-Ras; (vii) рибозимы, такие как ингибиторы VEGF (например, ANGIOZYME®), и (viii) вакцины, такие как генно-терапевтические вакцины, например, АЛЛОВЕКТИН®, ЛЕУВЕКТИН® и ВАКСИД®; ПРОЛЕЙКИН® rIL-2; ингибитор топоизомеразы 1, такой как ЛУРТОТЕКАН®; АБАРЕЛИКС® rmRH; (ix) анти-ангиогенные средства; и (x) фармацевтически приемлемые соли, кислоты и производные любого из перечисленных выше.
Дополнительные химиотерапевтические средства включают терапевтические антитела, такие как алемтузумаб (Campath), цетуксимаб (ERBITUX®, Imclone), панитумумаб (VECTIBIX®, Amgen), пертузумаб (OMNITARG®, 2C4, Genentech), тозитумумаб (Bexxar, Corixia) и конъюгат антитела и лекарственного средства, гемтузумаб озогамицин (MYLOTARG®, Wyeth). Дополнительные гуманизированные моноклональные антитела с терапевтическим потенциалом в качестве средств в сочетании с соединениями по настоящему изобретению включают: аполизумаб, азелизумаб, атлизумаб, бапинеузумаб, биватузумаб мертанзин, кантузумаб мертанзин, цеделизумаб, цертолизумаб пегол, цидфузитузумаб, цидтузумаб, даклизумаб, экулизумаб, эфализумаб, эпратузумаб, эрлизумаб, фелвизумаб, фонтолизумаб, гемтузумаб озогамицин, инотузумаб озогамицин, ипилимумаб, лабетузумаб, линтузумаб, матузумаб, меполизумаб, мотавизумаб, мотовизумаб, натализумаб, нимотузумаб, ноловизумаб, нумавизумаб, окрелизумаб, омализумаб, паливизумаб, пасколизумаб, пекфузитузумаб, пектузумаб, пекселизумаб, раливизумаб, ранибизумаб, ресливизумаб, реслизумаб, резивизумаб, ровелизумаб, руплизумаб, сибротузумаб, сиплизумаб, сонтузумаб, текатузумаб тетраксетан, тадоцизумаб, тализумаб, тефибазумаб, тоцилизумаб, торализумаб, тукотузумаб целмолейкин, тукуситузумаб, умавизумаб, уртоксазумаб, устекинумаб, визилизумаб и анти-интерлейкин-12 (ABT-874/J695, Wyeth Research and Abbott Laboratories), который представляет собой рекомбинантное, с исключительно человеческой последовательностью, полноразмерное IgG1 λ антитело, генетически модифицированное для распознавания белка интерлейкин-12 p40.
Термин "пролекарство", используемый в настоящей заявке, относится к форме предшественника или производного фармацевтически активного вещества, которая является менее эффективной для пациента или цитотоксичной для опухолевых клеток по сравнению с исходным лекарственным средством и способна ферментативно или гидролитически активироваться или преобразовываться в более активную исходную форму. См., например, Wilman, "Prodrugs in Cancer Therapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986), и Stella et al., "Prodrugs:A Chemical Approach to Targeted Drug Delivery," Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства по настоящему изобретению включают, но не ограничиваются этим, фосфат-содержащие пролекарства, тиофосфат-содержащие пролекарства, сульфат-содержащие пролекарства, пептид-содержащие пролекарства, D-аминокислота-модифицированные пролекарства, гликозилированные пролекарства, β-лактам-содержащие пролекарства, необязательно замещенный феноксиацетамид-содержащие пролекарства или необязательно замещенный фенилацетамид-содержащие пролекарства, 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут быть преобразованы в более активное цитотоксичное лекарственное средство. Примеры цитотоксичных лекарственных средств, которые могут быть дериватизированы в форму пролекарства, для использования в настоящем изобретении включают, но не ограничиваются этим, химиотерапевтические средства, описанные выше.
"Липосома" относится к везикуле, состоящей из одного или нескольких липидов, фосфолипидов и/или поверхностно-активных веществ, которая является полезной для доставки лекарственного средства (такого как соединение по настоящему изобретению и, необязательно, химиотерапевтического средства) млекопитающему. Компоненты липосомы могут быть в форме бислоя, подобно структуре липидов биологических мембран.
Термин "вкладыш в упаковку" используется как относящийся к инструкциям, традиционно включаемым в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозах, введении, противопоказаниях и/или предупреждения, касающиеся применения таких терапевтических продуктов.
Термин "хиральный" относится к молекулам, которые являются несовмещаемыми со своим зеркальным изображением, тогда как термин "ахиральный" относится к молекулам, которые являются совмещаемыми со своим зеркальным изображением.
Термин "стереоизомеры" относится к соединениям, которые имеют одинаковый химический состав, но отличаются расположением атомов или групп в пространстве.
"Диастереомер" относится к стереоизомеру с двумя или более центрами хиральности, и такие молекулы не являются зеркальным изображением друг друга. Диастереомеры имеют разные физические свойства, например, температуры плавления, температуры кипения, спектральные характеристики и реакционную способность. Смеси диастереомеров можно разделить с использованием аналитических процедур высокого разрешения, таких как электрофорез и хроматография.
"Энантиомеры" относятся к двум стереоизомерам соединения, которые являются несовмещаемыми со своим зеркальным изображением.
Стереохимические определения и преобразования, импользуемые в настоящей заявке, в основном, находятся в соответствии с S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью к вращению плоскости плоскость-поляризованного света. При описании оптически активного соединения префиксы D и L или R и S используют для обозначения абсолютной конфигурации молекулы вокруг ее хирального центра(центров). Префиксы d и l или (+) и (-) используют для указания знака вращения плоскость-поляризованного света соединением, при этом (-) или l означают, что соединение является левовращающим. Соединение, перед которым стоит префикс (+) или d, является правовращающим. Для какой-либо определенной химической структуры эти стереоизомеры являются идентичными, за исключением того, что они являются зеркальными изображениями друг друга. Конкретный стереоизомер также может быть указан как энантиомер, и смесь таких изомеров часто называют энантиомерной смесью. Смесь 50:50 энантиомеров называется рацемической смесью или рацематом, которая может быть образована при отсутствии стереоселективности или стереоспецифичности в химической реакции или процессе. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных типов, лишенных оптическй активности.
Фраза "фармацевтически приемлемая соль", используемая в настоящей заявке, относится к фармацевтически приемлемым органическим или неорганическим солям соединения по настоящему изобретению. Иллюстративные соли включают, но не ограничиваются этим, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислотный фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Фармацевтически приемлемая соль может включать другую молекулу, такую как ацетатный ион, сукцинатный ион или другой противоион. Противоион может представлять собой любую органическую или неорганическую группу, которая стабилизирует заряд исходного соединения. Кроме того, фармацевтически приемлемая соль может содержать более одного заряженного атома в своей структуре. Случаи, когда где несколько заряженных атомов являются частью фармацевтически приемлемой соли, могут включать несколько противоионов. Следовательно, фармацевтически приемлемая соль может содержать один или несколько заряженных атомов и/или один или несколько противоионов.
"Сольват" относится к ассоциации или комплексу одной или нескольких молекул растворителя и соединения по настоящему изобретению. Примеры растворителей, которые образуют сольваты, включают, но не ограничиваются этим, воду, изопропанол, этанол, метанол, DMSO, этилацетат, уксусную кислоту и этаноламин. Термин "гидрат" относится к комплексу, где молекула растворителя представляет собой воду.
Термин "защитная группа" или "Pg" относится к заместителю, который традиционно используют для блокирования или защиты определенной функциональной группы в процессе реакции других функциональных групп в соединении. Например, "амино-защитная группа" представляет собой заместитель, присоединенный к аминогруппе, который блокирует или защищает функциональную аминогруппу в соединении. Подходящие амино-защитные группы включают ацетил, трифторацетил, фталимидо, трет-бутоксикарбонил (BOC), бензилоксикарбонил (CBz) и 9-флуоренилметиленоксикарбонил (Fmoc). Подобным образом, "гидрокси-защитная группа" относится к заместителю гидроксигруппы, который блокирует или защищает функциональную гидроксигруппу. Подходящие гидрокси-защитные группы включают ацетил, триалкилсилил, диалкилфенилсилил, бензоил, бензил, бензилоксиметил, метил, метоксиметил, триарилметил и тетрагидропиранил. "Карбокси-защитная группа" относится к заместителю карбоксигруппы, который блокирует или защищает функциональную карбоксигруппу. Традиционно используемые карбокси-защитные группы включают -CH2CH2SO2Ph, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этоксиметил, 2-(п-толуолсульфонил)этил, 2-(п-нитрофенилсульфенил)этил, 2-(дифенилфосфино)этил, нитроэтил и подобные. Общее описание защитных групп и их использование см. в T. W. Greene and P. Wuts, Protective Groups in Organic Synthesis, Third Ed., John Wiley & Sons, New York, 1999; и P. Kocienski, Protecting Groups, Third Ed., Verlag, 2003.
Термин "пациент" включает пациентов-людей и пациентов-животных. Термин "животное" включает домашних животных (например, собак, кошек и лошадей), животных мясных пород, животных зоопарка, морских животных, птиц и другие подобные виды животных.
Фраза "фармацевтически приемлемый" указывает, что вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, составляющими композицию, и/или млекопитающим, который принимает такое лечение.
Термины "соединение(соединения) по изобретению," и "соединение(соединения) по настоящему изобретению", если не указано иное, включают соединения формулы I и Ia и их стереоизомеры, таутомеры, сольваты, метаболиты, соли (например, фармацевтически приемлемые соли), полиморфы и пролекарства. Если не указано иное, структуры, представленные в настоящей заявке, также включают соединения, которые отличаются только присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения формул I и Ia и формул 1a-11, где один или несколько атомов водорода замещены дейтерием или тритием или один или несколько атомов углерода замещены 13C- или 14C-обогащенным углеродом, включены в объем настоящего изобретения.
ПИРАЗОЛОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ-ИНГИБИТОРЫ JAK
В одном варианте осуществления обеспечиваются соединение формулы Ia и фармацевтические композиции, включающие такое соединение, которые являются полезными для лечения заболеваний, состояний и/или расстройств, реагирующих на ингибирование JAK киназ.
В одном варианте осуществления обеспечиваются соединение формулы I и фармацевтические композиции, включающие такое соединение, которые являются полезными для лечения заболеваний, состояний и/или расстройств, реагирующих на ингибирование JAK киназ.
Другой вариант осуществления включает соединения формулы Ia:
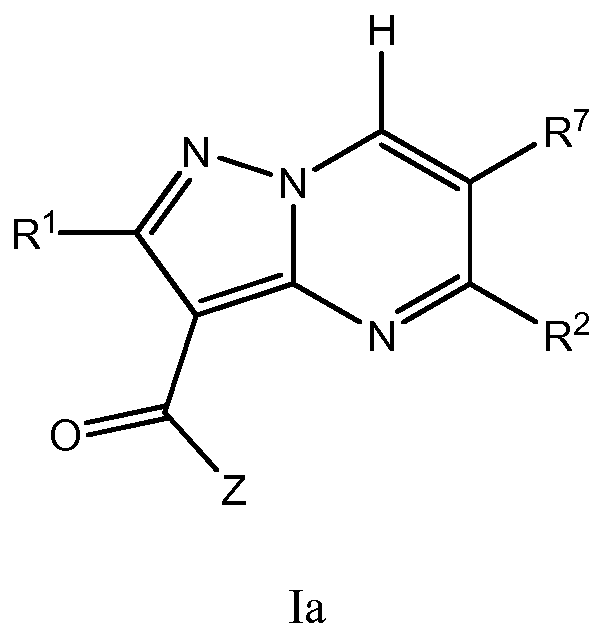
их энантиомеры, диастереомеры или фармацевтически приемлемые соли, где:
R1 представляет собой H;
R2 представляет собой -OR4, -NR3R4, -NR3N12R4, -NR3S(O)R4 или -NR3S(O)2R4;
R3 представляет собой H или C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, где указанные алкил, алкенил и алкинил необязательно замещены оксо, F, ORa или NRaRb;
R4 представляет собой H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, -(C0-C5 алкил)(C1-C9 гетероциклил), -(C0-C5 алкил)(C3-C6 циклоалкил), -(C0-C5 алкил)(C1-C9 гетероарил), -(C0-C5 алкил)(C6-C10 арил), где указанные алкил, алкенил и алкинил необязательно замещены группой R8 и указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены группой R9; или
R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют C1-C9 гетероциклил, необязательно замещенный группой R13;
Z представляет собой -OR6 или -NR5R6;
R5 представляет собой H или C1-C3 алкил;
R6 представляет собой H, C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил, -(C0-C5 алкил)(C1-C9 гетероциклил), -(C0-C5 алкил)(C3-C8 циклоалкил), -(C0-C5 алкил)(C1-C9 гетероарил), -(C0-C5 алкил)(C6-C9 арил), где указанные алкил, алкенил и алкинил необязательно замещены группой R10 и указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены группой R11;
R7 представляет собой H, галоген, C1-C3 алкил, C2-C3 алкенил, C2-C3 алкинил или -О(C1-C3 алкил);
R8 независимо представляет собой оксо, F, ORa или NRaRb;
R9 независимо представляет собой оксо, -CN, -CF3, галоген, -C(O)C1-C6 алкил, -C(O)ORa, -C(О)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa, -(C0-C5 алкил)SRa, -O[C(Ra)2]1-3O-, C1-C3 алкил, необязательно замещенный группой оксо или F, -(C0-C5 алкил)C1-C9 гетероциклил, необязательно замещенный галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом, -(C0-C5 алкил)C6 арил, необязательно замещенный галогеном или группой C1-C3 алкил -О(C1-C3 алкил), или -(C0-C5 алкил)C1-C9 гетероарил, необязательно замещенный галогеном или C1-C3 алкилом;
R10 независимо представляет собой оксо, F, ORa или NRaRb;
R11 независимо представляет собой оксо, -CN, -CF3, галоген, -O[C(Ra)2]1-3O-, -C(O)C1-C6 алкил, -C(O)ORa, -C(O)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa, C1-C6 алкил, необязательно замещенный группой оксо или F, -(C0-C5 алкил)C1-C9 гетероциклил, необязательно замещенный галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом, -(C0-C5 алкил)C1-C9 гетероарил, необязательно замещенный галогеном или C1-C3 алкилом, -(C0-C5 алкил)фенил, необязательно замещенный C1-C3 алкилом, -CF3, галогеном, -CN, -ORa или -NRaRb, или -(C0-C5 алкил)C3-C6 циклоалкил, необязательно замещенный оксо, -NRcRd, C1-C3 алкилом или F;
R12 представляет собой H или C1-C3 алкил;
R13 представляет собой оксо, галоген, C1-C3 алкил, -C(O)C1-C6 алкил, -C(O)ORa, C6 арил, C3-C6 циклоалкил, C1-C5 гетероарил или C4-C5 гетероциклил; где указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены C1-C4 алкилом, -(C0-C3 алкил)ORc, оксо, галогеном или NRcRd;
Ra и Rb независимо представляют собой H, -CF3, -CHF2, -CH2F, C1-C6 алкил, C6 арил, C3-C6 циклоалкил или C4-C5 гетероциклил; где указанные алкил, арил и циклоалкил необязательно замещены C1-C4 алкилом, -(C0-C3 алкил)ORc, оксо, галогеном, NRcRd или C4-C5 гетероциклилом; или
Ra и Rb вместе с атомом азота, с которым они связаны, образуют C1-C5 гетероциклил, необязательно замещенный оксо, F, C1-C3 алкилом, -C(O)C1-C6 алкилом или -C(O)ORa; и
Rc и Rd независимо представляют собой H, C1-C3 алкил, C3-C6 циклоалкил или фенил, где указанные алкил, циклоалкил и фенил необязательно замещены галогеном, CH3, OH, NH2, C(O)O(C1-C6 алкил) или C(O)NH(C1-C6 алкил).
Другой вариант осуществления включает соединения формулы I:
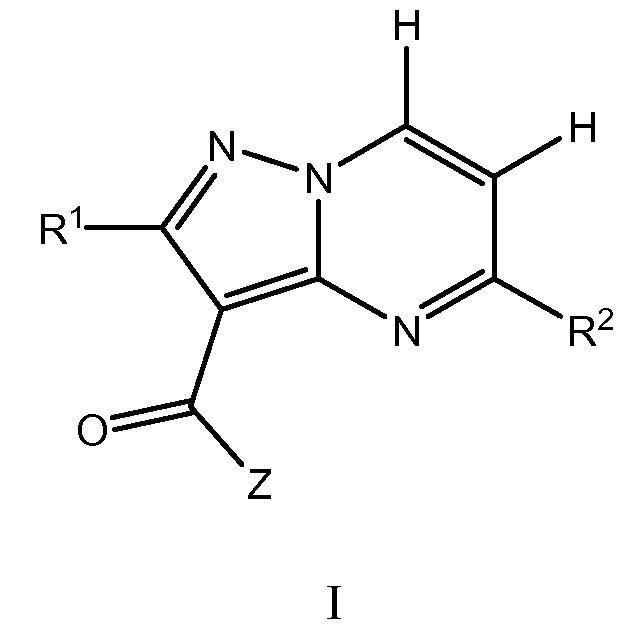
их энантиомеры, диастереомеры или фармацевтически приемлемые соли, где:
R1 представляет собой H;
R2 представляет собой -OR4 или -NR3R4;.
R3 представляет собой H или C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, где указанные алкил, алкенил и алкинил необязательно замещены оксо, F, ORa или NRaRb;
R4 представляет собой H, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил, -(C0-C5 алкил)(C1-C9 гетероциклил), -(C0-C5 алкил)(C3-C6 циклоалкил), -(C0-C5 алкил)(C1-C9 гетероарил), (C0-C5 алкил)(C6-C9 арил), где указанные алкил, алкенил и алкинил необязательно замещены оксо, F, ORa или NRaRb, и указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены
оксо, -CN, -CF3, галогеном, -C(O)C1-C6 алкилом, -C(O)ORa, -C(O)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa, -O[C(Ra)2]1-3O-,
C1-C3 алкилом, необязательно замещенным группой оксо или F,
-(C0-C5 алкил)C1-C9 гетероциклилом, который необязательно замещен галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом, или
-(C0-C5 алкил)C1-C9 гетероарилом, который необязательно замещен галогеном или C1-C3 алкилом;
R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют C1-C5 гетероциклил, необязательно замещенный оксо, F, C1-C3 алкилом, -C(O)C1-C6 алкилом или -C(O)ORa;
R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют C1-C5 гетероциклил, необязательно замещенный оксо, F, C1-C3 алкилом, -C(O)C1-C6 алкилом или -C(O)ORa;
Z представляет собой -OR6 или -NR5R6;
R5 представляет собой H или C1-C3 алкил;
R6 представляет собой H, C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил, -(C0-C5 алкил)(C1-C9 гетероциклил), -(C0-C5 алкил)(C3-C8 циклоалкил), -(C0-C5 алкил)(C1-C9 гетероарил), -(C0-C5 алкил)(C6-C9 арил), где указанные алкил, алкенил и алкинил необязательно замещены оксо, F, ORa или NRaRb, и указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены
оксо, -CN, -CF3, галогеном, -O[C(Ra)2]1-3O-, -C(O)C1-C6 алкилом, -C(О)ORa, -C(О)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa,
C1-C6 алкилом, необязательно замещенным группой оксо или F,
-(C0-C5 алкил)C1-C9 гетероциклилом, который необязательно замещен галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом,
-(C0-C5 алкил)C1-C9 гетероарилом, который необязательно замещен галогеном или C1-C3 алкилом,
-(C0-C5 алкил)фенилом, который необязательно замещен C1-C3 алкилом, -CF3, галогеном, -CN, -ORa или -NRaRb, или
-(C0-C5 алкил)C3-C6 циклоалкилом, который необязательно замещен оксо, -NRcRd, C1-C3 алкилом или F;
Ra и Rb независимо представляют собой H, -CF3, -CHF2, -CH2F, C1-C6 алкил, C6 арил, C3-C6 циклоалкил или C4-C5 гетероциклил; где указанные алкил, арил и циклоалкил необязательно замещены C1-C4 алкилом, (C0-C3 алкил)ORc, оксо, галогеном, NRcRd или C4-C5 гетероциклилом; или
Ra и Rb вместе с атомом азота, с которым они связаны, образуют C1-C5 гетероциклил, необязательно замещенный оксо, F, C1-C3 алкилом, -C(O)C1-C6 алкилом или -C(O)ORa; и
Rc и Rd независимо представляют собой H, C1-C3 алкил, C3-C6 циклоалкил или фенил, где указанные алкил, циклоалкил и фенил необязательно замещены галогеном, CH3, OH или NH2, C(O)O(C1-C6 алкил) или C(O)NH(C1-C6 алкил).
В одном варианте осуществления R2 представляет собой -NR3R4, -NR3N12R4, -NR3S(O)R4 или -NR3S(O)2R4. В другом варианте осуществления R2 представляет собой -NR3R4, -NR3N12R4 или -NR3S(O)2R4. В другом варианте осуществления R2 представляет собой -NR3S(O)2R4. В другом варианте осуществления R2 представляет собой -NR3N12R4. В одном варианте осуществления R2 представляет собой -NR3R4. В одном варианте осуществления R2 представляет собой -NHR4.
В одном варианте осуществления формулы I, R2 представляет собой -NR3R4.
В одном варианте осуществления формулы I, R2 представляет собой -NHR4.
В одном варианте осуществления формулы I, R2 представляет собой -OR4.
В одном варианте осуществления формулы I, R2 представляет собой -NR3R4 и R3 представляет собой H или C1-C4 алкил, необязательно замещенный группой OH.
В одном варианте осуществления формулы I, R4 представляет собой H или C1-C4 алкил, необязательно замещенный группой OH.
В одном варианте осуществления формулы I, R4 представляет собой H, метил, этил, изопропил или -CH2CH2OH.
В одном варианте осуществления формулы I, R2 представляет собой -NR3R4, и R3 и R4 представляют собой H.
В одном варианте осуществления формулы I, R4 представляет собой C1-C6 алкил, -(C0-C3 алкил)фенил, (C0-C3 алкил)(C3-C5 гетероциклил), -(C0-C3 алкил)(C6-C7 циклоалкил), -(C0-C3 алкил)(C3-C5 гетероарил), где указанный алкил необязательно замещен группой оксо, F, ORa или NRaRb, и указанные фенил, циклоалкил, гетероарил и гетероциклил необязательно замещены
C1-C3 алкилом, необязательно замещенным группой F,
-O[C(Ra)2]1-3O-, -CF3, -OCF3, -OCHF2, галогеном, -C(O)C1-C6 алкилом, -C(O)ORa, -C(О)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa,
-(C0-C3 алкил)C3-C5 гетероциклилом, который необязательно замещен галогеном, оксо, C1-C3 алкилом или C(O)C1-C6 алкилом,
или -(C0-C3 алкил)C3-C5 гетероарилом, который необязательно замещен галогеном или C1-C3 алкилом.
В одном варианте осуществления R4 представляет собой C1-C6 алкил, -(C0-C5 алкил)(C1-C9 гетероциклил), -(C0-C5 алкил)(C3-C6 циклоалкил), -(C0-C5 алкил)(C1-C9 гетероарил), -(C0-C5 алкил)(C6-C10 арил), где указанный алкил необязательно замещен группой R8, и указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены группой R9.
В другом варианте осуществления, R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют C1-C5 гетероциклил, необязательно замещенный группой R13.
В одном варианте осуществления формулы I, R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют C4-C5 гетероциклил, необязательно замещенный оксо, F, C1-C3 алкилом, -C(O)C1-C6 алкилом или -C(O)ORa.
В одном варианте осуществления формулы I, R4 представляет собой фенил, -(CH2)фенил, - (CH2CH2)фенил, -CH(CH3)фенил, -C(CH3)2фенил, -(C0-C3 алкил)C4-C5 гетероциклил или -(C0-C3 алкил)C3-C5 гетероарил, где указанный фенил необязательно замещен 1 или 2 заместителями, независимо выбранными из метила, этила, изопропила, F, Cl, -OCH2O-, -OCH2CH2O-, -OCH2CH2CH2O-, -OCH2CH2NH2, -OCH2CH2NMe2, -OCH2(C4-C5 гетероциклил), -OH, -OCH3, -OCH2CH3, -CF3, -OCF3 и -OCHF2, указанный гетероциклил выбран из тетрагидропиранила, тетрагидрофуранила, пирролидинила, морфолинила, пиперазинила и пиперидинила, указанный гетероциклил необязательно замещен галогеном, метилом или C(O)O(трет-бутил), указанный гетероарил выбран из пиразолила, имидазолила, фуранила и тиенила, и указанный гетероарил необязательно замещен галогеном или метилом.
В одном варианте осуществления R4 представляет собой -(C0-C5 алкил)(C6-C10 арил), необязательно замещенный группой R9. В одном примере, R4 представляет собой -(C0-C5 алкил)(C6-C10 арил), необязательно замещенный (C1-C3 алкил)ом или галогеном, и указанный арил представляет собой фенил, нафталинил, инденил, инданил, 1,2-дигидронафталинил и 1,2,3,4-тетрагидронафтил. В другом примере, R4 выбран из:

где волнистые линии представляют точку присоединения R4 в соединени по настоящему изобретению.
В одном варианте осуществления R4 представляет собой фенил, -(CH2)фенил, -(CH2CH2)фенил, -CH(CH3)фенил, -CH(CH2CH3)фенил, -(R)-CH(CH3)фенил, -(S)-CH(CH3)фенил, -(R)-CH(CH2CH3)фенил, -(S)-CH(CH2CH3)фенил или -C(CH3)2фенил, где указанный фенил необязательно замещен группой R9. В одном примере, указанный фенил необязательно замещен 1 или 2 группами R9, где R9 независимо выбран из метила, этила, изопропила, циклопропила, F, Cl, -OCH2O-, -OCH2CH2O-, -OCH2CH2CH2O-, -OCH2CH2NH2, -OCH2CH2NMe2, -O(CH2)1-3(C4-C5 гетероциклил), C3-C5 гетероарила, -(CH2)0-3C3-C5 гетероциклила, необязательно замещенного C1-C3 алкилом или галогеном, -OH, -OCH3, -OCH2CH3, -SH, -SCH3, -SCH2CH3, -N(CH3)2 -N(CH2CH3)2, -CN, -CF3, -OCF3, -OCHF2 и C(O)O(C1-C3 алкил). В другом примере, R4 выбран из:
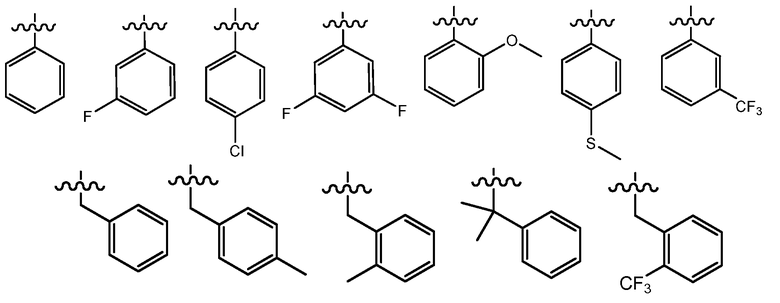
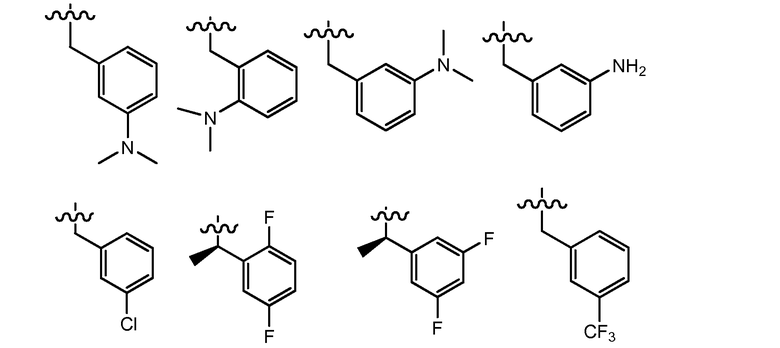
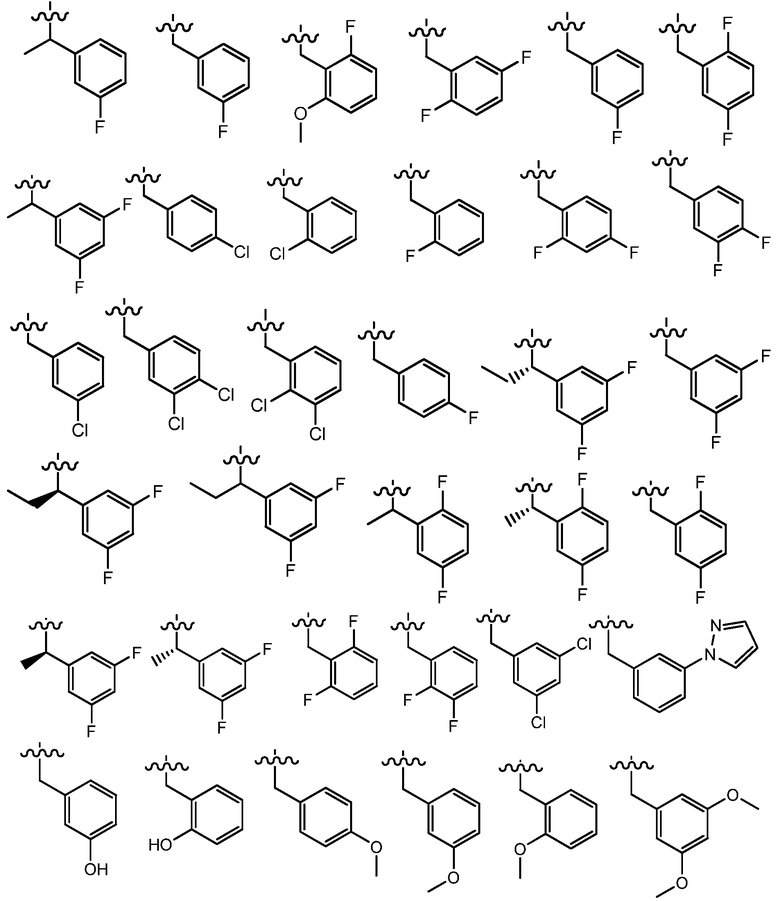

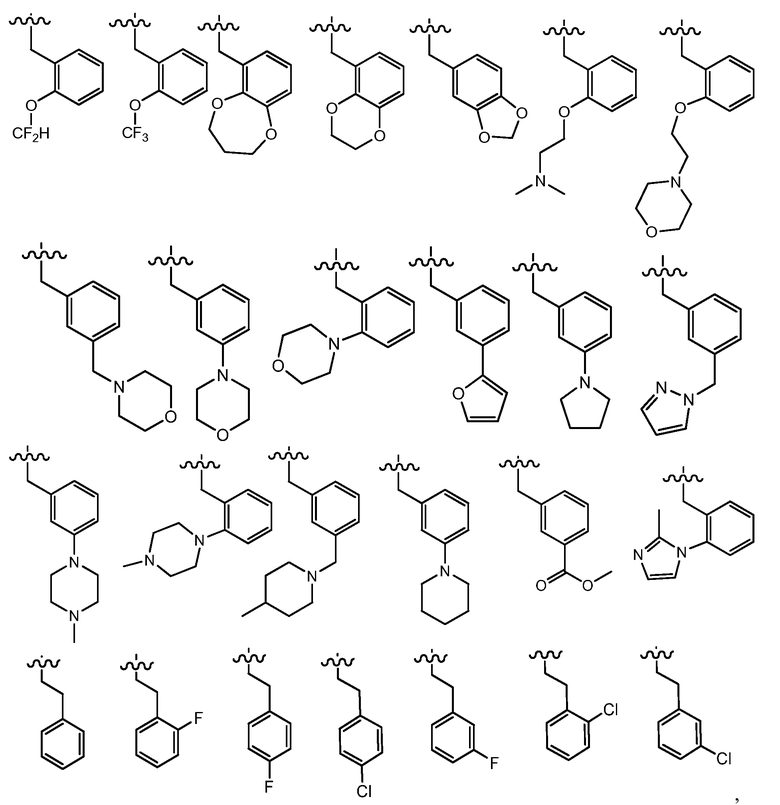
где волнистые линии представляют точку присоединения R4.
В другом варианте осуществления, R4 представляет собой -(C0-C5 алкил)(C1-C9 гетероциклил) или -(C0-C5 алкил)(C1-C9 гетероарил), где указанные гетероарил и гетероциклил необязательно замещены группой R9. В одном примере, R4 представляет собой пиридинил, -(CH2)пиридинил, -(CH2CH2)пиридинил, -CH(CH3)пиридинил, пиримидинил, -(CH2)пиримидинил, имидазолил, -(CH2)имидазолил, пиразолил, -(CH2)пиразолил, тетрагидропиранил, тетрагидрофуранил, пирролидинил, морфолинил, пиперазинил или пиперидинил, необязательно замещенный группой R9. В одном примере, R9 представляет собой метил, этил, изопропил, F, Cl, -NH2, -NMe2, -OCH3, -OH, -OCH2CH3, -CF3, -OCF3 -OCHF2, C(O)O(трет-бутил) или фенил. В другом примере, R4 выбран из:
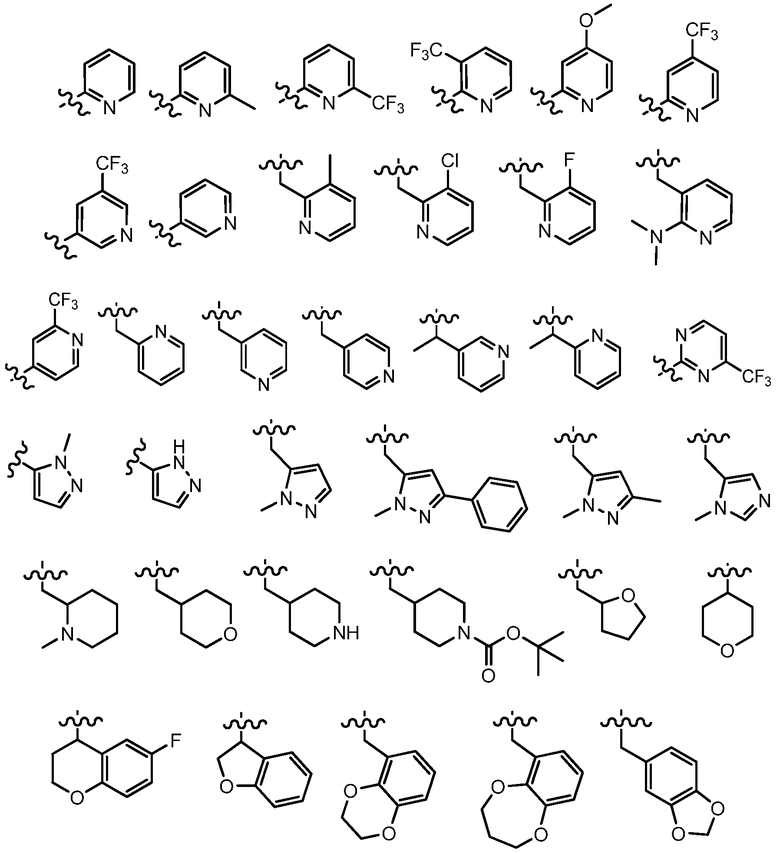
где волнистые линии представляют точку присоединения R4 .
В одном варианте осуществления формулы I, R4 представляет собой C4-C5 гетероциклил или -(CH2)C4-C5 гетероциклил, где указанный гетероциклил представляет собой тетрагидропиранил, тетрагидрофуранил, пирролидинил, пиперазинил, пиперидинил или морфолинил, необязательно замещенный группой метил или C(O)O(трет-бутил).
В одном варианте осуществления формулы I, R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют пирролидинил, пиперазинил, пиперидинил или морфолинил, необязательно замещенный метилом.
В одном варианте осуществления R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют азетидинил, необязательно замещенный группой R13. В другом варианте осуществления R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют азетидинил, необязательно замещенный фенилом.
В одном варианте осуществления формулы I, R4 представляет собой пиридинил или -(CH2)пиридинил, где указанный пиридинил необязательно замещен метилом, F или Cl.
В одном варианте осуществления R4 представляет собой циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, -(CH2)циклопропил, -(CH2)циклобутил, -(CH2)циклопентил, -(CH2)циклогексил, -(CH2)циклогептил, инданил или тетрагидронафталинил, и указанный R4 независимо необязательно замещен группой R9. В одном примере, R9 представляет собой F, оксо, метил или CH2NH2.
В одном варианте осуществления формулы I, R4 представляет собой циклогексил, циклогептил, -(CH2)циклогексил или -(CH2)циклогептил, и указанные циклогексил и циклогептил независимо необязательно замещены оксо, метилом или CH2NH2.
В одном варианте осуществления Z представляет собой -NR5R6.
В одном варианте осуществления Z представляет собой -NR5R6 и R5 представляет собой H.
В одном варианте осуществления Z представляет собой -NR5R6, R5 представляет собой H, и R6 представляет собой H.
В одном варианте осуществления формулы I, Z представляет собой -NR5R6.
В одном варианте осуществления формулы I, Z представляет собой -OR6.
В одном варианте осуществления формулы I, Z представляет собой -NR5R6, и R5 представляет собой H.
В одном варианте осуществления R6 представляет собой C1-C10 алкил, -(C0-C5 алкил)(C1-C9 гетероциклил), -(C0-C5 алкил)(C3-C8 циклоалкил), -(C0-C5 алкил)(C1-C9 гетероарил), -(C0-C5 алкил)(C6-C9 арил), где алкил необязательно замещен группой R10, и где арил, циклоалкил, гетероарил и гетероциклил необязательно замещены группой R11.
В одном варианте осуществления формулы I, R6 представляет собой C1-C8 алкил, -(C0-C3 алкил)(C3-C5 гетероциклил), -(C0-C3 алкил)(C3-C8 циклоалкил), -(C0-C3 алкил)(C3-C5 гетероарил) или -(C0-C1 алкил)(фенил), где указанный алкил необязательно замещен группой оксо, F, ORa или NRaRb, и указанные фенил, циклоалкил, гетероарил и гетероциклил необязательно замещены
оксо, -CN, -CF3, галогеном, -C(O)C1-C6 алкилом, -C(O)ORa, -C(O)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa,
C1-C6 алкилом, необязательно замещенным группой оксо или F,
-(C0-C2 алкил)C3-C5 гетероциклилом, который необязательно замещен галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом,
-(C0-C2 алкил)C3-C5 гетероарилом, который необязательно замещен галогеном или C1-C3 алкилом,
-(C0-C2 алкил)фенилом, который необязательно замещен C1-C3 алкилом, -CF3, галогеном, -CN, -ORa или -NRaRb, или
-(C0-C2 алкил)C6-C8 циклоалкилом, который необязательно замещен оксо, -NRcRd, C1-C3 алкилом или F.
В одном варианте осуществления R6 представляет собой C1-C8 алкил, необязательно замещенный группой R10. В одном варианте осуществления R6 представляет собой метил, этил, изопропил, н-бутил, втор-бутил, трет-бутил, 3,3-диметилбут-1-ил, пент-3-ил, октил, -C(CH2)2CH2OH, -CH2CH2OH или -CH2CH2OCH3.
В одном варианте осуществления формулы I, R6 представляет собой C1-C8 алкил, необязательно замещенный группой оксо, F, ORa или NRaRb.
В одном варианте осуществления формулы I, R6 представляет собой метил, этил, изопропил, н-бутил, втор-бутил, трет-бутил, 3,3-диметилбут-1-ил, пент-3-ил, октил, -C(CH2)2CH2OH, -CH2CH2OH или -CH2CH2OCH3.
В одном варианте осуществления R6 представляет собой C3-C5 гетероциклил или -(CH2)C3-C5 гетероциклил, необязательно замещенный группой R11. В другом варианте осуществления R6 представляет собой C3-C5 гетероциклил или -(CH2)C3-C5 гетероциклил, необязательно замещенный группой R11, где указанный гетероциклил представляет собой тетрагидрофуранил, тетрагидропиранил, пиперазинил, пиперидинил, морфолинил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридинил, и где указанный R11 независимо представляет собой оксо, -CN, -CF3, галоген, -C(O)C1-C6 алкил, -C(O)ORa, -C(O)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa, C1-C6 алкил, необязательно замещенный группой оксо или F, -(C0-C5 алкил)C1-C9 гетероциклил, необязательно замещенный галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом, -(C0-C5 алкил)C1-C9 гетероарил, необязательно замещенный галогеном или C1-C3 алкилом, -(C0-C5 алкил)фенил, необязательно замещенный C1-C3 алкилом, -CF3, галогеном, -CN, -ORa или -NRaRb, или -(C0-C5 алкил)C3-C6 циклоалкил, необязательно замещенный оксо, -NRcRd, C1-C3 алкилом или F. В одном примере, R6 представляет собой C3-C5 гетероарил, необязательно замещенный 1-4 группами R11. В другом примере, R6 представляет собой C3-C5 гетероарил, где указанный гетероарил замещен фенилом, который необязательно замещен C1-C3 алкилом, -CF3, галогеном, -CN, -ORa или -NRaRb, и где указанный гетероарил необязательно дополнительно замещен 1-2 группами R11, независимо выбранными из галогена, -CF3 или C1-C6 алкила, необязательно замещенного группой оксо или F.
В одном варианте осуществления Формулы I, R6 представляет собой C3-C5 гетероциклил или -(CH2)C3-C5 гетероциклил, где указанный гетероциклил представляет собой тетрагидрофуранил, пиперазинил, пиперидинил или морфолинил, необязательно замещенный метилом, этилом или C(O)Отрет-бутилом.
В одном варианте осуществления формулы I, R6 представляет собой -(C0-C2 алкил)C3-C8 циклоалкил, где указанный циклоалкил необязательно замещен C1-C6 алкилом, C(O)OCH3, C(O)OH, OH, CN, C(O)циклогексилом, C(O)(C4-C5 гетероциклил) или -CH2циклогексилом, необязательно замещенным группой NH2, и где указанный гетероциклил выбран из пиперазинила, пиперидинила или морфолинила, и указанный гетероциклил необязательно замещен метилом или CH2NH2.
В одном варианте осуществления R6 представляет собой циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, -(CH2)циклогексил, -(CH2CH2)циклогексил, -(CH2)циклогептил, бицикло[2.2.1]гептил или -(CH2)бицикло[2.2.1]гептил, и где R6 необязательно замещен 1-3 заместителями, выбранными из оксо, галогена, C1-C6 алкила, C(O)OCH3, C(O)OH, OH, CN, C(O)циклогексила, C(O)(C4-C5 гетероциклил) и -CH2циклогексила, необязательно замещенного группой NH2, и где указанный гетероциклил выбран из пиперазинила, пиперидинила или морфолинила, и указанный гетероциклил необязательно замещен метилом или CH2NH2.
В одном варианте осуществления формулы I, R6 представляет собой циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, -(CH2)циклогексил, -(CH2CH2)циклогексил, -(CH2)циклогептил, бицикло[2.2.1]гептил или -(CH2)бицикло[2.2.1]гептил, и где R6 необязательно замещен 1-3 заместителями, выбранными из C1-C6 алкила, C(O)OCH3, C(O)OH, OH, CN, C(O)циклогексила, C(O)(C4-C5 гетероциклил) или -CH2циклогексила, необязательно замещенного NH2, и где указанный гетероциклил выбран из пиперазинила, пиперидинила или морфолинила, и указанный гетероциклил необязательно замещен метилом или CH2NH2.
В одном варианте осуществления R6 представляет собой C3-C5 гетероарил или -(CH2)C3-C5 гетероарил, и где R6 необязательно замещен группой R11.
В одном варианте осуществления формулы I, R6 представляет собой C3-C5 гетероарил или -(CH2)C3-C5 гетероарил, и где R6 необязательно замещен одним или несколькими заместителями, выбранными из оксо, -CN, -CF3, галогена, -C(O)C1-C6 алкила, -C(O)ORa, -C(O)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa,
C1-C6 алкила, необязательно замещенного группой оксо или F,
-(C0-C2 алкил)C4-C5 гетероциклила, необязательно замещенного галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом,
-(C0-C2 алкил)C3-C5 гетероарила, необязательно замещенного галогеном или C1-C3 алкилом,
-(C0-C2 алкил)фенила, необязательно замещенного C1-C3 алкилом, -CF3, галогеном, -CN, -ORa или -NRaRb, и
-(C0-C2 алкил)C6-C7 циклоалкила, необязательно замещенного оксо, C1-C3 алкилом или F.
В одном варианте осуществления R6 представляет собой изоксазолил, оксазолил, изотиазолил, тиазолил, имидазолил, пиразолил или пиридинил, и где R6 необязательно замещен 1-3 заместителями, выбранными из -CF3, галогена, C1-C6 алкила, необязательно замещенного группой оксо или F, -(C1-C6 алкил)ORa, фенила, необязательно замещенного метилом, этилом, изопропилом, -CF3, -CN, ORa, Cl, F, Br или I, и пиридинила, необязательно замещенного метилом, этилом, изопропилом, -CF3, -CN, ORa, Cl, F, Br или I.
В одном варианте осуществления формулы I, R6 представляет собой пиразолил или пиридинил, и где R6 необязательно замещен 1-3 заместителями, выбранными из C1-C6 алкила, необязательно замещенного группой оксо или F, галогена и фенила, и где указанный фенил необязательно замещен метилом, этилом, изопропилом, -CF3, -CN, ORa, Cl или F.
В одном варианте осуществления формулы I, R6 представляет собой фенил или -CH2фенил, и где указанный фенил необязательно замещен F, Cl, -OH, -OCH3, -OCH2CH3, -Офенилом, -C(O)NH2, -C(O)OH, -C(O)OCH3, циклогексилом, метилом, этилом или изопропилом.
В одном варианте осуществления R7 представляет собой галоген. В одном варианте осуществления R7 представляет собой Cl. В одном варианте осуществления R7 представляет собой H.
В одном варианте осуществления R8 независимо представляет собой оксо, галоген, ORa или NRaRb. В одном варианте осуществления R8 независимо представляет собой галоген. В одном варианте осуществления R8 представляет собой F.
В одном варианте осуществления R9 независимо представляет собой -CF3, галоген, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa, -(C0-C5 алкил)SRa, -O[C(Ra)2]1-3O-, C1-C3 алкил, необязательно замещенный группой оксо или F, -(C0-C5 алкил)(C3-C6 циклоалкил), необязательно замещенный группой оксо или F, -(C0-C5 алкил)C1-C9 гетероциклил, необязательно замещенный галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом, -(C0-C5 алкил)C6 арил, необязательно замещенный галогеном или группой C1-C3 алкил -О(C1-C3 алкил), или -(C0-C5 алкил)C1-C9 гетероарил, необязательно замещенный галогеном или C1-C3 алкилом. В одном варианте осуществления R9 независимо представляет собой Cl, F, -CF3, -CH3, -OH, -OCH3, -OCH2CH3, -O(CH2)2O-, -O(CH2)3O-, -OCHF2, -OCF3,-N(CH3)2, -NH2, морфолинил, пирролидинил, пиразолил, -OCH2(пиразолил), N-метил-пиперидинил или -O(CH2)2(морфолинил).
В одном варианте осуществления R10 независимо представляет собой оксо, галоген, ORa или NRaRb. В одном варианте осуществления R10 независимо представляет собой галоген. В одном варианте осуществления R10 представляет собой F.
В одном варианте осуществления R11 независимо представляет собой оксо, -CF3, галоген, -C(O)C1-C6 алкил, -C(O)ORa, -C(O)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa, C1-C6 алкил, необязательно замещенный группой оксо или F, -(C0-C5 алкил)C1-C9 гетероциклил, необязательно замещенный галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом, -(C0-C5 алкил)C1-C9 гетероарил, необязательно замещенный галогеном или C1-C3 алкилом, -(C0-C5 алкил)фенил, необязательно замещенный C1-C4 алкилом, C1-C4 алкенилом, C1-C4 алкинилом, C3-C6 циклоалкилом, -CF3, галогеном, -CN, -ORa или -NRaRb, или -(C0-C5 алкил)C3-C6 циклоалкил, необязательно замещенный оксо, -NRcRd, C1-C3 алкилом или F. В одном варианте осуществления R11 независимо представляет собой Cl, F, -CF3, -CH3, -CH2CH3, -OH, -OCH3, -OCH2CH3, 2-метил-5-хлорфенил, 2,5-дихлорфенил, 2,5-дифторфенил, 2,5-диметилфенил, gem-дифтор, gem-диметил, 2-гидроксиэтил, 2-метоксиэтил, 3,5-диметилфенил, 3,5-дихлорфенил, 3,5-дифторфенил, 2,4-дифторфенил, 2-хлор-5-метилфенил, 2-метилфенил, 2-трифторметилфенил, 2-хлорфенил, 2-фторфенил, 3-метилфенил, 3-фторфенил, 3-хлорфенил, 3-цианофенил, 2-иодфенил, 2-бромфенил, фенил, пиридил, -C(O)OCH3, -CH2(4-аминоциклогекс-1-ил), 2-хлор-6-иодфенил, 2,6-дихлорфенил, 2,6-диметилфенил, 2,6-дибромфенил, 2-хлор-6-метилфенил, 2-хлор-6-фторфенил, 2-бром-6-фторфенил, 2-бром-6-метилфенил, 2-фтор-6-метилфенил, 2-хлор-6-трифторметилфенил, 2-тиометилфенил, 2-этилфенил, 2-этинил-6-метилфенил, 2-этинил-6-фторфенил, 2-хлор-5-цианофенил, 2-метоксифенил, 2-циклопропилфенил, 2-метокси-6-метилфенил-2-этинилфенил, 2-хлор-4-цианофенил, 2-изопропилфенил или 2-трифторметоксифенил.
В одном варианте осуществления формулы I, R6 представляет собой:
-(C0-C1 алкил)(C6-C9 циклоалкил), необязательно замещенный оксо, -CN, -CF3, галогеном, -C(O)C1-C6 алкилом, -C(O)ORa, -C(O)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa или C1-C6 алкилом, необязательно замещенным группой оксо или F,
-(C0-C2 алкил)C4-C5 гетероциклил, необязательно замещенный галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом,
-(C0-C2 алкил)C3-C5 гетероарил, необязательно замещенный галогеном, C1-C3 алкилом или фенилом, где указанный фенил необязательно замещен C1-C3 алкилом, -CF3, галогеном, -CN, -ORa или -NRaRb,
-(C0-C2 алкил)фенил, необязательно замещенный галогеном, -CN, -ORa или -NRaRb или -(C0-C2 алкил)C6-C7 циклоалкилом, необязательно замещенным группой оксо, C1-C3 алкил или F; и
R4 представляет собой H или -(C0-C3 алкил)фенил, где указанный фенил необязательно замещен:
C1-C3 алкилом, необязательно замещенным группой F,
-OCH2O-, -OCH2CH2O-, -OCH2CH2CH2O-, -CF3, -OCF3, -OCHF2, галогеном, -C(O)C1-C6 алкилом, -C(O)ORa, -C(О)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa,
-(C0-C3 алкил)C4-C4 гетероциклилом, который необязательно замещен галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом, или
-(C0-C3 алкил)C3-C5 гетероарилом, который необязательно замещен галогеном или C1-C3 алкилом.
В другом варианте осуществления, R6 представляет собой циклогексил, необязательно замещенный 1 или 2 заместителями, независимо выбранными из метила, этила, пентила, C(O)OCH3, C(O)OH, OH, CN, C(O)циклогексила и C(O)(C4-C5 гетероциклил), где указанный гетероциклил представляет собой пиперазинил, пиперидинил или морфолинил, необязательно замещенный метилом, CH2NH2, или CH2циклогексила, необязательно замещенного группой NH2; и R4 представляет собой -(CH2)фенил, где указанный фенил необязательно замещен 1 или 2 заместителями, независимо выбранными из метила, F, Cl, -OCH2O-, -OCH2CH2O-, -OCH2CH2CH2O-, -OCH2CH2NMe2, -OCH2(C4-C5 гетероциклил), -OH, -CF3, -OCF3, -OCH3, -OCH2CH3, -OCHF2, -(C0-C1 алкил)C4-C5 гетероциклила, где указанный гетероциклил выбран из пирролидинила, морфолинила, пиперазинила или пиперидинила и необязательно замещен метилом и -(C0-C1 алкил)C4-C5 гетероарилом, где указанный гетероарил выбран из пиразолила, имидазолила, фуранила и тиенила и необязательно замещен метилом. В одном примере этого варианта осуществления, R2 представляет собой -NR3R4, и R1 и R3 представляют собой H.
В одном варианте осуществления формулы I, R6 представляет собой -(C0-C1 алкил)(C6-C7 циклоалкил), где указанный циклоалкил необязательно замещен оксо, -CN, -CF3, галогеном, -C(O)C1-C6 алкилом, -C(О)ORa, -C(О)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa,
C1-C6 алкилом, необязательно замещенным группой оксо или F,
-(C0-C2 алкил)C4-C5 гетероциклилом, который необязательно замещен галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом,
-(C0-C2 алкил)C3-C5 гетероарилом, который необязательно замещен галогеном или C1-C3 алкилом,
-(C0-C2 алкил)фенилом, который необязательно замещен галогеном, -CN, -ORa или -NRaRb, или
-(C0-C2 алкил)C6-C7 циклоалкилом, который необязательно замещен оксо, C1-C3 алкилом или F; и
R4 представляет собой -(C0-C2 алкил)пиридинил, где указанный пиридинил необязательно замещен -OCH2O-, -OCH2CH2O-, -OCH2CH2CH2O-, -CF3, -OCF3, -OCHF2, галогеном, -C(O)C1-C6 алкилом, -C(O)ORa, -C(О)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa,
C1-C3 алкилом, необязательно замещенным группой F,
-(C0-C3 алкил)C4-C4 гетероциклилом, необязательно замещенным галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом, или
-(C0-C3 алкил)C3-C5 гетероарилом, необязательно замещенным галогеном или C1-C3 алкилом.
В одном варианте осуществления формулы I, R6 представляет собой циклогексил, необязательно замещенный 1 или 2 заместителями, независимо выбранными из метила, этила, пентила, C(O)OCH3, C(O)OH, OH, CN, C(O)циклогексила, C(O)(C4-C5 гетероциклил), где указанный гетероциклил представляет собой пиперазинил, пиперидинил или морфолинил, необязательно замещенный метилом, CH2NH2, или CH2циклогексила, необязательно замещенного группой NH2; и R4 представляет собой пиридинил или -(CH2)пиридинил, где указанный пиридинил необязательно замещен метилом, F или Cl. В другом примере этого варианта осуществления, R2 представляет собой -NR3R4, и R1 и R3 представляют собой H.
В одном варианте осуществления R6 представляет собой C1-C4 алкил, необязательно замещенный группой R10, C3-C5 гетероциклил, C3-C5 гетероарил или C3-C7 циклоалкил, где указанный гетероциклил, гетероарил и циклоалкил необязательно замещены группой R11; и R4 представляет собой H, -(C0-C5 алкил)(C1-C9 гетероциклил), -(C0-C5 алкил)(C3-C6 циклоалкил), -(C0-C5 алкил)(C1-C9 гетероарил), -(C0-C5 алкил)(C6-C10 арил), где указанный алкил необязательно замещен группой R8, и указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены группой R9.
В одном варианте осуществления формулы I, R1 представляет собой H; R2 представляет собой -NR3R4; R3 представляет собой H; и R6 представляет собой C3-C5 гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из оксо, -CF3, галогена, -C(O)C1-C6 алкила,
C1-C6 алкила, необязательно замещенного группой оксо или F,
-(C0-C2 алкил)C4-C5 гетероциклила, необязательно замещенного галогеном, оксо, C1-C3 алкилом или C(O)C1-C3 алкилом,
-(C0-C2 алкил)C3-C5 гетероарила, необязательно замещенного галогеном или C1-C3 алкилом,
-(C0-C2 алкил)фенила, необязательно замещенного C1-C3 алкилом, -CF3, галогеном, -CN, -ORa или -NRaRb, и
-(C0-C2 алкил)C6-C7 циклоалкила, необязательно замещенного оксо, C1-C3 алкилом или F. И в одном примере этого варианта осуществления, R4 представляет собой H.
В одном варианте осуществления формулы I, когда R4 представляет собой -(C0-C5 алкил)(C1-C5 гетероциклил), -(C0-C5 алкил)(C3-C6 циклоалкил), -(C0-C5 алкил)(C1-C9 гетероарил), -(C0-C5 алкил)(C6-C9 арил), тогда арил, циклоалкил, гетероарил и гетероциклил необязательно замещены 1-3 заместителями, независимо выбранными из оксо, C1-C3 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из оксо и F, -CN, -CF3, галогена, -C(O)C1-C6 алкила, -C(O)ORa, -C(O)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa, -(C0-C5 алкил)C1-C9 гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из галогена, оксо, C1-C3 алкила и C(O)C1-C3 алкила, -(C0-C5 алкил)C1-C9 гетероарила, необязательно замещенного 1-3 заместителями, независимо выбранными из галогена и C1-C3 алкила, -OCH2O-, -OCH2CH2O-, -OCH2CH2CH2O- и -OCH2(C4-C5 гетероциклил). Когда R4 представляет собой алкил, алкенил или алкинил, тогда алкил, алкенил и алкинил необязательно замещены 1-3 заместителями, независимо выбранными из оксо, F, ORa и NRaRb.
В одном варианте осуществления формулы I, когда R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют C1-C5 гетероциклил, тогда гетероциклил необязательно замещен 1-3 заместителями, независимо выбранными из оксо, F, C1-C3 алкила, -C(O)C1-C6 алкила и -C(О)ORa.
В одном варианте осуществления формулы I, когда R6 представляет собой C6 арил, C3-C8 циклоалкил, C3-C5 гетероарил и C3-C5 гетероциклил, тогда арил, циклоалкил, гетероарил и гетероциклил необязательно замещены 1-3 заместителями, независимо выбранными из оксо, C1-C6 алкила, необязательно замещенного 1-3 заместителями, независимо выбранными из оксо и F, -CN, -CF3, галогена, -OCH2O-, -OCH2CH2O-, -OCH2CH2CH2O-, -C(O)C1-C6 алкила, -C(О)ORa, -C(О)NRaRb, -(C0-C5 алкил)NRaRb, -(C0-C5 алкил)ORa, -(C0-C5 алкил)C1-C9 гетероциклила, необязательно замещенного 1-3 заместителями, независимо выбранными из галогена, оксо, C1-C3 алкила и C(O)C1-C3 алкила, -(C0-C5 алкил)C1-C9 гетероарила, необязательно замещенного 1-3 заместителями, независимо выбранными из галогена и C1-C3 алкила, -(C0-C5 алкил)фенила, необязательно замещенного 1-3 заместителями, независимо выбранными из галогена, -CN, -CF3, -ORa и -NRaRb, и -(C0-C5 алкил)C3-C6 циклоалкила, необязательно замещенного 1-3 заместителями, независимо выбранными из оксо, C1-C3 алкила и F. Когда R6 представляет собой алкил, алкенил или алкинил, тогда алкил, алкенил и алкинил необязательно замещены 1-3 заместителями, независимо выбранными из оксо, F, ORa и NRaRb.
В одном варианте осуществления формулы I, когда Ra и Rb представляют собой C1-C6 алкил, C6 арил, C3-C6 циклоалкил или C4-C5 гетероциклил, тогда алкил, арил, циклоалкил и гетероциклил необязательно замещены 1-3 заместителями, независимо выбранными из C1-C4 алкила, (C0-C3 алкил)ORc, оксо, галогена, NRcRd и C4-C5 гетероциклила. Когда Ra и Rb вместе с атомом азота, с которым они связаны, образуют C1-C5 гетероциклил, тогда гетероциклил необязательно замещен 1-3 заместителями, независимо выбранными из оксо, F, C1-C3 алкила, -C(O)C1-C6 алкила и -C(O)ORa.
В одном варианте осуществления формулы I, когда Rc и Rd представляют собой C1-C3 алкил, C3-C6 циклоалкил или фенил, тогда алкил, циклоалкил и фенил необязательно замещены 1-3 заместителями, независимо выбранными из галогена, CH3, OH, NH2, C(O)O(C1-C6 алкил) и C(O)NH(C1-C6 алкил).
В одном варианте осуществления Ra и Rb независимо представляют собой H, -CF3, -CHF2, -CH2F, C1-C6 алкил, фенил, C3-C6 циклоалкил или C4-C5 гетероциклил; где указанные алкил, арил и циклоалкил необязательно замещены C1-C4 алкилом, -(C0-C3 алкил)ORc, оксо, галогеном, NRcRd или C4-C5 гетероциклилом. В одном варианте осуществления Ra и Rb вместе с атомом азота, с которым они связаны, образуют C1-C5 гетероциклил, необязательно замещенный оксо, F, C1-C3 алкилом, -C(O)C1-C6 алкилом или -C(O)ORa. В одном варианте осуществления Ra и Rb независимо представляют собой H или C1-C3 алкил.
В одном варианте осуществления Rc и Rd независимо представляют собой H, C1-C3 алкил, C3-C6 циклоалкил или фенил, где указанные алкил, циклоалкил и фенил необязательно замещены галогеном, CH3, OH, NH2, C(O)O(C1-C6 алкил) или C(O)NH(C1-C6 алкил). В одном варианте осуществления Rc и Rd независимо представляют собой H или C1-C3 алкил.
В одном варианте осуществления R7 представляет собой H; R2 представляет собой -NR3S(O)2R4; R3 представляет собой H; и R4 представляет собой фенил, необязательно замещенный 1-3 группами R9. В одном варианте осуществления R2 представляет собой -NR3S(O)2R4; R3 представляет собой H; R4 представляет собой фенил, необязательно замещенный 1-3 заместителями, выбранными из C1-C3 алкила, -CF3 и галогена; Z представляет собой -NR5R6; R5 представляет собой H; и R6 представляет собой циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, и где R6 необязательно замещен 1-3 заместителями, выбранными из оксо, галогена и C1-C6 алкила.
В одном варианте осуществления R7 представляет собой H; R2 представляет собой -NR3R4; R3 представляет собой H; R5 представляет собой H; R6 представляет собой пиразолил, необязательно замещенный метилом и замещенный фенилом, где указанный фенил необязательно замещен одной или двумя группами, выбранными из метила, галогена, метокси, циано, трифторметила, гидрокси или трифторметокси.
В одном варианте осуществления соединение формулы I является, по меньшей мере, в 10 или более раз более селективным в ингибировании активности JAK2 киназы по сравнению с ингибированием активности каждой из JAK1, JAK3 и Tyk-2.
В одном варианте осуществления соединение по настоящему изобретению является примерно в 5 или более раз более селективным в ингибировании активности JAK3 киназы по сравнению с ингибированием активности JAK2 киназы. В другом варианте осуществления соединение по настоящему изобретению является примерно в 10 или более раз более селективным в ингибировании активности JAK3 киназы по сравнению с ингибированием активности JAK2 киназы.
Соединения по настоящему изобретению могут содержать асимметрические или хиральные центры и поэтому могут существовать в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений по настоящему изобретению, включая но не ограничиваясь этим: диастереомеры, энантиомеры и атропизомеры, а также их смеси, такие как рацемические смеси, составляют часть настоящего изобретения. Кроме того, настоящее изобретение охватывает все геометрические изомеры и изомеры положения. Например, если соединение по настоящему изобретению включает двойную связь или конденсированное кольцо, как цис-, так и транс-формы, а также их смеси охватываются как входящие в объем настоящего изобретения. Как отдельные изомеры положения, так и смесь изомеров положения, например, в результате N-окисления пиримидинильного и пиррозолильного колец, или E и Z формы соединений по настоящему изобретению (например, оксимные группы), также включены в объем настоящего изобретения.
В структурах, показанных в настоящей заявке, где стереохимия какого-либо конкретного хирального атома не указана, предусматриваются все стереоизомеры, и они включены как соединения по настоящему изобретению. Когда стереохимия указана заштрихованным конусом или пунктирной линией, представляющей конкретную конфигурацию, в этом случае стереоизомер таким образом указан и определен.
Соединения по настоящему изобретению могут существовать в несольватированной, а также в сольватированной форме с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобные, и предполагается, что настоящее изобретение, как оно определено формулой изобретения, охватывает как сольватированные, так и несольватированные формы.
В одном варианте осуществления соединения по настоящему изобретению могут существовать в различных таутомерных формах, и все такие формы охватываются как входящие в объем настоящего изобретения, определенный формулой изобретения. Термин "таутомер" или "таутомерная форма" относится к структурным изомерам с разной энергией, которые являются взаимопреобразующимися через низкий энергетический барьер. Например, таутомеры по протону (также известные как прототропные таутомеры) включают взаимопреобразования через миграцию протона, такие как кето-енольная и имин-енаминовая изомеризации. Таутомеры по валентности включают взаимопреобразования путем реорганизации некоторых из связывающих электронов.
Настоящее изобретение также охватывает изотопно-меченные соединения по настоящему изобретению, которые являются идентичными соединениям, указанным в настоящей заявке, но отличающиеся тем, что один или несколько атомов замещены атомом, имеющим атомную массу или массовое число отличные от атомной массы или массового числа, которые обычно присутствуют в природе. Все изотопы любого конкретного указанного атома или элемента предусматриваются как входящие в объем настоящего изобретения. Иллюстративные изотопы, которые могут быть включены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и иода, такие как 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18О, 32P, 33P, 35S, 18F, 36Cl, 123I и 125I, соответственно. Некоторые изотопно-меченные соединения по настоящему изобретению (например, соединения, меченные 3H и 14C) являются полезными в анализах дистрибуции соединения и/или тканевого субстрата. Изотопы трития (т.е. 3H) и углерода-14 (т.е. 14C) являются полезными, благодаря простоте их получения и детекции. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2H), может дать некоторые терапевтические преимущества в результате лучшей метаболической стабильности (например, увеличенный период полувыведения in vivo или потребность в более низких дозах) и, следовательно, могут быть предпочтительными в некоторых обстоятельствах. Позитрон-испускающие изотопы, такие как 15O, 13N, 11C и 18F, являются полезными для исследований методом позитрон-эмиссионной томографии (PET) для исследования степени занятости субстрата рецептором. Изтопно-меченные соединения по настоящему изобретению получают, в основном, следуя процедурам, аналогичным тем, которые раскрыты в схемах и/или в примерах, представленных в настоящей заявке ниже, путем замещения не меченого изотопом реагента изотопно-меченным реагентом.
СИНТЕЗ ПИРАЗОЛОПИРИМИДИНОВЫХ СОЕДИНЕНИЙ-ИНГИБИТОРОВ JAK
Соединения по настоящему изобретению можно синтезировать с использованием путей синтеза, описанных в настоящей заявке. В некоторых вариантах осуществления, можно использовать способы, хорошо известные в химии, в дополнение к описанию, содержащемуся в настоящей заявке, или в свете этого описания. Исходные вещества, как правило, являются доступными из коммерческих источников, таких как Aldrich Chemicals (Milwaukee, Wis.), или их можно легко получить с использованием способов, хорошо известных специалистам в данной области (например, можно получить способами, в общем виде описанными в Louis F. Fieser and Mary Fieser, Reagents for Organic Synthesis, v. 1-19, Wiley, N. Y. (1967-1999 ed.), Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая дополнения (также доступные через Beilstein online database)) или Comprehensive Heterocyclic Chemistry, Editors Katrizky and Rees, Pergamon Press, 1984.
Соединения по настоящему изобретению можно получить отдельно или в виде библиотек соединений, включающих, по меньшей мере, 2, например, от 5 до 1000 соединений или от 10 до 100 соединений по настоящему изобретению. Библиотеки соединений по настоящему изобретению можно получить с использованием комбинаторного "разделение и смешивание" подхода или путем нескольких параллельных процессов синтеза с использованием либо фазы раствора, либо твердофазной химии и процедур, известных специалистам в данной области. Таким образом, в соответствии со следующим аспектом настоящего изобретения, обеспечивается библиотека соединений, включающая, по меньшей мере, 2 соединения по настоящему изобретению, их энантиомеры, диастереомеры или фармацевтически приемлемые соли.
Для иллюстративных целей, схема реакций 1, представленная ниже, представляет пути получения для синтеза соединений по настоящему изобретению, а также ключевых промежуточных соединений. Для более подробного описания отдельных реакционных стадий, см. раздел “Примеры” ниже. Специалистам в данной области должно быть понятно, что для синтеза соединений по настоящему изобретению можно использовать другие пути синтеза. Хотя конкретные исходные вещества и реагенты показаны на схемах и обсуждаются ниже, их легко можно заменить другими исходными веществами и реагентами для получения различных производных и/или реакционных условий. Кроме того, многие соединения, полученные способами, описанными ниже, могут быть далее модифицированы в свете настоящего раскрытия с использованием традиционных химических приемов, хорошо известных специалистам в данной области.
Соединения по настоящему изобретению можно получить из коммерчески доступных исходных веществ с использованием общих способов, проиллюстрированных в настоящей заявке.
Схема реакций 1
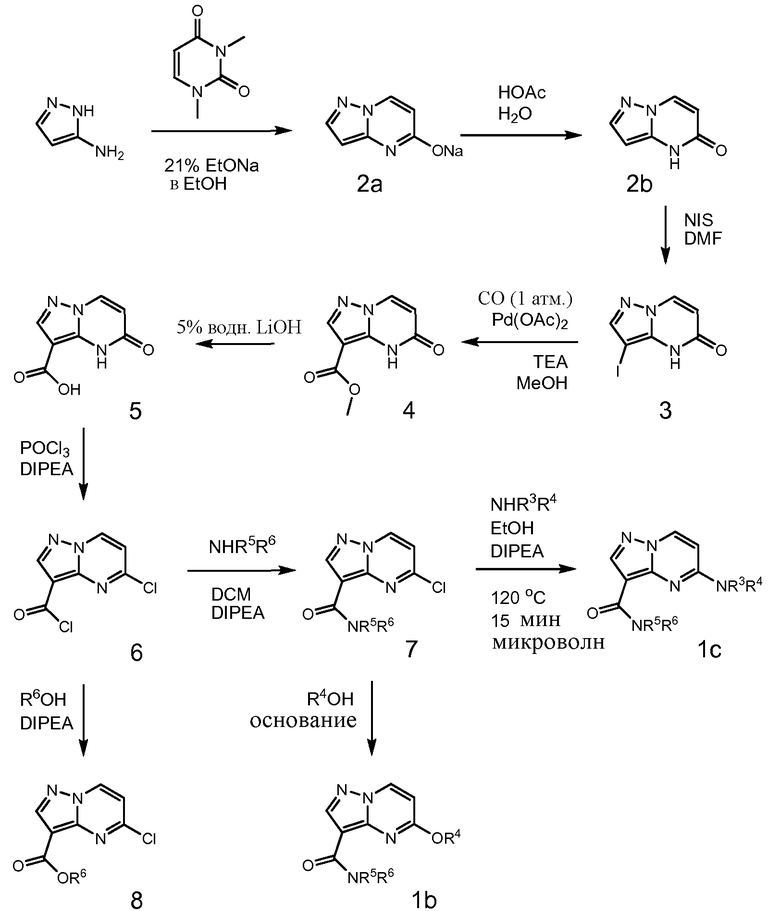

Соединения формулы 1 можно синтезировать, как показано на Схеме реакций 1. Например, коммерчески доступные соединения 3-аминопиразол и 1,3-диметилурацил могут взаимодействовать вместе в растворе этоксида натрия с получением соединения 2a, которое может быть преобразовано из формы натриевой соли в соединение 2b путем обработки разбавленной кислотой. Соединение 2b можно подвергнуть иодированию с использованием N-иодсукцинимида (NIS) в DMF с получением соединения 3. Карбонилирование соединения 3 в щелочных условиях (таких как триэтиламин (TEA)) с использованием оксида углерода и палладиевого катализатора в метаноле дает метиловый эфир соединения 4, который можно гидролизовать в водном растворе гидроксида лития с получением соединения 5. Нагревание соединения 5 в смеси оксихлорида фосфора и диизопропилэтиламина (DIPEA) дает дихлорированное соединение 6, которое представляет собой общее промежуточное соединение для конечного синтеза соединений Ia, Ib и Ic. Таким образом, соединение 6 можно подвергнуть взаимодействию с первичным или вторичным амином в мягких условиях с получением амида 7, затем в более жестких условиях с вторым амином или алкоксидом с получением соединений Ic или Ib, соответственно. Альтернативно, соединение 6 можно подвергнуть взаимодействию в щелочных условиях со спиртом с получением сложных эфиров формулы 8, которые можно подвергнуть дальнейшему взаимодействию с первичным или вторичным амином с получением соединений формулы Ia.
Схема реакций 2
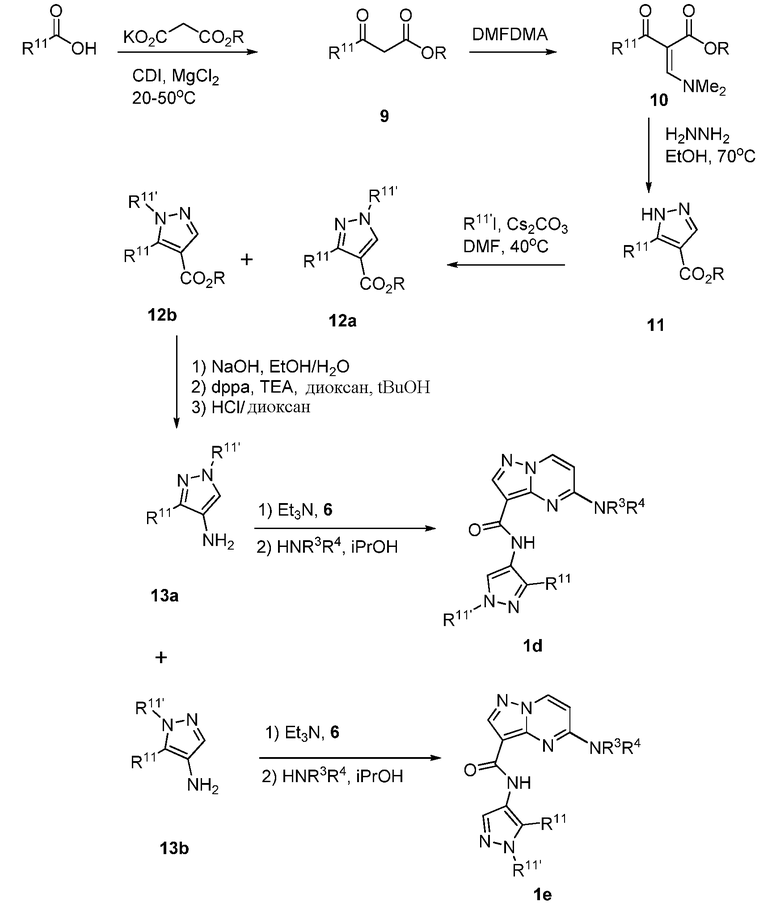
Соединения по настоящему изобретению можно синтезировать, как показано на Схеме 2. Например, коммерчески доступные бензойные кислоты можно подвергнуть взаимодействию с 3-этокси-3-оксопропаноатом калия в присутствии карбонилдиимидазола (CDI) и хлорид магния с получением β-кето-эфира 9 (где R представляет собой алкил, например, этил). Соединение 9 можно подвергнуть нагреванию с 1,1-диметокси-N,N-диметилметанамином (N,N-диметилформамидDMA) с получением соединения 10. Циклизация соединения 10 с использованием гидразина в этаноле обеспечивает получение пиразольного соединения 11. Алкилирование соединения 11 алкилгалогенидами в присутствии основания, такого как карбонат цезия, позволяет получить смесь региоизомеров 12a и 12b (где R11 представляет собой необязательно замещенный алкил). Гидролиз этилового эфира, с последующей перегруппировкой Курциуса с использованием азида дифенилфосфоновой кислоты (dppa) и трет-бутанола обеспечивает получение трет-бутилкарбамат-защищенного амино-пиразола, у которого удаляют защиту при помощи HCl, с получением амино-пиразольных соединений 13a и 13b. Региоизомеры 13a и 13b можно разделить с использованием хроматографии на диоксиде кремния. Ацилирование каждого региоизомера отдельно при помощи 5-хлорпиразоло[1,5-a]пиримидин-3-карбонилхлорида (соединение 6) в присутствии триэтиламина, с последующим аминированием с использованием микроволнового облучения обеспечивает получение соединений формулы 1d и 1e.
Схема реакций 3
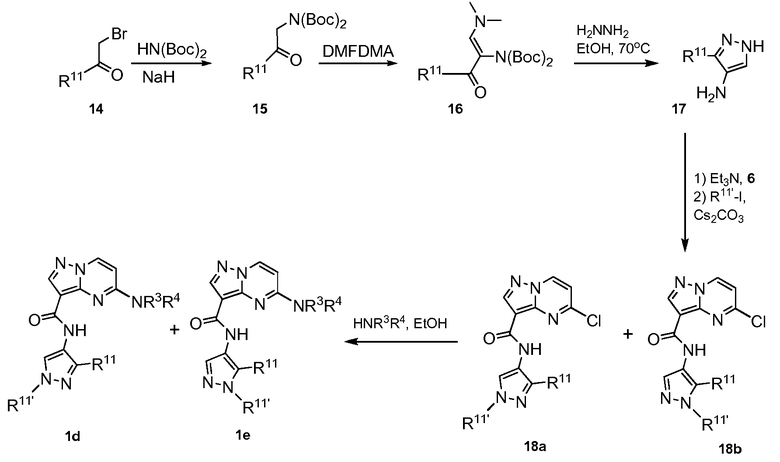
Альтернативный способ синтеза соединений по настоящему изобретению проиллюстрирован на Схеме реакций 3. Алкилирование ди-трет-бутилиминодикарбоната при помощи гидрида натрия и различных α-бромкетонов 14 дает соединение 15. Соединение 15 можно подвергнуть нагреву с N,N-диметилформамидомDMA с получением соединения 16. Циклизация соединения 16 с использованием гидразина в этаноле обеспечивает получение пиразольного соединения 17. Ацилирование каждого региоизомера отдельно соединением 6 в присутствии триэтиламина, с последующим алкилированием пиразола алкилгалогенидами обеспечивает получение соединения 18a и 18b (где R11 представляет собой необязательно замещенный алкил). С использованием микроволнового облучения аминирование дает соединения формулы 1d и 1e.
Схема реакций 4
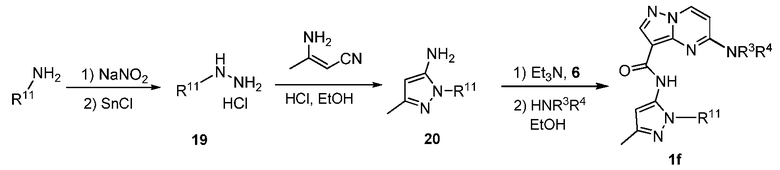
Схема реакций 4 иллюстрирует синтез соединений формулы 1f. Коммерчески доступные анилины подвергают диазотированию и опосредованному хлоридом олова восстановлению, что обеспечивает получение соединения 19. Конденсация соединения 19 с 3-аминокротонитрилом в этанольном растворе хлористоводородной кислоты дает амино-пиразольное соединение 20. Ацилирование при помощи соединения 6 в присутствии триэтиламина, с последующим аминированием с использованием микроволнового облучения обеспечивает получение соединений формулы 1f.
Схема реакций 5
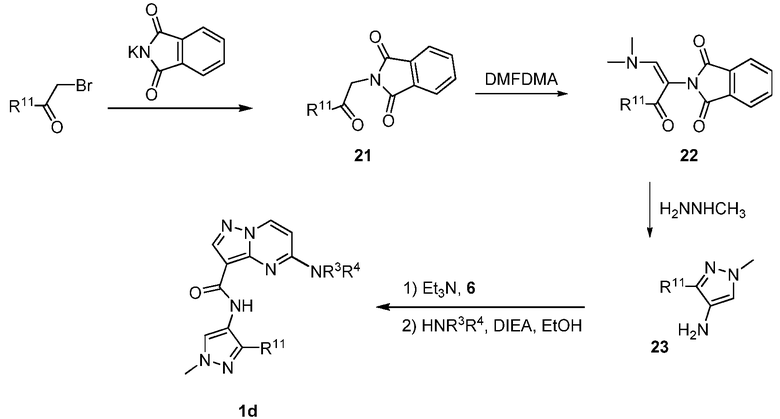
Альтернативный способ синтеза соединений формулы 1 описан на Схеме реакций 5. Алкилирование фталимида калия при помощи α-бромкетонов дает соединение 21. Конденсация с N,N-диметилформамидомDMA дает соединения 22. Соединения формулы 22 могут быть циклизованы при помощи N-метилгидразина с получением алкилированного пиразола 23. Ацилирование соединения 23 при помощи соединения 6 в присутствии триэтиламина, с последующим аминированием с использованием микроволнового облучения и замещенных аминов обеспечивает получение соединений формулы 1d.
Схема реакций 6
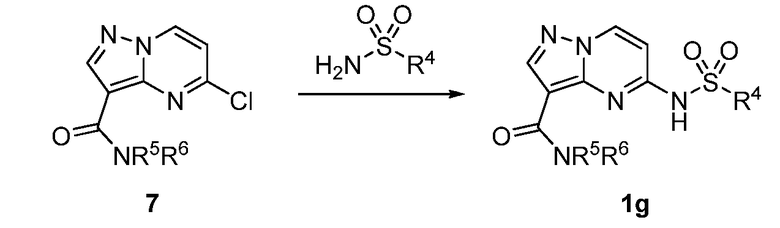
Соединения формулы 1g можно синтезировать, как показано на Схеме 6. Присоединение первичных сульфонамидов к 5-хлорпиразоло[1,5-a]пиримидиновому промежуточному соединению 7, опосредованное основанием, таким как карбонат цезия, в полярном апротонном растворителе, таком как 1,2-диметоксиэтан, позволяет получить соединения формулы 1g.
Схема реакций 7
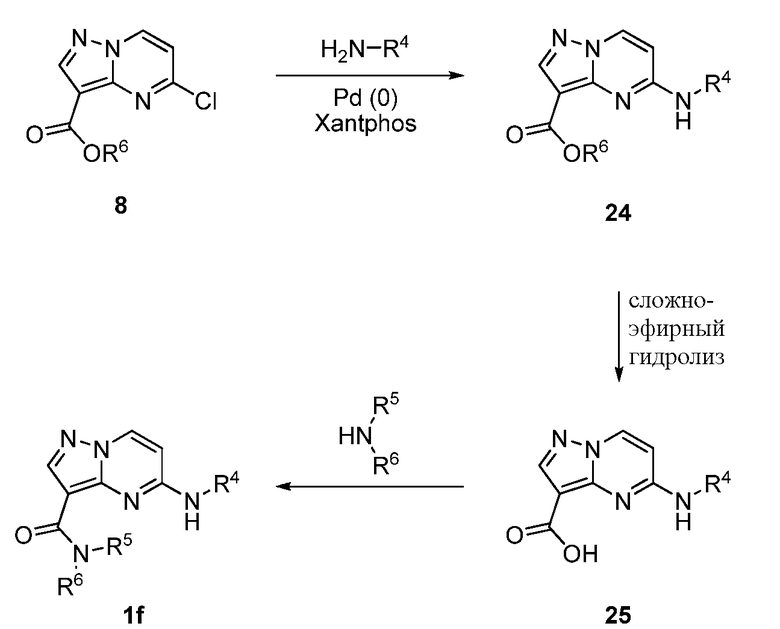
Соединения формулы 1f можно синтезировать, как показано на Схеме 7. Сочетание амино-замещенного R4 с 5-хлорпиразоло[1,5-a]пиримидиновым промежуточным соединением 8 в опосредованных палладием условиях с использованием лиганда, такого как Xantphos, приводит к соединению 24. Сложноэфирный гидролиз в щелочных условиях позволяет получить кислоту 25. Образование амида для выхода на соединения формулы 1f можно осуществить через добавление аминов к хлорангидриду кислоты 25.
Схема реакций 8
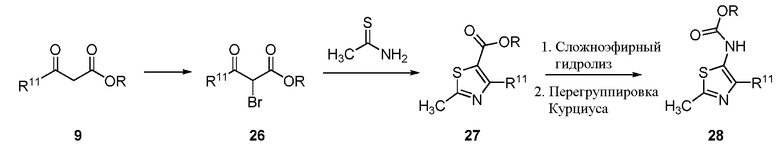
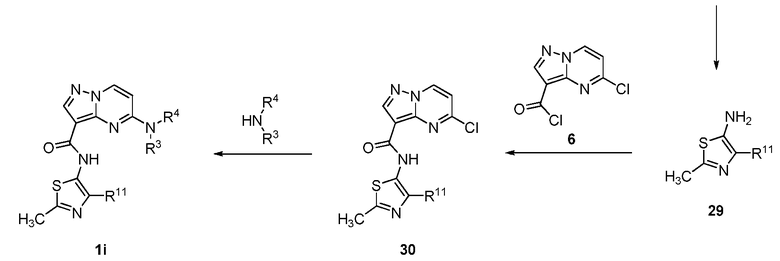
Соединения формулы 1i можно синтезировать, как показано на Схеме 8. Бромирование арилкетоэфира 9 (где R представляет собой алкил, например, этил) дает бромид 26. Алкилирование бромида 26 при помощи тиоацетамида с последующим циклодегидратацией при повышенной температуре позволяет получить тиазол 27. Гидролиз сложного эфира 27 в щелочных условиях с последующей перегруппировкой Курциуса с использованием дифенилфосфорилазида обеспечивает получение карбамата 28, после улавливания с использованием спирта, таким как трет-бутанол. Удаление карбамата соединения 28 в кислотных условиях приводит к 5-аминотиазолу 29, который при сочетании с хлорангидридом кислоты 6 обеспечивает получение амида 30. Аминирование хлорида 30 с использованием микроволнового облучения позволяет получить соединения формулы 1i.
Схема реакций 9

Соединения формулы 1j можно синтезировать, как показано на Схеме 9. Конденсация арилкетоэфира 9 (где R представляет собой алкил, например, этил) с 1,1-диметокси-N,N-диметилметанамином дает аминоэфир 31, который при обработке гидроксиламином и нагревании позволяет получить изоксазол 32. Гидролиз сложного эфира 32 в кислотных условиях с последующей перегруппировкой Курциуса дает карбамат 33, после улавливания с использованием спирта, такого как трет-бутанол. Удаление карбамата соединения 33 в кислотных условиях приводит к 4-аминоизоксазолу 34, который, при сочетании с хлорангидридом кислоты 6, обеспечивает получение амида 35. Аминирование хлорида 35 использованием микроволнового облучения позволяет получить соединения формулы 1j.
Схема реакций 10
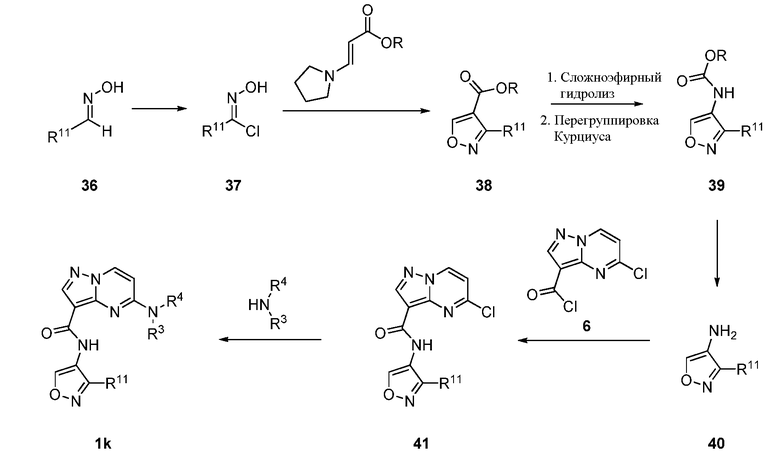
Соединения формулы 1k можно синтезировать в соответствии со Схемой 10. Хлорирование арилоксима 36 при помощи N-хлорсукцинимида обеспечивает получение α-хлорбензальдоксима 37. Обработка α-хлорбензальдоксима 37 третичным аминовым основанием, таким как триэтиламин, дает бензонитрил N-оксид, который участвует в диполярном циклоприсоединении с эфиром 3-пирролидин-1-ил-акриловой кислоты, с получением изоксазола 38 (где R представляет собой алкил, например, этил). Гидролиз сложного эфира 38 в кислотных условиях с последующим перегруппировкой Курциуса с использованием дифенилфосфорилазида обеспечивает получение карбамата 39, после улавливания с использованием спирта, такого как трет-бутанол. Удаление карбамата соединения 39 в кислотных условиях приводит к 4-аминоизоксазолу 40, который при сочетании с хлорангидридом кислоты 6 обеспечивает получение амида 41. Аминирование хлорида 41 с использованием микроволнового облучения позволяет получить соединения формулы 1k.
Схема реакций 11
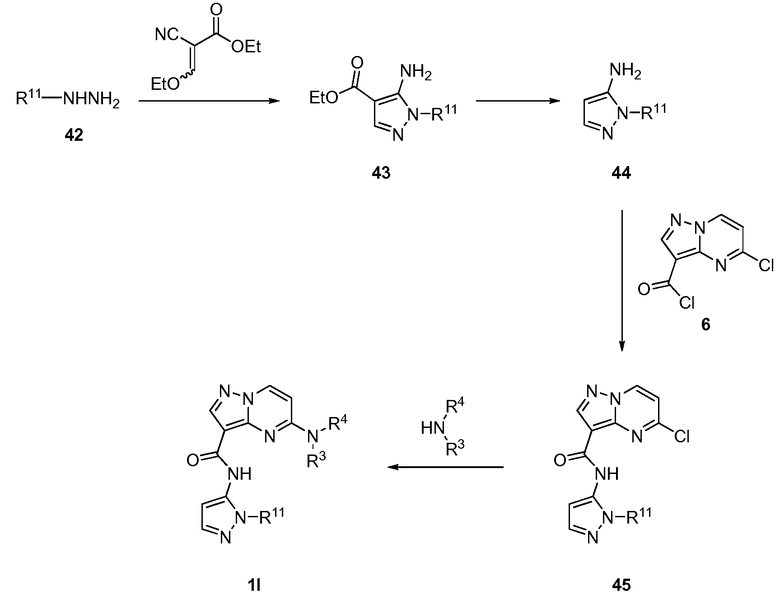
Соединения формулы 11 можно синтезировать в соответствии со Схемой 11. Присоединение арилгидразина 42 к этил 2-циано-3-этоксиакрилату обеспечивает получение 5-амино-1-арилпиразола 43. Гидролиз сложного эфира 43 с последующим декарбоксилированием полученной кислоты осуществляют в кислотных условиях с получением 5-амино-1-арилпиразола 44, который при сочетании с хлорангидридом кислоты 6 обеспечивает получение амида 45. Аминирование хлорида 45 с использованием микроволнового облучения позволяет получить соединения формулы 11.
При получении соединений по настоящему изобретению, может быть необходима защита отдаленной функциональной группы (например, первичного или вторичного амина) в промежуточных соединениях. Необходимость в такой защите зависит от природы отдаленной функциональной группы и условий способов получения. Подходящие амино-защитные группы (NH-Pg) включают ацетил, трифторацетил, трет-бутоксикарбонил (BOC), бензилоксикарбонил (CBz) и 9-флуоренилметиленооксикарбонил (Fmoc). Необходимость в такой защите легко может определить специалист в данной области. Общее описание защитных групп и их использование см. в T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991.
Соединения по настоящему изобретению можно получить из легко доступных исходных веществ с использованием общих способов, проиллюстрированных в настоящей заявке.
СПОСОБЫ РАЗДЕЛЕНИЯ
В каждой из иллюстративных Схем может быть выгодным разделение продуктов реакции, отделяя их один от другого и/или от исходних веществ. Желаемые продукты каждой стадии или ряда стадий разделяют и/или очищают (далее - разделяют) до желаемой степени гомогенности методами, традиционно используемыми в данной области техники. Типично такие разделения включают мультифазную экстракцию, кристаллизацию из растворителя или смеси растворителей, дистилляцию, сублимацию или хроматографию. Хроматография может включать любое количество способов, включая, например: обращенно-фазовую и с нормальной фазой; вытеснительную в зависимости от размера; ионно-обменную; методы и оборудование для жидкостной хроматографи высокого, среднего и низкого давления; аналитическую в небольшом масштабе; в псевдоожиженном слое (SMB) и препаративную тонко- или толстослойную хроматографию, а также крупномасштабную тонкослойную и флэш-хроматографию.
Другой класс способов разделениия включает обработку смеси реагентом, выбранным для связывания (или чтобы каким-либо иным образом орбеспечить возможность разделения) непрореагировавшего исходного вещества, побочного продукта реакции или подобных веществ. Такие реагенты включают адсорбенты или абсорбенты, такие как активированный уголь, молекулярные сита, ионно-обменные среды или подобные. Альтернативно, реагенты могут представлять собой кислоты в случае основного вещества, основания в случае кислотного вещества, связывающие реагенты, такие как антитела, связывающие белки, селективные хелатообразователи, такие как краун-эфиры, реагенты для жидкость/жидкостной ионной экстракции (LIX) или подобные.
Выбор подходящих способов разделения зависит от природы веществ, подлежащих разделению. Например, от температуры кипения и молекулярной массы в дистилляции и сублимации, присутствия или отсутствия полярных функциональных групп в хроматографии, стабильности веществ в кислотной и щелочной среде в мультифазной экстракции и т.п. Специалист в данной области может использовать способы, которые наиболее вероятно обеспечат достижение желаемого разделения.
Диастереомерные смеси можно разделить на их индивидуальные диастереоизомеры на основании их физико-химических отличий способами, хорошо известными специалистам в данной области, такими как хроматография и/или фракционированная кристаллизация. Энантиомеры можно разделить путем преобразования энантиомерной смеси в диастереомерную смесь путем взаимодействия с подходящим оптически активным соединением (например, хиральным вспомогательным веществом, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделения диастереоизомеров и путем преобразования (например, гидролиза) индивидуальных диастереоизомеров в соответствующие чистые энантиомеры. Также некоторые соединения по настоящему изобретению могут представлять собой атропизомеры (например, замещенные биарила), и их рассматривают как часть настоящего изобретения. Энантиомеры также можно разделить с использованием хиральной ВЭЖХ колонки.
Отдельный стереоизомер, например, энантиомер, по существу, не содержащие его стереоизомера, можно получить путем разделения рацемической смеси при помощи способа, такого как образование диастереомеров с использованием оптически активных агентов разделения (Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds, John Wiley & Sons, Inc., New York, 1994; Lochmuller, C. H., J. Chromatogr., 113(3):283-302 (1975)). Рацемические смеси хиральных соединений по настоящему изобретению можно разделить и выделить любым подходящим способом, включая: (1) образование ионной диастереомерной соли с использованием хиральных соединений и разделение методом фракционированной кристаллизации или другими способами, (2) образование диастереомерных соединений с использованием хиральных агентов дериватизации, разделение диастереомеров и преобразование в чистые стереоизомеры и (3) разделение по существу чистых или обогащенных стереоизомеров непосредственно в хиральных условиях. См.: Drug Stereochemistry, Analytical Methods and Pharmacology, Irving W. Wainer, Ed., Marcel Dekker, Inc., New York (1993).
Диастереомерные соли могут быть образованы путем взаимодействия энантиомерно чистых хиральных оснований, таких как бруцин, хинин, эфедрин, стрихнин, α-метил-β-фенилэтиламин (амфетамин) и подобных, с асимметрическими соединениями, содержащими кислотные функциональные группы, такие как карбоновая кислота и сульфоновая кислота. Диастереомерные соли можно разделить при помощи фракционированной кристаллизации или ионной хроматографии. Для разделения оптических изомеров аминосоединений, добавление хиральных карбоновых или сульфоновых кислот, таких как камфорсульфоновая кислота, винная кислота, миндальная кислота или молочная кислота, может привести к образованию диастереомерной соли.
Альтернативно, субстрат, подлежащий разделению, подвергают взаимодействию с одним энантиомером хирального соединения с образованием диастереомерной пары (Eliel, E. и Wilen, S., Stereochemistry of Organic Compounds, John Wiley & Sons, Inc., New York, 1994, p. 322). Диастереомерные соединения могут быть образованы путем взаимодействия асимметрических соединений с энантиомерно чистыми хиральными агентами дериватизации, такими как ментильные производные, с последующим разделением диастереомеров и гидролизом с получением чистого или обогащенного энантиомера. Способ определения оптической чистоты включает получение хиральных сложных эфиров, таких как ментиловый эфир, например, (-) ментилхлорформиат, в присутствии основания или сложного эфира Мошера, α-метокси-α-(трифторметил)фенилацетата (Jacob, J. Org. Chem. 47:4165 (1982)), рацемической смеси и анализ ЯМР спектра на присутствие двух атропизомерных энантиомеров или диастереомеров. Стабильные диастереомеры атропизомерных соединений можно разделить и выделить с использованием хроматографии с нормальной и обращенной фазой, следуя способам разделения атропизомерных нафтил-изохинолинов (WO 96/15111). В соответствии со способом (3), рацемическую смесь двух энантиомеров можно разделить при помощи хроматографии с использованием хиральной стационарной фазы (Chiral Liquid Chromatography W. J. Lough, Ed., Chapman and Hall, New York, (1989); Okamoto, J. of Chromatogr. 513:375-378 (1990)). Обогащенные или очищенные энантиомеры можно разделить способами, используемыми для разделения других хиральных молекул с асимметрическими атомами углерода, такими как оптическое вращение и круговой дихроизм.
Изомеры положения, например, E и Z формы, соединений по настоящему изобретению и промежуточные соединения для их синтеза можно наблюдать с использованием методов анализа, таких как ЯМР и аналитическая ВЭЖХ. Для некоторых соединений, где энергетический барьер для взаимопреобразования является достаточно высоким, E и Z изомеры можно разделить, например, путем препаративной ВЭЖХ.
БИОЛОГИЧЕСКАЯ ОЦЕНКА
Предыдущие исследования показали, что выделенный киназный домен человеческого JAK2 фосфорилирует пептидные субстраты в киназных анализах in vitro. Salzman et al., Biochem. Biophys. Res. Commun. 246:627-633 (2004). Каталитически активный киназный домен человеческого JAK2 очищали из экстрактов клеток насекомого SF9, инфицированных рекомбинантным бакуловирус- экспрессирующим вектором, кодирующим человеческий JAK2 киназный домен (аминокислотные остатки D812-G1132 в соответствии с нумерацией GenBank sequence accession number NP_004963.1). Активность JAK2 киназного домена можно измерить различными прямыми и косвенными способами, включая количественное определение фосфорилирования пептидных субстратов, происходящих из человеческого JAK3 белка, Salzman et al., Biochem. Biophys. Res. Commun. 246:627-633 (2004). Активность JAK2 киназного домена измеряли in vitro путем отслеживания фосфорилирования происходящих из JAK3 пептидов с использованием метода Caliper LabChip (см. Примеры).
ВВЕДЕНИЕ ПИРАЗОЛОПИРИМИДИНОВЫХ СОЕДИНЕНИЙ
Другой вариант осуществления включает способ лечения или уменьшения тяжести заболевания или состояния, реагирующего на ингибирование активности JAK2 киназы у пациента. Способ включает стадию введения пациенту терапевтически эффективного количества соединения по настоящему изобретению.
Другой вариант осуществления включает способ лечения или уменьшения тяжести заболевания или состояния, реагирующего на ингибирование активности JAK3 киназы у пациента. Способ включает стадии введения пациенту терапевтически эффективного количества соединения по настоящему изобретению.
В одном варианте осуществления соединение по настоящему изобретению вводят пациенту в терапевтически эффективном количестве для лечения или уменьшения тяжести заболевания или состояния, реагирующего на ингибирование активности JAK киназы, и указанное соединение является, по меньшей мере, в 10 или более раз более селективным в ингибировании активности JAK2 киназы по сравнению с ингибированием активности каждой из JAK1, JAK3 и Tyk-2.
В одном варианте осуществления заболевание или состояние представляет собой рак, удар, диабет, гепатомегалию, сердечно-сосудистое заболевание, рассеянный склероз, болезнь Альцгеймера, кистозный фиброз, вирусное заболевание, аутоиммунные заболевания, атеросклероз, рестеноз, псориаз, аллергические расстройства, воспаление, неврологические расстройства, гормонально-зависимое заболевание, состояния, связанные с трансплантацией органов, иммунодефицитные расстройства, деструктивные костные расстройства, проиферативные расстройства, инфекционные заболевания, состояния, связанные с клеточной гибелью, тромбин-индуцированную агрегацию тромбоцитов, заболевание печени, патологические иммунные состояния с T-клеточной активацией, расстройства ЦНС или миелопролиферативное расстройство.
В одном варианте осуществления заболевание или состояние представляет собой рак.
В одном варианте осуществления заболевание представляет собой миелопролиферативное расстройство.
В одном варианте осуществления миелопролиферативное расстройство представляет собой истинную полицитемию, эссенциальный тромбоцитоз, миелофиброз или хронический миелогенный лейкоз (CML).
В одном варианте осуществления рак представляет собой рак молочной железы, яичника, шейки матки, предстательной железы, яичек, полового члена, мочеполовых путей, семиному, рак пищевода, гортани, желудочный рак, рак желудка, желудочно-кишечного тракта, кожи, кератоакантому, фолликулярную карциному, меланому, рак легкого, мелкоклеточную карциному легкого, не-мелкоклеточную карциному легкого (NSCLC), аденокарциному легкого, сквамозную карциному легкого, рак толстой кишки, поджелудочной железы, щитовидной железы, папиллярный, мочевого пузыря, печени, желчных протоков, почки, кости, миелоидные расстройства, лимфоидные расстройства, волосисто-клеточный рак, рак буккальной полости и глотки (оральный), губы, языка, рта, слюнной железы, глотки, тонкого кишечника, толстой кишки, прямой кишки, анальный, почечный, предстательной железы, вульвы, щитовидной железы, толстого кишечника, эндометрия, матки, головного мозга, центральной нервной системы, рак брюшной полости, гепатоклеточный рак, рак головы, рак шеи, болезнь Ходжкина или лейкоз.
В одном варианте осуществления сердечно-сосудистое заболевание представляет собой рестеноз, кардиомегалию, атеросклероз, инфаркт миокарда или застойную сердечную недостаточность.
В одном варианте осуществления нейродегенеративное заболевание представляет собой болезнь Альцгеймера, болезнь Паркинсона, амиотрофический боковой склероз, болезнь гентингтона и церебральную ишемию и нейродегенеративное заболевание, вызванное травматическим поражением, глутаматной нейротоксичностью или гипоксией.
В одном варианте осуществления воспалительное заболевание представляет собой ревматоидный артрит, псориаз, контактный дерматит или аллергические реакции замедленного типа.
В одном варианте осуществления аутоиммунное заболевание представляет собой волчанку или рассеянный склероз.
Соединение по настоящему изобретению можно вводить любым путем, подходящим для заболевания или состояния, подлежащего лечению. Подходящие пути включают пероральный, парентеральный (включая подкожный, внутримышечный, внутривенный, врутриартериальный, врутрикожный, интратекальный и эпидуральный), чрескожный, ректальный, назальный, местный (включая буккальный и сублингвальный), вагинальный, интраперитонеальный, внутрилегочный и интраназальный. Для местного иммуносупрессивного лечения, соединения можно вводить в очаг поражения, включая перфузию или осуществление каким-либо иным образом контакта трансплантата с ингибитором до трансплантации. Должно быть понятно, что предпочтительный путь может варьировать в зависимости, например, от состояния реципиента. Когда соединение по настоящему изобретению вводят перорально, оно может быть сформулировано в виде пилюли, капсулы, таблетки и т.п. с фармацевтически приемлемым носителем или эксципиентом. Когда соединение по настоящему изобретению вводят парентерально, оно может быть сформулировано с фармацевтически приемлемым парентеральным носителем и в стандартной лекарственной форме для инъекций, как подробно описано ниже.
Доза для лечения человека, который является пациентом, может находиться в пределах от около 10 мг до около 1000 мг соединения по настоящему изобретению. Типичная доза может составлять около 100 мг до около 300 мг соединения по настоящему изобретению. Дозу можно вводить один раз в день (QD), два раза в день (BID) или более часто, в зависимости от фармакокинетических и фармакодинамических свойств, включая абсорбцию, дистрибуцию, метаболизм и скорость выведения из организма конкретного соединения. Кроме того, факторы токсичности могут влиять на дозу и режим введения. При введении пероральным путем, пилюлю, капсулу или таблетку можно вводить ежедневно или реже в течение определенного периода времени. Схему можно повторить в виде нескольких циклов терапии.
Другой вариант осуществления включает способ лечения или профилактики рака у млекопитающего, нуждающегося в таком лечении, при этом способ включает введение указанному млекопитающему терапевтически эффективного количества соединения формул I-Ia, его стереоизомера, таутомера, пролекарства или фармацевтически приемлемой соли.
Другой вариант осуществления включает соединения формул I-Ia, стереоизомер, таутомер, пролекарство или фармацевтически приемлемую соль такого соединения для применения в терапии.
Другой вариант осуществления включает применение соединения формул I-Ia, его стереоизомера, таутомера, пролекарства или фармацевтически приемлемой соли для получения лекарственного средства для лечения заболевания, описанного в настоящей заявке (например, рака или воспалительного заболевания).
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ПИРАЗОЛОПИРИМИДИНОВЫХ СОЕДИНЕНИЙ
Другой вариант осуществления включает фармацевтическую композицию, которая включает соединение по настоящему изобретению и фармацевтически приемлемый носитель, адъювант или наполнитель.
В одном варианте осуществления фармацевтическая композиция также включает дополнительное терапевтическое средство, выбранное из антипролиферативного средства, противовоспалительного средства, иммуномодулирующего средства, нейротропного фактора, средства для лечения сердечно-сосудистого заболевания, средства для лечения заболевания печени, противовирусного средства, средства для лечения гематологических расстройств, средства для лечения диабета или средства для лечения иммунодефицитных расстройств.
В одном варианте осуществления соединение по настоящему изобретению присутствует в фармацевтической композиции в количестве, которое детектируемым образом ингибирует активность JAK2 киназы, вместе с фармацевтически приемлемым носителем, адъювантом или наполнителем.
В одном варианте осуществления соединение по настоящему изобретению присутствует в фармацевтической композиции в количестве, которое детектируемым образом ингибирует активность JAK3 киназы, вместе с фармацевтически приемлемым носителем, адъювантом или наполнителем.
В одном варианте осуществления соединение по настоящему изобретению присутствует в фармацевтической композиции в количестве, которое детектируемым образом ингибирует активность JAK2 киназы, и является, по меньшей мере, в 10 или более раз более селективным в ингибировании активности JAK2 киназы по сравнению с ингибированием активности каждой из JAK1, JAK3 и Tyk-2.
Типичную композицию получают путем смешивания соединения по настоящему изобретению и носителя, разбавителя или эксципиента. Подходящие носители, разбавители и эксципиенты хорошо известны специалистам в данной области и включают вещества, такие как углеводы, воски, водорастворимые и/или водонабухаемые полимеры, гидрофильные или гидрофобные вещества, желатин, масла, растворители, воду и подобные вещества. Конкретный используемый носитель, разбавитель или эксципиент зависит от способа и назначения, для которого используют соединение по настоящему изобретению. Растворители, как правило, выбирают на основании растворителей, которые специалист в данной области считает безопасными (GRAS) для введения млекопитающему. Как правило, безопасные растворители представляют собой нетоксичные водные растворители, такие как вода и другие нетоксичные растворители, которые являются растворимыми в воде или смешиваемыми с водой. Подходящие водные растворители включают воду, этанол, пропиленгликоль, полиэтиленгликоли (например, PEG400, PEG300) и т.п. и их смеси. Композиции также могут включать один или несколько буферов, стабилизаторов, поверхностно-активных веществ, смачивающих веществ, смазывающих веществ, эмульгаторов, суспендирующих веществ, консервантов, антиокидантов, веществ, делающих композицию непрозрачной, агентов скольжения, технологических добавок, красителей, подсластителей, ароматизаторов, отдушек и других известных добавок для получения лекарственного средства (т.е. соединения по настоящему изобретению или содержащей его фармацевтической композиции) в приятной на вид форме или для облегчения получения фармацевтического продукта (т.е. лекарственного средства).
Композиции можно получить с использованием традиционных процедур растворения и смешивания. Например, сыпучее лекарственное вещество (т.е. соединение по настоящему изобретению или стабилизированная форма соединения, такая как комплекс с циклодекстриновым производным или другим известным комплексообразующим веществом) растворяют в подходящем растворителе в присутствии одного или нескольких эксципиентов, описанных выше. Соединение по настоящему изобретению типично формулируют в фармацевтические лекарственные формы для обеспечения легко контролируемого дозирования лекарственного средства и для обеспечения следования пациента предписанному режиму лечения.
Фармацевтическая композиция (или состав) для применения может быть упакована различными способами в зависимости от способа, используемого для введения лекарственного средства. Как правило, коммерческое изделие включает контейнер, содержащий помещенную в него фармацевтическую композицию в подходящей форме. Подходящие контейнеры хорошо известны специалистам в данной области и включают такие материалы, как бутыли (пластиковые и стеклянные), саше, ампулы, пластиковые пакеты, металлические цилиндры и т.п. Контейнер также может включать устройство, защищающее от проникновения в него, препятствующее доступу к содержимому упаковки, когда это не нужно. Кроме того, контейнер имеет помещенную в него этикетку, которая описывает содержимое контейнера. Этикетка также может включать соответствующие предупреждения.
Фармацевтические композиции соединения по настоящему изобретению можно получить для различных путей и типов введения. Соединение по настоящему изобретению, имеющее желаемую степень чистоты, необязательно, является смешанным с фармацевтически приемлемыми разбавителями, носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences (1980) 16th edition, Osol, A. Ed.) в форме лиофилизированной композиции, тонкоизмельченного порошка или водного раствора. Композицию можно получить путем смешивания, при температуре окружающей среды при подходящем значении pH и при желаемой степени чистоты, с физиологически приемлемыми носителями, т.е. носителями, которые не являются токсичными для реципиентов при используемых дозах и концентрациях. pH композиции в основном зависит от конкретного применения и концентрации соединения, но может находиться в пределах от около 3 до около 8. Композиция в ацетатном буфере при pH 5 представляет собой подходящий вариант осуществления.
В одном варианте осуществления соединение по настоящему изобретению для использования в фармацевтической композиции является по существу стерильным. Соединение обычно хранят в виде твердой композиции, хотя приемлемыми являются также лиофилизированные композиции или водные растворы.
Фармацевтические композиции по настоящему изобретению формулируют, дозируют и вводят способом, т.е. что касается количества, концентраций, схем введения, курса, носителей и пути введения, который согласуется с традиционной медицинской практикой. Факторы, которые следует принять во внимание в этом контексте, включают конкретное расстройство, подлежащее лечению, конкретного млекопитающего, которого лечат, клиническое состояние индивидуального пациента, причину расстройства, участок доставки средства, способ введения, схему введения и другие факторы, известные лечащим врачам. "Терапевтически эффективное количество" соединения, которое следует вводить, зависит от таких факторов и представляет собой минимальное количество, необходимое для профилактики, облегчения или лечения расстройства. Такое количеств предпочтительно ниже количества, которое является токсичным для реципиента.
В качестве общего предложения, начальное фармацевтически эффективное количество ингибитора, вводимого парентерально, в расчете на одну дозу, находится в пределах от около 0,01-100 мг/кг, например, от около 0,1 до 20 мг/кг массы тела пациента в день, при типичных начальных пределах использования соединения от 0,3 до 15 мг/кг/день.
Приемлемые разбавители, носители, эксципиенты и стабилизаторы является нетоксичными для реципиентов при используемых дозах и концентрациях и включают буферы, такие как фосфатный, цитратный и другие органические кислоты; антиокиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмонийхлорид; гексаметонийхлорид; бензалконийхлорид, бензетонийхлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (меньше чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие вещества, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как ион натрия; комплексы металлов (например, Zn-белковые комплексы); и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG). Активные фармацевтические ингредиенты также могут быть захвачены в микрокапсулы, полученные, например, методами коацервации или межфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатина и микрокапсулы из поли-(метилметакрилат)а, соответственно, в коллоидных системах доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие технологии раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Можно получить препараты замедленного высвобождения. Подходящие примеры препаратов замедленного высвобождения включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие соединение по настоящему изобретению, при этом такие матрицы имеют вид формованных изделий, например, пленки или микрокапсулы. Примеры матриц замедленного высвобождения включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поли(виниловый спирт)), полилактиды, сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, неразлагаемый этилен-винилацетат, разлагаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (микросферы для инъекций, состоящие из сополимера молочной кислоты-гликолевой кислоты и леупролидацетата) и поли-D-(-)-3-гидроксимасляная кислота.
Композиции, предназначенные для in vivo введения, должны быть стерильными, что легко достигается при помощи фильтрации через стерильные мембранные фильтры.
Композиции включают такие композиции, которые являются подходящими для путей введения, подробно описанных в настоящей заявке. Композиции удобным образом могут быть представлены в стандартной лекарственной форме, и их можно получить любым способом, хорошо известным в области фармацевтики. Способы и композиции, в основном можно найти в Remington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA). Такие способы включают стадии приведения активного ингредиента в ассоциацию с носителем, который составляет один или несколько вспомогательных ингредиентов. Как правило, композиции получают путем однородного и тесного приведения в ассоциацию активного ингредиента с жидкими носителями или тонкоизмельченными твердыми носителями или и теми и другими и затем, если это необходимо, формования продукта.
Композиции соединения по настоящему изобретению, подходящие для перорального введения, можно получить в виде дискретных единиц, таких как пилюли, капсулы, саше или таблетки, каждая из которых содержит предварительно определенное количество соединения по настоящему изобретению.
Прессованные таблетки можно получить путем прессования в подходящей машине активного ингредиента в свободнотекучей форме, такой как порошок или гранулы, необязательно смешанного со связующим, смазывающим веществом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим веществом. Формованные таблетки можно получить путем формования в подходящей машине смеси порошкообразного активного ингредиента, смоченного инертным жидким разбавителем. Таблетки, необязательно, могут иметь покрытие или насечку и, необязательно, могут быть сформулированы таким образом, чтобы обеспечить медленное или контролируемое высвобождение из них активного ингредиента.
Таблетки, драже, лепешки, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы, например, желатиновые капсулы, сиропы или эликсиры можно получить для перорального применения. Композиции соединения по настоящему изобретению, предназначенные для перорального применения, можно получить в соответствии с любым способом, известным из уровня техники для получения фармацевтических композиций, и такие композиции могут содержать одно или несколько веществ, включающих подсластители, отдушки, красители и консерванты, для получения приятного на вкус препарата. Таблетки, содержащие активный ингредиент в смеси с нетоксичным фармацевтически приемлемым эксципиентом, который является подходящим для получения таблеток, являются приемлемыми. Такие эксципиенты могут представлять собой, например, инертные разбавители, такие как карбонат кальция или натрия, лактоза, фосфат кальция или натрия; гранулирующие вещества или разрыхлители, такие как кукурузный крахмал или альгиновая кислота; связующие, такие как крахмал, желатин или аравийская камедь; и смазывающие вещества, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без покрытия или могут иметь покрытие, нанесенное известными способами, включая микроинкапсулирование для замедления разложения и адсорбции в желудочно-кишечном тракте и обеспечения, таким образом, замедленного действия в течение более длительного периода времени. Например, можно использовать обеспечивающие замедление действия вещества, такие как глицерилмоностеарат или глицерилдистеарат, отдельно или с воском.
В случае инфекций глаз или других наружных тканей, например, рта и кожи, композиции предпочтительно наносят в виде мази или крема для местного применения, содержащих активный ингредиент(ингредиенты) в количестве, например, от 0,075 до 20% масс/масс. Когда получают композицию в форме мази, активные ингредиенты можно использовать либо с парафиновой, либо со смешиваемой с водой основой для мази. Альтернативно, активные ингредиенты можно сформулировать в форму крема с использованием основы для крема масло-в-воде.
Если это желательно, водная фаза основы для крема может включать многоатомный спирт, т.е. спирт, содержащий две или более гидроксильные группы, такой как пропиленгликоль, бутан 1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль (включая PEG 400) и их смеси. Желательно, когда композиции для местного применения могут включать соединение, которое усиливает абсорбцию или пенетрацию активного ингредиента через кожу или другие пораженные участки. Примеры таких усилителей чрескожной пенетрации включают диметилсульфоксид и родственные аналоги.
Масляная фаза эмульсий по настоящему изобретению может быть образована из известных ингредиентов известным способом. Хотя эта фаза может включать только эмульгатор (иначе известный как “эмульгент”), желательно, когда она включает смесь, по меньшей мере, одного эмульгатора с жиром или маслом или и жиром и маслом. Предпочтительно, гидрофильный эмульгатор включают вместе с липофильным эмульгатором, который действует как стабилизатор. Также предпочтительно включение как масла, так и жира. Вместе, эмульгатор(эмульгаторы) со стабилизатором(стабилизаторами) или без него образуют так называемый эмульгирующий воск, и воск вместе с маслом и жиром образуют так называемую эмульгирующую основу для мази, которая образует масляную дисперсную фазу композиций крема. Эмульгаторы и стабилизаторы эмульсии, подходящие для использования в композиции по настоящему изобретению, включают Tween® 60, Span® 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия.
Водные суспензии по настоящему изобретению содержат активные вещества в смеси с эксципиентами, подходящими для получения водных суспензий. Такие эксципиенты включают суспендирующее вещество, такое как натрий карбоксиметилцеллюлоза, кроскармелоза, повидон, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, камедь трагаканта и аравийскую камедь, и диспергирующие или смачивающие вещества, такие как природный фосфатид (например, лецитин), продукт конденсации алкилоксида (например, этиленоксида, пропиленоксида) с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида длинноцепочечным алифатическим спиртом (например, гептадекаэтиленоксицетанолом), продукт конденсации этиленоксида неполным сложным эфиром, являющимся производным жирной кислоты и гекситангидрида (например, полиоксиэтиленсорбитанмоноолеат). Водная суспензия также может содержать один или несколько консервантов, таких как этил или н-пропил п-гидроксибензоат, один или несколько красителей, одну или несколько отдушек и один или несколько подсластителей, таких как сахароза или сахарин.
Фармацевтическая композиция соединения по настоящему изобретению может быть в форме стерильного препарата для инъекций, такого как стерильная водная или масляная суспензия для инъекций. Такую суспензию можно сформулировать в соответствии со способом, известным из уровня техники, с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих веществ, которые были указаны выше. Стерильный препарат для инъекций также может быть в форме стерильного раствора или суспензии для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, таком как раствор в 1,3-бутан-диоле, или может быть получен в форме лиофилизированного порошка. Из приемлемых носителей и растворителей, которые можно использовать, можно указать воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно используют в качестве растворителя или среды для суспендирования. Для этих целей можно использовать любое светлое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, также можно использовать в препаратах для инъекций.
Количество активного ингредиента, которое можно объединить веществом-носителем для получения отдельной единицы лекарственной формы, варьирует в зависимости от хозяина, принимающего лечение, и конкретного пути введения. Например, композиция с высвобождением по времени, предназначенная для перорального введения человеку, может содержать приблизительно от 1 до 1000 мг активного вещества, объединенного с подходящим и удобным количеством вещества-носителя, которое может варьировать от около 5 до около 95% от общего количества композиции (масс.:масс.). Фармацевтическую композицию можно получить для обеспечения легко отмеряемых количеств для введения. Например, водный раствор, предназначенный для внутривенной инфузии, может содержать от около 3 до 500 мкг активного ингредиента на миллилитр раствора для введения посредством инфузии подходящего объема при скорости около 30 мл/час.
Композиции, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, которые делают композицию изотоничной с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие вещества и загустители.
Композиции, подходящие для местного введения в глаз, также включают глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, в частности, водном растворителе для активного ингредиента. Активный ингредиент предпочтительно присутствует в таких композициях в концентрации от 0,5 до 20%, более предпочтительно от 0,5 до 10%, в частности, около 1,5% масс/масс.
Композиции, подходящие для местного введения в рот, включают лепешки, включающие активный ингредиент в имеющей приятный вкус основе, обычно такой, как сахароза и аравийская камедь или трагакант; пастилки, включающие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь; и полоскания для рта, включающие активный ингредиент в подходящем жидком носителе.
Композиции для ректального введения могут быть представлены в виде суппозитория с подходящей основой, включающей например, масло какао или салицилат.
Композиции, подходящие для внутрилегочного или назального введения, имеют размер частиц, например, в пределах от 0,1 до 500 микрон (включая размеры частиц в пределах от 0,1 до 500 микрон с инкрементами в микронах, такими как 0,5, 1, 30 микрон, 35 микрон и т.д.), которые вводят путем быстрой ингаляции через носовой проход или путем ингаляции через рот, чтобы достичь цели. Подходящие композиции включают водные или масляные растворы активного ингредиента. Композиции, подходящие для введения в форме аэрозоля или сухого порошка, можно получить в соответствии с традиционными способами, и они могут доставляться с другими терапевтическими средствами, такими как соединения, которые до настоящего времени использовали для лечения или профилактики ВИЧ инфекций, как описано ниже.
Композиции, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или композиций спрея, содержащих, помимо активного ингредиента, такие носители, которые известны из уровня техники как подходящие.
Композиции могут быть упакованы в однодозовые или многодозовые контейнеры, например, запаянные ампулы и флаконы, и могут храниться в высушенном замораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Импровизированные растворы и суспензии для инъекций получают из стерильных порошков, гранул и таблеток, таких которые описаны выше. Предпочтительные композиции стандартной лекарственной формы представляют собой такие, которые содержат суточную дозу или субъединицу суточной дозы, как указано в настоящей заявке выше, или подходящую часть такой дозы, активного ингредиента.
Настоящее изобретение также обеспечивает получение ветеринарных композиций, включающих, по меньшей мере, один активный ингредиент, определенный выше, вместе с используемым в ветеринарии носителем. Используемые в ветеринарии носители представляют собой вещества, полезные для целей введения композиции, и могут представлять собой твердые, жидкие или газообразные вещества, которые являются инертными или приемлемыми в ветеринарии и являются совместимыми с активным ингредиентом. Эти ветеринарные композиции можно вводить парентерально, перорально или любым другим желательным путем.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
Соединение по настоящему изобретению можно сочетать, в фармацевтической объединенной композиции или режиме введения в качестве комбинированной терапии, с вторым соединением, которое обладает анти-гиперпроиферативными или химиотерапевтическими свойствами, которое является полезным для лечения заболевания или расстройства, реагирующего на ингибирование JAK киназы, например, гиперпроиферативного расстройства (например, рака), или которое является полезным в лечении другого расстройства, указанного в настоящей заявке. Второе соединение в фармацевтической комбинированной композиции или режиме введения предпочтительно обладает активностью комплементарной активности соединения по настоящему изобретению, которое является частью такой комбинации, таким образом, они не оказывают неблагоприятного влияния друг на друга. Такие молекулы подходящим образом присутствуют в комбинации в количествах, которые являются эффективными для предназначенных целей.
Поэтому другой вариант осуществления включает способ лечения или уменьшения тяжести заболевания или состояния, реагирующего на ингибирование активности JAK2 киназы у пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения по настоящему изобретению и, кроме того, включающий введение второго химиотерапевтического средства.
Другой вариант осуществления поэтому включает способ лечения или уменьшения тяжести заболевания или состояния, реагирующего на ингибирование активности JAK3 киназы у пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения по настоящему изобретению и, кроме того, включающий введение второго химиотерапевтического средства.
Комбинированную терапию можно вводить в режиме одновременного или последовательного введения. При последовательном введении, такое сочетание можно вводить с использованием двух или более введений. Комбинированное введение включает совместное введение с использованием отдельных композиций или одной фармацевтической композиции, а также последовательное введение в любом порядке, при этом предпочтительно существует период времени, в течение которого оба (или все) активных средства одновременно проявляют свою биологическую активность.
Подходящие дозы для любого из описанных выше совместно вводимых средств представляют собой такие, которые используют в настоящее время, и могут быть снижены, благодаря совместному действию (синергизм) нового идентифицированного средства и других химиотерапевтических средств или лечений.
Комбинированная терапия может обеспечить "синергизм" и быть “синергической”, т.е. эффект, достигаемый при совместном использовании активных ингредиентов, больше, чем сумма эффектов, которые получают при отдельном использовании таких соединений. Синергический эффект может быть достигнут, когда активные ингредиенты: (1) совместно сформулированы и вводятся или доставляются одновременно в комбинированной композиции, представляющей собой стандартную лекарственную форму; (2) доставляются поочередно или параллельно в виде отдельных композиций; или (3) с использованием какого-либо другого режима введения. При доставке в виде чередующейся терапии синергический эффект можно получить, когда соединения вводят или доставляют последовательно, например, путем отдельных инъекций в отдельных шприцах. Как правило, при чередующейся терапии эффективную дозу каждого активного ингредиента вводят последовательно, т.е. поочередно, тогда как в комбинированной терапии эффективные дозы двух или более активных ингредиентов вводят вместе.
МЕТАБОЛИТЫ ПИРАЗОЛОПИРИМИДИНОВЫХ СОЕДИНЕНИЙ
Другой вариант осуществления включает in vivo метаболические продукты вводимого соединения по настоящему изобретению. Такие продукты могут образовываться, например, в результате окисления, восстановления, гидролиза, амидирования, деамидирования, этерификации, деэтерификации, ферментативного расщепления и т.п. вводимого соединения.
Продукты метаболизма типично идентифицируют путем получения радиомеченного (например, 14С или 3H) изотопа соединения по настоящему изобретению, введения его парентеральным путем в дозе, которая делает возможной его детекцию (например, больше чем около 0,5 мг/кг), животному, такому как крыса, мышь, морская свинка, обезьяна, или человеку, обеспечивая достаточно времени для метаболизма (типично от около 30 секунд до 30 часов) и выделяя продукты его преобразования из мочи, крови или других биологических образцов. Эти продукты можно легко выделить, поскольку они являются меченными (другие продукты выделяют с использованием антител, способных связываться с эпитопами, выживающими в метаболите). Структуры метаболитов определяют традиционным способом, например, с использованием анализа МС, ЖХ/МС или ЯМР. Как правило, анализ метаболитов осуществляют таким же способом, как обычно используемые способы исследования метаболизма лекарственных средств, которые хорошо известны специалистам в данной области. Продукты преобразования, если они не обнаружены каким-либо иным образом in vivo, являются полезными для диагностических анализов для определения терапевтических доз соединения по настоящему изобретению.
ПРОМЫШЛЕННЫЕ ИЗДЕЛИЯ
Другой вариант осуществления включает набор для лечения заболевания или расстройства, реагирующего на ингибирование JAK киназы. Набор включает:
(a) первую фармацевтическую композицию, включающую соединение по настоящему изобретению; и
(b) инструкции по применению.
В другом варианте осуществления, набор, кроме того, включает:
(c) вторую фармацевтическую композицию, которая включает химиотерапевтическое средство.
В одном варианте осуществления инструкции включают инструкции для одновременного, последовательного или отдельного введения указанных первой и второй фармацевтических композиций пациенту, нуждающемуся в этом.
В одном варианте осуществления первая и вторая композиции содержатся в отдельных контейнерах.
В одном варианте осуществления первая и вторая композиции содержатся в одном и том же контейнере.
Контейнеры для использования включают, например, бутыли, флаконы, шприцы, блистерные упаковки и т.п. Контейнеры могут быть выполнены из различных материалов, таких как стекло или пластик. Контейнер включает соединение по настоящему изобретению или содержащую его композицию, которые являются эффективными для лечения состояния, и может иметь стерильное отверстие для доступа (например, контейнер может содержать пакет с внутривенным раствором или флакон, имеющий пробку, которую можно проткнуть гиподермической иглой для инъекций). Контейнер включает композицию, включающую, по меньшей мере, одно соединение по настоящему изобретению. Этикетка или вкладыш в упаковку указывает, что композицию используют для лечения определенного состояния, такого как рак. В одном варианте осуществления этикетка или вкладыши в упаковку указывают, что композицию, включающую соединение по настоящему изобретению, можно использовать для лечения определенного расстройства. Кроме того, этикетка или вкладыш в упаковку могут указывать, что пациент, подлежащий лечению, представляет собой такого пациента, у которого имеется расстройство, характеризующееся чрезмерной или нарушенной киназной активностью. Этикетка или вкладыш в упаковку также могут указывать, что композицию можно использовать для лечения других расстройств.
Промышленное изделие может включать (a) первый контейнер с соединением по настоящему изобретению, содержащемся в нем; и (b) второй контейнер со второй фармацевтической композицией, содержащейся в нем, при этом вторая фармацевтическая композиция включает химиотерапевтическое средство. Промышленное изделие в этом варианте осуществления настоящего изобретения, кроме того, может включать вкладыш в упаковку, указывающий, что первое и второе соединения можно использовать для лечения пациентов, подверженных риску таких расстройств, как удар, тромбообразование или тромбоз. Альтернативно или дополнительно, промышленное изделие, кроме того, может включать второй (или третий) контейнер, включающий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-буферный физиологический раствор, раствор Рингера и раствор декстрозы. Он также может включать другие вещества, которые желательны с коммерческой точки зрения или с точки зрения потребителя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
В одном варианте осуществления соединения по настоящему изобретению можно использовать для контроля JAK протеинкиназ, тирозиновых киназ, дополнительных сериновых/треониновых киназ и/или киназ с двойной специфичностью. Таким образом, они являются полезными в качестве фармакологических стандартов для использования в разработке новых биологических испытаний, анализов и в поиске новых фармакологических средств.
Соединения по настоящему изобретению могут быть испытаны на их способность модулировать активность JAK протеинкиназ, тирозиновых киназ, дополнительных сериновых/треониновых киназ и/или киназ с двойной специфичностью in vitro и in vivo. In vitro анализы включают биохимические и клеточные анализы, в которых определяют ингибирование киназной активности. Другие in vitro анализы предназначены для количественного определения способности соединения по настоящему изобретению связываться с киназами, и это можно измерить либо путем радиоактивного мечения соединения по настоящему изобретению до связывания, выделения комплекса соединение по настоящему изобретению/киназа и определения количества связанной радиоактивной метки, либо путем осуществления конкурентного анализа, где соединение по настоящему изобретению инкубируют с известными радиомеченными лигандами. Эти и другие полезные in vitro анализы хорошо известны специалистам в данной области.
Для иллюстрации настоящего изобретения включены следующие примеры. Однако должно быть понятно, что эти примеры не ограничивают настоящее изобретение и предназначены только для предложения способа осуществления на практике настоящего изобретения. Специалистам в данной области должно быть понятно, что описанные химические реакции легко можно адаптировать для получения других соединений по настоящему изобретению, и альтернативные способы получения соединений по настоящему изобретению включены в объем настоящего изобретения. Например, синтез соединений по настоящему изобретению, которые не проиллюстрированы примерами, успешно может быть осуществлен с использованием модификаций, очевидных для специалистов в данной области, например, путем защиты мешающих реакции групп подходящим образом, путем использования других подходящих реагентов, известных из уровня техники, отличных от тех, которые описаны в настоящем изобретении, и/или путем осуществления рутинных модификаций реакционных условий. Альтернативно, другие реакции, раскрытые в настоящей заявке или известные из уровня техники, будут признаны как подходящие для получения других соединений по настоящему изобретению.
БИОЛОГИЧЕСКИЕ ПРИМЕРЫ
Активность выделенного киназного домена JAK2 можно измерить путем отслеживания фосфорилирования пептидных субстратов, происходящих из человеческой JAK3 киназы, in vitro (Saltzman et al, Biochem. Biophys. Res. Commun. 246:627-633 (2004). Человеческий JAK2 киназный домен экспрессировали с использованием N-концевой His6 метки, а затем сайта расщепления тромбина, используя систему бакуловирусного экспрессирующего вектора. Экспрессируемый киназный домен определяли как аминокислотные остатки D812-G1132, в соответствии с нумерацией GenBank, номер доступа последовательности NP_004963.1. Рекомбинантные векторы переноса ДНК ко-трансфицировали при помощи BakPAK6 линеаризированной ДНК (Clontech Laboratories, Inc., Mountain View, CA) и полученные исходные вирусные продукты амплифицировали с использованием стандартных протоколов. Белок продуцировали в SF9 клетках, которые выращивали до плотности клеток 2E6/мл в ESF921 среде (Expression Systems LLC, Woodland, CA) и инфицировали при M.O.I=1 в биореакторах Wave. Клетки собирали через 72 часа после инфицирования и активный JAK2 фермент очищали из лизатов инфицированных клеток при помощи Ni-NTA (Qiagen, Valencia, CA) колоночной хроматографии, с последующей Sephacryl S-200 (GE Healthcare, Piscataway, NJ) колоночной хроматографией.
Предыдущие исследования показали, что выделенные киназные домены человеческих JAK1, JAK2, JAK3 или TYK2 фосфорилируют пептидные субстраты в in vitro киназных анализах (Saltzman et al., Biochem. Biophys. Res. Commun. 246:627-633 (2004)). Каталитически активный киназный домен человеческого JAK1, JAK2, JAK3 или TYK2 очищали из экстрактов SF9 клеток насекомого, инфицированных рекомбинантным бакуловирусным экспрессирующим вектором, кодирующим человеческие JAK1, JAK2, JAK3 или TYK2 киназные домены (JAK1 аминокислотные остатки N852-D1154 в соответствии с нумерацией GenBank, номер доступа последовательности P23458, JAK2 аминокислотные остатки D812-G1132 в соответствии с нумерацией GenBank, номер доступа последовательности NP_004963.1; JAK3 аминокислотные остатки S783-S1124 в соответствии с нумерацией GenBank, номер доступа последовательности P52333, и TYK2 аминокислотные остатки N873-C 1187 в соответствии с нумерацией GenBank, номер доступа последовательности P29597). Активность JAK1, JAK2, JAK3 или TYK2 киназных доменов можно измерить различными прямыми и косвенными способами, включая количественное определение фосфорилирования пептидных субстратов, происходящих из человеческого JAK3 белка (Saltzman et al., Biochem. Biophys. Res. Commun. 246:627-633 (2004)). Активность JAK1, JAK2, JAK3 или TYK2 киназных доменов измеряли in vitro путем отслеживания фосфорилирования происходящих из JAK3 пептидов с использованием метода Caliper LabChip.
Пример A
Протокол анализа ингибирования JAK2
Активность выделенного JAK2 киназного домена измеряли путем отслеживания фосфорилирования пептида, происходящего из JAK3 (Val-Ala-Leu-Val-Asp-Gly-Tyr-Phe-Arg-Leu-Thr-Thr), флуоресцентно меченного по N-концу 5-карбоксифлуоресцеином, с использованием метода Caliper LabChip (Caliper Life Sciences, Hopkinton, MA). Для определения констант ингибирования (Ki), осуществляли серийное разведение соединений в DMSO и добавляли к 50 мкл смесей для киназных реакций, содержащим 0,2 нМ очищенного JAK2 фермента, 100 мМ Hepes pH7,2, 0,015% Brij-35, 1,5 мкМ пептидного субстрата, 25 мкМ АТФ, 10 мМ MgCl2, 4 мМ DTT при конечной концентрации DMSO 2%. Реакции инкубировали при 22°C в 384-луночных полипропиленовых микротитровальных планшетах в течение 30 минут и затем останавливали путем добавления 25 мкл содержащего EDTA раствора (100 мМ Hepes pH 7,2, 0,015% Brij-35, 150 мМ EDTA), с получением конечной концентрации EDTA 50 мМ. После прекращения киназной реакции, относительное количество фосфорилированного продукта определяли как долю от общего количества пептидного субстрата с использованием Caliper LabChip 3000, в соответствии с указаниями изготовителя. Затем определяли значения Ki с использованием модели Моррисона прочного связывания. Morrison, J.F., Biochim. Biophys. Acta. 185:269-296 (1969); William, J.W. and Morrison, J.F., Meth. Enzymol, 63:437-467 (1979).
Пример B
Протокол анализа ингибирования JAK1 и TYK2
Активность выделенного JAK1 или TYK2 киназного домена измеряли путем отслеживания фосфорилирования пептида, происходящего из JAK3 (Val-Ala-Leu-Val-Asp-Gly-Tyr-Phe-Arg-Leu-Thr-Thr), флуоресцентно меченного по N-концу 5-карбоксифлуоресцеином, с использованием метода Caliper LabChip (Caliper Life Sciences, Hopkinton, MA). Для определения констант ингибирования (Ki) осуществляли серийное разведение соединений в DMSO и добавляли к 50 мкл смесей для киназных реакций, содержащих 1,5 нМ JAK1, 0,2 нМ очищенного JAK2 или 1 нМ очищенного TYK2 фермента, 100 мМ Hepes pH7,2, 0,015% Brij-35, 1,5 мкМ пептидного субстрата, 25 мкМ АТФ, 10 мМ MgCl2, 4 мМ DTT, при конечной концентрации DMSO 2%. Реакции инкубировали при 22°C в 384-луночных полипропиленовых микротитровальных планшетах в течение 30 минут и затем останавливали путем добавления 25 мкл содержащего EDTA раствора (100 мМ Hepes pH 7,2, 0,015% Brij-35, 150 мМ EDTA) с получением конечной концентрации EDTA 50 мМ. После прекращения киназной реакции относительное количество фосфорилированного продукта определяли как долю от общего количества пептидного субстрата с использованием Caliper LabChip 3000, в соответствии с указаниями изготовителя. Затем определяли значения Ki с использованием модели Моррисона прочного связывания (Morrison, J.F., Biochim. Biophys. Acta. 185:269-296 (1969); William, J.W. and Morrison, J.F., Meth. Enzymol, 63:437-467 (1979)).
Пример C
Протокол анализа ингибирования JAK3
Активность выделенного JAK3 киназного домена измеряли путем отслеживания фосфорилирования пептида, происходящего из JAK3 (Leu-Pro-Leu-Asp-Lys-Asp-Tyr-Tyr-Val-Val-Arg), флуоресцентно меченного по N-концу 5-карбоксифлуоресцеином, с использованием метода Caliper LabChip (Caliper Life Sciences, Hopkinton, MA). Для определения констант ингибирования (Ki), осуществляли серийное разведение соединений в DMSO и добавляли к 50 мкл смесей для киназных реакций, содержащих 5 нМ очищенного JAK3 фермента, 100 мМ Hepes pH7,2, 0,015% Brij-35, 1,5 мкМ пептидного субстрата, 5 мкМ АТФ, 10 мМ MgCl2, 4 мМ DTT, при конечной концентрации DMSO 2%. Реакции инкубировали при 22°C в 384-луночных полипропиленовых микротитровальных планшетах в течение 30 минут и затем останавливали путем добавления 25 мкл содержащего EDTA раствора (100 мМ Hepes pH 7,2, 0,015% Brij-35, 150 мМ EDTA) с получением конечной концентрации EDTA 50 мМ. После прекращения киназной реакции относительное количество фосфорилированного продукта определяли как долю от общего количества пептидного субстрата с использованием Caliper LabChip 3000, в соответствии с указаниями изготовителя. Затем определяли значения Ki с использованием модели Моррисона прочного связывания (Morrison, J.F., Biochim. Biophys. Acta. 185:269-296 (1969); William, J.W. and Morrison, J.F., Meth. Enzymol, 63:437-467 (1979)).
Пример D
Клеточные фармакологические анализы
Активности соединений определяли в клеточных анализах, которые разработаны для измерения JAK2-зависимого сигнала или пролиферации. Осуществляли серийные разведения соединений в DMSO и инкубировали с Set-2 клетками (German Collection of Microorganisms and Cell Cultures (DSMZ); Braunschweig, Germany), которые экспрессируют JAK2V617F мутантный белок, в 96-луночных микротитровальных планшетах в течение 1 часа при 37°C в среде RPMI, при конечной плотности 100000 клеток на лунку и конечной концентрации DMSO 0,57%. Опосредованные соединениями эффекты на фосфорилирование STAT5 затем измеряли в лизатах инкубированных клеток с использованием метода Meso Scale Discovery (MSD) (Gaithersburg, Maryland), в соответствии с протоколом изготовителя, и определяли значения EC50. Альтернативно, серийно разведенные соединения добавляли в 384-луночные микротитровальные планшеты в среду RPMI с 10% фетальной бычьей сывороткой (Invitrogen Corp.; Carlsbad, CA), при конечной плотности 2500 клеток на лунку и конечной концентрации DMSO 0,3%, и инкубировали при 37°C в течение 72 часов. Затем определяли жизнеспособность клеток с использованием набора для анализа CellTiter-Glo® Luminescent Cell Viability Assay, в соответствии с протоколом изготовителя (Promega; Madison, WI), и определяли значения EC50.
Активности соединений определяли в клеточных анализах, которые разработаны для измерения TYK2-зависимого сигнала. Осуществляли серийные разведения соединений в DMSO и инкубировали с NK92 клетками (American Type Culture Collection (ATCC); Manassas, VA) в 96-луночных микротитровальных планшетах в течение 1 часа при 37°C в среде RPMI, при конечной плотности 100000 клеток на лунку и конечной концентрации DMSO 0,57%. Затем в микротитровальные планшеты, содержащие NK92 клетки и соединение, добавляли человеческий рекомбинантный IL-12 (R&D systems; Minneapolis, MN) в конечной концентрации 10 нг/мл и планшеты инкубировали в течение 1 часа при 37°C. Опосредованные соединениями эффекты на фосфорилирование STAT4 затем измеряли в лизатах инкубированных клеток с использованием метода Meso Scale Discovery (MSD) (Gaithersburg, Maryland), в соответствии с протоколом изготовителя, и определяли значения EC50.
Активности соединений определяли в клеточных анализах, которые разработаны для измерения JAK1 или JAK2-зависимого сигнала. Осуществляли серийные разведения соединений в DMSO и инкубировали с TF-1 клетками (American Type Culture Collection (ATCC); Manassas, VA) в 384-луночных микротитровальных планшетах в среде OptiMEM без фенолового красного, 1% FBS, который предварительно подвергали десорбционной обработке углем/декстраном, 0,1 мМ NEAA, 1 мМ пирувата натрия (Invitrogen Corp.; Carlsbad, CA), при конечной плотности 100000 клеток на лунку и конечной концентрации DMSO 0,2%. Затем в микротитровальные планшеты, содержащие TF-I клетки и соединение, добавляли человеческий рекомбинантный IL-6 (R&D systems; Minneapolis, MN) или EPO (Invitrogen Corp.; Carlsbad, CA) в конечной концентрации 30 нг/мл или 10 Единиц/мл, соответственно, и планшеты инкубировали в течение 30 минут при 37°C. Опосредованные соединениями эффекты на фосфорилирование STAT3 или STAT5 затем измеряли в лизатах инкубированных клеток в присутствии IL-6 или EPO, соответственно, с использованием метода Meso Scale Discovery (MSD) (Gaithersburg, Maryland), в соответствии с протоколом изготовителя, и определяли значения EC50.
ПРЕПАРАТИВНЫЕ ПРИМЕРЫ
В примерах, описанных ниже, если не указано иное, все значения температур указаны в градусах Цельсия. Реагенты закупали у коммерческих поставщиков, таких как Aldrich Chemical Company, Lancaster, TCI или Maybridge, и использовали без дополнительной очистки, если не указано иное.
Реакции, описанные ниже, осуществляли, в основном, при положительном давлении сухого азота (если не указано иное), в безводных растворителях.
Колоночную хроматографию осуществляли на системе Combiflash (Изготовитель: Teledyne Isco), включающей колонку с силикагелем, традиционным методом флэш-хроматографии на силикагеле или методом обращено-фазовой ВЭЖХ на C-18 колонке с использованием в качестве элюента ацетонитрила/воды, содержащей либо 0,1% трифторуксусной кислоты (TFA), либо 0,1% муравьиной кислоты. 1H ЯМР спектры записывали на устройстве Bruker, работающем при 400 МГц или 500 МГц. 1H ЯМР спектры получали в виде растворов в CDCl3 или d6-DMSO (указаны в м.д.), с использованием тетраметилсилана в качестве стандарта (0,00 м.д.). При указании мультиплетности пиков использовали следующий аббревиатуры: с (синглет), д (дублет), т (триплет), м (мультиплет), ушир. (уширенный), дд (дублет дублетов), дт (дублет триплетов). Константы взаимодействия (J), когда они представлены, указаны в Герцах (Гц).
Пример 1
5-(3-хлорбензиламино)-N-циклогексилпиразоло[1,5-α]пиримидин-3-карбоксамид
пиразоло[1,5-α]пиримидин-5-олат натрия
Механически перемешиваемую смесь 3-аминопиразола (9,38 г, 0,11 мМ, 1,0 экв.), 1,3-диметилурацила (14,7 г, 0,11 мМ, 1,0 экв.) и 21% этоксида натрия в этаноле (170 мл, 5,0 экв.) нагревали до температуры кипения с обратным холодильником. В течение нескольких минут происходило образование тяжелого осадка. После кипячения с обратным холодильником в течение 1 часа, 1,3-диметилурацил больше не определялся тонкослойной хроматографией (ТСХ) (92:8 дихлорметан (дихлорметан):MeOH). Реакционную смесь охлаждали, фильтровали, промывали холодным этанолом и сушили в вакууме с получением 13,47 г (95%) пиразоло[1,5-α]пиримидин-5-олата натрия. LCMS (ESI) m+H=136,0; 1H ЯМР (400 МГц, ДМСО-d6) δ: 8,0 (д, 1H), 7,43 (д, 1H), 5,65 (д, 1H), 5,37 (д, 1H).

пиразоло[1,5-α]пиримидин-5(4H)-он
Пиразоло[1,5-α]пиримидин-5-олат натрия (13,47 г) растворяли в 500 мл уксусной кислоты и 100 мл воды, перемешивали в течение 15 минут, затем упаривали досуха в вакууме. Остаток суспендировали в 300 мл смеси 9:1 дихлорметан:метанол и фильтровали под вакуумом через силикагель для удаления ацетата натрия. Слой силикагеля промывали при помощи 700 мл дополнительного раствора дихлорметан:метанол. Объединенный раствор дихлорметан:метанол концентрировали досуха. Твердый продукт суспендировали в смеси 1:1 гексан:дихлорметан и фильтровали с получением 9,9 г (85%) пиразоло[1,5-α]пиримидин-5(4H)-она. LCMS (ESI) m+H=136,0; 1H ЯМР (400 МГц, ДМСО-d6) δ: 12,1 (с широкий обмениваемый, 1H), 8,47 (д, 1H, J=7,9), 7,75 (д, 1H, J=1,9), 5,94 (д, 1H, J=7,5), 5,81 (д, 1H, J=1,7).

3-иодпиразоло [1,5-α]пиримидин-5(4H)-он
Пиразоло[1,5-α]пиримидин-5(4H)-он (1,0 г, 7,4 мМ, 1,0 экв.) и N-иодсукцинимид (1,67 г, 7,4 мМ, 1,0 экв.) объединяли с 20 мл DMF и слегка нагревали. В течение минуты образовывался тяжелый осадок. Реакционную смесь перемешивали еще в течение 1 часа при температуре окружающей среды, затем охлаждали на бале лед-вода и фильтровали. Собранное твердое вещество промывали при помощи 20 мл дихлорметана и сушили на воздухе с получением 1,66 г (86%) 3-иодпиразоло[1,5-α]пиримидин-5(4H)-она. LCMS (ESI) m+H=262,2; 1H ЯМР (400 МГц, ДМСО-d6) δ: 12,1 (с, 1H), 8,5 (д, 1H, J=7,6), 7,84 (с, 1H), 6,01 (д, 1H, J=7,1).
метил 5-оксо-4,5-дигидропиразоло[1,5-α]пиримидин-3-карбоксилат
Смесь 3-иодпиразоло[1,5-α]пиримидин-5(4H)-она (1,5 г, 5,7 мМ, 1,0 экв.), ацетата палладия (0,27g, 1,2 мМ, 0,2 экв.), триэтиламина (2,3 мл, 17 мМ, 3,0 экв.) и 75 мл метанола перемешивали, дегазировали два раза в вакууме (с продувкой азотом), затем создавали оболочку из оксида углерода с использованием баллона. Реакционную смесь нагревали до 55°C в течение 5 часов. Анализ ТСХ (95:5 дихлорметан:метанол) показал завершение реакции. Реакционную смесь фильтровали через целит и концентрировали в вакууме. Остаток перекристаллизовывали из воды и фильтровали с получением 0,81 г (73%) метил 5-оксо-4,5-дигидропиразоло[1,5-α]пиримидин-3-карбоксилата, который имел чистоту 97,6% по данным ВЭЖХ. 1H ЯМР (400 МГц, ДМСО-d6) δ: 11,0 (ушир.с, 1H), 8,58 (д, 1H), 8,19 (с, 1H), 6,19 (д, 1H), 3,80 (с, 3H).
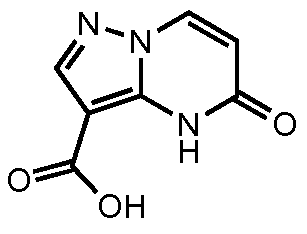
5-оксо-4,5-дигидропиразоло[1,5-α]пиримидин-3-карбоновая кислота
Раствор метил 5-оксо-4,5-дигидропиразоло[1,5-α]пиримидин-3-карбоксилата (0,75 г, 3,89 мМ, 1,0 экв.), гидроксида лития (0,466 г, 19,4 мМ, 5,0 экв.) и 20 мл воды перемешивали при температуре окружающей среды в течение 3 часов. Анализ ВЭЖХ показал завершение реакции. Добавляли уксусную кислоту (5 мл) и осажденное твердое вещество собирали путем фильтрования под вакуумом с получением 0,65 г (93%) 5-оксо-4,5-дигидропиразоло[1,5-α]пиримидин-3-карбоновой кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ: 12,5 (ушир.с, 1H), 11,3 (ушир.с, 1H), 8,57 (д, 1H), 8,08 (д, 1H), 6,15 (д, 1H).

5-хлорпиразоло[1,5-α]пиримидин-3-карбонилхлорид
Смесь 5-оксо-4,5-дигидропиразоло[1,5-α]пиримидин-3-карбоновой кислоты (371 мг, 2,1 мМ, 1,0 экв.), оксихлорида фосфора (20 мл) и N,N-диизопропилэтиламина (1,2 мо, 6,9 мМ, 3,3 экв.) кипятили с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали и концентрировали при пониженном давлении. Осуществляли поглощение остатка в дихлорметан и концентрировали снова 3 раза. Остаток распределяли между водой и дихлорметаном. Дихлорметановый слой сушили при помощи сульфата натрия, фильтровали под вакуумом через слой силикагеля и концентрировали с получением 390 мг (87%) 5-хлорпиразоло[1,5-α]пиримидин-3-карбонилхлорида в виде желтого твердого вещества, которое использовали непосредственно без дополнительной очистки.

5-хлор-N-циклогексилпиразоло[1,5-α]пиримидин-3-карбоксамид
К перемешиваемому раствору неочищенного 5-хлорпиразоло[1,5-α]пиримидин-3-карбонилхлорида (200 мг, 0,9 мМ, 1,0 экв.) в 15 мл дихлорметана добавляли циклогексиламин (400 мкл, 4,0 мМ, 4 экв.). Реакционную смесь перемешивали в течение 15 минут затем гасили при помощи 0,4 мл уксусной кислоты. Реакционную смесь концентрировали при пониженном давлении и остаток распределяли между водой и дихлорметаном. Дихлорметановую фазу концентрировали и неочищенный продукт очищали флэш-хроматографией на силикагеле (97:3 дихлорметан метанол) с получением 310 мг (100%) 5-хлор-N-циклогексилпиразоло[1,5-α]пиримидин-3-карбоксамида. LCMS (ESI) m+H=279,1; 1H ЯМР (400 МГц, CDCl3) δ: 8,66 (с, 1H), 8,65 (д, 1H), 7,47 (д (широкий обмениваемый) 1H), 6,93 (д, 1H), 4,08 (м, 1H), 2,02 (м, 2H), 1,80 (м, 2H), 1,62 (м, 1H), 1,40 (м, 5H).

5-(3-хлорбензиламино)-N-циклогексилпиразоло[1,5-α]пиримидин-3-карбоксамид
Раствор 5-хлор-N-циклогексилпиразоло[1,5-α]пиримидин-3-карбоксамида (28 мг, 0,09 мМ, 1,0 экв.), 3-хлорбензиламина (28 мг, 0,18 мМ, 2,0 экв.), N,N-диизопропилэтиламина (26 мг, 0,18 мМ, 2,0 экв.) и 2 мл этанола нагревали при помощи микроволнового облучения при 120°C в течение 10 минут. Анализ ТСХ (95:5 дихлорметан:метанол) показал завершение реакции. Реакционную смесь охлаждали, кристаллический продукт собирали фильтрованием, промывали холодным этанолом и сушили на воздухе с получением 29,7 мг (77%) 5-(3-хлорбензиламино)-N-циклогексилпиразоло[1,5-α]пиримидин-3-карбоксамида. LCMS (ESI) m+H=384,2; 1H ЯМР (400 МГц, ДМСО-d6) δ: 8,61 (перекрывающиеся д и т, 2H), 8,06 (с, 1H), 7,60 (д, 1H), 7,4-7,25 (м, 4H), 6,49 (д, 1H), 3,70 (м, 1H), 1,75-1,5 (м, 5H), 1,4-0,8 (м, 5H).
Пример 2
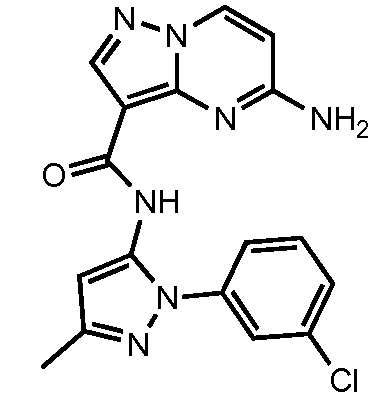
5-амино-N-(1-(3-хлорфенил)-3-метил-1H-пиразол-5-ил)пиразоло-[1,5-α]пиримидин-3-карбоксамид
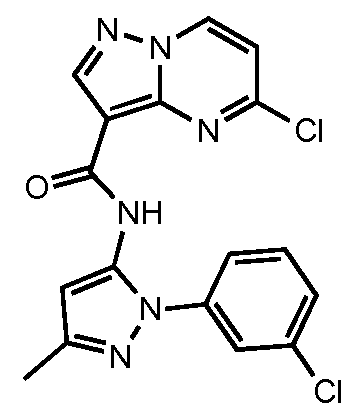
5-хлор-N-(l-(3-хлорфенил)-3-метил-1Н-пиразол-5-ил)пиразоло[1,5-α]пиримидин-3-карбоксамид
Раствор 5-хлорпиразоло[1,5-α]пиримидин-3-карбонилхлорида (150 мг, 0,69 мМ, 1,0 экв.), 1-(3-хлорфенил)-3-метил-1Н-пиразол-5-амина (140 мг, 0,69 мМ, 1,0 экв., доступный от Enamine, Ltd, Cincinnati, OH Cat# EN300-02447), N,N-диизопропилэтиламина (0,18 мл, 1,0 мМ, 1,0 экв.) и 15 мл дихлорметана перемешивали при температуре окружающей среды в течение 3 дней. Реакционную смесь распределяли между дихлорметаном и водой. Дихлорметановую фазу сушили над сульфатом натрия и фильтровали под вакуумом через силикагель. Слой силикагеля промывали смесью 95:5 дихлорметан:метанол. Объединенные фильтраты концентрировали с получением 250 мг (93%) 5-хлор-N-(l-(3-хлорфенил)-3-метил-1Н-пиразол-5-ил)пиразоло[1,5-α]пиримидин-3-карбоксамида который имел чистоту 74% по данным ВЭЖХ, и его использовали без дополнительной очистки. ЖХМС (ESI) m+H=387,2, (два изотопа хлора).
Смесь 74% чистого 5-хлор-N-(l-(3-хлорфенил)-3-метил-1Н-пиразол-5-ил)пиразоло[1,5-α]пиримидин-3-карбоксамида (55 мг, 0,14 мМ, 1,0 экв.) и 3 мл концентрированного гидроксида аммония герметично закрывали и нагревали в микроволновом реакторе при 105°C в течение 30 минут. Реакционную смесь охлаждали и осажденный продукт собирали фильтрованием с получением 25 мг (48%) 5-амино-N-(1-(3-хлорфенил)-3-метил-1Н-пиразол-5-ил)пиразоло[1,5-α]пиримидин-3-карбоксамида, который очищали обращенно-фазовой хроматографией на C-18 с использованием смеси ацетонитрил/вода (градиент 0→60, 0,1% TFA) и лиофилизировали. ЖХМС (ESI) m+H=368,3 (один изотоп хлора), 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,94 (с, 1H), 8,66 (д, 1H), 8,20 (с, 1H) 7,67 (с, 1H), 7,57 (д, 1H), 7,49 (дд, 1H), 7,44 (д, 1H), 6,89 (ушир.с, 1H), 6,40 (перекрывающиеся д и с, 2H), 2,26 (с, 3H).
Пример 3
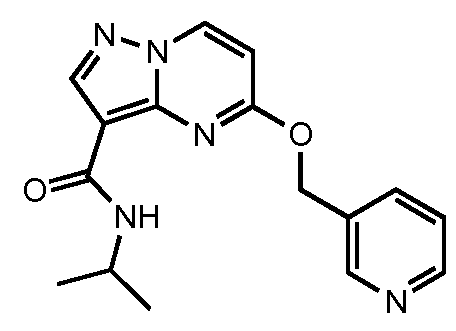
N-изопропил-5-(пиридин-3-илметокси)пиразоло[1,5-α]пиримидин-3-карбоксамид

5-хлор-N-изопропилпиразоло[1, 5-α]пиримидин-3-карбоксамид
Смесь 5-оксо-4,5-дигидропиразоло[1,5-α]пиримидин-3-карбоновой кислоты (2,0 г, 10 мМ, 1,0 экв.), 30 мл оксихлорида фосфора (300 мМ, 30 экв.) и N,N-диизопропилэтиламина (8 мл, 40 мМ, 4 экв.) нагревали при перемешивании до температуры кипения с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали и концентрировали в вакууме. Коричневое масло поглощали в дихлорметан и добавляли изопропиламин (3 мл, 30 мМ, 3 экв.). Реакционную смесь перемешивали в течение 5 минут, затем распределяли между этилацетатом и водой. Органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом натрия и фильтровали под вакуумом через слой силикагеля. Фильтрат концентрировали и охлаждали и кристаллизованный продукт собирали фильтрованием с получением 2,31 г (90%) 5-хлор-N-изопропилпиразоло[1,5-α]пиримидин-3-карбоксамида. ЖХМС (ESI) m+H=239,1 (моно-хлорированный изотоп) 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,33 (д, 1H), 8,60 (с, 1H), 7,47 (д, 1H), 7,36 (д, 1H), 4,09 (м, 1H), 1,20 (д, 6H).
К дегазированному раствору 3-пиридилкарбинола (17,6 мг, 0,16 мМ, 1,5 экв.) в 0,8 мл DMF добавляли одномолярный раствор гексаметилдисилазида лития (215 мкл, 0,22 мМ, 2,0 экв.). Эту смесь перемешивали в течение 10 минут, затем добавляли по каплям к перемешиваемому раствору 5-хлор-N-изопропилпиразоло[1,5-α]пиримидин-3-карбоксамида (25,7 мг, 0,11 мМ, 1,0 экв.) в одном мл DMF. Реакционную смесь очищали с использованием обращенно-фазовой ВЭЖХ (5→30% ацетонитрил/вода, 0,1% муравьиной кислоты) и продукт лиофилизировали с получением 22,7 мг (68%) N-изопропил-5-(пиридин-3-илметокси)пиразоло[1,5-α]пиримидин-3-карбоксамида. ЖХМС (ESI) m+H=312,2, 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,09 (д, 1H), 8,76 (д, 1H), 8,59 (дд, 1H), 8,38 (с, 1H), 7,95 (д, 1H), 7,45 (дд 2H), 6,81 (д, 1H), 5,61 (с, 1H), 4,08 (м, 1H), 1,19 (д, 6H).
Пример 4

метил 5-(3-фторбензиламино)пиразоло[1,5-α]пиримидин-3-карбоксилат

метил 5-хлорпиразоло[1,5-α]пиримидин-3-карбоксилат
Смесь 5-оксо-4,5-дигидропиразоло[1,5-α]пиримидин-3-карбоновой кислоты (151 мг, 0,84 мМ, 1,0 экв.), оксихлорида фосфора (20 мл) и N,N-диизопропилэтиламина (440 мкл, 2,5 мМ, 3,0 экв.), нагревали при температуре кипения с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до температуры окружающей среды в течение ночи, затем концентрировали при пониженном давлении. Остаток растворяли в 20 мл метанола, перемешивали в течение 30 минут и концентрировали в вакууме. Остаток распределяли между этилацетатом и водой. Органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали через слой силикагеля и концентрировали с получением 160 мг (90%) метил 5-хлорпиразоло[1,5-α]пиримидин-3-карбоксилата ЖХМС (ESI) m+H=212,2, 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,34 (д, 1H), 8,68 (с, 1H), 7,42 (д, 1H), 3,83 (с, 3H).
Раствор метил 5-хлорпиразоло[1,5-α]пиримидин-3-карбоксилата (240 мг, 1,1 мМ, 1,0 экв.), 3-фторбензиламина (200 мкл, 2,0 мМ, 2,0 экв.), 30 мл этанола и 400 мкл N,N-диизопропилэтиламина (2,0 мМ, 2 экв.) объединяли и нагревали при температуре кипения с обратным холодильником в течение 4 часов. Смесь концентрировали и продукт собирали фильтрованием и промывали холодным этанолом с получением 271 мг (80%) метил 5-(3-фторбензиламино)пиразоло[1,5-α]пиримидин-3-карбоксилата ЖХМС (ESI) m+H=301,2, 1H ЯМР (400 МГц, ДМСО-d6) δ: 8,56 (д, 1H), 8,41 (м 1H), 8,17 (с, 1H), 7,35 (м, 3H), 7,08 (тд, 1H), 6,44 (д, 1H), 4,61 (д, 2H), 3,74 (с, 3H)
Примеры 5-221, представленные в Таблице 1, получали в соответствии с описанными выше способами.
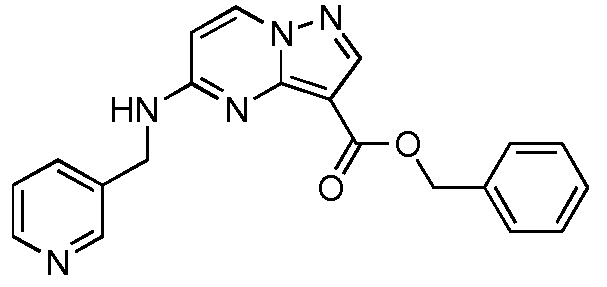
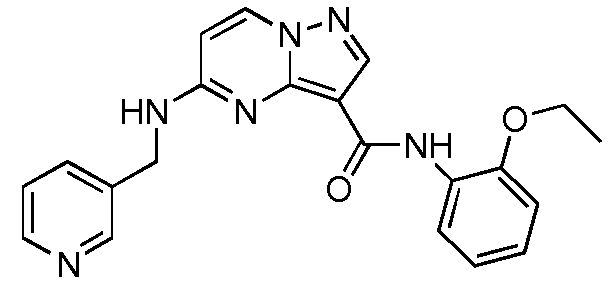
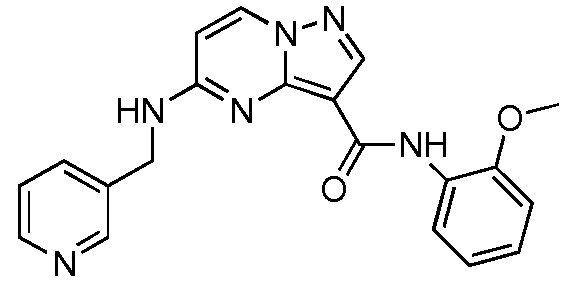
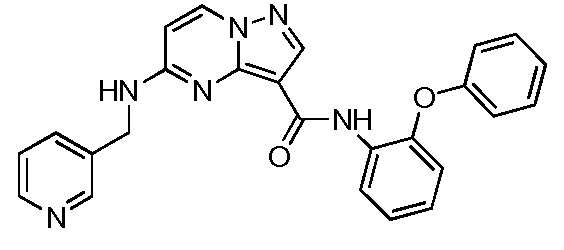
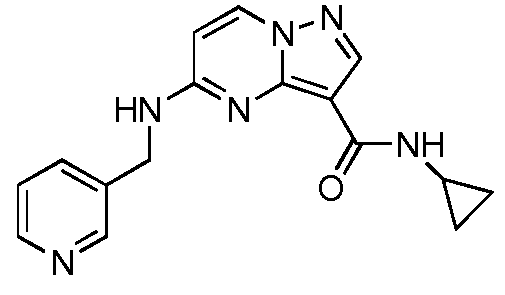
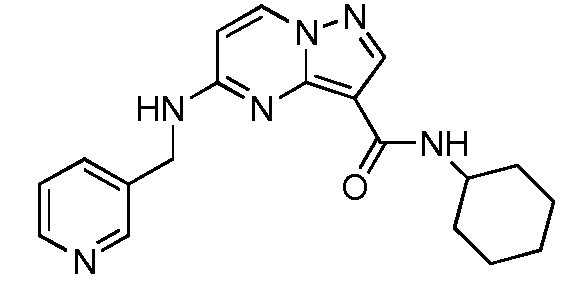
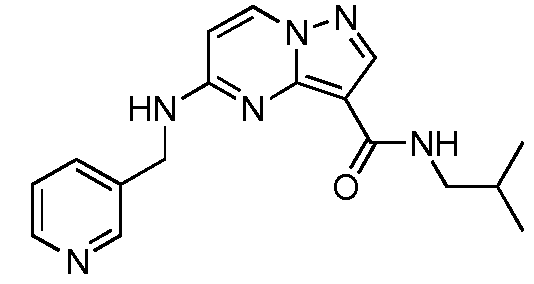
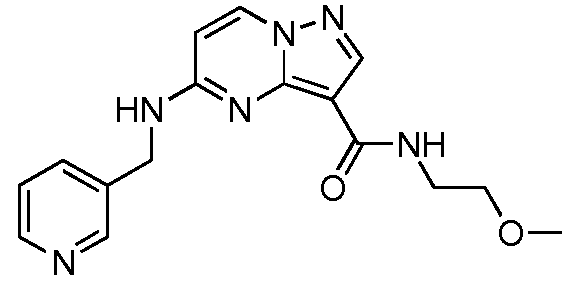
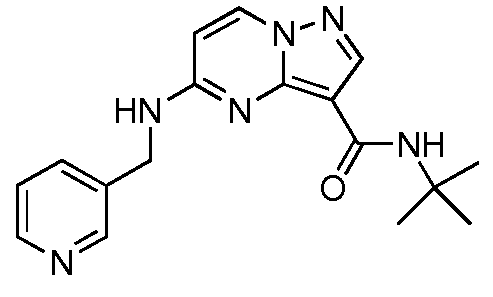
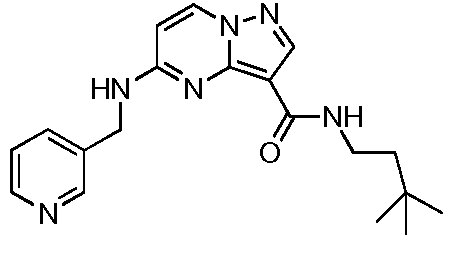
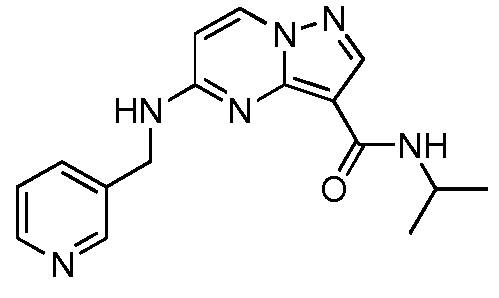
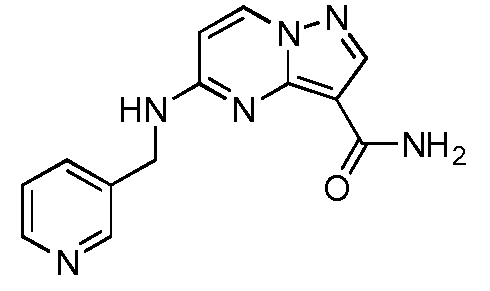
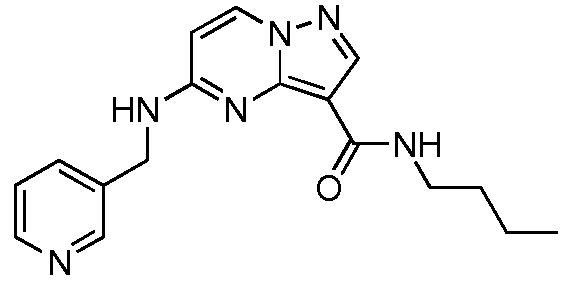
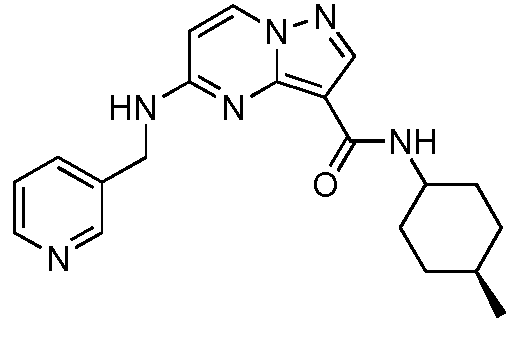
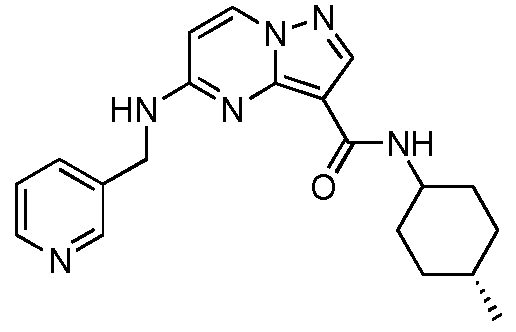

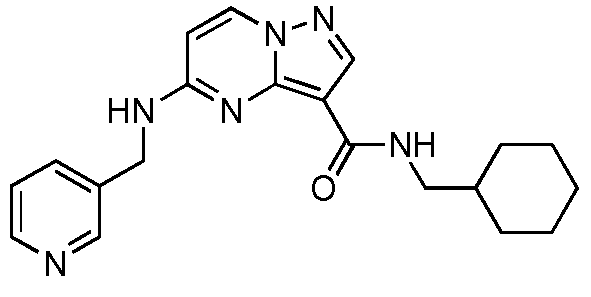
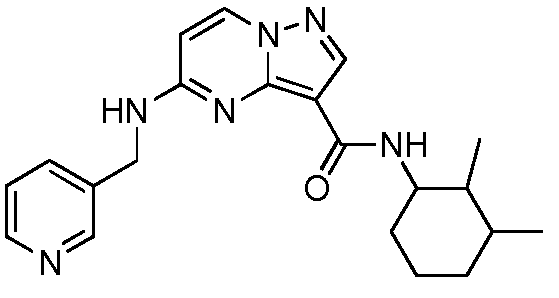
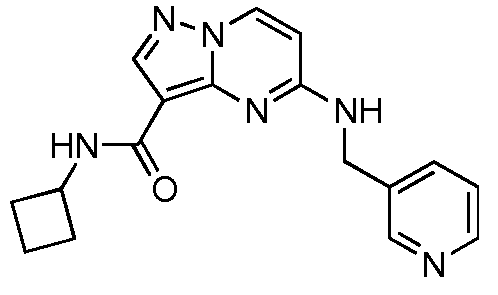


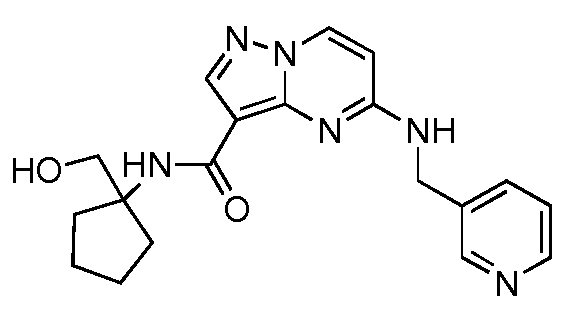
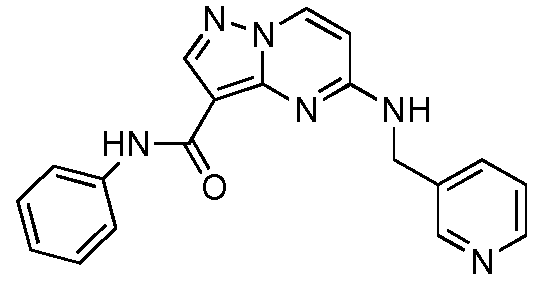
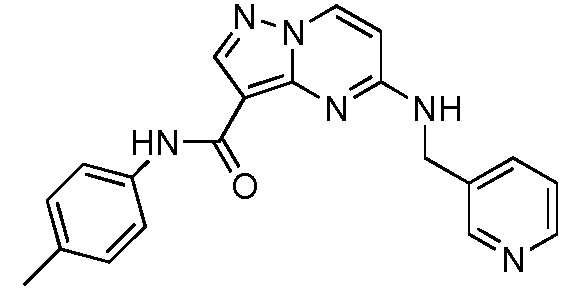

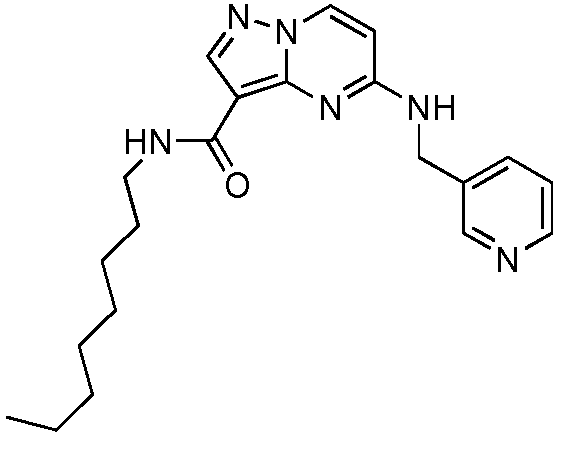
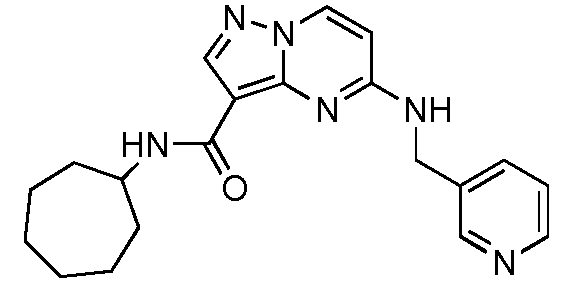
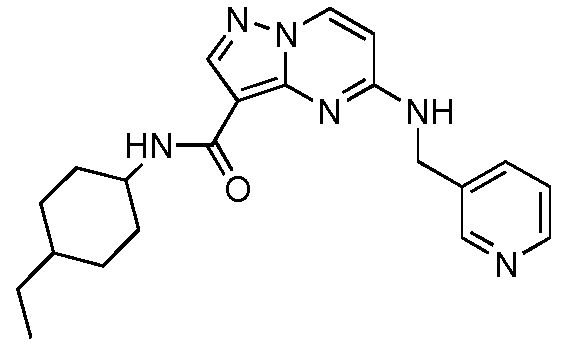
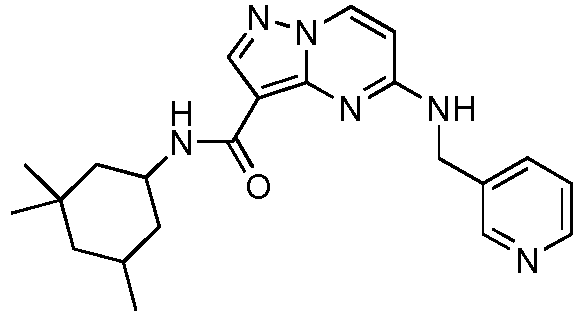

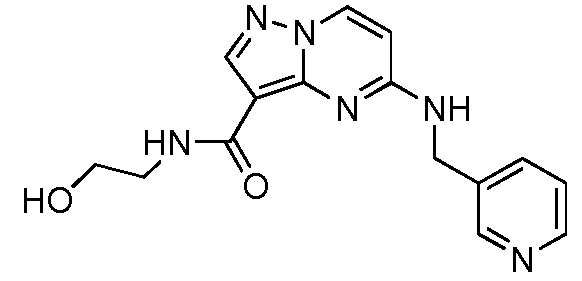
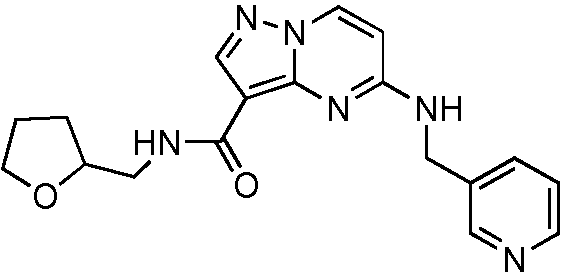
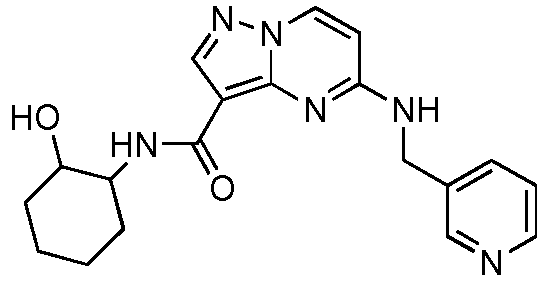
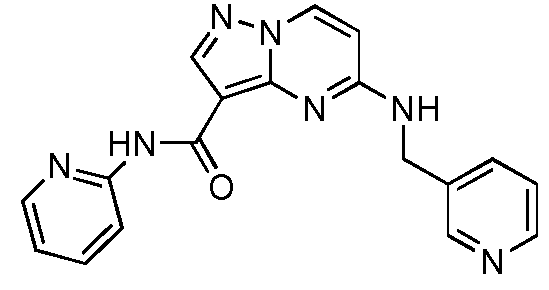
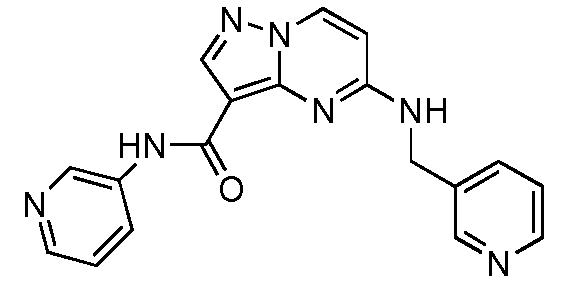
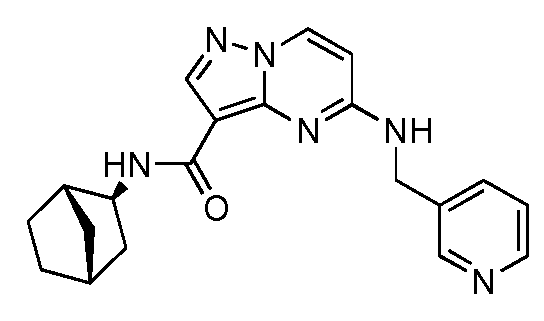
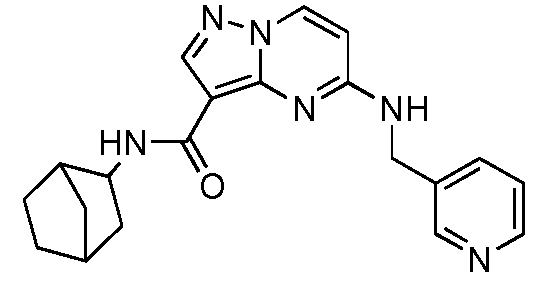
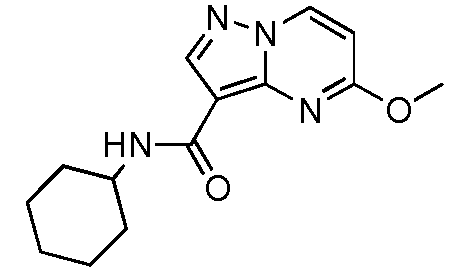
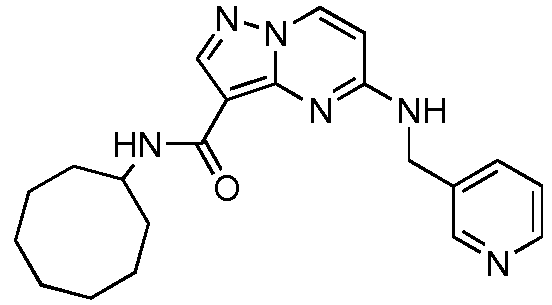
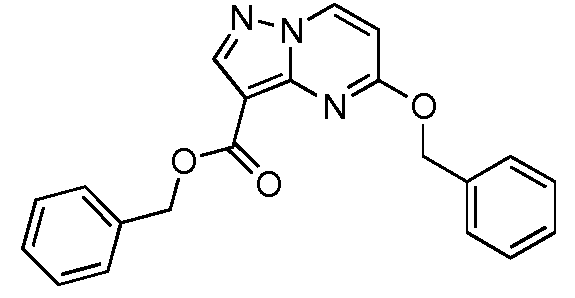
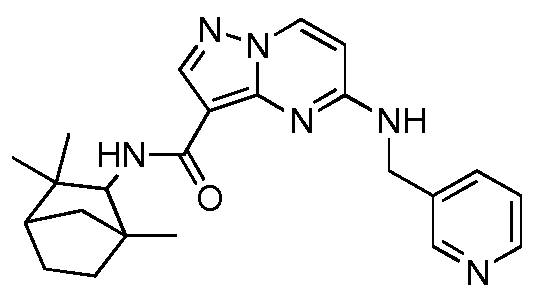
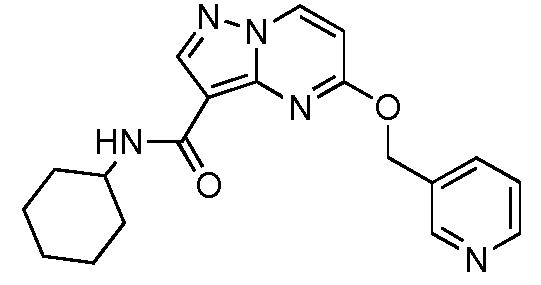
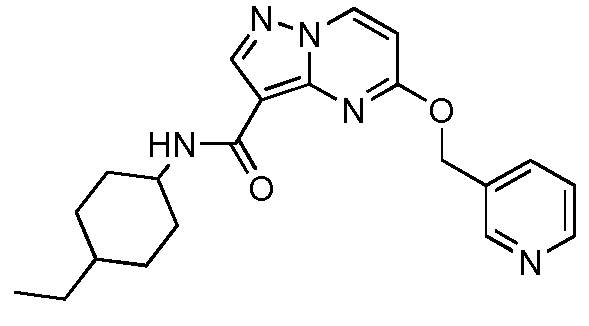
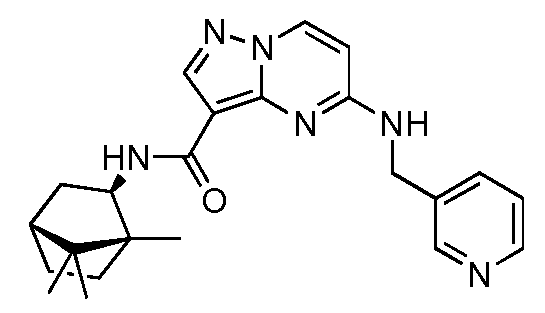
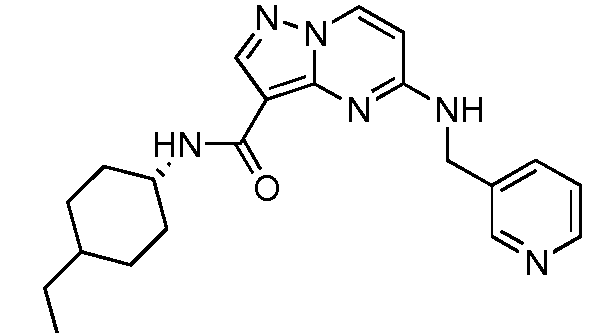
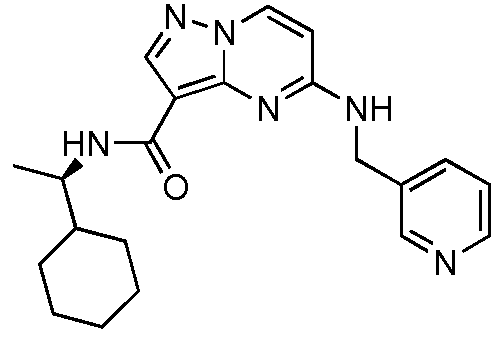

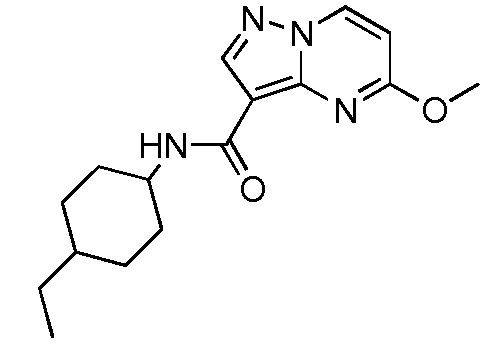
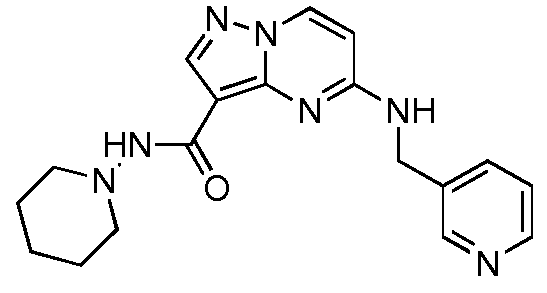
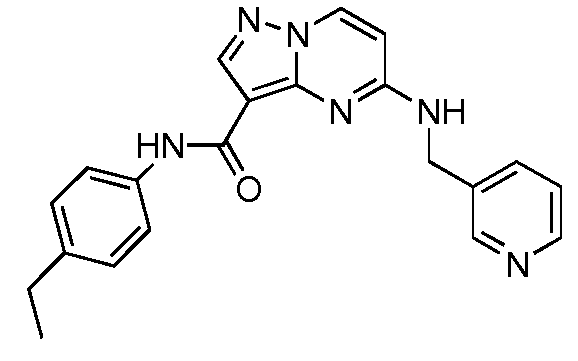
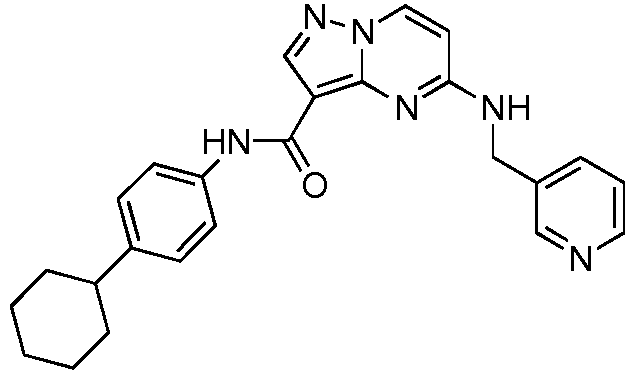
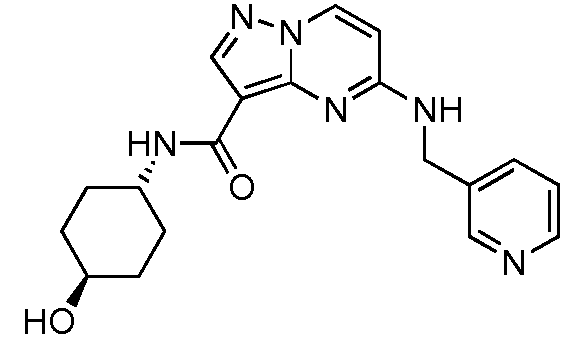
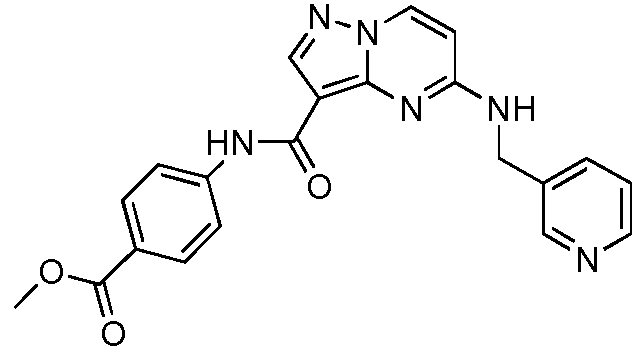
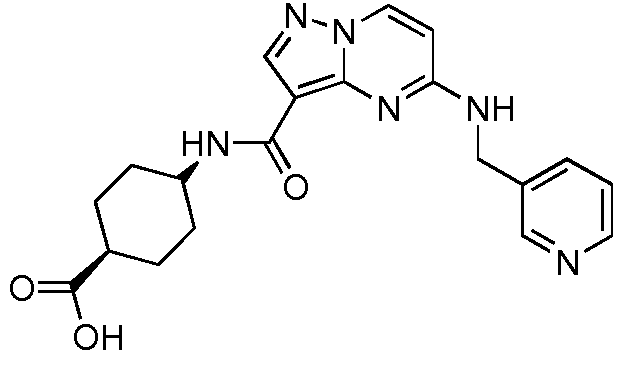
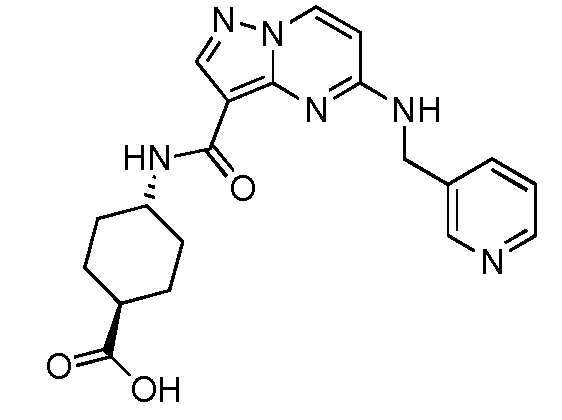
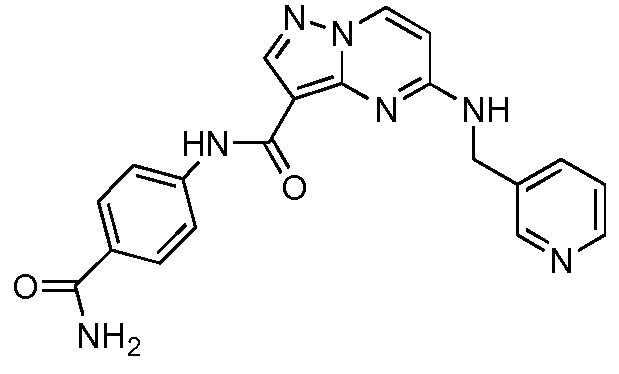
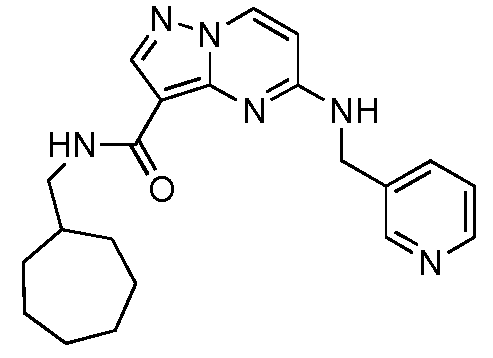
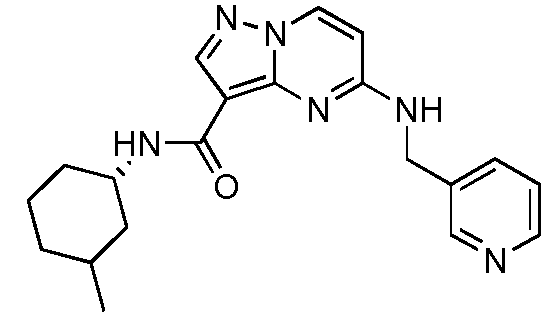
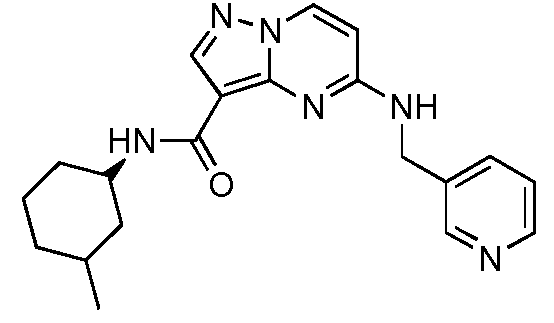
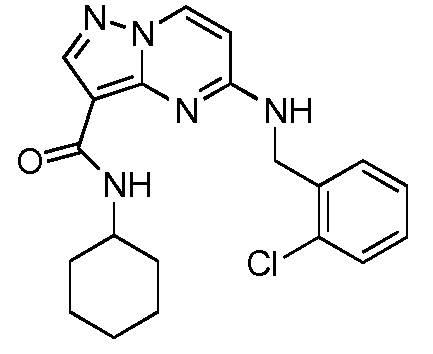
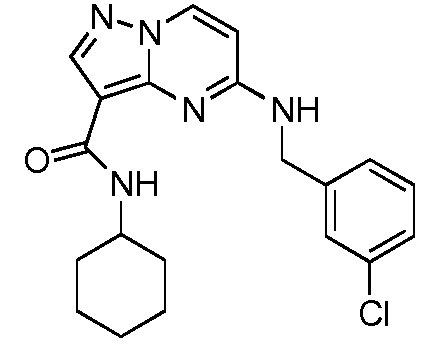
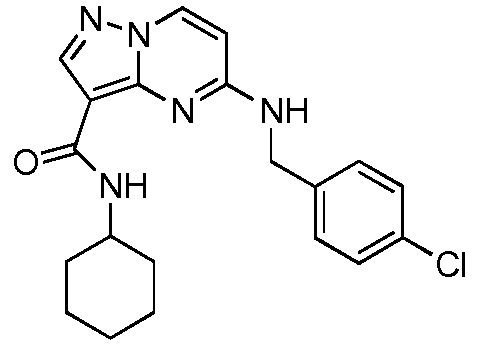
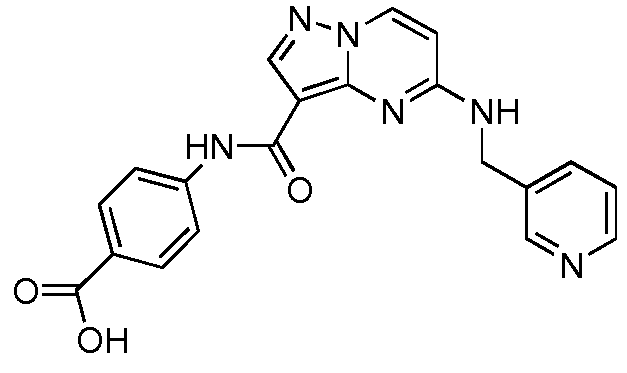
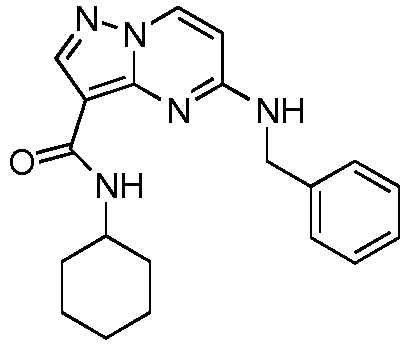
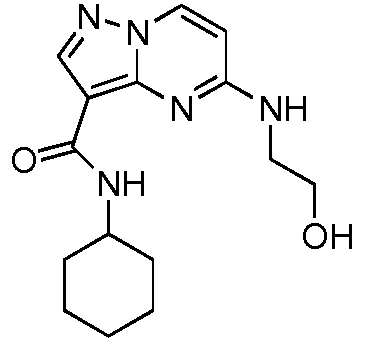
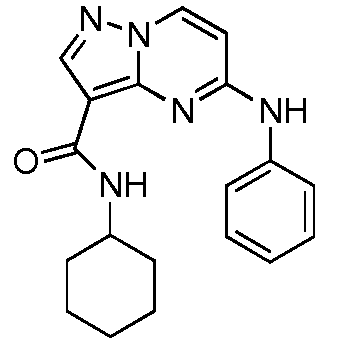
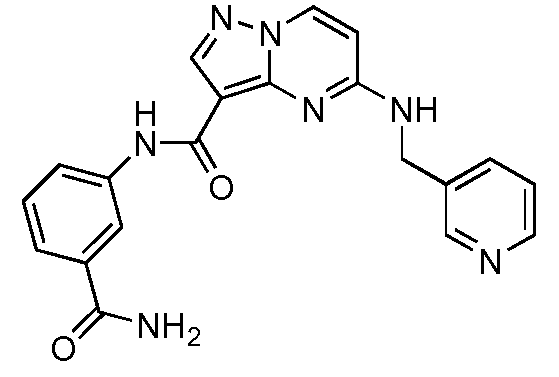

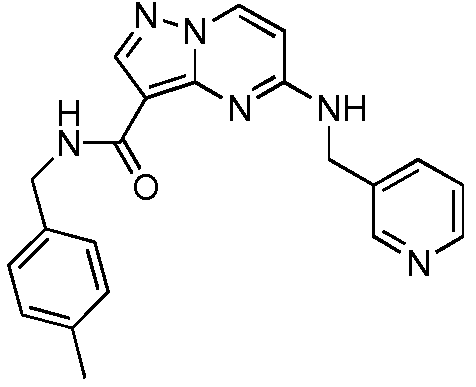
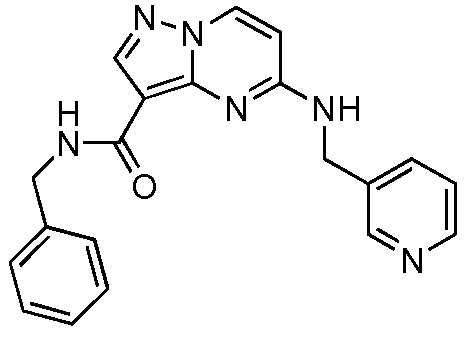
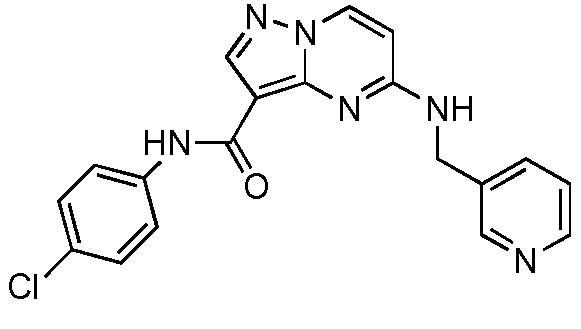
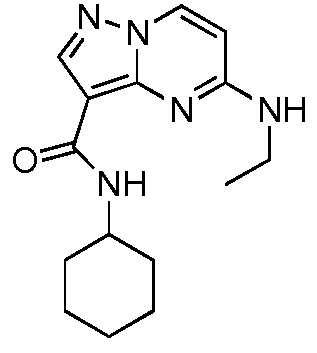
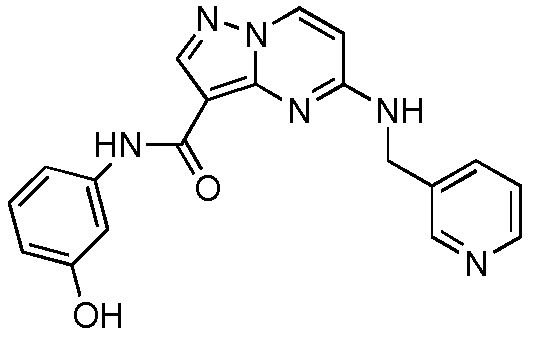
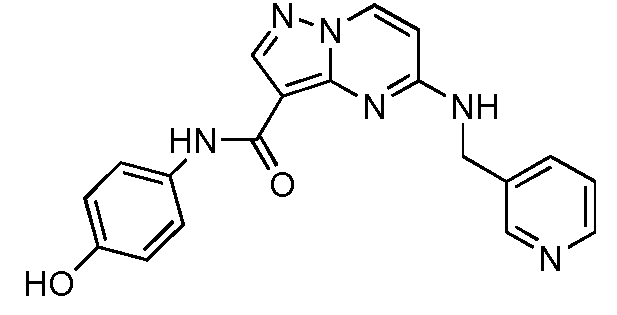
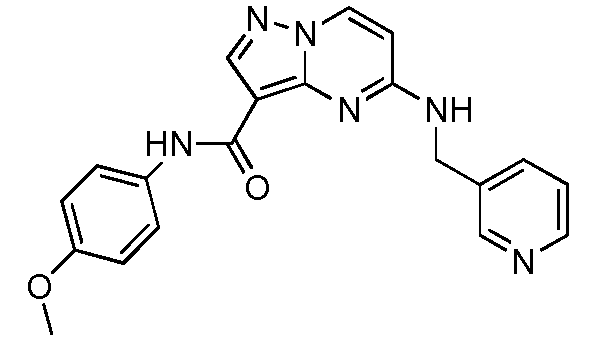
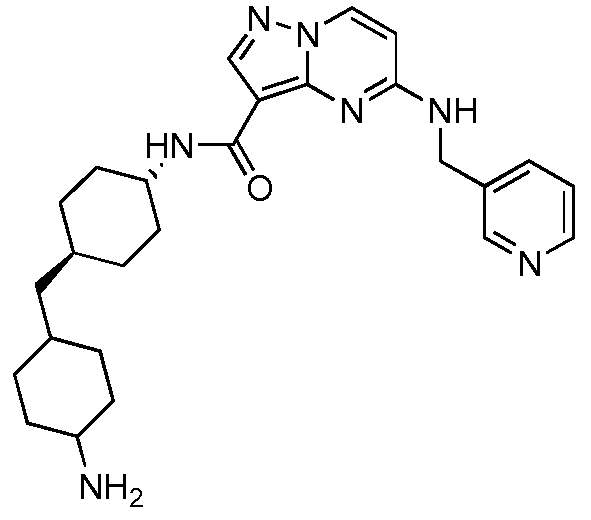

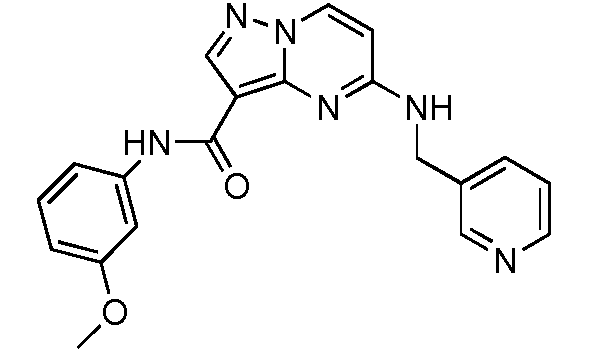
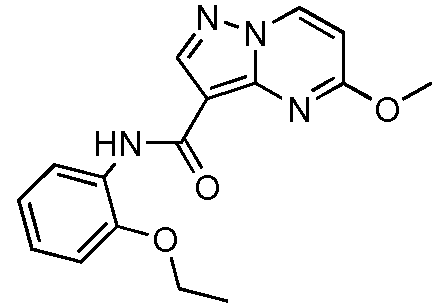

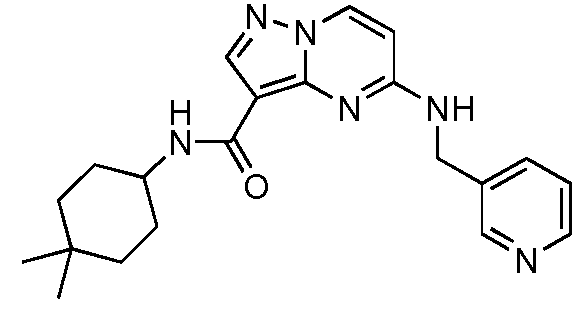
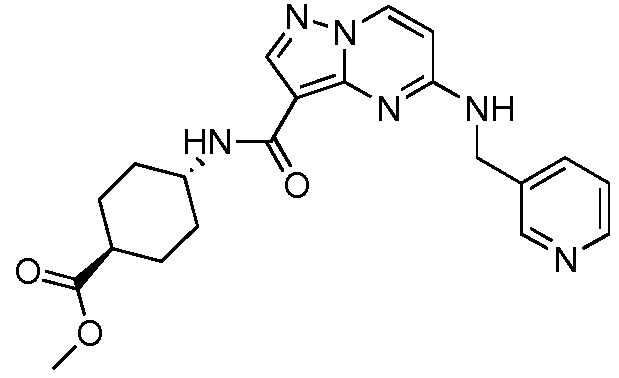
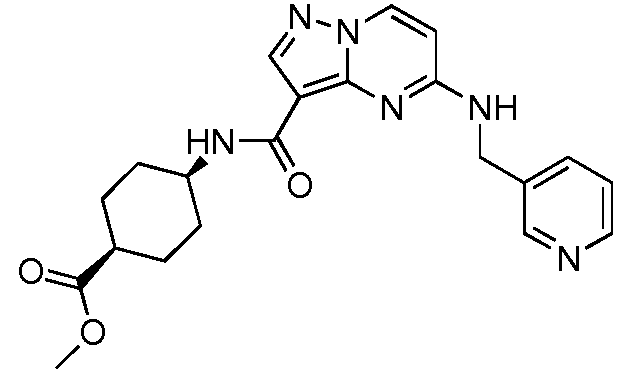
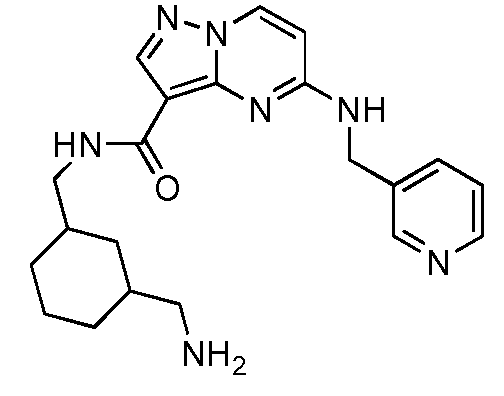
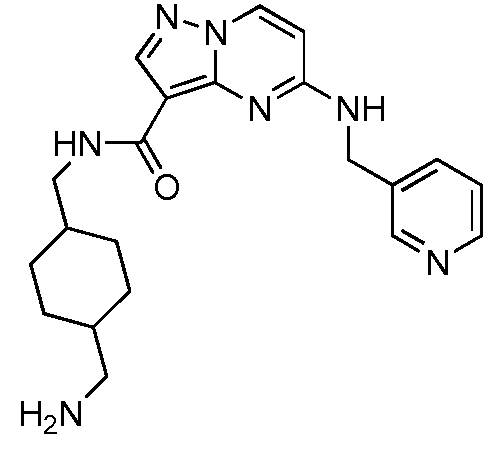
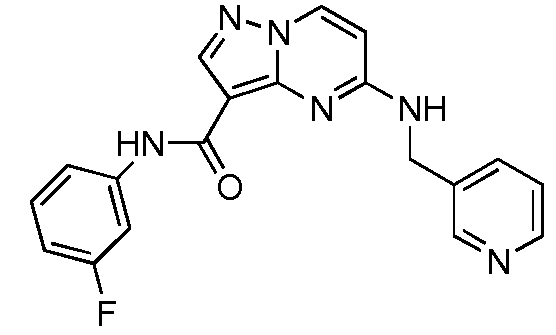

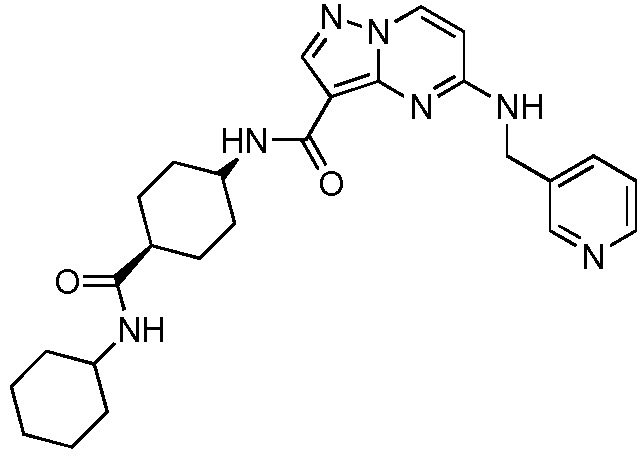
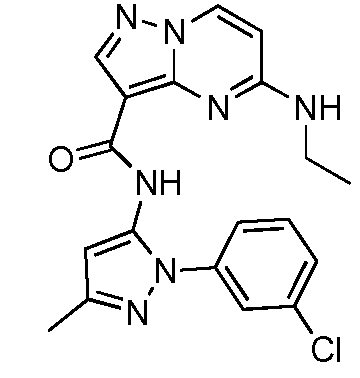
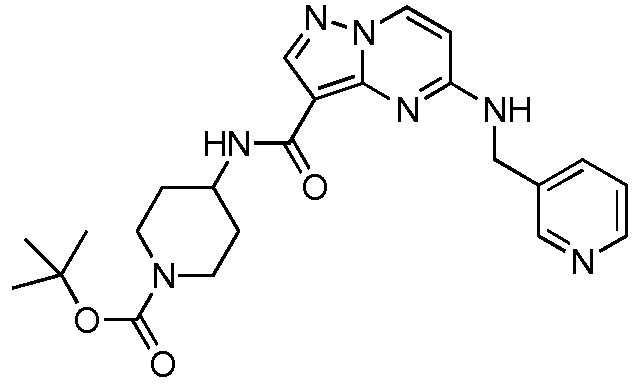
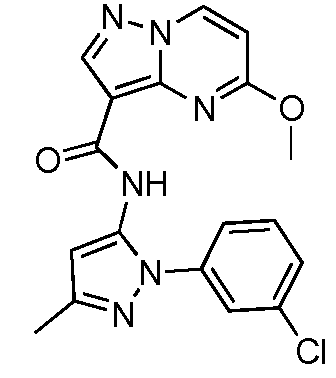
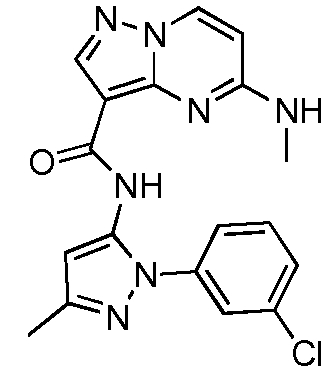
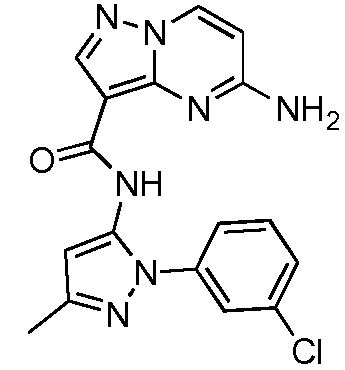
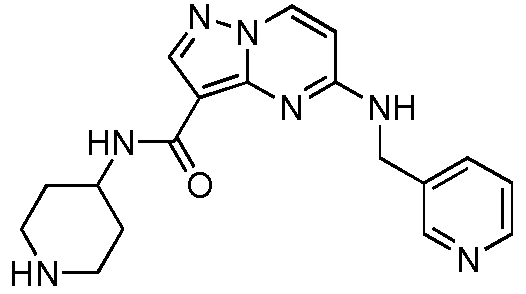
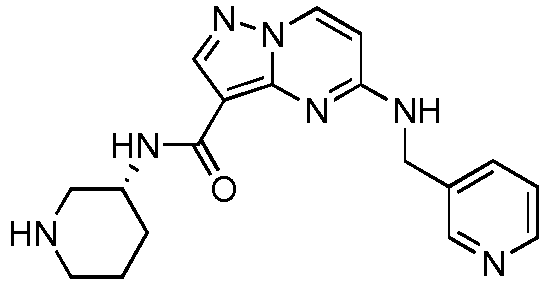
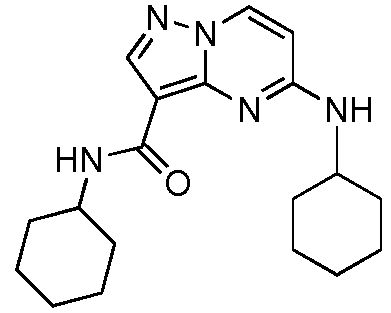
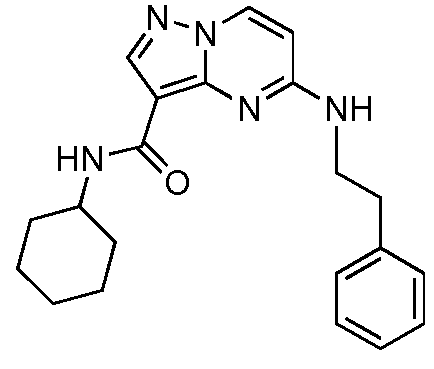
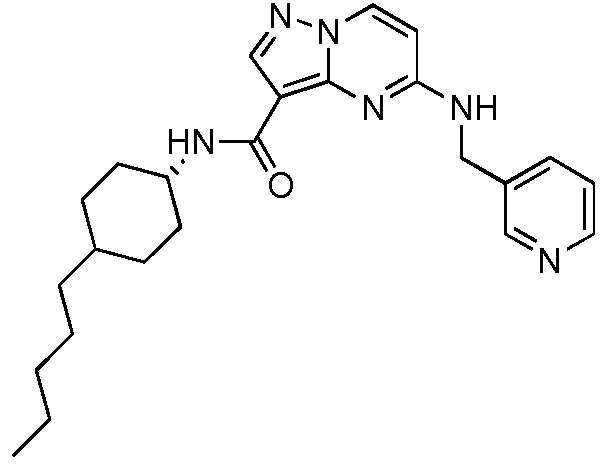

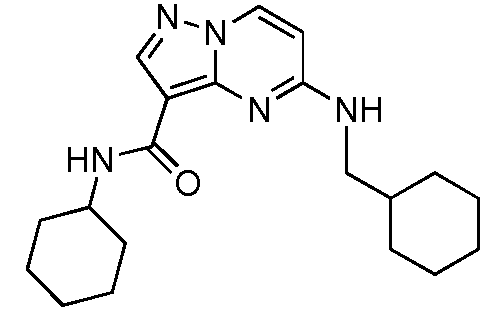
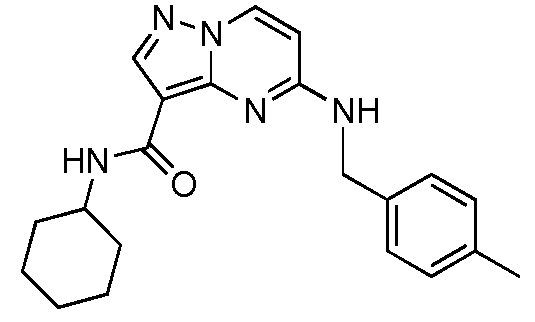
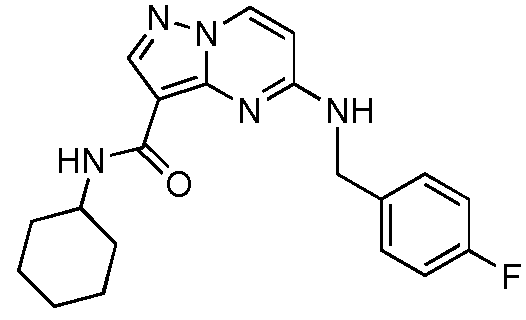
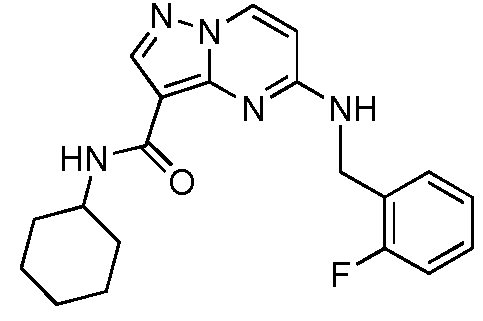
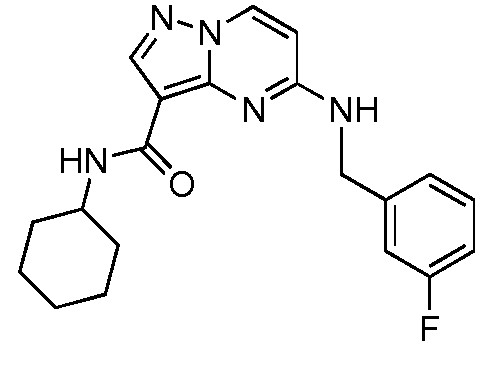
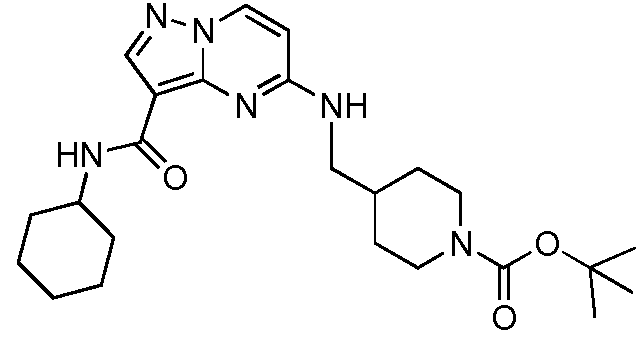
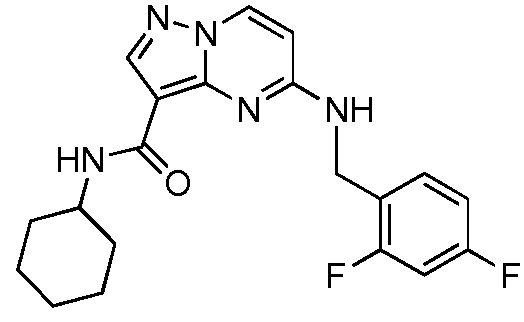

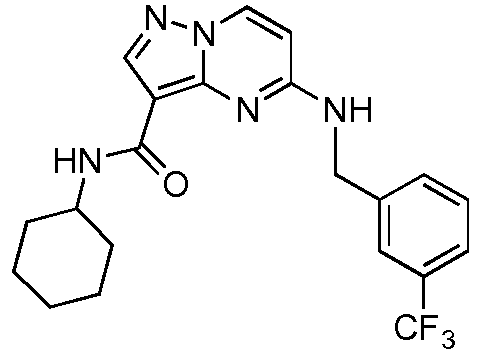
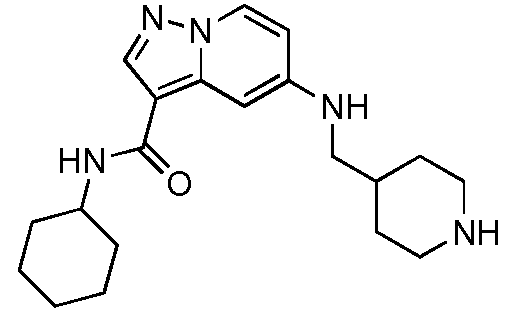
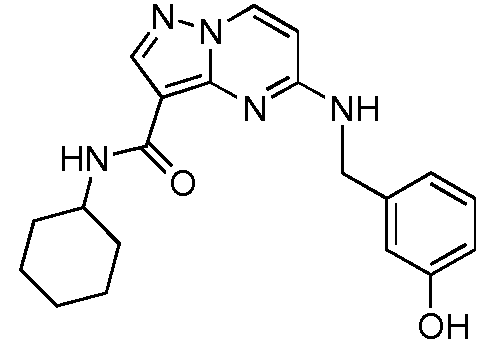
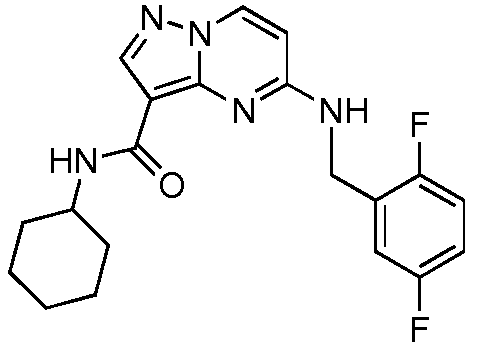
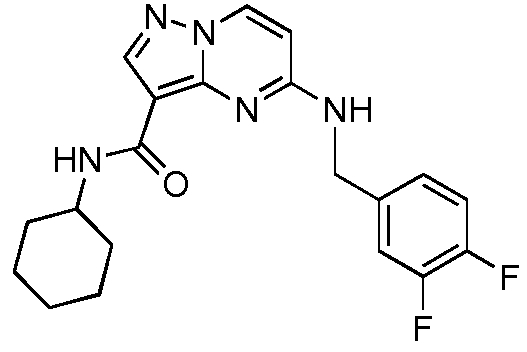
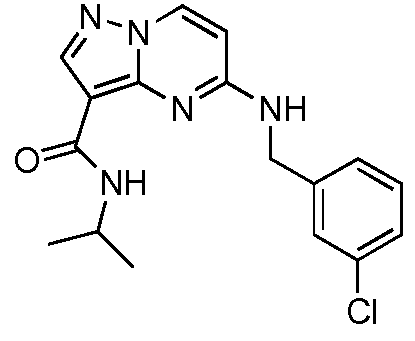
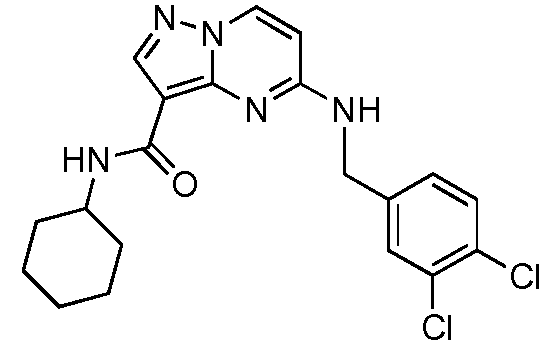
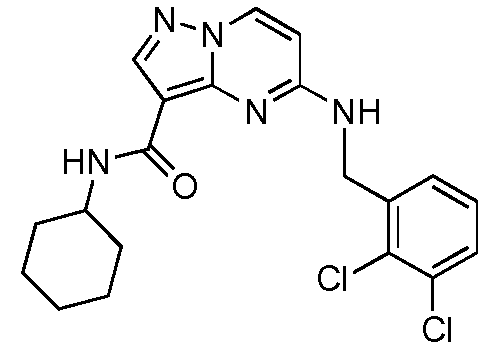

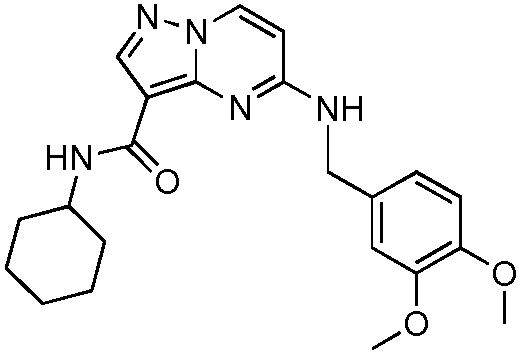

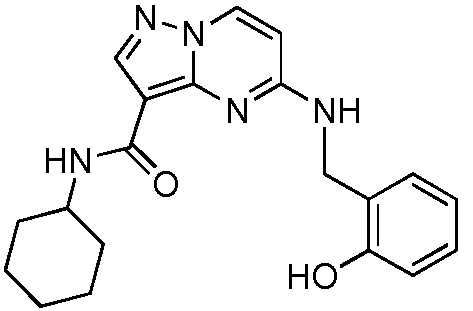
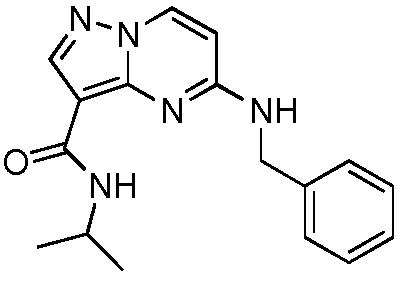
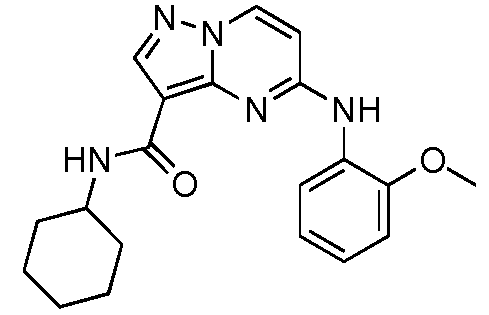
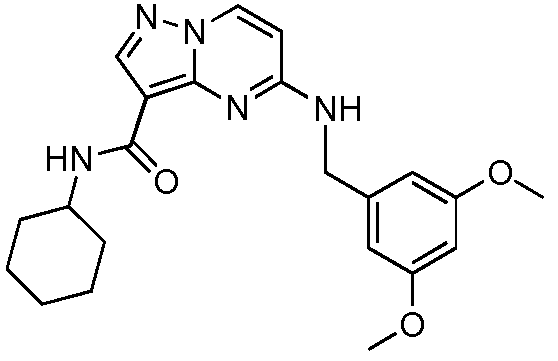
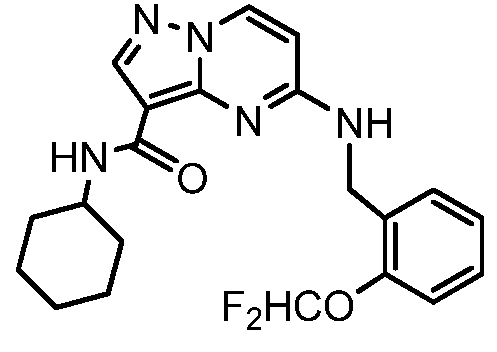
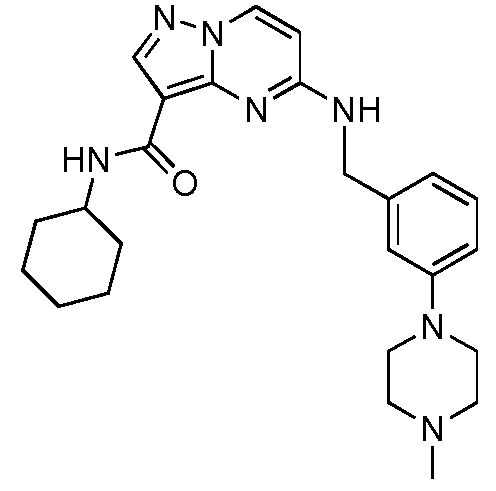
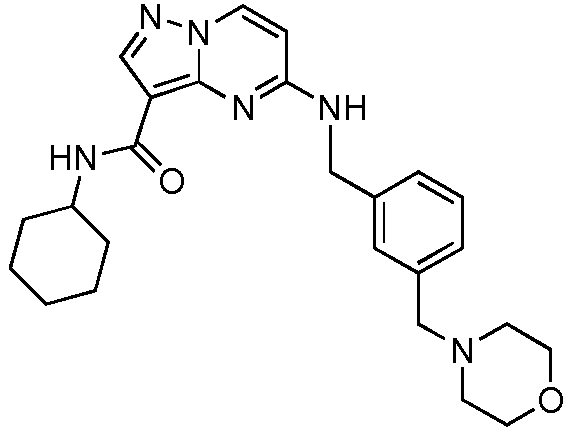


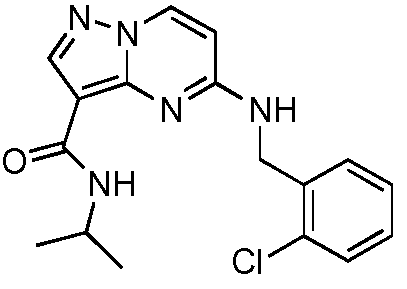
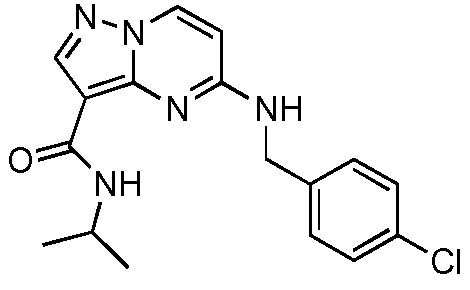
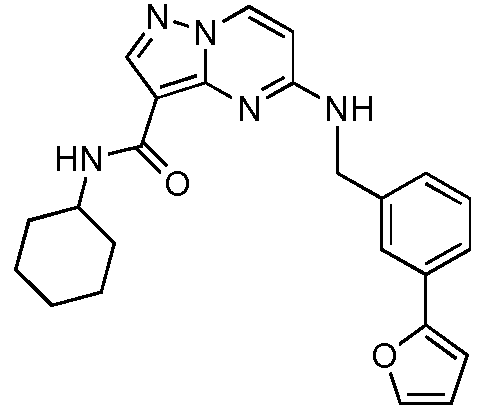
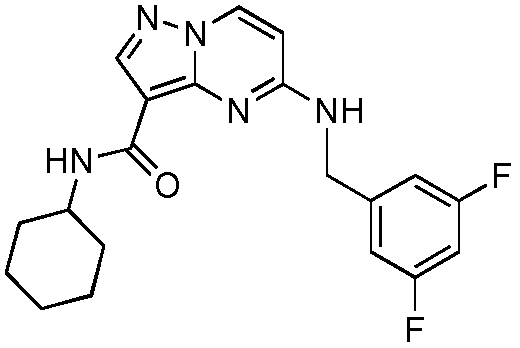
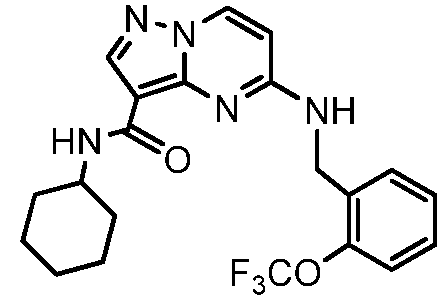
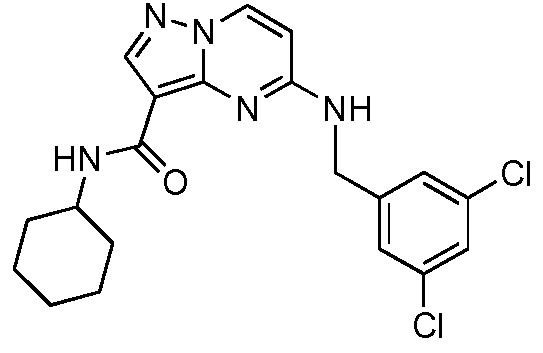


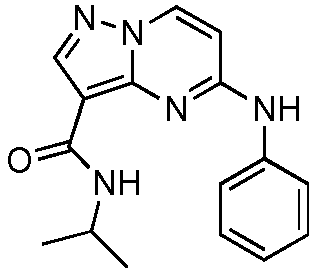

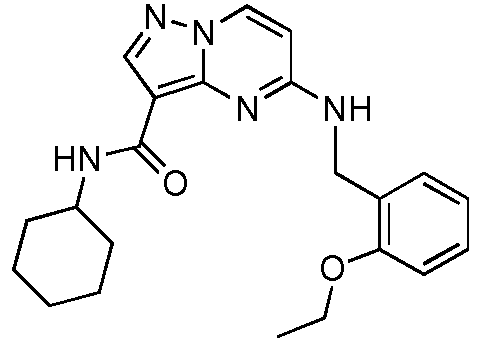
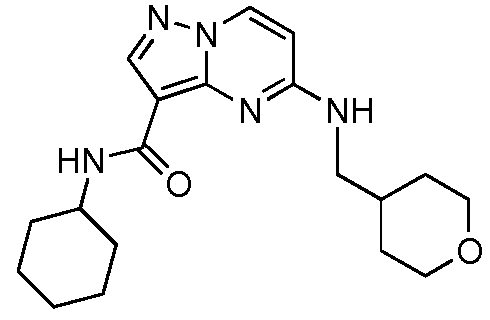

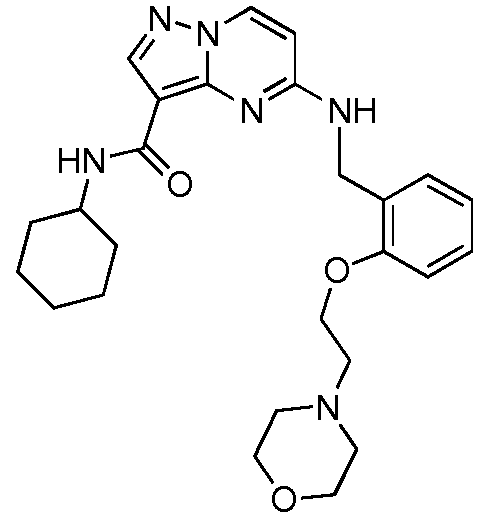

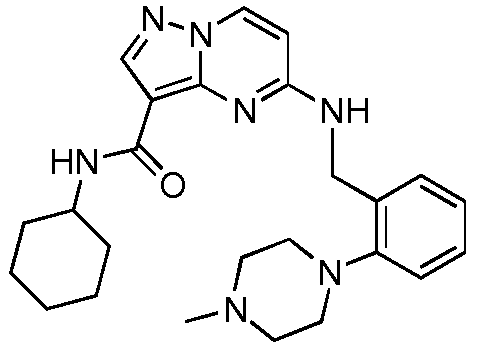

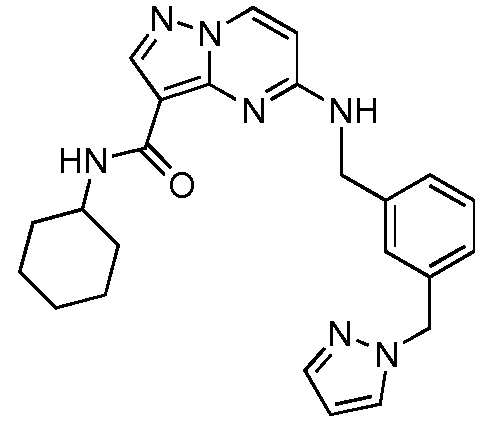
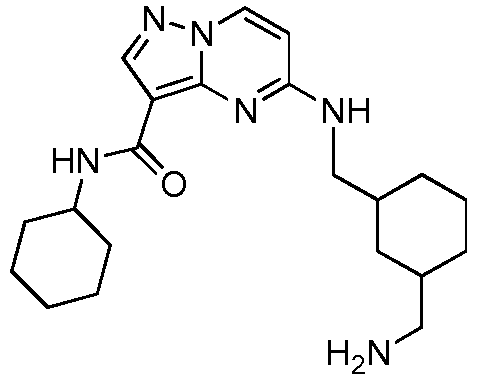
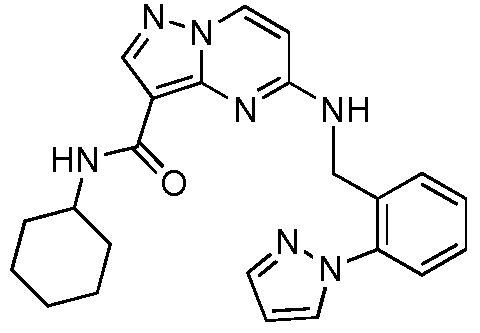
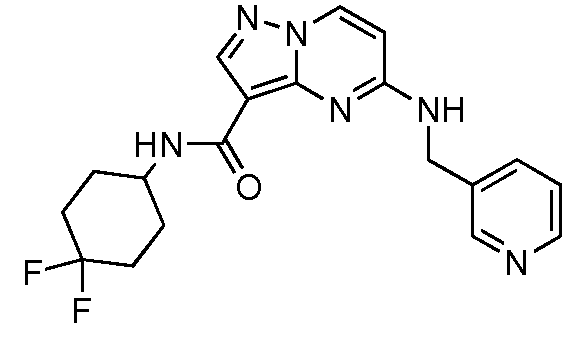
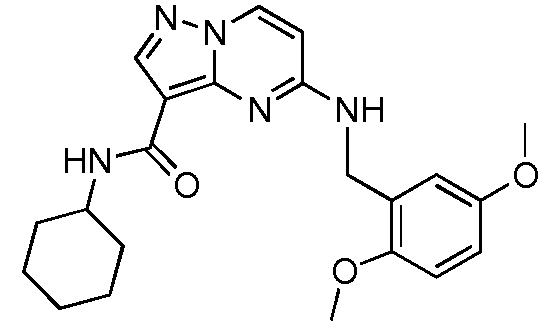
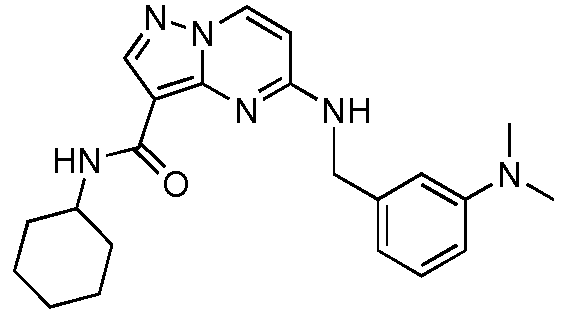
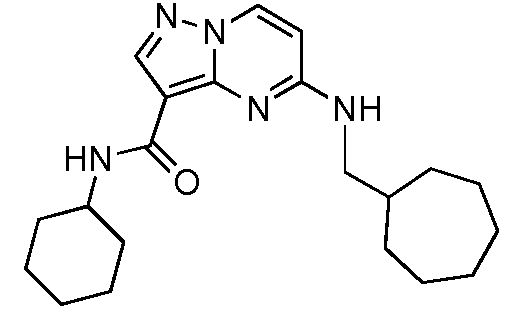
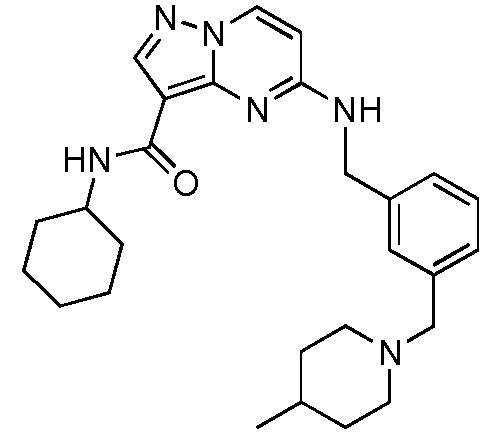
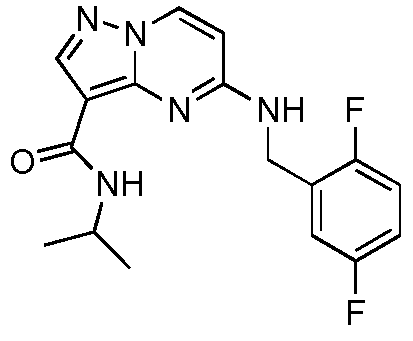
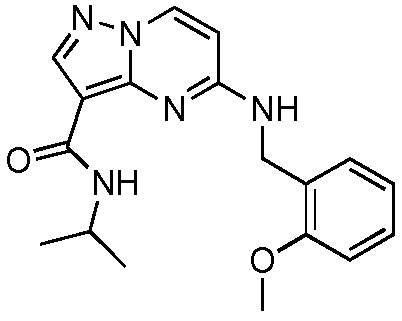
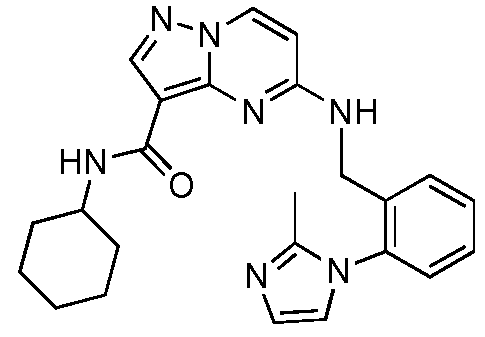
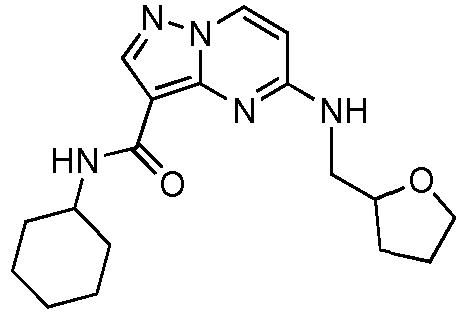
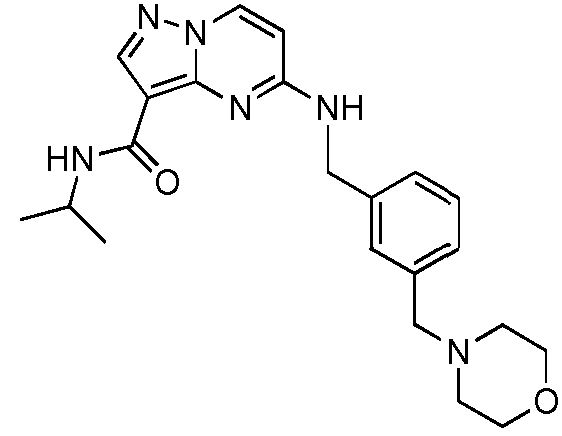

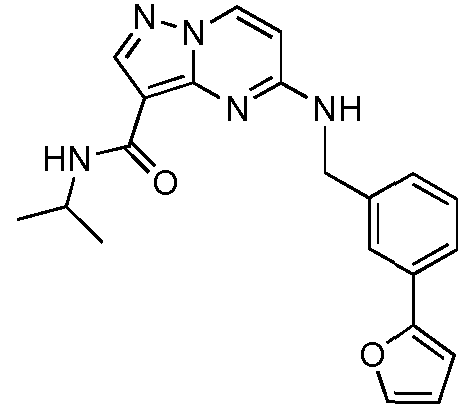
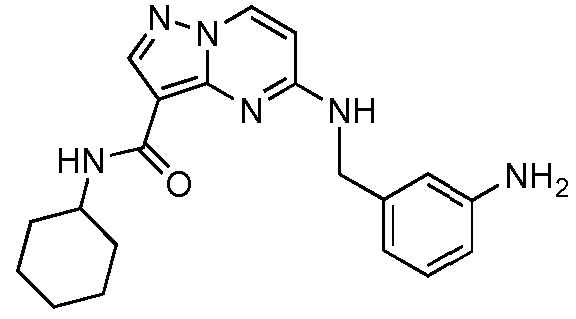



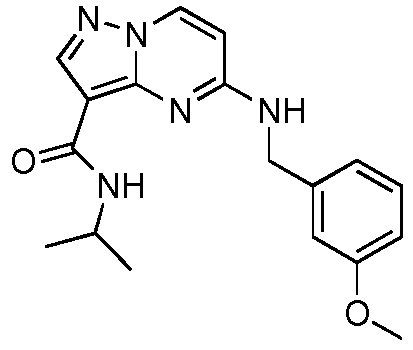
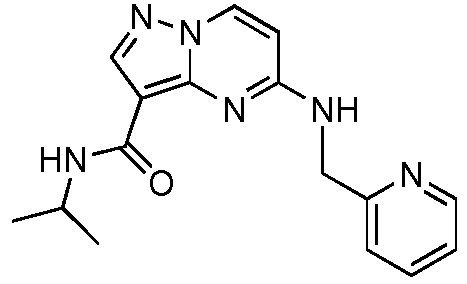




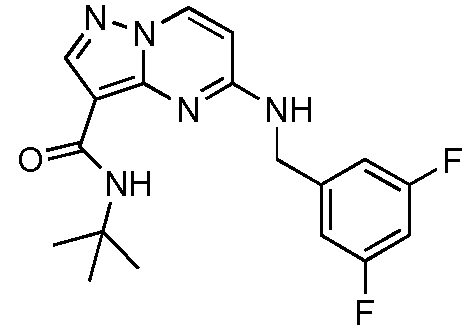
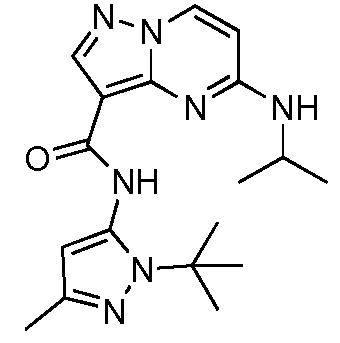
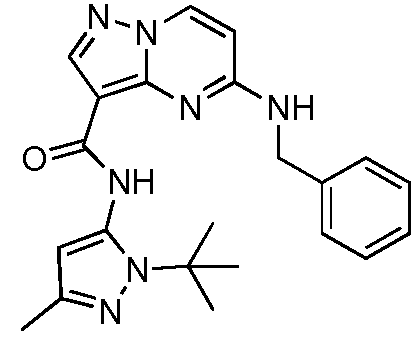



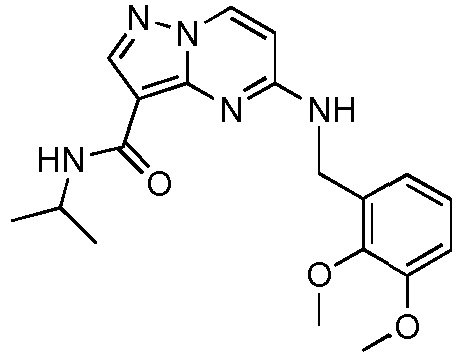
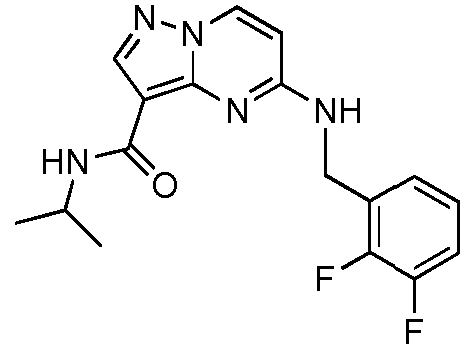
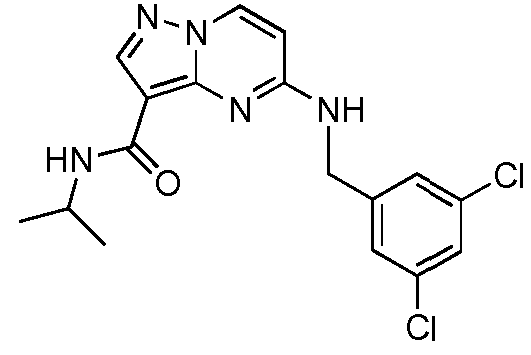
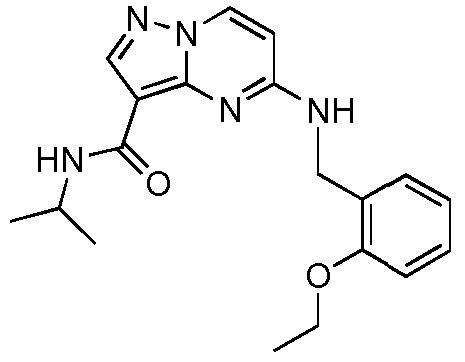

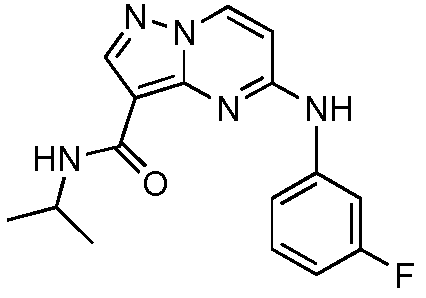
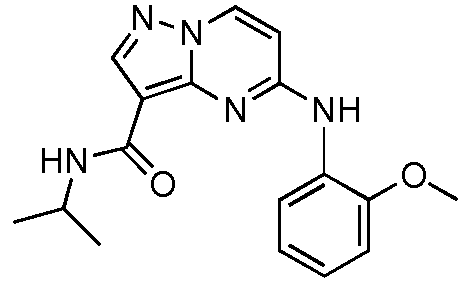

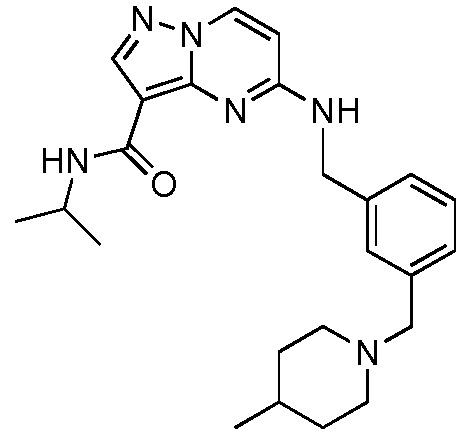
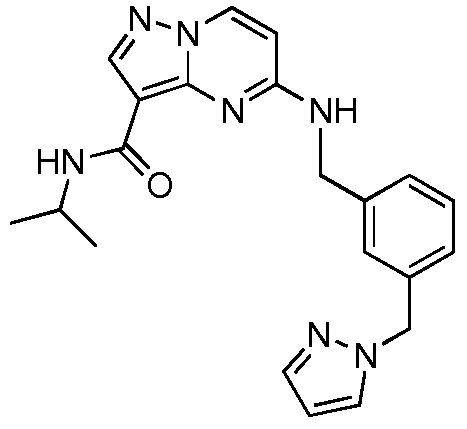
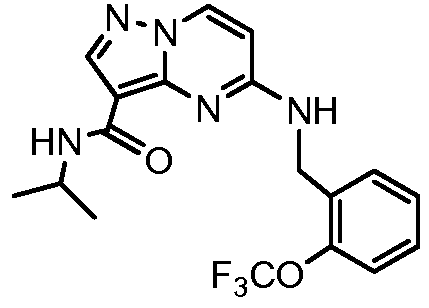
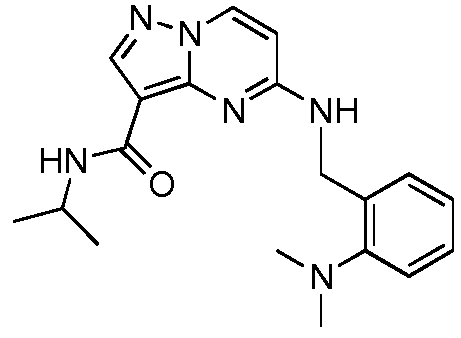
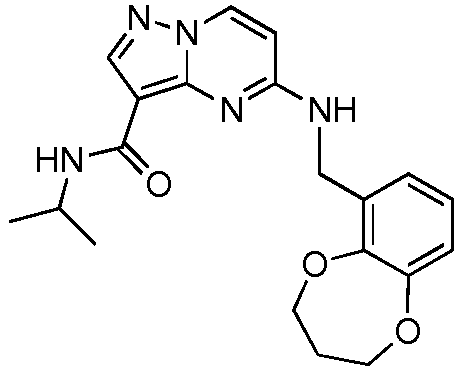
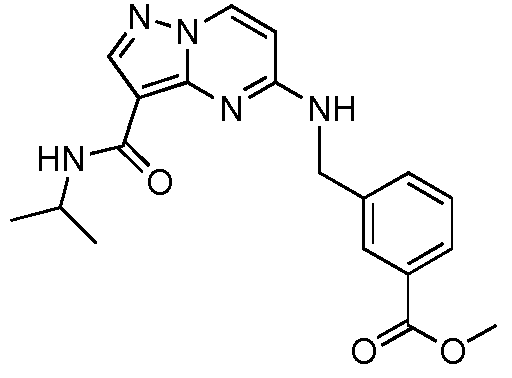
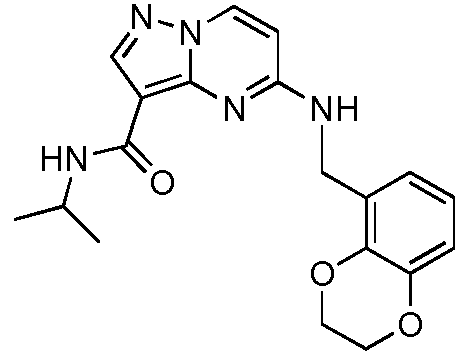
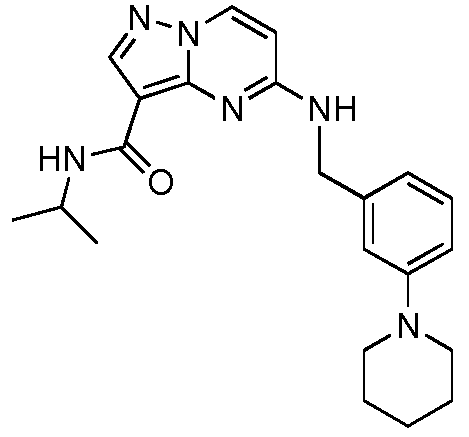
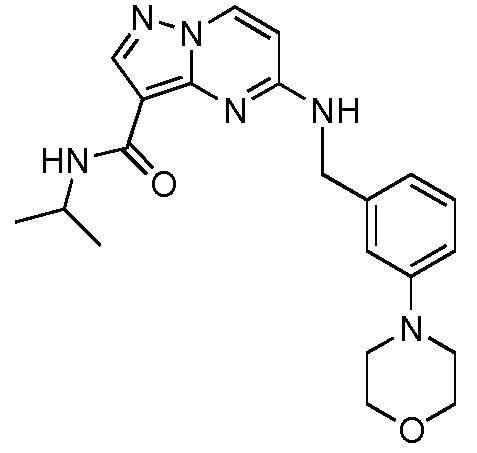
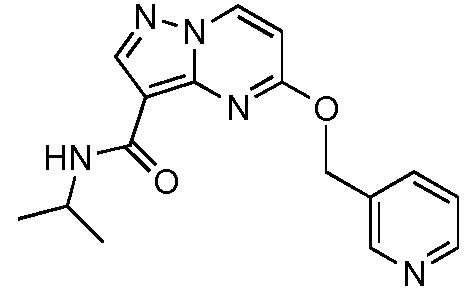

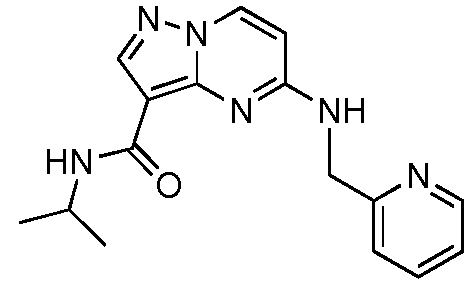
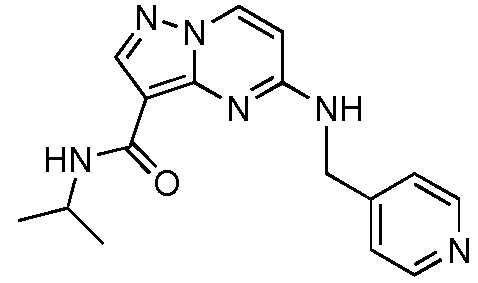
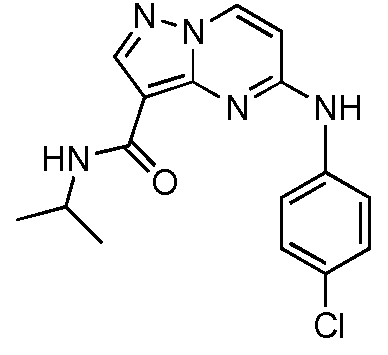
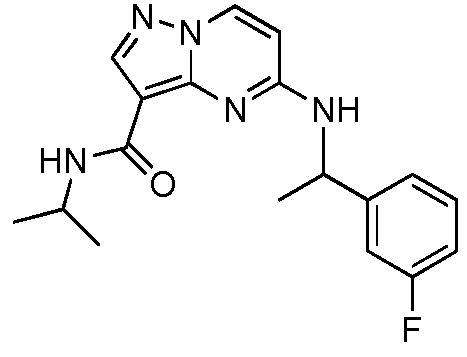
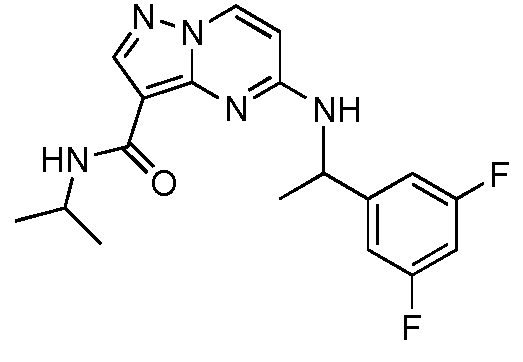
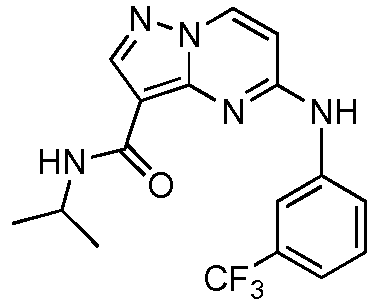
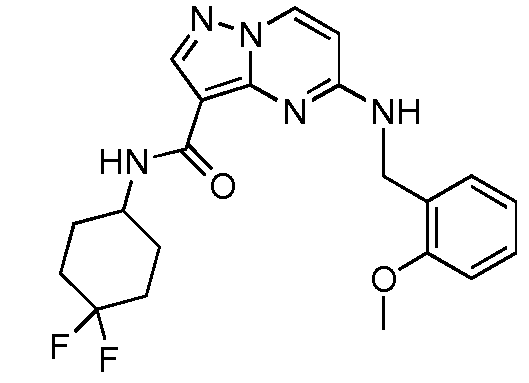

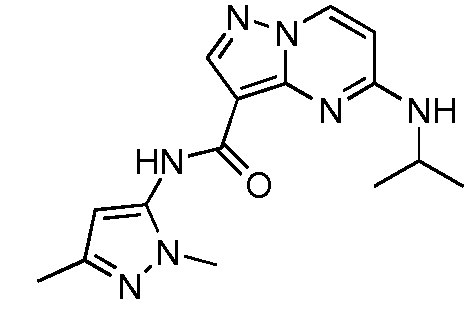


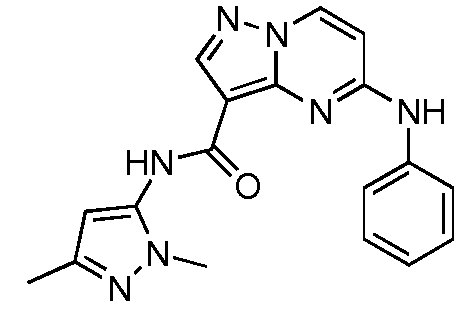
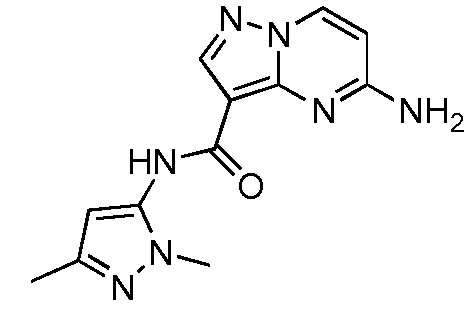
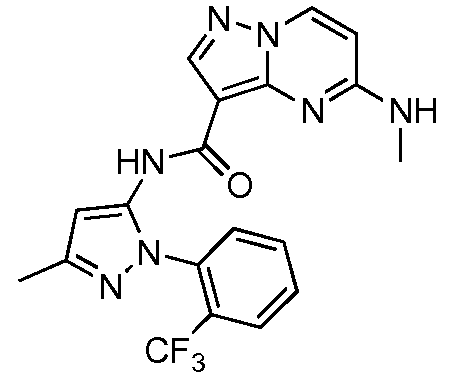
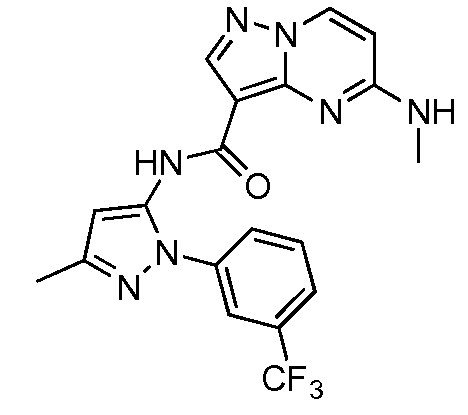
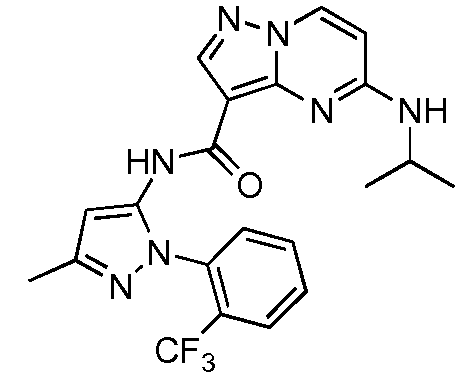
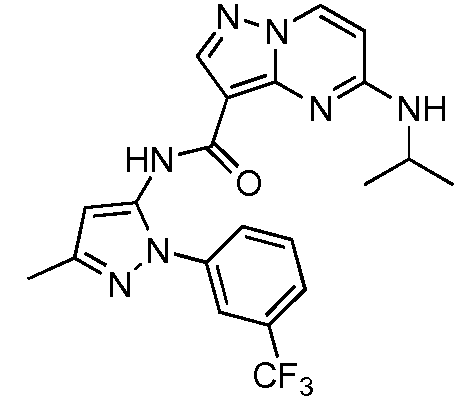
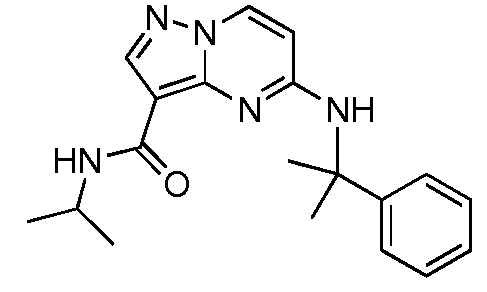
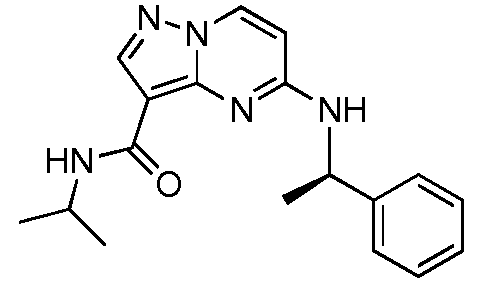

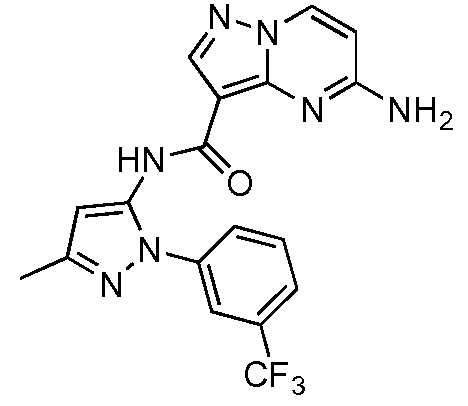
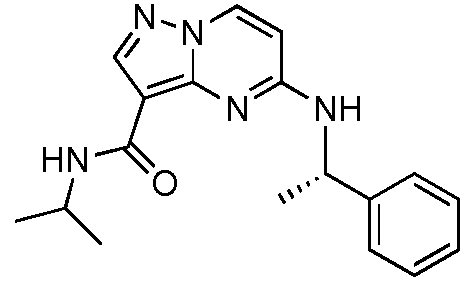

Пример 222

5-Амино-N-(3-(5-хлор-2-метилфенил)-1-метил-1H-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
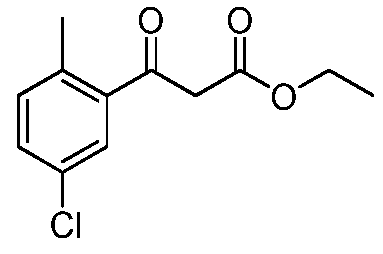
Этил 3-(5-хлор-2-метилфенил)-3-оксопропаноат
К перемешиваемому раствору 5-хлор-2-метилбензойной кислоты (4,85 г, 28,4 ммоль) в тетрагидрофуране (30 мл) добавляли N,N-карбонилдиимидазол (4,87 г, 30,0 ммоль, 1,06 экв.). Через 30 минут реакционную смесь добавляли к суспензии этилмалоната калия (11,61 г, 68,22 ммоль, 2,40 экв.) и хлорида магния (3,27 г, 34,3 ммоль, 1,21 экв.) в тетрагидрофуране (50 мл). Полученную суспензию нагревали при 50°C. Через 10 часов, реакционную смесь распределяли между этилацетатом и водой. Органическую часть сушили над сульфатом магния, фильтровали и концентрировали с получением 8,07 г (118%) этил 3-(5-хлор-2-метоксифенил)-3-оксопропаноата, который использовали без очистки. ЖХМС (ESI) m+H=241,2
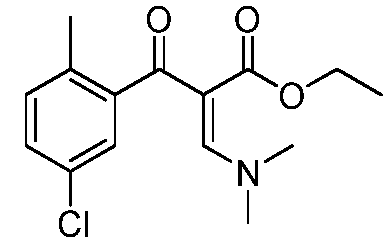
Этил 2-(5-хлор-2-метилбензоил)-3-(диметиламино)акрилат
Раствор этил 3-(5-хлор-2-метилфенил)-3-оксопропаноата (28,4 ммоль) в 1,1-диметокси-N,N-диметилметанамине (10,0 мл, 75,3 ммоль, 2,6 экв.) нагревали при 90°C. Через 3 часа реакционную смесь концентрировали в вакууме и полученный остаток очищали колоночной флэш-хроматографией на силикагеле (0→80% этилацетата в дихлорметане) с получением 2,87 г (34%) этил 2-(5-хлор-2-метилбензоил)-3-(диметиламино)акрилата. ЖХМС (ESI) m+H=296,3.
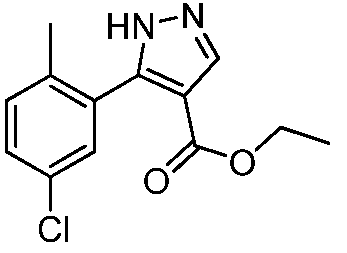
Этил 5-(5-хлор-2-метилфенил)-1Н-пиразол-4-карбоксилат
Раствор этил 2-(5-хлор-2-метилбензоил)-3-(диметиламино)акрилата (2,87 г, 9,70 ммоль) и гидразина (0,50 мл, 16,0 ммоль, 1,6 экв.) в 30 мл этанола нагревали при 70°C в течение 2 часов. Растворитель и избыток гидразина затем выпаривали с получением 2,57 г (100%) этил 5-(5-хлор-2-метоксифенил)-1Н-пиразол-4-карбоксилата, который использовали без дополнительной очистки. ЖХМС (ESI) m+H=265,2.

Раствор этил 5-(5-хлор-2-метилфенил)-1H-пиразол-4-карбоксилата (9,70 ммоль), карбоната цезия (3,83 г, 11,8 ммоль, 1,2 экв.) и иодметана (0,90 мл, 14,0 ммоль, 1,5 экв.) в N,N-диметилформамиде (35 мл) нагревали при 40°C. Через 7 часов реакционную смесь распределяли между этилацетатом и водой. Органическую часть сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали колоночной флэш-хроматографией на силикагеле (0→40% этилацетата в дихлорметане) с получением 2,18 г (81%) 1:1 смеси региоизомерных продуктов, этил 3-(5-хлор-2-метилфенил)-1-метил-1H-пиразол-4-карбоксилата и этил 5-(5-хлор-2-метилфенил)-1-метил-1H-пиразол-4-карбоксилата. ЖХМС (ESI) m+H=279,2.
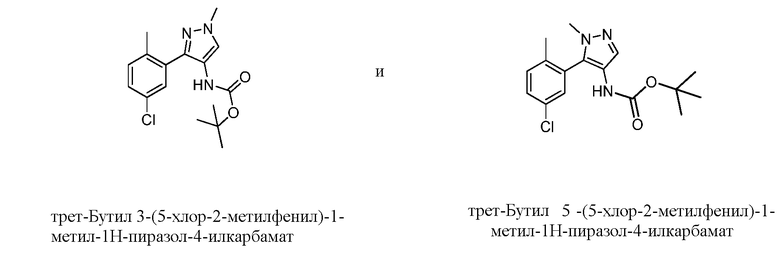
Раствор этил 3-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-карбоксилата и этил 5-(5-хлор-2-метилфенил)-1-метил-1H-пиразол-4-карбоксилата (1:1 смесь региоизомеров, 2,179 г, 7,818 ммоль) и 1,0 M водного раствора гидроксида натрия (14 мл, 20 ммоль, 4 экв.) в этаноле (10 мл) нагревали при 50°C в течение 16 часов. После выпаривания этанола остаток разбавляли водой. Полученный водный раствор подкисляли до около pH 2 при помощи 1,0 M водного раствора фосфорной кислоты. Этот раствор экстрагировали дихлорметанои (3×). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали с получением 1,936 г (99%) соответствующих карбоновых кислот, которые использовали сразу же без дополнительной очистки. ЖХМС (ESI) m+H=251,1.
К раствору промежуточных карбоновых кислот в диоксане (15 мл) добавляли триэтиламин (2,2 мл, 15,8 ммоль, 4,1 экв.) и азид дифенилфосфоновой кислоты (1,9 мл, 8,82 ммоль, 2,3 экв.). Через 1 час реакционную смесь нагревали до 90°C и добавляли трет-бутиловый спирт (15 мл). Через 2 часа реакционную смесь концентрировали в вакууме и полученный остаток распределяли между этилацетатом и водой. Органическую часть промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали колоночной флэш-хроматографией на силикагеле (0→50% этилацетата в дихлорметане) с получением 1,64 г (66%) 1:1 смеси региоизомерных продуктов. ЖХМС (ESI) m+H=322,2.

К раствору трет-бутил 3-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-илкарбамата и трет-бутил 5-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-илкарбамата (1:1 смесь региоизомеров, 1,64 г, 5,09 ммоль) в дихлорметане (10 мл) добавляли хлористый водород (10,0 мл, 40 ммоль, 16 экв., 4,0 M в 1,4-диоксане). Через 16 часов реакционную смесь концентрировали в вакууме. Полученный твердый остаток распределяли между дихлорметаном и насыщенным водным раствором бикарбоната натрия. Водную часть снова экстрагировали дихлорметаном и объединенные органические экстракты сушили над сульфатом магния и концентрировали. Неочищенный продукт очищали и региоизомеры разделяли колоночной флэш-хроматографией на силикагеле (0→100% этилацетата в дихлорметане) с получением: 429,7 мг 3-(5-хлор-2-метилфенил)-1-метил-1H-пиразол-4-амина. ЖХМС (ESI) m+H=222,1; 1H ЯМР (400 МГц, CDCl3) δ: 7,35 (д, J=1,8, 1H), 7,24-7,17 (м, 2H), 7,04 (с, 1H), 3,84 (с, 3H), 2,76 (с, 2H), 2,30 (с, 3H) и 420,2 мг 5-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-амина. ЖХМС (ESI) m+H=222,2; 1H ЯМР (400 МГц, CDCl3) δ: 7,33 (дд, J=8,3, 2,1, 1H), 7,28 (с, 1H), 7,24-7,19 (м, 2H), 3,57 (с, 3H), 2,71 (с, 2H), 2,15 (с, 3H).

5-Хлор-N-(3-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
К раствору 3-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-амина (182,9 мг, 0,4826 ммоль, 1,2 экв.) в дихлорметане (5 мл) добавляли 5-хлорпиразоло[1,5-a]пиримидин-3-карбонилхлорид (91,2 мг, 0,411 ммоль, 1,0 экв.) и триэтиламин (0,30 мл, 2,2 ммоль, 5,2 экв.) при комнатной температуре. Через 16 часов реакционную смесь распределяли между этилацетатом и насыщенным водным раствором бикарбоната натрия. Органический слой сушили над сульфатом магния, фильтровали и концентрировали с получением 143,1 мг (87%) 5-хлор-N-(3-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида, который использовали далее без очистки. ЖХМС (ESI) m+H=401,0.

5-амино-N-(3-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
Газообразный аммиак барботировали через охлажденную льдом суспензию 5-хлор-N-(3-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида (143,1 мг, 0,3566 ммоль) в 3,0 мл изопропанола в течение 20 минут. Реакционный сосуд закрывали крышкой и нагревали при помощи микроволнового облучения при 110°C в течение 30 минут. Реакционную смесь концентрировали досуха. Неочищенный продукт очищали при помощи обращенно-фазовой ВЭЖХ и лиофилизировали с получением 76,4 мг (56%) 5-амино-N-(3-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида. ЖХМС (ESI) m+H=382,1; 1H ЯМР (400 МГц, ДМСО) δ 9,34 (с, 1H), 8,63 (д, J=7,6, 1H), 8,16 (д, J=9,6, 2H), 7,41 (м, 3H), 6,37 (д, J=7,6, 1H), 3,89 (с, 3H), 2,26 (с, 3H).
Пример 223
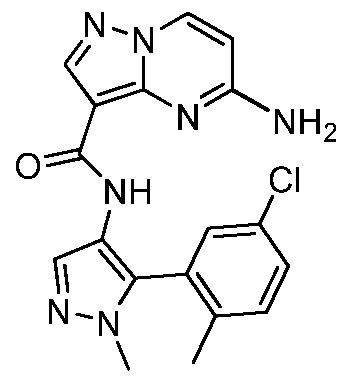
5-Амино-N-(5-(5-хлор-2-метилфенил)-1-метил-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
С использованием 5-(5-хлор-2-метилфенил)-1-метил-1H-пиразол-4-амина и следуя процедурам, описанным в Примере 222, получали указанное в заголовке соединение 5-амино-N-(5-(5-хлор-2-метилфенил)-1-метил-1H-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид. ЖХМС (ESI) m+H=382,1; 1H ЯМР (400 МГц, ДМСО) δ 9,16 (с, 1H), 8,61 (д,J=7,6, 1H), 8,13 (с, 1H), 7,83 (с, 1H), 7,50 (м 3H), 6,35 (д, J=7,6, 1H), 3,60 (с, 3H), 2,13 (с, 3H).
Пример 224

5-Амино-N-(3-(5-хлор-2-метилфенил)-1-(2-метоксиэтил)-1H-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
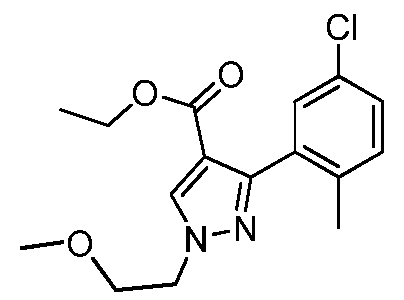
Этил 3-(5-хлор-2-метилфенил)-1-(2-метоксиэтил)-1Н-пиразол-4-карбоксилат
Раствор этил 5-(5-хлор-2-метилфенил)-1Н-пиразол-4-карбоксилата (0,2286 г, 0,8636 ммоль), карбоната цезия (359,1 мг, 1,102 ммоль, 1,276 экв.) и 1-бром-2-метоксиэтана в N,N-диметилформамиде (6 мл) нагревали при 50°C. Через 2,5 часа реакционную смесь распределяли между этилацетатом и водой. Органический слой сушили над сульфатом магния, фильтровали и концентрировали с получением 257,7 мг (92%) этил 3-(5-хлор-2-метилфенил)-1-(2-метоксиэтил)-1H-пиразол-4-карбоксилата, который использовали далее без очистки. ЖХМС (ESI) m+H=323,2.
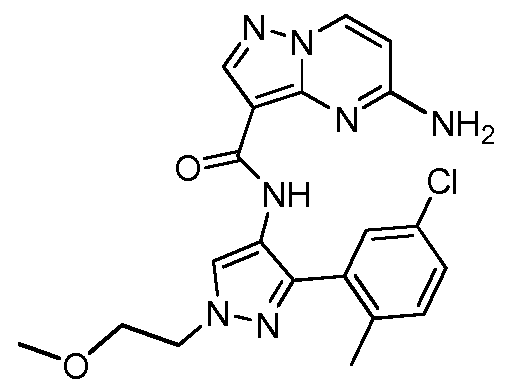
5-Амино-N-(3-(5-хлор-2-метилфенил)-1-(2-метоксиэтил)-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
Указанное в заголовке соединение получали с использованием этил 3-(5-хлор-2-метилфенил)-1-(2-метоксиэтил)-1Н-пиразол-4-карбоксилата и следуя процедурам, описанным в Примере 222. ЖХМС (ESI) m+H=426,2; 1H ЯМР (400 МГц, ДМСО) δ 9,34 (с, 1H), 8,63 (д, J=7,5, 1Н), 8,16 (д, J=1,6, 2H), 7,41 (м, 3H), 6,37 (д, J=7,6, 1H), 4,31 (т, J=5,2, 2H), 3,74 (т, J=5,2, 2H), 3,27 (с, 3H), 2,26 (с, 3H).
Пример 225

5-Амино-N-(3-(2,5-диметилфенил)-1-метил-1H-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
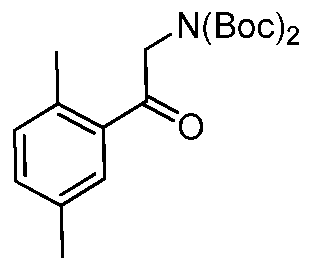
Ди-трет-бутил 2-(2,5-диметилфенил)-2-оксоэтилиминодикарбонат
В высушенную в печи колбу загружали ди-трет-бутилиминодикарбоксилат (2,566 г, 11,81 ммоль, 1,10 экв.) в N,N-диметилформамиде (30 мл) и добавляли гидрид натрия (0,586 г, 14,6 ммоль, 1,37 экв., 60% в минеральном масле) при комнатной температуре. Через 1,5 часа к реакционной смеси добавляли 2-бром-1-(2,5-диметилфенил)этанон (2,432 г, 10,71 ммоль, 1,00 экв.) при комнатной температуре. Еще через 1,5 часа реакционную смесь распределяли между этилацетатом и водой. Органическую часть промывали водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали колоночной флэш-хроматографией на силикагеле (0→40% этилацетата в гептане) с получением 3,01 г (77%) ди-трет-бутил 2-(2,5-диметилфенил)-2-оксоэтилиминодикарбоната. ЖХМС (ESI) m+Na = 386,2.
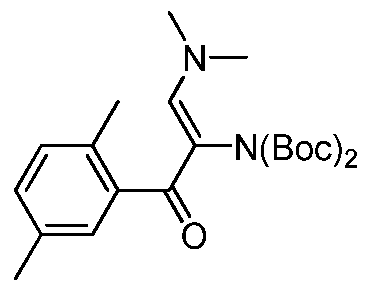
Ди-трет-бутил l-(диметиламино)-3-(2,5-диметилфенил)-3-оксопроп-1-ен-2-илиминодикарбонат
Раствор ди-трет-бутил 2-(2,5-диметилфенил)-2-оксоэтилиминодикарбоната (3,0076 г, 8,2752 ммоль, 1 экв.) и 1,1-диметокси-N,N-диметилметанамина (6,0 мл, 45 ммоль, 5,4 экв.) нагревали при 70°C в течение 17 часов и затем при 100°C в течение 24 часов. После выпаривания избытка 1,1-диметокси-N,N-диметилметанамина неочищенный продукт очищали колоночной флэш-хроматографией на силикагеле (0→50% этилацетата в гептане) с получением 1,305 г (38%) ди-трет-бутил 1-(диметиламино)-3-(2,5-диметилфенил)-3-оксопроп-1-ен-2-илиминодикарбоната. ЖХМС (ESI) m+H=419,3.
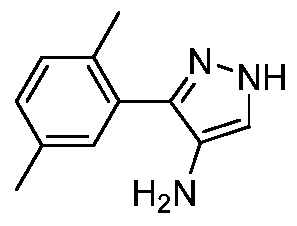
3-(2,5-Диметилфенил)-1Н-пиразол-4-амин
Ди-трет-бутил 1-(диметиламино)-3-(2,5-диметилфенил)-3-оксопроп-1-ен-2-илиминодикарбонат (1,305 г, 3,118 ммоль, 1,0 экв.) и гидразин (0,20 мл, 6,4 ммоль, 2,0 экв.) растворяли вместе в этаноле (15 мл). Реакционную смесь нагревали при 70°C в течение 1 часа и затем упаривали досуха. Твердый остаток растворяли в дихлорметане (8 мл) и хлористом водороде (8,0 мл, 100 ммоль, 40 экв., 4,0 M в 1,4-диоксане) и перемешивали при комнатной температуре в течение 3,5 часов. Растворитель и избыток хлористого водорода выпаривали и неочищенный продукт распределяли между насыщенным водным раствором бикарбоната натрия и дихлорметаном. Водный слой экстрагировали один раз дихлорметаном и объединенные органические экстракты сушили над сульфатом магния и концентрировали с получением 605,4 мг (104%) 3-(2,5-диметилфенил)-1Н-пиразол-4-амина, который использовали далее без очистки. ЖХМС (ESI) m+H=188,3.
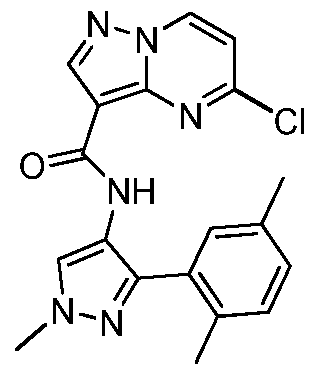
5-Хлор-N-(3-(2,5-диметилфенил)-1-метил-1H-пиразол-4-ил)пиразоло [1,5-a]пиримидин-3-карбоксамид
К раствору 5-хлорпиразоло[1,5-a]пиримидин-3-карбонилхлорида (400,4 мг, 1,853 ммоль, 1,16 экв.) в дихлорметане (6 мл) добавляли 3-(2,5-диметилфенил)-1Н-пиразол-4-амин (300,0 мг, 1,602 ммоль, 1,0 экв.) и триэтиламин (0,70 мл, 5,0 ммоль, 3,1 экв.) при комнатной температуре. Через 14 часов реакционную смесь распределяли между дихлорметаном и полунасыщенным водным раствором бикарбоната натрия. Водный слой экстрагировали один раз дихлорметаном. Объединенные органические части сушили над сульфатом магния, фильтровали и концентрировали с получением 5-хлор-N-(3-(2,5-диметилфенил)-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида, который использовали далее без очистки. ЖХМС (ESI) m+H=367,1.
К раствору полученного выше неочищенного вещества в N,N-диметилформамиде (12 мл) добавляли карбонат цезия (0,890 г, 2,73 ммоль, 2,0 экв.) и метилиодид (0,135 мл, 2,17 ммоль, 1,61 экв.). Реакционную смесь затем нагревали при 40°C. Через 5 часов реакционную смесь распределяли между этилацетатом и водой. Органическую часть промывали водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали колоночной флэш-хроматографией на силикагеле (20→90% этилацетата в дихлорметане) с получением 45,5 мг (9%) 5-хлор-N-(3-(2,5-диметилфенил)-1-метил-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида. ЖХМС (ESI) m+H=381,2.
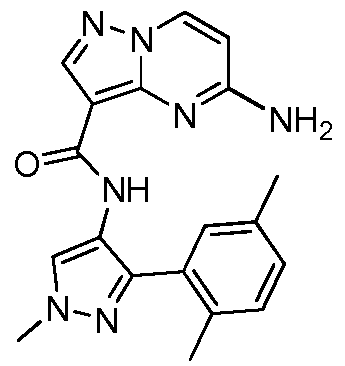
5-Амино-N-(3-(2,5-диметилфенил)-1-метил-1H-пиразол-4-ил)пиразоло [1,5-a]пиримидин-3-карбоксамид
Газообразный аммиак барботировали через охлажденную льдом суспензию 5-хлор-N-(3-(2,5-диметилфенил)-1-метил-1H-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида (45,5 мг, 0,119 ммоль) в этаноле (3,0 мл) в течение 20 минут. Реакционный сосуд закрывали крышкой и нагревали при 100°C при помощи микроволнового облучения в течение 30 минут. Реакционную смесь концентрировали досуха и неочищенный продукт очищали обращенно-фазовой ВЭЖХ и лиофилизировали с получением 4,0 мг (9,3%) 5-амино-N-(3-(2,5-диметилфенил)-1-метил-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида. ЖХМС (ESI) m+H=362,1; 1H ЯМР (400 МГц, ДМСО) δ 9,47 (с, 1H), 8,62 (д, J=7,5, 1H), 8,16 (д, J=7,1, 2H), 7,30 (д, J=8,2, 1H), 7,19 (д, J=6,2, 2H), 6,36 (д, J=7,6, 1H), 5,75 (с, 2H), 3,88 (с, 3H), 2,29 (с, 3H), 2,21 (с, 3H).
Пример 226
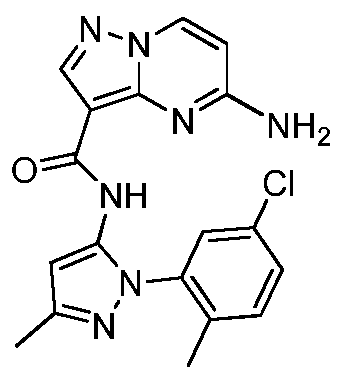
5-Амино-N-(1-(5-хлор-2-метилфенил)-3-метил-1Н-пиразол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид

(5-Хлор-2-метилфенил)гидразин гидрохлорид
К охлажденной льдом суспензии 5-хлор-2-метиланилина (1,4362 г, 10,143 ммоль, 1,00 экв.) в воде (10 мл) добавляли концентрированную хлористоводородную кислоту (10 мл). К этой реакционной смеси добавляли по каплям раствор нитрита натрия (0,791 г, 11,5 ммоль, 1,13 экв.) в воде (5 мл) при 0°C. Через 2 часа реакционную смесь медленно добавляли к перемешиваемому охлажденному льдом раствору хлорида олова дигидрата (5,88 г, 25,8 ммоль, 2,55 экв.) в концентрированной хлористоводородной кислоте (8 мл). Воду добавляли по необходимости для поддержания перемешивания в процессе образования твердых частиц. Реакцию поддерживали при 0°C в течение 45 минут. Белые твердые частицы фильтровали и промывали диэтиловым эфиром (2×50 мл). Твердые частицы сушили в вакууме с получением 1,49 г (76%) гидрохлорида (5-хлор-2-метилфенил)гидразина. 1H ЯМР (400 МГц, ДМСО-d6) δ: 10,08 (с, 3H), 7,98 (с, 1H), 7,13 (д, 1H), 6,97 (с, 1H), 6,91 (д, 1H), 2,14 (с, 3Н).
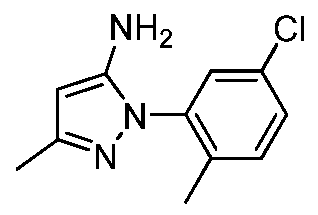
1-(5-Хлор-2-метилфенил)-3-метил-1Н-пиразол-5-амин
К раствору гидрохлорида (5-хлор-2-метилфенил)гидразина (1,49 г, 7,72 ммоль, 1,00 экв.) в этаноле (8 мл) добавляли хлористый водород (4,0 мл, 20 ммоль, 2 экв., 5 M водный раствор) и 3-аминокротонитрил (0,664 г, 8,09 ммоль, 1,05 экв.). Реакционную смесь перемешивали при 80°C в течение 16 часов и затем доводили до нейтрального значения pH при помощи насыщенного водного раствора бикарбоната натрия. Полученный раствор экстрагировали два раза дихлорметаном и объединенные экстракты сушили над сульфатом магния, фильтровали и концентрировали с получением 1,41 г (82%) 1-(5-хлор-2-метилфенил)-3-метил-1Н-пиразол-5-амина, который использовали далее без дополнительной очистки. ЖХМС (ESI) m+H=222,2; 1H ЯМР (400 МГц, ДМСО-d6) δ: 7,39 (д, 1H), 7,37 (д, 1H), 7,25 (с, 1H), 5,22 (с, 1H), 5,00 (с, 2H), 2,04 (перекрывающиеся с и с, 6H).
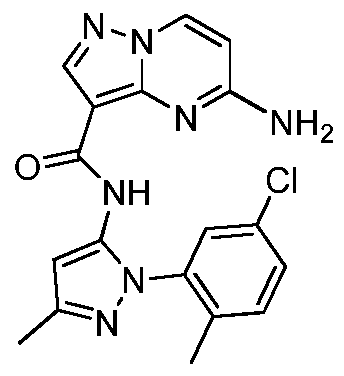
5-Амино-N-(1-(5-хлор-2-метилфенил)-3-метил-1H-пиразол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
Указанное в заголовке соединение получали с использованием l-(5-хлор-2-метилфенил)-3-метил-1Н-пиразол-5-амина и следуя процедурам, описанным в Примере 222. ЖХМС (ESI) m+H=382,1; 1H ЯМР (400 МГц, ДМСО) δ 9,73 (с, 1H), 8,63 (д, J=7,5, 1H), 8,18 (с, 1H), 7,58-7,45 (м, 3H), 6,41 (с, 1H), 6,37 (д, J=7,6, 1H), 2,22 (с, 3H), 2,04 (с, 3H).
Пример 227
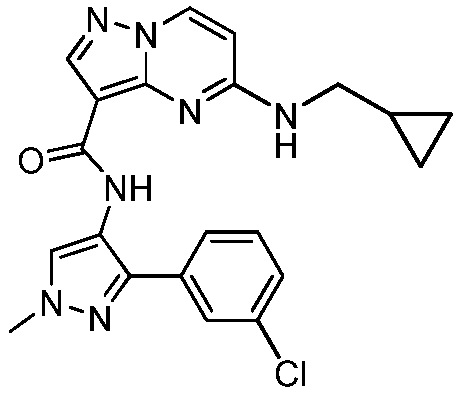
N-(3-(3-Хлорфенил)-1-метил-1H-пиразол-4-ил)-5-(циклопропилметиламино)пиразоло[1,5-a]пиримидин-3-карбоксамид
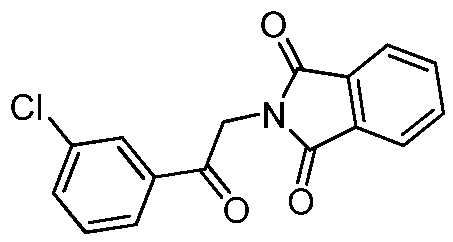
2-(2-(3-Хлорфенил)-2-оксоэтил)изоиндолин-1,3-дион
Раствор 2-бром-3'-хлорацетофенона (0,9271 г, 3,971 ммоль, 1,0 экв.) и фталимида калия (0,8129 г, 4,389 ммоль, 1,1 экв.) в N,N-диметилформамиде (15 мл) нагревали при 50°C. Через 1 час растворитель удаляли при помощи роторного испарителя. Полученные твердые частицы растирали в порошок с этилацетатом и фильтровали. Собранные твердые частицы сушили в вакууме с получением 1,19 г (117%) 2-(2-(3-хлорфенил)-2-оксоэтил)изоиндолин-1,3-диона, который использовали далее без очистки. 1H ЯМР (400 МГц, ДМСО-d6) δ: 8,13 (с, 1H), 8,05 (д, 1H), 7,96 (м, 2H), 7,93 (м, 2H), 7,83 (д, 1H), 7,65 (т, 1H), 5,29 (с, 2H).

2-(3-(3-Хлорфенил)-1-(диметиламино)-3-оксопроп-1-ен-2-ил)изоиндолин-1,3-дион
Перемешиваемую смесь 2-(2-(3-хлорфенил)-2-оксоэтил)изоиндолин-1,3-диона (782,2 мг, 2,610 ммоль, 1 экв.) и 1,1-диметокси-N,N-диметилметанамина (1,5 мл, 11 ммоль, 4,3 экв.) нагревали при 100°C в течение 18 часов. Избыток 1,1-диметокси-N,N-диметилметанамина удаляли при помощи роторного испарителя. Неочищенный продукт очищали колоночной флэш-хроматографией на силикагеле (50→100% этилацетата в гептане) с получением 740 мг (80%) 2-(3-(3-хлорфенил)-1-(диметиламино)-3-оксопроп-1-ен-2-ил)изоиндолин-1,3-диона. ЖХМС (ESI) m+H=355,2; 1H ЯМР (400 МГц, CDCl3) δ: 7,90 (д д, 2H), 7,77 (д д, 2H), 7,57 (с, 1H), 7,44 (д, 1H), 7,37 (перекрывающиеся д и с, 2H), 7,31 (т, 1H), 3,00 (с, 6H).
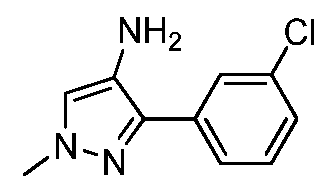
3-(3-Хлорфенил)-1-метил-1H-пиразол-4-амин
Раствор 2-(3-(3-хлорфенил)-1-(диметиламино)-3-оксопроп-1-ен-2-ил)изоиндолин-1,3-диона (2,30 г, 6,48 ммоль, 1,0 экв.) и N-метилгидразина (1,4 мл, 26 ммоль, 4,0 экв.) в этаноле (50 мл) нагревали при 80°C. Через 2 часа реакционную смесь концентрировали и полученную неочищенную смес региоизомеров разделяли и очищали колоночной флэш-хроматографией на силикагеле (0→80% этилацетата в дихлорметане) с получением: 715,0 мг (53%) 3-(3-хлорфенил)-1-метил-1Н-пиразол-4-амина. ЖХМС (ESI) m+H=208,2; 1H ЯМР (400 МГц, CDCl3) δ: 7,78 (с, 1H), 7,63 (д, 1H), 7,33 (т, 1H), 7,25 (перекрывающаяся CDCl3, 1H), 7,04 (с, 1H), 3,84 (с, 3H) и 274,6 мг (20%) 5-(3-хлорфенил)-1-метил-1H-пиразол-4-амина. ЖХМС (ESI) m+H=208,2; 1H ЯМР (400 МГц, CDCl3) δ: 7,43 (т, 1H), 7,38 (перекрывающиеся д и с, 2H), 7,27 (д, 1H), 7,23 (с, 1H), 3,76 (с, 3H).
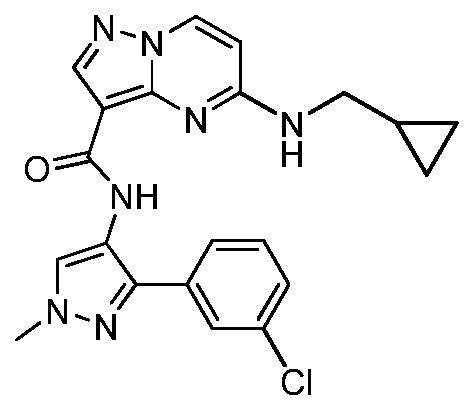
N-(3-(3-Хлорфенил)-1-метил-1H-пиразол-4-ил)-5-(циклопропилметиламино)пиразоло[1,5-a]пиримидин-3-карбоксамид
К раствору 5-хлорпиразоло[1,5-a]пиримидин-3-карбонилхлорида (0,166 г, 0,768 ммоль) в дихлорметане (8 мл) добавляли 3-(3-хлорфенил)-1-метил-1H-пиразол-4-амин (73,6 мг, 0,354 ммоль) и триэтиламин (0,20 мл, 1,4 ммоль) при комнатной температуре. Через 1 час реакционную смесь распределяли между дихлорметаном и полунасыщенным водным раствором бикарбоната натрия. Органический слой сушили над сульфатом магния и концентрировали с получением 5-хлор-N-(3-(3-хлорфенил)-1-метил-1H-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида, который использовали далее без очистки. ЖХМС (ESI) m+H=387,1.
Раствор полученного выше неочищенного 5-хлор-N-(3-(3-хлорфенил)-1-метил-1Н-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида, циклопропилметиламина (0,1 мл, 1,0 ммоль) и N,N-диизопропилэтиламина (0,20 мл, 1,1 ммоль) в этаноле (5 мл) нагревали при 120°C при помощи микроволнового облучения. Через 30 минут реакционную смесь концентрировали досуха и полученный неочищенного продукт очищали обращенно-фазовой ВЭЖХ и лиофилизировали с получением 95,7 мг (64%) N-(3-(3-хлорфенил)-1-метил-1Н-пиразол-4-ил)-5-(циклопропилметиламино)пиразоло[1,5-a]пиримидин-3-карбоксамида. ЖХМС (ESI) m+H=422,1; 1H ЯМР (400 МГц, ДМСО) δ 9,62 (с, 1H), 8,58 (д, J=7,6, 1H), 8,20 (с, 1H), 8,14 (с, 2H), 7,75-7,59 (м, 2H), 7,46 (т, J=7,8, 1H), 7,42-7,34 (м, 1H), 6,41 (д, J=7,6, 1H), 3,90 (с, 3H), 2,62-2,54 (м, 2H), 0,76 (с, 1H), 0,38-0,24 (м, 2H), -0,14 (м, 2H).
Пример 228
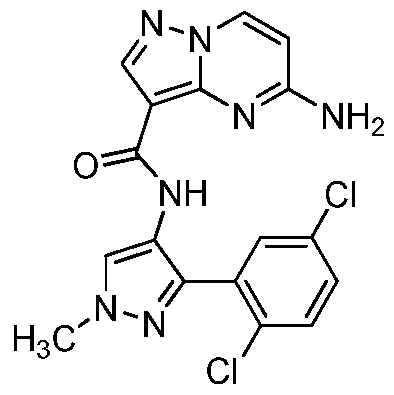
[3-(2,5-Дихлорфенил)-1-метил-1H-пиразол-4-ил]-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
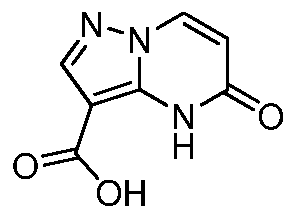
5-оксо-4,5-дигидропиразоло[1,5-a]пиримидин-3-карбоновая кислота
К перемешиваемому раствору 5-амино-1Н-пиразол-4-карбоновой кислоты (10,0 г, 71,4 ммоль) в этаноле (100 мл) добавляли этоксид натрия (17,0 г, 245 ммоль) с последующим добавлением 1,3-диметилурацила (11,0 г, 78,6 ммоль). Реакционную смесь затем перемешивали при температуре кипения с обратным холодильником в течение ночи в атмосфере аргона. Смесь выливали в ледяную воду и полученный раствор подкисляли до около pH=3-4 при помощи концентрированной HCl. Суспензию перемешивали в течение 2 часов и затем фильтровали с получением промежуточного соединения, которое использовали без дополнительной очистки (10,0 г, 58% выход). 1H ЯМР (400 МГц, ДМСО-d6): 8,54 (д, J=9,2 Гц, 1H), 8,06 (с, 1H), 6,11 (д, J=12 Гц, 1H).

5-Хлорпиразоло[1,5-a]пиримидин-3-карбонилхлорид
Суспензию 5-оксо-4,5-дигидропиразоло[1,5-a]пиримидин-3-карбоновой кислоты (9,5 г, 53,1 ммоль) и диизопропилэтиламина (17,1 г, 132,6 ммоль) в оксихлориде фосфора(V) (250 мл) нагревали при 130°C в атмосфере аргона в течение 3,5 часов. Смесь концентрировали в вакууме и пропускали через колонку с силикагелем (дихлорметан) с получением 5-хлорпиразоло[1,5-a]пиримидин-3-карбонилхлорида в виде твердого вещества (8,0 г, 70% выход). 1H ЯМР (400 МГц, CDCl3) δ: 8,72 (д, J=7,2 Гц, 1H), 8,65 (с, 1H), 7,17 (д, J=7,6 Гц, 1H).
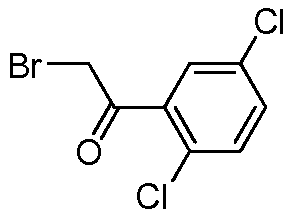
2-Бром-1-(2,5-дихлорфенил)этанон
К охлажденному льдом раствору 2',5'-дихлорацетофенона (1,0 г, 5,0 ммоль) в уксусной кислоте (10 мл) добавляли HBr (~ 1%) с последующим добавлением раствора брома (0,80 г, 5,0 ммоль) в уксусной кислоте (3 мл). Полученную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Смесь выливали в ледяную воду и затем нейтрализовали насыщенным водным раствором карбоната натрия. Затем к смеси добавляли насыщенный водный раствор тиосульфата натрия. Полученную смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Очистка колоночной флэш-хроматографией давала 2-бром-1-(2,5-дихлорфенил)этанон в виде масла (0,70 г, 50% выход). 1H ЯМР (400 МГц, CDCl3) δ: 7,54 (д, J=2,4 Гц, 1H), 7,43 (м, 1H), 7,40 (м, 1H), 4,68 (с, 2H).
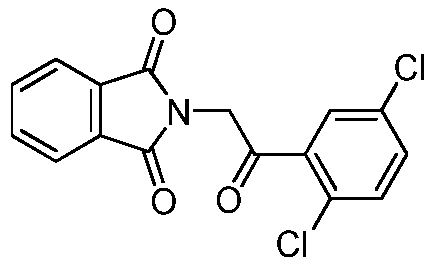
2-(2-(2,5-Дихлорфенил)-2-оксоэтил)изоиндолин-1,3-дион
К охлажденному льдом раствору 2-бром-1-(2,5-дихлорфенил)этанон (0,10 г, 0,37 ммоль) в N,N-диметилформамиде (8 мл) добавляли фталимид калия (76 мг, 0,41 ммоль). Смесь нагревали до комнатной температуры в течение 2 часов. Полученную смесь затем выливали в воду и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали. Перекристаллизация с использованием диэтилового эфира давала 2-(2-(2,5-дихлорфенил)-2-оксоэтил)изоиндолин-1,3-дион в виде белого твердого вещества. (110 мг, 88% выход). 1H ЯМР (400 МГц, CDCl3) δ: 7,92-7,94 (м, 2H), 7,78-7,80 (м, 2H), 7,72 (м, 1H), 7,45-7,46 (м, 2H), 5,08 (с, 2H).
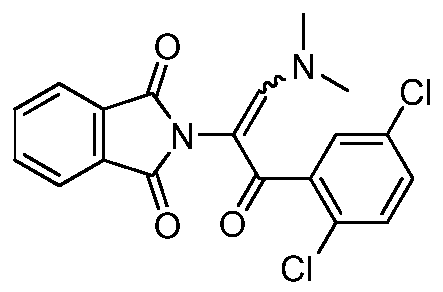
2-(3-(2,5-Дихлорфенил)-1-(диметиламино)-3-оксопроп-1-ен-2-ил)изоиндолин-1,3-дион
Раствор 2-(2-(2,5-дихлорфенил)-2-оксоэтил)изоиндолин-1,3-диона (0,10 г, 0,30 ммоль) в 1,1-диметокси-N,N-диметилметанамине (8 мл) нагревали при температуре кипения с обратным холодильником в течение 2 часов. Полученную смесь затем концентрировали. Очистка колоночной флэш-хроматографией давала 2-(3-(2,5-дихлорфенил)-1-(диметиламино)-3-оксопроп-1-ен-2-ил)изоиндолин-1,3-дион в виде твердого вещества (0,90 г, 77% выход).
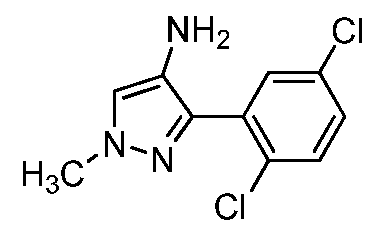
3-(2,5-Дихлорфенил)-1-метил-1Н-пиразол-4-амин
К охлажденному льдом раствору 2-(3-(2,5-дихлорфенил)-1-(диметиламино)-3-оксопроп-1-ен-2-ил)изоиндолин-1,3-диона (0,050 г, 0,13 ммоль) в этаноле (6 мл) добавляли 40% водный раствор метилгидразина (45 мг, 0,39 ммоль). Смесь затем нагревали при температуре кипения с обратным холодильником в течение 3 часов. Реакционную смесь затем концентрировали и очищали колоночной флэш-хроматографией с получением 3-(2,5-дихлорфенил)-1-метил-1Н-пиразол-4-амина в виде твердого вещества (12 мг, 38% выход). 1H ЯМР (400 МГц, CDCl3) δ: 7,50 (д, J=3,6 Гц, 1H), 7,38 (д, J=8,8 Гц, 1H), 7,28 (м, 1H), 7,06 (с, 1H), 3,86 (с, 3H), 2,98 (с, 2H).

5-Хлор-N-(3-(2,5-дихлорфенил)-1-метил-1H-пиразол-4-ил)пиразоло-[1,5-a]пиримидин-3-карбоксамид
К охлажденному льдом раствору 3-(2,5-дихлорфенил)-1-метил-1Н-пиразол-4-амина (121 мг, 0,50 ммоль) и триэтиламина (101 мг, 1,00 ммоль) в дихлорметане (15 мл) добавляли 5-хлорпиразоло[1,5-a]пиримидин-3-карбонилхлорид (162 мг, 1,5 ммоль). Реакционную смесь нагревали до комнатной температуры в течение 3 часов. Смесь затем промывали насыщенным водным раствором хлорида натрия. Собранные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали. Очистка при помощи препаративной ВЭЖХ давала 5-хлор-N-(3-(2,5-дихлорфенил)-1-метил-1H-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид в виде твердого вещества (110 мг, 52% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,34 (д, J=7,6 Гц, 1H), 9,21 (с, 1H), 8,69 (с, 1H), 8,33 (с, 1H), 7,71 (д, J=9,2 Гц, 1H), 7,60 (д, J=9,2 Гц, 1H), 7,54 (с, 1H), 7,36 (д, J=6,8 Гц, 1H), 3,93 (с, 3H).
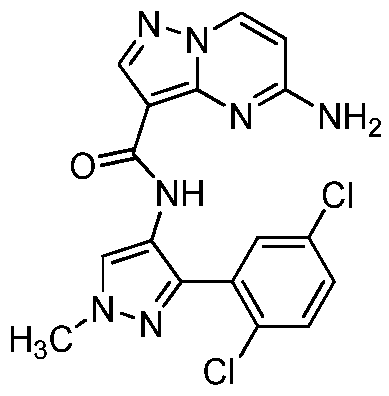
[3-(2,5-Дихлор-фенил)-1-метил-1Н-пиразол-4-ил]-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
Раствор 5-хлор-N-(3-(2,5-дихлорфенил)-1-метил-1H-пиразол-4-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида (110 мг, 0,26 ммоль) в этаноле, насыщенного аммиаком (4 мл), нагревали при 95°C в течение 30 минут с использованием микроволнового облучения. Смесь концентрировали. Очистка колоночной флэш-хроматографией давала [3-(2,5-дихлор-фенил)-1-метил-1Н-пиразол-4-ил]-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты в виде твердого вещества (80 мг, 77% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,37 (с, 1H), 8,63 (д,J=7,6 Гц, 1H), 8,14-8,16 (м, 2H), 7,70 (м, 1H), 7,52-7,55 (м, 2H), 6,39 (д, J=8,0 Гц, 1H), 3,91 (с, 3H).
Пример 229
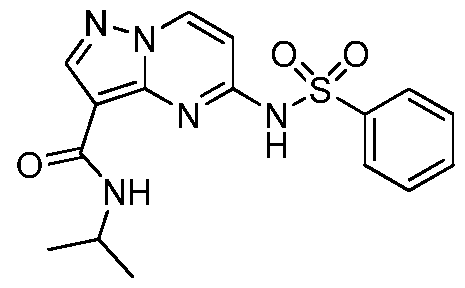
Изопропиламид 5-бензолсульфониламино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
Смесь 5-хлор-N-изопропилпиразоло[1,5-a]пиримидин-3-карбоксамида (95,5 мг, 0,40 ммоль, 1,0 экв.), бензолсульфонамида (62,0 мг, 0,40 ммоль, 1,0 экв.) и карбоната цезия (312 мг, 0,96 ммоль, 2,4 экв.) в 1,2-диметоксиэтане (8 мл) нагревали до 85°C в течение 72 часов. Растворитель удаляли в вакууме и полученный остаток растворяли в воде. pH раствора затем доводили до около 5 путем добавления водного раствора 1M HCl и экстрагировали дихлорметаном (2×30 мл). Органические экстракты концентрировали в вакууме и остаток очищали колоночной флэш-хроматографией на силикагеле (градиент: 0→10% метанола в дихлорметане) с получением 57,0 мг (40%) изопропиламида 5-бензолсульфониламино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты в виде твердого вещества. ЖХМС (ESI) m+H=360,3; 1H ЯМР (400 МГц, ДМСО-d6) δ: 12,2 (с, 1H), 8,97 (д, 1H), 8,30 (с, 1H), 8,01 (д, 2H), 7,64 (м, 4H), 6,64 (м, 1H), 4,13 (м, 1H), 1,21 (д, 6H).
Пример 230

(5-Метил-изоксазол-3-ил)-амид 5-(6-трифторметил-пиридин-2-иламино)-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
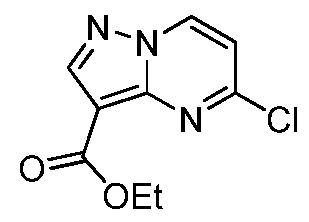
Этил 5-Хлорпиразоло[1,5-a]пиримидин-3-карбоксилат
К суспензии этилового эфира 5-оксо-4,5-дигидро-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (получен в соответствии с Gavrin, L. K. et al, J. Org. Chem. 2007, 72, 1043-1046) (3,00 г, 14,5 ммоль, 1 экв.) в оксихлориде фосфора (30 мл) добавляли диизопропилэтиламин (2,00 мл, 11,6 ммоль, 0,8 экв.). Смесь нагревали до 90°C в течение 4,5 часов. После охлаждения смесь осторожно гасили ледяной водой и экстрагировали дихлорметаном. Органический экстракт промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с получением твердого вещества. Растирание в порошок (диэтиловый эфир) давало 2,38 г (73%) этил 5-хлорпиразоло[1,5-a]пиримидин-3-карбоксилата в виде твердого вещества. ЖХМС (ESI) m+H=226,2 (монохлорированный изотоп); 1H ЯМР (400 МГц, CDCl3) δ: 8,63 (д, 1H), 8,56 (с, 1H), 6,99 (д, 1H), 4,43 (кв, 2H), 1,42 (т, 3H).
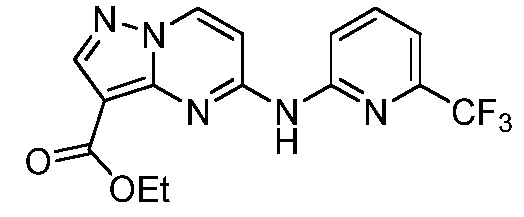
Этил 5-(6-(трифторметил)пиридин-2-иламино)пиразоло[1,5-a]пиримидин-3-карбоксилат
В 20-мл микроволновой реакционный сосуд загружали этил 5-хлорпиразоло[1,5-a]пиримидин-3-карбоксилат (1,28 г, 5,67 ммоль, 1 экв.), 2-амино-6-(трифторметил)пиридин (1,10 г, 6,81 ммоль, 1,2 экв.), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (132 мг, 0,22 ммоль, 4 моль%), трис(дибензилиденацетон) дипалладий(0) (104 мг, 0,11 ммоль, 2 моль%), трет-бутоксид натрия (652 мг, 6,81 ммоль, 1,2 экв.) и толуол (12 мл). Сосуд герметично закрывали и содержимое дегазировали, продували аргоном и затем нагревали в микроволновом реакторе при 140°C в течение 20 минут. После охлаждения смесь разбавляли этилацетатом и фильтровали через слой Целита®. Фильтрат промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали колоночной флэш-хроматографией на силикагеле (градиент: 0→20% этилацетата в дихлорметане) с получением 344 мг (17%) этил 5-(6-(трифторметил)пиридин-2-иламино)пиразоло[1,5-a]пиримидин-3-карбоксилата в виде оранжевого твердого вещества. ЖХМС (ESI) m+H=352,1; 1H ЯМР (300 МГц, ДМСО-d6) δ: 11,06 (с, 1H), 9,16 (д, 1H), 8,94 (д, 1H), 8,39 (с, 1H), 8,10 (т, 1H), 7,57 (д, 1H), 7,05 (д, 1H), 4,31 (кв, 2H), 1,40 (т, 3H).
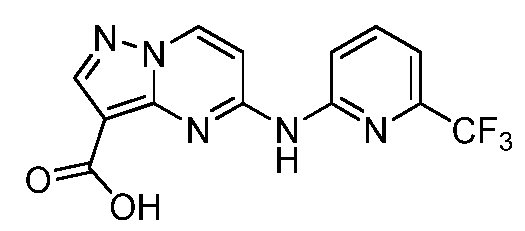
5-(6-Трифторметил-пиридин-2-иламино)-пиразоло[1,5-a]пиримидин-3-карбоновая кислота
Смесь этил 5-(6-(трифторметил)пиридин-2-иламино)пиразоло[1,5-a]пиримидин-3-карбоксилата (344 мг, 0,98 ммоль, 1,0 экв.), 2M водного раствора гидроксида натрия (1,50 мл, 3,0 экв.) и этанола (15 мл) нагревали до температуры кипения с обратным холодильником в течение 5 часов. После охлаждения осадок собирали фильтрованием, промывали этанолом и сушили на воздухе. Полученное твердое вещество суспендировали в растворе 1,25 M HCl в метаноле (16 мл) и затем концентрировали в вакууме. Остаток растирали в порошок (диэтиловый эфир) с получением 355 мг (количественный выход) 5-(6-трифторметил-пиридин-2-иламино)-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты, которую использовали без дополнительной очистки. ЖХМС (ESI) m+H=324,2; 1H ЯМР (300 МГц, ДМСО-d6) δ: 11,03 (с, 1H), 9,01 (д, 1H), 8,95 (д, 1H), 8,35 (с, 1H), 8,10-8,02 (м, 1H), 7,54 (д,lH), 7,16 (д, 1H).
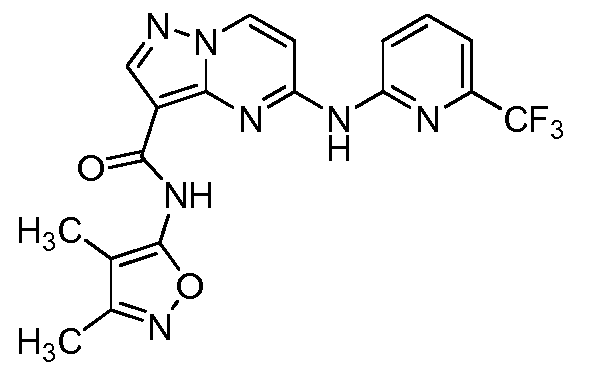
(5-Метил-изоксазол-3-ил)-амид 5-(6-трифторметил-пиридин-2-иламино)-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
Диизопропилэтиламин (101 мг, 0,78 ммоль, 0,8 экв.) добавляли к суспензии 5-(6-трифторметил-пиридин-2-иламино)-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (0,98 ммоль, 1,0 экв.) в оксихлориде фосфора (6 мл) при 0°C. Смесь затем нагревали до 90°C в течение 20 часов. После охлаждения растворитель удаляли в вакууме и остаток подвергали азеотропной перегонке с дихлорметаном и затем концентрировали с получением неочищенного хлорангидрида кислоты в виде твердого вещества. Половину этого неочищенного вещества (примерно 0,49 ммоль) использовали непосредственно на следующей стадии.
Смесь хлорангидрида кислоты (0,49 ммоль, 1,0 экв.) и 5-амино-3,4-диметил-1,2-изоксазола (66,0 мг, 0,59 ммоль, 1,2 экв.) в пиридине (4 мл) нагревали до 60°C в течение 90 минут. После охлаждения растворитель удаляли в вакууме и выделенный остаток растирали в порошок (вода) и снова растирали в порошок (метанол) и полученное твердое вещество сушили в вакууме с получением 56,3 мг (28%) (5-метил-изоксазол-3-ил)-амида 5-(6-трифторметил-пиридин-2-иламино)-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты. ЖХМС (ESI) m+H=418,1; 1H ЯМР (400 МГц, ДМСО-d6) δ: 11,12 (с, 1H), 10,04 (с, 1H), 9,04 (д, 1H), 8,50 (с, 1H), 8,41 (д, 1H), 8,02 (т, 1H), 7,58 (д, 1H), 7,30 (д, 1H), 2,19 (с, 3H), 1,88 (с, 3H).
Пример 231
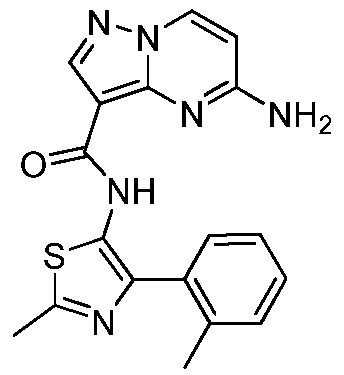
(2-метил-4-o-толил-тиазол-5-ил)-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
Этиловый эфир 3-оксо-3-o-толил-пропионовой кислоты
К перемешиваемой суспензии гидрида натрия (60% дисперсия в минеральном масле, 7,20 г, 180 ммоль, 3,6 экв.) в толуоле (300 мл) медленно добавляли диэтилкарбонат (23,6 г, 200 ммоль, 4,0 экв.) при температуре окружающей среды. После перемешивания в течение 15 минут добавляли 2-метилацетофенон (6,70 г, 50,0 ммоль, 1,0 экв.) и полученную смесь нагревали до температуры кипения с обратным холодильником в течение 18 часов. Затем добавляли по каплям ледяную уксусную кислоту (15 мл) в течение 10 минут, с последующим осторожным добавлением ледяной воды (150 мл). Полученную смесь экстрагировали этилацетатом и объединенные органические экстракты сушили над сульфатом магния и концентрировали в вакууме. Полученный остаток очищали колоночной флэш-хроматографией на силикагеле (градиент: 0→5% этилацетата в пентане) с получением 7,94 г (77%) этилового эфира 3-оксо-3-o-толил-пропионовой кислоты в виде масла (4:1 смесь кето/енольных таутомеров). 1H ЯМР (Кето таутомер) (400 МГц, CDCl3) δ: 7,66 (с, 1H), 7,41 (с, 1H), 7,30-7,25 (м, 2H), 4,22-4,15 (м, 2H), 3,96-3,94 (м, 2H), 2,55 (с, 3H), 1,28-1,22 (м, 3H).
Этиловый эфир 2-бром-3-оксо-3-o-толил-пропионовой кислоты
Бром (1,65 г, 10,3 ммоль, 1,03 экв.) добавляли по каплям к перемешиваемому раствору этилового эфира 3-оксо-3-o-толил-пропионовой кислоты (2,06 г, 10,0 ммоль, 1,0 экв.) в 1,4-диоксане (25 мл) при температуре окружающей среды. Смесь перемешивали в течение 1 часа и затем разбавляли трет-бутилметиловым эфиром (50 мл). Полученный раствор промывали последовательно водой, водным раствором карбоната калия и насыщенным водным раствором хлорида натрия. Собранные органические слои сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением 2,74 г (96%) этилового эфира 2-бром-3-оксо-3-o-толил-пропионовой кислоты в виде темно-коричневого остатка. 1H ЯМР (400 МГц, CDCl3) δ: 7,66 (д, 1H), 7,46-7,37 (м, 1H), 7,28 (м, 2H), 5,62 (с, 1H), 4,29-4,22 (кв, 2H), 2,52 (с, 3H), 1,28-1,19 (т, 3H).
Этиловый эфир 2-метил-4-o-толил-тиазол-5-карбоновой кислоты
Перемешиваемую смесь этилового эфира 2-бром-3-оксо-3-o-толил-пропионовой кислоты (2,74 г, 9,60 ммоль, 1,0 экв.) и тиоацетамида (0,76 г, 10,1 ммоль, 1,05 экв.) в этаноле (30 мл) нагревали до температуры кипения с обратным холодильником в течение 4 часов. Охлажденную смесь фильтровали и концентрировали в вакууме. Остаток распределяли между этилацетатом и водой и органическую фазу отделяли и затем промывали насыщенным водным раствором хлорида натрия. Собранное органическое вещество сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученный остаток очищали колоночной флэш-хроматографией на силикагеле (градиент: 0→20% этилацетата в пентане) с получением 0,84 г (34%) этилового эфира 2-метил-4-o-толил-тиазол-5-карбоновой кислоты в виде масла. ЖХМС (ESI) m+H=261,9; 1H ЯМР (400 МГц, CDCl3) δ: 7,31-7,18 (м, 4H), 4,16 (кв, 2H), 2,76 (с, 3H), 2,18 (с, 3H), 1,14 (т, 3H).
2-Метил-4-o-толил-тиазол-5-карбоновая кислота
Смесь этилового эфира 2-метил-4-o-толил-тиазол-5-карбоновой кислоты (0,84 г, 3,20 ммоль, 1,0 экв.) и гидроксида калия (0,36 г, 6,40 ммоль, 2,0 экв.) в 50% водном растворе метанола (10 мл) нагревали до 50°C в течение 5 часов. Смесь концентрировали и остаток разбавляли водой и подкисляли до около pH 1 путем добавления 6н раствора HCl. Полученный раствор экстрагировали этилацетатом (3×). Объединенные экстракты сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением 0,61 г (81 %) 2-метил-4-o-толил-тиазол-5-карбоновой кислоты в виде твердого вещества. ЖХМС (ESI) m+H=234,0; 1H ЯМР (400 МГц, CDCl3) δ: 7,32-7,17 (м, 4H), 2,75 (с, 3H), 2,17 (с, 3H).

трет-Бутиловый эфир (2-метил-4-o-толил-тиазол-5-ил)-карбаминовой кислоты
Смесь 2-метил-4-o-толил-тиазол-5-карбоновой кислоты (300 мг, 1,29 ммоль, 1,0 экв.), дифенилфосфорилазида (DPPA) (354 мг, 1,29 ммоль, 1,0 экв.) и триэтиламина (130 мг, 1,29 ммоль, 1,0 экв.) в трет-бутаноле (10 мл) нагревали до 85°C в течение 4 часов. После охлаждения смесь разбавляли водой и экстрагировали этилацетатом (3×). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (градиент: 2→25% этилацетата в пентане) с получением 352 мг (90%) трет-бутилового эфира (2-метил-4-o-толил-тиазол-5-ил)-карбаминовой кислоты в виде масла. ЖХМС (ESI) m+H=305,1; 1H ЯМР (400 МГц, CDCl3) δ: 7,33-7,24 (м, 4H), 6,58 (с, 1H), 2,64 (с, 3H), 2,24 (с, 3H), 1,48 (с, 9H).
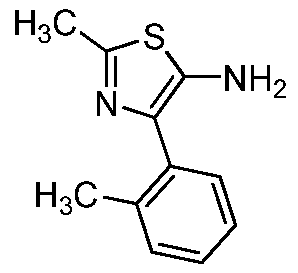
2-Метил-4-o-толил-тиазол-5-иламин
Раствор трет-бутилового эфира (2-метил-4-o-толил-тиазол-5-ил)-карбаминовой кислоты (340 мг, 1,12 ммоль, 1,0 экв.) в дихлорметане (10 мл) обрабатывали трифторуксусной кислотой (0,7 мл, 9,00 ммоль, 8,0 экв.) в течение 24 часов при температуре окружающей среды. Смесь концентрировали в вакууме и полученный остаток растворяли в дихлорметане и промывали последовательно 10% водным раствором карбоната калия и насыщенным водным раствором хлорида натрия. Собранную органическую фазу сушили над сульфатом магния и фильтровали. Фильтрат пропускали через катридж Isolute® SCX-2 (элюировали дихлорметаном, смесью дихлорметан/метанол (1:1) и 2M аммиака в метаноле) с получением 62,0 мг (27%) 2-метил-4-o-толил-тиазол-5-иламина в виде коричневого остатка. ЖХМС (ESI) m+H=205,0; 1H ЯМР (400 МГц, CDCl3) δ: 7,33-7,18 (м, 4H), 3,54-3,45 (ушир, 2H), 2,58 (с, 3H), 2,29 (с, 3H).
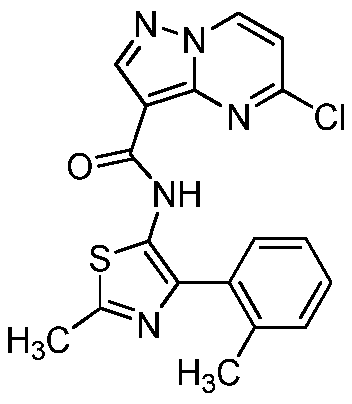
(2-Метил-4-o-толил-тиазол-5-ил)-амид 5-хлор-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
К охлажденному льдом раствору 2-метил-4-o-толил-тиазол-5-иламина (55,0 мг, 0,27 ммоль, 1,0 экв.) и диизопропилэтиламина (52,0 мг, 0,41 ммоль, 1,5 экв.) в дихлорметане (10 мл) добавляли раствор 5-хлорпиразоло[1,5-α]пиримидин-3-карбонилхлорида (58,0 мг, 0,27 ммоль, 1,0 экв.) в дихлорметане (5 мл). Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение ночи. Смесь промывали водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Очистка колоночной флэш-хроматографией на силикагеле (градиент: 0→3% метанола в дихлорметане) давала 74,0 мг (73%) (2-метил-4-o-толил-тиазол-5-ил)-амид 5-хлор-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты в виде твердого вещества. ЖХМС (ESI) m+H=384,0 (монохлорированный изотоп); 1H ЯМР (400 МГц, CDCl3) δ: 9,73 (с, 1H), 8,70 (с, 1H), 8,63 (д, 1H), 7,44-7,30 (м, 4H), 6,93 (д, 1H), 2,72 (с, 3H), 2,31 (с, 3H).
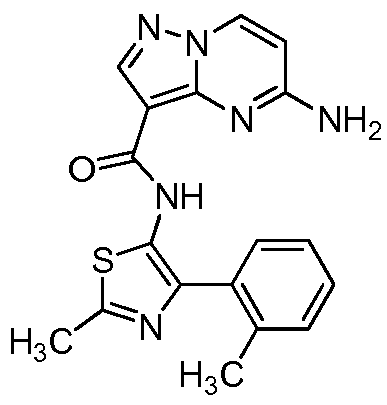
(2-Метил-4-o-толил-тиазол-5-ил)-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
Смесь (2-метил-4-o-толил-тиазол-5-ил)-амида 5-хлор-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (74,0 мг, 0,19 ммоль, 1,0 экв.) и раствора 2M аммиака в пропан-2-оле (3 мл) герметично закрывали и нагревали в микроволновом реакторе при 120°C в течение 1 часа. Растворитель удаляли в вакууме и полученный остаток очищали колоночной флэш-хроматографией на силикагеле (градиент: 0→5% метанола в дихлорметане) с получением 11,0 мг (16%) (2-метил-4-o-толил-тиазол-5-ил)-амида 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты. ЖХМС (ESI) m+H=365,1; 1H ЯМР (400 МГц, ДМСО-d6) δ: 10,35 (с, 1H), 8,66 (д, 1H), 8,23 (с, 1H), 7,47-7,37 (м, 4H), 6,38 (д, 1H), 2,61 (с, 3H), 2,20 (с, 3H).
Пример 232
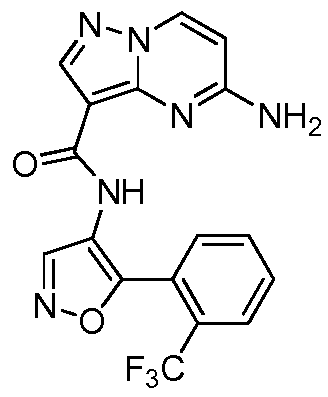
[5-(2-Трифторметил-фенил)-изоксазол-4-ил]-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
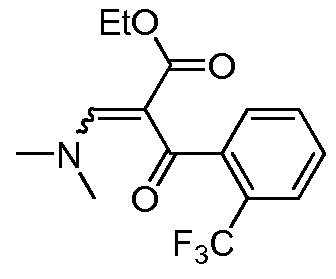
Этиловый эфир 3-диметиламино-2-(2-трифторметил-бензоил)-акриловой кислоты
Раствор этилового эфира 3-оксо-3-(2-трифторметил-фенил)-пропионовой кислоты, полученного в соответствии с процедурой, аналогичной описанной в Примере 231, (3,14 г, 12,1 ммоль, 1,0 экв.), и 1,1-диметокси-N,N-диметилметанамина (5,60 мл, 42,2 ммоль, 3,5 экв.) в N,N-диметилформамиде нагревали до температуры кипения с обратным холодильником в течение 5 часов. После охлаждения смесь распределяли между этилацетатом и водой. Органическую фазу отделяли и промывали последовательно водой (4×) и насыщенным водным раствором хлорида натрия. Собранное органическое вещество сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с получением 3,20 г (83%) этилового эфира 3-диметиламино-2-(2-трифторметил-бензоил)-акриловой кислоты в виде оранжевого воскообразного твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ: 7,86 (с, 1H), 7,67-7,64 (м, 1H), 7,51-7,41 (м, 2H), 7,35 (д, 1H), 3,81 (кв, 2H), 3,42-3,17 (м, 3H), 3,11-2,93 (м, 3H), 0,78-0,69 (т, 3H).
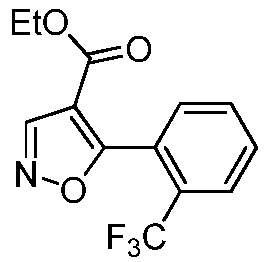
Этиловый эфир 5-(2-трифторметил-фенил)-изоксазол-4-карбоновой кислоты
Смесь этилового эфира 3-диметиламино-2-(2-трифторметил-бензоил)-акриловой кислоты (3,10 г, 9,80 ммоль, 1,0 экв.) и гидроксиламингидрохлорида (683 мг, 9,80 ммоль, 1,0 экв.) в метаноле (25 мл) нагревали до температуры кипения с обратным холодильником в течение 90 минут. После охлаждения смесь распределяли между водой и этилацетатом и разделяли. Водный слой экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Очистка колоночной флэш-хроматографией на силикагеле (градиент: 0→30% этилацетата в циклогексане) давала 1,43 г (51%) этилового эфира 5-(2-трифторметил-фенил)-изоксазол-4-карбоновой кислоты. 1H ЯМР (300 МГц, CDCl3) δ: 8,38 (с, 1H), 7,69 (д, 1H), 7,61-7,47 (м, 2H), 7,27 (д, 1H), 3,93 (ущир, 2H), 0,87 (ушир, 3H).
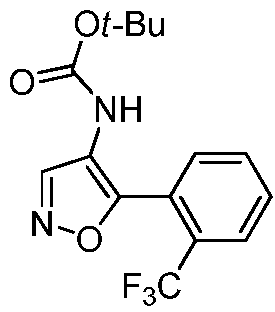
трет-Бутиловый эфир [5-(2-трифторметил-фенил)-изоксазол-4-ил]-карбаминовой кислоты
Смесь этилового эфира 5-(2-трифторметил-фенил)-изоксазол-4-карбоновой кислоты (1,43 г, 5,01 ммоль, 1,0 экв.), водного раствора 6M HCl (34 мл) и уксусной кислоты (20 мл) нагревали до температуры кипения с обратным холодильником в течение 5,5 часов. После охлаждения смесь распределяли между водой и этилацетатом и разделяли. Органическую фазу промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 745 мг (58%) неочищенной 5-(2-трифторметил-фенил)-изоксазол-4-карбоновой кислоты, которую использовали без очистки.
Смесь 5-(2-трифторметил-фенил)-изоксазол-4-карбоновой кислоты (745 мг, 2,90 ммоль, 1,0 экв.) и тионилхлорида (8 мл) нагревали до температуры кипения с обратным холодильником в течение 3 часов. Смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток растворяли в ацетоне (8 мл), охлаждали на ледяной бане и добавляли азид натрия (339 мг, 5,20 ммоль, 1,8 экв.). Смесь перемешивали в течение 1 часа при указанной температуре, затем в течение 1 часа при температуре окружающей среды. Реакционную смесь разбавляли этилацетатом и полученный раствор промывали последовательно водой и насыщенным водным раствором хлорида натрия. Собранный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток растворяли в трет-бутаноле (8 мл) и нагревали до температуры кипения с обратным холодильником в течение 16 часов. Реакционную смесь концентрировали в вакууме. Очистка при помощи колоночной флэш-хроматографией на силикагеле (градиент: 0→20% этилацетата в циклогексане) давала 345 мг (36%) трет-бутилового эфира [5-(2-трифторметил-фенил)-изоксазол-4-ил]-карбаминовой кислоты. 1H ЯМР (300 МГц, CDCl3) δ: 8,89 (с, 1H), 7,88-7,84 (м, 1H), 7,72-7,66 (м, 2H), 7,54-7,49 (м, 1H), 5,98 (с, 1H), 1,48 (с, 9H).
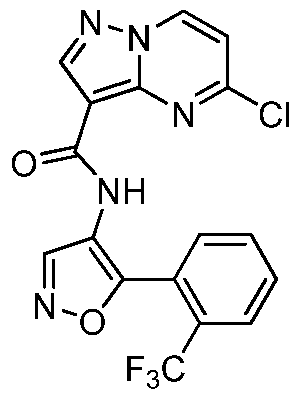
[5-(2-Трифторметил-фенил)-изоксазол-4-ил]-амид 5-хлор-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
Смесь трет-бутилового эфира [5-(2-трифторметил-фенил)-изоксазол-4-ил]-карбаминовой кислоты (345 мг, 1,05 ммоль, 1,0 экв.), 4M HCl в диоксане (2 мл) в 1,4-диоксане (3 мл) нагревали до 40°C в течение 20 часов. Смесь концентрировали в вакууме с получением остатка, который растворяли в дихлорметане (12 мл) и обрабатывали диизопропилэтиламином (271 мг, 2,10 ммоль, 2,0 экв.). Смесь охлаждали на ледяной бане и добавляли по каплям раствор 5-хлорпиразоло[1,5-α]пиримидин-3-карбонилхлорида (1,05 ммоль, 1,0 экв.) в дихлорметане (6 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 18 часов. Раствор промывали последовательно водным раствором 1M HCl, насыщенным водным раствором бикарбоната натрия и водой. Собранный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток растирали в порошок (метанол) и выделенное твердое вещество промывали метанолом и диэтиловым эфиром, затем сушили в вакууме с получением 367 мг (86%) [5-(2-трифторметил-фенил)-изоксазол-4-ил]-амида 5-хлор-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты. ЖХМС (ESI) m+H=408,0 (моно Cl); 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,50 (с, 1H), 9,35 (д, 1H), 9,22 (с, 1H), 8,71 (с, 1H), 8,03 (д, 1H), 7,97-7,82 (м, 3H), 7,38 (д, 1H).

[5-(2-Трифторметил-фенил)-изоксазол-4-ил]-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
Смесь [5-(2-трифторметил-фенил)-изоксазол-4-ил]-амида 5-хлор-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (200 мг, 0,49 ммоль, 1,0 экв.) и 2M аммиака в пропан-2-оле (4 мл) герметично закрывали и нагревали в микроволновом реакторе при 120°C в течение 40 минут. Растворитель удаляли в вакууме и полученный остаток очищали колоночной флэш-хроматографией на силикагеле (градиент: 0→5% метанола в дихлорметане) с получением 58,6 мг (31%) [5-(2-трифторметил-фенил)-изоксазол-4-ил]-амида 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты. ЖХМС (ESI) m+H=389,1; 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,60 (с, 1H), 9,07 (с, 1H), 8,63 (д, 1H), 8,18 (с, 1H), 7,99 (д, 1H), 7,95-7,77 (м, 3H), 7,70-6,60 (ушир, 2H), 6,39 (д, 1H).
Пример 233
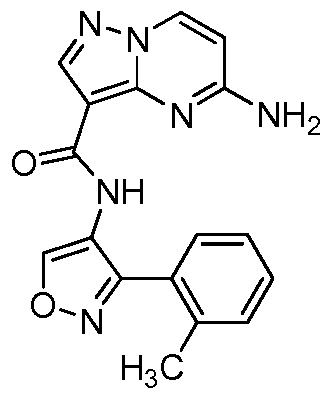
(3-o-Толил-изоксазол-4-ил)-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
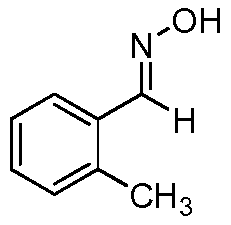
2-Метил-бензальдегидоксим
Смесь o-толуальдегида (5,00 г, 41,6 ммоль, 1,0 экв.), гидроксиламингидрохлорида (3,18 г, 45,8 ммоль, 1,1 экв.) и пиридина (3,29 г, 41,6 ммоль, 1,0 экв.) в этаноле (100 мл) перемешивали при температуре окружающей среды в течение 2 часов. pH смеси доводили до около 1 путем добавления водного раствора 1M HCl. Полученный раствор экстрагировали дихлорметаном. Собранные органические экстракты сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с получением масла (6,30 г), которое использовали непосредственно на следующей стадии. ЖХМС (ESI) m+H+MeOH = 168,0; 1H ЯМР (400 МГц, CDCl3) δ: 8,42 (с, 1H), 7,70-7,63 (д, 1H), 7,29-7,16 (м, 3H), 2,43 (с, 3H).
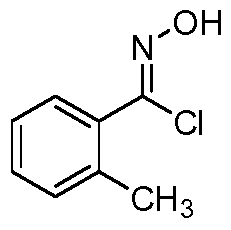
N-Гидрокси-2-метилбензолкарбоксимидоилхлорид
N-Хлорсукцинимид (2,22 г, 16,6 ммоль, 1,0 экв.) добавляли к перемешиваемому раствору 2-метил-бензальдегидоксима (2,25 г, 16,6 ммоль, 1,0 экв.) в N,N-диметилформамиде (30 мл) при температуре окружающей среды. Перемешивание продолжали в течение 2 часов и реакцию гасили (лед-вода). Полученную смесь экстрагировали этилацетатом. Объединенные органические экстракты промывали последовательно водой (6×) и насыщенным водным раствором хлорида натрия (2×). Органическую фазу затем сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с получением 2,07 г (74%) N-гидрокси-2-метилбензолкарбоксимидоилхлорида в виде зеленого масла. 1H ЯМР (300 МГц, CDCl3) δ: 8,14 (с, 1H), 7,48-7,44 (м, 1H), 7,37-7,20 (м, 3H), 2,43 (с, 3H).
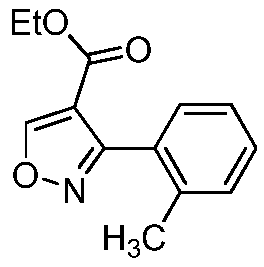
Этиловый эфир 3-o-толил-изоксазол-4-карбоновой кислоты
К перемешиваемому раствору N-гидрокси-2-метилбензолкарбоксимидоилхлорида (2,07 г, 12,2 ммоль, 1,0 экв.) в диэтиловым эфиром (15 мл) добавляли раствор этилового эфира 3-пирролидин-1-ил-акриловой кислоты (получен в соответствии с процедурой, описанной в Патенте США № 4187099) (2,06 г, 12,2 ммоль, 1,0 экв.) и триэтиламина (1,48 г, 12,2 ммоль, 1,0 экв.) в диэтиловым эфиром (30 мл) по каплям в течение 15 минут. Полученную смесь перемешивали при температуре окружающей среды в течение 16 часов, распределяли между водой и диэтиловым эфиром и разделяли. Водную фазу экстрагировали диэтиловым эфиром (2×) и объединенные эфирные экстракты сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Очистка колоночной флэш-хроматографией на силикагеле (градиент: 0→20% этилацетата в циклогексане) давала 1,32 г (47%) этилового эфира 3-o-толил-изоксазол-4-карбоновой кислоты. 1H ЯМР (400 МГц, CDCl3) δ: 9,02 (с, 1H), 7,39-7,34 (м, 1H), 7,32-7,24 (м, 3H), 4,19 (кв, 2H), 2,23 (с, 3H), 1,17 (т, 3H).
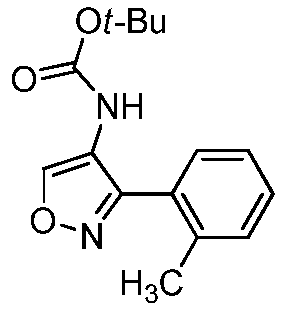
трет-Бутиловый эфир (3-o-толил-изоксазол-4-ил)-карбаминовой кислоты
Раствор этилового эфира 3-o-толил-изоксазол-4-карбоновой кислоты (1,32 г, 5,71 ммоль, 1,0 экв.), водного раствора 6M HCl (40 мл) и уксусной кислоты (24 мл) нагревали до температуры кипения с обратным холодильником в течение 5 часов. После охлаждения смесь распределяли между водой и этилацетатом и разделяли. Органическую фазу последовательно промывали водой и насыщенным водным раствором хлорида натрия. Собранное органическое вещество затем сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с получением 930 мг (80%) неочищенной 3-o-толил-изоксазол-4-карбоновой кислоты, которую использовали без очистки.
Смесь 3-o-толил-изоксазол-4-карбоновой кислоты (930 мг, 4,58 ммоль, 1,0 экв.), азида дифенилфосфоновой кислоты (1,26 г, 4,58 ммоль, 1,0 экв.) и триэтиламина (463 мг, 4,58 ммоль, 1,0 экв.) в трет-бутаноле (40 мл) нагревали до 85°C в течение 16 часов. Смесь концентрировали в вакууме и остаток поглощали в этилацетат и последовательно промывали водным раствором 1M HCl, насыщенным водным раствором бикарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Собранное органическое вещество сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (градиент: 0→15% этилацетата в циклогексане) с получением 943 мг (75%) трет-бутилового эфира (3-o-толил-изоксазол-4-ил)-карбаминовой кислоты. ЖХМС (ESI) m+H=275,0; 1H ЯМР (300 МГц, CDCl3) δ: 8,92 (с, 1H), 7,47-7,29 (м, 4H), 5,87 (с, 1H), 2,29 (с, 3H), 1,48 (с, 9H).
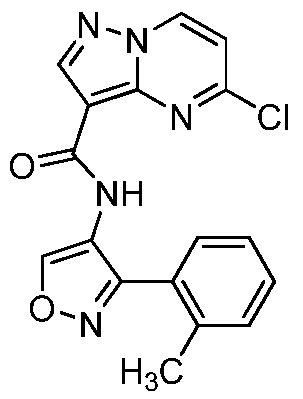
(3-o-Толил-изоксазол-4-ил)-амид 5-хлор-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
Смесь трет-бутилового эфира (3-o-толил-изоксазол-4-ил)-карбаминовой кислоты (500 мг, 1,82 ммоль, 1,0 экв.), 4M HCl в диоксане (4 мл) в 1,4-диоксане (5 мл) перемешивали при температуре окружающей среды в течение 22 часов и при 40°C в течение 1 часа. Смесь концентрировали в вакууме с получением остатка, который растворяли в дихлорметане (15 мл) и обрабатывали диизопропилэтиламином (523 мг, 4,05 ммоль, 2,2 экв.). Смесь охлаждали на ледяной бане и добавляли по каплям раствор 5-хлорпиразоло[1,5-α]пиримидин-3-карбонилхлорида (1,82 ммоль, 1,0 экв.) в дихлорметане (10 мл). После добавления реакционную смесь нагревали до комнатной температуры. Через 65 часов раствор последовательно промывали водным раствором 1M HCl, насыщенным водным раствором бикарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток растирали в порошок (метанол) с получением 444 мг (70%) (3-o-толил-изоксазол-4-ил)-амида 5-хлор-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты. ЖХМС (ESI) m+H=354,2 (моно Cl); 1H ЯМР (300 МГц, ДМСО-d6) δ: 9,47 (с, 1H), 9,36 (д, 1H), 9,11 (с, 1H), 8,72 (с, 1H), 7,53-7,40 (м, 4H), 7,37 (д, 1H), 2,31 (с, 3H).
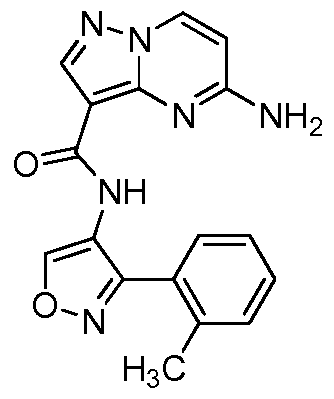
(3-o-Толил-изоксазол-4-ил)-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
Смесь (3-o-толил-изоксазол-4-ил)-амида 5-хлор-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (200 мг, 0,57 ммоль, 1,0 экв.) и 2M аммиака в пропан-2-оле (3 мл) нагревали в герметично закрытом сосуде при 65°C в течение 18 часов и затем в микроволновом реакторе при 100°C в течение 30 минут. После охлаждения полученный осадок выделяли фильтрованием. Твердые частицы последовательно промывали пропан-2-олом и диэтиловым эфиром и сушили в вакууме при 55°C с получением 153 мг (80%) (3-o-толил-изоксазол-4-ил)-амида 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты в виде твердого вещества. ЖХМС (ESI) m+H=335,1; 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,51 (с, 1H), 9,34 (с, 1H), 8,65 (д, 1H), 8,21 (с, 1H), 7,58-7,44 (м, 4H), 7,01 (ушир, 1H), 6,39 (д, 1H), 2,27 (с, 3H).
Пример 234
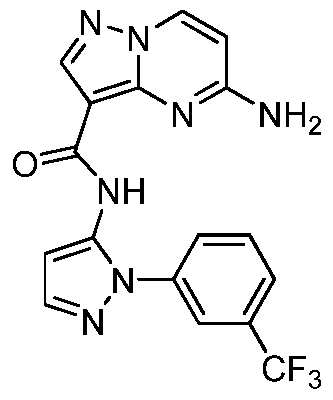
[2-(3-Трифторметил-фенил)-2H-пиразол-3-ил]-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
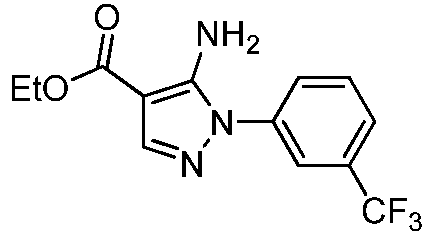
Этил 5-амино-1-(3-(трифторметил)фенил)-1H-пиразол-4-карбоксилат
К раствору этил 2-циано-3-этоксиакрилата (0,81 г, 4,8 ммоль) в этаноле (50 мл) добавляли 3-(трифторметил)фенилгидразин (0,85 г, 4,8 ммоль). Полученную реакционную смесь кипятили с обратным холодильником в течение 24 часов в атмосфере азота. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением 0,94 г (выход: 66%) вещества, которое использовали без дополнительной очистки. MS (ESI) m/z:300,3.

1-(3-(Трифторметил)фенил)-1H-пиразол-5-амин
Раствор этил 5-амино-1-(3-(трифторметил)фенил)-1Н-пиразол-4-карбоксилата (0,9 г, 3 ммоль) в диоксане (20 мл), насыщенном HCl, нагревали до 150°C в течение 5 часов в герметично закрытой пробирке. Реакционную смесь затем охлаждали и концентрировали в вакууме. Остаток разбавляли водой и водный раствор экстрагировали этилацетатом (3×50 мл). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной флэш-хроматографией (5:1 этилацетат/петролейный эфир) с получением продукта (430 мг, 63%). MS (ESI) m/z:228,1.
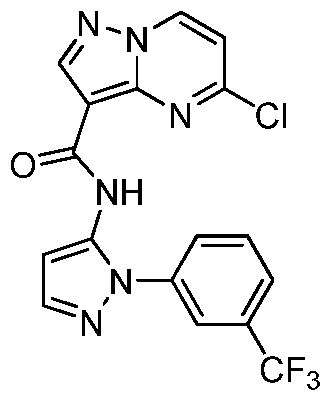
5-Хлор-N-(1-(3-(трифторметил)фенил)-1H-пиразол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамид
К перемешиваемому раствору 1-(3-(трифторметил)фенил)-1H-пиразол-5-амина (200 мг, 0,88 ммоль) в дихлорметане (30 мл) добавляли 5-хлорпиразоло[1,5-a]пиримидин-3-карбонилхлорид (215 мг, 1,0 ммоль) и диизопропилэтиламин (130 мг, 1,0 ммоль). Смесь нагревали до 50°C в течение ночи. После охлаждения до комнатной температуры смесь концентрировали с получением неочищенного 5-хлор-N-(l-(3-(трифторметил)фенил)-1Н-пиразол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида (210 мг, выход 58%), который использовали на следующей стадии без дополнительной очистки. MS (ESI) m/z 407,2
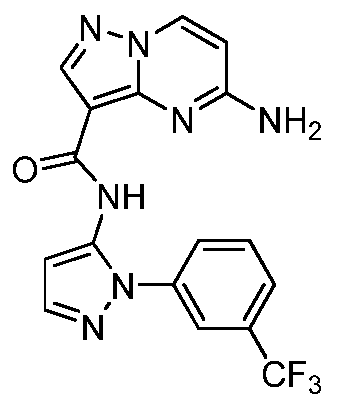
[2-(3-Трифторметил-фенил)-2H-пиразол-3-ил]-амид 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты
Раствор 5-хлор-N-(l-(3-(трифторметил)фенил)-1H-пиразол-5-ил)пиразоло[1,5-a]пиримидин-3-карбоксамида (210 мг, 0,52 ммоль) в этаноле (20 мл), насыщенном аммиаком, нагревали до 100°C в течение ночи в герметично закрытой пробирке. После охлаждения до комнатной температуры растворитель удаляли при пониженном давлении и полученный остаток очищали препаративной ВЭЖХ с получением [2-(3-трифторметил-фенил)-2H-пиразол-3-ил]-амида 5-амино-пиразоло[1,5-a]пиримидин-3-карбоновой кислоты (8 мг, выход: 4%). 1H ЯМР (400 МГц, ДМСО-d6) δ: 9,94 (с, 1H), 8,62 (д, J=7,6 Гц, 1H), 8,16 (с, 1H), 7,49-7,69 (м, 8H), 6,53 (с, 1H), 6,37 (д, J=7,6 Гц, 1H), MS (ESI) m/z : 388,1.
Примеры 235-452, представленные в Таблице 2, получали в соответствии с описанными выше способами.
(ESI) m/z
5-амино-пиразоло[1,5-а]пиримидин-3-карбоновой кислоты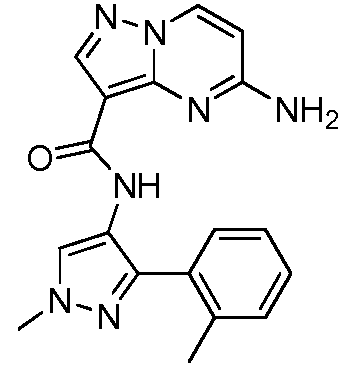
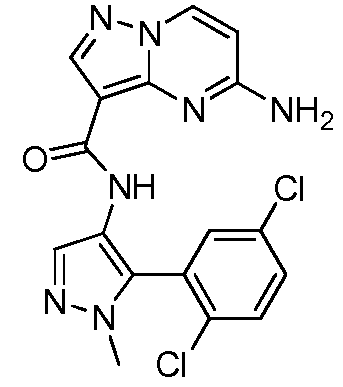
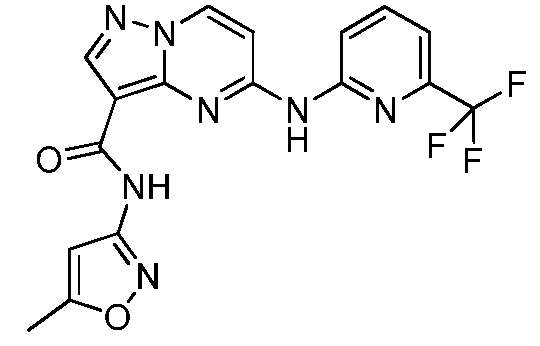
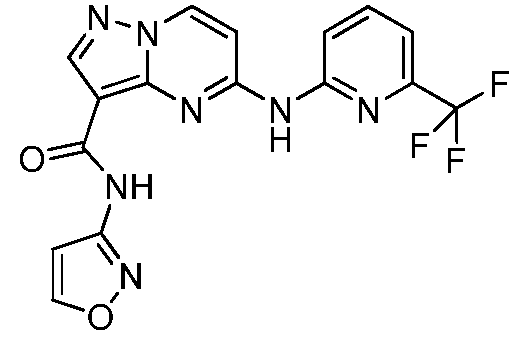
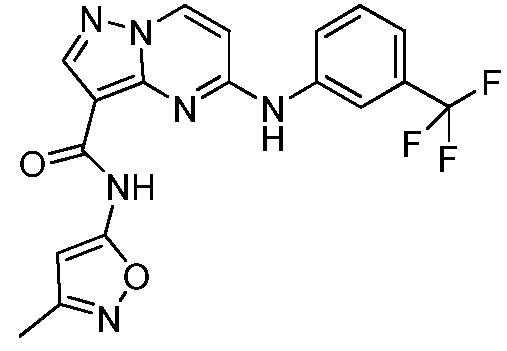

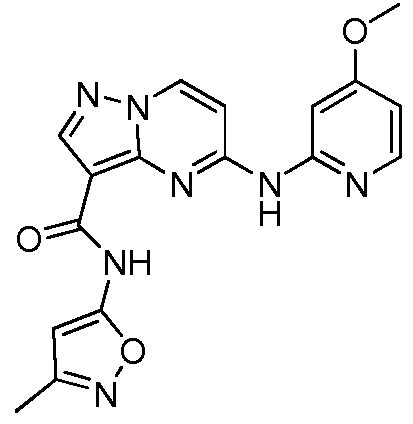
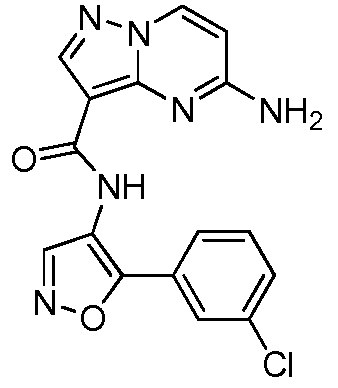

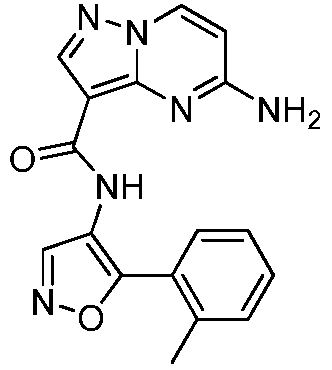
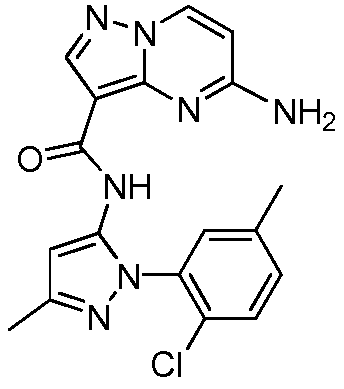
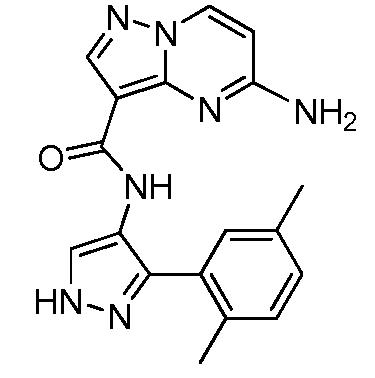
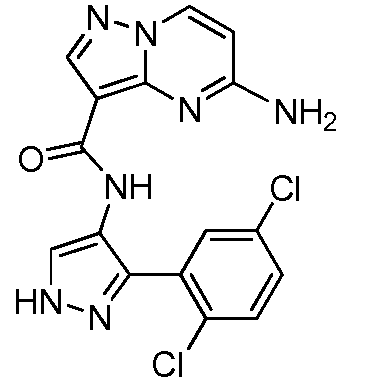
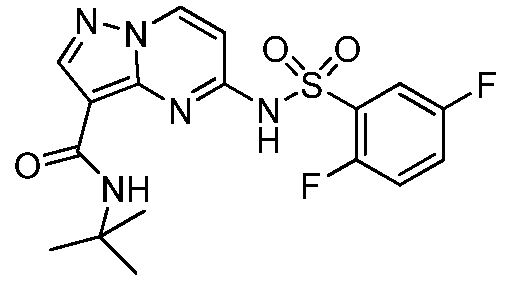
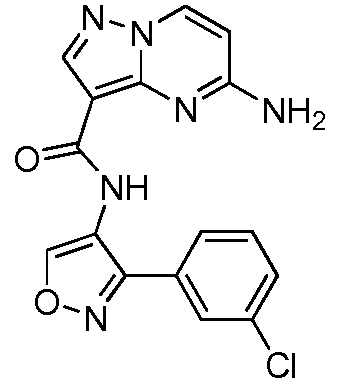



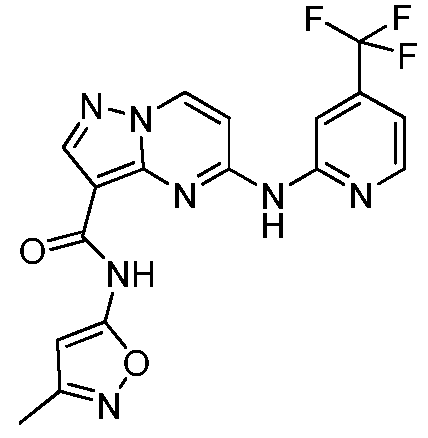
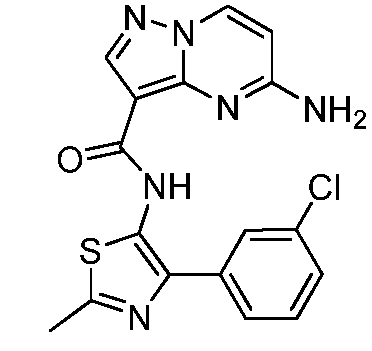

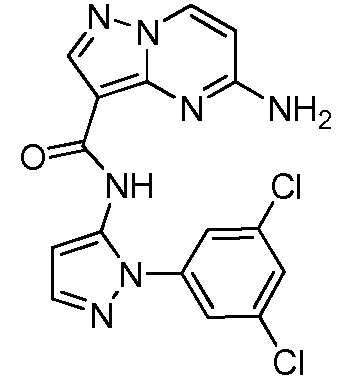
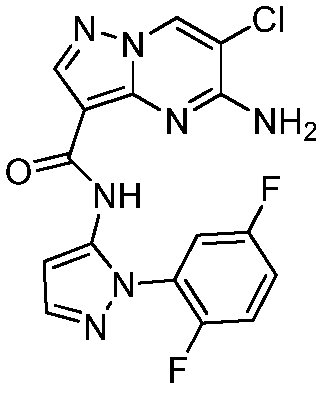


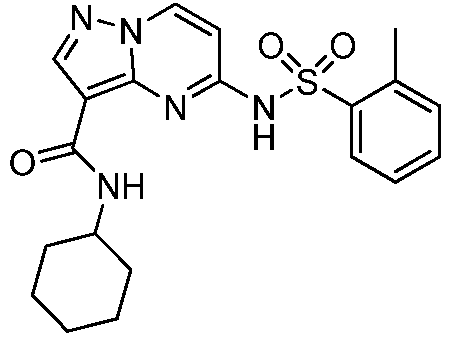
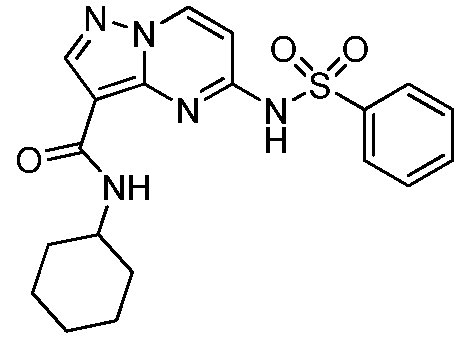



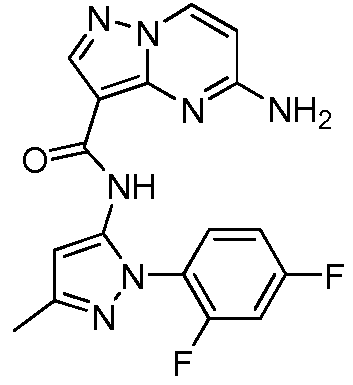
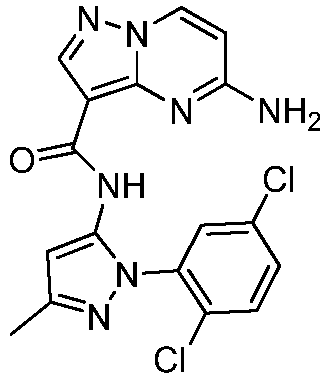
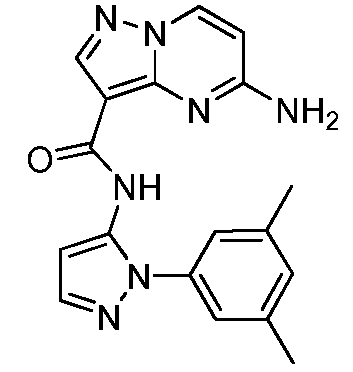
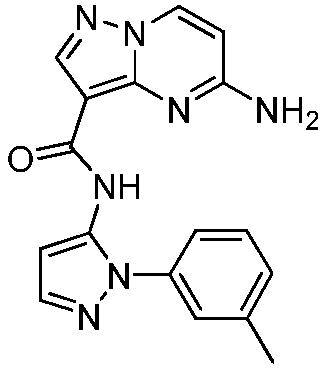

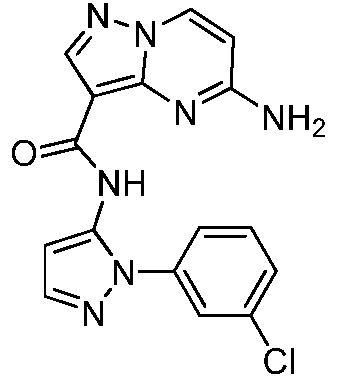
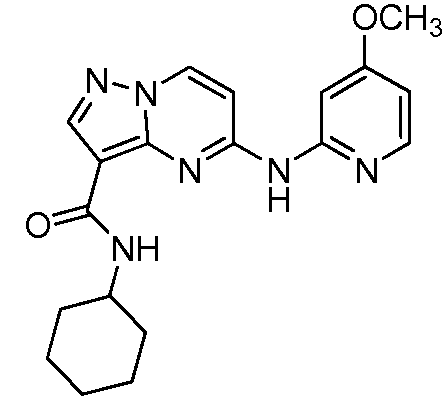
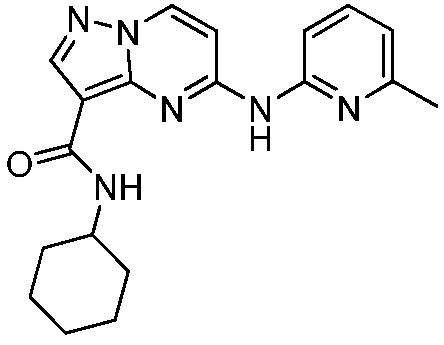


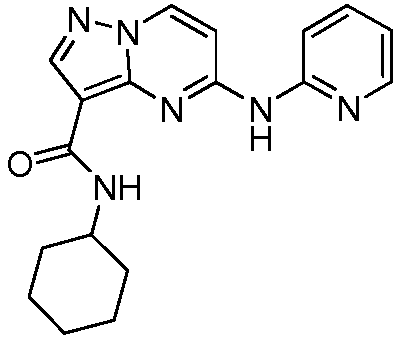

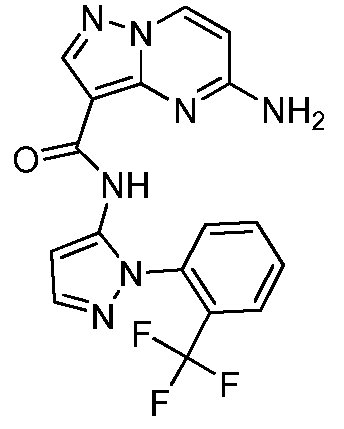
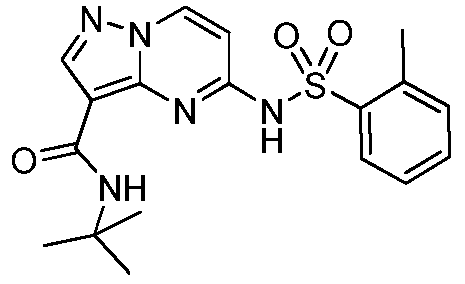

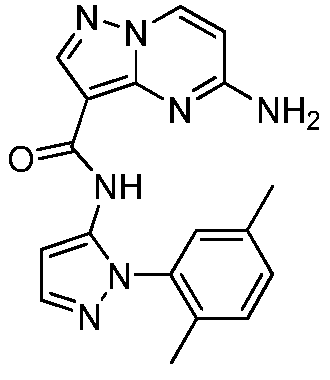
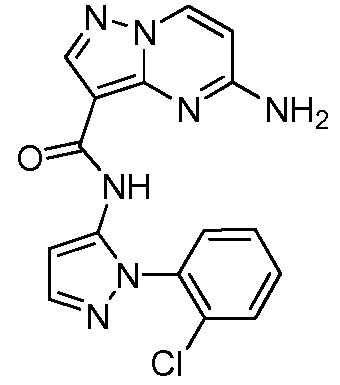
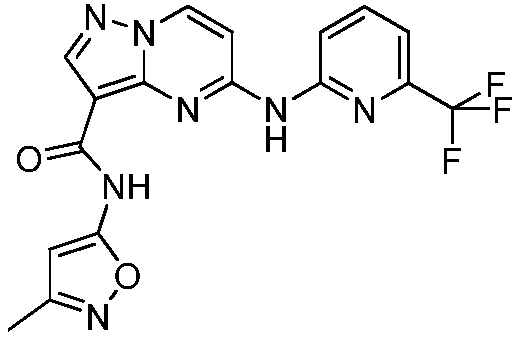


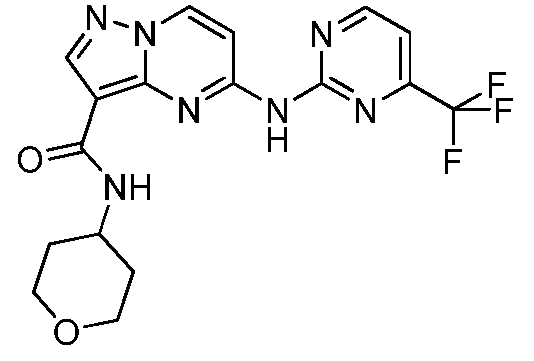
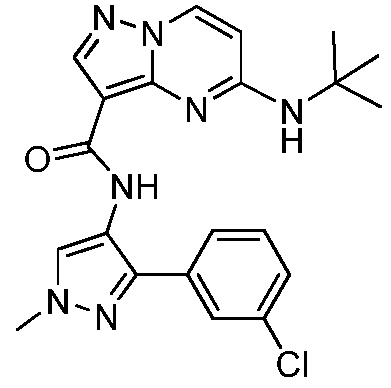
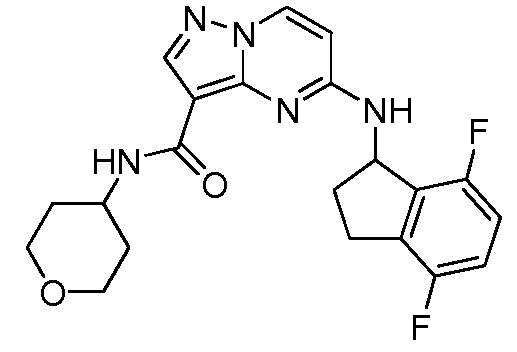
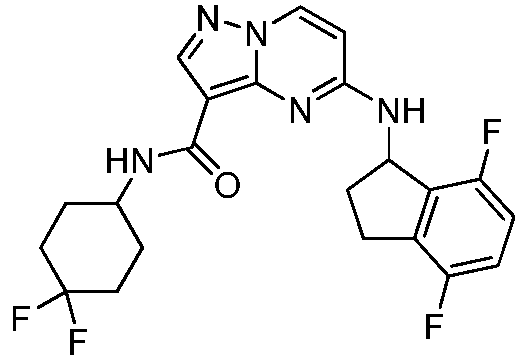
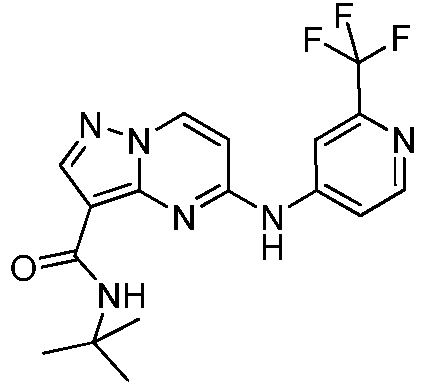
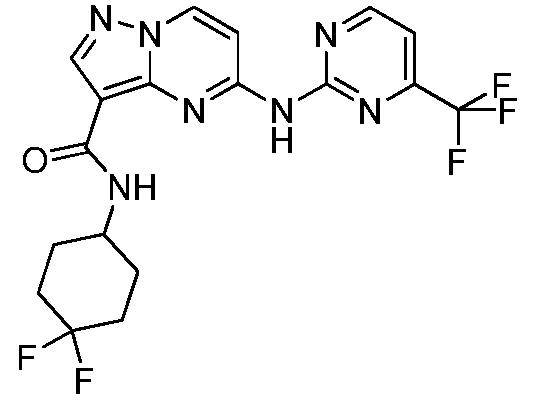
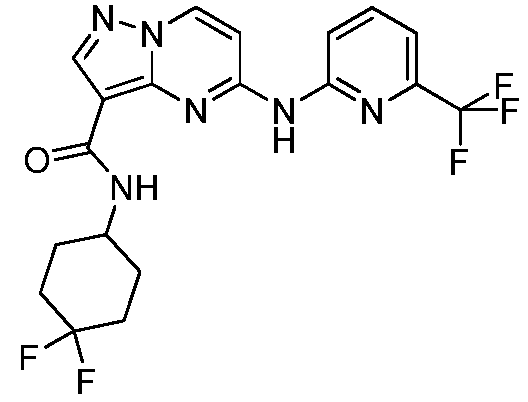
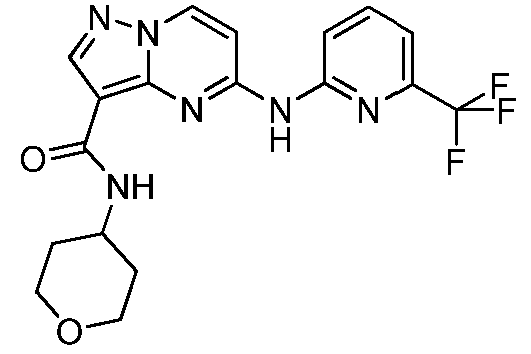
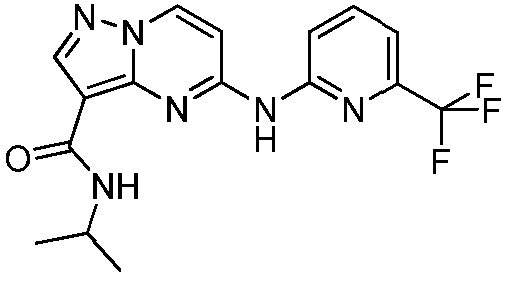
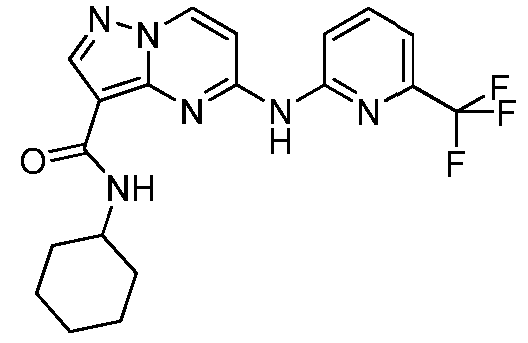
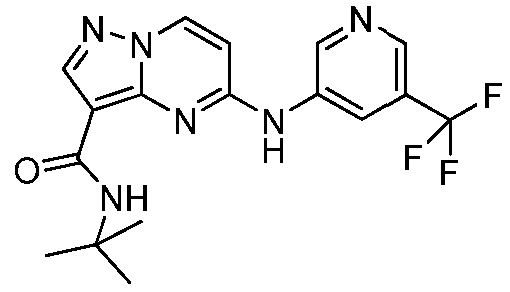
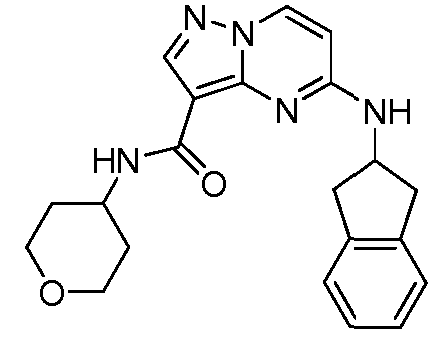


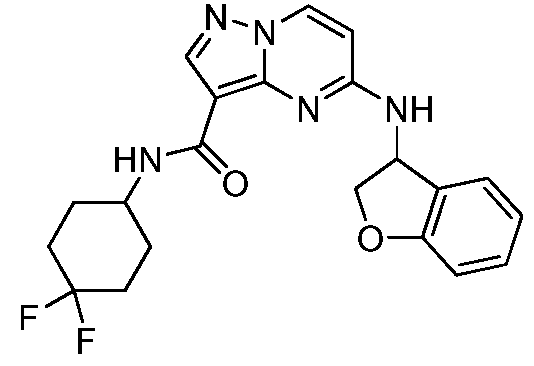
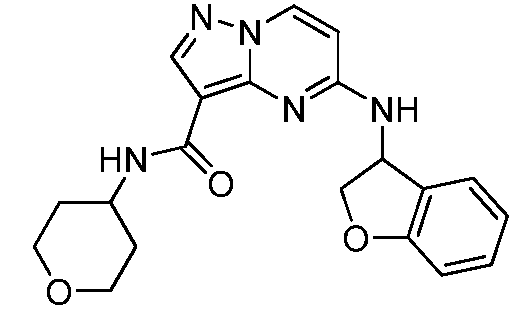

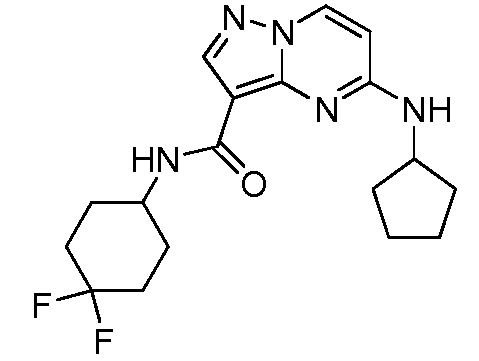
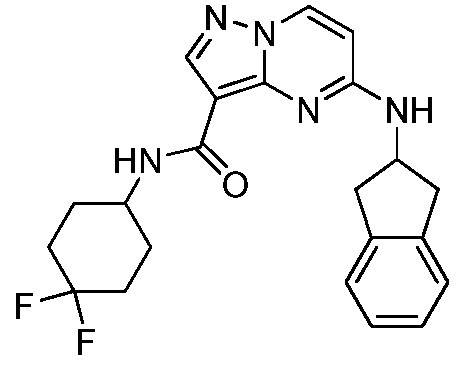
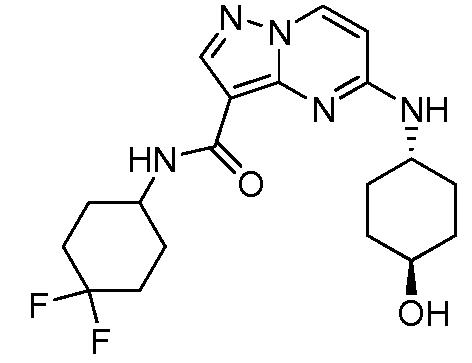
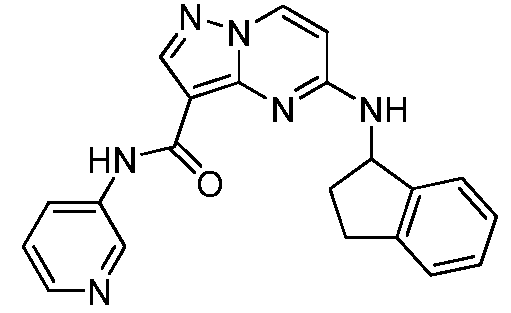
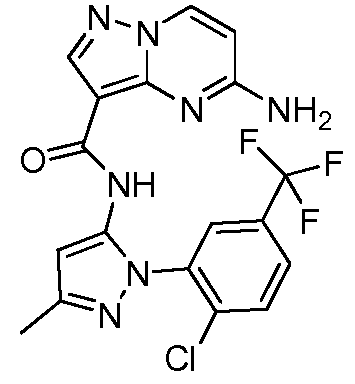
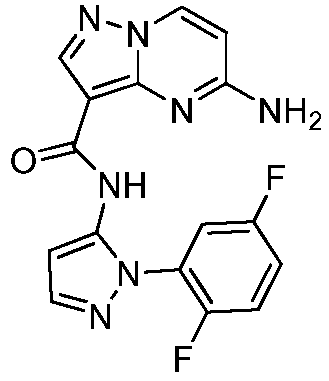

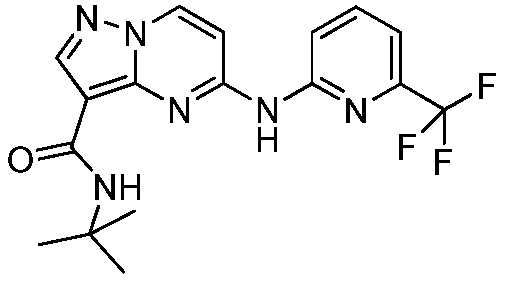

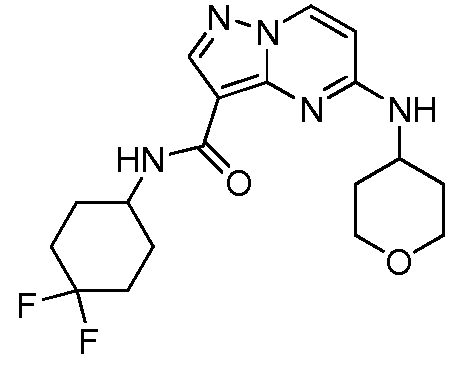

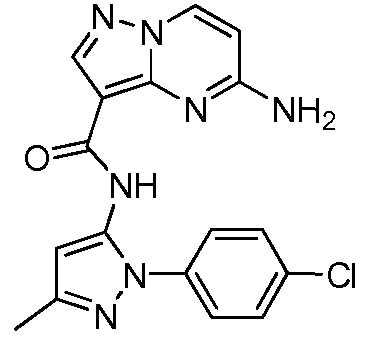
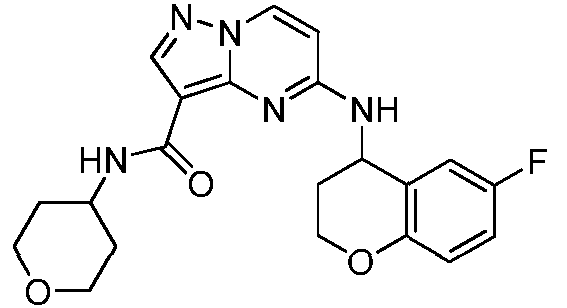
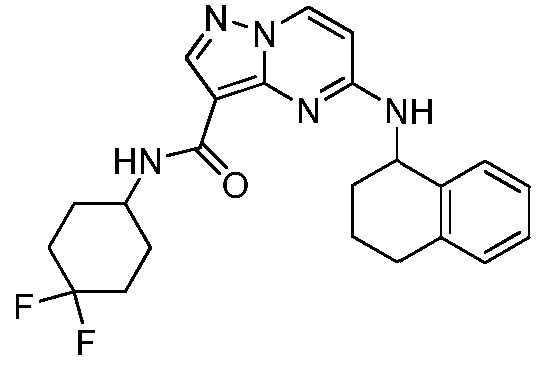
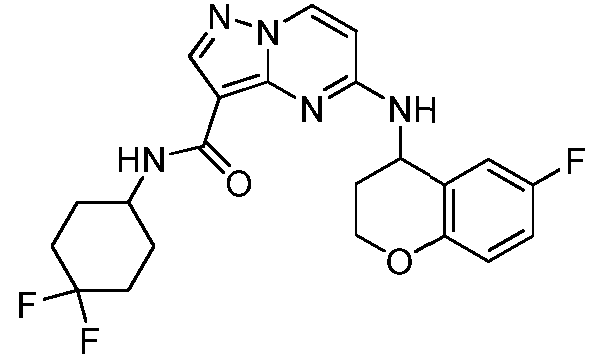
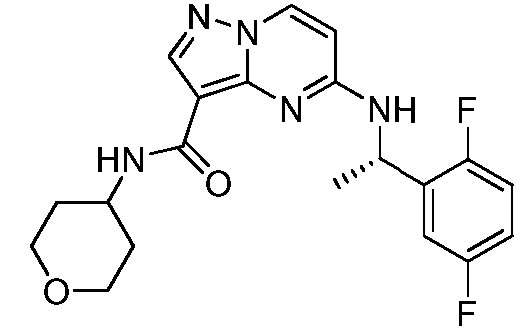
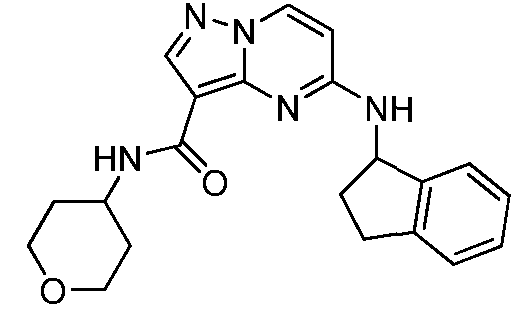

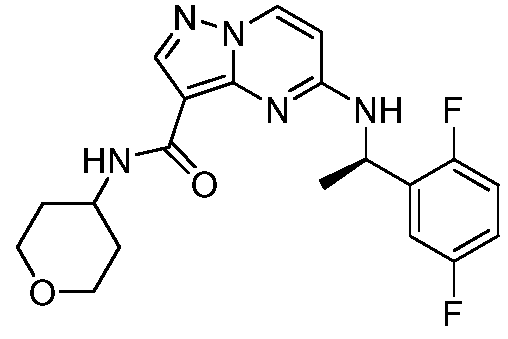

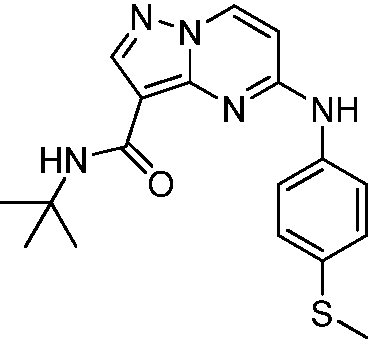

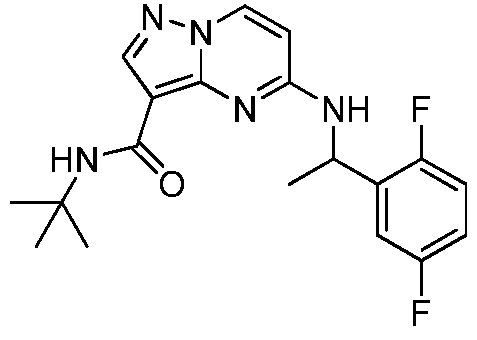
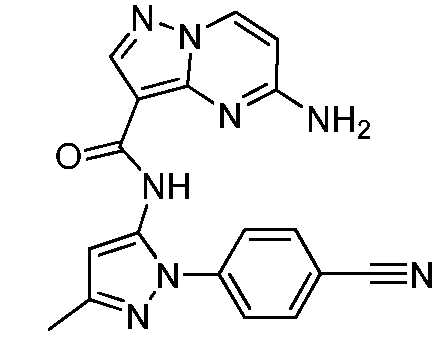
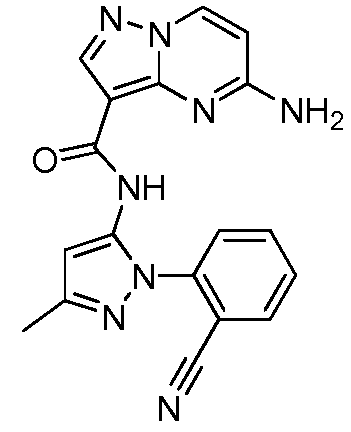

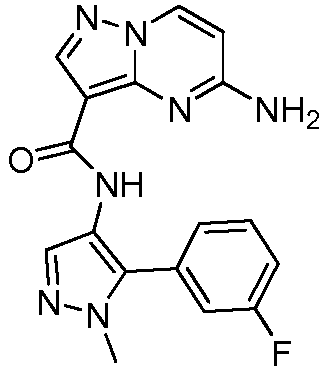
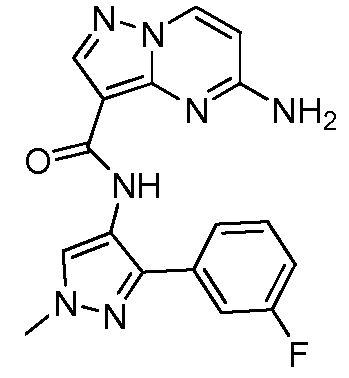

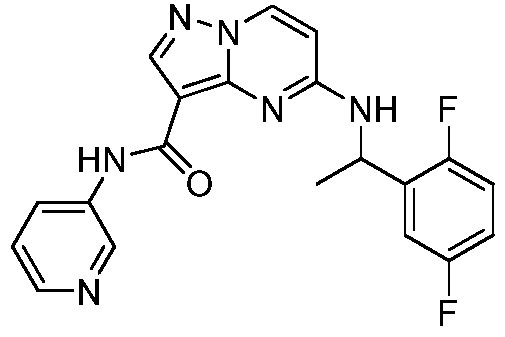
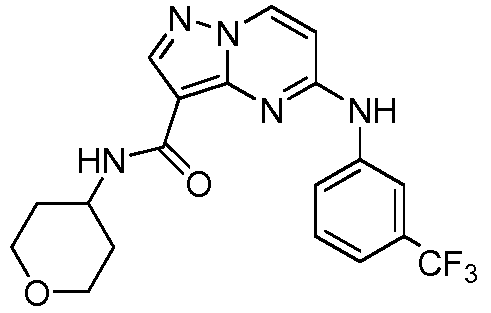
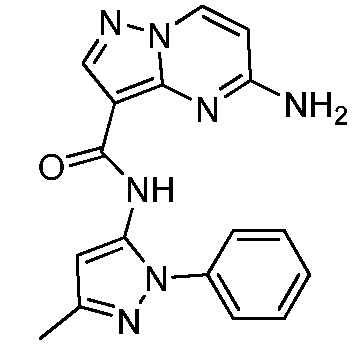

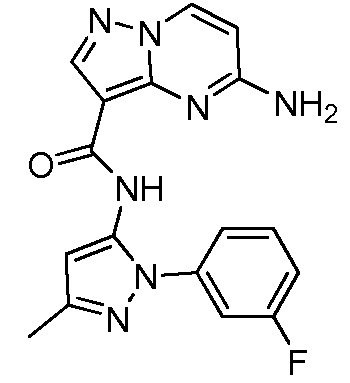
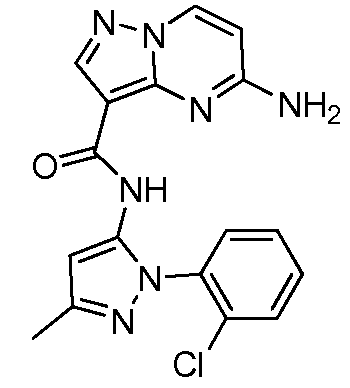

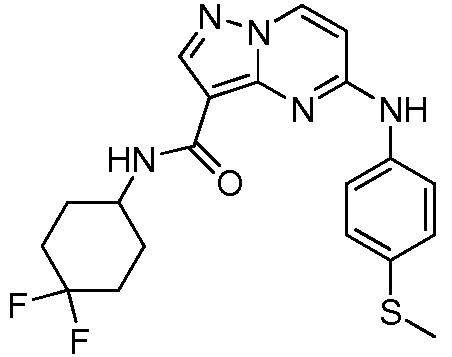
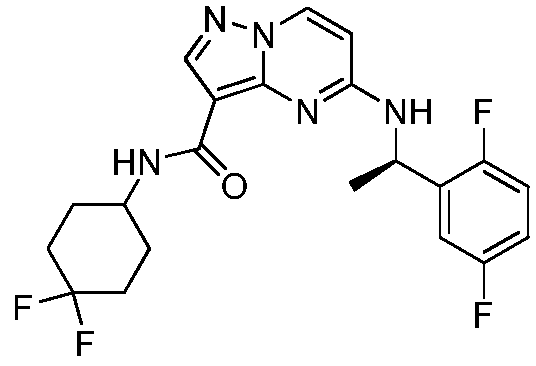
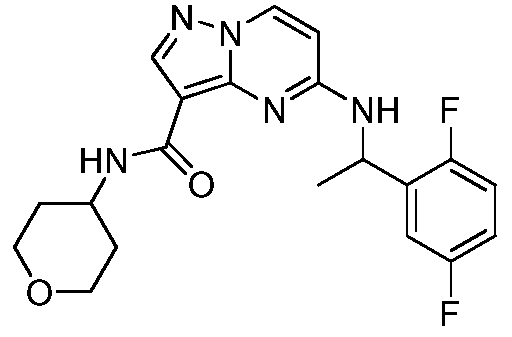

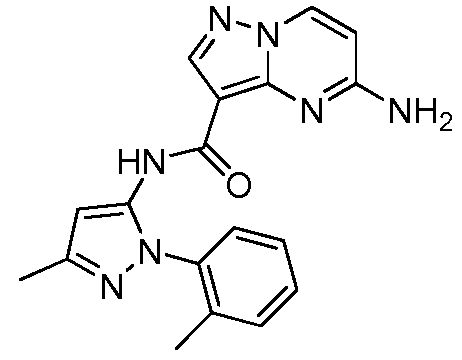
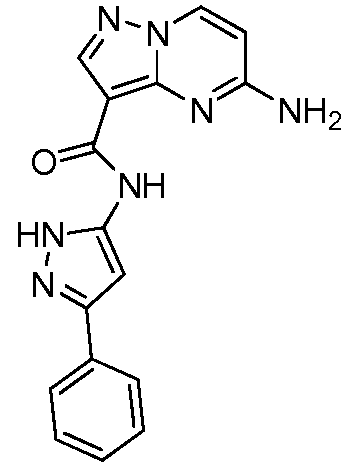


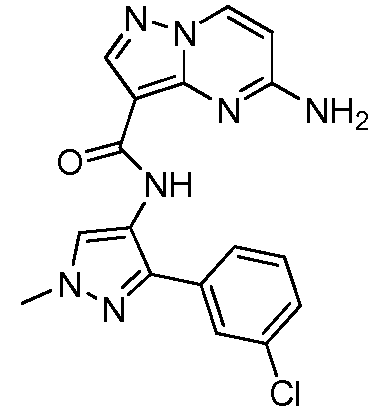
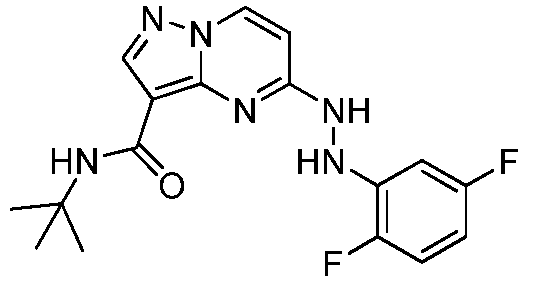
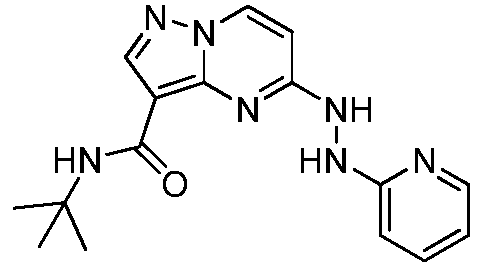
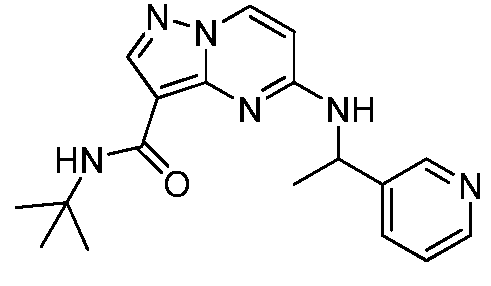
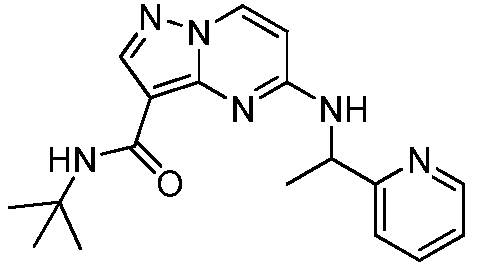
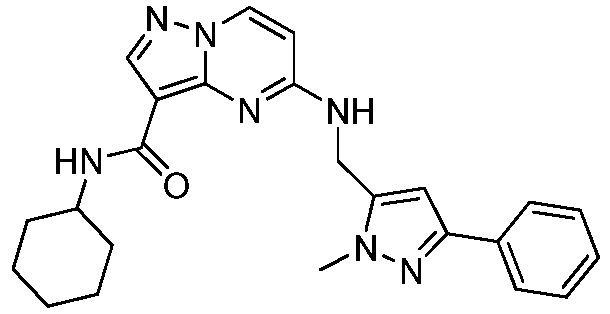
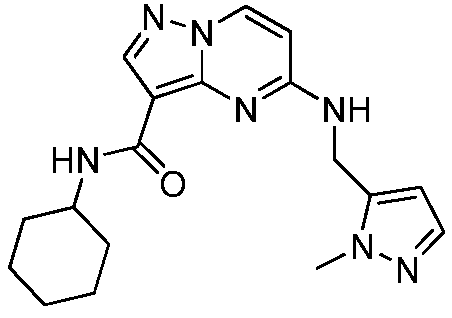
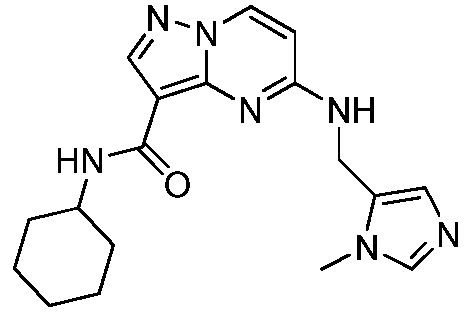
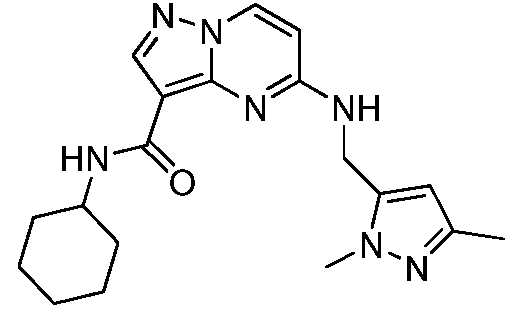
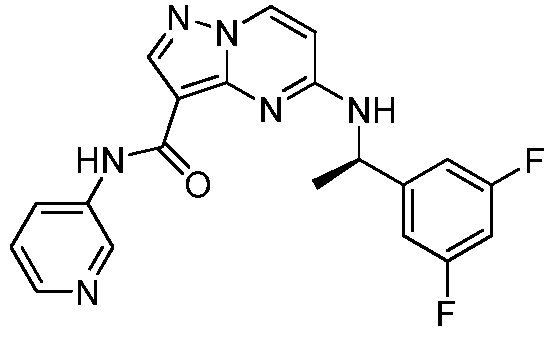
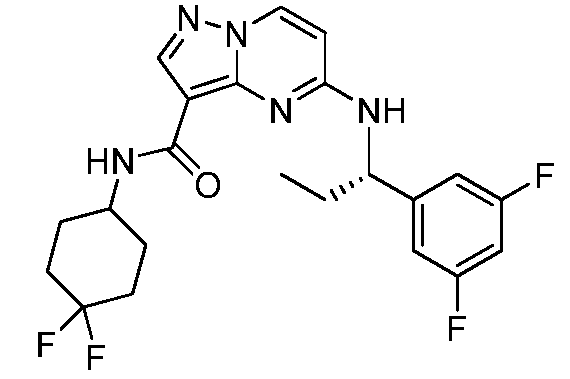

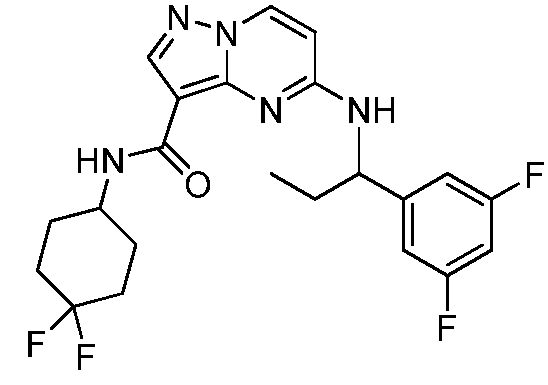
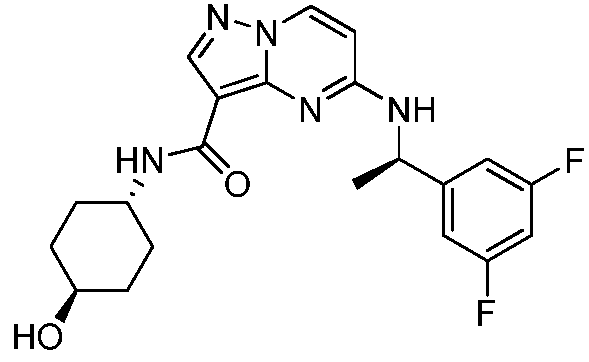

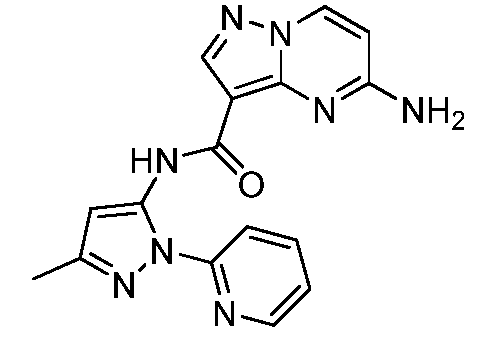
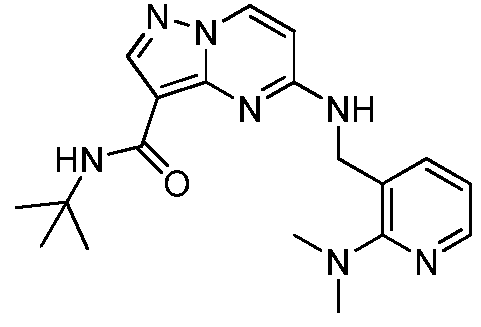
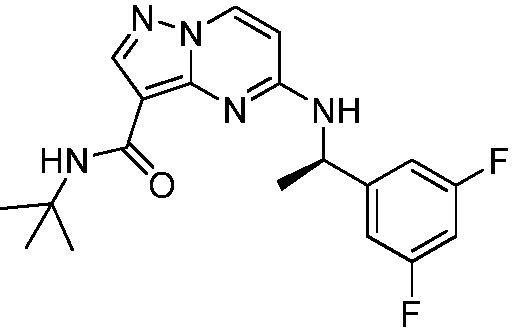
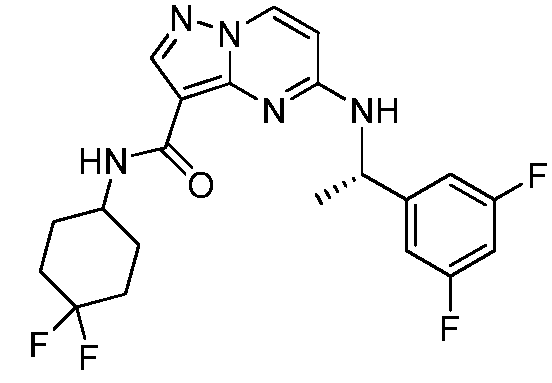

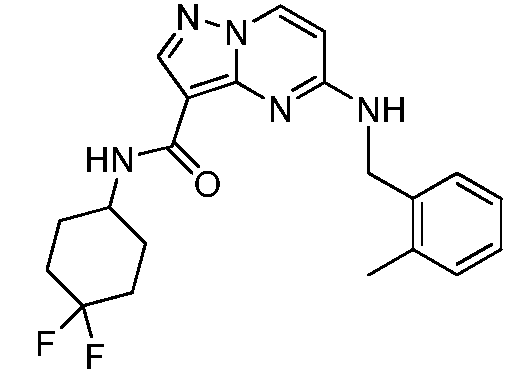

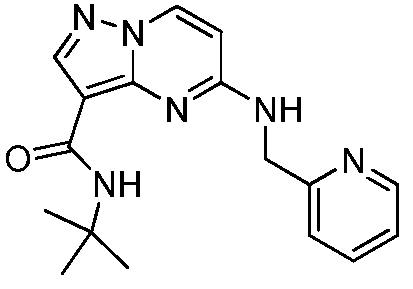
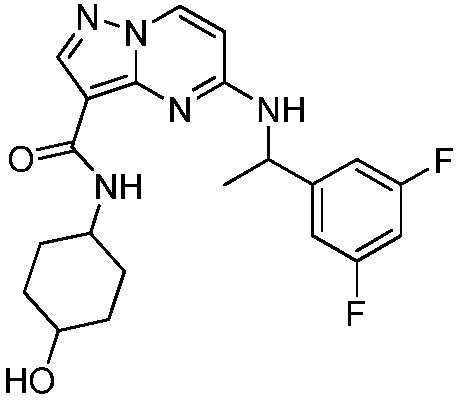
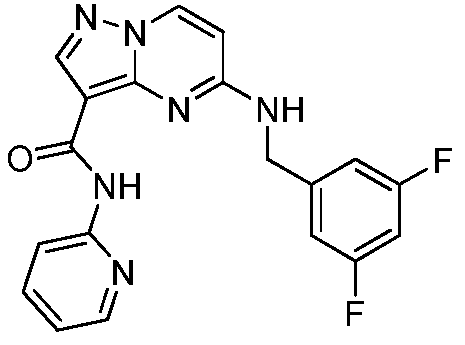
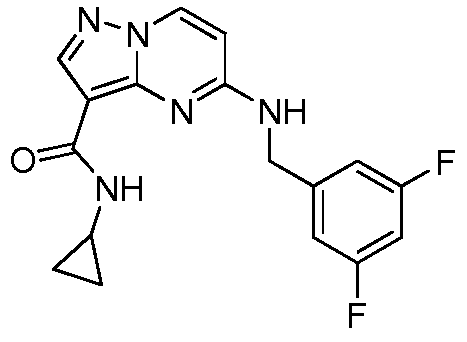
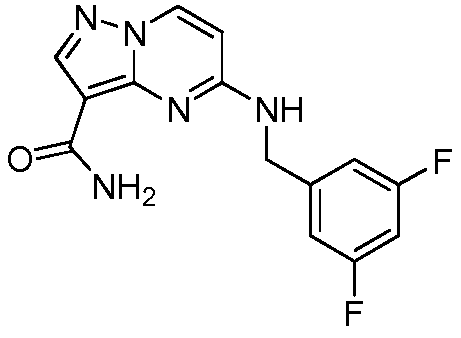
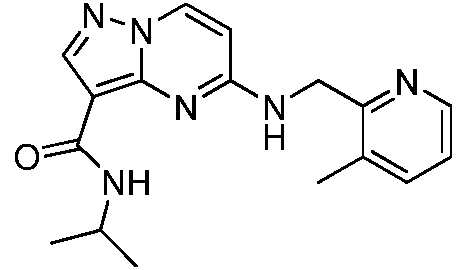
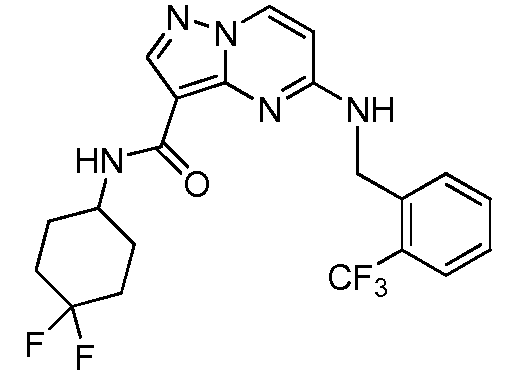
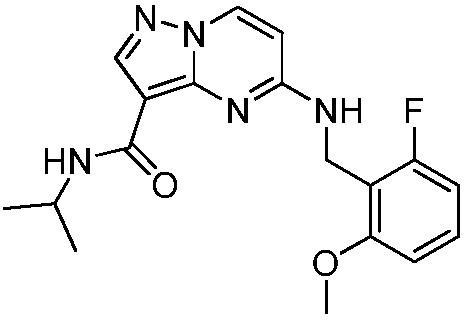
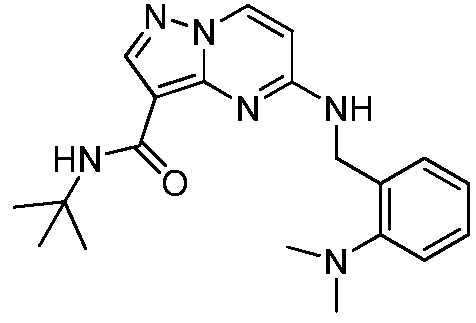
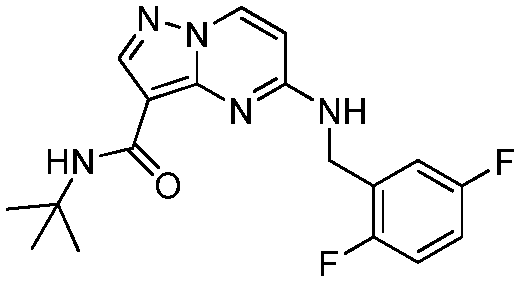

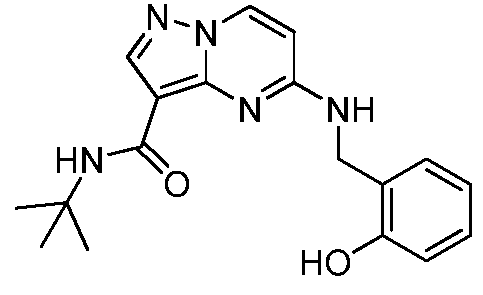
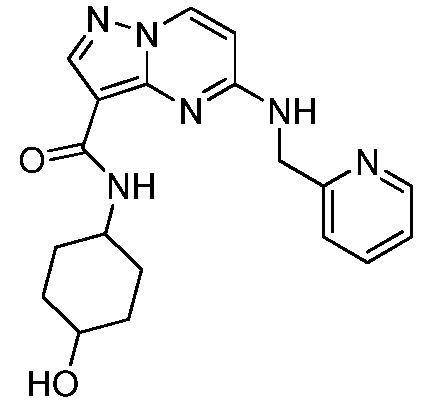

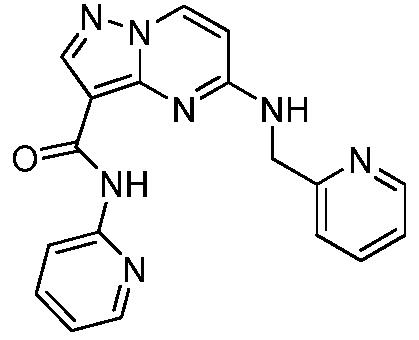
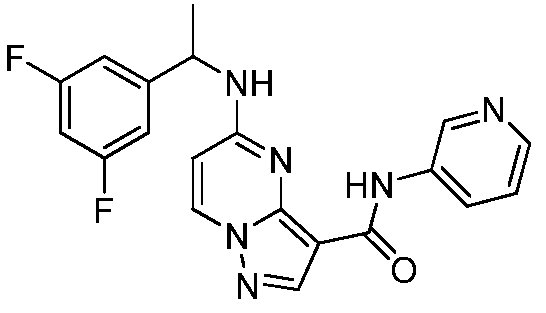
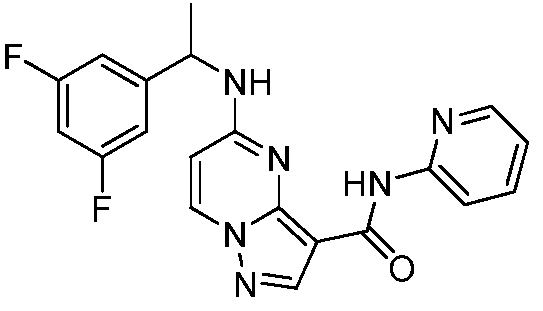



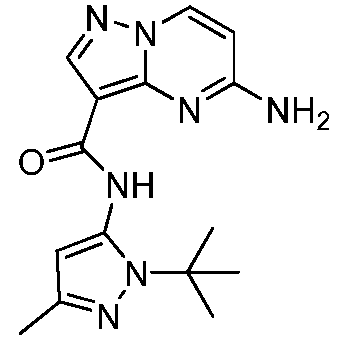
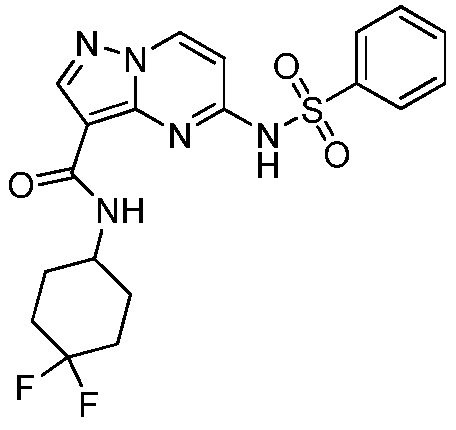


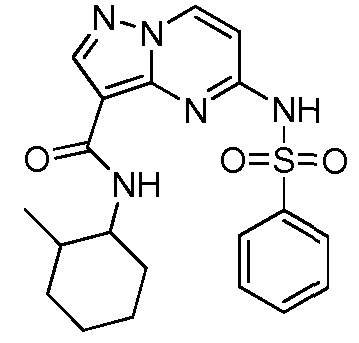

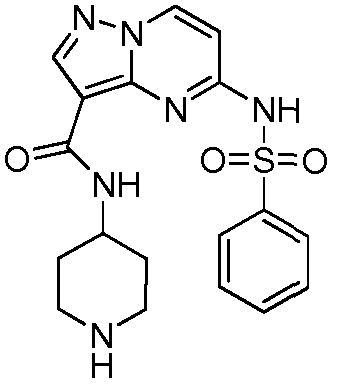
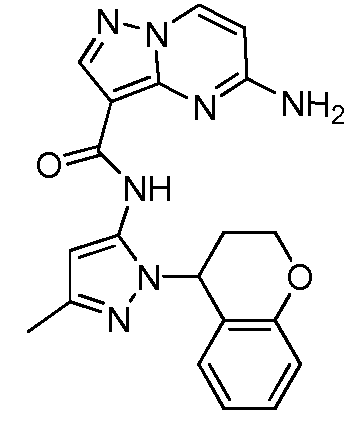
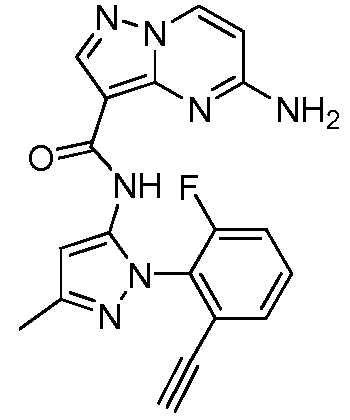
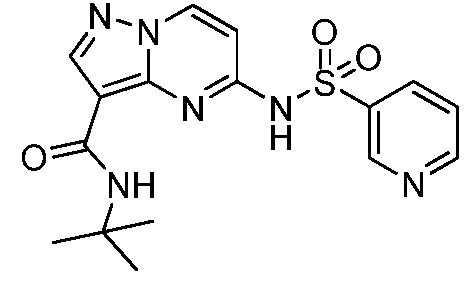
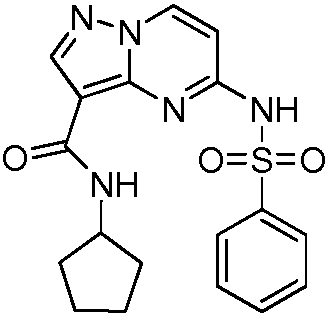
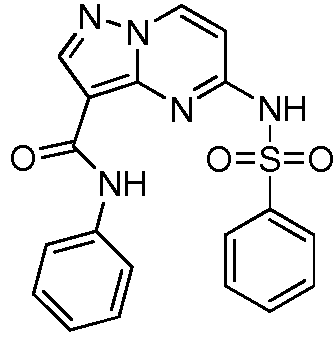
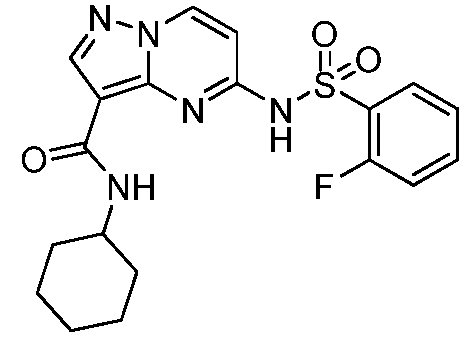
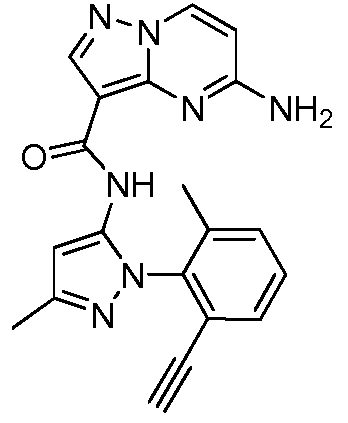
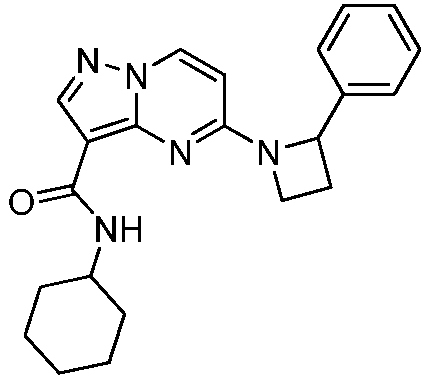
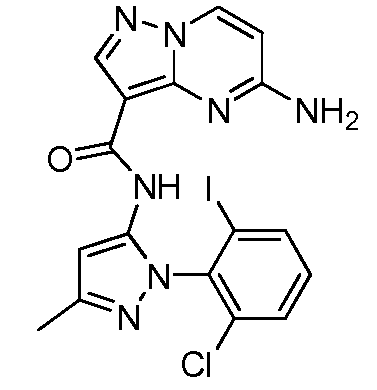
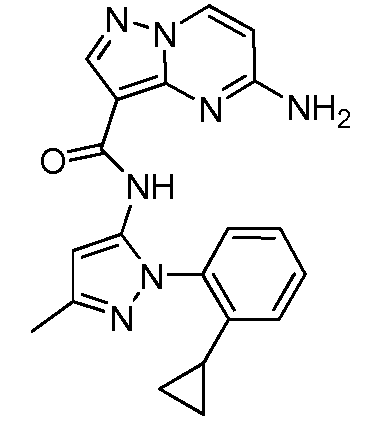
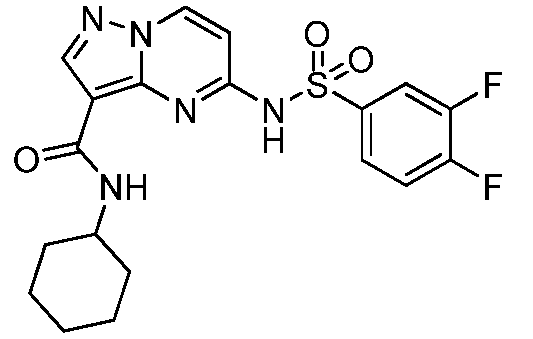
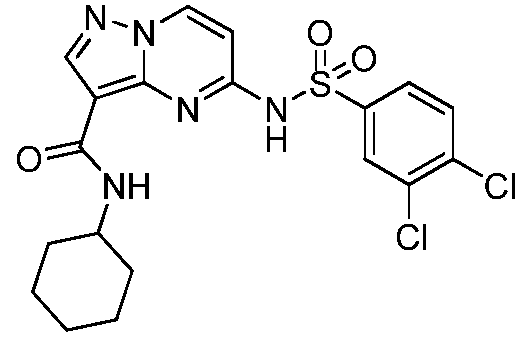

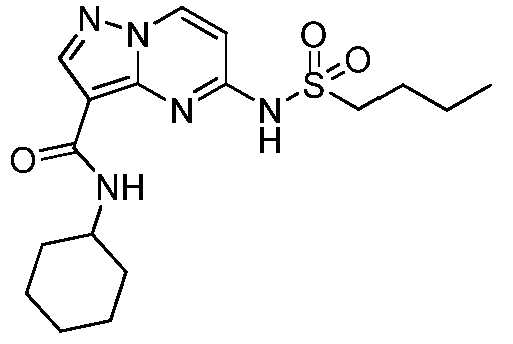
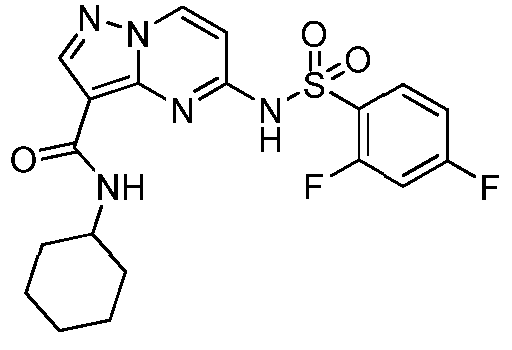
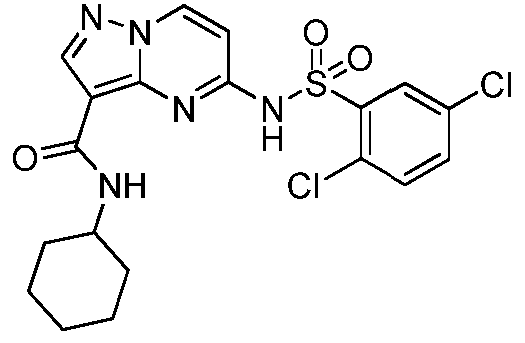
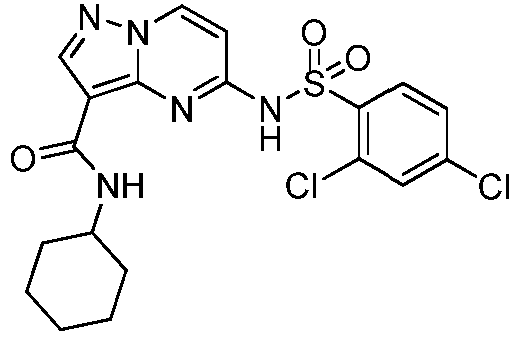
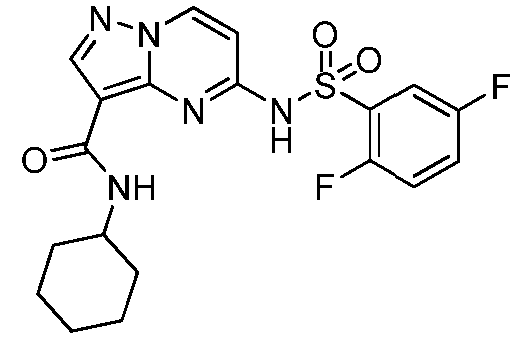

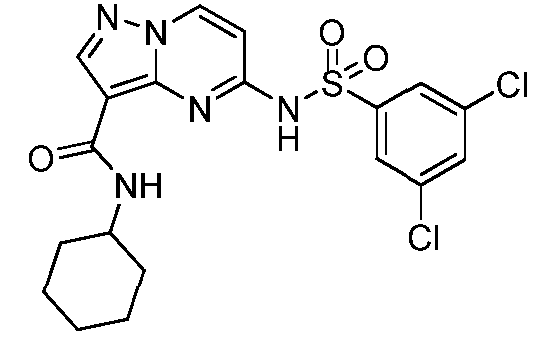
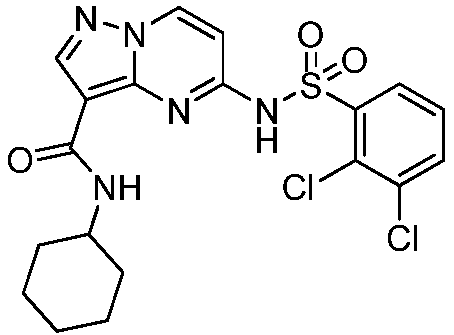
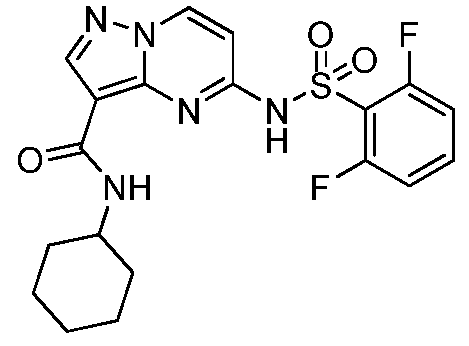
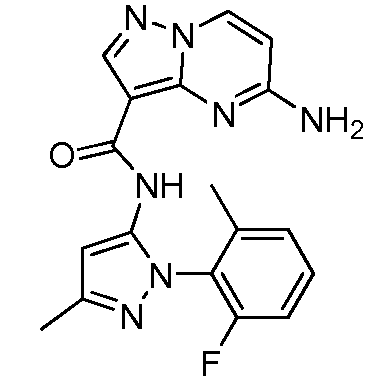
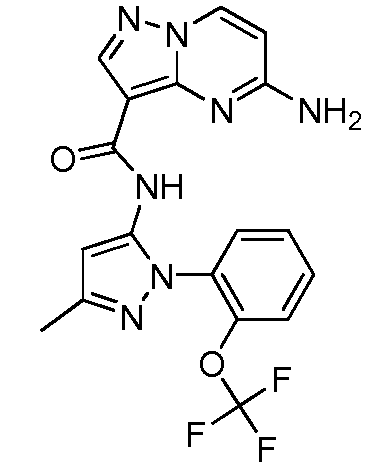
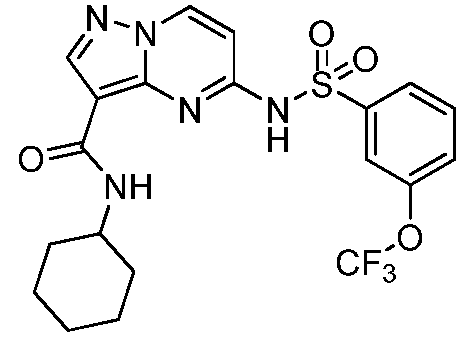
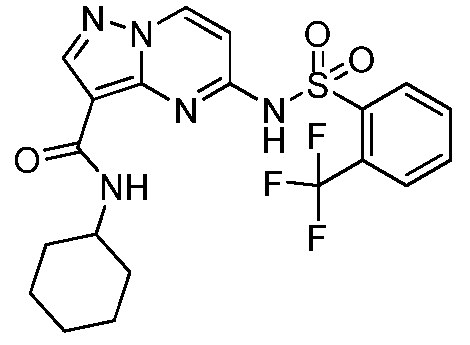
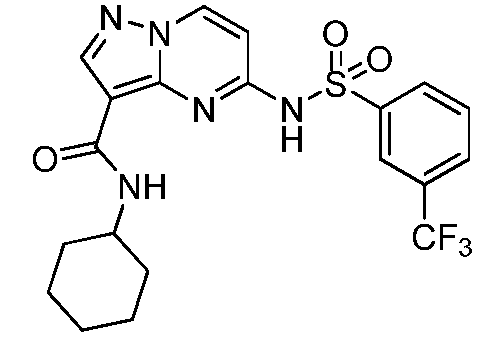

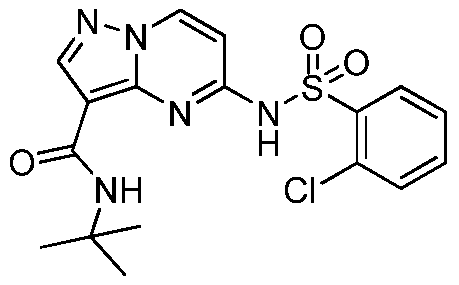
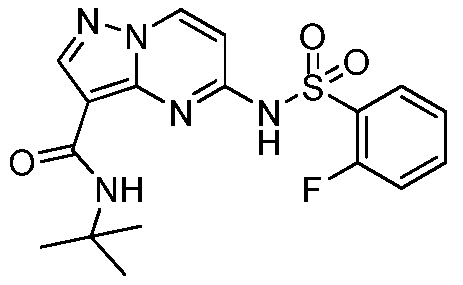
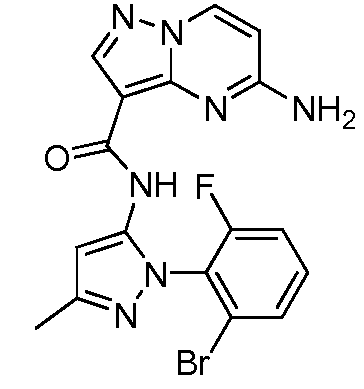
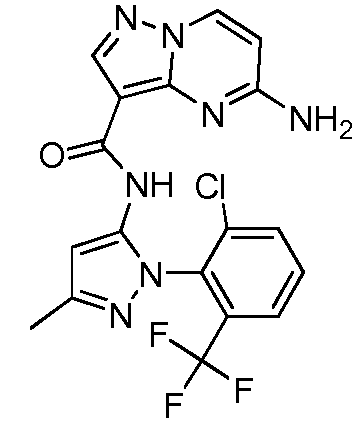
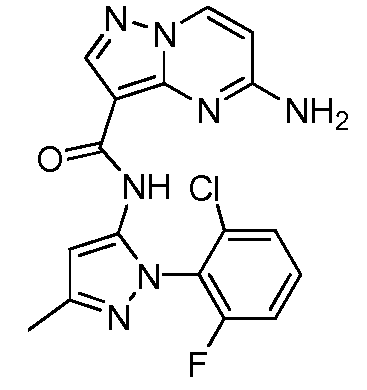



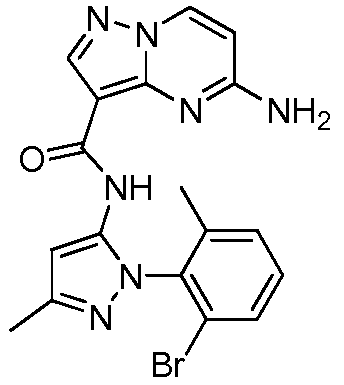
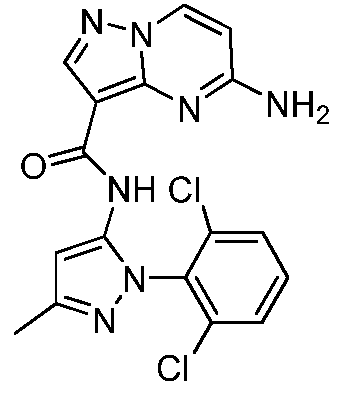

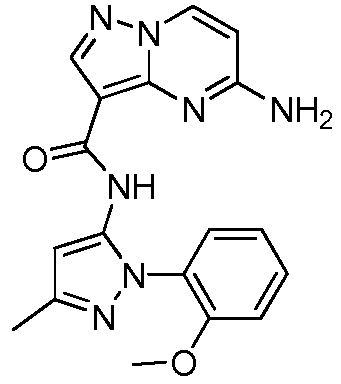
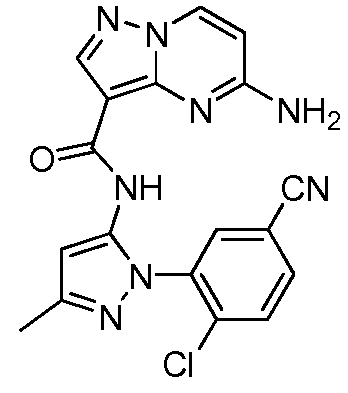
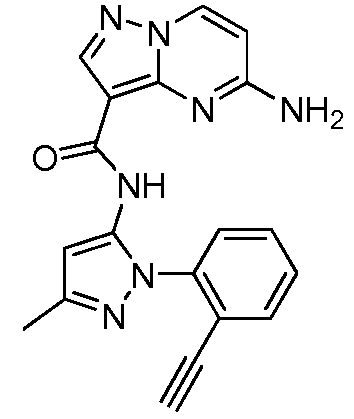
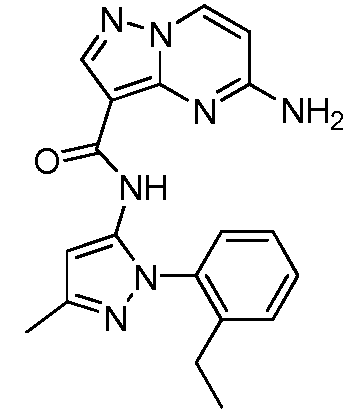


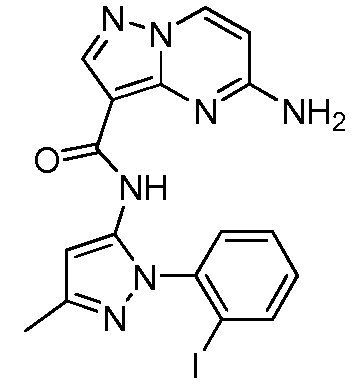

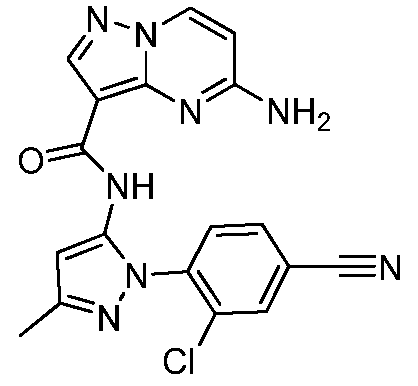
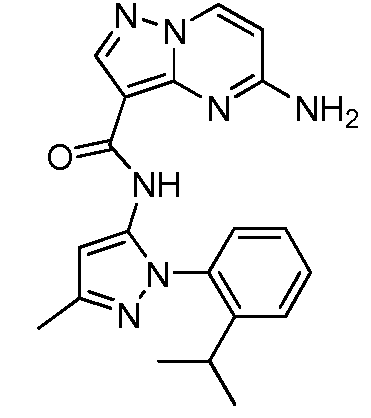



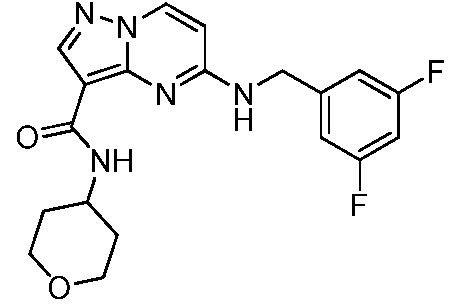
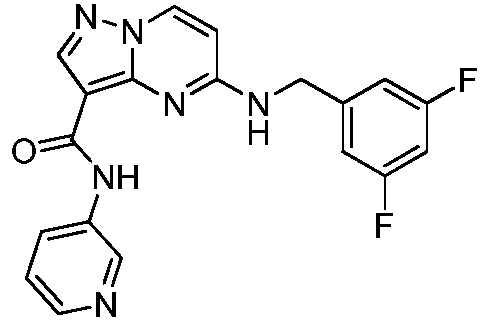
Соединения Примеров 1-452 были испытаны на их способность ингибировать активность JAK киназы. Соединения Примеров 1-452, как было обнаружено, имеют Ki меньше чем около 1 мкМ в анализах активности JAK киназы (например, см. Примеры A-C). Соединения по настоящему изобретению поэтому являются полезными в качестве ингибиторов JAK киназы.
В Таблице 3 ниже представлены данные ферментативной активности (Ki) для некоторых соединений по настоящему изобретению, испытанных в описанных выше анализах (Примеры A-C).
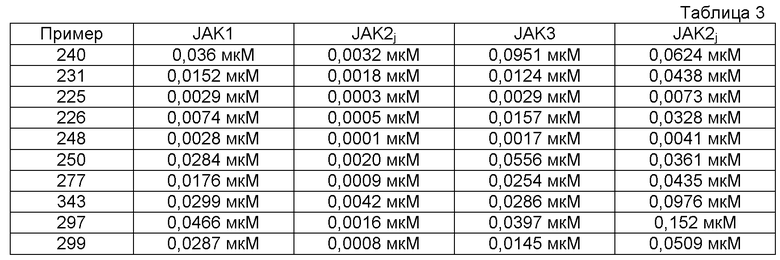
В Таблице 4 ниже представлены некоторые данные клеточного анализа фармакологической активности (EC50) для соединений по настоящему изобретению, испытанных в описанных выше клеточных анализах (Пример D).

Хотя настоящее изобретение было описано и проиллюстрировано в некоторой степени конкретно, должно быть понятно, что настоящее раскрытие представлено только в качестве примера, и что специалисты в данной области могут осуществить различные изменения в комбинации и расположении частей, без отступления от сути и объема настоящего изобретения, определяемого формулой изобретения.
Делается ссылка на Временную заявку США, серийный № 61/110497, поданную 31 октября 2008 года, которая включена в настоящую заявку посредством ссылки во всей полноте для всех целей.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИАЗОЛОПИРИДИНОВЫЕ СОЕДИНЕНИЯ-ИНГИБИТОРЫ JAK И СПОСОБЫ | 2009 |
|
RU2561104C2 |
| ТРИАЗОЛПИРИДИНОВЫЕ СОЕДИНЕНИЯ, ИНГИБИРУЮЩИЕ JAK, И СПОСОБЫ | 2009 |
|
RU2560153C2 |
| ИНГИБИРУЮЩИЕ JAK СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИМИДИНА И СПОСОБЫ | 2010 |
|
RU2567238C2 |
| ИНГИБИРУЮЩИЕ JAK СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИМИДИНА И СПОСОБЫ | 2010 |
|
RU2675857C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PRMT5 | 2018 |
|
RU2797822C2 |
| АРИЛЬНЫЕ, ГЕТЕРОАРИЛЬНЫЕ И ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ОПОСРЕДОВАННЫХ КОМПЛЕМЕНТОМ РАССТРОЙСТВ | 2015 |
|
RU2707749C2 |
| ПИРАЗОЛО[1,5-A]ПИРИМИДИНИЛКАРБОКСАМИДЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ | 2017 |
|
RU2799332C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ НЕКОТОРЫХ ЛЕЙКОЗОВ | 2019 |
|
RU2804709C2 |
| ПРОИЗВОДНОЕ N-(АЗААРИЛ)ЦИКЛОЛАКТАМ-1-КАРБОКСАМИДА, МЕТОД ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2765785C2 |
| ТЕРАПЕВТИЧЕСКИ АКТИВНЫЕ ПРОИЗВОДНЫЕ ОКСАЗОЛИНА | 2013 |
|
RU2656209C2 |
Изобретение относится к новым соединениям формулы Ia, их стереомерам или фармацевтически приемлемым солям, ингибирующим активность JAK киназы. Соединения могут найти применение при лечении воспалительных заболеваний, таких как ревматоидный артрит, псориаз, контактный дерматит, при лечении аутоиммунных заболеваний, таких как волчанка, рассеянный склероз, нейродегенеративных заболеваний, таких как болезнь Альцгеймера, и др. В формуле Ia
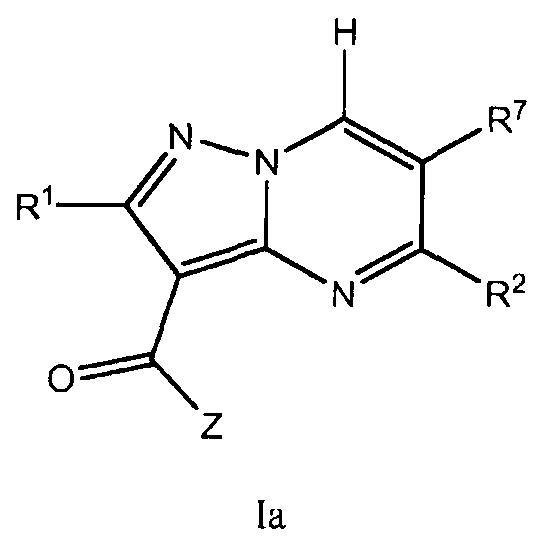
R1 представляет собой Н; R2 представляет собой -OR4, -NR3R4- или -NR3S(О)2R4; R3 представляет собой Н или C1-C6алкил, где указанный алкил необязательно замещен ORa; R4 представляет собой Н, C1-C6алкил, -(C0-C5алкил)(С3-C6циклоалкил), -(C0-C5алкил)(C4-C5гетероарил), где гетероарил содержит 1-2 атома азота в качестве гетероатомов, или -(C0-C5алкил)(C6арил), где указанный алкил необязательно замещен группой R8 и указанные арил, циклоалкил и гетероарил необязательно замещены группой R9; или R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют C3гетероциклил, содержащий 1 атом азота в качестве гетероатома, необязательно замещенный группой R13; Z представляет собой -NR5R6; R5 представляет собой Н; R6 представляет собой Н, C1-С10алкил, -(С0-С5алкил)(C4-C5гетероциклил), где гетероциклил содержит атом кислорода в качестве гетероатома, -(C0-C5алкил)(С3-С8циклоалкил), -(C0-C5алкил)(С3-С5гетероарил), где гетероарил содержит 1 атом азота или 1 атом кислорода или содержит 2 атома, выбранных из кислорода, азота и серы, в качестве гетероатомов, -(С0-С5алкил)(С6арил), где указанный алкил необязательно замещен группой R10, и указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены группой R11; R7 представляет собой Н; R8 и R10 каждый независимо представляет собой галоген или ORa; R9 независимо представляет собой -CN, -CF3, галоген, -С(О)ORa, -C(O)NRaRb, -(C0-C5алкил)NRaRb, -(C0-C5алкил)ORa, -(C0-C5алкил)SRa, -О[С(Ra)2]1-3О-, C1-С3алкил, необязательно замещенный F, -(C0-C5алкил)(С3-С6циклоалкил), необязательно замещенный группой оксо или F, -(C0-C5алкил)С3-С6гетероциклил, где гетероциклил содержит 1-2 гетероатома, выбранных из атомов кислорода и азота, и где гетероциклил необязательно замещен галогеном или C1-С3алкилом, -(C0-C5алкил)C6арил, необязательно замещенный галогеном, или -(C0-C5алкил)C4-C5гетероарил, где гетероарил содержит 1 атом азота или 1 атом кислорода или содержит 2 атома, выбранных из атомов кислорода, азота и серы в качестве гетероатомов, и где гетероарил необязательно замещен галогеном или C1-С3алкилом; R10 независимо представляет собой галоген или ORa. Другие значения радикалов указаны в формуле изобретения. 3 н. и 12 з.п. ф-лы, 4 табл., 452 пр.
1. Соединение формулы Ia

его стереоизомеры или фармацевтически приемлемые соли,
где:
R1 представляет собой Н;
R2 представляет собой -OR4, -NR3R4- или -NR3S(О)2R4;
R3 представляет собой Н или C1-C6алкил, где указанный алкил необязательно замещен ORa;
R4 представляет собой Н, C1-C6алкил, -(C0-C5алкил)(С3-C6циклоалкил), -(C0-C5алкил)(C4-C5гетероарил), где гетероарил содержит 1-2 атома азота в качестве гетероатомов, или -(C0-C5алкил)(C6арил), где указанный алкил необязательно замещен группой R8 и указанные арил, циклоалкил и гетероарил необязательно замещены группой R9; или
R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют C3гетероциклил, содержащий 1 атом азота в качестве гетероатома, необязательно замещенный группой R13;
Z представляет собой -NR5R6;
R5 представляет собой Н;
R6 представляет собой Н, C1-С10алкил, -(С0-С5алкил)(C4-C5гетероциклил), где гетероциклил содержит атом кислорода в качестве гетероатома, -(C0-C5алкил)(С3-С8циклоалкил), -(C0-C5алкил)(С3-С5гетероарил), где гетероарил содержит 1 атом азота или 1 атом кислорода или содержит 2 атома, выбранных из кислорода, азота и серы, в качестве гетероатомов, -(С0-С5алкил)(С6арил), где указанный алкил необязательно замещен группой R10, и указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены группой R11;
R7 представляет собой Н;
R8 независимо представляет собой галоген или ORa;
R9 независимо представляет собой -CN, -CF3, галоген, -С(О)ORa, -C(O)NRaRb, -(C0-C5алкил)NRaRb, -(C0-C5алкил)ORa, -(C0-C5алкил)SRa, -О[С(Ra)2]1-3О-, C1-С3алкил, необязательно замещенный F, -(C0-C5алкил)(С3-С6циклоалкил), необязательно замещенный группой оксо или F, -(C0-C5алкил)С3-С6гетероциклил, где гетероциклил содержит 1-2 гетероатома, выбранных из атомов кислорода и азота, и где гетероциклил необязательно замещен галогеном или C1-С3алкилом, -(C0-C5алкил)C6арил, необязательно замещенный галогеном, или -(C0-C5алкил)C4-C5гетероарил, где гетероарил содержит 1 атом азота или 1 атом кислорода или содержит 2 атома, выбранных из атомов кислорода, азота и серы в качестве гетероатомов, и где гетероарил необязательно замещен галогеном или C1-С3алкилом;
R10 независимо представляет собой галоген или ORa;
R11 независимо представляет собой -CN, -CF3, галоген, -O[C(Ra)2]1-3O-, -С(О)ORa, -C(O)NRaRb, -(C0-C5алкил)ORa, C1-C6алкил, необязательно замещенный группой оксо или F, -(C0-C5алкил)C4-C5гетероциклил, где гетероциклил содержит 1 атом азота или 1 атом серы в качестве гетероатомов и где гетероциклил необязательно замещен галогеном, оксо или C1-С3алкилом, -(C0-C5алкил)C4-C5гетероарил, где гетероарил содержит 1 атом азота или 1 атом кислорода или содержит 2 атома, выбранных из атомов кислорода, азота и серы в качестве гетероатомов, и где гетероарил необязательно замещен галогеном или C1-С3алкилом, -(C0-C5алкил)фенил, необязательно замещенный C1-C4алкилом, C2-C4алкинилом, С3-С6циклоалкилом, -CF3, галогеном, -CN, -ORa или -NRaRb, или -(C0-C5алкил)С3-С6циклоалкил, необязательно замещенный C1-С3алкилом;
R13 представляет собой С6арил;
Ra и Rb независимо представляют собой Н, -CF3, C1-C6алкил, С6арил, С3-С6циклоалкил или C4-C5гетероциклил, где гетероциклил содержит 1-2 гетероатома, выбранных из атомов кислорода и азота; где указанные алкил, арил и циклоалкил необязательно замещены C1-C4алкилом, -(С0-С3алкил)ORc, галогеном или NRcRd; или
Ra и Rb вместе с атомом азота, с которым они связаны, образуют С4-С5гетероциклил, где гетероциклил содержит 1-2 гетероатома, выбранных из атомов кислорода и азота, и где гетероциклил необязательно замещен C1-С3алкилом или -С(О)ORa; и
Rc и Rd независимо представляют собой Н или C1-С3алкил.
2. Соединение по п.1, выбранное из формулы I
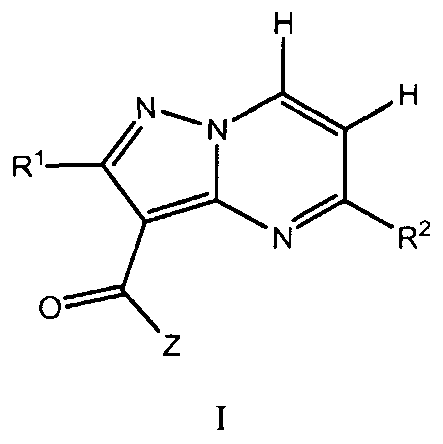
его стереоизомеры или фармацевтически приемлемые соли,
где:
R1 представляет собой Н;
R2 представляет собой -OR4 или -NR3R4;
R3 представляет собой Н или C1-C6алкил, где указанный алкил необязательно замещен ORa;
R4 представляет собой Н, C1-C6алкил, -(C0-C5алкил)(С3-C6циклоалкил), -(C0-C5алкил)(C4-C5гетероарил), где гетероарил содержит 1-2 атома азота в качестве гетероатомов, или (C0-C5алкил)(С6 арил), где указанный алкил необязательно замещен F или ORa, и указанные арил, циклоалкил и гетероарил необязательно замещены
-CN, -CF3, галогеном, -С(О)ORa, -C(O)NRaRb, -(C0-C5алкил)NRaRb, -(C0-C5 алкил)ORa, -О[С(Ra)2]1-3О-,
C1-С3алкилом, необязательно замещенным F,
-(C0-C5алкил)С3-С6гетероциклилом, где гетероциклил содержит 1-2 гетероатома, выбранных из атомов кислорода и азота, и где гетероциклил необязательно замещен галогеном или C1-С3алкилом, или
-(C0-C5алкил)C4-C5гетероарилом, где гетероарил содержит 1 атом азота или 1 атом кислорода или содержит 2 атома, выбранных из атомов кислорода, азота и серы в качестве гетероатомов, и где гетероарил необязательно замещен галогеном или C1-С3алкилом; или
R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют С3гетероциклил, содержащий 1 атом азота в качестве гетероатома;
Z представляет собой -NR5R6;
R5 представляет собой Н;
R6 представляет собой Н, C1-С10алкил, -(C0-C5алкил)(C4-C5гетероциклил), где гетероциклил содержит атом кислорода в качестве гетероатома, -(C0-C5алкил)(С3-С8циклоалкил), -(C0-C5алкил)(С3-C5гетероарил), где гетероарил содержит 1 атом азота или 1 атом кислорода или содержит 2 атома, выбранных из атомов кислорода, азота и серы в качестве гетероатомов, или -(C0-C5алкил)(C6арил), где указанный алкил необязательно замещен F или ORa, и указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены
-CN, -CF3, галогеном, -О[С(Ra)2]1-3О-, -С(О)ORa, -С(O)NRaRb, -(C0-C5алкил)ORa,
C1-C6алкилом, необязательно замещенным группой оксо или F,
-(C0-C5алкил)C4-C5гетероциклилом, где гетероциклил содержит 1 атом азота или 1 атом серы в качестве гетероатомов и где гетероциклил необязательно замещен галогеном, оксо или C1-С3алкилом,
-(C0-C5алкил)C4-C5гетероарилом, где гетероарил содержит 1 атом азота или 1 атом кислорода или содержит 2 атома, выбранных из атомов кислорода, азота и серы в качестве гетероатомов, и где гетероарил необязательно замещен галогеном или C1-С3алкилом,
-(C0-C5 алкил)фенилом, который необязательно замещен C1-С3алкилом, -CF3, галогеном, -CN, -ORa или -NRaRb, или
-(C0-C5алкил)С3-С6циклоалкилом, который необязательно замещен C1-С3алкилом;
Ra и Rb независимо представляют собой Н, -CF3, C1-C6алкил, C6арил, С3-C6циклоалкил или С4-С5гетероциклил, где гетероциклил содержит 1-2 гетероатома, выбранных из атомов кислорода и азота; где указанные алкил, арил и циклоалкил необязательно замещены C1-C4алкилом, (С0-С3алкил)ORc, галогеном или NRcRd; или
Ra и Rb вместе с атомом азота, с которым они связаны, образуют C4-C5гетероциклил, где гетероциклил содержит 1-2 гетероатома, выбранных из атомов кислорода и азота, и где гетероциклил необязательно замещен C1-С3алкилом или -С(О)ORa; и
Rc и Rd независимо представляют собой Н или C1-С3алкил.
3. Соединение по пп.1, 2, где R2 представляет собой -NHR4.
4. Соединение по п.1, где R2 представляет собой -NH2.
5. Соединение по п.1, где R4 представляет собой C1-C6алкил, -(C0-C5алкил)(С3-С6циклоалкил), -(C0-C5алкил)(C4-C5гетероарил), где гетероарил содержит 1-2 атома азота в качестве гетероатомов, -(C0-C5алкил)(C6арил), где указанный алкил необязательно замещен группой R8, и указанные арил, циклоалкил и гетероарил необязательно замещены группой R9.
6. Соединение по п.1, где R3 и R4, взятые вместе с атомом азота, с которым они связаны, образуют С3гетероциклил, содержащий 1 атом азота в качестве гетероатома, необязательно замещенный группой R13.
7. Соединение по п.1, где R2 представляет собой -NHS(O)2R4.
8. Соединение по пп.1 и 7, где R4 представляет собой -(C6арил), необязательно замещенный группой R9.
9. Соединение по п.1, где Z представляет собой -NHR6.
10. Соединение по п.1, где R6 представляет собой C1-С10алкил, -(C0-C5алкил)(C4-C5гетероциклил), где гетероциклил содержит атом кислорода в качестве гетероатома, -(C0-C5алкил)(С3-C8циклоалкил), -(C0-C5алкил)(С3-С5гетероарил), где гетероарил содержит 1 атом азота или 1 атом кислорода или содержит 2 атома, выбранных из атомов кислорода, азота и серы в качестве гетероатомов, -(C0-C5алкил)(С6арил), где указанный алкил необязательно замещен группой R10, и указанные арил, циклоалкил, гетероарил и гетероциклил необязательно замещены группой R11.
11. Соединение по п.1, где R2 представляет собой -NR3S(O)2R4; R3 представляет собой Н; и R4 представляет собой фенил, необязательно замещенный 1-3 заместителями, выбранными из C1-С3алкила, -CF3 и галогена; и R6 представляет собой циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил и где R6 необязательно замещен 1-3 заместителями, выбранными из галогена и C1-C6алкила.
12. Соединение по п.1, где R2 представляет собой -NR3R4; R3 представляет собой Н; R6 представляет собой пиразолил, замещенный фенилом и необязательно дополнительно замещенный метилом, и где указанный фенил необязательно замещен одним или двумя заместителями, выбранными из метила, галогена, метокси, циано, трифторметила, гидрокси и трифторметокси.
13. Фармацевтическая композиция, обладающая способностью ингибирования JAK киназы, включающая терапевтически эффективное количество соединения по любому из пп.1-12 и фармацевтически приемлемый носитель, адъювант или наполнитель.
14. Способ лечения или уменьшения тяжести заболевания или состояния, реагирующего на ингибирование активности JAK киназы, включающий введение терапевтически эффективного количества соединения по пп.1-12.
15. Соединение по п.1, обладающее способностью ингибирования JAK киназы, для получения лекарственного средства для лечения заболевания, опосредованного активностью JAK киназы.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| RU2006143571A,27.07.2008 | |||
Авторы
Даты
2015-01-20—Публикация
2009-11-02—Подача