ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению модифицирующих транскриптом агентов для содействия в лечении злокачественностей путем предотвращения злокачественных клеток от реализации генетических изменений, необходимых для противостояния повреждению клеток и выживаемости при химиотерапии или радиотерапии, более конкретно оно относится к комбинированному применению модифицирующих транскриптом агентов, ингибирующих механизм метилирования ДНК и дезацетилирование гистонов, и еще более конкретно оно относится к применению в комбинации посредством набора для лечения, содержащего гидралазин и вальпроевую кислоту или любую ее соль, например вальпроат магния, для содействия в лечении рака вместе с химиотерапией или радиотерапией.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рак или злокачественности можно классифицировать как солидные или гемопоэтические. Примеры первых включают, среди прочих, рак, такой как рак молочной железы, головы и шеи, ободочной и прямой кишки. Примеры гематологического типа включают лейкоз и лимфомы. ДНК в ядре клетки расположена в хроматине и имеет несколько уровней порядка. Составной единицей хроматина является нуклеосома, состоящая из октамерных ядерных белков, известных как гистоны, на которые наматывается ДНК. Расположение или упаковка ДНК в нуклеосомах играет важную роль в генной регуляции. Ковалентные видоизменения гистонов, такие как ацетилирование, имеют основную роль в отношении регуляции хроматина и генной экспрессии (Cho KS, Etizondo LI, Boerkoel CF: Advances in chromatin remodeling and human disease. Curr Opin Genet Dev 2004; 14: 308-15).
В настоящее время рак остается важной мировой проблемой здравоохранения. Согласно Международному агентству по изучению рака и Международной организации здравоохранения, заболеваемость этой болезнью значительно увеличивается, оценка показывает, что в 2000 году наблюдалось 10 миллионов новых случаев, а через 20 лет их будет 15 миллионов. (Mignogna MD, Fedele S, Russo LL. The World Cancer Report and the burden of oral cancer. Eur J Cancer Prev. 2004; 13: 139-42). С другой стороны, выживаемость пациентов, страдающих от наиболее распространенных типов рака, таких как рак легкого, предстательной железы и молочной железы за последние годы определенно улучшилась. Пятилетняя выживаемость составляла 50% в 1974 году, а в период от 1992 до 1999 года она увеличилось до 63% (Jemal A, Murray Т, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ. Cancer statistics, 2005. CA Cáncer J Clin. 2005; 55: 10-30).
Хотя прогресс в формах лечения позволил получить незначительные преимущества относительно выживаемости, результаты все еще далеки от того, чтобы быть оптимальными. В настоящее время химиотерапия вместе с хирургией и радиотерапией все еще являются основными принципами лечения, так как огромное большинство пациентов, больных раком, нуждаются в этой форме терапии.
Обширные знания, полученные в последние годы в области молекулярной природы рака, предоставили возможность разрабатывать новые формы терапии, направленные в основном на блокирование функции онкогенов или реактивирование экспрессии супрессивных генов. Примерами таких работ является применение моноклональных антител против некоторых онкогенных рецепторов, таких как EGFR, HER2 и так далее. В случае супрессивных генов, некоторыми работами в области терапии являются применение рекомбинантного аденовируса, укрывающего кодирующий ген для функционального продукта р53 (Hermiston TW, Kirn DH. Genetically based therapeutics for cancer: similarities and contrasts with traditional drug discovery and development. Mot Ther. 2005; 11: 496-507).
Вообще, авторы изобретения могут напомнить о такой новой форме терапии рака, как направленной на единственный генный продукт, или терапии единственного гена. Однако этот подход имеет серьезные недостатки, так как геном злокачественных клеток является очень легко приспосабливаемым, и так как природа рака является многостадийной, поэтому не существует единственного генетического изменения, ответственного за развитие злокачественного фенотипа. Это означает, что хотя блокирование или реституция гена или его продукта может привести к важному противоопухолевому эффекту, указанный эффект не будет поддержан, так как со всей определенностью злокачественная клетка в конечном счете будет вырабатывать сопротивляемость против указанной терапии, поскольку злокачественная клетка будет увеличивать или уменьшать экспрессию генов и тем самым может приспособиться к эффекту, вызванному указанной терапией (Ross JS, Schenkein DP, Pietrusko R, Rolfe M, Linette GP, Stec J, Stagliano NE, Ginsburg GS, Symmans WF, Pusztai L, Hortobagyi GN. Targeted therapies for cancer 2004. Am J Clin Pathol. 2004; 122: 598-609).
В настоящее время хорошо известно, что злокачественные клетки имеют множественные дефекты, а именно мутации, делеции, дупликации, амплификации, а также эпигенетические изменения, причем последние являются стабильными функциональными изменениями в основном благодаря видоизменениям хроматина, из которых двумя наиболее важными изменениями являются метилирование ДНК и ацетилирование гистонов. Эпигенетические изменения должны иметь определенный характер и действовать в полном функциональном соответствии для поддержания "злокачественного гомеостаза". Эта концепция является очень важной, так как все дефекты злокачественных клеток не являются простым сложением, это согласуется с фактом, что белки, кодируемые генами, играют множественные роли в сетях комплексных и взаимодействующих функций, контролирующих положительную и отрицательную обратную связь. Кроме того, в многостадийном процессе, который имеет место при генерации опухоли, клетка должна сохраняться в устойчивом состоянии между положительными и отрицательными сигналами как по онкогенным путям, так и от супрессивных генов для обеспечения того, чтобы процессы пролиферации и смерти клеток происходили согласно динамике злокачественного состояния (Weinstein IB. Cancer. Addiction to oncogenes - the Achilles heat of cancer. Science. 2002; 297 (5578): 63-4).
Кроме внутренней сложности глобальной генной экспрессии злокачественных клеток, картина становится гораздо более сложной при попытке регулирования генной экспрессии как результата экзогенных стимулов, в частности вследствие химиотерапевтического и или радиотерапевтического эффекта. Химиотерапия и радиотерапия вызывают мгновенные изменения транскрипции генов, и эти изменения происходят не только в тех генах, которые в основном отвечают за канцерогенные процессы, но также и в генах, которые не принимают непосредственного участия, например занятых в метаболизме, транспорте и так далее (Alaoui-Jamali MA, Dupre I, Qiang H. Prediction of drug sensitivity and drug resistance in cancer by transcriptional and proteomic profiling. Drug Resist Updat. 2004:7: 245-55). Наиболее важный аспект, однако, заключается в том, что только те клетки, которые способны иметь адекватный транскрипционный ответ на вредный стимул, являются единственными клетками, которые будут выживать после повреждения. Ясно, что для того чтобы этот ответ "адаптироваться" к выживанию произошел, необходимо, чтобы эпигенетические механизмы, регулирующие транскрипцию, были нетронутыми. Поэтому, если злокачественная клетка находится под влиянием модифицирующих транскриптом агентов, транскрипционный сигнал, необходимый для выживания, не произойдет, и клетка, возможно, приобретет необратимые функциональные изменения или претерпит апоптоз. Транскрипцию эукариотических клеток можно определить как способность упомянутых клеток экспрессировать биологически активные белки. Поэтому транскрипция представляет собой очень регулируемое явление. Процесс начинается на генном уровне и заканчивается на уровне белка и включает в себя много стадий, следовательно, транскрипция имеет несколько уровней регулирования, среди которых есть следующие: 1) хроматиновая структура, являющаяся физической конструкцией ДНК, что включает уровень хроматиновой упаковки, определяющий способность регуляторных белков связываться с генными регуляторными и промоторными областями, 2) контроль инициации транскрипции, 3) транспорт транскрипта, 4) обработка транскрипта и модифицирование, 5) стабильность транскрипта, 6) инициация трансляции, 7) посттрансляционные изменения и 8) транспорт и стабильность белка. (Archambault J, Friesen JD. Genetics of eukaryotic RNA polymerases I, II, and III. Microbiol Rev. 1993; 57: 703-24). Несомненно, транскрипционные эффекты будут более важными при их действии на более высоком уровне регулирования транскрипции. Таким образом, модифицирующие транскриптом агенты путем действия на самом высоком уровне регулирования транскрипции будут иметь наибольшее влияние на общую генную экспрессию.
Ковалентные видоизменения гистонов, такие как ацетилирование и метилирование ДНК, играют существенную роль в определении степени хроматиновой упаковки и в конечном итоге в определении общей генной экспрессии, вследствие чего агенты, ингибирующие метилирование ДНК и дезацетилирование гистонов продемонстрировали способность значительно изменять экспрессию. Потеря метилирования могла бы уменьшить количество протеиновых комплексов, связанных с метилированными доменами в некоторых положениях, приводя к снижению активности гистондезацетилаз, которые должны были бы ингибировать агенты, ингибирующие гистондезацетилазу. Также потеря комплексов, подавляющих транскрипцию, может благоприятствовать ре-ассоциации генных промоторов с комплексами, активирующими транскрипцию, обладающими гистон-ацетилазной активностью. Известно, что наиболее распространенная форма ДНК метилтрансферазы (DNMT1) может непосредственно связываться с гистондезацетилазами, а также то, что амино-конец также обладает способностью связываться с корепрессорами (Nakao M. Epigenetics: interaction of DNA methylation and chromatin. Gene. 2001; 278: 25-31; Robertson KD. DNA methylation and chromatin -unraveling the tangled web. Oncogene. 2002; 21: 5361-79).
Несмотря на то, что были протестированы сотни потенциальных противоопухолевых агентов, лечение рака человека все еще требует внимания, при этом многие способы противоопухолевого лечения являются только частично эффективными с потенциальными возможностями в отношении проявления побочных эффектов практически на все системы. Поэтому существует потребность не только в том, чтобы иметь более эффективные терапевтические альтернативы, но также и в том, чтобы иметь несколько более специфических терапий, с помощью которых можно атаковать злокачественные клетки более селективным путем на уровне генной транскрипции. По этой причине одной из задач настоящего изобретения является предоставление композиции для содействия лечению рака на основе изменения транскриптома, посредством применения модифицирующих транскрипцию агентов, таких как гидралазан и магния вальпроат, благодаря которым клетки становятся неспособными выжить под воздействием вредных стимулов, индуцированных химиотерапией или радиотерапией.
Антигипертензивный агент гидралазин представляет собой ингибитор метилирования ДНК, который применяли в экспериментальных системах с целью гипометилирования Т клеток ДНК, что делает эти клетки аутореактивными (Yung R, Chang S, Hemati N, Johnson K, Richardson B. Mechanisms of drug-induced lupus. IV. Comparison of procainamide and hydralazine with analogs in vitro and in vivo. Arthritis Rheum. 1997; 40: 1436-43). Совсем недавно было показано, что гидралазин вызывает деметилирование промоторной области супрессивных генов и индуцирует их реактивацию на моделях in vitro и in vivo; а также то, что реактивированные генные продукты являются функциональными (Segura В, Trejo-Becerril С, Pérez E, Chavez A, Salazar AM, Lizano M,  Reactivation of tumor suppressor genes by the cardiovascular drugs hydralazine and procainamide and their potential use in cancer therapy. Clin Cancer Res. 2003; 9: 1596-603).
Reactivation of tumor suppressor genes by the cardiovascular drugs hydralazine and procainamide and their potential use in cancer therapy. Clin Cancer Res. 2003; 9: 1596-603).
Гидралазин оказывает прямые ингибирующие эффекты на ДНК метилтрансферазу и на модели in vitro, было показано, что два атома азота молекулы взаимодействуют с аминокислотами Lys162 и Arg240 активного сайта фермента, отвечающего за способности к деметилированию и реактивированию функции супрессивных генов (Angeles ЕЕ, Vazquez-Valadez, VH, Vasquez-Valadez О, Velazquez-Sanchez AM, Ramirez A, Martinez L, Diaz-Barriga S, Romero-Rojas A, Cabrera G,  Duenas- Gonzalez A: Computational studies of 1-hydrazinophthalazine (Hydralazine) as antineoplasic agent. Docking studies on methyltransferase. Letters Drug Design Discovery 2005; 4:282-286).
Duenas- Gonzalez A: Computational studies of 1-hydrazinophthalazine (Hydralazine) as antineoplasic agent. Docking studies on methyltransferase. Letters Drug Design Discovery 2005; 4:282-286).
Вальпроевая кислота или ее соли, как в случае вальпроата магния, известна также как VPA, 2-пропилпентановая кислота, является лекарственным средством, которое в течение многих лет использовалось в качестве противосудорожного средства с хорошим, как было показано, профилем безопасности (Perucca E: Pharmacological and therapeutic properties of valproate: a summary after 35 years of clinical experience. CNS Drugs 2002, 16: 695-714). Недавно было показано, что это лекарственное средство представляет собой ингибитор гистондезацетилаз. Ингибируемые ферменты представляют собой ферменты класса 1 и II семейства за исключением гистондезацетилаз 6 и 10. Гиперацетилирование гистонов НЗ и Н4, наблюдаемое in vitro и in vivo, сопровождает ферментный ингибирующий эффект в отношении этого семейства ферментов. Это действие на гистоны оказывает существенное влияние на индукцию дифференциации, индукцию апоптоза и ингибирование клеточной пролиферации (Gurvich N, Tsygankova ОМ, Meinkoth JL, Klein PS: Histone deacetylase is a target of valproic acid-mediated cellular differentiation. Cancer Res 2004, 64:1079-1086).
По этой причине еще одной задачей настоящего изобретения является предоставление набора для лечения, составленного из гидралазина и вальпроевой кислоты или любой из ее солей, например вальпроата магния, который способствует обычно используемой противораковой терапии.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
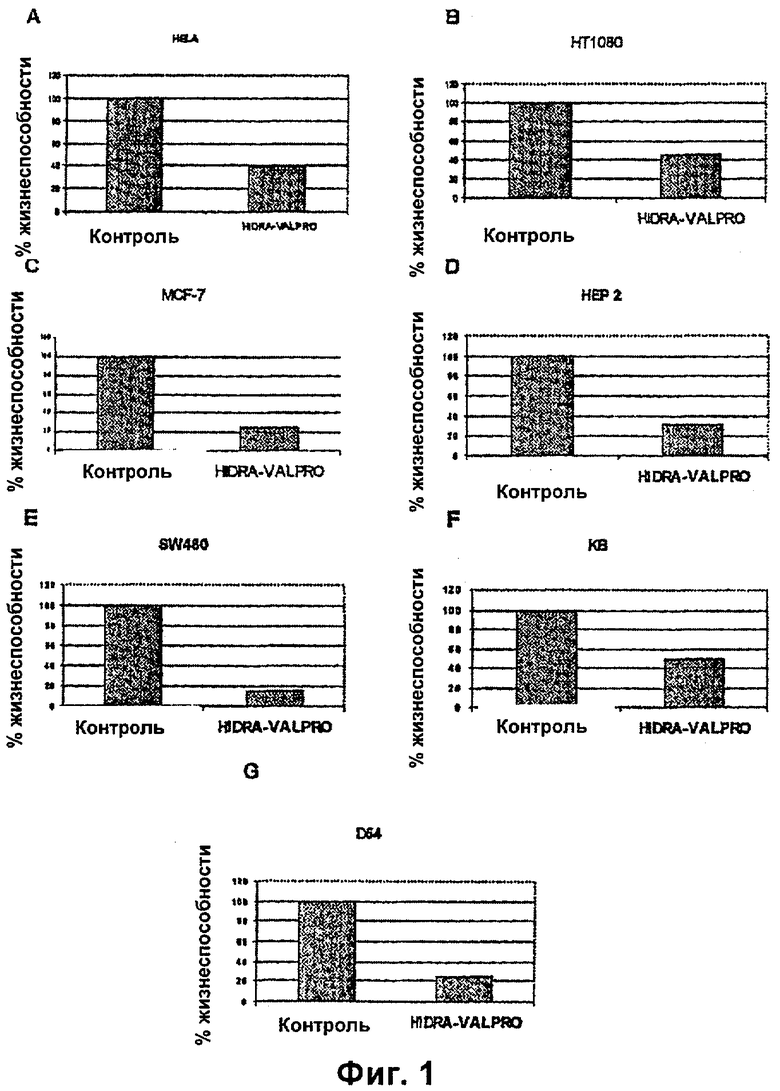
На фиг.1А, В, C, D, Е, F и G показан цитоксический эффект на различные линии злокачественных клеток, обработанные модифицирующей транскриптом композицией по настоящему изобретению.
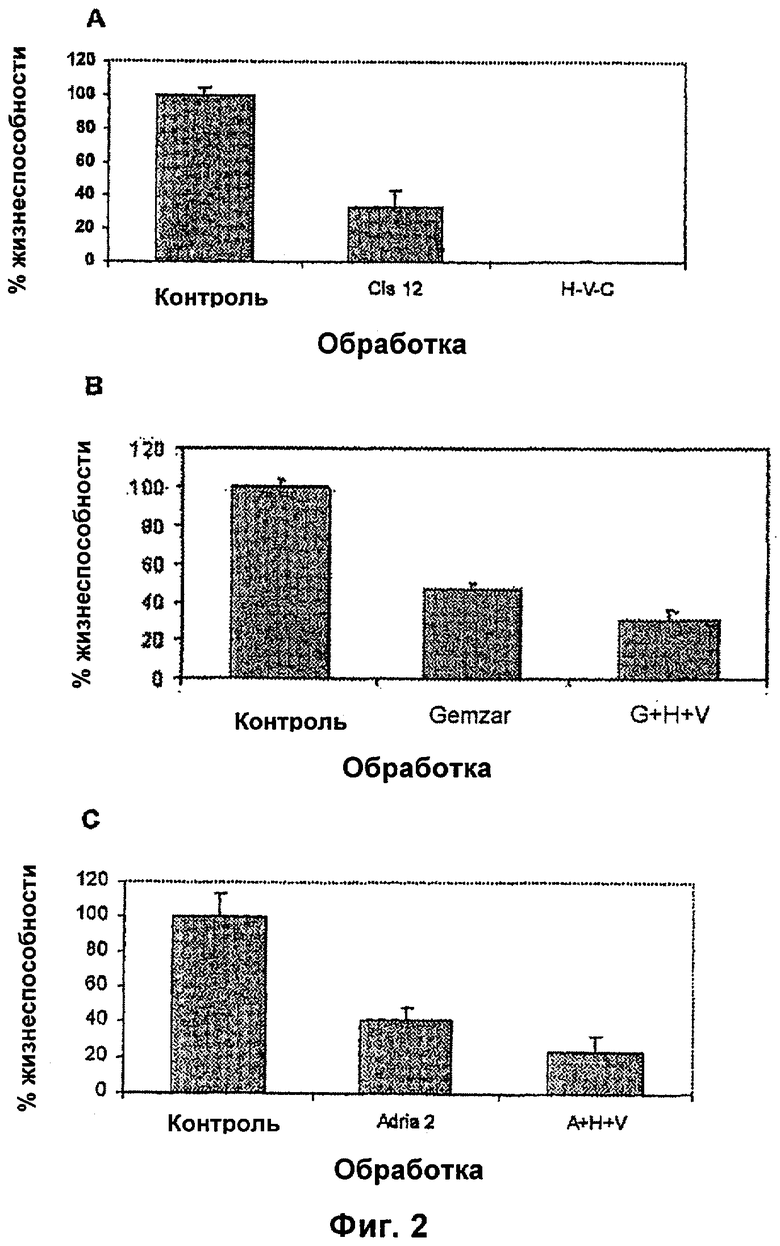
На фиг.2А, В и С показано то, как модифицирующая транскриптом композиция по настоящему изобретению вызывает потенцирование цитотоксического эффекта репрезентативных химиотерапевтических агентов (цисплатина, доксорубицина и гемцитабина) на линию злокачественных клеток.
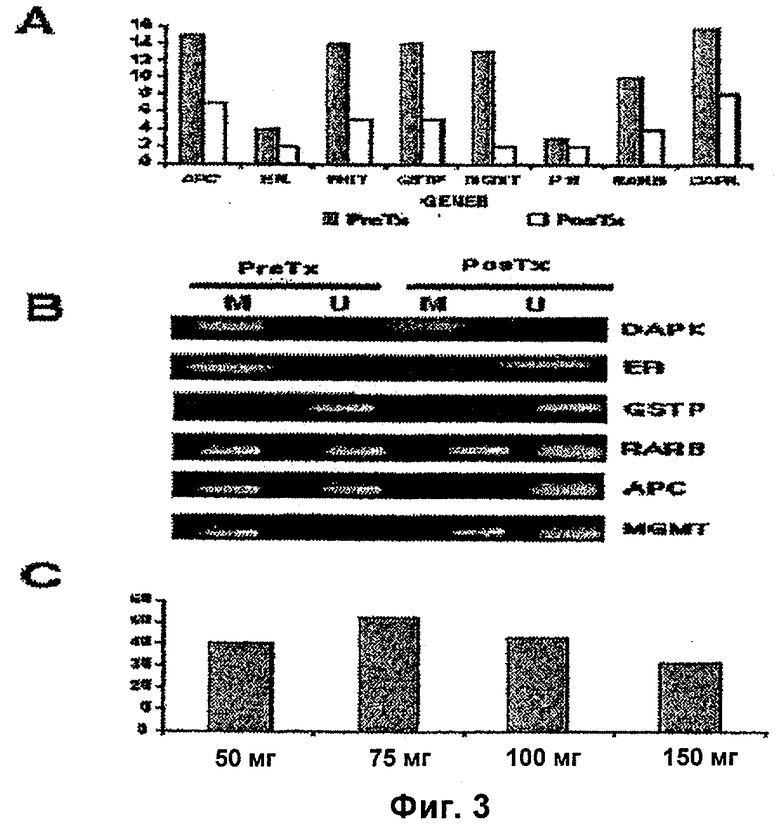
На фиг.3А показаны частоты метилирования каждого гена согласно настоящему изобретению.
На фиг.3В показаны репрезентативные случаи частот метилирования согласно настоящему изобретению.
На фиг.3С показана корреляция между процентом метилирования и дозой гидралазина согласно настоящему изобретению.
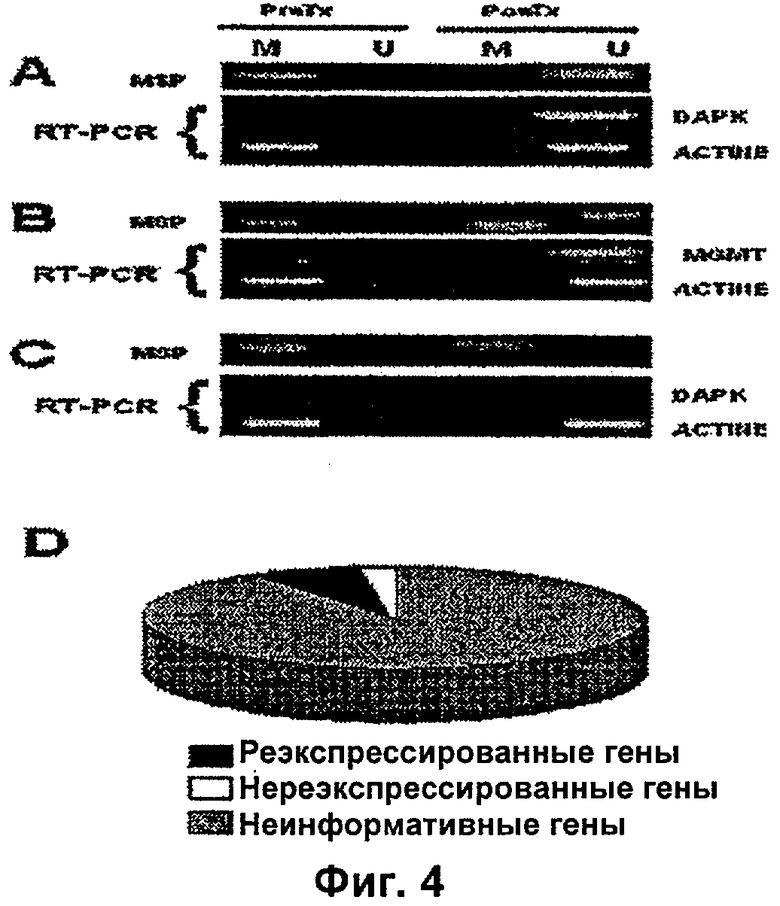
На фиг.4А, В и С показаны типичные случаи генной экспрессии мессенджера в биопсиях до и после обработки.
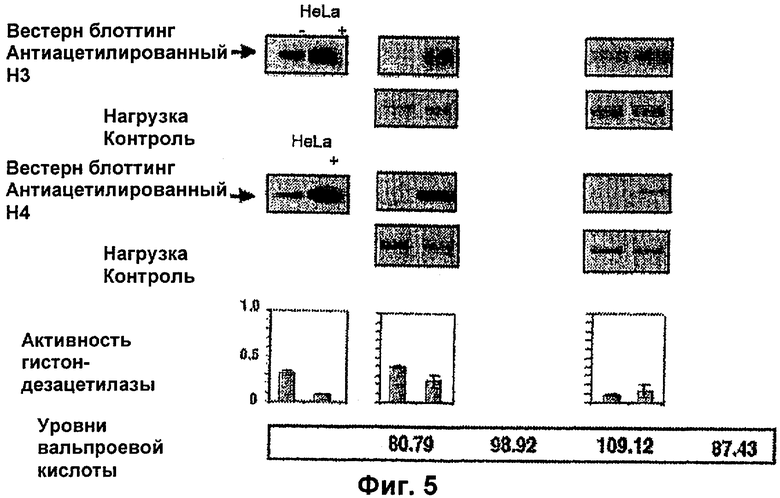
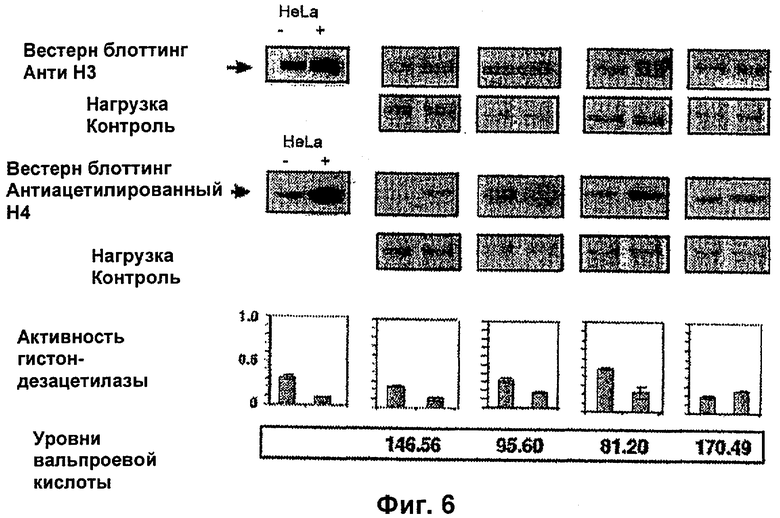
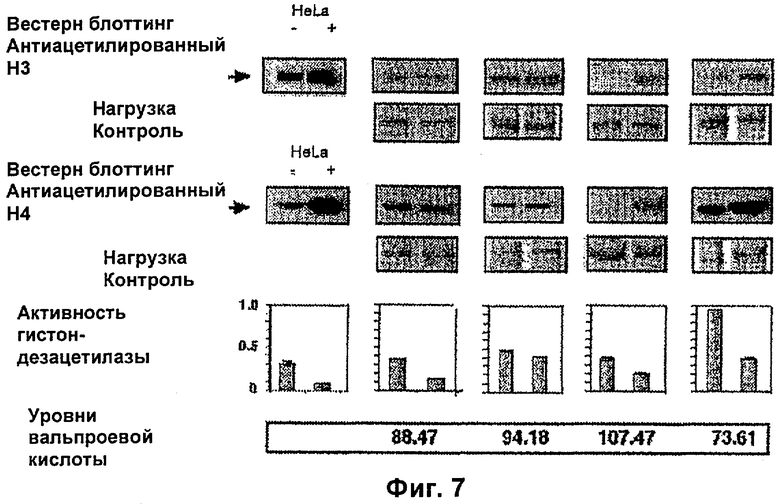
На фиг.5, 6 и 7 представлены данные по активности гистондезацетилазы согласно настоящему изобретению.
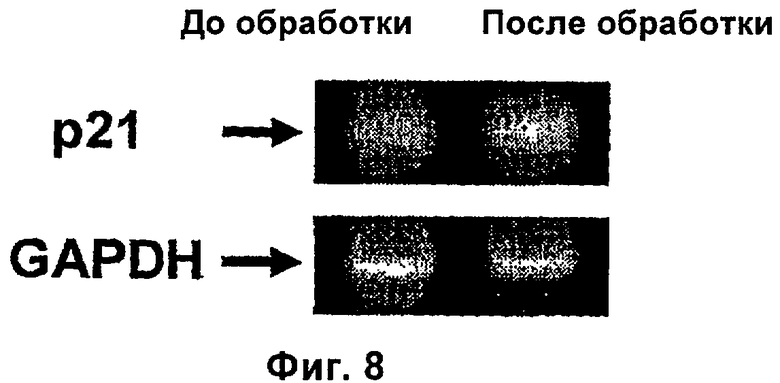
На фиг.8 показан ингибирующий эффект композиции по настоящему изобретению на гистондезацетилазу.
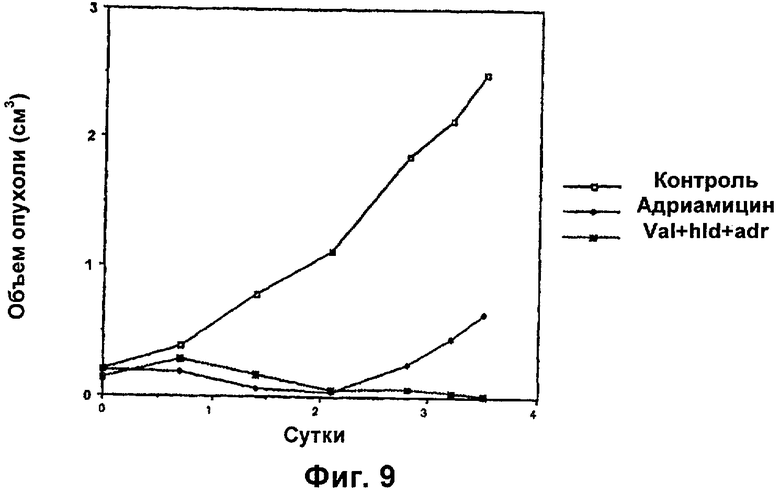
На фиг.9 показан блокирующий эффект на опухолевый рост у животных, обработанных и необработанных композицией по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложено применение композиции и набора для лечения для содействия в лечении злокачественностей посредством применения модифицирующих транскриптом соединений, которые дополняют лечение с помощью химиотерапии или радиотерапии.
Композиция модифицирующих транскриптом агентов представляет собой комбинацию гидралазина и вальпроевой кислоты или любой из ее солей, например вальпроата магния, которая содействует химиотерапии, причем химиотерапия может иметь место при следующих соединениях: хлорамбуциле, циклофосфамиде, ифосфамиде, мехлорэтамине, мелфалане, тиотепа, кармустине, ломустине, алтретамине, дакарбазине и прокарбазине, цисплатине, карбоплатине и оксалиплатине, доксорубицине, даунорубицине, эпирубицине, идарубицине, митомицине С, блеомицине, дактиномицине, ретиноидах, гормональных агентах, винкристине, винбластине, виндезине, винорельбине, иринотекане, топотекане, этопозиде, тенипозиде, паклитакселе, доцетакселе, 5-фторурациле, гемцитабине, метотрексате, интерлейкинах, интерферонах, моноклональных антителах, таких как трастузумаб, цетуксимаб, ритуксан, миелотарг, и небольших ингибирующих молекулах, таких как гефитиниб, эрлотиниб и иматиниб, но не ограничивается ими.
Композицию и набор для лечения по настоящему изобретению можно применять против опухолей нескольких типов, включая, без ограничения, рак молочной железы, яичника, матки, кожи, кости, предстательной железы, печени, почки, легкого, головного мозга, головы и шеи, желчного пузыря, поджелудочной железы, ободочной и прямой кишки, паращитовидных желез, щитовидной железы, надпочечников, желудка, почки, феохромоцитому, опухоль Вильмса, рак яичка, нейробластому, саркому, острый и хронический лейкоз, лимфомы и миелодисплазийные синдромы.
Композицию по настоящему изобретению можно вводить пероральным путем или любым другим путем введения в препарате, содержащем 83 мг гидралазина и вальпроевую кислоту или ее соль, например вальпроат магния, в дозе 30 мг/кг (мас.), если субъект проявляет медленное ацетилирование, или 182 мг гидралазина и вальпроевую кислоту или ее соль, например вальпроат магния, в дозе 30 мг/кг (мас.), если субъект проявляет быстрое ацетилирование. Оба агента в любом из их воплощений следует вводить в препарате контролируемого высвобождения, начиная введение препарата за 7 суток до первой дозы химиотерапии или первого сеанса радиотерапии для предоставления возможности модификации транскриптома перед цитотоксическим повреждением при этих способах лечения.
ПРИМЕРЫ
ПРИМЕР ПРИМЕНЕНИЯ 1
Для демонстрации того, что модифицирующая транскриптом композиция, гидралазин и вальпроевая кислота или вальпроат магния обладают противоопухолевыми эффектами, использовали ряд линий злокачественных клеток рака шейки матки, молочной железы, ободочной кишки, верхних дыхательных путей и пищеварительного тракта и саркомы. Клетки помещали в 96-луночные планшеты (Falcon Becton Dickinson, Franklin Lakes, NJ) с плотностью 1,5-2,5×103 клеток/лунка в 0,1 мл полной среды. На следующие сутки клетки обрабатывали гидралазином при 10 мкМ и вальпроатом магния при 1 мМ в течение 4 суток. На следующие сутки измеряли жизнеспособность клеток с использованием МТТ-анализа. Кратко, в каждую лунку добавляли 50 мкл МТТ-реагента (бромида 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия) в фосфатном буферном растворе. Жизнеспособные клетки с активными митохондриями восстанавливают МТТ до осаждаемого фиолетового соединения - формазана, который растворяется в ДМСО (диметилсульфоксиде) при его добавлении по 150 мкл в каждую лунку. Затем проводят спектрофотометрический анализ на ELISA- (иммуноферментный твердофазный анализ) ридере. Все анализы проводили в трех повторах. Цитотоксический эффект каждой обработки выражали в процентах клеточной жизнеспособности относительно необработанного контроля (% контроля), который определяли как [(A570nm обработанных клеток)/(A570nm необработанных клеток)]×100.
На фиг.1А, В, C, D, Е, F и G показано, что во всех обработанных линиях клеток HeLa, клеточной линии карциномы шейки матки, саркомы НТ1080, рака молочной железы MCF-7, эпидермоидных карцином гортани и полости рта KB и НЕР2, соответственно; карциномы ободочной кишки SW480, эпидермоидной карциномы полости рта KB, эпидермоидной карциномы гортани НЕР2,
D54 модифицирующая транскриптом композиция привела к значительной цитотоксичности, изменяющейся в диапазоне от 12,7%-го до 43,4%-го уменьшения жизнеспособности.
ПРИМЕР ПРИМЕНЕНИЯ 2
После демонстрации того, что модифицирующая транскриптом композиция обладает ингибирующими эффектами на рост линий злокачественных клеток, проводили исследование в отношении увеличения композицией цитотоксического эффекта химиотерапевтических агентов. С этой целью были выбраны три лекарственных средства, которые являются типичными представителями своего класса: цисплатин из алкилирующих агентов, доксорубицин из антибиотиков, гемцитабин из антиметаболитов. Клетки помещали в 96-луночные планшеты (Falcon Becton Dickinson, Franklin Lakes, NJ) с плотностью 1,5-2,5×103 клеток/лунка в 0,1 мл полной среды. На следующие сутки клетки обрабатывали химиотерапевтическим агентом в концентрации, указанной на фиг.2А, В и С, и гидралазином при 10 мкМ и вальпроевой кислотой или вальпроатом магния при 1 мМ. На следующие сутки среду, содержащую лекарственные средства, удаляли и добавляли свежие гидралазин и вальпроат магния в тех же концентрациях в течение дополнительных 48 часов. На следующие сутки (4-е сутки) измеряли жизнеспособность клеток с использованием МТТ-анализа. Кратко, в каждую лунку добавляли 50 мкл МТТ-реагента в фосфатном буферном растворе. Жизнеспособные клетки с активными митохондриями восстанавливают МТТ до осаждаемого фиолетового соединения - формазана, который растворяется в ДМСО при его добавлении по 150 мкл в каждую лунку. Затем проводят спектрофотометрический анализ на ELISA-ридере. Все анализы проводили в трех повторах. Цитотоксический эффект каждой обработки выражали в процентах клеточной жизнеспособности относительно необработанного контроля (% контроля), который определяли как [(A570nm обработанных клеток)/(A570nm необработанных клеток)]×100. На Фиг.2А, В и С показано, что во всех случаях цитотоксичность модифицирующей транскриптом композиции и химиотерапевтического агента является более значительной. В этих условиях концентрация цисплатина 12 мкМ, которая является ингибирующей концентрацией 50 (IC50), привела к уменьшению жизнеспособности 37% в клетках HeLa при обработке модифицирующей транскриптом композицией. Аналогичный эффект также был продемонстрирован для адриамицина и гемцитабина по уменьшению жизнеспособности 27% и 37% соответственно.
ПРИМЕР ПРИМЕНЕНИЯ 3
Для демонстрации того, что деметилирующий и реактивирующий эффект от транскрипции супрессивных генов может быть клинически достигаемым, была проведена фаза 1 клинических испытаний с целью показать дозу, при которой гидралазин может обладать деметилирующим и реактивирующим эффектом транскрипции у пациентов, больных раком. С этой целью, гидралазин вводили группам из 4 пациентов в каждой группе в течение 10 суток в дозах: 1) 50 мг/сутки, 2) 75 мг/сутки, 3) 100 мг/сутки и 4) 150 мг/сутки. Перед началом обработки и на 11-е сутки брали биопсии и образцы периферической крови. Анализировали уровень метилирования до и после обработки для промотеров следующих генов: АРС, MGMT; ER, GSTP1, DAPK, PARβ, FHIT и р16, а также уровень экспрессии их мессенджеров посредством RT-PCR. Также оценивали уровень метилирования генного субъекта по отношению к родительской дезактивации Н19 и геномный клон, который обычно считают метилированным, и общее содержание метилированных цитокинов в геноме. Токсичность гидралазина оценивали с использованием шкалы Национального Института Рака США (СТС NCI). Гидралазин был хорошо переносимым, и только следующие нежелательные эффекты были зарегистрированы: тошнота, недомогание (sickness), усталость, головная боль и учащенное сердцебиение. Что касается генов, то было обнаружено, что 70% анализируемых образцов (89 из 128) имели по меньшей мере один метилированный ген в биопсии, взятой до обработки, 8 генов на каждую из 16 биопсий - больных, и что все пациенты имели в своих опухолях по меньшей мере один метилированный ген. Индивидуальный анализ каждого гена продемонстрировал следующие частоты метилирования: АРС 94%, ER 25%, FHIT 88%, GSTP1 88%, MGMT 81%, р16 19%, RARβ 62% и DAPK 100%. В биопсиях после обработки была обнаружена переменная частота деметилирования для каждого гена, изменяющаяся в диапазоне от 15% в 2 из 13 образцов MGMT до 67% в 2 из 3 образцов гена р16. (Фиг.3А). Репрезентативные случаи представлены на Фиг.3В. Корреляция между процентом деметилирования и дозой гидралазина была следующей: 50 мг 40%, 75 мг 52%, 100 мг 43%, 150 мг 32% (см. фиг.3С).
Анализ генной экспрессии показывает, что 90% (116 из 128) образцов опухолей экспрессировали мессенджер в биопсии до и после обработки независимо от уровня метилирования гена, следовательно, они не являются информативными. В 12 информативных случаях было обнаружено, что в 9 из них не было экспрессии гена до обработки, являющегося метилированным, но после обработки они стали деметилированными и реэкспрессировали ген. Репрезентативные случаи представлены на фиг.4А, В и С, а в целом частота генной реэкспрессии суммирована на фиг.4D.
Изложенные выше результаты показывают, что гидралазин в интервале доз между 50 и 150 мг является эффективным в отношении изменения генной экспрессии у пациентов, больных раком (Zambrano P, Segura-Pacheco В, Pereez-Cardenas E, Cetina L, Revilla-Vazquez A, Taja-Chayeb L, Chavez- Blanco A, Angeles E, Cabrera G, Sandoval K, Trejo-Becerril C, Chanona-Vilchis J, Duenas-González A. A phase I study of hydralazine to demethylate and reactivate the expression of tumor suppressor genes. BMC Cancer 2005; 5: 44).
ПРИМЕР ПРИМЕНЕНИЯ 4
Чтобы доказать, что вальпроевая кислота или ее соль, например вальпроат магния, индуцирует гиперацетилирование гистонов и ингибирование активности гистондезацетилаз в опухоли пациентов, больных раком, было проведено еще одно клиническое испытание, в котором пациентам с раком шейки матки вводили различные дозы вальпроевой кислоты или ее соли, например вальпроата магния. Двенадцать пациентов с недавним диагнозом этого рака и без предшествующего лечения получали следующие дозы вальпроата магния в группах по 4 пациента. Группа 1 - 20 мг/кг, группа 2 - 30 мг/кг, группа 3 - 40 мг/кг. Брали биопсию опухоли и образец крови до обработки и на следующие сутки (6-е сутки), так как вальпроевую кислоту или ее соль, например вальпроат магния, вводили в течение 5 суток в разделенных дозах каждые 8 часов. Гиперацетилирование гистона НЗ в образцах и гистона Н4 в опухоли анализировали с помощью вестерн-блоттинг анализа, активность гистондезацетилаз в экстрактах ядер опухолей с использованием колориметрического анализа, а также уровни вальпроевой кислоты в сыворотке. Также анализировали уровень экспрессии генов р21 и CAR в биопсиях после обработки. В конце цикла лечения определяли токсичность обработки. Все пациенты прошли обработку; средняя доза составила 1890 мг/сутки со средними значениями, соответствующими дозам 20, 30 и 40 мг/кг, 1245, 2000 и 2425 мг соответственно. У девяти из 12 пациентов наблюдали сонливость степени 2. После обработки обнаружили гиперацетилирование Н3 и Н4 у девяти и семи пациентов соответственно; причем у шести из них обнаружили гиперацетилирование обоих гистонов (положительный и отрицательный контроль, клетки HeLa, обработанные или необработанные трикостатином, соответственно). Активность гистондезацетилаз уменьшилась у 8 пациентов, тогда как у двух пациентов, которые были статистически значимыми (двусторонний t тест р<0,0264) изменений не было. (Положительный и отрицательный контроль, экстракты ядер клеток HeLa, обработанные или необработанные трикостатином), фиг.5, 6 и 7. Эти результаты показывают, что вальпроат магния в использованных дозах является эффективным и хорошо переносимым в качестве ингибитора гистондезацетилаз, что отражается в увеличении экспрессии таких генов, как р21 (фиг.8).
ПРИМЕР ПРИМЕНЕНИЯ 5
После оценки способности гидралазина и вальпроевой кислоты или ее соли, например вальпроата магния, изменять генную экспрессию в опухолях пациентов, авторы изобретения провели исследование на модели саркомы иммунодефицитных мышей в отношении следующего: увеличила ли композиция этих модифицирующих транскриптом агентов противоопухолевый эффект химиотерапии. С этой целью исследовали группы 6 бестимусных мышей-самок, которым инъецировали по 6 миллионов клеток саркомы клеточной линии НТ1080. После образования опухолей животных систематически обрабатывали гидралазином и вальпроевой кислотой или ее солью, например вальпроатом магния, в дозах, эквивалентных тем, которые применяли в отношении пациентов. Были сформированы следующие группы обработки: 1) контрольная, обработанная физиологическим раствором, 2) обработанная раз в неделю адриамицином, 3) обработанная композицией гидралазина и вальпроата в течение 7 суток с последующей такой же недельной обработкой адриамицином. Результаты показывают, что через 5 недель опухоли у необработанных животных достигают объема между 2 и 3 см3, а лечение адриамицином приводит к почти полному противоопухолевому эффекту через 3 недели после лечения, однако, начиная с этого времени опухоли снова растут, в то время как у животных, обработанных композицией, повторный рост опухолей блокируется, как показано на фиг.9. Указанное выше свидетельствует о том, что модифицирующая транскриптом комбинация предупреждает клетку опухоли от осуществления транскрипционных изменений, необходимых для восстановления способности к росту. Это явление обычно имеет место при лечении рака у пациентов, у которых наблюдается, что полностью или почти полностью противоопухолевая реакция позже часто сменяется рецидивом. Поэтому композиция по настоящему изобретению может индуцировать отсроченную или полную ремиссии опухолей.
Композиция по настоящему изобретению может быть включена в набор для лечения, который следует вводить пероральным или любым другим путем введения в препарате, содержащем 83 мг гидралазина и вальпроевую кислоту или ее соль, например вальпроат магния, в дозе 30 мг/кг (мас.), если субъект проявляет медленное ацетилирование, и 182 мг гидралазина и вальпроевую кислоту или ее соль, например вальпроат магния, в дозе 30 мг/кг (мас.), если субъект проявляет быстрое ацетилирование. Во избежание пиков в сывороточных уровнях, продуцируемых гидралазином и вальпроевой кислотой или ее солью, например вальпроатом магния, и для уменьшения побочных эффектов, возникающих от их быстрой абсорбции, оба агента следует вводить в препарате контролируемого высвобождения.
Поскольку эффект гидралазина на ингибирование метилирования начинается по меньшей мере через 48 часов после его введения, а эффект вальпроевой кислоты или ее соли, например вальпроата магния, на транскрипцию может повышаться на фоне деметилирования, лечение композицией предпочтительно должно начинаться за семь суток до первой дозы химиотерапии или радиотерапии для предоставления возможности модификации транскриптома перед цитотоксическим повреждением при химиотерапии или радиотерапии.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способы и композиции для лечения опухолей | 2017 |
|
RU2741786C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ АНТИТЕЛА К СЕМАФОРИНУ 4D В КОМБИНАЦИИ С ЭПИГЕНЕТИЧЕСКИМ МОДУЛИРУЮЩИМ АГЕНТОМ | 2018 |
|
RU2783535C2 |
| ИНГИБИТОРЫ ГИСТОНДЕЗАЦЕТИЛАЗЫ ИЗ НОВЫХ ПРОИЗВОДНЫХ БЕНЗАМИДА С СИЛЬНОЙ ДИФФЕРЕНЦИРОВОЧНОЙ И АНТИПРОЛИФЕРАТИВНОЙ АКТИВНОСТЬЮ | 2004 |
|
RU2364589C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК | 2014 |
|
RU2565548C1 |
| СПОСОБЫ ИНДУКЦИИ КОНЕЧНОЙ ДИФФЕРЕНЦИРОВКИ | 2010 |
|
RU2530648C2 |
| СИСТЕМЫ, СПОСОБЫ И СОСТАВЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2644635C2 |
| СПОСОБЫ ИНДУКЦИИ КОНЕЧНОЙ ДИФФЕРЕНЦИРОВКИ | 2003 |
|
RU2394022C2 |
| СПОСОБЫ КОМБИНИРОВАННОЙ ТЕРАПИИ ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2577278C2 |
| СПОСОБ ИНДУКЦИИ КОНЕЧНОЙ ДИФФЕРЕНЦИРОВКИ | 2003 |
|
RU2320331C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ АГОНИСТА RAR-α | 2006 |
|
RU2405447C2 |
Изобретение относится к применению модифицирующих транскриптом агентов с целью предотвращения подверженности злокачественных клеток генетическим изменениям, необходимым для сопротивления повреждению клеток и выживаемости при химиотерапии или радиотерапии. Заявлена фармацевтическая композиция, содержащая гидралазин и вальпроевую кислоту или ее соль, например вальпроат магния, в фармацевтически приемлемом носителе для содействия в лечении рака вместе с химиотерапией или радиотерапией. Заявленное изобретение обеспечивает синергетический эффект при лечении рака известными терапевтическими средствами. 4 з.п. ф-лы, 9 ил.
1. Фармацевтическая композиция, содержащая гидралазин и вальпроевую кислоту или ее соль, например вальпроат магния, в фармацевтически приемлемом носителе для содействия в лечении рака вместе с химиотерапией или радиотерапией.
2. Фармацевтическая композиция по п.1, содержащая от 50 до 100 мг гидралазина и от 20 до 50 мг/кг вальпроевой кислоты или ее соли, например вальпроата магния, в фармацевтически приемлемом носителе для введения субъектам, рассматриваемым в качестве обладающих медленным ацетилированием.
3. Фармацевтическая композиция по п.1, содержащая от 150 до 200 мг гидралазина и от 20 до 50 мг/кг вальпроевой кислоты или ее соли, например вальпроата магния, в фармацевтически приемлемом носителе для введения субъектам, рассматриваемым в качестве обладающих быстрым ацетилированием.
4. Фармацевтическая композиция по п.1, где химиотерапевтический агент включает хлорамбуцил, циклофосфамид, ифосфамид, мехлорэтамин, мелфалан, тиотепа, кармустин, ломустин, алтретамин, дакарбазин и прокарбазин, цисплатин, карбоплатин и оксалиплатин, доксорубицин, даунорубицин, эпирубицин, идарубицин, митомицин С, блеомицин, дактиномицин, ретиноиды, гормональные агенты, винкристин, винбластин, виндезин, винорельбин, иринотекан, топотекан, этопозид, тенипозид, паклитаксел, доцетаксел, 5-фторурацил, гемцитабин, метотрексат, интерлейкины, интерфероны, моноклональные антитела, такие как трастузумаб, цетуксимаб, ритуксан, миелотарг, и небольшие ингибирующие молекулы, такие как гефитиниб, эрлотиниб и иматиниб, но не ограничивается ими.
5. Фармацевтическая композиция по п.1, где указанный рак представляет собой любую солидную опухоль, включая, без ограничения, рак молочной железы, яичника, матки, кожи, кости, предстательной железы, печени, почки, легкого, головного мозга, головы и шеи, желчного пузыря, поджелудочной железы, ободочной и прямой кишки, паращитовидных желез, щитовидной железы, надпочечников, желудка, почки, феохромоцитому, опухоль Вильмса, рак яичка, нейробластому, саркому, острый и хронический лейкоз, лимфомы и миелодисплазийные синдромы.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| A phase I study of hydralazine to demethylate and reactivate the expression of tumor suppressor gene | |||
| PILAR-ZAMBRANO et al | |||
| Солесос | 1922 |
|
SU29A1 |
Авторы
Даты
2010-05-20—Публикация
2005-11-18—Подача