Предлагаемое изобретение относится к медицине, а именно к онкологии, и может быть использовано для исследования биораспределения фотосенсибилизаторов и их фармакокинетики в испытаниях на животных.
Изучение новых фотосенсибилизаторов на экспериментальных опухолях животных является необходимым условием, предшествующим внедрению любого препарата в клиническую практику.
Одной из главных задач в исследовании новых фотосенсибилизаторов in vivo является наблюдение их распределения в организме животного и фармакокинетики. Это связано с тем, что эффективность флюоресцентной диагностики и фотодинамической терапии определяется уровнем накопления фотосенсибилизатора в опухолевой ткани и особенностями его распределения в нормальных тканях.
Селективность накопления фотосенсибилизатора в опухоли и быстрое выведение из окружающих нормальных тканей являются критериями его перспективности для флюоресцентной диагностики и фотодинамической терапии рака. С одной стороны, они обеспечивают высокий флюоресцентный контраст опухоли, повышающий эффективность диагностики и точность определения границ новообразования, а с другой - повышают прицельность лазерного воздействия во время сеанса фотодинамической терапии, что минимизирует повреждение окружающих нормальных тканей.
К сожалению, все известные на сегодняшний день фотосенсибилизаторы накапливаются не только в опухоли, но и в нормальных органах и тканях. При этом в коже, мышцах и жировой ткани их уровень существенно ниже, чем во внутренних органах - печени, почках, селезенке, кишечнике [1]. Характерно, что содержание некоторых фотосенсибилизаторов в нормальных органах иногда превышает их содержание в опухолевой ткани.
Изучение распределения фотосенсибилизатора в организме связано со снижением риска развития побочных реакций при его применении. В частности, накопление фотосенсибилизаторов в нормальных тканях даже в малых концентрациях приводит к развитию фототоксичности, ограничивающей их использование. Для оценки продолжительности периода кожной фототоксичности особенно важен контроль за содержанием препарата в коже. Угроза высокой фототоксичности возрастает при длительном удержании фотосенсибилизатора в организме. В связи с этим в разработке новых фотосенсибилизаторов отмечается тенденция к увеличению скорости выведения препарата из организма.
Исследование кинетики накопления фотосенсибилизатора в опухоли необходимо для оптимизации режимов фотодинамической терапии. В ходе исследований определяется время максимального накопления фотосенсибилизатора в опухоли, на основании которого устанавливается оптимальное время между введением препарата и облучением, так называемый лекарственно-световой интервал. Известно, что кинетика накопления фотосенсибилизатора в опухоли зависит не только от его химической природы, но и от способа введения в организм, концентрации, индивидуальных характеристик метаболизма. Поэтому при выработке рекомендаций препарата к клиническому использованию учитываются все эти особенности.
В настоящее время для исследования биораспределения и фармакокинетики фотосенсибилизаторов используются различные методы флюоресцентного анализа: спектрофотометрия, микроспектрометрия, флюоресцентная спектроскопия, флюоресцентная микроскопия и лазерная сканирующая конфокальная микроскопия. Спектрофотометрия позволяет определять концентрацию фотосенсибилизаторов в гомогенизированных образцах органов и тканей [2, 3]. Применение микроспектрометрии описано для измерения интенсивности флюоресценции, внутриклеточной концентрации флюорофора и его спектральных характеристик в единичных клетках и тканевых срезах [4]. Выявить особенности и механизм накопления фотосенсибилизаторов помогают методы флюоресцентной микроскопии и лазерной сканирующей конфокальной микроскопии [5], исследующие флюоресценцию в гистологических срезах или макропрепаратах тканей ex vivo. Метод локальной флюоресцентной спектроскопии активно используется для точечного измерения флюоресцентного сигнала с поверхности изолированных органов и тканей. Он характеризуется высокой чувствительностью, но требует большого количества животных и не всегда точен в определении количественного содержания фотосенсибилизаторов в тканях.
Очевидно, что любые манипуляции, нарушающие естественные физиологические условия или состояние органа или ткани (извлечение, заморозка, хранение, гомогенизация и т.д.), могут привести к изменению фотохимических свойств и распределению фотосенсибилизатора и, как следствие, ошибкам в интерпретации результатов.
Известен способ прижизненного исследования флюоресценции фотосенсибилизаторов в биологических тканях методом локальной флюоресцентной спектроскопии [6, 7]. При этом производится регистрация обратно отраженного, обратно рассеянного и флюоресцентного излучений. Уровень флюоресценции, определяющий содержание фотосенсибилизатора в тканях, оценивается по отношению площадей под пиком флюоресценции и под пиком отраженного лазерного излучения. При исследовании флюоресценции опухоли in vivo спектры регистрируют локально, контактным способом, путем подведения световода к коже над опухолью под прямым углом. Однако исследование распределения фотосенсибилизаторов в органах животного таким способом невозможно. Величина сигнала отраженного лазерного излучения зависит от многих факторов: степени пигментации анализируемого объекта, рельефа поверхности анализируемого объекта, пространственного положения световода в момент регистрации спектра. Глубина залегания опухоли и ее гистологические характеристики также влияют на результат. Показано, что уровень флюоресценции при регистрации спектров через кожу в 1.5-2 раза ниже, чем при регистрации с поверхности опухоли ех vivo. Поэтому многие исследователи находят более целесообразной регистрацию флюоресценции фотосенсибилизаторов в опухоли и нормальных органах и тканях ex vivo [8].
Современная экспериментальная онкология ощущает недостаток методов прижизненного и неинвазивного наблюдения флюоресценции фотосенсибилизаторов на уровне целого организма. Все используемые в настоящее время способы требуют умерщвления животных, что противоречит принципам этики медико-биологического эксперимента.
Задача, на решение которой направлено изобретение, заключается в сохранении экспериментальных животных.
Поставленная задача достигается тем, что исследования проводят прижизненно и неинвазивно методом диффузионной флюоресцентной томографии с использованием прибора, в котором источник и приемник излучения расположены в конфигурации «на просвет», регистрируют флюоресценцию в натянутых участках кожи и в органах брюшной полости, при этом анализ интенсивности флюоресценции проводят по изображениям животного во фронтальной плоскости; при регистрации флюоресценции в органах брюшной полости отдельно исследуют печень, почки, мочевой пузырь, а в случае отсутствия возможности идентификации этих органов на полученных изображениях оценивают накопление фотосенсибилизатора в брюшной полости в целом; при наличии у экспериментального животного опухоли дополнительно регистрируют флюоресценцию в тканях опухоли; в качестве натянутых участков кожи используют кожу подмышечных впадин.
Авторами данной заявки впервые показано, что исследование биораспределения фотосенсибилизаторов можно проводить прижизненно и неинвазивно, если использовать метод диффузионной флюоресцентной томографии (ДФТ) и соблюдать при этом ряд условий, существенность которых установлена авторами данной заявки. Эти условия составляют существенные отличительные признаки, отраженные в формуле изобретения.
Метод ДФТ предназначен для получения in vivo информации о флюоресцирующих объектах в биоткани на глубине до нескольких сантиметров с миллиметровым разрешением на основе обработки сигнала от прошедшего через ткань лазерного излучения. Облучение объекта производится на длине волны возбуждения фотосенсибилизатора, прием сигнала - как на длине волны зондирующего излучения, так и в спектре флюоресценции вещества. Основным направлением развития и использования метода ДФТ является прижизненная визуализация опухолей мелких лабораторных животных [9, 10]. Необходимое условие визуализации - введение флюоресцирующих меток в опухолевую ткань.
Фотосенсибилизаторы, имеющие максимальное поглощение и флюоресценцию в красной области спектра, где биологические ткани характеризуются наибольшей прозрачностью, являются перспективными агентами для наблюдения методом ДФТ. Известно, что эндогенная флюоресценция биологических тканей в красной области спектра крайне мала. Поэтому регистрируемая флюоресценция в данной области может быть обусловлена только экзогенными маркерами, а получаемые ДФТ-изображения дают прямую информацию о накоплении фотосенсибилизаторов.
Изображения животных без фотосенсибилизатора (контроль) выглядят темными, имеют низкую интенсивность сигнала. При этом отдельные участки, в частности натянутая кожа в области подмышечных впадин, выглядят более светлыми, поскольку они более прозрачны для возбуждающего света. После введения фотосенсибилизатора на изображениях появляются светлые области с более высокой интенсивностью сигнала, которые соответствуют зонам накопления фотосенсибилизатора.
На основании многочисленных эмпирических данных мы впервые сформулировали критерии для идентификации органов и тканей животного на флюоресцентных изображениях. Идентификацию органов в проекции брюшной полости проводят по форме и локализации флюоресцирующих зон. Печень на изображениях идентифицируется как крупная светлая область однородного или неоднородного цвета, но всегда содержащая обширный участок с высокой интенсивностью сигнала. Располагается, как правило, на стороне изображения, соответствующей правому боку животного. Имеет неправильную или треугольную форму. Мочевой пузырь идентифицируется как небольшая яркая светлая область округлой формы в нижней части брюшной полости посередине. Почки идентифицируются как 2 области среднего размера, овальной или бобовидной формы, расположенные симметрично относительно позвоночника. Иногда на изображениях отчетливо различима только одна почка.
Появление на изображениях флюоресцирующих областей указанной формы и локализации позволяет судить о преимущественном накоплении фотосенсибилизатора в том или ином органе брюшной полости в данный момент времени. Повторное сканирование того же животного методом ДФТ через разные интервалы времени дает информацию о перераспределении фотосенсибилизатора в организме и путях выведения.
Накопление фотосенсибилизатора в коже оценивают путем сравнения (визуального или значений интенсивности) сигнала в натянутых участках в области подмышечных впадин с таковым на контрольном изображении.
К сожалению, в отдельных случаях идентификация органов животного затруднена, например, по причине обширного свечения всей брюшной полости или, наоборот, очень слабого сигнала. Тем не менее, оценка интенсивности флюоресцентного сигнала в целом в проекции брюшной полости представляется важным критерием при исследовании фармакокинетики фотосенсибилизаторов.
Необходимость использования прибора, в котором источник и приемник расположены в конфигурации «на просвет», объясняется тем, что данная конфигурация обеспечивает получение наиболее полной информации о флюоресценции в глубине биотканей. При сканировании мелких лабораторных животных это открывает возможность визуализации флюоресценции в органах брюшной полости и глубоко локализованных опухолях.
Авторами данной заявки показано также, что анализ интенсивности флюоресценции необходимо проводить по изображениям животного во фронтальной плоскости, т.к. в данном случае анатомические особенности животного позволяют идентифицировать органы по топологии ДФТ-сигнала, а именно дифференцировать на изображениях печень, почки и мочевой пузырь при накоплении в них фотосенсибилизатора.
Исследование биораспределения фотосенсибилизаторов и их фармакокинетики проводят как на здоровых животных, так и на животных с опухолями различного гистогенеза. Возрастание интенсивности сигнала в области опухоли после введения фотосенсибилизатора позволяет исследовать селективность накопления, а также динамику накопления и выведения фотосенсибилизатора из опухолевой ткани.
В ходе разработки предлагаемого способа с целью подтверждения результатов исследования биораспределения фотосенсибилизаторов методом ДФТ мы выполнили анализ флюоресценции органов и тканей ex vivo стандартными методами - конфокальной флюоресцентной микроскопией и флюоресцентной спектроскопией. С глубоким удовлетворением обнаружили, что органы и ткани, обозначаемые на изображениях как зоны с наибольшей интенсивностью сигнала, действительно имеют максимальную флюоресценцию, вызванную накоплением фотосенсибилизатора. А форма и локализация данных зон на изображениях соответствует форме и топологии органов.
Разработанный способ исследования биораспределения и фармакокинетики фотосенсибилизаторов показал свою эффективность на препаратах разной химической природы (фталоцианины, хлорины, 5-ала-индуцированный протопорфирин IX), которые в настоящее время применяются в клинической практике для флюоресцентной диагностики и фотодинамической терапии рака. Сведения о фармакокинетике фотосенсибилизаторов, полученные прижизненно с помощью предлагаемого изобретения и также подтвержденные стандартными методами, совпадают с данными литературы, полученными в ходе доклинических испытаний препаратов. Представляется перспективным использование разработанного способа для исследования биораспределения и фармакокинетики новых фотосенсибилизаторов.
Предлагаемый способ осуществляют следующим образом.
При подготовке к исследованию в случае необходимости проводят эпиляцию тела животного или части тела. Затем животному вводят раствор фотосенсибилизатора внутривенно или перорально. Возможно также внутрибрюшинное введение, если в дальнейшем не планируется наблюдение накопления и распределения фотосенсибилизатора в органах брюшной полости. Первое изображение получают до введения фотосенсибилизатора. Данное изображение служит контролем. На ДФТ-изображении светлые оттенки соответствуют высокой интенсивности флюоресцентного сигнала, темные оттенки - низкой. Следующие изображения получают через разные интервалы времени, в зависимости от задачи и типа фотосенсибилизатора. Для получения изображения животное фиксируется на специальной подставке за 4 конечности и помещается в темную камеру томографа в вертикальном положении. Сканирование осуществляется во фронтальной плоскости животного. По окончании процедуры сканирования животное освобождают, а для следующего сканирования фиксируют в том же положении.
Для получения прижизненных флюоресцентных изображений используют диффузионный флюоресцентный томограф, удовлетворяющий следующим условиям. Источник и приемник излучения располагаются в конфигурации «на просвет». Источники зондирующего излучения находятся в диапазоне 630-680 нм. Размер области сканирования не менее 30×40 мм. Таким условиям удовлетворяет, например, диффузионный флюоресцентный томограф ДФТ-2М, описанный в МПК7 А61В 5/00. Устройство получения флюоресцентных томографических изображений. Заявка 2006124041/14 (22) от 2006.07.06.
Используется также конфокальный лазерный сканирующий микроскоп и волоконный спектрометр.
Приводим описание фигур, иллюстрирующих предлагаемый способ.
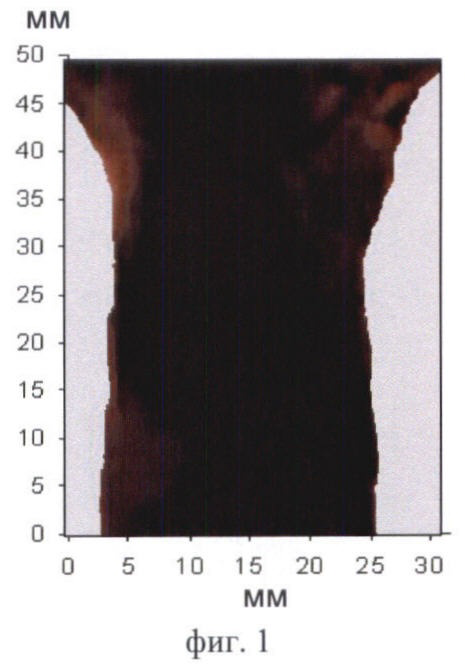
На фиг.1 приведено двумерное флюоресцентное изображение здоровой мыши без фотосенсибилизатора (контроль).
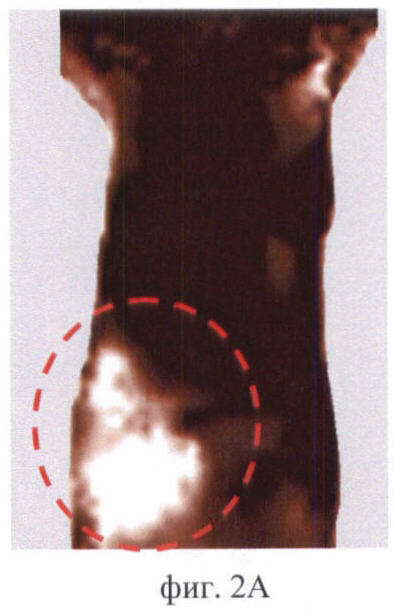
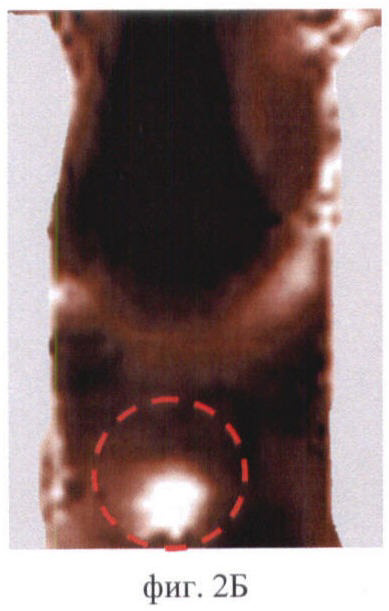
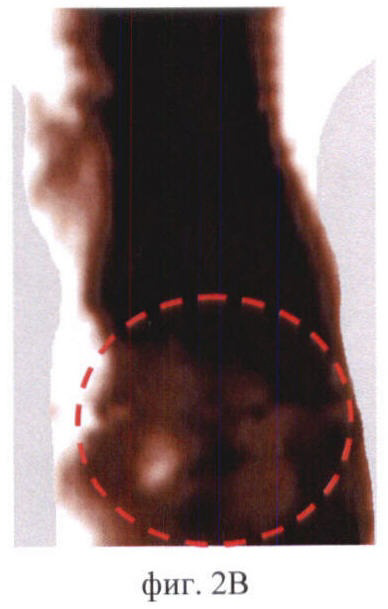
На фиг.2 (А, Б, В) приведены примеры идентификации органов брюшной полости мыши на флюоресцентных изображениях:
Фиг.2А - печень;
Фиг.2Б - мочевой пузырь;
Фиг.2В - почки.
На фиг.2 (А, Б, В) соответствующие органы выделены пунктиром.
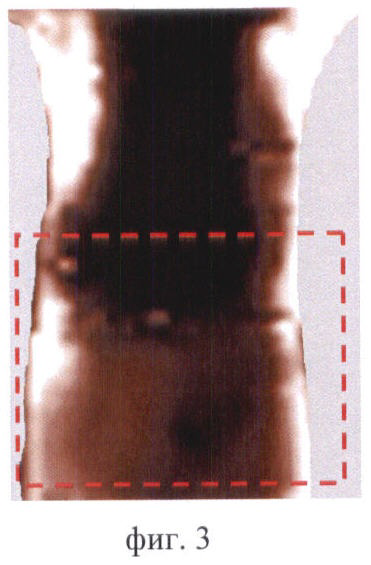
На фиг.3 продемонстрирован пример флюоресцентного изображения мыши, когда свечение наблюдается по всей области брюшной полости мыши и идентификация отдельных органов затруднена. Область флюоресценции в брюшной полости выделена пунктиром.
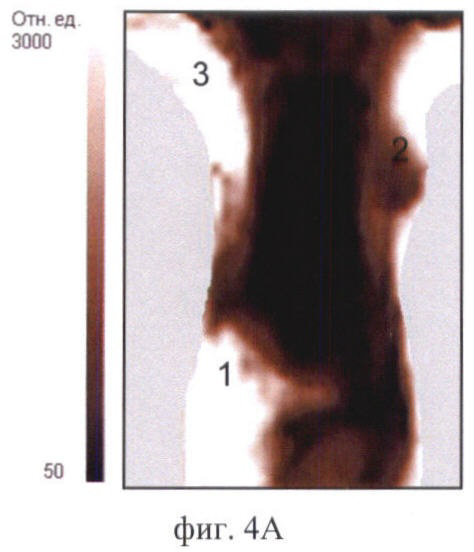
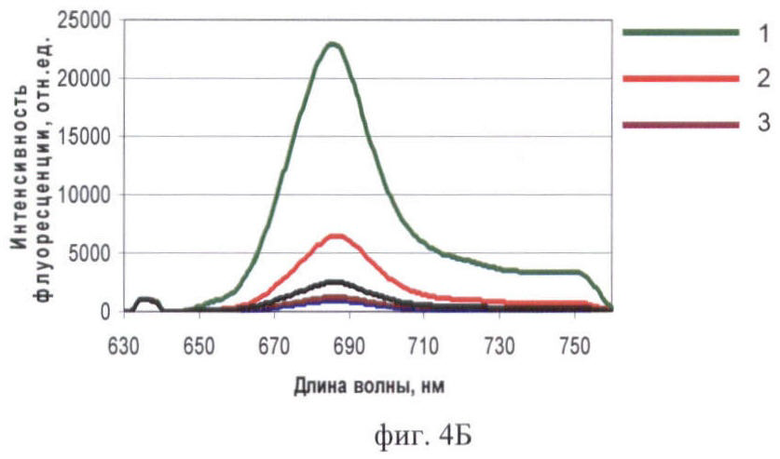
На фиг.4 продемонстрировано исследование биораспределения фотосенсибилизатора Фотосенс разными методами:
Фиг.4А - изображение мыши, полученное на диффузионном флюоресцентном томографе iv vivo;
Фиг.4Б - спектры органов и тканей того же животного ех vivo.
На фиг.4 (А, Б) цифрами обозначены: 1 - печень, 2 - опухоль, 3 - кожа.
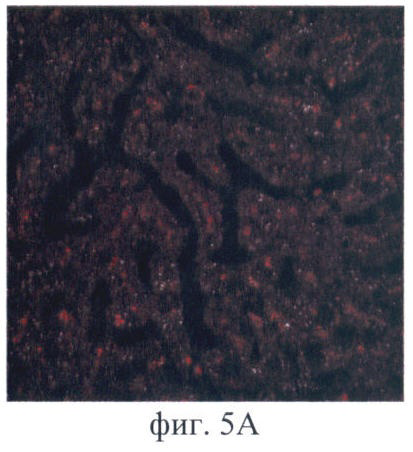
На фиг.5 приведены типичные изображения образцов ех vivo органов и тканей, полученные методом флюоресцентной микроскопии:
Фиг.5А - печень;
Фиг.5Б - опухоль;
Фиг.5В - кожа.
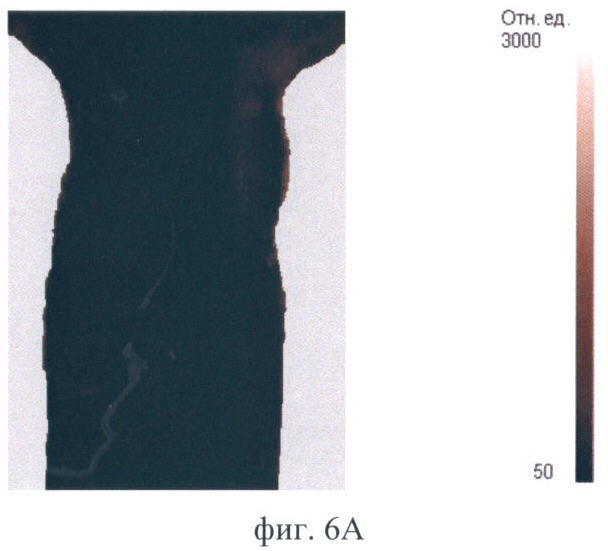
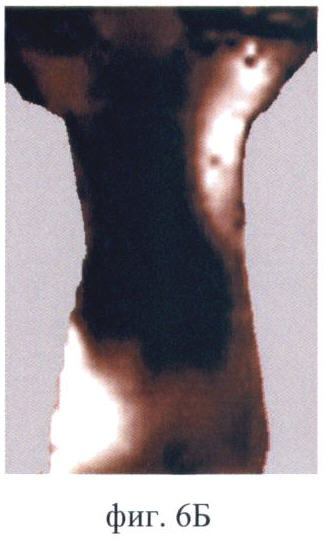
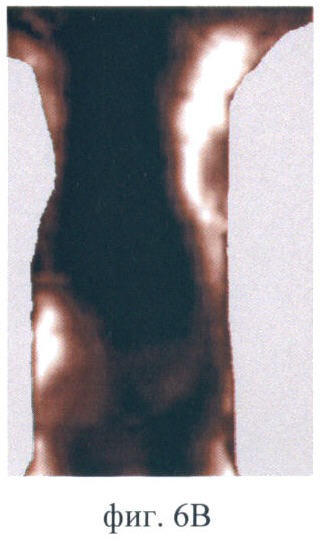
На фиг.6 (А-Д) продемонстрирован прижизненный мониторинг накопления фотосенсибилизатора Фотосенс в опухоли РШМ-5:
Фиг.6А - контроль до введения препарата;
Фиг.6Б - через 2 ч после введения;
Фиг.6В - через 48 ч после введения;
Фиг.6Г - через 72 ч после введения;
Фиг.6Д - через 96 ч после введения.
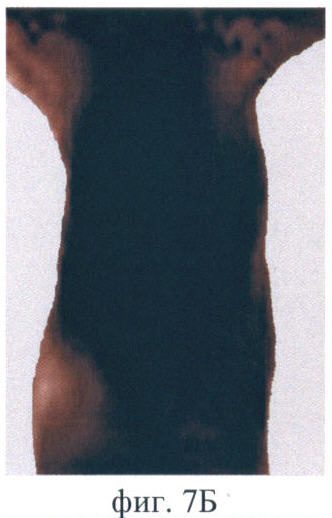
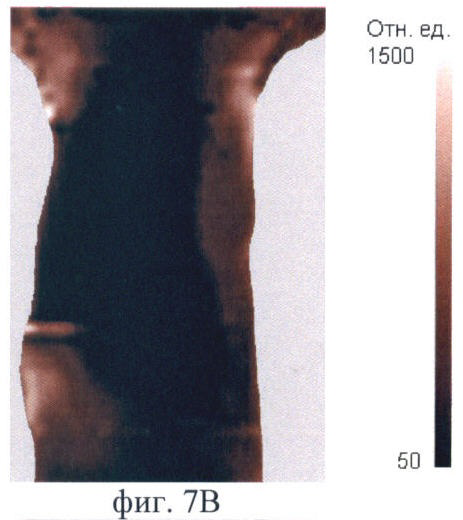
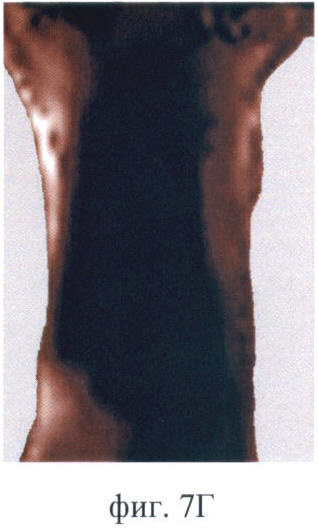
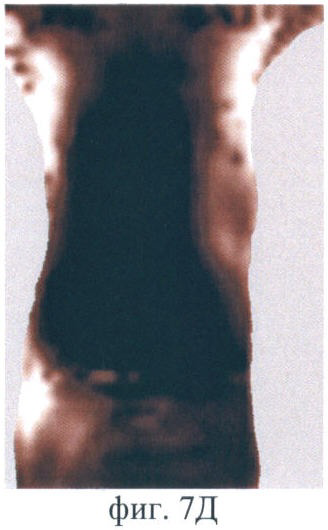
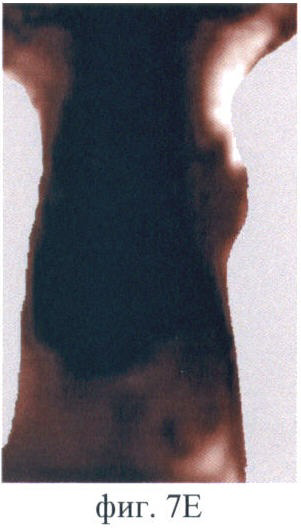
На фиг.7 (А-Е) продемонстрирован прижизненный мониторинг накопления фотосенсибилизатора (5-ала индуцированного протопорфирина IX) в опухоли РШМ-5:
Фиг.7А - контроль до введения препарата Аласенс;
Фиг.7Б - через 2 ч после введения;
Фиг.7В - через 3 ч после введения;
Фиг.7Г - через 4 ч после введения;
Фиг.7Д - через 6 ч после введения;
Фиг.7Е - через 24 ч после введения.
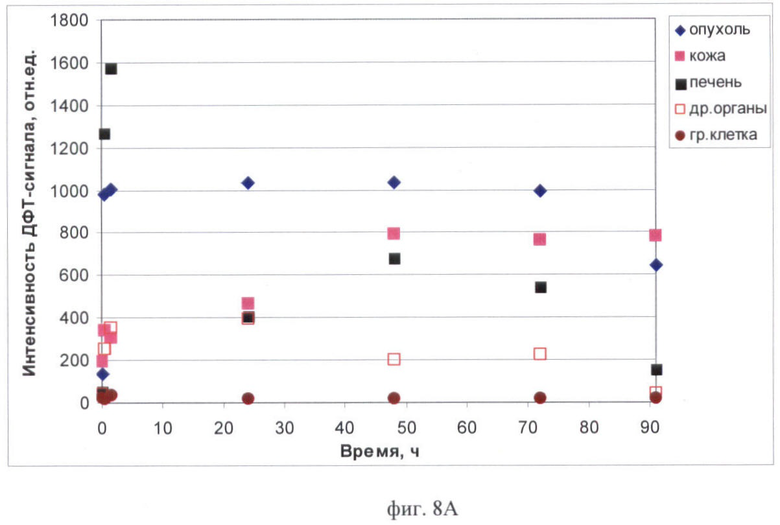
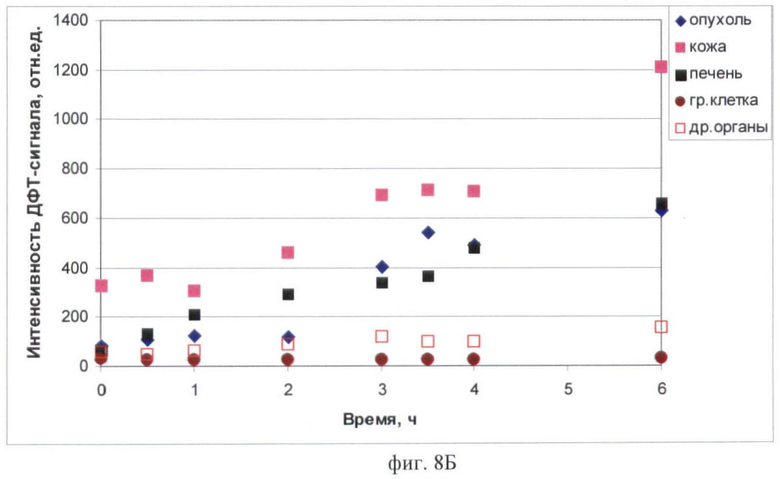
На фиг.8 (А, Б) продемонстрировано изменение интенсивности ДФТ-сигнала в органах и тканях мышей с опухолью РШМ-5 по времени:
8А - до и после внутривенного введения фотосенса в дозе 1 мг/кг мыши с опухолью РШМ-5;
8Б - до и после перорального введения аласенса в дозе 400 мг/кг.
Примеры, подтверждающие существенность отличительных признаков
Пример 1
Наблюдение биораспределения фотосенсибилизаторов в брюшной полости животных. Исследование выполнено на мышах линий СВА, BDF и balb/c с привитыми экспериментальными опухолями. В ДФТ-установке источником облучения служил полупроводниковый лазер с длиной волны 635 нм и мощностью на объекте 10 мВт, приемником сигнала - высокочувствительный ФЭУ. Для разделения спектров возбуждения и флюоресценции использовался фильтр HQ 710/50. Область сканирования составляла 35×50 мм. Подготовка животного к сканированию заключалась в эпиляции исследуемой части тела и фиксации животного на специальной подставке. Сканирование в ДФТ-установке проводили in vivo до введения фотосенсибилизатора (контроль) и далее каждые 30 мин в течение 6 ч. Использовали фотосенсибилизаторы Фотосенс (внутривенно), Аласенс (перорально) и Фотодитазин (внутривенно) в концентрациях 1 мг/кг, 400 мг/кг, 25 мг/кг соответственно.
Контрольные изображения всегда выглядит темными (фиг.1). Интенсивность сигнала в проекции брюшной полости низкая - не более 100 отн.ед. После введения фотосенсибилизаторов происходит их накопление в нормальных органах и тканях, в т.ч. в брюшной полости. Флюоресценция фотосенсибилизаторов в организме животного приводит к возрастанию сигнала в отдельных участках изображения, которые соответствуют зонам накопления фотосенсибилизатора. О преимущественном накоплении фотосенсибилизатора в том или ином органе брюшной полости судили по форме и локализации флюоресцирующих зон. В ходе экспериментов in vivo было обнаружено, что печень в большом количестве накапливает все фотосенсибилизаторы и на изображениях - крупная светлая область неправильной или треугольной формы. Появление на изображениях печени зафиксировано у всех исследуемых животных. На фиг.2А продемонстрировано типичное изображение печени на примере мыши линии BDF через 6 ч после введения Аласенса. Почки и мочевой пузырь идентифицируются на изображениях реже. Характерно, что почки выглядят как 2 (реже 1) области среднего размера, овальной или бобовидной формы, расположенные симметрично относительно позвоночника. Мочевой пузырь идентифицируется как небольшая яркая светлая область округлой формы в нижней части брюшной полости посередине. В одних случаях это связано с накоплением фотосенсибилизаторов в данных органах в концентрациях, недостаточных для визуализации, в других - с высоким накоплением фотосенсибилизатора в окружающих органах и тканях. Для примера приведены изображения мочевого пузыря у мыши линии СВА через 3 ч после введения фотодитазина (фиг.2Б) и почек у мыши линии balb/c через 5 ч после введения Аласенса (фиг.2В). В некоторых случаях идентификация отдельных органов на изображениях была невозможна по причине свечения всей брюшной полости, как, например, у мыши линии BDF через 46 ч после введения фотосенса (фиг.3). Усредненная интенсивность сигнала в проекции брюшной полости при этом составляла 850 отн.ед.
Пример 2.
Наблюдение биораспределения фотосенсибилизатора в организме животного и подтверждение результата стандартными методами. Выполнено на мышах линии BDF с опухолью карцинома легких Льюис, трансплантированной в подлопаточную область. Исследование начали на 12-й день после перевивки опухоли, когда максимальный линейный размер опухоли составлял 1.2 см. Фотосенс вводили внутривенно в дозе 1 мг/кг. Технические характеристики ДФТ-установки описаны в примере 1. Первое изображение (контроль) получали до введения фотосенсибилизатора, последующие - каждые 30 мин in vivo в течение 6 ч, а также через 24 ч. Далее проводили эвтаназию животного под наркозом и анализировали флюоресценцию образцов опухолевой ткани ex vivo методами флюоресцентной спектроскопии и лазерной конфокальной флюоресцентной микроскопии.
Обнаружено in vivo накопление Фотосенса как в опухоли, так и в нормальных органах и тканях (фиг.4А). Установлено, что к 24 ч после введения Фотосенс достигает максимума накопления в опухоли и внутренних органах. На полученном изображении отчетливо визуализируется печень в виде обширной светлой области в левой части проекции брюшной полости. Область печени на изображении имеет наибольшую интенсивность сигнала - порядка 6000 отн.ед. (в контроле - 80 отн.ед.), что обусловлено очень высоким содержанием Фотосенса. Интенсивность сигнала в опухоли не превышала 850 отн.ед. (в контроле - 110 отн.ед.). Наблюдается флюоресценция кожи. Высокое свечение кожи на изображении связано с ее высокой прозрачностью для возбуждающего излучения. Интенсивность сигнала в коже в области подмышечных впадин составляла 2700 отн.ед. (в контроле 400 отн.ед.). Полученные данные о биораспределении фотосенса подтверждаются стандартными методами. Спектры флюоресценции органов и тканей с фотосенсом имеют характерную форму с пиком на 685 нм (фиг.4Б). Максимальная интенсивность флюоресценции характерна для образца печени (23000 отн.ед.). Флюоресценция опухолевой ткани была меньше (6500 отн.ед.). Небольшая по сравнению с печенью и опухолью флюоресценция характерна для кожи (1500 отн.ед.). На микрофотографиях (фиг.5) отмечается интенсивная флюоресценция фотосенсибилизатора в клетках печени и опухоли. Значительно меньше флюоресцирующих участков найдено в образцах кожи.
Пример 3.
Прижизненный мониторинг биораспределения фотосенсибилизатора Фотосенс. Исследование проводилось на мышах-самках линии СВА с трансплантированным в подлопаточную область раком шейки матки РШМ-5. Перед началом исследования с тела животного в области сканирования удалялся волосяной покров путем машинной стрижки и последующей обработки кремом для эпиляции. В качестве источника облучения использовался полупроводниковый лазер с длиной волны 635 нм и мощностью на объекте 10 мВт. Для разделения спектров возбуждения и флюоресценции использовался фильтр HQ 710/50. Приемником служил высокочувствительный охлаждаемый ФЭУ. Сканирование осуществлялось путем пошагового синхронного перемещения источника и приемника, расположенных в конфигурации «на просвет», шаг сканирования 1 мм. Для процедуры сканирования животное фиксировалось на специальной подставке между двумя стеклянными пластинами с легким прижатием (расстояние между пластинами 1.2 мм). Область сканирования составляла 30×40 мм. Исследование начали на 10-й день после перевивки опухоли, когда максимальный линейный размер опухоли составлял 1 см. Фотосенс вводили внутривенно в дозе 1 мг/кг. На ДФТ-установке сканирование животного проводили до введения фотосенсибилизатора (контроль), после введения каждые 60 мин в течение 4 ч, далее - 1 раз в сутки. Максимальный срок наблюдения составлял 96 ч.
Полученное контрольное изображение имеет низкую интенсивность сигнала. Более светлыми выглядят участки натянутой кожи в области подмышечных впадин, т.к. они более прозрачны для возбуждающего света (фиг.6А). В течение первого часа после введения фотосенсибилизатор поступает в опухоль, кожу и внутренние органы. К 2 ч наблюдения сигнал в зонах накопления фотосенсибилизатора возрастает и в течение следующих 24 ч сохраняется на том же уровне (фиг.6Б). Это позволяет судить о достижении максимума накопления. В максимуме накопления фотосенса опухоль выглядит как яркая однородная область, контрастная по отношению к окружающим тканям. Очень высокая интенсивность сигнала характерна для печени. Фотосенс присутствует и в других органах брюшной полости (возможно в кишечнике и селезенке), о чем свидетельствует наличие других светлых участков, кроме печени, в проекции брюшной полости. Но идентификация этих органов не представляется возможной в связи с особенностями анатомического строения животного. Через 48 ч после введения фотосенс удерживается в опухоли, но на изображении опухолевая ткань выглядит неоднородной, содержит более темные участки. При этом содержание фотосенсибилизатора в печени снижается, а на изображении уменьшается площадь яркого светящегося участка в проекции печени (фиг.6В). Через 72 ч флюоресценция опухоли сохраняется на том же уровне. Тогда как флюоресценция печени продолжает снижаться, интенсивность сигнала в проекции органа падает (фиг.6Г). Через 96 ч наблюдается практически полное выведение фотосенса из внутренних органов. В опухоли интенсивность сигнала снижается. Однако величина сигнала выше, чем в контроле, и опухоль на изображении все еще хорошо различима (фиг.6Д). Флюоресценция кожи на протяжении всего времени наблюдения практически не изменяется.
Пример 4.
Прижизненный мониторинг биораспределения 5-алк-индуцированного протопорфирина IX. Выполняли на ДФТ-установке, описанной в примере 3. Моделью опухоли служил рак шейки матки РШМ-5, привитый мышам линии СВА в область лопатки. Исследование начали на 13-й день после перевивки опухоли, когда максимальный линейный размер опухоли составлял 1 см. Препарат Аласенс вводили перорально в дозе 400 мг/кг. Собственно Аласенс (5-алк, 5-аминолевулиновая кислота) фотосенсибилизатором не является. Введение его в организм приводит к повышенному, относительно здоровых тканей, накоплению эндогенного фотоактивного соединения протопорфирина IX в опухолевых клетках. На ДФТ-установке сканирование животного проводили до введения препарата (контроль), затем каждые 30 мин в течение 6 ч и через 24 ч. При подготовке к сканированию исследуемую часть тела животного эпилировали, а животное фиксировали на специальной подставке. Область сканирования составляла 30×40 мм.
После введения Аласенса изменения на изображениях отмечаются через 1.5-2 ч (фиг.7А, Б). В это время на изображениях появляется печень, которая выглядит как область неправильной формы со средней интенсивностью сигнала в проекции брюшной полости. При дальнейшем наблюдении немного увеличивается ее площадь (фиг.7Б, В, Г). Наибольшая флюоресценция печени, вызванная накоплением протопорфирина IX, наблюдается через 6 ч (фиг.7Д). Накопление фотосенсибилизатора в опухоли начинается чуть позже, чем во внутренних органах, а именно - через 3 ч после введения аласенса. Постепенно интенсивность сигнала в опухоли повышается, и максимум накопления достигается к 6 ч. Интенсивность сигнала в коже начинает возрастать с 2 ч наблюдения и достигает максимума также к 6 ч. Через 24 ч сохраняется небольшая флюоресценция в коже. К этому времени наблюдается практически полное выведение фотосенсибилизатора из опухолевой ткани, т.к. сигнал в опухоли значительно снижается (фиг.7Е). Флюоресценция в органах брюшной полости сохраняется, однако происходит выведение фотосенсибилизатора из печени и его перераспределение. В проекции брюшной полости наблюдается обширная зона флюоресценции, и отдельные органы не идентифицируются (фиг.7Е).
Пример 5.
Количественная оценка биораспределения фотосенсибилизаторов в организме. Выполнена количественная оценка накопления и распределения фотосенсибилизаторов в тканях животных, представленных в примерах 3 и 4.
На получаемых ДФТ-изображениях каждой точке соответствует определенная интенсивность сигнала, которая складывается из интенсивности сигналов возбуждающего лазерного излучения, проходящего сквозь тело животного, и флюоресценции. В качестве параметра для количественной оценки использовали усредненное значение сигнала по областям опухоли, печени, других органов брюшной полости, кожи, грудной клетки. Области усреднения сигнала на ДФТ-изображениях, полученных прижизненно через разные интервалы времени, были одинаковы и содержали не менее 50 значений.
Показано, что фотосенсибилизатор Фотосенс длительно удерживается в опухоли и органах брюшной полости (фиг.8А). В первые 1.5 ч значительно возрастает интенсивность сигнала в печени (с 52 до 1574 отн.ед.) и опухоли (со 138 до 1001 отн.ед.). В дальнейшем высокий уровень флюоресценции сохраняется в опухоли в течение 72 ч. Через 90 ч интенсивность сигнала в опухоли снижается до 642 отн.ед. В печени и других органах брюшной полости интенсивность ДФТ-сигнала варьирует. Через 24 ч после введения фотосенса флюоресценция печени ниже, чем в первые часы наблюдения, и составляет 405 отн.ед. Через 48 ч флюоресцения немного возрастает (678 отн.ед), а через 72 ч опять снижается (542 отн.ед). Отмечено, что перераспределение фотосенсибилизатора в организме животного происходит таким образом, что при снижении флюоресценции в печени наблюдается возрастание сигнала в других органах брюшной полости. При этом значения интенсивности составляют 393 отн.ед. через 24 ч, 203 отн.ед. через 48 ч, 224 отн.ед. через 72 ч. К 90 ч наблюдения отмечается снижение сигнала как в печени, так и в других органах в связи с выведением до 154 и 43 отн.ед. соответственно. Динамика накопления фотосенса в коже характеризуется возрастанием флюоресценции на протяжении 48 ч и последующим удержанием на более-менее одинаковом уровне порядка 770 отн.ед.
В случае 5-алк-индуцированного протопорфирина IX отмечена другая динамика биораспределения (фиг.8Б). Накопление данного фотосенсибилизатора в опухоли и нормальных тканях происходит постепенно и достигает максимума к 6 ч наблюдения. Небольшая флюоресценция в опухоли (109 отн.ед) и печени (136 отн.ед.) появляется уже через 30 мин после введения препарата. Интенсивность сигнала в опухоли резко возрастает через 3 ч (до 405 отн.ед.), а через 6 ч она составляет 628 отн.ед. Флюоресценция в печени через 6 ч находится на том же уровне, что и в опухоли (662 отн.ед.). Накопление фотосенсибилизатора в других органах брюшной полости невелико. Интенсивность сигнала в данной области постепенно возрастает к 2 ч (с 58 отн.ед. в контроле до 89 отн.ед.) и далее удерживается на невысоком уровне. В коже небольшая флюоресценция протопорфирина отмечается через 2 ч. Через 3 ч интенсивность сигнала в коже возрастает до 690 отн.ед. при контрольном значении 325 отн.ед. и сохраняется на данном уровне минимум в течение часа. К 6 ч наблюдения отмечается новое возрастание флюоресцении в коже.
Характерно, что флюоресценция фотосенса в опухоли выше, чем протопорфирина IX. Средняя интенсивность сигнала в максимуме накопления достигает 1034 и 628 отн.ед. соответственно. Интенсивность ДФТ-сигнала в области грудной клетки в обоих случаях не изменяется.
Таким образом, установили in vivo, что предлагаемое изобретение позволяет наблюдать биораспределение фотосенсибилизаторов разной химической природы в организме экспериментальных животных. Показано прижизненное детектирование флюоресценции фотосенсибилизаторов в опухоли, коже и органах брюшной полости. Нами были выявлены различия во флюоресцентных свойствах и фармакокинетике фотосенсибилизаторов, которые соответствуют данным, полученным стандартными инвазивными методами.
Литература
1. Морозова Н.Б., Якубовская Р.И., Деркачева В.М., Лукъянец Е.А. Биораспределение препарата фталосенса у интактных животных и животных с опухолями различного гистогенеза // Российский онкологический журнал. - 2007. - №1. - С.37-43.
2. Смирнова З.С., Оборотова Н.А., Макарова О.А. и др. Эффективность и фармакокинетика липосомальной лекарственной формы фотосенсибилизатора "Фотосенс" на основе сульфофталоцианина алюминия // Химико-фармацевтический журнал. - 2005 - Т.39. - №7. - С.3-6.
3. Schneckenburger Н., Lang М., Kollner Т. et. al. Fluorescence spectra and microscopic imaging of porphyrins in single cells and tissues // Lasers in Medical Science. - 1989. - V.4. - №159. - P.159-166.
4. Назарова А.И., Феофанов А.В., Кармакова Т.А. и др. Влияние заместителей на фотохимические и биологические свойства 13,15-N-циклоимидных производных хлорина р6. // Биоорганическая химия. - 2005. - Т.31. - №5. - С.1-14.
5. Peavy G.М., Krasieva Т.В., Tromberg B.J., et. al. Variation in the distribution of a phthalocyanine photosensitizer in naturally occurring tumors of animals // J. Photochem. Photobiol. - 1995. - V.27. - P.271-277.
6. Bulgakova N.N., Kazachkina N.I., Sokolov V.V., Smirnov V.V. Local fluorescence spectroscopy and detection of malignancies using laser excitation at various wavelengths // Laser Physics. - 2006. - V.16. - №5. - P.889-895.
7. Loschenov V.В., Konov V.I., Prokhorov A.M. Photodynamic therapy and fluorescence diagnostics // Laser Physics. - 2000. - V.10. - №6. - P.1188-1207.
8. Фомина Г.И. Изучение новых фотосенсибилизаторов, предназначенных для флюоресцентной диагностики и фотодинамической терапии опухолей // Автореф. дис…канд.биол.наук. M., 2001, 33 с.
9. Zacharakis G., Kambara H., Shih H., et. al. Volumetric tomography of fluorescent proteins through small animals in vivo // PNAS. - 2005. - V.102. - №51. - P.18252-18257.
10. Montet X., Figueiredo J., Alencar H., et. al. Tomographic fluorescence imaging of tumor vascular volume in mice // Radiology. - 2007. - V.242. - №3. - P.751-758.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРИЖИЗНЕННОГО ИССЛЕДОВАНИЯ ФОТОСЕНСИБИЛИЗАТОРОВ | 2008 |
|
RU2373973C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ОПУХОЛЕЙ | 2012 |
|
RU2519936C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОПТИМАЛЬНЫХ РЕЖИМОВ ФЛУОРЕСЦЕНТНОЙ ДИАГНОСТИКИ И ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2008 |
|
RU2376044C1 |
| СУЛЬФОЗАМЕЩЕННЫЕ ФТАЛОЦИАНИНЫ КАК ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 1999 |
|
RU2183635C2 |
| СПОСОБ ФЛЮОРЕСЦЕНТНОЙ ДИАГНОСТИКИ НОВООБРАЗОВАНИЙ | 2001 |
|
RU2218570C2 |
| СПОСОБ ЭНДОСКОПИЧЕСКОЙ ФЛЮОРЕСЦЕНТНОЙ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ПОЛЫХ ОРГАНОВ | 1997 |
|
RU2129273C1 |
| СПОСОБ ЛЕЧЕНИЯ ПОВЕРХНОСТНОГО РАКА МОЧЕВОГО ПУЗЫРЯ | 2010 |
|
RU2448745C2 |
| ОКТА-4,5-КАРБОКСИФТАЛОЦИАНИНЫ КАК ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2000 |
|
RU2193563C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОБЪЕМА РЕЗЕКЦИИ МОЧЕВОГО ПУЗЫРЯ ПРИ ЭНДОСКОПИЧЕСКОМ ЛЕЧЕНИИ РАКА МОЧЕВОГО ПУЗЫРЯ | 2006 |
|
RU2317009C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ НОВООБРАЗОВАНИЙ КОЖИ ВЕК | 2007 |
|
RU2350262C2 |





Изобретение относится к экспериментальной медицине, а именно к экспериментальной онкологии, и может быть использовано для исследования биораспределения фотосенсибилизаторов в организме мелких лабораторных животных. Животному вводят фотосенсибилизатор. Проводят регистрацию флюоресценции прижизненно и неинвазивно методом диффузионной флюоресцентной томографии с использованием прибора, в котором источник и приемник излучения расположены в конфигурации «на просвет». Анализ интенсивности флюоресценции проводят по изображениям животного во фронтальной плоскости. Регистрацию флюоресценции осуществляют как в органах брюшной полости, так и в натянутых участках кожи и брюшной области в целом. В качестве натянутых участков кожи используют кожу подмышечных впадин. Способ позволяет проводить исследования прижизненно и неинвазивно, оценивать накопление фотосенсибилизатора в коже для выбора фотосенсибилизатора с минимальной кожной фототоксичностью, позволяет оценить накопление фотосенсибилизатора в тканях, не прибегая к идентификации органов при изучении динамики накопления и выведения фотосенсибилизаторов. 1 з.п.ф-лы, 8 ил.
1. Способ исследования биораспределения фотосенсибилизатора, включающий введение фотосенсибилизатора экспериментальному животному, прижизненное и неинвазивное исследование методом диффузионной флюоресцентной томографии с использованием прибора, в котором источник и приемник излучения расположены в конфигурации «на просвет», и последующую регистрацию флюоресценции в органах брюшной полости, отличающийся тем, что регистрацию флюоресценции осуществляют как в органах брюшной полости, так и в натянутых участках кожи и брюшной полости в целом.
2. Способ по п.1, отличающийся тем, что в качестве натянутых участков кожи используют кожу подмышечных впадин.
| ЗАГАЙНОВА Е.В., Флюоресцентный имиджинг глубоко локализованных опухолей | |||
| Российский Биотерапевтический Журнал | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| SERDAROGLU A et al | |||
| Fluorescence molecular tomography based on a priori information | |||
| Proceedings of the Optical Society of America (OSA) Biomedical Optics Meeting, Fort Lauderdale, FL, March 2006, [он лайн] | |||
Авторы
Даты
2010-07-20—Публикация
2008-09-24—Подача