1. Введение
Рак является важной проблемой здравоохранения в мире. Несмотря на то что сделаны успехи в обнаружении и лечении рака, в настоящее время не существует вакцины или другого общепризнанного универсально успешного профилактического или терапевтического средства. Устранение болезни в настоящее время основывается на комбинации раннего диагноза и интенсивной терапии, которая может включать один или больше разнообразных видов лечения, таких как хирургическое, лучевую терапию, химиотерапию и гормональную терапию. Несмотря на то что такие виды лечения приносят пользу многим пациентам, для многих видов рака продолжает сохраняться высокая летальность. Создание усовершенствованных противораковых препаратов будет способствовать предупреждению и лечению рака.
К сожалению, рак является главной причиной смерти, второй только по отношению к сердечной болезни, и для мужчин и для женщин. В борьбе с раком созданы многочисленные методы, и они остаются предметом современных исследований, направленных на понимание природы и причины болезни, обеспечивая способы для ее контроля или излечения.
Хотя оценены тысячи потенциальных противораковых веществ, лечение рака человека остается полным сложностей, которые часто представляют собой набор субоптимальных альтернатив лечения. По существу, желательным дополнением к способам терапевтического воздействия, доступным онкологу в настоящее время, могли бы быть терапевтические препараты, имеющие небольшую токсичность или не имеющие ее, являющиеся недорогими для получения или изготовления, являющиеся хорошо переносимыми пациентом и легко применяемыми. Также желательными являются вещества, которые будут селективно повышать чувствительность злокачественной ткани для того, чтобы допустить применение более низких доз облучения или терапии для достижения того же самого терапевтического эффекта с меньшим ущербом для здоровых тканей. Подобным образом, желательными являются также вещества, которые не допускают появления рака или его повторного появления. Настоящее изобретение возмещает эти потребности, предоставляя такие химиотерапевтические и сенсибилизирующие вещества.
Следовательно, технической задачей, лежащей в основе настоящего изобретения, является предоставление альтернативных или добавочных соединений с противораковой активностью и способов для клинического применения.
Данная проблема решена предоставлением вариантов осуществления, как определено в формуле изобретения.
Соединения данного изобретения пригодны в лечении рака. Они являются эффективными в ингибировании выживания и/или роста раковых клеток и/или для ингибирования нежелательного клеточного роста вообще.
Затем данное изобретение обеспечивает фармацевтические и терапевтические композиции, которые содержат фармацевтически или терапевтически эффективное количество этих соединений, и терапевтические средства и способы лечения, использующие такие соединения. Конкретнее, данное изобретение относится к способам лечения рака применением орально (пероральным приемом) натриевой соли мышьяковистой кислоты, раскрытым в данном описании.
Роль триоксида мышьяка в лечении рака, как описано некоторыми изобретателями, отличается от данного изобретения, тогда как роль мышьяка (WO 800245; Komipharm International) в лечении злокачественных новообразований была ограничена первичными опухолями.
Также заявленным является набор для ингибирования ненормального клеточного роста, содержащий натриевую соль мышьяковистой кислоты и/или синтетические аналоги, модификации и фармакологически активные фрагменты этого.
Прежде чем настоящие соединения, композиции, формулировки и способы описаны, необходимо иметь в виду, что данное изобретение не ограничивается отдельными соединениями, способами, композициями и терапевтическими показаниями, описанными здесь, так как такие способы, композиции и терапевтические показания, конечно, меняются. Также необходимо иметь в виду, что используемая здесь терминология существует только с целью описания конкретных вариантов описания изобретения и не имеет целью ограничивать рамки настоящего изобретения, которое является определенным только прилагаемой формулой изобретения.
При применении в данном описании, включая прилагаемые пункты формулы изобретения, формы единственного числа слов, такие как "a," "an" и "the", включают их соответствующие упоминания во множественном числе, если контекст явно не диктует по-другому. Таким образом, например, ссылка на "организм" включает один или больше различных организмов, ссылка на "клетку" включает одну или больше таких клеток, и ссылка на "способ" включает ссылку на равноценные действия и способы, известные среднему специалисту в данной области техники, и так далее.
Если не определено иначе, все используемые здесь технические и научные термины имеют то же самое значение, как обычно понимает средний специалист в области техники, к которой данное изобретение относится. Хотя в выполнении или опробовании настоящего изобретения могут быть использованы способы и материалы, сходные или равноценные тем, которые описаны здесь, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки и другие ссылки, рассмотренные ранее, предоставлены только для их раскрытия до даты подачи настоящей заявки. Ничто в данном описании не является истолкованным как допущение, что изобретение является не имеющим права предвидеть такое раскрытие на основании его предшествующего изобретения. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые здесь, включены путем отсылки целиком, включая все чертежи.
Прежде размещения далее изобретения может быть полезно для его понимания поставить вперед формулировки определенных терминов, которые используются в дальнейшем.
"Пациент" в целях настоящего изобретения включает человека и других животных, особенно млекопитающих, и другие организмы. Таким образом, способы являются применимыми и в лечении человека и при использовании в ветеринарии. В предпочтительном варианте осуществления пациент является млекопитающим, а в наиболее предпочтительном варианте осуществления - человеком.
Термин "животное" относится к организму с замкнутой кровеносной системой кровеносных сосудов и включает птиц, млекопитающих и крокодилов. Термин "животное", использованный в данном описании, также включает человеческие субъекты.
Термин "ангиогенез" относится к порождению новых кровеносных сосудов в клетки, ткани, органы или опухоли.
Термин "метастаз" относится к процессу, посредством которого опухолевые клетки распространяются в отдаленные части тела. Данный термин также используется здесь для того, чтобы сослаться на опухоль, которая развивается вследствие метастатического процесса.
Термин "связанный" используется здесь взаимозаменяемо со следующим: объединенный с, добавленный к, смешанный с, пассируемый на, инкубированный с, происходящий из и т.д. Кроме того, соединения настоящего изобретения могут быть "введены" любым традиционным способом, таким как, например, парентеральный, оральный и местный пути и путем ингаляции, как описано здесь.
При использовании в данном описании термин "безопасное и эффективное количество" относится к количеству компонента, которое является достаточным для того, чтобы приводить к желательному терапевтическому ответу без чрезмерно вредных побочных эффектов (таких как токсичность, раздражительность или аллергический ответ) соразмерно с приемлемым отношением польза/риск при применении по способу данного изобретения. То, что означается термином "терапевтически эффективное количество", представляет собой количество соединения настоящего изобретения, эффективного для того, чтобы давать желательный терапевтический ответ. Данное количество, например, может быть эффективным в задержке роста, задержке метастазирования, ингибировании ангиогенеза и/или теломеры и/или служить причиной уменьшения рака, или саркомы, или лимфомы. Конкретное безопасное и эффективное количество или терапевтически эффективное количество будет изменяться с такими факторами, как конкретное состояние, подлежащее лечению, физическое состояние пациента, тип млекопитающего, подвергающегося лечению, продолжительность лечения, природа сопутствующей терапии (если это имеет место) и определенные применяемые формулировки и структуры соединений или их производных.
"Анти-ангиогенное" количество относится к количеству соединения или композиции, эффективному для того, чтобы ослабить, подавить или ингибировать ангиогенез или приводить к улучшению симптомов, связанных с ангиогенной болезнью. Желательным результатом может быть или субъективное облегчение симптома(ов), или объективно идентифицируемое улучшение у получателя дозы, уменьшение васкуляризации эндотелиальных клеток или уменьшение в скорости ангиогенеза, как отмечается клиницистом или другим квалифицированным экспертом.
Термины "лечение рака", "терапия" и тому подобное относятся в целом к любому улучшению у млекопитающего, имеющего рак, у которого улучшение может быть приписано лечению с соединениями настоящего изобретения. Улучшение может быть или субъективным, или объективным. Например, если млекопитающее является человеком, пациент может заметить улучшение силы или энергичности или уменьшение боли в качестве субъективных симптомов улучшения или ответа на терапию. Альтернативно, клиницист может заметить уменьшение размера или тяжести опухоли, основываясь на медицинском осмотре, лабораторных параметрах, опухолевых маркерах или радиографических данных. Некоторые лаборатории отмечают, что клиницист может наблюдать в качестве ответа на терапию за нормализацией тестов, включая такие как количество лейкоцитов, количество эритроцитов, количество тромбоцитов, скорость оседания эритроцитов и уровни различных ферментов. Кроме того, клиницист может наблюдать уменьшение обнаруживаемого опухолевого маркера. Альтернативно, могут быть использованы другие тесты для оценки объективного улучшения, такие как эхограммы, исследование методом ядерного магнитного резонанса и исследование методом позитронной эмиссионной томографии.
"Ингибирование роста опухолевых клеток" может быть оценено любым общепринятым способом измерения, является ли рост опухолевых клеток замедленным или уменьшенным. Это включает прямое наблюдение и непрямую оценку, такую как субъективные симптомы или объективные признаки, как обсуждено выше.
Таким образом, композиции изобретения вводят в клетки. Под "введенный" здесь подразумевается ведение терапевтически эффективной дозы веществ-кандидатов изобретения в клетку или клеточную культуру или пациенту. Под "терапевтически эффективной дозой" здесь подразумевается доза, которая вызывает действия, для которых она введена. Точная доза будет зависеть от цели лечения, будет устанавливаться специалистом в данной области техники с применением известных методик. Как известно в данной области, приспособления для системной против (в сравнении с) локализованной доставки, возраст, вес тела, общее здоровье, пол, диета, время введения, взаимодействие веществ и тяжесть состояния могут быть необходимы и могут быть установлены специалистом в данной области обычным экспериментированием. Под "клетками" здесь подразумевается почти любая клетка, в которой митоз или мейоз может быть изменен.
Следовательно, настоящее изобретение относится к фармацевтической противораковой композиции, содержащей терапевтически эффективное количество натриевой соли мышьяковистой кислоты следующей формулы (I):
O=As-O-Na+
2. Область техники
Настоящее изобретение относится к соединениям, способам и композициям для лечения первичных и метастатических неопластических болезней, включая, но без ограничения, мочеполовые карциномы.
Конкретнее, настоящее изобретение относится к новым химиотерапевтическим композициям натриевой соли мышьяковистой кислоты и методам нового применения орально мышьяковых соединений для лечения рака простаты, первичных и метастатических опухолей мочеполовой системы; и мочевого пузыря, почки, семенника и метастатического рака кости.
3. Предшествующий уровень техники
Большинство химиотерапевтических веществ в настоящее время создано для внутривенного применения. Оральное лечение противоопухолевыми веществами в настоящее время, однако, представляет интерес вследствие преимуществ легкого применения, лучшего одобрения пациента и уменьшения в стоимости и увеличения качества жизни пациентов. Например, пациенты могут подвергаться оральному лечению как амбулаторные больные.
Поэтому понятно, что у оральных препаратов для лечения рака есть будущее, и они будут играть более важную роль, чем они играли в прошлом. Появляются соображения о предпочтениях пациентов и качестве жизни, которые становятся главными соображениями в паллиативных режимах лечения, предваряя создание веществ, применяемых орально. Внутривенное введение (в/в) является главным источником неудобства и стресса для раковых пациентов, и приблизительно 90% опрошенных пациентов высказывают предпочтение в пользу оральной против в/в химиотерапии, преимущественно вследствие удобства применения за пределами клинической обстановки или предшествующих проблем, связанных с внутривенным доступом.
Одна из ключевых целей настоящего изобретения - предоставить химиотерапевтический продукт для лечения рака, который проявляет высокую биодоступность, увеличенную противораковую активность и высокий уровень безопасности после орального введения.
3.1. Мочеполовой рак
В число мочеполовых злокачественных образований входят (в числе других) раки простаты, мочевого пузыря, почки и яичка. Проблемы, представленные этими злокачественными образованиями, подобны тем, с которыми сталкиваются исследователи и практикующие клиницисты при лечении всех других типов рака. Курение, которое сильно связано с развитием рака легкого, обусловливает одну третью часть раков мочевого пузыря, а некоторые исследования связывают тучность с повышенным риском для раков толстой кишки, молочной железы и почки.
3.2. Рак мочевого пузыря
Карциномы мочевых путей встречаются в 90% случаев прямо в мочевом пузыре, в 8% в почечной лоханке и в 2% в мочеточнике или мочеиспускательном канале. Рак мочевого пузыря является четвертым наиболее общим раком среди мужчин и восьмым среди женщин. Существуют предположения, что 25% раков мочевого пузыря у мужчин связаны с профессиональным облучением и 50% с курением сигарет. Курение является ключевым определяющим фактором риска, который сохраняется в течение до 10 лет после прекращения курения. Выбор лечения основывается на степени болезни: поверхностная, инвазивная или метастатическая. Комбинированную химиотерапию применяют для лечения метастатической болезни. Уротелиальные опухоли являются химиочувствительными, и некоторое количество отдельных препаратов приводит к кратковременным регрессиям в от 20 до 30 процентах случаев. Один режим называется MVAC режимом. Он состоит из комбинированного лечения метотрексатом, винбластином, адриамицином (доксорубицином) и цисплатином. Некоторые препараты дают в течение нескольких дней с лекарствами, затем повторяют каждые несколько недель в течение нескольких месяцев.
3.3. Рак почки
Почечно-клеточный рак приводит к 90-95 процентам злокачественных новообразований, возникающих из почки. Почечно-клеточная карцинома поражает более 30000 американцев ежегодно и обусловливает около 12000 смертей в Соединенных Штатах каждый год. Рак почки обыкновенно появляется у взрослых в возрасте между 50 и 70 годами, хотя он описан у детей младше 3 лет. Рак почки обусловливает приблизительно 3% новообразований у взрослых, причем отношение мужчин и женщин составляет 1,5:1. Существует сильная корреляция между курением сигарет и развитием почечно-клеточного рака. Недоказанные факторы, которые могут увеличить риск рака почки, включают поликистозную болезнь почки, сахарный диабет и хронический диализ. До 85% раков почки представляют собой светлоклеточный тип; от 5% до 15% раков почки представляют собой сосочковую гистологическую разновидность. Основным типом лечения рака почки является хирургия, хотя также может быть рекомендована лучевая терапия. Для некоторых людей может быть использовано гормональное лечение или биологическое лечение или после хирургического вмешательства или в том случае, когда рак не может быть удален хирургическим путем. Иногда рак почки спонтанно исправляется без какого-либо лечения, но это происходит редко. Все еще не показано, что химиотерапия является полезной в лечении рака почки.
3.4. Тестикулярный рак
Тестикулярный рак поражает главным образом молодых мужчин в возрастной группе от 20 до 44 лет, где он является наиболее обычным раком. В целом, тестикулярный рак является не очень обычным. Тестикулярный рак очень хорошо поддается лечению, и больше 9 из 10 пациентов излечивается. Первичные опухоли половых клеток (GCTs) яичка, являющиеся результатом злокачественной трансформации примордиальных (первичных) половых клеток, составляют 95 процентов тестикулярных новообразований. Эта болезнь примечательна молодым возрастом пациентов, пораженных болезнью, тотипотентной способностью для дифференциации опухолевых клеток и ее излечимостью; больше чем 90 процентов всех вновь диагностированных пациентов будет излечено, а после прихода химиотерапии на основе цисплатина излечивается приблизительно от 70 до 80 процентов пациентов с метастатической болезнью.
Обычно используемыми видами лечения являются хирургия, лучевая терапия и химиотерапия, в зависимости от стадии рака и его распространения. Химиотерапия наиболее часто применяется для не семиномных тестикулярных раков, однако она также используется для распространенной семиномы. Тестикулярный рак можно лечить различными комбинациями препаратов, наиболее часто в комбинациях используют ВЕР, Блеомицин, Этопозид и Цисплатин.
3.5. Рак предстательной железы
Рак предстательной железы представляет собой наиболее общее злокачественное заболевание мужчин в Соединенных Штатах и является третьей наиболее общей причиной смерти от рака у мужчин в возрасте старше 55 (после карциномы легкого и толстой кишки). Наиболее обычным лечением рака предстательной железы на начальной стадии является хирургия с последующей рентгенотерапией. Существуют также различные виды гормональной терапии. Клетки рака простаты не имеют тенденции к быстрому росту, как некоторые другие типы рака. По этой причине не доказано, что традиционные химиотерапевтические препараты являются вполне такими же полезными, как они являются при других значительных раках. Тем не менее, как было показано, некоторые обычные химиотерапевтические препараты являются пригодными, особенно на поздней стадии рака предстательной железы. Хотя существует три химиотерапевтические препарата, утвержденные Администрацией по контролю за продуктами питания и лекарствами США для применения при раке предстательной железы, - Таксотер® (доцетаксель), Новантрон® (митоксантрона гидрохлорид) и Эмцит® (эстрамустин натрий фосфат) - применяется некоторое количество наиболее обычных химиотерапевтических средств, утвержденных для других раков, на «неотмеченной (неутвержденной)» основе для рака простаты на поздней стадии. Химиотерапия обычно используется у пациентов с запущенной стадией рака простаты, которые долго не реагируют на гормональную терапию. Ни один из этих препаратов не является последовательно полезным при болезни. Наиболее обычными местами метастазов у пациентов с раком предстательной железы являются кость и лимфатические узлы. Костные метастазы являются особенно мучительными, так как они могут вызывать сильную боль у пациента.
3.6. Вторичный рак кости
Вторичный рак кости не начинается в кости, а является результатом распространения раковых клеток в кость из первичной опухоли. Иногда только один участок кости является затронутым, но у других людей развивается некоторое количество костных производных, часто в различных костях в теле. Хотя любой тип рака может распространиться в кость, наиболее обычными типами являются раки молочной железы, предстательной железы, легкого и щитовидной железы. Лечение для вторичного рака кости зависит от типа первичного рака. Например, клетки рака предстательной железы могут отделиться от предстательной железы, переместиться с кровью в кость и начать расти и увеличиваться на этом месте. Такие раковые клетки в кости будут реагировать на тот же самый тип лечения, как раковые клетки в предстательной железе. Хотя вторичный рак кости может встречаться в любой кости в теле, в большинстве случаев затронутыми костями являются кости позвоночника, ребра, тазовые кости, кости черепа и верхние кости рук и ног.
3.7. Мышьяк и его медицинское применение
Мышьяк использовали в качестве фармацевтического средства в течение более чем 2400 лет для лечения целого ряда болезней, включая рак, но он является также ядом и канцерогенным веществом. С быстрым развитием медицины в 20 веке применение лекарственного мышьяка быстро сокращалось. Интерес к мышьяковым соединениям возродился, когда было показано, что ежедневное внутривенное введение одного триоксида мышьяка вызывало полные ответы у значительного большинства пациентов с вновь диагностированной и рецидивной острой промиелоцитарной лейкемией. Дополнительные испытания идут полным ходом у пациентов с гематологическими злокачественными болезнями и солидными опухолями, такими как рак предстательной железы и рак поджелудочной железы. Недостатком триоксида мышьяка является то, что его вводят внутривенно ежедневным вливанием в течение 1-4 часов на протяжении до 6 недель. Пилотное (предварительное) исследование с применением оральной формулировки триоксида мышьяка у пациентов с острой промиелоцитарной лейкемией происходит в настоящее время. Предварительные результаты показывают, что эффективность и побочные эффекты сравнимы с внутривенным введением триоксида мышьяка. То же самое было отмечено в пилотном исследовании орального тетрасульфида тетрамышьяка, даваемого пациентам с острой промиелоцитарной лейкемией. Таким образом, оральный препарат мышьяка с похожей или лучшей эффективностью при лейкемии и солидных опухолях и меньшими побочными эффектами, особенно у пациентов, которым требуется долгосрочный период лечения, будет иметь преимущества в стоимости и качестве жизни. Мышьяк существует и в трехвалентном и в пятивалентном окисленных состояниях, как химически нестабильный сульфид или оксид, или как соль натрия, калия или кальция. Трехвалентные производные мышьяка, содержащие арсенит натрия, и триоксид мышьяка ингибируют многие ферменты, вступая в реакцию с биологическими лигандами, которые имеют доступные серные группы. Пятивалентный мышьяк является агентом, разобщающим митохондриальное окислительное фосфорилирование. Таким образом, не удивительно, что триоксид мышьяка оказывает противоопухолевые эффекты посредством приведения в действие апоптоза, индукцией активных форм кислорода, ингибированием ангиогенеза, а в клетках острой промиелоцитарной лейкемии также деградацией химерного белка PML-RARα. Ответ зависит от клеточного типа и вида мышьяка.
В 1991 году Национальный Институт раковых заболеваний сообщил, что триоксид мышьяка ингибирует рост и стимулирует апоптоз в различных раковых клеточных линиях, и начал исследовательскую программу по оценке его клинической активности при гематологических злокачественных болезнях, таких как острая промиелоцитарная лейкемия, острая миелоидная лейкемия, острая лимфоцитарная лейкемия, хроническая миелогенная лейкемия, неходжкинская лимфома, болезнь Ходжкина, хроническая лимфоцитарная лейкемия, миелодиспластический синдром и множественная миелома. Он также поддерживает исследование на солидных опухолях, таких как запущенный гормоно-резистентный рак предстательной железы и почечно-клеточный рак, и на цервикальном раке и резистентной переходно-клеточной карциноме мочевого пузыря.
Другие клинические исследования находятся в процессе реализации, включая Фазу II Исследований на солидных опухолях. На основе многообещающих доклинических данных полным ходом идут или находятся в завершающих стадиях планирования клинические испытания, поддержанные NCI, по изучению потенциала триоксида мышьяка для лечения солидных опухолей.
4. Раскрытие изобретения
Настоящее изобретение относится к фармацевтической композиции, предназначенной для лечения мочеполовых болезней и костных метастазов, и к способу лечения таких болезней.
Соответственно, настоящее изобретение обеспечивает фармацевтическую композицию, предназначенную для лечения мочеполовых болезней и костных метастазов у человека, где указанная фармацевтическая композиция содержит эффективное количество соли мышьяковистой кислоты и щелочного или щелочноземельного металла и/или фармацевтически приемлемый адъювант (вспомогательное вещество).
Согласно настоящему изобретению указанная соль щелочного металла с мышьяковистой кислотой является мета-арсенитом натрия (AsO2Na) или мета-арсенитом калия (AsO2K).
Эффективным количеством соли мышьяковистой кислоты и щелочного или щелочноземельного металла является 0,0001-1500 мг/кг, предпочтительно 1-1000 мг/кг, более предпочтительно 1-150 мг/кг и наиболее предпочтительно 50-100 мг/кг веса тела/день.
Указанная фармацевтическая композиция предпочтительно встречается в форме для орального введения, где указанная форма для орального введения является таблеткой, капсулой, порошком и/или раствором с фармацевтически приемлемым переносчиком, растворителем или эксципиентом.
Указанная мочеполовая болезнь включает в основном рак предстательной железы, мочевого пузыря, почки и яичка.
Согласно изобретению химиотерапевтический продукт содержит натриевую соль мышьяковистой кислоты, имеющую формулу (I):
O=As-O-Na+
Кроме того, изобретение включает фармацевтические композиции, содержащие такие продукты вместе с фармацевтически приемлемым переносчиком или растворителем. Подходящие переносчики и растворители хорошо известны, так как являются основами технологии приготовления композиций в форме единичной дозировки и для орального введения.
В дополнительном аспекте изобретение включает способ для лечения рака в животном или человеческом теле, способ, содержащий одновременное, раздельное или последовательное введение в указанное тело натриевой соли мышьяковистой кислоты.
Изобретатель исследовал эффективность трех соединений мышьяка различной валентности и метилирования на наборе клеточных линий опухолей человека in vitro, натриевой соли мышьяковистой кислоты (As3+), диметилмышьяковой кислоты (As5+) и мышьяковой кислоты (As5+). Неожиданно натриевая соль мышьяковистой кислоты оказалась наиболее эффективной и показала противоопухолевую активность на модели опухоли человека in vivo, что является основанием для развития натриевой соли мышьяковистой кислоты далее в качестве нового мышьякового соединения. Натриевая соль мышьяковистой кислоты неожиданно была более эффективной in vitro и продемонстрировала дифференциальную активность на лейкемии, меланоме и на линиях рака молочной железы, а не AS2O3. Натриевая соль мышьяковистой кислоты неожиданно является допускающей укорочение теломер клеток рака человека, вызывая клеточное старение и хромосомные аномалии, но не ингибирует прямо теломеразную активность. Результаты показывают, что натриевая соль мышьяковистой кислоты является ингибитором теломеры. Натриевая соль мышьяковистой кислоты быстро всасывалась и после в/в и после орального введения и оставалась в плазме в течение продолжительных периодов. Неожиданно, биодоступность оральной натриевой соли мышьяковистой кислоты была приблизительно 100%. Исследование токсичности на животных показало, что главными органами-мишенями были костный мозг и лимфоидные органы. Таким образом, натриевая соль мышьяковистой кислоты может быть введена орально. Ее можно применять в длительном лечении раковых пациентов с солидными опухолями или лейкемией при уровнях доз ниже максимально переносимых доз (МПД), в одиночку или в комбинации с другими лечебными способами, поддерживая хорошее качество жизни.
Это соединение (NaAsO2) настоящего изобретения разрабатывается как новое противораковое средство. Соединение обладает хорошей цитотоксической активностью на наборе из 43 клеточных линий опухолей человека in vitro со значением IC50 0,6 мкМ. Резко выраженная селективность наблюдалась на опухолевых клеточных линиях, полученных от лейкемии, рака молочной железы и меланомы. В непосредственном сравнении натриевая соль мышьяковистой кислоты неожиданно была по меньшей мере в 15 раз более эффективной, чем клинически используемое вещество триоксид мышьяк, и имела также лучшую дифференциальную активность. Натриевая соль мышьяковистой кислоты, скомбинированная с 5-фторурацилом (5-FU) или винбластином, может давать в результате аддитивные эффекты. Калий в арсените уменьшает цитотоксическую активность.
In vivo натриевая соль мышьяковистой кислоты (орально и интраперитонеально) была неожиданно погранично (предельно) активна на 2/7 подкожно трансплантированных гетеротрансплантатах опухоли человека (почечно-клеточная карцинома RXF 944LX и рак молочной железы MAXF 401). Вообще самая высокая эффективность натриевой соли мышьяковистой кислоты была получена с дозами 1/3-2/3 от максимально переносимой дозы (МПД). Эффективность соединения была лучше при применении ежедневных введений в течение 5 или больше дней по сравнению с прерывистыми режимами (каждые 4 дня ×3, еженедельно ×3).
Удивительно, натриевая соль мышьяковистой кислоты орально показала высокую терапевтическую эффективность у раковых пациентов, страдающих от мочеполового рака, преимущественно предстательной железы и костных метастазов, после лечения 2,5; 10; 12,5; 15; 17,5 и 20 мг натриевой соли мышьяковистой кислоты в виде капсул в течение 14 последовательных дней.
Неожиданно все пациенты чрезвычайно хорошо переносили натриевую соль мышьяковистой кислоты без появления неблагоприятных событий (AE's) или существенных неблагоприятных событий (SAE's). Разработанное лечение не вызывало каких-либо нарушений в ощущении здоровья (самочувствия) у каких-либо пациентов. Не наблюдалось изменения в течение хода исследования в какой-либо активности ЭКГ пациентов, аудиометрии или при неврологических обследованиях.
Неожиданно натриевая соль мышьяковистой кислоты, соединение изобретения, имеет огромные терапевтические преимущества и преимущества безопасности по сравнению с триоксидом мышьяка. Триоксид мышьяка As2O3, как было показано, удлиняет QT и QT интервал, скорректированный с учетом скорости (QTc), что может предрасполагать пациента к потенциально губительной атипической желудочковой тахикардии и служить причиной полной атриовентрикулярной блокады.
Кроме того, неблагоприятные события, случающиеся у 10% или больше пациентов, леченых триоксидом мышьяка, включают усталость, лихорадку, отек, боль в груди, ознобы, реакции в месте инъекции (т.е. боль, эритему, отек), слабость, увеличение веса, тошноту, потерю аппетита, уменьшенный аппетит, понос или частый жидкий стул, рвоту, боль в животе, диспепсию, ангину, запор, гипокалиемию, гипомагниемию, увеличение сывороточного AST (SGOT) и/или ALT (SGPT), гиперкалиемию, гипокальцинемию, головную боль, бессонницу, парестезию, головокружение, тремор, кашель, одышку, носовое кровотечение, гипоксию, плевральный выпот, носоглоточное капание (носовые выделения), свистящее дыхание, уменьшенные дыхательные шумы, крепитирующие хрипы, влажные хрипы, дерматит, зуд, кровоподтеки, сухую кожу, эритему, потение, тахикардию, отклонения ЭКГ, синуситы, простой герпес, инфекции верхних дыхательных путей, артралгию, миальгию, костную боль, боль в спине, боль в шее, боль в конечностях, лейкоцитоз, анемию, тромбоцитопению, нейтропению (может быть лихорадочная), гипотензию, гипертензию, слезотечение, бледность, беспокойство, депрессию, глазное раздражение, неясное зрение и влагалищное кровотечение.
Неожиданно не наблюдалось никаких из этих неблагоприятных событий при оральном применении натриевой соли мышьяковистой кислоты, которая является соединением настоящего изобретения.
5. Подробное описание изобретения
Здесь описаны способы и композиции для лечения первичного и метастатического урологического новообразования и/или костного метастаза.
Изобретение частично основывается на схеме приема для орального введения композиции, содержащей натриевую соль мышьяковистой кислоты. Оно также частично основывается на терапевтической эффективности натриевой соли мышьяковистой кислоты изобретения против определенных раков.
Данное изобретение включает способ лечения первичных солидных опухолей у млекопитающего, который касается введения нелетального и терапевтически эффективного количества натриевой соли мышьяковистой кислоты самой по себе или в комбинации с одним или больше терапевтическими средствами млекопитающему, нуждающемуся в такой терапии.
Изобретение также включает способ лечения нарушений крови у млекопитающих, который касается введения натриевой соли мышьяковистой кислоты самой по себе или в комбинации с одним или больше терапевтическими препаратами пораженному болезнью млекопитающему.
Соединение мышьяка изобретения, натриевая соль мышьяковистой кислоты, может быть использовано в целом ряде известных форм, например, как соль, как органический/неорганический комплекс, как органический хелат, или в форме, инкапсулированной в систему нацеливания лекарства.
Следует признавать, что изобретение включает пролекарства натриевой соли мышьяковистой кислоты или соединения, которые превращаются in vivo в биологически активные формы натриевой соли мышьяковистой кислоты. Такие пролекарства можно применять для того, чтобы уменьшить токсичность или избежать токсичности обычного фармацевтического вещества или оптимизировать лечение и эффективность. Натриевая соль мышьяковистой кислоты может быть синтезирована или приобретена в больших количествах.
В нашем варианте осуществления натриевая соль мышьяковистой кислоты приготовлена в капсулах. Как правило, квалифицированный специалист будет признавать, что форма натриевой соли мышьяковистой кислоты, которую следует применять, должна быть терапевтически эффективной без чрезмерной токсичности.
Любой подходящий путь введения натриевой соли мышьяковистой кислоты можно применять в соответствии с настоящим изобретением, включая, но без ограничения, оральное введение, парентеральное введение, такое как внутривенное, подкожное, внутримышечное и интратекальное, и интраназальное, ректальное или вагинальное введение. Введение также может быть сделано прямо в опухоль или через трансдермальный пластырь или имплантированное устройство (особенно для медленного высвобождения). Также можно использовать местное введение.
Фармацевтические композиции для применения могут быть в виде стерильных физиологически приемлемых (водных или органических) растворов, коллоидных суспензий, кремов, мазей, паст, капсул, таблеток в виде капсулы, таблеток и облаток. К тому же следует иметь в виду, что также включены формы с задержанным медленным введением или длительно высвобождающие формы.
Соединения мышьяка настоящего изобретения можно также применять против множества первичных и метастатических неопластических болезней, включая, но без ограничения, первичные и метастатические опухоли центральной нервной системы, молочной железы, толстой кишки, яичников, почек, легкого, печени, мочевого пузыря, предстательной железы и головы и шеи.
5.1. Фармацевтические формулировки
Следовательно, настоящее изобретение относится к фармацевтической противораковой композиции, содержащей терапевтически эффективное количество натриевой соли мышьяковистой кислоты, представленной следующей формулой (I)
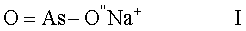
и ее фармацевтически приемлемых солей, используемых для изготовления вещества для лечения клеточного пролиферативного нарушения, и один или больше фармацевтически приемлемый адъювант, эксципиент, переносчик, буфер, растворитель и/или обычное фармацевтическое вспомогательное средство. В предпочтительном варианте осуществления изобретения соединение изобретения может быть введено в фармацевтически приемлемую формулировку. Настоящее изобретение относится к любым фармацевтически приемлемым формулировкам, таким как синтетические или природные полимеры в виде макромолекулярных комплексов, нанокапсулы, микросферы или шарики, формулировки на основе липидов, включая эмульсии «масло в воде», мицеллы, смешанные мицеллы, синтетические мембранные везикулы и выделенные эритроциты. В добавление к соединению и фармацевтически приемлемому полимеру фармацевтически приемлемая формулировка, используемая в способе изобретения, может содержать дополнительные фармацевтичеси приемлемые переносчики и/или эксципиенты. При использовании в данном описании, фармацевтически приемлемый переносчик включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые вещества, изотонические вещества и вещества, задерживающие всасывание, и тому подобное, которое является физиологически совместимым. Например, переносчик может быть пригодным для инъекции в кровь. Эксципиенты включают фармацевтически приемлемые стабилизаторы и дезинтегрирующие вещества. В другом варианте осуществления фармацевтически приемлемые формулировки включают формулировки на основе липидов. Любые из известных систем доставки вещества на основе липидов могут быть использованы в осуществлении изобретения. Например, мультивезикулярные липосомы (MVL), мультиламеллярные липосомы (также известные как мультиламеллярные везикулы, или MLV), одноламеллярные липосомы, включая маленькие одноламеллярные липосомы (также известные как одноламеллярные везикулы, или SUV) и большие одноламеллярные липосомы (также известные как большие одноламеллярные везикулы, или LUV), все могут быть использованы, поскольку может быть осуществлен продолжительный ход высвобождения инкапсулированных соединений. В одном варианте осуществления формулировка на основе липидов может представлять собой мультивезикулярную липосомную систему. Состав синтетической мембранной везикулы обычно представляет собой комбинацию фосфолипидов, обычно в комбинации со стероидами, особенно cholcompoundol. Можно использовать также другие фосфолипиды или другие липиды. Примеры липидов, пригодных в приготовлении (получении) синтетической мембранной везикулы, включают фосфатидилглицерины, фосфатидилхолины, фосфатидилсерины, фосфатидилэтаноламины, сфинголипиды, цереброзиды и ганглиозиды. Предпочтительно используют фосфолипиды, включая яичный фосфатидилхолин, дипалмитоилфосфатидилхолин, дистеароилфосфатидилхолин, диолеоилфосфатидилхолин, дипалмитоилфосфатидилглицерин и диолеоилфосфатидилглицерин. В другом варианте осуществления композиция, содержащая соединение, может быть заключена или наполнена в биопоглощаемый матрикс. Кроме того, матрикс может состоять из указанного биополимера. Подходящий биополимер для настоящего изобретения может также включать одну или больше макромолекул, выбранных из группы, состоящей из коллагена, эластина, фибронектина, витронектина, ламинина, полигликолевой кислоты, гиалуроновой кислоты, хондроитинсульфата, дерматансульфата, гепаринсульфата, гепарина, фибрина, целлюлозы, желатина, полилизина, эхинонектина, энтактина, тромбоспондина, увоморулина, бигликана, декорина и декстрана. Формулировка данных макромолекул в биополимер является хорошо известной в данной области техники.
В предпочтительном варианте осуществления терапевтическая композиция не является иммуногенной при введении пациенту-человеку с терапевтическими целями.
Терапевтическая композиция настоящего изобретения может включать фармацевтически приемлемые соли компонентов этого. Фармацевтически приемлемые соли включают аддукты кислых солей, которые образованы с неорганическими кислотами, такими как, например, соляная и фосфорная кислоты, или такими органическими кислотами, как уксусная, виннокаменная, миндальная и тому подобными. Физиологически удовлетворительные переносчики хорошо известны в данной области техники. Примерами жидких переносчиков являются стерильные водные растворы, которые не содержат веществ в добавление к активным ингредиентам и воде, или содержат буфер, такой как фосфат натрия при физиологическом значении рН, физиологический раствор или оба, такой как фосфатно-буферный раствор. Кроме того, водные переносчики могут содержать больше чем одну буферную соль, так же как и соли, такие как хлориды натрия и калия, декстрозу, пропиленгликоль, полиэтиленгликоль и другие растворенные вещества. Жидкие композиции могут также содержать жидкие фазы в дополнение к воде и за исключением воды. Примерами таких добавочных жидких фаз являются глицерин, растительные масла, такое как хлопковое масло, органические соединения, такие как этилолеат, и эмульсии вода-масло. Терапевтическая композиция содержит полипептид настоящего изобретения, обычно в количестве по меньшей мере 0,1 весового процента полипептида на вес всей терапевтической композиции. Весовой процент представляет собой отношение веса полипептида ко всей композиции. Таким образом, например, 0,1 весовой процент представляет собой 0,1 грамма полипептида на 100 грамм всей композиции.
Термин "фармацевтически приемлемая соль" относится к тем солям соединений, которые сохраняют биологическую эффективность и свойства свободных оснований и которые получают реакцией с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, ортофосфорная кислота, метансульфокислота, этансульфокислота, толуолсульфокислота, салициловая кислота и тому подобными. Фармацевтическая композиция, содержащая активный ингредиент, может быть в виде, пригодном для орального применения, например в качестве таблеток, пилюль, лепешек, водных или масляных суспензий, дисперсных порошков или гранул, эмульсий, жестких или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для орального применения, могут быть приготовлены согласно любому способу, известному в данной области техники для производства фармацевтических композиций, и такие композиции могут содержать одно или больше веществ, выбранных из группы, состоящей из подслащивающих веществ, веществ, придающих вкус, красителей и консервантов для того, чтобы предоставить фармацевтически превосходные и приятные препараты. Таблетки содержат активный ингредиент в смеси с нетоксическими фармацевтически приемлемыми эксцепиентами, которые пригодны для производства таблеток. Эти эксципиенты могут быть, например, инертными растворителями, такими как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующими и дезинтегрирующими веществами, например кукурузным крахмалом или альгиновой кислотой; связующими веществами, например крахмалом, желатином или гуммиарабиком, и смазывающими веществами, например стеаратом магния, стеариновой кислотой или тальком. Таблетки могут быть не покрыты, или они могут быть покрыты с помощью известных методик, чтобы задержать разрушение и всасывание в желудочно-кишечном тракте и таким образом обеспечить продолжительное действие в течение более длительного периода. Например, можно использовать вещество для временной задержки, такое как глицерилмоностеарат или глицерилдистеарат. Таблетки также можно покрыть с помощью методик, описанных в США Патентах №4,256,108; 4,166,452 и 4,265,874, для создания осмотических терапевтических таблеток с контролируемым высвобождением. Фармацевтическая композиция может также, или альтернативно, содержать одно или больше веществ, которые могут быть связаны с модулирующим веществом или могут быть свободны внутри композиции. Фактически любое вещество может быть введено в комбинацию с модулирующим веществом, как описано здесь, для множества целей, как описано ниже. Примеры типов веществ, которые могут быть введены с модулирующим веществом, включают анальгетики, анестетики, антиангинальные средства, антибиотики, противораковые препараты (например, таксол или митомицин С), противовоспалительные средства (например, ибупрофен и индометацин), противоглистные, антидепрессанты, противоядия, противорвотные, антигистаминные препараты, антигипертензивные препараты, противомалярийные средства, антимикротрубочковые препараты (например, колхицин или винка алкалоиды), препараты от мигрени, антибактериальные, антипсихотические средства, жаропонижающие средства (антипиретики), антисептики, агенты-антисигнализаторы (например, ингибиторы протеинкиназы С или ингибиторы внутриклеточной мобилизации кальция), антиартритические, антитромбиновые средства, противотуберкулезные средства, противокашлевые средства, противовирусные средства, препараты для подавления аппетита, кардиотонические вещества, препараты от химической зависимости, слабительные, химиотерапевтические вещества, коронарные, черепно-мозговые или периферические сосудорасширяющие средства, противозачаточные средства, депрессанты, мочегонные средства, отхаркивающие средства, факторы роста, гормональные вещества, снотворные средства, иммуносупрессирующие вещества, антагонист наркотических аналгетиков, парасимпатомиметики, успокоительные средства, стимуляторы, симпатомиметики, токсины (например, холерный токсин), транквилизаторы и почечные антибактериальные средства.
Формулировки для орального применения могут также быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым растворителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активные вещества в смеси с эксципиентами, пригодными для производства водных суспензий. Такими эксципиентами являются суспендирующие вещества, такие как натрийкарбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, поливинил-пиролидон альгината натрия, трагакантовая камедь и аравийская камедь; диспергирующими или увлажняющими веществами могут быть природный фосфатид, например лецитин, или продукты конденсации алкилен оксида с жирными кислотами, например полиоксиэтиленстеарат, или продукты конденсации этилен оксида с длинноцепочечными алифатическими спиртами, например гептадекаэтиленоксицетанол, или продукты конденсации этилен оксида с неполными соединениями, полученными из жирных кислот и гексита, такого как полиоксиэтилен с неполными соединениями, полученными из жирных кислот, и гексит ангидридов, например полиоксиэтиленсорбитмоноолеат. Водные суспензии могут содержать один или больше консервантов, например этил, или n-пропил, р-гидроксибензоат, одно или больше красящих веществ, одно или больше веществ, придающих вкус, и одно или больше подслащивающих веществ, таких как сахароза или сахарин.
Масляные суспензии могут быть приготовлены суспендированием активного ингредиента в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или в кокосовом масле или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например воск, твердый парафин или цетиловый спирт. Для придания аппетитности оральному препарату могут быть добавлены подслащивающие вещества, такие как вышеизложенные, и вещества, придающие вкус. Данные композиции можно сохранить добавлением антиоксиданта, такого как аскорбиновая кислота.
Дисперсные порошки и гранулы, пригодные для приготовления водных суспензий добавлением воды, предоставляют активный ингредиент в смеси с диспергирующим или увлажняющим веществом, суспендирующим веществом и одним или больше предохраняющими средствами. Подходящие диспергирующие или увлажняющие вещества и суспендирующие вещества показаны, например подслащивающие вещества, придающие вкус, и подкрашивающие вещества также могут быть представлены.
Фармацевтические композиции изобретения могут также быть в виде эмульсий «масло в воде». Масляная фаза может представлять собой растительное масло, например оливковое масло или арахисовое масло, или минеральное масло, например жидкий парафин или смеси этого. Пригодными эмульгирующими веществами могут быть природные камеди, например аравийская камедь или трагакантовая камедь, природные фосфатиды, например культурная соя, лецитин, и соединения или неполные соединения производные от жирных кислот и гексит ангидридов, например сорбитмоноолеат и продукты конденсации указанных неполных соединений с этиленоксидом, например полиоксиэтиленсорбитмоноолеатом. Эмульсии могут также содержать подслащивающие вещества и вещества, придающие вкус.
Сиропы и эликсиры могут быть разработаны с подслащивающими веществами, например глицерином, пропиленгликолем, сорбитом или сахарозой. Такие формулировки также могут содержать успокоительные, консервирующие и окрашивающие вещества. Фармацевтические композиции могут быть в виде стерильных инжектируемых водных или масляных суспензий. Эта суспензия может быть разработана согласно известному уровню техники с применением тех пригодных диспергирующих веществ или смачивающих веществ и суспендирующих веществ, которые были упомянуты выше. Стерильный инжектируемый препарат может также находиться в стерильном инжектируемом растворе или суспензии в нетоксическом парентерально приемлемом дилюенте или растворителе, например, абсолютированном в 1,3-бутандиоле. К приемлемым носителям или растворителям, которые можно применять, относятся вода, раствор Рингера и изотонический раствор хлористого натрия. Кроме того, стерильные, жирные масла являются условно применимыми в качестве растворителя или суспендирующей среды. Для этой цели можно применять любое мягкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, в приготовлении инъецируемых средств находят применение жирные кислоты, такие как олеиновая кислота.
Уровни дозировок примерно от около 0,05 мг до около 140 мг на килограмм веса тела в день пригодны в лечении вышеуказанных состояний (от около 2,5 мг до около 7 г на пациента в день). Например, воспаление можно эффективно лечить введением от около 0,01 до 50 мг соединения на килограмм веса тела в день (от около 0,5 мг до около 3,5 г на пациента в день). Количество активного ингредиента, которое можно скомбинировать с веществами-носителями для того, чтобы обеспечить форму единичной дозировки, будет изменяться в зависимости от того, кого лечат, и конкретного способа введения. Например, формулировка, предназначенная для орального введения человеку, может изменяться от около 5 до около 95% общей композиции. Формы единичной дозировки будут содержать в большинстве случаев от около 1 мг до около 500 мг активного ингредиента. Понятно, однако, что отдельный уровень дозы для любого конкретного пациента будет зависеть от целого ряда факторов, включая активность конкретного примененного соединения, возраст, вес тела, общее состояние здоровья, пол, время введения, путь введения, скорость выделения, комбинацию препаратов и тяжесть отдельной болезни, подвергающейся лечению. Дозировка эффективного количества соединений согласно изобретению будет изменяться в зависимости от факторов, включая конкретное соединение, токсичность, ингибиторную активность, состояние, подвергающееся лечению, и применяют ли соединение одно или с другими видами терапии. Обычно дозировка эффективного количества будет колебаться от около 0,0001 мг/кг до 1500 мг/кг, более предпочтительно от 1 до 1000 мг/кг, более предпочтительно от около 1 до 150 мг/кг веса тела и наиболее предпочтительно от около 50 до 100 мг/кг веса тела. Изобретение относится также к процедуре или способу лечения вышеупомянутых патологических состояний. Соединения настоящего изобретения могут быть введены профилактически или терапевтически, предпочтительно в количестве, которое является эффективным против упомянутых нарушений, теплокровному животному, например человеку, нуждающемуся в таком лечении, причем соединения предпочтительно используются в виде фармацевтических композиций.
Формулировки фармацевтически приемлемых эксципиентов и растворов-переносчиков являются хорошо известными специалистам в данной области, так как представляют собой разработку подходящего дозирования и схемы лечения для применения отдельных композиций, описанных здесь, в целом ряде лечебных режимов, включая, например, оральное, парентеральное, внутривенное, интраназальное и внутримышечное введение и формулировку.
5.1.1. Оральная доставка
В определенном применении фармацевтические композиции, раскрытые в данном описании, могут быть доставлены посредством орального введения животному. По существу эти композиции могут быть разработаны с инертным растворителем или с усвояемым съедобным переносчиком, или они могут быть заключены в желатиновую капсулу с твердой или мягкой оболочкой, или они могут быть сжаты в таблетки, или они могут быть прямо включены в пищу.
Активные соединения даже можно соединить с экципиентами и применять в виде проглатываемых таблеток, буккальных таблеток, шариков, капсул, эликсиров, суспензий, сиропов, вафель и тому подобного. Таблетки, шарики, пилюли, капсулы и тому подобное могут также содержать следующее: связующее вещество, как трагакантовая камедь, гуммиарабик, кукурузный крахмал или желатин; эксципиенты, такие как дифосфат кальция; дезинтегрирующее вещество, такое как кукурузный крахмал, картофельный крахмал, альгиновая кислота и тому подобное; смазочный материал, такой как стеарат магния; и может быть добавлено подслащивающее вещество, такое как сахароза, лактоза или сахарин, или вещество, придающее вкус, такое как мятное масло, масло гаультерии или вишневая приправа. Когда форма единичной дозировки представляет собой капсулу, она может содержать в добавление к веществам вышеупомянутого типа жидкий переносчик. Различные другие материалы могут присутствовать в качестве покрывающих веществ или для того, чтобы иным способом видоизменять физическую форму единицы дозировки. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или обоими. Сироп эликсира может содержать активное соединение, сахарозу, в качестве подслащивающего вещества, метил и пропилпарабены как предохраняющие средства, краситель и вещество, придающее вкус, такой как вишневый или апельсиновый вкус. Конечно, любое вещество, использованное в приготовлении любой формы единичной дозировки, должно быть фармацевтически чистым и по существу не токсичным в примененных количествах. Кроме того, активные соединения могут быть включены в препараты и формулировки с замедленным высвобождением.
Обычно такие формулировки могут содержать по меньшей мере около 0,1% активного соединения или больше, хотя процент активного ингредиента(ов) может, конечно, варьировать и может легко находиться между приблизительно 1 или 2% и около 60% или 70% или больше веса или объема всей формулировки. Естественно, количество активного соединения(ий) в каждой терапевтически пригодной композиции, которую можно приготовить, является таким, что подходящая дозировка будет получена в любой данной единичной дозе соединения. Такие факторы, как растворимость, биодоступность, биологический период полураспада, путь введения, срок хранения продукта, так же как и другие фармакологические соображения, будут рассмотрены специалистом в области приготовления таких фармацевтических формулировок и как таковых множества дозировок и лечебных режимов, которые могут являться желательными.
Для орального введения композиции настоящего изобретения могут быть альтернативно объединены с одним или больше эксципиентами в виде раствора для полоскания полости рта, зубной пасты, буккальной таблетки, орального спрея или подъязычной орально применяемой формулировки. Например, раствор для полоскания полости рта можно приготовить включением активного ингредиента в необходимом количестве в соответствующий растворитель, такой как декагидрат тетрабората натрия (Раствор Добеля). Альтернативно, активный ингредиент может быть включен в оральный раствор, такой как раствор, содержащий декагидрат тетрабората натрия, глицерин и гидрокарбонат калия, или рассыпан в зубном порошке, или добавлен в терапевтически эффективном количестве к композиции, которая может включать воду, связующие вещества, абразивы, вещества, придающие вкус, пенообразующие вещества и гигроскопические вещества. Альтернативно композициям может быть придана форма таблетки или раствора, которые могут быть помещены под язык или, иначе говоря, растворены во рту.
5.1.2. Доставка путем инъекции
В определенных случаях будет желательно доставить фармацевтические композиции, раскрытые здесь, парентерально, внутривенно, внутримышечно или даже интраперитонеально. Растворы активных соединений в качестве свободного основания или фармакологически приемлемых солей можно приготовить в воде, соответствующим образом смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии могут быть также приготовлены в глицерине, жидких полиэтиленгликолях и смесях этого и в маслах. При обычных условиях хранения и использования эти препараты содержат предохраняющее средство для предотвращения роста микроорганизмов.
Фармацевтические формы, пригодные для применения в виде инъекции, включают стерильные водные растворы или дисперсии и стерильные порошки для незапланированного приготовления стерильных растворов или дисперсий для инъекций. Во всех случаях форма должна быть стерильной и должна быть жидкой в том смысле, что она должна быть легко впрыскиваемой. Она должна быть стабильной при условиях производства и хранения и должна быть сохранена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Переносчик может быть растворителем или дисперсионной средой, включая, например, воду, этанол, высокомолекулярный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобное), подходящими смесями этого и/или растительными маслами. Надлежащую текучесть можно сохранить, например, использованием покрытия, такого как лецитин, сохранением необходимого размера частицы в случае дисперсии и использованием поверхностно-активных веществ. Предотвращению действия микроорганизмов могут способствовать различные антибактериальные и противогрибковые средства, например парабены, хлоробутанол, фенол, аскорбиновая кислота, тимерозал и тому подобное. Во многих случаях предпочтительно включить изотонические вещества, например сахара или хлорид натрия. Продолжительное всасывание инъецируемых композиций осуществлено использованием в композициях веществ, задерживающих всасывание, например моностеарата алюминия и желатина.
Для парентерального введения в водном растворе, например раствор должен быть соответствующим образом приготовлен в буфере, если необходимо, и жидкий растворитель сначала приводили в изотоническое состояние с соответствующим солевым раствором или раствором глюкозы. Эти особые водные растворы особенно пригодны для внутривенного, внутримышечного, подкожного и интраперитонеального введения. В этой связи стерильные водные среды, которые могут быть использованы, будут известны специалистам в данной области техники в свете настоящего раскрытия. Например, одна дозировка может быть растворена в 1 мл изотонического раствора NaCl и или добавлена к 1000 мл жидкости для введения в подкожную клетчатку или впрыснута в предполагаемом месте вливания. Некоторое изменение в дозировке будет неизбежно происходить в зависимости от состояния субъекта, подвергающегося лечению. Человек, отвечающий за введение, будет, во всяком случае, определять соответствующую дозу для отдельного субъекта. Более того, для введения человеку препараты должны соответствовать стандартам стерильности, пирогенности и основным стандартам безопасности и чистоты, как требуется государственными или региональными службами биологических норм.
Стерильные растворы для инъекций приготавливают введением активных соединений в необходимом количестве в соответствующий растворитель с некоторыми из других ингредиентов, перечисленных выше, по требованию, с последующей стерилизацией фильтрованием. Дисперсии обычно приготавливают введением различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и необходимые другие ингредиенты из тех, которые перечислены выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительными способами приготовления являются методы вакуумной сушки и сублимационной сушки, которые дают порошок активного ингредиента плюс любой дополнительный желательный ингредиент из предварительно стерильно профильтрованных растворов этого.
Композиции, раскрытые в данном описании, могут быть разработаны в нейтральном виде или в виде соли. Фармацевтически приемлемые соли включают аддукты кислых солей (образованные со свободными аминогруппами белка) и которые образованы с неорганическими кислотами, такими как, например, соляная или ортофосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, виннокаменная, миндальная и тому подобными. Соли, образованные со свободными карбоксильными группами, могут также быть получены из неорганических оснований, таких как, например, гидроокиси натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, гистидин, прокаин и тому подобных. После приготовления растворы могут быть введены способом, совместимым с лекарственной формой, и в таком количестве, которое является терапевтически эффективным. Формулировки являются легко вводимыми в целом ряде лекарственных форм, таких как растворы для инъекций, высвобождающие лекарство капсулы и тому подобное.
При использовании в данном описании "переносчик" включает любой и все растворители, дисперсионные среды, носители, покрытия, дилюенты, антибактериальные и противогрибковые вещества, изотонические и задерживающие всасывание вещества, буферы, растворы-переносчики, суспензии, коллоиды и тому подобное. Применение таких сред и веществ для фармацевтически активных субстанций хорошо известно в данной области техники. За исключением того, что какие-либо обычные среды или вещество является несовместимым с активным ингредиентом, тогда его применение в фармацевтической композиции обдумывается. Также в композиции может быть введен добавочный активный ингредиент.
Фраза "фармацевтически приемлемый" относится к молекулярным составам и композициям, которые не вызывают аллергическую или подобную неблагоприятную реакцию при введении человеку. Приготовление водной композиции, которая содержит белок в качестве активного ингредиента, хорошо известно в данной области. Обычно, такие композиции приготавливают как инжектируемые или как жидкие растворы или суспензии; также могут быть приготовлены твердые формы, пригодные для растворения в жидкости или приготовления суспензии в жидкости до инъекции. Препарат также может быть эмульгированным.
5.1.3. Назальная доставка
В некоторых вариантах осуществления фармацевтические композиции могут доставлять интраназальные спреи, ингаляция и/или другие посредники аэрозольной доставки. Более того, доставка веществ с использованием интраназальных микрочастиц смолы и лизофосфатидилглицериновых соединений также хорошо известна в фармацевтическом деле.
5.2. Раки-мишени
Субъекты, подвергающиеся лечению, будут обычно включать млекопитающих и наиболее предпочтительно будут являться человеческими субъектами, например человеческими субъектами с раком. Соединения изобретения можно использовать в одиночку или в комбинации. Кроме того, рассматриваемые соединения можно использовать с другими типами лечения. Например, предметные соединения можно применять с другими химиотерапевтическими препаратами, например тамоксифеном, таксолом, метотрексатом, биологическими препаратами, такими как антитела, факторы роста или лимфокины, облучением и т.д. Комбинированная терапия может приводить к синергическим результатам. Предпочтительным показанием является рак, особенно раки, установленные предварительно.
Композиции и способы, предоставленные в данном описании, считаются особенно пригодными для лечения первичных и метастатических неопластических опухолей, включая солидные опухоли, такие как опухоли молочной железы, центральной нервной системы, толстого кишечника, яичника, почки, легкого, печени, мочевого пузыря, предстательной железы, головы и шеи и т.д. В частности, опухоли, которые можно лечить композициями и способами изобретения, включают опухоли эпителиальной природы, такие как, но без ограничения:
Легкого: бронхогенную карциному (плоскоклеточную, недифференцированную мелкоклеточную, недифференцированную крупноклеточную, аденокарциному), альвеолярную (альвеолярно-клеточную) карциному, бронхиальную аденому, саркому, лимфому, хондроматозную гамартому, мезотелиому; Желудочно-кишечные: пищевода (плоскоклеточную карциному, аденокарциному), карциному желудка, колоректальную карциному; Мочеполового тракта: почки (аденокарциному, опухоль Вильмса [нефпробластому], лимфому, лейкемию), мочевого пузыря и мочеиспускательного канала (плоскоклеточную карциному, переходно-клеточную карциному, аденокарциному), предстательной железы (аденокарциному, саркому), яичка (семиному); Печени: гепатому (гепатоцеллюлярную карциному); Кости: остеогенную саркому (остеосаркому); Нервной системы: нейробластому, ретинобластому, глиобластому, олигодендроглиому; Гинекологические: шейки (цервикальную карциному, предопухолевую цервикальную дисплазию); Гематологические: крови (миелоидную лейкемию [острую и хроническую], острую лимфобластную лейкемию, хроническую лимфоцитарную лейкемию), болезнь Ходжкина, неходжкинскую лимфому [злокачественную лимфому]; Кожи: злокачественную меланому, базальноклеточную карциному, плоскоклеточную карциному, саркому Калоши; Желез и протоков: аденокарциному, папиллярную карциному и папиллярную аденокарциному. Таким образом, термин "раковая клетка", как данный здесь, включает клетку, задетую любым одним из вышеопределенных состояний.
Термин "лейкемия" широко относится к прогрессирующим злокачественным болезням кроветворных органов и, как правило, характеризуется искаженной пролиферацией и развитием лейкоцитов и их предшественников в крови и костном мозге. Лейкемию обычно клинически классифицируют на основе (1) длительности и характера болезни - острая или хроническая; (2) типа затронутых клеток; миелоидная (миелогенная), лимфоидная (лимфогенная), или моноцитарная и (3) увеличения или отсутствия увеличения количества ненормальных клеток в крови - лейкемия или алейкемия (сублейкемия). Модель лейкемии Р388 широко принята в качестве являющейся предсказывающей антилейкемическую активность in vivo. Полагают, что соединение, которое оказалось положительным в результате проверки на Р388, как правило, будет демонстрировать некоторый уровень антилейкемической активности in vivo независимо от типа лейкемии, которую лечат. Соответственно, настоящее изобретение включает способ лечения лейкемии и предпочтительно способ лечения острой нелимфоцитарной лейкемии, хронической лимфоцитарной лейкемии, острой гранулоцитарной лейкемии, хронической гранулоцитарной лейкемии, острой промиелоцитарной лейкемии, Т-клеточной лейкемии взрослых, алейкемической лейкемии, лейкоцитемической лейкемии, базофильной лейкемии, недифференцируемого лейкоза, лейкемии крупного рогатого скота, хронической миелоцитарной лейкемии, лейкемии кожи, эмбриональной лейкемии, эозинофильной лейкемии, лейкемии Гросса, лейкоза ворсистых клеток, гемобластной лейкемии, гемоцитобластной лейкемии, гистиоцитарной лейкемии, лейкемии стволовых клеток, острой моноцитарной лейкемии, лейкопенической лейкемии, лимфатической лейкемии, лимфобластной лейкемии, лимфоцитарной лейкемии, лимфогенной лейкемии, лимфоидной лейкемии, злокачественной лимфомы, тучноклеточной лейкемии, мегакариоцитарного лейкоза, микромиелобластной лейкемии, моноцитарной лейкемии, миелобластной лейкемии, миелоцитарной лейкемии, миелоидной гранулоцитарной лейкемии, миеломоноцитарной лейкемии, лейкемии Негеле, плазмоклеточного лейкоза, плазмоцитарной лейкемии, промиелоцитарной лейкемии, лейкемии клеток Ридера, лейкемии Шиллинга, недифференцируемого лейкоза, сублейкемической лейкемии и лейкемии недифференцированных клеток.
Термин "саркома" обычно относится к опухоли, которая является составленной из субстанции, подобной эмбриональной соединительной ткани, и обычно состоит из плотно упакованных клеток, вставленных в волокнистое или гомогенное вещество. Саркомы, которые можно лечить соединениями изобретения и по выбору потенцирующим средством и/или химиотерапевтическим препаратом, включают хондросаркому, фибросаркому, лимфосаркому, меланому, миксосаркому, остеосаркому, саркому Абемети, жировую саркому, липосаркому, альвеолярную саркому мягких тканей, амелобластосаркому, ботриоидную саркому, хлоромасаркому, хориокарциному, эмбриональную саркому, опухоль Вильмса, эндометриальную саркому, стромальную саркому, саркому Юинга, фасциальную саркому, фибробластическую саркому, гигантоклеточную саркому, гранулоцитарную саркому, саркому Ходжкина, идиопатическую множественную геморрагическую саркому, иммунобластную саркому В клеток, лимфому, иммунобластную саркому Т-клеток, саркому Йенсена, саркому Калоши, саркому Купферовской клетки, злокачественную гемангиому, лейкосаркому, злокачественную мезенхимому, паростальную саркому, ретикулоцитарную саркому, саркому Роуса, серокистозную саркому (serocystic), синовиальную саркому и остеогенную саркому.
Термин "меланома" использован, чтобы обозначить опухоль, вырастающую из меланоцитной системы кожи и других органов. Меланомы, которые можно вылечить указанными соединениями и по выбору потенцирующим средством и/или химиотерапевтическим препаратом, включают, например, лентигиноз конечностей (меланому из лентигиноза конечностей), амеланотическую меланому, доброкачественную юношескую меланому, меланому Клодмана, меланому S91, меланому Хардинга-Пасси, юношескую меланому, злокачественную меланому лентиго, злокачественную меланому, узелковую меланому, подногтевую меланому и поверхностно распространенную меланому.
Термин "карцинома" относится к злокачественному новому росту, происходящему из эпителиальных клеток, имеющих тенденцию проникать в окружающие ткани и давать начало метастазам. Примеры карцином, которые можно лечить указанным соединением и по выбору потенцирующим средством и/или химиотерапевтическим препаратом, включают, например, ацинарную карциному, ацинозную карциному, аденокистозную карциному, аденоидную кистозную карциному, аденоматозную карциному, карциному коры надпочечника, альвеолярную карциному, альвеолярно-клеточную карциному, карциному базальных клеток, базально-клеточную карциному, базалоидную карциному, базально-плоскоклеточную карциному, бронхоальвеолярную карциному, альвеолярно-клеточную карциному, бронхогенную карциному, медуллярную карциному, холангиоклеточную карциному, хориокарциному, коллоидный рак, угревидный рак, карциному туловища, решетчатовидную карциному, кожную карциному, цилиндрическую карциному, карциному цилиндрической клетки, карциному протока, твердую карциному, эмбриональную карциному, энцефалоидную карциному, эпидермоидную карциному, эпителиальную аденоидную карциному, экзофитную карциному, рак из язвы, фиброзную карциному, карциному gelatiniforni, студенистую карциному, гигантоклеточную карциному, карциному gigantocellulare (рак гигантоклеточный), железистую карциному, гранулезоклеточную карциному, карциному матрикса волоса, гематоидную карциному, гепатоцеллюлярную карциному, карциному из клеток Гюртле, гиалиновую карциному, гипернефроидную карциному, инфантильную эмбриональную карциному, карциному на месте, интраэпидермальную карциному, внутриэпителиальную карциному, карциному Кромпечера, рак из клеток Кульчицкого, крупноклеточную карциному, хрусталиковую карциному, чечевицеобразную карциному, липоматозную карциному, лимфоэпителиальную карциному, рак мозговидный (мозговик, карциному medullare), медуллярную карциному, меланотическую карциному, мягкую карциному, слизеобразующую карциному, муциновую карциному, карциному mucocellulare, мукоэпидермоиную карциному, карциному mucosum, слизистую карциному, миксоматозную карциному, носоглоточную карциному, овсяно-клеточную карциному, карциному оссифицирующую (ossificans), остеоидную карциному, папиллярную карциному, перипортальную карциному, прединвазивную карциному, карциному шиповатого эпидермоцита, мацерированную карциному, почечно-клеточную карциному почки, резервноклеточную карциному, саркомоподобный рак, карциному слизистой носовой полости, скиррозную карциному, карциному мошонки, карциному перстневидной клетки, простую карциному, мелкоклеточную карциному, соланоидную карциному, шаровидноклеточную карциному, веретеноклеточную карциному, губчатый рак, сквамозную карциному, плоскоклеточную карциному, волокнистую карциному, телеангиэктатическую карциному, карциному из гладких мышечных волокон и сосудистой ткани, переходно-клеточную карциному, туберозную карциному, шишковатую карциному, веррукозную карциному и ворсинчатую карциному.
Дополнительные раки, которые могут быть вылечены соединением согласно изобретению, включают, например, болезнь Ходжкина, неходжкинскую лимфому, множественную миелому, нейробластому, рак молочной железы, рак яичника, рак легкого, рабдомиосаркому, первичный тромбоцитоз, первичную макроглобулинемию, мелкоклеточный рак легкого, первичные опухоли мозга, рак желудка, рак толстой кишки, злокачественную инсулиному поджелудочной железы, злокачественный карциноид, унарный рак мочевого пузыря, предзлокачественные повреждения кожи, тестикулярный рак, лимфому, рак щитовидной железы, нейробластому, рак пищевода, рак мочеполового тракта, злокачественную гиперкальциемию, рак шейки матки, эндометриальный рак, рак коры надпочечника и рак предстательной железы.
В конкретном варианте осуществления настоящее изобретение предоставляет композиции и способы для усиления опухолевого специфического иммунитета у индивидуумов, страдающих от колоректального рака, метастазирующего в печень, для того чтобы ингибировать развитие неопластической болезни. Предпочтительные способы лечения этих неопластических болезней включают введение композиции мышьяка, которая вызывает иммунный ответ против опухолевых клеток.
В другом конкретном варианте осуществления настоящее изобретение предоставляет композиции и способы для усиления специфического иммунитета у индивидуумов, страдающих от гепатоцеллюлярной карциномы, для того чтобы ингибировать развитие неопластической болезни и в корне истребить все предраковые и неопластические клетки.
Наконец, настоящее изобретение предоставляет hsp композиции и способы для усиления специфического иммунитета к предраковым и неопластическим клеткам молочной железы у женщин. Настоящее изобретение также предоставляет композиции и способы для ингибирования пролиферации раковой клетки и метастазирования. Эти соединения можно применять в одиночку или в комбинации друг с другом или с модификаторами биологической реакции.
6. Сведения, подтверждающие возможность осуществления изобретения
Следующие подразделы описывают исследование фармацевтической композиции, содержащей натриевую соль мышьяковистой кислоты, in vivo с использованием раковых пациентов. Результаты демонстрируют, что натриевая соль мышьяковистой кислоты, введенная орально, является эффективной при лечении мочеполового рака.
6.1. Методы и материалы
Раковых пациентов, страдающих от рака предстательной железы и/или мочеполового рака, лечили в клиническом исследовании ICH-GCP натриевой солью мышьяковистой кислоты орально. Пациенты, страдающие от мочеполового рака, главным образом, рака предстательной железы и костных метастазов, не подлежали каким-либо принятым способам лечения и были подвергнуты лечению натриевой солью мышьяковистой кислоты в диапазоне 7 различных уровней дозирования. Считается, что натриевая соль мышьяковистой кислоты действует как теломерный яд, так как она допускает укорочение теломер клеток рака человека, которое приводит к хромосомным отклонениям, но не ингибирует теломеразную активность.
Натриевую соль мышьяковистой кислоты давали ежедневно в течение 14 последовательных дней соответственно уровню дозы лечебной схемы, представленной ниже:
Уровень лечения 1: Одна капсула, каждая 2,5 мг мета-арсенита натрия, ежедневно (каждые 24 часа), до завтрака
Уровень лечения 2: Две капсулы, каждая 2,5 мг натриевой соли мышьяковистой кислоты, ежедневно, 1 до завтрака, 1 до обеда
Уровень лечения 3: Четыре капсулы, каждая 2,5 мг натриевой соли мышьяковистой кислоты, ежедневно, 1 до завтрака, 2 перед ланчем, 1 перед обедом
Уровень лечения 4: Пять капсул, каждая 2,5 мг натриевой соли мышьяковистой кислоты, ежедневно, 2 до завтрака, 2 перед ланчем, 1 перед обедом
Уровень лечения 5: Шесть капсул, каждая 2,5 мг натриевой соли мышьяковистой кислоты, ежедневно, 2 до завтрака, 2 перед ланчем, 2 перед обедом
Посещения пациентов были запланированы для контроля податливости, токсичности и безопасности и были проведены следующим образом:
Визит 1: проводили между днем - 7 и днем 0 (начало лечения)
Визит 2: на первый день лечения мета-арсенитом натрия
Визит 3: на 8 день лечения натриевой солью мышьяковистой кислоты
Визит 4: на 15 день (приблизительно 24 часа) после завершения лечения в течение 14 последовательных дней натриевой солью мышьяковистой кислоты
Визит 5: на 22 день (приблизительно 7 дней) после завершения лечения в течение 14 последовательных дней натриевой солью мышьяковистой кислоты
Визит 6: на 42 день (приблизительно 28 дней) после завершения лечения в течение 14 последовательных дней натриевой солью мышьяковистой кислоты
В течение этого исследования были оценены следующие целевые параметры: профиль токсичности, эффективность, параметры ферментов печени (GOT, GPT, a-GT, АР), функция почки, гематологические функции, определения опухолевых маркеров (СЕА и PSA) и фармакокинетика натриевой соли мышьяковистой кислоты.
6.2. Результаты
Ниже представлено краткое изложение клинических результатов для каждого пациента, участвующего в данном исследовании. Сообщенные полученные данные включают величину опухолевых маркеров СЕА (карциноэмбриональный антиген) и PSA (специфический антиген простаты) и результаты по эффективности, токсичности и безопасности.
Таблицы 1 и 2 представляют сводку данных по пациенту с приведением значений PSA и СЕА:
Неожиданно все пациенты очень хорошо перенесли натриевую соль мышьяковистой кислоты. Не наблюдалось неблагоприятных событий (AE's) или существенных неблагоприятных событий (SAE's). Исследование лекарства не вызывало каких-либо нарушений в самочувствии ни у одного пациента. В течение хода исследования ни у одного пациента не наблюдалось изменения активности ЭКГ, аудиометрии или неврологических показателей. Ни один из пациентов не подвергался лучевой терапии до лечения натриевой солью мышьяковистой кислоты. Натриевая соль мышьяковистой кислоты показала высокий уровень эффективности.
6.2.1. Пример 1: Пациент К.Ф.
Гистология: Запущенный, неоперабельный, солидный рак предстательной железы с инфильтрацией в ректальную слизистую стенку, 11.02.2004
Стадия: Стадия Дюкса С, рТ 4 показатель Глисона 6
Терапия
Так как пациент страдает от коронарной болезни сердца с инфарктом миокарда и имплантацией эндопротезов коронарных сосудов, радикальное удаление предстательной железы вместе с семенными пузырьками (простатовезикулэктомия) не могло быть выполнено, и было начато полное удаление андрогенов антагонистом LHRH (одна плановая подкожная инъекция каждые 3 месяца) и антиандрогеном орально (таблетки андрокура в дозировеке 1×1/день после ланча). Паллиативная трансуретральная резекция простаты (TURP) для облегчения мочеиспускания была выполнена в мае 2004.
Данный пациент принимал участие в исследовании уровней доз 1, 3 и 5 натриевой соли мышьяковистой кислоты. Результаты в отношении этого пациента клинически значимое изменение уровней PSA для всех 3 уровней доз лекарства. Уровень дозы один (2,5 мг натриевой соли мышьяковистой кислоты) показал значительное снижение PSA от 0,29 нг/мл до 0,16 нг/мл. Это снижение соответствует уменьшению опухолевой активности на 44,83%. Уровень дозы три (10 мг натриевой соли мышьяковистой кислоты) показал увеличение PSA от 0,16 до 0,18 нг/мл. Уровень дозы пять (12,5 мг натриевой соли мышьяковистой кислоты) вновь показывает увеличение, в этот раз от 0,17 до 0,18 нг/мл. Ни один из уровней дозы 3 или 5 не показал какого-либо значительного изменения опухолевой активности.
Уровень дозы один показал уменьшение размера опухоли от 20×35 мм до 20×34 мм. Уровень дозы три также показал уменьшение от 20×35 до 20×34 мм, тогда как уровень дозы пять не показал изменения размера от 20×34 мм.
Вторичные параметры (параметры безопасности) не показали клинически важных результатов при каком-либо уровне дозы. Наблюдалось обратимое увеличение трансаминаз печени sGPT и sGOT в течение приема натриевой соли мышьяковистой кислоты в дозовой группе III и V (визит 3 и 4). Ко времени визита 5 трансаминазы уже возвратились к нормальным значениям. Это увеличение, по-видимому, связано с введением исследуемого вещества, натриевой соли мышьяковистой кислоты.
Оценка/критика клинического ответа/прогрессии для уровня дозы один была - частичный ответ. Для обоих уровней доз три и пять - болезнь показала стабильность.
6.2.2. Пример 2: Пациент Г.Р.
Гистология: Запущенный, неоперабельный, солидный рак предстательной железы с экстраграндулярным опухолевым ростом
Стадия: Стадия Дюкса С, рТ 4 показатель Глисона 4
Терапия
Этот пациент страдал как от карциномы предстательной железы, так и от почечно-клеточной карциномы (после выполнения радикальной нефрэктомии) и поверхностного рака мочевого пузыря (без опухолевых рецидивов). Пациент был включен в исследование вследствие продолжающегося подъема уровней PSA после полного удаления андрогенов антагонистом LHRH (одна плановая подкожная инъекция каждые 3 месяца) и антиандрогеном орально (таблетки касодекса в дозировке 1×1/день после ланча).
Данный пациент принимал участие в исследовании уровней доз 1, 3 и 5 натриевой соли мышьяковистой кислоты. Результаты в отношении данного пациента показали клинически значительное изменение в уровнях PSA для всех 3 уровней доз натриевой соли мышьяковистой кислоты. Уровень дозы один показал значительное понижение PSA от 1,61 нг/мл до 0,37 нг/мл. Это снижение соответствует уменьшению опухолевой активности на 77,1%. Уровни доз три и пять показывают снижение PSA от 0,37 до 0,12 нг/мл и от 0,11 до 0,07 нг/мл соответственно. Уровень дозы три показал уменьшение опухолевой активности на 67,56%, тогда как уровень дозы пять не показал значительного изменения.
Уровень дозы один показал уменьшение размера опухоли от 12,5×65 мм до 0,8×30 мм. Уровень дозы три также показал уменьшение опухоли предстательной железы от 60×25 до 50×25 мм, тогда как уровень дозы пять не показал изменения размера.
Вторичные параметры (параметры безопасности) не показали клинически важных результатов при каком-либо уровне дозы. Были определены повышенные перед исследованием триглицериды и уровень холестерина, которые не изменялись во время прохождения исследования. Уровни глюкозы всегда были повышенными, что можно объяснить причинами, связанными с питанием, так как образцы крови всегда брали утром после обильного завтрака.
Оценка/критика клинического ответа/прогрессии для всех трех уровней доз была - частичный ответ.
6.2.3. Пример 3: Пациент К.С.
Гистология: Запущенный, неоперабельный, солидный, андроген-резистентный рак предстательной железы с внекапсулярным опухолевым ростом.
Стадия: Dukes С, рТ 4 Gleason score 4
Терапия
Так же как и от рака предстательной железы, данный пациент также страдает от рака прямой кишки. Этот пациент был включен вследствие запущенной и неоперабельной ситуации. Было выполнено удаление андрогенов антагонистом LHRH (одна плановая подкожная инъекция каждые 3 месяца).
Этот пациент принимал участие в исследовании уровней дозы 1, 3 и 5 натриевой соли мышьяковистой кислоты. Результаты для данного пациента показывают клинически важное изменение уровней PSA для всех 3 уровней дозы лекарства. Уровни доз один и три показывают снижение PSA от 0,24 до 0,11 нг/мл и 0,11 до 0,08 нг/мл, соответственно. Уровень дозы пять не показал изменения от 0,09 нг/мл. Уровень дозы один показал снижение опухолевой активности на 54,12% и уровень три, более того 67,56%. Уровень дозы пять не показал значительного изменения.
Уровень дозы один показал уменьшение размера опухоли от 30×35 мм до 30×30 мм. Уровни дозы три и пять не показали изменения в размере.
Вторичные параметры (параметры безопасности) не показали клинически важных результатов при каком-либо уровне доз. Было обнаружено обратимое и слабое увеличение sGPT.
Оценка/критика клинического ответа/прогрессии для уровней доз один и три была - частичный ответ. Уровень дозы пять показал устойчивость болезни.
6.2.4. Пример 4: Пациент Дж.С.
Гистология: Запущенный, неоперабельный, андроген-устойчивый солидный рак предстательной железы с внекапсулярным опухолевым ростом.
Стадия: Стадия Дюкса С, рТ 4 показатель Глисона 8
Терапия
Пациент был включен в исследование вследствие продолжающегося подъема уровней PSA после субкапсулярной орхиэктомии для удаления андрогенов.
Данный пациент принимал участие в исследовании уровней дозы 1, 3 и 5 натриевой соли мышьяковистой кислоты. Результаты для данного пациента показали клинически значительное изменение уровней PSA для всех 3 уровней доз препарата. Уровень дозы один показал увеличение PSA от 0,19 нг/мл до 0,21 нг/мл. Уровни доз три и пять показывают увеличение PSA от 0,21 нг/мл до 0,27 нг/мл и уменьшение PSA с 0,27 до 0,24 нг/мл, соответственно. Уровни дозы один и три показали увеличение опухолевой прогрессии, тогда как уровень дозы пять не показал значительного изменения.
Уровень дозы один показал увеличение размера опухоли от 30×30 мм до 35×35 мм. Уровни дозы три и пять не показали изменения от 30×35 мм.
Вторичные параметры (параметры безопасности) не показали клинически важных результатов при каком-либо уровне доз. Существующее до исследования повышение sGGT и тромбоцитов оставалось неизмененным во время прохождения исследования.
Оценка/критика клинического ответа/прогрессии для уровней доз один и три была - прогрессия болезни. Уровень дозы пять показал частичный ответ на натриевую соль мышьяковистой кислоты.
6.2.5. Пример 5: Пациент Д.Б.
Гистология: Локальный рецидив солидного рака предстательной железы после радикальной простатэктомии (стадия рТ2С Gleason 6) с инфильтрацией шейки мочевого пузыря, неоперабельный.
Стадия: Стадия Дюкса С, рТ 4 показатель Глисона 6
Терапия
Данный пациент был включен в исследование вследствие продолжающегося подъема уровней PSA после радикальной простатэктомии и полного удаления андрогенов антагонистом LHRH (одна плановая подкожная инъекция каждые 3 месяца) и антиандрогеном орально (таблетки касодекса в дозировке 1×1/день после ланча).
Этот пациент принимал участие в исследовании уровней доз 1, 3 и 5 натриевой соли мышьяковистой кислоты. Результаты для данного пациента показывают клинически важное изменение уровней PSA при уровне один дозы лекарства. Уровень дозы один показал значительное снижение PSA от 0,45 нг/мл до 0,04 нг/мл. Данное снижение соответствует уменьшению опухолевой активности на 91,11%. Уровни дозы три и пять не показали изменения от 0,04 нг/мл.
Измерение поражения опухоли с помощью какого-либо из стандартных способов измерения было не доступно.
Вторичные параметры (параметры безопасности) не показали клинически важных результатов при каком-либо уровне доз. Наблюдалось обратимое увеличение трансаминаз sGOT, sGPT и sGGT.
Оценка/критика клинического ответа/прогрессии для уровней доз три и пять была - частичный ответ. Для обоих уровней доз три и пять болезнь показала полный ответ на натриевую соль мышьяковистой кислоты.
6.2.6. Пример 6: Пациент Г-В.С.
Гистология: Запущенный, неоперабельный, солидный рак предстательной железы с внекапсулярным опухолевым ростом в шейку мочевого пузыря и тазовую стенку и распространением костных метастазов.
Стадия: Стадия Дюкса С, рТ 4 показатель Глисона 9 М2
Терапия
Данный пациент был включен в исследование вследствие запущенного статуса обнаруженного рака предстательной железы с множественными костными метастазами, проникшими во весь скелет. Было выполнено полное удаление андрогена антагонистом LHRH (одна плановая подкожная инъекция каждые 3 месяца) и антиандрогеном орально (таблетки касодекса в дозировке 1×1/день после ланча).
Этот пациент принимал участие в исследовании уровней дозы 2 и 4 натриевой соли мышьяковистой кислоты. Результаты для данного пациента показывают клинически важное изменение уровней PSA для обоих уровней доз. Уровень дозы два показал снижение PSA от 725 нг/мл до 6,15 нг/мл с уменьшением опухолевой активности на 99,15%, тогда как уровень дозы четыре показал снижение PSA от 6,15 нг/мл до 3,67 нг/мл с дальнейшим уменьшением опухолевой активности до 40,32%.
Уровень дозы два показал уменьшение размера опухоли от 65×40 мм до 15×30 мм, тогда как уровень дозы четыре не показал изменения в размере от 15×40 мм.
Вторичные параметры (параметры безопасности) не показали клинически важных результатов при каком-либо уровне доз. Качество жизни пациента было сильно улучшено натриевой солью мышьяковистой кислоты. Существующий перед исследованием подъем sGGT вследствие потребления алкоголя ухудшился в течение продолжения исследования. Концентрация гемоглобина увеличилась с 10,0 до 11,1 г/л, тогда как PSA уменьшился от 725 до 3,67 нг/мл.
Оценка/критика клинического ответа/прогрессии для обоих уровней доз была - частичный ответ на натриевую соль мышьяковистой кислоты.
6.3. Заключение
В целом пациенты, принимающие участие в уровнях доз 1, 3 и 5, показали, главным образом, уменьшение уровней PSA и размера опухоли. Большинство пациентов показало по меньшей мере частичный ответ на натриевую соль мышьяковистой кислоты, с одним пациентом, показавшим стабильный статус болезни. Пациент при уровнях доз 2 и 4, Г-В.С., показал очень отчетливый ответ на лечение натриевой солью мышьяковистой кислоты с поразительно уменьшающимися уровнями PSA (99,15% снижение опухолевой активности), а также и значительное уменьшение размера опухоли. Параметры безопасности (лабораторные) не показали клинически важных результатов. Натриевая соль мышьяковистой кислоты была неожиданно очень хорошо перенесена без появления AS's или SAE'S. В целом оральная натриевая соль мышьяковистой кислоты, даже при низких дозах и для относительно коротких периодов лечения, неожиданно показала самый положительный ответ при лечении рака предстательной железы и/или мочеполового рака и костного метастаза.
Заявленная группа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения метастатической неопластической болезни. Предложен способ лечения, который заключается во введении терапевтически эффективного количества мета-арсенита натрия. Дополнительно осуществляют введение другого химиотерапевтического вещества. Предложена композиция, содержащая мета-арсенит натрия. Предложен набор для ингибирования анормального клеточного роста, включающий терапевтически эффективное количество фармацевтической композиции, содержащей мета-арсенит натрия, и другое химиотерапевтическое вещество. Заявленная группа изобретений обеспечивает возможность лечения метастатической неопластической болезни альтернативным соединением с противораковой активностью, а также безопасность лечения. 5 н. и 4 з.п. ф-лы, 2 табл.
1. Способ лечения метастатической неопластической болезни у пациента, включающий введение пациенту терапевтически эффективного количества метаарсенита натрия.
2. Способ по п.1, дополнительно включающий введение терапевтически эффективного количества по меньшей мере еще одного химиотерапевтического вещества.
3. Способ по п.1, согласно которому метаарсенит натрия вводят орально.
4. Композиция, включающая метаарсенит натрия, для лечения метастатической неопластической болезни у пациента.
5. Композиция по п.4, предназначенная для орального введения.
6. Применение метаарсенита натрия для приготовления фармацевтической композиции для лечения метастатической неопластической болезни у пациента.
7. Применение по п.6, в котором указанный метаарсенит натрия предназначен для орального введения.
8. Набор для ингибирования анормального клеточного роста, включающий терапевтически эффективное количество фармацевтической композиции, содержащей метаарсенит натрия, и химиотерапевтическое вещество.
9. Набор для ингибирования анормального клеточного роста, включающий терапевтически эффективное количество фармацевтической композиции, содержащей метаарсенит натрия.
| WO 9918798 A1, 22.04.1999 | |||
| RU 2000128723 A, 20.10.2002 | |||
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЛЕЙКОЗОВ И СПОСОБ ЛЕЧЕНИЯ ЛЕЙКОЗОВ | 1994 |
|
RU2035181C1 |
| JP 6087761 A, 29.03.1994 | |||
| МОИСЕЕНКО В.М | |||
| Паллиативное лечение больных солидными опухолями с метастатическим поражением костей // Практическая онкология | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2010-10-20—Публикация
2006-05-09—Подача