Настоящее изобретение относится к композиции стабилизатора, содержащей аминокислоту и сахар, где все компоненты химически определены, к композиции вакцины, содержащей данную композицию стабилизатора и биологическую молекулу и/или микроорганизм; к способу изготовления фармацевтической композиции, предусматривающему смешивание данной композиции стабилизатора с биологической молекулой и/или микроорганизмом; к применению данной композиции стабилизатора и к приготовленным с помощью этого вакцинам.
В биофармацевтической индустрии, относящейся к производству микроорганизмов и биологических молекул как продуктов, стабильность указанных продуктов является важной задачей. Практически всегда данные продукты должны быть изготовлены, сохранены и транспортированы. Неминуемо со временем при действии температурных изменений и других физических и химических влияний произведенные материалы теряют свое первоначальное эффективное количество или желаемые качественные показатели. Поэтому применяют условия и добавки для предотвращения указанных потерь качества или эффективного количества.
Наиболее используемые стабилизирующие условия представляют собой хранение при пониженной температуре, выше или ниже 0°С, и снижение содержания воды; особенно пригодной является лиофилизация. При лиофилизации образец, содержащий биологически или фармацевтически активную молекулу, микроорганизм, клетку или ткань, сначала замораживают и затем высушивают под вакуумом. Лиофилизированные образцы могут храниться, например, при 4°С и оставаться стабильными часто в течение многих лет. Представлены обзоры: М.Pikal, 1990 (BioPharm, том 3, н. 8, стр.18-27 и н. 9, стр.26-30); L Gatlin и др., 1994 (Bioprocess Techn., том 18, стр.317-367); J.Carpenter и др., 1997 (Pharm. Research, том 14, стр.969-975); F.Bedu-Addo, 2004 (Pharm. Techn., 1 February, стр.10-18).
Идеально лиофилизированный продукт имеет практически неизменяемое качество и количество замороженных и высушенных компонентов через определенный период времени, как и лиофилизированную консистенцию или "кек" элегантного привлекательного внешнего вида, который может выдержать физические воздействия при транспортировке и который быстро растворяется при восстановлении в растворителе.
Для достижения всех указанных требований в лиофилизированном образце и для того, чтобы образец "оставался в живых" при неблагоприятных условиях, которые возникают в процессе лиофилизирования (замораживание, высушивание, нагревание, охлаждение), продолжительного хранения в лиофилизированном состоянии и восстановлении, образец обычно смешивают со стабилизирующей композицией перед лиофилизацией.
Компоненты композиции стабилизатора обычно обозначают:
наполнитель, смеситель для "кека", лиопротектор, модификатор тоничности, поверхностно-активное вещество, крио(генный) протектор, протектор для замораживания, осушитель, лиофильный агент и т.д., где конкретное соединение может иметь несколько функций.
Термин "совместимый раствор" также используют для обозначения компонента, который стабилизирует молекулы и организмы при низком содержании воды в окружающей среде (M.S. da Costa и др. 1998, Adv. Bioch. Eng and Techn., том 61, стр.117-153).
Стабилизирующие композиции для лиофилизации или для стабилизации в других случаях представляют собой сложные смеси белков, углеводов, липидов и солей; композиция которых может быть адаптирована для стабилизации каждой молекулы или микроорганизма, или для какой-либо специфической цели.
Хотя редко бывает известно, как именно действует стабилизатор, общее открытие заключается в том, что большие соединения высокой молекулярной массы в целом обеспечивают хороший стабилизирующий эффект.
Соответственно, указанные крупные соединения были среди главных ингредиентов, используемых ранее в стабилизаторах. Для снижения стоимости материалов их брали из легко доступных продуктов животного происхождения, например, порошкового молока, триптозы, желатина, сывороточного альбумина, коллагена, казеинового гидролизата, хондроитинсульфата и т.д.
К сожалению, использование данных соединений животного происхождения имеет потенциальный риск загрязнения посторонними агентами в других отношениях стерильного или контролируемого продукта. Данная проблема всегда имела большое значение с открытия внутривидовых зоонозных заболеваний и вновь открытых заболеваний, связанных с прионами. В результате контролирующие органы требуют проведения расширенных испытаний на отсутствие посторонних агентов в стабилизированных биологических продуктах перед выпуском их на рынок.
Это приводит к отказу от использования данных животных соединений вначале только в культуре, используемой в производстве биологических молекул или микроорганизмов. Например, В. Makoschey и др. (2002, Cytotechnology vol. 39, p.139-145) описывают лиофильный стабилизатор для использования в стабилизации вирусов, который произведен без сыворотки; стабилизатор содержит сахара, аминокислоты, желатин и пептиды из гидролизата белка животного происхождения.
Позднее также стабилизаторы, которые используют после производства, были модифицированы в их композиции, в результате были разработаны такие композиции стабилизаторов, которые не содержат сыворотки (без сыворотки крови животных), не содержат белка (без белка животных, но могут содержать другие компоненты животного происхождения) или даже не содержат животных компонентов (ACF) (не содержащие любой компонент животного происхождения).
При этом оставалась потребность в композициях стабилизаторов с высокой молекулярной массой и большими молекулами для их стабилизирующего эффекта. Поэтому крупные соединения для ACF стабилизаторов получали, например, из растений или микробов, таких как: естолат (yestolate), пептон соевых бобов, рекомбинантный желатин, (гидрокси-этил-) крахмал, альгинат и т.д.
Альтернативно используют большие полимерные соединения природного или синтетического происхождения, такие как полисахариды, поливинилпоролидон, фикол, полилизин, полиэтиленгликоль, (карбокси)метилцеллюлоза, декстран, полисорбаты (например, Твин®80) и т.д. Например, Osterberg и др. (1997, Pharm. Res., том 14, стр.892-898) заменил сывороточный альбумин Твином®80 в качестве стабилизирующего соединения для белка фактора VIII.
Однако существует несколько проблем даже с данными соединениями ACF стабилизаторов. Например, некоторые из данных стабилизирующих соединений не устойчивы к стерилизации нагреванием, и поскольку стерильность стабилизирующей композиции часто является обязательным требованием, то единственным путем достичь этого является более трудоемкий процесс стерилизации фильтрацией.
Также в случае, если стабилизированный продукт должен вводиться человеку или животному, то некоторые из соединений ACF стабилизаторов не могут быть использованы, поскольку они токсичны или могут вызвать аллергическую реакцию.
Самая известная проблема во всех данных случаях состоит в том, что композиции стабилизаторов, даже ACF, до сих пор имеют тот общий недостаток, что они содержат или состоят из неизвестных, гетерогенных и неопределенных элементов. Например, композиция гидролизатов натуральных растительных продуктов не установлена вообще. Аналогично, для упомянутых полимерных структур известна только их химическая структура в общих чертах; определены только средний размер молекулы и средняя длина боковых цепей использованных соединений. Таким образом, указанные молекулы фактически включают в себя семейство химических структур с широкой вариабельностью молекул.
Следовательно, такие соединения представляют собой соединения с неопределенными свойствами и имеют разброс характеристик от партии к партии. Это требует тщательной селекции исходных соединений для подходящих партий для производства композиции стабилизатора. Партии соединений, которые имеют желаемое качество, имеют ограниченную доступность.
Использование таких неопределенных соединений в стабилизирующих композициях вызывает неизвестные или неконтролируемые изменения в композиции, качестве и выходе продуктов, которые стабилизируют данными композициями.
Такое неконтролируемое качество продукта крайне нежелательно в промышленности, в которой стремятся производить стойкие, безопасные, высококачественные продукты и может быть преодолено дорогостоящими и длительными процедурами селекции исходных материалов, проверки поступающих товаров, выпуска продукции и контролем качества конечного продукта.
Задачей изобретения является предоставить альтернативную и улучшенную композицию стабилизатора, которая не имеет указанных недостатков известного уровня техники.
К удивлению авторов было обнаружено, что композиция стабилизатора, содержащая, по меньшей мере, одну аминокислоту и, по меньшей мере, один сахар, где все соединения химически определены, может обеспечить эффективную стабилизацию качества и количества биологических молекул и микроорганизмов без необходимости в большой молекулярной массе, или в присутствии больших или неопределенных соединений. Это обеспечивает много преимуществ над известным уровнем техники.
Стабилизирующая композиция по изобретению не содержит сыворотки, белка и животных соединений и, следовательно, не вносит посторонних агентов в контролируемый продукт, который стабилизируют. Кроме того, стабилизирующая композиция устраняет необходимость во включении неопределенных, гетерогенных и неизвестных соединений, что дает, в результате, стабилизацию продуктов, приводящую к предсказуемым и контролируемым конечным продуктам. Оба аспекта снижают требования к контролю конечных продуктов на качество и посторонние агенты.
Стабилизирующая композиция содержит только точно известные соединения, не имеет разброса характеристик от партии к партии или ограниченной доступности партий с требуемыми подходящими характеристиками. Это снижает требования для входного контроля и селекции исходных материалов. Далее, стабилизирующая композиция, согласно настоящему изобретению, является нетоксичной для людей или животных и стерилизуется нагреванием.
Стабилизирующая композиция обеспечивает хорошую стабилизацию биологических молекул и микроорганизмов от физических и химических влияний, в частности, она стабилизирует качество и эффективное количество образцов от негативных влияний, испытываемых с течением времени и при изменении температуры. При лиофилизации стабилизирующая композиция придает устойчивость биологическим молекулам и микроорганизмам к условиям процессов замораживания, высушивания, нагревания и охлаждения, как и к негативным влияниям при продолжительном хранении в лиофилизированном состоянии и при восстановлении.
Кроме того, стабилизирующая композиция обеспечивает лиофилизированную консистенцию или "кек" элегантного привлекательного внешнего вида, который может выдержать физические воздействия при транспортировке и который быстро растворяется при восстановлении в растворителе.
Таким образом, изобретение относится к композиции стабилизатора, содержащей, по меньшей мере, одну аминокислоту и, по меньшей мере, один сахар, характеризующийся тем, что все соединения определены химически.
"Композиция стабилизатора" определяется как композиция, которая при смешивании с биологическими молекулами или микроорганизмами имеет стабилизирующий эффект; а именно композиция стабилизатора может предотвратить в большой степени потерю качества или эффективного количества образцов, содержащих биологические молекулы и/или микроорганизмы.
"Эффективное количество" представляет собой, например, количество биологически или фармацевтически активных биологических молекул, или число живых или инфекционных микроорганизмов.
"Потеря качества" может иными словами происходить при физических и/или химических влияниях, таких как со временем при изменениях температуры, механических воздействиях (например, транспорт) и/или изменениях физической формы (например, замораживание, высушивание).
Композиция стабилизатора может быть в форме водного раствора, водного концентрата или может быть предоставлена в виде сухой смеси химических средств, пригодных для приготовления водного раствора или водного концентрата композиции стабилизатора согласно изобретению.
Биологические молекулы и/или микроорганизмы, которые стабилизируют, могут быть в жидкой, сухой, замороженной или лиофилизированной форме перед смешиванием с композицией стабилизатора.
Микроорганизмы могут быть живые или мертвые, например, как результат намеренной инактивации.
"Сахар" известен как соединение, дающее сладкий или сладковатый вкус, и более конкретно - представляет собой углевод, такой как моно- или дисахарид, сахарный спирт или полиол и их производные.
По изобретению соединение является "химически определенным", когда оно состоит исключительно из идентичных молекул.
Соответственно, такое химически определенное соединение имеет точно известную, однозначную, стандартную химическую структуру, и оно применяется в точно известном количестве.
Химически определенное соединение стабилизатора согласно изобретению не является неопределенным, гетерогенным или неизвестным соединением, таким как белковый лизат, экстракт, гидролизат или пептидная смесь. Кроме того, композиция стабилизатора согласно изобретению не содержит полимерного соединения, у которого известны только средняя молекулярная масса или средняя длина боковых цепей.
Химически определенное соединение стабилизатора согласно изобретению является легко доступным у коммерческих поставщиков чистых реактивов; предпочтительно используют самую высокую доступную степень чистоты. Хотя требование к соединению быть химически определенным не исключает присутствия примесей в следовых количествах в таком соединении. Такими примесями могут быть, например, тяжелые металлы, осадки, растворители или нечто подобное. Предпочтительно примеси представлены в количестве менее чем 1% массы химически определенного соединения, более предпочтительно менее чем 0,1, 0,01, 0,001 или 0, 0001% по массе.
Предпочтительно требование быть химически определенным относится к молекулам соединения согласно изобретению в ионизированной форме в водном растворе. Таким образом, в предпочтительном воплощении такое химически определенное соединение может быть представлено в твердой или неионизированной форме в форме различных солей, или в формах, имеющих различное число связанных молекул кристаллической воды (гидратные формы).
Предпочтительно композиция стабилизатора согласно изобретению обеспечивает стабилизацию биологических молекул и/или микроорганизмов, по меньшей мере, на том же уровне, как и стабилизаторы известного уровня техники, содержащие неопределенные соединения.
Предпочтительно потеря титра при использовании композиции стабилизатора согласно изобретению для стабилизации продукта, содержащего живой микроорганизм, составляет менее 1 log10. Более предпочтительно, если менее чем 0,5 log10.
Однако это требуется не всегда: в некоторых применениях отсутствие неопределенных соединений в стабилизаторе и, следовательно, в конечном продукте имеет огромное значение; несколько более низкий выход в качестве и/или количестве, проистекающий из использования композиции стабилизатора согласно изобретению, является в таком случае совершенно приемлемым в обмен на многие преимущества, которые оно предлагает, над стабилизаторами известного уровня техники.
Например, в случае, когда стабилизатор по изобретению используют как стабилизатор для долговременного хранения посевного материала микроорганизмов, как, например, в глицериновом стоке. В таком случае ACF стабилизация полностью определенным стабилизатором может быть более важна и потеря в титре до 2 log10 может быть допустимой, поскольку в любом случае посевной материал обычно культивируют до правильного количества для инокуляции.
Далее, специалист в данной области может оптимизировать, например, композицию стабилизатора по изобретению или условия его использования путем обычных экспериментов. Поэтому данные оптимизированные композиции и условия входят в объем изобретения.
Для оценки уровня стабилизации могут быть использованы соответствующие оставшиеся эффективные количество и качество стабилизированного продукта и соответствующие методы. Например, количество и вирулентность (качество) вирусных и бактериальных соединений может быть определено титрованием или методом предельных разведений, биологические молекулы могут быть определены биохимически (например, энзиматически), иммунологически (иммунофлюоресцентный способ) или физически (например, электрофорез, хроматография или масс-спектрометрия). Все указанные техники являются хорошо известными и доступными в данной области техники.
В предпочтительном воплощении композиция стабилизатора по изобретению содержит дополнительно, по меньшей мере, один полиамин.
"Полиамин" обозначает соединение с двумя или более аминогруппами.
В более предпочтительных воплощениях данное изобретение относится к композиции стабилизатора согласно изобретению:
- где сахар представляет собой, по меньшей мере, один из выбранных из группы, состоящей из глюкозы, лактозы, сахарозы, мальтозы, трегалозы, сорбита и маннита,
- где полиамин представляет собой, по меньшей мере, один из выбранных из группы, состоящей из этилендиамина, кадаверина, путресцина, спермидина и спермина,
- где аминокислота представляет собой глутамат (глутаминовую кислоту) или глицин, или где содержатся обе данные аминокислоты.
В другом более предпочтительном воплощении композиция стабилизатора по изобретению представляет собой буферный водный раствор, предпочтительно данный водный раствор имеет рН между 6-8, более предпочтительно - рН приблизительно 6,9.
Буфером может быть, например, Трис/цитрат, предпочтительно в концентрации около 50 мМ/10 мМ.
Предпочтительно используют буфер на основе фосфата, более предпочтительно - дигидрат двузамещенного фосфата натрия.
Предпочтительно буфер представляют в количестве между 0,1 и 100 г/л, более предпочтительно 1 г/л.
В альтернативном более предпочтительном воплощении водный раствор композиции стабилизатора согласно изобретению представляет собой концентрированный раствор, содержащий соединения композиции стабилизатора в концентрации, которая выше, чем та, в которой данные соединения будут в конечной фармацевтической композиции, которая образуется после смешивания композиции стабилизатора согласно изобретению с биологическими молекулами или микроорганизмами, которые стабилизируют.
Предпочтительно композиция стабилизатора является в 2, 3, 4, 5, 10 или 20 раз более концентрированной по сравнению с концентрацией или количеством в конечной фармацевтической композиции; наиболее предпочтительной является композиция стабилизатора в 4-кратной концентрации.
В более предпочтительном воплощении предоставляется сухая композиция химических средств, которая удобна для растворения в соответствующем растворителе для получения водного раствора или концентрата композиции стабилизатора по изобретению.
Предоставление смеси химических средств для последующего растворения имеет преимущества хранения малых объемов. Это экономит место на складе и облегчает транспортировку и продажу.
Еще более предпочтительно в композиции стабилизатора согласно изобретению:
- сахар представляет собой сахарозу, сорбит или маннит; более предпочтительно - D-сорбит;
- аминокислота представляет собой глутамат или глицин; еще более предпочтительно, включают оба L-глутамат и глицин;
- используют комбинацию полиаминов; более предпочтительно спермин и путресцин или спермин и этилендиамин.
В другом более предпочтительном воплощении композиции стабилизатора согласно изобретению 4-кратный концентрат содержит:
- сахар в количестве между 10 и 200 г/л, предпочтительно около 75 г/л;
- аминокислоту в количестве между 0,1 и 400 г/л; предпочтительно включают L-глутамат около 20 г/л или глицин около 160 г/л;
- полиамин в количестве между 0,1 и 100 г/л; предпочтительно включают спермин около 10 г/л или спермидин около 2,5 г/л.
В другом предпочтительном воплощении композиция стабилизатора согласно изобретению содержит сахар и глутамат в качестве аминокислоты, и дополнительно содержит, по меньшей мере, один совместимый раствор. Совместимый раствор предпочтительно представляет собой, по меньшей мере, один, выбранный из группы, состоящей из саркозина, бетаина, диглицина и холина. Совместимый раствор в 4-кратном концентрате предпочтительно представлен в количестве между 0,1 и 400 г/л; предпочтительно между 50-200 г/л, более предпочтительно - около 160 г/л.
Как отмечалось ранее, несущественно, в какой форме соли или гидрата используют композицию стабилизатора; например, спермин может быть использован в следующих формах: спермин, спермин-дигидрат или спермина тетрагидрохлорид; соответственно, спермидин может быть использован как спермидин или спермидина тригидрохлорид.
Поскольку стабилизатор согласно изобретению предполагают смешивать с биологическими молекулами или микроорганизмами, в некоторых применениях соединения стабилизатора могут быть частью продукта, который вводят человеку или животным. Поэтому соединения композиции стабилизатора согласно изобретению являются нетоксичными, по меньшей мере, нетоксичными в концентрациях, представленных в конечном продукте, который применяют.
Предпочтительно соединения композиции стабилизатора согласно изобретению не вызывают нежелательной аллергической реакции.
Предпочтительно композиция стабилизатора согласно изобретению является стерильной. Стерилизация стабилизатора согласно изобретению может быть достигнута нагреванием, фильтрацией, облучением или любым подходящим способом, известным в данной области техники. Предпочтительно композицию стабилизатора стерилизуют нагреванием.
Химически определенные соединения, подходящие для использования в композиции стабилизатора согласно изобретению перечислены в качестве примеров в табл.1.
Как известно в данной области техники, производные описанных здесь соединений композиции стабилизатора согласно изобретению доступны или могут быть синтезированы. Указанные производные также подходят для использования в качестве соединений композиции стабилизатора согласно изобретению. Таким образом, указанные производные входят в объем изобретения.
Было проведено большое число экспериментов с композициями стабилизатора согласно изобретению. Они были проведены для включения всех условий, при которых композиция стабилизатора согласно изобретению обеспечивает эффективную стабилизацию:
- охлаждение для хранения продукта в жидкой форме, например, при 4°С,
- замораживание; для хранения продукта в состоянии глубокой заморозки, например, при -20°С или -45°С,
- лиофилизация, включая высушивание, нагревание, охлаждение,
- замораживание лиофилизированного продукта для хранения в глубоко замороженном состоянии, например, при -20°С или -45°С,
- охлаждение лиофилизированного продукта для хранения при 4°С,
- нагревание лиофилизированного продукта до температуры выше комнатной, и
- восстановление лиофилизированного продукта в растворителе.
При проведении данных экспериментов со стабилизированными композициями, содержащими микроорганизмы, остающееся число живых инфекционных микроорганизмов в восстановленных продуктах определяли хорошо известными количественными способами, основанными на титровании или конечном разведении. Для биологических молекул количество и качество определяли такими специальными исследованиями, как титрование, ИФА или биотесты.
Указанные эксперименты и их результаты представлены в примерах и показывают, что композиция стабилизатора согласно изобретению обеспечивает эффективную стабилизацию микроорганизмов или биологических молекул не только для различных применений, связанных с лиофилизацией, но и для стабилизации антигенов при хранении в охлажденном или замороженном состоянии до или вместо лиофилизации.
В альтернативном воплощении композиция стабилизатора по изобретению характеризуется отсутствием соединений с высокой молекулярной массой или большого размера.
По изобретению "высокая молекулярная масса" и "большие" соединения определяют как любое соединение, имеющее молекулярную массу или размер иона молекулы более 203 Да. Например, спермин не был бы таким большим соединением, т.к. его молекулярный ион имеет молекулярную массу только 202 Да, исключая кристаллическую воду или солевые формы, такие как гидраты или (гидро)хлориды.
Как описано выше, было удивительно обнаружить, что ни одно из больших соединений, обычно используемых в данной области техники, не требуется для получения эффекта стабилизации, фактически не требуется соединения крупнее, чем спермин.
Преимущества этого уже упоминались: высокомолекулярные, большие молекулы часто не определены и гетерогенны или, в лучшем случае, известны только средний молекулярный размер и средняя длина боковых цепей соединений. Следовательно, такие неопределенные соединения, используемые в композиции стабилизатора, дадут, в результате, стабилизированный продукт с непредсказуемыми характеристиками.
В альтернативном предпочтительном воплощении изобретение относится к композиции вакцины, содержащей композицию стабилизатора согласно изобретению и, по меньшей мере, одну биологическую молекулу или, по меньшей мере, один микроорганизм или их комбинацию.
Композиция вакцины обычно представляет собой в данной области техники композицию, содержащую иммуногенное соединение в фармацевтически приемлемом носителе, где иммуногенное соединение способно вызвать пассивную или активную активацию иммунной системы. Подразумевают, что вызванный иммунный ответ препятствует возникновению или прогрессированию определенной инфекции или облегчение симптомов заболевания.
Фармацевтически приемлемым носителем может быть, например, стерильная вода или стерильный физиологический раствор. В более сложной форме носитель может быть, например, буфером.
"Биологическая молекула" в данном изобретении понимается, как молекула, которая может быть найдена в природе; в частности, это относится к белку, углеводу, липиду или нуклеиновой кислоте. Происхождение молекулы может быть биологическим или искусственным, выделенным либо ex vivo, либо ex vitro.
Термин "белок" подразумевает содержание молекулярной цепи из двух или более аминокислот; поэтому пептиды, олигопептиды и полипептиды входят в определение белка.
Композиция вакцины согласно изобретению может быть в любой форме, например: лиофилизированная, жидкая или замороженная; или может быть создана или преобразована в жидкость, гель, мазь, порошок, таблетку или капсулу или лиофилизированную массу, в зависимости от желаемого способа хранения, транспортировки или применения.
Композиция вакцины согласно изобретению может включать в себя единичные иммуногенные микроорганизмы и биологические молекулы или их комбинацию.
В предпочтительных воплощениях изобретение относится к композиции вакцины:
- где микроорганизм представляет собой вирус или бактерию, или где содержатся оба - и вирус, и бактерия; более предпочтительно вирус представлен, по меньшей мере, одним видом, выбранным из группы, состоящей из герпес-, парамиксо-, ортомиксо-, адено-, рабдо-, бирна-, корона-, пневмо- и поксвирусов; еще более предпочтительно вирус выбирают из группы, состоящей из вируса бычьего герпеса, вируса бычьего парагриппа 3, вируса псевдобешенства, респираторно-синцитиального вируса человека и вируса гриппа человека или животных; бактерию выбирают из группы, состоящей из видов Streptococcus, Staphylococcus, Escherichia, Mycoplasma, Edwardsiella, Campylobacter and Salmonella,
- где биологическая молекула представляет собой, по меньшей мере, одну, выбранную из группы, состоящей из белка, углевода, липида или нуклеиновой кислоты; более предпочтительно белок представляет собой, по меньшей мере, один, выбранный из группы, состоящей из антитела, фрагмента антитела, цитокина, гормона или фермента.
Фрагменты антител представляют собой, например, Fab-фрагменты или единичную цепь антител.
Гормоны для использования с композицией стабилизатора по изобретению представляют собой, например, инсулин, гонадотропные гормоны, такие как фолликулостимулирующий гормон, человеческий хорионический гонадотропин и эритропоэтин.
Композиции вакцин и стабилизатора по изобретению применимы с широким рядом вирусов, любого геномного или морфологического типа, инфекционных для любых видов животных или для людей. В частности, результаты, полученные при стабилизации частного вируса животных, могут быть прямо экстраполированы для предсказания результатов стабилизации соответствующего вируса, инфицирующего хозяина из других видов животных или человека и для других видов вирусов данного вирусного семейства.
Вирусы, имеющие оболочку, особенно чувствительны к химическим и физическим влияниям. Следовательно, сами по себе вирусы могут быть эффективно стабилизированы композицией стабилизатора по изобретению, что еще больше обеспечивает их эффективность.
Бактерии для использования со стабилизатором согласно изобретению могут быть одного типа, например, как характеризуемые по окрашиванию грамположительные или грамотрицательные.
Результаты, полученные по стабилизации данных бактерий, могут быть экстраполированы на другие бактериальные виды упомянутых родов.
Промышленная система для производства биологических молекул и микроорганизмов для применения со стабилизатором по изобретению может быть любой in vitro или in vivo системой. Например, вирусы могут быть получены в культуре клеток, на куриных эмбрионах или в организме хозяина-животного; бактерии могут быть получены при использовании сходных технологий и, дополнительно, в культуральном бульоне; биологические молекулы могут быть получены выделением из животного или микроорганизма, особенно успешно могут быть применены рекомбинантные экспрессионные системы. В данной области техники известно много других воплощений.
Однако оптимальная сохранность и предсказуемость стабилизированного конечного продукта достигается удалением неизвестных гетерогенных или неопределенных компонентов как на стадии производства, так и из композиции стабилизатора.
Таким образом, в наиболее предпочтительном воплощении композиции вакцины согласно изобретению биологическая молекула или микроорганизм, или оба из них производятся свободными от животных компонентов.
Промышленные системы ACF представляют собой, например, вирусные культуры на клетках в ACF среде; бактериальные культуры в ACF культуральном бульоне; рекомбинантные экспрессионные культуры, использующие ACF среды, например, бакуловирусная экспрессионная система с использованием клеток насекомых.
В другом предпочтительном воплощении композиция вакцины согласно изобретению содержит адъювант.
Адъюванты обычно используют для усиления иммунного ответа на компонент вакцины, при стимулировании иммунной системы человека или животного неспецифическим путем. В данной области техники известно много различных адъювантов, например минеральные и биологические масла, сапонины, пептиды, оксид алюминия и производные и т.д.
В другом предпочтительном воплощении композиция вакцины является лиофилизированной.
В лиофилизированной форме композиция стабилизатора по изобретению является наиболее полезной; лиофилизированные композиции вакцины согласно изобретению стабильны, например, при +4°С от нескольких месяцев до нескольких лет.
Процедуры лиофилизации известны в данной области техники, оборудование для лиофилизации различной градации коммерчески доступно. Обычно композиции вакцины, содержащие стабилизатор согласно изобретению заливают в стеклянные пузырьки определенного объема, например между 0,5 и 50 мл, предпочтительно 1,2 или 5 мл. Затем данные пузырьки замораживают и подвергают процессу лиофилизации.
Типичный процесс лиофилизации содержит следующие шаги:
- глубокое замораживание в течение 10-60 мин для закрепления жидкости в определенной структуре;
- первая стадия высушивания при температуре от -20°С до 20°С в течение 1-12 часов при глубоком вакууме для сублимации кристаллизированной воды;
- вторая стадия высушивания при температуре от 0°С до 40°С в течение 1/2-6 часов при среднем вакууме для удаления незамороженной воды;
упаковка замороженной высушенной массы (например, закрывание стеклянных пузырьков резиновыми крышками) для сохранения сухого состояния, например, под вакуумом или в азоте; и
- хранение при +4°С.
Специалист в данной области имеет квалификацию для внесения стандартных изменений и оптимизации данного процесса для получения наилучших результатов для индивидуальных типов образцов.
Процесс лиофилизации можно оптимизировать мониторингом температуры и содержанием воды в аппарате при высушивании. Также обычно используют дифференциальную сканирующую калориметрию для определения параметров продукта до и после лиофилизации.
Остаточное содержание воды (rwc) в конечном продукте является важным параметром, определяющим стабильность лиофилизированных продуктов. Предпочтительно rwc лиофилизированных образцов и вакцин согласно изобретению менее 5%. Для определения rwc может быть успешно использовано титрование по Карлу Фишеру (Karl Fisher), известное в данной области техники.
В другом предпочтительном воплощении лиофилизированная вакцина согласно изобретению готовится в форме лиосферы, как описано в европейском патенте ЕР 799613.
Лиофилизированная масса произведенной композиции вакцины согласно изобретению может быть в любой форме. Стабилизирующая композиция согласно изобретению обеспечивает полезные характеристики композиции вакцины для достижения элегантного и привлекательного внешнего вида лиофилизированной массы. Предпочтительно лиофилизированный "кек" в стеклянном пузырьке имеет блестящий, гомогенный вид и предпочтительно остается прикрепленным к стенкам пузырька при его встряхивании и не является настолько ломким, что измельчается при нормальных условиях транспортировки.
Следовательно, желаемый внешний вид лиофилизированной вакцинальной массы относится не только к субъективным или эстетическим характеристикам, но также содержит реальные положительные технические эффекты; в частности, подразумеваются эффективность стабилизации, устойчивость при транспортировке и скорость повторного размораживания.
Особый интерес представляет предотвращение появления внешнего вида, известного в данной области техники как "коллапсированный", когда лиофилизированная масса, имеющая аморфный и комкообразный вид, повторно растворяется медленно и не полностью и не обеспечивает адекватной стабилизации биологических молекул и/или микроорганизмов, которые должны быть сохранены.
В другом предпочтительном воплощении готовый для использования раствор вакцины, получаемый восстановлением лиофилизированной композиции вакцины согласно изобретению в фармацевтически приемлемом носителе.
Поскольку лиофилизированные композиции вакцин согласно изобретению растворяются быстро, то предпочтительно проводить восстановление непосредственно перед применением раствора вакцины. Таким образом, подтверждается, что раствор вакцины является свежим, заданной дозы и качества.
Композиция вакцины согласно изобретению может быть введена человеку или животному согласно способам, известным в данной области техники. Например, парентеральные применения, такие как все пути проникновения инфекции внутрь или через кожу: внутримышечно, внутривенно, внутрибрюшинно, внутрикожно, под слизистую или подкожно. Альтернативные пути употребления, которые обоснованы, представляют собой местное применение в форме капель, спрея, геля или мази для эпителия слизистых оболочек глаз, носа, рта, ануса или вагины или наносятся на эпидермис наружной кожи любой части тела спреем в виде аэрозоля или пудрой.
Альтернативно применение может быть через алиментарный путь при смешивании с едой, кормом или питьевой водой, например, в виде порошка, жидкости, таблетки или введением непосредственно в рот в виде жидкости, геля, таблетки, капсулы или в анус в виде суппозитория. Также с успехом можно применить способ вакцинации иммерсией.
Предпочтительными путями введения являются внутримышечные или подкожные инъекции или интраназальный спрей.
При этом не говорится, что оптимальный путь введения зависит от специфических особенностей инфекции или симптомов, которые предотвращают или уменьшают, от характеристик формулы вакцины, которую используют, и от индивидуальных параметров видов-мишеней.
Схема введения композиции вакцины согласно изобретению человеку или животным может представлять собой одну или несколько доз, которые могут быть даны в одно время или последовательно, способом, совместимым с дозировкой и формулой, в количестве, которое будет иммунологически эффективным, как, например, одна доза в год.
В альтернативном воплощении изобретение относится к способу производства фармацевтической композиции, предусматривающему смешивание композиции стабилизатора согласно изобретению с композицией, содержащей, по меньшей мере, одну биологическую молекулу или, по меньшей мере, один микроорганизм или их комбинацию.
Фармацевтическая композиция, произведенная способом по изобретению, может быть в любой форме: жидкой или сухой, замороженной, лиофилизированной и т.д.
Смешивание может быть выполнено с использованием любой подходящей техники, доступной в данной области техники.
Предпочтительно способ согласно изобретению предусматривает смешивание 1 части композиции стабилизатора согласно изобретению в виде стерильного водного буферного раствора в 4-кратной концентрации с 3 частями композиции, содержащей, по меньшей мере, одну биологическую молекулу и/или, по меньшей мере, один микроорганизм для производства фармацевтической композиции согласно изобретению.
Композиция, содержащая, по меньшей мере, одну биологическую молекулу и/или, по меньшей мере, один микроорганизм или их комбинацию, которую смешивают с композицией стабилизатора согласно изобретению, имеет предпочтительно жидкую форму. Данная композиция может быть получена из вирусной или бактериальной культуры или культурой экспрессионной системы. Данная композиция может быть получена, например, в результате дальнейшей обработки, такой как центрифугирование, например, могут быть использованы культуральный супернатант или (ресуспендированный) осадок после центрифугирования; или может быть использована необработанная цельная культура.
Предпочтительно смешивание композиции стабилизатора и композиции, содержащей биологическую молекулу и/или один микроорганизм способом по изобретению производят в течение короткого времени после изготовления и завершения последующей обработки для получения наилучших результатов стабилизации.
Предпочтительно стабилизированную фармацевтическую композицию, полученную таким образом, затем хранят охлажденной или замораживают до последующей обработки и собирают результаты контроля качества продукции.
В предпочтительных воплощениях способа согласно изобретению:
- микроорганизм представляет собой вирус или бактерию, или включают и вирус, и бактерию;
- вирус представляет собой, по меньшей мере, один вид вируса, выбранный из группы, состоящей из герпес-, парамиксо-, ортомиксо-, адено-, рабдо-, бирна-, корона-, пневмо- и поксвирусов;
- биологическая молекула представляет собой, по меньшей мере, одну, выбранную из группы, состоящей из белка, углевода, липида и нуклеиновой кислоты;
- белок представляет собой, по меньшей мере, один, выбранный из группы, состоящей из антитела, фрагмента антитела, цитокина, гормона или фермента;
- биологическая молекула или микроорганизм, или оба из них произведены без животных компонентов;
- конечную фармацевтическую композицию подвергают лиофилизации.
В более предпочтительном воплощении изобретение относится к фармацевтической композиции, полученной способом согласно изобретению, где композиция представляет собой вакцину.
В еще более предпочтительном воплощении изобретение относится к способу производства раствора вакцины восстановлением фармацевтической композиции согласно изобретению в фармацевтически приемлемом носителе.
В другом альтернативном воплощении изобретение относится к применению композиции стабилизатора согласно изобретению для стабилизации качества и количества, по меньшей мере, одной биологической молекулы или, по меньшей мере, одного микроорганизма, или их комбинации в композиции.
В предпочтительных воплощениях применения согласно изобретению:
- микроорганизм представляет собой вирус или бактерию, или включены и вирус, и бактерия;
- вирус представляет собой, по меньшей мере, один вид вируса, выбранный из группы, состоящей из герпес-, парамиксо-, ортомиксо-, адено-, рабдо-, бирна-, корона-, пневмо- и поксвирусов;
- биологическая молекула представляет собой, по меньшей мере, одну, выбранную из группы, состоящей из белка, углевода, липида и нуклеиновой кислоты;
- белок представляет собой, по меньшей мере, один, выбранный из группы, состоящей из антитела, фрагмента антитела, цитокина, гормона или фермента;
- биологическая молекула или микроорганизм, или оба из них произведены без животных компонентов.
В более предпочтительном воплощении изобретение относится к применению раствора вакцины согласно изобретению или раствора вакцины, полученного способом по изобретению, для иммунизации человека или животных.
Изобретение далее охарактеризовано при помощи ссылок на следующие неограничивающие примеры.
ПРИМЕРЫ
Как упоминалось ранее, эксперименты по лиофилизации проводят с включением всех условий, при которых должен работать эффективный стабилизатор: охлаждение, замораживание, высушивание, нагревание.
Общая схема экспериментов по лиофилизации, выполненных по стабилизированию микроорганизмов, выглядит следующим образом:
- композиции, содержащие микроорганизмы, получают из культуры, обрабатывают, если требуется, и хранят при 4°С или ниже 0°С;
- композицию стабилизатора согласно изобретению готовят, взвешивая требуемые соединения в желаемых количествах, добавляя их к требуемому объему стерильной дистиллированной воды и смешивая их до растворения. Затем композицию стабилизатора стерилизуют нагреванием при 121°С в течение 20 мин;
- в начале эксперимента образцы размораживают, смешивают с объемом 4-кратно концентрированного стабилизатора, который представляет собой одну третью часть объема образца. Используют стабилизатор согласно изобретению или стандартные композиции стабилизаторов. Кроме того, в эксперимент включают образцы без какого-либо стабилизатора;
- стабилизированные образцы помещают в стандартные стеклянные пузырьки объемом 10 мл в определенном наполняющем объеме: BHV и PI3 вирусы по 2 мл, PRV, миксома вирус, BRSV, EIV и BCV по 1 мл. Бактериальные образцы помещают в пузырьки по 2,5 мл на пузырек;
- образцы лиофилизируют по стандартной двухстадийной программе, до содержания остаточной воды менее 5%, и затем плотно закрывают резиновыми пробками под вакуумом;
- затем образцы хранят при 4°С или при более высокой температуре в течение определенного периода времени; результаты в колонках "сразу, 4°С" являются результатами титрования образцов, хранившихся при 4°С менее 1 месяца после лиофилизации; результаты в колонках "3 дня, 28°С" являются результатами титрования образцов, хранившихся при 28°С 3 дня после хранения при 4°С после лиофилизациии и затем измеренных количественно сразу спустя указанные 3 дня; результаты в колонках "1 год, 4°С" являются результатами титрования образцов, хранившихся при 4°С, по меньшей мере, 1 год после лиофилизации.
Хранение при 28°С в течение 3 дней включают как исследование на увеличенную стабильность; в большинстве случаев данные результаты являются показательными для хранения на протяжении увеличенного периода времени в естественном или охлажденном состоянии.
Для определения количества и качества микроорганизмов, оставшихся после применения указанных условий, определяют инфекционные титры вирусных образцов и проводят подсчет на плашках бактериальных образцов.
Исследование титров BRS вируса
Стабилизированные образцы BRS вируса разводят в среде стандартной клеточной культуры, дополненной 10% FCS (объем/объем) до разведений между 10-1 и 10-7 в 0,2 мл. Вносят разведения в BEL клетки в лунках микропланшета для титрования: 1,5×105 BEL клеток/мл, по 0,2 мл/лунку. 10 лунок используют для разведения вируса. Инкубируют микропланшеты 8 дней (3-5% СО2, 37°С). Фиксируют планшеты смесью ацетон/РВS 70/30% по объему в течение 10-15 мин при комнатной температуре. Фиксированный монослой сначала инкубируют с моноклональными антителами, специфичными к BRS вирусу и затем с анти-FIТС-конъюгатом к антителам + Эванс голубой (контрастная окраска). Те лунки, в которых проявились положительные флуоресцентные клетки, считают как положительные. Титры вируса подсчитывают по методу Рида-Менча и выражают в ТЦД50.
Все эксперименты включают образец гомологичного стандартного вируса и отрицательный контроль для каждой серии титрования вируса. Все вирусные титрования выполняют в дубле в один день. Представляют средние значения титров.
Исследование титров вируса миксомы
Клетки RK 13 высевают в 96-луночные планшеты, 4×105 клеток в мл, по 100 мкл в лунку в стандартной клеточной среде с 5% фетальной телячьей сыворотки (FCS) и подходящими антибиотиками. Планшеты инкубируют в течение ночи при 37°С в 5% атмосфере СО2.
На следующий день готовят разведения стабилизированного образца, содержащего вирус миксомы, от 10-1 до 10-8. Вносят по 20 мкл каждого вирусного разведения в лунку планшета с клетками RK 13 в триплетах. После инкубации в течение 1 часа при 37°С и 5% CO2, в лунки добавляют по 100 мкл свежей культуральной среды с FCS и инкубируют планшеты 2-3 для до появления вирусных бляшек и определяют цитопатогенный эффект (ЦПЭ).
Затем планшет опорожняют, окрашивают разведением нафталина черного, инкубируют 1 час при комнатной температуре. Планшеты снова опорожняют, промывают водопроводной водой, высушивают и считают, используя световую микроскопию.
Число живых инфекционных вирусов миксомы в исходном образце считают по алгоритму Спирмана-Кербера и выражают в ТЦД50.
Исследование титров BHV, PI3 и PRV вирусов
Стабилизированные образцы BHV, PI3, PRV вирусов титруют, как и вирус миксомы, за исключением того, что для BHV и PI3 используют JCK клетки и для PRV используют Vero клетки. ЦПЭ определяют подсчетом плашек, используя световую микроскопию.
Исследование титров BHV
Суспензию MDBK клеток помещают в 96-луночный планшет, по 200 мкл/лунку 1×105 клеток/мл в DMEM среде, дополненной 10% FCS и подходящими антибиотиками. Планшеты инкубируют 3 дня при 37°С и 5% СO2. Через 3 дня образуется сплошной монослой. Удаляют среду и добавляют по 200 мкл свежей среды без FCS и антибиотиков и инкубируют планшеты в течение 2 часов. Готовят 10-кратные разведения стабилизированных образцов BCV. Планшеты для микротитрования вновь опорожняют и вносят разведения от 10-3 до 10-8 в монослой MDBK клеток. Планшеты инкубируют 5-6 дней. Вирусные бляшки визуализируют для иммунофлюоресцентного подсчета с помощью поликлональной кроличьей анти-BCV сыворотки и козьих анти-кроличьих конъюгированных антител, меченных FITC. После окрашивания Эванс голубым бляшки подсчитывают, используя УФ-микроскопию. Подсчет живых вирусных ТЦД50 титров производят алгоритмом Рида-Менча.
Вирус гриппа лошадей (EIV)
EIV титруют на куриных эмбрионах; разведения стабилизированной пробы EIV вносят в алантоидную полость оплодотворенного 10-дневного куриного яйца и инкубируют при 40-42°С в течение 3-5 дней. Открывают яйца и тестируют алантоидную жидкость способом гемагглютинации, используя куриные эритроциты. Количество живых инфекционных EIV в исходном образце рассчитывают из наивысшего разведения, полученного в реакции гемагглютинации.
В некоторых экспериментах оценивают качество лиофилизированного "кека". Это включает визуальный осмотр и встряхивание пузырька.
Дают условные показатели:
+ элегантный внешний вид, хорошая прочная структура
0 удовлетворительный внешний вид и структура
- ниже желаемого внешний вид и структура
Бактерии
Бактериальные культуры получают выращиванием сток материала в шейкерных фляшках в соответствующей стандартной среде роста. Затем данные культуры определяют количественно высеванием в дуплетах серий лимитирующих разведений образцов на плашки с кровяным агаром для подсчета числа колоний, появившихся после ночной инкубации. В некоторых экспериментах число колоний, восстановившихся после лиофилизации, выражают в виде % от числа колоний в начальной культуре перед лиофилизацией. Соответствующие культуры затем смешивают 1:4 с 4-кратной концентрированной композицией стабилизатора согласно изобретению и подвергают стандартной двухстадийной программе лиофилизации.
Для экспериментов с Е. coli используют штамм К12 и дифференциальную среду роста: стандартная LB среда, LB с ампициллином и кровяной агар. Эффективность композиции стабилизатора согласно изобретению сравнивают со стандартным стабилизатором, содержащим альбумин.
Образцы тестируют или перед, или сразу после лиофилизации, или после 3 дней инкубации при 28°С или 30°С для определения усиленной стабильности.
Для контроля включен обычный стабилизатор известного уровня техники как пример для сравнения (Makoschey и др., супра), который отмечен как "об.стаб."
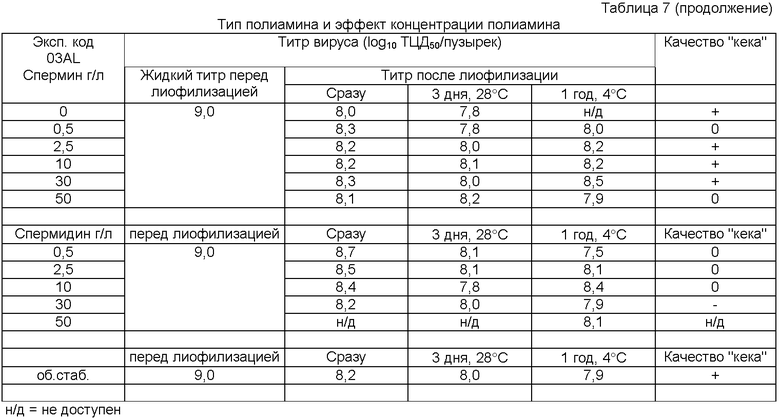

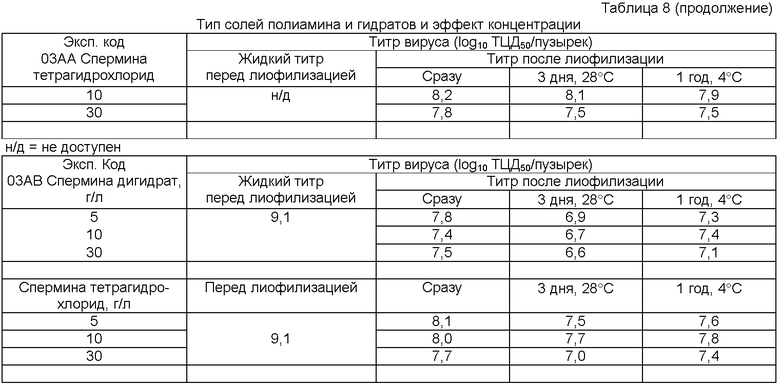
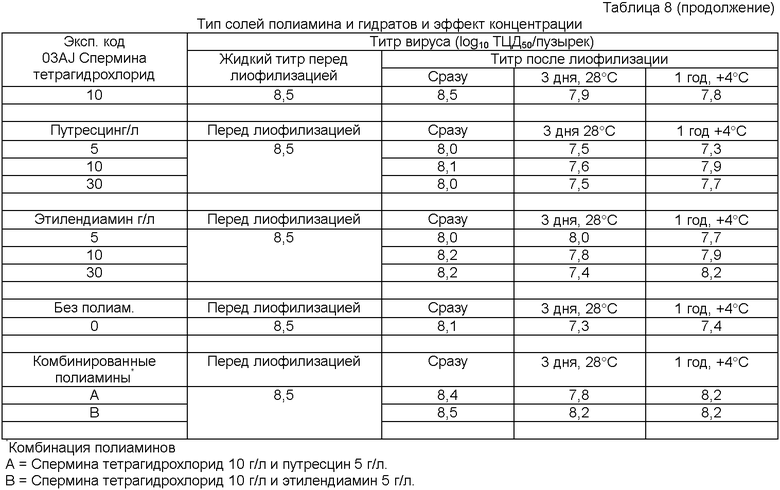
Сравнительные примеры выполняют с обычным стабилизатором (Makoschey и др., супра), который отмечен как "об.стаб."
Стабилизация различных вирусов и эффект полиамина
Варианты рН показаны в таблице:
4,0×109
1,2×109
2,4×109
Настоящее изобретение относится к фармакологии. Композиция стабилизатора вакцины содержит, по меньшей мере, одну аминокислоту в количестве от 0,025 до 100 г/л, по меньшей мере, один сахар в количестве от 2,5 до 50 г/л и, по меньшей мере, один полиамин в количестве от 0,025 до 25 г/л, где все соединения химически определены, таким образом, являющаяся свободной от сыворотки, белка, животных соединений, от полимера, у которого известны только средняя молекулярная масса или средняя длина боковых цепей, от протеинового лизата, экстракта гидролизата или пептидной смеси, характеризующаяся тем, что полиамин представляет собой, по меньшей мере, один, выбранный из группы, состоящей из этилендиамина, кадаверина, путресцина, спермидина и спермина. Изобретение относится также к композиции вакцины, содержащей указанную композицию стабилизатора и биологическую молекулу и/или микроорганизм; к способу изготовления фармацевтической композиции, предусматривающему смешивание указанной композиции стабилизатора с биологической молекулой и/или микроорганизмом; к применению указанной композиции стабилизатора и приготовленных с помощью этого вакцин. Изобретение обеспечивает повышение стабилизирующих свойств стабилизатора и стабильности вакцины. 8 н. и 22 з.п. ф-лы, 13 табл.
1. Композиция стабилизатора вакцины, содержащая, по меньшей мере, одну аминокислоту в количестве от 0,025 до 100 г/л, по меньшей мере, один сахар в количестве от 2,5 до 50 г/л и, по меньшей мере, один полиамин в количестве от 0,025 до 25 г/л, где все соединения химически определены, таким образом являющаяся свободной от сыворотки, белка, животных соединений, от полимера, у которого известны только средняя молекулярная масса или средняя длина боковых цепей, от протеинового лизата, экстракта гидролизата или пептидной смеси, характеризующаяся тем, что полиамин представляет собой, по меньшей мере, один, выбранный из группы, состоящей из этилендиамина, кадаверина, путресцина, спермидина и спермина.
2. Композиция стабилизатора по п.1, где сахар представляет собой, по меньшей мере, один, выбранный из группы, состоящей из глюкозы, лактозы, сахарозы, мальтозы, трегалозы, сорбита и маннита.
3. Композиция стабилизатора по п.1 или 2, где аминокислота является глутаматом или глицином или где включены обе данные аминокислоты.
4. Композиция стабилизатора по п.1 или 2, где композиция представляет собой буферный водный раствор.
5. Композиция стабилизатора по п.4, где буфер имеет в основе фосфат.
6. Композиция вакцины, содержащая композицию стабилизатора по любому из пп.1-5 и, по меньшей мере, одну биологическую молекулу, или, по меньшей мере, один микроорганизм, или их комбинацию.
7. Композиция вакцины по п.6, где микроорганизм представляет собой вирус или бактерию или где включены оба - вирус и бактерия.
8. Композиция вакцины по п.7, где вирус представляет собой, по меньшей мере, один вид вируса, выбранный из группы, состоящей из герпес-, парамиксо-, ортомиксо-, адено-, рабдо-, бирна-, корона-, пневмо- и поксвирусов.
9. Композиция вакцины по п.8, где биологическая молекула представляет собой, по меньшей мере, одну, выбранную из группы, состоящей из белка, углевода, липида и нуклеиновой кислоты.
10. Композиция вакцины по п.9, где белок представляет собой, по меньшей мере, один, выбранный из группы, состоящей из антитела, фрагмента антитела, цитокина, гормона и фермента.
11. Композиция вакцины по любому из пп.6-10, где биологическая молекула, или микроорганизм, или оба из них произведены без животных компонентов.
12. Композиция вакцины по любому из пп.6-10, дополнительно содержащая адъювант.
13. Композиция вакцины по любому из пп.6-10, где композиция вакцины имеет лиофилизированную форму.
14. Раствор вакцины, полученный восстановлением лиофилизированной композиции вакцины по п.13 в фармацевтически приемлемом носителе.
15. Способ изготовления фармацевтической композиции, предусматривающий смешивание композиции стабилизатора по любому из пп.1-5 с композицией, содержащей, по меньшей мере, одну биологическую молекулу, или, по меньшей мере, один микроорганизм, или их комбинацию.
16. Способ по п.15, где микроорганизм представляет собой вирус или бактерию или где включены оба - вирус и бактерия.
17. Способ по п.16, где вирус представляет собой, по меньшей мере, один вид вируса, выбранный из группы, состоящей из герпес-, парамиксо-, ортомиксо-, адено-, рабдо-, бирна-, корона-, пневмо- и поксвирусов.
18. Способ по п.15, где биологическая молекула представляет собой, по меньшей мере, одну, выбранную из группы, состоящей из белка, углевода, липида и нуклеиновой кислоты.
19. Способ по п.18, где белок представляет собой, по меньшей мере, один, выбранный из группы, состоящей из антитела, фрагмента антитела, цитокина, гормона и фермента.
20. Способ по любому из пп.15-19, где биологическая молекула, или микроорганизм, или оба из них произведены без животных компонентов.
21. Способ по любому из пп.15-19, где конечную фармацевтическую композицию подвергают лиофилизации.
22. Фармацевтическая композиция, полученная способом по любому из пп.15-21, где композиция представляет собой композицию вакцины.
23. Способ приготовления раствора вакцины, предусматривающий восстановление фармацевтической композиции по п.22 в фармацевтически приемлемом носителе.
24. Применение композиции стабилизатора по любому из пп.1-5 для стабилизации качества и/или количества, по меньшей мере, одной биологической молекулы, или, по меньшей мере, одного микроорганизма, или их комбинации в композиции вакцины.
25. Применение по п.24, где микроорганизм представляет собой вирус или бактерию или где включены оба - вирус и бактерия.
26. Применение по п.25, где вирус представляет собой, по меньшей мере, один вид вируса, выбранный из группы, состоящей из герпес-, парамиксо-, ортомиксо-, адено-, рабдо-, бирна-, корона-, пневмо- и поксвирусов.
27. Применение по п.24, где биологическая молекула представляет собой, по меньшей мере, одну, выбранную из группы, состоящей из белка, углевода, липида и нуклеиновой кислоты.
28. Применение по п.27, где белок представляет собой, по меньшей мере, один, выбранный из группы, состоящей из антитела, фрагмента антитела, цитокина, гормона и фермента.
29. Применение по любому из пп.24-28, где биологическая молекула, или микроорганизм, или оба из них произведены без животных компонентов.
30. Применение раствора вакцины по п.14 или раствора вакцины, полученного способом по п.23, для иммунизации человека или животного.
| US 3915794, 28.10.1975 | |||
| WO 03029417 A, 10.04.2003 | |||
| WO 9521860 A, 17.08.1995. |
Авторы
Даты
2011-01-20—Публикация
2006-03-07—Подача