Область изобретения
Настоящее изобретение относится к способам получения никотиновых соединений и их фармацевтически приемлемых солей, а также фармацевтическим композициям и способам лечения различных состояний и расстройств, связанных с нарушением функции центральной и вегетативной нервной системы.
Предпосылки изобретения
Никотин был предложен как обладающий различными фармакологическими эффектами. См., например, Pullan et al., N. Engl. J. Med. 330:811-815 (1994). Некоторые из таких эффектов можно отнести к эффектам, влияющим на высвобождение нейротрансмиттеров. Были сообщения о высвобождении ацетилхолина, допамина, норэпинефрина, серотонина и глутамата при введении никотина (Rowell et al., J. Neurochem. 43:1593 (1984); Rapier et al., J. Neurochem. 50:1123 (1988); Sandor et al., Brain Res. 567:313 (1991); Vizi, Br. J. Pharmacol. 47:765 (1973); Hall et al., Biochem. Pharmacol. 21:1829 (1972); Hery et al., Arch. Int. Pharmacodyn. Ther. 296:91 (1977); Toth et al., Neurochem Res. 17:265 (1992)). Подтверждающие сообщения и последние дополнительные исследования содержали модуляцию в центральной нервной системе (ЦНС) глутамата, оксида азота, ГАМК, тахикининов, цитокинов и пептидов (описано в Brioni et al., Adv. Pharmacol. 37:153 (1997)). Кроме того, никотин, как это сообщалось, усиливает фармакологическое действие некоторых фармацевтических композиций, применяемых для лечения некоторых расстройств. См., например, Sanberg et al., Pharmacol. Biochem. & Behavior. 46:303 (1993); Harsing et al., J. Neurochem. 59:48 (1993); Hughes, Proceedings from Intl. Symp. Nic. S40 (1994). Кроме того, были предположения о нейрозащитном действии никотина, см., например, Sjak-shie et al., Brain Res. 624:295 (1993). Также были предложены другие благоприятные фармакологические эффекты. См., например, Decina et al., Biol. Psychiatry. 28:502 (1990); Wagner et al., Pharmacopsychiatry. 21:301 (1988); Pomerleau et al., Addictive Behaviors. 9:265 (1984); Onaivi et al., Life Sci. 54(3):193 (1994); Tripathi et al., J. Pharmacol. Exp. Ther. 221:91 (1982); Hamon, Trends in Pharmacol. Res. 15:36 (1994).
Сообщалось о различных соединениях, мишенью для которых являются nAChR (никотиновые ацетилхолинергические рецепторы), в качестве полезных для лечения широкого ряда состояний и расстройств. См., например, Williams et al., DN&P. 7(4):205 (1994); Arneric et al., CNS Drug Rev. 1(1):1 (1995); Arneric et al., Exp. Opin. Invest. Drug 5(1):79 (1996); Bencherif et al., J. Pharmacol. Exp. Ther. 279:1413 (1996); Lippiello et al., J. Pharmacol. Exp. Ther. 279:1422 (1996); Damaj et al., J. Pharmacol. Exp. Ther. 291:390 (1999); Chiari et al., Anesthesiology. 91:1447 (1999); Lavand'homme and Eisenbach, Anesthesiology 91:1455 (1999); Holladay et al., J. Med. Chem. 40(28): 4169 (1997); Bannon et al., Science. 279: 77 (1998); PCT WO 94/08992; PCT WO 96/31475; PCT WO 96/40682; и патенты США №№ 5583140, выданный на имя Bencherif et al.; 5597919, выданный на имя Dull et al.; 5604231, выданный на имя Smith et al.; и 5852041, выданный на имя Cosford et al. Сообщалось, что никотиновые соединения являются особенно полезными для лечения широкого ряда расстройств ЦНС. Действительно, различные никотиновые соединения, как сообщалось, обладают терапевтическими свойствами. См., например, Bencherif and Schmitt, Current Drug Targets: CNS and Neurological Disorders 1(4): 349-357 (2002), Levin and Rezvani, Current Drug Targets: CNS and Neurological Disorders 1(4): 423-431 (2002), O'Neill, et al., Current Drug Targets: CNS and Neurological Disorders 1(4): 399-411 (2002), патенты США №№ 5187166, выданный на имя Kikuchi et al., 5672601, выданный на имя Cignarella, PCT WO 99/21834 и PCT WO 97/40049, патентная заявка Великобритании GB 2295387 и европейская патентная заявка 297858.
Расстройства ЦНС являются расстройством неврологического типа. Расстройства ЦНС могут быть индуцированы лекарственными средствами; их причиной может быть генетическая предрасположенность, инфекция или травма; или их этиология может быть неизвестной. Расстройства ЦНС включают нейропсихиатрические расстройства, неврологические заболевания и психические заболевания, и включают нейродегенеративные заболевания, поведенческие расстройства, когнитивные расстройства и когнитивно-аффективные расстройства. Существуют некоторые расстройства ЦНС, клиническое проявление которых отнесено к нарушению функции ЦНС (т.е. расстройства, являющиеся результатом несоответствующих уровней высвобождения нейротрансмиттеров, несоответствующих свойств нейротрансмиттерных рецепторов и/или несоответствующего взаимодействия между нейротрансмиттерами и нейротрансмиттерными рецепторами). Некоторые расстройства ЦНС могут возникать за счет дефицита ацетилхолина, допамина, норэпинефрина и/или серотонина.
Относительно распространенные расстройства ЦНС включают пресенильную деменцию (раннее начало болезни Альцгеймера), старческую деменцию (деменцию Альцгеймерового типа), микроинфарктную деменцию, деменцию, связанную со СПИДом, сосудистую деменцию, болезнь Creutzfeld-Jakob, болезнь Pick, Паркинсонизм, включая болезнь Паркинсона, деменцию по типу тельца Lewy, прогрессивный супрануклеарный паралич, хорею Гентингтона, позднюю дискинезию, гиперкинезию, эпилепсию, маниакальный синдром, расстройство, связанное с дефицитом внимания, беспокойство, легастению, шизофрению, депрессию, обсессивно-компульсивное расстройство и синдром Tourette.
Подтипы nAChR присутствуют как в центральной, так и в периферической нервной системе, но распределение этих подтипов гетерогенное. Например, подтипы, которые преобладающе присутствуют в головном мозге позвоночных, представляют собой α4β2, α7 и α3β2, тогда как подтипы, которые преобладающе присутствуют в вегетативных ганглиях, представляют собой α3β4, а подтипы, присутствующие в невромышечном синапсе представляют собой α1β1δγ и α1β1δε (см., например Dwoskin et al., Exp. Opin. Ther. Patents 10: 1561 (2000); Schmitt and Bencherif, Annual Reports in Med. Chem. 35: 41 (2000)).
Ограничение некоторых никотиновых соединений связано с тем, что они вызывают различные нежелательные фармакологические эффекты в результате взаимодействия с nAChR в периферических тканях (например, путем стимуляции подтипов nAChR, присутствующих в мышцах и ганглиях). Поэтому существует потребность в соединениях, композициях и способах профилактики и/или лечения различных состояний или расстройств (например, расстройств ЦНС), в том числе для облегчения симптомов таких расстройств, где соединения проявляют никотиновую фармакологию с благоприятным эффектом на nAChR ЦНС (например, на функционирование ЦНС), но без каких-либо существенных сопутствующих эффектов на периферические nAChR (соединения, специфические в отношении nAChR ЦНС). Также чрезвычайно желательно получить соединения, композиции и способы, влияющие на функцию ЦНС, не оказывающие при этом существенного влияния на те подтипы рецепторов, которые могут вызывать нежелательные побочные эффекты (например, заметное действие в сердечно-сосудистой и скелетно-мышечной областях).
Способы лечения и/или профилактики описанных выше состояний и расстройств путем введения E-метаникотиновых соединений, особенно тех, которые усиливают воздействие на функцию ЦНС, не оказывая при этом существенного влияния на те подтипы рецепторов, которые могут вызывать нежелательные побочные действий, описаны в известном уровне техники. Репрезентативные E-метаникотиновые соединения для применения в лечении и/или профилактике описанных выше расстройств, раскрыты, например, в патенте US № 5212188, выданном на имя Caldwell et al., патенте US № 5604231, выданном на имя Smith et al., патенте US № 5616707, выданном на имя Crooks et al.; патенте US № 5616716, выданном на имя Dull et al., патенте US № 5663356, выданном на имя Ruecroft et al., патенте US № 5726316, выданном на имя Crooks et al., патенте US № 5811442, выданном на имя Bencherif et al., патенте US № 5861423, выданном на имя Caldwell et al., PCT WO 97/40011; PCT WO 99/65876 PCT WO 00/007600; и патентной заявке США серийный № 09/391747, поданной 8 сентября 1999 года, при этом содержание каждого из указанных документов включено в настоящую заявку посредством ссылки.
Способы синтеза для получения E-метаникотиновых соединений, описанные в известном уровне техники, обычно включают осуществление реакции Гека (Heck) между галогензамещенным гетероарильным кольцом, таким как галоген-пиридин или галоген-пиримидин, и соединением, содержащим двойную связь. Содержащее двойную связь соединение типично включает либо гидроксигруппу, которую преобразуют в аминогруппу с образованием E-метаникотина, либо содержит защищенную аминогруппу, с которой снимают защиту после реакции Гека с получением E-метаникотина. Ограничением химической реакции сочетания Гека является тот факт, что, хотя основным продуктом реакции является требуемый E-метаникотин, образуются второстепенные продукты реакции, в том числе Z-метаникотин, метаникотиновое соединение, где двойная связь переместилась из положения, смежного с гетероарильным (таким как пиридиновое или пиримидиновое) кольцом (т.е. несопряженная двойная связь), и соединение, в котором гетероарильная группа присоединена по вторичному (в противопоставлении первичному) углероду алкена (т.е. метиленовое соединение или “экзо” двойная связь). Удаление таких второстепенных продуктов реакции может быть затруднительным, особенно при крупномасштабном синтезе.
Было бы выгодным обеспечение новых способов получения очищенных E-метаникотиновых соединений, по существу, не содержащих описанных выше второстепенных продуктов реакции. Также было бы выгодным обеспечение новых форм солей этих лекарственных средств для улучшения их биодоступности, и/или способствующих получению больших количеств таких соединений разумным с коммерческой точки зрения способом. Настоящее изобретение обеспечивает такие новые способы синтеза и новые формы солей.
Краткое описание изобретения
В настоящей заявке описаны новые способы синтеза E-метаникотиновых соединений, а также новые фармацевтически приемлемые формы солей E-метаникотиновых соединений. Также раскрыты фармацевтические композиции, содержащие новые формы солей, и способы лечения и/или профилактики с применением новых форм солей.
Способы синтеза E-метаникотиновых соединений типично включают стадию осуществления реакции Гека между галогензмещенным гетероарильным кольцом, таким как галоген-пиридин или галоген-пиримидин, и содержащим двойную связь соединением. Содержащее двойную связь соединение типично содержит либо гидроксигруппу, которую затем преобразуют в аминогруппу с образованием E-метаникотинового соединения, либо содержит защищенную аминогруппу, с которой снимают защиту после реакции Гека с образованием E-метаникотинового соединения.
После реакции Гека и образования E-метаникотина со свободной аминогруппой (либо путем преобразования гидроксигруппы, либо снятия защиты с защищенной аминогруппы) следующая стадия включает образование гидроксибензоатной соли E-метаникотинового соединения. При определенных условиях можно осуществить осаждение гидроксибензоатной соли E-метаникотинового соединения из раствора, оставляя при этом в растворе второстепенные продукты реакции в виде примесей (Z-метаникотин и/или изомеры E-метаникотинового соединения, в которых двойная связь мигрировала в положение, отличное от непосредственно смежного с гетероарильным кольцом, или в которых присоединение арильной группы к алкеновой цепи имеет место по вторичному углероду двойной связи). Такое улучшение обеспечивает относительно легкое удаление таких второстепенных продуктов реакции, особенно при крупномасштабном производстве.
В одном варианте осуществления изобретения синтез E-метаникотинов включает образование промежуточного соединения аминзащищенного 4-пентен-2-амина и сочетание этого промежуточного соединения через реакцию Гека с галогензамещенным гетероарильным кольцом. Выбор гетероарильного кольца не является существенным для успешного осуществления реакции сочетания Гека, хотя пиридиновое и пиримидиновое кольца могут быть предпочтительными. (2S)-(4E)-N-метил-5-[3-(5-изопропоксипиридин)ил)]-4-пентен-2-амин является типичным E-метаникотином, п-гидроксибензоат является типичной гидроксибензоатной солью, и п-гидроксибензоат (2S)-(4E)-N-метил-5-[3-(5-изопропоксипиридин)ил)]-4-пентен-2-амина является типичной гидроксибензоатной солью E-метаникотина.
Пример реакции представлен ниже:
Cy-галоген + CH2=CH-CH2CH(CH3)N(CH3)(трет-Boc) →
(E) Cy-CH=CH-CH2CH(CH3)N(CH3)(трет-Boc)
+ (Z) Cy-CH=CH-CH2CH(CH3)N(CH3)(трет-Boc)
+ (E и/или Z) Cy-CH2CH=CHCH(CH3)N(CH3)(трет-Boc)
+ Cy-C(=CH2)-CH2CH(CH3)N(CH3)(трет-Boc)
где Cy представляет собой пяти- или шестичленное гетероарильное кольцо.
В другом варианте осуществления изобретения реакцию сочетания Гека осуществляют с применением гидроксиалкена, такого как 4-пентен-2-ол, и гидроксигруппу преобразуют в аминогруппу после осуществления реакции сочетания Гека. Преобразование можно осуществить, например, путем преобразования гидроксигруппы в тозилат и замещения тозилата подходящим амином, таким как метиламин. В этом варианте осуществления изобретения реакция сочетания Гека все еще образует основные и второстепенные продукты, за исключением случаев, когда они включают гидроксигруппу, а не защищенную аминогруппу. После образования аминсодержащего соединения (т.е. (E)-метаникотина), если примеси (т.е. второстепенные продукты реакции сочетания Гека) на этот момент еще не удалены, применяемые химические способы для образования гидроксибензоатных солей, по существу, те же самые.
После снятия защиты с аминогруппы (в первом варианте осуществления изобретения) или образования аминогруппы (во втором варианте осуществления изобретения) может быть образована гидроксибензоатная соль E-метаникотина путем взаимодействия с гидроксибензойной кислотой, как описано в настоящей заявке. Образуются гидроксибензоатные соли основного продукта ((E)-метаникотина) и второстепенных продуктов. Однако в определенных условиях гидроксибензоатная соль основного продукта реакции, гидроксибензоатная соль (Е)-метаникотина, осаждается из раствора в относительно чистой форме, оставляя исходный раствор, обогащенный второстепенными продуктами реакции, присутствующими в виде примесей. Такой результат является существенным продвижением в синтезе и очистке (E)-метаникотинов.
В одном варианте осуществления изобретения гидроксибензоатные соли выделяют и затем применяют в виде промежуточных соединений с образованием различных форм солей путем взаимодействия с различными фармацевтически приемлемыми кислотами или их солями. Однако в другом варианте осуществления изобретения гидроксибензоатные соли E-метаникотина применяют в качестве активных фармацевтических ингредиентов (API). Гидроксибензоатные соли можно применять непосредственно, или они могут быть включены в фармацевтические композиции путем объединения их с фармацевтически приемлемым эксципиентом. Гидроксибензоатные соли и/или фармацевтические композиции можно применять для лечения и/или профилактики широкого ряда состояний или расстройств. Расстройства, в частности, представляют собой те расстройства, которые характеризуются нарушением функции никотиновой холинергической нейротрансмиссии, включая расстройства, при которых происходит нейромодуляция высвобождения нейротрансмиттеров, например высвобождения допамина. Соединения можно применять в способах лечения и/или профилактики расстройств, таких как расстройства центральной нервной системы (ЦНС), которые характеризуются изменением нормального высвобождения нейротрансмиттеров. Соединения также можно применять для лечения определенных состояний (например, способ облегчения боли). Способы включают введение субъекту эффективного количества гидроксибензоатной соли Е-метаникотина или фармацевтической композиции, содержащей гидроксибензоатную соль Е-метаникотина, как описано в настоящей заявке.
Фармацевтические композиции, при их применении в эффективных количествах, могут взаимодействовать с соответствующими участками никотиновых рецепторов в организме пациента и действовать как терапевтические и/или профилактические средства в отношении широкого ряда состояний и расстройств, в частности расстройств ЦНС, характеризующихся изменением нормального высвобождения нейротрансмиттеров. Фармацевтические композиции могут обеспечивать терапевтическую пользу субъектам, страдающим от таких расстройств, и у которых наблюдаются клинические проявления таких расстройств, состоящую в том, что соединения в таких композициях, когда их применяют в эффективных количествах, могут (i) проявлять никотиновую фармакологию и воздействовать на соответствующие участки никотиновых рецепторов (например, активировать никотиновые рецепторы), и (ii) модулировать выделение нейротрансмиттеров и, следовательно, предотвращать и подавлять симптомы, связанные с такими расстройствами. Кроме того, соединения могут (i) увеличивать количество никотиновых холинергических рецепторов в головном мозге пациента, (ii) проявлять нейрозащитное действие и (iii) при применении в эффективных количествах могут демонстрировать относительно низкие уровни неблагоприятных побочных действий (например, значительное повышение кровяного давления и частоты сердечных сокращений, существенное негативное действие на желудочно-кишечный тракт и существенное негативное действие на скелетные мышцы).
Описанные выше и другие аспекты настоящего изобретения подробно поясняются в представленных ниже подробном описании изобретения и примерах.
Подробное описание изобретения
Гидроксибензоатные соли, описанные в настоящей заявке, полученные из E-метаникотинов и гидроксибензойных кислот, обладают многими преимуществами по сравнению с другими солями, полученными из E-метаникотинов и других кислот. В основном, соли E-метаникотинов с гидроксибензойными кислотами представляют собой водорастворимые вещества, которые в природе обычно являются высоко кристаллическими и менее гигроскопичными по сравнению с другими солями. Например, п-гидроксибензоатная соль (2S)-(4E)-N-метил-5-[3-(5-изопропоксипиридин)ил)]-4-пентен-2-амина представляет собой физически и химически стабильный, свободнотекучий кристаллический порошок. Такие свойства представляют определенные преимущества для разработки фармацевтических композиций и производства фармацевтических средств. Если необходимо, эту соль можно измельчить до приемлемых размеров частиц для получения фармацевтических средств. Эта соль совместима с широким рядом эксципиентов, которые могут быть выбраны для изготовления твердых пероральных лекарственных форм. Это особенно относится к тем эксципиентам, например производным полисахаридов, которые представляют собой фармацевтически определенные гидраты, и тем, которые содержат лишь слабо связанную на поверхности воду. В качестве иллюстрации, соли, полученные из некоторых E-метаникотинов, таких как E-метаникотин, и фумаровой кислоты, склонны к образованию примесей внутри соли. Например, примеси возникают в результате реакции присоединения по Михаэлю вторичного амина в E-метаникотине к олефину в фумаровой кислоте. Такие примеси снижают химическую чистоту соли и неблагоприятно влияют на химическую целостность соли при длительном хранении.
Способы синтеза, описанные в настоящей заявке, будут лучше понятны из представленных ниже предпочтительных вариантов осуществления изобретения. Для определения объема настоящего изобретения будут применены следующие определения.
Как определено в настоящей заявке, термин “ароматический” относится к 3-10-, предпочтительно, 5- и 6-членным ароматическим и гетероароматическим кольцам.
Как определено в настоящей заявке, “группы, содержащие ароматическую группу” относятся к фрагментам, которые являются или содержат ароматическую группу. Соответственно, фенильная и бензильная группы включены в это определение, поскольку обе эти группы представляют собой или содержат ароматическую группу.
Как определено в настоящей заявке, термин "арил" относится к ароматическим радикалам, содержащим от шести до десяти атомов углерода, таким как фенил, нафтил и т.п.; "замещенный арил" относится к арильным радикалам, дополнительно содержащим одну или несколько групп заместителей, определенных в настоящей заявке.
Как определено в настоящей заявке, термин "алкиларил" относится к алкилзамещенным арильным радикалам; "замещенный алкиларил" относится к алкиларильным радикалам, дополнительно содержащим одну или несколько групп заместителей, определенных в настоящей заявке; "арилалкил" относится к арилзамещенным алкильным радикалам; и "замещенный арилалкил" относится к арилалкильным радикалам, дополнительно содержащим одну или несколько групп заместителей, определенных в настоящей заявке.
Как определено в настоящей заявке, C1-6 алкильные радикалы (низшие алкильные радикалы) содержат от 1 до 6 атомов углерода в линейной или разветвленной цепи, и также содержат C3-6 циклоалкильные группы и алкильные радикалы, которые содержат C3-6 циклоалкильные группы.
Как определено в настоящей заявке, термин "алкенил" относится к углеводородным радикалам с линейной или разветвленной цепью, включая C1-8, предпочтительно, C1-5, и содержащим, по меньшей мере, одну углерод-углеродную двойную связь; "замещенный алкенил" относится к алкенильным радикалам, дополнительно содержащим одну или несколько групп заместителей, определенных в настоящей заявке.
Как определено в настоящей заявке, C1-6 алкоксирадикалы содержат от 1 до 6 атомов углерода в линейной или разветвленной цепи, а также содержат C3-6 циклоалкильные и алкоксирадикалы, которые содержат C3-6 циклоалкильные группы.
Как определено в настоящей заявке, арильные радикалы выбраны из фенила, нафтила и инденила.
Как определено в настоящей заявке, циклоалкильные радикалы представляют собой насыщенные или ненасыщенные содержащие циклическое кольцо радикалы, содержащие от трех до восьми атомов углерода, предпочтительно, от трех до шести атомов углерода; "замещенный циклоалкил" относится к циклоалкильным радикалам, дополнительно содержащим одну или несколько групп заместителей, определенных в настоящей заявке.
Как определено в настоящей заявке, галоген представляет собой хлор, йод, фтор или бром.
Как определено в настоящей заявке, гетероарильные радикалы содержат от 3 до 10 членов, предпочтительно 5 или 6 членов, включая один или несколько гетероатомов, выбранных из кислорода, серы и азота. Примеры подходящих 5-членных кольцевых гетероарильных групп представляют собой фурил, пирролил, имидазолил, оксазолил, тиазолил, тиенил, тетразолил и пиразолил. Примеры подходящих 6-членных кольцевых гетероарильных групп представляют собой пиридинил, пиримидинил и пиразинил, из которых пиридинил и пиримидинил являются предпочтительными.
Как определено в настоящей заявке, "гетероциклил" относится к насыщенным или ненасыщенным циклическим радикалам, содержащим один или несколько гетероатомов (например, O, N, S) как часть кольцевой структуры, и содержащим от двух до семи атомов углерода в кольце; "замещенный гетероциклил" относится к гетероциклильным радикалам, дополнительно содержащим одну или несколько групп заместителей, определенных в настоящей заявке. Примеры подходящих гетероциклильных групп представляют собой, но не ограничены этим, пиперидинил, морфолинил, пирролидинил, имидазолидинил, пиразолидинил, изотиазолидинил, тиазолидинил, изоксазолидинил, оксазолидинил, пиперазинил, тетрагидропиранил и тетрагидрофуранил.
Как определено в настоящей заявке, полициклоалкильные радикалы представляют собой сконденсированные циклические кольцевые структуры. Типичные полициклоалкильные радикалы представляют собой, но не ограничены этим, адамантил, борнанил, норборнанил, борненил и норборненил. Полициклоалкильные радикалы могут также содержать один или несколько гетероатомов, таких как N, O или S.
Как определено в настоящей заявке, циклоалкильные радикалы содержат от 3 до 8 атомов углерода. Примеры подходящих циклоалкильных радикалов представляют собой, но не ограничены этим, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, и циклооктил.
Как определено в настоящей заявке, термин “замещенный”, как он использован с любым из указанных выше терминов, означает присутствие одного, двух или трех заместителей, таких как алкил, замещенный алкил, алкенил, замещенный алкенил, гетероциклил, замещенный гетероциклил, циклоалкил, замещенный циклоалкил, арил, замещенный арил, алкиларил, замещенный алкиларил, арилалкил, замещенный арилалкил, F, Cl, Br, I, NR'R", CF3, CN, NO2, C2R', SH, SCH3, N3, SO2CH3, OR', (CR'R")qOR', O-(CR'R")qC2R', SR', C(=O)NR'R", NR'C(=O)R", C(=O)R', C(=O)OR', OC(=O)R', (CR'R")qOCH2C2R', (CR'R")qC(=O)R', (CR'R")qC2(CHCH3)OR', O(CR'R")qC(=O)OR', (CR'R")qC(=O)NR'R", (CR'R")qNR'R", CH=CHR', OC(=O)NR'R" и NR'C(=O)OR", где q представляет собой целое число, имеющее значение от 1 до 6, и R' и R", каждый независимо, представляет собой водород или алкил (например, C1-10 алкил, предпочтительно, C1-5 алкил и, более предпочтительно, метил, этил, изопропил, третичный бутил или изобутил), циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и адамантил), неароматическое гетероциклическое кольцо, где гетероатом гетероциклического фрагмента отделен от какого-либо другого атома азота, кислорода или серы, по меньшей мере, двумя атомами углерода (например, хинуклидинил, пирролидинил и пиперидинил), группы, содержащие ароматическую группу (например, пиридинил, хинолинил, пиримидинил, фуранил, фенил и бензил, где любой из вышеуказанных может быть подходящим образом замещен, по меньшей мере, одной группой заместителей, таких как заместители алкил, гидроксил, алкоксил, галоген или амино).
Как определено в настоящей заявке, термин “агонист” означает вещество, которое стимулирует партнера, с которым связывается, типично - рецептор. Стимуляция определяется в контексте конкретного анализа или может быть очевидной из обсуждаемого в настоящем описании при сравнении с фактором или веществом, которое принято как “агонист” или “антагонист” конкретного связывающегося с ним партнера, в, по существу, одинаковых условиях, как должно быть понятно специалистам в данной области. Стимуляцию можно определить по усилению конкретного действия или функции, индуцируемой путем взаимодействия агониста или частичного агониста с партнером, с которым он связывается, и может содержать аллостерические действия.
Как определено в настоящей заявке, термин “антагонист” означает вещество, которое ингибирует партнера, с которым связывается, типично - рецептор. Ингибирование определяется в контексте конкретного анализа или может быть очевидным из обсуждаемого в настоящем описании при сравнении с фактором или веществом, которое принято как “агонист” или “антагонист” конкретного связывающегося с ним партнера, в, по существу, одинаковых условиях, как должно быть понятно специалистам в данной области. Ингибирование можно определить по ослаблению конкретного действия или функции, индуцируемой путем взаимодействия антагониста с партнером, с которым он связывается, и может содержать аллостерические действия.
Как определено в настоящей заявке, термин “частичный агонист” означает вещество, обеспечивающее определенный уровень стимуляции своего партнера по связыванию, который является промежуточным между тем, который обеспечивается полным или совершенным антагонистом и агонистом, определяемый при помощи любого принятого стандарта определения агонистической активности. Должно быть понятно, что стимуляцию, а следовательно, и ингибирование определяют как, по существу, характерные для какого-либо вещества или класса веществ, подлежащих определению, являются ли они агонистами, антагонистами или частичными агонистами. Как определено в настоящей заявке, “характеристическая активность”, или “эффективность”, относится к некоторой мере биологической эффективности комплекса связывающихся партнеров. В отношении фармакологии рецепторов контекст, в котором следует определять характеристическую активность или эффективность, будет зависеть от контекста комплекса связывающихся партнеров (например, рецептор/лиганд) и рассмотрения активности относительно конкретного биологического результата. Например, в некоторых обстоятельствах, характеристическая активность может варьировать, в зависимости от участвующей второй посреднической системы. См. Hoyer, D. и Boddeke, H., Trends Pharmacol Sci. 14(7):270-5 (1993). Когда являются уместными такие специфические для определенного контекста оценки, и каким образом они могут соответствовать в контексте настоящего изобретения, это должно быть очевидным для специалистов в данной области.
Как определено в настоящей заявке, нейротрансмиттеры, высвобождение которых опосредовано соединениями, описанными в настоящей заявке, представляют собой, но не ограничены этим, ацетилхолин, допамин, норэпинефрин, серотонин и глутамат, и соединения, описанные в настоящей заявке, функционируют как агонисты или частичные агонисты на одном или нескольких nAChR центральной нервной системы (ЦНС).
I. Соединения
Соединения, описанные в настоящей заявке, представляют собой гидроксибензоатные соли соединений (E)-метаникотинового типа.
A. Гидроксибензойные кислоты
Гидроксибензойные кислоты, которые можно применять для получения гидроксибензоатных солей соединений (E)-метаникотинового типа, имеют следующую общую формулу:
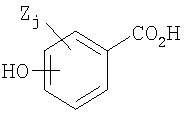
где гидроксигруппа может присутствовать в орто-, мета- или пара-положении относительно карбоновокислотной группы, Z представляет собой неводородный заместитель, и j означает число от нуля до трех, представляющее количество заместителей Z, которые могут присутствовать в кольце. Примеры подходящих заместителей Z представляют собой алкил, замещенный алкил, алкенил, замещенный алкенил, гетероциклил, замещенный гетероциклил, циклоалкил, замещенный циклоалкил, арил, замещенный арил, алкиларил, замещенный алкиларил, арилалкил, замещенный арилалкил, F, Cl, Br, I, NR'R", CF3, CN, NO2, C2R', SH, SCH3, N3, SO2CH3, OR', (CR'R")qOR', O-(CR'R")qC2R', SR', C(=O)NR'R", NR'C(=O)R", C(=O)R', C(=O)OR', OC(=O)R', (CR'R")qOCH2C2R', (CR'R")qC(=O)R', (CR'R")qC2(CHCH3)OR', O(CR'R")qC(=O)OR', (CR'R")qC(=O)NR'R", (CR'R")qNR'R", CH=CHR', OC(=O)NR'R" и NR'C(=O)OR", где q представляет собой целое число, имеющее значение от 1 до 6, и R' и R", каждый независимо, представляет собой водород или алкил (например, C1-10 алкил, предпочтительно, C1-5 алкил и, более предпочтительно, метил, этил, изопропил, третичный бутил или изобутил), циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и адамантил), неароматическое гетероциклическое кольцо, где гетероатом гетероциклического фрагмента отделен от какого-либо другого атома азота, кислорода или серы, по меньшей мере, двумя атомами углерода (например, хинуклидинил, пирролидинил и пиперидинил), группы, содержащие ароматическую группу (например, пиридинил, хинолинил, пиримидинил, фуранил, фенил и бензил, где любая из вышеперечисленных групп может быть подходящим образом замещена, по меньшей мере, одной группой заместителей, таких как заместители алкил, гидроксил, алкоксил, галоген или амино). Другие типичные ароматические кольцевые системы описаны в Gibson et al., J. Med. Chem. 39:4065 (1996). R' и R" могут представлять собой линейный или разветвленный алкил, или R' и R" и промежуточные атомы могут объединяться с образованием кольцевой структуры (например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил или хинуклидинил). Гидроксибензойные кислоты могут быть необязательно замещены хиральной функциональной группой, что может способствовать очищению E-метаникотинов, которые содержат хиральный углерод, путем образования диастереомеров.
Типичные бензойные кислоты, которые можно применять, включают салициловую кислоту, метагидроксибензойную кислоту, пара-гидроксибензойную кислоту, ванилиновую кислоту, изованилиновую кислоту, гентизиновую кислоту, галловую кислоту, 5-аминосалициловую кислоту, сиреневую кислоту, 4-метилсалициловую кислоту, 3-хлор-4-оксибензойную кислоту и 5-гидроксиизофталевую кислоту.
B. E-метаникотины
E-метаникотиновые соединения представляют собой соединения формулы:
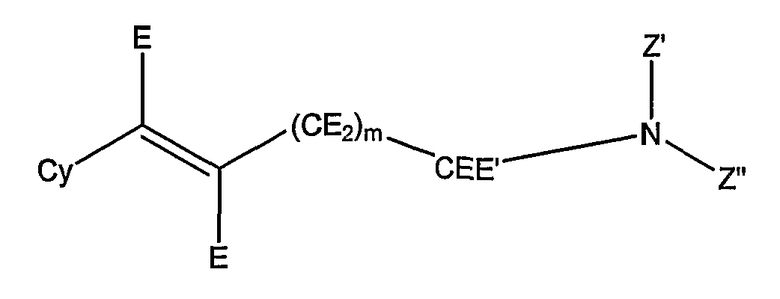
где:
Cy представляет собой 5- или 6-членное гетероарильное кольцо,
E и E', каждый независимо, представляет собой водород, алкил, замещенный алкил, галогензамещенный алкил, циклоалкил, замещенный циклоалкил, гетероциклил, замещенный гетероциклил, арил, замещенный арил, алкиларил, замещенный алкиларил, арилалкил или замещенный арилалкил;
Z' и Z'', каждый независимо, представляет собой водород или алкил (включая циклоалкил), и предпочтительно, по меньшей мере, один из Z' и Z'' представляет собой водород и, наиболее предпочтительно, Z' представляет собой водород, а Z'' представляет собой метил; альтернативно, Z', Z'' и связанный с ними атом азота могут образовывать кольцевую структуру, такую как азиридинил, азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, и
обе группы E двойной связи, предпочтительно, представляют собой водород, и
m имеет значение 1, 2, 3, 4, 5 или 6.
В одном варианте осуществления изобретения все группы E и E' представляют собой водород, а в другом варианте осуществления изобретения, по меньшей мере, одна из групп E или E' представляет собой алкил, а остальные группы E и E' представляют собой водород. В предпочтительном варианте осуществления изобретения E' представляет собой алкильную группу, предпочтительно метильную группу.
Изомеры, смеси, включая рацемические смеси, энантиомеры, диастереомеры и таутомеры этих соединений, а также их фармацевтически приемлемые соли также входят в объем настоящего изобретения.
В одном варианте осуществления изобретения Cy представляет собой шестичленный кольцевой гетероарил, имеющий формулу:
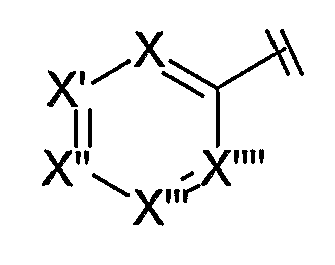
где каждый из X, X', X'', X''' и X'''' независимо представляет собой азот, азот, связанный с кислородом (например, N-оксид или функциональная группа N-O), или углерод, связанный с H или группой неводородного заместителя. Не более трех из X, X', X'', X''' и X'''' могут представлять собой азот или азот, связанный с кислородом, и предпочтительно, чтобы только один или два из Х, X', X'', X''' и X'''' представляли собой азот или азот, связанный с кислородом. Кроме того, особенно предпочтительно, чтобы не более одного из Х, X', X'', X''' и X'''' представлял собой азот, связанный с кислородом; и предпочтительно, чтобы в случае, когда один из указанных заместителей представляет собой азот, связанный с кислородом, этот заместитель представлял собой X'''. Наиболее предпочтительно, когда X''' представляет собой азот. В определенных предпочтительных обстоятельствах X' и X''', оба представляют собой азот. Типично, X, X'' и X'''' представляют собой углерод, связанный с группой заместителя, и типично, когда заместители у X, X'' и X'''' представляют собой водород. Для некоторых других предпочтительных соединений, где X''' представляет собой углерод, связанный с группой заместителя, такой как водород, X и X', оба представляют собой азот. В некоторых других предпочтительных соединениях, где X' представляет собой углерод, связанный с группой заместителя, такой как водород, X и X''' оба представляют собой азот.
Подходящие неводородные заместители определены выше при описании Z.
В другом варианте осуществления изобретения Cy представляет собой 5-членный кольцевой гетероарил, имеющий формулу:
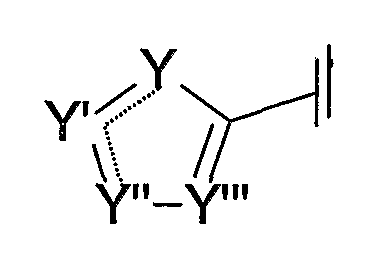
где Y и Y'', каждый независимо, представляет собой азот, азот, связанный с группой заместителя, кислород, серу или углерод, связанный с группой заместителя, и Y' и Y''' представляют собой азот или углерод, связанный с группой заместителя. Пунктирные линии означают, что связи (между Y и Y' и между Y' и Y'') могут быть либо простыми, либо двойными связями. Однако, когда связь между Y и Y' представляет собой простую связь, связь между Y' и Y'' должна представлять собой двойную связь, и наоборот. В случаях, когда Y или Y'' представляет собой кислород или серу, только один из Y и Y'' может представлять собой либо кислород, либо серу. По меньшей мере, один из Y, Y', Y'' и Y''' должен представлять собой кислород, серу, азот или азот, связанный с группой заместителя. Предпочтительно, чтобы не более трех из Y, Y', Y'' и Y''' представляли собой кислород, серу, азот или азот, связанный с группой заместителя. Кроме того, предпочтительно, чтобы, по меньшей мере, один, но не более трех, из Y, Y', Y'' и Y''' представляли собой азот.
Группы заместителей у X, X', X", X"', X'''', Y, Y', Y" и Y''', когда они находятся в смежном положении, могут объединяться с образованием одного или нескольких насыщенных или ненасыщенных, замещенных или незамещенных карбоциклических или гетероциклических колец, содержащих, но не ограниченных этим, такие функциональные группы, как простой эфир, ацеталь, кеталь, амин, кетон, лактон, лактам, карбамат или мочевина.
В зависимости от природы и положения каждого отдельного E и E', некоторые соединения могут быть оптически активными (например, соединения могут иметь один или несколько хиральных центров с R- или S-конфигурацией). Настоящее изобретение относится к рацемическим смесям таких соединений, а также отдельным энантиомерным соединениям.
Особый интерес представляют арилзамещенные аминовые соединения формулы:
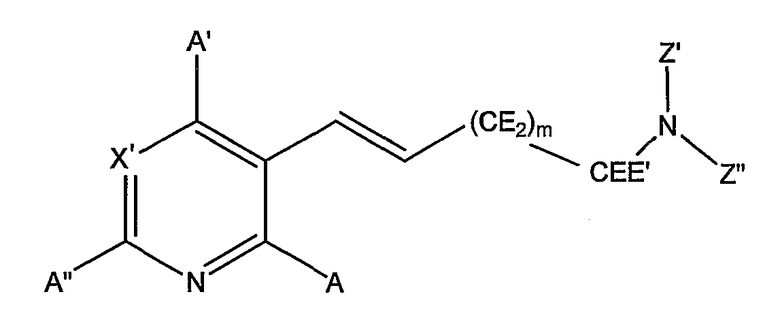
где X', E, E', Z', Z'' и m определены выше, и A, A' и A'' представляют собой водород или группу заместителей Z, определенную выше при описании гидроксибензойных кислот. Предпочтительно, все E представляют собой водород, и E' представляет собой алкил, предпочтительно метил. Предпочтительно, Z' представляет собой водород, и Z'' представляет собой водород или метил. Предпочтительно, m имеет значение 1 или 2.
Примерами арилзамещенных аминовых соединений являются соединения, описанные в патенте US № 5212188, выданном на имя Caldwell et al.; патенте US № 5604231, выданном на имя Smith et al.; патенте US № 5616707, выданном на имя Crooks et al.; патенте US № 5616716, выданном на имя Dull et al.; патенте US № 5663356, выданном на имя Ruecroft et al.; патенте US № 5726316, выданном на имя Crooks et al.; патенте US № 5811442, выданном на имя Bencherif et al.; патенте US № 5861423, выданном на имя Caldwell et al.; патенте US № 6337351, выданном на имя Dull et al.; WO 97/40011; WO 99/65876; и WO 00/007600. Перечисленные выше ссылочные документы включены в настоящую заявку посредством ссылки во всей их полноте в целях раскрытия типичных соединений, приемлемых для осуществления настоящего изобретения.
Примеры соединений, приемлемых в соответствии с настоящим изобретением, представляют собой соединения метаникотинового типа. Типичные предпочтительные соединения представляют собой (E)-метаникотин, (3E)-N-метил-4-(5-этокси-3-пиридинил)-3-бутен-1-амин, (2S)-(4E)-N-метил-5-(3-пиридинил)-4-пентен-2-амин, (2R)-(4E)-N-метил-5-(3-пиридинил)-4-пентен-2-амин, (2S)-(4E)-N-метил-5-(5-метокси-3-пиридинил)-4-пентен-2-амин, (2R)-(4E)-N-метил-5-(5-метокси-3-пиридинил)-4-пентен-2-амин, (2S)-(4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амин, (2R)-(4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амин, (3E)-N-метил-4-(5-нитро-6-амино-3-пиридинил)-3-бутен-1-амин, (3E)-N-метил-4-(5-(N-бензилкарбоксамидо)-3-пиридинил)-3-бутен-1-амин, (2S)-(4E)-N-метил-5-(5-пиримидинил)-4-пентен-2-амин, (2R)-(4E)-N-метил-5-(5-пиримидинил)-4-пентен-2-амин, (4E)-N-метил-5-(2-амино-5-пиримидинил)-4-пентен-2-амин, (4E)-N-метил-5-(5-амино-3-пиридинил)-4-пентен-2-амин, (2S)-(4E)-N-метил-5-(5-изопропокси-1-оксо-3-пиридинил)-4-пентен-2-амин, (3E)-N-метил-4-(5-изобутокси-3-пиридинил)-3-бутен-1-амин, (3E)-N-метил-4-(1-оксо-3-пиридинил)-3-бутен-1-амин, (4E)-N-метил-5-(1-оксо-3-пиридинил)-4-пентен-2-амин, (3E)-N-метил-4-(5-этилтио-3-пиридинил)-3-бутен-1-амин, (4E)-N-метил-5-(5-трифторметил-3-пиридинил)-4-пентен-2-амин, (4E)-N-метил-5-(5-((карбоксиметил)окси)-3-пиридинил)-4-пентен-2-амин, (4E)-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амин и (4E)-N-метил-5-(5-гидрокси-3-пиридинил)-4-пентен-2-амин. Дополнительные типичные примеры представляют собой (2S)-(4E)-N-метил-5-(5-циклогексилокси-3-пиридинил)-4-пентен-2-амин, (2R)-(4E)-N-метил-5-(5-циклогексилокси-3-пиридинил)-4-пентен-2-амин, (2S)-(4E)-N-метил-5-(5-фенокси-3-пиридинил)-4-пентен-2-амин, (2R)-(4E)-N-метил-5-(5-фенокси-3-пиридинил)-4-пентен-2-амин, (2S)-(4E)-N-метил-5-(5-(4-фторфенокси)-3-пиридинил)-4-пентен-2-амин, (2R)-(4E)-N-метил-5-(5-(4-фторфенокси)-3-пиридинил)-4-пентен-2-амин, (2S)-(4E)-N-метил-5-(5-(4-хлорфенокси)-3-пиридинил)-4-пентен-2-амин, (2R)-(4E)-N-метил-5-(5-(4-хлорфенокси)-3-пиридинил)-4-пентен-2-амин, (2S)-(4E)-N-метил-5-(5-(3-цианофенокси)-3-пиридинил)-4-пентен-2-амин, (2R)-(4E)-N-метил-5-(5-(3-цианофенокси)-3-пиридинил)-4-пентен-2-амин, (2S)-(4E)-N-метил-5-(5-(5-индолилокси)-3-пиридинил)-4-пентен-2-амин и (2R)-(4E)-N-метил-5-(5-(5-индолилокси)-3-пиридинил)-4-пентен-2-амин.
II. Получение соединений
Способ, при помощи которого синтезируют соединения (E)-метаникотинового типа, описанные в настоящей заявке, может варьировать. Например, соединения можно получить путем катализируемой палладием реакции сочетания ароматического галогенида и конечного олефина, содержащего защищенный аминовый заместитель, снятия защитной группы с получением первичного или вторичного амина и необязательного алкилирования с получением вторичного или третичного амина. В частности, некоторые соединения метаникотинового типа можно получить, подвергая 3-галогензамещенное, необязательно 5-замещенное, пиридиновое соединение или 5-галогензамещенное пиримидиновое соединение катализируемой палладием реакции сочетания с применением олефина, содержащего защищенную функциональную группу амина (например, такого олефина, как полученный взаимодействием фталимидной соли с 3-галоген-1-пропеном, 4-галоген-1-бутеном, 5-галоген-1-пентеном или 6-галоген-1-гексеном). См., Frank et al., J. Org. Chem., 43(15):2947-2949 (1978); и Malek et al., J. Org. Chem., 47:5395-5397 (1982).
В другом варианте осуществления изобретения соединения синтезируют путем конденсации спирта олефинового ряда, такого как 4-пентен-2-ол, с ароматическим галогензамещенным соединением, таким как 3-бромпиридин или 3-йодпиридин. Типично, применяют способы, описанные в Frank et al., J. Org. Chem., 43: 2947-2949 (1978) и Malek et al., J. Org. Chem., 47: 5395-5397 (1982), которые включают катализируемое палладием сочетание олефина и ароматического галогензамещенного соединения. Спирт олефинового ряда необязательно может быть защищен в виде простого трет-бутилдиметилсилилового эфира до реакции сочетания. Затем десилилирование дает спирт олефинового ряда. Затем продукт конденсации спирта преобразуют в амин с применением способов, аналогичных описанным в de Costa et al., J. Org. Chem., 35: 4334-4343 (1992). Типично, продукт конденсации спирта преобразуют в арилзамещенный олефиновый амин путем активации спирта с применением метансульфонилхлорида или п-толуолсульфонилхлорида, с последующим замещением мезилата или тозилата, применяя аммиак или первичный или вторичный амин. Таким образом, когда амин представляет собой аммиак, получают соединение арилзамещенного олефинового первичного амина; когда амин представляет собой первичный амин, такой как метиламин или циклобутиламин, получают соединение арилзамещенного олефинового вторичного амина; и когда амин представляет собой вторичный амин, такой как диметиламин или пирролидин, получают соединение арилзамещенного олефинового третичного амина. Другие типичные спирты олефинового ряда представляют собой 4-пентен-1-ол, 5-гексен-2-ол, 5-гексен-3-ол, 3-метил-3-бутен-1-ол, 2-метил-3-бутен-1-ол, 4-метил-4-пентен-1-ол, 4-метил-4-пентен-2-ол, 1-октен-4-ол, 5-метил-1-гептен-4-ол, 4-метил-5-гексен-2-ол, 5-метил-5-гексен-2-ол, 5-гексен-2-ол и 5-метил-5-гексен-3-ол. Трифторметилзамещенные спирты олефинового ряда, такие как 1,1,1-трифтор-4-пентен-2-ол, можно получить из 1-этокси-2,2,2-трифторэтанола и аллилтриметилсилана с применением способов, описанных Kubota et al., Tetrahedron Letters, 33(10):1351-1354 (1992), или из сложного этилового эфира трифторуксусной кислоты и аллилтрибутилстаннана с применением способов, описанных в Ishihara et al., Tetrahedron Letters, 34(56): 5777-5780 (1993). Некоторые спирты олефинового ряда являются оптически активными, и их можно применять в виде энантиомерных смесей или в виде чистых энантиомеров, чтобы получить соответствующие оптически активные формы соединений арилзамещенных олефиновых аминов. Когда аллилиловый спирт олефинового ряда, такой как металлиловый спирт, подвергают взаимодействию с ароматическим галогензамещенным соединением, получают арилзамещенный олефиновый альдегид; и полученный альдегид может быть преобразован в соединение арилзамещенного олефинового амина путем восстановительного аминирования (например, путем обработки с использованием алкиламина и цианоборгидрида натрия). Предпочтительными ароматическими галогензамещенными соединениями являются соединения 3-бромпиридинового типа и соединения 3-йодпиридинового типа. Типично, группы заместителей таких соединений 3-галогенпиридинового типа представляют собой группы, которые могут выдержать контакт с такими химическими продуктами (например, тозилхлоридом и метиламином) и реакционные условия, используемые для получения соединения арилзамещенного олефинового амина. Альтернативно, заместители, такие как -OH, -NH2 и -SH, могут быть защищены как соответствующие ацильные соединения, или заместители, такие как -NH2, могут быть защищены как фталимидная функциональная группа. В случае дигалогенароматического соединения возможны последовательные катализируемые палладием (по типу Гека) сочетания с двумя различными олефиновыми боковыми цепями.
В одном варианте осуществления изобретения соединения (E)-метаникотинового типа содержат разветвленную боковую цепь, например (4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амин. Применяя один синтетический подход, упомянутое последним соединение может быть синтезировано конвергентным способом, в котором боковую цепь, N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амин, соединяют с 3-замещенным 5-галогензамещенным пиридином, 5-бром-3-изопропоксипиридином, в условиях реакции Гека, с последующим удалением трет-бутоксикарбонильной защитной группы. Типично, применяют способы, аналогичные описанным в W.C. Frank et al., J. Org. Chem. 43:2947 (1978) and N. J. Malek et al., J. Org. Chem. 47:5395 (1982), включающие катализируемое палладием сочетание олефина и ароматического галогензамещенного соединения. Необходимый N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амин может быть синтезирован следующим образом: (i) коммерчески доступный 4-пентен-2-ол (Aldrich Chemical Company, Lancaster Synthesis Inc.) может быть обработан п-толуолсульфонилхлоридом в пиридине с получением п-толуолсульфоната 4-пентен-2-ола, ранее описанного T. Michel et al., Liebigs Ann. 11: 1811 (1996); (ii) полученный тозилат можно подвергнуть нагреванию с избыточным количеством метиламина с получением N-метил-4-пентен-2-амина; (iii) можно осуществить взаимодействие полученного амина, такого как описанный ранее A. Viola et al., J. Chem. Soc., Chem. Commun. 21: 1429 (1984), с 1,2 молярного эквивалента ди-трет-бутилдикарбоната в безводном тетрагидрофуране с получением боковой цепи, N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амина. Галогензамещенный пиридин (например, 5-бром-3-изопропоксипиридин), может быть синтезирован, по меньшей мере, двумя разными путями. В одном способе получения 3,5-дибромпиридин нагревают при 140°C в течение 14 часов с 2 молярными эквивалентами изопропоксида калия в безводном изопропаноле в присутствии медного порошка (5% мас./мас. 3,5-дибромпиридина) в герметично закрытой стеклянной пробирке с получением 5-бром-3-изопропоксипиридина. Второй способ получения 5-бром-3-изопропоксипиридина из 5-бромникотиновой кислоты можно осуществить следующим образом: (i) 5-бромникотиновую кислоту преобразуют в 5-бромникотинамид путем обработки тионилхлоридом с последующим взаимодействием промежуточного соединения хлорангидрида кислоты с водным раствором аммиака; (ii) полученный 5-бромникотинамид, ранее описанный C.V. Greco et al., J. Heterocyclic Chem. 7 (4): 761 (1970), подвергают расщеплению по Гофману путем обработки гидроксидом натрия и 70%-ным раствором гипохлорита кальция; (iii) полученный 3-амино-5-бромпиридин, ранее описанный C.V. Greco et al., J. Heterocyclic Chem. 7(4): 761 (1970), может быть преобразован в 5-бром-3-изопропоксипиридин путем диазотирования с использованием изоамилнитрита в кислотных условиях, с последующей обработкой промежуточного соединения - диазониевой соли - изопропанолом с получением 5-бром-3-изопропоксипиридина. Катализируемое палладием сочетание 5-бром-3-изопропоксипиридина и N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амина осуществляют в ацетонитриле-триэтиламине (2:1, об./об.) с использованием катализатора, состоящего из 1 мол.% ацетата палладия(II) и 4 мол.% три-o-толилфосфина. Реакцию можно осуществить путем нагревания компонентов при 80°C в течение 20 часов с получением (4E)-N-метил-N-(трет-бутоксикарбонил)-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина. Удаление трет-бутоксикарбонильной защитной группы можно осуществить путем обработки 30 молярными эквивалентами трифторуксусной кислоты в анизоле при 0°C с получением (4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина. Различные N-метил-5-(5-алкокси или 5-арилокси-3-пиридинил)-4-пентен-2-амины можно получить из 3,5-дибромпиридина с применением такого типа технологии (т.е. обработки алкоксидами или арилоксидами натрия или калия с последующим сочетанием по Геку и снятием защиты).
В другом варианте осуществления изобретения соединение, такое как (4E)-N-метил-5-(5-метокси-3-пиридинил)-4-пентен-2-амин, может быть синтезировано путем сочетания галогензамещенного пиридина, 5-бром-3-метоксипиридина, с олефином, содержащим функциональную группу вторичного спирта, 4-пентен-2-ола, в условиях реакции Гека; и полученное промежуточное соединение пиридинилового спирта может быть преобразовано в его п-толуолсульфонатный эфир с последующей обработкой метиламином. Типично, применяют способы, аналогичные описанным в W.C. Frank et al., J. Org. Chem. 43: 2947 (1978) N. J. Malek et al., J. Org. Chem. 47: 5395 (1982), включающие катализируемое палладием сочетание олефина и ароматического галогензамещенного соединения. Галогензамещенный пиридин, 5-бром-3-метоксипиридин, синтезируют способом, аналогичным описанному в H. J. den Hertog et al., Recl. Trav. Chim. Pays-Bas. 67:377 (1948), а именно путем нагревания 3,5-дибромпиридина с 2,5 молярного эквивалента метоксида натрия в безводном метаноле в присутствии медного порошка (5% мас./мас. 3,5-дибромпиридина) в герметично закрытой стеклянной пробирке при 150°C в течение 14 часов с получением 5-бром-3-метоксипиридина. Полученный 5-бром-3-метоксипиридин, ранее описанный D.L. Comins, et al., J. Org. Chem. 55: 69 (1990), можно подвергнуть сочетанию с 4-пентен-2-олом в ацетонитриле-триэтиламине (1:1, об./об.) с использованием катализатора, состоящего из 1 мол.% ацетата палладия(II) и 4 мол.% три-o-толилфосфина. Реакцию осуществляют путем нагревания компонентов в герметично закрытой стеклянной пробирке при 140°C в течение 14 часов с получением (4E)-N-метил-5-(5-метокси-3-пиридинил)-4-пентен-2-ола. Полученный спирт обрабатывают 2 молярными эквивалентами п-толуолсульфонилхлорида в безводном пиридине при 0°C с получением п-толуолсульфоната (4E)-N-метил-5-(5-метокси-3-пиридинил)-4-пентен-2-ола. Промежуточный тозилат обрабатывают 120 молярными эквивалентами метиламина в виде 40%-ного водного раствора, содержащего небольшое количество этанола в качестве сорастворителя, с получением (4E)-N-метил-5-(5-метокси-3-пиридинил)-4-пентен-2-амина. Когда 3,5-дибромпиридин подвергают сочетанию по Геку с N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином в условиях, описанных выше, получают N-метил-N-(трет-бутоксикарбонил)-5-(5-бром-3-пиридинил)-4-пентен-2-амин. Это соединение можно подвергнуть сочетанию в последующей реакции Гека со стиролом со снятием защиты (удаление трет-бутоксикарбонильной группы), как описано выше, с получением (4E)-N-метил-5-[3-(5-транс-бета-стирилпиридин)ил]-4-пентен-2-амина. Аналогичное второе сочетание с этинилбензолом и последующее снятние защиты дает (4E)-N-метил-5-[3-(5-фенилэтинилпиридин)ил]-4-пентен-2-амин.
Можно получить оптически активные формы некоторых арилзамещенных олефиновых аминовых соединений, таких как (2S)-(4E)-N-метил-5-(3-пиридинил)-4-пентен-2-амин. В одном синтетическом подходе указанный последним тип соединений синтезируют путем сочетания галогензамещенного пиридина, 3-бромпиридина, с олефином, содержащим хиральную функциональную группу вторичного спирта, (2R)-4-пентен-2-ола, в условиях реакции Гека. Полученное хиральное промежуточное соединение пиридинилового спирта, (2R)-(4E)-5-(3-пиридинил)-4-пентен-2-ол, преобразуют в его соответствующий сложный п-толуолсульфонатный эфир, который затем обрабатывают метиламином, что дает замещение тозилата с инверсией конфигурации. Типично, применяют способы, аналогичные описанным в W.C. Frank et al., J. Org. Chem. 43: 2947 (1978) и N.J. Malek et al., J. Org. Chem. 47: 5395 (1982), включающие катализируемое палладием сочетание ароматического галогензамещенного соединения и олефина. Хиральную боковую цепь, (2R)-4-пентен-2-ол, можно получить путем обработки хирального эпоксида, (R)-(+)-пропиленоксида (коммерчески доступный от Fluka Chemical Company), винилмагнийбромидом и йодидом меди(I) в тетрагидрофуране при низких температурах (от -25 до -10°C) с применением общих способов синтеза, описанных в A. Kalivretenos, J.K. Stille, L.S. Hegedus, J. Org. Chem. 56: 2883 (1991), с получением (2R)-4-пентен-2-ола. Полученный хиральный спирт подвергают реакции Гека с 3-бромпиридином в ацетонитриле-триэтиламине (1:1, об./об.) с применением катализатора, состоящего из 1 мол.% ацетата палладия(II) и 4 мол.% три-o-толилфосфина. Реакцию осуществляют путем нагревания компонентов при 140°C в течение 14 часов в герметично закрытой стеклянной пробирке с получением продукта реакции Гека, (2R)-(4E)-5-(3-пиридинил)-4-пентен-2-ола. Полученный хиральный пиридиниловый спирт обрабатывают 3 молярными эквивалентами п-толуолсульфонилхлорида в безводном пиридине при 0°C с получением промежуточного тозилатного соединения. Сложный п-олуолсульфонатный эфир нагревают с 82 молярными эквивалентами метиламина в виде 40%-ного водного раствора, содержащего небольшое количество этанола в качестве сорастворителя, с получением (2S)-(4E)-N-метил-5-(3-пиридинил)-4-пентен-2-амина.
Аналогичным способом можно синтезировать соответствующий энантиомер арилзамещенного олефинового амина, такой как (2R)-(4E)-N-метил-5-(3-пиридинил)-4-пентен-2-амин, применяя сочетание по Геку 3-бромпиридина и (2S)-4-пентен-2-ола. Полученное промежуточное соединение, (2S)-(4E)-5-(3-пиридинил)-4-пентен-2-ол, преобразуют в его п-толуолсульфонат, который подвергают замещению метиламина. Хиральный спирт, (2S)-4-пентен-2-ол, получают из (S)-(-)-пропиленоксида (коммерчески доступный от Aldrich Chemical Company) с применением способа, аналогичного описанному для получения (2R)-4-пентен-2-ола из (R)-(+)-пропиленоксида, как сообщалось в A. Kalivretenos, J.K. Stille, L.S. Hegedus, J. Org. Chem. 56: 2883 (1991).
В другом варианте можно получить такие соединения, как (3E)-N-метил-4-(3-(6-аминопиридин)ил)-3-бутен-1-амин, подвергая 3-галогензамещенный пиридин, такой как 2-амино-5-бромпиридин (Aldrich Chemical Company), катализируемой палладием реакции сочетания с олефином, содержащим защищенную аминовую функциональную группу, таким как N-метил-N-(3-бутен-1-ил)бензамид. Бензоил-защитнную группу из полученного продукта реакции Гека можно удалить путем нагревания с водным раствором кислоты с получением (3E)-N-метил-4-(3-(6-аминопиридин)ил)-3-бутен-1-амина. Олефиновое исходное соединение, N-метил-N-(3-бутен-1-ил)бензамид, можно получить путем взаимодействия 4-бром-1-бутена с избыточным количеством сконденсированного метиламина в N,N-диметилформамиде в присутствии карбоната калия с получением N-метил-3-бутен-1-амина. Обработка указанного последним соединения бензоилхлоридом в дихлорметане, содержащем триэтиламин, дает олефиновую боковую цепь, N-метил-N-(3-бутен-1-ил)бензамид.
Соединения, описанные в настоящей заявке, могут содержать пиразиновое или пиридазиновое кольцо. Применяя способы, описанные M. Hasegawa, et al. (Европейский патент № 0516409 B1), 2-метилпиразин или 3-метилпиридазин (оба доступные от Aldrich Chemical Company) можно сконденсировать с N-метил-N-(трет-бутоксикарбонил)-3-аминобутаналем с получением (4E)-N-метил-N-(трет-бутоксикарбонил)-5-(2-пиразинил)-4-пентен-2-амина и (4E)-N-метил-N-(трет-бутоксикарбонил)-5-(3-пиридазинил)-4-пентен-2-амина соответственно. Удаление трет-бутоксикарбонильной группы при помощи трифторуксусной кислоты дает (4E)-N-метил-5-(2-пиразинил)-4-пентен-2-амин и (4E)-N-метил-5-(3-пиридазинил)-4-пентен-2-амин соответственно. Необходимый N-метил-N-(трет-бутоксикарбонил)-3-аминобутаналь может быть получен из соответствующего спирта с применением способов, описанных M. Adamczyk, Y.Y. Chen в Международной заявке PCT WO 9212122. Спирт, N-метил-N-(трет-бутоксикарбонил)-3-амино-1-бутанол, может быть получен из коммерчески доступного 4-гидрокси-2-бутанона (Lancaster Synthesis, Inc.) путем последовательного восстановительного аминирования (с использованием метиламина и цианоборгидрида натрия и химических способов, описанных R. F. Borch, Org. Syn., 52:124 (1974)) и защиты с применением ди-трет-бутилдикарбоната.
Реакция сочетания Гека, описанная выше, также является приемлемой для получения соединений, которые содержат некоторые сконденсированные гетероциклы. Такие соединения могут быть синтезированы путем катализируемого палладием сочетания бромсодержащего гетероциклического соединения, такого как 6-бром-2-метил-1H-имидазо[4,5-b]пиридин, с указанной выше боковой цепью олефинового амина, N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином. Типично, для реакции сочетания применяют способы, аналогичные описанным в W.C. Frank et al., J. Org. Chem. 43: 2947 (1978) и N. J. Malek et al., J. Org. Chem. 47: 5395 (1982), включающие катализируемое палладием сочетание олефина и ароматического галогензамещенного соединения. Полученное трет-бутоксикарбонилзащищенное (Boc-защищенное) промежуточное соединение можно подвергнуть обработке сильной кислотой, такой как трифторуксусная кислота, с получением (4E)-N-метил-5-(6-(2-метил-1H-имидазо[4,5-b]пиридин)ил)-4-пентен-2-амина. Необходимый бромимидазопиридин, 6-бром-2-метил-1H-имидазо[4,5-b]пиридин, можно получить с 82% выходом путем нагревания 2,3-диамино-5-бромпиридина с уксусной кислотой в полифосфорной кислоте, в соответствии со способами, описанными P.K. Dubey et al., Indian J. Chem. 16B(6):531-533 (1978). 2,3-диамино-5-бромпиридин можно получить с 97% выходом путем нагревания 2-амино-5-бром-3-нитропиридина (коммерчески доступный от Aldrich Chemical Company и Lancaster Synthesis, Inc.) с дигидратом хлорида олова(II) в кипящем этаноле, в соответствии со способом, описанным S.X. Cai et al., J. Med. Chem. 40(22): 3679-3686 (1997).
В другом примере бромсодержащий сконденсированный гетероцикл, такой как 6-бром-1,3-диоксоло[4,5-b]пиридин, можно подвергнуть сочетанию с описанной выше боковой цепью олефинового амина, N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином, с применением реакции Гека. С полученного Boc-защищенного промежуточного соединения можно снять защиту при помощи сильной кислоты, такой как трифторуксусная кислота, с получением (4E)-N-метил-5-(6-(1,3-диоксоло[4,5-b]пиридин)ил)-4-пентен-2-амина. Необходимое бромсодержащее соединение, 6-бром-1,3-диоксоло[4,5-b]пиридин, может быть синтезировано из 5-бром-2,3-дигидроксипиридина, также известного как 5-бром-3-гидрокси-2(1H)-пиридинон, при помощи способа метиленирования с использованием бромхлорметана, в присутствии карбоната калия и N,N-диметилформамида, в соответствии со способом F. Dallacker et al., Z. Naturforsch. 34 b:1729-1736 (1979). 5-бром-2,3-дигидроксипиридин можно получить из фурфураля (2-фуральдегид, коммерчески доступный от Aldrich Chemical Company и Lancaster Synthesis, Inc.) с применением способов, описанных в F. Dallacker et al., Z. Naturforsch. 34 b:1729-1736 (1979). Альтернативно, 5-бром-2,3-дигидроксипиридин можно получить в соответствии со способом, описанным в EP 0081745, выданном на имя D. Rose и N. Maak.
В другом примере соединения, содержащего сконденсированный гетероцикл, бромсодержащее соединение, 7-бром-2,3-дигидро-1,4-диоксино[2,3-b]пиридин (также известный, как 7-бром-5-аза-4-оксахроман), может быть сконденсировано с описанной выше боковой цепью олефинового амина, N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином, с применением реакции Гека. С полученного Boc-защищенного соединения может быть снята защита при помощи сильной кислоты, такой как трифторуксусная кислота, с получением (4E)-N-метил-5-(7-(2,3-дигидро-1,4-диоксино[2,3-b]пиридин)ил-4-пентен-2-амина. Бромсодержащее соединение, 7-бром-2,3-дигидро-1,4-диоксино[2,3-b]пиридин, можно получить путем обработки 5-бром-2,3-дигидроксипиридина 1,2-дибромэтаном и карбонатом калия в N,N-диметилформамиде, в соответствии со способом F. Dallacker et al., Z. Naturforsch. 34 b: 1729-1736 (1979). 5-бром-2,3-дигидроксипиридин можно получить из фурфураля, как описано выше.
Другие полициклические ароматические соединения можно получить при помощи реакции Гека. Таким образом, некоторые соединения можно синтезировать при помощи катализируемого палладием сочетания бромсодержащего сконденсированного гетероцикла, такого как 6-бром-1H-имидазо[4,5-b]пиридин-2-тиол, с описанной выше боковой цепью олефинового амина, N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином. Boc-защищенное промежуточное соединение, продукт реакции Гека, можно подвергнуть обработке сильной кислотой, такой как трифторуксусная кислота, с получением (4E)-N-метил-5-(6-(2-тио-1H-имидазо[4,5-b]пиридин)ил)-4-пентен-2-амина. Необходимое бромсодержащее соединение, 6-бром-1H-имидазо[4,5-b]пиридин-2-тиол, можно получить путем обработки 6-бром-1H-имидазо[4,5-b]пиридина серой при 230-260°C, в соответствии со способами, описанными в Y.M. Yutilov, Khim. Geterotsikl Doedin. 6: 799-804 (1988). 6-бром-1H-имидазо[4,5-b]пиридин может быть получен от Sigma-Aldrich Chemical Company. Альтернативно, 6-бром-1H-имидазо[4,5-b]пиридин можно получить путем обработки 2,3-диамино-5-бромпиридина муравьиной кислотой в полифосфорной кислоте, с применением способа, аналогичного описанному P.K. Dubey et al., Indian J. Chem. 16B(6):531-533 (1978). 2,3-диамино-5-бромпиридин можно получить с 97% выходом путем нагревания 2-амино-5-бром-3-нитропиридина (коммерчески доступный от Aldrich Chemical Company и Lancaster Synthesis, Inc.) с дигидратом хлорида олова(II) в кипящем этаноле, в соответствии со способом, описанным в S. X. Cai et al., J. Med. Chem., 40(22): 3679-3686 (1997). Альтернативно, 6-бром-1H-имидазо[4,5-b]пиридин-2-тиол можно получить путем нагревания 2,3-диамино-5-бромпиридина с K+- SCSOEt в водном этаноле с применением способа, аналогичного описанному T.C. Kuhler et al., J. Med Chem. 38(25): 4906-4916 (1995). 2,3-диамино-5-бромпиридин можно получить из 2-амино-5-бром-3-нитропиридина, как описано выше.
В соответствующем примере 6-бром-2-фенилметилтио-1H-имидазо[4,5-b]пиридин можно подвергнуть сочетанию через реакцию Гека с описанной выше боковой цепью олефинового амина, N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином. Полученное Boc-защищенное промежуточное соединение можно подвергнуть обработке с сильной кислотой, такой как трифторуксусная кислота, с получением (4E)-N-метил-5-(6-(2-фенилметилтио-1H-имидазо[4,5-b]пиридин)ил)-4-пентен-2-амина. Бромсодержащее соединение, 6-бром-2-фенилметилтио-1H-имидазо[4,5-b]пиридин, можно получить путем алкилирования описанного 6-бром-1H-имидазо[4,5-b]пиридин-2-тиола при помощи бензилбромида, в присутствии карбоната калия и N,N-диметилформамида.
В другом примере 6-бромоксазолo[4,5-b]пиридин, когда его последовательно подвергают катализируемому палладием сочетанию с N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином и снятию защиты при помощи трифторуксусной кислоты, дает (4E)-N-метил-5-(6-оксазолo[4,5-b]пиридинил)-4-пентен-2-амин. Необходимый 6-бромоксазолo[4,5-b]пиридин может быть получен из 2-амино-5-бром-3-пиридинола путем конденсации с муравьиной кислотой или триалкилортоформиатом при помощи способа, аналогичного описанному M-C. Viaud et al., Heterocycles 41: 2799-2809 (1995). Применение других карбоновых кислот дает 2-замещенные-6-бромоксазолo[4,5-b]пиридины, которые также являются субстратами для реакции Гека. Синтез 2-амино-5-бром-3-пиридинола осуществляют из фурфуриламина (Aldrich Chemical Company). Таким образом, 5-бром-3-пиридинол (полученный из фурфуриламина в соответствии с патентом США № 4192946) может быть хлорирован при помощи способов, описанных в V. Koch et al., Synthesis, 499 (1990), с получением 2-хлор-5-бром-3-пиридинола, который, в свою очередь, может быть преобразован в 2-амино-5-бром-3-пиридинол путем обработки аммиаком.
5-бромоксазолo[5,4-b]пиридин, изомерный в результате ориентации конденсации циклов в направлении ранее описанного 6-бромоксазолo[4,5-b]пиридина, также можно применять в реакции сочетания Гека с N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином. Последующее удаление трет-бутоксикарбонильной защитной группы обеспечивает (4E)-N-метил-5-(5-оксазолo[5,4-b]пиридинил)-4-пентен-2-амин. 5-бромоксазолo[5,4-b]пиридин может быть синтезирован из 3-амино-5-бром-2-пиридинола (3-амино-5-бром-2-пиридон) путем конденсации с муравьиной кислотой (или ее производным), как описано выше. 3-амино-5-бром-2-пиридинол может быть получен путем бромирования (с применением способа, описанного T. Batkowski, Rocz. Chem. 41: 729-741 (1967)) и последующего восстановления при помощи хлорида олова(II) (в соответствии со способом, описанным S.X. Cai et al., J. Med. Chem. 40(22): 3679-3686 (1997)) коммерчески доступного 3-нитро-2-пиридинола (Aldrich Chemical Company).
Другие полициклические ароматические соединения по настоящему изобретению можно получить при помощи реакции Гека. Таким образом, 5-бромфуро[2,3-b]пиридин и 5-бром-1H-пирролo[2,3-b]пиридин оба можно подвергнуть катализируемому палладием сочетанию с описанной выше боковой цепью олефинового амина, N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином, с получением (4E)-N-метил-N-(трет-бутоксикарбонил)-5-(5-фуро[2,3-b]пиридинил)-4-пентен-2-амина и (4E)-N-метил-N-(трет-бутоксикарбонил)-5-(5-1H-пирролo[2,3-b]пиридинил)-4-пентен-2-амина соответственно. Последующее удаление трет-бутоксикарбонилбной группы при помощи трифторуксусной кислоты дает (4E)-N-метил-5-(5-фуро[2,3-b]пиридинил)-4-пентен-2-амин и (4E)-N-метил-5-(5-1H-пирролo[2,3-b]пиридинил)-4-пентен-2-амин. Необходимые 5-бромфуро[2,3-b]пиридин и 5-бром-1H-пирролo[2,3-b]пиридин могут быть получены из 2,3-дигидрофуро[2,3-b]пиридина и 2,3-дигидропирролo[2,3-b]пиридина соответственно путем бромирования (бром и бикарбонат натрия в метаноле) и дегидрирования (2,3-дихлор-5,6-дициано-1,4-бензохинон), с применением химических способов, описанных в E.C. Taylor et al., Tetrahedron. 43: 5145-5158 (1987). 2,3-дигидрофуро[2,3-b]пиридин и 2,3-дигидропирролo[2,3-b]пиридин, в свою очередь, получают из 2-хлорпиримидина (Aldrich Chemical Company), как описано A.E. Frissen et al., Tetrahedron. 45: 803-812 (1989), путем нуклеофильного замещения хлорида (с использованием натриевой соли 3-бутин-1-ола или 4-амино-1-бутина) и последующей внутримолекулярной реакцией Дильса-Альдера. С применением аналогичных химических способов 2,3-дигидрофуро[2,3-b]пиридин и 2,3-дигидропирролo[2,3-b]пиридин также могут быть получены из 3-метилтио-1,2,4-триазена (E. C. Taylor et al., Tetrahedron. 43: 5145-5158 (1987)), который, в свою очередь, получают из глиоксаля и S-метилтиосемикарбазида (W. Paudler et al., J. Heterocyclic Chem. 7: 767-771 (1970)).
Бромированные дигидрофуропиридины, дигидропирролoпиридины и дигидропиранoпиридины также являются субстратами для катализируемого палладием сочетания. Например, 5-бром-2,3-дигидрофуро[2,3-b]пиридин и 5-бром-2,3-дигидропирролo[2,3-b]пиридин (получены бромированием 2,3-дигидрофуро[2,3-b]пиридина и 2,3-дигидропирролo[2,3-b]пиридина, как описано выше), оба можно подвергнуть сочетанию с описанной выше боковой цепью олефинового амина, применяя способ Гека. Последующее снятие защиты дает соответствующие (4E)-N-метил-5-(5-(2,3-дигидрофуро[2,3-b]пиридин)ил)-4-пентен-2-амин и (4E)-N-метил-5-(5-(2,3-дигидропирролo[2,3-b]пиридин)ил)-4-пентен-2-амин. Аналогичная обработка 6-бром-2,3-дигидрофуро[3,2-b]пиридина (изомерный по конденсации циклов с [2,3-b] системой) дает (4E)-N-метил-5-(6-(2,3-дигидрофуро[3,2-b]пиридин)ил)-4-пентен-2-амин. Необходимый 6-бром-2,3-дигидрофуро[3,2-b]пиридин может быть получен из 5-бром-2-метил-3-пиридинола путем последовательной обработки двумя эквивалентами диизопропиламида лития (для образования 2-метиленил, 3-оксидианиона) и одним эквивалентом дибромметана. Альтернативно, с применением химических способов, аналогичных описанным M.U. Koller et al., Synth. Commun. 25: 2963-74 (1995), силилзащищенный пиридинол (5-бром-2-метил-3-триметилсилилоксипиридин) можно последовательно обработать одним эквивалентом диизопропиламида лития и алкил- или арилальдегидом с получением 2-(2-(1-алкил- или 1-арил-1-гидрокси)этил)-5-бром-3-(триметилсилилокси)пиридина. Такие вещества могут быть преобразованы при помощи способов (таких как катализируемая кислотой циклизация или синтез Вильямсона), известных специалистам в данной области, в соответствующие циклические простые эфиры (2-алкил- или 2-арил-6-бром-2,3-дигидрофуро[3,2-b]пиридины). Аналогичный химический способ, в котором эпоксиды (вместо альдегидов) применяют во взаимодействии с пиридинилметильным карбанионом, приводит к 2-алкил- и 2-арил-7-бром-2,3-дигидропиранo[3,2-b]пиридинам. Эти 2-замещенные бромированные дигидрофуро- и дигидропиранoпиридины также являются субстратами для реакции Гека. Например, 6-бром-2,3-дигидро-2-фенилфуро[3,2-b]пиридин можно подвергнуть сочетанию, в катализируем палладием способе, с N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином, обработать продукт сочетания трифторуксусной кислотой (для удаления трет-бутоксикарбонильной группы) с получением (4E)-N-метил-5-(6-(2,3-дигидро-2-фенилфуро[3,2-b]пиридин)ил)-4-пентен-2-амина.
5-бром-2-метил-3-пиридинол, используемый для синтеза бромированных дигидрофуро- и дигидропиранoпиридинов, получают путем стандартных преобразований коммерчески доступных веществ. Таким образом, 2-метилникотиновую кислоту (Aldrich Chemical Company) можно преобразовать, путем последовательной обработки тионилхлоридом, бромом и аммиаком (способ, описанный C.V. Greco et al., J. Heterocyclic Chem. 7: 761-766 (1970)), в 5-бром-2-метилникотинамид. Перегруппировка Гофмана 5-бром-2-метилникотинамида с гипохлоритом дает 3-амино-5-бром-2-метилпиридин, который может быть преобразован в 5-бром-2-метил-3-пиридинол путем диазотирования с использованием нитрита натрия в водном растворе серной кислоты. Альтернативно, сложный аланинэтиловый эфир (Aldrich Chemical Company) преобразуют (с использованием этилформиата) в его N-формильное производное, которое затем преобразуют в 5-этокси-4-метилоксазол при помощи пентоксида фосфора (N. Takeo et al., патент Японии № 45012732). Реакция Дильса-Альдера 5-этокси-4-метилоксазола с акрилонитрилом дает 5-гидрокси-6-метилникотинoнитрил (T. Yoshikawa et al., Chem. Pharm. Bull. 13: 873 (1965)), который преобразуют в 5-амино-2-метил-3-пиридинол путем гидратирования и перегруппировки Гофмана (Y. Morisawa et al., Agr. Biol. Chem. 39: 1275-1281 (1975)). 5-амино-2-метил-3-пиридинол можно затем преобразовать, путем диазотирования в присутствии бромида меди, в требуемый 5-бром-2-метил-3-пиридинол.
Каждый из этих способов обеспечивает соединения (E)-метаникотинового типа в качестве основного продукта, но также приводит к образованию небольших количеств соответствующих соединений (Z)-метаникотинового типа и других изомеров, как описано выше. Эти второстепенные продукты реакции можно удалить при помощи традиционных способов, если это требуется. Альтернативно, как описано более подробно ниже, соединения (E)-метаникотинового типа можно выделить в виде гидроксибензоатных солей, которые могут осаждаться в, по существу, чистой форме из реакционной смеси, включая гидроксибензоатные соли соединений (Z)-метаникотинового типа и других второстепенных продуктов реакции.
Для получения соединений можно применять другие способы, помимо реакции сочетания Гека. Например, соединения (E)-метаникотинового типа можно получить при помощи способов, описанных Loffler et al., Chem. Ber., 42:3431-3438 (1909) и Laforge, J.A.C.S., 50:2477 (1928), из соединений типа замещенных никотинов. Некоторые соединения типа 6-замещенных метаникотинов можно получить из соответствующих соединений 6-замещенных никотинов, применяя общие способы, описанные Acheson et al., J. Chem. Soc., Perkin Trans. 1(2):579-585 (1980). Необходимые предшественники для таких соединений, соединения типа 6-замещенных никотинов, могут быть синтезированы из сложных эфиров 6-замещенных никотиновых кислот с применением общих способов, описанных Rondahl, Acta Pharm. Suec., 14:113-118 (1977). Получение некоторых соединений типа 5-замещенных метаникотинов можно осуществить из соответствующих соединений типа 5-замещенных никотинов с применением общего способа, раскрытого Acheson et al., J. Chem. Soc., Perkin Trans. 1(2): 579-585 (1980). Соединения 5-галогензамещенных никотинов (например, типа фтор- и бромзамещенных никотиновых соединений) и соединения типа 5-аминоникотиновых можно получить с применением общих способов, раскрытых Rondahl, Act. Pharm. Suec., 14:113-118 (1977). Соединения 5-трифторметилникотинового типа можно получить с применением технологии и веществ, описанных в Ashimori et al., Chem. Pharm. Bull., 38(9):2446-2458 (1990), и Rondahl, Acta Pharm. Suec., 14:113-118 (1977).
Получение E-метаникотингидроксибензоатов
(E)-метаникотингидроксибензоаты получают путем взаимодействия соединений E-метаникотинового типа, описанных выше, с гидроксибензойными кислотами. Стехиометрия отдельных компонентов (E-метаникотин и гидроксибензойная кислота), используемых для получения солей, может варьировать. Молярное отношение оксибензойной кислоты к основанию (E-метаникотин) обычно составляет от 2:1 до 1:2, более предпочтительно 2:1 или 1:1, но возможны другие отношения (такие как 3:2). Предпочтительно, когда молярное отношение кислоты к основанию составляет 1:1. В зависимости от того, каким способом получают соли по настоящему изобретению, эти соли могут иметь кристаллические структуры, которые могут поглощать растворители, присутствующие в процессе образования соли. Таким образом, соли по настоящему изобретению могут быть в форме гидратов и других сольватов с разной стехиометрией растворителя относительно арилзамещенного амина.
Способ получения соединений по настоящему изобретению может варьировать. Например, получение (2S)-(4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина в форме п-гидроксибензоата может включать: (i) добавление раствора подходяще чистого соединения, растворенного в этаноле, к раствору п-гидроксибензойной кислоты (1,1 эквивалента) в этаноле, нагревание при температуре кипения с обратным холодильником, с образованием осадка; (ii) применение нагрева и/или воды и этанола (количество воды не превышает 10%) для растворения осадка, (iii) охлаждение полученного раствора, если необходимо, чтобы вызвать осаждение соли, и (iv) фильтрацию и сбор соли. Стехиометрия, смесь растворителей, концентрация растворенного вещества и используемая температура могут варьировать, но получение солей известно специалистам, квалифицированным в данной области.
Получение других форм солей
При необходимости, после выделения гидроксибензоатных солей могут быть образованы другие формы солей, например путем непосредственного взаимодействия с другими фармацевтически приемлемыми кислотами или путем выделения сначала свободного основания (путем взаимодействия с сильным основанием и экстракции в подходящий растворитель), а затем взаимодействия с другой фармацевтически приемлемой кислотой. Такие способовы известны специалистам в данной области.
III. Фармацевтические композиции
Фармацевтические композиции по настоящему изобретению содержат гидроксибензоаты, описанные в настоящей заявке, в чистом виде или в форме композиции, в которой соединения объединены с каким-либо другим фармацевтически совместимым продуктом, который может быть инертным или физиологически активным. Такие композиции можно вводить, например, перорально, парентерально, ректально или местным путем.
Примеры твердых композиций для перорального введения представляют собой, но не ограничены этим, таблетки, пилюли, порошки (желатиновые капсулы, саше) и гранулы. В таких композициях активное соединение смешивают с одним или несколькими инертными разбавителями, такими как крахмал, целлюлоза, сахароза, лактоза или диоксид кремния; идеально, под потоком инертного газа, такого как аргон.
Композиции также могут содержать вещества, отличные от разбавителей, например одно или несколько смазывающих веществ, таких как стеарат магния или тальк, краситель, покрытие (таблетки с покрытием) или лак.
Примеры жидких композиций для перорального введения представляют собой, но не ограничены этим, растворы, суспензии, эмульсии, сиропы и эликсиры, которые являются фармацевтически приемлемыми и типично содержат инертные разбавители, такие как вода, этанол, глицерин, растительные масла или жидкий парафин. Такие композиции могут содержать вещества, отличные от разбавителей, например смачивающие вещества, подсластители, загустители, отдушки и стабилизаторы.
Стерильные композиции для парентерального введения могут представлять собой, например, водные или неводные растворы, суспензии и эмульсии. Примеры подходящих растворителей и носителей представляют собой, но не ограничены этим, водные растворы, предпочтительно, забуференные водные растворы, пропиленгликоль, полиэтиленгликоль, растительные масла, особенно оливковое масло, подходящие для инъекций сложные органические эфиры, например этилолеат, и другие подходящие органические растворители. Такие композиции также могут содержать адъюванты, в частности смачивающие вещества, вещества для придания изотоничности, эмульгаторы, разрыхлители и стабилизаторы. Такие стерильные композиции можно стерилизовать различными способами, например путем асептического фильтрования, путем введения стерилизующих веществ в композицию, путем облучения и путем нагревания. Их также можно получать в форме стерильных твердых композиций, которые можно растворить во время использования в стерильной воде или любой другой стерильной среде для инъекций.
Примеры композиций для ректального введения представляют собой, но не ограничены этим, суппозитории и ректальные капсулы, которые помимо активного вещества могут включать эксципиенты, такие как масло какао, полусинтетические глицериды и полиэтиленгликоли.
Композиции для местного введения могут быть, например, в форме кремов, лосьонов, глазных примочек, растворов для полоскания рта, назальных капель или аэрозолей.
Фармацевтические композиции также могут содержать различные другие компоненты в виде добавок или вспомогательных веществ. Примеры фармацевтически приемлемых компонентов или вспомогательных веществ, которые применяют в соответствующих обстоятельствах, представляют собой антиоксиданты, акцепторы свободных радикалов, пептиды, факторы роста, антибиотики, бактериостатические вещества, иммуносупрессоры, антикоагулянты, буферные вещества, противовоспалительные средства, жаропонижающие средства, связующие для контролируемого высвобождения, анестезирующие средства, стероиды и кортикостероиды. Такие компоненты могут обеспечивать дополнительную терапевтическую пользу, влиять на терапевтическое действие фармацевтической композиции, или их действие может быть направлено на предотвращение каких-либо потенциальных побочных действий, которые могут возникать в результате введения фармацевтической композиции. В некоторых обстоятельствах соединение по настоящему изобретению можно применять как часть фармацевтической композиции с другими соединениями, предназначенными для профилактики или лечения определенного заболевания.
IV. Способы лечения
Гидроксибензоатные соли, описанные в настоящей заявке, являются полезными для лечения тех состояний и расстройств, для которых были предложены другие типы никотиновых соединений в качестве терапевтических средств. См., например, Williams et al., DN&P. 7(4):205-227 (1994); Arneric et al., CNS Drug Rev. 1(1):1-26 (1995); Arneric et al., Exp. Opin. Invest. Drugs 5(1):79-100 (1996); Bencherif et al., J. Pharmacol. Exp. Ther. 279:1413 (1996); Lippiello et al., J. Pharmacol. Exp. Ther. 279:1422 (1996); Damaj et al., Neuroscience (1997); Holladay et al., J. Med. Chem. 40(28): 4169-4194 (1997); Bannon et al., Science. 279: 77-80 (1998); PCT WO 94/08992; PCT WO 96/31475; и Патенты США №№ 5583140, выданный на имя Bencherif et al.; 5597919, выданный на имя Dull et al.; и 5604231, выданный на имя Smith et al.
Соли также можно применять в качестве вспомогательной терапии в сочетании с существующими терапевтическими средствами для лечения указанных выше типов заболеваний и расстройств. В таких ситуациях предпочтительно вводить активные ингредиенты таким образом, чтобы свести к минимуму воздействия на подтипы nAChR, такие как воздействия, связанные с мышцами и ганглиями. Это можно осуществлять путем направленной доставки лекарственного средства и/или путем корректирования дозы таким образом, чтобы требуемое воздействие достигалось без приближения к той пороговой дозе, которая вызывает значительные побочные действия. Фармацевтические композиции можно применять для облегчения каких-либо симптомов, связанных с указанными состояниями, заболеваниями и расстройствами.
Примеры состояний и расстройств, которые можно лечить, представляют собой неврологические расстройства, нейродегенеративные расстройства, в частности расстройства ЦНС, и воспалительные расстройства. Расстройства ЦНС могут быть индуцированы лекарственными средствами; их причиной может быть генетическая предрасположенность, инфекция или травма; или их этиология может быть неизвестной. Расстройства ЦНС представляют собой нейропсихиатрические расстройства, неврологические заболевания и психические заболевания, и представляют собой нейродегенеративные заболевания, поведенческие расстройства, когнитивные расстройства и когнитивно-аффективные расстройства. Существуют некоторые расстройства ЦНС, клиническое проявление которых отнесено к нарушению функции ЦНС (т.е. расстройства, являющиеся результатом неподходящих уровней высвобождения нейротрансмиттеров, неподходящих свойств нейротрансмиттерных рецепторов и/или неподходящего взаимодействия между нейротрансмиттерами и нейротрансмиттерными рецепторами). Некоторые расстройства ЦНС могут возникать за счет дефицита ацетилхолина, допамина, норэпинефрина и/или серотонина.
Примеры расстройств ЦНС, которые можно лечить при помощи E-метаникотиновых соединений и гидроксибензоатных солей, описанных в настоящей заявке, и фармацевтических композиций, содержащих такие соединения и соли, представляют собой пресенильную деменцию (раннее начало болезни Альцгеймера), старческую деменцию (деменцию Альцгеймерового типа), деменцию по типу телец Lewy, микроинфарктную деменцию, деменцию, связанную со СПИДом, ВИЧ-индуцированную деменцию, множественные церебральные инфаркты, Паркинсонизм, включая болезнь Паркинсона, болезнь Pick, прогрессивный супрануклеарный паралич, хорею Гентингтона, позднюю дискинезию, гиперкинезию, эпилепсию, маниакальный синдром, расстройство, связанное с дефицитом внимания, беспокойство, депрессию, дислексию, депрессию, связанную с шизофренией, обсессивно-компульсивное расстройство, синдром Tourette, легкое нарушение познавательной способности (MCI), возрастное ухудшение памяти (AAMI), ранние амнезийные и когнитивные расстройства, связанные с возрастом или возникающие в результате алкоголизма, или синдромом иммунодфицита, или связанные с сосудистыми расстройствами, с генетическими изменениями (такими как, например, трисомия 21) или с дефицитом внимания или дефицитом познавательной способности, острые или хронические нейродегенеративные состояния, такие как боковой амиотрофический склероз, рассеянный склероз, периферические нейротрофии и травмы головного или спинного мозга. Кроме того, соединения можно применять для лечения никотиновой зависимости и/или других поведенческих расстройств, связанных с веществами, которые вызывают зависимость (например, алкоголь, кокаин, героин и опиаты, психостимулирующие средства, бензодиазепины и барбитураты), и для лечения ожирения. Соединения также можно применять для лечения патологий воспалительного характера желудочно-кишечной системы, таких как болезнь Крона, синдром раздраженной толстой кишки и язвенный колит, и диареи.
Способы введения гидроксибензоатных солей могут быть разными. Соли можно вводить путем ингаляции (например, в форме аэрозоля, либо назальным путем, либо с применением устройств для доставки, например, таких, которые описаны в патенте US № 4922901, выданном на имя Brooks et al.); местным путем (например, в форме лосьона); перорально (например, в жидкой форме в растворителе, таком как водная или неводная жидкость, или в твердом носителе); внутривенно (например, в растворе декстрозы или физиологическом растворе); в виде инфузии или инъекции (например, в виде суспензии или в виде эмульсии в фармацевтически приемлемой жидкости или смеси жидкостей); интраректально; интрацеребровентрикулярно; или чрескожным путем (например, с применением чрескожного пластыря). Хотя можно вводить соли в форме нерасфасованного активного химического вещества, предпочтительно представлять каждую соль в форме фармацевтической композиции или препарата эффективного и действенного введения. Примеры способов введения таких солей должны быть очевидны для специалистов. Например, соли можно вводить в форме таблетки, твердой желатиновой капсулы или в форме капсулы с контролируемым высвобождением. В качестве другого примера, соли можно доставлять чрескожно способами с применением пластырей, которые доступны от Novartis and Alza Corporation. Фармацевтические композиции по настоящему изобретению можно вводить с перерывами, или постепенно, непрерывно, с постоянной или контролируемой скоростью, теплокровному животному (например, млекопитающему, такому как мышь, крыса, кошка, кролик, собака, свинья, корова или обезьяна); но, преимущественно, соединения являются предпочтительными для введения человеку. Кроме того, время введения и количество введений в день вводимого фармацевтического препарата могут варьировать. Введение, предпочтительно, должно быть таким, чтобы активные ингредиенты фармацевтической композиции взаимодействовали с участками рецепторов в организме субъекта, которые влияют на функционирование ЦНС или желудочно-кишечного (GI) тракта. Более конкретно, при лечении расстройств ЦНС введение, предпочтительно, должно быть таким, чтобы оптимизировать эффект на те соответствующие подтипы рецепторов, которые влияют на ЦНС, в то же время сводя к минимуму действие на мышечные рецепторы. Другие подходящие способы введения солей описаны в патенте US № 5604231, выданном на имя Smith et al., раскрытие которого включено в настоящую заявку посредством ссылки во всей его полноте.
Подходящая доза солей представляет собой такое количество, которое является эффективным для предотвращения возникновения симптомов расстройства или для лечения некоторых симптомов расстройства, от которого страдает пациент. Под "эффективным количеством", "терапевтическим количеством" или "эффективной дозой" подразумевается количество, достаточное, чтобы вызвать требуемый фармакологическое или терапевтическое действие, таким образом, приводя к эффективной профилактике или лечению расстройства. Таким образом, при лечении расстройства ЦНС эффективное количество гидроксибензоатных солей представляет собой такое количество, которое необходимо для доставки через гематоэнцефалический барьер субъекта достаточного количества свободного основания лекарственного средства для связывания с соответствующими участками рецепторов в головном мозге субъекта и для модулирования соответствующих подтипов никотиновых рецепторов (например, обеспечения секреции нейротрансмиттеров, обеспечивая, таким образом, эффективную профилактику или лечение расстройства). Профилактика расстройства очевидна, по меньшей мере, по отсрочке возникновения симптомов расстройства или снижению тяжести симптомов. Лечение расстройства очевидно, по меньшей мере, по уменьшению симптомов, связанных с расстройством, или уменьшению случаев повторного возникновения симптомов расстройства.
Эффективная доза может варьировать в зависимости от таких факторов, как состояние пациента, тяжесть симптомов расстройства и способа, применяемого для введения фармацевтической композиции. Когда пациентом является человек, эффективная доза типичных солей, как правило, требует введения таких солей в количестве, достаточном для модуляции соответствующих рецепторов для воздействия на высвобождение нейротрансмиттеров (например, допамина), но этого количества должно быть недостаточно для индукции воздействий на скелетные мышцы и ганглии в какой-либо значительной степени. Эффективная доза гидроксибензоатной соли, конечно, будет различаться для разных пациентов, но, как правило, содержит количества, начиная с которых проявляются воздействия на ЦНС или другие требуемые терапевтические действия, но ниже количества, при котором наблюдаются мышечные действия.
Дозы зависят от требуемого действия, длительности лечения и применяемого пути введения; как правило, они находятся в пределах от 0,05 до 100 мг активного вещества в день при пероральном введении взрослому пациенту. Обычно лечащий врач определяет подходящую дозу с учетом возраста, веса и всех других факторов, специфических для конкретного пациента.
Соли по настоящему изобретению при применении в эффективных количествах в соответствии со способом по настоящему изобретению часто не способны вызывать активацию nAChR ганглия человека в какой-либо значительной степени. Такая селективность солей по настоящему изобретению против тех nAChR, которые ответственны за сердечно-сосудистые побочные эффекты, демонстрируется отсутствием способности таких солей активировать никотиновую функцию хромаффинной ткани надпочечников. Как таковые, такие соли обладают низкой способностью вызывать приток изотопных рубидиевых ионов через nAChR в клеточных препаратах, полученных из надпочечника. В основном, типичные предпочтительные соли, приемлемые для осуществления настоящего изобретения, максимально активируют приток изотопных рубидиевых ионов меньше 10 процентов, предпочтительно меньше 5 процентов от максимально обеспечиваемого S(-) никотином.
Соли являются эффективными в том, что в некоторой степени обеспечивают предотвращение развития расстройств ЦНС, облегчая симптомы расстройств ЦНС, и в некоторой степени уменьшая повторы расстройств ЦНС. Однако такие эффективные количества таких солей не являются достаточными, чтобы вызвать какие-либо заметные нежелательные никотиновые действия, как продемонстрировано путем снижения эффектов на препаратах, которые, как полагают, отражают воздействия на сердечно-сосудистую систему или воздействия на мышечно-скелетную систему. Таким образом, введение солей по настоящему изобретению обеспечивает терапевтическое окно, в рамках которого обеспечивается лечение некоторых расстройств ЦНС в отсутствие нежелательных периферических никотиновых воздействий/побочных действий. То есть эффективная доза соединения по настоящему изобретению является достаточной для обеспечения требуемых воздействий на ЦНС, но она является недостаточной (т.е. не является достаточно высокой), чтобы вызвать нежелательные побочные действия. Предпочтительно, эффективное введение соединения по настоящему изобретению, обеспечивающее лечение расстройств ЦНС, представляет собой введение меньше 1/3, предпочтительно меньше 1/5 и более предпочтительно меньше 1/10 от количества, достаточного, чтобы вызвать какие-либо значительные побочные действия.
Следующие синтетические и аналитические примеры представлены для иллюстрации настоящего изобретения и не должны рассматриваться как ограничивающие изобретение. В этих примерах все части и проценты являются массовыми, если не указано иное. Выходы реакций указаны в мольных процентах.
Пример 1: синтез п-гидроксибензоата (2S)-(4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина
п-гидроксибензоат (2S)-(4E)- N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина
п-гидроксибензойную кислоту (2,62 г, 19,0 ммоль) добавляли по порциям к перемешиваемому раствору (2S)-(4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина (4,79 г, чистота 93%, 19,0 ммоль) в изопропилацетате (50 мл). В процессе добавления наблюдали кристаллизацию соли. По завершении добавления п-гидроксибензойной кислоты суспензию нагревали при температуре около ее точки кипения, при этом медленно добавляли изопропанол. После добавления 15 мл изопропанола достигали полное растворение. Охлаждение раствора до температуры окружающей среды (в течение ночи) давало осаждение кристаллической массы, которую собирали путем фильтрования с отсосом и сушили на воздухе (4,03 г). Вторую партию (0,82 г) выделяли из концентрированного фильтрата путем добавления ацетона. Две партии кристаллов объединяли и перекристаллизовывали из ацетона (50 мл). Твердое вещество собирали путем фильтрования с отсосом и сушили в вакуумной печи (50°C) в течение 18 часов. Получали 4,24 г (60,0%) белых кристаллов (чистота 98+%, определенная методами ГХМС и ЖХМС; т.пл. 99-101°C).
Пример 2: синтез (2S)-(4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина (через реакцию Гека с (S)-N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амином) и использование п-гидроксибензоатной соли для облегчения выделения и очистки (2S)-(4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина
3-бром-5-изопропоксипиридин
В 72-л реактор загружали последовательно трет-пентоксид натрия (2,2 кг, 20 моль) и 1-метил-2-пирролидинон (17,6 л). Полученную смесь перемешивали в течение 1 часа, а затем добавляли 2-пропанол (12 л) в течение 2 часов. Затем в реактор добавляли 3,5-дибромпиридин (3,0 кг, 13 моль) и смесь нагревали при 75°C в течение 12 часов в атмосфере азота. Смесь затем охлаждали, разбавляли толуолом (15 л) и промывали водой (30 л). Водную фазу экстрагировали толуолом (15 л) и объединенные толуольные фазы промывали водой (15 л) и концентрировали при пониженном давлении с получением 2,5 кг темного масла. Полученное масло объединяли с равного размера партией вещества второй фракции и подвергали вакуумной перегонке (т. кип. 65°C при 0,3 мм) с получением 3,1 кг (57%) 3-бром-5-изопропоксипиридина в виде бледно-желтого масла.
(2R)-4-пентен-2-ол
(2R)-4-пентен-2-ол получали с выходом 82,5% из (R)-(+)-пропиленоксида в соответствии со способами, описанными в A. Kalivretenos, J. K. Stille, L. S. Hegedus, J. Org. Chem. 56: 2883 (1991).
(S)-N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амин
Смесь (R)-4-пентен-2-ола (7,62 г, 88,5 ммоль), пиридина (15 мл) и безводного (полученного перегонкой с гидридом кальция) дихлорметана (30 мл) перемешивали на ледяной бане, добавляя при этом п-толуолсульфонилхлорид (18,6 г, 97,4 ммоль) в течение 3 минут. Смесь перемешивали 20 минут при 0°C и 16 часов при температуре окружающей среды, при этом происходило образование тяжелого осадка. Добавляли насыщенный водный раствор бикарбоната натрия (75 мл) и двухфазную смесь интенсивно перемешивали в течение 3 часов. Дихлорметановую фазу и два дихлорметановых экстракта (по 50 мл каждый) водной фазы объединяли, сушили (Na2SO4) и концентририровали при помощи роторного испарителя. Обработка в высоком вакууме давала 18,7 г светло-желтого масла, которое объединяли с диметилформамидом (ДМФА) (35 мл) и 40%-ным водным раствором метиламина (35 мл). Полученный раствор перемешивали при температуре окружающей среды в течение 48 часов и затем выливали в смесь насыщенного водного раствора хлорида натрия (300 мл) и 2,5 M гидроксида натрия (50 мл). Полученную смесь экстрагировали простым эфиром (5×250 мл) и эфирные экстракты сушили (Na2SO4) и концентририровали при помощи роторного испарителя (из охлаждающей ледяной бани) до объема около 250 мл. Оставшийся раствор объединяли с ди-трет-бутилдикарбонатом (16,9 г, 77,4 ммоль) и ТГФ (100 мл) и смесь перемешивали при температуре окружающей среды в течение 16 часов. Летучие вещества выпаривали при помощи роторного испарителя и остаток перегоняли в вакууме при давлении 5 мм (т. кип. 79-86°C) с получением 7,74 г (выход 43,9%) прозрачной бесцветной жидкости.
п-гидроксибензоат (2S)-(4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина
Смесь 3-бром-5-изопропоксипиридина (21,0 г, 97,2 ммоль), (S)-N-метил-N-(трет-бутоксикарбонил)-4-пентен-2-амина (24,0 г, 120 ммоль), ДМФА (53 мл), K2CO3 (22 г, 159 ммоль), ацетата палладия(II) (0,22 г, 0,98 ммоль) и три-o-толилфосфина (0,57 г, 1,9 ммоль) дегазировали и помещали в атмосферу азота. Перемешиваемую смесь затем нагревали при 130°C в течение 2,5 часа. Для удаления палладиевой соли добавляли SmopexТМ (20 г) и этилацетат (100 мл). Перемешиваемую смесь нагревали при 50°C в течение 5 часов и при температуре окружающей среды в течение 16 часов и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток (83 г) растворяли в метаноле (25 мл), охлаждали на холодной водяной бане (<5°C) и обрабатывали по каплям 6 M HCl (100 мл). Полученную смесь перемешивали 3 часа при температуре окружающей среды и метанол удаляли путем концентрирования в вакууме. Оставшуюся водную смесь промывали дихлорметаном (100 мл), подщелачивали при осторожном (при охлаждении) добавлении 3 M NaOH и экстрагировали (2×200 мл) дихлорметаном. Полученные последними экстракты промывали насыщенным водным раствором NaCl и концентрировали в вакууме. Остаток растворяли в ацетоне (150 мл) и добавляли п-гидроксибензойную кислоту (14,0 г, 101 ммоль). По завершении растворения п-гидроксибензойной кислоты раствор выдерживали при температуре окружающей среды, при этом образовывалось большое количество твердого вещества (несколько часов). После нескольких часов охлаждения при -15°C, смесь фильтровали с отсосом. Полученное твердое вещество (24,8 г) перекристаллизовывали из ацетона (240 мл) с получением 22,3 г (61,6%) не совсем белых кристаллов (чистота 97+% по данным ГХМС и ЖХМС).
Пример 3: синтез 2,5-дигидроксибензоата (2S)-(4E)-N-метил-5-(5-метокси-3-пиридинил)-4-пентен-2-амина (гентизат)
2,5-дигидроксибензоат (2S)-(4E)-N-метил-5-(5-метокси-3-пиридинил)-4-пентен-2-амина
Горячий раствор 2,5-дигидроксибензойной кислоты (гентизиновой кислоты) (0,582 г, 3,78 ммоль) в абсолютном этаноле (1 мл) добавляли к теплому раствору (2S)-(4E)-N-метил-5-(5-метокси-3-пиридинил)-4-пентен-2-амина (1,00 г, 4,85 ммоль, 86,7% E-изомера по данным ГХ-FID) в абсолютном этаноле (1 мл), используя дополнительное количество этанола (2 мл) при переносе. Полученную смесь концентрировали при помощи роторного испарителя, оставляя 1,5 мл этанола в растворе. При перемешивании и нагревании до температуры, близкой к температуре кипения с обратным холодильником, происходила кристаллизация. Полученную горячую смесь обрабатывали по каплям этилацетатом (5,5 мл). После охлаждения до комнатной температуры смесь подвергали дальнейшему охлаждению при 5°C в течение 48 часов. Полученные твердые частицы фильтровали, промывали этилацетатом (2×5 мл) и сушили при 50°C с получением 1,24 г (91%) не совсем белого порошка (98,0% E-изомера по данным ГХ-FID в расчете на свободное основание). Для удаления окраски образца полученное вещество перекристаллизовывали из этанола/изопропанола (3,5 мл: 5,5 мл) с получением 1,03 г (выход извлеченного продукта 83%) не совсем белого порошка и затем его перекристаллизовывали из этанола/этилацетата (3 мл: 12 мл) с получением 0,90 г (выход извлеченного продукта 87%) белого кристаллического порошка, т. пл. 166-167°C.
Пример 4: синтез 2,5-дигидроксибензоата E-метаникотина
2,5-дигидроксибензоат E-метаникотина
2,5-дигидроксибензойную кислоту (гентизиновую кислоту) (0,475 г, 3,08 ммоль) добавляли к раствору E-метаникотина (0,500 г, 3,08 ммоль) в этилацетате (3 мл) и изопропаноле (2,5 мл) и полученную смесь осторожно нагревали до растворения всех твердых веществ. Сразу после охлаждения происходило осаждение белого осадка в форме гранул, и смесь охлаждали при 5°C. Твердое вещество фильтровали, промывали холодным изопропанолом (3×2 мл) и сушили в вакууме при 40°C в течение 4 часов с получением 0,58 г (29,7%) светло-желтого хлопьевидного твердого вещества, т. пл. 90-91,5°C. 1H-ЯМР (D2O): стехиометрия моно-соли. Рассчитано для C10H14N2·C7H6O4·0,15 H2O: C, 64,00%; H, 6,41%; N, 8,78%. Найдено: C, 63,92, 64,00%; H, 6,33, 6,34%; N, 8,79, 8,84%.
Пример 5: синтез 3,5-дигидроксибензоата E-метаникотина
3,5-дигидроксибензоат E-метаникотина
3,5-дигидроксибензойную кислоту (0,475 г, 3,08 ммоль) добавляли к теплому раствору E-метаникотина (0,500 г, 3,08 ммоль) в изопропаноле (11 мл) и метаноле (4,5 мл). После нагревания до температуры, близкой к температуре кипения с обратным холодильником, для растворения полученной смолы светло-желтый раствор охлаждали до комнатной температуры и затем еще охлаждали при 5°C. Полученную осажденную темно-желтую смолу растворяли в изопропилацетате (3 мл) и метаноле (4 мл), при нагревании для лучшего растворения смеси. После охлаждения до комнатной температур и дальнейшего охлаждения при 5°C не совсем белое твердое вещество фильтровали, промывали изопропилацетатом и сушили с получением 0,505 г (51,8%) воскообразных рыжевато-коричневых хлопьев, т. пл. 160-161,5°C. 1H-ЯМР (D2O): стехиометрия моно-соли. Рассчитано для C10H14N2·C7H6O4·0,15 H2O: C, 64,00%; H, 6,41%; N, 8,78%. Найдено: C, 64,03, 64,02%; H, 6,38, 6,38%; N, 8,80, 8,76%.
Аналитические примеры
Пример 6: определение связывания с соответствующими участками рецепторов
Взаимодействие гидроксибензоатных солей с соответствующими участками рецепторов можно определить в соответствии со способами, описанными в патенте US № 5597919, выданном на имя Dull et al. Константы ингибирования (значения Ki), указанные в нМ, можно рассчитать из значений ИК50 при помощи способа Cheng et al., Biochem. Pharnacol. 22:3099 (1973). Низкие константы связывания указывают на то, что компоненты солей, описанных в настоящей заявке, демонстрируют высокое сродство связывания с определенными никотиновыми рецепторами ЦНС.
Представленное выше описание является иллюстрацией настоящего изобретения и не должно рассматриваться как ограничивающее настоящее изобретение. Изобретение определено формулой изобретения, представленной ниже, включая также эквиваленты заявленных признаков.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМОРФНЫЕ ФОРМЫ (2S)-(4Е)-N-МЕТИЛ-5-[3-(5-ИЗОПРОПОКСИПИРИДИН)ИЛ]- 4-ПЕНТЕН-2-АМИНА ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 2007 |
|
RU2440984C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ КОГНИТИВНЫХ ФУНКЦИЙ | 2012 |
|
RU2665021C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УЛУЧШЕНИЯ КОГНИТИВНЫХ ФУНКЦИЙ | 2012 |
|
RU2792010C2 |
| ПРОИЗВОДНЫЕ АМИНОВ ИЛИ АМИДОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ АНТАГОНИЗИРОВАНИЯ РЕЦЕПТОРА Y5 НЕЙРОПЕПТИДА NPY | 2000 |
|
RU2228927C2 |
| СОЕДИНЕНИЯ, КОТОРЫЕ УСИЛИВАЮТ РЕЦЕПТОР ГЛУТАМАТА, И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2005 |
|
RU2403242C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЗМЕНЕНИЙ ПОВЕДЕНИЯ | 2018 |
|
RU2799049C2 |
| ПРИМЕНЕНИЕ АКТИВНЫХ ФАРМАЦЕВТИЧЕСКИХ СОЕДИНЕНИЙ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 2011 |
|
RU2563167C2 |
| НОВЫЕ СОЕДИНЕНИЯ ПИРИДИНОВ И ПИРАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ КАННАБИНОИДНОГО РЕЦЕПТОРА 2 | 2019 |
|
RU2797345C2 |
| ЗАМЕЩЕННЫЕ ПИРИДИНОВЫЕ И ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2014 |
|
RU2802185C2 |
| ЗАМЕЩЕННЫЕ ПИРИДИНОВЫЕ И ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2014 |
|
RU2668073C2 |
Изобретение относится к гидроксибензоатным солям соединений Е-метаникотинового типа, которые могут быть использованы при расстройствах ЦНС. Новая соль представляет собой продукт реакции (4Е)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина и гидроксибензойной кислоты, где гидроксибензойная кислота имеет формулу:

в которой гидроксигруппа может присутствовать в орто-, мета- или пара-положении относительно группы карбоновой кислоты, Z представляет собой неводородный заместитель, выбранный из группы, состоящей из С1-10 алкила, Cl, NR'R'', OR', C(=O)OR', где R' и R'', каждый независимо представляет собой водород, С1-10 алкил, и
j представляет собой число, имеющее значение от нуля до трех, представляющее количество заместителей Z, которое может присутствовать в кольце, где молярное отношение (4Е)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина к гидроксибензойной кислоте находится в интервале от 1:2 до 2:1. Изобретение также относится к фармацевтической композиции на основе предлагаемой соли и способу получения соли. 5 н. и 4 з. п. ф-лы.
1. Соль, полученная как продукт реакции (4Е)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина и гидроксибензойной кислоты, где гидроксибензойная кислота имеет формулу:
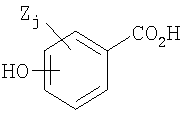
где гидроксигруппа может присутствовать в орто-, мета- или параположении относительно группы карбоновой кислоты, Z представляет собой неводородный заместитель, выбранный из группы, состоящей из С1-10 алкила, Cl, NR'R'', OR', C(=O)OR',
где R' и R'', каждый независимо представляет собой водород, С1-10 алкил, и
j представляет собой число, имеющее значение от нуля до трех, представляющее количество заместителей Z, которое может присутствовать в кольце,
где молярное отношение (4Е)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина к гидроксибензойной кислоте находится в интервале от 1:2 до 2:1.
2. Соль по п.1, где гидроксибензойная кислота представляет собой о-, м- или п-гидроксибензойную кислоту.
3. Соль по п.1, где гидроксибензойная кислота представляет собой гентизиновую кислоту (2,5-дигидроксибензойную кислоту).
4. Соединение, обозначенное как п-гидроксибензоат (2S)-(4Е)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина.
5. Соль по п.1, где (4Е)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амин представляет собой (2S)-(4Е)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амин.
6. Фармацевтическая композиция, обладающая активностью при заболеваниях ЦНС, содержащая эффективное количество соли по любому из пп.1-5 вместе с фармацевтически приемлемым носителем.
7. Способ получения (2S)-(4Е)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина или его соответствующей гидроксибензоатной соли, включающий стадии:
a) осуществления реакции сочетания Гека между 3-галоген-5-изопропоксипиридином и соединением формулы (S)-CH2=CH-CH2-CH(CH3)-N(CH3)(pg), где pg представляет собой защитную группу для амина в присутствии катализатора, и
b) снятия защиты с аминогруппы,
е) образования гидроксибензоатной соли путем взаимодействия указанной смеси с гидроксибензойной кислотой формулы:

где гидроксигруппа может присутствовать в орто-, мета- или параположении относительно группы карбоновой кислоты, Z представляет собой неводородный заместитель, выбранный из группы, состоящей из С1-10 алкила, Cl, NR'R'', OR', C(=O)OR',
где R' и R'', каждый независимо представляет собой водород, С1-10 алкил, и
j представляет собой число, имеющее значение от нуля до трех, представляющее количество заместителей Z, которое может присутствовать в кольце,
где молярное отношение Е-метаникотина к гидроксибензойной кислоте находится в интервале от 1:2 до 2:1,
f) выделения гидроксибензоатной соли (2S)-(4Е)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина, и
g) необязательно, преобразования гидроксибензоатной соли (2S)-(4E)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амина в (2S)-(4Е)-N-метил-5-(5-изопропокси-3-пиридинил)-4-пентен-2-амин.
8. Способ по п.7, где гидроксибензойная кислота представляет собой о-, м- или п-гидроксибензойную кислоту.
9. Применение композиции, содержащей соль по любому из пп.1-5 для получения лекарственного средства, полезного для лечения расстройства ЦНС.
| US 6432954 B1, 13.08.2002 | |||
| US 6232316 B1, 15.05.2001 | |||
| US 6492399 B1, 10.12.2001 | |||
| RU 2001133360 A1, 20.07.2003. |
Авторы
Даты
2011-01-20—Публикация
2005-11-09—Подача