Область техники, к которой относится изобретение
Настоящее изобретение относится к усовершенствованному способу получения метилацетата из диметилового эфира, и более обобщенно, к получению сложных алкиловых эфиров алифатических карбоновых кислот путем карбонилирования простых алкиловых эфиров. В другом аспекте настоящее изобретение относится к получению низших алифатических карбоновых кислот путем первоначального образования сложного алкилового эфира из низшего простого алкилового эфира, с последующим гидролизом сложного эфира в кислоту. Примером такого способа является получение уксусной кислоты путем карбонилирования диметилового эфира, с образованием метилацетата и последующим гидролизом сложного эфира, чтобы получить уксусную кислоту.
Уровень техники
Для получения уксусной кислоты в промышленности наиболее широко используется способ карбонилирования метанола, который описан, например, в патентах GB №1185453 и 1277242 и в патенте US №3689533. В способах этого типа метанол взаимодействует с монооксидом углерода или с газом, содержащим монооксид углерода, в присутствии катализатора, содержащего родий или иридий, и в присутствии дополнительного промотора, содержащего галоген (обычно йод). Однако, несмотря на широкое применение, в этих способах необходимо использовать дорогие, корозионно-стойкие сплавы из-за наличия йода, который приводит к образованию незначительного количества примесей йодсодержащих побочных продуктов, которые трудно удаляются из уксусной кислоты при традиционной дистилляции. В этом процессе были исследованы некоторые каталитические системы, но ни один из них не был внедрен в промышленность, главным образом, из-за проблем со сроком службы катализатора и селективностью.
Метилацетат представляет собой важное соединение, которое используется в процессах нефтехимической промышленности, главным образом, в качестве сырья для производства уксусного ангидрида и/или уксусной кислоты. Кроме того, метилацетат может быть использован для получения этилидендиацетата, предшественника винилацетата и поливинилацетата. Диметиловый эфир можно легко получить из синтез-газа, причем стоимость его производства может быть ниже, чем для метанола.
В ряде патентов описаны способы, в которых метанол или смесь метанола и диметилового эфира карбонилируется в присутствии катализатора. Обычно продукты представляют собой смесь уксусной кислоты и метилацетата, которая иногда содержит уксусный ангидрид. В этих патентах описано, что одной из возможных реакций является карбонилирование диметилового эфира с образованием метилацетата. Однако обычно диметиловый эфир используется не в качестве единственного или основного компонента сырья, а в качестве второстепенного компонента в потоках метанола.
Например, в выложенной заявке DE №3606169 фирмы BASF AG описано карбонилирование смеси метанола, метилацетата и/или диметилового эфира в присутствии кобальтсодержащего цеолитного катализатора, с получением продукта, содержащего уксусную кислоту, метилацетат и/или диметиловый эфир. Предпочтительными являются цеолиты типа пентасила с 10 кольцами, с промежуточным размером пор между порами в цеолите А с 8-кольцами и порами в цеолитах X и Y с 12-кольцами.
Jones и др., в патенте US №6130355 описали способ карбонилирования метанола и/или диметилового эфира с образованием уксусной кислоты с использованием катализатора, содержащего, по меньшей мере, один благородный металл из VIII группы, галоидированное соединение, в качестве сокатализатора, и йодидную соль, в качестве стабилизатора катализатора. Другие патенты, где раскрыты способы получения уксусной кислоты и/или метилацетата, в которых диметиловый эфир может присутствовать в сырье в смеси с метанолом, включают патенты US №6353132 и 6355837 и опубликованную заявку US 2003/0054951, все выданы Zoeller и др. В патентах US №5189203, 5286900 (оба выданы Hansen и др.) и 5728871 (Hansen и др.) описаны способы, в которых сначала используется синтез-газ, с целью получения метанола, который затем объединяется с диметиловым эфиром, и эта смесь карбонилируется с получением уксусной кислоты в качестве основного продукта.
В некоторых других работах исследовано карбонилирование диметилового эфира в качестве основного или единственного компонента сырья с использованием различных катализаторов. Например, Jones и др. в патенте US №5763654 описали такой способ, в котором катализатор представляет собой благородный металл из VIII группы с содержащим галогенид сокатализатором и метилиодидом в качестве промотора. В реакторе присутствует вода, хотя, согласно раскрытию этого патента, концентрация используемой воды меньше, чем в обычном уровне техники. Основным продуктом является уксусная кислота.
Wegman (патент US №5218140) экспериментально исследовал главным образом карбонилирование метанола для того, чтобы получить уксусную кислоту с использованием гетерополикислотных катализаторов. В этом патенте описан ряд экспериментов, в которых сырьем был диметиловый эфир (примеры 28-33); однако, в этих опытах степень превращения в метилацетат была относительно низкой.
Sardesai и др. (Energy Sources 2002, №24, р.301) также исследовали карбонилирование диметилового эфира с использованием ряда гетерополикислотных катализаторов. Полученные результаты по степени превращения и селективности по метилацетату сильно изменялись. Bagno и др. (J. Org. Chern. 1990, №55, р.4284) проводили такой процесс с использованием так называемых "суперкислотных" катализаторов, включающих BF3 и трифторметансульфокислоты, и в этом случае получены различные результаты по селективности относительно метилацетата.
Раскрытие изобретения
Вкратце, настоящее изобретение включает в себя способ получения продукта, содержащего низший сложный алкиловый эфир низшей алифатической карбоновой кислоты, который заключается во взаимодействии низшего простого алкилового эфира с монооксидом углерода в присутствии катализатора, содержащего морденит и/или ферриерит в практически безводных условиях.
Более конкретно, в настоящем изобретении разработан способ получения метилацетата за счет взаимодействия диметилового эфира с монооксидом углерода в присутствии катализатора, содержащего морденит и/или ферриерит, в практически безводных условиях.
Краткое описание чертежей
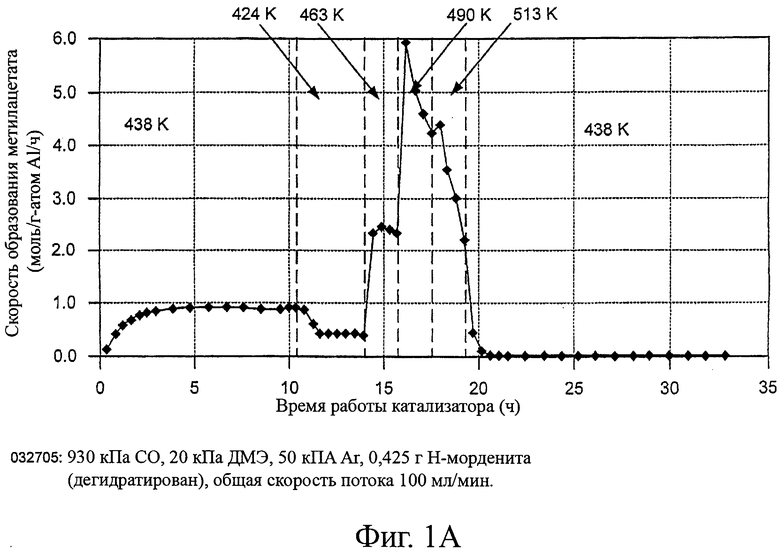
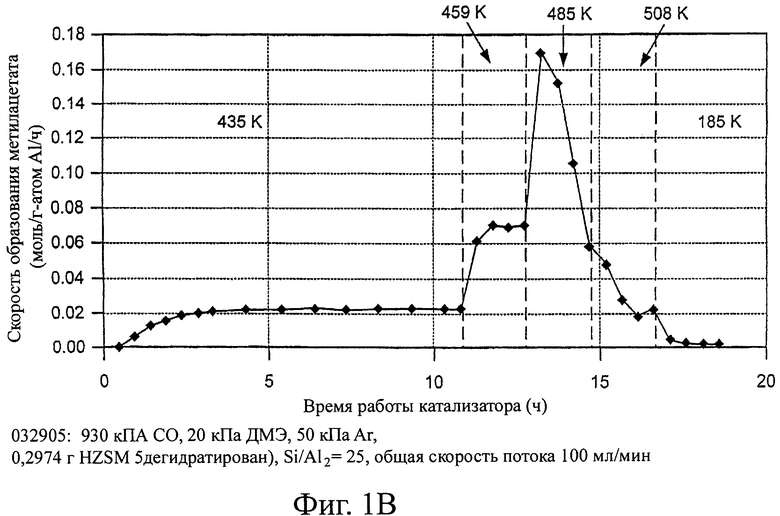
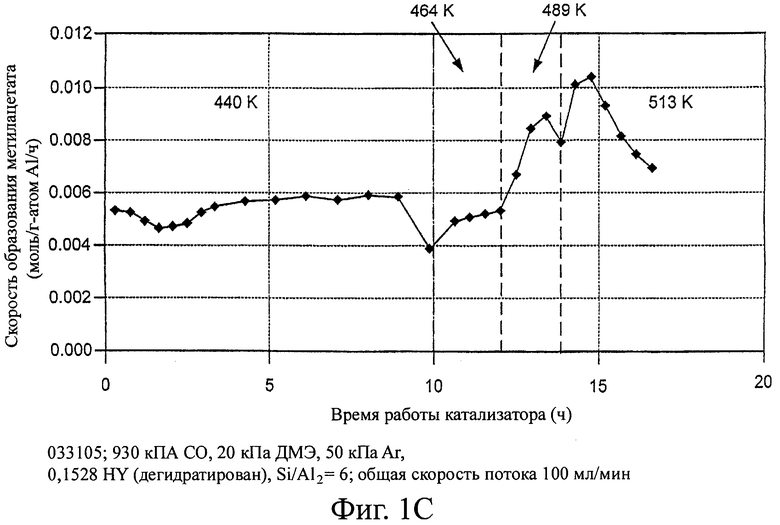
На фиг.1 изображены скорости образования метилацетата с использованием различных цеолитов в качестве возможных катализаторов для способа настоящего изобретения.
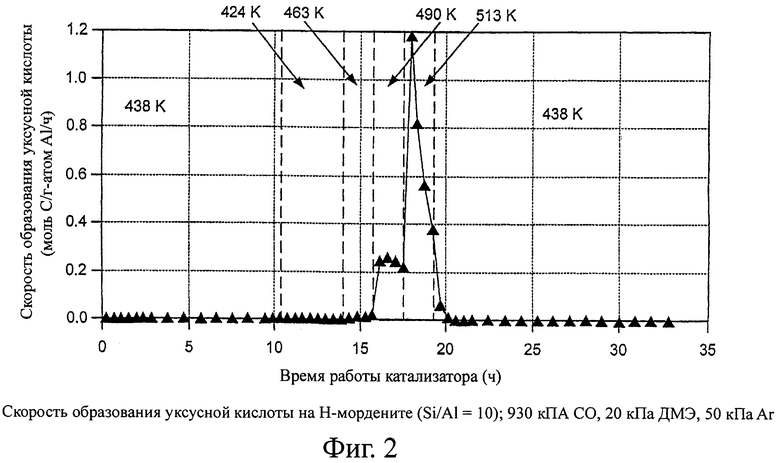
На фиг.2 изображены скорости образования уксусной кислоты с использованием катализатора - Н-морденитного цеолита в способе согласно изобретению.
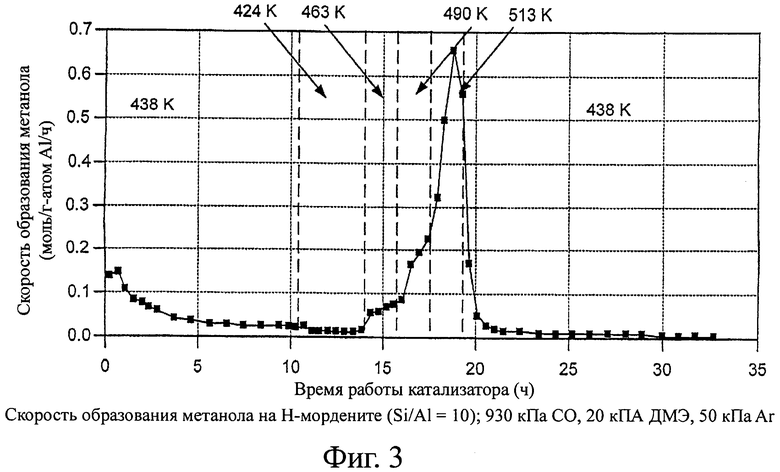
На фиг.3 изображены скорости образования метанола с использованием катализатора - Н-морденитного цеолита в способе согласно изобретению.
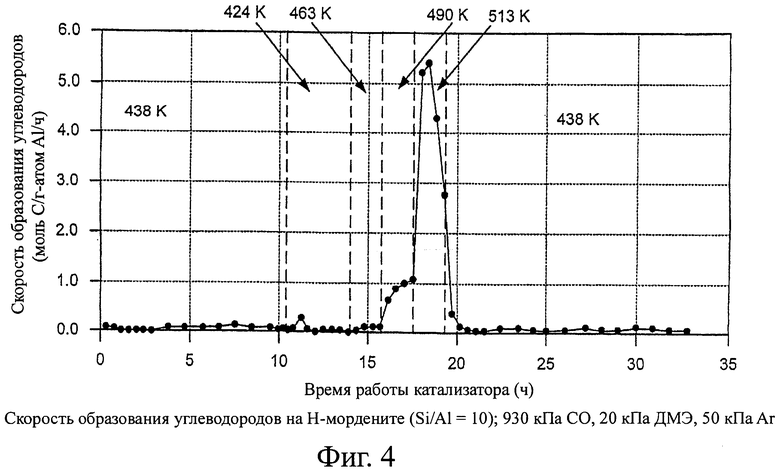
На фиг.4 изображены скорости образования углеводородов с использованием катализатора - Н-морденитного цеолита в способе согласно изобретению.
На фиг.5 приведены рассчитанные значения селективности по продуктам.
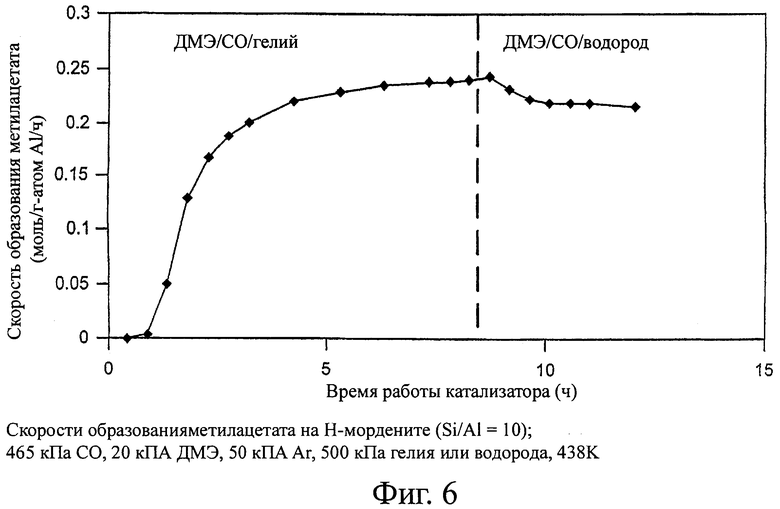
На фиг.6 изображены скорости образования метилацетата с использованием катализатора - Н-морденитного цеолита в присутствии (и в отсутствие) водорода в реакционной смеси.
Осуществление изобретения
Коротко, настоящее изобретение включает в себя способ получения продукта, содержащего низший сложный алкиловый эфир низшей алифатической карбоновой кислоты, который заключается во взаимодействии низшего простого алкилового эфира с монооксидом углерода в присутствии катализатора, содержащего морденит или ферриерит, в практически безводных условиях.
Более конкретно, в настоящем изобретении разработан способ получения метилацетата за счет взаимодействия диметилового эфира с монооксидом углерода в присутствии катализатора, содержащего морденит или ферриерит, в практически безводных условиях.
Один компонент сырья для этого способа содержит (главным образом) низший простой алкиловый эфир, то есть соединение, имеющее формулу
R1-О-R2,
в которой R1 и R2 независимо представляют собой C1-С6 алкильные группы или R1+R2 вместе образуют С2-С6 алкиленовую группу. Общее число атомов углерода в группах R1 и R2, если R1 и R2 представляют собой алкильные группы, составляет от 2 до 12, предпочтительно от 2 до 8, наиболее предпочтительно от 2 до 6. Предпочтительно, R1 и R2 являются алкильными группами с неразветвленной цепью, наиболее предпочтительны алкильные группы с неразветвленной цепью, причем в каждой имеется от 1 до 3 атомов углерода. Если R1 и R2 образуют алкиленовую группу (то есть, простой эфир является циклическим эфиром), то общее число атомов углерода предпочтительно составляет от 2 до 4.
Суммарную реакцию можно представить в виде
R1-O-R2+СО→R1COOR2.
Используемый здесь термин "алкил" означает насыщенную алифатическую или циклическую группу с неразветвленной или разветвленной цепью, или их сочетание, в которой имеется указанное число атомов углерода (например, С3 означает три атома углерода). Примеры ациклических алкильных групп включают такие группы, как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил и различные пентильные и гексильные изомеры. Примеры циклических алкильных групп включают циклопропил, циклобутил, циклопентил и циклогексил. Комбинации циклических и ациклических алкильных групп включают, например, циклопропилметил, циклобутилметил, циклопропилэтил и др.
Используемый здесь термин «алкилен» относится к насыщенным алифатическим группам, которые могут образовать две простые связи с другими группами. Эти группы включают, например, метилен (-СН2), этилен (-СН2СН2-) и гексилен [(-СН2-)6]. Хотя алкиленовые группы могут быть неразветвленными или разветвленными группами, в способах настоящего изобретения предпочтительными являются алкиленовые группы с неразветвленной цепью.
Если простой эфир является симметричным простым эфиром, например диметиловым эфиром, основным продуктом будет соответствующий сложный алкиловый эфир алифатической кислоты (в этом случае, метилацетат). Если простой эфир является несимметричным, то продукт будет содержать один или оба из двух возможных сложных эфиров карбоновой кислоты, в зависимости от того, какая из двух связей С-О расщепляется в этой реакции. Например, если сырье представляет собой метилэтиловый простой эфир (R1 = метил; R2 = этил), тогда продукт может содержать этилацетат и/или метилпропионат.
Второй компонент процесса представляет собой сырье, содержащее монооксид углерода. Это сырье может содержать практически чистый монооксид углерода (СО), например, монооксид углерода, который обычно предоставляется поставщиками промышленных газов, или сырье может содержать примеси, которые не мешают превращению простого алкилового эфира в желательный сложный эфир, такие как водород, азот, гелий, аргон, метан и/или диоксид углерода. Например, сырье может содержать монооксид углерода, который обычно получают в промышленности в результате удаления водорода из синтез-газа путем криогенного разделения и/или с использованием мембран.
Сырье - монооксид углерода может содержать значительные количества водорода. Например, это сырье может представлять собой общеизвестный синтез-газ, то есть любую смесь из числа газообразных смесей, которые применяются для синтеза множества органических или неорганических соединений, и в частности для синтеза аммиака. Синтез-газ обычно образуется при взаимодействии богатого углеродом вещества с водяным паром (в процессе, известном как паровой риформинг) или с паром и кислородом (процесс парциального окисления). Эти газы содержат главным образом монооксид углерода и водород, и, кроме того, могут содержать небольшие количества диоксида углерода и азота. Возможность использования синтез-газа обеспечивает другое преимущество изобретения по сравнению со способами получения уксусной кислоты из метанола, а именно вариант использования менее дорогого сырья монооксида углерода. В процессах превращения метанола в уксусную кислоту введение водорода в сырье может привести к получению нежелательных побочных продуктов гидрирования; поэтому сырье должно представлять собой монооксид углерода высокой чистоты.
Катализатор состоит из морденита или ферриерита, или смеси, или их комбинаций, либо в чистом виде (то есть, в кислотной форме, обычно обозначаемой как Н-морденит и Н-ферриерит), либо необязательно в ионообменной форме, или содержащих один или несколько металлов, таких как медь, никель, иридий, родий, платина, палладий или кобальт. Морденитные катализаторы, кроме атомов кремния и алюминия, могут содержать дополнительные элементы в цеолитном каркасе, особенно галлий и/или железо. Ферриеритные катализаторы, кроме атомов кремния и алюминия, могут содержать дополнительные элементы цеолитном каркасе, особенно бор, галлий и/или железо. Элементы, модифицирующие каркас, в катализаторах обоих типов могут быть введены в каркас с помощью любых традиционных приемов. Когда элемент, модифицирующий каркас, используется или в морденитном, или ферриеритном катализаторе, целесообразно, чтобы катализатор имел отношение диоксида кремния к оксиду элемента, модифицирующего каркас, приблизительно от 10:1 до 100:1. Введение Т-атома, где Т представляет собой В, Ga или Fe, в цеолиты с ферриеритной структурой описано в работах Melian-Cabrera и др., Catalysis Today 110 (2005) 255-263; Shawki и др., ЕР (заявка) №234766 (1987), Sulikowski и др., J. Chem. Soc., Chem. Comm., 1289 (1989); Borade и др., J. Chem. Soc, Chem.Comm., 2267 (1996); Jacob и др., Zeolites 430 (1993) том 13. Введение Т-атома, где Т-атом представляет собой Ga или Fe, в цеолиты с морденитной структурой раскрыто Smith, в документе WO 05/085162.
Морденит (обычно доступен как Na-морденит, NH4-морденит или Н-морденит) является представителем минералов класса алюмосиликатных цеолитов. Формула морденита в Na-форме обычно имеет вид Na(AlSi5O12).3H2O или (Na2,Ca,K2)Al2Si10O24.7H2O. Морденит доступен из ряда промышленных источников таких материалов. Ферриерит является другим представителем минералов класса алюмосиликатных цеолитов и также доступен в Na-, NH4- и Н-форме. Формула ферриерита в Na-форме обычно имеет вид Na0,8K0,2MgSi15A13O36.9H2O или (Mg,Na2,K2,Ca)3-5Mg[Al5-7Si27,5-31О72).18H2O. Он также доступен из ряда промышленных источников. Дополнительную информацию об этих материалах можно найти в Интернете на сайте International Zeolite Association, www.iza-online.org.
Поскольку процесс следует проводить практически в отсутствие воды, катализатор должен быть высушен до начала работы, например, путем предварительного нагревания до 400-500°С.
Обычно процесс проводится при температуре приблизительно равной 250°С или ниже, то есть при температуре приблизительно от 100 до 250°С, предпочтительно приблизительно от 150 до 180°С. Одним признаком способа является то, что неожиданно карбонилирование диметилового эфира (ДМЭ) в метилацетат с использованием катализаторов на основе морденитного цеолита и при практическом отсутствии воды может быть осуществлено с очень высокой селективностью при существенно более низкой температуре, чем цитированные в уровне техники в случае карбонилирования метанола. Кроме того, в таких условиях морденит практически не обладает активностью при карбонилировании метанола. Кроме того, температуру процесса поддерживают в указанном выше диапазоне для того, чтобы минимизировать дегидратацию метанола, который может присутствовать в любом количестве, с образованием углеводородов и воды, поскольку в присутствии воды процесс карбонилирования диметилового эфира в метилацетат сильно ингибируется.
Типичный диапазон рабочего давления составляет приблизительно от 1 до 100 бар, предпочтительное давление монооксида углерода больше чем 10 бар и давление диметилового эфира ниже 5 бар.
Способ осуществляют в практически безводных условиях, то есть практически в отсутствие воды. Установлено, что вода ингибирует карбонилирование диметилового эфира с образованием метилацетата. Это сопоставимо со способами уровня техники, в которых диметиловый эфир является компонентом сырья и в которых вода также подается в реактор. Таким образом, концентрацию воды поддерживают на возможно низком уровне для того, чтобы обеспечить наилучший режим протекания желательной реакции. С целью осуществления такого режима, реагенты - простой эфир и монооксид углерода - и катализатор предпочтительно высушивают до введения в этот способ.
Способ может быть осуществлен в непрерывном или в периодическом режиме, при этом обычно непрерывный режим является предпочтительным. Существенно, что процесс проводят в газовой фазе, причем реагенты вводятся или в жидком, или в газообразном состоянии и продукты выводят в виде газов. По желанию, продукты реакции в последующем можно охлаждать и конденсировать. Катализатор можно использовать или в неподвижном слое, или в флюидизированном слое. В рабочем режиме способа непрореагировавшие исходные материалы можно извлекать и рециркулировать в реактор. Полученный метилацетат можно извлекать и продавать как таковой, или, по желанию, его можно направлять на установки другого химического процесса. По желанию, весь продукт реакции можно направлять на технологическую установку химического превращения метилацетата и необязательно других компонентов в другие полезные продукты.
В одном предпочтительном варианте осуществления изобретения метилацетат извлекают из продуктов реакции и приводят в контакт с водой, для того, чтобы получить уксусную кислоту за счет процесса гидролиза. Альтернативно, весь продукт можно подавать на стадию гидролиза и после этого выделять уксусную кислоту из смеси. Стадия гидролиза может быть проведена в присутствии кислотного катализатора и может быть осуществлена как процесс реакционной дистилляции, который хорошо известен из уровня техники.
После разделения спиртов, полученных в реакторе гидролиза, они могут быть направлены в реактор дегидратации с целью получения простого эфира, который можно выделить из воды и рециркулировать в установку карбонилирования в качестве свежего сырья для процесса карбонилирования.
В другом варианте осуществления гидролиз полученного сложного эфира до спирта и карбоновой кислоты проводят путем инжекции воды в одну или несколько точек в слое катализатора, когда в результате карбонилирования образуется значительное количество сложного эфира. В результате такой инжекции воды превращение диметилового эфира в метилацетат практически прекращается и отпадает необходимость в отдельном реакторе гидролиза. Таким образом, морденитный или ферриеритный катализатор могут играть роль кислотного катализатора при гидролизе сложноэфирного продукта для того, чтобы получить карбоновую кислоту. Если реактор представляет собой аппарат с флюидизированным слоем, с обратным смешением, тогда реактор и катализатор необходимо будет тщательно высушивать, прежде чем снова использовать их в основном процессе. С другой стороны, если реактор представляет собой трубчатый реактор, с многоэтапным введением воды после основной реакционной зоны, то указанная осушка не является обязательной.
С использованием морденитного катализатора степень превращения может быть доведена до 100%, предпочтительно приблизительно от 10% до 100%, в зависимости от применяемых значений объемной скорости и давления реагентов. Показано, что селективность образования метилацетата является постоянной, причем значения составляют выше 99% при 165°С в течение 10 часов и более. При 190°С селективность по метилацетату сначала равна 96%, но уменьшается во время эксплуатации. Указанные результаты являются неожиданными при использовании морденита и при поддержании практически безводных условий, так как из уровня техники известно, что обычно морденит следует использовать для превращения метанола в уксусную кислоту при температурах существенно выше чем 250°С. При таких температурах также может происходить дезактивация катализатора карбонилирования метанола из-за образования углеводородов, которые могут блокировать поры и/или активные центры катализатора. Кроме того, как будет продемонстрировано в примерах, в экспериментах с другими цеолитами в аналогичных условиях, не наблюдается желаемая степень превращения и/или селективность как для морденита и ферриерита.
Более того, по сравнению со способами уровня техники, в продукте согласно изобретению имеется относительно немного бензина и/или других высших углеводородов. Часто, когда в качестве сырья используется метанол, протекает так называемая реакция "MTG" (метанол в бензин), в которой образуется нежелательно большое количество таких углеводородов. Образование метанола может происходить на ранних стадиях реакции; однако, этот процесс можно свести к минимуму путем предварительной обработки слоя катализатора диметиловым эфиром при обычных температурах процесса.
Следующие примеры приведены с целью иллюстрации изобретения. Однако эти примеры не предназначены для ограничения объема настоящего изобретения.
Общие методики
1) Получение катализатора
Промышленные образцы катализаторов получают в форме аммонийной соли или кислоты и предварительно обрабатывают их в токе сухого воздуха при 773 К в течение 3 часов.
2) Реакция карбонилирования диметилового эфира
Процесс карбонилирования диметилового эфира проводят в микрореакторе из нержавеющей стали в неподвижном слое, содержащем 0,15-0,5 г катализатора. Катализаторы активируют при 773 К в токе сухого воздуха в течение 2 часов, охлаждают до температуры реакции (150-240°С), продувают в токе сухого гелия и герметизируют на давление 10 бар до введения реагентов. Реакционная смесь состоит из 20 кПа диметилового эфира, 930 кПа монооксида углерода и 50 кПа аргона, который представляет собой внутренний стандарт (1 бар = 101 кПа). Все потоки на стадии предварительной обработки и реагенты сушат путем пропускания через слой гидрида кальция (0,5 г, реагент Aldrich), размещенный непосредственно до реактора. Для транспорта реагентов и продуктов использовались обогреваемые линии (температура 200-250°С). Непрерывный анализ газов проводился в хроматографе (Agilent 6890), оборудованном детекторами ионизации в пламени и детекторами теплопроводности, с соответствующими колонками с метилсилоксаном и Porapak® Q, соответственно.
3) Реакция карбонилирования диметилового эфира синтез-газом
Эксперименты с добавкой водорода проводили в проточном реакторе, описанном выше. Реакционная смесь состоит из 10 кПа диметилового эфира, 465 кПа монооксида углерода, 25 кПа аргона и 500 кПа гелия или водорода. Гелий в качестве инертного разбавителя заменяют водородом после того как установится стационарное состояние каталитической системы.
Эксперименты проводят с использованием описанной выше методики карбонилирования диметилового эфира на семи катализаторах в диапазоне температур 148-335°С, причем большинство опытов проведено при 150-240°С и давлении монооксида углерода 9,3 бар. Катализаторы включают морденит (H-MOR; Si/Al=10 и Si/Al=45), цеолит MFI (H-ZSM5; Si/Al=12), Y фожазит (H-Y; Si/Al=3) ферриерит (Н-FER; Si/Al=34) и аморфный алюмосиликат (Si/Al=6). Условия проведения экспериментов были следующими: общее давление 10 бар, суммарный поток=100 см3 (STP)/мин, сырье 2% ДМЭ/5% Ar/93% СО (пропущено через слой осушителя (0,5 г СаН2) до реактора при комнатной температуре) при постепенном повышении температуры между 144 и 335°С.
Эти эксперименты демонстрируют, что морденит и ферриерит существенно превосходят другие цеолитные катализаторы для процесса карбонилирования диметилового эфира. Скорости образования метилацетата показаны на фигуре 1. В условиях реакции скорость приблизительно при 165°С (нормализована на 1 атом А1) на HMOR была почти в 50 раз больше, чем на H-ZSM5 и более чем в 150 раз превышала скорость на H-Y. Ни на одном из трех цеолитов не наблюдалась дезактивация при температурах между 150 и 190°С. При повышенных температурах (~488 К) скорости образования метилацетата снижались во время работы, по-видимому, в результате образования значительного количества больших инертных остатков. Если этот процесс заходит достаточно глубоко, то активность катализаторов карбонилирования не возвращается на начальный уровень при повторном испытании при пониженных температурах (165-185°С).
На цеолите H-Y при температурах не менее 488 К в продуктах реакции содержится широкий ряд углеводородов, причем некоторые из них выходят вместе с метилацетатом и метанолом на хроматограмме газовой пробы. Поэтому при этих температурах приведенные скорости образования метилацетата и метанола на H-Y могут быть немного завышены по сравнению с реальными скоростями образования.
На фигурах 2 и 3 показаны скорости образования уксусной кислоты и метанола на H-MOR. Уксусная кислота образуется за счет гидролиза метилацетата или карбонилирования метанола при температурах ≥490 К на H-MOR. Метанол не может образоваться из диметилового эфира в отсутствие воды, которая, однако, может образоваться как побочный продукт превращения метанола в бензин. Начальные скорости образования метанола соответствуют или взаимодействию с остаточной водой, или с водой, образовавшейся из гидроксильных групп, оставшихся в цеолитах после предварительной обработки (сушки) катализатора при 500°С. Поэтому, когда выше 463 К наблюдаются заметные значения стационарной скорости образования метанола, то предположительно образуются углеводороды, даже если они не детектируются в отходящем потоке методом газовой хроматографии. Скорости образования углеводородов (рассчитаны по превращению диметилового эфира в продукты, отличающиеся от метилацетата, уксусной кислоты или метанола) на H-MOR показаны на фигуре 4. На других цеолитах не наблюдается образование уксусной кислоты. Значения селективности по продуктам показаны на фигуре 5.
Кроме того, были испытаны H-MOR с низким содержанием алюминия (Si/Al=45) и аморфный алюмосиликат (Si/Al=6) в широком диапазоне температур (160-335°С).
Скорости карбонилирования (на атом Al) на H-MOR с низким содержанием алюминия были приблизительно в 10 раз ниже скорости на H-MOR с высоким содержанием алюминия (Si/Al=10). Пониженная активность карбонилирования (на атом Al) на этом материале не является совершенно неожиданной, поскольку для него наблюдается повышенная скорость образования углеводородов. В процессе превращения метанола (и ДМЭ) в углеводороды вода образуется в стехиометрическом количестве; а исследования авторов изобретения показали, что для активности в процессе карбонилирования необходимы безводные условия. Однако при протекании конкурирующих реакций с образованием углеводородов безводные условия невозможны.
Для сравнения также был испытан аморфный алюмосиликат (площадь поверхности равна 440 м2/г). Небольшая активность карбонилирования для алюмосиликата наблюдается, начиная с 259°С. При этой температуре скорости карбонилирования на этом материале на 3-4 порядка величины ниже, чем на H-MOR (Si/Al=10).
Результаты описанных выше испытаний обобщены в приведенной ниже таблице 1.
0,425 r
0,446 г
0,297 г
0,153 г
0,427 г
0,5476 г
Эксперименты с синтез-газом
Н-Морденит был испытан в процессе карбонилирования диметилового эфира в присутствии водорода. На скорости карбонилирования практически не влияет наличие водорода в количестве до половины от общего объема реагентов (фигура 6). Синтез-газ с различными соотношениями водород:монооксид углерода можно использовать, без снижения скорости процесса карбонилирования диметилового эфира.
Введение каркасных металлов
Из аммонийной формы был получен (GaAl/Si)NH4-(SiO2/Ga2O3 ~ 39.2 и SiO2/Al2O3 ~ 19.4) и испытан в процессе карбонилирования ДМЭ в следующих условиях. Образец обрабатывают в токе сухого воздуха (3,33 см3с-1) при 773 К (скорость нагрева 0,0167 К с-1) в течение 3 часов, чтобы превратить аммонийную форму в H+-форму. Скорости карбонилирования ДМЭ измеряли в реакторе из нержавеющей стали с неподвижным слоем катализатора (внутренний и наружный диаметры равны 8,1 и 9,5 мм), который помещен внутри трехсекционной печи электросопротивления. Образец катализатора (0,5 г, диаметр частиц 185-250 мкм) нагревают в токе сухого воздуха (около 1,67 см3с-1г-1, сорт Zero, фирма Praxair) в течение 3 часов при 773 К (скорость нагрева 0,0167 К с-1) до охлаждения в токе гелия (~3,33 см3с-1г-1, высшей чистоты, фирма Praxair) до температуры реакции (438 К), и затем подают смесь 2% ДМЭ/5% Ar/93% СО (99,5% ДМЭ, Praxair; высшей чистоты Ar/CO, Praxair).
Результаты испытаний катализаторов сопоставлены в таблице 2 с данными для Н-морденита (H-MOR) (от фирмы Zeolyst), испытанного в таких же условиях.
Соотношение Al/Si
Проведена серия экспериментов с использованием катализаторов с различными соотношениями Al/Si. В таблице 3 приведен перечень образцов H-MOR и соответствующие значения скорости [моль/г-атом Al/час] и выхода продукта за один проход [г МеОАс/кг цеолита/час]. Обычно используют образец (0,5 г) при 438 К при общем давлении 10 атм (20 кПа ДМЭ, 50 кПа Ar, 930 кПа СО) и скорости потока 1,67 см3/с. На этих образцах наблюдаются вполне удовлетворительные скорости в единицах «моль/кг-1 час-1». Эти результаты демонстрируют, что производительность массы катализатора (и предположительно объема) может быть увеличена за счет изменения соотношения Si к Al.
Все публикации и патентные заявки, цитированные в настоящем описании, введены в изобретение путем отсылки, как если бы каждую отдельную публикацию или патентную заявку ввели в изобретение в качестве конкретной отсылки.
Хотя настоящее изобретение было описано в некоторых деталях с помощью иллюстраций и примеров с целью ясности понимания, специалисты в этой области техники легко могут признать, что, в свете рекомендаций настоящего изобретения могут быть выполнены определенные изменения и модификации без отклонения от смысла или объема прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КАРБОНИЛИРОВАНИЯ АЛИФАТИЧЕСКИХ СПИРТОВ И/ИЛИ ИХ РЕАКЦИОННОСПОСОБНЫХ ПРОИЗВОДНЫХ | 2006 |
|
RU2458909C2 |
| СПОСОБ КАРБОНИЛИРОВАНИЯ ДИМЕТИЛОВОГО ЭФИРА | 2008 |
|
RU2469018C2 |
| СПОСОБ КАРБОНИЛИРОВАНИЯ ДЛЯ ПОЛУЧЕНИЯ МЕТИЛАЦЕТАТА | 2017 |
|
RU2739320C2 |
| СПОСОБ КАРБОНИЛИРОВАНИЯ ДИМЕТИЛОВОГО ЭФИРА | 2008 |
|
RU2478609C2 |
| СПОСОБ КАРБОНИЛИРОВАНИЯ ДИМЕТИЛОВОГО ЭФИРА | 2008 |
|
RU2473535C2 |
| СЕЛЕКТИВНОЕ ДЕАЛЮМИНИРОВАНИЕ ЦЕОЛИТОВ СТРУКТУРНОГО ТИПА МОРДЕНИТА | 2009 |
|
RU2515729C2 |
| СПОСОБ КАРБОНИЛИРОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ПРЕДВАРИТЕЛЬНО ОБРАБОТАННОГО ЦЕОЛИТНОГО КАТАЛИЗАТОРА | 2016 |
|
RU2734824C2 |
| СПОСОБ КАРБОНИЛИРОВАНИЯ ДЛЯ ПОЛУЧЕНИЯ МЕТИЛАЦЕТАТА | 2009 |
|
RU2522431C2 |
| СПОСОБ ПОЛУЧЕНИЯ АКРИЛОВОЙ КИСЛОТЫ И МЕТИЛАКРИЛАТА | 2016 |
|
RU2712277C1 |
| СПОСОБ ОБРАБОТКИ ЦЕОЛИТНЫХ КАТАЛИЗАТОРОВ | 2014 |
|
RU2689390C2 |

Изобретение относится к способу получения низшего сложного алкилового эфира низшей алифатической карбоновой кислоты, имеющего формулу R1-COO-R2 заключающемуся во взаимодействии предварительно высушенного низшего простого алкилового эфира, имеющего формулу R1-O-R2, в которой R1 и R2 независимо представляют собой C1-С6 алкильные группы, при условии, что суммарное число атомов углерода в группах R1 и R2 составляет от 2 до 12, или R1 и R2 вместе образуют С2-С6 алкиленовую группу, с сырьем, содержащим монооксид углерода, в присутствии катализатора, содержащего морденит и/или ферриерит в безводных условиях. Также изобретение относится к способу получения карбоновых кислот гидролизом получаемых обозначенным выше способом сложных эфиров. Применение настоящего способа позволяет повысить выход и селективность по целевому продукту. 2 н. и 27 з.п. ф-лы, 3 табл., 6 ил.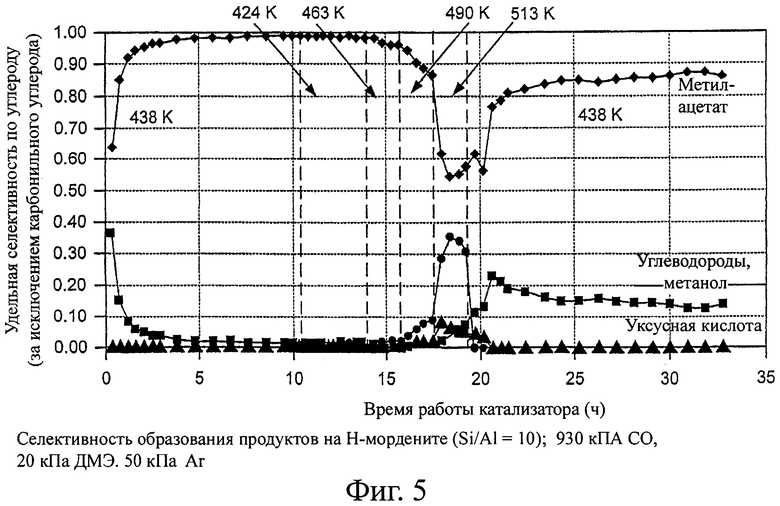
1. Способ получения низшего сложного алкилового эфира низшей алифатической карбоновой кислоты, имеющего формулу
R1-COO-R2,
заключающийся во взаимодействии предварительно высушенного низшего простого алкилового эфира, имеющего формулу
R1-O-R2,
в которой R1 и R2 независимо представляют собой C1-C6 алкильные группы, при условии, что суммарное число атомов углерода в группах R1 и R2 составляет от 2 до 12, или R1 и R2 вместе образуют С2-С6 алкиленовую группу с сырьем, содержащим монооксид углерода, в присутствии катализатора, содержащего морденит и/или ферриерит в безводных условиях.
2. Способ по п.1, в котором сложный эфир представляет собой метилацетат, и простой эфир означает диметиловый эфир.
3. Способ по п.1, в котором катализатор является Н-морденитом.
4. Способ по п.1, в котором температура составляет приблизительно от 100 до 250°С.
5. Способ по п.1, в котором температура составляет приблизительно от 150 до 180°С.
6. Способ по п.1, в котором катализатор находится в неподвижном слое.
7. Способ по п.1, в котором катализатор находится во флюидизированном слое.
8. Способ по п.1, который является непрерывным способом.
9. Способ по п.1, который является периодическим способом.
10. Способ по п.1, в котором сырье, содержащее монооксид углерода, дополнительно включает в себя водород.
11. Способ по п.10, в котором сырье, содержащее монооксид углерода, включает в себя синтез-газ.
12. Способ по п.1, в котором R1 и R2 означают C1-C6 алкильные группы.
13. Способ по п.1, в котором R1 и R2 представляют собой С1-С6 алкильные группы с неразветвленной цепочкой.
14. Способ по п.1, в котором R1 и R2 представляют собой алкильные группы с неразветвленной цепочкой, имеющие от 1 до 3 атомов углерода.
15. Способ по п.12, в котором алкильные группы содержат в сумме от 2 до 8 атомов углерода.
16. Способ по п.15, в котором алкильные группы представляют собой алкильные группы с неразветвленной цепью.
17. Способ по п.12, в котором алкильные группы содержат в сумме от 2 до 6 атомов углерода.
18. Способ по п.1, в котором R1 и R2 вместе образуют С2-С6 алкиленовую группу.
19. Способ по п.1, в котором R1 и R2 вместе образуют С2-С6 алкиленовую группу с неразветвленной цепью.
20. Способ по п.1, в котором R1 и R2 вместе образуют С2-С4 алкиленовую группу.
21. Способ по п.1, в котором катализатор содержит один или несколько дополнительных металлов в каркасе.
22. Способ по п.21, в котором металлы в каркасе выбирают из галлия, бора и железа.
23. Способ по п.22, в котором металл в каркасе представляет собой галлий.
24. Способ по п.21, в котором катализатор включает морденит, и металл в каркасе выбирают из галлия и/или бора.
25. Способ по п.21, в котором катализатор включает ферриерит, и металл в каркасе выбирают из галлия, бора и/или железа.
26. Способ получения карбоновой кислоты, включающий гидролиз низшего сложного алкилового эфира низшей алифатической карбоновой кислоты, имеющего формулу
R1-COO-R2,
полученного взаимодействием предварительно высушенного низшего простого алкилового эфира, имеющего формулу
R1-O-R2,
где R1 и R2 независимо представляют собой C1-C6 алкильные группы при условии, что суммарное число атомов углерода в группах R1 и R2 составляет от 2 до 12, или R1 и R2 вместе образуют С2-С6 алкиленовую группу с сырьем, содержащим монооксид углерода, в присутствии катализатора, содержащего морденит и/или ферриерит в безводных условиях.
27. Способ по п.26, в котором карбоновая кислота представляет собой уксусную кислоту и сложный эфир представляет собой метилацетат.
28. Способ по п.26 или 27, в котором гидролиз осуществляют в другом реакторе, отдельно от процесса получения сложного эфира.
29. Способ по п.26 или 27, в котором гидролиз осуществляют в том же самом реакторе, в котором получают сложный эфир.
| RU 5420345 A, 30.05.1995 | |||
| US 4612387 A, 16.09.1986 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЭФИРА МУРАВЬИНОЙ КИСЛОТЫ ИЛИ МЕТАНОЛА И КАТАЛИЗАТОР ЭТОГО СПОСОБА | 2001 |
|
RU2231521C2 |
Авторы
Даты
2011-02-10—Публикация
2006-05-03—Подача