Изобретение относится к медицине, а именно к трансфузиологии и интенсивной терапии, и может быть использовано для эффективного удаления из плазмы крови макромолекул (белков, сложных белковых комплексов, вирусов и др.) при лечении аутоиммунных, метаболических и иных заболеваний.
В последние годы в клиническую практику все шире внедряются способы и устройства экстракорпоральной обработки крови, для селективного удаления из нее компонентов, играющих основную роль в патогенезе различных острых и хронических заболеваний. Одним из таких способов является каскадная плазмофильтрация. Известна система для каскадной плазмофильтрации (Патент США №4839055, опубл. 13.06.1989), содержащая насос подачи крови, плазмофильтр, насос подачи плазмы, фракционатор плазмы, резервуар с замещающей жидкостью и насос подачи замещающей жидкости.
Недостатком системы является отсутствие возможности регенерации (промывки) фракционатора плазмы. Фракционатор в процессе проведения плазмофильтрации может заблокироваться макромолекулами, что приводит к преждевременному прекращению процедуры. По мере блокирования пор фракционатора макромолекулами снижается селективность удаления патологических макромолекул и повышаются потери полезных компонентов плазмы крови, становится необходимым использование замещающей жидкости (раствора альбумина или компонентов донорской плазмы). Частично проблема может быть решена заменой фракционатора плазмы или параллельным подключением двух фракционаторов (Патент Японии, публикация SHO 63-28626).
Наиболее близкими к заявляемым решениям являются способ и устройство каскадной фильтрации (инструкция к аппарату CF 100 швейцарской фирмы Infomed, www.infomed.biz), при котором плазму перфузируют через мембрану капилляров фракционатора плазмы. При этом выходной конец капилляров закрыт, в результате чего производят «тупиковую» фильтрацию. Макромолекулы остаются во внутреннем пространстве фракционатора - внутри капилляров, а остальную часть плазмы фильтруют через мембрану капилляров во внешнее пространство и возвращают пациенту. При заполнении капилляров производят их периодическую промывку путем перфузии через них изотоничекого раствора. При этом открывают выходной конец капилляров и закрывают отток профильтровавшейся плазмы без макромолекул.
Устройство для каскадной плазмофильтрации CF 100 предназначено для перфузии плазмы крови, полученной на сепараторах крови (аппаратах для плазмафереза) любого типа (центрифужного или мембранного) через фракционатор плазмы с целью эффективного удаления из нее макромолекл (иммуноглобулинов, фибриногена, липопротеидов, иммунных комплексов и др.). Устройство состоит из емкости для плазмы, емкости для изотонического раствора натрия хлорида, отдельно ветвей подачи плазмы и изотонического раствора, каждая из которых снабжена пережимом, тройника, ветви подачи плазмы и изотонического раствора во внутреннее пространство фракционатора с насосным сегментом, соединенным с насосом подачи плазмы и изотонического раствора, фракционатора плазмы, ветви отбора профильтровавшейся плазмы из внешнего пространства фракционатора с пережимом и ветвью к датчику давления во внешнем пространстве фракционатора плазмы, ветви слива концентрата и промывочного раствора из внутреннего пространства фракционатора с пережимом и ветвью к датчику давления во внутреннем пространстве фракционатора плазмы, емкости для сбора концентрата и промывочного изотонического раствора. После сборки и заполнения жидкостью экстракорпорального контура устройство подключают к контуру сепаратора крови. После начала получения плазмы на сепараторе крови и накопления ее в достаточном количестве в емкости для плазмы включают насос, который подает плазму через соответствующие ветви на вход внутреннего пространства фракционатора плазмы со скоростью от 15 до 80 мл/мин. При этом плазму фильтруют в периферийную часть фракционатора и далее через соответствующую ветвь реинфузируют пациенту (напрямую или через сепаратор крови), а концентрат макромолекул остается во внутреннем пространстве фракционатора. Датчики давления контролируют степень заполнения центральной части внутреннего пространства фракционатора плазмы макромолекулами и при достижении заданного уровня давления (100-250 мм рт.ст.) осуществляют промывку внутреннего пространства фракционатора 50-250 мл изотонического раствора, увеличивая при этом скорость перфузии насоса до 100-250 мл/мин. После окончания промывки возобновляют перфузию плазмы. Для этого скорость перфузии насоса уменьшают до рабочих величин. Выше перечисленную последовательность действий повторяют несколько раз.
Однако в процессе использования данных способа и устройства было установлено, что по мере заполнения капилляров макромолекулами постепенно происходит ухудшение фильтрационных свойств мембраны, увеличиваются потери полезных компонентов плазмы крови и, тем самым, снижается селективность удаления макромолекул. Это становится заметно, когда давление перед фракционатором плазмы превышает 150 мм рт.ст. и особенно значимо у больных пациентов с повышенным содержанием в крови сложных белковых комплексов, таких как липопротеиды очень низкой плотности, с высоким уровнем триглицеридов и присутствием в плазме крови хиломикронов. При промывке осуществляется удаление концентрата макромолекул из капилляров, но фильтрационные свойства мембраны при этом полностью не восстанавливаются. Часть пор остается блокированной макромолекулами. При возобновлении фильтрации наблюдается быстрый рост давления перед фракционатором и постепенное учащение промывок. Потери полезных компонентов плазмы крови происходят при каждой промывке фракционатора, поэтому частые промывки также снижают селективность удаления макромолекул, ограничивают объем процедуры (в ряде случаев приходится ее досрочно прекращать) и/или делают необходимым использование для восполнения потерь полезных компонентов донорских трансфузионных сред и/или препаратов (альбумина и др.).
Задачей изобретения является создание способа и устройства для каскадной плазмофильтрации, характеризующихся отсутствием указанных выше недостатков, обеспечивающих проведение процедуры независимо от состава и свойств плазмы больного.
Технический результат заключается в возможности проведения процедуры каскадной плазмофильтрации при любых свойствах плазмы крови пациента, снижении потерь полезных компонентов плазмы крови, уменьшении потребности в растворе для промывки фракционатора плазмы.
Решение поставленной задачи достигается тем, что способ проведения каскадной плазмофильтрации включает разделение плазмы на фильтрат и концентрат с использованием фракционатора, имеющего внутреннее и внешнее пространство для концентрата и фильтрата, соответственно, в процессе разделения плазмы измеряют величину давления на входе фракционатора, при превышении уровня давления 100-150 мм рт.ст. процесс разделения продолжают с периодическим или одновременным отбором концентрата из внутреннего пространства фракционатора для последующего удаления, при этом отбор концентрата осуществляют со скоростью 5-20% от скорости перфузии плазмы до достижения уровня давления на входе фракционатора 150-250 мм рт.ст., при достижении максимального значения скорости отбора концентрата процесс разделения плазмы прекращают и осуществляют промывку фракционатора через внутреннее или внешнее пространство, после чего разделение плазмы на фильтрат и концентрат возобновляют. Скорость отбора концентрата из внутреннего пространства фракционатора увеличивают при увеличении давления перед фракционатором. Промывку фракционатора осуществляют прямоточным пропусканием изотонического раствора через внутреннее пространство фракционатора, при этом изотонический раствор берут в объеме, не меньше 2-х объемов внутреннего пространства фракционатора и пропускают через внутреннее пространство фракционатора с увеличением скорости до 100-200 мл/мин. Дополнительно может быть использована противоточная промывка пор мембраны капилляров фракционатора, для чего предварительно вытесняют профильтровавшуюся плазму из внешнего пространства фракционатора изотоническим раствором в объеме не меньше объема внешнего пространства фракционатора, затем промывают поры мембраны капилляров путем перфузии через нее противотоком изотонического раствора в объеме, равном 1-3 объемам внешнего пространства фракционатора. Противоточную промывку фракционатора осуществляют после проведения прямоточной промывки при снижении эффективности получения перфузированной плазмы за очередной цикл перфузии, выраженной в незначительном снижении давления перед фракционатором плазмы после прямоточной промывки, меньше чем на 100 мм рт.ст., быстром его нарастании более 200 мм рт.ст. при возобновлении перфузии плазмы, при котором объем вновь профильтрованной до очередной промывки плазмы прогрессивно уменьшается и не достигает 500 мл.
Решение поставленной задачи достигается также тем, что устройство для проведения каскадной плазмофильтрации, включающее фракционатор, имеющий, по крайней мере, один вход и два выхода, снабженный мембранным фильтром, разделяющим внутренний объем фракционатора на внутреннее и внешнее пространство для концентрата и фильтрата, соответственно, при этом вход и один из выходов предназначены для соединения с внутренним пространством фракционатора, а второй выход - с его внешним пространством, а также емкость для плазмы, емкость для промывочного изотонического раствора, соединенные через тройник с ветвью подачи плазмы или промывочного изотонического раствора на вход фракционатора, емкость для сбора промывочной жидкости и/или концентрата макромолекул плазмы, соединенную ветвью с выходом из внутреннего пространства фракционатора, насосный сегмент, установленный в ветви подачи плазмы или промывочного изотонического раствора на вход фракционатора, пережимы, установленные на ветвях, соединенных с выходами из фракционатора, а также выходами из емкости для плазмы и емкости для промывочного изотонического раствора согласно техническому решению снабжено воздушной ловушкой и датчиком давления, установленными в ветви перед входом в фракционатор, который имеет дополнительный вход, предназначенный для соединения с его внешним пространством, а также первой дополнительной ветвью, снабженной пережимом, один конец которой соединен с дополнительным входом фракционатора, а противоположный конец через тройник подключен к ветви на участке, соединяющем выход воздушной ловушки со входом, предназначенным для соединения с внутренним пространством фракционатора. Кроме того, устройство может быть снабжено капельницами, установленными на выходах из емкости для плазмы и емкости для промывочного изотонического раствора, выполненными с возможностью визуального или автоматического контроля уровня жидкости. Устройство снабжено второй дополнительной ветвью, содержащей дополнительный насосный сегмент, подключенной посредством двух тройников параллельно к ветви, соединяющей фракционатор с емкостью для сбора промывочной жидкости и/или концентрата макромолекул плазмы, при этом пережим на последней ветви расположен на участке между тройниками с возможностью переключения режимов слива концентрата и промывочного раствора из внутреннего пространства фракционатора.
Таким образом, для решения поставленной задачи был предложен способ, состоящий из 4-х сменяющих друг друга режимов и устройство для реализации данного способа.
Первый режим. Начало процедуры осуществляют в «тупиковом» режиме аналогично началу работы на аппарате SF-100. При достижении целевого давления перед фильтром (100-150 мм рт.ст.) переходят во второй режим.
Второй режим. Осуществляют постоянный принудительный отбор насосом концентрата макромолекул из внутреннего пространства фракционатора. При этом осуществляют подбор скорости отбора, обеспечивающей стабильное перфузионное целевое (100-150 мм рт.ст.) давление перед фракционатором плазмы. Для реализации данного режима скорость отбора концентрата не должна превышать 20% от скорости перфузии плазмы, т.к. в противном случае увеличивается потеря полезных компонентов плазмы. Если при достижении предельно возможной скорости отбора концентрата продолжается рост давления перед фракционатором плазмы и оно превышает 200 мм рт.ст., то переходят к третьему режиму работы.
Третий режим - чередование «тупиковой» фильтрации и промывок внутреннего пространства фракционатора. Проведение процедуры в этом режиме аналогично работе на аппарате SF-100. Во время «тупиковой» фильтрации при превышении целевого перфузионного давления перед фракционатором плазмы (150-250 мм рт.ст.) прекращают подачу плазмы. При этом в начале проводят вытеснение плазмы изотоническим раствором из магистрали ее подачи во фракционатор и реинфузию пациенту профильтровавшейся части плазмы в объеме не меньше объема магистрали подачи плазмы от тройника ветви изотонического раствора до вводного штуцера фракционатора. Затем проводят промывку внутреннего пространства фракционатора путем подачи изотонического раствора в объеме 100-250 мл на его вход и слива промывной жидкости на выходе. После промывки прекращают подачу промывочного раствора и возвращаются к перфузии плазмы, предварительно вытеснив изотонический раствор из фракционатора. Далее фильтрацию плазмы чередуют с промывками фракционатора плазмы. Если промывки внутреннего пространства фракционатора не приводят к восстановлению его фильтрационных свойств: (т.е происходит блокировка пор мембраны, а не внутреннего пространства фракционатора) переходят к четвертому режиму. Свидетельством блокирования пор мембраны являются ситуации, когда:
- давление перед фракционатором плазмы, после промывки, в начале очередного цикла перфузии превышает 100 мм рт.ст.;
- давление перед фракционатором плазмы после промывки снижается незначительно, меньше чем на 100 мм рт.ст.,
- давление перед фракционатором плазмы после промывки вновь быстро нарастает до 200 мм рт.ст. и объем перфузированной плазмы за очередной цикл перфузии не достигает 500 мл.
Четвертый режим - чередование «тупиковой» фильтрации с противоточной промывкой пор мембраны фракционатора. При этом отмывающий изотонический солевой раствор подают не на вход фракционатора плазмы (т.е. не во внутреннее пространство), а на второй выход внешнего пространства (т.е. снаружи капилляров). При этом в начале проводят вытеснение из внешнего пространства фракционатора и реинфузию пациенту профильтровавшейся части плазмы в объеме не меньше объема внешнего пространства фракционатора, а затем проводят перфузию изотонического раствора через мембрану во внутреннее пространство и удаление его вместе с концентратом через выходное отверстие фракционатора плазмы. При этом практически полностью восстанавливаются свойства мембраны. После промывки прекращают подачу промывочного раствора и возвращаются к перфузии плазмы. Далее фильтрацию плазмы чередуют с промывками фракционатора плазмы.
Достоинством первого режима является простота, недостатком - короткое время его возможного использования, т.к. после перфузии 500-1000 мл плазмы давление обычно достигает 150 мм рт.ст. и увеличивается потеря полезных компонентов плазмы крови. Переключение на второй режим позволяет продолжить плазмофильтрацию. При этом несколько увеличивается потеря полезных компонентов плазмы крови. У ряда больных, несмотря на переход на второй режим происходит прогрессивное заполнение внутреннего пространства фракционатора. Обычно это наблюдается после перфузии еще 500-1000 мл плазмы. Частично восстановить свойства фракционатора плазмы можно промыванием его внутреннего пространства (режим 3). При этом по сравнению с режимом 2 еще несколько увеличивается потеря полезных компонентов плазмы крови (каждая промывка примерно соответствует потере 100 мл плазмы) и увеличивается количество изотонического раствора инфузируемого пациенту при промывке. Возможный объем плазмофильтрации в этом режиме составляет 1000-2000 мл. В ряде случаев (например, при высоком уровне триглицеридов плазмы крови) наблюдается забивание пор мембраны капиллярных волокон и режим 3 уже не способен обеспечить эффективную фильтрацию плазмы. Режим 4 обеспечивает гарантируемую промывку пор мембраны и восстановление работы фракционатора плазмы. Это наиболее сложный режим. Так как промывка происходит противотоком через внешнее пространство фракционатора, имеющее достаточно большой объем, при этом увеличивается потеря полезных компонентов плазмы крови и количество инфузируемого пациенту изотонического раствора. Обычно это режим необходим у больных с выраженной гипертриглицеридемией во второй половине процедуры.
Добавление второго режима приводит к уменьшению числа промывок и отсрочивает переход к третьему режиму. Добавление четвертого режима позволяет за счет противоточной промывки практически полностью освободить от макромолекул поры мембраны и практически полностью восстановить ее фильтрационные свойства. Поскольку при такой промывке увеличиваются потери полезных компонентов плазмы крови, использование ее рекомендовано во второй части процедуры.
Последовательная смена режимов позволяет максимально использовать их преимущества и минимизировать недостатки, что обеспечивает высокую селективность удаления целевых компонентов, снижает потери полезных компонентов плазмы крови, делает возможным проведение процедуры при любых свойствах плазмы крови пациента.
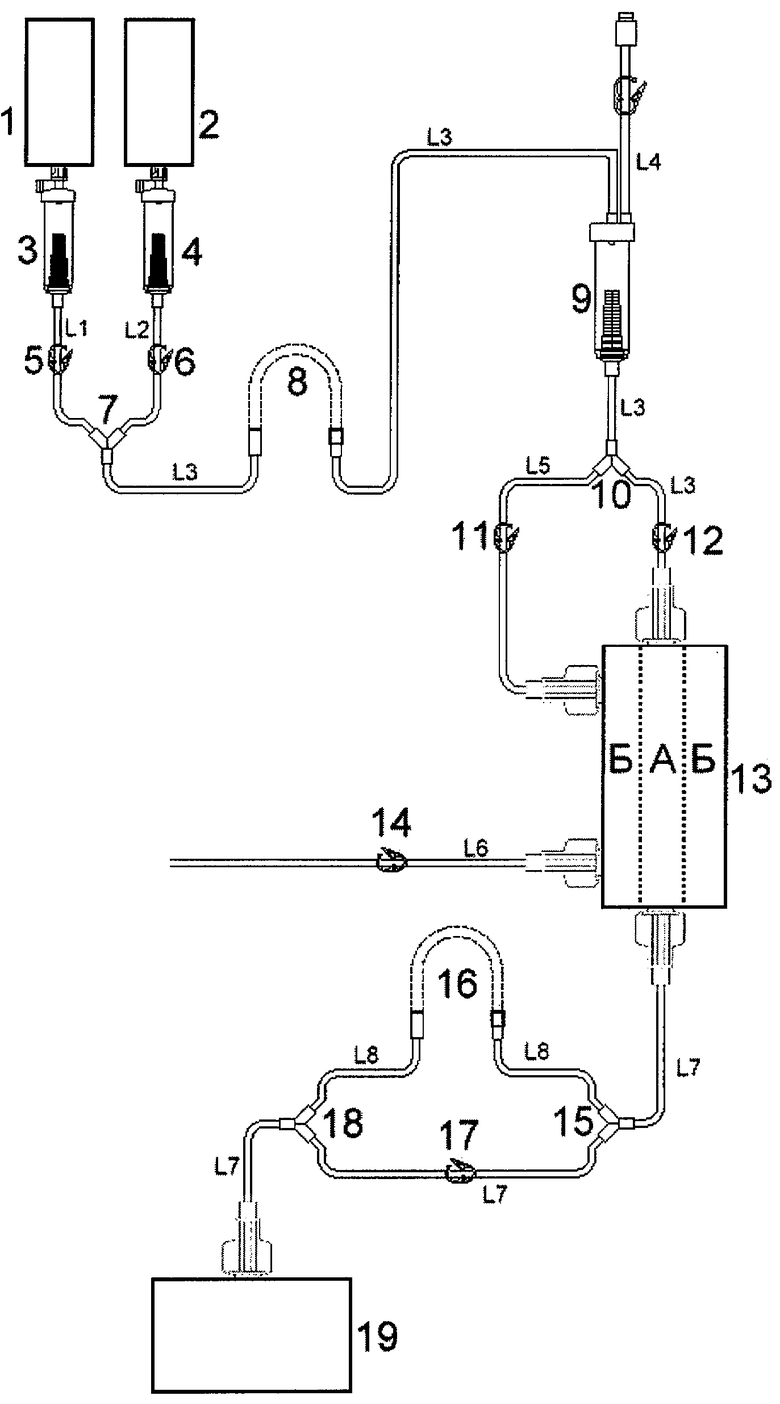
Изобретение поясняется чертежом, на котором представлена схема заявляемого устройства. Позициями на чертеже обозначены: 1 - емкость для плазмы; 2 - емкость для изотонического раствора (натрия хлорида); 3, 4 - капельницы (уровень жидкости может определяться визуально или автоматически аппаратом); 5, 6, 11, 12, 14, 17 - пережимы (могут быть ручными, являющимися принадлежностью магистрали, либо автоматическими, являющимися составной частью аппарата); 7, 10, 15, 18 - тройники; 8 - насосный сегмент насоса подачи плазмы и изотонического раствора; 9 - воздушная ловушка; 13 - фракционатор плазмы; 16 - насосный сегмент насоса отбора концентрата; 19 - емкость для сбора концентрата и промывочного изотонического раствора. Буквами обозначены: А - внутреннее пространство фракционатора; Б - внешнее пространство фракционатора, буквой L с цифровыми индексами обозначены ветви магистрали: L1 - ветвь подачи плазмы; L2 - ветвь подачи изотонического раствора; L3 - ветвь подачи плазмы и изотонического раствора во внутреннее пространство фракционатора; L4 - ветвь к датчику давления; L5 - ветвь подачи изотонического раствора во внешнее пространство фракционатора для противоточной промывки мембраны, L6 - ветвь отбора профильтрованной плазмы из внешнего пространства фракционатора, L7 - ветвь слива концентрата и промывочного раствора из внутреннего пространства фракционатора, L8 - ветвь дозированного отбора концентрата из внутреннего пространства фракционатора.
Устройство состоит из емкости для плазмы 1, емкости для изотонического раствора 2, которые через ветви подачи плазмы L1, изотонического раствора L2, содержащие капельницы 3 и 4 для визуального или автоматического контроля уровня жидкости и тройник 7 соединены с ветвью L3 подачи плазмы и изотонического раствора во внутреннее пространство фракционатора. Ветвь L3 имеет в своем составе насосный сегмент насоса подачи плазмы и изотонического раствора 8, предназначенного для перфузии плазмы (промывочного изотонического раствора) к фракционатору 13, воздушную ловушку 9 для предотвращения попадания воздуха во фракционатор 13, тройник 10, соединяющий ее с ветвью L5 подачи изотонического раствора во внешнее пространство фракционатора для противоточной промывки мембраны. Фракционатор 13 содержит несколько сотен капилляров, стенки которых представляют собой полупроницаемые мембраны с размером пор от 1 до 100 нм. Мембраны капилляров делят внутренний объем фракционатора на внешнее и внутреннее пространство. Фракционатор имеет два входа и два выхода: по одному входу и выходу, предназначенными для соединения с внутренним и внешним пространством фракционатора, соответственно. Ветвь L3 соединена со входом внутреннего пространства фракционатора 13, а ветвь L5 - со входом внешнего пространства фракционатора 13. Зажимы 5 и 6 обеспечивают попеременную подачу во фракционатор 13 плазмы или промывочного изотонического раствора. Зажимы 11 и 12 обеспечивают попеременную подачу изотонического промывочного раствора во внутреннее или внешнее пространство фракционатора 13 для его поточной или противоточной промывки соответственно. Воздушная ловушка 9 имеет отвод - ветвь к датчику давления L4, позволяющему мониторировать давление на входе во фракционатор 13. Уровень давления отражает степень блокирования пор мембраны капилляров и самих капилляров фракционатора макромолекулами. В зависимости от уровня давления определяется необходимость промывки фракционатора 13. Выходной конец внешнего пространства фракционатора 13 соединен с ветвью L6 отбора профильтровавшейся плазмы из внешнего пространства фракционатора, обеспечивающей реинфузию очищенной плазмы пациенту напрямую или через сепаратор крови. Имеющийся на ветви L6 зажим 14 перекрывается во время промывки фракционатора 13 и препятствует попаданию избыточного количества промывочного изотонического раствора пациенту. Выходной конец внутреннего пространства фракционатора 13 обеспечивает отбор (слив) концентрата макромолекул или промывочного изотонического раствора. Он соединен ветвью L7 слива концентрата и промывочного раствора из внутреннего пространства фракционатора с емкостью для сбора концентрата и промывочного изотонического раствора 19. Тройники 15 и 18 соединяют ветвь L7 с ветвью L8 дозированного отбора концентрата из внутреннего пространства фракционатора. Ветвь L8 имеет насосный сегмент 16 насоса отбора концентрата. Насос обеспечивает дозированный отбор концентрата макромолекул из внутреннего пространства фракционатора 13. Переключение режима дозированного отбора концентрата макромолекул и режима слива концентрата (промывочного раствора) осуществляется пережимом 17 и включением/выключением насоса с насосным сегментом 16.
Устройство работает следующим образом
После сборки и заполнения экстракорпорального контура устройство подключают к контуру сепаратора крови. После начала получения плазмы на сепараторе крови и накопления ее в достаточном количестве в емкости для плазмы 1 включают насос 8. При этом открыты пережимы 5, 12, 14, закрыты пережимы 6, 11, 17. Насос 8 через ветви L1 и L3 подает плазму на вход внутреннего пространства фракционатора плазмы 13. При этом концентрат макромолекул остается внутри пространства А, а остальная часть плазмы фильтруется в пространство Б и далее через ветвь L6 реинфузируется пациенту (напрямую или через сепаратор крови). Датчик давления, соединенный с устройством ветвью L4, контролирует степень заполнения пространства А фракционатора плазмы макромолекулами. При достижении заданного уровня давления (100-150 мм рт.ст.) включают насос 16 и начинают непрерывный отбор концентрата макромолекул через ветвь L8 из пространства А фракционатора в контейнер 19 для последующего удаления. Скорость отбора концентрата может составлять от 5 до 20% от скорости перфузии плазмы. При продолжающемся увеличении давления перед фракционаторм плазмы увеличивают скорость отбора концентрата. Если уровень давления достигнет 200 мм рт.ст. при максимальной скорости отбора концентрата (20% от скорости перфузии плазмы) осуществляют промывку внутреннего пространства А. Для этого закрывают пережим 5, открывают пережим 6, останавливают насос 16, открывают пережим 17 и закрывают пережим 14, скорость перфузии насоса 8 увеличивают до 100-200 мл/мин, через внутреннее пространство А перфузируют 150-250 мл изотонического раствора, промывочный раствор через ветвь L7 сливают в контейнер 19. После окончания промывки возобновляют перфузию плазмы. Для этого скорость перфузии насоса 8 уменьшают до рабочей, закрывают пережим 6, открывают пережим 5, открывают пережим 14, закрывают пережим 17. Выше перечисленную последовательность действий можно повторять несколько раз. Если промывка внутреннего пространства фракционатора плазмы не приводит к восстановлению его фильтрационных свойств (давление перед фракционатором плазмы снижается незначительно, меньше чем на 100 мм рт.ст., вновь быстро нарастает до 200 мм рт.ст. и объем перфузированной плазмы за очередной цикл перфузии не достигает 500 мл), это свидетельствует о блокаде пор мембраны, а не внутреннего пространства фракционатора, и является показанием к промывке в режиме противотока. Для этого закрывают пережим 5, открывают пережим 6, открывают пережим 11, закрывают пережим 12, увеличивают скорость перфузии насоса 8 до 100-200 мл/мин. Изотоническим раствором в объеме 100-200 мл из емкости 2 через ветви L2, L3, L5 вытесняют профильтровавшуюся плазму из внешнего пространства Б фракционатора. После этого закрывают пережим 14, открывают пережим 17 и промывают поры мембраны путем перфузии через нее противотоком 150-250 мл изотонического раствора. Промывочный раствор через ветвь L7 сливают в контейнер 19. По окончании промывки возобновляют перфузию плазмы. При необходимости промывку осуществляют несколько раз.
В заявляемом устройстве в качестве фракционатора плазмы 13 может быть использован любой фракционатор плазмы типа Evaflux фирмы Kavasumi (Япония) или Cascadeflo фирмы Asashi (Япония). Мембрана фракционатора плазмы может быть изготовлена из диацетата целлюлозы, поливинилового спирта, полиэтилена, полипропилена, полисульфона, сополимера этиленвинилового спирта (EVAL), полиметилметакрилата (РММА), полиакрилонитрила (PAN) или других полимеров. Размер пор мембраны капиллярных волокон фракционатора не ограничивается, но обычно находится в диапазоне от 5 до 100 нм (A.Sueoka, 1997).
Примеры реализации заявляемых технических решений
Пример 1. Пациент А. Необходимо удалить холестерин и липопротеиды низкой плотности. Концентрация других крупноглобулярных белков в пределах нормы. Процедура начата в режиме 1. Давление перед фракционатором при этом достигло 150 мм рт.ст. после фильтрации 1,5 л плазмы. Был осуществлен переход в режим 2. Давление перед фракционатором продолжало расти, пока соотношение скорости насоса 16 не достигло 1:5 от скорости насоса 8. Давление стабилизировалось на уровне 180 мм рт.ст. Насос 16 продолжал отбор концентрата из внутреннего пространства фракционатора плазмы оставшуюся часть процедуры. Всего было удалено 280 мл концентрата. Частота встречаемости такой ситуации около 40%.
Пример 2. Пациент Б. Необходимо удалить холестерин, триглицериды, липопротеиды низкой и очень низкой плотности. Их концентрация умеренно повышена. У пациента также повышена концентрация циркулирующих иммунных комплексов. Процедура начата в режиме 1. До повышения давления до 150 мм. рт.ст. удалось получить 900 мл плазмы. Далее последовал переход к режиму 2. Несмотря на максимальную скорость насоса 16, продолжался рост давления перед фракционатором и к моменту перфузии 1,4 л плазмы оно достигло 200 мм рт.ст. Насос подачи плазмы был остановлен. Начата промывка внутреннего пространства 200 мл изотонического раствора. Давление перед фракционатором снизилось до 50 мм рт.ст. Возобновлена перфузия плазмы. Было получено еще 500 мл плазмы. Давление снова повысилось до 200 мм рт.ст., что свидетельствовало о необходимости промывки. В дальнейшем циклы промывки и перфузии плазмы чередовались. Всего было осуществлено 3 промывки. Получено 100 мл концентрата, 600 мл промывочной жидкости. В пациента инфузировано около 350 мл изотонического раствора. Частота встречаемости такой ситуации около 40%.
Пример 3. Пациент В. Необходимо удалить холестерин, триглицериды, липопротеиды низкой и очень низкой плотности в очень высокой концентрации (>20 ммоль/л). После перфузии 750 мл плазмы давление перед фракционатором повысилось до 150 мм рт.ст. Несмотря на переход к режиму 2 и максимальную скорость насоса 16 после перфузии 150 плазмы давление выросло до 200 мм рт.ст. Промывка фракционатора в режиме 3 привела к снижению давления до 100 мм рт.ст. После возобновления перфузии плазмы удалось профильтровать еще 300 мл плазмы. Давление снова выросло до 200 мм рт.ст., такой эффект промывки свидетельствовал о блокировании пор мембраны фракционатора. Был осуществлен переход к режиму 4. Вначале 50-ю мл изотонического раствора была вытеснена плазма из ветви L3, затем 100-а мл изотонического раствора профильтровавшаяся плазма из внешнего пространства фракционатора Б через ветвь L6 была вытеснена для реинфузии пациенту, затем 200-и мл изотонического раствора в режиме противотока промыта мембрана фракционатора, собрано 200 мл промывочной жидкости. После возобновления перфузии плазмы через фракционатор удалось перфузировать 550 мл плазмы. Далее давление снова поднялось до 200 мм рт.ст. В дальнейшем циклы противоточной промывки и перфузии плазмы чередовались. Всего было осуществлено 4 промывки. Получено 50 мл концентрата, 1000 мл промывочной жидкости. В пациента инфузировано около 900 мл изотонического раствора. Частота встречаемости такой ситуации около 10%.
Результаты исследований, представленных в Примерах 1-3, сведены в Таблицу 1.
Из Таблицы 1 видно, что в результате комбинации режимов удается минимизировать нежелательные эффекты процедуры: общее количество изотонического раствора, инфузированное пациенту, и потери плазмы крови минимальны и находятся в безопасных пределах. При этом целевой объем перфузии плазмы осуществляется полностью, независимо от состава плазмы пациента.
В Таблицах 2 и 3 представлен сравнительный анализ результатов плазмофильтрации, проведенных способом-прототипом (вариант 1) и заявляемым способом (вариант 2).
Из Таблицы 2 следует, что при использовании прототипа процедура прекращена досрочно (*) из-за невозможности ее продолжения, в случае применения предлагаемого устройства процедура выполнена в полном объеме.
Из таблицы 3 следует, что при использовании предлагаемого устройства по сравнению с прототипом меньше количество использованного для промывки и инфузированного пациенту изотонического раствора (*), а также меньше потери плазмы крови (**).
Применение заявляемых способа и устройства делает возможным проведение процедуры при любых свойствах плазмы крови пациента, снижает потери полезных компонентов плазмы крови, обеспечивает высокую селективность удаления целевых компонентов, уменьшает потребность в растворе для промывки фракционатора плазмы, уменьшает количество инфузированного пациенту изотонического раствора.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ОФТАЛЬМОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2798002C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ГЕПАТИТА У ДЕТЕЙ | 2014 |
|
RU2553179C1 |
| УСТРОЙСТВО ДЛЯ ПРОВЕДЕНИЯ ОДНОИГОЛЬНОГО МЕМБРАННОГО ПЛАЗМАФЕРЕЗА | 2001 |
|
RU2203099C2 |
| СПОСОБ ПРОЛОНГИРОВАНИЯ БЕРЕМЕННОСТИ ПРИ РАННЕЙ ПРЕЭКЛАМПСИИ | 2023 |
|
RU2803574C1 |
| Способ лечения желтухи у больных острой печеночной недостаточностью | 2015 |
|
RU2607193C1 |
| СПОСОБ ЭКСТРАКОРПОРАЛЬНОЙ РЕГЕНЕРАЦИИ ПЛАЗМЫ ПОСЛЕ ПЛАЗМАФЕРЕЗА | 1993 |
|
RU2033190C1 |
| ПЛАЗМОФИЛЬТР | 2012 |
|
RU2514545C2 |
| МЕМБРАННЫЙ ФИЛЬТР И СИСТЕМА ДЛЯ ПЛАЗМАФЕРЕЗА (ВАРИАНТЫ) | 1999 |
|
RU2153389C1 |
| Аппарат "вспомогательная печень | 1986 |
|
SU1424851A1 |
| СПОСОБ ПЛАЗМАФЕРЕЗА В ОДНОИГОЛЬНОМ ЭКСТРАКОРПОРАЛЬНОМ КОНТУРЕ ДЛЯ ЖИВОТНЫХ, В ТОМ ЧИСЛЕ С МАЛЫМ ВЕСОМ, И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2016 |
|
RU2651073C2 |
Группа изобретений относится к медицине, а именно к эфферентной терапии, и может быть использована при лечении аутоиммунных, метаболических и иных заболеваний. Для этого осуществляют каскадную плазмофильтрацию посредством устройства, включающего фракционатор, имеющий один вход и два выхода, снабженный мембранным фильтром, разделяющим внутренний объем фракционатора на внутреннее и внешнее пространство для концентрата и фильтрата. Вход и один из выходов предназначены для соединения с внутренним пространством фракционатора, а второй выход - с его внешним пространством. Перед входом во фракционатор установлены воздушная ловушка и датчик давления. Также устройство содержит емкость для плазмы, емкость для промывочного изотонического раствора, соединенные через тройник с ветвью подачи плазмы или промывочного изотонического раствора на вход фракционатора, емкость для сбора промывочной жидкости и/или концентрата макромолекул плазмы, соединенную ветвью с выходом из внутреннего пространства фракционатора. Насосный сегмент, установленный в ветви подачи плазмы или промывочного изотонического раствора на вход фракционатора, пережимы, установленные на ветвях, соединенных с выходами из фракционатора, а также выходами из емкости для плазмы и емкости для промывочного изотонического раствора. Плазма поступает во фракционатор, где происходит ее разделение на фильтрат и концентрат. В процессе разделения плазмы измеряют величину давления на входе фракционатора, и при достижении уровня давления 100-150 мм рт.ст. процесс разделения продолжают с периодическим или одновременным отбором концентрата из внутреннего пространства фракционатора для последующего удаления. При этом отбор концентрата осуществляют со скоростью 5-20% от скорости перфузии плазмы до достижения уровня давления на входе фракционатора 150-250 мм рт.ст. При достижении максимального значения скорости отбора концентрата, процесс разделения плазмы прекращают и осуществляют промывку фракционатора через внутреннее или внешнее пространство, в том числе и в противоточном режиме, после чего разделение плазмы на фильтрат и концентрат возобновляют. Изобретения позволяют обеспечить высокую селективность удаления целевых компонентов, снижая потерю полезных компонентов плазмы крови. 2 н. и 7 з.п. ф-лы, 1 ил., 3 табл.
1. Способ проведения каскадной плазмофильтрации, включающий разделение плазмы на фильтрат и концентрат с использованием фракционатора, имеющего внутреннее и внешнее пространство для концентрата и фильтрата соответственно, в процессе разделения плазмы измеряют величину давления на входе фракционатора, при превышении уровня давления 100-150 мм рт.ст. процесс разделения продолжают с периодическим или одновременным отбором концентрата из внутреннего пространства фракционатора для последующего удаления, при этом отбор концентрата осуществляют со скоростью 5-20% от скорости перфузии плазмы до достижения уровня давления на входе фракционатора 150-250 мм рт.ст., при достижении максимального значения скорости отбора концентрата процесс разделения плазмы прекращают и осуществляют промывку фракционатора через внутреннее или внешнее пространство, после чего разделение плазмы на фильтрат и концентрат возобновляют.
2. Способ по п.1, характеризующийся тем, что скорость отбора концентрата из внутреннего пространства фракционатора увеличивают при увеличении давления перед фракционатором.
3. Способ по п.1, характеризующийся тем, что промывку фракционатора осуществляют прямоточным пропусканием изотонического раствора через внутреннее пространство фракционатора.
4. Способ по п.3, характеризующийся тем, что изотонический раствор берут в объеме не меньше 2-х объемов внутреннего пространства фракционатора и пропускают через внутреннее пространство фракционатора с увеличением скорости до 100-200 мл/мин.
5. Способ по п.3, характеризующийся тем, что дополнительно осуществляют противоточную промывку пор мембраны капилляров фракционатора, при этом предварительно вытесняют профильтровавшуюся плазму из внешнего пространства фракционатора изотоническим раствором в объеме не меньше объема внешнего пространства фракционатора, затем промывают поры мембраны капилляров путем перфузии через нее противотоком изотонического раствора в объеме, равном 1-3 объемам внешнего пространства фракционатора.
6. Способ по п.5, характеризующийся тем, что противоточную промывку фракционатора осуществляют после проведения прямоточной промывки при снижении эффективности получения перфузированной плазмы за очередной цикл перфузии, выраженной в незначительном снижении давления перед фракционатором плазмы после прямоточной промывки меньше, чем на 100 мм рт.ст., быстром его нарастании более 200 мм рт.ст. при возобновлении перфузии плазмы, при котором объем вновь профильтрованной до очередной промывки плазмы прогрессивно уменьшается и не достигает 500 мл.
7. Устройство для проведения каскадной плазмофильтрации, включающее фракционатор, имеющий, по крайней мере, один вход и два выхода, снабженный мембранным фильтром, разделяющим внутренний объем фракционатора на внутреннее и внешнее пространство для концентрата и фильтрата соответственно, при этом вход и один из выходов предназначены для соединения с внутренним пространством фракционатора, а второй выход - с его внешним пространством, а также емкость для плазмы, емкость для промывочного изотонического раствора, соединенные через тройник с ветвью подачи плазмы или промывочного изотонического раствора на вход фракционатора, емкость для сбора промывочной жидкости и/или концентрата макромолекул плазмы, соединенную ветвью с выходом из внутреннего пространства фракционатора, насосный сегмент, установленный в ветви подачи плазмы или промывочного изотонического раствора на вход фракционатора, пережимы, установленные на ветвях, соединенных с выходами из фракционатора, а также выходами из емкости для плазмы и емкости для промывочного изотонического раствора, отличающееся тем, что оно снабжено воздушной ловушкой и датчиком давления, установленными в ветви перед входом в фракционатор, который имеет дополнительный вход, предназначенный для соединения с его внешним пространством, а также первой дополнительной ветвью, снабженной пережимом, один конец которой соединен с дополнительным входом фракционатора, а противоположный конец через тройник подключен к ветви на участке, соединяющем выход воздушной ловушки со входом, предназначенным для соединения с внутренним пространством фракционатора.
8. Устройство по п.7, отличающееся тем, что оно снабжено капельницами, установленными на выходах из емкости для плазмы и емкости для промывочного изотонического раствора, выполненными с возможностью визуального или автоматического контроля уровня жидкости.
9. Устройство по п.7, отличающееся тем, что оно снабжено второй дополнительной ветвью, содержащей дополнительный насосный сегмент, подключенной посредством двух тройников параллельно к ветви, соединяющей фракционатор с емкостью для сбора промывочной жидкости и/или концентрата макромолекул плазмы, при этом пережим на последней ветви расположен на участке между тройниками с возможностью переключения режимов слива концентрата и промывочного раствора из внутреннего пространства фракционатора.
| Эфферентная терапия в комплексном лечении внутренних болезней // под ред | |||
| А.Л.КОСТЮЧЕНКО | |||
| - СПб.: Фолиант, 2003, с.9, 187 | |||
| US 4839055 А, 13.06.1989 | |||
| УСТРОЙСТВО ДЛЯ ЭКСТРАКОРПОРАЛЬНОЙ ДЕТОКСИКАЦИИ КРОВИ | 1990 |
|
RU2020973C1 |
| СОРБЕНТ ДЛЯ УДАЛЕНИЯ АТЕРОГЕННЫХ ЛИПОПРОТЕИДОВ ИЗ КРОВИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1996 |
|
RU2108858C1 |
| WO 2009055287 A1, 30.04.2009 | |||
| US 5152743 A, 06.10.1992 | |||
| СОКОЛОВ А.А | |||
| Эфферентные методы интенсивной терапии аутоиммунных и метаболических | |||
Авторы
Даты
2011-06-20—Публикация
2010-01-12—Подача