Изобретение относится к способу очистки и производства аминокислот, в частности к получению аминокислот из растворов, содержащих в качестве примеси углеводы, и может быть использовано в пищевой и фармацевтической промышленности.
Одним из наиболее распространенных методов синтеза аминокислот является микробиологический, в ходе которого штаммы-продуценты синтезируют аминокислоту, потребляя при этом органические вещества. Максимальный биосинтез L-лизина наблюдается при использовании питательных сред на основе сахарозы [И.М.Грачева, Н.Н.Гаврилова, Л.А.Иванова Технология микробных белковых препаратов, аминокислот и жиров. - М.: Пищевая промышленность, 1980. 448 с.]. После завершения процесса биосинтеза в составе культуральной жидкости наряду с целевой аминокислотой содержатся и остаточные углеводы с концентрацией 3-5 г/л. В ходе дальнейшего выделения, разделения и концентрирования возможно взаимодейтвие аминокислот с углеводами при повышении температуры технологических растворов с образованием окрашенных веществ - меланоидинов и снижение концентрации целевого продукта [Взаимодействие фруктозы и глютаминовой кислоты в лимоннокислых средах. / В.Ф.Селеменев, И.П.Шамрицкая, К.Лепс, Г.Ю.Орос. // Изв. ВУЗов. Пищевая технология. 1979, №2. С.40-44]. Для предотвращения потерь аминокислот в процессе их производства актуальной задачей является разделение аминокислот и углеводов.
Известен способ очистки лизина от минеральных катионов (Na+, K+, Са2+) с помощью катионита КУ-2-8 в NH4 +-форме [Исследование работы крупногабаритного ионообменного фильтра в процессе выделения кристаллического лизина из культуральной жидкости. / А.Ф.Шолин и др. // Теория и практика сорбционных процессов. 1981. №14. С.107-110]. Очистка L-лизина от сопутствующих компонентов культуральной жидкости, элюатов и маточников осуществляется с помощью макропоритсого анионита АВ-17-2П в хлоридной или гидроксильной форме [Способ очистки L-лизина от сопутствующих компонентов культуральной жидкости, элюатов и маточников. / В.Ф.Селеменев и др. Патент РФ №2140902. Приоритет 16.07.97].
Однако при ионообменных способах очистки аминокислот образуются большие объемы сточных вод, велики затраты на регенерацию ионообменников растворами кислот и щелочей. Мембранные методы позволяют сократить объемы сточных вод и затраты реагентов. Способ очистки водных растворов синтетических аминокислот, содержащих органические и неорганические примеси, описан в [Пат. 1466676 Франция, МКИ С07С. Precede de purification des acides amines. / Sumitoro Chemical Co." заявл. 14.01.66, опубл. 12.12.66.]. pH при очистке поддерживали около изоэлектрической точки. Приведен пример получения препарата с содержанием основного вещества 97% из 2% раствора глицина.
Известна электродиализная установка с биполярной мембраной, примененная для разделения растворов, содержащих аминокислоты (аспарагиновую кислоту, фенилаланин) и хлорид натрия [20. Pat. 4330 USA, 1C С07С 227-40, B01D 061-40. Electrodialytic treatment of aqueous solutions containing amino acids or other amphoteric compounds for salt separation. / Chlanda, P.Frederich (USA); Alliend - Signal, Inc. - №393165; Appl. 14.08.89; Pat. 2.08.90].
В работе [Electrodialysis of acetate fermentation broths. / U.N.Chukwu, M.Cheryan. // Appl. Biochem. Biotechnol. - 1999. - V.77-79. - P.485-499] проведено электродиализное отделение уксусной кислоты от остатков непрореагировавшей глюкозы в ацетатном ферментационном бульоне.
Наиболее близким по совокупности признаков является описанный электродиализный способ получения L-лизина из лизинсодержащих растворов, включающий обработку рацемата разделяющим агентом с получением солей D- и L-лизина, удаление D-формы и разложение гидротартрата лизина методом электродиализа в электродиализаторе с чередующимися катионообменными и биполярными мембранами в интенсивном токовом режиме (12-18 мА/см) с выделением чистого L-лизина (Пат. РФ №2223946, МПК С07С 227/34; 229/26.; опубл. 20.02.2004).
К недостаткам вышеизложенного способа относятся:
- предложенный способ позволяет производить выделение лизина из растворов его солей с разделяющим оптически активным агентом без использования концентрированных растворов кислот, но не предполагает разделения аминокислот и неэлектролитов, которое требуется при микробиологическом синтезе;
- использование интенсивных токовых режимов приводит к существенным энергозатратам.
Технический результат - получение чистого раствора аминокислоты от неэлектролитов (углеводов) методом электродиализа с чередующимися биполярными и монополярными (катионообменными или анионообменными) мембранами.
Технический результат достигается тем, что способ разделения аминокислот и углеводов электродиализом включает внесение исходного раствора, содержащего аминокислоту и углевод, в дилюатные секции электродиализатора с расположенными между электродами чередующимися катионообменными и биполярными мембранами или анионообменными и биполярными мембранами, при pH исходного раствора, равном p1 соответствующей аминокислоты, при этом в камерах концентрирования циркулирует дистиллированная вода, а в электродные камеры подают раствор сульфата натрия с концентрацией 0.025 моль/дм3, причем образовавшиеся в дилюатных камерах катионы или анионы аминокислот переносятся через катионообменные или анионообменные мембраны в камеры концентрирования, а углевод остается в растворе, вытекающем из дилюатной секции.
Разделение проводится в электродиализаторе с платиновым анодом и никелевым катодом, состоящим из семи камер, разделенных чередующимися ионообменными мембранами, при плотности электрического тока 0,1-7,0 мА/см2.
В качестве исходного раствора в процессе разделения может быть взят раствор, содержащий нейтральную (например, глицин), основную (например, лизин) или кислую (например, глютаминовая кислота) аминокислоту и углевод.
На фиг.1 представлена схема электродиализного аппарата с чередующимися катионообменными и биполярными мембранами (1-7 номера секций, К - катионообменные мембраны, АК - биполярные мембраны, АА - аминокислота).
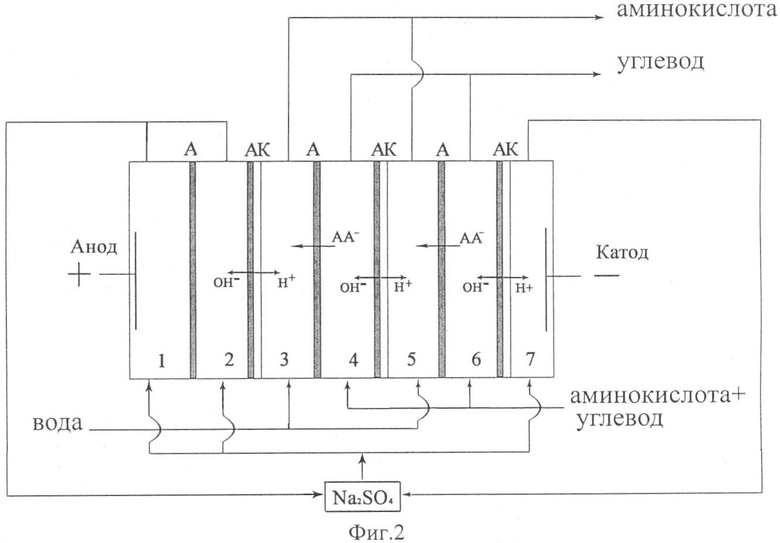
На фиг.2 представлена схема электродиализного аппарата с чередующимися анионообменными и биполярными мембранами (1-7 номера секций, А - катионообменные мембраны, АК - биполярные мембраны, АА - аминокислота).
Таблица 1. Характеристики процесса разделения глицина и сахарозы электродиализом с чередующимися катионообменными и биполярными мембранами (МК-40/МБ-3), а также анионообменными и биполярными мембранами (МА-41/МБ-3).
Таблица 2. Характеристики процесса разделения глицина и глюкозы электродиализом с чередующимися катионообменными и биполярными (МК-40/МБ-3) мембранами, а также анионообменными и биполярными мембранами (МА-41/МБ-3).
Таблица 3. Характеристики процесса разделения лизина и сахарозы электродиализом с катионообменными (МК-40) и биполярными (МБ-3 или Fumaser FBM) мембранами.
Таблица 4. Характеристики процесса разделения глютаминовой кислоты и сахарозы электродиализом с анионообменными (МА-41) и биполярными (МБ-3) мембранами.
Использовали биполярные мембраны МБ-3 (производство ОАО «Щекиноазот», РФ) или Fumaser FBM (производство FuMa-Tech GmbH? Германия), а также сульфокатионообменные мембраны МК-40 и сильноосновные анионообменные мембраны МА-41 (производство ОАО «Щекиноазот», РФ).
Гетерогенные катионообменные мембраны МК-40 изготовлены на основе катионита КУ-2, функциональными группами в котором являются сульфогруппы. Гетерогенные анионообменные мембраны МА-41 получаются на основе анионита АВ-17, который содержит четвертичные группы аммониевого основания. Биполярные мембраны МБ-3 изготавливаются прессованием в один лист катионообменной мембраны МК-41 и анионообменной мембраны МА-41. Мембрана МК-41 изготовлена на основе катионита КФ-1, который содержит в качестве функциональных групп остатки фосфорной кислоты. Мембрана FBM имеет многослойную структуру: катионообменный слой (сульфокислотные группы в сшитом полиэфиркетоне), анионообменный слой (четверичные ионы аммония, внедренные в матрицу полисульфона) и тонкий промежуточный слой, содержащий третичные амино-группы.
Рабочая площадь каждой из мембран составляла 20 см2. Через камеры обессоливания (дилюатные) 2, 4, 6 пропускали исходный раствор, через камеры концентрирования 3 и 5, куда осуществлялся перенос аминокислоты, дистиллированную воду. Линейная скорость протока в камерах обессоливания составляла 0.11-0.22 см/с. В электродные камеры 1,7 подавался вспомогательный электролит - сульфат натрия с концентрацией 0.025 моль/дм3.
Эффективность процесса разделения оценивали по величине коэффициента разделения, который рассчитывали по формуле:
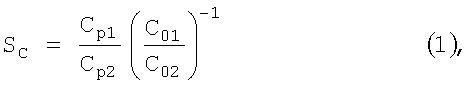
где Cp1 - концентрация 1-го компонента в пермеате (растворе камеры концентрирования), Ср2 - концентрация 2-го компонента в пермеате, C01 - концентрация 1-го компонента в исходном растворе, С02 - концентрация 2-го компонента в исходном растворе.
При подаче напряжения на электроды биполярные мембраны генерируют ионы Н+ и ОН- без использования дополнительных реагентов, за счет разложения воды. Таким образом, происходит подкисление и подщелачивание растворов в камерах электродиализатора, в результате чего биполярные ионы аминокислоты превращаются в катионы (фиг.1) или анионы (фиг.2). Катионы аминокислоты мигрируют через катионообменные мембраны к катоду, а анионы аминокислоты через анионообменные мембраны к аноду. Таким образом, согласно фиг.1 и фиг.2, нечетные камеры являются камерами концентрирования аминокислоты, а четные - дилюатными камерами.
Исходный раствор, содержащий аминокислоту и углевод, подавали в камеры обессоливания 2, 4, 6, ограниченные с катодной стороны катионообменными, а с анодной стороны биполярными мембранами (фиг.1) или же с анодной стороны анионообменными, а с катодной стороны биполярными мембранами (фиг.2). Величина pH исходного раствора была равной р1 аминокислоты, таким образом, аминокислота присутствовала в исходном растворе преимущественно в виде биполярных ионов, которые не способны мигрировать в электрическом поле. За счет использования биполярных мембран происходило безреагентное подкисление (подщелачивание) раствора и образование катионов (анионов) аминокислоты, которые переносились через катионообменные (анионообменные) мембраны в камеры концентрирования. Через камеры концентрирования 3 и 5, куда осуществлялся перенос аминокислоты, пропускали дистиллированную воду. Таким образом, из камер обессоливания (2, 4, 6) вытекал раствор, обедненный аминокислотой, и содержащий углевод - дилюат. Продукт - раствор, содержащий аминокислоту без примесей углевода, вытекал из камер концентрирования (3, 5).
В электродные камеры 1, 7 подавали вспомогательный электролит - сульфат натрия с концентрацией 0.025 моль/дм3. Это позволяет избежать нежелательных процессов электрохимического превращения аминокислот в электродных секциях. Процесс проводили в гальваностатическом режиме, при плотности тока 0.1-3.0 мА/см2.
Пример 1
В качестве аминокислоты был выбран глицин. Глицин является представителем нейтральных аминокислот и, в зависимости от pH среды, способен существовать в виде катионов, биполярных ионов и анионов, а значит, может переноситься как через катионообменную, так и через анионообменную мембрану.
Эксперименты проводились в электродиализаторах, представленных на фиг.1 и фиг.2. Исходный раствор содержал глицин в концентрации 0.1 моль/л и сахарозу в концентрации 0.01 моль/л. Линейная скорость протока в секциях составляла 0.1 см/с.
При электродиализе с чередующимися катионообменными и биполярными мембранами глицин в виде катионов переносился через катионообменную мембрану в камеру концентрирования, сахароза преимущественно оставалась в секции обессоливания. При электродиализе с чередующимися анионообменными и биполярными мембранами глицин в виде анионов переносился через анионообменную мембрану в камеру концентрирования, сахароза преимущественно оставалась в секции обессоливания.
Таблица 1 демонстрирует влияние плотности тока на коэффициент разделения глицина и сахарозы при электродиализе с чередующимися катионообменными и биполярными, а также чередующимися анионообменными и биполярными мембранами. Результаты опытов, представленные в таблице 1, свидетельствуют о том, что с увеличением используемой плотности тока коэффициент разделения сначала резко возрастает, затем его рост замедляется. Поэтому оптимальной является плотность тока 2.0 мА/см2, при этом коэффициент разделения достигает величины 40.0 для электродиализатора, изображенного на фиг.1, и 46.4 для электродиализатора, изображенного на фиг.2. Из таблицы 1 видно, что эффективнее разделение глицина и сахарозы протекает при использовании электродиализатора с чередующимися анионообменными и биполярными мембранами.
Пример 2. В качестве кислой аминокислоты был выбран глицин, в качестве углевода - глюкоза. Глицин является представителем нейтральных аминокислот и, в зависимости от pH среды, способен существовать в виде катионов, биполярных ионов и анионов, а значит, может переноситься как через катионообменную, так и через анионообменную мембрану.
Эксперименты проводились в электродиализаторах, представленных на фиг.1 и фиг.2. Исходный раствор содержал глицин в концентрации 0.1 моль/л и глюкозу в концентрации 0.01 моль/л. Линейная скорость протока в секциях составляла 0.1 см/с.
При электродиализе с чередующимися катионообменными и биполярными мембранами глицин в виде катионов переносился через катионообменную мембрану в камеру концентрирования, глюкоза преимущественно оставалась в секции обессоливания. При электродиализе с чередующимися анионообменными и биполярными мембранами глицин в виде анионов переносился через анионообменную мембрану в камеру концентрирования, глюкоза преимущественно оставалась в секции обессоливания.
Таблица 2 демонстрирует влияние плотности тока на коэффициент разделения глицина и глюкозы при электродиализе с чередующимися катионообменными и биполярными, а также чередующимися анионообменными и биполярными мембранами. Результаты опытов, представленные в таблице 1, свидетельствуют о том, что с увеличением используемой плотности тока коэффициент разделения сначала резко возрастает, затем его рост замедляется. Поэтому оптимальной является плотность тока 2.0 мА/см2, при этом коэффициент разделения достигает величины 8.0 для электродиализатора, изображенного на фиг.1, и 8.9 для электродиализатора, изображенного на фиг.2. Из таблицы 1 видно, что эффективнее разделение глицина и глюкозы протекает при использовании электродиализатора с чередующимися анионообменными и биполярными мембранами. Однако в обоих случаях коэффициент разделения для системы глицин - глюкоза меньше, чем для смеси глицин - сахароза, что объясняется большей величиной диффузионного потока глюкозы через ионообменные мембраны, по сравнению с сахарозой.
Пример 3. В качестве кислой аминокислоты была выбрана глютаминовая кислота, в качестве углевода - сахароза. Глютаминовая кислота в щелочных и нейтральных растворах существует в виде одно- и двухзарядных анионов, и может переноситься через анионообменную мембрану. Поэтому разделение глютаминовой кислоты и сахарозы проводили в электродиализаторе, представленном на фиг.2.
Исходный раствор содержал глютаминовую кислоту в концентрации 0.025 моль/л и сахарозу в концентрации 0.01 моль/л. Линейная скорость протока в секциях составляла 0.1 см/с.
Таблица 3 демонстрирует влияние плотности тока на коэффициент разделения глютаминовой кислоты и сахарозы при электродиализе с чередующимися анионообменными и биполярными мембранами. С увеличением используемой плотности тока коэффициент разделения возрастает и при плотности тока 4.0 мА/см2 фактор разделения достигает величины 80.8.
Пример 4. В качестве основной аминокислоты был выбран лизин, в качестве углевода - сахароза. Лизин в кислых и нейтральных растворах существует в виде одно- и двухзарядных катионов, а значит, может переноситься через катионообменную мембрану. Поэтому разделение лизина и сахарозы проводили в электродиализаторе, представленном на фиг.1.
Исходный раствор содержал лизин в концентрации 0.025 моль/л и сахарозу в концентрации 0.01 моль/л. Линейная скорость протока в секциях составляла 0.1 см/с.
Таблица 4 демонстрирует влияние плотности тока на коэффициент разделения лизина и сахарозы при электродиализе с чередующимися катионообменными и биполярными мембранами двух типов: МБ-3 и Fumasep FBM. С увеличением используемой плотности тока коэффициент разделения возрастает и при плотности тока 7.0 мА/см2 он достигает величины 203.3 для системы с биполярными мембранами МБ-3 и 235.0 при использовании биполярных мембран Fumasep FBM.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОНЦЕНТРИРОВАНИЯ ОСНОВНЫХ АМИНОКИСЛОТ ЭЛЕКТРОДИАЛИЗОМ | 2009 |
|
RU2412748C2 |
| СПОСОБ ОБЕССОЛИВАНИЯ РАСТВОРОВ НЕЙТРАЛЬНЫХ АМИНОКИСЛОТ | 2016 |
|
RU2647739C1 |
| Электродиалиазатор | 1985 |
|
SU1274714A1 |
| МНОГОКАМЕРНЫЙ ЭЛЕКТРОДИАЛИЗАТОР ГЛУБОКОЙ ДЕМИНЕРАЛИЗАЦИИ | 2007 |
|
RU2380145C2 |
| СПОСОБ РЕГЕНЕРАЦИИ ХЛОРИСТОГО ЛИТИЯ, ДИМЕТИЛАЦЕТАМИДА И ИЗОБУТИЛОВОГО СПИРТА ИЛИ ХЛОРИСТОГО ЛИТИЯ И ДИМЕТИЛАЦЕТАМИДА ИЗ ТЕХНОЛОГИЧЕСКИХ РАСТВОРОВ ПРОИЗВОДСТВА ПАРААРАМИДНЫХ ВОЛОКОН | 2014 |
|
RU2601459C2 |
| ЭЛЕКТРОДИАЛИЗАТОР | 1992 |
|
RU2050176C1 |
| Способ снижения солесодержания водных растворов и мембранный аппарат для его осуществления | 1989 |
|
SU1757725A1 |
| СПОСОБ ОЧИСТКИ КОНЦЕНТРИРОВАННЫХ ВОДНЫХ РАСТВОРОВ ГЛИОКСАЛЯ ОТ ПРИМЕСЕЙ ОРГАНИЧЕСКИХ КИСЛОТ | 2010 |
|
RU2455052C1 |
| Электродиализатор | 1980 |
|
SU891111A1 |
| СПОСОБ ПОЛУЧЕНИЯ L-ЛИЗИНА | 2002 |
|
RU2223946C1 |
Изобретение относится к способу очистки и производства аминокислот, в частности к получению нейтральных (глицин), кислых (глютаминовая кислота) и основных (лизин) аминокислот, и может быть использовано в пищевой и фармацевтической промышленности. Способ разделения аминокислот и сахаров электродиализом включает внесение исходного раствора, содержащего аминокислоту и сахарозу, в дилюатные секции электродиализатора с расположенными между электродами чередующимися катионообменными и биполярными мембранами, или анионообменными и биполярными мембранами, при рН исходного раствора, равном р1 соответствующей основной аминокислоты, при этом в камерах концентрирования циркулирует дистиллированная вода, а в электродные камеры подают раствор сульфата натрия с концентрацией 0.025 моль/дм3, причем образовавшиеся в дилюатных камерах катионы (или анионы) аминокислот переносятся через катионообменные (анионообменные) мембраны в камеры концентрирования, а сахароза остается в растворе, вытекающем из секции обессоливания (дилюате). Способ обеспечивает получение аминокислоты, очищенной от неэлектролитов (углеводов). 4 з.п. ф-лы, 2 ил., 4 табл.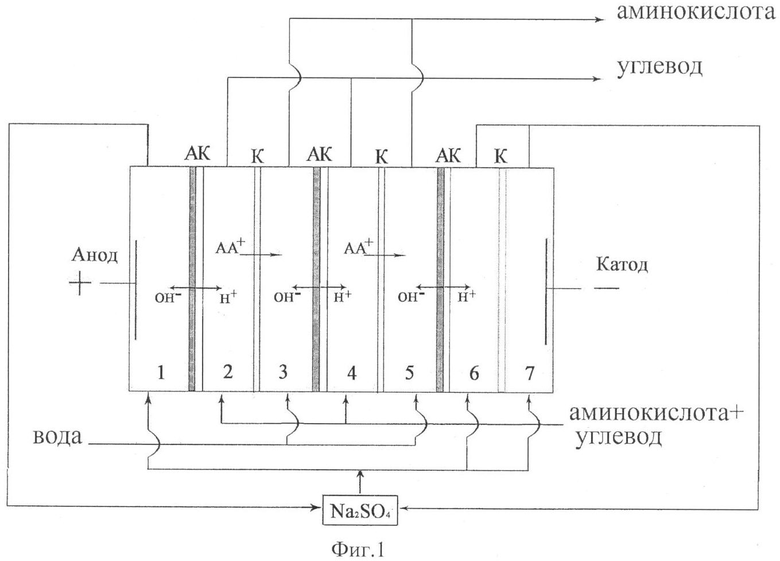
1. Способ разделения аминокислот и углеводов электродиализом, включающий внесение исходного раствора, содержащего аминокислоту и углевод, в дилюатные секции электродиализатора с расположенными между электродами чередующимися катионообменными и биполярными мембранами или анионообменными и биполярными мембранами, при рН исходного раствора равном р1 соответствующей аминокислоты, при этом в камерах концентрирования циркулирует дистиллированная вода, а в электродные камеры подают раствор сульфата натрия с концентрацией 0,025 моль/дм3, причем образовавшиеся в дилюатных камерах катионы или анионы аминокислот переносятся через катионообменные или анионообменные мембраны в камеры концентрирования, а углеводы остаются в растворе, вытекающем из дилюатной секции.
2. Способ по п.1, отличающийся тем, что в качестве аминокислоты используется нейтральная аминокислота глицин, а в качестве примеси - сахароза, при этом используется любой из указанных электродиализаторов.
3. Способ по п.1, отличающийся тем, что в качестве аминокислоты используется нейтральная аминокислота глицин, а в качестве примеси - глюкоза, при этом используется любой из указанных электродиализаторов.
4. Способ по п.1, отличающийся тем, что в качестве аминокислоты используется основная аминокислота лизин, а в качестве примеси - сахароза, при этом используется электродиализатор с чередующимися катионообменными и биполярными мембранами.
5. Способ по п.1, отличающийся тем, что в качестве аминокислоты используется кислая аминокислота - глютаминовая кислота, а в качестве примеси - сахароза, при этом используется электродиализатор с чередующимися анионообменными и биполярными мембранами.
| 1991 |
|
RU2001665C1 | |
| СПОСОБ НАНОФИЛЬТРАЦИОННОГО РАЗДЕЛЕНИЯ ЖИДКИХ ОРГАНИЧЕСКИХ СМЕСЕЙ | 2005 |
|
RU2297975C1 |
| JP 2005081226 A, 31.03.2005 | |||
| US 2003098274 A1, 29.05.2003 | |||
| WO 2004076041 A1, 10.09.2004 | |||
| US 2007216057 A1, 20.09.2007 | |||
| JP 58005343 A, 12.01.1983. | |||
Авторы
Даты
2011-08-20—Публикация
2009-11-05—Подача