Изобретение относится к области медицины, а именно нейрореаниматологии, нейрохирургии (нейротравматологии), и может быть использовано для прогнозирования течения травматической болезни головного мозга (ТБГМ) у пострадавших с тяжелой черепно-мозговой травмой (ЧМТ), как изолированной, так и сочетанной.
Травмы головного мозга и их последствия остаются одной из наиболее трудных и нерешенных проблем современной медицины и имеют огромное значение в связи со своей распространенностью и тяжелыми медицинскими и социальными последствиями (Лихтерман Л.Б. и соавт., 1993; Коновалов А.Н. и соавт., 1999; Gamer, 2000; Nepomnyaschy et al., 2001; Badikian et al., 2005).
Среди всех травм черепно-мозговая травма (ЧМТ) является основной причиной смертности (Ромоданов А.П. и соавт., 1992; Maas et al.,2000). Ежегодно в мире от черепно-мозговой травмы (ЧМТ) погибает 1,5 млн человек, а 2,4 млн становятся инвалидами. В России каждый год ЧМТ получают около 600 тыс. человек, 50 тыс. из них умирают, а еще 50 тыс. становятся инвалидами. Пострадавшими являются, как правило, лица молодого, трудоспособного возраста. По количеству недожитых вследствие преждевременной смерти лет ЧМТ и другие травмы обусловливают почти половину потерь трудового потенциала России, превышая таковые от болезней сердечно-сосудистой системы в 4,5 раза (Лихтерман Л., 2000). Все вышеизложенное определяет актуальность дальнейшего исследования механизмов патогенеза ЧМТ с целью совершенствования терапии этого заболевания.
Если очаг повреждения локализуется в головном мозге, то принято говорить о травматической болезни головного мозга (ТБГМ), а к ее характеристике присоединяется снижение или устранение координирующей по отношению к функционированию органов и систем роли ЦНС (Белицкая Т.С., 2000; Беляевский А.Д. и соавт. 2001, 2003).
Проведенными исследованиями по научно-медицинской и патентной литературе выявлены различные способы определения динамики течения ЧМТ и прогнозирования течения ТБГМ.
Так, в статье Алимова Р.А., Фролова В.И., Досмухамедова Х.К. Оценка состояния больных с сочетанной черепно-мозговой травмой // Мед. журнал Узбекистана, 1990, №3, с.30-32, описан способ оценки состояния больных с ЧМТ, основанный на оценке состояния пострадавшего по показателю интенсивности реакции организма - отношению количества нейтрофильных лейкоцитов к лимфоцитам (нейтрофильно-лейкоцитарному индексу - НЛИ) в крови больного. Однако, несмотря на свою простоту, данный способ требует существенных затрат времени, поскольку он предполагает ежедневные динамический контроль НЛИ, объективную оценку результатов лечения и его корректировку.
В статье Крылова В.Е., Лазаревой Л.В., Зянгировой С.Т. Прогнозирование динамики течения черепно-мозговой травмы // Казанский медицинский журнал, 1992, т.73, №2, с.93-96, описан способ прогнозирования динамики течения и исхода ЧМТ по изменению активности холинэстеразы в артериальной (в общей сонной артерии) и венозной (в яремной вене) крови. Данный способ основан на определении отклонения активности холинэстеразы в артерио-венозной разнице в притекающей и оттекающей от мозга крови и вычислении показателя тяжести ЧМТ в норме и при патологии. Однако этот способ достаточно травматичен, трудоемок и также требует значительных временных затрат.
В работе Королюк М.А., Иванова Л.И., Майрова И.Г., Токарева В.Е. Метод определения активности каталазы // Лаб. дело, 1988, №1, с.16-19, описан способ прогнозирования травмы головного мозга путем исследования активности каталазы в ликворе пострадавших.
Известен также патент РФ №2146060 (опубл. в БИ №6, 2000 г.) "Способ определения тяжести черепно-мозговой травмы", предусматривающий исследование спинномозговой жидкости пострадавшего и определение в ней концентрации продуктов перекисного окисления липидов - малонового диальдегида и диеновых конъюгатов.
Недостаток данных методов состоит в травматичности, что связано с взятием у пострадавшего спинномозговой жидкости. Исследование проводится через 0,5-3 часа после получения травмы, что позволяет лишь на момент обследования определить тяжесть состояния больного, но отнюдь не прогнозировать дальнейшее течение болезни. Для осуществления прогноза данным методом определять показатели необходимо в течение 3-14 дней, что является трудоемким процессом, требующим забора значительного количества крови у больного, которому эта кровь необходима.
Известен патент №2178179 (Опубликовано: 10.01.2002) «Способ прогнозирования течения травматической болезни головного мозга (ТБГМ)», предусматривающий исследование биологической жидкости с определением в ней концентрации малонового диальдегида - МДА, отличающийся тем, что у пострадавшего на вторые сутки после травмы производят забор венозной крови, в которой помимо определения значения МДА определяют значения других показателей перекисного окисления липидов (ПОЛ): суммарной пероксидазной активности - СПА и содержания шиффовых оснований - ШО, после забора крови больному внутривенно вводят 20 мг эпиталамина, разведенного в 10 мл изотонического раствора NaCl, через 6-8 ч после введения эпиталамина у больного повторно производят забор венозной крови, в которой вновь определяют значения МДА, СПА и ШО, и при снижении значений показателей ПОЛ: МДА и СПА - менее чем на 30% каждого, ШО - менее чем на 15% прогнозируют неблагоприятное течение ТБГМ.
К недостаткам данного метода следует отнести то, что оценивается только динамика процесса восстановления метаболического обмена по уровню маркеров перекисного окисления липидов, в то время как в заявляемом способе исследуется динамика гуморального ответа (цитокины), сопряженного с биохимическими маркерами оксидантного стресса (МДА) и компонентом антиоксидантной защиты (супероксиддисмутаза) в ответ на введение Эпокрина.
Известен патент №2183834 (Опубликовано: 20.06.2002) «Способ прогнозирования исхода лечения черепно-мозговой травмы:» у пациента проводят исследование ликвора, при этом в первые 5-7 дней после травмы в нем определяют число нейтрофилов, уровень мочевины, активность лактатдегидрогеназы (ЛДГ), щелочной фосфатазы (ЩФ) и, если число нейтрофилов более 10 в 1 мм3, уровень мочевины выше 10 ммоль/л, активность ЛДГ выше 30 МЕ/л, ЩФ выше 5 МЕ/л, прогнозируют неблагоприятный исход лечения ЧМТ.
К недостаткам данного метода следует отнести:
- использование показателей, не позволяющих определить характер гуморального ответа и степень метаболических нарушений со стороны системы ПОЛ/АОЗ при ЧМТ;
- травматический способ забора материала - спинномозговая пункция на протяжении 5-7 дней, что при некоторых видах повреждений противопоказано.
Известен патент №2209432 (Опубликовано: 27.07.2003) «Способ прогнозирования возникновения воспалительных осложнений в остром периоде черепно-мозговой травмы», предусматривающий определение гуморального ответа одновременно в ликворе и крови, отличающийся тем, что в качестве гуморального ответа определяют цитокиновый ответ провоспалительных цитокинов интерлейкина-1 и -6, при значениях провоспалительных цитокинов интерлейкина-1 в ликворе от 300 пг/мл до 1000 пг/мл и крови от 200 пг/мл до 400 пг/мл и интерлейкина-6 в ликворе от 100 пг/мл до 1000 пг/мл и крови от 100 пг/мл до 800 пг/мл прогнозируют возникновение внутричерепных воспалительных осложнений, а при значениях провоспалительных цитокинов интерлейкина-1 в ликворе от 100 пг/мл до 150 пг/мл и крови от 200 пг/мл до 700 пг/мл и интерлейкина-6 в ликворе от 6,1 пг/мл до 10 пг/мл и крови от 10 пг/мл до 120 пг/мл прогнозируют возникновение внечерепных воспалительных осложнений.
К недостаткам данного метода следует отнести следующее:
- предложенный способ позволяет прогнозировать появление только воспалительных осложнений в о. периоде черепно-мозговой травмы (ЧМТ), в то время как травматическая болезнь головного мозга (ТБГМ) должна рассматриваться как форма течения посттравматического адаптационного процесса, при которой метаболические сдвиги, возникшие в области травмы (головном мозге), приводят к нарушению целостности органных компартментов интактных органов (О.С.Насонкина, И.И.Дерябина [1987] и С.А.Георгиева с соавт.[1993]); т.е. исследуемый авторами риск возникновения воспалительных осложнений - это только один из аспектов травматической болезни головного мозга;
- для проведения исследования необходим забор ликвора, что является достаточно травматичной процедурой;
- авторы исследуют исходный цитокиновый статус в ликворе после ЧМТ, что не позволяет оценить динамику гуморального ответа (цитокины), сопряженного с биохимическими маркерами оксидантного стресса (МДА) и компонентом антиоксидантной защиты (супероксиддисмутазы);
- приводятся конкретные цифры уровней исследуемых цитокинов, что подразумевает применение определенного иммуноферментного набора реагентов (в их случае - Cytelise) и ограничивает возможность применения.
Известен патент №2196334 (Опубликовано: 10.01.2003) «Способ диагностики прогредиентного течения травматической болезни головного мозга (ТБГМ) путем исследования сыворотки крови», отличающийся тем, что у больного в конце восстановительного периода методом ИФА определяют уровень цитокинов ФНО- и ИЛ-4, и при уровне цитокина ФНО- выше 16,8 пкг/мл, а цитокина ИЛ-4 ниже 97,88 пкг/мл диагностируют прогредиентное течение ТБГМ.
К недостаткам данного метода следует отнести следующее:
- исследуется только гуморальный ответ (цитокины);
- прогнозируется только один из вариантов течения ТБГМ - прогредиентное течение;
- диагностика проводится в конце восстановительного периода ЧМТ, а в нашем случае диагностика проводится в 1,2-е сутки после травмы (острый период), т.е. благодаря вовремя скорректированной терапии можно вообще избежать прогредиентного течения ТБГМ;
- приводятся конкретные цифры уровней исследуемых цитокинов, что подразумевает применение определенного иммуноферментного набора реагентов.
Наиболее близким по технической сущности и выбранным в качестве прототипа является защищенный патентом №2178179 (Опубликовано: 10.01.2002) «Способ прогнозирования течения травматической болезни головного мозга (ТБГМ)».
Недостатки способа-прототипа устраняются в заявляемом изобретении.
Задачей настоящего изобретения является снижение травматичности способа прогнозирования течения травматической болезни головного мозга при тяжелой ЧМТ, как сочетанной, так и изолированной.
Поставленная цель достигается тем, что в первый час после поступления пациента с тяжелой ЧМТ больному вводят Эпокрин (международное непатентованное название - эпоэтин альфа, химическое название рекомбинантный эритропоэтин человека) в дозе 10000 ME, внутривенно в первые 24 ч от момента травмы. До введения Эпокрина и спустя 24 часа после введения Эпокрина определяют содержание в сыворотке крови цитокинов: ИЛ-6, ИЛ-10 (показатели гуморального ответа организма на травму); дополнительно определяют в эритроцитах содержание малонового диальдегида (МДА) (продукта перекисного окисления липидов) и уровень супероксиддисмутазы (СОД) (фермента, осуществляющего антиоксидантную защиту).
Затем для каждого из рассматриваемых показателей определяют (в процентах) относительное изменение его значения после введения Эпокрина путем вычисления отношения разницы значений каждого из рассматриваемых показателей до и после введения Эпокрина к значению соответствующего показателя до введения Эпокрина. Вычисления проводят по формуле:
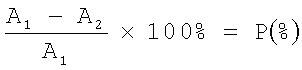
где A1 - значение показателя до введения Эпокрина,
А2 - значение показателя после введения Эпокрина,
Р - относительное изменение значений.
При повышении содержания ИЛ-6 более чем 35% и ИЛ-10 - менее чем на 20%, МДА - более чем на 30% на фоне повышения уровня СОД на 45% и менее прогнозируют неблагоприятное течения ТБГМ. В результате врач получает возможность оценить динамику гуморального ответа (цитокины), сопряженного с биохимическими маркерами оксидантного стресса (МДА) и компонентом антиоксидантной защиты (супероксиддисмутаза), и в конечном итоге оценить способность организма к восстановлению цитокинового баланса и метаболического обмена, и тем самым, осуществить прогнозирование течения ТБГМ.
Технический результат, получаемый в результате использования заявляемого изобретения, состоит в повышении точности и расширении арсенала используемых средств за счет того, что результат оценивается в процентах к исходному уровню, что не лимитирует применение определенных тест-систем; позволяет избежать осложнений ЧМТ благодаря вовремя скорректированной терапии за счет того, что диагностика проводится в 1-е сутки после травмы (острый период).
Теоретической предпосылкой заявляемого изобретения явились проведенные нами исследования по оценке важности и установление взаимосвязи тяжести течения ТБГМ и изменений в концентрации интерлейкина-6, интерлейкина-10, продукта ПОЛ (МДА), компонента АОЗ (супероксиддисмутазы) в ответ на введение в остром периоде тяжелой сочетанной или изолированной ЧМТ препарата рекомбинантного эритропоэтина человека (Эпокрина), приводящего к нормализации баланса между про- и противовоспалительными цитокинами и снижению активизации процессов ПОЛ.
Травма нарушает деятельность мозга как за счет первичного (биомеханические факторы), так и вследствие последующего вторичного повреждения (активация патофизиологических каскадов). Вторичное повреждение охватывает множество сложных биохимических и клеточных процессов, усугубляющих тяжесть первичного повреждения (Дафин Ф. Мурешану, 2007). К таковым относятся изменения цитокинового баланса, активация процессов перекисного окисления липидов и компонентов антиоксидантной защиты организма.
Установлено, что в развитии иммунных реакций в ЦНС существенное значение имеют ряд факторов: состояние ГЭБ, уровень антигенного представительства в ткани мозга и уровень адгезии клеток к эндотелию сосудов мозга, активация Т-лимфоцитов, которая может иметь поликлональный характер, недостаток контролирующих систем, срыв механизмов толерантности и контроля за иммунными реакциями за счет дисбаланса активационных и супрессорных цитокинов, их растворимых рецепторов и ингибиторов (Гусев Е.И. и соавт., 1998; Fabry.et al., 1994). Цитокины призваны обеспечить адекватность ответных реакций путем регулирования межклеточных взаимодействий (Акмаев И.Г, 1997). По мнению Scares et al. (1995) баланс между провоспалительными и ингибиторными, антивоспалительными цитокинами является критическим в определении степени выраженности нейроаутоиммунного процесса в пределах центральной нервной системы, что способствует прогрессированию повреждения при ЧМТ и поддерживает хронический воспалительный процесс.
В то же время активация процессов ПОЛ - ключевое звено гибели нейронов при повреждении головного мозга (Крыжановский Г.Н., 1997). Активация процессов ПОЛ является общей реакцией мозга на повреждение при ЧМТ (Руководство по черепно-мозговой травме. Под ред. акад. РАМН А.Н.Коновалова - М. - 1998. - С.461). Она является ярким показателем степени нарушения метаболизма и выраженности деструктивных процессов как в организме в целом, так и в тканях головного мозга (В.А.Розанов, В.А.Цепколенко, Л.Э.Клаупик. Современные представления о патогенезе необратимых повреждений нервных клеток при черепно-мозговой травме//Журнал вопросы нейрохирургии им. Н.Н.Бурденко, 1998, №2. С.37-41).
Ряд работ указывают на взаимодействие компонентов цитокиновой сети и продуктов ПОЛ при вторичных повреждениях, вызванных ТБГМ. Так провоспалительные цитокины усиливают микробицидность мононуклеарных клеток за счет индукции синтеза супероксидных и нитроксидных радикалов (Кетлинский С.А., Калинина Н.М., 1995). С другой стороны, противовоспалительные цитокины ИЛ-4, ИЛ-10, интерлейкин-13 (ИЛ-13), ТФР-бета, являясь антагонистами противовоспалительных цитокинов, оказывают некоторые противоположные эффекты при развитии воспалительной реакции (Фрейдлин И.С., 1995). Они выступают как синергисты в подавлении продукции супероксидных и нитроксидных радикалов, действуя на фермент, участвующий в их образовании.
Феномен «кислородного взрыва» фагоцитов, как инициатора воспалительной реакции, является пусковым моментом для избыточного выделения интерлейкинов и других биологически активных веществ (Меньщикова Е.Б. и соавт., 2006; Пасечник И.Н., 2002, Новик Е.С., 2007).
Исследование крови пострадавшего проводят именно на 2-е сутки после травмы, поскольку к этому времени, как правило, наблюдается относительная стабилизация состояния больного вследствие выведения из шока, улучшения реологических свойств крови. Одновременно, к этому времени происходит ограничение очагов ишемии и формирование очагов травматического некроза в головном мозге, что позволяет только к этому времени оценить функциональные возможности ткани головного мозга (Касумова С.Ю. Патоморфология черепно-мозговой травмы//Нейротравматология. Справочник. - Ростов-на-Дону, 1999, с.187-191). Это позволяет оценить функциональные возможности ткани головного мозга, не поврежденной необратимо в результате полученной травмы с минимальным влиянием процессов, протекающих в организме в период шока.
Препарат рекомбинантного эритропоэтина человека (Эпокрин) разрешен к медицинскому применению приказом МЗМП РФ №212 от 20 июля 1995 г. - гликопротеид, по своему составу, биологическим и иммунологическим свойствам идентичен природному эритропоэтину человека. Препарат рекомбинантного эритропоэтина человека проявляет свойства нейропротектора в экспериментальной модели инсульта и ЧМТ. Препарат уменьшает объем зоны повреждения и улучшает функциональный исход, что возможно обусловлено подавлением воспалительного ответа на повреждение (Hasselblatt et al., 2006). Sakanaka et al. (1998) установили, что эритропоэтин может увеличивать деятельность антиокислительных ферментов, таких как супероксиддисмутаза, глутатионпироксидаза в нейронах, таким образом, защищая мозговую паренхиму от повреждения при ишемии. Описано его использование для лечения церебральных ишемий (патент №2242991, опубликован 27.12.2004). Calapai et al. (2000) и Sasaki (2000) предположили, что эритропоэтин может проявлять нейропротективное действие, уменьшая NO-обусловленное формирование свободных радикалов или противодействуя их токсичности. Chen et аl. (2007) в своем исследовании на модели животного с травмой головного мозга установили, что введение рекомбинантного эритропоэтина может уменьшить воспалительный ответ в мозге после травматического повреждения и это может являться одним из механизмов, посредством которых рекомбинантный эритропоэтин улучшает результаты лечения. Учитывая, что течение ТБГМ зависит от степени баланса между провоспалительными и противовоспалительными цитокинами в тканях головного мозга (Soares et al., 1995) и от выраженности сдвигов метаболического обмена в системе ПОЛ и АОЗ (Ромоданов А.П., Копьев О.В., Педаченко Е.Г. и др. Патогенетическое обоснование периодов травматической болезни головного мозга// Журнал вопросы нейрохирургии им. Н.Н.Бурденко, 1990, №6, с.10-13), динамика изменений данных показателей могут служить объективными лабораторными критериями оценки метаболических сдвигов в течении ТБГМ.
Способ осуществляют следующим образом.
После предварительного обследования пострадавшего, включающего клинические и лабораторные исследования, больному для определения уровня цитокинов забирают кровь из локтевой вены иглой с широким просветом без шприца. Для получения плазмы пробы крови центрифугируют 15 минут при 3000 об/мин. Получают эритроцитарную массу и плазму крови, которую отбирают и хранят при температуре +4°С.
Данные исследования проводят по приведенным ниже методикам.
Определение в крови количественной концентрации цитокинов ИЛ-6 и ИЛ-10 проводят методом, основанным на твердофазном «сэндвич»-варианте иммуноферментного анализа. Специфическими реагентами набора являются моноклональные антитела, сорбированные на поверхности лунок разборного полистирольного планшета.
Методика исследования однотипна для количественного определения ИЛ-1 бета, ИЛ-6, ФНО-альфа, ИЛ-10. На первой стадии анализа исследуемые и контрольные образцы инкубируют в лунках с иммобилизированными антителами. Несвязавшийся материал удаляют отмывкой. Связавшийся цитокин взаимодействовал при инкубации с конъюгатом №1 (антитела к определенному цитокину человека с биотином). Далее несвязавшийся конъюгат №1 удаляют отмывкой. На третий стадии связавшийся конъюгат №1 взаимодействовал при инкубации с конъюгатом №2 (стрептавидин с пероксидазой хрена). Несвязавшийся конъюгат так же удаляют и количество связавшегося конъюгата №2 определяют цветной реакцией с использованием субстрата пероксидазы хрена-перекиси водорода и хромогена-тетраметилбензидина. Реакцию останавливают добавлением стоп-реагента и измеряют оптическую плотность растворов в лунках при длине волны 450 нм. Интенсивность желтого окрашивания пропорциональна количеству содержащегося в образце интерлейкина.
Для определения уровня ИЛ-6, ИЛ-10 используют наборы реагентов ИФА-Бест ЗАО «Вектор-Бест» (г.Новосибирск). Измерения проводят с помощью вертикального спектрофотометра «Униплан 2005». Количественное содержание цитокинов выражают в пкг/мл.
Определение содержания малонового диальдегида (МДА) в эритроцитах крови проводят по методу И.Д.Стальной и Т.Д.Горишвили (Стальная И.Д., Горишвили Т.Д. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты. - В кн.: Современные методы в биохимии. - М.: «Медицина», 1977, с.66-68), в основе которого лежит образование окрашенного триметилового комплекса МДА с двумя молекулами 0,68% тиобарбитуровой кислоты. К 1 мл 1% гемолизата добавляли 1 мл 33% раствора трихлоруксусной кислоты и 1 мл 0,75% раствора ТБК. Пробы помещали в кипящую водяную баню при 100°С на 15 мин. После охлаждения пробы центрифугировали при 3000 об/мин. Оптическую плотность раствора измеряли на ФЭК при длине волны 535 нм в кювете с толщиной слоя 1 см против дистиллированной воды.
Количество ТБК-активных продуктов вычисляли по формуле:
С-D/KlV,
где D - оптическая плотность пробы;
К - молярный коэффициент, равный 1,56·105 моль-1см-1;
l - толщина кювета;
V - объем пробы.
Содержание МДА в гемолизате выражают в нмоль/мг гемоглобина.
Определение содержания внутриклеточной супероксиддисмутазы проводят по методу Сироты (Сирота Т.В. Новый подход в исследовании процесса аутоокисления адреналина и использования его для измерения активности супероксиддисмутазы//Вопр. мед. химии, 1999, №3, с.14-15). Принцип метода определения внутриклеточной СОД основывается на ее способности ингибировать процесс восстановления нитротетразолиевого синего (НТС) при аутоокислении адреналина в адренохром в щелочной среде в условиях генерации супероксидного анион радикала.
К 1 мл 1% гемолизата добавляют 250 мкл 96% этилового спирта и 150 мкл хлороформа, интенсивно встряхивают до полного осаждения гемоглобина, препятствующего определению. Центрифугируют при 3000 об/мин в течение 10-15 минут.
К 3,5 мл 50 ммоль Na-карбонатного буфера (рН 10,55) добавляют 100 мкл супернатанта-гемолизата эритроцитов с осажденным гемоглобином (50 мкл плазмы), 0,2 мл водного раствора HTC (1:1v:v) и 50 мкл 0,1% раствора адреналина, тщательно перемешивают. Инкубируют в водяном термостате при +27°С в течение 10 минут по секундомеру. Развивается фиолетовая окраска. Оптическую плотность опытных проб измеряют при длине волны 540 нм против контрольной пробы. В контроль вместо биосубстрата вносят соответствующее количество дистиллированной воды. Активность СОД вычисляют по формуле:
Т%=(Ек-Еоп/Ек)·100%,
где Т% - процент ингибирования реакции востановления НТС;
Ек - оптическая плотность контрольной пробы;
Еоп - оптическая плотность опытной пробы.
За условную единицу активности фермента принимают 50% ингибирование скорости восстановления НТС.
СОД(для гемолизата)=Т%/50%·V·t·c,
где V - объем биосубстрата (мл);
t - время инкубации (мин);
с - концентрация гемоглобина в 1 мл гемолизата (г/л).
Активность СОД выражают в усл.ед./мин·мг Hb.
После забора крови на исследование больному внутривенно вводят Эпокрин в дозе 10000 ME. Через 24 часа после введения Эпокрина у больного повторно производят забор венозной крови, в которой вновь определяют концентрацию тех же показателей.
Затем для каждого из рассматриваемых показателей определяют (в процентах) относительное изменение его значения после введения Эпокрина путем вычисления отношения разницы значений каждого из рассматриваемых показателей до и после введения Эпокрина к значению соответствующего показателя до введения Эпокрина. Вычисления производят по формуле:
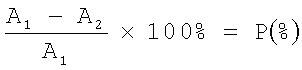
где A1 - значение показателя до введения Эпокрина,
А2 - значение показателя после введения Эпокрина,
Р - относительное изменение значений.
При повышении содержания ИЛ-6 на 35% и выше и ИЛ-10 не более чем на 20%, МДА - на 30% и выше, на фоне повышения уровня СОД не более чем на 45% прогнозируют неблагоприятное течение ТБГМ.
По результатам прогноза больному корректируют курс интенсивной терапии.
Работоспособность заявляемого метода подтверждается следующими клиническими примерами.
Пример 1.
Больной П-ов, 36 лет, история болезни №37088, поступил в отделение анестезиологии и реанимации МЛПУ ГБСМП №2 г. Ростова-на-Дону по поводу открытой ЧМТ, тяжелого ушиба головного мозга со сдавлением мозга внутримозговой гематомой, ушибленной раны головы. При поступлении состояние кр. тяжелое, кожа и видимые слизистые бледной окраски, АД=100/60 мм рт.ст., пульс = 90 уд. в мин, ЧД = 16 в мин, уровень сознания - кома I, зрачки D=S, фотореакция снижена, нистагм горизонтальный, мышечный тонус снижен. По данным компьютерной томограммы головного мозга (КТ): внутримозговая медиальная гематома справа, субарахноидальное кровоизлияние. При ультразвуковом (УЗ) исследовании органов брюшной полости патологии не выявлено, свободная жидкость не определялась. Больному был назначен комплекс интенсивной терапии, включающий в себя гемостатические, дегидратационные мероприятия, а также ингаляцию увлажненного кислорода через лицевую маску.
Сразу после поступления в стационар, в первые сутки от момента травмы, после предварительного обследования пострадавшего, включающего клинические и лабораторные исследования, у больного из периферической вены был произведен забор крови, в которой определили показатели: ИЛ-6=145,20 пг/мл, ИЛ-10=5,84 пг/мл, МДА=1,66 нмоль/мг Hb, СОД=1,86 ед./мин·мг Hb. После забора крови больному внутривенно ввели Эпокрин в дозе 10000 ME, разведенный в 10 мл изотонического раствора NaCl. Через 24 часа после введения Эпокрина у больного повторно произвели забор венозной крови, в которой вновь определили значение тех же показателей цитокинов, ПОЛ и системы АОЗ. Были получены следующие величины: ИЛ-6=197,18 пг/мл, ИЛ-10=6,97 пг/мл, МДА=2,17 нмоль/мг Hb, СОД=2,68 ед./мин·мг Hb. Затем, по предложенной выше формуле, были определены изменения данных показателей после введения Эпокрина. Вычисления показали, что произошло следующее изменение каждого из показателей: повышение ИЛ-6 и ИЛ-10 на 36% и 19,4% соответственно, повышение МДА на 30,7%, повышение СОД на 44%. Больному был поставлен прогноз неблагоприятного течения ТБГМ.
Течение болезни протекало в соответствии с поставленным неблагоприятным прогнозом и осложнилось развитием ПОН, сепсиса, двусторонней пневмонии. Проводилась ИВЛ длительностью 30 суток. В течение 10 дней пациент находился в коме 1, затем его состояние расценивалось как апалический синдром. Через 21 день больной был переведен из АРО в отделение нейрохирургии.
Пример 2.
Больной Ж-ев, 18 лет, история болезни №49113, поступил в отделение анестезиологии и реанимации МЛПУ ГБСМП №2 г. Ростова-на-Дону по поводу ЗЧМТ, ушиба головного мозга тяжелой степени тяжести, травматического субарахноидального кровоизлияния, перелома затылочной кости слева, ссадины лица. При поступлении состояние кр. тяжелое, кожа и видимые слизистые бледной окраски, АД=100/60 мм рт.ст., пульс = 98 уд. в мин, ЧД=16 в мин, уровень сознания - кома I, зрачки D=S, фотореакция снижена, мышечный тонус умеренно снижен. По данным компьютерной томограммы головного мозга (КТ): в левой лобной области очаг геморрагического пропитывания около 2×0,5 см, САК, линейный перелом затылочной кости слева без выраженного смещения отломков. При ультразвуковом (УЗ) исследовании органов брюшной полости патологии не выявлено, свободная жидкость не определялась. Больному был назначен комплекс интенсивной терапии, включающий в себя гемостатические, дегидратационные мероприятия, а также ингаляцию увлажненного кислорода через лицевую маску. Сразу после поступления в стационар, в первые сутки от момента травмы, после предварительного обследования пострадавшего, включающего клинические и лабораторные исследования, у больного из периферической вены был произведен забор крови, в которой определили показатели: ИЛ-6=28,21 пг/мл, ИЛ-10=6,33 пг/мл, МДА=1,57 нмоль/мг Hb, СОД=2,15 ед./мин·мг Hb. После забора крови больному внутривенно ввели Эпокрин в дозе 10000 ME, разведенный в 10 мл изотонического раствора NaCl. Через 24 часа после введения Эпокрина у больного повторно произвели забор венозной крови, в которой вновь определили значение тех же показателей цитокинов, ПОЛ и системы АОЗ. Были получены следующие величины: ИЛ-6=37,97 пг/мл, ИЛ-10=7,65 пг/мл, МДА=2,03 нмоль/мг Hb, СОД=3,14 ед./мин·мг Hb. Затем, по предложенной выше формуле, были определены изменения данных показателей после введения Эпокрина. Вычисления показали, что произошло следующее изменение каждого из показателей: повышение ИЛ-6 и ИЛ-10 на 34,6% и 20,9% соответственно, повышение МДА на 29,3%, повышение СОД на 46%. Больному был поставлен прогноз благоприятного течения ТБГМ.
Течение болезни протекало в соответствии с поставленным благоприятным прогнозом: на 3-е сутки больной вышел из комы, на 7-е сутки больной был переведен из АРО в отделение нейрохирургии. За период наблюдения в АРО осложнений у больного не наблюдалось.
С целью исследования эффективности предлагаемого способа прогнозирования течения ТБГМ в отделении анестезиологии и реанимации БСМП-2 г. Ростова-на-Дону согласно заявляемому способу были обследованы 30 человек с тяжелой сочетанной и изолированной ЧМТ. Из них у 19 пациентов было отмечено повышение уровня ИЛ-6 на 35% и выше, ИЛ-10 - на 20% и ниже, показатель МДАэритроцитов увеличился более чем на 30% на фоне повышения уровня СОД на 45% и менее. У этих пациентов наблюдали неблагоприятное течения ТБГМ.
Таким образом, заявляемый способ позволяет с высокой точностью осуществлять прогноз исхода ТБГМ при наименее травматичном исследовании и производить выбор или корректировку проводимой интенсивной терапии.
Заявляемый метод апробирован в клинической практике и может быть рекомендован к внедрению в стационарах интенсивной терапии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ТРАВМАТИЧЕСКОЙ БОЛЕЗНИ ГОЛОВНОГО МОЗГА | 2001 |
|
RU2178179C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДОВ ЗАБОЛЕВАНИЯ У ПАЦИЕНТОВ С ЧЕРЕПНО-МОЗГОВОЙ ТРАВМОЙ РАЗЛИЧНОЙ СТЕПЕНИ ТЯЖЕСТИ (ЕГО ВАРИАНТЫ) | 2023 |
|
RU2799834C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТЯЖЕСТИ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ | 1998 |
|
RU2146060C1 |
| СПОСОБ ЛЕЧЕНИЯ ПОСТРАДАВШИХ С СОЧЕТАННОЙ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМОЙ | 2010 |
|
RU2446834C2 |
| СПОСОБ ДИАГНОСТИКИ ПРОГРЕДИЕНТНОГО ТЕЧЕНИЯ ТРАВМАТИЧЕСКОЙ БОЛЕЗНИ ГОЛОВНОГО МОЗГА | 2001 |
|
RU2196334C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ИНТЕНСИВНОЙ ТЕРАПИИ У ПОСТРАДАВШИХ С ТЯЖЕЛОЙ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМОЙ | 2010 |
|
RU2441574C1 |
| СПОСОБ ДИАГНОСТИКИ КРАТНОСТИ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ В ОСТРОМ ПЕРИОДЕ СОТРЯСЕНИЯ ГОЛОВНОГО МОЗГА | 2001 |
|
RU2196332C1 |
| СПОСОБ ЛЕЧЕНИЯ ПОСТТРАВМАТИЧЕСКОГО ИММУНОДЕФИЦИТА В ОСТРОМ ПЕРИОДЕ ТРАВМАТИЧЕСКОЙ БОЛЕЗНИ ГОЛОВНОГО МОЗГА | 1999 |
|
RU2141325C1 |
| СПОСОБ ПРЕВЕНТИВНОЙ ТЕРАПИИ РИНАЛЬНЫХ ОСЛОЖНЕНИЙ ПОСЛЕ ТРАВМЫ НОСА | 2013 |
|
RU2559587C2 |
| СПОСОБ ЛЕЧЕНИЯ ЦЕРЕБРОВАСКУЛЯРНЫХ НАРУШЕНИЙ ГОЛОВНОГО МОЗГА (ВАРИАНТЫ) | 2017 |
|
RU2659674C1 |
Изобретение относится к области медицины, а именно нейрореаниматологии, нейрохирургии (нейротравматологии), и касается способа прогнозирования течения травматической болезни головного мозга (ТБГМ) у пострадавших с тяжелой черепно-мозговой травмой (ЧМТ). Сущность способа заключается в том, что в первый час после поступления пациента с тяжелой ЧМТ больному вводят рекомбинантный эритропоэтин человека (Эпокрин) в дозе 10000 ME, внутривенно. До введения эритропоэтина и спустя 24 часа после его введения определяют содержание в сыворотке крови цитокинов: ИЛ-6, ИЛ-10, определяют в эритроцитах крови содержание малонового диальдегида (МДА) и уровень супероксиддисмутазы (СОД). Затем для каждого из рассматриваемых показателей определяют (в процентах) относительное изменение его значения после введения эритропоэтина путем вычисления отношения разницы значений каждого из рассматриваемых показателей до и после введения эритропоэтина к значению соответствующего показателя до введения эритропоэтина. При повышении содержания ИЛ-6 на 35% и выше, ИЛ-10 на 20% и ниже, МДА эритроцитов - более чем на 30%, уровня СОД на 45% и менее прогнозируют неблагоприятное течение ТБГМ. Использование способа позволяет с высокой точностью осуществлять прогноз исхода ТБГМ при наименее травматичном исследовании и производить выбор или корректировку проводимой интенсивной терапии.
Способ прогнозирования течения травматической болезни головного мозга (ТБГМ), предусматривающий исследование биологической жидкости с определением в ней концентрации малонового диальдегида (МДА), отличающийся тем, что у пострадавшего в первые сутки после травмы производят забор венозной крови, в которой помимо определения значения МДА определяют содержание в сыворотке крови цитокинов ИЛ-6, ИЛ-10 и уровень супероксиддисмутазы (СОД), после забора крови больному внутривенно вводят рекомбинантный эритропоэтин человека в дозе 10000 ME, через 24 ч после введения рекомбинантного эритропоэтина человека у больного повторно производят забор венозной крови, в которой вновь определяют значения ИЛ-6, ИЛ-10, МДА эритроцитов и уровень СОД, вычисляют отношение разницы значений каждого из рассматриваемых показателей до и после введения рекомбинантного эритропоэтина человека к значению соответствующего показателя до введения рекомбинантного эритропоэтина человека и при повышении содержания ИЛ-6 на 35% и выше, ИЛ-10 на 20% и ниже, МДА эритроцитов - более чем на 30%, уровня СОД на 45% и менее прогнозируют неблагоприятное течения ТБГМ.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ТРАВМАТИЧЕСКОЙ БОЛЕЗНИ ГОЛОВНОГО МОЗГА | 2001 |
|
RU2178179C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ТРАВМАТИЧЕСКОГО СДАВЛЕНИЯ ГОЛОВНОГО МОЗГА | 2004 |
|
RU2276364C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ТЯЖЕЛОЙ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ | 2000 |
|
RU2199941C2 |
| БОРЩИКОВА Т.И | |||
| и др | |||
| Развитие неспецифических синдромов при тяжелой черепно-мозговой травме и их влияние на течение и исход заболевания //Тезисы докладов | |||
| Анестезия и интенсивная терапия в нейрохирургии и неврологии | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2011-08-20—Публикация
2010-05-27—Подача