Настоящее изобретение относится к получению органических соединений, в частности производного ациламиноалкиленамида - антагониста вещества Р.
Более конкретно настоящее изобретение относится к способу получения соединений формулы I
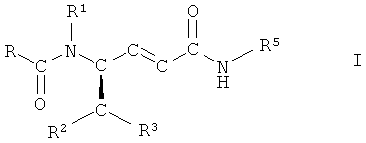 ,
,
или их сольватов, или гидратов,
где R представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы;
R1 представляет собой водород или С1-С7алкил;
R2 представляет собой водород, С1-С7-алкил или фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и C1-C7-алкоксигруппы;
R3 представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы, или R3 представляет собой нафтил, 1H-индол-3-ил или 1-С1-С7-алкилиндол-3-ил и
R5 представляет собой С3-С8-никлоалкил, D-азациклогептан-2-он-3-ил или L-азациклогептан-2-он-3-ил.
Соединения формулы I пригодны для лечения ряда состояний, связанных с веществом Р и нейрокинином.
N-[(E)-(R)-1-(3,4-Дихлорбензил)-3-((R)-2-оксоазепан-3-илкарбонил)аллил]-N-метил-3,5-бистрифтометилбензамид является особенно предпочтительным соединением формулы I. Он также известен как N-[(R,R)-(E)-1-(3,4-дихлорбензил)-3-(2-оксоазепан-3-ил)карбамоил]аллил-N-метил-3,5-бис(трифторметил)бензамид и N-[(R)-эпсилон-капролактам-3-ил]амид (4R)-4-[N'-метил-N'-(3,5-бистрифторбензоил)амино]-4-(3,4-дихлорбензил)бут-2-еновой кислоты, и имеет структуру формулы А
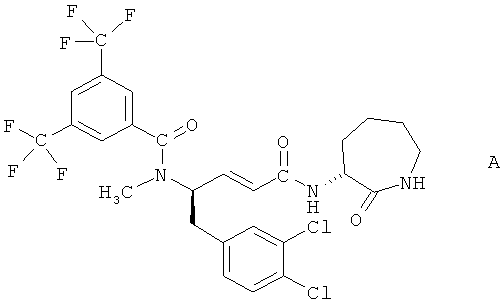 ,
,
Соединение формулы А, особенно его полугидрат, пригодно для лечения функциональных нарушений подвижности внутренних органов, таких как синдром раздраженной толстой кишки или функциональная диспепсия, особенно синдром раздраженной толстой кишки с преобладанием диареи.
Соединения формулы I могут быть получены с использованием способа, описанного в международной патентной заявке WO 98/07694, содержание которой, включено в описание настоящей заявки посредством ссылки.
Однако настоящее изобретение относится к улучшенному способу получения соединений формулы I, их сольватов и гидратов, особенно N-[(R)-эпсилон-капролактам-3-ил]амида(4R)-4-N'-метил-N'-(3,5-бистрифторбензоил)амино]-4-(3,4-дихлорбензил)бут-2-еновой кислоты, с улучшенным уровнем безопасности, гигиены и легкости управления. Способ также обеспечивает достижение высокого выхода в промышленном масштабе.
Первый объект настоящего изобретения относится к способу получения соединений формулы I
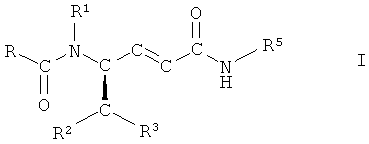 ,
,
или их сольватов, или гидратов,
где R представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы;
R1 представляет собой водород или С1-С7-алкил;
R2 представляет собой водород, С1-С7-алкил или фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы;
R3 представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы, или R3 представляет собой нафтил, 1H-индол-3-ил или 1-С1-С7-алкилиндол-3-ил и
R5 представляет собой С3-С8-циклоалкил, D-азациклогептан-2-он-3-ил или L-азациклогептан-2-он-3-ил,
включающему стадии:
(а) взаимодействие соединения формулы II
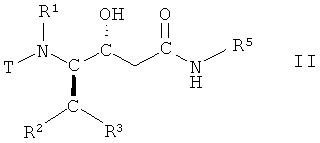 ,
,
в которой R1, R2, R3 и R5 имеют вышеопределенные значения и Т представляет собой защитную группу, с основанием, с получением соединения формулы III
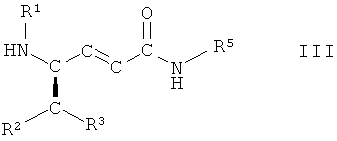 ,
,
в которой R1, R2, R3 и R5 имеют вышеопределенные значения, и
(б) взаимодействие соединения формулы III, в которой R1, R2, R3 и R5 имеют вышеопределенные значения, с соединением формулы IV
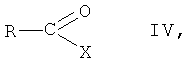
в которой R представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-C7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы, и Х представляет собой галоген, в присутствии основания, с образованием соединения формулы I, и
(в) необязательно, получение его сольвата или гидрата.
Второй объект настоящего изобретения относится к способу получения соединений формулы I
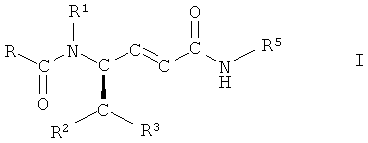 ,
,
или их сольватов, или гидратов,
где R представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы;
R1 представляет собой водород или С1-С7-алкил;
R2 представляет собой водород, С1-С7-алкил или фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и C1-C7-алкоксигруппы;
R3 представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы, или R3 представляет собой нафтил, 1H-индол-3-ил или 1-С1-С7-алкилиндол-3-ил и
R5 представляет собой С3-С8-циклоалкил, D-азациклогептан-2-он-3-ил или L-азациклогептан-2-он-3-ил,
включающему стадии:
(i) взаимодействие соединения формулы V
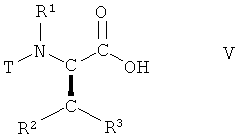 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, с 2,2-диметил[1,3]диоксан-4,6-дионом в присутствии основания с образованием соединения формулы VI
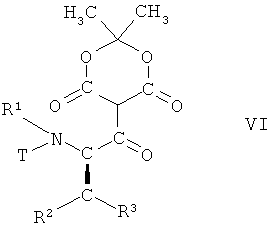 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения и Т
представляет собой защитную группу;
(ii) взаимодействие соединения формулы VI, в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, с метанолом, с получением соединения формулы VII
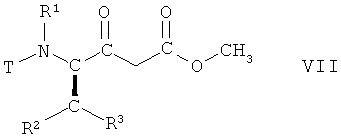 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу;
(iii) восстановление соединения формулы VII, в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, с образованием соединения формулы VIII
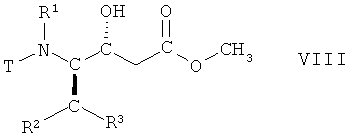 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу;
(iv) гидролиз соединения формулы VIII, в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, с получением соответствующей карбоновой кислоты формулы IX
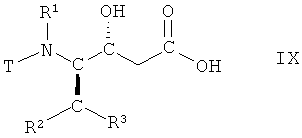 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу;
(v) взаимодействие соединения формулы IX, в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, с соединением формулы Х
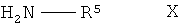 ,
,
в которой R5 представляет собой С3-С8-циклоалкил, D-азациклогептан-2-он-3-ил
или L-азациклогептан-2-он-3-ил, с образованием соединения формулы II
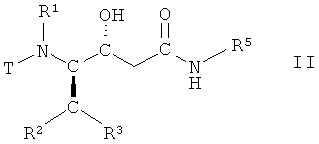 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения, Т представляет собой защитную группу и R5 представляет собой С3-C8-циклоалкил, D-азациклогептан-2-он-3-ил или L-азациклогептан-2-он-3-ил;
(vi) необязательно, очистка соединения формулы II, в которой R1, R2, R3 и R5 имеют вышеопределенные значения и Т представляет собой защитную группу;
(vii) взаимодействие соединения формулы II, в которой R1, R2, R3 и R5 имеют вышеопределенные значения и Т представляет собой защитную группу, с основанием, с получением соединения формулы III
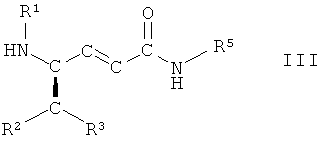 ,
,
в которой R1, R2, R3 и R5 имеют вышеопределенные значения;
(viii) взаимодействие соединения формулы III, в которой R1, R2, R3 и R5 имеют вышеопределенные значения, с соединением формулы IV
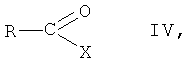
в которой R представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы, и Х представляет собой галоген, в присутствии основания, с образованием соединения формулы I, и
(ix) необязательно, получение его сольвата или гидрата.
Термины, используемые в описании, имеют следующие значения.
«Галоген» или «гало», как используется в описании, означает элемент, относящийся к группе 17 (прежде группа VII) Периодической таблицы элементов, который может быть, например, фтором, хлором, бромом или йодом. Предпочтительным галогеном или гало является хлор или бром, особенно хлор.
«С1-С7-алкил», как используется в описании, означает прямолинейную или разветвленную алкильную группу, включающую от 1 до 7 атомов углерода, которая может быть, например, метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом, трет-бутилом, прямолинейным или разветвленным пентилом, прямолинейным или разветвленным гексилом или прямолинейным или разветвленным гептилом.
«С1-С7-алкоксигруппа», как используется в описании, означает прямолинейную или разветвленную алкильную группу, связанную с О, которая может быть, например, метоксигруппой, этоксигруппой, н-пропоксигруппой, изопропоксигруппой, н-бутоксигруппой, изобутоксигруппой, втор-бутоксигруппой, трет-бутоксигруппой, прямолинейной или разветвленной пентилоксигруппой, прямолинейной или разветвленной гексилоксигруппой или прямолинейной или разветвленной гептилоксигруппой.
«С3-С7-циклоалкил», как используется в описании, означает полностью насыщенное карбоциклическое кольцо, имеющее от 3 до 8 кольцевых атомов углерода, например моноциклическую группу, такую как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, или бициклическую группу, такую как бициклогептил или бициклооктил.
По всему тексту описания и последующей формулы изобретения, до тех пор, пока по смыслу не потребуется иное, слово «включает» или варианты, такие как «включают» или «включающий», следует понимать как включающее в себя указанное целое число, или интервал или группу целых чисел, или интервалов, не исключая любого другого целого числа или группы целых чисел, или их интервала или интервалов.
В соответствии с формулой I следующие подходящие, предпочтительные, более предпочтительные или наиболее предпочтительные аспекты изобретения, могут быть охвачены независимо, совместно или в любой комбинации.
Подходящий R представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, C1-C7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы. В случае, когда R представляет собой фенил, замещенный С1-С7-алкилом, предпочтительно он является фенилом, замещенным С1-С4-алкилом. Однако, когда R представляет собой фенил, замещенный С1-С7-алкоксигруппой, то он предпочтительно представляет собой фенил, замещенный С1-С4-алкоксигруппой.
Более подходящий R представляет собой фенил, замещенный в одном или двух положениях, особенно в двух положениях, трифторметилом. Главным образом, R представляет собой 3,5-бистрифторметилфенил.
Подходящий R1 представляет собой С1-С7-алкил, более предпочтительно -С1-С4-алкил, еще более предпочтительно -метил.
Подходящий R1 представляет собой водород или С1-С7-алкил.
Предпочтительным R2 является водород.
Подходящий R3 представляет собой фенил, замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы.
Более подходящим является R3, представляющий собой фенил, замещенный в одном или двух положениях, предпочтительно в двух положениях, галогеном, предпочтительно хлором. Особо подходящим является R3, представляющий собой 3,4-дихлорфенил.
Подходящим R5 является D-азациклогептан-2-он-3-ил.
Соединения формулы I или промежуточные соединения, используемые для получения соединений формулы I, могут быть фармацевтически приемлемыми соединениями формулы I, меченными изотопами или промежуточными соединениями, меченными изотопами, используемыми для получения соединений формулы I соответственно, в которых один или более атомов заменены атомами, имеющими аналогичное атомное число, а атомную массу или массовое число, отличное от атомной массы или массового числа, обычно найденного в природе. Примеры изотопов, подходящих для введения в соединения, включают изотопы водорода, например 2Н и 3Н, углерода, например 11С, 13С и 14С, хлора, например 36Cl, фтора, например 18F, йода, например 123I и 125I, азота, например 13N и 15N, кислорода, например, 15О, 17O и 18О, и серы, например 35S.
Некоторые меченные изотопами соединения формулы I, например введением радиоактивного изотопа, пригодны для исследований распределения в тканях лекарственного средства и/или субстрата. Особенно пригодны для таких целей радиоактивные изотопы трития (3Н) и углерода-14 (14С), ввиду легкости их введения и доступности средств регистрации. Замещение тяжелыми изотопами, такими как дейтерий (2Н) может оказывать некоторый терапевтический эффект, возникающий в результате большой метаболической стабильности, например увеличение периода полувыведения in vivo или уменьшение необходимой дозировки, и, следовательно, может быть предпочтительным в некоторых случаях. Замещение позитронактивными изотопами, такими как 11С, 18F, 15О и 13N, может быть полезным для позитронно-эмиссионной томографии (PET) для изучения занятости рецептора субстратом.
Меченные изотопами соединения формулы I или меченные изотопами промежуточные соединения, используемые для получения соединений формулы I, в общем, могут быть получены традиционными методами, известными специалисту, или способами, аналогичными способам, описанным в сопроводительных примерах, с использованием соответствующего меченного изотопами реагента вместо ранее использованного немеченого реагента.
Фармацевтически приемлемые сольваты настоящего изобретения включают такие, в которых растворитель кристаллизации может быть замещен изотопами, например D2O, d6-ацетон или d6-ДМСО.
Соединения формулы I могут быть получены из соединения формулы V
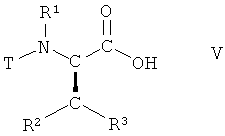 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, посредством осуществления следующего многостадийного способа.
На стадиях способа 1 и 2 соединение формулы V такое, как определено выше, удлиняется на два атома углерода.
На первой из этих стадий соединение формулы V, в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, взаимодействует с 2,2-диметил[1,3]диоксан-4,6-дионом (кислота Мельдрума), в присутствии основания, с образованием соединения формулы VI
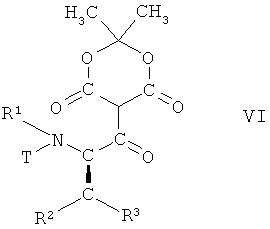 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, или по аналогии, например, так, как описано далее в примерах.
Данную стадию целесообразно осуществлять в присутствии основания, например диметилпиридин-4-иламина. Стадию целесообразно проводить в органическом растворителе, например толуоле. Температура реакции может быть, например, от комнатной температуры до 60°С, предпочтительно от 25°С до 35°С.
Защитная группа Т может быть выбрана из подходящих защитных групп в соответствии с природой функциональной группы, например так, как описано в Protective Groups in Organic Synthesis, T.W.Greene and P.G.M.Wuts, John Wiley & Sons Inc, 2е издание, 1991, где также описаны методики, пригодные для замещения защитной группы водородом. Подходящей является защитная группа, представляющая собой трет-бутоксикарбонил или ВОС.
В способе, раскрытом в WO 98/07694, для получения соединений формулы I лекарственное вещество получают разделением двух диастереомеров на последней промежуточной стадии. На данной стадии происходит потеря более чем половины материала. Начиная осуществление данного способа с использованием оптически активного соединения, можно избежать данной проблемы, что позволяет значительно увеличить выход и уменьшить потери.
На стадии 2 способа соединение формулы VI, в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, взаимодействует с метанолом, предпочтительно при отсутствии воды, с получением соединения формулы VII
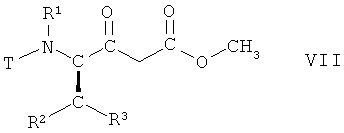 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, или аналогичным образом, например, так, как описано далее в примерах.
На стадии 3 способа соединение формулы VII, в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, восстанавливают, с получением соответствующего (R)-гидроксисоединения, т.е. соединения формулы VIII
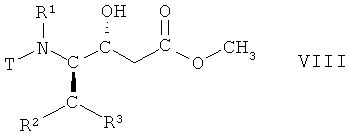 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу. Взаимодействие осуществляют с использованием известных процедур восстановления кетонов или аналогичным образом, например так, как описано далее в примерах. Реакцию целесообразно проводить в смеси органических растворителей, например трет-бутилметилового эфира и метанола, и воды. Подходящим восстановителем является борогидрид натрия. Взаимодействие может быть осуществлено при комнатной температуре, но целесообразно при 15°С-25°С.
Полученное (R)-гидроксисоединение имеет правую конфигурацию для дальнейшего образования транс-двойной связи.
На стадии 4 способа соединение формулы VII, в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, подвергают гидролизу с получением соответствующей карбоновой кислоты, т.е. соединения формулы IX
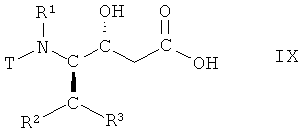 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу. Взаимодействие осуществляют с использованием известных методик гидролиза сложных эфиров, с получением карбоновых кислот, или аналогичным образом, например так, как описано далее в примерах. Реакцию традиционно проводят в смеси водорастворимых органических растворителей, например, трет-бутилметилового эфира и метанола, и воды. Подходящим гиролизующим агентом является сильное основание, такое как моногидрат гидроксида лития. Взаимодействие может быть осуществлено при комнатной температуре, но предпочтительно при 15°С-25°С.
На стадии 5 способа соединение формулы IX, в которой R1, R2 и R3 имеют вышеопределенные значения и Т представляет собой защитную группу, взаимодействует с соединением формулы Х
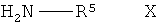 ,
,
в которой R5 представляет собой С3-С8-циклоалкил, D-азациклогептан-2-он-3-ил или L-азациклогептан-2-он-3-ил, с образованием соединения формулы II
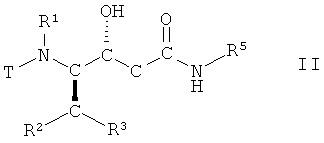 ,
,
в которой R1, R2 и R3 имеют вышеопределенные значения, Т представляет собой защитную группу и R5 представляет собой С3-С8-циклоалкил, D-азациклогептан-2-он-3-ил или L-азациклогептан-2-он-3-ил.
Реакцию осуществляют с использованием известных процедур взаимодействия карбоновых кислот с аминами, с получением амидных производных, или аналогичным образом, например так, как описано далее в примерах. Традиционно взаимодействие осуществляют в органических растворителях, например N,N-диметилформамиде. Реакцию целесообразно осуществлять при комнатной температуре, но предпочтительно при 15°С-25°С.
На стадии 6 способа соединение формулы II очищают, т.е. удаляют нежелательные изомеры. Неожидано получение продукта высокой чистоты было достигнуто посредством перемешивания в органическом растворителе, например трет-бутилметиловом эфире, при температуре от комнатной температуры до 60°С, целесообразно от 45°С до 55°С, но особенно целесообразно при температуре около 50°С.
На стадии 7 способа соединение формулы II, в которой R1, R2, R3 и R5 имеют вышеопределенные значения и Т представляет собой защитную группу, взаимодействует с основанием, с образованием соединения формулы III
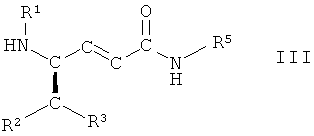 ,
,
в которой R1, R2, R3 и R5 имеют вышеопределенные значения. Обычно в бета-гидроксисложных эфирах или амидах гидроксильную группу вначале превращают в уходящую группу перед отщеплением, индуцированным основанием, с образованием транс-двойной связи. Однако, неожиданно, на стадии 7 способа транс-двойную связь получают при одностадийном, индуцированном основанием, одновременном удалении как (R)-гидроксигруппы, так и ВОС-группы. Кроме того, соответствующий изомер соединения, имеющий гидроксильную группу в (S)-конфигурации, не подвергается взаимодействию.
Обычно реакцию проводят в органическом растворителе, например тетрагидрофуране. Температура реакции может быть, например, от -10°С до 10°С, целесообразно от -5°С до 5°С, но особенно целесообразно от -2°С до 2°С. Данные условия реакции оптимизируют для поддержания образования побочных продуктов на низком уровне: с основаниями более сильными чем, например, этоксид натрия в этаноле, наблюдается преимущественное образование цис-связи, что сподвигает двойную связь на образование енамина и эпимиризацию в кампролактамном фрагменте. С более слабыми основаниями требуется большее время реакции и достигается лишь частичная конверсия.
На стадии 8 способа соединение формулы III, в которой R1, R2, R3 и R5 имеют вышеопределенные значения, взаимодействует с соединением формулы IV
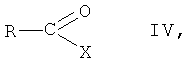
в которой R представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, C1-C7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы, и Х представляет собой галоген, целесообразно хлор, в присутствии основания, с образованием соединения формулы I, в которой R1, R2, R3 и R5 имеют вышеопределенные значения, или его соли.
Реакцию осуществляют с испозованием известных методик взаимодействия аминов с ацилгалогенидами, с образованием амидных производных, или аналогичных образом, например так, как описано далее в примерах. Обычно реакцию проводят в органическом растворителе, например трет-бутилметиловом эфире, и основание представляет собой, например, триэтиламин. Температура реакции может быть, например, от -10°С до 20°С, целесообразно от -5°С до 15°С, но особенно целесообразно от 0°С до 5°С.
На стадии 9 способа, которая является необязательной стадией, соединение формулы I, в которой R1, R2, R3 и R5 имеют вышеопределенные значения, кристаллизуют в подходящем растворителе с получением свободного соединения, сольвата или гидрата.
Соединения формулы I могут быть получены в форме свободного соединения, его гидрата или сольвата, содержащего растворитель, применяемый для кристаллизации. Например, когда соединение формулы I представляет собой соединение формулы А, его кристаллизуют из метанола и воды с получением стабильного полугидрата лекарственного вещества.
Изобретение иллюстрируется следующим примером.
ПРИМЕР
Получение полугидрата N-[(Е)-(R)-1-(3,4-дихлорбензил)-3-((R)-2-оксоазепан-3-илкарбамоил)аллил]-N-метил-3,5-бистрифторметилбензамида
Полугидрат N-[(Е)-(R)-1-(3,4-дихлорбензил)-3-((R)-2-оксоазепан-3-илкарбамоил)аллил]-N-метил-3,5-бистрифторметилбензамида получают нижеследующим способом. Все реакции проводят в атмосфере азота.
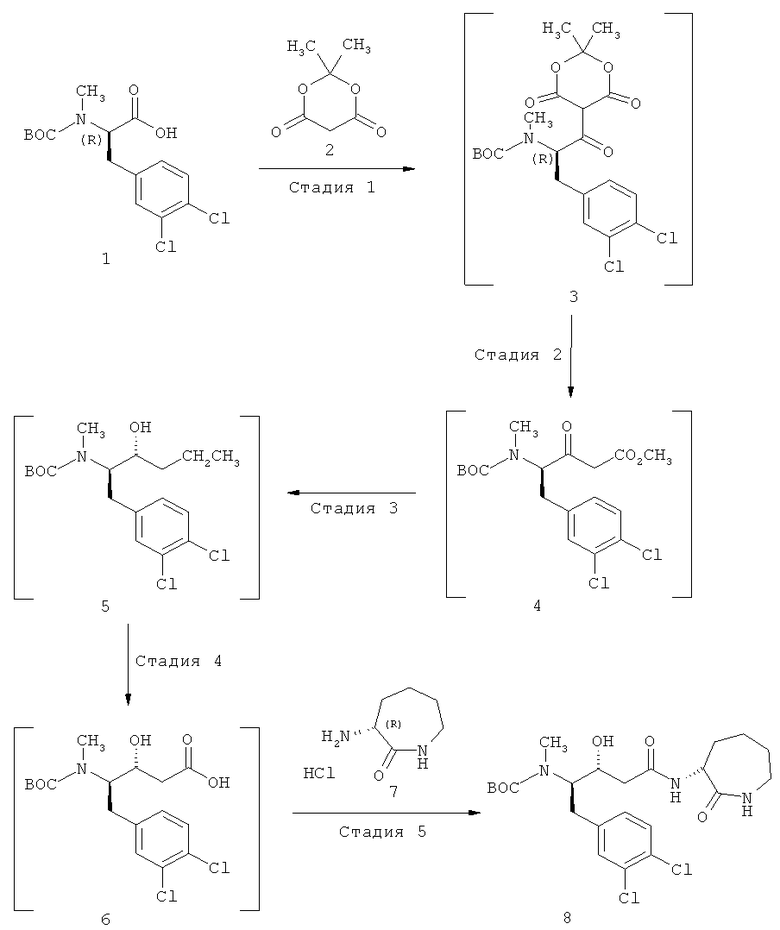
Стадии 1+2: метиловый эфир (R)-4-(трет-бутоксикарбонилметиламино)-5-(3,4-дихлорфенил)-3-оксопентановой кислоты
Раствор 1,3-дициклогексилкарбодиимида (2,9011 г, 13,9 ммоля) в толуоле (3 мл) при 29-31°С в течение приблизительно 1 ч добавляют к перемешиваемой в толуоле (3 мл) смеси (R)-2-(трет-бутоксикарбонилметиламино)-3-(3,4-дихлорфенил)пропионовой кислоты (1, 4,179 г, 12 ммоля), 2,2-диметил[1,3]диоксан-4,6-диона (2, 1,7815 г, 12,36 ммоля) и диметилпиридин-4-иламина (2,0943 г, 16,8 ммоля). Для промывки используют толуол (1 мл). Перемешивание при 29-31°С продолжают еще приблизительно 3 ч. После охлаждения до температуруры около 0°С (-2°С/2°С) к суспензии добавляют 25% (мас./мас.) раствор гидросульфата калия (приблизительно 9 мл) до достижения значения рН 2-3. Затем перемешивание прекращают и позволяют слоям разделиться. После этого смесь медленно перемешивают, фильтруют при охлаждении (0-5°С), а остаток на фильтре промывают толуолом (12 мл, 0-5°С). Слоям фильтрата позволяют разделиться при температуре около 0-5°С. Нижний водный слой отделяют. Верхний органический слой, содержащий промежуточный трет-бутиловый эфир [(R)-1-(3,4-дихлорбензил)-2-(2,2-диметил-4,6-диоксо[1,3]диоксан-5-ил)-2-оксоэтил]метилкарбаминовой кислоты (3), пропускают через фильтр, наполненный безводным сульфатом натрия (5 г), при 0-5°С и фильтрат помещают в реактор, содержащий метанол (18 мл, 20-25°С). Остаток на фильтре промывают толуолом (5 мл) и фильтрат также помещают в реактор. Полученный раствор нагревают (температура рубашки около 68°С) и перемешивают при температуре около 63°С приблизительно 4 ч, затем концентрируют при температуре рубашки около 50°С и пониженном давлении, с получением маслянистого остатка, который растворяют в трет-бутилметиловом эфире (24 мл) при нормальном давлении и температуре рубашки около 50°С, а после этого снова концентрируют при пониженном давлении с получением метилового эфира (R)-4-(трет-бутоксикарбонилметиламино)-5-(3,4-дихлорфенил)-3-оксопентановой кислоты (4) в виде маслянистого остатка. Затем остаток снова растворяют в трет-бутилметиловом эфире (24 мл) при нормальном давлении и температуре рубашки 50°С, а после этого охлаждают до 18-22°С и непосредственно используют на следующей стадии.
Стадия 3: метиловый эфир (3R,4R)-4-(трет-бутоксикарбонилметиламино)-5-(3,4-дихлорфенил)-3-гидроксипентановой кислоты (5)
Борогидрид натрия (0,227 г, 6 ммоля) добавляют к перемешиваемому раствору метилового эфира (R)-4-(трет-бутоксикарбонилметиламино)-5-(3,4-дихлорфенил)-3-оксопентановой кислоты (4) в трет-бутилметиловом эфире при 18-22°С. Затем при 18-22°С в течение приблизительно 20 мин добавляют воду (3 мл) и перемешивание продолжают около 15 мин. Затем при 18-22°С в течение приблизительно 30 мин добавляют метанол (3 мл) и перемешивание продолжают около 30 мин, получая метиловый эфир (3R,4R)-4-(трет-бутоксикарбонилметиламино)-5-(3,4-дихлорфенил)-3-гидроксипентановой кислоты (5), который непосредственно используют на следующей стадии.
Стадия 4: (3R,4R)-4-(трет-бутоксикарбонилметиламино)-5-(3„4-дихлорфенил)-3-гидроксипентановая кислота (6)
Воду (3 мл) при 18-22°С добавляют к перемешиваемому реакционной смеси, содержащей метиловый эфир (3R,4R)-4-(трет-бутоксикарбонилметиламино)-5-(3,4-дихлорфенил)-3-гидроксипентановой кислоты (5), а затем добавляют моногидрат гидроксида лития (0,775 г, 18 ммолей). Перемешивание при 18-22°С продолжают около 2 ч. После этого в течение приблизительно 30 мин добавляют соляную кислоту (около 12,6 мл 2 н. раствора, 25,2 ммоля) до получения значения рН 1,7-2,2. Затем к перемешиваемой смеси добавляют толуол (12 мл) и перемешивание при 18-22°С продолжают около 10 мин. Перемешивание прекращают и позволяют слоям разделиться. Нижний водный слой отделяют, а верхний органический слой экстрагируют водой (12 мл). Перемешивание прекращают и нижний водный слой отделяют. Органический слой фильтруют через фильтр, наполненный безводным сульфатом натрия (3 г), для удаления остатков воды и 1,3-дициклогексилмочевины, образовавшейся на стадии 1. Остаток на фильтре промывают толуолом (2 мл) и затем к фильтрату добавляют N,N-диметилформамид (12 мл). Полученный раствор концентрируют дистилляцией толуола при температуре рубашки около 50°С и пониженном давлении до получения остатка объемом приблизительно 14 мл. Полученный раствор, содержащий (3R,4R)-4-(трет-бутоксикарбонилметиламино)-5-(3,4-дихлорфенил)-3-гидроксипентановую кислоту (6), непосредственно используют на следующей стадии.
Стадия 5: трет-бутиловый эфир [(1R,2R)-1-(3,4-дихлорбензил)-2-гидрокси-3-((R)-оксоазепан-3-илкарбамоил]пропил]метилкарбаминовой кислоты (8)
Триэтиламин (1,396 г = 1,91 мл, 13,8 ммоля) добавляют к перемешиваемой смеси гидрохлорида (R)-3-аминоазепан-2-она (7) в N,N-диметилформамиде (12 мл) при 18-22°С и после этого перемешивание продолжают еще около 1 ч. К перемешиваемой смеси при 18-22°С добавляют гидрат 1-гидроксибензотриазола (2,113 г, 13,8 ммоля), а затем раствор (3R,4R)-4-(трет-бутоксикарбонилметиламино)-5-(3,4-дихлорфенил)-3-гидроксипентановой кислоты (6) в N,N-диметилформамиде. N,N-Диметилформамид (2 мл) используют для промывки. Смесь охлаждают до 0-5°С, а затем последовательно добавляют 1,3-дициклогексилкарбодиимид (2,847 г, 13,8 ммоля) и N,N-диметилформамид, применяемый для промывки. Перемешивание при 0-5°С продолжают около 1 ч, после этого смесь нагревают до приблизительно 18-22°С и перемешивают еще около 20 ч. Выпавшие в осадок твердые вещества выделяют фильтрованием, а остаток на фильтре промывают N,N-диметилформамидом (12 мл). Полученный фильтрат концентрируют при температуре рубашки приблизительно 60°С и пониженном давлении, до получения около 19,5 г концентрата. Полученную суспензию охлаждают до приблизительно 20-25°С и в течение приблизительно 20 мин добавляют водный раствор гидрокарбоната калия (1,92 г, 19,17 ммоля) в воде (32 мл), с выделелением диоксида углерода, получая суспензию. Выпавшие в осадок твердые вещества выделяют фильтрованием, промывают водой (24 мл) и сушат под вакуумом при приблизительно 60°С до постоянной массы, получая сырой трет-бутиловый эфир [(1R,2R)-1-(3,4-дихлорбензил)-2-гидрокси-3-((R)-2-оксоазепан-3-илкарбамоил)пропил]метилкарбаминовой кислоты (8) (6,019 г, 99,8% от теории, исходя из (R)-2-(трет-бутоксикарбонилметиламино)-3-(3,4-дихлорфенил)пропионовой кислоты (1).
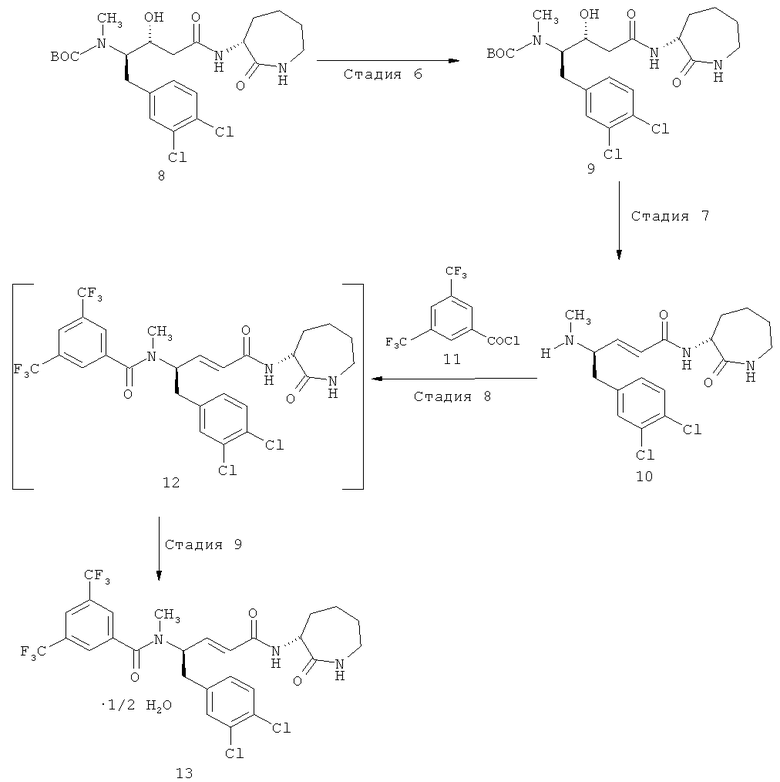
Стадия 6: трет-бутиловый эфир [(1R,2R)-1-(3,4-дихлорбензил)-2-гидрокси-3-((R)-2-оксоазепан-3-илкарбамоил)пропил]метилкарбаминовой кислоты (9)
трет-Бутиловый эфир [(1R,2R)-1-(3,4-дихлорбензил)-2-гидрокси-3-((R)-2-оксоазепан-3-илкарбамоил)пропил]метилкарбаминовой кислоты (8) (6,019 г) добавляют к перемешиваемому трет-бутилметиловому эфиру (35 мл) при температуре около 20-25°С. Затем смесь нагревают до температуры около 50-52°С и перемешивают при этой температуре около 1 ч. После этого суспензию охлаждают до приблизительно 0-5°С и перемешивают при этой температуре около 1 ч. Выпавшие в осадок твердые вещества выделяют фильтрованием, промывают трет-бутилметиловым эфиром (24 мл) и сушат под вакуумом при приблизительно 70°С до постоянной массы, получая трет-бутиловый эфир [(1R,2R)-1-(3,4-дихлорбензил)-2-гидрокси-3-((R)-2-оксоазепан-3-илкарбамоил)пропил]метилкарбаминовой кислоты (9) (4,2625 г, 70,7% от теории, исходя из (R)-2-(трет-бутоксикарбонилметиламино)-3-(3,4-дихлорфенил)пропионовой кислоты (1). Степень чистоты 98,5% (ВЭЖХ, расчет по площади). После этого продукт очищают кристаллизацией из смеси дихлорметан/трет-бутилметиловый эфир, т.пл. 186,8-187,4°С, MS-ES+ (MNa)+=524 (35Cl2), [α]D 20=+17,24° (94% этанол).
Стадия 7: ((R)-2-оксоазепан-3-ил)амид (E)-(R)-5-(3,4-дихлорфенил)-4-метиламинопент-2-ановой кислоты (10)
Перемешиваемую смесь трет-бутилового эфира [(1R,2R)-1-(3,4-дихлорбензил)-2-гидрокси-3-((R)-2-оксоазепан-3-илкарбамоил)пропил]метилкарбаминовой кислоты (9) (1,005 г, 2,0 ммоля) и тетрагидрофурана (12 мл) охлаждают до -2°С/2°С и затем в течение приблизительно 20 мин при -2°С/2°С добавляют 21% раствор этоксида натрия в этаноле (1,5 мл, 4,0 ммоля). Полученный раствор перемешивают при приблизительно 0°С около 4,5 ч, а затем при приблизительно 0°С в течение приблизительно 10 мин добавляют 5 мас.% водный раствор гидрокарбоната калия (0,253 г, 2,53 ммоля в 4,81 г воды). Температуру увеличивают до приблизительно 20°С, а затем добавляют толуол (17 мл). После перемешивания в течение приблизительно 16 ч при температуре около 20°С перемешивание останавливают и позволяют слоям разделиться. Нижний водный слой отделяют, а органический слой экстрагируют водой (3,5 мл). Затем органический слой концентрируют при температуре рубашки 60°С и пониженном давлении, до получения около 10 г остатка, вызывая кристаллизацию продукта. По истечении перемешивания в течение приблизительно 10 мин при 60°С дистилляцию продолжают до получения приблизительно 5 г остатка. После этого добавляют воду (0,36 мл) и продолжают перемешивание при 60°С около 30 мин. Затем смесь около 30 мин охлаждают до приблизительно 0°С и продолжают перемешивание при этой температуре приблизительно 2 ч. Выпавшие в осадок твердые вещества выделяют фильтрованием и остаток на фильтре промывают толуолом (3 мл). После сушки при приблизительно 60°С под вакуумом до постоянной массы, получают ((R)-2-оксоазепан-3-ил)амид (E)-(R)-5-(3,4-дихлорфенил)-4-метиламинопент-2-ановой кислоты (10) (0,580 г, 75,5% от теории, исходя из (9), т.пл. 153-158°С, MS-ES+: (MH)+=384 (35Cl2), [α]D 20=-80,4° (этанол).
Стадия 8: N-[(E)-(R)-1-(3,4-дихлорфенил)-3-((R)-2-оксоазепан-3-илкарбамоил)аллил]-N-метил-3,5-бистрифторметилбензамид (12)
Перемешиваемую смесь ((R)-2-оксоазепан-3-ил)амида (E)-(R)-5-(3,4-дихлорфенил)-4-метиламинопент-2-ановой кислоты (10) (1,1529 г, 3 ммоля) в трет-бутилметиловом эфире (10 мл) охлаждают до приблизительно 0°С. После этого в течение приблизительно 15 мин при 0-5°С добавляют 3,5-бистрифторметилбензоилхлорид (0,87 г = 0,57 мл, 3,15 ммоля), а затем в течение приблизительно 30 мин при приблизительно 0-5°С добавляют триэтиламин (0,319 г = 0,44 мл, 3,15 ммоля). Перемешивание при 0-5°С продолжают около 10 мин, а затем смесь в течение приблизительно 30 мин нагревают до 20-25°С. Выпавшие в осадок твердые вещества удаляют фильтрованием и остаток на фильтре промывают трет-бутилметиловым эфиром (5 мл). Полученный фильтрат перемешивают и добавляют метанол (3 мл). Затем раствор концентрируют дистилляцией при температуре рубашки около 50°С и пониженном давлении до получения приблизительно 10,5 мл остатка. После этого добавляют метанол (8,5 мл) и раствор снова концентрируют дистилляцией при температуре рубашки около 50°С и пониженном давлении до получения приблизительно 10,5 мл остатка. Снова добавляют метанол (8,5 мл) и раствор концентрируют дистилляцией при температуре рубашки около 50°С и пониженном давлении до получения приблизительно 10,5 мл остатка. Раствор, содержащий N-[(E)-(R)-1-(3,4-дихлорфенил)-3-((R)-2-оксоазепан-3-илкарбамоил)аллил]-N-метил-3,5-бистрифторметилбензамид (12), охлаждают до 18-22°С и непосредственно используют на следующей стадии.
Стадия 9: полугидрат N-[(E)-(R)-1-(3,4-дихлорбензил)-3-((R)-2-оксоазепан-3-илкарбамоил)аллил]-N-метил-3,5-бистрифторметилбензамида (13)
Воду (2,6 мл) добавляют к перемешиваемому раствору (10,5 мл) N-[(E)-(R)-1-(3,4-дихлорфенил)-3-((R)-2-оксоазепан-3-илкарбамоил)аллил]-N-метил-3,5-бистрифторметилбензамида (12) в метаноле при приблизительно 18-22°С до начала кристаллизации. После перемешивания в течение около 10 мин при 18-22°С добавляют воду (1 мл) в течение приблизительно 20 мин. Перемешивание при 18-22°С продолжают 2 ч. Выпавшие в осадок твердые вещества выделяют фильтрованием и остаток на фильтре промывают смесью метанола и воды (2 мл + 1 мл), а затем водой (3 мл). Твердое вещество сушат при 30°С под вакуумом до постоянной массы, получая полугидрат N-[(E)-(R)-1-(3,4-дихлорфенил)-3-((R)-2-оксоазепан-3-илкарбамоил)аллил]-N-метил-3,5-бистрифторметилбензамида(13) [1,6241 г = 85,5% от теории, исходя из ((R)-2-оксоазепан-3-ил)амида (E)-(R)-5-(3,4-дихлорфенил)-4-метиламинопент-2-ановой кислоты (10)], т.пл. 127-131°С, спекание >123°С, MS-ES+: (MH)+=624 (35Cl2), [α]D 20=+40,6° (метанол).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ АЦИЛАМИНОАЛКЕНИЛЕНАМИДА ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ ФУНКЦИОНАЛЬНОЙ ПОДВИЖНОСТИ ВНУТРЕННИХ ОРГАНОВ | 2003 |
|
RU2353356C2 |
| АЦИЛАМИНОАЛКЕНИЛЕНАМИДНЫЕ ПРОИЗВОДНЫЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2185375C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ФЕНИЛПРОПАРГИЛОВОГО ЭФИРА | 2001 |
|
RU2259353C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИМИДАЗОПИРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОВТИ TNF | 2014 |
|
RU2684635C1 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИМИДАЗОПИРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2697090C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОПИРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2696275C1 |
| АКТИВНЫЙ КОМПОНЕНТ ЛЕКАРСТВЕННОГО ПРЕПАРАТА, СТЕРОИД, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2172740C2 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2009 |
|
RU2518462C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2691629C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОПИРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2678305C1 |
В настоящей заявке описан способ получения соединений формулы (I) 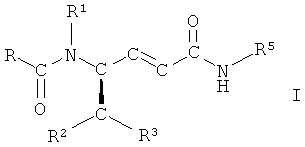
путем взаимодействия соединения 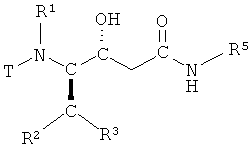
с основанием и последующего взаимодействия образующегося соединения 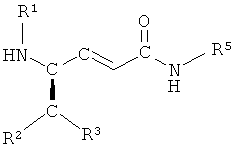 с соединением
с соединением 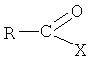 , где R, R1, R2, R3, R5, Т и X имеют значения, указанные в формуле изобретения. Соединения формулы I пригодны для лечения ряда состояний, связанных с веществом Р и нейрокинином. 4 з.п. ф-лы.
, где R, R1, R2, R3, R5, Т и X имеют значения, указанные в формуле изобретения. Соединения формулы I пригодны для лечения ряда состояний, связанных с веществом Р и нейрокинином. 4 з.п. ф-лы.
1. Способ получения соединений формулы I
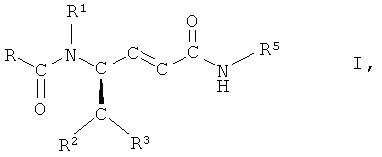
или их сольватов, или гидратов, где
R представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы;
R1 представляет собой водород или С1-С7-алкил;
R2 представляет собой водород, С1-С7-алкил или фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы;
R3 представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы, или R3 представляет собой нафтил, 1H-индол-3-ил или 1-С1-С7-алкилиндол-3-ил; и
R5 представляет собой С3-С8-циклоалкил, D-азациклогептан-2-он-3-ил или L-азациклогептан-2-он-3-ил,
включающий стадии:
(а) взаимодействия соединения формулы II
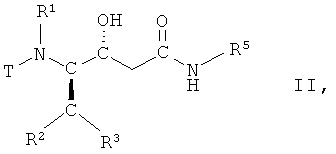
в которой R1, R2, R3 и R5 имеют вышеопределенные значения, и Т представляет собой ВОС защитную группу, где ВОС представляет собой трет-бутоксикарбонил, с основанием, с получением соединения формулы III
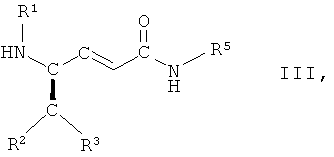
в которой R1, R2, R3 и R5 имеют вышеопределенные значения; и
(б) взаимодействия соединения формулы III, в которой R1, R2, R3 и R5 имеют вышеопределенные значения, с соединением формулы IV
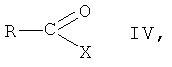
в которой R представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы, и X представляет собой галоген, в присутствии основания, с образованием соединения формулы I, и
(в) необязательно, получение сольвата или гидрата.
2. Способ по п.1, в котором основание, используемое на стадии (а), представляет собой этоксид натрия.
3. Способ по п.1 или 2, в котором соединение формулы II, в которой R1, R2, R3 и R5 и Т имеют значения, указанные в п.1, получают посредством стадий:
(i) взаимодействия соединения формулы V
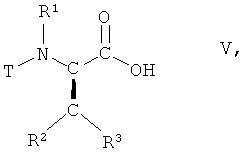
в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с 2,2-диметал[1,3]диоксан-4,6-дионом в присутствии основания, с образованием соединения формулы VI
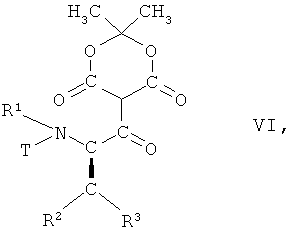
в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу;
(ii) взаимодействия соединения формулы VI, в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с метанолом, с получением соединения, формулы VII
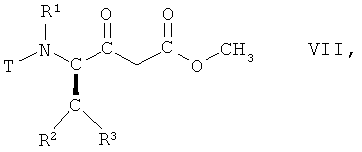
в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу;
(iii) восстановления соединения формулы VII, в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с образованием соединения формулы VIII
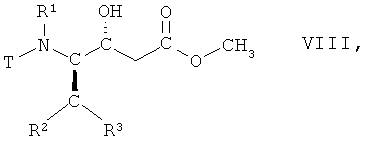
в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу;
iv) гидролиза соединения формулы VIII, в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с получением соответствующей карбоновой кислоты формулы IX
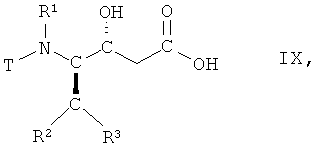
в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу;
(v) взаимодействия соединения формулы IX, в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с соединением формулы X

в которой R5 представляет собой С3-С8-циклоалкил, D-азациклогептан-2-он-3-ил или L-азациклогептан-2-он-3-ил.
4. Способ по п.1 или 2, в котором соединение формулы I представляет собой полугидрат N-[(R)-эпсилон-капролактам-3-ил]амида (4R)-4-[N′-метил-N′-(3,5-бистрифторбензоил)амино]-4-(3,4-дихлорбензил)бут-2-еновой кислоты.
5. Способ получения соединений формулы I по п.1, включающий стадии:
(i) взаимодействия соединения формулы V
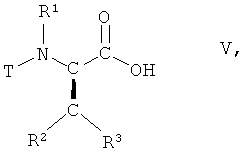
в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с 2,2-диметил[1,3]диоксан-4,6-дионом в присутствии основания, с образованием соединения формулы VI
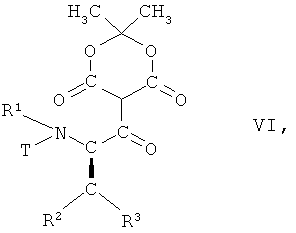
в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу;
(ii) взаимодействия соединения формулы VI, в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с метанолом, с получением соединения формулы VII
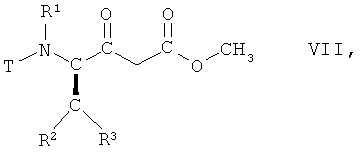
в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу;
(iii) восстановления соединения формулы VII, в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с образованием соединения формулы VIII
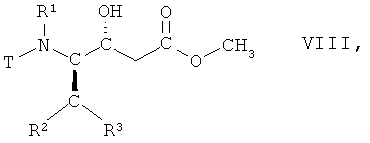
в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу;
(iv) гидролиза соединения формулы VIII, в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с получением соответствующей карбоновой кислоты формулы IX
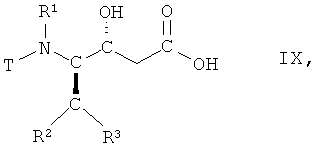
в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу;
(v) взаимодействия соединения формулы IX, в которой R1, R2, R3 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с соединением формулы X

в которой R5 представляет собой С3-С8-циклоалкил, D-азациклогептан-2-он-3-ил или L-азациклогептан-2-он-3-ил, с образованием соединения формулы II
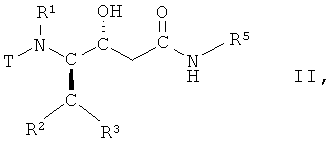
в которой R1, R2, R3 имеют значения, указанные в п.1, Т представляет собой ВОС защитную группу и R5 представляет собой С3-С8-циклоалкил, D-азациклогептан-2-он-3-ил или г-азациклогептан-2-он-3-ил;
(vi) необязательно, очистки соединения формулы II, в которой R1, R2, R3 и R5 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу;
(vii) взаимодействия соединения формулы II, в которой R1, R2, R3 и R5 имеют значения, указанные в п.1, и Т представляет собой ВОС защитную группу, с основанием, с получением соединения формулы III
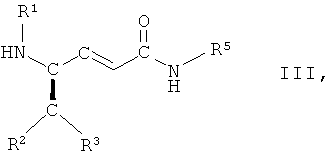
в которой R1, R2, R3 и R5 имеют значения, указанные в п.1;
viii) взаимодействия соединения формулы III, в которой R1, R2, R3 и R5 имеют значения, указанные в п.1, с соединением формулы IV
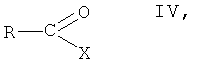
в которой R представляет собой фенил, незамещенный или замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, С1-С7-алкила, трифторметила, гидроксигруппы и С1-С7-алкоксигруппы, и X представляет собой галоген, в присутствии основания, с образованием соединения формулы I, в которой R, R1, R2, R3 и R5 имеют значения, указанные в п.1; и
(ix) необязательно, получения сольвата или гидрата.
| АЦИЛАМИНОАЛКЕНИЛЕНАМИДНЫЕ ПРОИЗВОДНЫЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2185375C2 |
Авторы
Даты
2011-11-10—Публикация
2007-04-11—Подача