Изобретение относится к биотехнологии и медицине и касается биологически активного конъюгата эритропоэтина с полиэтиленгликолем. Конъюгат обладает увеличенным временем циркуляции в крови.
Биологически активные белки (далее БАБ) играют важную роль в поддержании жизнедеятельности организма в целом и каждой его клетки в частности. Примерами таких белков могут быть как ферменты и гормоны, так и цитокины. Наиболее распространенными лекарственными средствами БАБ являются препараты на основе интерферонов, инсулина, гранулоцитного колониестимулирующего фактора, эритропоэтина (далее ЭПО), гормона роста человека и др.
Однако в практической деятельности у данных препаратов было выявлено много недостатков: быстрое разрушение в организме, что вынуждает значительно увеличивать дозу и частоту введения; плохое прохождение в ткани; побочные, в том числе аллергические, реакции и пр. Это диктует необходимость поиска новых лекарственных форм применения БАБ для достижения лучшего биологического эффекта.
Одним из результатов такого поиска было создание соединений протеинов с полиэтиленгликолем (А.В.Кучумова. Пегилирование рекомбинантной L-аспарагиназы Erwinia carotovora с целью усиления ее терапевтически значимых свойств. Диссертация… кандидата биологических наук: 03.00.04 Москва, 2007 102 с.: 61 07-3/645). Этот процесс получил название "ПЭГилирование".
Полиэтиленгликоль (далее ПЭГ) - химическое вещество, обладающее свойствами, которые позволяют использовать его в качестве носителя для биоорганических молекул или соединений. Например, ПЭГ агломерирует молекулы, что позволяет создавать депо лекарственного вещества. Кроме того, вследствие локальной повышенной концентрации действующего вещества усиливается его проведение внутрь тканей.
Весьма большой интерес в этом плане вызывает создание ПЭГилированного эритропоэтина - одного из гормонов почек, который по химическому строению является гликопротеином, состоящим из 165 аминокислот. Физиологически ЭПО является основным регулятором эритропоэза, т.е. стимулирует образование эритроцитов из поздних клеток-предшественников и повышает выход ретикулоцитов из костного мозга. Он способствует пролиферации и дифференцировке клеток эритроидного ростка, а также препятствует их апоптозу. Для выполнения последней функции концентрация эритропоэтина должна поддерживаться на определенном, постоянном для каждого человека, уровне. До тех пор пока не нарушена оксигенация тканей, концентрация эритропоэтина, так же как и объем циркулирующих эритроцитов, остается постоянной (Ермоленко В.М., Николаев А.Ю. Эритропоэтин: биологические свойства и применение в клинике. Тер. арх. 1990; 62(11): 141-145).
Клинически ЭПО применяется для лечения анемии при хронической почечной недостаточности (диализные и предиализные пациенты), при онкологических заболеваниях (цитостатическая терапия), при трансплантации органов и тканей, при комплексном лечении СПИД (терапия ВИЧ-инфекции зидовудином), при аутодонорстве, для лечения анемии при хронических воспалительных заболеваниях, при анемии у ослабленных пациентов (пожилые люди, недоношенные дети, обожженные и т.д.) и при отказе от трансфузий аллогенных гемокомпонентов (Дж.Денхэм, И. Чанарин. Болезни крови у пожилых // М., Медицина, 1989; И.Е.Тареева. Нефрология: Руководство для врачей. М.: Медицина, 1995; 1496 cc., Шевченко Ю.Л. и др., Эритропоэтин в профилактике и лечении анемий. Воен-мед. журн., 1996; 317 (II): 45-8; А.В.Папаян, Л.Ю.Жуков. Анемии у детей, СПБ: Современная медицина, 2008).
Биодоступность коммерческих препаратов на основе рекомбинантного эритропоэтина ограничена из-за короткого периода полураспада в плазме крови и склонности к деградации протеазами (Павлов А.Д., Морщакова Е.Ф. Регуляция эритропоэза: Физиологические и клинические аспекты. М.: Медицина, 1987. 272 cc.).
Таким образом, пегилирование ЭПО является весьма перспективным способом устранения вышеуказанных недостатков.
ПЭГ - химическое вещество, обладающее свойствами, которые позволяют использовать его в качестве носителя для биоорганических молекул или соединений. Одной из важнейших особенностей ПЭГ-молекул является их высокая гидрофильность, формирующая принципиально новые физико-химические свойства модифицируемого пептида. Высокое содержание атомов водорода даже в одной молекуле ПЭГ позволяет ей связываться с 2-3 молекулами воды. Подобный эффект влечет за собой формирование «водного облака» вокруг модифицированной молекулы «ПЭГ-белок», в результате значительно повышается ее гидродинамический радиус. Этот своеобразный «щит» воды, с одной стороны, значительно повышает растворимость и биодоступность препарата, а с другой - защищает молекулу от других белков (антитела, комплемент). (Никитин. И.Г. Пегилированные интерфероны-альфа: новые возможности в лечении хронического гепатита С. Фарматека, №9 (60), 2002).
ПЭГилирование позволяет пролонгировать действие протеинов: получить длительный терапевтический эффект при однократном применении лекарственного средства; избежать колебаний концентрации лекарственных веществ в крови, вызывающих нежелательные побочные явления; снизить токсичность лекарственного вещества (Никитин И.Г., Сторожаков Т.Н. Пегилированные лекарственные препараты, http://medi.ru/doc/08h1301.htm).
В ковалентных конъюгатах ПЭГ защищает полипептид от ферментативной деградации в организме, снижает его иммуногенность, улучшает переносимость, а также увеличивает общий размер молекулы и, как следствие, время ее циркуляции в организме, препятствуя выведению через почки, что допускает более редкое введение препарата и более ровное поддерживание терапевтических концентраций в крови (Никитин И.Г., Сторожаков Г.И. «Вирусные гепатиты, достижения, перспективы», 2001, №3(13), с.3-8).
Наиболее близким аналогом заявленного изобретения является препарат МИРЦЕРА по патенту WO №2002/049673. В данном конъюгате ЭПО и ПЭГ одна линейная молекула полимера массой 30 кДа присоединена к терминальной α-аминогруппе белка посредством амидной связи. Недостаток данного препарата заключен в способе производства, так как ввиду специфики процесса получения препарата МИРЦЕРА определенная часть ε-аминогрупп и гетероциклических атомов азота гистидина и триптофана в данном конъюгате остается заблокированной, что снижает конечную биологическую активность препарата из-за препятствования взаимодействию со специфическими рецепторами.
Предлагаемое изобретение, помимо расширения арсенала эффективных биологически активных средств на основе ЭПО, позволяет по сравнению с наиболее близким аналогом достигнуть увеличения времени циркуляции в крови с большим сохранением биологической активности модифицированного белка.
Данная задача решается за счет получения нового биологически активного конъюгата ЭПО и ПЭГ, отличающегося тем, что молекула ПЭГ присоединена к гликопротеину посредством ароматической азогруппы.
Из известного уровня техники не следует, что такое присоединение приведет к меньшей потере уровня активности белка. Данный технический эффект является неочевидным.
Таким образом, заявленное техническое решение не только является новым, но и не следует из существующего уровня техники.
Следующая структура иллюстрирует заявленное изобретение
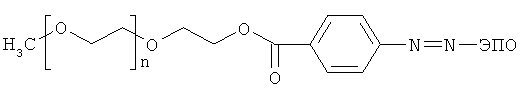
где ЭПО - эритропоэтин;
N - целое число в интервале от 450 до 1140.
Молекулярная масса ПЭГ в предлагаемом конъюгате находится в интервале от 20 до 50 кДа.
Особенность предлагаемого конъюгата заключается в том, что ПЭГ с ЭПО связан посредством азогруппы, образующей хромофор, поглощающий в видимой и ближней УФ-области электронного спектра (20000-34000 см-1) и придающий окраску целевому конъюгату (фиг.1).
Рекомбинантный эритропоэтин, используемый в заявленном изобретении, может быть типа альфа или бета.
Пример 1. Фармакокинетика конъюгата ПЭГ-ЭПО.
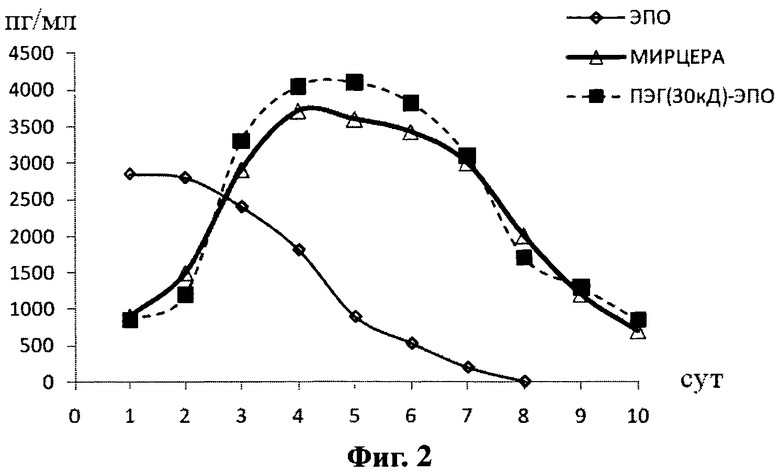
Самцам мышей линии СВА внутримышечно вводили по 1 мкг конъюгата ПЭГ-ЭПО, после чего собирали кровь в первый день через 2 ч после инъекции и далее через каждые 24 ч в течение 10 дней. В качестве контроля использовали препарат МИРЦЕРА и свободный ЭПО, которые вводили по той же схеме. Взятые пробы крови инкубировали в течение 45 мин при 37°С, после чего отделяли тромб и повторно инкубировали при 4°С, полученную сыворотку центрифугировали и сохраняли при -65°С до проведения тестов. Содержание ПЭГ-ЭПО в сыворотках крови определяли с помощью иммуноферментного анализа. Данные по фармакокинетики препаратов представлены на фиг.2, из которой видно, что время циркуляции ПЭГ-ЭПО сопоставимо со временем циркуляции препарата МИРЦЕРА.
Пример 2. Специфическая активность ПЭГ-ЭПО.
Специфическую активность определяли измерением увеличения количества эритроцитов после парентерального введения ПЭГ-ЭПО нормоцитемическим мышам линии B6D2F1, возрастом от 7 до 15 недель. Животным вводили ранжированные дозы, которые приводили к измеряемому увеличению числа ретикулоцитов. Подсчет количества ретикулоцитов в крови экспериментальных животных осуществляли методом микрофлуориметрии в проточном цитометре. In vivo активность испытуемых образцов ПЭГ-ЭПО рассчитывали методом параллельных линий по сравнению с биологической активностью стандартного образца. В качестве контроля использовали препарат МИРЦЕРА. Показатели биологических активностей приведены в таблице.
Таким образом, полученные данные показали, что предложенный конъюгат ПЭГ-ЭПО сохраняет значительную часть биологической активности немодифицированного ЭПО и превосходит активность препарата МИРЦЕРА.
Пример 3. Токсичность ПЭГ-ЭПО.
Токсичность ПЭГ-ЭПО оценивали на самцах мышей линии СВА, которым вводили конъюгат ПЭГ-ЭПО в интервале от 50 до 500 МЕ/кг. При введении животным предлагаемого конъюгата не регистрировались летальные эффекты, не установлено значимых изменений во внутренних органах, гематологических и биохимических показателей крови. На основании полученных данных, исходя из того, что разовая доза конъюгата для человека составляет не более 50 МЕ/кг, был сделан вывод о том, что предлагаемый конъюгат ПЭГ-ЭПО является нетоксичным соединением.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНТЕРФЕРОН, КОНЪЮГИРОВАННЫЙ С ПОЛИЭТИЛЕНГЛИКОЛЕМ | 2010 |
|
RU2433135C1 |
| КОНЪЮГАТ ГЛИКОПРОТЕИНА, ОБЛАДАЮЩЕГО АКТИВНОСТЬЮ ЭРИТРОПОЭТИНА, С ПРОИЗВОДНЫМИ N-ОКСИДА ПОЛИ-1,4-ЭТИЛЕНПИПЕРАЗИНА (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА | 2013 |
|
RU2556378C2 |
| ПРИМЕНЕНИЕ ЭРИТРОПОЭТИНА | 2003 |
|
RU2305554C2 |
| ПРОИЗВОДНЫЕ ПОЛИЭТИЛЕНГЛИКОЛЯ, СОДЕРЖАЩИЕ АРОМАТИЧЕСКУЮ ДИАЗОГРУППУ | 2010 |
|
RU2439091C1 |
| Пролонгированный фактор эритропоэза человека и лекарственное средство на его основе | 2015 |
|
RU2664588C2 |
| ГЕМОСТИМУЛИРУЮЩЕЕ СРЕДСТВО | 2010 |
|
RU2437675C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ЦИТОКИНОВОГО И ИММУНОМОДУЛИРУЮЩЕГО ДЕЙСТВИЯ | 2002 |
|
RU2222345C2 |
| ЛЕЧЕНИЕ НЕЙРОДЕГЕНЕРАТИВНЫХ РАССТРОЙСТВ | 2006 |
|
RU2467761C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ Fc-ОБЛАСТЬ ИММУНОГЛОБУЛИНА В КАЧЕСТВЕ НОСИТЕЛЯ | 2004 |
|
RU2352583C2 |
| БЕЛКОВЫЙ КОМПЛЕКС, ПОЛУЧЕННЫЙ С ИСПОЛЬЗОВАНИЕМ ФРАГМЕНТА ИММУНОГЛОБУЛИНА, И СПОСОБ ПОЛУЧЕНИЯ ТАКОГО КОМПЛЕКСА | 2004 |
|
RU2356909C2 |
Изобретение относится к биотехнологии и к иммунологии. Изобретение представляет собой эритропоэтин, конъюгированный с полиэтиленгликолем, где ПЭГ присоединен к эритропоэтину посредством ароматической азогруппы. Изобретение позволяет увеличить время циркуляции эритропоэтина в крови с сохранением его биологической активности. 2 з.п. ф-лы, 2 ил., 1 табл.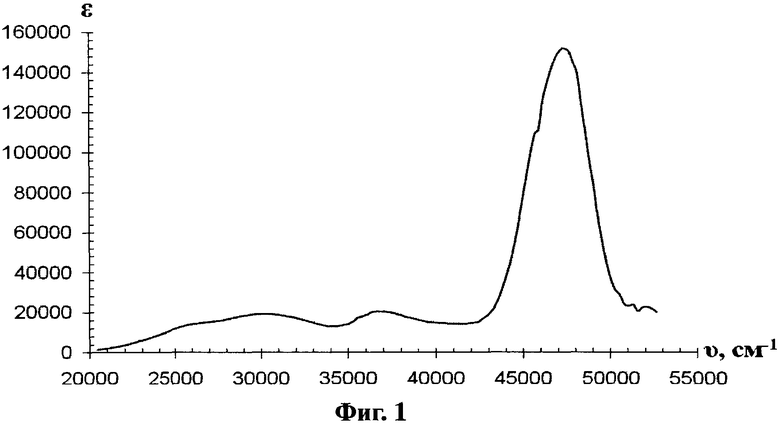
1. Эритропоэтин, конъюгированный с полиэтиленгликолем (ПЭГ), отличающийся тем, что ПЭГ присоединен к эритропоэтину посредством ароматической азогруппы и имеет следующую структуру:

где ЭПО - эритропоэтин;
n - целое число в интервале от 450 до 1140.
2. Эритропоэтин, конъюгированный с ПЭГ, по п.1, отличающийся тем, что эритропоэтин является рекомбинантным эритропоэтином типа альфа или бета.
3. Эритропоэтин, конъюгированный с ПЭГ, по п.1, отличающийся тем, что молекулярная масса полиэтиленгликолевого фрагмента находится в интервале от 20 до 50 кДа.
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ЦИТОКИНОВОГО И ИММУНОМОДУЛИРУЮЩЕГО ДЕЙСТВИЯ | 2002 |
|
RU2222345C2 |
| RU 2073031 C1, 10.02.1997. | |||
Авторы
Даты
2011-11-10—Публикация
2010-10-06—Подача