Настоящее изобретение относится к композициям, содержащим нестеридные противовоспалительные лекарственные средства, к способам их получения и применения.
Нестеридные противовоспалительные лекарственные средства (НПВС) представляют собой широко распространенный класс лекарственных средств. Они составляют четко определенную группу соединений и включают фенилпропионовые кислоты, такие как ибупрофен, напроксен, кетопрофен и флурбипрофен. Они используются преимущественно для лечения одного из нескольких состояний: боли, воспаления и лихорадки, например, ревматоидного артрита, анкилозирующего спондилита, остеоартрита, послеоперативной боли, послеродовой боли и повреждения мягких тканей.
НПВС представляют собой в основном кислотные и по существу нерастворимые лекарственные средства. Они обычно вводятся в виде пероральной фармацевтической композиции, имеющей форму таблеток. Соответственно, для сочетания с НПВС могут быть выбраны фармацевтически приемлемые эксципиенты, с которыми НПВС совместимы и с которыми могут быть сформированы таблетки с достаточной степенью твердости, способные быстро высвобождать лекарственное средство в организм с тем, чтобы оно было доступно для всасывания.
Основной проблемой, связанной с указанными выше расстройствами, является оптимизация начала действия НПВС, особенно в случае лечения боли. Считается, что быстрое разложение композиции приводит к быстрому разложению лекарственного средства в организме, что ведет к более раннему началу терапевтического действия в сравнении со стандартной дозированной формой. Соответственно, желательно получить твердую дозированную форму для перорального введения, которая была бы адаптирована для целей быстрого разложения в желудочно-кишечном тракте. Однако поскольку многие НПВС представляют собой кислые лекарственные средства, их всасывание может стать проблематичным в кислой среде желудка. Кроме того, хотя в литературе имеется много сообщений о композициях, приспособленных для быстрого высвобождения, тем не менее, основной проблемой, связанной с приемом ибупрофена и других НПВС, является то, что их необходимо вводить в относительно высоких дозах, то есть до 800 мг на стандартную дозу. Таким образом, возникает проблема, связанная с созданием дозированной формы, которая бы включала НПВС вместе с эксципиентами, используемыми для создания таблетированной дозированной формы, а также с эксципиентами, применяемыми для достижения быстрого разложения, но при этом таблетка не должна быть слишком большой, с тем, чтобы быть удобной для приема и чтобы такие таблетки можно было производить в стандартных условиях крупномасштабного производства. Кроме того, твердые стандартные дозированные формы должны обладать достаточной твердостью для получения в условиях жесткого процесса производства (например, в тех случаях, когда в процесс производства включается стадия нанесения пленочного покрытия в перфорированном вращающемся барабане, а также стадия упаковки в соответствующих условиях и т.п.), но при этом она должна обладать соответствующими характеристиками по разложению, с тем чтобы достигалось быстрое высвобождение лекарственного средства из композиции, и поддерживались соответствующие показатели растворения. Другой существенной проблемой, которую также необходимо преодолеть, является то, что композиция должна быть пригодна для прессования в условиях стандартной машины для таблетирования, так чтобы при этом удалось избежать прилипания композиции к штамповочным частям машины для таблетирования.
В заявке на Европейский патент №362728 (1990 год) описывается процедура получения порошка ибупрофена, который характеризуется легкой текучестью и улучшенными показателями хранения и соответствующими свойствами такой композиции, подходящими для непосредственного таблетирования. Считается, что процесс затвердевания расплавленного ибупрофена представляет собой чрезвычайно непростую задачу, поскольку расплавленный ибупрофен, который застывает при температуре примерно 74,8°С, становится маслянистым и вязким при охлаждении с тенденцией к переохлаждению и преобразуется в кристаллическое состояние лишь очень медленно. В соответствии с EP 362728 было предложено получать частицы ибупрофена в процессе отверждения расплавленного ибупрофена на контактном охлаждающем устройстве (например, на роллере или охлаждающем транспортере) при температуре 0-50°С, при введении затравки, с последующим дроблением. Было предложено вносить затравку путем нанесения расплавленного слоя, который застывает на контактном охладителе. Указанная затравка также может быть добавлена к роллеру в форме частиц или внесена в расплавленный продукт. Предполагается, что любой процесс получения расплавленного ибупрофена может использоваться для образования частиц ибупрофена, хотя наиболее подходящей является процедура получения расплавленного продукта путем ректификации ибупрофена, в соответствии со способом, описанным в заявке на патент Германии №3802619. Единственный пример, приведенный в указанном описании, позволяет увидеть, что порошок ибупрофена, получаемый в соответствии с описанным способом, должен быть смешан со значительным количеством дополнительных эксципиентов перед таблетированием.
В заявке на Европейский патент №686392 (1995 г.) описывается термический процесс получения гранул, пригодных для непосредственного таблетирования, который включает процесс экструзии в расплавленном состоянии активного соединения с низкой точкой плавления и необходимых для таблетирования вспомогательных веществ, при повышенной температуре с образованием гомогенного неагглютинирующего экструдата, который затем измельчают с образованием таблетируемых гранул. За счет функционирования смешивающих и разминающих элементов экструдера, смесь переводят в компактную форму с образованием экструдата в условиях температуры, при которой часть активного соединения плавится. Указанный экструдат прессуют через перфорированную пластинку с получением тонких тяжей диаметром 0,3-2,0 мм и измельчают после охлаждения с получением гранул с желательным размером частиц. Получаемые таким образом гранулы могут быть сразу подвергнуты таблетированию и при этом требуется только один замасливающий агент. Соответственно, активный ингредиент в этом случае имеет форму нерасплавленных кристаллов в отвержденном расплаве других активных ингредиентов. Отмечается, что в рамках данного процесса все вспомогательные компоненты, такие как связующее вещество, вспомогательные добавки, применяемые для разложения, наполнители и другие вспомогательные компоненты, могут быть включены непосредственно в состав гранул.
В контексте вышеуказанного следует отметить документ WO 01/41733 (The Boots Company PLC), в котором описывалось, что если включать агент, способствующий разложению, в расплавленный НПВС и тщательно смешать его с другими компонентами и затем охладить и размолоть до получения гранул, то будет создана композиция, подходящая для таблетирования с минимальным числом эксципиентов, нужных для таблетирования, и обладающая хорошими показателями для таблетирования, показателями разложения и растворения, если в эту композицию будет также включен диоксид кремния. Указанный способ был существенно усовершенствован в сравнении со способом, описанным в WO 02/098391. Таким образом, в рамках указанного способа НПВС образуется в виде гомогенного экструдата в ходе процесса экструзии расплава. В документе описаны предпочтительные условия охлаждения и обработки.
Все указанные выше способы относятся к производству таблеточных композиций, включающих НПВС в качестве единственного основного терапевтического агента. Поскольку наличие других агентов не исключается, то авторы изобретения уделяли первостепенное внимание получению НПВС.
Может возникнуть потребность в получении фармацевтической композиции, которая будет включать другой активный агент анальгетического действия, кроме НПВС, например, сочетанного продукта. Одним из таких анальгетических агентов, который был объединен с НПВС, является ацетаминофен (также измассатный как парацетамол), который проявляет анальгетические (ослабление боли) и антипиретические (ослабление лихорадки) свойства, но по существу не оказывает противовоспалительного эффекта. Такие продукты, в числе других свойственных им показателей, чрезвычайно эффективны для лечения боли и лихорадочного состояния, например, головой боли, мышечной боли и боли в суставах, боли в спине, при кашле, простуде и группе. Однако имеются также проблемы, связанные с созданием пероральной дозированной формы (например, таблеточной формы), содержащей парацетамол.
В частности, парацетамол представляет собой тонкоизмельченный мягкий порошок, и в качестве такового он не подходит для непосредственного прессования в таблетки. Соответственно, необходимо провести предварительную обработку парацетамола перед его прессованием до твердой дозированной формы. В типичном случае парацетамол подвергают влажной грануляции, в коде которой образуется гранулированная форма парацетамола и которую впоследствии смешивают с дополнительными таблеточными эксципиентами, а полученную смесь прессуют с получением таблеток. Альтернативно формы парацетамола, подходящие для непосредственного прессования, которые уже были подвергнуты предварительной обработке, могут быть получены от специализированных поставщиков. Такая потребность в предварительной обработке, как правило, повышает сложность и стоимость процесса получения твердых дозированных форм парацетамола. Кроме того, парацетамол в типичном случае вводится в относительно высоких дозах, например, до 500 мг на стандартную дозу. Соответственно, возникает проблема получения дозированной формы, которая включает парацетамол вместе с эксципиентами, применяемыми для создания таблеточной дозированной формы, и эксципиентами, используемыми для достижения быстрого разложения, но при этом такая таблетка не должна быть слишком крупной и должна быть комфортной для приема пациентом, а получение таких таблеток должно быть совместимо с процессом стандартного крупномасштабного производства. Соответственно, указанная проблема возрастает в случае объединения парацетамола с другим фармацевтически активным агентом (например, НПВС), который также может вводиться в относительно высокой дозе.
Настоящее изобретение направлено на поиски способа получения композиций, включающих и парацетамол, и НПВС, с тем чтобы указанный способ позволил преодолеть по меньшей мере некоторые из указанных выше недостатков. В частности, настоящее изобретение относится к разработке композиций, которые обладают свойствами к таблетированию с минимальным набором таблеточных эксципиентов, и характеризуется выгодными свойствами по таблетированию, показателями разложения и растворения.
Авторы изобретения обнаружили, что если смесь, включающую расплавленный НПВС и парацетамол, содержащиеся в ней, отверждать и формировать в гранулы, то указанные гранулы в типичном случае будут демонстрировать улучшенные показатели текучести, улучшенную способность к прессованию и могут быть подвергнуты непосредственному формированию в таблетки, которые в типичном случае будут также демонстрировать хорошие показатели разложения и растворения.
Соответственно, в первом аспекте настоящего изобретения предлагается способ получения гранулированной композиции, включающей множество отвержденных расплавленных гранул, содержащих нестероидное противовоспалительное средство (НПВС) и парацетамол, где указанный способ включает стадии
(а) формирования расплавленной смеси путем перемешивания расплавленного НПВС в форме свободной кислоты и парацетамола, необязательно при наличии одного или нескольких эксципиентов; и
(b) получения из расплавленной смеси отвержденных расплавленных гранул.
Такой способ далее в тексте называется как «способ согласно настоящему изобретению».
Предпочтительно стадия (а) согласно способу по настоящему изобретению имеет место при расплавлении в экструдере. Предпочтительно на стадии (b) расплавленную смесь охлаждают с получением отвержденного расплава и на основе отвержденного расплава получают множество отвержденных гранул расплава. Множество отвержденных гранул расплава может быть получено при измельчении отвержденного расплава.
Неожиданно было обнаружено, что гранулированная композиция, получаемая по способу согласно настоящему изобретению, в типичном случае демонстрирует улучшенные показатели текучести и легкость прессования, которые отличаются от варианта необработанного парацетамола. Соответственно, гранулированная композиция может быть подвергнута непосредственно прессованию с получением таблеток, при наличии минимального набора таблеточных эксципиентов. При этом таблетки, полученные на основе гранулированной композиции, в типичном случае демонстрируют повышенную твердость в сравнении с более мягкими таблетками, получаемыми на основе сухой смеси парацетамола и ибупрофена. Таблетки, формируемые из гранулированной композиции, в типичном случае обладают достаточной твердостью для введения их в условия жесткой обработки, имеющиеся в процессе производства, например, на стадии нанесения пленочного покрытия. Соответственно, гранулированная композиция позволяет получать препарат в твердой дозированной форме, поскольку легко прессуется и не прилипает к штамповочным частям таблеточной машины. В этой связи выход продукта в процессе прессования при использовании гранулированной композиции, полученной согласно способу настоящего изобретения, существенно возрастает в сравнении с вариантом использования смеси из необработанного парацетамола и НПВС. Кроме того, в типичном случае отсутствует необходимость проводить предварительную обработку парацетамола (например, в рамках процесса грануляции, который повышает текучесть продукта) или использовать непосредственно прессуемые формы парацетамола в способе согласно настоящему изобретению, поскольку парацетамол может быть взят непосредственно без предварительной обработки из объемной формы продукта в процесс производства. Соответственно, способ согласно настоящему изобретению может позволить снизить общую стоимость производства и упростить сложный процесс производства твердых дозированных форм, содержащих НПВС и парацетамол.
Другие преимущества гранулированной композиции, получаемой по способу согласно настоящему изобретению, связаны с относительно малым количеством дополнительных таблеточных эксципиентов, необходимых для получения дозированной формы, в частности, твердой дозированной формы для перорального введения, что, в свою очередь, позволяет получать более мелкие дозированные формы, содержащие относительно высокую концентрацию НПВС и парацетамола, что сопровождается увеличением комфорта для пациента.
Неожиданно было обнаружено, что фармацевтические композиции, в частности, твердые дозированные формы для перорального введения, полученные на основе гранулированной композиции, производимой в соответствии со способом согласно настоящему изобретению, обладают ценными свойствами по разложению. Кроме того, результаты оценки показателя растворимости таких фармацевтических композиций в типичном случае демонстрируют неожиданно высокий уровень растворенных в водной среде НПВС и парацетамола после относительно коротких периодов времени.
Таким образом, способ согласно настоящему изобретению в типичном случае обеспечивает преимущества в процессе обработки НПВС и парацетамола, увеличении комфорта для пациента, увеличении прочности твердых дозированных форм, обладающих желательными показателями разложения и растворения, и в снижении общей стоимости таблеток, изготавливаемых на основе НПВС и парацетамола.
В способе согласно настоящему изобретению НПВС в форме свободной кислоты подвергают расплавлению. Соответственно, термины «расплав» и «расплавленный» в контексте настоящего описания означает, что НПВС в форме свободной кислоты должен быть расплавлен либо полностью, либо по меньшей мере частично, в процессе формирования гранулированной композиции. Предпочтительно НПВС в форме свободной кислоты подвергают полному расплавлению при получении гранулированной композиции.
Термин «НПВС в форме свободной кислоты» авторы используют для обозначения того факта, что НПВС включает кислотную группу, которая не дериватизирована, например, при образовании соли. Термин «НПВС в форме свободной кислоты» включает НПВС, которые включают недериватизированные группы карбоновой кислоты per se (например, пропионовые кислоты) и/или НПВС, которые включают недериватизированные кислотные енольные группы (например, оксикамы). Для специалистов в данной области понятно, что НПВС в форме свободной кислоты отличается по физическим и химическим свойствам от того же НПВС в форме соли. Соответственно, расплавленные смеси, образуемые при расплавлении только солей НПВС (например, без включения в процесс расплава каких-либо НПВС в форме свободной кислоты), не охватываются способом согласно настоящему изобретению. Предпочтительно расплавленную смесь получают путем расплавления НПВС только в форме свободных кислот. Соответственно, расплавленные гранулы, получаемые в соответствии со способом настоящего изобретения, представляют собой по существу формы, свободные от солей НПВС.
Способ по настоящему изобретению позволяет получать гранулярный компонент, включающий множество НПВС, в частности, НПВС, которые предпочтительно ингибируют Cox-1.
Подходящие типы НПВС, которые предпочтительно ингибируют Cox-1, могут быть выбраны из следующих групп:
(1) пропионовые кислоты;
(2) уксусные кислоты;
(3) фенамовые кислоты;
(4) бифенилкарбоновые кислоты;
(5) оксикамы.
Подходящие пропионовые кислоты, которые могут применяться согласно настоящему изобретению, включают, без ограничения, ибупрофен, напроксен, беноксапрофен, флурбипрофен, фенопрофен, фенбуфен, кетопрофен, индопрофен, пирпрофен, карпрофен, оксапрозин, прапопрофен, миропрофен, тиоксапрофен, супрофен, альминопрофен, тиапрофеновую кислоту, флупрофен и буклоксиновую кислоту. Предпочтительные представители группы пропионовой кислоты включают ибупрофен, напроксен, флурбипрофен, фенопрофен, кетопрофен и фенбуфен, в особенности ибупрофен.
Подходящие уксусные кислоты, которые могут применяться согласно настоящему изобретению, включают, без ограничения, индометацин, сулиндак, толметин, зомепирак, диклофенак, фенклофенак, алклофенак, ибуфенак, изоксепак, фурофенак, тиопинак, зидометацин, ацеметацин, фентиазак, клиданак и оксипинак. Предпочтительные представители группы уксусной кислоты включают толметин-натрий, зомепинак-натрий, сулиндак и индометацин.
Подходящие фенамовые кислоты, которые могут применяться согласно настоящему изобретению, включают, без ограничения, мефенамовую кислоту, меклофенамовую кислоту, флуфенамовую кислоту, нифлуминовую кислоту и толфенамовую кислоту. Предпочтительные представители группы фенамовой кислоты включают мефенамовую кислоту и меклофенамовую кислоту.
Бифенилкарбоновые кислоты, подходящие для применения согласно настоящему изобретению, включают, без ограничения, дифлунизал и флуфенизал.
Оксикамы, подходящие для использования согласно настоящему изобретению, включают, без ограничения, мелоксикам, пироксикам, субоксикам, изоксикам. Предпочтительные представители группы оксикамов включают пироксикам и мелоксикам.
Соответственно, НПВС, подходящие для использования согласно настоящему изобретению, демонстрируют в типичном случае изомерию. Соответственно, все стереоизомеры, диастереоизомеры, энантиомеры и их смеси, включающие рацемические смеси НПВС, охватываются областью настоящего изобретения.
Особенно предпочтительный класс НПВС, подходящий для применения в способе согласно настоящему изобретению, представлен пропионовыми кислотами, в особенности 2-арилпропионовыми кислотами, и в частности 2-фенилпропионовыми кислотами.
Особенно предпочтительные пропионовые кислоты включают напроксен, флурбипрофен, ибупрофен и кетопрофен, в частности их рацемические смеси и S(+)-энантиомеры данных соединений. Более предпочтительные 2-арилпропионовые кислоты включают флурбипрофен и ибупрофен, в частности их рацемические смеси и их S(+)-энантиомеры. Еще более предпочтительные 2-арилпропионовые кислоты включают рацемический флурбипрофен и рацемический ибупрофен, в особенности рацемический ибупрофен.
Предпочтительные НПВС, подходящие для применения, согласно настоящему изобретению обладают относительно низкой точкой плавления, так что в этом случае процесс расплавления не требует использования значительных количеств энергии, что позволяет снизить стоимость производства. Как указывалось выше, наиболее подходящий класс соединений включает 2-арилпропионовые кислоты, которые в основном относятся по существу к нерастворимым соединениям с неприятными вкусовыми свойствами. Соответственно, типичные точки плавления низкоплавких НПВС находятся в диапазоне от 30 до 300°С. Предпочтительные НПВС имеют точки плавления в диапазоне 30-200°С (например, рацемический напроксен, имеющий точку плавления 156°С), более предпочтительно в диапазоне 30-160°С и еще более предпочтительно в диапазоне 40-120°С (например, рацемический ибурофен, имеющий точку плавления 114°С), наиболее предпочтительно 40-100°С (например, рацемический ибупрофен, имеющий точку плавления в диапазоне 75-77°С), S(+)-ибупрофен (имеющий точку плавления 52-54°С) и рацемический кетопрофен (имеющий точку плавления 96°С). Предпочтительные низкоплавкие НПВС включают напроксен, кетопрофен, флурбипрофен, ибупрофен. Предпочтительно НПВС имеет форму рацемический смеси или энантиомера (в особенности S(+)-энантиомеров) указанных соединений.
Настоящее изобретение особенно хорошо адаптировано к лекарственному средству, содержащему ибупрофен. Термин «лекарственное средство, содержащее ибупрофен» предпочтительно включает рацемический ибупрофен и S(+)-ибупрофен. Самые удачные результаты были получены при использовании рацемического ибупрофена в форме свободной кислоты, который характеризуется слабой растворимостью и вводится в высокой дозировке.
Соответственно, гранулированные композиции и расплавленные гранулы могут включать одно или несколько разных НПВС согласно настоящему описанию. Однако предпочтительно гранулированная композиция и расплавленные гранулы включают один НПВС. Наиболее предпочтительно гранулированная композиция и расплавленные гранулы включают один НПВС в виде одного энантиомера или рацемической смеси, например, только S(+)-ибупрофен или только рацемический ибупрофен. Кроме того, согласно настоящему описанию гранулированная композиция (например, гранулы расплава) или фармацевтическая композиция, созданная на ее основе, может включать один или несколько других фармацевтических активных агентов, кроме НПВС и парацетамола. Однако высокопредпочтительная гранулированная композиция (например, гранулы расплава) или фармацевтическая композиция, созданная на ее основе, включает НПВС и парацетамол в качестве единственных активных ингредиентов, наиболее предпочтительно один НПВС согласно настоящему описанию и парацетамол.
Соответственно, в том случае, когда НПВС в форме свободной кислоты подвергают расплавлению, образуется жидкая форма продукта. Парацетамол имеет точку плавления в диапазоне 169-172°С, и в зависимости от используемого НПВС в форме свободной кислоты и условий способа производства указанный парацетамол может быть частично или полностью расплавлен в процессе создания гранулированной композиции. Предпочтительно парацетамол по существу не расплавляется в ходе получения гранулированной композиции. Соответственно, парацетамол может частично растворяться в расплавленном НПВС в форме свободной кислоты, однако большая часть парацетамола в типичном случае диспергирована в расплавленном НПВС в форме свободной кислоты. Таким образом, НПВС в форме свободной кислоты растворяется и образует расплавленную фазу, в которую включены парацетамол и другие необязательные эксципиенты.
При охлаждении расплавленной смеси НПВС в форме свободной кислоты и парацетамола указанный НПВС в типичном случае образует непрерывную твердую фазу кристаллического типа, которая облекает или покрывает парацетамол. Отвержденный расплав может быть перемолот непосредственно с получением гранул, которые приемлемы для дальнейшего непосредственного прессования в фармацевтически дозированную форму с минимальным набором таблеточных эксципиентов. Иными словами, НПВС в форме свободной кислоты, по меньшей мере, частично теряет свое кристаллическое состояние и действует как носитель для парацетамола. Предпочтительно, когда НПВС в форме свободной кислоты полностью расплавляется, расплавленный НПВС в форме свободной кислоты при охлаждении образует одну непрерывную фазу, а именно одну непрерывную твердую кристаллическую фазу, то есть кристаллическая структура НПВС не прерывается НПВС, имеющим структуру, отличную от кристаллической. Такое может произойти, например, в том случае, когда НПВС лишь частично расплавлен, и в этом случае кристаллическая структура расплавленного НПВС прерывается наличием нерасплавленного НПВС, то есть в этом случае НПВС не имеет единую кристаллическую структуру, поскольку кристаллическая структура отвержденного расплавленного НПВС отличается (например, по размеру частиц) от соответствующего параметра в кристаллической структуре нерасплавленного НПВС.
Таким образом, в контексте настоящего описания термин «отвержденные гранулы расплава» обозначает гранулы, полученные при смешивании расплавленного НПВС в форме свободной кислоты и парацетамола, необязательно при наличии одного или нескольких таблеточных эксципиентов, с последующим охлаждением до температуры ниже точки плавления НПВС и образованием гранул на основе твердой массы. Гранулированная композиция включает множество таких гранул.
Неожиданно было обнаружено, что если НПВС в форме свободной кислоты полностью расплавляется в процессе получения гранулированной композиции, то полученная фармацевтическая композиция (например, в виде твердой дозированной формы), образованная из такой гранулированной композиции, в типичном случае лучше растворяется и демонстрирует улучшенный профиль растворимости в сравнении с соответствующей фармацевтической композицией, образованной при частичном расплавлении НПВС в форме свободной кислоты. В этой связи фармацевтическая композиция, образованная из гранулированной композиции, в которой НПВС в форме свободной кислоты полностью расплавлен, в типичном случае высвобождает более высокую концентрацию НПВС в водную среду в течение относительно короткого периода времени в сравнении с соответствующей фармацевтической композицией, образованной из гранулированной композиции, в которой НПВС в форме свободной кислоты расплавлен частично.
Неожиданно было обнаружено, что только в случае НПВС в форме свободной кислоты необходимо, чтобы он был расплавлен на стадии (а) согласно способу настоящего изобретения. Парацетамол в типичном случае диспергируется в расплавленном НПВС в форме свободной кислоты и нет необходимости, чтобы он был расплавлен.
Все преимущества, описанные выше применительно к улучшенным показателями текучести, обрабатываемости и показателям растворения гранулированной композиции, в типичном случае сохраняются даже в том случае, когда парацетамол не расплавлен. Соответственно, способ согласно настоящему изобретению может быть осуществлен при такой температуре, когда парацетамол не расплавлен (например, при температуре, которая существенно ниже, чем точка плавления парацетамола), что снижает и/или устраняет возможность разложения парацетамола в процессе получения гранулированной композиции.
Кроме того, и это выглядит еще более неожиданно, такие благоприятные эффекты в типичном случае сохраняются даже в том случае, когда масса парацетамола, присутствующего в расплавленных гранулах, выше, чем масса ибупрофена, также присутствующего в расплавленных гранулах. В частности, было обнаружено, что расплавленная смесь, включающая расплавленный НПВС в форме свободной кислоты, парацетамол и любые другие необязательные эксципиенты, в типичном случае все еще обладает требуемой текучестью, так что она может быть обработана и сформована в расплавленные гранулы с использованием стандартных методик (например, расплавленная смесь может быть сформована в экструдере и затем выпущена из экструдера на охлаждающее полотно, как будет описано ниже), несмотря на то, что расплавленная смесь содержит относительно малую пропорцию расплавленной фазы (то есть расплавленного НПВС в форме свободной кислоты). Неожиданно было обнаружено, что расплавленные гранулы, содержащие большее по массе количество парацетамола, чем ибупрофена, также демонстрируют в типичном случае существенно улучшенные показатели текучести и прессуемости в сравнении с необработанным парацетамолом. В этой связи указанная смесь может подвергаться непосредственному прессованию в таблетки, обладающие желательной твердостью, при использовании минимального набора эксципиентов. Это в особенности удивительно, поскольку известно, что парацетамол представляет собой вещество, плохоподдающееся прессованию, и тем не менее расплавленные гранулы, содержащие избыток парацетамола, демонстрируют существенно улучшенные показатели прессуемости в сравнении с самим парацетамолом. Фармацевтические композиции (например, таблетки), образованные на основе таких гранул, содержащих избыток парацетамола, также демонстрируют желательные показатели растворения парацетамола, в соответствии с которыми достигаются высокие уровни растворенных НПВС и парацетамола в водной среде, в частности, в водно-кислой среде, после относительно коротких периодов времени. Соответственно, такие фармацевтические композиции могут доставлять более высокие количества НПВС и парацетамола в кислых условиях желудочно-кишечного тракта или желудка, когда при наличии такой необходимости их принимает пациент, при этом может быть достигнуто ускорение начала терапевтического действия парацетамола НПВС. Считается, пока лишь в теории, что улучшенный уровень растворения связан с физической структурой расплавленной гранулы. Поскольку парацетамол присутствует в избытке, отвержденные гранулы расплава включают частицы парацетамола, которые частично покрыты оболочкой и прилипают друг к другу в связи с НПВС в форме свободной кислоты. Парацетамол представляет собой легко растворимое вещество в кислых водных условиях, тогда как НПВС в форме свободной кислоты таким не является. Таким образом, в водной среде частицы парацетамола начинают растворяться и тонкие слои НПВС, имеющиеся между такими частицами, уменьшаются и их растворение происходит значительно быстрее. В этой связи другим преимуществом такой гранулированной композиции является ее легкая растворимость.
Соответственно, такие характеристики высокожелательны при проведении комбинированного лечения ибупрофеном и парацетамолом, поскольку парацетамол в типичном случае вводится в относительно высоких дозах (например, 500 мг на стандартную дозу), в сравнении с НПВС (например, 200 мг на стандартную дозу).
Таким образом, в соответствии с предпочтительным аспектом настоящего изобретения масса парацетамола в отвержденных гранулах расплава выше или равна массе НПВС в отвердженных гранулах расплава, применительно к общей массе гранул расплава. Более предпочтительно масса парацетамола в отвержденных гранулах расплава выше, чем масса НПВС в отвержденных гранулах расплава, применительно к общей массе гранул расплава.
Соответственно, масса парацетамола в гранулированной композиции выше или равна, предпочтительно выше чем масса НПВС в гранулированной композиции, применительно к общей массе гранулированной композиции.
Предпочтительно масса парацетамола к массе НПВС в отвержденных гранулах расплава выше чем 1:1, более предпочтительно выше или равна 1,5:1, еще более предпочтительно выше или равна 2:1. Предпочтительно весовое соотношение парацетамола к НПВС в отвержденных гранулах расплава меньше или равно 10:1, более предпочтительно меньше или равно 5:1 и еще более предпочтительно меньше или равно 3:1.
Особенно предпочтительно весовое соотношение парацетамола к НПВС в отвержденных гранулах расплава составляет от 2,2:1 до 2,8:1 и конкретно составляет примерно 2,5:1.
Предпочтительно весовое соотношение парацетамола к НПВС в гранулированной композиции больше чем 1:1, более предпочтительно больше или равно 1,5:1, еще более предпочтительно больше или равно 2:1. Предпочтительно весовое соотношение парацетамола к НПВС в гранулированной композиции меньше или равно 10:1, более предпочтительно меньше или равно 5:1 и еще более предпочтительно меньше или равно 3:1.
Особенно предпочтительно весовое соотношение парацетамола к НПВС в гранулированной композиции составляет от 2,2:1 до 2,8:1 и конкретно составляет примерно 2,5:1.
Предпочтительно парацетамол присутствует в количестве, большем или равном 40 масс.%, более предпочтительно в количестве, большем или равном 45 масс.%, еще более предпочтительно в количестве, большем или равном 50 масс.%, и еще более предпочтительно в количестве, большем или равном 55 масс.% гранулированной композиции, применительно к общей массе гранулированной композиции.
Предпочтительно парацетамол присутствует в количестве, меньшем или равном 80 масс.%, более предпочтительно в количестве, меньшем или равном 75 масс.%, и наиболее предпочтительно в количестве, меньшем или равном 70 масс.%, от гранулированной композиции применительно к общей массе гранулированной композиции.
Предпочтительно парацетамол присутствует в количестве, большем или равном 40 масс.%, более предпочтительно в количестве, большем или равном 45 масс.%, еще более предпочтительно в количестве, большем или равном 50 масс.%, и наиболее предпочтительно в количестве, большем или равном 55 масс.% от отвержденных гранул расплава, применительно к общей массе отвержденных гранул расплава.
Предпочтительно парацетамол присутствует в количестве, меньшем или равном 80 масс.%, более предпочтительно в количестве, меньшем или равном 75 масс.%, еще более предпочтительно в количестве, меньшем или равном 70 масс.%, от отвержденных гранул расплава применительно к общей массе отвержденных гранул расплава.
Предпочтительно НПВС присутствует в количестве, меньшем или равном 45 масс.%, более предпочтительно в количестве, меньшем или равном 40 масс.% от гранулированной композиции, применительно к общей массе гранулированной композиции.
Предпочтительно НПВС присутствует в количестве, большем или равном 20 масс.%, более предпочтительно в количестве, большем или равном 25 масс.% от гранулированной композиции, применительно к общей массе гранулированной композиции.
Предпочтительно НПВС присутствует в количестве, меньшем или равном 45 масс.%, более предпочтительно в количестве, меньшем или равном 40 масс.% от отвержденных гранул расплава, применительно к общей массе отвержденных гранул расплава.
Предпочтительно НПВС присутствует в количестве, большем или равном 20 масс.%, более предпочтительно в количестве, большем или равном 25 масс.% от отвержденных гранул расплава применительно к общей массе отвержденных гранул расплава.
Предпочтительно парацетамол и любые другие необязательные таблеточные эксципиенты однородно диспергируют в расплавленном НПВС в форме свободной кислоты. Таким образом, получают однородную смесь. Указанную смесь оставляют охлаждаться с использованием методик, приведенных в данном описании, до образования твердого вещества. По мере охлаждения смесь становится более вязкой. Таким образом, отвержденная смесь преобразуется в гранулы.
Согласно способу по настоящему изобретению НПВС в форме свободной кислоты, парацетамол и другие необязательные эксципиенты, включаемые в гранулы расплава, могут быть перемешаны в твердом состоянии перед расплавлением НПВС в форме свободной кислоты. Альтернативно парацетамол и другие необязательные эксципиенты, подлежащие включению в расплавленные гранулы, могут быть добавлены к расплавленному НПВС в форме свободной кислоты. Способы, в соответствии с которыми один или несколько дополнительных компонентов перемешивают с НПВС в форме свободной кислоты и парацетамолом перед расплавлением НПВС в форме свободной кислоты, и способ, в соответствии с которым один или несколько дополнительных компонентов добавляют к расплавленной смеси, включающей расплавленный НПВС в форме свободной кислоты и парацетамол, также входят в область настоящего изобретения. Особенно предпочтительный способ включает объединение в твердом состоянии НПВС в форме свободной кислоты, парацетамола и любых необязательных дополнительных эксципиентов, подлежащих включению в гранулы расплава, с последующим расплавлением НПВС в форме свободной кислоты. Хотя процесс расплавления может быть осуществлен с использованием множества способов, например, путем нагревания НПВС в форме свободной кислоты и парацетамола в подходящем резервуаре, предпочтительно процесс расплавления проводят по способу экструзии в расплавленном состоянии, подробно описанном ниже.
Соответственно, расплавленная смесь может быть получена путем расплавления НПВС в форме свободной кислоты с последующим добавлением парацетамола и необязательно одного или нескольких эксципиентов к расплавленному НПВС в форме свободной кислоты. Предпочтительно расплавленную смесь получают путем перемешивания НПВС в форме свободной кислоты, парацетамола и одного или нескольких эксципиентов в сухом состоянии с последующим расплавлением НПВС в форме свободной кислоты.
Расплавленную смесь подвергают отверждению с использованием любого подходящего способа. Указанные способы включают и быстрое охлаждение, и медленное охлаждение. Предпочтительно расплавленную смесь подвергают быстрому охлаждению (то есть гасят соответствующим образом), как будет описано ниже. В типичном случае такой способ позволяет из расплавленного НПВС получить одну непрерывную кристаллическую фазу. Так, например, расплавленная смесь может быть оставлена для охлаждения в охлажденном резервуаре. Расплавленная смесь может быть вылита на охлаждающие лотки, которые могут находиться в статическом состоянии или могут непрерывно двигаться. Лотки в статическом состоянии могут быть помещены в охлаждающие комнаты. Двигающиеся лотки или конвейеры могут иметь дополнительные охлаждающие устройства, в которых используется, например, охлаждающая вода. Охлажденная расплавленная смесь образует твердое вещество, которое можно соскрести с конвейера и собрать по мере ее поступления и падения с одного из концов непрерывно движущегося конвейера.
Отвержденный расплав НПВС и парацетамола может быть сформирован в гранулы, с использованием множества способов. Так, например, указанный расплав может быть распылен до получения гранул. Он также может быть размолот и/или просеян. Указанный расплав может быть также пропущен через распыляющее устройство, такое как распылительная башня или распылительный гранулятор, в которых расплавленный материал распыляют через отверстие в поток охлажденного воздуха, что приводит к его застыванию/отверждению, и далее собирают. Если расплав подвергают экструзии, то экструдат может быть охлажден и далее разбит на подходящие по размерам кусочки, с последующим их перемалыванием и/или просеиванием. Альтернативно экструдат может быть подвергнут экструзии через соответствующие отверстия и раздроблен до гранул подходящего размера для таблетирования.
В соответствии с предпочтительным аспектом гранулированную композицию получают в ходе процесса экструзии расплава. Аппарат для осуществления такого процесса широко используется и знаком специалистам в данной области. Подходящий для использования в рамках настоящего изобретения экструдер описан в WO 02/098391 и доступен от компании APV, UK, Ltd, номер модели APV MPC40.
На первой стадии данного процесса композицию, включающую НПВС в форме свободной кислоты, парацетамол и любые другие необязательные наполнители подают в цилиндр нагретого экструдера. Расплавляют в экструдере по меньшей мере только НПВС в форме свободной кислоты, что приводит к образованию расплавленной смеси, включающей расплавленный НПВС в форме свободной кислоты, парацетамол и другие необязательные эксципиенты. В условиях давления НПВС в форме свободной кислоты может быть расплавлен при температуре, которая ниже его нормальной точки плавления. Максимальная температура определяется стабильностью расплавленного НПВС, парацетамола и любых других объединяемых с ними эксципиентов. НПВС в форме свободной кислоты может быть нагрет до любой подходящей температуры. В основном, чем выше температура, тем быстрее НПВС в форме свободной кислоты будет плавиться, хотя должен быть достигнут баланс за счет притока энергии, требуемой для нагревания НПВС в форме свободной кислоты. В основном считается, что для достижения максимальной эффективности НПВС в форме свободной кислоты должен нагреваться до температуры не более 50°С, предпочтительно 1-25°С, более предпочтительно 5-20°С, выше его точки плавления для минимизации энергетической стоимости процесса. Предпочтительный диапазон нагревания составляет 30-160°С, более предпочтительно, 35-140°С и наиболее предпочтительно 40-120°С.
В предпочтительных вариантах осуществления настоящего изобретения НПВС в форме свободной кислоты расплавляют, и парацетамол остается в твердой форме. Таким образом, композиция предпочтительно нагревается при температуре, которая выше чем точка плавления НПВС в форме свободной кислоты, но ниже чем точка плавления парацетамола.
В основном НПВС в форме свободной кислоты нагревается в нагретом цилиндре экструдера, имеющем вход для твердой композиции и выход для расплавленного экструдата. Термин «расплавленный экструдат» обозначает композицию, в которой НПВС в форме свободной кислоты расплавлен, предпочтительно полностью расплавлен, вместе с выбранными эксципиентами, в случае их присутствия. Другие эксципиенты и парацетамол фактически могут не подвергаться сами расплавлению, но они проходят вместе с расплавленным НПВС через экструдер и диспергируются в НПВС. Цилиндр может быть разделен на несколько зон нагревания, при необходимости. Кроме того, проведение операции с НПВС в форме свободной кислоты в экстурдере с винтовой конфигурацией будет также способствовать расплавлению НПВС в форме свободной кислоты, что снизит потребность в подводимом нагреве. Соответственно, цилиндр экструдера может быть нагрет до температуры, меньшей чем точка плавления НПВС в форме свободной кислоты. Например, нормальная точка плавления рацемического ибупрофена составляет 75-77°С, однако в условиях силового воздействия/давления (которые имеются в экструдере или в аналогичных устройствах для обработки) подводимое извне тепло, необходимое для расплавления ибупрофена, может быть существенно снижено за счет механического тепла, генерируемого при интенсивном перемешивании в самом экструдере. В основном считается, что экструдер следует нагревать до температуры не менее чем на 25°С ниже точки плавления НПВС в форме свободной кислоты, предпочтительно в диапазоне от 20°С ниже точки плавления НПВС в форме свободной кислоты до 50°С выше точки плавления НПВС в форме свободной кислоты, более предпочтительно от 15°С ниже точки плавления НПВС в форме свободной кислоты до 25°С выше плавления и наиболее предпочтительно до температуры в диапазоне по 10°С на каждой стороне точки плавления НПВС в форме свободной кислоты. Некоторые экструдера позволяют поддерживать различные зоны нагрева в экструдере, которые нагреваются до разных температур. Указанные температуры могут быть подобраны при желании с тем, чтобы обеспечивать полное расплавление НПВС в форме свободной кислоты на первой стадии (а) способа согласно настоящему изобретению. Предпочтительно композицию нагревают до температуры 80-130°С, более предпочтительно в диапазоне 100-120°С, для расплавления НПВС в форме свободной кислоты. В том случае, когда НПВС в форме свободной кислоты представлен ибупрофеном, может быть удобно нагреть указанный НПВС в диапазоне 50-130°С, более предпочтительно в диапазоне 60-100°С. Температура ибупрофена в цилиндре экструдера предпочтительно поддерживается в диапазоне 66-96°С и более предпочтительно в диапазоне 70-82°С.
Экструдер может также включать одну или несколько охлаждающих зон. Указанные зоны охлаждения могут быть обязательны для целей удаления тепла, генерированного при разминании материалов, подлежащих экструзии, в частности, для гарантии достижения качественного потока материалов в экструдере и выходящего потока из экструдера.
В предпочтительном способе согласно настоящему изобретению экструдер имеет зону охлаждения и зону нагрева. Более предпочтительно в нем имеется зона охлаждения со стороны входа в экструдер, так что материал, поступающий в экструдер, может транспортироваться или иным способом продвигаться по экструдеру в зону нагрева. В зону охлаждения отводится внутреннее тепло, генерируемое в материале, подлежащем экструзии, что предупреждает частичное расплавление композиции, которое рассматривается как неблагоприятное для экструдируемого продукта. Предпочтительно экструдер содержит зону с охлаждаемым транспортирующим устройством и зону с нагретым расплавом.
В рамках особенно предпочтительного способа предлагается зона нагрева в концевой части экструдера, на выходе или рядом с выходом из экструдера. Экструдированный материал может быть нагрет для гарантии того, что пропускаемый через выход экструдера материал нагрет в достаточной мере, с целью максимизации температурного перепада между расплавленным экструдатом и охлаждающим устройством для экструдата, для оптимизации процесса охлаждения. Так, например, цилиндр может быть нагрет с тем, чтобы НПВС в форме свободной кислоты, как один из компонентов экструдата, был пропущен через выход предпочтительно в расплавленном состоянии или по существу в расплавленном состоянии. Давление в экструдере может вызвать снижение точки плавления НПВС в форме свободной кислоты. Соответственно, предпочтительная температура в экструдате, проходящем через выход экструдера, находится в диапазоне от 20°С с каждой стороны нормальной точки плавления НПВС в форме свободной кислоты, предпочтительно в пределах 10°С с каждой стороны точки плавления НПВС в форме свободной кислоты.
Экструдер в соответствующем варианте снабжается по меньшей мере одной шнековой трубой при помощи устройств, сгруппированных таким образом, чтобы генерировать тепло в композиции. Обычно это может быть достигнуто при сочетании разминающих лопастей и винтовых шнеков. В основном, предпочтительно иметь винтовые шнеки на входе, с тем чтобы транспортировать материал от входа. Указанный материал может быть экструдирован в цилиндре экструдера с помощью шнеков и/или лопастей. Предпочтительно использовать более чем одну шнековую трубу, например двушнековую трубу, для целей максимизации экструзионного эффекта, применительно к материалу, подлежащему экструзии. Использование лопастей также способствует достижению максимального сдвига на материале, подлежащем экструзии. Лопасти могут быть смещены на некоторый желательный угол или сочетание некоторых желательных углов для генерирования в соответствующем варианте внутреннего тепла в композиции, с целью расплавления НПВС-компонента. Конфигурация и/или размер лопастей будет зависеть от таких факторов, как диаметр и/или длина экструдера, соотношение длины к диаметру, скорость работы экструдера, применяемый в устройстве вращающий момент и желательная температура для расплавления НПВС. Шнеки и/или лопасти могут быть ориентированы в одном и/или противоположном направлении, для максимизации давления в зоне перемешивания, при необходимости.
Предпочтительный вариант конфигурации включает винтовые переносные шнеки на входе экструдера, множество лопастей, которые могут иметь различные размеры и углы смещения, а также винтовые переносные шнеки на выходе для транспортировки экструдата из экструдера. Кроме того, предпочтительно винтовые переносные шнеки на выходе экструдера могут включать чередование компонентов обратной спирали и прямой спирали.
Согласно способу настоящего изобретения вторая стадия данного процесса требует охлаждения экструдированной композиции.
Предпочтительно расплав охлаждают быстро (например, гасят). Материал, охлажденный таким способом, в типичном случае включает НПВС, в котором диспергирована частица парацетамола. НПВС в типичном случае формирует непрерывную кристаллическую фазу, которая охватывает частицы парацетамола.
Предпочтительно экструдат формируют в виде двух или более тонких лент. Этого достигают предпочтительно путем пропускания расплавленного экструдата через каналы на выходе из устройства, которые формируют потоки или ленты экструдата, которые, в свою очередь, могут быть направлены на охлаждающее устройство, предпочтительно на охлаждающий ленточный конвейер или охлаждающий барабан.
Ленты расплавленного экструдата быстро охлаждают с помощью указанных охлаждающих устройств, например, ленты отверждают в течение 5 минут или менее, предпочтительно в течение 3 минут или менее, более предпочтительно в течение 1 минуты или менее (например, 0-60 секунд), предпочтительно в течение 50 секунд или менее (например, 1-50 секунд), более предпочтительно в течение 1-40 секунд и наиболее предпочтительно в течение 1-30 секунд.
При этом ширина каждой ленты расплавленного экструдата должна быть выше, чем глубина ленты с тем, чтобы оптимизировать процесс охлаждения. Ширина каждой ленты зависит, по меньшей мере, до некоторой степени от вязкости расплавленного экструдата. Предпочтительно каждая лента расплавленного экструдата вносится на охлаждающее устройство до достижения глубины, равной 10 мм или менее, предпочтительно до 6 мм (например, 0,1-6 мм), предпочтительно 0,5-5 мм, например 3-4 мм, и наиболее предпочтительно 1-3 мм, например 2 мм.
Охлаждение обычно происходит вначале на той стороне ленты, которая находится ближе к охлаждающему устройству. Соответственно, обычно раньше затвердевает нижняя поверхность ленты, тогда как верхняя поверхность ленты все еще остается расплавленной. По мере дальнейшего охлаждения ленты экструдат отверждается на всю длину.
Для достижения максимального выхода используют множество лент, идущих параллельно друг другу, например, на охлаждающем транспортере. Предпочтительно имеется более двух лент, например три, четыре, пять, шесть, семь, восемь, девять или десять или более лент в соответствии с размером экструдера. Количество лент может быть ограничено шириной образуемой ленты и полной шириной охлаждающих устройств, применяемых для максимизации числа количества лент. При этом было обнаружено, что ленты с расплавленным экструдатом не распределяются по охлаждающему устройству, и, соответственно, требуется небольшое пространство между лентами.
Для достижения быстрого охлаждения предпочтительно поддерживать значительное различие в температуре между расплавленным экструдатом и охлаждающим устройством, как только экструдат входит в контакт с охлаждающим устройством, например, по меньшей мере равное 25°С, предпочтительно, по меньшей мере 35°С, более предпочтительно, по меньшей мере 45°С и наиболее предпочтительно по меньшей мере 55°С. Верхний предел указанного диапазона ограничен точкой плавления НПВС, но нежелательно нагревать экструдированный материал до такой высокой температуры, поскольку дополнительная стоимость использованной при этом энергии не компенсируется преимуществами такого процесса обработки. Соответственно, практически верхний предел каждого из указанных выше диапазонов составляет 100°С, чаще 80°С.
В основном ожидается, что расплавленный экструдат будет охлаждаться до температуры ниже, чем точка плавления НПВС в форме свободной кислоты, перед образованием гранул. Расплавленная композиция может быть вылита на охлаждающие лотки, которые могут находиться в статическом состоянии или могут постоянно двигаться. Статические лотки могут быть помещены в охлаждающие комнаты. Движущиеся лотки или ленты могут включать дополнительное охлаждающее устройство, например, подача охлажденной воды. Охлажденный расплав переходит в твердый материал, который можно отскрести от транспортера или далее собрать, по мере того, как он будет поступать на другой конец непрерывно движущегося полотна и падать вниз. Предпочтительно расплавленная композиция может быть охлаждена при пропускании расплавленной смеси по движущемуся охлаждающему транспортеру, предпочтительно по непрерывно вращающемуся охлаждающему транспортеру. Предпочтительно транспортер охлаждается водой. Вода может подаваться на нижнюю часть транспортера вдоль всей его длины или частично на некоторые участки, в зависимости от потребностей и в соответствии с длиной такого транспортера, количеством расплавленной композиции и скоростью движения транспортера. Особенно предпочтительно охлаждать расплавленную композицию, по меньшей мере, вначале с использованием охлаждающего устройства, например, до тех пор, пока компонент НПВС начнет затвердевать. Представляется выгодным вариант, когда транспортер охлаждают водой практически по всей его длине и требуется лишь минимальная длина (например, 3-7 м) для охлаждения НПВС до твердого состояния.
Как указывалось выше, охлажденные композиции включают в типичном случае частицы парацетамола, диспергированные в матричном материале НПВС.
Отвержденный расплав может быть сформирован в гранулы с использованием для этого множества способов. Например, он может быть распылен или измельчен в гранулы. Он также может быть перемолот и/или просеян. Указанный расплав охлаждают на движущемся транспортере или в движущемся барабане, при этом охлажденный расплав может быть раздроблен до кусочков подходящего размера, с последующим перемалыванием и/или просеиванием указанных кусочков.
Гранулированная композиция может быть просеяна для гарантии того, что гранулы расплава имеют соответствующий размер для эффективного таблетирования. Гранулы, получаемые при охлаждении расплавленной композиции, имеют предпочтительно размер, который подходит для таблетирования, предпочтительно в стандартном аппарте для крупномасштабного таблетирования. Гранулы расплава в гранулированной композиции предпочтительно содержат частицы со средним размером в диапазоне 10-2000 мкм, более предпочтительно 50-1000 мкм и наиболее предпочтительно 100-400 мкм. Хорошие результаты получаются в том случае, когда объемная плотность гранул расплава укладывается в диапазон 0,1-1 г/мл, более предпочтительно 0,3-0,6 г/мл. Другие предпочтительные свойства достигаются в том случае, когда плотность выпускаемой жидкости находится в диапазоне 0,3-0,7 г/мл (более предпочтительно, 0,4-0,6 г/мл). Кроме того, предпочтительно, чтобы гранулы расплава имели пористость в диапазоне 0,5-2,0 г/мл.
В соответствии со вторым аспектом настоящего изобретения предлагается гранулированная композиция, включающая множество гранул отвержденного расплава, которые содержат НПВС в форме свободной кислоты согласно настоящему описанию парацетамол и необязательно один или несколько эксципиентов, определенных в настоящем описании.
Предпочтительно по существу масса НПВС в гранулах расплава представлена в форме свободной кислоты. Предпочтительно парацетамол представлен в форме частиц, диспергированных в отвержденном расплаве НПВС в форме свободной кислоты.
Предпочтительно масса парацетамола в гранулах расплава выше или равна, более предпочтительно выше чем масса НПВС в форме свободной кислоты в гранулах расплава применительно к общей массе гранул расплава. Выше были указаны особенно предпочтительные соотношения как по массе, так и по весовому проценту парацетамола и НПВС, которые могут присутствовать в гранулах расплава и/или в гранулированной композиции.
В соответствии с третьим аспектом настоящее изобретение относится к гранулированной композиции, включающей множество гранул отвержденного расплава, которые содержат НПВС согласно настоящему описанию, и парацетамол, а также необязательно один или несколько эксципиентов, определенных в настоящем описании, где указанную гранулированную композицию получают согласно способу первого аспекта настоящего изобретения.
Предпочтительно гранулированная композиция согласно второму аспекту настоящего изобретения, получаемая по способу первого аспекта настоящего изобретения, состоит только из гранул расплава. Гранулы расплава могут состоять только из НПВС и парацетамола. Альтернативно гранулы расплава могут также включать один или несколько эксципиентов согласно настоящему описанию. Однако следует понимать, что главное преимущество настоящего изобретения заключается в том, что количество эксципиентов, необходимых для достижения быстро разлагаемой дозированной формы, такой как прессованная таблетка с хорошими характеристиками растворения, является минимальным.
Особенно предпочтительным эксципиентом, который может быть включен в гранулы расплава, является средство, способствующее разложению. Предпочтительно гранулы отвержденного расплава в гранулированной композиции включают одно или несколько средств, способствующих разложению.
Средство, способствующее разложению, может также присутствовать в качестве дополнительного экстра-гранулярного компонента, используемого при получении таблетки. Предпочтительно средство, способствующее разложению, присутствует в гранулированной композиции, еще более предпочтительно средство, способствующее разложению, является единственным средством такого рода, входящим в состав гранулированной композиции. Если средство, способствующее разложению, включается в расплавленную смесь, которая содержит расплавленный НПВС и парацетамол, и далее тесно смешивается в ней, с последующим охлаждением и перемалыванием смеси до гранул, то получают фармацевтическую композицию, способную к таблетированию при наличии минимального набора эксципиентов для таблетирования и обладающую выгодными свойствами для таблетирования, способностью к разложению и растворению. Средство, способствующее разложению, вызывает быстрое разложение твердой дозированной формы, такой как таблетка в условиях желудочно-кишечного тракта. Примеры средств, способствующие разложению, включают один или несколько видов пшеничного крахмала, кукурузного крахмала, картофельного крахмала, гликолят натрий-крахмала, низкозамещенную гидроксипропилцеллюлозу, альгиновую кислоту, сшитый поливинилпирролидон, алюмосиликат магния и натрий-кроскармеллозу. Предпочтительные средства, способствующие разложению, включают такие средства, которые набухают под действием воды, что приводит к тому, что ингредиенты в гранулированной композиции и полученные на их основе дозированные формы отталкиваются друг от друга и движутся в водную среду, способствующую разложению. Предпочтительные средства, способствующие разложению, включают один или несколько приведенных ниже следующих компонентов: натрий-кроскармеллоза и гликолят натрий-крахмала, в особенности натрий-кроскармеллозу.
Предпочтительно средство, способствующее разложению, присутствует в композиции в количестве, меньшем или равном 20 масс.%, более предпочтительно в количестве, меньшем или равном 15 масс.%, еще более предпочтительно в количестве, меньшем или равном 10 масс.% от гранулированной композиции. Предпочтительно средство, способствующее разложению, присутствует в композиции в количестве, выше или равном 1 масс.%, более предпочтительно в количестве, выше или равном 2 масс.%, и наиболее предпочтительно в количестве, выше или равном 3 масс.% от гранулированной композиции.
Предпочтительно средство, способствующее разложению, присутствует в композиции в количестве, меньшем или равном 20 масс.%, более предпочтительно в количестве, меньшем или равном 15 масс.%, еще более предпочтительно в количестве, меньшем или равном 10 масс.% от гранул отвержденного расплава.
Предпочтительно средство, способствующее разложению, присутствует в композиции в количестве, выше или равном 1 масс.%, более предпочтительно в количестве, выше или равном 2 масс.%, и наиболее предпочтительно в количестве, выше или равном 3 масс.% от гранул отвержденного расплава.
Предпочтительно процентное весовое соотношение НПВС к средству, способствующему разложению, в гранулах отвержденного расплава составляет от 20:1 до 2:1, более предпочтительно от 15:1 до 5:1 и наиболее предпочтительно от 12:1 до 7:1.
Предпочтительно процентное весовое соотношение парацетамола к средству, способствующему разложению, в гранулах отвержденного расплава составляет от 20:1 до 2:1, более предпочтительно от 15:1 до 5:1 и наиболее предпочтительно от 12:1 до 7:1.
Необязательно гранулированная композиция и гранулы отвержденного расплава могут включать дополнительные эксципиенты, такие как разбавитель или поверхностно-активное вещество. Предпочтительно гранулированная композиция и гранулы отвержденного расплава содержат только НПВС, парацетамол и средство, способствующее разложению.
Следует понимать, что гранулированная композиция может быть получена в соответствии с настоящим изобретением, в рамках простого и рентабельного крупномасштабного процесса производства. Как было показано, композиции, изготавливаемые на основе гранулированной композиции, согласно настоящему изобретению являются стабильными при хранении и обладают хорошими свойствами по растворению. Гранулированная композиция демонстрирует в типичном случае желательные показатели текучести и прессуемости и может подвергаться таблетированию с использованием минимального набора эксципиентов, без прилипания или связывания с компонентами устройства в процессе таблетирования, так что создается дозированная форма, которая имеет подходящие показатели твердости в сочетании с хорошими свойствами по разложению. Кроме того, значительно снижается неприятный вкус, связанный с некоторыми НПВС.
Гранулы отвержденного расплава могут быть сформированы в композицию непосредственно сами или могут быть объединены с дополнительным экстра-гранулярным компонентом и введены в состав стандартной дозированной формы.
Таким образом, в четвертом аспекте настоящее изобретение относится к фармацевтической композиции в виде стандартной дозированной формы для перорального введения, которая включает гранулированную композицию, определенную в настоящем описании, включающую множество гранул отвержденного расплава, которые содержат НПВС в форме свободной кислоты, парацетамол и необязательно один или несколько эксципиентов. Предпочтительно указанная стандартная форма представляет собой твердую стандартную дозированную форму.
Указанная стандартная дозированная форма может быть пригодна для непосредственного приема путем ее проглатывания, может быть диспергирована в воде перед приемом или может быть адаптирована для разложения в ротовой полости. Предпочтительно стандартная дозированная форма адаптирована для высвобождения НПВС и парацетамола в желудке или в желудочно-кишечном тракте. Наиболее предпочтительно стандартная дозированная форма проглатывается пациентом при наличии такой необходимости.
Подходящие стандартные дозированные формы включают прессованные таблетки, жевательные таблетки, шипучие композиции и пастилки. Наиболее предпочтительно стандартная дозированная форма представляет собой прессованную таблетку, особенно нешипучую прессованную таблетку.
Прессованная таблетка может быть необязательно покрыта пленочной оболочкой, например, на основе обычного целлюлозного полимера, такого как гидроксипропилметилцеллюлоза, или на основе обычного сахарного покрытия, например, на основе покрытия из сахарозы или лактозы.
Пропорция НПВС в стандартной дозированной форме зависит от дозы, необходимой для достижения желательного терапевтического эффекта. Лекарственные средства, вводимые в низкой дозе, такие как флурбипрофен и кетопрофен, могут присутствовать в таких небольших количествах, как 10 масс.% от всей стандартной дозированной формы. Однако предпочтительная особенность настоящего изобретения заключается в том, что НПВС, вводимые в высокой дозе, такие как ибупрофен, могут быть изготовлены в сочетании с парацетамолом в виде более мелких дозированных форм, чем сравнимые дозированные формы, получаемые в рамках стандартных методик таблетирования (например, путем сухого смешивания компонентов и последующего прессования полученной смеси).
Предпочтительно НПВС присутствует в количестве, большем или равном 10 масс.%, более предпочтительно в количестве, большем или равном 15 масс.%, еще более предпочтительно в количестве, большем или равном 20 масс.%, от стандартной дозированной формы применительно к общей массе стандартной дозированной формы.
Предпочтительно НПВС присутствует в количестве, меньшем или равном 45 масс.%, более предпочтительно в количестве, меньшем или равном 40 масс.%, еще более предпочтительно в количестве, меньшем или равном 35 масс.%, наиболее предпочтительно в количестве, меньшем или равном 30 масс.% от стандартной дозированной формы применительно к общей массе стандартной дозированной формы.
Предпочтительно парацетамол присутствует в количестве, большем или равном 35 масс.%, более предпочтительно в количестве, большем или равном 40 масс.%, еще более предпочтительно в количестве, большем или равном 45 масс.%, еще более предпочтительно в количестве, большем или равном 50 масс.,% и наиболее предпочтительно в количестве, большем или равном 55 масс.% от стандартной дозированной формы, применительно к общей массе всей стандартной дозированной формы.
Предпочтительно парацетамол присутствует в количестве, меньшем или равном 80 масс.%, более предпочтительно в количестве, меньшем или равном 75 масс.%, еще более предпочтительно в количестве, меньшем или равном 70 масс.%, наиболее предпочтительно в количестве, меньшем или равном 65 масс.%, и наиболее предпочтительно в количестве, большем или равном 57 масс.% от стандартной дозированной формы, применительно к общей массе всей стандартной дозированной формы.
Предпочтительно НПВС и парацетамол, а также средство, способствующее разложению, в случае его наличия в композиции, являются единственными компонентами гранулированной композиции в стандартной дозированной форме. Весовые соотношения НПВС к парацетамолу, НПВС к средству, способствующему разложению, парацетамола к средству, способствующему разложению, и количество средства, способствующего разложению, указанные для гранулированной композиции, равным образом и независимо применимы также к стандартной дозированной форме.
Стандартные дозировки для проведения эффективной терапии известны специалистам в данной области применительно к каждому НПВС. Так, например, они могут включать НПВС в количестве до 5 мг, 10 мг, 12,5 мг, 25 мг, 50 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 500 мг, 600 мг и 800 мг. В том случае, когда используются производные указанных средств, обычно выбирают точные стандартные дозировки, которые эквивалентны приведенным выше дозам НПВС. Для проведения тех видов терапии, которые описаны в настоящем тексте, максимальная дневная доза ибупрофена составляет в основном 3200 мг. Однократная вводимая ежедневная стандартная доза может составлять 100 мг. Предпочтительные стандартные дозы находятся в диапазоне 100-400 мг, более предпочтительно в диапазоне 100-300 мг и в особенности составляют 200 мг ибупрофена. Максимальная дневная доза флурбипрофена составляет в основном 300 мг. Однократная стандартная доза может составлять 12,5 мг. Предпочтительные стандартные дозы находятся в диапазоне 12,5-150 мг, более предпочтительно в диапазоне 25-100 мг и в особенности составляют 50 мг флурбипрофена. Максимальная дневная доза напроксена составляет в основном 1500 мг. Однократная стандартная ежедневная доза может составлять 125 мг. Предпочтительные стандартные дозы находятся в диапазоне 220-750 мг, более предпочтительно в диапазоне 220-500 мг и в особенности составляют 220-250 мг напроксена. Максимальная дневная доза кетопрофена составляет в основном 200 мг. Однократная стандартная ежедневная доза может составлять 25 мг. Предпочтительные стандартные дозы находятся в диапазоне 25-100 мг, более предпочтительно в диапазоне 25-75 мг и в особенности составляют 50 мг кетопрофена.
Стандартные дозировки, применяемые для достижения эффективной терапии, известны специалистам в данной области также применительно к парацетамолу. Так, например, они могут включать 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг и 800 мг. Предпочтительные стандартные дозы находятся в диапазоне от 100 до 650 мг, более предпочтительно от 200 мг до 550 мг и наиболее предпочтительно от 250 до 500 мг.
Предпочтительные стандартные дозированные формы включают 500 мг парацетамола и 200 мг ибупрофена, 325 парацетамола и 200 мг ибупрофена и 1000 мг парацетамола и 400 мг ибупрофена.
Предпочтительно гранулированную композицию согласно настоящему описанию объединяют с дополнительным экстра-гранулярным компонентом и затем из полученной смеси изготавливают стандартную дозированную форму. Указанный дополнительный экстра-гранулярный компонент включает ингредиенты, введенные в стандартную дозированную форму, но которые не содержатся в гранулах отвержденного расплава. Они могут быть смешаны с гранулами отвержденного расплава одновременно или на следующей стадии процесса изготовления стандартной дозированной формы. Особым преимуществом настоящего изобретения является то, что все ингредиенты дополнительного экстра-гранулярного компонента могут быть объединены с гранулированной композицией в одно и то же время и при этом в типичном случае отсутствует необходимость в значительной обработке ингредиентов дополнительного экстра-гранулярного компонента перед его объединением с гранулированной композицией. Гранулы расплава могут быть объединены с дополнительным экстра-гранулярным компонентом с помощью обычных методик объединения и смешивания с получением однородной смеси ингредиентов. Примеры аппаратов, которые могут использоваться для осуществления этого процесса, включают смесители Ribbon Blender, ABC Blender, V-Blender and Plough Blender. Однородная смесь представляет в типичном случае сухую смесь, которая может быть подвергнута прессованию в таблетки с использованием стандартных машин для таблетирования.
Соответственно, предпочтительные стандартные дозированные формы включают
(а) гранулированную композицию согласно настоящему изобретению, которая включает множество гранул отвержденного расплава, содержащих НПВС в форме свободной кислоты, парацетамол и необязательно один или несколько эксципиентов;
(b) дополнительный экстра-гранулярный компонент, включающий один или несколько ингредиентов согласно настоящему описанию.
Как указывалось выше, наиболее предпочтительной стандартной дозированной формой является нешипучая прессованная таблетка.
Предпочтительно стандартная дозированная форма включает 60-99 масс.%, более предпочтительно 75-95 масс.%, еще более предпочтительно 80-90 масс.% гранулированной композиции, применительно к общей массе всей стандартной дозированной формы.
Предпочтительно стандартная дозированная форма включает 0,5-40 масс.%, более предпочтительно 5-25 масс.%, еще более предпочтительно 10-20 масс.% дополнительного экстра-гранулярного компонента применительно к общей массе всей стандартной дозированной формы.
Подходящие ингредиенты, которые могут присутствовать в дополнительном экстра-гранулярном компоненте или которые могут использоваться в качестве эксципиентов в гранулированной композиции, включают любой из следующих ингредиентов.
Водорастворимый или водонерастворимый разбавитель
Подходящие водорастворимые материалы растворителя включают сахара (такие как сахароза, фруктоза, лактоза, декстроза), циклодекстрин, мальтодекстрин и соли органических кислот (например, цитрат натрия и цитрат калия).
Подходящие водонерастворимые материалы разбавителя включают производные целлюлозы (такие как микрокристаллическая целлюлоза), крахмал и его производные (такие как предварительно желируемый крахмал), фосфат дикальция, фосфат трикальция, сульфат кальция и карбонат кальция. Микрокристаллическая целлюлоза и фосфат дикальция являются предпочтительными водонерастворимыми разбавителями.
В случае их наличия в композиции разбавитель может присутствовать в количестве от 0,1 до 25 масс.%, более предпочтительно в количестве от 0,1 до 20 масс.%, еще более предпочтительно в количестве от 1 до 15 масс.% и наиболее предпочтительно в количестве от 4 до 15 масс.% от стандартной дозированной формы применительно к общей массе стандартной дозированной формы.
Несмотря на то, что разбавитель может присутствовать в гранулах расплава и/или в дополнительном экстра-гранулярном компоненте предпочтительно, чтобы разбавитель присутствовал исключительно в дополнительном экстра-гранулярном компоненте стандартной дозированной формы.
Поверхностно-активное вещество
Предпочтительные поверхностно-активные вещества включают лаурилсульфат натрия или полоксамер. Поверхностно-активное вещество может использоваться в количестве от 0,05 масс.% до 8 масс.%, более предпочтительно в количестве от 0,1 до 5 масс.% и наиболее предпочтительно в количестве от 0,2 до 2 масс.% от стандартной дозированной формы применительно к общей массе стандартной дозированной формы. Несмотря на то, что поверхностно-активное вещество может присутствовать в гранулах расплава предпочтительно, если поверхностно-активное вещество имеется в стандартной дозированной форме, чтобы оно присутствовало исключительно в составе дополнительного экстра-гранулярного компонента.
«Впитывающий агент»
Термин «впитывающий агент» относится к любому эксципиенту, который формирует капиллярные проходы внутри компактной структуры, такой как таблетка, так что, когда указанная компактная структура помещается в водную среду, жидкость проходит по указанным проходам за счет капиллярного эффекта, далее происходит разложение компактной структуры, поскольку разрушаются связи между частицами в жидкости. Впитывающий агент нерастворим в воде и предпочтительно присутствует только во вспомогательной гранулированной композиции, используемой для таблетирования.
Нерастворимый впитывающий агент выбирают из неорганических материалов, крахмалов, целлюлозных материалов, таких как гидроксиэтилцеллюлоза (HEC), гидроксипропилцеллюлоза (HPC), гидроксипропилметилцеллюлоза (HPMC) и их смесей. Предпочтительно неорганический материал включает двуокись кремния, порошок PTFE, силикаты щелочного металла, силикаты щелочноземельного металла, карбонаты и бикарбонаты щелочного металла, а также карбонаты щелочноземельного металла. Соответствующие примеры включают карбонат натрия, бикарбонат натрия, карбонат калия, карбонат магния, карбонат кальция, порошок PTFE, силикат натрия, силикат калия, силикат магния и силикат кальция. Предпочтительно крахмальный материал включает крахмалы, такие как картофельный крахмал, кукурузный крахмал, рисовый крахмал, крахмал тапиоки и производные крахмала, включающие модифицированные крахмалы, такие как предварительно желированный крахмал. Более предпочтительно впитывающий агент включает, по меньшей мере, один из следующих материалов: двуокись кремния и/или карбонаты щелочноземельного металла, в особенности карбонат кальция, тальк, кукурузный крахмал и предварительно желированный крахмал. Наиболее предпочтительно впитывающий агент включает двуокись кремния.
Предпочтительно впитывающий агент, особенно в том случае, когда им является двуокись кремния, присутствует в количестве от 0,05 до 10 масс.%, более предпочтительно в количестве от 0,05 до 5 масс.%, еще более предпочтительно, в количестве от 0,1 до 3 масс.% и наиболее предпочтительно в количестве от 0,2 до 1 масс.% от стандартной дозированной формы применительно к общей массе стандартной дозированной формы.
Наиболее предпочтительно впитывающий агент присутствует исключительно в составе дополнительного экстра-гранулярного компонента.
Замасливатель
Для получения таблеток ибупрофена могут быть использованы стандартные замасливатели, например, стеариновая кислота, лаурилсульфат натрия, полиэтиленгликоль, гидрогенизированное растительное масло, стерилфумарат натрия, стеарат магния или стеарат кальция. Указанные замасливатели могут быть включены в состав твердой стандартной дозированной формы в количестве от 0,5 до 5 масс.%, более предпочтительно в количестве от 0,1 до 3 масс.% применительно к общей массе стандартной дозированной формы. Несмотря на то, что замасливатель, если он присутствует в стандартной дозированной форме, может быть включен в гранулы отвержденного расплава и/или в дополнительный экстра-гранулярный компонент предпочтительно, чтобы замасливатель присутствовал только в составе дополнительного экстра-гранулярного компонента.
Другой фармакологически активный ингредиент и/или усилитель
Подходящие агенты могут включать любой другой ингредиент, обычно используемый в композиции, применяемой для лечения боли, воспаления и/или лихорадочного состояния, например, кофеин или другое производное ксантина, другой анальгетик, например, кодеин, релаксант скелетной мускулатуры; антигистамин (например, акривастин, астемизол, азатадин, азеластин, бромдифенгидрамин, бромфенирамин, карбиноксамин, цетиризин, хлорфенирамин, ципрогептадин, дексбромфенирамин, дексхлорфенирамин, дифенгидрамин, эбастин, кетотифен, лодоксамид, лоратидин, левокабастин, мекитазин, оксатомид, фениндамин, фенилтолоксамин, пириламин, сетастин, тазифиллин, темеластин, терфенидин, трипеленнамин или трипролидин (предпочтительно используют неседативные антигистамины)); противоотечный препарат (например, псевдоэфедрин, фенилпропаноламин и фенилэфедрин); противокашлевый препарат (например, карамифен, кодеин или декстрометорпан); отхаркивающее средство (например, гуаифенезин, цитрат калия, гуйаяколсульфонат калия, сульфат калия и гидрат терпина); противоязвенный антагонист гистамина (например, мизопростол); и/или противорвотный препарат (например, домперидон). Другой фармакологически активный ингредиент и/или усилитель может быть включен в гранулы расплава и/или в дополнительный экстра-гранулярный компонент.
Другие известные специалистам в данной области обычные эксципиенты, применяемые при таблетировании, также могут быть включены в гранулированную композицию согласно настоящему изобретению при желании, хотя следует понимать, что главное достоинство настоящего изобретения заключается в том, что количество эксципиентов, необходимых для достижения быстро разлагаемой дозированной формы, такой как прессованная таблетка с хорошими показателями растворения, является минимальным.
Предпочтительная стандартная дозированная форма, в особенности прессованная таблетка, в частности нешипучая прессованная таблетка, включает:
а) гранулированную композицию согласно настоящему изобретению, которая включает множество гранул отвержденного расплава, содержащих НПВС и равномерно распределенный в нем парацетамол; и
(b) дополнительный экстра-гранулярный компонент, включающий нерастворимый впитывающий агент, который присутствует в количестве от 0,05 до 5,0 масс.% применительно к общей массе стандартной дозированный формы.
Другая предпочтительная стандартная дозированная форма, в особенности композиция прессованной таблетки, в частности, нешипучей прессованной таблетки, включает
а) гранулированную композицию согласно настоящему изобретению, которая включает множество гранул отвержденного расплава, содержащих НПВС, парацетамол и средство, способствующее разложению, которые однородно распределены в них; и
b) дополнительный экстра-гранулярный компонент, включающий нерастворимый впитывающий агент, который присутствует в количестве от 0,05 до 5,0 масс.% применительно к общей массе стандартной дозированный формы.
Предпочтительно нерастворимый впитывающий агент включает двуокись кремния.
Еще одна предпочтительная дозированная форма, в особенности прессованная таблетка, в частности нешипучая прессованная таблетка, включает
(а) гранулированную композицию, содержащую множество гранул отвержденного расплава, которые включают ибупрофен, парацетамол и средство, способствующее разложению; и
(b) дополнительный экстра-гранулярный компонент, включающий нерастворимый впитывающий агент, который присутствует в количестве от 0,05 до 5,0 масс.% применительно к общей массе стандартной дозированной формы.
Предпочтительно дополнительный экстра-гранулярный компонент также включает разбавитель, присутствующий в количестве от 4 до 15 масс.% от общей массы стандартной дозированной формы.
Предпочтительно определенная выше гранулированная композиция присутствует в количестве от 60 до 99,5 масс.%, более предпочтительно в количестве от 75 до 95 масс.%, еще более предпочтительно в количестве от 80 до 90 масс.% от стандартной дозированной формы применительно к общей массе всей стандартной дозированной формы.
В частности, определенный выше дополнительный эктра-гранулярный компонент присутствует в количестве от 0,5 до 40 масс.%, более предпочтительно в количестве от 5 до 25 масс.%, еще более предпочтительно в количестве от 10 до 20 масс.% от стандартной дозированной формы применительно к общей массе всей стандартной дозированной формы.
Следует понимать, что ибупрофен, парацетамол и средство, способствующее разложению, могут присутствовать в количествах, указанных выше.
Соответственно, настоящее изобретение распространяется на способ создания прессованной дозированной формы, в частности нешипучей прессованной дозированной формы, включающий прессование указанной гранулированной композиции, согласно настоящему изобретению необязательно с дополнительным экстра-гранулярным компонентом, согласно настоящему изобретению с формированием прессованной дозированной формы.
Предпочтительно прессованная дозированная форма включает нешипучую прессованную дозированную форму, в особенности нешипучую прессованную таблетку.
НПВС представляют собой прежде всего противовоспалительное, анальгетическое и жаропонижающее средство, однако они также предложены для применения в других терапевтических направлениях, включающих лечение разрежения кости периодонта, зуд и болезнь Альцгеймера. Парацетамол обладает анальгетическим и жаропонижающим действием. В этой связи стандартные дозированные формы согласно настоящему изобретению показаны для использования во всех вариантах терапевтического применения, в случае которых эффективны ингибиторы циклооксигеназы и которые включают ревматоидный артрит, остеоартрит, анкилозирующий спондилит, серонагетивные артропатии, расстройства околосуставных тканей и повреждения мягкой ткани. Они могут также использоваться при лечении послеоперативной боли, послеродовой боли, зубной боли, при дисменорее, головной боли, мигрени, ревматической боли, мышечной боли, боли в спине, невралгии и скелетно-мышечной боли или в случае дискомфорта, ассоциированного со следующими состояниями: респираторная инфекция, простуда или грипп, подагра или утренняя тугоподвижность тела.
Таким образом, в соответствии с пятым аспектом настоящее изобретение относится к гранулированной композиции, приведенной в настоящем описании, или к стандартной дозированной форме, согласно настоящему изобретению применяемым в медицине.
Соответственно, в шестом аспекте настоящего изобретения предлагается гранулированная композиция, приведенная в настоящем описании, или стандартная дозированная форма согласно настоящему изобретению для применения при лечении боли и/или воспаления, и/или лихорадочного состояния.
Соответственно, в седьмом аспекте настоящее изобретение относится к способу лечения боли и/или лихорадки, включающему введение гранулированной композиции согласно настоящему изобретению, или стандартной дозированной формы, согласно настоящему изобретению млекопитающему, при наличии такой необходимости.
Соответственно, в восьмом аспекте настоящее изобретение относится к применению гранулированной композиции, согласно настоящему изобретению при производстве лекарственного средства для лечения боли и/или воспаления, и/или лихорадочного состояния.
Соответственно, в девятом аспекте настоящее изобретение относится к применению стандартной дозированной формы при получении лекарственного средства для лечения боли и/или воспаления, и/или лихорадочного состояния.
В соответствии с десятым аспектом настоящее изобретение относится к применению расплавленного НПВС для модификации свойств прессуемости парацетамола. Предпочтительно расплавленный НПВС улучшает прессуемость парацетамола.
Следует понимать, что все особенности первого аспекта настоящего изобретения представляют предпочтительные особенности всех других аспектов настоящего изобретения. Аналогично все особенности конкретного аспекта настоящего изобретения отражают предпочтительные особенности всех других аспектов настоящего изобретения.
Ниже настоящее изобретение будет проиллюстрировано рядом неограничивающих примеров.
В приведенных примерах рацемический ибупрофен и рацемический флурбипрофен доступны от компании BASF, Германия; напроксен доступен от компании Albemarle Corporation, США; парацетамол в виде плотного порошка доступен от компании Mallinckrodt, США, натрий-кроскармеллоза доступна от компании FMC Corporation, Брюссель, Бельгия, под торговой маркой Ac-Di-Sol; французский мел доступен от компании Luzenac, France; коллоидная двуокись кремния (также известная как коллоидный силикагель) доступна от компании Degussa, Франкфурт, Германия, под торговой маркой Aerosil 2000; стеарат магния доступен от компании Hays Chemicals UK; стеариновая кислота доступна от компании Hays Chemicals UK; микрокристаллическая целлюлоза доступна от компании FMC Corporation, Брюссель, Бельгия, под торговой маркой Avicel PH101; фосфат дикальция доступен от компании Univar Limited UK, под торговой маркой Emcompress; лактоза NF Fast Flo доступна от компании DMV, Голландия, гидроксипропилметилцеллюлоза доступна от компании Dow Chemical Company, США; и опаспрей белый (Opaspray White) доступен от компании Colorcon, США. Экструдер представляет собой двушнековый экструдер APV MPC40, доступный от компании APV, UK Ltd.
Определение растворения
Способность к растворению измеряют с использованием метода растворения, описанного в Фармакопее США, том 23, страница 1791, в аппарате 2, в котором используются лопасти со скоростью 50 об/мин, и фосфатный буфер (выбранный для работы при pH 2,7 и/или pH 6,0 и/или pH 5,8).
Прочность на раздавливание
Прочность на раздавливание представляет собой меру твердости таблетки. Указанный показатель измеряют при регистрации прочности на раздавливание по диаметру, когда таблетку разрушают между двумя двигающимися щеками дробилки в тестере таблеток Schluniger 6D. Движущиеся щеки дробилки в таблеточном тестере устанавливают на отметках 23, 24, 25, 26, 27 и 29 в качестве расстояния. Чем выше показатель установленного расстояния, тем более высокое давление подводят к таблетке.
Значения, приведенные жирным шрифтом в таблицах 1, 2 и 4, указывают компоненты, которые формируют часть расплавленной гранулированной композиции, а показатели, приведенные обычным шрифтом, указывают компоненты, которые формируют часть дополнительной гранулированной композиции. Числовые значения в этих таблицах относятся к весовому проценту каждого компонента, присутствующего в соответствующей композиции.
Пример 1 (а): Получение гранулированного компонента
Способ, общий для всех иллюстрирующих примеров, включает сухое смешивание парацетамола и НПВС в форме свободной кислоты, необязательно в сочетании с другими эксципиентами, которые могут присутствовать в гранулированном компоненте, с последующим нагреванием смеси при температуре 100-165°С в экструдере для полного расплавления НПВС в форме свободной кислоты и перемешивания после этого расплавленного НПВС с парацетамолом и другими необязательными эксципиентами. Расплавленную массу выливают на охлажденные лотки из нержавеющей стали или на охлажденный движущийся транспортер при температуре 10°С и оставляют для охлаждения. Расплавленная смесь отверждается в типичном случае в течение 60 секунд; смесь может быть подвергнута перемешиванию в ходе охлаждения. Полученную таким образом твердую массу перемалывают при пропускании через конусную дробилку, включающую сито с круглыми отверстиями по 1 мм. Полученные гранулы собирают.
Пример 1(b): Получение таблетки
Соответствующие дополнительные экстра-гранулярные компоненты (показанные обычным шрифтом в таблицах 1, 2 и 4), а именно коллоидную двуокись кремния, стеарат магния, стеариновую кислоту, лактозу, фосфат дикальция и микрокристаллическую целлюлозу, смешивают одновременно с гранулированной композицией, полученной по процедуре указанного выше примера 1 (а), примерно в течение 15 минут в смесителе. Перемешанный сухой материал вносят в роторную машину для таблетирования (Fette P1200) и проводят прессование с образованием таблеток (скорость таблеточной машины составляет 100000 таблеток в час и сила уплотнения составляет от примерно 6 кН до 28 кН), которые содержат терапевтическую дозу НПВС и парацетамола.
Примеры 2-8
Получают таблетки на основе компонентов, указанных в таблице 1, по процедуре примера 1. Масса каждой подвергаемой прессованию композиции корректируют так, чтобы получить таблетку, содержащую желательный терапевтический уровень НПВС и парацетамола. В примерах 1-8 рацемический ибупрофен присутствует в количестве 200 мг на таблетку. Следовательно, парацетамол присутствует в количестве 500 мг на таблетку в примерах 1 и 4-7 и в количестве 325 на таблетку в примерах 2, 3 и 8. Однако следует понимать, что может быть использован только диапазон терапевтических доз НПВС и парацетамола.
На фиг.1 показана зависимость прочности на раздавливание таблетки от силы уплотнения, прилагаемой в ходе таблетирования, очищенного в примере 1. В этой связи таблетки, имеющие соответствующую твердость, могут быть получены при использовании силы уплотнения в широком диапазоне. Соответственно, получаемые при этом таблетки имеют достаточную твердость и жесткость, с тем чтобы они могли подвергаться дальнейшим жестким условиям процесса производства, например, при нанесении пленочного покрытия.
Примеры 9-16
Получают таблетки на основе компонентов, указанных в таблице 2, по процедуре примера 1. Масса каждой подвергаемой прессованию композиции корректируют так, чтобы получить таблетку, содержащую желательный терапевтический уровень НПВС. В этой связи напроксен присутствует в количестве 250 мг на таблетку в рамках примеров 9-12, мелоксикам присутствует в количестве 20 мг на таблетку в примерах 15 и 16 и рацемический флурбипрофен присутствует в количестве 20 на таблетку в примерах 15 и 16. Соответственно, парацетамол присутствует в количестве 317 мг на таблетку в примерах 9 и 11, 488 мг на таблетку в примерах 10 и 12, и 237 мг на таблетку в примерах 13-16.
Пленочное покрытие
На таблетки, описанные в примерах 1-16, может быть нанесено покрытие с использованием композиции, включающей:
Композицию пленочного покрытия получают путем растворения гидроксипропилметилцеллюлозы и опаспрея белого в очищенной воде с использованием мешалки Silverson (Silverson Machines Ltd, UK). Далее диспергируют французский мел в полученном растворе. Таблеточное ядро покрывают пленкой с использованием стандартного перфорированного лотка, такого как Manesty Accelacota 150.
Для этого на таблетку согласно примеру 1 наносят покрытие с использованием указанной выше композиции пленочного покрытия и определяют профиль растворения полученной таблетки. Результаты оценки показателя растворения приведены в таблице 3 и продемонстрированы на фиг.2.
*1 - 6-метокси-альфа-метил-2-нафталинуксусная кислота
*2 - 2-фтор-α-метил-4-бифенил уксусная кислота.
Приведенные результаты показывают, что значительные количества и ибупрофена, и парацетамола растворяются уже через 10 минут. Соответственно, такая таблетка может обеспечивать более ранее начало терапевтического действия.
Кристаллическая структура рацемического ибупрофена, плотного порошка парацетамола и отвержденного экструдата, содержащих ибупрофен, парацетамол и натрий-кроскармеллозу
Кристаллические структуры рацемического ибупрофена, плотного порошка парацетамола, сухой смеси рацемического ибупрофена и плотного порошкового парацетамола, а также отвержденной экструдированной массы рацемического ибупрофена и избытка парацетамола, образованной при расплавлении ибупрофена, но не парацетамола, показаны на фиг.3-6 соответственно. Кристаллические структуры определяют с использованием сканирующей электронной микроскопии (СЭМ).
Из фиг.3, 4 и 5 видно, что парацетамол и ибупрофен имеют четкую кристаллическую структуру. Кристаллы парацетамола более неровные по размеру и форме, чем кристаллы ибупрофена. Кристаллы парацетамола имеют по существу кубическую форму и крупнее, чем кристаллы ибупрофена, которые имеют форму игл. На фиг.3 и 4 парацетамол указан буквой P, а ибупрофен на этих чертежах указан буквой I. И наоборот, кристаллическая структура отвержденной экструдированной расплавленной массы, содержащей избыточное количество парацетамола, относительно ибупрофена (фиг.6), демонстрирует кристаллы парацетамола (P), которые по существу представляют собой четко различимые, соединенные вместе кристаллы, окруженные отвержденным расплавом ибупрофена (I).
Примеры 17 и 18: Улучшенные показатели текучести и прессуемости фармацевтической композиции согласно настоящему изобретению в сравнении с композицией сухой смеси
Таблетки, содержащие рацемический ибупрофен и парацетамол, согласно примерам 17 и 18 получают на основе композиции, показанной в таблице 4.
(получают при экструзии расплава)
(получают из сухой смеси)
Таблетки, приведенные в таблице 17, получают в ходе процесса экструзии расплава, описанного в примерах 1а и 1b. Таблетки, описанные в примере 18, получают из сухой смеси компонентов, перечисленных в таблице 3. В частности, материал сырья просеивают через сито с размером пор 16 меш, отдельно от безводной коллоидной двуокиси кремния, которую пропускают через сито с размером пор 30 меш, и в сухом виде смешивают друг с другом указанные компоненты в течение 15 минут в барабанном смесителе. Далее порошковую смесь прессуют на таблеточном прессе с одним штамповочным устройством Manesty F3 с использованием стандартного устройства размером 18×8 мм в машине для получения таблетки массой 660 мг. Получаемая смесь имеет липкую консистенцию и высокий уровень прилипаемости к штамповочным устройствам, применяемым при прессовании. В этой связи смесь трудно прессовать.
И наоборот, композиция согласно примеру 17, описанная в таблице 4, демонстрирует превосходный показатель текучести (то есть она нелипкая), которую легче прессовать. При этом имеется возможность запускать роторную таблеточную машину с более быстрой скоростью, до 100000 таблеток час.
Прочность на раздавливание таблеток, полученных по процедуре примеров 17 и 18, определяют при регистрации прочности на раздавливание по диаметру, когда таблетки разрушают между двумя двигающимися щеками в дробилке в тестере таблеток Schluniger 6D. Прочность на раздавливание представляет собой меру твердости таблетки (то есть более высокая прочность на раздавливание соответствует большей твердости таблетки). Щеки в дробилке, используемые в тестере таблеток, устанавливают на отметках расстояния 24, 26, 28 и 29 в данном приборе.
Таблетки, описанные в примере 17, которые получают в процессе расплавления-экструзии, демонстрируют прочность на раздавливание, равную 6,9-7,1 кП (в среднем 7,0 кП). Тогда как таблетки, описанные в примере 18, полученные на основе сухой смеси, демонстрируют прочность на раздавливание, равную 2,0-3,2 кП (в среднем 2,7 кП).
Полученные результаты показывают, что расплавленные гранулы, использованные для получения таблеток в примере 17, демонстрируют улучшенные показатели текучести и легче прессуются, чем композиция на основе сухой смеси рацемического ибупрофена и парацетамола, описанная в примере 18. Кроме того, таблетки, полученные в процессе расплава-экструзии (пример 17), имеют значительно большую жесткость и твердость, чем соответствующие таблетки, полученные на основе сухой смеси (пример 18). Следовательно, таблетки согласно примеру 17 более приемлемы в связи с тем, что они могут выдерживать жесткие условия процесса производства (например, нанесение сахарной пленки, процесс упаковки и т.п.).
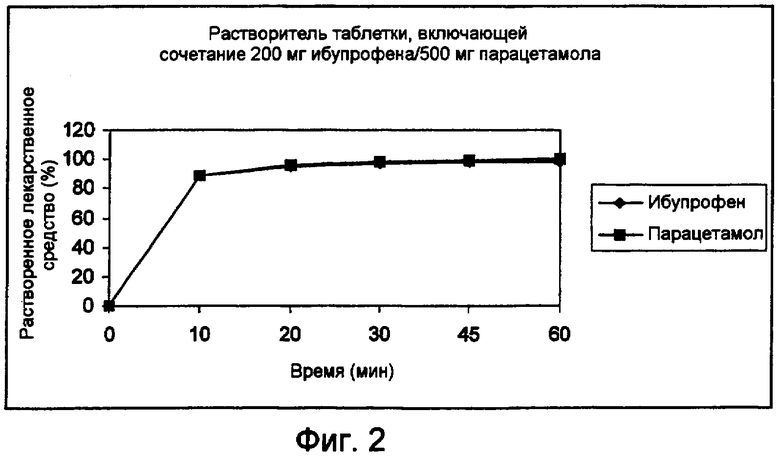




Предложен способ получения гранулированной композиции, включающий множество гранул отвержденного расплава, которые содержат нестероидное противовоспалительное средство (НПВС), выбранное из арилпропионовых кислот и арилуксусных кислот и парацетамол; причем способ включает стадии: (а) получение расплавленной смеси путем смешивания расплавленного НПВС в форме свободной кислоты и парацетамола, необязательно при наличии одного или нескольких эксципиентов; и (b) формирование на основе расплавленной смеси гранул отвержденного расплава. Предложены также гранулированная композиция, полученная заявленным способом, для лечения боли и/или воспаления, и/или лихорадочного состояния и соответствующая фармацевтическая композиция. Показано: заявленная гранулированная композиция позволяет сформировать таблетки с достаточной степенью твердости (прочность на раздавливание 6,9-7,1 кП) при растворимости 89% ибупрофена и парацетамола уже через 10 мин. 7 н. и 30 з.п. ф-лы, 6 ил., 4 табл.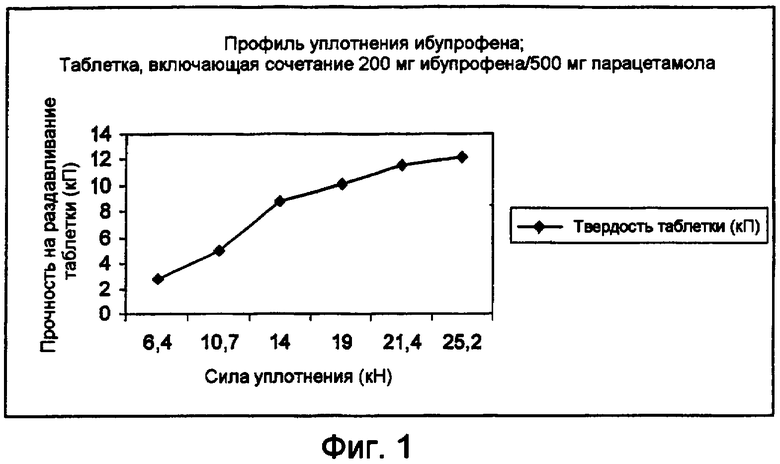
1. Способ получения гранулированной композиции, содержащей множество гранул отвержденного расплава, включающих нестероидное противовоспалительное средство (НПВС) и парацетамол, где НПВС выбирают из арилпропионовых кислот и арилуксусных кислот и где указанный способ включает стадии:
(a) получения расплавленной смеси путем смешивания расплавленного НПВС и парацетамола, необязательно при наличии одного или нескольких эксципиентов; и
(b) формирования на основе расплавленной смеси гранул отвержденного расплава.
2. Способ по п.1, отличающийся тем, что масса парацетамола в гранулах отвержденного расплава выше или равна массе НПВС, присутствующего в гранулах отвержденного расплава.
3. Способ по п.1 или 2, отличающийся тем, что весовое соотношение парацетамола к НПВС в гранулах отвержденного расплава выше или равно 1,5:1.
4. Способ по п.3, отличающийся тем, что весовое соотношение парацетамола к НПВС в гранулах отвержденного расплава выше или равно 2,1:1 и меньше или равно 3:1.
5. Способ по п.1, отличающийся тем, что парацетамол присутствует в количестве, большем или равном 40 мас.% и меньшем или равном 80 мас.% от гранул отвержденного расплава, применительно к общей массе гранул отвержденного расплава.
6. Способ по п.1, отличающийся тем, что НПВС присутствует в количестве, большем или равном 20 мас.% и меньшем или равном 45 мас.% от гранул отвержденного расплава, применительно к общей массе гранул отвержденного расплава.
7. Способ по п.1, отличающийся тем, что НПВС полностью расплавлен в расплавленной смеси.
8. Способ по п.1, отличающийся тем, что парацетамол не расплавляют при получении расплавленной смеси.
9. Способ по п.1, отличающийся тем, что НПВС включает 2-арил-пропионовую кислоту.
10. Способ по п.9, отличающийся тем, что 2-арилпропионовая кислота включает рацемический ибупрофен или S(+)-ибупрофен.
11. Способ по п.1, отличающийся тем, что расплавленную смесь получают путем расплава-экструзии смеси, включающей НПВС, парацетамол и необязательно один или несколько эксципиентов.
12. Способ по п.1, отличающийся тем, что расплавленную смесь формируют в виде гранул отвержденного расплава путем охлаждения расплавленной смеси с получением отвержденного расплава и при измельчении отвержденного расплава с образованием гранул отвержденного расплава.
13. Способ по п.1, отличающийся тем, что расплавленная смесь на стадии (а) включает НПВС, парацетамол и средство, способствующее разложению.
14. Способ по п.13, отличающийся тем, что указанное средство, способствующее разложению, присутствует в количестве от большего или равного 1 мас.% до меньшего или равного 20 мас.% от гранул отвержденного расплава, применительно к общей массе гранул отвержденного расплава.
15. Способ по п.1, который также включает стадию прессования гранулированной композиции с образованием нешипучей прессованной таблетки.
16. Гранулированная композиция для применения при лечении боли, и/или воспаления, и/или лихорадочного состояния, включающая множество гранул отвержденного расплава, которые включают НПВС согласно любому из пп.1-14, парацетамол и необязательно один или несколько эксципиентов, согласно любому из пп.1-14.
17. Гранулированная композиция по п.16, отличающаяся тем, что масса парацетамола в гранулах отвержденного расплава выше или равна массе НПВС, присутствующего в гранулах отвержденного расплава.
18. Гранулированная композиция по п.16, отличающаяся тем, что весовое соотношение парацетамола к НПВС в гранулах отвержденного расплава выше или равно 1,5:1.
19. Гранулированная композиция по п.16, отличающаяся тем, что весовое соотношение парацетамола к НПВС в гранулах отвержденного расплава выше или равно 2:1 и меньше или равно 3:1.
20. Гранулированная композиция по п.16, отличающаяся тем, что парацетамол присутствует в композиции в количестве, большем или равном 40 мас.% и меньшем или равном 80 мас.% от гранул отвержденного расплава, применительно к общей массе гранул отвержденного расплава.
21. Гранулированная композиция по п.16, отличающаяся тем, что НПВС присутствует в композиции в количестве, большем или равном 20 мас.% и меньшем или равном 45 мас.% от гранул отвержденного расплава, применительно к общей массе гранул отвержденного расплава.
22. Гранулированная композиция по п.16, отличающаяся тем, что гранулы отвержденного расплава получают путем полного расплавления НПВС.
23. Гранулированная композиция по п.16, отличающаяся тем, что НПВС включает 2-арилпропионовую кислоту.
24. Гранулированная композиция по п.16, отличающаяся тем, что 2-арил-пропионовая кислота включает рацемический ибупрофен или S(+)-ибупрофен.
25. Гранулированная композиция по п.16, отличающаяся тем, что гранулы отвержденного расплава включают НПВС, парацетамол и средство, способствующее разложению.
26. Гранулированная композиция по п.25, отличающаяся тем, что средство, способствующее разложению, присутствует в количестве от большего или равного 1 мас.% до меньшего или равного 20 мас.% от гранул отвержденного расплава применительно к общей массе гранул отвержденного расплава.
27. Гранулированная композиция для применения при лечении боли, и/или воспаления, и/или лихорадочного состояния, включающая множество гранул отвержденного расплава, получаемых по способу согласно любому из пп.1-14.
28. Фармацевтическая композиция для применения при лечении боли, и/или воспаления, и/или лихорадочного состояния, включающая стандартную дозированную форму, которая содержит гранулированную композицию согласно любому из пп.16-27.
29. Фармацевтическая композиция по п.28, отличающаяся тем, что стандартная дозированная форма включает твердую стандартную дозированную форму, в частности прессованную таблетку.
30. Фармацевтическая композиция по п.28, отличающаяся тем, что стандартная дозированная форма также включает дополнительный экстрагранулярный компонент.
31. Фармацевтическая композиция по п.30, отличающаяся тем, что стандартная дозированная форма включает 60-99,5 мас.% гранулированной композиции относительно общей массы стандартной дозированной формы.
32. Фармацевтическая композиция по п.30, отличающаяся тем, что стандартная дозированная форма включает 0,5-40 мас.% дополнительного экстрагранулярного компонента относительно общей массы стандартной дозированной формы.
33. Фармацевтическая композиция по п.28, отличающаяся тем, что дополнительный экстрагранулярный компонент включает один или несколько эксципиентов, выбранных из разбавителя, поверхностно-активного вещества, впитывающего агента и замасливателя.
34. Фармацевтическая композиция по п.28, отличающаяся тем, что стандартная дозированная форма включает дополнительный фармакологически активный ингредиент.
35. Способ лечения боли, и/или воспаления, и/или лихорадочного состояния, включающий введение гранулированной композиции по любому из пп.16-27 или фармацевтической композиции по любому из пп.28-34 млекопитающему при наличии такой необходимости.
36. Применение гранулированной композиции по любому из пп.16-27 или фармацевтической композиции по любому из пп.28-34 при производстве лекарственного средства для лечения боли, и/или воспаления, и/или лихорадочного состояния.
37. Применение расплавленного НПВС, выбранного из арилпропионовых кислот и арилуксусных кислот для модификации свойства прессуемости парацетамола.
| US 6787157 B1, 07.09.2004 | |||
| ЭНЦИКЛОПЕДИЯ ЛЕКАРСТВ | |||
| - М.: РЛС, 2001, с.701 статья «пливалгин» | |||
| КОМБИНИРОВАННЫЙ ПРЕПАРАТ ДЛЯ УСТРАНЕНИЯ СИМПТОМОВ ПРОСТУДНЫХ ЗАБОЛЕВАНИЙ И ГРИППА (ВАРИАНТЫ) | 2003 |
|
RU2237470C1 |
| ПРЕПАРАТ "АНТИГРИППИН" | 1999 |
|
RU2192248C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТАБЛЕТОК С ПОКРЫТИЕМ | 1995 |
|
RU2177310C2 |
| ТЕХНОЛОГИЯ ЛЕКАРСТВЕННЫХ ФОРМ | |||
| /Под ред | |||
| Л.А.Ивановой | |||
| - М.: Медицина, 1991, т.2, с.142, 144-163. | |||
Авторы
Даты
2012-01-10—Публикация
2006-09-07—Подача