Изобретение относится к области иммунологии, именно к способам усиления иммунного ответа у животных и человека на различные антигены, и может быть использовано в медицине, ветеринарии, безвирусном растениеводстве и биотехнологии для получения антител.
Вакцинация, т.е. преднамеренное введение в организм животного или человека ослабленных или убитых возбудителей инфекций, является наиболее действенным средством профилактики инфекционных заболеваний. В результате вакцинации развивается иммунный ответ (ИО) на антигены возбудителя, направленный на их удаление из организма. При повторных контактах вакцинированного человека или животного с данным антигеном ИО осуществляется намного быстрее и эффективнее, так что заболевание не развивается или протекает значительно легче.
Вакцинация целыми вирусными частицами или клетками бактерий, даже убитыми или ослабленными, часто сопровождается нежелательными побочными эффектами. Кроме того, из множества антигенов возбудителя только часть является эффективными иммуногенами (т.е. антигенами, вызывающими сильный ИО). При современном уровне техники имеется возможность точной идентификации тех фрагментов возбудителя, которые обладают максимальной иммуногенностью, и их получения в достаточных для вакцинации количествах путем выделения из возбудителя или искусственного синтеза. В большинстве случаев такие фрагменты представляют собой короткие олигопептиды длиной несколько аминокислотных остатков (антигенные детерминанты, эпитопы). Из-за малых размеров они обладают очень низкой иммуногенностью и не могут быть использованы для вакцинации сами по себе.
Один из подходов к усилению ИО на слабые антигены заключается в использовании т.н. иммунологических адъювантов. Адъювантами называют любые вещества или их композиции, которые активируют иммунную систему, в результате чего специфический ИО на определенный антиген значительно усиливается. Самым известным и наиболее часто используемым является полный адъювант Фрейнда, состоящий из водно-маслянной эмульсии и убитых клеток микобактерий. Из всех известных, этот адъювант отличается наиболее высокой эффективностью, однако он токсичен, его нельзя использовать для человека, домашних и сельскохозяйственных животных и применять внутривенно.
Другой подход к усилению ИО на слабые антигены заключается в повышении (или восстановлении) их иммуногенности посредством сборки на поверхности носителя (платформы), размеры которого обычно многократно превосходят размеры отдельного эпитопа. В основе этого способа лежит врожденное свойство иммунной системы теплокровных животных с высокой эффективностью реагировать на макромолекулярные комплексы, поверхность которых представляет собой систему регулярно повторяющихся антигенных детерминант. Вирусные частицы представляют собой природные устойчивые макромолекулярные комплексы именно такого рода, поэтому в последние годы их активно используют в качестве платформы для создания иммуногенных композиций.
Способы создания иммуногенных композиций на основе вирусов (растений), определяющие современный уровень техники, основаны на конструировании химерных вирусных частиц. У таких частиц в аминокислотную последовательность белка оболочки (БО) вставлен фрагмент целевого белка (ЦБ), например, один из его эпитопов. Такие композиции представляют собой вирусные или свободные от РНК вирусоподобные частицы (ВПЧ), несущие на своей поверхности чужеродные эпитопы. Их получают при полимеризации рекомбинантных молекул БО, сконструированных путем слияния вирусного БО с чужеродным эпитопом методами генетической инженерии. При иммунизации вирусные частицы выступают в качестве носителя (платформы), а экспонированный на поверхности частицы эпитоп - в качестве антигена. Вакцины, полученные на основе практической реализации этого подхода, стимулируют долговременный клеточный и гуморальный протективный иммунитет (Turpen et al. Production of peptides in plants as viral coat protein fusions. US Patent 5977438. Nov. 1999; Werner et al. International Patent Application PCT/EP 2006/009029 (WO/2007/031339); Wemer et al. Immunoabsorbent nanoparticles based on a tobamovirus displaying protein A. Proc. Natl. Acad. Sci. USA, 2006, 103, 17678-17683; McCormick & Palmer. Genetically engineered Tobacco mosaic virus as nanoparticle vaccines. Expert Rev Vaccines. 2008, 7, 33-41; Steinmetz et al., Structure-based engineering of an icosahedral vims for nanomedicine and nanotechnology. Curr. Top.Microbiol. Immunol. 2009, 327, 23-58; Denis et al., Immunogenicity of papaya mosaic virus-like particles fused to a hepatitis С virus epitope: evidence for the critical function of multimerization. Virology 2007, 363, 59-68; Acosta-Ramirez et al., Translating innate response into long-lasting antibody response by the intrinsic antigen-adjuvant properties of papaya mosaic virus. Immunology, 2007, 124, 186-197; Lacasse et al., Novel plant virus-based vaccine induces protective cytotoxic T-lymphocyte-mediated antiviral immunity through dendritic cell maturation. J. Virology, 2008, 82, 785-794; Leclerc et al., Adjuvant viral particle. US Patent 7641896, Jan.5 2010).
Недостатком этих способов является сложность получения иммуногенной композиции. Упрощенная схема такой работы выглядит следующим образом. В реакции обратной транскрипции на матрице геномной вирусной РНК получают кДНК-копию гена БО. Полученную кДНК размножают с помощью полимеразной цепной реакции (ПЦР). Продукт ПЦР (ген БО) клонируют в бактериальной плазмиде. Аналогичным образом получают кДНК, кодирующую фрагмент целевого белка (ЦБ). Затем обе ДНК объединяют in vitro («сливают»), одновременно добавляя к конструкции ряд элементов, обеспечивающих эффективную экспрессию полученного гена в бактериальных клетках и возможность очистки рекомбинантного белка из лизата. Полученной плазмидой заражают клетки Escherichia coli. В результате экспрессии рекомбинантного гена образуется БО вируса, слитый с ЦБ («фьюжен-белок»), который собирается в вирусоподобные частицы (ВПЧ) непосредственно в клетках бактерий в силу способности БО к самосборке. ВПЧ выделяют из клеточного лизата (обычно с помощью дорогостоящей аффинной хроматографии) и используют по назначению. Несмотря на то, что в этом описании опущены многие важные детали, можно видеть, что получение каждого вида рекомбинантного вируса, несущего химерный БО, - это сложный и трудоемкий процесс. Тем не менее, этот подход в случае нативных вирусов применяется, так как иным образом зафиксировать ЦБ на интактных вирусных частицах (ВТМ, или вируса мозаики папайи, или любых других вирусов) нельзя.
Другой важный недостаток иммуногенных композиций на основе химерных вирусов заключается в отсутствии у них универсальности. Для каждого нового ЦБ или эпитопа надо получать свою платформу и проделывать заново описанные генно-инженерные манипуляции. Условия этих операций для различных ЦБ могут сильно отличаться, и для создания новой иммуногенной композиции нередко требуется предварительная длительная оптимизация этих условий.
Известен способ усиления ИО, объединяющий оба упомянутые технические решения, который целесообразно взять за прототип (Leclerc D., Immunogenic affinity-conjugated antigen systems based on papaya mosaic virus and uses thereof. US Patent applications 2010/0047264).
Согласно одному из воплощений прототипа, в качестве адъюванта используют очищенный препарат вируса мозаики папайи (ВМП). Животных иммунизируют смесью антигена и ВМП. Показано, что нативные частицы ВМП обладают адъювантной активностью. Эта активность продемонстрирована на двух модельных антигенах - лизоциме и овальбумине, и выражается в том, что титр мышиных антисывороток, полученных при совместной иммунизации этими антигенами и ВМП, выше, чем при иммунизации этими антигенами без ВМП.
Согласно другому воплощению прототипа, ВПЧ на основе ВМП используют в качестве носителя (платформы) для создания иммуногенных композиций. ВПЧ получают путем полимеризации химерного БО ВМП, объединенного (слитого) с целевым пептидом в результате генетической модификации гена БО. Упомянутый целевой пептид обладает высоким сродством (аффинностью) к поринам Salmonella typhi. Для создания иммуногенной композиции химерные ВПЧ смешивают с антигенами (поринами), которые аффинно адсорбируются на частицах носителя. Показано, что парентеральное или пероральное введение такой композиции индуцирует у животного протективный иммунитет к возбудителю сальмонеллеза.
Недостатками прототипа являются сложность получения иммуногенной композиции и слабая адъювантная активность ВМП, выражающаяся в низком титре антисывороток, получаемых с его помощью.
Целью изобретения является упрощение способа получения адъюванта и иммуногенной композиции и повышение их эффективности при стимуляции ИО. Поставленная задача решается тем, что в качестве адъюванта и в качестве носителя (платформы) для создания иммуногенной композиции используют сферические частицы (СЧ), получаемые путем термической перестройки структуры спиральных растительных вирусов, в частности вируса табачной мозаики (ВТМ). Предлагаемое решение основано на том, что упомянутые СЧ обладают значительно большей иммуногенностью, чем исходные частицы нативного вируса.
Изобретение осуществляется двумя способами.
Один способ осуществления настоящего изобретения состоит в следующем. Суспензию частиц ВТМ в концентрации 0,1-10 мг/мл подвергают кратковременной тепловой обработке при температуре выше 94°С. СЧ, образовавшиеся в результате такой обработки, смешивают с антигеном в массовом соотношении 1:1-1:25. Смесь готовят непосредственно перед инъекцией или за некоторое время до нее. Животному парентерально вводят смесь антигена и СЧ. В результате введения такой смеси у животного развивается ИО на введенный антиген, выражающийся в появлении в сыворотке крови антител, специфичных к данному антигену.
Другой способ осуществления настоящего изобретения состоит в следующем. Суспензию частиц ВТМ в концентрации 0,1-10 мг/мл подвергают кратковременной тепловой обработке при температуре выше 94°С. СЧ, образовавшиеся в результате такой обработки, используют в качестве носителя для создания иммуногеной композиции. СЧ смешивают с антигеном в соотношении, обеспечивающем образование монослоя молекул антигена на поверхности носителя. Антиген ковалентно фиксируют на поверхности носителя посредством обработки смеси формальдегидом в течение 10 мин. Полученную композицию вводят животному парентерально. В результате введения композиции у животного развивается ИО на введенный антиген, выражающийся в появлении в сыворотке крови антител, специфичных к данному антигену.
Краткое описание рисунков
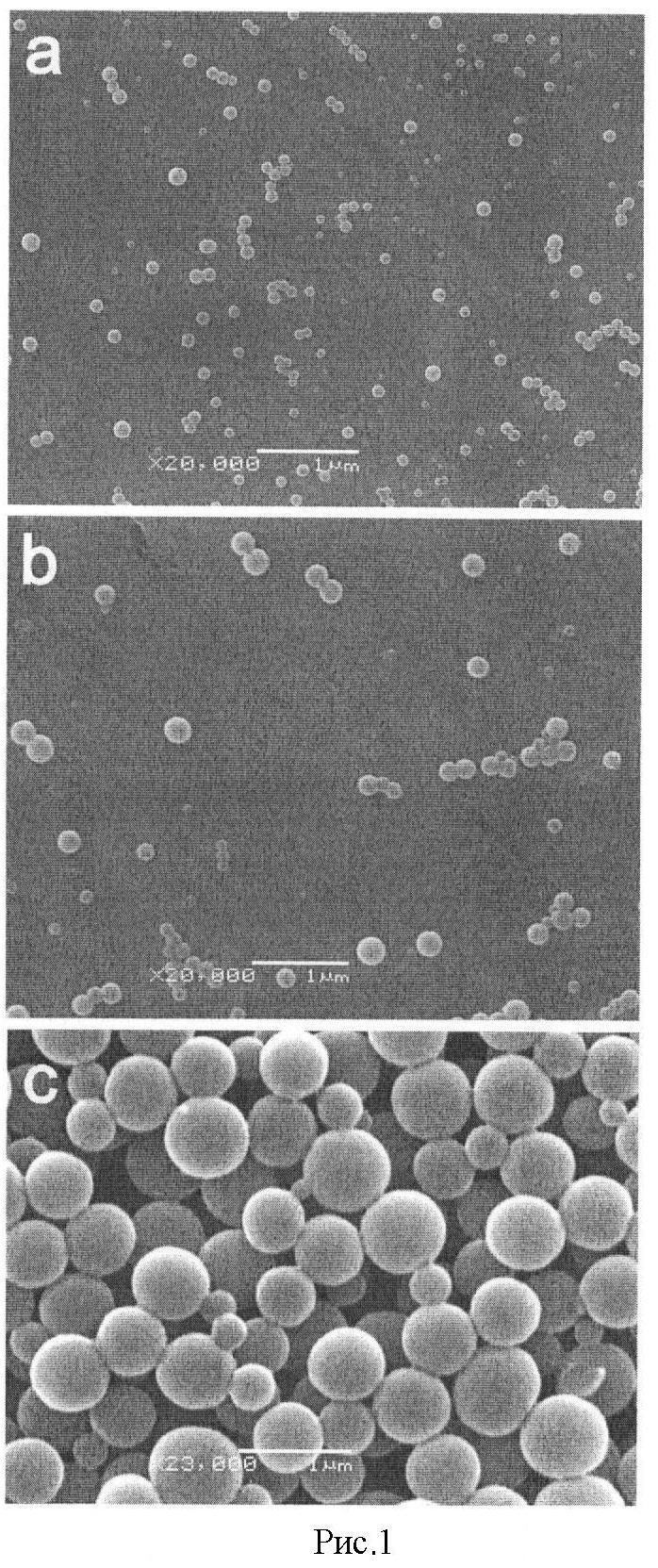
Рисунок 1 иллюстрирует внешний вид СЧ, получаемых при нагревании суспензии нативных частиц ВТМ до 98°С, и зависимость размера СЧ от исходной концентрации ВТМ: (а) 0,1 мг/мл; (b) 1,0 мг/мл; (с) 10 мг/мл. Сканирующая электронная микроскопия.
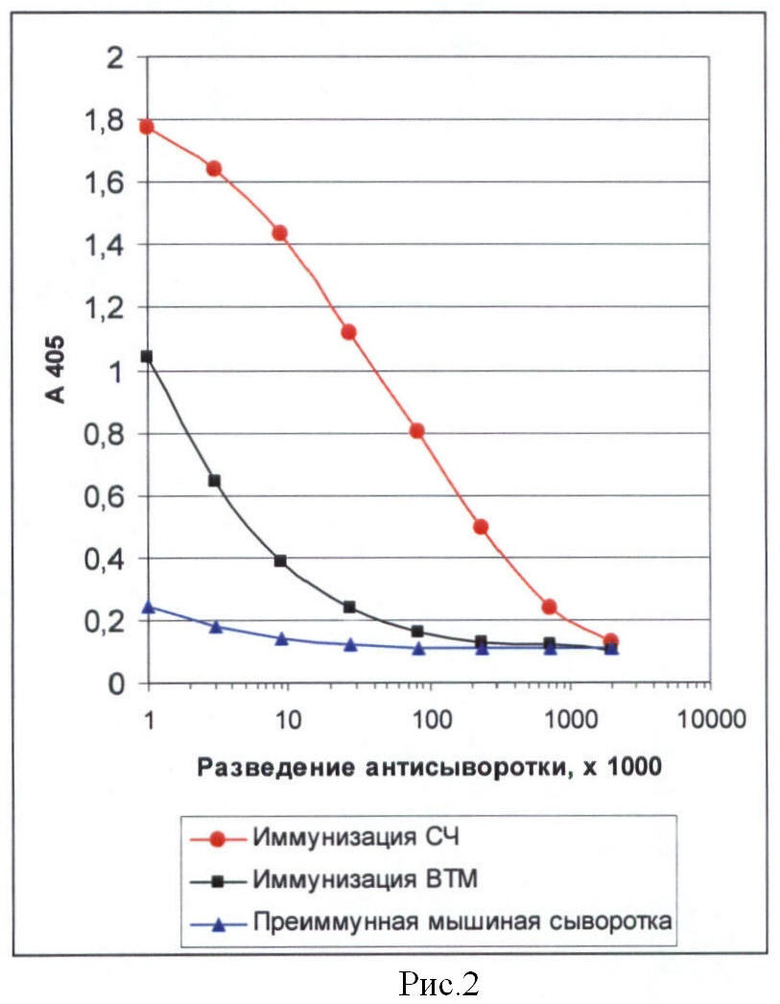
Рисунок 2 представляет собой график, иллюстрирующий результаты определения титра мышиных антисывороток к ВТМ и к СЧ и демонстрирующий более высокую иммуногенность СЧ по сравнению с частицами нативного ВТМ. Твердофазный иммуноферментный анализ (ИФА).
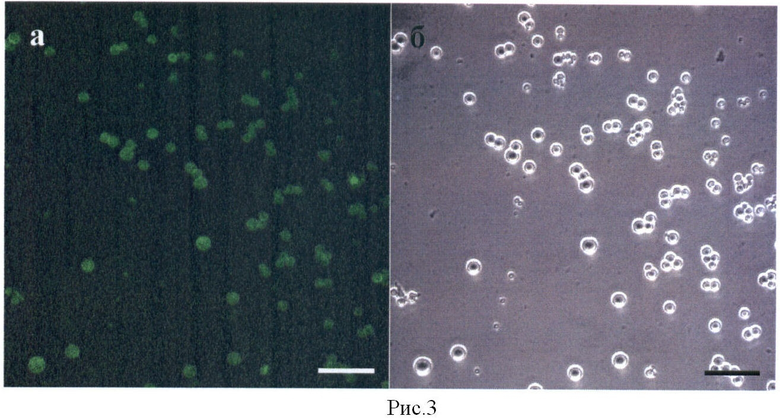
Рисунок 3 показывает, что поверхность всех СЧ полностью покрыта молекулами БО ХВК, меченными флуоресцеинизотиоцианатом (ФИТЦ). (а) Флуоресцентная микроскопия; Размер метки 3 мкм. (б) фазовый контраст.
Рисунок 4 иллюстрирует, что экспрессированный в бактериях рекомбинантный белок Р2 связывается с поверхностью СЧ и выявляется с помощью кроличьих антител к вирусу оспы сливы и вторичных ослиных антикроличьих антител, конъюгированных с флуорофором Alexa 555 красным. Размер метки 5 мкм. Флуоресцентная микроскопия.
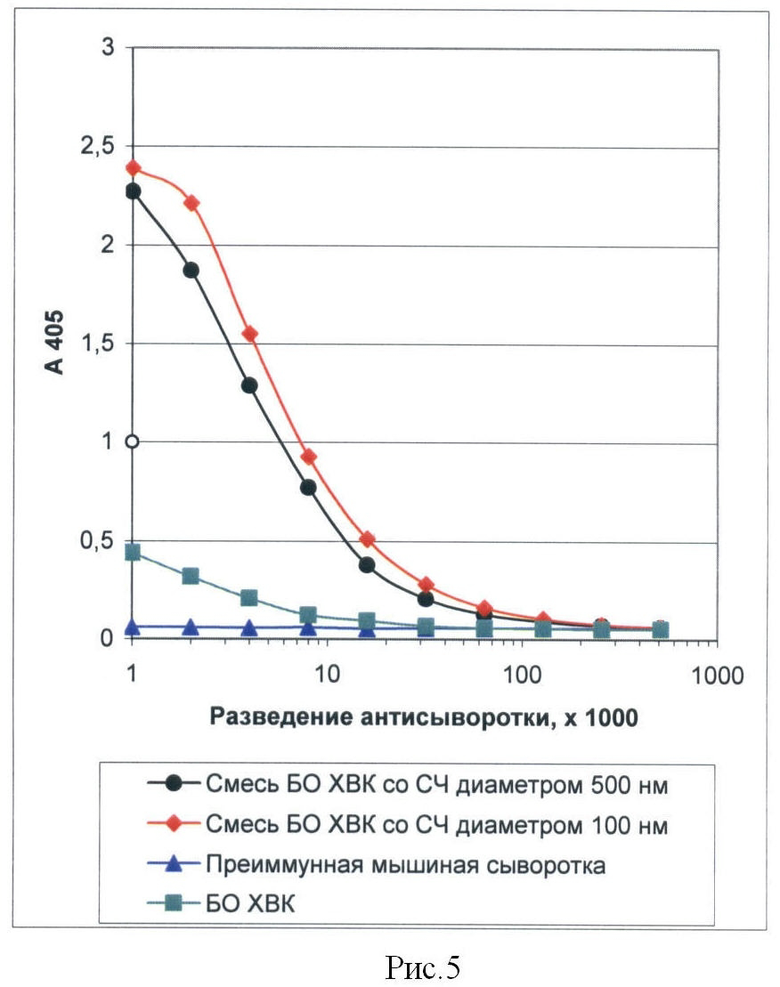
Рисунок 5 представляет собой график, иллюстрирующий результаты определения титра мышиных антисывороток к БО Х-вируса картофеля (ХВК), полученных при иммунизации животных смесью антигена и СЧ разных размеров. ИФА.
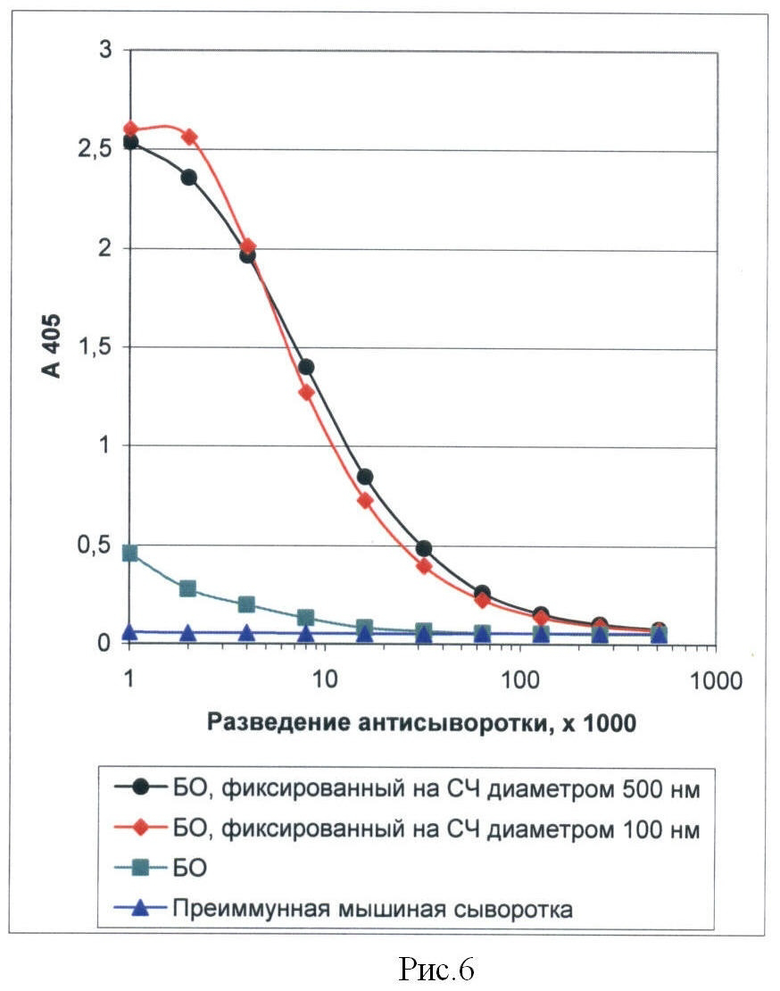
Рисунок 6 представляет собой график, иллюстрирующий результаты определения титра мышиных антисывороток к БО ХВК, полученных при иммунизации животных антигеном, фиксированным на поверхности СЧ различных размеров. ИФА.
Рисунок 7 представляет собой график, иллюстрирующий адъювантный эффект СЧ и иммуногенность композиции, приготовленной на их основе, при стимуляции ИО на рекомбинантный белок N1. ИФА.
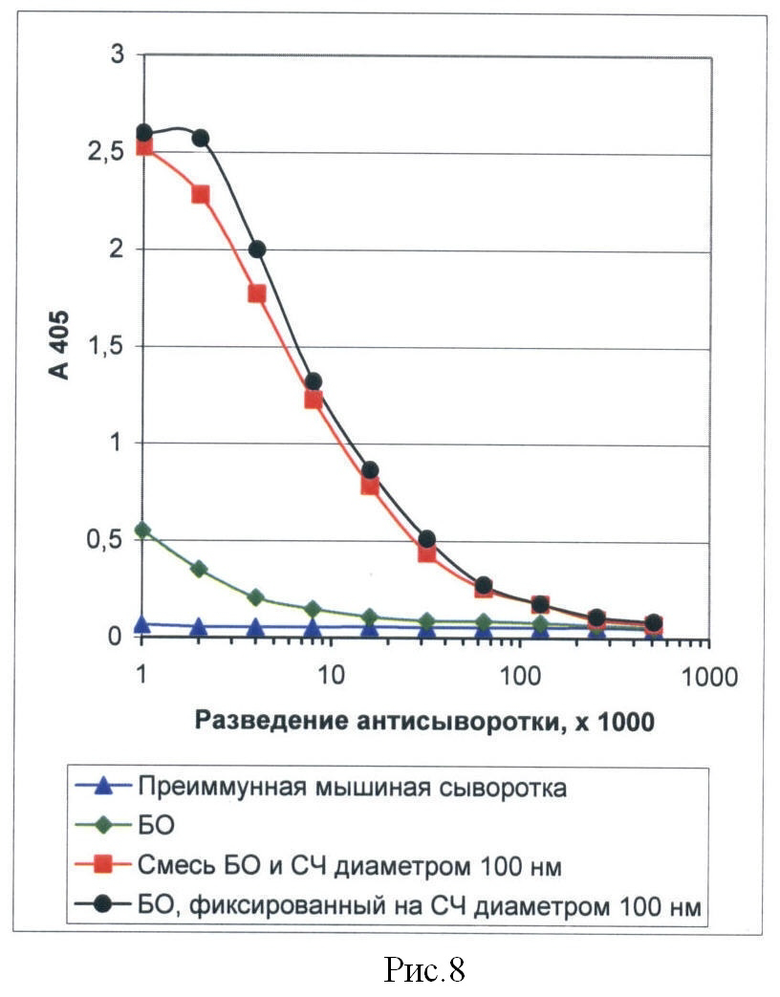
Рисунок 8 представляет собой график, иллюстрирующий результаты определения титра мышиных антисывороток к вирусу, полученных при иммунизации животных БО ХВК в смеси со СЧ или фиксированным на их поверхности. ИФА.
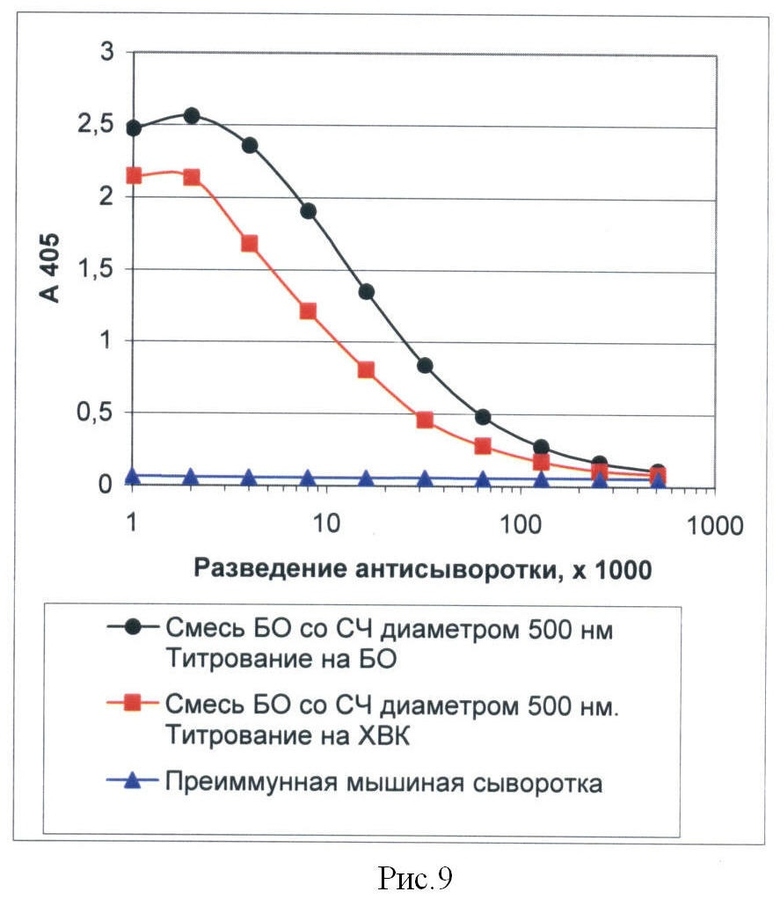
Рисунок 9 представляет собой график, иллюстрирующий влияние дозы СЧ на интенсивность стимуляции иммунного ответа к антигену. ИФА.
ПРИМЕРЫ
Пример 1
Получение сферических частиц (СЧ)
Получение очищенного препарата ВТМ. ВТМ накапливали в растениях табака Nicotiana tabacum с.Самсун. Для препаративного выделения вируса зараженные листья гомогенизировали в 0,02 М натрий-фосфатном буфере, рН 7,5, содержащем 0,2% Na2SO3, 0,01 М ЭДТА и 0,2 М сахарозы, в соотношении 1:5 (г/мл). Экстракт осветляли центрифугированием в роторе JA-20 15000 об/мин в течение 20 мин при 4°С. К осветленному экстракту добавляли водный раствор Тритона Х-100 до конечной концентрации 5% и перемешивали 30 мин при 4°С. Экстракт наслаивали на 20% (г/г) сахарозную подушку, приготовленную на 0,02 М натрий-фосфатном буфере, рН 7,5 с 0,01 М ЭДТА, и центрифугировали в роторе 50.2 Ti на ультрацентрифуге L5-50 (Beckman) 29000 об/мин в течение 210 мин при 4°С. Осадки ресуспендировали в 0,02 М натрий-фосфатном буфере, рН 7,5, содержащим 0,01 М ЭДТА, и оставляли на ночь при 4°С. Вирусный препарат осветляли на настольной центрифуге Eppendorf 5414 в течение 10 мин, разводили в 0,02 М натрий-фосфатном буфере, рН 7,5 с 0,01 М ЭДТА, и центрифугировали в роторе 50.2 Ti на ультрацентрифуге L5-50 30000 об/мин в течение 90 мин при 4°С. Осадок ресуспендировали в 0,02 М натрий-фосфатном буфере, рН 7,5, и осветляли на настольной центрифуге Eppendorf в течение 10 мин. Концентрацию ВТМ в очищенном препарате определяли, используя коэффициент экстинкции А260=2,7. Выход вируса составлял около 500 мг в пересчете на 100 г листовой массы. Анализ ВТМ методом электрофореза в денатурирующем полиакриламидном геле не выявил примесей в очищенном вирусном препарате. Выделение вируса по описанной методике занимало 2 рабочих дня.
Получение сферических частиц (СЧ). В полипропиленовые тонкостенные пробирки объемом 0,5 мл вносили по 50 мкл очищенного препарата ВТМ и наслаивали 30 мкл минерального масла. Пробирки помещали в ячейки термоциклера «Терцик» (ДНК-Технология, Россия) и запускали программу, регулирующую температуру в ячейке: 1) нагревание от 10 до 98°С, 90 сек; 2) инкубация при температуре 98°С, 10 сек; 3) охлаждение до 10°С, 90 сек. По завершении программы пробирки извлекали, удаляли масло и центрифугировали содержимое пробирок 1000 g 5 мин. Надосадочную жидкость отбирали, а осадок ресуспендировали в 50 мкл деионизованной воды. Все операции проводили при комнатной температуре.
Процесс превращения нативного ВТМ в СЧ изучали с помощью сканирующей электронной микроскопии. Высушенные образцы СЧ помещали в ионно-напылительную установку IB-3 Ion Coater (Eico, Japan) и ионизировали поверхность напылением золота с палладием. Анализ проводили при помощи сканирующего электронного микроскопа JSM-6380LA (JEOL, Japan) при 80 кВ. Цифровое изображение получали при помощи камеры Gatan Eriangshen ES500W с использованием программного обеспечения Gatan Digital Micrograph™. При указанных условиях палочковидные частицы ВТМ превращаются в СЧ, размер которых зависит от исходной концентрации ВТМ. Средний диаметр СЧ при концентрации ВТМ 0,1, 1,0 и 5 мг/мл составляет 50, 100 и 500 нм, соответственно (Рис.1).
Данный пример показывает, что предлагаемый нами способ позволяет значительно упростить, по сравнению с прототипом, процедуру получения носителя (платформы). Носитель (СЧ) получают путем кратковременного (10 сек) прогревания суспензии ВТМ при температуре 98°С, в результате которого палочковидные частицы ВТМ превращаются в СЧ определенного размера. Таким образом, результатом изобретения является существенное упрощение способа получения носителя (платформы).
Пример 2
Сравнение иммуногенности СЧ и нативного ВТМ.
Мышей линии BALB/c в возрасте 6-8 недель иммунизировали внутрибрюшинно СЧ или вирионами ВТМ в дозе 100 мкг антигена на 1 инъекцию. Проведено 3 инъекции с двухнедельным интервалом между ними. При первой инъекции антиген вводили в смеси с равным объемом полного адъюванта Фрейнда, при 2 последующих - с равным объемом неполного адъюванта Фрейнда. Кровь, индивидуально от каждой мыши, брали из хвостовой вены через неделю после последней иммунизации. Кровь выдерживали 2 ч при комнатной температуре до формирования сгустка, помещали на ночь в холодильник и на следующий день сгусток отделяли центрифугированием 10000 g 10 мин. Полученную сыворотку использовали для определения титра антител к СЧ и к ВТМ. Титр определяли в пуле, полученном путем смешивания равных объемов антисывороток от каждого животного, с помощью непрямого метода иммуноферментного анализа (ИФА). На планшетах MaxiSorp (Nunc) сорбировали СЧ или ВТМ (6 мкг/мл в PBS: 0,05 М К2НРО4, 0,1 М NaCl, pH 7,4) в объеме 100 мкд на лунку. Планшеты выдерживали ночь в холодильнике, промывали PBST (PBS, 0,1% Твин 20, pH 7,4) 5 раз по 200 мкл на лунку и вносили тестируемые антисыворотки в двойных серийных разведениях, приготовленных на PBST, начиная с разведения 1/1000. В качестве отрицательного контроля использовали преиммунную мышиную сыворотку. Инкубировали 1 ч при 37°С на термостатируемом шейкере, промывали, как описано и добавляли пероксидазный конъюгат (Promega) в рабочем разведении 1/20000, приготовленном на PBS, содержащим 0,5% бычьего сывороточного альбумина. Инкубировали 1 ч при 37°С на шейкере, промывали, как описано и добавляли субстрат - ABTS с перекисью водорода в 0,05 М цитратно-фосфатном буфере pH 4,4. Оптическую плотность в лунках определяли на ридере Titerteck Multiscan при длине волны 405 нм через 20 мин после добавления субстрата. Титром антисыворотки считали ее последнее разведение, оптическая плотность в котором втрое превышала соответствующее значение преиммунной мышиной сыворотки. Данные, представленные на рис.2, показывают, что титр антител к СЧ в 20 раз превышал титр антител к ВТМ.
Этот пример демонстрирует тот неочевидный факт, что СЧ обладают намного более высокой иммуногенностью, чем исходные частицы нативного ВТМ. Это обстоятельство имеет решающее значение для достижения цели настоящего изобретения. Известно, что для индукции гуморального иммунного ответа (синтеза антител) необходима кооперация В и Т-лимфоцитов, при которой рецепторы В-лимфоцитов распознают антиген, а Т-лимфоциты взаимодействуют с носителем. Известно также, что антительный ответ на антиген, присоединенный к носителю, прямо зависит от иммуногенности носителя. Таким образом, эффективность иммунизации (вакцинации) определенной композицией определяется не только иммуногенностью ЦБ, присоединенного к носителю, но и, главным образом, иммуногенностью самого носителя.
Пример 3
Получение белка оболочки вируса Х картофеля
Для препаративного выделения вируса Х картофеля (ХВК) листья зараженных растений дурмана Datura stramonium гомогенизировали с помощью блендера в 200 мл 0,05 М натрий-фосфатного буфера, pH 8,0, содержащего 0,15% 2-меркаптоэтанол и 0,5% ДИЕКА). К двум объемам экстракта, профильтрованного через двойной слой марли, добавляли один объем хлороформа, смесь интенсивно встряхивали в течение 10 мин и осветляли центрифугированием в роторе JA-20 (Beckman) 10000 g в течение 15 мин при 4°С. Осветленный супернатант подкисляли 0,5 М лимонной кислотой до рН 4.8, перемешивая экстракт на магнитной мешалке 20 мин при 4°С. Образовавшийся осадок клеточных компонентов удаляли центрифугированием 10000 g 10 мин. При перемешивании на магнитной мешалке к осветленному экстракту добавляли 1 N NaOH, доводя рН до нейтральных значений, сухой NaCl до конечной концентрации 0,1%, и полиэтиленгликоль (мол.м. 6 кДа) до конечной концентрации 8%. После полного растворения добавленных компонентов содержимое оставляли при 4°С на 30 мин для формирования вируссодержащего осадка. Осадок собирали центрифугированием при 10000 g 15 мин в роторе JA-20 и заливали на ночь 0,05 М натрий-фосфатным буфером, рН 7,2. Окончательную очистку вируса проводили путем ультрацентрифугирования препарата через 30% сахарозную подушку в роторе 50.2 Ti в течение 180 мин при 36000 об/мин. Вирус ресуспендировали в 0,05 М натрий-фосфатном буфере, рН 7,2 и осветляли низкоскоростным центрифугированием на настольной центрифуге Eppendorf 10000 g 10 мин. Концентрацию ХВК в очищенном препарате определяли, используя коэффициент экстинкции А 260=2,9. Белок оболочки (БО) ХВК выделяли путем обработки вирусной суспензии нейтральным раствором 2М LiCl. Суспензию инкубировали ночь при -20°С и центрифугировали при 10000 g. Супернатант, содержащий БО ХВК, диализовали против тридистилированной воды. Белок после диализа ультрацентрифугировали при 100000 g для удаления примесей олигомеров БО. Концентрацию БО определяли, используя коэффициент экстинкции А280=1,2.
Пример 4
Получение рекомбинантных БО ХВК, содержащих эпитопы вируса оспы сливы
Эпитопы БО вируса оспы сливы (ВОС) «VNTNRDRDVDAG» длиной 12 аминокислотных остатков и «SMLNPIFTPA» длиной 10 аминокислотных остатков (Femandez-Femandez, et al. 2002. Identification of immunogenic hot spots within plum pox potyvirus capsid protein for efficient antigen presentation. J. Virol. 76, 12646-12653) были соединены, соответственно, с N-концом полноразмерного БО ХВК (рекомбинантный белок Р2) или с N-концом БО ХВК с делецией первых 20 аминокислот (рекомбинантный белок N1). Рекомбинантные конструкции, экспрессирующие слитые с (His)6 - пептидом рекомбинантные белки, были получены путем клонирования соответствующих ПЦР-фрагментов в плазмидный вектор pQE. Рестрикционные ПЦР-фрагменты были лигированы по соответствующим сайтам в экспрессирующий вектор, как было описано ранее (Ivanov, K.I., et al. 1994. The immobilized movement proteins of two tobamoviruses form stable ribonucleoprotein complexes with full-length viral genomic RNA. FEBS Lett. 346, 217-220). Для клонирования созданных конструкций и их суперэкспрессии были использованы штаммы Е. coli DH5ot и M15[pREP4]. Клетки Е. coli, трансформированные рекомбинантным вектором, выращивали в культуральной жидкости при 37°С до OD600 равным 0.8-0.9. Все манипуляции с рекомбинантными ДНК проводились по стандартным методикам (Sambrook, J., Ftitsch, E.F.and Maniatis T. (1989) Molecular cloning: A laboratory Manual, 2nd edn. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY). Экспрессию рекомбинантных белков индуцировали добавлением 1 мМ IPTG, культуру клеток растили дополнительно 3 ч при 37°С. Хроматографическую очистку (His)6-рекомбинантных белков на Ni-HTA-агарозе проводили согласно протоколу производителя (QIAGEN).
Пример 5
Связывание целевых белков с поверхностью СЧ
Адсорбция БО ХВК. БО ХВК был получен как описано в примере 3. Для наблюдения за связыванием БО с поверхностью СЧ (полученных, как описано в примере 1) белок предварительно метили флуоресцентной меткой, К 1 мг БО ХВК добавляли 18 мкг флуоресцеина изотиоцианата (ФИТЦ), инкубировали 24 часа при 4°С и диализовали против воды для удаления несвязавшейся флуоресцентной метки. 50 мкг СЧ инкубировали с 1 мкг белка в воде. Адсорбцию БО на поверхности СЧ наблюдали с помощью флуоресцентного микроскопа LeicaDRMB, снабженного интегрированной камерой ORCAII-ERG2 (Hamamatsu, Japan). Данные, представленные на рисунке 3, показывают, что БО ХВК покрывает всю поверхность СЧ.
Адсорбция рекомбинантного белка Р2. Рекомбинантный белок Р2 получали, как описано в примере 4. 50 мкг СЧ инкубировали с 1 мкг белка в воде. Связывание Р2 с поверхностью СЧ наблюдали методом конфокальной флуоресцентной микроскопии с помощью иммунохимического окрашивания, основанного на применении кроличьих антитела к ВОС и вторичных ослиные антикроличьих антител, конъюгированных с флуорофором Alexa 555 красным. Данные, представленные на рисунке 4, показывают, что белок Р2 покрывает всю поверхность СЧ.
Данный пример демонстрирует то неочевидное обстоятельство, что, в отличие от нативных вирусных частиц, поверхность СЧ обладает высокой сорбционной емкостью в отношении белков различного происхождения. В силу этой особенности СЧ способ приготовления композиции на их основе заключается в простом смешивании СЧ и ЦБ в соотношении, обеспечивающем образование монослоя ЦБ на поверхности СЧ. В этой связи, при создании иммуногенной композиции отпадает надобность в генно-инжернерных манипуляциях, описанных выше. Кроме того, в отличие от прототипа, СЧ обладают универсальностью: раз полученные, они могут быть использованы для адсорбции любых ЦБ.
Таким образом, другим результатом изобретения является получение универсальных носителей (платформ) для создания различного вида комплексов и иммуногенных композиций.
Пример 6
Адъювантная активность СЧ
Беспородных белых мышей иммунизировали внутрибрюшинно смесью СЧ диаметром 100 или 500 нм и антигена - БО ХВК, в массовом соотношении 25:1. Доза СЧ составляла 500 мкг, а БО - 20 мкг на 1 инъекцию. Контрольную группу мышей иммунизировали по такой же схеме одним БО. Смесь для инъекции готовили непосредственно перед иммунизацией. Объем инъецируемой смеси составлял 0,5 мл на 1 животное. Каждая группа состояла из 5 животных. Проведено 3 иммунизации с двухнедельным интервалом между ними. Кровь индивидуально от каждой мыши брали из хвостовой вены через неделю после последней иммунизации. Кровь выдерживали 2 ч при комнатной температуре до формирования сгустка, помещали на ночь в холодильник и на следующий день сгусток отделяли центрифугированием 10000 g 10 мин. Полученную сыворотку использовали для определения титра антител к БО. С этой целью на планшетах MaxiSorp (Nwic) сорбировали БО ХВК (6 мкг/мл в деионизованной воде). ИФА выполняли как описано в примере 2.
Результаты определения титров антисывороток показывают, что иммунизация животных смесью СЧ и БО приводит к десятикратному увеличению концентрации антител к БО ХВК в крови иммунизированного животного по сравнению с иммунизацией одним БО. Титр антител на 7 день после последней иммунизации смесью СЧ и БО составил 1/64000 (Рис.5).
В прототипе, титры антисывороток к лизоциму и к овальбумину на 10 день после инъекции (2 мг белка и 30 мг ВМП) составили, соответственно, 1/640 и 1/2560 и практически не отличались от титров, полученных при иммунизации без ВМП. На 30 день после инъекции титры возросли и составили, соответственно, 1/1280 и 1/10240. Титр определяли методом непрямого ИФА, адсорбируя на планшете лизоцим и овальбумин в концентрации, соответственно, 100 и 150 мкг/мл.
Этот пример показывает, что адъювант на основе СЧ значительно более эффективен, чем ВМП. Титры антисывороток, полученных с помощью СЧ, в сравнимом временном интервале в 10-100 раз превышали титры, полученные с помощью ВМП. Этот эффект был достигнут при использовании в 100 раз более низкой дозы антигена, в 60 раз более низкой дозы адъюванта ив 16-25 раз более низкой концентрации антигена, адсорбированного на планшете для ИФА.
Таким образом, другим результатом изобретения является создание нового эффективного адъюванта на основе СЧ.
Пример 7
Изучение иммуногенности композиций на основе СЧ
Иммуногенность композиции из СЧ и БО ХВК. Беспородных белых мышей в возрасте 8-10 недель иммунизировали внутрибрюшинно СЧ диаметром 100 или 500 нм, поверхность которых была покрыта БО ХВК, как описано в примере 5. Комплекс белка со СЧ стабилизировали добавлением формальдегида до концентрации 0,05% (10 мин, 20°С). Доза СЧ на 1 инъекцию составляла 500 мкг. Объем инъецируемой смеси составлял 0,5 мл на 1 животное. Контрольную группу мышей иммунизировали по такой же схеме одним БО. Каждая группа состояла из 5 животных. Проведено 3 иммунизации с двухнедельным интервалом между ними. Процессы взятия крови, ее обработки и определения титра антител к БО ХВК осуществляли, как описано в примере 6.
Результаты определения титров антисывороток показывают, что иммунизация животных СЧ, покрытыми БО ХВК, приводит к пятнадцатикратному увеличению количества антител к БО ХВК в крови иммунизированного животного по сравнению с иммунизацией одним БО. Титр антител на 7 день после последней иммунизации составил 1/128000 (Рис.6).
Иммуногенность композиции из СЧ и рекомбинантного белка N1 ВОС. Мышей линии BALB/c иммунизировали рекомбинантным белком N1, тем же белком в смеси со СЧ, и тем же белком, адсорбированным на поверхности СЧ. Способ получения рекомбинантного белка N1 описан в примере 4. Белок N1 адсорбировали на поверхности СЧ, как описано в примере 5, и стабилизировали образовавшийся комплекс добавлением формальдегида до концентрации 0,05% (10 мин, 20°С). Количество рекомбинантного белка N1 во всех случаях составляло 28 мкг на 1 инъекцию. Были проведены 3 внутрибрюшинных иммунизации с двухнедельным интервалом между ними. Через неделю после последней иммунизации, полученную антисыворотку использовали для определения титра антител к эпитопу ВОС. Определение титра методом ИФА выполняли как описано в примере 6. Результаты, представленные на рисунке 7, показывают, что СЧ усиливают антительный ответ на химерный белок N1, т.е. обладают адъювантной активностью. При иммунизации смесью СЧ и белка N1 титр антисыворотки возрастал в 10 раз по сравнению с иммунизацией одним белком N1. При иммунизации белком N1, фиксированным на поверхности СЧ, титр возрастал в 80 раз и составил 1/600000.
В прототипе изучен гуморальный иммунный ответ на иммуногенную композицию, представляющую собой химерные ВПЧ ВМП, на которых аффинно адсорбированы модельные антигены: порины OmpC и OmpF Salmonella typhi (Пример 4, рисунок 6) или коровый антиген вируса гепатита С (пример 8, рисунок 13 А). Представленные результаты показывают, что титр антител класса IgG к OmpC на 15 день после инъекции составлял 1/20000, а на 15 день после бустерной инъекции достиг максимума и составил в среднем 1/160000. Титр антител к антигену вируса гепатита С составил 1/4500.
Данный пример показывает, что композиции на основе СЧ превосходят композиции, описанные в прототипе, по иммуногенности и темпу образования антител при примерно равном количестве антигена, использованного для иммунизации (10 мкг в прототипе, 20 мкг в нашем изобретении). Вместе с тем, способ получения иммуногенных композиций в нашем изобретении отличается от прототипа простотой.
Таким образом, еще одним результатом изобретения является простой способ создания высокоактивных иммуногенных композиций, основанный на использовании СЧ в качестве носителя (платформы).
Пример 8
Образование антител к интактному вирусу при совместной иммунизации БО ХВК и СЧ
Антисыворотки к БО ХВК, полученные, как описано в примерах 6 и 7, титровали методом ИФА на планшетах, покрытых интактным ХВК. На планшетах MaxiSorp (Nunc) адсорбировали ХВК (6 мкг/мл в PBS) в объеме 100 мкл на лунку. Остальные процедуры осуществляли, как описано в Примере 6.
Результаты определения титров антисывороток представлены на рисунке 8. Они показывают, что при совместной иммунизации животных смесью БО и СЧ или БО, фиксированным на СЧ, в крови иммунизированных животных возникают антитела к интактному вирусу. Совместная иммунизация животных БО ХВК и СЧ приводит к пятнадцатикратному увеличению концентрации антител к ХВК в крови иммунизированного животного по сравнению с иммунизацией одним БО. Титр антител на 7 день после последней иммунизации составил 1/128000.
Данный пример показывает, что совместная иммунизация СЧ и фрагментом вируса, именно его БО, в смеси со СЧ или фиксированным на поверхности СЧ, индуцирует образование антител к интактному вирусу.
Пример 9
Влияние дозы СЧ на образование антител к БО и к интактному вирусу при совместной иммунизации антигеном и СЧ.
Беспородных белых мышей иммунизировали внутрибрюшинно смесью СЧ диаметром 500 нм и БО ХВК в массовом соотношении 1:1. Доза СЧ составляла 30 мкг, БО - 30 мкг на 1 инъекцию. Для иммуноферментного определения титра антител к БО и к вирусу на планшетах MaxiSorp (Nunc) сорбировали БО ХВК (6 мкг/мл в деионизованной воде) или ХВК (6 мкг/мл в PBS) в объеме 100 мкл на лунку. Остальные процедуры осуществляли, как описано в Примере 6.
Результаты определения титров мышиных антисывороток, представленные на рисунке 9, показали, что при совместной иммунизации животных смесью БО и СЧ в массовом соотношении 1:1, в крови иммунизированных животных возникают антитела к БО и к интактному вирусу. Титр антител на 7 день после последней иммунизации составил 1/128000.
Данный пример показывает, что СЧ, используемые в качестве адъюванта или в качестве носителя для создания иммуногенной композиции, обладают высокой иммуногенностью в широком интервале концентраций.
Таким образом, предлагаемый способ усиления иммунного ответа обладает следующими преимуществами по сравнению с прототипом: 1) позволяет значительно упростить процедуру получения носителя (платформы); 2) позволяет получать универсальный и более иммуногенный носитель для создания различного вида комплексов и иммуногенных композиций; 3) позволяет упростить процедуру получения иммуногенных композиций; 4) адъювант на основе СЧ значительно более эффективен, чем ВМП.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЧУЖЕРОДНЫЕ АНТИГЕНЫ НА ПОВЕРХНОСТИ СФЕРИЧЕСКИХ НОСИТЕЛЕЙ, ПОЛУЧЕННЫХ ПРИ ТЕРМИЧЕСКОЙ ДЕНАТУРАЦИИ СПИРАЛЬНЫХ ВИРУСОВ | 2010 |
|
RU2440140C1 |
| НОВЫЙ ТИП ЧАСТИЦ-НОСИТЕЛЕЙ (ПЛАТФОРМ) ДЛЯ ПОЛУЧЕНИЯ АКТИВНЫХ КОМПЛЕКСОВ | 2010 |
|
RU2441667C1 |
| ВАКЦИНА ПРОТИВ КРАСНУХИ НА ОСНОВЕ СТРУКТУРНО-МОДИФИЦИРОВАННОГО ВИРУСА РАСТЕНИЙ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2016 |
|
RU2660563C2 |
| ВИРИОНЫ И ВИРУСОПОДОБНЫЕ ЧАСТИЦЫ ВИРУСА МОЗАИКИ АЛЬТЕРНАНТЕРЫ КАК УСИЛИТЕЛИ ИММУННОГО ОТВЕТА | 2015 |
|
RU2639491C2 |
| РЕКОМБИНАНТНАЯ ВАКЦИНА ПРОТИВ СИБИРСКОЙ ЯЗВЫ НА ОСНОВЕ ВИРУСОВ РАСТЕНИЙ | 2023 |
|
RU2821917C1 |
| АНТИГЕН ДЛЯ РЕКОМБИНАНТНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА КРАСНУХИ | 2019 |
|
RU2709328C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТИВНЫХ КОЛИЧЕСТВ АНТИГЕНОВ ФЛОЭМНО-ОГРАНИЧЕННЫХ ВИРУСОВ | 2012 |
|
RU2525136C1 |
| Иммуногенная композиция на основе рекомбинантных псевдоаденовирусных частиц, а также на основе белковых антигенов и способ получения иммуногенной композиции | 2018 |
|
RU2691302C1 |
| ВАКЦИННЫЙ ПРЕПАРАТ | 2009 |
|
RU2409386C1 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ НА ОСНОВЕ СИНТЕТИЧЕСКИХ ПЕПТИДОВ, КОПИРУЮЩИХ АКТУАЛЬНЫЕ ДЕТЕРМИНАНТЫ gp120 ВИЧ1 | 2014 |
|
RU2577132C1 |


Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для усиления иммунного ответа у человека и животных на антиген, состоящий из одного или большего количества эпитопов. Для этого проводят парентеральную иммунизацию пациента либо смесью упомянутого антигена и адъюванта, представляющего собой сферические частицы, либо упомянутым антигеном, фиксированным на поверхности сферических частиц. При этом сферические частицы состоят из термоденатурированного белка оболочки спиральных вирусов растений, преимущественно вируса табачной мозаики. Изобретения обеспечивают эффективную стимуляцию иммунного ответа на антиген при парентеральной иммунизации пациента малыми дозами антигена. 2 н.п.ф-лы, 9 пр., 9 ил.
1. Способ усиления иммунного ответа на антиген, состоящий из одного или большего количества эпитопов, посредством применения для парентеральной иммунизации животных или человека смеси упомянутого антигена и адъюванта, отличающийся тем, что в качестве адъюванта используют сферические частицы, состоящие из термоденатурированного белка оболочки спиральных вирусов растений, преимущественно вируса табачной мозаики (ВТМ).
2. Способ усиления иммунного ответа на антиген, состоящий из одного или большего количества эпитопов, посредством применения для парентеральной иммунизации животных или человека упомянутого антигена, фиксированного на поверхности сферических частиц, состоящих из термоденатурированного белка оболочки спиральных вирусов растений, преимущественно ВТМ.
| US 2010047264 A1, 25.02.2010 | |||
| RU 2215035 C2, 27.10.2003 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| МЕЩЕРЯКОВА Ю.А | |||
| Вирус мозаики коровьего гороха как вектор для получения рекомбинантных антигенов вирусов гепатита В и гриппа А в растениях | |||
| Дис.… к.б.н | |||
| - М., 2009, с.8-121 | |||
| WERNER S | |||
| et al | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2012-02-20—Публикация
2010-12-09—Подача