Изобретение относится к области ветеринарной вирусологии и биотехнологии, касается ассоциированной вакцины инактивированной эмульсионной, которая может быть использована для специфической профилактики болезней птиц, индуцируемых вирусами ньюкаслской болезни (МБ) птиц, инфекционного бронхита кур (ИБК), синдрома снижения яйценоскости - 76 (ССЯ-76), инфекционной бурсальной болезни (ИББ) и реовирусного теносиновита (РВТ) птиц.
Мировая тенденция второй половины XX века в птицеводстве - это эпоха превращения домашних мелкотоварных хозяйств в крупномасштабное высокопродуктивное производство. Такая ситуация породила уникальные изменения биоэкологической ниши, окружающей выращиваемое поголовье и, в частности, привела к чрезвычайно спрессованной во времени трансформации спектра вирусных инфекций, повсеместно поражающих домашнюю птицу. За этот период появились вновь, антигенно обновились или существенно усилили вирулентность более десяти возбудителей, став причиной весьма опасных инфекционных болезней птиц. Среди хорошо известных, например, вирусов МБ или болезни Марека (БМ) особое место заняли возбудители ИБК, ИББ, ССЯ-76 и РВТ. Именно эти этиологические агенты, действуя порознь, или, как правило, в ассоциации наносят катастрофический с экономической точки зрения ущерб промышленному птицеводству. При этом ущерб становится более ощутимым, когда эти заболевания поражают племенное ядро или стада кур-несушек (1, 2).
Эффективность предупреждения указанных заболеваний во всем мире связывают главным образом с применением живых и инактивированных вакцин. При этом вакцинопрофилактика до последнего времени остается единственным фундаментально проработанным методическим приемом для эффективного противостояния инфекционным болезням при крупномасштабном выращивании птицы.
Однако каждый тип вакцин, используемых для специфической профилактики вышеуказанных заболеваний у птиц, имеет преимущества и недостатки. Преимущество живых вакцин состоит в технологичности и в возможности использования массовых методов применения при вакцинации. К недостаткам живых вакцин относятся формирование нестабильной иммунной реакции у птиц, развитие различного рода осложнений, таких как повышенная реактогенность, развитие иммуносупрессии, а иногда и гибели птиц при воздействии неблагоприятных условий содержания и наличия сопутствующих инфекций, а также возможны проблемы воспроизводства, длительная персистенция и выделение вакцинного вируса во внешнюю среду.
В промышленном птицеводстве широкое применение нашли сорбированные на гидроокиси алюминия (ГОА) или масляные на основе эмульсии обратного типа инактивированные вакцины, обладающие существенными преимуществами по сравнению с живыми вакцинными препаратами. Прежде всего следует отметить их высокую безопасность и безвредность; возможность стандартизации дозированного введения специфического антигена, стабильность основных биологических свойств, возможность создания системного, напряженного и продолжительного иммунологического эффекта (3).
Известна вакцина против НБ птиц инактивированная эмульсионная, содержащая в качестве активного вещества авирулентный очищенный антигенный материал из штамма "Ла Сота" вируса НБ, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 8,0 lg ЭИД50/см3 и титром гемагглютинирующей активности (ГА-активность) в экстраэмбриональной жидкости не ниже 1:256, и в качестве целевой добавки масляный адъювант в эффективном соотношении (4, 5).
Известна вакцина против ИБК инактивированная эмульсионная, содержащая в качестве активного вещества авирулентный очищенный антигенный материал из штамма 4/91 вируса ИБК, полученного в 9÷11-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 5,0 lg ЭИД50 /см3 и депонированного в ЕСАСС под № V93070612, и в качестве целевой добавки масляный адъювант в соотношении, мас.%:
Известна вакцина против ССЯ-76 птиц инактивированная эмульсионная, содержащая в качестве активного вещества авирулентный очищенный антигенный материал из штамма "БИСС №113" (авторское наименование) вируса ССЯ-76 птиц, полученного в 9÷11-суточных утиных эмбрионах (УЭ) или 9÷11-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 6,0 lg ЭИД50/0,2 см3 и ГА-активностью не ниже 1:4096, и в качестве целевой добавки масляный адъювант в соотношении, мас.%:
Известна вакцина против ИББ птиц инактивированная эмульсионная, содержащая в качестве активного вещества авирулентный очищенный антигеный материал из штамма "БГ" (авторское наименование) вируса ИББ птиц, полученного в 9÷11-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 4,5 lg ЭИД50/0,2 см3, и в качестве целевой добавки масляный адъювант в соотношении, мас.%:
Известна вакцина против ИББ птиц инактивированная эмульсионная, содержащая в качестве активного вещества авирулентный очищенный антигенный материал из штамма "К-58" (авторское наименование) вируса ИББ птиц, полученного в 9÷11-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 5,25 lg ЭИД50/0,2 см3, и в качестве целевой добавки масляный адъювант в соотношении, мас.%:
Известна вакцина против РВТ птиц инактивированная эмульсионная, содержащая в качестве активного вещества авирулентный очищенный антигенный материал из штамма "S 1133" реовируса птиц, полученного в культуре клеток фибробластов эмбрионов SPF-кур (ФЭК) с инфекционной активностью до инактивации не ниже 7,0 lg ТЦД50/см3, и в качестве целевой добавки масляный адъювант в эффективном соотношении (14÷17).
Применение моновалентных инактивированных вакцин в птицеводстве ограничено необходимостью одновременной вакцинации против нескольких инфекций в короткий промежуток времени (как правило, в пределах 80÷100-суточного возраста), коротким производственным сроком использования птицы, а также ограниченного мышечного пространства для одновременной инъекции нескольких препаратов. Кроме того, многократное повторение индивидуального способа вакцинации сказывается на затратах труда, растягивает сроки образования иммунитета у птиц, способствует возникновению стрессовых явлений и осложнений.
Указанные недостатки частично устранены разработкой и применением в птицеводстве ассоциированных инактивированных вакцин, имеющих в составе разнообразное количественное и качественное соотношение антигенов.
Известна вакцина ассоциированная против НБ птиц и ИБК инактивированная эмульсионная, содержащая смесь авирулентных очищенных антигенных материалов из штамма "Ла Сота" вируса НБ птиц и из штамма "Н-52" вируса ИБК, полученных культивированием в чувствительных биологических системах, и масляный адъювант в эффективном соотношении (18).
Известна вакцина ассоциированная против ССЯ-76 птиц и ИБК инактивированная эмульсионная, содержащая смесь авирулентных очищенных антигенных материалов из штамма "БИСС №113" вируса ССЯ-76 птиц и из штамма "Н-52" вируса ИБК, полученных культивированием в чувствительных биологических системах, и масляный адъювант в эффективном соотношении (19).
Известна вакцина ассоциированная против ССЯ-76 птиц, ИБК и ИББ кур инактивированная эмульсионная, содержащая смесь авирулентных очищенных антигенных материалов из штамма "БИСС №113" вируса ССЯ-76 птиц, из штамма "Н-52" вируса ИБК и из штамма "БГ" вируса ИББ, полученных культивированием в чувствительных биологических системах, и масляный адъювант в эффективном соотношении (20).
Известна вакцина ассоциированная против ИБК, НБ, ИББ и ССЯ-76 птиц инактивированная эмульсионная, содержащая смесь авирулентных очищенных антигенных материалов из штамма "Чапаевский" вируса ИБК, из штамма "Ла Сота" вируса НБ, из штамма "Д-78" или из штамма "Винтерфилд 2512" вируса ИББ и из штамма "В 8/78" вируса ССЯ-76 птиц, полученных культивированием в чувствительных биологических системах, и масляный адъювант в эффективном соотношении (21).
Наиболее близкой к предложенному изобретению по совокупности существенных признаков является вакцина ассоциированная против НБ птиц, ИБК, ИББ, ССЯ-76 и РВТ птиц инактивированная эмульсионная, содержащая смесь авирулентных очищенных антигенных материалов из штамма «Ла Сота» вируса НБ птиц, из штамма "Чапаевский" вируса ИБК, из штамма «Д-78» или из штамма «Винтерфилд-2512» вируса ИББ, из штамма «В 8/78» вируса ССЯ-76 и из штамма "S 1133 " вируса РВТ, полученных культивированием в чувствительных биологических системах, и масляный адъювант в эффективном соотношении (2, 22. 23).
Общим существенным недостатком известных ассоциированных инактивированных вакцин, в том числе вакцины-прототипа, является их недостаточно высокая эффективность вследствие:
1) низкой концентрации специфических антигенных компонентов в прививном объеме и их сложных взаимодействий в составе вакцины,
2) несоответствия антигенного профиля используемых в составе вакцины специфических антигенов эпизоотической обстановке.
Кроме того, соавторы вакцины-прототипа рекомендовали для профилактики НБ птиц дополнительно применять живую вакцину, а для профилактики ИБК сначала живую, а затем инактивированную или одновременно применять обе.
Известно также, что при изготовлении ассоциированных инактивированных вакцин с валентностью выше трех происходит значительное взаимное разведение содержащихся в них антигенных компонентов. В результате снижается их концентрация в прививном объеме препарата. При этом возможность повышения концентрации вирусов при помощи культивирования ограничена. В связи с этим одним из наиболее важных технологических показателей является определение минимальной концентрации антигенов и их оптимального соотношения в прививном объеме вакцины, что обеспечивало бы формирование напряженного иммунитета у кур. Немаловажным в производстве эмульсионных вакцин является выбор адъюванта, который обеспечивал бы стабильность вакцинной эмульсии, индукцию и персистенцию высоких титров антител у привитых птиц при отсутствии побочных эффектов в местах своего введения, а также удобство применения вакцины в производственных условиях. Поэтому проблема получения высокоэффективной ассоциированной вакцины инактивированной эмульсионной против основных возбудителей вирусных заболеваний птиц продолжает оставаться актуальной и является основным направлением исследований по созданию искомого препарата.
Задача, на решение которой направлено настоящее изобретение, заключается в получении вакцины ассоциированной инактивированной эмульсионной, создающей эффективную защиту восприимчивых птиц от заражения возбудителями НБ, ИБК, ССЯ-76, ИББ и РВТ. Основными показателями эффективности применения препарата являются защита племенных стад кур от НБ, ИБК и ССЯ-76, а также создание ранней защиты цыплят с помощью материнского иммунитета от ИББ и РВТ.
Технический результат от использования предложенного изобретения заключается в расширении арсенала высокоиммуногенных безвредных и ареактогенных ассоциированных вакцин инактивированных эмульсионных против возбудителей НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц, циркулирующих на территории Российской Федерации. Технический результат достигнут благодаря определению минимальной концентрации каждого антигена в прививном объеме препарата, минимальной инфекционной активности вирусов, входящих в состав предлагаемой вакцины, до инактивации и оптимальному соотношению антигенных компонентов в вакцине, а
также благодаря нахождению эффективного, удобного в технологическом плане и безопасного адъюванта.
Указанный технический результат достигнут созданием вакцины ассоциированной против НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц инактивированной эмульсионной, охарактеризованной следующей совокупностью признаков.
Согласно изобретению предлагаемая вакцина содержит в качестве активного вещества смесь из авирулентного очищенного антигенного материала из штамма «Ла Сота» вируса НБ птиц, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 10,3 lg ЭИД50/см3, из авирулентного очищенного антигенного материала из штамма «Н-52» вируса ИБК, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 7,2 lg ЭИД50/см3, из авирулентного очищенного антигенного материала из штамма "БИСС №113" вируса ССЯ-76, полученного в 11÷12-суточных ЭУ с инфекционной активностью до инактивации не ниже 7,5 lg ЭИД50/см3, из авирулентного очищенного антигенного материала из штамма "К-58" или из штамма "БГ" вируса ИББ птиц, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 5,5 lg ЭИД50/см3, и из авирулентного очищенного антигенного материала из штамма "1133" вируса РВТ птиц, полученного в культуре клеток ФЭК с инфекционной активностью до инактивации не ниже 7,5 lg ТЦД50/см3, взятых в объемном соотношении 0,5:2,0:0,5:1,0:1,0 соответственно и в количествах, обеспечивающих протективную иммуногенную активность каждого антигена в организме птицы после введения ей целевого препарата.
В качестве целевой добавки предлагаемая вакцина содержит масляный адъювант марки Montanide ISA-70 VG производства "Seppic" (Франция, стандарт ИСО 9001).
В предлагаемой вакцине активное вещество и целевая добавка объединены в соотношении, мас.%: 30,0÷70,0 соответственно.
Предлагаемое изобретение включает следующую совокупность существенных признаков, обеспечивающих получение технического результата во всех случаях, на которые испрашивается правовая охрана:
1. Вакцина ассоциированная против НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц инактивированная эмульсионная.
2. Активное вещество.
3. В качестве активного вещества смесь из авирулентного очищенного антигенного материала из штамма "Ла Сота" вируса НБ птиц, сем. Paramyxoridae, подсемейства Paramyxoridae, рода Avulavirus, серотипа 1, из авирулентного очищенного антигенного материала из штамма "Н-52" вируса ИБК, сем. Coronoviridae, рода Coronavirus, серотипа Массачусетс, из авирулентного очищенного антигенного материала из штамма "БИСС №113" вируса ССЯ-76 птиц, сем. Adenoviridae, рода Aviadenovirus, серотипа 3, коллекция ФГУ "ВГНКИ" "БИСС №113-ДЕП", из авирулентного очищенного антигенного материала из штамма "К-58" или штамма "БГ" вируса ИББ птиц, сем. Birnaviridae, рода Avibimavirus, коллекция ФГУ "ВГНКИ" "К-58 №122-ДЕП" или "БГ" №102 ДЕП соответственно, и из авирулентного очищенного антигенного материала из штамма "1133" вируса РВТ птиц, сем. Reoviridae, рода Orthoreovirus, коллекция ФГУ "ВГНКИ" "1133-ДЕП", взятых в объемном соотношении 0,5:2,0:0,5:1,0:1,0 соответственно и в количествах, обеспечивающих протективную иммунногенную активность каждого антигена в организме птиц после введения им целевого препарата.
4. Целевая добавка.
5. В качестве целевой добавки масляный адъювант.
Признаками изобретения, характеризующими предлагаемую вакцину и совпадающими с признаками прототипа, в том числе родовое понятие, отражающее назначение, являются:
1. Вакцина ассоциированная против НБ птиц, ИБК, ССЯ-76, ИББ и РТВ птиц инактивированная эмульсионная.
2. Активное вещество.
3. Целевая добавка.
По сравнению с вакциной-прототипом существенные отличительные признаки предлагаемой вакцины заключаются в том, что в качестве активного вещества она содержит смесь из авирулентного очищенного антигенного материала из штамма "Ла Сота" вируса НБ птиц, сем. Paramyxoviridae, подсем. Paramyxovirinae, рода Avulavirus, серотипа 1, из авирулентного очищенного антигенного материала из штамма "Н-52" вируса ИБК, сем. Coronoviridae, рода Coronavirus, серотипа Массачусетс, из авирулентного очищенного антигенного материала из штамма "БИСС №113" вируса ССЯ-76 птиц, сем. Adenoviridae, рода Aviadenovirus, серотипа 3, коллекция ФГУ "ВГНКИ" "БИСС №113-ДЕП", из авирулентного очищенного антигенного материала из штамма "К-58" или штамма "БГ" вируса ИББ птиц, сем. Birnaviridae, рода Avibirnavirus. коллекция ФГУ "ВГНКИ" "К-58 №122-ДЕП" или "БГ" 102 ДЕП соответственно, и из авирулентного очищенного антигенного материала из штамма "1133" вируса РВТ птиц, сем. Reoviridae рода Orthoreovirus, коллекция ФГУ "ВГНКИ" "1133-ДЕП", взятых в объемном соотношении 0,5:2,0:0,5:1,0:1,0 соответственно и в количествах, обеспечивающих иммуногенную активность каждого антигена в организме птицы после введения ей целевого препарата.
Предлагаемое изобретение характеризуется другими отличительными признаками, выражающими конкретные формы выполнения или особые условия его использования.
1. Авирулентный очищенный антигенный материал из штамма "Ла Сота" вируса НБ птиц, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 10,3 lg ЭИД50/см3 в количестве, мас.%: 3,0÷6,0.
2. Авирулентный очищенный антигенный материал из штамма " Н-52" вируса ИБК, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью не ниже 7,2 lg ЭИД50/см3, в количестве, мас.%: 6,0÷12,0.
3. Авирулентный очищенный антигенный материал из штамма "БИСС №113" вируса ССЯ-76 птиц, полученного в 11÷12-суточных УЭ с инфекционной активностью до инактивации не ниже 7,5 lg ЭИД50/см3, в количестве, мас.%: 3,0÷6,0.
4. Авирулентный очищенный антигенный материал из штамма "К-58" или из штамма "БГ" вируса ИББ птиц, полученного в 9÷11-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 5,5 lg ЭИД50/см3, в количестве 6,0 мас.%.
5. Авирулентный очищенный антигенный материал из штамма "1133" вируса РТВ птиц, полученного в культуре клеток ФЭК с инфекционной активностью до инактивации не ниже 7,5 lg ТЦД50/см3, в количестве 6,0 мас.%.
6. Масляный адъювант в количестве не менее 70,0 мас.%.
7. Смесь из авирулентного очищенного антигенного материала из штамма "Ла Сота" вируса НБ птиц, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 10,3 lg ЭИД50/см3, из авирулентного очищенного антигенного материала из штамма "Н-52" вируса ИБК, полученного 9÷12-суточных эмбрионах SPF- кур с инфекционной активностью до инактивации не ниже 7,2 lg ЭИД50/см3, из авирулентного очищенного антигенного материала из штамма "БИСС №113" вируса ССЯ-76 птиц, полученного в 11÷12-суточных УЭ с инфекционной активностью до инактивации не ниже 7,5 lg ЭИД50/см3, из авирулентного очищенного антигенного материала из штамма "К-58" или из штамма "БГ" вируса ИББ птиц, полученного в 9÷11-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 5,5 lg ЭИД50/см3, и из авирулентного очищенного антигенного материала из штамма "1133" вируса РВТ птиц, полученного в культуре клеток ФЭК с инфекционной активностью до инактивации не ниже 7,5 lg ТЦД50/см3, и масляный адъювант в соотношении, мас.%:
Входящие в предлагаемую вакцину штаммы вирусов известны и являются производственными при изготовлении моновакцин (1÷11).
В результате проведенных исследований авторы определили важнейшие технологические показатели, позволившие создать препарат, в котором отсутствует конкуренция между антигенами, входящими в состав предлагаемой вакцины, а его иммуногенные свойства были сравнимы с таковыми после применения монопрепаратов. Высокий иммунологический эффект в отношении специфических антигенов, входящих в состав вакцины, был достигнут двумя способами: изменением объемного соотношения антигенов, а также с помощью концентрирования методом ультрафильтрации.
Дополнительный технический результат от использования предлагаемого изобретения достигается за счет того, что для инактивации вирусосодержащих материалов используют аминоэтилэтиленимин (АЭЭИ), что позволяет значительно снизить трудо- и энергозатраты на изготовление вакцины и повысить качество антигенных материалов.
Дополнительный технический результат от использования предлагаемого изобретения в части повышения антигенной и иммуногенной активности целевого продукта достигается также за счет использования в его составе масляного адъюванта Montanide ISA-70 VG производства фирмы " SEPPIC" (Франция, стандарт ИСО 9001).
Сущность изобретения пояснена на графических материалах, на которых на:
фиг.1 представлено графическое изображение динамики образования поствакцинальных антител на антигенный компонент НБ птиц предлагаемой вакцины;
фиг.2 - графическое изображение динамики образования поствакцинальных антител на антигенный компонент ИБК предлагаемой вакцины;
фиг.3 - графическое изображение динамики образования поствакцинальных антител на антигенный компонент ССЯ-76 птиц предлагаемой вакцины;
фиг.4 - графическое изображение динамики образования поствакцинальных антител на антигенный компонент ИББ птиц предлагаемой вакцины;
фиг.5 - графическое изображение динамики образования поствакцинальных антител на антигенный компонент РВТ птиц предлагаемой вакцины.
Используемый для изготовления предлагаемой вакцины штамм "Ла Сота" вируса НБ птиц характеризуется следующими признаками и свойствами.
Морфологические признаки
Вирус НБ птиц штамма "Ла Сота" относится к сем. Paramyxoviridae, подсем. Paramyxovirinae, роду Avulavirus, серотипу 1 и обладает одноцепочечным несегментированным РНК-геномом негативной полярности, состоящим более чем из 15000 нуклеотидов. Сферические, покрытые оболочкой, вирионы имеют диаметр 150 нм и более с характерными поверхностными выступами длиной 8 нм. Есть филаментозные формы диаметром 60÷100 нм и варьирующей длины до нескольких микрометров. Нуклеокапсид имеет спиральный тип симметрии, РНП 12÷17 нм, длину до 1 мкм и жестко упорядоченную структуру. Встречаются вирионы, содержащие несколько нуклеокапсидов.
Антигенные свойства
Антигенная структура стабильна: 5÷7 полипептидов с молекулярной массой 35÷200 килодальтон, один или более поверхностных антигенов; один нуклеокапсидный антиген. Реплицируются в цитоплазме. Обладают геммаглютинирующими свойствами. Некоторые члены семейства имеют нейраминидазу и РНК-зависимую РНК-полимеразу. При вакцинации вирус индуцирует образование специфических антител. Титр гемагглютининов в экстраэмбриональной жидкости при культивировании в эмбрионах кур не ниже 1:256.
Биотехнологические характеристики
Вирус НБ проявляет высокую биологическую, иммуногенную и антигенную активность, культивируется в 9÷12-суточных эмбрионах SPF-кур. Инфекционная активность в лиофилизованном виде не ниже 8,0 lg ЭИД50/см3.
Устойчивость к внешним факторам
Штамм "Ла Сота" вируса НБ птиц чувствителен к эфиру, инактивируется при рН 3,0. Лиофилизованный вирус хранится при температуре минус 2÷40°С в течение 12 месяцев.
Дополнительные признаки и свойства
Свободен от бактериальной и грибной контаминации. Сохраняет инфекционную активность при температуре минус 20÷40°С в течение 12 месяцев, а в лиофилизованном виде при титровании в эмбрионах или в трахеальной органной культуре эмбрионов кур не ниже 6,5 lg ЭИД50/см3.
Для получения антигенного материала из штамма "Ла Сота" вируса НБ птиц в качестве чувствительной биологической системы культивирования используют преимущественно 9÷12-суточные эмбрионы SPF-кур. Полученный вирусосодержащий материал очищают от балластных примесей центрифугированием или любым другим известным методом.
Для инактивации вируса НБ птиц используют АЭЭИ, который добавляют в очищенную вирусосодержащую суспензию до концентрации (%): 0,05÷0,1. Инактивацию вируса проводят при температуре (37±0,5)°С и рН в пределах 7,0÷7,6 в течение 24 часов. По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную суспензию антигена добавляют 1 М раствор тиосульфата натрия из расчета 10% к объему использованного АЭЭИ. Полученный антиген подвергают контролю на антигенную активность, авирулентность, стерильность и рН.
Для изготовления предлагаемой вакцины используют авирулентный очищенный антигенный материал из штамма "Ла Сота" вируса НБ птиц, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 9,0 lg ЭИД50/см3 и ГА-активностью не ниже 1:512, в количестве, мас.%: 3,0-6,0.
Штамм " Н-52" вируса ИБК относится к сем. Coronaviridae, роду Coronavirus, серотипу Массачусетс, реизолирован в 1994 году из голландской коммерческой живой вакцины против ИБК и депонирован 28.12.1984 г.в коллекцию штаммов микроорганизмов ВНИИВИП.
Используемый для изготовления предлагаемой вакцины штамм "Н-52" вируса ИБК характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм "Н-52" вируса ИБК является РНК-содержащим вирусом. Вирус ИБК полиморфен, но в основном круглой формы. Вирионы состоят из нуклеокапсидоспиральной симметрии и липопротеидной оболочки, образующие подобие солнечной короны. Геном вируса представлен односпиральной молекулой РНК с молекулярной массой 6,5÷11 МД. Вирионная РНК обладает инфекционностью. Геном состоит из 27÷33 тыс. нуклеотидов. Гены структурных белков расположены в 3-концевой области гена. Вирионы вируса ИБК содержат три основных вирусоспецифических протеина: гликопротеин шипиков (S), гликопротеин мембраны (М) и протеин нуклеокапсида (N). Дополнительно четвертый протеин (малый мембранный протеин (SM)) ассоциирует с мембранной оболочкой. S-протеин состоит из двух или трех копий: каждая в свою очередь представлена двумя гликополипептидами S1 и S2. Антигемагглютирующие и вируснейтрализующие антитела индуцируются белком S1.
Антигенные свойства
Вирус ИБК в организме птиц индуцирует образование вирусоспецифических антител. Наиболее высокие титры антител обнаруживают различными серологическими методами через 28 дней после вакцинации.
Биотехнические характеристики
Штамм "Н-52" вируса ИБК репродуцируется в 10÷11-суточных эмбрионах SPF-кур. Инфекционная активность вируса составляет 7,0 lg ЭИД50/см3.
Устойчивость к внешним факторам
Вирус ИБК слабо устойчив к физико-химическим воздействиям. Вирионы чувствительны к жирорастворителям, детергентам. Вирус ИБК погибает через 5 мин после нагревания до температуры 56°С и через 90 минут после нагревания до температуры 45°С. Вируссодержащий материал в виде аллантоисной жидкости остается активным в течение многих лет при хранении при температуре минус 30°С. На открытом воздухе вирус ИБК сохраняет жизнеспособность до 12 дней летом и до 56 дней зимой. Эпизоотические штаммы сравнительно более устойчивы к факторам внешней среды, чем вакцинные. Способность некоторых штаммов выживать при низких рН в присутствии пищеварительных ферментов и желчных солей может обуславливать их энтеротропность. Вирус ИБК чувствителен к эфиру, хлороформу, деоксихолату натрия и общепринятым дезинфектантам. Чувствительность к растворителям липидов является характерным признаком при дифференциации полевых изолятов вируса ИБК от некоторых других вирусов, вызывающих болезни птиц - аденовирусов, реовирусов. Антибиотики и сульфаниламиды не оказывают губительного действия на вирус.
Дополнительные признаки и свойства
Обладает антигенной активностью в составе инактивированной вакцины.
Для получения антигенного материала из штамма "Н-52" вируса ИБК в качестве чувствительной биологической системы культивирования используют преимущественно 9÷12-суточные эмбрионы SPF-кур. Полученный вирусосодержащий материал очищают от балластных примесей центрифугированием или любым другим известным способом.
Для инактивации вируса ИБК используют АЭЭИ, который добавляют в очищенную вирусосодержащую суспензию до концентрации (%): 0,3÷0,5. Инактивацию вируса проводят при температуре (25±0,5)°С и рН в пределах 7,4÷7,6 в течение 36 часов. По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную суспензию антигена добавляют 1 М раствор тиосульфата натрия из расчета 10% к объему использованного АЭЭИ. Полученный антиген подвергают контролю на антигенную активность, авирулентность, стерильность и рН.
Для изготовления предлагаемой вакцины используют авирулентный очищенный антигенный материал из штамма "Н-52" вируса ИБК, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 7,5 lg ЭИД50/см3, в количестве, мас.%: 6,0÷12,0.
В случае если инфекционный титр вируса ИБК не удовлетворяет технологическим требованиям (7,55 lg ЭИД50/см3), инактивированный антиген вируса можно сконцентрировать с помощью проточной ультрафильтрации. Для этого можно использовать установку для ультрафильтрации "Сартокон-мини".
Исходный вирус (авторское наименование изолята "БИСС №113") для получения штамма "БИСС №113" выделен из органов репродуктивной системы курицы с признаками острой формы ССЯ-76 в 1999 г. в Ульяновской области. Производственный штамм "БИСС №113" вируса ССЯ-76 получен путем проведения
4-х последовательных пассажей на развивающихся УЭ.
Полученный штамм депонирован 5 октября 2000 г. во Всероссийскую государственную коллекцию штаммов микроорганизмов, используемых в ветеринарии и животноводстве, Федерального государственного учреждения "Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов" (ФГУ "ВГНКИ") под регистрационным наименованием "БИСС №113-ДЕП".
Используемый для изготовления предлагаемой вакцины штамм "БИСС №113" вируса ССЯ-76 птиц характеризуется следующими признаками исвойствами. Морфологические признаки
Штамм "БИСС №113" вируса ССЯ-76 относится к семейству Adenoviridae, роду Aviadenovirus, к 3 серологической группе. При электронно-микроскопическом исследовании штамм "БИСС №113" представлен вирионами экосаэдрической формы, которые лишены суперкапсидной оболочки и не содержат липидов. Диаметр нуклеокапсида 70÷8 нм. Вирус ССЯ-76 птиц имеет 13 структурных полипептидов, 7 из которых соответствуют полипептидам аденовируса птиц типа 1.
Антигенные свойства
По своим антигенным свойствам штамм "БИСС №113" относится к 3 серологической группе птичьих аденовирусов. Вирус стабильно нейтрализуется гомологичной антисывороткой в перекрестной реакции торможения гемагглютинации (РТГА) со специфическими сыворотками штаммов "В 8/78", ВГНКИ №98 "Б-93 " и "БИСС №113" вируса ССЯ-76 и с гетерологичными сыворотками к парамиксовирусу - 1 (ПМВ-1), вызывающему болезнь Ньюкасла, и ортомиксовирусам 5÷7 серотипов. Штамм "БИСС №113" был идентифицирован как вирус, аналогичный эталонному " В 8/78" и известному отечественному ВГНКИ №98 "Б 93" штаммам вируса ССЯ-76, и отнесен к аденовирусам птиц 3 серологической группы.
Через 14÷21 сутки после заражения 120-суточных кур вирусом штамма "БИСС №113" отмечают появление вируснейтрализующих (ВН-) и гемагглютинирующих (ГА-) антител. ГА-титр штамма достигает 18,0÷21,0 лог2. Пробы экстраэмбриональной жидкости (ЭЭЖ) после расплодки штамма на УЭ исследовали в реакции гемагглютинации (РГА). Исследуемые пробы ЭЭЖ имели ГА-активность в разведении 1:32768÷1:262144.
Биотехнологические характеристики
Штамм "БИСС №113" хорошо размножается в 9÷11-суточных УЭ, зараженных в аллантоистную полость. Инфекционная активность штамма через 120 часов при температуре (37±0,5)°С достигает значения 6,75÷0,31 lg ЭИД50/0,2 см3. Штамм хорошо размножается также в гусиных эмбрионах и культуре клеток утиных фибробластов, вызывая цитопатогенное действие (ЦПД). В то же время вирус ССЯ-76 вообще не культивируется в куриных эмбрионах. Штамм является генетически стабильным и сохраняет свои свойства на протяжении 10 пассажей.
Гемагглютинирующие свойства
Штамм "БИСС №113" обладает выраженными ГА-свойствами. Агглютинирует эритроциты кур и уток, вызывая образование среднезернистой РГА с предельным титром 21,0 лог2.
Инфекционные свойства
Вирус ССЯ-76 штамма "БИСС №113" контагиозен для кур, уток и гусей при интраназальном, оральном и внутримышечном заражении. Начиная с 14 суток после введения вируса 120-суточным цыплятам, отмечают появление депигментированных лишенных скорлупы яиц. В течение 4 недель процент яиц с мягкой скорлупой и безскорлупных составляет около 30% и более.
Вирус не вызывает клинических признаков болезни при экспериментальном и естественном заражениях. Патологоанатомические изменения не выражены и определяются только гистологически по изменениям в репродуктивных органах.
Генотаксономическая характеристика
Сердцевина вириона содержит двухцепочечную молекулу ДНК и два внутренних белка. Масса нуклеиновой кислоты достигает 17,3% массы вириона.
Основная масса белков вируса ССЯ-76 птиц сосредоточена в капсидной оболочке вириона. На долю сердцевинных белков приходится до 20% всех протеинов вируса. Сердцевинный белок "1" с молекулярной массой 46×103 г/моль легко отделяется от внутреннего нуклеотида, содержащего ДНК в комплексе с богатым аргинином сердцевинным белком "2".
Гексон, основание пептона и его нить (фибер) вируса ССЯ-76 штамма "БИСС №113" построены из полипептидов с молекулярными массами 120×103, 70×103 и 62×103 г/моль соответственно.
Белковые структуры вируса ССЯ-76 штамма "БИСС №113" формируют несколько антигенов. В составе структурного вирусного антигена у них обнаружены типоспецифические, группоспецифические и подгруппоспецифические антигены. В составе структурного вирусного антигена выявлено три основных компонента, обозначенных А, В и С. Антиген А структурно тесно связан с гексоном, антиген Б - с пептоном, антиген С - с нитями вириона (фибера). Связанный с гексоном компонент А содержит группоспецифический антиген (а) и типоспецифический антиген (Е). Антигенный фактор, связанный с пептоном, назван антигеном β, а с нитью вириона (фибер) - антигеном "у".
С помощью ПЦР и секвенирования амплифицированных участков генома установлено, что аллантоистная жидкость от УЭ, зараженных вирусом ССЯ-76 штамма "БИСС №113", содержала геном вируса ССЯ-76.
Нуклеотидная последовательность амплифицированного консервативного фрагмента гена гексона штамма "БИСС №113" имела полную гомологию с референсными штаммами вируса ССЯ-76.
Физические свойства
Масса вириона составляет 252×103 г/моль. Плавучая плотность 1,32÷1,35 г/см3 в градиенте CsCl. Константа седиментации зрелого вириона составляет 8-10×10-13÷9-10×10-13 c.
Устойчивость к внешним факторам
Вирус ССЯ-76 штамма "БИСС №113" стабилен при рН пределах 6,0÷9,0. Устойчив к жирорастворителям. Инактивируется при 56°С.
Дополнительные признаки и свойства
Антигенная активность - 100%.
Патогенность выражена.
Вирулентность выражена.
Контагиозность выражена.
Онкогенность отсутствует.
Свободен от контаминации бактериальной и грибковой флоры, микоплазмами и ГА-вирусами.
Для получения антигенного материала из штамма "БИСС №113" вируса ССЯ-76 птиц в качестве чувствительной биологической системы культивирования используют 9÷11-суточные УЭ. Полученный вирусосодержащий материал очищают от балластных примесей центрифугированием или любым другим известным методом.
Для инактивации вируса ССЯ-76 птиц исследуют АЭЭИ, который добавляют в очищенную вирусосодержащую суспензию до концентрации (%): 0,2÷0,3. Инактивацию вируса проводят при температуре (37±0,5)°С и рН 7,4÷7,6 в течение 48 часов. По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную суспензию антигена добавляют 1 М раствор тиосульфата натрия из расчета 10% к объему использованного АЭЭИ. Полученный антиген подвергают контролю на антигенную активность, авирулентность, стерильность и рН.
Для изготовления предлагаемой вакцины используют авирулентный очищенный антигенный материал из штамма "БИСС №133" вируса ССЯ-76 птиц, полученного в 9÷11-суточных УЭ с инфекционной активностью не ниже 4,8 lg ЭИД50/см3 и ГА-активностью не ниже 1:8192, в количестве, мас.%: 3,0÷6,0.
Вирусный изолят, послуживший источником для получения производственного штамма "К-58" (авторское наименование) вируса ИББ птиц, выделен из фабрициевых сумок больных бройлеров на птицефабрике "Васильевская" Пензенской области в 1994 году. Вакцинный штамм "К-58" получен путем многократных последовательных пассажей исходного вируса на 9÷11-суточных эмбрионах SPF-кур и SPF-цыплятах.
Штамм "К-58" депонирован во Всероссийскую государственную коллекцию штаммов микроорганизмов, используемых в ветеринарии и животноводстве, Федерального государственного учреждения "Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов" (ФГУ "ВГНКИ") МСХ РФ 1 июня 2004 года под регистрационным номером - штамм "К-58 №122-ДЕП" вируса ИББ птиц.
Штамм "К-58" вируса ИББ птиц характеризуется следующими признаками и свойствами:
Морфологические признаки
Штамм "К-58" вируса ИББ птиц относится к семейству Birnaviridae, роду Avibirnavirus, серотипу 1 и обладает морфологическими признаками, характерными для возбудителя ИББ: форма вириона экосаэдрическая, размер вириона 58÷60 нм. Капсид Т13, оболочка отсутствует.
Антигенные свойства
По своим антигенным свойствам штамм "К-58" вируса ИББ птиц относится к сероварианту 1. Вирус стабильно нейтрализуется гомологичной антисывороткой. Вирус не проявляет ГА-активности. При вакцинации вирус индуцирует образование специфических антител, выявляемых в РДП в разведении 1:4÷1:64, в ИФА - 1:400÷1:10000 и более, при гипериммунизации в РДП до 1:4096 и выше, в ИФА - более 1:10000. При определении антигенного соответствия вакцинного штамма "К-58" с полевыми изолятами вируса ИББ птиц было проведено сравнение вариабельной области гена VP2 37 полевых изолятов, выделенных в 1993-1996 гг. на территории РФ и странах СНГ и 7 образцов коммерческих живых вакцин.
Установлено, что большинство полевых изолятов вируса ИББ птиц, выделенных на птицефабриках России, антигенно отличаются от импортных вакцинных штаммов фирм «Рон-Мерье» (Франция), «Интервет» (Голландия), «Солвей-Дюфар» (США), «Сафит» (Израиль) на 5÷8% и имеют структуру, близкую к вакцинному штамму "К-58".
Биотехнологические характеристики
Штамм "К-58" репродуцируется в 9÷11-суточных эмбрионах SPF-кур при температуре 37,7°С и влажности 55÷64%. В течение 72÷96 часов инкубирования вирус накапливается до уровня 5,5÷7,0 lg ЭИД50/0,2 см3.
Генотаксономическая характеристика
Штамм "К-58" является РНК-содержащим вирусом. РНК имеет молекулярную массу 2,16×106 Da. Нуклеиновая кислота является 2-нитевой, 2-сегментной (А и В). Вирус имеет белковую оболочку, образованную 5 видами белков (VP1, VP2, VP3, VP4 и VP5):
VP1 - РНК-зависимая РНК-полимераза;
VP2, VP3 - структурные белки;
VP4 - протеаза;
VP5 - не идентифицирован.
Липиды отсутствуют.
Штамм "К-58" проявляет генетическую стабильность. Основная масса мутаций сосредоточена в области РНК, кодирующей VP2. Мутации, ведущие к замене аминокислот, определяют антигенную вариабельность VP2.
Штамм "К-58" проявляет высокую степень гомологии (98%) по сравнению с многочисленной группой изолятов (30), выделенных на территории РФ в 1993÷1996 гг.
Физические свойства
Масса вириона составляет 55×106 Да. Коэффициент седиментации 460 S в градиенте сахарозы. Плавучая плотность 1,33÷1,34 г/см3 в градиенте CsCl.
Устойчивость к внешним факторам
Штамм "К-58" устойчив к растворителям (эфиру, хлороформу) и детергентам, чувствителен к формальдегиду, УФ-облучению, у-облучению и высыханию.
Дополнительные признаки и свойства
Иммуногенная активность - 100%.
Реактогенность - отсутствует.
Патогенность - отсутствует.
Вирулентность - отсутствует.
Онкогенность - отсутствует.
Контагиозность - отсутствует.
Стабильность аттенуации отмечена при проведении 5 пассажей на чувствительных цыплятах.
Для получения антигенного материала из штамма "К-58 " вируса ИББ птиц в качестве чувствительной биологической системы культивирования используют 9÷11-суточные эмбрионы SPF-кур. Полученный вирусосодержащий материал очищают от балластных примесей центрифугированием или любым другим известным методом.
Для инактивации вируса ИББ птиц используют АЭЭИ, который добавляют в очищенную вирусосодержащую суспензию до концентрации (%): 0,1÷0,3. Инактивацию вируса проводят при температуре 27°С и рН в пределах 7,8÷8,1 в течение 24 часов. По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную суспензию антигена добавляют 1 М раствор тиосульфата натрия из расчета 10% к объему использованного АЭЭИ. Полученный антиген подвергают контролю на антигенную активность, авирулентность, стерильность и рН.
Для изготовления предлагаемой вакцины используют авирулентный очищенный антигенный материал из штамма "К-58" вируса ИББ птиц, полученного в 9÷11-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 5,5 lg ЭИД50/см3, в количестве 6,0 мас.%.
Вирусный изолят, послуживший источником для получения производственного штамма "БГ " (авторское наименование) вируса ИББ птиц, выделен из фабрициевых сумок больных бройлеров птицефабрики "Уральская " Оренбургской области в 1993 году. Вакцинный штамм "БГ " получен путем многократных последовательных пассажей на 10-суточных эмбрионах SPF-кур.
Штамм "БГ " депонирован во Всероссийскую государственную коллекцию штаммов микроорганизмов, используемых в ветеринарии и животноводстве, Федерального государственного учреждения "Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов" (ФГУ "ВГНКИ") МСХ РФ 21 июня 1996 года под регистрационным наименованием - штамм "БГ" №102 ДЕП вируса ИББ птиц.
Штамм "БГ" вируса ИББ птиц характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм "БГ "вируса ИББ птиц относится к семейству Birnaviridae, роду Avibirnavirus, серотипу 1, обладает морфологическими признаками, характерными для возбудителя ИББ птиц, форма вириона экосаэдрическая, размер вириона составляет 58÷60 нм. Капсид - T13, оболочка отсутствует.
Антигенные свойства
По своим антигенным свойствам штамм "БГ" относится к сероварианту 1. Вирус стабильно нейтрализуется гомологичной антисывороткой. Вирус не проявляет ГА-активности. При вакцинации вирус индуцирует образование специфических антител, выявляемых в РДП в разведении 1:4÷1:64, в ИФА в разведении 1:400÷1:10000 и более, при гипериммунизации в РДП до 1:4096 и выше, в ИФА более 1:10000. При определении антигенного соответствия вакцинного штамма "БГ" с полевыми изолятами вируса ИББ птиц было проведено сравнение вариабельной области VP2 37 полевых изолятов, выделенных в 1993÷1996 гг. на территории РФ и сопредельных стран, и 7 образцов коммерческих живых вакцин. Для этого в ПЦР амплифицировали, используя специфические олигонуклеотидные праймеры и термостабильную Taq - ДНК - полимеразу, вариабельную область гена VP2, кодирующую основной конформационный эпитоп. Методом прямого секвенирования определяли нуклеотидную последовательность этого наиболее важного в проявлении антигенных свойств участка генома полевых изолятов и вакцинного штамма ИББ. Установлено, что большинство полевых изолятов вируса ИББ, выделенных на птицефабриках России, антигенно отличаются от импортных вакцинных штаммов фирм "Рон-Мерье" (Франция), "Интервет" (Голландия), "Солвей Дюфар" (США), "Сафит" (Израиль) на (%): 5÷8 и имеют структуру, близкую к вакцинному штамму "БГ".
Биотехнологические характеристики
Штамм "БГ" предназначен для приготовления живой и инактивированной вакцины и диагностических препаратов. Штамм "БГ" репродуцируется в 10-суточных эмбрионах SPF-кур при 37,7°С и влажности (%): 55÷64. В течение 72÷96 часов инкубирования вирус накапливается от 5,25 до 6,0 lg ЭИД50/0,2 см3.
Генотаксономическая характеристика
Штамм "БГ" является РНК-содержащим вирусом. РНК имеет молекулярную массу 2,16×106 Da. РНК является 2-нитевой, 2-сегментной (А и В).
Вирус имеет белковую оболочку, содержащую 5 видов белков (VP1-VP5). Липиды отсутствуют. Белковая оболочка обнаруживает следующие ферменты:
VP1 - РНК-зависимая РНК-полимераза;
VP2 и VP3 - структурные белки;
VP4 - протеаза;
VP5 - не идентифицирован.
Штамм "БГ" проявляет генетическую стабильность. Основная масса мутаций сосредоточена в VP2. Аминокислотные изменения VP2 определяют антигенную вариабельность.
Сегмент А нуклеиновой кислоты содержит две частично перекрывающие открытые рамки для считывания малого VP5 и большого полипротеинового предшественника белков VP2 и VP3. Сегмент В кодирует VP1.
Физические свойства
Масса вириона составляет 55×106 Дa. Коэффициент седиментации 460S в градиенте сахарозы. Плавучая плотность 1,33÷1,34 г/см3 в градиенте CsCl.
Устойчивость к внешним факторам
Штамм "БГ" устойчив к растворителям (эфиру, хлороформу) и детергентам, чувствителен к формальдегиду, УФ-облучению, у-облучению и высыханию.
Дополнительные признаки и свойства
Иммуногенная активность - 100%.
Реактогенность - отсутствует.
Патогенность - отсутствует.
Онкогенность - отсутствует.
Контагеозность - отсутствует.
Стабильность аттенуации - отмечена при проведении 5 пассажей на чувствительных цыплятах.
Для получения антигенного материала из штамма "БГ" вируса ИББ птиц в качестве чувствительной биологической системы культивирования используют 9÷11-суточные эмбрионы SPF-кур. Полученный вирусосодержащий материал очищают от балластных примесей центрифугированием или любым другим известным методом.
Для инактивации вируса ИББ птиц используют АЭЭИ, который добавляют в очищенную вирусосодержащую суспензию до концентрации 0,1%. Инактивацию вируса проводят при температуре 27°С и рН в пределах 7,8÷8,1 в часов. По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную суспензию антигена добавляют 1 М раствор тиосульфата натрия из расчета 10% к объему использованного АЭЭИ.
Полученный антиген подвергают контролю на антигенную активность, авирулентность, стерильность и рН.
Для изготовления предлагаемой вакцины используют авирулентный очищенный антигенный материал из штамма "БГ" вируса ИББ птиц, полученного в 9÷11-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 5,5 lg ЭИД50/0,2 см3, в количестве 6,0 мас.%.
В случае если инфекционный титр вируса ИББ птиц штамма "БГ" не удовлетворяет технологическим требованиям (5,5 lg ЭИД50/см3), то инактивированный антиген можно сконцентрировать с помощью проточной ультрафильтрации. Для этого можно использовать установку для ультрафильтрации "Сартокон-мини".
Используемый для изготовления предлагаемой вакцины штамм "1133" вируса РВТ птиц относится к семейству Reoviridae, роду Orthoreovirus, депонирован 25.05.1998 г. в коллекцию штаммов микроорганизмов ФГУ "ВГНКИ" под регистрационным номером "1133-ДЕП" и характеризуется следующими признаками и свойствами.
Морфологические признаки
Реовирус не имеет оболочки, обладает икосаэдральной симметрией и двухкапсидной структурой. Вирусные частицы имеют диаметр около 75 нм и плотность в хлориде цезия 1,36÷1,37 г/см3. Вирусный геном состоит из 2-спиральной РНК и имеет фрагментарную структуру. По размеру геном можно разделить на три класса с 10 дискретными молекулярными видами.
Антигенные свойства
Реовирусы птиц обладают группоспецифическим антигеном. Его можно наблюдать в реакции диффузионной преципитации. Специфичность антигена серотипа можно определить в реакции нейтрализации. Нейтрализующие антитела определяются уже спустя 70 дней после инфицирования, а преципитирующие - приблизительно на вторую неделю. Исследованиями in vivo и in vitro была доказана способность реовирусов птиц вырабатывать интерферон.
Биотехнологические характеристики
Реовирусы хорошо растут в эмбрионах SPF-кур после инфицирования через желточный мешок или на хориоаллантоисную оболочку, при этом гибель эмбрионов наступает через 3÷5 или 8 дней соответственно. Вирус способен расти в первичных куриных клеточных культурах легких, почек, печени, макрофагов и семенников эмбриона. Фибробласты куриного эмбриона также являются подходящей средой для роста вируса, но для этого часто приходится проводить адаптацию вируса. Доказано, что реовирус растет в таких клеточных линиях, как Vero, ВНК 21/13, почек кроликов, почек свиней, в клеточной линии японских перепелов и лимфобластоидных клетках кур.
Устойчивость к внешним факторам
Реовирусы не чувствительны к эфиру, слабо чувствительны к хлороформу. Они устойчивы к действию рН 3, перекиси водорода в течение 1 часа при комнатной температуре, 2-х процентному лизолу и 3-процентному формалину. Кроме того, они устойчивы к метаболическим ингибиторам ДНК: актиномицину Д, цитозинарабиноозиду и 5-фтор-2дезоксиридину. Реовирусы устойчивы к нагреванию и способны находиться при температуре 60°С в течение 8÷10 часов. Инактивируются 70% этанолом, 0,5% органическим йодом и 5%-раствором перекиси водорода.
Дополнительные признаки и свойства
Обладает антигенной активностью в составе инактивированной вакцины.
Патогенность - выражена.
Вирулентность - выражена.
Контагиозность - выражена.
Онкогенность - отсутствует.
Штамм "1133" реовируса свободен от контаминации бактериями, микоплазмами и другими гемагглютинирующими вирусами.
Для получения антигенного материала из штамма "1133" вируса РВТ в качестве чувствительной системы культивирования используют преимущественно первичную культуру клеток ФЭК. Полученный вирусосодержащий материал очищают от балластных примесей центрифугированием или любым другим известным методом.
Для инактивации вируса РВТ птиц используют АЭЭИ, который добавляют в очищенную вирусосодержащую суспензию до концентрации 0,1%. Инактивацию вируса проводят при температуре (37±0,5)°С и рН 7,4÷7,6 в течение 24 часов. По окончании инактивации АЭЭИ нейтрализуют внесением в антигенный материал тиосульфата натрия. Для этого в охлажденную суспензию антигена добавляют 2 М раствор тиосульфата натрия из расчета 10% к объему использованного АЭЭИ. Полученный антиген подвергают контролю на антигенную активность, авирулентность, стерильность и рН.
Для изготовления предлагаемой вакцины используют авирулентный очищенный антигенный материал из штамма "1133" вируса РВТ птиц, полученного в культуре клеток ФЭК с инфекционной активностью до инактивации не ниже 7,0 lg ТЦД50/см3, в количестве не ниже 6,0 мас.%.
Для изготовления предлагаемой вакцины полученные антигенные материалы из штамма "Ла Сота" вируса НБ птиц, из штамма "Н-52" вируса ИБК, из штамма "БИСС №-113" вируса ССЯ-76, из штамма "К-58" или из штамма "БГ" вируса ИББ и из штамма "1133" вируса РВТ смешивают в объемном соотношении 0,5:2,0:0,5:1,0:1,0 соответственно и смесь тщательно эмульгируют с масляным адъювантом в весовом соотношении, мас.%: 30,0:70,0 соответственно. При этом для получения антигенной фазы препарата используют два метода ее составления:
1) смешивание неодинаковых весовых объемов полученных антигенных материалов в соотношении, мас.%:
2) смешивание одинаковых весовых объемов антигенных материалов (в случае использования концентрированных антигенов) в соотношении, мас.%:
Из масляных адъювантов целесообразно использовать масляный адъювант марки Montanide ISA-70 VG производства фирмы "SEPPIC" (Франция, стандарт ИСО 9001).
Содержание антигенов в предлагаемой вакцине в указанном выше соотношении является их эффективным количеством в препарате, обеспечивающим достижение технического результата.
Использование предлагаемого изобретения расширяет арсенал высокоиммуногенных безвредных и ареактогенных эмульсионных инактивированных ассоциированных вакцин против НБ, ИБК, ССЯ-76, ИББ и РВТ, способных защищать взрослое поголовье птиц от заражения возбудителями НБ, ИБК, ССЯ-76, а также индуцировать высокий уровень материнских антител у молодняка птиц и соответственно защитить его от заражения вирусами НБ, ИБК, ИББ и РВТ в первые дни жизни.
Сущность предлагаемого изобретения пояснена примерами его исполнения и использования.
Пример 1
Получение антигенного материала из штамма "Ла Сота" вируса НБ птиц
Для получения производственной расплодки вируса НБ птиц используют вирус производственного штамма "Ла Сота", репродуцированный 9÷12-суточных эмбрионах SPF-кур с титром инфекционной и ГА-активности не ниже 8,0 lg ЭИД50/см3 и 1:1024 соответственно и хранившийся при температуре не выше минус 40°С в течение не более 90 суток. Посевной вирус размораживают при температуре (+18°С)-(+24°С) и центрифугируют при 2500 об/мин в течение 10 минут. Надосадочную жидкость отбирают, разводят стерильным физиологическим раствором рН 7,2 из расчета 100000÷200000 ЭИД50/см3 (1:10000).
Приготовленный таким образом вирусосодержащий материал используют для заражения 9÷10-суточных эмбрионов SPF-кур. Вирусосодержащий материал вносят в аллантоисную полость в объеме 0,2 см3. Зараженные куриные эмбрионы инкубируют 72÷96 часов при температуре (+36°С)-(+37°С) и относительной влажности (%): 60±70. Овоскопию зараженных эмбрионов проводят ежедневно в течение 96 часов инкубации. По окончании инкубации эмбрионы помещают в холодильную камеру при температуре (+2°С)-(+6°С) на 16÷18 часов для того, чтобы при вскрытии исключить попадание эритроцитов в алантоисно-эмбриональную жидкость. Перед вскрытием эмбрионы выдерживают 2÷3 часа при комнатной температуре до испарения конденсата (влаги) на скорлупе. После охлаждения куриные эмбрионы вскрывают, соблюдая правила асептики. ЭЭЖ от каждых 20÷30 эмбрионов собирают в стерильные флаконы вместимостью 200÷500 см 3. Затем ЭЭЖ центрифугируют при 1000 об/мин в течение 10÷15 минут для удаления эритроцитов. После центрифугирования вирусный материал сливают в 15÷20-литровые бутыли. Из каждой бутыли берут пробу в количестве 1,0 см3 для определения титра гемагглютинина и биологической активности вируса НБ. Инфекционная активность вирусосодержащего материала, идущего на составление предлагаемой вакцины, должна быть не ниже 9,0 lg ЭИД50/см3, а ГА-активность не ниже 1:521.
Полученный вирусный материал подвергают инактивации рабочим раствором АЭЭИ. Для этого предварительно вирусную суспензию нагревают в реакторе до температуры (37,0±0,5)°С, а затем в нее добавляют 10%-ный раствор АЭЭИ (рабочий раствор) до конечной концентрации (%): 0,05-0,1. После добавления инактиванта смесь перемешивают в течение 20÷30 минут и перекачивают в стерильный реактор.
Инактивацию вируса НБ проводят в течение 24 часов при температуре (37±0,5)°С и периодическом перемешивании суспензии. По окончании инактивации полученный антигенный материал охлаждают до (+4°С)-(+8°С) и хранят не более 60 суток. Из реактора отбирают пробу в количестве 200 см3 для определения титра вирусного антигена в РГА, контроля авирулентности, стерильности и рН.
Используемый для изготовления предлагаемой вакцины антиген вируса НБ должен быть стерильным и авирулентиным, иметь титр ГА-активности не ниже 1:512 и рН в пределах 7,0÷7,6. Антигенный материал вируса НБ птиц, входящий в состав предлагаемой вакцины, считают полностью авирулентным, если:
- отсутствует гибель куриных эмбрионов в течение 2-х последовательных пассажей;
- капельная РГА с ЭЭЖ, полученной от куриных эмбрионов после 2-х последовательных пассажей, отрицательная.
Полученный антигенный материал используют в количестве, мас.%: от 3,0 до 6,0 для изготовления эмульсионной формы предлагаемой вакцины.
Пример 2
Получение антигенного материала из штамма "Н-52" вируса ИБК
Для получения производственной расплодки вируса ИБК используют вирус производственного штамма "Н-52", репродуцированный в 10÷11-суточных эмбрионах SPF-кур с титром инфекционной активности не ниже 4,0 lg ЭИД50/см3 и хранившийся при температуре не выше минус 30°С в течение не более 4-6 месяцев. Посевной вирус размораживают при температуре (+18°С)-(+24°С) и центрифугируют при 2500 об/мин в течение 10 минут. Надосадочную жидкость отбирают, разводят физиологическим раствором рН 7,0÷7,4 из расчета 1000÷10000 ЭИД50/см3. Приготовленный таким образом вирусосодержащий материал используют для заражения 10÷11-суточных эмбрионов SPF-кур.
Вирусосодержащий материал вносят в аллантоисную полость в объеме 0,2 см3. Зараженные куриные эмбрионы инкубируют 48 часов при температуре (36±0,5)°С и относительной влажности воздуха (%): 60÷70. Овоскопию зараженных эмбрионов проводят ежедневно в течение 72 часов инкубации. По окончании инкубации эмбрионы помещают в холодильную камеру при температуре (+4°С)÷(+8°С) на 12-24 часа. Затем производят сбор вирусосодержащего материала. По мере накопления вирусосодержащую жидкость подвергают очистке путем центрифугирования. Центрифугирование проводят в течение 10÷15 минут при 1000 об/мин и температуре (+2°С)÷(+6°С). При этом аллантоисную жидкость освобождают от осколков скорлупы, клеток и эритроцитов. Очищенную вирусосодержащую суспензию сливают в стеклянные 20 дм3 стерильные бутыли. Из каждой бутыли берут пробу в количестве 1,0 см3 для определения инфекционной активности вируса ИБК. Инфекционная активность вирусосодержащего материала, идущего на составление предлагаемой вакцины, должна быть не ниже 7,5 lg ЭИД50/см3.
Инактивацию вируса ИБК проводят рабочим раствором АЭЭИ. Для этого при перемешивании в суспензию добавляют 10%-ный раствор АЭЭИ до конечной концентрации (%): 0,3÷0,5. В процессе инактивации суспензию перемешивают каждые 2÷4 часа в течение 5÷10 минут.Инактивацию вируса ИБК проводят в течение 36 часов при температуре (25±0,5)°С и периодическом перемешивании суспензии. По окончании инактивации полученный антигенный материал охлаждают до (+4°С)÷(+8°С) и хранят не более 30 суток. Из каждой бутыли отбирают пробу в количестве 20 см3 для определения титра полученного антигена в ИФА, контроля авирулентности, стерильности и рН.
Используемый для изготовления предлагаемой вакцины антиген вируса ИБК должен быть стерильным и авирулентным, иметь титр ГА-активности не ниже 1:8192 и рН в пределах 7,4÷7,6.
Антигенный материал вируса ИБК, входящий в состав предлагаемой вакцины, считают полностью авирулентым, если отсутствует гибель эмбрионов и не отмечаются специфические изменения, характерные для ИБК. Полученный антигенный материал используют в количестве от 6,0 до 12,0 мас.% при изготовлении эмульсионной формы предлагаемой вакцины.
В случае если инфекционный титр вируса ИБК не удовлетворяет техническим требованиям (7,5 lg ЭИД50/см3), инактивированный антиген вируса можно сконцентрировать с помощью проточной ультрафильтрации. Для этого можно использовать установку для ультрафильтрации "Сартакон-мини".
Степень концентрации антигена определяют визуально по формуле:
Kv=V1/V1-V2, где:
V1 - исходный объем вирусной суспензии, л;
V2 - объем образовавшегося фильтрата, л.
Для определения необходимой кратности концентрирования используют формулу:
Кк = Антилог Ктр/Антилог Кфакт,
где:
Кк - кратность концентрирования;
Антилог Ктр - антилогарифм требуемой концентрации антигена;
Антилог Кфакт - антилогарифм фактической концентрации антигена.
Пример 3
Получение антигенного материала из штамма "К-58" или штамма "БГ" вируса ИББ птиц
На первом этапе готовят матровый материал из штамма "К-58" или штамма "БГ" вируса ИББ птиц. В качестве системы культивирования используют 9÷11-суточные эмбрионы SPF-кур. На границе подскорлупной оболочки и хориоаллантоисной оболочки (ХАО) делают насечку, не повреждая ХАО, и затем с помощью шприца вводят вирусосодержащий материал в количестве 0,2 см3 на ХАО. Инфицированные эмбрионы инкубируют при температуре 37,5°С в течение 48÷120 часов. Павшие эмбрионы разделывают, замораживают при температуре 4°С в течение 45 минут, дважды промораживают-оттаивают, добавляют фосфатный буфер рН 7,5, центрифугируют в течение 10 минут при 2500 об/мин. Полученную вирусосодержащую жидкость с инфекционной активностью 5,5÷7,0 lg ЭИД50/0,2 см3 используют в качестве матровой расплодки. Полученный вирус используют для массового заражения 9÷11-суточных эмбрионов SPF-кур. Вирусный материал в количестве 0,2 см3 вносят на ХАО и инкубируют при температуре 37,5°С в течение 48÷120 часов. Павшие эмбрионы разделывают, замораживают при температуре минус 40°С и полученное сырье используют для изготовления вакцины. Вирусосодержащий материал размораживают, измельчают на коллоидной мельнице, экстрагируют в течение 45 минут при температуре 4°С, дважды промораживают-оттаивают, добавляют фосфатный буфер рН 7,5 и подвергают очистке от балластных примесей. Для этого в вирусосодержащую суспензию вносят 1% фреона 113 и 0,5% хлороформа и при постоянной работе мешалки смесь гомогенизируют в течение 30 минут. Затем вирусную суспензию подают со скоростью 300 л/час на сепаратор "Альфа-Лаваль", который вращается со скоростью 1500 об/ мин. Через каждые 25÷30 минут работы проводят сброс из сепаратора, затем сепаратор вновь выводят в рабочий режим и доводят сепарацию до конца. Такой режим очистки обеспечивает получение прозрачной суспензии вируса ИББ птиц. Очищенную суспензию подают в стерильный реактор для инактивации вируса. Из инактивантов используют АЭЭИ в виде 10% водного раствора, рН 7,9÷8,1. В подогретую до 27°С вирусосодержащую суспензию вносят 10%-ный водный раствор АЭЭИ до конечной концентрации 0,1%. Смесь тщательно перемешивают и выдерживают при 27°С в течение 24 часов. По окончании инактивации антигенный материал охлаждают до (+2°С)÷(+8°С).
Антигенный материал вируса ИББ птиц, входящий в состав предлагаемой вакцины, считают авирулентным, если в течение 216 часов инкубации в каждом из трех пассажей не будет специфической гибели эмбрионов с характерными изменениями (отечность головы, кровоизлияние, изменение печени).
Полученный антигенный материал используют в количестве, мас.%: не менее 6,0 при изготовлении эмульсионной формы предлагаемой вакцины.
Пример 4
Получение антигенного материала из штамма "БИСС №113" вируса ССЯ-76 птиц
Для изготовления предлагаемой вакцины используют производственный штамм "БИСС №113" вируса ССЯ-76, полученный из ФГУ "ВГНКИ". Указанный штамм используют для получения матровой расплодки. Для этого три ампулы лиофилизованного вируса растворяют в 30 см3 стерильного 0,9% раствора хлорида натрия. Приготовленным вирусом заражают 150 УЭ 9÷11-суточного возраста путем его введения в дозе 0,2 см3 в аллантоисную полость. Зараженные эмбрионы инкубируют при температуре (37,4±0,5)°С и относительной влажности (%): 60÷70 в течение 96÷120 часов. Каждые 24 часа эмбрионы овоскопируют. Через 96÷120 часов после заражения и инкубации эмбрионы используют для получения вируса. Перед вскрытием эмбрионы охлаждают при (+4°С)÷(+8°С) в течение 12÷24 часов. После этого из них через прокол в хориоаллантоисной оболочке стерильной пипеткой отбирают вирусосодержащую жидкость. Собранную жидкость центрифугируют при 1000 об/мин в течение 15 минут и сливают по 50÷100 см3 в стерильные флаконы емкостью по 100÷200 см3. В стерильных условиях из каждого флакона отбирают по 3÷5 см3 жидкости для контроля стерильности и ГА-активности. Полученная матровая расплодка должна быть стерильной и иметь ГА-активность не ниже 1:4096. Матровую расплодку вируса ССЯ-76 хранят в замороженном виде при температуре не выше минус 40°С в течение 90 суток.
Для получения производственной расплодки вируса ССЯ-76 птиц используют партию УЭ в количестве, обеспечивающем изготовление планируемого объема серии вакцины. Для заражения эмбрионов используют матровую расплодку вируса, которую предварительно размораживают в водяной бане при температуре (+18°С)÷(20°С), очищают хлороформом и центрифугируют при 2500 об/мин в течение 20 минут. Надосадочную жидкость отбирают в стерильные флаконы. Активность вируса определяют в РГА и производят корректировку объема путем разведения вирусной суспензии 0,9% раствором натрия хлорида до активности 1:2048÷1:4096 ГАЕ/0,2 см3. Подготовленный таким образом матровый вирус используют для получения производственной партии вируса ССЯ -76 птиц.
Полученным вирусом заражают партию УЭ в количестве, обеспечивающем изготовление планируемого объема серии вакцины. Зараженные эмбрионы инкубируют при температуре (37,4±0,5)°С и относительной влажности (%): 60÷70 в течение 96÷120 часов. Через 96÷120 часов после заражения эмбрионы охлаждают при (+4°С)÷(+8°С) в течение 12÷24 часов, производят вскрытие зараженных эмбрионов и сбор вирусосодержащего материала. Полученный вирусосодержащий материал подвергают первичной очистке путем центрифугирования. Центрифугирование проводят в течение 7÷10 минут при 1000 об/мин и температуре (+2°С)÷(+6°С). При этом аллантоисную жидкость освобождают от осколков скорлупы, клеток и эритроцитов. Очищенную вирусосодержащую суспензию ЭЭЖ сливают в 20-литровые стерильные бутыли. Полученную ЭЭЖ подвергают инактивации АЭЭИ. Для этого вирусосодержашую ЭЭЖ нагревают в водяной бане до температуры (37,0±0,5)°С и рН 7,4÷7,8. При перемешивании в суспензию добавляют 10%-ный раствор АЭЭИ до конечной концентрации 0,2÷0,4%. Инактивацию ведут в течение 48 часов после добавления инактиванта при температуре (37,0±0,5)°С с периодическим перемешиванием. По окончании инактивации бутыли с полученным антигеном охлаждают при (4°С)÷(8°С) в течение 2 суток, периодически перемешивая суспензию. Затем из каждой бутыли отбирают пробу в количестве 20 см3 для определения титра РГА, контроля авирулентности, стерильности и рН. Антиген должен быть стерильным, иметь титр ГА-активности не ниже 1:8192 и рН в пределах 7,4÷7,8. Антигенный материал вируса ССЯ-76 птиц, входящий в состав предлагаемой вакцины, считают полностью авирулентным, если материал третьего пассажа не вызывает гемагглютинацию эритроцитов петуха. Антиген хранят при температуре (4°С)÷(8°С).
Полученный антигенный материал используют в количестве, мас.%: от 3,0 до 6,0 при изготовлении эмульсионной формы предлагаемой вакцины.
Пример 5
Получение антигенного материала из штамма "1133" вируса РВТ птиц
Для получения производственной расплодки вируса РВТ птиц используют матровый вирус производственного штамма "1133", репродуцированный в монослойной культуре клеток ФЭК с титром инфекционной активности не ниже 7,0÷7,5 lg ТЦД50/см3. В качестве системы культивирования вируса используют выращенную в роллерных сосудах культуру клеток ФЭК с плотным монослоем 2-3-суточного возраста. Для изготовления 1,5 млн доз предлагаемой вакцины необходимо получить 150 см3 вирусосодержащей суспензии. Для этого берут 1250 эмбрионов SPF-кур, из них готовят первично-трипсинизированную культуру клеток ФЭК в 550 роллерных сосудах емкостью 3 литра. Роллерные сосуды с плотным выросшим монослоем клеток ополаскивают раствором Хенкса и вносят по 10 см3 разведенного реовируса 0,1 ТЦД50/кл. Роллерные сосуды с инфицированной культурой помещают в роллерный аппарат стеллажного типа с вращением кассет 10÷12 об/час при температуре (37±1)°С на 1 час для контакта вируса с клетками. После этого в роллерные сосуды заливают поддерживающую среду ПСП рН 7,3÷7,4 с 2% инактивированной сывороткой КРС в объеме 300 см3. Срок культивирования вируса РВТ птиц от 2 до 3 суток. Для контроля культуры клеток оставляют незараженными 2 сосуда со сменой ростовой средой на поддерживающую в одинаковых условиях с инфицированными. Через 48 часов инфицированную культуру просматривают под микроскопом. Отбирают сосуды, в которых отмечают ЦПД с поражением 80÷90% клеточного монослоя, визуально просматривают на предмет контаминации бактериальной микрофлорой и грибками и замораживают при температуре минус 40°С. После однократного промораживания вирусосодержащую суспензию в роллерных сосудах оттаивают при комнатной температуре, встряхивая клетки с поверхности стекла сосудов. Оттаявшую суспензию сливают в 5-литровые бутыли и из каждой берут пробы высевов на стерильность и биологическую активность. До получения результатов контроля вирусосодержащий материал хранят при температуре 4°С не более 15 суток. После сбора вирусосодержащую суспензию подвергают первичной очистке путем центрифугирования. Центрифугирование проводят в течение 10÷15 минут при 1000 об/мин и температуре (2°С)÷(6°С). При этом ЭЭЖ освобождают от осколков скорлупы, клеток и эритроцитов. Очищенную вирусосодержащую суспензию сливают в стеклянные 20-литровые стерильные бутыли.
При активности реовируса не ниже 7,3 lg ТЦД50/см3 стерильный вирусосодержащий материал используют для инактивации.
Инактивацию вируса РВТ птиц проводят 10%-ным водным раствором АЭЭИ. В предварительно нагретую до 37°С суспензию вируса добавляют раствор АЭЭИ до конечной концентрации (%) 0,1. Инактивацию вируса проводят в течение 24 часов при рН 7,4÷7,6 и температуре (37±0,5)°С с периодическим перемешиванием суспензии. По окончании инактивации суспензию охлаждают до температуры (4°С)÷(8°С) и проводят нейтрализацию остаточного количества АЭЭИ путем добавления 2 М раствора тиосульфата натрия до конечной концентрации 0,01 М. Затем отбирают пробы для определения стерильности и полноты инактивации. Полученный антиген должен быть стерильным и авирулентным. Антигенный материал вируса РВТ птиц, входящий в состав предлагаемой вакцины, считают полностью авирулентным, если материал не проявляет ЦПД в третьем пассаже культуры клеток ФЭК. Полученный антиген хранят при температуре 4°С не более 30 суток.
Полученный антигенный материал используют в количестве не менее 6,0 мас.% при изготовлении эмульсионной формы предлагаемой вакцины.
Пример 6
Приготовление предлагаемой вакцины
На первом этапе определяли количественные показатели специфических антигенов в составе предлагаемой вакцины. Благодаря исследованию взаимосвязей показателей ее иммунологического действия выявляли наиболее важные технологические величины. Определяли показатели необходимой концентрации инактивированных вирусов НБ, ИБК, ССЯ-76, ИББ и РВТ в составе предлагаемой вакцины, что в свою очередь позволило установить критерии для величин инфекционных титров этих вирусов в производственных расплодках (ПР) до инактивации. Основные расчетные показатели представлены в таблице 1. Установлено, что для индукции у привитого поголовья минимального защитного уровня антител концентрация антигена вируса НБ птиц в 1 см3 предлагаемой вакцины должна иметь величину 7,54; ИБК - 6,17; ССЯ-76 - 3,32; ИББ - 5,43 lg ЭИД50 и вируса РВТ птиц - 7,32 lg ТЦД50.
В дальнейшем на основании расчетных показателей определяли оптимальный антигенный компонентный состав предлагаемой вакцины. Для этого сопоставляли расчетные количественные величины для вирусов, используемых в составе ассоциированной вакцины с фактическими величинами ПР соответствующих вирусов. Установлено, что инфекционная активность ПР вирусов НБ, ССЯ-76, ИББ и РВТ превышает расчетные минимальные титры для изготовления поливалентной вакцины, а инфекционная активность вируса ИБК, наоборот, ниже. Поэтому при компоновке пятивалентной вакцины увеличивали объем антигена ИБК, как минимум, в 1,6 раза за счет объема антигенов НБ и ССЯ-76, которые имеют более чем 10- и 100-кратный запас концентрации по инфекционной активности. Схема компоновки антигенной фазы предлагаемой пятивалентной инактивированной вакцины представлена в таблице 2. При этом для получения антигенной фазы препарата использовали два метода ее составления:
1) смешивание неодинаковых весовых объемов полученных антигенных материалов в соотношении, мас.%:
2) смешивание одинаковых весовых объемов антигенных материалов (в случае использования концентированных антигенов) в соотношении, мас.%:
После контроля на стерильность и полноту инактивации полученные антигенные материалы из вирусов НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц объединяли в объемном соотношении 0,5:2,0:0,5:1,0:1,0 соответственно в стерильном реакторе при температуре (4°С)÷(8°С), перемешивали в течение 20÷30 минут с помощью пропеллерной мешалки. Реактор со смесью антигенов через систему трубопроводов подключали к проточной центрифуге ОТР-102 К-01. Центрифугу разгоняли до 15000÷17000 об/мин и в нее подавали антигенную смесь. После прохождения центрифуги очищенная суспензия поступала в стерильную промежуточную емкость, а из нее - на фильтровальную установку с элементами ЭПРС, где смесь антигенов дополнительно очищалась от белковых компонентов. После фильтрования очищенная антигенная смесь поступала в стерильный реактор - накопитель с температурой во внутренней полости (4°С)÷(8°С).
Полученный антигенный материал тщательно эмульгировали с масляным адъювантом в соотношении, мас.%: 30,0÷70,0 соответственно. В качестве целевой добавки использовали масляный адъювант марки Montanide ISA-70 VG производства фирмы "Seppic" (Франция, стандарт ИСО 9001).
Изготовление предлагаемой вакцины проводили в 2 стадии. На стадии получения предэмульсии в реактор со стерильным масляным адъювантом при включенной пропеллерной мешалке (250÷300 об/мин) подавали необходимый объем смеси приготовленных инактивированных антигенов со скоростью 100÷120 литров в час. После подачи антигена в адъювант смесь продолжали перемешивать с той же скоростью в течение 60÷90 минут при температуре в пределах (12°С)÷(16°С).
На стадии получения эмульсии включали гомогенизатор "Silverson - 450 LS" и проводили эмульгирование смеси в течение 3 часов. Пропеллерная мешалка при этом выключалась. Процесс эмульгирования проводили при температуре (12°С)÷(16°С). После окончания эмульгирования из реактора отбирали пробу вакцины, выдерживали ее при температуре (2°С)÷(8°С) в течение 1 суток и проводили контроль препарата на стерильность, безвредность и ареактогенность, антигенную активность, а также физических параметров эмульсии: тип эмульсии, вязкость и стабильность.
Предлагаемая вакцина имеет оптимальный компонентный состав, мас.%:
Содержание антигенных материалов в предлагаемой вакцине в указанных выше пределах является их эффективным количеством в препарате, обеспечивающим достижение технического результата от использования изобретения.
Полученная вакцина представляет собой однородную эмульсию белого, розового или кремового цвета. Допускается отслоение в верхней части флакона слоя масла. При интенсивном встряхивании однородность содержимого легко восстанавливается.
Стерильность вакцины определяли в соответствии с ГОСТ 28085-89 "Препараты биологические. Методы биологического контроля стерильности". Сущность метода заключается в определении отсутствия роста бактериальной и грибковой микрофлоры в посевах из образцов вакцины на питательные среды.
Для проверки безвредности вакцину в объеме 1,0 см3 вводили 10 цыплятам подкожно в область средней трети шеи или внутримышечно в грудную мышцу. Вакцину считали безвредной, если все цыплята в течение 21 суток оставались живыми, без клинических признаков переболевания. При вскрытии птицы на месте введения вакцины не должно быть выраженной воспалительной реакции.
Антигенную активность полученного перпарата определяли следующим образом. Прежде всего формировали опытную и контрольную группы цыплят по 10 голов в каждой. Цыплятам опытной группы вводили вакцину в объеме 0,5 см3 однократно подкожно в область средней трети шеи или внутримышечно в область груди. 10 интактных цыплят оставляли в качестве контроля. Сыворотки крови получали от всех цыплят опытной и контрольной групп до вакцинации и через 21 сутки после прививки для выявления специфических антител.
Оценку антигенной активности предлагаемой вакцины по антигенному компоненту "НБ" птиц проводили в РТГА согласно "Методическим указаниям по определению уровня антител к вирусу "НБ" птиц в реакции торможения гемагглютинации (РТГА)" или методом ИФА согласно наставлению по применению соответствующего набора. Использовали индивидуальные сыворотки, полученные от цыплят контрольной и опытной групп до и после вакцинации.
Оценку антигенной активности предлагаемой вакцины по антигенному компоненту "ИБК" проводили в ИФА согласно "Методическим указаниям по определению уровня антител к вирусу ИБК в ИФА". Исследовали индивидуальные сыворотки, полученные от цыплят контрольной и антигенной групп до и после вакцинации.
Оценку антигенной активности предлагаемой вакцины по антигенному компоненту "ИББ птиц" проводили в ИФА согласно "Методическим указаниям по определению уровня антител к вирусу ИББ в ИФА". Исследовали индивидуальные сыворотки, полученные от цыплят контрольной и опытной групп до и после вакцинации.
Оценку антигенной активности предлагаемой вакцины по антигенному компоненту "реовирус" проводили в ИФА согласно "Методическим указаниям по определению уровня антител к реовирусу в ИФА". Исследовали индивидуальные сыворотки, полученные от цыплят контрольной и опытной групп до и после вакцинации.
Предлагаемую вакцину считали антигенно-активной, если через 21 сутки после вакцинации не менее чем у 80% привитых цыплят титр антител составлял:
- к вирусу НБ птиц не ниже 5,0 log2 в РТГА;
- к вирусу ССЯ-76 птиц не ниже 5,0 log2 в РТГА;
- к вирусу ИБК не ниже двух минимальных положительных значений в ИФА;
- к вирусу ИББ птиц не ниже двух минимальных положительных значений в ИФА;
- к реовирусу не ниже двух минимальных положительных значений в ИФА.
Стабильность эмульсии определяли методами центрифугирования образца вакцины, "быстрого старения" образца вакцины и определения гранулометрического состава препарата. Кинематическую вязкость вакцины определяли на вискозиметре ВПЖ-2 и выражали в мм2/сек. Полученная вакцина, содержащая в своем составе масляный адъювант марки Montanide ISA-70 VG, образующий тип эмульсии "вода-масло", имела относительную вязкость, не превышающую 200 мм2/сек.
При положительных результатах контроля полученную вакцину фасовали в стерильные флаконы объемом 200 см3 (200 доз) или 250 см3 (250 доз).
Вакцина ассоциированная против НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц инактивированная эмульсионная предназначена для профилактики указанных заболеваний в неблагополучных и угрожаемых по данным заболеваниям хозяйствах различного направления выращивания птицы. Вакцинации подлежит клинически здоровая птица в возрасте 90÷120 суток, но не позднее, чем за 1 месяц до начала яйцекладки. Перед применением вакцину выдерживают в помещении 6-9 часов при температуре (20°С)÷(25°С). Вакцину вводят однократно подкожно в среднюю треть шеи или внутримышечно в область грудной мышцы в дозе 1,0 см3.
Через 28 суток после иммунизации птиц проводят контроль напряженности иммунитета к вирусам НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц, исследуя не менее 25 проб сывороток крови в РТГА и/или в ИФА.
Вакцинация считается успешной, если не менее чем у 80% привитых птиц уровень антител составляет:
- к вирусам НБ и ССЯ-76 птиц не ниже 5,0 log2 в РТГА или не ниже двух минимальных положительных значений в ИФА с соответствующими тест-системами, зарегистрированными в РФ;
- к вирусу ИБК, ИББ и РВТ птиц не ниже двух минимальных положительных значений в ИФА с соответствующими тест-системами, зарегистрированными в РФ.
Предлагаемая вакцина индуцирует у привитых птиц иммунный ответ к возбудителям НБ, ИБК, ИББ, ССЯ-76 и РВТ через 28 суток после применения, который сохраняется в течение 12 месяцев и трансовариально передается потомству.
Пример 7
Проведены испытания эффективности вакцины ассоциированной против НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц инактивированной эмульсионной, изготовленной так, как описано в примере 6, и содержащей, мас.%:
Испытание иммуногенной активности полученного препарата провели на 20 цыплятах в возрасте 70 суток, десять цыплят иммунизировали внутримышечно в прививном объеме 1,0 см3, а 10 цыплят оставили не вакцинированными в качестве контрольной группы. Отбор крови для получения сывороток осуществляли до вакцинации, через 14, 28 и 60 суток после ее проведения. Сыворотки крови исследовали методом РТГА на наличие антител к вирусам НБ и ССЯ-76 и методом ИФА на наличие антител к вирусам ИБК, ИББ и РВТ. Результаты исследований титров антител по каждому антигенному компоненту вакцины приведены в таблице 3.
Данные таблицы 3 свидетельствует о том, что титры антител против НБ, ИБК, ССЯ-76, ИББ и РВТ у птиц через 28 суток значительно увеличивались по сравнению с исходными показателями и в несколько раз превышали требуемые минимальные титры ко всем антигенным компонентам вакцины, и сохранялись на высоком уровне к 60 суткам наблюдений. Титры антител ко всем антигенным компонентам в контрольной группе оставались на примерно одном уровне в течение всего срока наблюдений (60 суток).
Результаты изучения динамики образования поствакцинальных антител на каждый антигенный компонент ассоциированной вакцины в графическом виде представлены на фиг.1-5.
Данные, приведенные на фиг.1, свидетельствуют о том, что полученная вакцина обладает высокой антигенной активностью и вызывает у птиц формирование высоких титров антител к вирусу НБ птиц, причем прирост титров антител был постоянным в течение всего срока наблюдений и достигал максимального значения 16,7±0,3 log2 через 60 суток после прививки.
Данные, представленные на фиг.2, свидетельствуют о том, что ассоциированная вакцина индуцирует у привитых цыплят образование высоких уровней антител к вирусу ИБК. Максимальный уровень титров антител наблюдали у птиц через 28 суток после вакцинации и составлял 9552±567.
Данные, приведенные на фиг.3, свидетельствуют о том, что полученный препарат обладает высокой антигенной активностью по антигенному компоненту ССЯ-76 и вызывает у птиц формирование титра антител на уровне 12,3±0,6 log2 через 28 суток после вакцинации.
Данные, приведенные на фиг.4, свидетельствуют о том, что испытуемая вакцина способствовала формированию у птиц высоких титров антител к вирусу ИББ с достижением максимальных значений (5177±390) через 28 суток после вакцинации.
Данные, приведенные на фиг.5, свидетельствуют о том, что испытуемая вакцина продемонстрировала высокую антигенную активность. У привитых птиц регистрировали равномерный прирост титров антител к вирусу РВТ в течение всего срока наблюдения, которые достигали максимального значения 5329±507 через 60 суток после прививки.
Предложенная вакцина вызывает формирование титров антител, которые значительно, более чем в 2 раза, превышали минимальные защитные титры, которые выражают протективную реакцию от соответствующих инфекций.
Через 60 суток после вакцинации во всех группах после диагностического убоя производили осмотр места введения вакцины, результатом которого явилось отсутствие в них остатков эмульсии, воспалительных изменений или участков некроза.
Таким образом, вакцина ассоциированная против НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц инактивированная эмульсионная обладает высокой иммуногенной и антигенной активностью в отношении всех 5 антигенных компонентов и безвредна для птиц.
Пример 8
Проведена проверка безвредности, реактогенности и иммуногенной активности вакцины ассоциированной против НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц инактивированной эмульсионной, изготовленной так, как описано в примере 6, и содержащей, мас.%:
Проверку препарата на безвредность и реактогенность проводили на цыплятах кросса "Хайсекс-браун" в возрасте 70 суток. При однократном введении вакцины в дозе 1 см3 птицы оставались живыми и клинически здоровыми на протяжении 21 сут наблюдения. После убоя птиц в местах введения вакцины не было обнаружено признаков воспаления, участков некроза или следов нерассосавшейся вакцинной эмульсии.
Оценку иммуногенной активности препарата проводили на цыплятах кросса "Хайсекс-браун" в возрасте 70 суток. Вакцину вводили внутримышечно в грудные мышцы в прививном объеме 1,0 см3 цыплятам в количестве 10 голов, а еще 10 голов оставили не вакцинированными в качестве контроля. Для получения сывороток у подопытной и контрольной групп птиц отбирали кровь до вакцинации, через 14, 28 и 60 суток и исследовали на наличие титров антител к вирусам НБ и ССЯ-76 с помощью РТГА и к вирусам ИБК, ИББ и РВТ с помощью ИФА. Вакцина ассоциированная считается иммуногенной, если через 28 суток не менее чем у 80% привитых птиц накопление антител к вирусам НБ, ИБК, ССЯ-76, ИББ и РВТ обнаруживается в следующих титрах:
- к вирусу НБ не ниже 5 log2 в РТГА, не ниже двух минимальных положительных значений в ИФА;
- к вирусу ИБК не ниже двух минимальных положительных значений в ИФА;
- к вирусу ССЯ-76 не ниже 5 log2 в РТГА или не ниже двух минимальных положительных значений в ИФА;
- к вирусу ИББ не ниже двух минимальных положительных значений в ИФА;
- к вирусу РВТ не ниже двух минимальных положительных значений в ИФА.
Результаты испытаний приведены в таблице 4.
Данные, приведенные в таблице 4, свидетельствуют о том, что титры антител против НБ, ИБК, ССЯ-76, ИББ и РВТ через 28 суток значительно увеличивались по сравнению с исходными титрами, в несколько раз превышали требуемые минимальные титры ко всем антигенным компонентам вакцины и сохранялись на высоком уровне к 60 суткам наблюдений. Титры антител ко всем антигенным компонентам в контрольной группе оставались на одном уровне в течение всего срока наблюдений (60 суток). По окончании срока наблюдений птиц убивали, вскрывали места введения вакцины и визуально оценивали их на наличие воспалительных реакций, очагов некроза и остатков вакцинной эмульсии. У всех птиц вакцинированной группы (10 голов) в толще мускулатуры, в месте введения вакцины не было обнаружено некротических очагов, признаков воспаления или присутствия остатков вакцинной эмульсии.
Таким образом, предложенная вакцина обладает хорошими иммуногенными свойствами, безопасна для птиц и может использоваться для вакцинации кур против НБ, ИБК, ССЯ-76, ИББ и РБТ.
Пример 9
Проведена проверка напряженности и продолжительности поствакцинального иммунитета у кур мясного направления, привитых вакциной ассоциированной против НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц, изготовленной так, как описано в примере 6, и содержащей, мас.%:
Ассоциированную вакцину испытали на ремонтном молодняке в возрасте 70 сут, предварительно иммунизированном живыми вакцинами против НБ птиц, ИБК, ИББ, и РВТ птиц, согласно схемам, принятым на птицефабрике - поставщике. После иммунизации молодняка полученным препаратом напряженность поствакцинального иммунного ответа птиц оценивали в течение 280 суток. Для этого у привитых кур периодически проводили взятие крови, после чего вычисляли средние титры сывороточных антител. Результаты исследований представлены в таблице 5.
Данные, представленные в таблице 5, показывают, что в течение всего срока наблюдений (280 сут) у птиц сохранялись высокие уровни антител ко всем антигенным компонентам ассоциированной вакцины. Следует отметить, что через 30 суток после иммунизации (возраст птиц 100 суток) уровни антител к вирусам НБ, ИБК, ИББ и РВТ выросли относительно исходных титров в 2 и более раз, а титр антител к вирусу ССЯ-76 составил 10,6±0,2 log2, т.е. значительно превысил минимальный необходимый уровень (5 log2). Дальнейшие исследования показали, что высокие уровни антител к вирусам НБ, ИБК, ССЯ-76, ИББ и РВТ сохранялись в течение всего продуктивного периода жизни племенного поголовья кур. Так, через 280 суток после применения экспериментальной ассоциированной вакцины титр антител к вирусу НБ составил 8,3±0,5 log2; ССЯ-76 птиц - 7,5±0,5 log2; ИБК-1: 6774±430; ИББ-1: 5181±262 и РВТ - 2947±538.
Пример 10
Проведены производственные испытания вакцины ассоциированной против НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц инактивированной эмульсионной, изготовленной так, как описано в примере 6, и содержащей, мас.%:
Производственные испытания препарата проведены в условиях птицефабрики "Ивановский бройлер"(г.Иваново).
Ассоциированную вакцину испытывали на ремонтном молодняке в возрасте 70 суток в количестве 12000 голов, предварительно иммунизированном живыми вакцинами против НБ, ИБК, ИББ и РВТ согласно схемам, принятым на данном предприятии. После вакцинации в течение 280 суток оценивали напряженность поствакцинального иммунного ответа птиц. Для этого в привитом стаде периодически проводили выборочное (от 25 голов) взятие крови, после чего вычисляли средние титры сывороточных антител. Результаты исследований представлены в таблице 6.
Данные, представленные в таблице 6, свидетельствуют о том, что в течение всего срока наблюдений после вакцинации (280 суток) у птиц сохранялись высокие уровни антител ко всем антигенным компонентам ассоциированной вакцины. Следует отметить, что через 30 суток после иммунизации (возраст птиц 100 суток) уровни антител к вирусам НБ, ИБК, ССЯ-76, ИББ и РВТ выросли относительно исходных титров в 2 и более раз, а титр антител к вирусу ССЯ-76 составлял 10,6±0,2 log2, т.е. значительно превышал минимальный необходимый уровень (5,0 log2). Дальнейшие исследования показали, что высокие уровни антител к вирусам НБ, ИБК, ССЯ-76, ИББ и РВТ сохранялись в течение всего продуктивного периода жизни племенного поголовья кур. Так, через 280 суток после применения экспериментальной ассоциированной вакцины титр антител к вирусу НБ составлял 8,3±0,5 log2; ССЯ-76 птиц - 7,5±0,5 log2; ИБК - 1:6774±430; ИББ - 1:5181±262 и РВТ - 2947±538.
Таким образом, вакцина ассоциированная против НБ птиц, ИБК, ССЯ-76, ИББ и РВТ птиц инактивированная эмульсионная является высоко иммуногенным и безвредным препаратом.
Источники информации
1. Справочник ветеринарного врача птицеводческого предприятия. Т.1-2. - СПб, 1995 г.
2. Джавадов Э.Д. Вирус-индуцированные иммуносупрессии и способы их предупреждения в промышленном птицеводстве. // Автореферат дис. докт. вет. наук - М. 2004. - С.50.
3. Борисов В.В., Борисов А.В., Старов С.К. Особенности применения инактивированных вакцин в птицеводстве. // БИО. - 2007. - №2. - С.37-41.
4. Горшкова Т.К., Панферова С.М. и Воронина Г.А. Инактивированная вакцина против ньюкаслской болезни птиц из очищенного и концентрированного вируса. // Акт. вопр. вет. вирусолог.: тез. докл. научн.-теорет. конф. мол. ученых, ноябрь 1990 г. - Владимир, 1990. - С.73-74.
5. Сюрин В.Н. и 3 соавт. Вирусные болезни животных. - М.: ВНИТИБП, 1998. - С.214-233.
6. Сергеев В.А. Вирусные вакцины. Киев: Урожай, 1993. - С.158-172.
7. Сюрин В.Н. и 3 соавт. Вирусные болезни животных.- М.: ВНИТИБП, 1998. - С.183-198.
8. Пат. США №6086892; А61К 39/215, А61К 39/12, А65К 39/295, А61К 39/155, C12N 7/00; 11.07.2000 г.
9. Сюрин В.Н. и 3 соавт. Вирусные болезни животных.- М.: ВНИТИБП, 1998. - С.846-870.
10. Пат. РФ №2233671; А61К 39/235, C12N 7/00; 04.01.2003 г.
11. Сюрин В.Н. и 3 соавт. Вирусные болезни животных.- М.: ВНИТИБП, 1998. - С.65-84.
12. Пат. РФ №2127603; А61К 39/12, C12N 7/00; 20.03.1999 г.
13. Пат. РФ №2283137; А61К 39/12, C12N 7/00; 10.09.2006 г.
14. Сюрин В.Н. и 3 соавт. Вирусные болезни животных.- М.: ВНИТИБП, 1998. - С.17-19.
15. Пат. США №5525342; А61К 39/295, 39/15, 39/255, 39/215; 10.06.1996 г.
16. Пат. США №5833995; А61К 39/15, 10.11.1998 г.
17. Пат. США №6159472; А61К 39/00, А61К 39/12, А65К 39/15, 12.12.2000 г.
18. Фролов С.В. Разработка ассоциированной вакцины против инфекционного бронхита кур и ньюкаслской болезни: Автореф. дисс. канд. вет. наук. - Владимир, 2000. - 26 с.
19. Борисов В.В., Хлыбова Т.В., Борисов А.В. Иммуногенная активность инактивированной ассоциированной вакцины против синдрома снижения яйценоскости - 76 птиц и инфекционного бронхита кур. // Пробл. инфекц. патол. с-х ж-ных: Тез. докл. конф. - Владимир, 1997. - С.150.
20. Борисова О.А., Борисов В.В., Гусев С.А. и др. Изучение антигенной активности ассоциированной инактивированной вакцины против синдрома снижения яйценоскости - 76, инфекционного бронхита и инфекционной бурсальной болезни кур. // Производство и контроль медицинских и ветеринарных препаратов, опыт применения и реализации их в странах СНГ: Тез. докл. конф., посвящ. 30-летию ФГУП ПЗБ. - Вольгинский, 1999, - С.53.
21. Дубовой А.С. Ассоциированные инактивированные вакцины в птицеводстве, // Мат. науч.-практ. конф., посвящ. 190-летию высшего вет. образования в России и 100-летию вет. науки. - СПб., 1998. - Ч.1 - С.74-75.
22. Дубовой А.С., Джавадов Э.Д. и Полежаев Ф.И. Иммунитет у птицы, привитой, поливалентной инактивированной эмульсионной вакциной "Авикрон". // Ветеринария. - 2004, №4. - С.13-14.
23. Джавадов Э.Д., Дмитриева М.Е., Вихрева И.Н., Дубовой А.С. и Самусева Г.Н. Инактивированные вакцины серии "Авикрон " - эффективная профилактика болезней птиц в промышленном птицеводстве. // Ветеринария. - 2009, №6. - С.13-14.
Y=A+Bx2
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 ПТИЦ | 2003 |
|
RU2239452C2 |
| ИНАКТИВИРОВАННАЯ СОРБИРОВАННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 2004 |
|
RU2283136C2 |
| ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 2004 |
|
RU2283137C2 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ НЬЮКАСЛСКОЙ БОЛЕЗНИ, РЕОВИРУСНОГО ТЕНОСИНОВИТА И МЕТАПНЕВМОВИРУСНОЙ ИНФЕКЦИИ ПТИЦ ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ | 2011 |
|
RU2480238C1 |
| ШТАММ "БИСС № 113" ВИРУСА СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ - 76 ПТИЦ ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2221865C1 |
| ВИРУСВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 2004 |
|
RU2272649C1 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 ПТИЦ | 2003 |
|
RU2233671C1 |
| ШТАММ "К-58" ВИРУСА ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2004 |
|
RU2268936C1 |
| ИНАКТИВИРОВАННАЯ СОРБИРОВАННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО ЛАРИНГОТРАХЕИТА ПТИЦ | 2003 |
|
RU2259845C1 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 1998 |
|
RU2127603C1 |
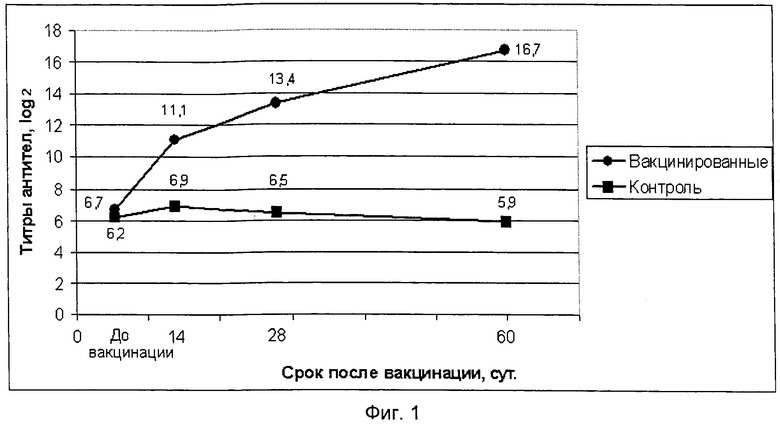
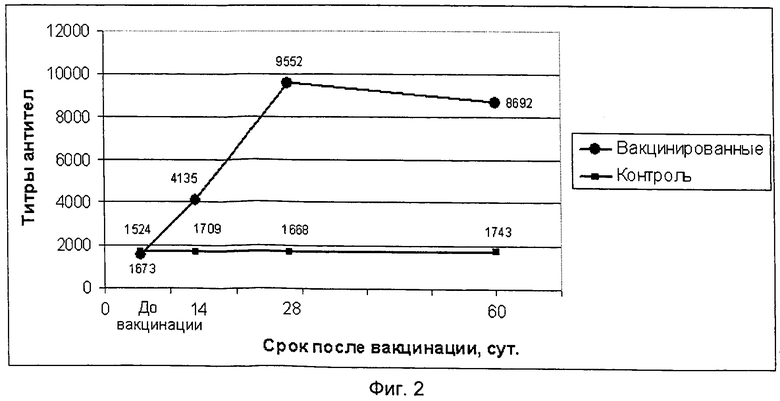
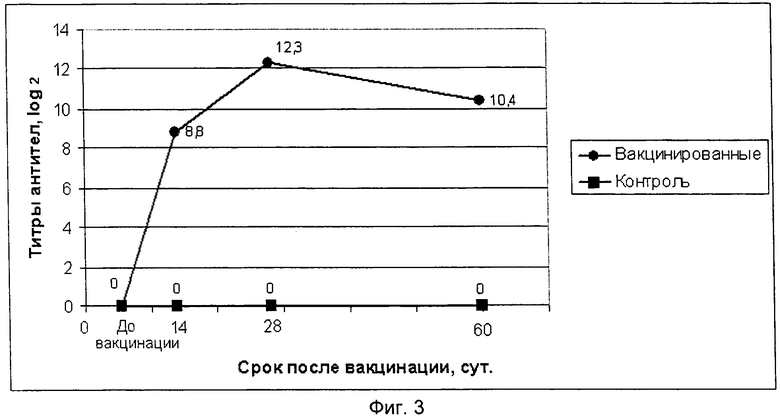
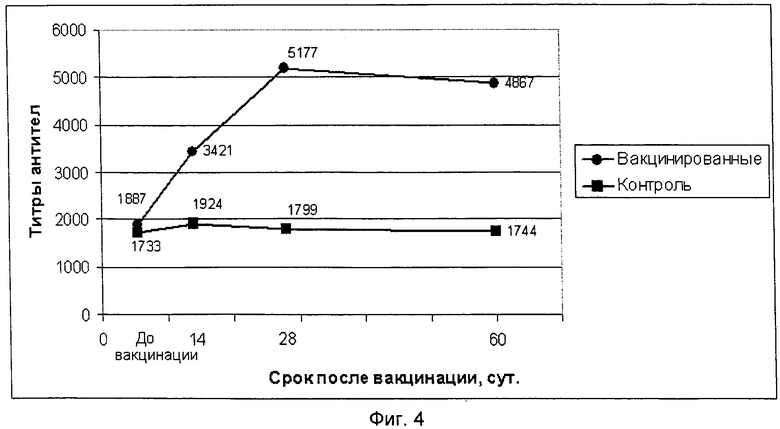

Изобретение относится к ветеринарной вирусологии и биотехнологии. Вакцина содержит активное вещество и целевую добавку. В качестве активного вещества вакцина содержит смесь из авирулентного очищенного антигенного материала из штамма "Ла Сота" вируса НБ птиц, сем. Paramyxoviridae, подсем. Paramyxovirinae, рода Avulavirus, серотипа 1, из авирулентного очищенного антигенного материала из штамма "Н-52" вируса ИБК, сем. Coronaviridae, рода Coronavirus, серотипа Массачусетс, из авирулентного очищенного антигенного материала из штамма "БИСС №113" вируса ССЯ-76 птиц, сем. Adenoviridae, рода Aviadenovirus, серотипа 3, коллекция ФГУ "ВГНКИ" "БИСС №113-ДЕП", из авирулентного очищенного антигенного материала из штамма "К-58" или из штамма "БГ" вируса ИББ птиц, сем. Birnaviridae, рода Avibirnavirus, коллекция ФГУ "ВГНКИ" "К-58 №122-ДЕП" или "БГ"102 ДЕП соответственно, и из авирулентного очищенного антигенного материала из штамма "1133" вируса РВТ птиц, сем. Reoviridae, рода Orthoreovirus, коллекция ФГУ "ВГНКИ" "1133-ДЕП", взятых в соотношении 0,5:2,0:0,5:1:1 соответственно и в количествах, обеспечивающих протективную иммуногенную активность каждого антигена в организме птицы после введения ей целевого препарата. В качестве целевой добавки вакцина содержит масляный адъювант марки Montanide ISA-70 VG. Изобретение обеспечивает индукцию у привитой птицы высокого уровня антител к возбудителям НБ, ИБК, ССЯ-76, ИББ и РВТ через 28 суток после применения вакцины, который сохраняется в течение 12 месяцев и трансовариально передается потомству. 7 з. п. ф-лы, 6 табл., 10 пр., 5 ил.
1. Вакцина ассоциированная против ньюкаслской болезни (НБ) птиц, инфекционного бронхита кур (ИБК), синдрома снижения яйеноскости-76 (ССЯ-76), инфекционной бурсальной болезни (ИББ) и реовирусного теносиновита (РВТ) птиц инактивированная эмульсионная, содержащая активное вещество и целевую добавку, отличающаяся тем, что в качестве активного вещества она содержит смесь из авирулентного очищенного антигенного материала из штамма "Ла Сота" вируса НБ птиц, сем. Paramyxoviridae, подсем. Paramyxovirinae, рода Avulavirus, серотипа 1, из авирулентного очищенного антигенного материала из штамма "Н-52" вируса ИБК, сем. Coronaviridae, рода Coronavirus, серотипа Массачусетс, из авирулентного очищенного антигенного материала из штамма "БИСС №113" вируса ССЯ-76 птиц, сем. Adenoviridae, рода Aviadenovirus, серотипа 3, коллекция ФГУ "ВГНКИ" "БИСС №113 - ДЕП", из авирулентного очищенного антигенного материала из штамма "К-58" или из штамма "БГ вируса ИББ птиц, сем. Birnaviridae, рода Avibirnavirus, коллекция ФГУ "ВГНКИ" "К-58 №122 - ДЕП" или "БГ" 102 ДЕП соответственно, и из авирулентного очищенного антигенного материала из штамма "1133" вируса РВТ птиц, сем. Reoviridae, рода Orthoreovirus, коллекция ФГУ "ВГНКИ" "1133 - ДЕП," взятых в объемном соотношении 0,5:2,0:0,5:1,0:1,0 соответственно и в количествах, обеспечивающих протективную иммуногенную активность каждого антигена в организме птицы после введения ей целевого препарата.
2. Вакцина по п.1, отличающаяся тем, что она содержит авирулентный очищенный материал из штамма "Ла Сота " вируса НБ птиц, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 10,3 lg ЭИД50/см3, в количестве, мас.%: 3,0÷6,0.
3. Вакцина по п.1, отличающаяся тем, что она содержит авирулентный очищенный антигенный материал из штамма "Н-52" вируса ИБК, полученного в 9÷12-суточных эмбрионах SPF- кур с инфекционной активностью до инактивации не ниже 7,2 log ЭИД50/см3, в количестве, мас.%: 6,0÷12,0.
4. Вакцина по п.1, отличающаяся тем, что она содержит авирулентный очищенный антигенный материал из штамма "БИСС №113" вируса ССЯ-76 птиц, полученного в 11÷12-суточных утиных эмбрионах (УЭ) с инфекционной активностью до инактивации не ниже 7,5 lg ЭИД50/см,3 в количестве, мас.%: 3,0÷6,0.
5. Вакцина по п.1, отличающаяся тем, что она содержит авирулентный очищенный антигенный материал из штамма "К-58" или из штамма "БГ "вируса ИББ птиц, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 5,5 lg ЭИД50/см,3 в количестве 6,0 мас.%.
6. Вакцина по п.1, отличающаяся тем, что она содержит авирулентный очищенный антигенный материал из штамма "1133" вируса РВТ птиц, полученного в культуре клеток ФЭК с инфекционной активностью до инактивации не ниже 7,5 lg ТЦД50/см,3 в количестве 6,0 мас.%.
7. Вакцина по п.1, отличающаяся тем, что в качестве целевой добавки она содержит масляный адъювант в количестве не менее 70,0 мас.%.
8. Вакцина по любому из пп.1-7, отличающаяся тем, что в качестве активного вещества она содержит смесь из авирулентного очищенного антигенного материала из штамма "Ла Сота" вируса НБ птиц, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 10,3 lg ЭИД50/см3, из авирулентного очищенного антигенного материала из штамма "Н-52" вируса ИБК, полученного в 9÷12-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 7,2 lg ЭИД50/см3, из авирулентного очищенного антигенного материала из штамма "БИСС №113" вируса ССЯ-76 птиц, полученного в 11÷12-суточных УЭ с инфекционной активностью до инактивации не ниже 7,5 lg ЭИД50/см3, из авирулентного очищенного антигенного материала из штамма "К-58" или из штамма "БГ" вируса ИББ птиц, полученного в 9÷11-суточных эмбрионах SPF-кур с инфекционной активностью до инактивации не ниже 5,5 lg ЭИД50/см3, и из авирулентного очищенного антигенного материала из штамма "1133" вируса РВТ птиц, полученного в культуре клеток ФЭК с инфекционной активностью до инактивации не ниже 7,5 lg ТЦД50/см3, а в качестве целевой добавки масляный адъювант в соотношении, мас.%:
| RU 2007139664 А, 27.04.2009 | |||
| US 6159472 A, 12.12.2000 | |||
| ДЖАВАДОВ Э.Д | |||
| и др | |||
| Инактивированные вакцины серии «авикрон» - эффективная профилактика болезней птиц в промышленном птицеводстве, ж.Ветеринария, №6, 2009, с.13-14. |
Авторы
Даты
2012-02-27—Публикация
2010-04-06—Подача