Изобретение относится к области ветеринарной вирусологии и биотехнологии и может быть использовано при разработке и изготовлении вакцинных препаратов для профилактики синдрома снижения яйценоскости - 76 птиц (ССЯ-76).
ССЯ-76 - вирусная болезнь кур-несушек, характеризующаяся резким, но непродолжительным снижением яичной продуктивности, появлением депигментированных яиц, яиц со слабой скорлупой и без скорлупы, а также увеличением процента боя и насечки.
Впервые болезнь была описана в 1976 году в Голландии. Позднее ССЯ-76 регистрировали во многих других странах Европы, Южной Америки, Австралии и Африки. В начале восьмидесятых годов прошлого века были выявлены случаи ССЯ-76 в нашей стране, что было подтверждено обнаруживанием в крови переболевших птиц антигемагглютининов к вирусу ССЯ-76.
Возбудителем болезни является ДНК-содержащий вирус, относящийся к семейству Adenoviridae, который в отличие от представителей других аденовирусов птиц способен агглютинировать эритроциты кур. К заболеванию восприимчивы куры-несушки всех пород в период наивысшей яйценоскости (180-240 сут), но возможно поражение птицы в любой период продуктивного цикла. Более восприимчивы к заболеванию куры высокопродуктивных мясояичных и мясных кроссов.
По данным многих зарубежных и отечественных исследователей экономический ущерб при ССЯ-76 складывается из потери от 5 до 30 яиц на курицу-несушку. а в племенных стадах с учетом выбраковки может доходить до 50 яиц.
Ущерб от болезни усугубляется затратами на оздоровительные мероприятия.
В настоящее время основным методом ликвидации ССЯ-76 в России является специфическая профилактика заболевания инактивированными вакцинами (1).
В связи с этим задача отбора и изучения эпизоотических изолятов данного возбудителя в целях получения новых производственных штаммов вируса ССЯ-76, обладающих высокой иммуногенной активностью, стабильностью при инактивации и обеспечивающих изготовление высокоэффективных инактивированных вакцинных препаратов, остается актуальной.
Известен штамм ВС-14 вируса ССЯ-76 птиц, используемый для изготовления инактивированной вакцины (2).
Известен штамм В8/78 вируса ССЯ-76 птиц, используемый для изготовления инактивированной вакцины (3).
Известен штамм "Б-93" вируса ССЯ-76 птиц, используемый для изготовления инактивированной вакцины (4).
Общими недостатками известных штаммов являются низкая антигенная активность изготовленных на их основе инактивированных вакцин по причине нестабильности штаммов при инактивации, а также необходимости их культивирования только на развивающихся утиных эмбрионах.
В задачу создания настоящего изобретения входило получить новый производственный штамм вируса ССЯ-76 птиц, обладающий высокой антигенной активностью, сохраняющий свои нативные иммунобиологические свойства при инактивации и пригодный для изготовления высокоэффективной инактивированной вакцины, для которой антиген можно получать как в развивающихся утиных, так и в куриных эмбрионах.
Технический результат от использования предлагаемого изобретения заключается в расширении арсенала штаммов вируса ССЯ-76, обладающих высокой биологической и антигенной активностью, сохраняющих свои нативные иммунобиологические свойства при инактивации и пригодных для изготовления высокоэффективных инактивированных вакцин.
Указанный технический результат достигнут получением штамма "БИСС" вируса ССЯ-76 птиц для изготовления инактивированной вакцины. Штамм "БИСС" является новым, ранее неизвестным. Штамм "БИСС" вируса ССЯ-76 птиц выделен из органов репродуктивной системы курицы с признаками острой формы ССЯ-76 в 1999 году в Ульяновской области. Производственный штамм "БИСС" вируса ССЯ-76 получен путем проведения 4-х последовательных пассажей на развивающихся утиных эмбрионах.
Полученный штамм депонирован во Всероссийской Государственной Коллекции штаммов микроорганизмов, используемых в ветеринарии и животноводстве, Всероссийского научно-исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов (ВГНКИ) МСХ РФ 5 октября 2000 г. под регистрационным шифром "БИСС 113-ДЕП".
Штамм "БИСС 113" вируса ССЯ-76 обладает высокой биологической и антигенной активностью в нативном виде и после инактивации. Экспериментально подтверждена его возможность использования для приготовления инактивированной вакцины против ССЯ-76 птиц, создающей эффективную защиту кур против указанного возбудителя заболевания.
Штамм "БИСС 113" вируса ССЯ-76 птиц характеризуется следующими признаками и свойствами.
Морфологические свойства
Штамм "БИСС 113" вируса ССЯ-76 относится к семейству Adenoviridae, роду Aviadenovirus, к 3 серологической группе. При электронно-микроскопическом исследовании штамм "БИСС 113" представлен вирионами икосаэдрической формы, которые лишены суперкапсидной оболочки и не содержат липидов. Диаметр нуклеокапсида 70±8 нм.
С помощью ПЦР и секвенирования апмлифицированных участков генома установлено, что аллантоисная жидкость от зараженных штаммом "БИСС" утиных эмбрионов содержала геном вируса ССЯ-76.
Нуклеотидная последовательность амплифицированного консервативного фрагмента гена гексона штамма "БИСС 113" имела полную гомологию с референтными штаммами вируса ССЯ-76.
Антигенные свойства
По своим антигенным свойствам штамм "БИСС 113" относится к 3 серологической группе птичьих аденовирусов. Вирус стабильно нейтрализуется гомологичной антисывороткой.
Через 14-21 сут после заражения 120-суточных кур отмечают появление вируснейтрализующих и гемагглютинирующих антител. Гемагглютинирующий титр штамма достигает 18,0-21,0 лог2. Пробы экстраэмбриональной жидкости после расплодки штамма на утиных эмбрионах исследовали в реакции гемагглютинации (РГА). Исследуемые пробы экстраэмбриональной жидкости имели гемагглютинирующую активность (ГА-активность) в разведении 1:32768-1:262144.
Биотехнологические характеристики
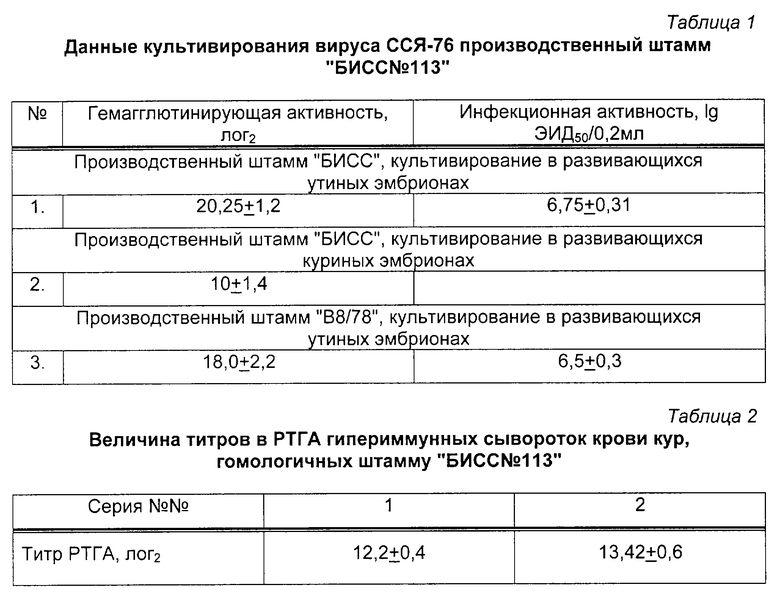
Штамм "БИСС 113" предназначен для изготовления инактивированной вакцины против ССЯ-76 птиц. Штамм хорошо размножается в 9-11-суточных утиных эмбрионах, зараженных в аллантоисную полость. Инфекционная активность штамма через 120 ч при температуре 37,0+0,5oС достигает 6,75+0,31 lg ЭИД50/0,2 см3.
Штамм также культивируется в куриных эмбрионах и первичной культуре клеток утиных фибробластов, вызывая цитопатическое действие (ЦПД). Результаты культивирования вируса ССЯ-76 штамма "БИСС 113" представлены в таблице 1. Штамм является генетически стабильным и сохраняет свои свойства на протяжении 10 пассажей.
Гемагглютинирующие свойства
Штамм "БИСС 113" обладает выраженными гемагглютинирующими свойствами. Агглютинирует эритроциты кур и уток, вызывая образование среднезернистой реакции гемагглютинации (РГА) с предельным титром 21,0 лог2.
Инфекционные свойства
К штамму "БИСС 113" восприимчивы куры, утки и гуси при интратрахеальном, оральном и внутримышечном заражениях. Начиная с 14 сут после введения вируса 120-суточным цыплятам, отмечают появление депигментированных лишенных скорлупы яиц. В течение четырех недель процент яиц с мягкой скорлупой и бесскорлупных составляет около 30% и более.
Клинических признаков болезни при экспериментальном и естественном заражениях вирус не вызывает. Патологоанатомические изменения не выражены и определяются только гистологически в виде внутринуклеарных включений в клетках эпителия железистого желудка.
Хемо-генотаксономическая характеристика
Сердцевина вириона содержит двухцепочечную молекулу ДНК и два внутренних белка. Масса нуклеиновой кислоты достигает 17,3% массы вириона.
Основная масса белков вируса ССЯ-76 птиц сосредоточена в капсидной оболочке вириона. На долю серцевинных белков приходится до 20% всех протеинов вируса. Серцевинный белок "1" с молекулярной массой 46•103 г/моль легко отделяется от внутреннего нуклеотида, содержащего ДНК в комплексе с богатым аргинином серцевинным белком "2".
Гексон, основание пептона и его нить (фибер) вируса "БИСС 113" построены из полипептидов с молекулярными массами 120•103, 70•103, 62•103 г/моль соответственно.
Белковые структуры вируса штамма "БИСС 113" формируют несколько антигенов. В составе структурного вирусного антигена у них обнаружены типоспецифические, группоспецифические, подгруппоспецифические антигены нити пектона. В составе структурного вирусного антигена выявлено три основных компонента, обозначенных А, В и С. Антиген А структурно связан с гексоном, антиген В - с пептоном, антиген С - с нитями вириона (фибера). Связанный с гексоном компонент А содержит группоспецифический антиген (а) и типоспецифический антиген (ε). Антигенный фактор, связанный с пептоном, назван антигеном β, а с нитью вириона (фибер) - γ.
Физические свойства
Масса вириона - 252•103 г/моль. Плавучая плотность 1,32-1,35 г/мл в градиенте С3С1. Константа седиментации зрелого вириона составляет 8-10•10-13-9-10•10-13 с.
Устойчивость к внешним факторам
Штамм "БИСС 113" стабилен при рН в пределах 6,0-9,0. Устойчив к жирорастворителям. Инактивируется при 56oС.
Дополнительные признаки и свойства
Иммуногенная активность - 100%.
Патогенность выражена.
Вирулентность выражена.
Контагиозность выражена.
Онкогенность выражена.
Онкогенность отсутствует.
Свободен от контаминации бактериальной и грибковой флоры, микоплазмами и гемагглютинирующими вирусами.
На основании полученных данных можно утверждать, что штамм "БИСС 113" по антигенному и иммунологическому спектрам является оригинальным, в таксономическом отношении новым, ранее неизвестным изолятом вируса ССЯ-76 птиц. Для снижения его эпизоотической опасности необходима своевременная профилактика вновь возникающих очагов болезни, а для этого необходима высокоактивная и безвредная вакцина.
Сущность предлагаемого изобретения пояснена на электронной микротографии, на которой изображены вирионы ССЯ-76 штамма "БИСС 113" (инструментальное увеличение 45000 и трехкратное при увеличении фотографии).
По мнению заявителя, предлагаемый штамм обладает установленными Патентным законом России признаками патентоспособности "новизна" и "изобретательский уровень".
Сущность предлагаемого изобретения пояснена примерами его использования.
Пример 1
Исходный вирус для получения штамма "БИСС 113" выделен из органов репродуктивной системы курицы с признаками острой формы ССЯ-76 в 1999 году в Ульяновской области. Вакцинный штамм получен во ВНИИ защиты животных путем проведения последовательных пассажей на развивающихся утиных эмбрионах 10-12-суточного возраста. Для получения вируса первого пассажа зараженные эмбрионы инкубировали в термостате в течение 120 ч при температуре 37,0±0,5oС. Гибель эмбрионов в течение первых 24 ч после введения вируса считали неспецифичной. Через 120 ч инкубации все эмбрионы охлаждали при температуре 4-8oС в течение 12-18 ч и вскрывали. Экстраэмбриональную жидкость (ЭЭЖ) из полости эмбриона отбирали пипеткой и собирали в стеклянные флаконы. Флаконы с вируссодержащей жидкостью подвергали низкоскоростному центрифугированию для освобождения от крупнодисперсных частиц. Осветленную суспензию использовали для последующего пассирования.
Полученный вирус был подвергнут всестороннему контролю в соответствии с руководством МЭБ по стандартным диагностическим методам и вакцина (1996) и на уровне 4 пассажа заложен на хранение в качестве матровой расплодки. Вирус матровой расплодки с титром инфекционной активности 6,75±0,31 lg ЭИД50/0,2 см3, представленный в виде вируссодержащей ЭЭЖ, хранят при температуре минус 40oС.
Полученному штамму вируса ССЯ-76 птиц присвоено авторское наименование "БИСС".
Пример 2
Для изготовления инактивированной эмульсионной вакцины используют производственный штамм "БИСС 113" вируса ССЯ-76, получаемый из ВГНКИ. Указанный штамм используют для получения матровой расплодки. Для этого 3 ампулы лиофилизированного вируса растворяют в 30 см3 стерильного 0,9% раствора хлорида натрия, содержащего 200 Ед/см3 стрептомицина. Приготовленным вирусом заражают 150 утиных эмбрионов 10-12-суточного возраста путем его введения в аллантоисную полость 0,2 см3. Зараженные эмбрионы инкубируют при температуре 37,4±0,5oC и относительной влажности 60-70% в течение 96-120 ч. Каждые 24 ч эмбрионы овоскопируют. Через 96-120 ч после заражения и инкубации эмбрионы используют для получения вируса. Перед вскрытием утиные эмбрионы охлаждают при 4-8oС в течение 12-24 ч. После этого из них через прокол в хориоаллантоисной оболочке стерильной пипеткой отбирают вируссодержащую жидкость. Собранную жидкость центрифугируют при 1000 об/мин в течение 15 мин и сливают по 50-100 см3 в стерильные флаконы емкостью по 100-200 см3. В стерильных условиях из каждого флакона отбирают по 3-5 см3 жидкости для контроля стерильности и гемагглютинирующей активности (ГА-активности). Полученная матровая расплодка должна быть стерильной и иметь ГА-активность не ниже 1-4096. Матровую расплодку хранят в замороженном виде при температуре не выше минус 40oС.
Матровую расплодку используют для получения производственной расплодки вируса. Для этого флаконы с матровым вирусом размораживают в водяной бане при 18-20oС, содержимое флаконов очищают хлороформом и центрифугируют при 2500 об/мин в течение 20 мин. Надосадочную жидкость отбирают в стерильные флаконы. Активность вируса определяют в РГА и производят корректировку объема путем разведения 0,9% раствором хлорида натрия до активности 2048-4096 ГАЕ/0,2 см3. Затем в суспензию матрового вируса добавляют 400 ЕД/см3 пенициллина, 400 мкг/см3 стрептомицина и 40 мкг/см3 нистатина. Поготовленный таким образом матровый вирус используют для получения производственной расплодки вируса.
Полученным вирусом заражают партию утиных эмбрионов в количестве, обеспечивающем изготовление планируемого объема серии вакцины. Зараженные утиные эмбрионы инкубируют при температуре 37,0±0,5oС и относительной влажности 60-70% в течение 96-120 ч. Через 96-120 ч после заражения эмбрионы охлаждают 4-8oС в течение 12-24 ч, производят вскрытие зараженных эмбрионов и сбор вируссодержащего материала. Полученный вируссодержащий материал подвергают первичной очистке путем центрифугирования. Центрифугирование проводят в течение 7-10 мин при 1000 об/мин и температуре 2-6oС. При этом аллантоисную жидкость освобождают от осколков скорлупы, клеток и эритроцитов. Очищенную вируссодержащую экстраэмбриональную жидкость (ЭЭЖ) сливают в стеклянные 20 дм3 стерильные бутыли. Полученную ЭЭЖ подвергают инактивации аминоэтилэтиленимином (АЭЭИ). Вируссодержащую ЭЭЖ нагревают в водяной бане до 37,0±0,5oС. При перемешивании в суспензию добавляют 10% раствор АЭЭИ до конечной концентрации 0,2-0,3%. Инактивацию ведут в течение 48 ч после добавления инактиванта при 37,0±0,5oС с периодическим перемешиванием. По окончании инактивации бутыли с полученным антигеном охлаждают при 4-8oС в течение 2 сут, периодически перемешивая суспензию. Затем из каждой бутыли отбирают пробу в количестве 20 см3 для определения титра в РГА, контроля, авирулентности, стерильности и рН. Инактивированный антиген должен быть стерильным и авирулентным, иметь ГА-титр не менее 1:8192 и рН в пределах 7,4-7,8. Антиген хранят при 4-8oС. Полученный антиген подвергают дополнительной отчистке от балластных примесей на проточной ультрацентрифуге и фильтровальной установке с элементом ЭПРС. После этого антигенный материал соединяют с масляным адъювантом в соотношении 30:70-40-60 по весу. Перед составлением вакцины проводят корректировку объема инактивированного антигена по титру гемагглютининов. ГА-активность инактивированного антигена в РГА инактивированного антигена в РТГА должна быть не меньше 1:4096. Для изготовления эмульсионной вакцины можно использовать как отечественные, так и зарубежные масляные адъюванты. В данном случае используют масляный адъювант фирмы "Сеппик" (Франция) "Монтанид ИЗА-70".
Изготовление инактивированной эмульсионной вакцины проводят следующим образом: в реактор со стерильным масляным адъювантом при включенной мешалке (250-300 об/мин) подают необходимый объем инактивированного материала со скоростью 2-3 дм3/мин (стадия предэмульсии).
Затем предэмульсию пропускают через гомогенизатор в течение 3 ч, получая в результате стабильную эмульсию типа "вода-масло". Учитывая термолабильность вирусного антигена, процесс эмульгирования проводят при температуре 4-8oС. При получении эмульсии контролируют некоторые ее характеристики: тип эмульсии, стабильность, вязкость и другие свойства. Готовую вакцину разливают во флаконы, объемом 200-450 см3, которые герметично укупоривают и закатывают алюминиевыми колпачками. Полученную вакцину контролируют по следующим показателям: по внешнему виду и цвету, наличию посторонней примеси и дефектов флаконов, стабильности эмульсии, определению относительной вязкости, плотности инактивации вакцины и ее антигенной активности.
Пример 3
Вируссодержащую аллантоисную жидкость концентрировали в градиенте сахарозы. После ресуспендирования коэффициент концентрирования составлял около 90. Концентрат исследовали средствами электронной микроскопии, используя негативное концентрирование препаратов 2% раствором фосфорно-вольфрамовой кислоты (ФВК), рН 6,8. При инструментальном увеличении 4,5•105 45-105 в поле зрения микроскопа наблюдали хорошо различимые вирусные частицы ССЯ-76 со свойственной им морфологией. К описанию изобретения приложена электронная микрофотография с изображением вируса ССЯ-76 штамма "БИСС 113" после 10 пассажей на утиных эмбрионах. Представленная микрофотография свидетельствует о том, что вирионы ССЯ-76 состоят из специфического нуклеокапсида без суперкапсидной оболочки. Диаметр нуклеокапсида 70±8 нм.
С помощью ПЦР и секвенирования амплифицированных участков генома установлено, что аллантоисная жидкость от зараженных штаммом "БИСС 113" утиных эмбрионов содержала геном вируса ССЯ-76. Нуклеотидная последовательность амплифицированного консервативного фрагмента гена гексона предлагаемого штамма имела полную гомологию с референтными штаммами вируса ССЯ-76.
Пример 4
После каждой расплодки штамма "БИСС 113" производили высевы вируссодержащего материала на питательные среды МПА, МПБ, МППБ под вазелиновым маслом и Сабуро. Использовали по 3 пробирки каждой из указанной сред для посева и по одной пробирке оставляли в качестве контроля. Объем посева в каждую пробирку составляет 0,1 см3. Засеянные контрольные пробирки со средними (кроме Сабуро) инкубировали при 37oС в течение 14 сут. Контрольную и засеянную среду Сабуро выдерживали в течение того же времени при комнатной температуре в затемненном месте.
Было установлено, что ни один из посевов не показал признаков роста бактериальной или грибковой микрофлоры.
Для исключения контаминации микоплазмами производили высевы по 0,5 см3 в 3 пробирки, содержащие по 4,5 см3 стандартного PPLO-бульона (20% лошадиной сыворотки; 1,47% PPLO основы; 2,5% аутолизата дрожжей; 0,5% глюкозы; 0,25 артинина; 0,01% никотинамида динуклеотида и L-цистеина; 0,05% ацетата таллия; индикатор - феноловый красный), одну пробирку оставляли незасеянной в качестве контроля. Инкубацию проводили при 37oС в течение 72 ч.
Дополнительно штамм "БИСС 113" контролировали на наличие микоплазм методом ПЦР.
Об отсутствии роста микоплазм в жидкой среде судили по сохранению цвета индикатора. Если в течение 72 ч окраска бульона не изменилась, выполняли "слепой" пассаж в жидкую среду. После 2 "слепых" пассажей делали высев на PPLO-агар. Чашки с агаром в течение 10 сут просматривали под микроскопом с затемненным полем при малом увеличении. По отсутствию роста специфических для микоплазм колоний (мелких росинчатых, с диаметром 0,1-1,0 мм с центром, врастающим в толщину агара) делали заключение о чистоте исследуемого материала. Ни в одной из исследуемых проб роста микоплазм обнаружено не было. Результат исследования штамма "БИСС 113" в ПЦР на наличие генома возбудителей микоплазмоза был отрицательный.
Пример 5
Для контроля контаминации штамма "БИСС 113" чужеродными вирусами проводили заражение 9-11-суточных эмбрионов SPF-кур в аллантоисную полость на хориоаллантоисную оболочку (ХАО).
Установлено, что штамм "БИСС 113" не вызывал у куриных эмбрионов гибели и видимых поражений эмбрионов на уровне 2 последовательных пассажей. Пробы аллантоисной жидкости имели активность в РГА с 1% суспензией эритроцитов петуха в разведении 1:1024-1:4096. Из этих проб было приготовлено разведение вируса с активностью 4 ГАЕ, которое затем тестировали в РТГА со специфическими гипериммунными сыворотками к вирусам ньюкаслской болезни птиц и ССЯ-76.
Проба ЭЭЖ была активной в РТГА с положительной сывороткой к вирусу ССЯ-76 и не вступала в реакцию с гипериммунной сывороткой к вирусу ньюкаслской болезни птиц. Пробы ЭЭЖ от первого и второго пассажей на куриных эмбрионах дополнительно исследовали методом ПЦР на выявление геномов вирусов ньюкаслской болезни птиц, инфекционного бронхита кур, инфекционной бурсальной болезни и инфекционного энцефаломиелита кур. Во всех случаях результат ПЦР был отрицательный.
Пример 6
Пробы ЭЭЖ после расплодок штамма на утиных эмбрионах исследовали в РГА. Для этого использовали отмытые от плазмы эритроциты петуха в виде 10-20 суспензии на физрастворе (хранение при 4oС не более 72 ч). Готовили 1% рабочую концентрацию взвеси эритроцитов. Реакцию ставили на планшетах для ГА с U-образными лунками. В нескольких повторностях производили серийные двукратные разведения (в диапазоне от 1:2 до 1:8388608) образцов ЭЭЖ по 200 мкл в лунке. В таком же объеме ко всем разведениям добавляли рабочую концентрацию взвеси эритроцитов. Полученную смесь инкубировали при комнатной температуре в течение 30 мин. Параллельно при тех же условиях испытывали образец положительного контроля - антиген вируса ССЯ-76, штамм "В8/78". По истечении срока инкубации оценивали характер осаждения эритроцитов на дно лунки. Положительный результат соответствовал размытому пристеночному осадку, повторяющему форму лунки. При отрицательной реакции на дне лунки наблюдали компактный круглый осадок эритроцитов. Было установлено, что исследуемые пробы ЭЭЖ имели ГА-активность 18,0-21,0 лог2.
Пример 7
Для антигенной идентификации штамма "БИСС 113" были получены гипериммунные сыворотки после многократных инъекций 60-суточным птицам вируссодержащего препарата на основе масляного адъюванта. Активность сывороток достигала величины 12,0 лог2 в РТГА. Данные сыворотки были предназначены для изготовления диагностических наборов.
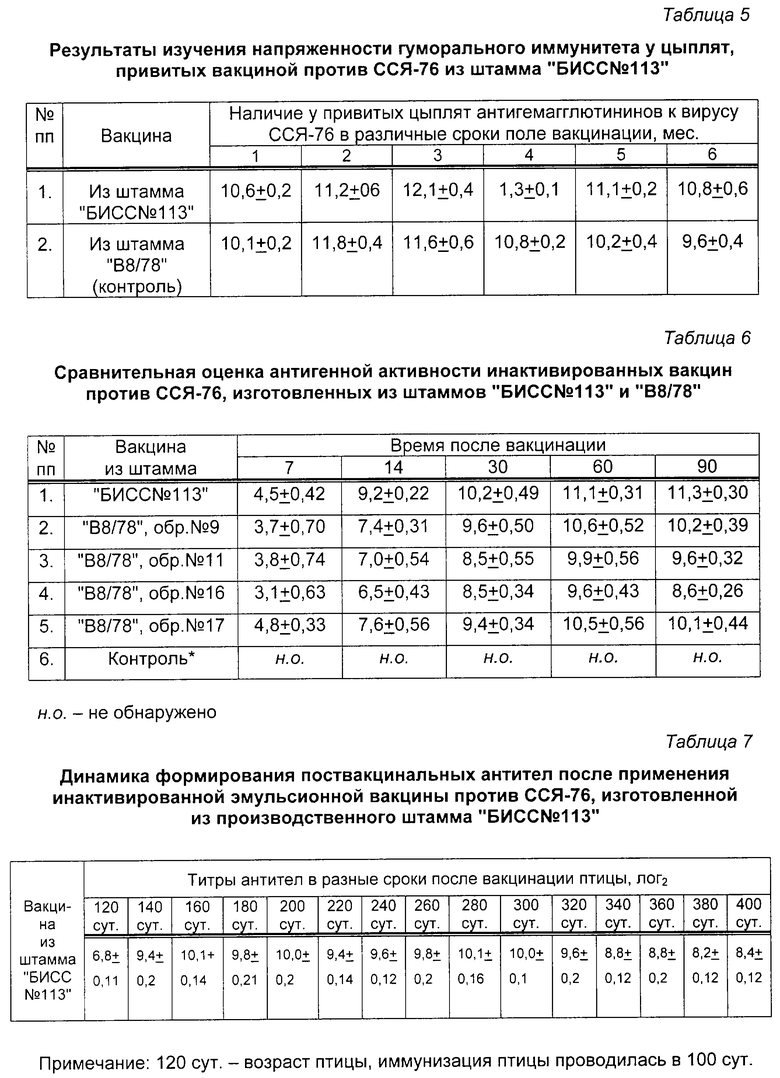
Результаты титрования сывороток, соответственно сериям, представлены в таблице 2.
Пример 8
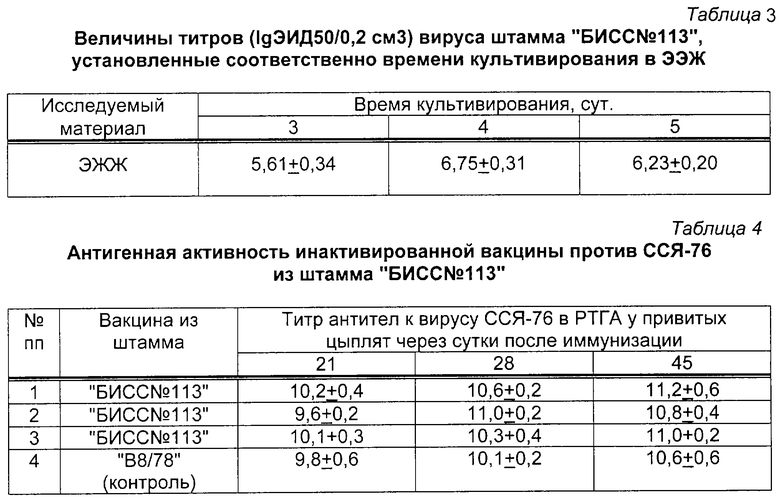
Штамм "БИСС 113" культивировали в утиных эмбрионах 9-11-суточного возраста. Заражение эмбрионов производили в аллантоисную полость. Объем инокулята был равен 0,2 см3. Эмбрионы после заражения вирусом инкубировали в термостате при температуре 37,0±0,5oС в течение 4-5 сут. После чего охлаждали в течение 4-6 ч при 4oС и в стерильных условиях отбирали ЭЭЖ, с которой потом ставили РГА с 1% суспензией эритроцитов петуха. Результаты накопления вируса ССЯ-76, штамм "БИСС 13", в развивающихся эмбрионах уток представлены в таблице 3.
Из данных, представленных в таблице 3, следует, что наибольшее накопление вируса ССЯ-76, штамм "БИСС 113", происходило в аллантоисной полости развивающихся утиных эмбрионов на 4-5 сут культивирования.
Пример 9
Для определения антигенной активности штамма "БИСС 113" в составе инактивированной вакцины были изготовлены три опытных образца препарата на основе масляного адъюванта "Монтанид ИЗА 70". Инактивированный вирус ССЯ-76 перед компоновкой вакцины разводили 1:2 стерильным ФБР. В качестве контроля использовали образец серийной инактивированной вакцины против ССЯ-76, приготовленной из штамма "В8/78". Все вакцины вводили цыплятам опытных и контрольных групп (в каждой группе по 20 голов). Результаты исследований по определению антигенной активности представлены в таблице 4.
Из данных таблицы 4 видно, что все три образца инактивированной вакцины против ССЯ-76, приготовленные из штамма "БИСС 113". индуцировали у привитых цыплят образование антител к вирусу ССЯ-76 в высоких титрах. Вакцина из штамма "В8/78" вызывала у иммунизированных цыплят образование антител к вирусу ССЯ-76 в титрах аналогичного уровня.
Пример 10
При изготовлении инактивированных вакцин против ССЯ-76 особенно важно контролировать напряженность и длительность поствакцинального иммунитета, создаваемого вакциной.
В связи с этим изучали динамику иммунной реакции птиц, вакцинированных инактивированным препаратом, приготовленным из штамма "БИСС 113".
Начиная с 30 по 120 сут после прививки, с периодичностью 1 раз в месяц оценивали напряженность гуморального иммунитета в РТГА. Полученные результаты представлены в таблице 5.
Согласно представленным в таблице 5 данным следует, что в интервале от 1 до 6 мес вакцинированная птица обеих групп имела антитела к вирусу ССЯ-76 в высоких титрах. Существенных различий в уровне поствакцинального иммунитета, вызванного вакцинами из штаммов "БИСС 113" и "В8/78", не было установлено. Полученные данные позволили сделать заключение, что однократная вакцинация цыплят инактивированным препаратом из штамма "БИСС 113" в дозе 0,5 см3 обеспечивала формирование напряженного уровня антител к вирусу ССЯ-76 в течение всего срока исследования.
Пример 11
Проведена сравнительная оценка антигенной активности инактивированных вакцин против ССЯ-76, изготовленных из штаммов "БИСС 113" и "В8/78".
Вакцины готовили на основе масляного адъюванта "Монтанид ИЗА70" в соотношении адъюванта с антигеном 7:3 по весу. Антиген предварительно разводили ФБР в соотношении 1:3.
Активность цельного антигена в РГА была следующей:
штамм "БИСС" - 21 лог2;
штамм "В8/78" (образец 9) - 19 лог2;
штамм "В8/78" (образец 11) - 19 лог2;
штамм "В8/78" (образец 16) - 19 лог2;
штамм "В8/78" (образец 17) - 19 лог2.
Вакцины эмульгировали в течение 3 мин при 3000 об/мин.
Вакцины проверяли на антигенную активность, прививая птиц в возрасте 100 сут внутримышечно в дозе 0,5 см3, а при проверке безвредности вакцины вводили в дозе 1,5 см3 и птиц выдерживали в течение 10-12 сут. Все вакцины не вызывали никаких отклонений у птицы как в поведении, так и в местах введения препаратов. Сыворотки крови отбирали через 7,11, 30, 60 и 90 сут после вакцинации и исследовали в РТГА, а результаты выражали в лог2. Результаты исследований приведены в таблице 6.
Согласно данным таблицы 6 следует, что наиболее высокой антигенной активностью обладают вакцина из штамма "БИСС 113" и образцы 9 и 17 вакцины из штамма "В8/78".
Пример 12
Проверена динамика формирования поствакцинальных антител после применения инактивированной эмульсионной вакцины против ССЯ-76. изготовленной из производственного штамма "БИСС 113" так, как описано в примере 2. Результаты исследований приведены в таблице 7.
Пример 13
Проведена оценка антигенной активности инактивированной эмульсионной вакцины против ССЯ-76, приготовленной из штамма "БИСС 113", выращенного в эмбрионах SPF-кур. Адъювант "Монтанид ИЗА 70". Вакцина изготовлена так, как описано в примере 9.
Результаты исследований приведены в таблице 8.
Пример 14
Устойчивость генотипа производственного штамма "БИСС 113" проверяли после 10 пассажей на утиных эмбрионах. Аналогично ранее поставленным экспериментам были проведены контрольные вакцинации птиц. Каких-либо существенных отклонений от ранее установленных показателей оценки напряженности гуморального иммунитета обнаружено не было.
Таким образом, приведенная выше информация свидетельствует о выполнении при использовании предлагаемого изобретения следующей совокупности условий:
- штамм "БИСС 113" вируса ССЯ-76 птиц, воплощающий предлагаемое изобретение, предназначен для использования в сельском хозяйстве, а именно в ветеринарной вирусологии и биотехнологии;
- для предлагаемого изобретения в том виде, как оно охарактеризовано в независимом пункте формулы изобретения, подтверждена возможность его осуществления с помощью описанных в заявке известных до даты приоритета средств и методов;
- штамм вируса ССЯ-76 птиц, полученный в соответствии с предлагаемым изобретением, имеет морфологические свойства, характерные для аденовирусов птиц, свободен от контаминации чужеродными вирусами, микоплазмами, бактериальной и грибковой флорой, накапливается в аллантоисной жидкости эмбрионов с титром инфекционности 6,75±0,31 lg ЭИД50/0,2 см3 и в РГА с 1% суспензией эритроцитов петуха с активностью 18,0-21,0 лог2. В составе инактивированной вакцины "БИСС 113" при внутримышечном введении создает у птиц напряженный и продолжительный иммунитет против ССЯ-76.
Следовательно, предлагаемое изобретение соответствует условию патентоспособности "промышленная применимость".
Источники информации
1. Сюрин В. Н. и др. Вирусные болезни животных. - М., ВНИТИБП, 1998, 846-870.
2. Baxendale J., Lutticken D. and al. The results of field trials conducted with an inactivated vaccine against the Egg Drop Syndrome-76 (EDS-76). Avian Pathology, 1980, V.9, 1, 77-91.
3. Пат. СССР 1809836, С 12 N 7/00,15.04.93 г.
4. Пат. России 2097066; А 61 К 39/12, C 12 N 7/00, А 61 К 39/235; 27.11.97 г. (прототип).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 ПТИЦ | 2003 |
|
RU2239452C2 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 ПТИЦ | 2003 |
|
RU2233671C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ НЬЮКАСЛСКОЙ БОЛЕЗНИ ПТИЦ, ИНФЕКЦИОННОГО БРОНХИТА КУР, СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76, ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ И РЕОВИРУСНОГО ТЕНОСИНОВИТА ПТИЦ ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ | 2010 |
|
RU2443429C2 |
| ВАКЦИНА ОВАК ПРОТИВ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 ПТИЦ | 1995 |
|
RU2097066C1 |
| ВАКЦИНА ПРОТИВ ГРИППА ПТИЦ ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ | 2006 |
|
RU2323741C2 |
| ВАКЦИНА ПРОТИВ ГРИППА ПТИЦ ИНАКТИВИРОВАННАЯ ЭМУЛЬГИРОВАННАЯ ФЛУ ПРОТЕКТ Н5 И СПОСОБ ПРОФИЛАКТИКИ ГРИППА ПТИЦ | 2007 |
|
RU2350350C1 |
| ШТАММ "О" ВИРУСА ИНФЕКЦИОННОГО ЛАРИНГОТРАХЕИТА ПТИЦ ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2207372C1 |
| Инактивированная вакцина против синдрома снижения яйценоскости-76 птиц | 1989 |
|
SU1809836A3 |
| ВИРУСВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО ЛАРИНГОТРАХЕИТА ПТИЦ | 2002 |
|
RU2214277C1 |
| НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 КУР | 2000 |
|
RU2167673C1 |

Изобретение относится к ветеринарной вирусологии и биотехнологии. Штамм депонирован в коллекции микроорганизмов ВГНКИ под шифром "БИСС 113-ДЕП". Штамм обладает высокой биологической, антигенной и иммуногенной активностью и пригоден для изготовления эффективных инактивированных вакцинных препаратов. 8 табл.
Штамм "БИСС № 113" вируса синдрома снижения яйценоскости - 76, сем. Adenoviridae, род Aviadenovirus, серогруппа 3, коллекция ВГНКИ "БИСС № 113-ДЕП", для изготовления вакцинных препаратов.
| ВАКЦИНА ОВАК ПРОТИВ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 ПТИЦ | 1995 |
|
RU2097066C1 |
| Инактивированная вакцина против синдрома снижения яйценоскости-76 птиц | 1989 |
|
SU1809836A3 |
| СЮРИН В.Н | |||
| и др | |||
| Вирусные болезни животных - М.: ВНИТИБП, 1998, с | |||
| Способ осахаривания древесных опилок | 1922 |
|
SU846A1 |
Авторы
Даты
2004-01-20—Публикация
2002-06-10—Подача