Область техники
Изобретение относится к области анатомии, физиологии и патофизиологии кровообращения, клинической кардиологии и сердечно-сосудистой хирургии.
Изобретение может быть использовано:
- для диагностики состояния кровообращения и планирования тактики и объема хирургического вмешательства при операциях на сердце и сосудах по критерию восстановления и поддержания физиологической закрученной структуры потока крови;
- для конструирования имплантируемых органозамещающих устройств, применяемых в сердечно-сосудистой хирургии, включая протезы клапанов сердца, протезы кровеносных сосудов, полностью имплантируемое искусственное сердце и др., создающих и поддерживающих поток крови с физиологической закрученной структурой;
- для конструирования насосов, магистралей, канюль, используемых в системах вспомогательного и искусственного кровообращения, формирующих и поддерживающих заданную закрученную структуру потока крови;
- для физического моделирования кровообращения с исследовательскими и испытательными целями, предусматривающего возможность формирования потока модельной жидкости или крови с заданной закрученной структурой.
Предшествующий уровень техники
Проблема описания структуры потока крови и определение границ физиологической нормы кровообращения является одной из центральных проблем физиологии, клинической патофизиологии, кардиологии и кардиохирургии.
Первые результаты исследований структурной организации потока крови были получены методами скоростной киносъемки движения крови, визуализирующими перемещение рентгеноконтрастных составов, введенных в кровеносное русло. Было установлено, что в потоке крови имеются линии тока, часто соответствующие спирали, и практически отсутствует перемешивание струй при прохождении крови в центральных отделах сердечно-сосудистой системы - сердце и магистральных сосудах. Было показано, что поток крови в норме не является турбулентным, имеет тонкий пограничный слой на стенках проточного канала и характеризуется малой диссипацией энергии вдоль течения.
С появлением методов прямого измерения скорости крови в потоке (электромагнитные расходомеры, пленочные термоанемометры, импульсная ультразвуковая доплер-велосиметрия) было установлено, что не только малая толщина пограничного слоя, но и сложная форма профиля продольных скоростей в сердце и аорте не позволяют однозначно считать этот поток ламинарным или турбулентным.
Во второй половине 70-х годов на основании морфологических исследований и физического моделирования, а также методами киноангиографии и вентрикулографии было обнаружено:
- асимметричное сопряжение основных полостей в магистральной части сердечно-сосудистой системы, способствующее закручиванию струи;
- спиральная ориентация части внутрисердечных трабекул;
- фрагментарная визуализация закрутки потока крови в центральных отделах кровообращения;
- спиральная ориентация ядер эндотелиальных клеток в аорте, соответствующая направлению приложения сдвиговых напряжений.
Это позволило предположить, что поток крови в центральных отделах системы кровообращения движется в виде закрученной струи, однако прямой визуализации и определения структуры реального или модельного потока осуществить не удавалось.
Появление новых методов исследования потоков жидкости (МР-томография и МР-велосиметрия, цветная доплер-эхокардиография, лазерная анемометрия) открыло возможности для трехмерного измерения поля скоростей в потоке крови. Так, методом цветной доплер-эхокардиографии было показано наличие закрутки потока крови в аорте, а с помощью МР-велосиметрии зарегистрированы эпизоды осесимметричного закрученного потока крови в сердце и некоторых крупных артериях. Но и эти исследования не дали количественного описания закрученного потока крови в силу отсутствия аналитических или численных методов моделирования течения в канале сложной геометрической конфигурации, каким является кровеносное русло.
Тем не менее, на основании эмпирических наблюдений был предложен ряд изделий для кардиохирургии, предполагающих закрутку потока для улучшения их функциональных характеристик.
В силу отсутствия адекватной гидродинамической модели закрученных потоков при конструировании этих изделий не могли быть использованы количественные соотношения, связывающие характеристики течения крови с геометрией проточного канала формируемого русла. Помимо этого в этих предложениях не учитывались структурные особенности и нестационарность закрученного течения крови.
В результате моделируемый на основании этих предложений поток не мог восстановить нормальные гидродинамические характеристики системы кровообращения без образования застойных зон и зон отрыва потока, являющихся факторами, провоцирующими тромбообразование, травму крови и гиперплазию в кровеносном русле.
Поэтому предложения, представленные ниже в качестве прототипов, не могли быть использованы как функционально полноценные органозамещающие устройства для сердечно-сосудистой системы.
Так, известен способ для формирования потока крови на выходе из канюли, выбранный в качестве прототипа (патент RU 2233632 С1, 10.08.2004). Результат достигается, по мнению авторов патента-прототипа, за счет формирования вращательно-поступательного движения крови в криволинейном канале змеевикового типа; поток при этом активно взаимодействует с криволинейными стенками магистрали и приобретает закрутку. Закрутка потока крови этим способом, по утверждению авторов, сохраняется на определенной длине прямолинейного участка ниже по потоку.
Однако в этом известном способе не содержатся основания, по которым поток, закрученный вокруг оси криволинейной магистрали, приобретет и сохранит вращение вокруг собственной оси симметрии, не учитываются существенные потери энергии течения при взаимодействии потока со стенкой и основания для исключения застойных зон. Все параметры закрутки формируемого потока носят умозрительный, качественный характер и не имеют экспериментального подтверждения.
Недостатками прототипа помимо изложенных являются:
- отсутствие обоснования соответствия параметров закрученного потока крови и конструкции канюли (радиус, кривизна и шаг закрутки потока и др.) индивидуальным нормативным показателям кровообращения пациента;
- отсутствие заданных граничных условий закрученного течения в канюле, определяющих условия взаимодействия потока крови и стенок проточного канала;
- отсутствие заданных начальных условий формирования закрученного потока в змеевике, определяющих поле скоростей в течении, его пространственно-временные характеристики, форму проточного канала и направления движения потока;
- отсутствие учета нестационарности потока, проявляющейся в изменении значений составляющих скорости течения на протяжении сердечного цикла;
- ограничение конструкций возможных типов канюль лишь одной, предлагаемой в изобретении.
Известна канюля, представленная в прототипе, позволяющая, по мнению авторов, придавать потоку крови, пропущенному через змеевик спиралевидной формы, право- или левостороннюю закрутку. Подобное предложение не может быть реализовано в связи с тем, что поток приобретает направление движения, соответствующее пространственной ориентации стенок змеевика, и никак не может приобрести закрутку вокруг собственной оси и потому не является закрученным потоком.
Известен сосудистый протез, содержащий трубку, на внутренней поверхности которой выполнен рельеф для закрутки потока крови (RU 2153360 С2, 27.02.1995). Недостатком известного протеза является невозможность создания потока крови с заданными характеристиками, соответствующими индивидуальным нормативным показателям пациента.
Известен протез клапана сердца, содержащий элементы, направляющие поток крови, которые могут иметь осевую асимметрию, изогнутые створки и/или корпус, при обтекании которых формируется закрученный поток (WO 02/062271).
Недостатками известного устройства является отсутствие условий сшивки потока до клапана, на уровне клапана и после клапана. Такое несоответствие вызывает дополнительные потери энергии и возмущение потока на клапане, что увеличивает риск тромбоза, травмы крови и снижает функциональные характеристики устройства.
Известен насос для системы вспомогательного кровообращения, формирующий закрученный поток крови, содержащий камеру с клапанами, расположенными напротив друг друга, и направляющую в виде спирали Архимеда (GB 2371230, 24.07.2002).
Недостатком данного устройства является отсутствие условий сшивки течений до и после насоса, что не позволяет исключить формирование застойных зон и зон отрыва потока, а следовательно, повышает риск тромбообразования и травмы крови в проточной камере насоса.
Известно закручивающее устройство, выполненное в виде насадки, на внутренней поверхности которого расположены направляющие элементы (SU 699125 А, 30.11.1979). Недостатком известного устройства является то, что с его помощью невозможно формирование потока крови или модельной жидкости с заданными характеристиками закрутки.
Раскрытие изобретения
Количественный анализ кровообращения в целом и структуры потока крови в сердце и магистральных сосудах человека и появление данного изобретения стало возможно только после получения точных решений основных нестационарных уравнений гидродинамики для вязких жидкостей (Kiknadze G.I., Krasnov Yu.K. Evolution of a spout like flow of a viscous fluid. Sov. Phys. Dokl. 1986; 31 (10): 799-801). Эти решения позволили с достаточной полнотой описать формирование и эволюцию потока крови в сердце и магистральных сосудах человека, что положено в основу предлагаемого изобретения.
Техническим результатом предложенного способа является:
- создание программного и математического обеспечения для определения количественных характеристик закрученного потока крови на основе точных решений нестационарных уравнений гидродинамики для закрученных потоков вязкой жидкости при диагностике состояния кровообращения, лечении болезней сердечно-сосудистой системы, конструировании имплантируемых и паракорпоральных органозамещающих устройств для сердечно-сосудистой хирургии, а также создании исследовательских и испытательных стендов, имитирующих различные состояния кровообращения;
- создание методов анализа состояния кровообращения с помощью точных решений нестационарных уравнений гидродинамики для закрученных потоков и формирование базы индивидуальных нормативных показателей кровообращения, основанной на концепции о закрученной структуре потока крови;
- создание принципов планирования и разработка тактики хирургического лечения больных с патологией сердца и сосудов, обеспечивающие возможность возврата состояния кровообращения к индивидуальной норме путем восстановления и поддержания закрученной структуры потока крови;
- создание способа формирования потока крови с заданной структурой, соответствующего точным решениям нестационарных уравнений гидродинамики для закрученных потоков вязкой жидкости, при обтекании устройств, имплантируемых в кровеносное русло, и при моделировании кровообращения в экспериментальных стендах;
- создание имплантируемых и паракорпоральных устройств для сердечно-сосудистой хирургии, позволяющих частично или полностью восстановить индивидуальные нормативные показатели кровообращения за счет формирования физиологической закрученной структуры потока крови;
- создание исследовательских и испытательных стендов, имитирующих широкий диапазон состояний кровообращения, в том числе закрученное течение крови или модельной жидкости.
Технический результат, достигаемый при использовании способа, основан на установленном факте, что поток крови в системе кровообращения человека и животных представляет собой закрученную струю. Поле скоростей и поле давления в этой струе определены точными решениями нестационарных уравнений гидродинамики вязкой жидкости (см. уже цитированную статью Kiknadze G.I., Krasnov Yu.K. Evolution of a spout like flow of a viscous fluid. Sov. Phys. Dokl. 1986; 31(10)). При этом обнаружены механизмы формирования и регуляции закрученной струи в сердце и магистральных сосудах (Кикнадзе Г.И., Олейников В.Г., Гачечиладзе И.А., Городков А.Ю., Доброва Н.Б., Бакей Ш., Бара Ж.-Л. О структуре потока в левом желудочке сердца и аорте на основании точных решений нестационарных уравнений гидродинамики и морфометрических исследований. Доклады Академии наук (ДАН) 1996, т.351, с.119-122); вычислены количественные значения основных параметров закрученной струи крови в аорте в норме у здоровых добровольцев (Городков А.Ю., Николаев Д.А. Анализ динамических характеристик закрученного потока крови на основании измерения геометрических параметров проточного канала с помощью МР-томографии. Бюл. НЦССХ им. А.Н.Бакулева РАМН. 2003, №9, с.67-69; Бокерия Л.А., Городков А.Ю., Кикнадзе Г.И. и др. Анализ поля скоростей закрученного потока крови в аорте на основании 3D картирования с помощью МР-велосиметрии. Бюл. НЦССХ им. А.Н.Бакулева РАМН. 2003, №9, с.70-74). Результаты последних исследований показали, что точные решения нестационарных уравнений гидродинамики адекватно отражают состояние кровообращения не только в норме, но и при патологии, при этом основным компенсаторным фактором, определяющим процесс ремоделирования сердца, является циркуляция потока, зависящая от азимутальной компонентой скорости. Так, показана возможность компенсации до 90% стеноза митрального клапана или до 85% регургитации митрального клапана за счет изменения азимутальной составляющей скорости (Бокерия Л.А., Городков А.Ю., Кикнадзе Г.И., Николаев Д.А., Ключников И.В., Алшибая М.Д. Анализ механизмов компенсации и ремоделирования левого желудочка при патологическом изменении геометрии полости. XI Научная сессия НЦССХ им. А.Н.Бакулева РАМН, Москва 13-15 мая 2007 г. Бюл. НЦССХ им. А.Н.Бакулева РАМН, 2007, т.8, №3: 200). Таким образом, точные решения позволяют провести анализ кровообращения при различных состояниях сердечно-сосудистой системы.
Обнаруженная закономерность закрутки потока крови и механизмы его формирования были экспериментально и теоретически исследованы и идентифицированы для физиологически нормального состояния организма. При этом использовали посмертные морфологические измерения сердца и аорты, динамическую реконструкцию аорты с помощью МР-томографии, измерение поля скоростей потока крови в аорте здоровых добровольцев с помощью МР-велосиметрии и количественный анализ закрученного потока крови с помощью точных решений Кикнадзе-Краснова, описывающих такие течения.
Указанный выше технический результат достигается при использовании предлагаемого в изобретении способа формирования потока крови в хирургически реконструируемых сегментах системы кровообращения, который заключается в проведении диагностики индивидуального состояния системы кровообращения пациента, измерении поля скоростей потока крови в камерах сердца и магистральных сосудах, сопоставлении измеренных параметров с физиологической нормой, определении параметров, формирующих закрученный поток крови, моделировании индивидуального закрученного течения крови в диагностируемой системе кровообращения и в исследовательских стендах, при этом обтекаемым поверхностям и направляющим элементам проточных каналов реконструируемой системы кровообращения придают формы, соответствующие линиям тока восстановленного нормально закрученного течения крови с соответствии с соотношениями:
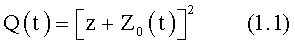

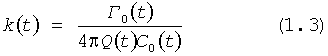
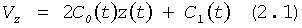
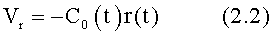
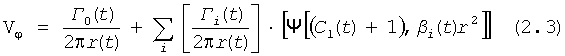
где Vr, Vz, Vφ - радиальная, продольная и тангенциальная составляющие скорости закрученного течения, ν - кинематическая вязкость среды, φ0 - начальный угол закрутки по отношению к радиусу потока, φ, z и r - текущие значения угловой, продольной и радиальной координат вдоль линии тока, Q(t), Z0(t), k(t), Г0(t) и C0(t) - параметры закрученного потока крови, зависящие от времени в силу нестационарности течения и соответствующие индивидуальным нормативным показателям для физиологического закрученного потока крови; Q0(t), - функция, пропорциональная объему закрученной струи крови, циклически меняющаяся в зависимости от фазы сердечного сокращения; C0(t) - индивидуальная характеристика закрученного потока - радиального градиента скорости; Z0(t) - индивидуальный нормативный показатель кровообращения; Г0(t) - индивидуальная характеристика закрученного потока - главной циркуляции потока; k(t) - параметр закрученного потока крови, зависящий от времени; Q(t) - индивидуальный объем крови, пропорциональный объемной скорости изгнания из левого желудочка в аорту; Z0(t) - индивидуальный продольный размер струи, пропорциональный изменению пропорционального размера сердца; k(t) - мера поворота струи в момент времени t сердечного цикла; Г0(t) - циркуляция закрученной струи; C0(t) - радиальный градиент скорости.
Диагностику потока крови осуществляют с помощью любых, в том числе ультразвуковых и магнитно-резонансных, методов измерения скорости, причем программное обеспечение выбранного метода измерения потока крови основано на использовании точных решений нестационарных уравнений гидродинамики для закрученных потоков вязкой жидкости и обеспечивает формирование базы нормативных показателей, определение пределов компенсаторного резерва системы кровообращения пациента, обоснование критериев декомпенсации по параметрам Q(t), Z0(t), k(t), Г0(t) и C0(t) закрученного потока крови, характеристику состояния кровообращения пациента на этапах планирования и оценки результата лечения, а также создание проектно-конструкторской документации для изготовления любых устройств, учитывающих закрученную структуру потока крови.
На обтекаемых поверхностях и направляющих в проточных каналах устройств выполняют рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Обтекаемые поверхности и направляющие элементы реконструируемой системы выполняют подвижными и/или эластичными.
Техническим результатом использования сосудистого протеза, предлагаемого в изобретении, является обеспечение внутри протеза потока крови, соответствующего по своей структуре физиологическому закрученному потоку, свободного от застойных зон и зон отрыва, снижающего риск тромбообразования, травмы крови и гиперплазии русла в месте имплантации протеза.
Сосудистый протез содержит трубку, на внутренней поверхности которой выполнен профиль для закрутки потока крови в соответствии с соотношениями (1.1-1.3) и локализацией реконструируемого сегмента.
На внутренней поверхности протеза выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Трубка может быть выполнена из эластичного био- и гемосовместимого материала, например синтетической вязаной ткани, обеспечивающего соответствие формы проходного сечения зависящим от времени нормативным показателям потока крови Q(t) и Z0(t) вдоль сосудистого русла на протяжении всего сердечного цикла.
Техническим результатом использования канюли, предлагаемой в изобретении, является обеспечение внутри канюли потока крови, соответствующего по своей структуре физиологическому закрученному потоку, свободного от застойных зон и зон отрыва, снижающего риск тромбообразования, травмы крови и гиперплазии русла в месте имплантации протеза. При этом поток крови на входе и выходе из канюли сопряжен (сшит) по значениям скоростей и давления с потоком крови, входящим в канюлю, и потоком крови в сосуде, следующем за канюлей.
Канюля для устройств паракорпоральной перфузии содержит проточный канал, на внутренней поверхности которого выполнен продольный профиль для закрутки потока крови, форма которого определяется соотношениями (1.1-1.3), учитывающими конкретную локализацию места введения канюли в сосудистое русло.
На внутренней поверхности канюли может быть выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Часть канала может содержать направляющие в виде ребер, канавок или лопаток, форма которых определяется соотношениями (1.1-1.3) в соответствии с конкретной локализацией места введения канюли в сосудистое русло.
Канюля может быть выполнена из эластичного материала, податливость которого обеспечивает вдоль проточного русла канюли в каждый момент сердечного цикла соответствие параметров Q(t), Z0(t) индивидуальным нормативным показателям кровообращения.
Техническим результатом использования протеза клапана сердца, предлагаемого в изобретении, является обеспечение транспротезного потока крови, соответствующего по своей структуре физиологическому закрученному потоку, свободного от застойных зон и зон отрыва, снижающего риск тромбообразования, травмы крови.
Протез клапана сердца содержит один или несколько запирающих элементов, размещенных центрально-симметрично в корпусе круглого и/или овального сечения, при этом на обтекаемых поверхностях клапана выполнен профиль в соответствии с соотношениями (1.1-1.3).
На обтекаемых поверхностях запирающих элементов и корпуса клапана выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Техническим результатом использования насоса для перекачки крови, предлагаемого в изобретении, является обеспечение в рабочей камере насоса и на выходе из нее закрученного потока, свободного от застойных зон и зон отрыва, что снижает риск тромбообразования и травмы крови. Формируемый поток на входе и выходе из насоса сопряжен (сшит) по полю скоростей и давления с потоками крови в местах его подключения.
Насос для перекачки крови содержит узел закрутки потока, проточный канал и клапаны на входе и выходе из канала, при этом на обтекаемой кровью поверхности выполнен рельеф, изменяющийся во времени в соответствии с соотношениями (1.1-1.3).
На поверхностях насоса, обтекаемых кровью, выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Насос для перекачивания крови, имеющий на входной части проточного канала направляющие в виде ребер, канавок или лопаток, геометрическая форма которых определяется соотношениями (1.1-1.3) и соответствует параметрам диастолического потока.
Насос для перекачивания крови, имеющий на выводной части проточного канала направляющие в виде ребер, канавок или лопаток, геометрическая форма которых определяется соотношениями (1.1-1.3) и соответствует параметрам систолического потока. При этом рельеф, соответствующий систолическому изгнанию, и рельеф, соответствующий диастолическому наполнению рабочей камеры насоса, плавно переходят один в другой.
Клапаны насоса могут быть выполнены по описанной выше конструкции протезов клапанов сердца.
Канал насоса может быть выполнен по конструкции канюли, описанной выше.
Техническим результатом использования закручивающего устройства, предлагаемого в изобретении, является формирование закрученного потока крови или модельной жидкости с заданным полем скоростей и давления, соответствующих различным моделируемым состояниям кровообращения.
Закручивающее устройство содержит насадок, на обтекаемой поверхности которого выполнены направляющие в виде ребер, канавок или лопаток, форма которых определяется соотношениями (1.1-1.3), причем угол закрутки направляющих относительно оси потока может произвольно изменяться оператором или специальным устройством для моделирования различных условий течения.
На обтекаемых кровью поверхностях устройства может быть выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка, при этом сопряжение углублений с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Краткое описание чертежей изобретения
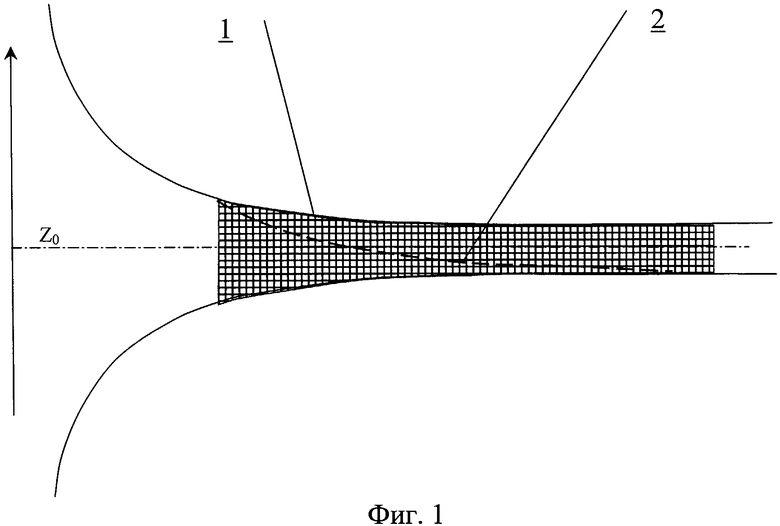
На фиг.1 представлен сосудистый протез.
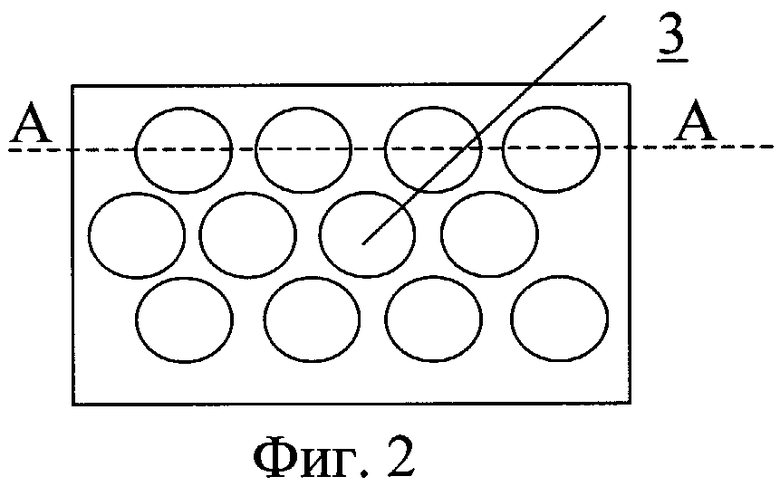
На фиг.2 - размещение на внутренней поверхности сосуда углублений.
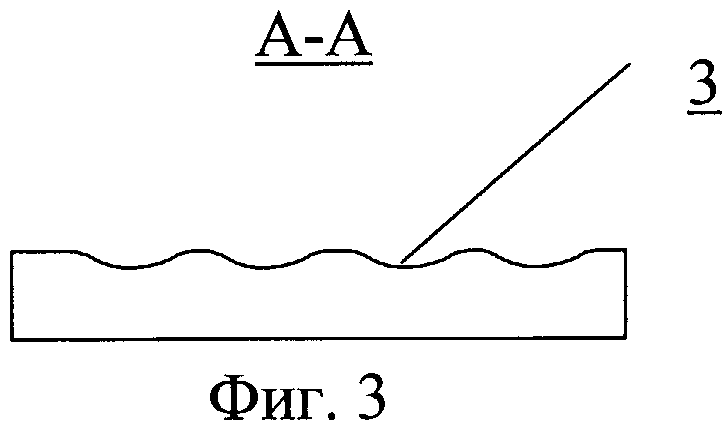
На фиг.3 - разрез А-А по фиг.2.
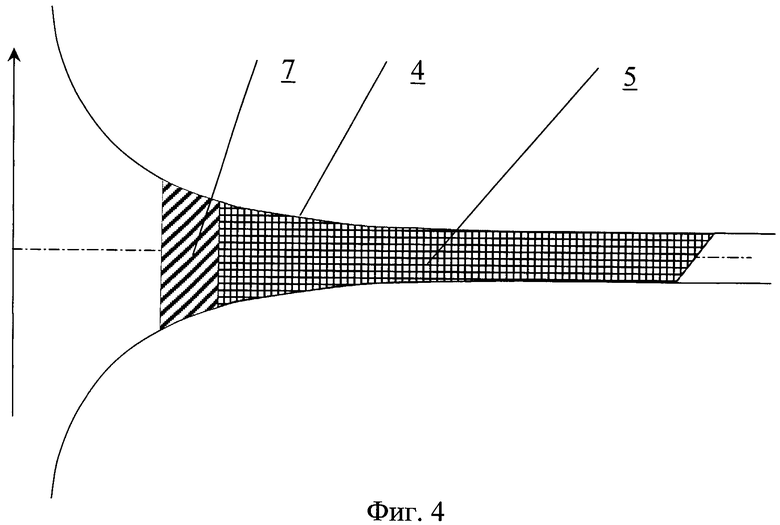
На фиг.4 представлена канюля.
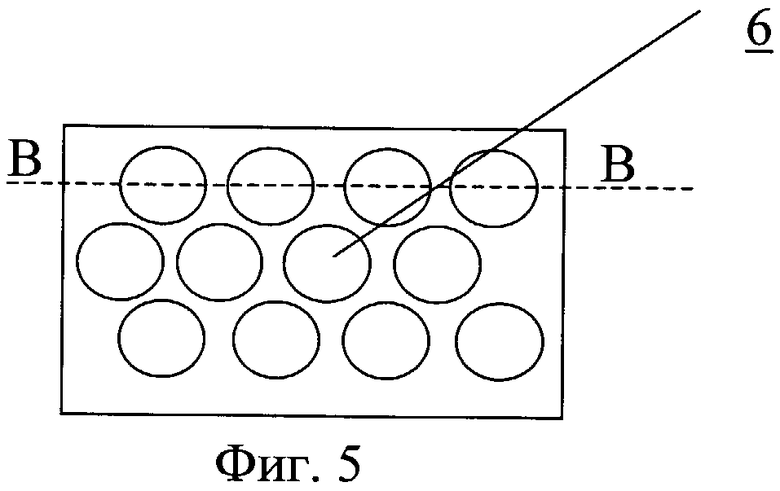
На фиг.5 - размещение на внутренней поверхности углублений.
На фиг.6 - разрез В-В по фиг.5.
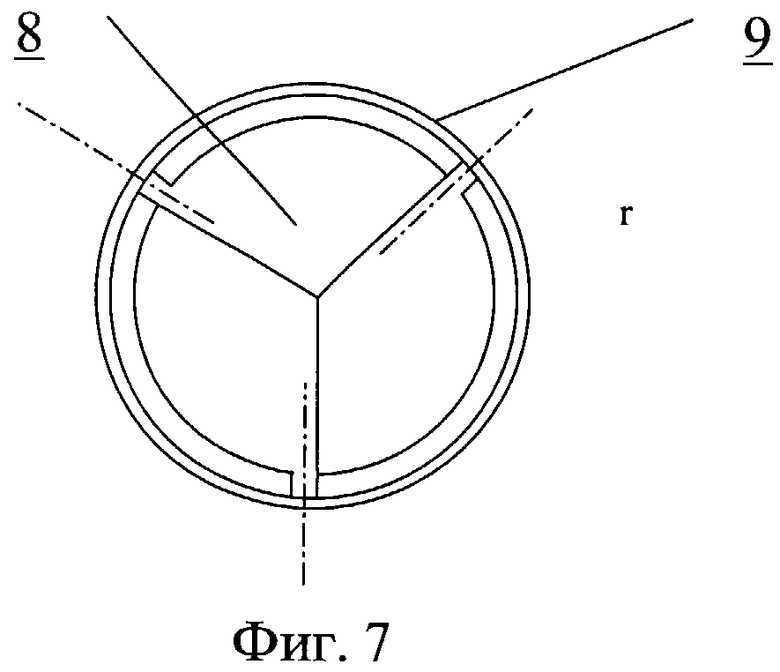
На фиг.7 - закрытый клапан сердца
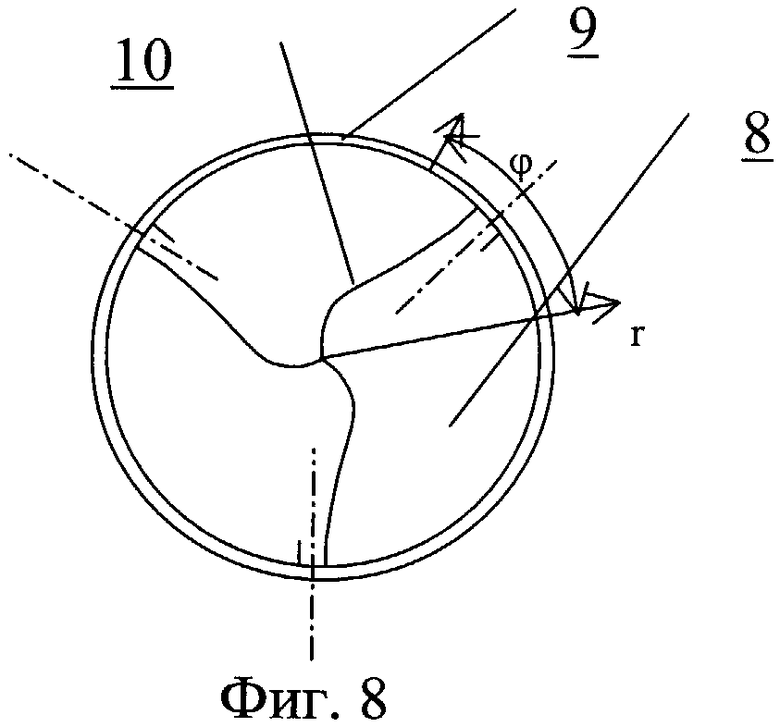
На фиг.8 - открытый клапан сердца.
На фиг.9 - створка клапана сердца.
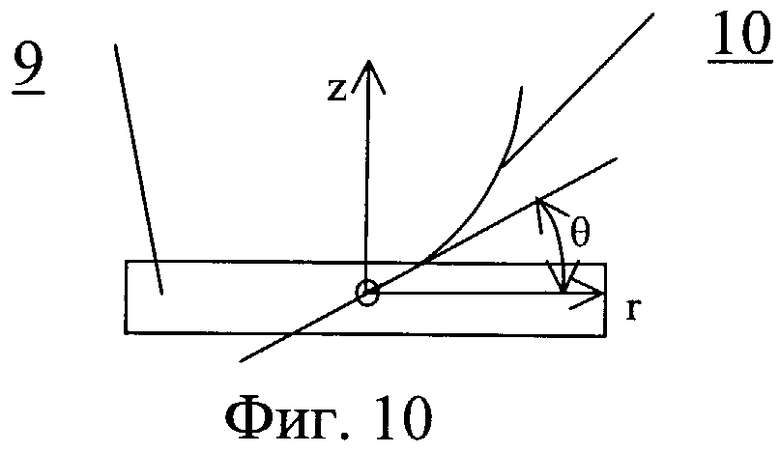
На фиг.10 - профиль клапана с открытой створкой
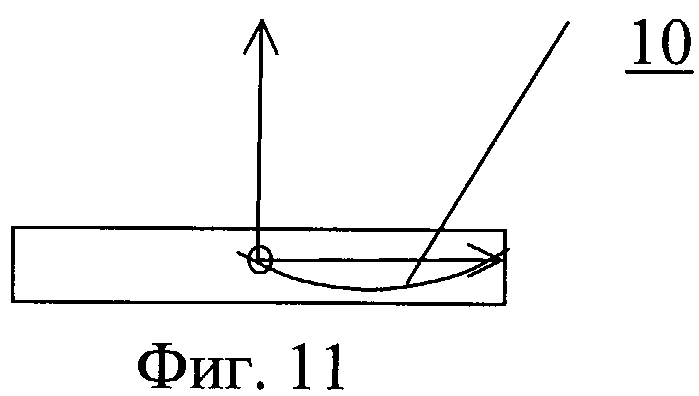
На фиг.11 - профиль клапана с закрытой створкой.
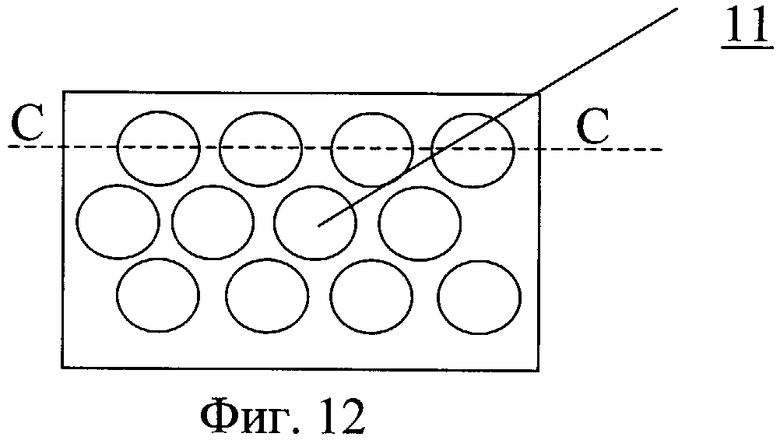
На фиг.12 - размещение углублений на внутренней поверхности.
На фиг.13 - разрез С-С по фиг.12.
На фиг.14 - поперечный разрез насоса.
На фиг.15 - продольный разрез насоса.
На фиг.16 - размещение на внутренней поверхности углублений.
На фиг.17 - разрез D-D по фиг.16.
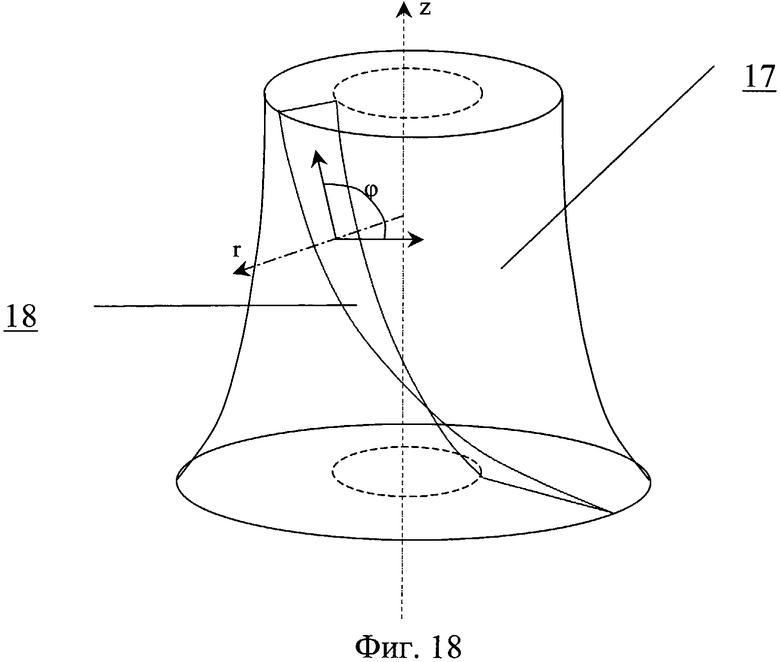
На фиг.18 - закручивающее устройство.
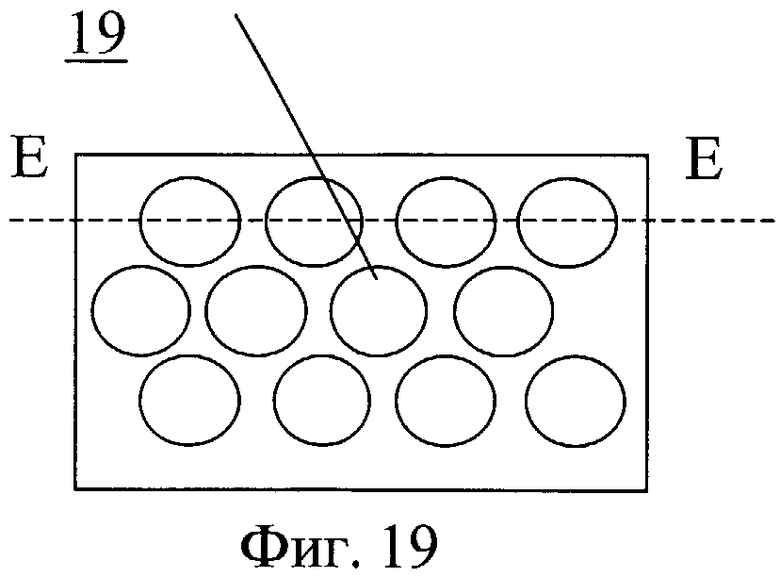
На фиг.19 - размещение углублений на внутренней поверхности закручивающего устройства.
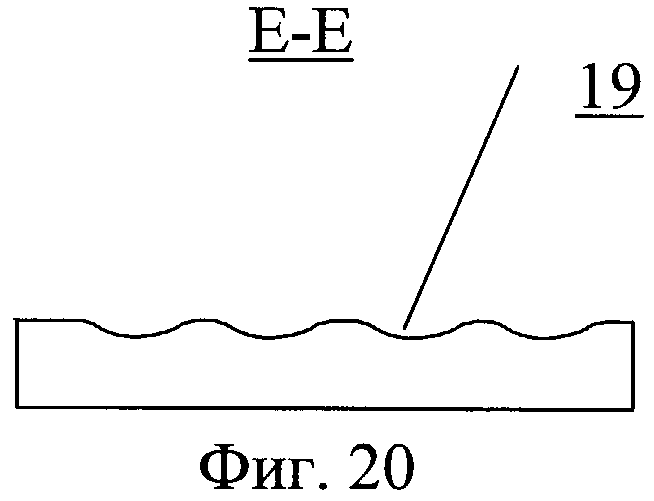
На фиг.20 - разрез Е-Е по фиг.19.
Варианты осуществления изобретения
Морфологическими, функциональными и экспериментальными методами доказано, что пульсирующий поток крови в сердце и магистральных сосудах имеет закрученную структуру, благодаря которой транспорт крови осуществляется без потерь энергии, формирования зон отрыва потока и застойных зон.
Количественный анализ структуры формируемого потока крови, механизмов его генерации и эволюции в сердце и магистральных сосудах, проведенный с помощью точных решений нестационарных уравнений гидродинамики для центростремительных потоков вязкой жидкости (Kiknadze G.I., Krasnov Yu.K. Evolution of a spout like flow of a viscous fluid. Sov. Phys. Dokl. 1986; 31(10): 799-801), позволил на основании экспериментальных и клинических исследований доказать соответствие полученных точных решений известным закономерностям физиологии кровообращения. В результате была сформулирована концепция, согласующая особенности закрученного течения крови и функции кровообращения (Кикнадзе Г.И., Олейников В.Г., Гачечиладзе И.А., Городков А.Ю., Доброва Н.Б., Бакей Ш., Бара Ж.-Л. О структуре потока в левом желудочке сердца и аорте на основании точных решений нестационарных уравнений гидродинамики и морфометрических исследований. Доклады Академии наук (ДАН) 1996, т.351, с.119-122; Городков А.Ю. Анализ структуры внутрисердечного закрученного потока крови на основании морфометрии трабекулярного рельефа левого желудочка сердца. Бюл. НЦССХ им. А.Н.Бакулева РАМН. 2003, №9, с.63-66).
Современное представление о природе закрученного потока крови в сердце, аорте и магистральных артериях состоит в том, что главным компонентом течения крови в условиях физиологической нормы, как указывалось выше, является формируемая на выходе из сердца закрученная струя, эволюционирующая в ходе сердечного сокращения под действием внутрисердечного трабекулярного рельефа. Прохождение закрученной струи вдоль кровеносного русла сопряжено с формированием устойчивых локализованных возвратных и вторичных течений, однако результирующий поток движется в аорте без зон отрыва и застойных зон и обеспечивает физиологически нормальное распределение крови по региональным бассейнам. При этом результирующий поток содержит совокупность всех закрученных течений, определяемых соотношениями (2.1-2.3), так же как доминантная закрученная струя, изгоняемая из сердца в результате сердечного сокращения.
В камерах сердца в зависимости от формы и пространственной ориентации трабекул и папиллярных мышц формируется закрученный поток крови в виде смерчеобразной струи, характеризуемой радиальным градиентом скорости C0(t), циркуляцией крови в вихре Г0(t) и начальной координатой Z0(t) в соответствии с точными решениями нестационарных уравнений гидродинамики для класса закрученных потоков Кикнадзе-Краснова:
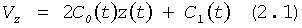
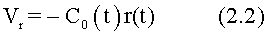
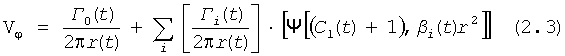
где Vr, Vz, Vφ - радиальная, продольная и тангенциальная составляющие скорости закрученного течения, r(t), z(t) и φ(t) - цилиндрические координаты, начало которых совмещено с единственной точкой Z0(t) внутри проточного канала, в которой Vr=Vz=Vφ=0, причем положение этой точки меняется в зависимости от времени, перемещаясь вдоль потока; Q(t) - индивидуальный объем крови, пропорциональный объемной скорости изгнания из левого желудочка в аорту; Z0(t) - индивидуальный продольный размер струи, пропорциональный изменению пропорционального размера сердца; k(t) - мера поворота струи в момент времени t сердечного цикла; Г0(t) - циркуляция закрученной струи; C0(t) - радиальный градиент скорости; C0(t), Г0(t) и Гi(t) - индивидуальные характеристики закрученного потока - соответственно радиальный градиент скорости, главная циркуляция и множественные i-е циркуляции среды в закрученном потоке, возникающие в композиции вихрей, объединенных одной доминантной циркуляцией,
Ψ[(C1+1), βi(t)r2] - неполная гамма-функция Эйлера, ответственная за диссипацию энергии в закрученном течении вязкой жидкости, управляющая этим процессом посредством индивидуального для каждого потока фактора:
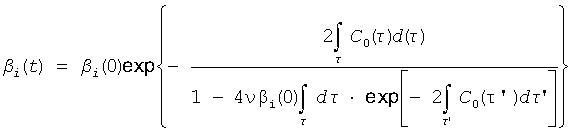
в котором ν - кинематическая вязкость среды, вовлеченной в закрученное течение.
Интеграл Коши-Эйлера, представляющий для таких течений изменение давления в процессе сердечного цикла, в частном случае, когда C1(t)=0, Г0(t)=Г1(t) доминирующая циркуляция и все остальные циркуляции, начиная с Г2(t)=0. Другими словами, интеграл Коши-Эйлера, определяющий изменение давления в доминирующей закрученной струе, имеет вид:
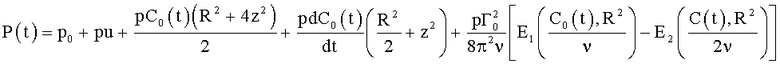
где E1 и E2 - известные интегральные показательные функции 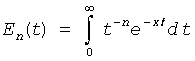 n-го порядка
n-го порядка
Обнаруженное течение (2.1-2.3) потенциально в продольном и радиальном направлениях и в связи с этим сопровождается незначительной диссипацией энергии потока, происходящей лишь в узкой приосевой зоне закрученной струи, поперечный размер (радиус) которой определяется соотношением:
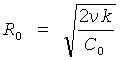
где k - коэффициент диссипации. Величина радиуса при характерных значениях вязкости и скорости течения в потоке крови составляет R≈1,5÷2,0 мм. Поэтому при радиусе закрученной струи крови 10-25 мм, соответствующем характерным размерам проточного канала для аорты и левого желудочка, диссипация энергии пренебрежимо мала и течение крови практически квазипотенциально.
Наблюдения за формируемой в сердце закрученной струей указывают, что эта струя имеет единственную циркуляцию и доминирует в просвете аорты в течение значительной части сердечного цикла, находясь в окружении возвратных закрученных течений с остаточными циркуляциями от предыдущего сердечного цикла, так же определяемых соотношениями (2.1-2.3). Доминирующая струя обладает единственной циркуляцией Г0, приобретенной благодаря спиральной пространственной ориентации трабекул и папиллярных мышц в полости левого желудочка сердца, формирующих изгоняемый закрученный поток крови, описываемый соотношениями (3.1-3.3).


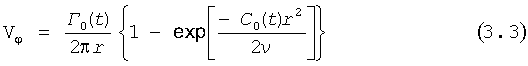
где Vr, Vz, Vφ, r, z, φ, C0(t), Г0(t) и ν определены выше.
Соответствие структуры физиологического закрученного потока крови точным решениям Кикнадзе-Краснова было доказано морфометрическими и клиническими функциональными исследованиями. Такие же закономерности присутствуют и в правых отделах сердца.
В самом деле, в работе (Городков А.Ю. Анализ структуры внутрисердечного закрученного потока крови на основании морфометрии трабекулярного рельефа левого желудочка сердца. Бюл. НЦССХ им. А.Н.Бакулева РАМН. 2003, №9, с.63-66) проведен анализ пространственной архитектоники проточного канала левого желудочка сердца. По совокупности признаков, определяющих различные фазы сердечного цикла, установлено, что трабекулярный рельеф левого желудочка сердца обнаруживает две независимые спирально организованные системы трабекул: одну - проявляющуюся при напряжении миокарда в систоле, другую - при диастолическом расслаблении миокарда. Эти две системы трабекул ориентированы по линиям тока, определяемым соотношениями (3.1-3.3), и выполняют роль направляющих лопаток, формирующих закрученную струю крови в ходе сердечного цикла. При наполнении левого желудочка поток обтекает структуры свободной стенки, рельеф которой выполнен трабекулями, составляющими профиль диастолического наполнения; при сердечном сокращении напряжение папиллярных мышц и продольных трабекул передней стенки левого желудочка приводит к проявлению и направлению потока на альтернативный рельеф, формирующий поток, изгоняемый в аорту. Пространственная организация трабекул и при наполнении желудочка, и при изгнании крови в аорту соответствует форме линий тока закрученного течения Кикнадзе-Краснова.
В работе (Городков А.Ю., Николаев Д.А. Анализ динамических характеристик закрученного потока крови на основании измерения геометрических параметров проточного канала с помощью МР-томографии. Бюл. НЦССХ им. А.Н.Бакулева РАМН. 2003, №9, с.67-69) приведены прижизненные измерения геометрии проточного канала аорты с помощью МР-томографии. На основании контуров серии сечений канала была произведена динамическая трехмерная реконструкция аорты. Адекватность реконструкции проверяли по измерению радиуса входного участка, объема и длины реконструированного сегмента аорты. Показано, что изменение этих величин в течение одного сердечного цикла соответствуют логике сердечного сокращения и изгнания в аорту.
В работе (Бокерия Л.А., Городков А.Ю., Кикнадзе Г.И., Николаев Д.А., Гачечиладзе И.А. Анализ поля скоростей закрученного потока крови в аорте на основании трехмерного картирования с помощью МР-велосиметрии. Бюл. НЦССХ им. А.Н.Бакулева РАМН. 2003, №9, с.70-74) проведен анализ поля скоростей в аорте на основании МР-велосиметрии. Рассчитанные по экспериментальным данным характеристики закрученного потока крови показали, что линии тока в аорте являются непрерывным продолжением систолического трабекулярного рельефа левого желудочка. Все это позволяет заключить, что поток крови в левом желудочке и аорте по своей структуре соответствует классу закрученных течений Кикнадзе-Краснова.
Проведенные исследования позволяют утверждать, что единственным способом формирования физиологического потока крови как в кровеносном русле, так и в имплантатах для сердечно-сосудистой хирургии является применение в качестве основного количественного критерия точных решений Кикнадзе-Краснова.
Этот способ обеспечивает гидродинамическую совместимость с физиологическим потоком, предотвращает формирование застойных зон и зон отрыва потока, снижает риск тромбообразования и травмы крови, предупреждает пластические изменения русла в случае неадекватного распределения сдвиговых напряжений на стенках.
Учитывая вышеизложенное, в настоящем изобретении предлагается способ диагностики состояния кровообращения и лечения заболеваний сердца и сосудов путем формирования закрученного потока крови. Такой поток должен формироваться в соответствии с индивидуальными нормативными показателями при реконструктивных операциях на сердце и сосудах, а также в конструкциях имплантатов для сердечно-сосудистой системы, используя в качестве количественного критерия точные решения нестационарных уравнений гидродинамики для класса закрученных течений Кикнадзе-Краснова.
Способ формирования потока крови в хирургически реконструируемых сегментах системы кровообращения заключается в том, что проводят диагностику индивидуального состояния системы кровообращения пациента, измеряют поле скоростей потока крови в камерах сердца и магистральных сосудах, определяют параметры, формирующие закрученный поток крови, моделируют индивидуальное течение крови в диагностируемой системе кровообращения, при этом обтекаемым поверхностям и направляющим элементам проточных каналов реконструируемой системы кровообращения придают формы, соответствующие линиям тока восстановленного нормально закрученного течения крови с соответствии с соотношениями (1.1-1.3; 3.1-3.3).
Диагностику потока крови осуществляют с помощью любых, в том числе ультразвуковых и магнитно-резонансных, методов измерения скорости, причем программное обеспечение выбранного метода измерения потока крови основано на использовании точных решений нестационарных уравнений гидродинамики для закрученных потоков вязкой жидкости и обеспечивает формирование базы нормативных показателей, определение пределов компенсаторного резерва системы кровообращения пациента, обоснование критериев декомпенсации по параметрам Q(t), Z0(t), k(t), Г0(t) и C0(t) закрученного потока крови, характеристику состояния кровообращения пациента на этапах планирования и оценки результата лечения, а также создание проектно-конструкторской документации для изготовления любых устройств, учитывающих закрученную структуру потока крови.
На обтекаемых поверхностях и направляющих выполняют рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Обтекаемые поверхности и направляющие элементы реконструируемой системы выполняют подвижными и/или эластичными.
Сосудистый протез содержит трубку, на внутренней поверхности которой выполнен профиль для закрутки потока крови в соответствии с соотношением (1.1) для конкретной локализации протезируемого сегмента.
На внутренней поверхности протеза выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Трубка может быть выполнена из эластичного био- и гемосовместимого материала, например синтетической вязаной ткани, обеспечивающего соответствие формы проходного сечения канала для потока крови нормативным параметрам течения Q(t) и Z0(t) вдоль сосудистого русла на протяжении всего сердечного цикла.
Канюля для устройств паракорпоральной перфузии содержит проточный канал, на внутренней поверхности которого выполнен продольный профиль для закрутки потока крови в соответствии с соотношениями (1.1-1.3) в соответствии с конкретной локализацией места введения канюли в сосудистое русло.
На внутренней поверхности канюли может быть выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Часть канала может содержать направляющие в виде ребер, канавок или лопаток с углом закрутки, определяемым соотношениями (1.1-1.3) в соответствии с конкретной локализацией места введения канюли в сосудистое русло.
Канюля может быть выполнена из эластичного материала, податливость которого обеспечивает вдоль проточного канала в каждый момент сердечного цикла соответствие параметров Q(t), Z0(t) индивидуальным нормативным показателям.
Протез клапана сердца содержит один или несколько запирающих элементов, размещенных центрально-симметрично в корпусе круглого и/или овального сечения, при этом на обтекаемых поверхностях клапана выполнен профиль в соответствии с соотношениями (1.1-1.3).
На обтекаемых поверхностях запирающих элементов и корпусе клапана выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Насос для перекачки крови содержит проточный канал и клапаны на входе и выходе из канала, при этом на обтекаемой кровью поверхности выполнен рельеф, изменяющийся вдоль потока в соответствии с соотношениями (1.1-1.3).
На обтекаемых кровью поверхностях насоса выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Насос дополнительно содержит на выводной части обтекаемой поверхности проточного канала направляющие в виде ребер, канавок или лопаток с углом закрутки
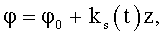
где ks(t) - зависящий от времени параметр закрученного потока крови, соответствующий нормативному показателю для систолического потока.
На входной части обтекаемой поверхности насоса выполнены направляющие в виде ребер, канавок или лопаток с углом закрутки 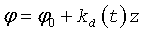 ,
,
где kd(t) - зависящий от времени параметр закрученного потока крови, соответствующий нормативному показателю для диастолического потока.
Клапаны насоса могут быть выполнены описанной выше конструкцией протезов клапанов сердца.
Канал насоса может быть выполнен по конструкции канюли, описанной выше.
Закручивающее устройство содержит насадок, на обтекаемой поверхности которого выполнены направляющие в виде ребер, канавок или лопаток, форма которых определена соотношениями (1.1-1.3), причем угол закрутки потока может произвольно изменяться оператором или специальным устройством для моделирования различных условий течения.
На обтекаемых кровью поверхностях закручивающего устройства может быть выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка. При этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
Способ осуществляется следующим образом:
- измеряют поле скоростей потока крови в камерах сердца и магистральных сосудах пациента, моделируют индивидуальное течение крови в диагностируемой системе кровообращения, используя гидродинамическую модель и программное обеспечение, основанные на точных решениях нестационарных уравнений гидродинамики для закрученных смерчеобразных потоков несжимаемой вязкой жидкости, компоненты скорости которого Vz, Vr и Vφ представлены для доминирующей закрученной струи соотношениями (3.1, 3.2, 3.3), а для полной струи в аорте соотношениями (2.1, 2.2, 2.3), или
- выполняют картирование поля скоростей потока крови в камерах сердца и сосудах пациента любыми, в том числе ультразвуковыми и магнитно-резонансными, методами; обрабатывают результаты с помощью программного обеспечения на основе точных решений нестационарных уравнений гидродинамики; рассчитывают характеристические параметры индивидуального закрученного потока, используя данные картирования и результаты оценки состояния системы кровообращения, полученные рутинными методами; определяют локализацию патологических изменений потока крови и степень отклонения структуры потока от индивидуальной физиологической нормы;
- на основании проведенного анализа оценивают степень необходимой хирургической коррекции геометрии камер сердца кровеносного русла, определяют тактику хирургического вмешательства исходя из необходимости обеспечить всюду вдоль потока крови продольно-радиальный и радиально-азимутальный профили русла, максимально приближенные к соотношениям:
в продольно-радиальной плоскости:
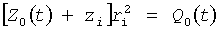
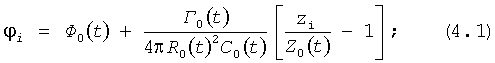
- в радиально-азимутальной плоскости:
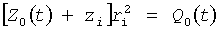
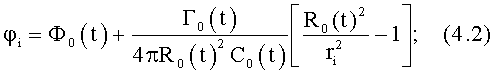
где zi, ri, φi, Z0(t)=z-zi, R0(t)=r-ri, Г0(t), C0(t), Ф0(t)=φi(t)-{[Г0(t)/4πR0(t)2C0(t)] [(R0(t)2/ri 2)-1]} определены выше, Q0(t) - функция, пропорциональная объему закрученной струи крови, циклически меняющаяся в зависимости от фазы сердечного сокращения, при этом мгновенные значения Q0(t) по всей длине кровеносного русла в любой момент времени сердечного цикла постоянны и рассчитываются по данным картирования поля скоростей закрученного потока крови;
- осуществляют по совокупности результатов диагностики, расчетных данных и моделирования течения крови хирургическое лечение патологически измененного сегмента системы кровообращения, подбирая оптимальную тактику геометрической реконструкции и/или конструкцию протеза пораженного сегмента русла путем восстановления формы, адекватной физиологически нормальному закрученному потоку за счет корректировки геометрических параметров и/или нанесения на обтекаемую поверхность направляющего рельефа, выбираемых на основе гидродинамической модели, и направляют поток в это русло, обеспечивая при этом сшивку полей скорости и давления потока с аналогичными полями, существующими в системе кровообращения пациента;
- осуществляют по совокупности результатов диагностики, расчетных данных и моделирования течения крови кардиохирургическое лечение пораженных сегментов сердечно-сосудистой системы пациента, требующее подключения аппаратов искусственного кровообращения и/или использования других паракорпоральных устройств, в которых геометрические формы и рельефы проточных каналов оптимизированы с целью сшивки поля скоростей и давления в системе кровообращения пациента с полем скоростей и давления в подключаемых аппаратах, при этом форму подключаемого контура моделируют на основе гидродинамической модели, учитывающей значения величин Q0(t), Г0(t), C0(t), Z0(t), R0(t), Ф0(t), измеренных в процессе диагностики потока крови в организме пациента, а конструкцию используемого аппарата паракорпорального кровообращения оборудуют соответствующей системой управления, контролирующей характеристики закрученного потока крови и геометрическую конфигурацию эластичных магистралей контура для приближения параметров потока крови в аппарате к параметрам потока в системе кровообращения пациента на основании соотношений (4.1) и (4.2);
- осуществляют по совокупности результатов диагностики, расчетных данных и моделирования течения крови кардиохирургическое лечение, требующее подключения насоса для вспомогательного кровообращения или полностью имплантируемого искусственного сердца, в которых геометрические формы и рельефы проточных каналов оптимизированы с целью сшивки поля скоростей и давления в подключаемых устройствах с полем скоростей и давления в системе кровообращения пациента, при этом форму результирующего проточного канала моделируют на основе гидродинамической модели, учитывающей значения величин Q0(t), Г0(t), C0(t), Z0(t), R0(t), Ф0(t), измеренных в процессе диагностики потока крови в организме пациента, а конструкцию устройств оборудуют соответствующей системой управления, контролирующей характеристики закрученного потока крови и геометрическую конфигурацию эластичных магистралей контура для приближения параметров потока крови в аппарате к параметрам потока в системе кровообращения пациента на основании соотношений (4.1) и (4.2);
- проводят контроль эффективности предпринятого хирургического лечения, определяя степень соответствия структуры закрученного потока крови индивидуальным нормативным показателям путем проведения анализа данных послеоперационного картирования поля скоростей в потоке крови и рутинных диагностических приемов и методов.
Реализация способа формирования потока поясняется примерами устройств.
Сосудистый протез содержит трубку 1, на внутренней поверхности которой выполнен профиль 2 для закрутки потока крови (фиг.1). На внутренней поверхности трубки может быть выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений 3. Протез может быть как жестким, так и обладать эластичными стенками.
Канюля содержит проточный канал 4, на внутренней поверхности которого выполнен продольный профиль 5 для закрутки потока крови (фиг.4). На внутренней поверхности может быть выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений 6. Часть канала канюли может содержать направляющие в виде ребер, канавок или лопаток с регулируемым углом закрутки. Канюля может быть выполнена из эластичного материала. Канюля может использоваться в комбинации с закручивающим устройством 7.
Протез клапана сердца содержит один или несколько запирающих элементов 8, размещенных центрально-симметрично в корпусе круглого и/или овального сечения 9 (фиг.7-11). Обтекаемая кромка запирающего элемента клапана в открытом состоянии должна соответствовать профилю 10, повторяющему ориентацию линии тока закрученного течения крови. На обтекаемых поверхностях может быть выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной поверхности в виде углублений 11.
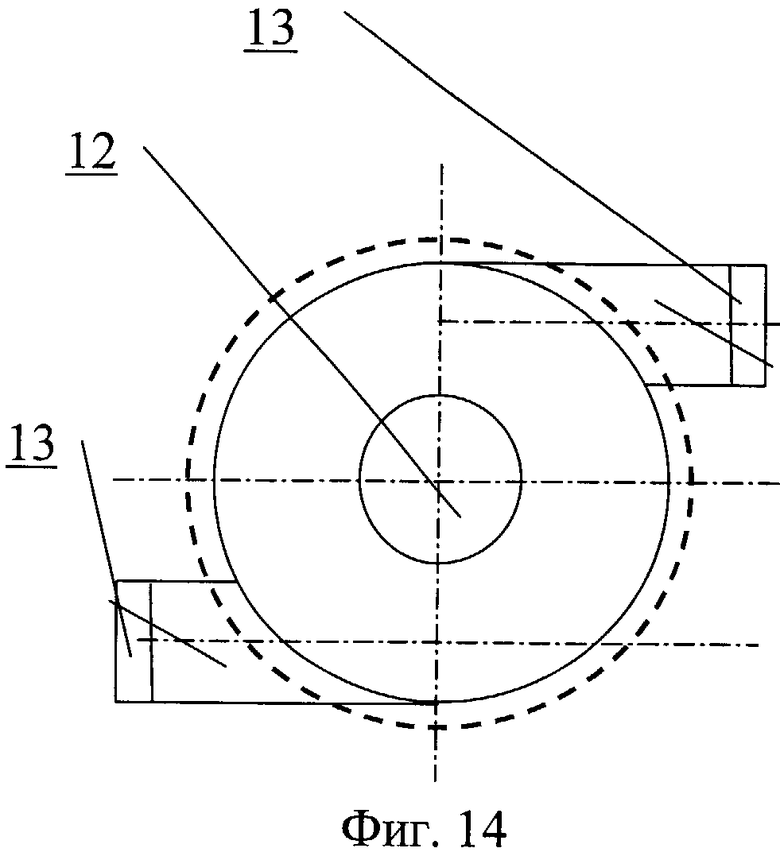
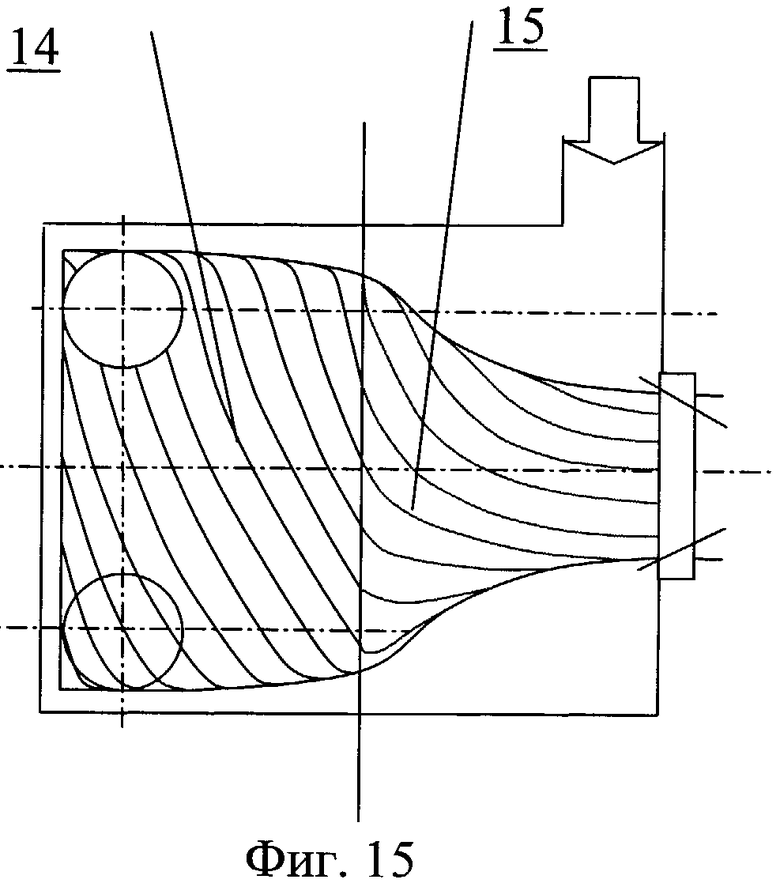
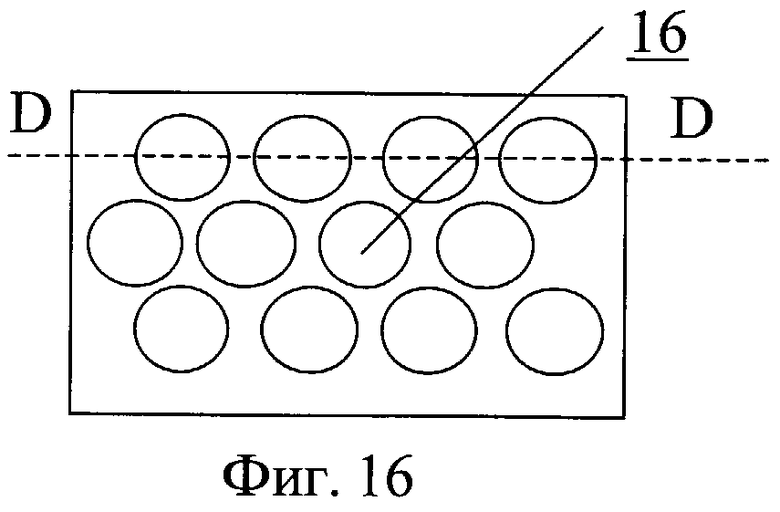
Насос для перекачки крови содержит проточный канал 12 и клапаны 13 на входе и выходе из канала (фиг.14, фиг.15). На обтекаемой поверхности входной части насоса выполнен профиль 14 для закрутки потока крови, наполняющего насос. На обтекаемой поверхности выводной части насоса выполнен профиль 15 для закрутки потока крови, изгоняемого из насоса. На обтекаемых поверхностях может быть выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной поверхности в виде углублений 16. На входной и/или выводной части проточного канала могут быть выполнены ребра, канавки или лопатки с регулируемым углом закрутки.
Закручивающее устройство выполнено в виде насадки 17, на обтекаемой поверхности которого выполнены направляющие 18 для закрутки потока в виде ребер, канавок или лопаток с регулируемым углом наклона. На обтекаемой поверхности может быть выполнен рельеф 19, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной поверхности в виде углублений.
Насосы и магистрали вспомогательного искусственного желудочка сердца, аппаратов искусственного кровообращения, полностью имплантируемого искусственного сердца и/или других паракорпоральных аппаратов рассчитывают, конструируют и изготавливают в соответствии с соотношениями (1.1-1.3; 2.1-2.3; 3.1-3.3; 4.1-4.2), а проточные каналы, контактирующие с потоком крови в этих устройствах, могут быть съемными и изготавливаются, при необходимости, индивидуально для конкретного пациента, при этом эластичность, геометрические формы, размеры и поверхностный рельеф каналов рассчитывают, конструируют и изготавливают в соответствии со значениями величин Q0(t), Г0(t), C0(t), Z0(t), R0(t), Фо(t), измеренных в процессе диагностики состояния кровообращения. Это обеспечивает формирование в этих устройствах закрученного смерчеобразного потока крови, соответствующего индивидуальной физиологической норме. В этом случае поток, формируемый по указанным соотношениям, удовлетворяет условиям сшивки поля скоростей и давления в подсоединяемом устройстве с полем скоростей и давления в потоке крови пациента, формируемом его сердцем при постепенном отключении вспомогательного и/или искусственного кровообращения. Причем аппараты искусственного и вспомогательного кровообращения и имплантируемое искусственное сердце, сконструированные с учетом соотношений (1.1-1.3; 2.1-2.3; 3.1-3.3; 4.1-4.2), формируют закрученный поток крови, соответствующий индивидуальной физиологической норме в течение всего времени имплантации.
Работа приведенных выше устройств осуществляется следующим образом.
Имплантируемые или паракорпоральные устройства (сосудистые протезы, протезы клапанов, искусственное сердце, устройства для вспомогательного кровообращения, канюли, аппараты искусственного кровообращения) включаются в кровеносное русло путем прямого подсоединения;
в испытательных и исследовательских стендах устройства для закрутки потока, изготовленные в соответствии с соотношениями (1.1-1.3; 2.1-2.3; 3.1-3.3; 4.1-4.2), включаются непосредственно в циркуляционный контур, имитирующий условия кровообращения.
Рельеф, нанесенный на обтекаемую поверхность, формирует закрученное течение крови или модельной жидкости в соответствии с решениями Кикнадзе-Краснова посредством взаимодействия с вязким потоком.
Производимая таким образом структурная организация потока позволяет получить физиологически адекватное течение крови или модельной жидкости без застойных зон и зон отрыва потока.
Промышленная применимость
Изобретение может быть применено для:
- создания программного обеспечения, используемого при измерении потока крови с исследовательскими и/или лечебными целями любыми методами, в том числе ультразвуковыми и магнитно-резонансными;
- определения для представительной стандартной выборки добровольцев физиологических норм кровообращения с учетом закрученной структуры потока крови;
- определения и идентификации индивидуальной структурной организации потока крови в сердце и магистральных сосудах пациента;
- планирования и проведения реконструктивных кардиохирургических вмешательств, предпринимаемых с целью восстановления нормальной геометрии кровеносного русла пациента, поддерживающей закрученную структуру потока крови;
- создания математического и программного обеспечения для индивидуального подбора конструкции имплантируемых органозамещающих устройств, поддерживающих нормальную закрученную структуру потока крови пациента;
- конструирования органозамещающих устройств для сердечно-сосудистой хирургии (протезов клапанов сердца и сосудистых протезов), восстанавливающих адекватную геометрию кровеносного русла пациента, обладающих повышенной безопасностью за счет формирования закрученной структуры потока крови;
- конструирования имплантируемых и паракорпоральных насосов для вспомогательного кровообращения и полностью имплантируемого искусственного сердца, а также устройств для их подключения, предусматривающих формирование закрученного потока крови внутри насоса и поддержание закрученной структуры потока крови в системе кровообращения с целью повышения эффективности и безопасности этих устройств;
- конструирования паракорпоральных насосов и контуров (аппараты искусственного кровообращения, паракорпоральные системы, поддерживающие жизненно важные функции - аппараты искусственная почка, искусственная печень и др.), их магистралей и аксессуаров (канюли, теплообменники, фильтры и др.), формирующих и поддерживающих структуру закрученного потока крови с целью повышения эффективности и безопасности этих устройств;
- конструирования исследовательских стендов для физического и математического моделирования различных состояний кровообращения в исследовательских целях с учетом закрученной структуры физиологического потока крови;
- конструирования испытательных стендов для оценки функциональных свойств имплантируемых органозамещающих устройств для сердечно-сосудистой хирургии в условиях закрученного потока модельной жидкости или крови с заданными характеристиками;
- конструирования специальной обтекаемой поверхности в перечисленных устройствах с целью создания условий течения в пограничном слое, препятствующих активации свертывающей системы крови и системы комплемента, оседанию и накоплению компонентов крови, травме клеточных элементов крови и другим явлениям, способным привести к гемолизу, патологической иммунной реакции, тромбообразованию и гиперплазии.
| название | год | авторы | номер документа |
|---|---|---|---|
| АОРТАЛЬНЫЙ ТРЕХСТВОРЧАТЫЙ ПРОТЕЗ КЛАПАНА СЕРДЦА | 2010 |
|
RU2434604C1 |
| ПЕРЕКАЧИВАЮЩЕЕ УСТРОЙСТВО ДЛЯ ПРАВЫХ ОТДЕЛОВ СЕРДЦА ПРИ СЛОЖНЫХ ВРОЖДЕННЫХ ПОРОКАХ СЕРДЦА, ТРЕБУЮЩИХ ПРОВЕДЕНИЯ ОПЕРАЦИИ ФОНТЕНА-ПРАВЫЙ НЕОЖЕЛУДОЧЕК | 2012 |
|
RU2523700C1 |
| Способ отсасывания пограничного слоя сплошной среды с поверхности тела и устройство для его реализации | 2018 |
|
RU2691705C1 |
| СПОСОБ СМЕРЧЕВОГО ПРЕОБРАЗОВАНИЯ ЭНЕРГИИ СПЛОШНОЙ СРЕДЫ, СМЕРЧЕВОЙ ПРЕОБРАЗОВАТЕЛЬ ЭНЕРГИИ (ВАРИАНТЫ), ПРЕОБРАЗОВАТЕЛЬ СОЛНЕЧНОЙ ЭНЕРГИИ, СПОСОБ МАГНИТОТЕПЛОВОГО ПРЕОБРАЗОВАНИЯ ЭНЕРГИИ, СМЕРЧЕВОЙ ПРЕОБРАЗОВАТЕЛЬ МАГНИТОТЕПЛОВОЙ ЭНЕРГИИ, СМЕРЧЕВОЙ НАГНЕТАТЕЛЬ И СМЕРЧЕВАЯ ТУРБИНА | 2008 |
|
RU2386857C1 |
| ПОВЕРХНОСТЬ ТЕЛА ДЛЯ УМЕНЬШЕНИЯ ТРЕНИЯ И ПОВЕРХНОСТЬ ТЕЛА ДЛЯ ИНТЕНСИФИКАЦИИ ТЕПЛООБМЕНА | 2006 |
|
RU2425260C2 |
| ПРОТЕЗ МИТРАЛЬНОГО КЛАПАНА СЕРДЦА | 2017 |
|
RU2641388C1 |
| ПОЛНОПРОТОЧНЫЙ ПРОТЕЗ КЛАПАНА СЕРДЦА | 2015 |
|
RU2580906C1 |
| ПРОТЕЗ КЛАПАНА СЕРДЦА | 2011 |
|
RU2477105C1 |
| ПРОТЕЗ МИТРАЛЬНОГО КЛАПАНА СЕРДЦА, ПОДДЕРЖИВАЮЩИЙ СМЕРЧЕОБРАЗНУЮ СТРУКТУРУ ПОТОКА КРОВИ | 2022 |
|
RU2793511C1 |
| ПОВЕРХНОСТЬ ОБТЕКАНИЯ ДЛЯ ФОРМИРОВАНИЯ ДИНАМИЧЕСКИХ ВИХРЕВЫХ СТРУКТУР В ПОГРАНИЧНЫХ И ПРИСТЕННЫХ СЛОЯХ ПОТОКОВ СПЛОШНЫХ СРЕД | 1992 |
|
RU2020304C1 |
Группа изобретений относится к клинической кардиологии и сердечно-сосудистой хирургии. Способ заключается в проведении диагностики индивидуального состояния системы кровообращения пациента, измерении поля скоростей потока крови в камерах сердца и магистральных сосудах, сопоставлении измеренных параметров с физиологической нормой, определении параметров, формирующих закрученный поток крови, моделировании индивидуального закрученного течения крови в диагностируемой системе кровообращения, при этом обтекаемым поверхностям и направляющим элементам проточных каналов реконструируемой системы кровообращения придают формы, соответствующие линиям тока восстановленного нормально закрученного течения крови в соответствии с приведенными соотношениями. Раскрыты устройства для осуществления способа: сосудистый протез, канюля, протез клапана сердца, насос для перекачки крови, закручивающее устройство. Технический результат, достигаемый изобретениями, состоит в исключении застойных зон и снижении риска тромбообразования, травмы крови и гиперплазии кровяного русла. 6 н. и 15 з.п. ф-лы, 20 ил.
1. Способ формирования потока крови в хирургически реконструируемых сегментах системы кровообращения, характеризующийся тем, что проводят диагностику индивидуального состояния системы кровообращения пациента, измеряют поле скоростей потока крови в камерах сердца и магистральных сосудах, определяют параметры, формирующие закрученный поток крови, моделируют индивидуальное течение крови в диагностируемой системе кровообращения, при этом обтекаемым поверхностям и направляющим элементам проточных каналов реконструируемой системы кровообращения хирургическими методами или с помощью конструкции органозамещающих имплантируемых устройств придают формы, соответствующие линиям тока восстановленного нормально закрученного течения крови с соответствии с соотношениями
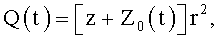
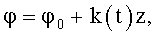
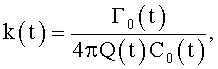
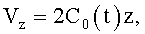
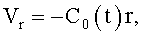
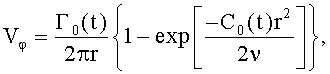
где φ0 - начальный угол закрутки по отношению к нормали оси потока; φ, z и r - текущие значения угловой, продольной и радиальной координат вдоль линии тока; Vr, Vz, Vφ - радиальная, продольная и тангенциальная составляющие скорости закрученного течения; ν - кинематическая вязкость среды, вовлеченной в закрученное течение; Q(t) - функция, пропорциональная объему закрученной струи крови, циклически меняющаяся в зависимости от фазы сердечного сокращения; C0(t) - индивидуальная характеристика закрученного потока - радиального градиента скорости; Z0(t) - индивидуальный нормативный показатель кровообращения; Г0(t) - индивидуальная характеристика закрученного потока - главной циркуляции потока; k(t) - параметр закрученного потока крови, зависящий от времени.
2. Способ по п.1, в котором диагностика потока крови осуществляется с помощью любых, в том числе ультразвуковых и магнитно-резонансных методов измерения скорости, причем программное обеспечение выбранного метода измерения потока крови основано на использовании точных решений нестационарных уравнений гидродинамики для закрученных потоков вязкой жидкости и обеспечивает формирование базы нормативных показателей, определение пределов компенсаторного резерва системы кровообращения пациента, обоснование критериев декомпенсации по параметрам Q(t), Z0(t), k(t), Г0(t) и C0(t) закрученного потока крови, характеристику состояния кровообращения пациента на этапах планирования и оценки результата лечения, а также создание проектно-конструкторской документации для изготовления любых устройств, учитывающих закрученную структуру потока крови.
3. Способ по п.1, в котором на обтекаемых поверхностях и направляющих выполняют рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка, при этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
4. Способ по п.1 или 2, в котором обтекаемые поверхности и направляющие элементы реконструируемой системы выполняют подвижными и/или эластичными.
5. Сосудистый протез, характеризующийся тем, что содержит трубку, на внутренней поверхности которой выполнен профиль для закрутки потока крови в соответствии с соотношением
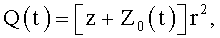
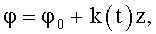
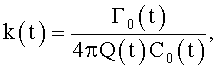
где φ0 - начальный угол закрутки по отношению к нормали оси потока; φ, z и r - текущие значения угловой, продольной и радиальной координат вдоль линии тока; Vr, Vz, Vφ - радиальная, продольная и тангенциальная составляющие скорости закрученного течения; ν - кинематическая вязкость среды, вовлеченной в закрученное течение; Q(t) - функция, пропорциональная объему закрученной струи крови, циклически меняющаяся в зависимости от фазы сердечного сокращения; C0(t) - индивидуальная характеристика закрученного потока - радиального градиента скорости; Z0(t) - индивидуальный нормативный показатель кровообращения; Г0(t) - индивидуальная характеристика закрученного потока - главной циркуляции потока; k(t) - параметр закрученного потока крови, зависящий от времени.
6. Протез по п.5, в котором на внутренней поверхности выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка, при этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
7. Протез по п.6, в котором трубка выполнена из эластичного био- и гемосовместимого материала, например синтетической вязаной ткани, обеспечивающего соответствие формы проходного сечения канала для потока крови нормативным параметрам потока крови Q(t) и Z0(t) вдоль сосудистого русла на протяжении всего сердечного цикла.
8. Канюля для устройств паракорпоральной перфузии, характеризующаяся тем, что содержит проточный канал, на внутренней поверхности которого выполнен продольный профиль для закрутки потока крови в соответствии с соотношением
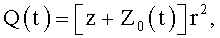
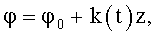
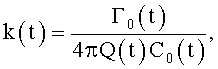
где φ0 - начальный угол закрутки по отношению к нормали оси потока; φ, z и r - текущие значения угловой, продольной и радиальной координат вдоль линии тока; Vr, Vz, Vφ - радиальная, продольная и тангенциальная составляющие скорости закрученного течения; ν - кинематическая вязкость среды, вовлеченной в закрученное течение; Q(t) - функция, пропорциональная объему закрученной струи крови, циклически меняющаяся в зависимости от фазы сердечного сокращения; C0(t) - индивидуальная характеристика закрученного потока - радиального градиента скорости; Z0(t) - индивидуальный нормативный показатель кровообращения; Г0(t) - индивидуальная характеристика закрученного потока - главной циркуляции потока; k(t) - параметр закрученного потока крови, зависящий от времени.
9. Канюля по п.8, в которой на внутренней поверхности выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка, при этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
10. Канюля по п.8 или 9, в которой, по крайней мере, часть канала содержит направляющие в виде ребер, или канавок, или лопаток с углом закрутки
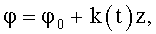
где φ0 - начальный угол закрутки по отношению к нормали оси потока; φ и z - текущие значения угловой и продольной координат вдоль линии тока; k(t) - параметр нестационарного закрученного потока крови, соответствующий индивидуальным нормативным показателям по п.1, в соответствии с конкретной локализацией места введения канюли в сосудистое русло.
11. Канюля по п.8 или 9, выполненная из эластичного материала, в которой податливость обеспечивает соответствие параметров Q(t) Z0(t) индивидуальным нормативным показателям по п.1 вдоль проточного канала в каждый момент сердечного цикла.
12. Протез клапана сердца, характеризующийся тем, что содержит один или несколько запирающих элемента, размещенных центрально-симметрично в корпусе круглого и/или овального сечения, при этом на обтекаемых поверхностях клапана выполнен профиль в соответствии с соотношениями
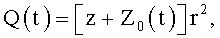
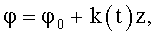
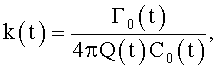
где φ0 - начальный угол закрутки по отношению к нормали оси потока; φ, z и r - текущие значения угловой, продольной и радиальной координат вдоль линии тока; Vr, Vz, Vφ - радиальная, продольная и тангенциальная составляющие скорости закрученного течения; ν - кинематическая вязкость среды, вовлеченной в закрученное течение; Q(t) - функция, пропорциональная объему закрученной струи крови, циклически меняющаяся в зависимости от фазы сердечного сокращения; C0(t) - индивидуальная характеристика закрученного потока - радиального градиента скорости; Z0(t) - индивидуальный нормативный показатель кровообращения; Г0(t) - индивидуальная характеристика закрученного потока - главной циркуляции потока; k(t) - параметр закрученного потока крови, зависящий от времени.
13. Протез по п.12, в котором на обтекаемой поверхности запирающих элементов и корпуса выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка, при этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
14. Насос для перекачки крови, характеризующийся тем, что содержит узел сжатия потока, проточный канал и клапаны на входе и выходе из канала, при этом на обтекаемой кровью поверхности выполнен изменяющийся во времени рельеф, соответствующий соотношениям
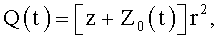
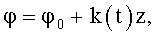
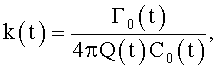
где φ0 - начальный угол закрутки по отношению к нормали оси потока; φ, z и r - текущие значения угловой, продольной и радиальной координат вдоль линии тока; Vr, Vz, Vφ - радиальная, продольная и тангенциальная составляющие скорости закрученного течения; ν - кинематическая вязкость среды, вовлеченной в закрученное течение; Q(t) - функция, пропорциональная объему закрученной струи крови, циклически меняющаяся в зависимости от фазы сердечного сокращения; C0(t) - индивидуальная характеристика закрученного потока - радиального градиента скорости; Z0(t) - индивидуальный нормативный показатель кровообращения; Г0(t) - индивидуальная характеристика закрученного потока - главной циркуляции потока; k(t) - параметр закрученного потока крови, зависящий от времени.
15. Насос по п.14, в котором на поверхностях, обтекаемых кровью, выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка, при этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
16. Насос по п.14 или 15, который дополнительно содержит на выводной части обтекаемой поверхности проточного канала направляющие в виде ребер, или канавок, или лопаток с углом закрутки
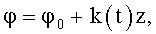
где φ0 - начальный угол закрутки по отношению к нормали оси потока; φ и z - текущие значения угловой и продольной координат вдоль линии тока; ks(t) - зависящий от времени параметр закрученного потока крови по п.1, соответствующий нормативному показателю для систолического потока.
17. Насос по п.14 или 15, в котором на входной части обтекаемой поверхности выполнены направляющие в виде ребер, или канавок, или лопаток с углом закрутки
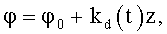
где φ0 - начальный угол закрутки по отношению к нормали оси потока; φ и z - текущие значения угловой и продольной координат вдоль линии тока; kd(t) - зависящий от времени параметр закрученного потока крови по п.1, соответствующий нормативному показателю для диастолического потока.
18. Насос по п.14 или 15, в котором клапаны на входе или на выходе выполнены в виде протезов клапанов сердца по п.12 или 13.
19. Насос по п.14 или 15, канюли и магистрали которого выполнены в виде канюли по п.8 или 9.
20. Закручивающее устройство, характеризующееся тем, что содержит насадок, на обтекаемой поверхности которого выполнены направляющие в виде ребер, или канавок, или лопаток с углом закрутки
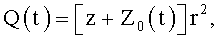
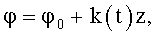
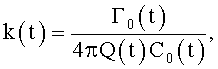
где φ0 - начальный угол закрутки по отношению к нормали оси потока; φ, z и r - текущие значения угловой, продольной и радиальной координат вдоль линии тока; Vr, Vz, Vφ - радиальная, продольная и тангенциальная составляющие скорости закрученного течения; ν - кинематическая вязкость среды, вовлеченной в закрученное течение; Q(t) - функция, пропорциональная объему закрученной струи крови, циклически меняющаяся в зависимости от фазы сердечного сокращения; C0(t) - индивидуальная характеристика закрученного потока - радиального градиента скорости; Z0(t) - индивидуальный нормативный показатель кровообращения; Г0(t) - индивидуальная характеристика закрученного потока - главной циркуляции потока; k(t) - параметр закрученного потока крови, зависящий от времени.
21. Закручивающее устройство по п.20, в котором на обтекаемых кровью поверхностях выполнен рельеф, представляющий собой участки исходно гладкой поверхности, чередующиеся с участками криволинейной формы в виде углублений, каждое из которых образовано сопряженными по общим касательным выпуклыми и вогнутыми поверхностями второго порядка, при этом сопряжение углубления с исходно гладкой поверхностью осуществляется с помощью выпуклых поверхностей, образующих скаты, для которых в местах сопряжения исходно гладкая поверхность является касательной.
| СОСУДИСТАЯ КАНЮЛЯ | 2002 |
|
RU2233632C1 |
| Протез легочной артерии | 1986 |
|
SU1362467A1 |
| Протез аортального клапана | 1987 |
|
SU1544418A1 |
| Протез клапана сердца | 1987 |
|
SU1475649A1 |
| SU 1614289 A, 15.11.1994 | |||
| US 6162017 A, 19.12.2000 | |||
| US 4857046 A, 15.08.1989. | |||
Авторы
Даты
2012-03-20—Публикация
2007-08-09—Подача