Изобретение относится к применению микроорганизма, принадлежащего к группе молочнокислых бактерий или мутанту или его производному, характеризующегося тем, что он способен к специфическому связыванию с бактерией, принадлежащей к группе mutans Streptococci, при котором специфическое связывание характеризуется: (i) стойкостью к тепловой обработке; и/или (ii) стойкостью к протеолитической обработке; и/или (iii) зависимостью от кальция; и/или (iv) формированием при pH в пределах между 4.5 и 8.5; и/или (v) формированием в присутствии слюны, для изготовления противокариозной композиции для лечения или предупреждения кариеса, вызванного mutans Streptococci, другими, чем Streptococcus mutans. Предпочтительно, специфическое связывание может быть проанализировано следующим образом:
(a) выращивание названного микроорганизма до стационарной фазы;
(b) смешивание названного микроорганизма с бактерией, принадлежащей к группе мутантов Streptococci, которая была выращена до стационарной фазы;
(c) инкубирование смеси, полученной на этапе (b) при условиях, позволяющих образование агрегатов названного микроорганизма и бактерии из группы mutans Streptococci; и
(d) определение агрегатов по наличию осадка в пробирке.
Другой объект настоящего изобретения представляет собой способ профилактики или лечения кариеса, вызванного mutans Streptococci, другими, чем Streptococcus mutans, содержащий введение микроорганизма, принадлежащего к группе молочнокислых бактерий, характеризующийся тем, что названный микроорганизм способен к специфическому связыванию с бактерией, принадлежащей к группе mutans Streptococci или мутанта, производного, аналога или фрагмента названного микроорганизма.
Mutans Streptococci поселяются в хозяине после того, как прорежутся первые зубы (Carlson et al., Caries Res. 9 (1975), 333-339). Они локализуются на поверхностях зубов, и их изобилие в зубном камне обусловливает самое большое из первоначальных повреждений (Duchin and van Houte Arch. Biol. Biol. 23 (1978) 779-786). Уровень их заселения внутри зубного камня увеличивается при потреблении сахарозы (Staat et al., J. Dent. Res. 54 (1975) 872-880). Они способны синтезировать некоторые макромолекулы из сахарозы, которые стимулируют их прикрепление к зубам (Tanzer et al., Infect. Immun. 10 (1974) 197-203). Mutans Streptococci являются быстрыми производителями кислоты из простых углеводов, включая сахарозу, и толерантны к низкому pH (Edwardsson, Arch. Biol. 13 (1968) 637-646). Более того, они, по существу, всегда восстанавливаются в местах развившихся первоначальных и упрочившихся кариозных повреждений (Littleton et al., Arch. Oral. Biol. 15 (1979) 461-463). Интерес к ним вырос после демонстрации их возможности вызывать и развивать кариозные повреждения у различных экспериментальных животных, включая моноинфицированных гнотобиотных животных. Их вирулентная экспрессия в значительной степени ассоциируется с потреблением углеводов, особенно сахарозы.
Роль других бактериальных видов, которые связаны с развитием кариеса, подобно молочнокислым бактериям или актиномицетам, не является решающей. Этих бактерий часто находят в кариозных повреждениях, но только в сообществе mutans Streptococci. Согласно современной точке зрения, присутствие mutans Streptococci представляет собой обязательное условие патогенеза кариеса (Tanzer et al., J. Dent. Educ. 65 (2001) 1028-1037). Группа mutans Steptococci образуется как содержащая, по меньшей мере, S. mutans, S. sobrinus, S. cricetus, S. rutti, S. ferus и S. macacae (Loesche et al., Microbio. Rev. 50 (4) (1986) 353-380). Благодаря тому факту, что Streptococcus mutans являются наиболее изобильным представителем из mutans Steptococci у людей, большинство микробиологических исследований кариеса, а также противокариозных мер сосредоточено на этих специфических видах.
Первоначальное присоединение S. mutans к поверхности зубов происходит посредством двух механизмов. Первый механизм представляет собой присоединение S. mutans посредством стрептококкового антигена I/II (SA I/II) - поверхностного белка, также известного под синонимами В, IF, P1, SR, MSL-1 или PAc, - к кутикуле, слою слюнных белков на поверхности зубов. Антитела против этого белка, как было показано, предотвращают адгезию S. mutans in vitro.
Соответственно, стрептококковый антиген I/II (SA I/II) является мишенью для вакцинации. В различных рекомбинантных комбинациях - полный антиген, область присоединения слюны, белок, объединенный с токсином холеры, или экспрессируемый на поверхности авирулентного штамма сальмонеллы - была показана успешная иммунизация животных. Она приводила к высоким титрам IgA и снижению колонизации S. mutans (Huang et al., Infect. Immun. 69 (2001), 2154-2161). Сопоставимые результаты были достигнуты при применении ДНК-вакцины, кодирующей SA I/II (Fan et al., J. Dent. Res. 81 (2002), 784-787).
Пассивный иммунитет достигнут посредством рекомбинантной экспрессии антител анти-SA I/II на поверхности молочнокислых бактерий. Эти молочнокислые бактерии образуют агрегаты с S. mutans, и введение этих бактерий крысам приводило к снижению образования кариеса (Krueger et al., Nature Biotechnology 20 (2002), 702-706).
WO 06/027265 относится к молочнокислым бактериям, способным присоединяться к S. mutans с целью подавить адгезию к зубам.
Наиболее важным партнером по соединению стрептококкового антигена является агглютинин слюны, белок, подобный гликопротеину легкого gp-340 из суперсемейства фагоцитарных цистеин-богатых рецепторов (Prakobphol et al., J. Biol. Chem. 275 (2000) 39860-39866).
Роль агглютинина в патогенезе кариеса до сих пор не полностью понятна. Он может приводить к адгезии S. mutans, когда присутствует в связанном с поверхностью виде, и он может приводить к агрегированию S. mutans, когда присутствует в растворенном состоянии. Последнее может приводить к удалению агрегированных S. mutans изо рта посредством слюны. Высокая концентрация агглютинина в слюне приводит in vitro к увеличению адгезии S. mutans, в то время как in vivo не наблюдается ясной корреляции между концентрацией агглютинина в слюне и риском появления кариеса (Stenudd et al., J. Dent. Res. 80 (2001), 2005-2010).
Моноклональные антитела против агглютинина полностью блокируют присоединение S. mutans к покрытому слюной гидроксиапатиту in vitro и предотвращают зависимое от агглютинина агрегирование (Carlen und Olsson, J. Dent. Res. 74 (1995), 1040-1047; Carlen et al., J. Dent. Res. 77 (1998), 81-90). Brady et al., Infect. Immun. 60 (1992), 1008-1017 показали, что поверхностная адгезия и агрегирование могут независимо друг от друга инициироваться различными антителами. Это показывает, что различные эпитопы агглютинина ответственны за оба эти явления.
Другие белки слюны, часто связываемые с развитием кариеса, представляют собой пролин-богатые белки (PRPs). Однако роль этих белков в адгезии кариесогенных бактерий вызывает дискуссию. Эти белки кодируются двумя генными локусами (PRH-1 и PRH-2) и встречаются в различных вариантах, которые различаются только несколькими аминокислотами (PRP-1, PRP-2, PIF. Db - двойная связь). Эти варианты могут быть протеолитически расщеплены, образуя в результате так называемые маленькие PRPs (PRP-3, PRP-4. Pif-f и Db-f). PRPs опосредуют прочное соединение симбионтов, подобных Actinomyces naeslundii или не-mutans Streptococci. Интересно, что это соединение имеет место только после адгезии белка к поверхности зуба, делая в результате конформационного сдвига сайт связывания доступным. S. mutans связываются только слабо. PRP-вариант Db играет существенную роль в эффективном связывании S. mutans. Высокая концентрация Db коррелирует с высокой адгезией S. mutans и сильным развитием кариеса. Сниженная доля PRP-Db в общей высокой концентрации PRP коррелирует со слабым развитием кариеса (Stenudd et al., J. Dent. Res. 80 (2001), 2005-2010). Присоединяется ли S. mutans непосредственно к PRPs, не известно.
Второй способ присоединения S. mutans к поверхности зуба представляет собой зависимую адгезию посредством сахарозы. S. mutans экспрессируют три различные гликозилтрансферазы (GYFs), которые способны синтезировать полимерный глюкан сахара. Глюканы существуют в водорастворимой форме (1-6 гликозидная связь) и нерастворимой форме, вызванной мутантом (1-3 гликозидная связь). Мутант не может быть разрушен ни ротовыми бактериями, ни ферментами слюны. Он образует клейкую матрицу внутри зубного камня, которая представляет основу для сахарозозависимой адгезии S. mutans. Гликозилтрансферазы GTFB и GTFC, широко распространенные ферменты, ответственные за образование мутанта, размещаются на клеточной поверхности S. mutans. В отличие от них, гликозилтрансфераза GTFD синтезирует растворимый глюкан и секретируется S. mutans. Эксперименты, применяющие GTF дефицитные S. mutans, показывают, что взаимодействие всех трех ферментов необходимо для сахарозозависимой адгезии (Ooshima et al., J. Dent. Res. 80 (2001), 1672-1677).
Гликозилтрансферазы имеют N-терминальный связывающий сайт сахарозы и С-терминальный связывающий сайт глюкана. Антитела против фермента или против связывающего сайта глюкана приводят к ингибированию сахарозозависимой адгезии S. mutans. Невозможно блокировать N-терминальный связывающий сайт сахарозы, применяя антитела (Yu et al., Infect. Immun. 65 (1997), 2292-2298).
Ингибирование гликозилтрансферазы, сопровождаемое снижением адгезии S. mutans, может быть достигнуто посредством некоторых флавоноидов и терпеноидов (US 2004/0057908) или экстрактов прополиса (Duarte et al., Biol. Pharmacol. Bull. 26 (2003), 527-531).
Были найдены молочнокислые бактерии под названием S11, которые снижают образование мутанта и, следовательно, адгезию S. mutans in vitro. Как описано выше, образование мутанта является существенным, для того чтобы S. mutans присоединялись к поверхности зуба. Так, Chung et al. (Oral Microbiol. Immunol. 19 (2004), 214-216) нашли присоединенные клетки S. mutans, когда их инкубировали с молочнокислыми бактериями из штамма S11, которые, как сказано, снижают образование мутанта. Присоединение S. mutans к мутанту происходит посредством присоединения бактериальных белков (белок, присоединяющий глюкан). Точный механизм этого присоединения должен быть определен (Sato et al., Infect. Immun. 65 (1997), 668-675).
Грибы Trichoderma harzianum и Penicillum purpurogenum производят гомолог альфа-1,3-глюконазы (Fuqlsanq et al., J. Biol. Chem. 275 (2000), 2009-2018). Применение видов Enterococcus, Lactobacillus и Lactococcus, эффективных против образования глюкана и образования зубного камня, описано (US 6,036,952). Механизм действия должен быть истолкован.
Другой подход к ингибированию кариеса представляет собой нейтрализацию низкого pH в зубном камне. Мочевина и аргинин являются компонентами слюны. Моча присутствует в концентрации 3-10 ммоль/л, без большого различия между тем, есть у людей кариес или нет. Концентрация свободного аргинина находится в пределах между 4 и 40 µмоль/л. Люди, не имеющие кариеса, в среднем, имеют более высокую концентрацию свободного аргинина в слюне, чем люди, пораженные кариесом (van Wuvckhuvse et al., J. Dent. Res. 74 (1995), 686-690).
Некоторые бактерии зубного камня, подобные Streptococcus sangius и Actinomyces naeslundi, способны расщеплять мочевину или аргинин, образуя в результате аммиак. Щелочной аммоний повышает pH зубного камня и поэтому снижает кариес (Curran et al., Appl. Environm. Microbiol. 61 (1995), 4494-4496; Morou-Bermudez and Burne. Infect. Immun. 68 (2000), 6670-6676). Таким образом, предполагается, что эти бактерии можно применять для лечения кариеса. Другой подход, предложенный для лечения кариеса, состоит в том, что при протеолизе PRP-1 и PRP-3 образуются аргинин-богатые белки, которые могут, после дальнейшего протеолиза посредством оральных бактерий, подобных S. sangius, S. oralis и S. mitis, приводить к более высокому pH в зубном камне. Посредством применения рекомбинантного варианта из этих белков сахарозозависимое снижение pH сдерживается (Li et al., Infect. Immun. 68 (2000), 5425-5429). Более того, описано, что применяя жевательную резинку, содержащую мочевину, после приема сахарозы, можно задержать падение pH, и таким образом, например, S. mutans могут не так сильно повлиять на кариес.
Однако из сказанного выше очевидно, что специалисты в данной области техники концентрируют свое внимание на противокариозных мерах, направленных против Streptococcus mutans. Никакие меры, которые позволили бы выбрать в качестве цели mutans Streptococci, других, чем Streptococcus mutans, не описываются, несмотря на их возможную роль в патогенезе кариеса. Поэтому необходимо найти средства и способы, которые выполнили бы вышеупомянутые желаемые критерии и которые были бы пригодны для предупреждения и/или лечения кариеса, вызванного бактериями, другими, чем Streptococcus mutans.
Техническая проблема, лежащая в основе настоящего изобретения, такова, чтобы осуществить вышеописанную необходимость. Решение названной технической проблемы достигается посредством обеспечения вариантов выполнения изобретения, как описано в формуле изобретения.
Таким образом, в первом объекте настоящее изобретение относится к применению микроорганизма, принадлежащего к группе молочнокислых бактерий или мутанту или его производного, характеризующегося тем, что он способен к специфическому связыванию с бактерией, принадлежащей к группе mutans Streptococci, при котором специфическое связывание характеризуется: (i) стойкостью к тепловой обработке; и/или (ii) стойкостью к протеолитической обработке; и/или (iii) зависимостью от кальция; и/или (iv) формированием при pH в пределах между 4.5 и 8.5; и/или (v) формированием в присутствии слюны, для изготовления противокариозной композиции для лечения или предупреждения кариеса, вызванного mutans Streptococci, другими, чем Streptococcus mutans. Предпочтительно, при специфическом связывании можно проанализировать следующее:
(a) выращивание названного микроорганизма до стационарной фазы;
(b) смешивание названного микроорганизма с бактерией, принадлежащей к группе mutans Streptococci, которые были выращены до стационарной фазы;
(c) инкубирование смеси, полученной на этапе (b) при условиях, позволяющих образование агрегатов названного микроорганизма и бактерии из группы mutans Streptococci; и
(d) определение агрегатов по наличию осадка в пробирке.
В предпочтительном варианте выполнения изобретения бактерия, принадлежащая к группе mutans Streptococci, использованная в таком анализе, представляет собой Streptococcus mutans.
Специфическое связывание, предпочтительно, оценивается, как описано здесь, в Примере 4 ниже.
В частности, для определения агрегатов mutans Streptococci по наличию осадка в пробирке, как описано в Примере 4 ниже, микроорганизмы, принадлежащие к группе молочнокислых бактерий, предпочтительно смешаны с mutans Streptococci в объемном отношении от 3:1 до 60:1 (mutans Streptococci:молочнокислые бактерии). Как молочнокислые бактерии, так и mutans Streptococci выращиваются до стационарной фазы, как описано в Примере 1. Предпочтительно, оптическая плотность измеряется способом фотометрии при длине волны 600 нм. Упомянутые отношения соответствуют отношению образующих колонию единиц от 1:50 до 1:2.5. Предпочтительно, OD600=1 в 1 мл соответствует 3×108 образующих колонию единиц mutans Streptococcus. Предпочтительно, OD600=1 в 1 мл соответствует 7×109 образующих колонию единиц молочнокислых бактерий, как здесь описано ниже. Предпочтительно, при определении агрегатов по наличию осадка в пробирке бактерии представлены в объеме 2 мл в пробирках Фалкон емкостью 15 мл. Если необходимо, суспензии культуры разбавляют забуференным фосфатом физиологическим раствором (PBS), чтобы получить упомянутое выше объемное отношение, сохраняя в то же время окончательный объем 2 мл. Предпочтительно, смесь перемешивается в течение около 15 секунд и затем оставляется в покое, по меньшей мере, на 5, 10, 15 минут, и более предпочтительно, по меньшей мере, на 20 минут при комнатной температуре, то есть при любой температуре между 16°С и 25°С. Агрегация наблюдается как немедленное помутнение суспензии, и после, по меньшей мере, 20 минут агрегация наблюдается как скопление агрегатов, которые оседают как видимые гранулы (примерно показано на Фиг.1, левая пробирка Фалкон), в то время как не mutans Streptococcus при агрегации смесей остаются в суспензии (примерно показано на Фиг.1, правая пробирка Фалкон). В качестве контроля само-агрегация соответствующей молочнокислой бактерии и штамма mutans Streptococcus может быть проанализирована в отсутствие либо mutans Streptococcus, либо молочнокислой бактерии.
Агрегация молочнокислой бактерии и mutans Streptococcus согласно описанному выше анализу может быть измерена количественно посредством отделения образовавшихся агрегатов центрифугированием, например, при 500×g в течение 30 секунд. Затем количество агрегатов может быть определено измерением количества не агрегированных клеток, которые остаются в супернатанте. Определение можно выполнить любым подходящим способом, известным специалисту в данной области техники. Предпочтительно, определение выполняется посредством удаления некоторого объема супернатанта, например, 1 мл. Затем оптическая плотность удаленного супернатанта может быть измерена при любой подходящей длине волны, известной специалисту, например, при 600 нм. Измеренное значение после вычитания значения, соответствующего контрольному испытанию без молочнокислой бактерии, представляет количество клеток, которые не были агрегированы.
В качестве альтернативы, чтобы исследовать возможную проблему самоагрегации, можно применить красящее вещество. Таким образом, в более предпочтительном варианте выполнения изобретения специфическое связывание можно проанализировать следующим образом:
(a) выращивание названного микроорганизма до стационарной фазы;
(b) смешивание названного микроорганизма с бактерией, принадлежащей к группе mutans Streptococci, которые были выращены до стационарной фазы и которые были окрашены, используя подходящее красящее вещество, предпочтительно, флюоресцирующее красящее вещество;
(c) инкубирование смеси, полученной на этапе (b), при условиях, позволяющих образование агрегатов названного микроорганизма и бактерии из группы mutans Streptococci; и
(d) определение агрегатов посредством определения красящего вещества, предпочтительно, флюоресцирующего красящего вещества.
Кроме того, в предпочтительном варианте выполнения изобретения бактерия, принадлежащая к группе mutans Streptococci, использованная в таком анализе, представляет собой Streptococcus mutans. Предпочтительно, такой анализ агрегации может быть выполнен, как описано здесь в Примере 5 ниже. В частности, для анализа агрегации mutans Streptococci, как описано в Примере 5 ниже, и молочнокислые бактерии и mutans Streptococci выращиваются до стационарной фазы, как описано в Примере 1. Предпочтительно, оптическая плотность измеряется способом фотометрии при длине волны 600 нм. Предпочтительно, OD600=1 в 1 мл соответствует 3×108 образующих колонию единиц mutans Streptococcus. Предпочтительно, OD600=1 в 1 мл соответствует 7×109 образующих колонию единиц молочнокислых бактерий, как здесь описано ниже. Затем mutans Streptococci окрашиваются. В другом, предпочтительном, варианте выполнения изобретения молочнокислые бактерии окрашиваются, в то время как Streptococci не окрашиваются. Поскольку может применяться любое красящее вещество в качестве красителя, предпочтительно, можно применить флюоресцирующий краситель, известный специалистам в данной области техники. Предпочтительно, специфический или не специфический флюоресцирующий краситель может применяться, например, CFDA-SE. Особым образом клетки собираются, например, центрифугированием, предпочтительно, при 3200×g в течение 5 минут. Затем полученные гранулы могут быть повторно суспендированы в любом подходящем буфере, известном специалисту в данной области техники, предпочтительно, в PBS буфере. Количество буфера можно рассчитать таким образом, чтобы полученная суспензия имела OD600, например, 4.2/мл. Затем суспензия может быть смешана с подходящим красителем, например, с флюоресцирующим красителем, предпочтительно, с 5,6-карбоксифлуоресцеиндиацетатом, сукцинимидиловым эфиром (CFDA-SE), более предпочтительно, с 2µл раствора CFDA-SE (Invitrogen). Затем клетки могут быть инкубированы в течение подходящего периода времени, как известно специалисту в данной области техники, например, в течение 2 часов, при подходящей температуре, как известно специалисту, например, при 37°С. На следующем этапе окрашенные клетки могут быть собраны, например, центрифугированием. Предпочтительно, центрифугирование выполняется при 3200×g в течение 5 минут. Клетки затем могут быть повторно суспендированы в любом подходящем буфере, как известно специалисту, например, в 2 мл PBS буфера. Для агрегирования микроорганизмы, принадлежащие к группе молочнокислых бактерий, предпочтительно, смешиваются с mutans Streptococci в объемном отношении от 3:1 до 1:3 (mutans Streptococci:молочнокислые бактерии). Более предпочтительно, объемное отношение смеси составляет 1:1. Упомянутое отношение соответствует числу единиц, образующих колонию, от 1:50 до 1:150. Для анализа реакции агрегации посредством измерения окрашивания, предпочтительно способом флюоресценции, молочнокислые бактерии и mutans Streptococci применяются в любом соответствующем объеме, как известно специалисту, предпочтительно, в объеме 50 µл. Предпочтительно, смешивание выполняется на пластине микротитратора, например, в 96-ячеечной пластине микротитратора. Затем смесь может быть перемешана, предпочтительно, в течение 12 минут при максимальной скорости. После этого смесь может быть центрифугирована, например, в течение 10 секунд при 500×g. Супернатант затем может быть удален, и гранулы повторно суспендированы в любом подходящем буфере, известном специалисту в данной области техники, предпочтительно, в PBS буфере в любом подходящем объеме, например, в 100 µл. Окрашивание суспензии можно измерить в смеси любым подходящим способом, известным специалисту. Предпочтительно, в случае флюоресценции, флюоресценция может быть определена посредством считывающего устройства, например, при длине волны 495 нм при возбуждении и 525 нм при эмиссии. Для контроля, можно проанализировать только молочнокислые бактерии, и только mutans Streptococci. Исходные данные любого окрашивания, например, флюоресцентного, можно измерить для определения только mutans Streptococci, и можно, предпочтительно, вычесть из значения агрегации с соответствующими молочнокислыми бактериями. Эффект агрегации присутствует, если исходные данные окрашивания, например, флюоресцентного, измеренного как показано здесь выше, вычитаются из измеренного окрашивания, например, флюоресцентного, образца, содержащего молочнокислые бактерии, как описано здесь выше, и испытуемые mutans Streptococci, как описано здесь выше, и полученное значение составляет, по меньшей мере, выше нуля. Более предпочтительно, эффект агрегации присутствует, если полученное значение выше нуля воспроизводится в ряде испытаний, выполненных, как описано здесь выше. "Ряд испытаний" означает, по меньшей мере, 2, предпочтительно 3, более предпочтительно 4, и наиболее предпочтительно 5 испытаний.
Описанное выше специфическое связывание не требует магния. Это свойство может быть испытано, как описано в прилагаемых Примерах.
Как показано в прилагаемых Примерах, неожиданно было найдено, что молочнокислые бактерии, которые первоначально были идентифицированы и выделены посредством вышеупомянутого анализа связывания благодаря их способности связывать Streptococcus mutans, в то же время не связывая другие виды Streptococcus, S. salivarius, S. oralis, S. mitis, и/или S. sanguinis (см. WO 06/27265), показали способность связывать различные другие mutans Streptococci, например, Streptococcus sobrinus, Streptococcus cricetus, Streptococcus ratti, Streptococcus ferus и Streptococcus macacae. Таким образом, идентификация молочнокислых бактерий, которые показали вышеописанные характеристики связывания в отношении Streptococcus mutans, и связывание которых, предпочтительно, оценивается вышеописанными анализами, обеспечивает молочнокислые бактерии, которые не только способны агрегировать Streptococcus mutans, но которые способны также агрегировать другие mutans Streptococci, то есть виды Streptococcus, которые имеют общие характеристики, как описано далее ниже, и которые также вносят свой вклад в развитие кариеса. Таким образом, молочнокислые бактерии, которые показали выше перечисленные характеристики связывания, в отличие от одного типа бактерии, принадлежащей к группе mutans Streptococci (например, Streptococcus mutans), как было найдено, также способны агрегировать другие бактерии, принадлежащие к группе mutans Streptococci, и могут, таким образом, применяться для предупреждения и/или лечения кариеса, вызванного такими другими бактериями. Таким образом, идентифицированные выше анализы для тестирования связывания молочнокислых бактерий с одной бактерией, принадлежащей к группе mutans Streptococci, позволяют идентифицировать молочнокислые бактерии, которые также связываются/агрегируют с другими бактериями из группы mutans Streptococci. Таким образом, настоящее изобретение обеспечивает важное улучшение в обеспечении средств и способов для исследования кариеса, который вызывается mutans Streptococci, другими, чем Streptococcus mutans.
Как очевидно из сказанного выше, все упомянутые выше характеристики относятся к упомянутому выше микроорганизму, принадлежащему к группе молочнокислых бактерий, подходящему агенту для предупреждения и/или лечения кариеса, в частности, кариеса, который вызван mutans Streptococci, другими, чем Streptococcus mutans. Соответственно, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, вызывает противокариозное действие, и таким образом представляет собой подходящий агент для предупреждения и/или лечения кариеса, в частности кариеса, вызванного mutans Streptococci, другими, чем Streptococcus mutans. "Кариес" или "зубной кариес" или "дупло в зубе" являются взаимозаменяемыми терминами для хронической инфекционной болезни, связанной с уязвимой разрушенной областью в зубе, которая постепенно приводит к потере зуба. Она обычно встречается у детей и подростков, но может поразить любого человека. Она является наиболее важной причиной потери зубов у более молодых людей. Кариес можно диагностировать посредством способов, известных специалистам в данной области техники (см., например, Angmar-Mansson and ten Bosch, Adv. Dent. Res. 7 (1993), 70-79).
Термин "mutans Streptococcus" относится к микроорганизму таксономической группы Streptococcus, который находится в зубном камне в ротовой полости и который вызывает ферментацию маннитола и сорбитола. Предпочтительно, это микроорганизм с упомянутыми выше характеристиками, который, кроме того, способен производить внеклеточные глюканы из сахарозы. Предпочтительно, названный микроорганизм является кариесогенным, в частности для людей и/или животных моделей. Более предпочтительно, термин относится к микроорганизму, который показывает все вышеупомянутые характеристики. Ферментация сорбитола и маннитола может быть проверена посредством использования любого подходящего теста, известного специалисту в данной области техники, например, тест API 20 Strep (Biomerieux, France).
Более предпочтительно, термин относится к микроорганизму, принадлежащему к видам Streptococcus mutans, Streptococcus sobrinus, Streptococcus cricetus, Streptococcus ratti, Streptococcus ferus, или Streptococcus macacae. Даже более предпочтительно, термин относится к микроорганизму, принадлежащему Streptococcus mutans серотипа c (DSMZ 20523), Streptococcus mutans серотипа e (NCTC 10923), Streptococcus mutans серотипа f (NCTC 11060), Streptococcus sobrinus DSM 20742, Streptococcus ratti DSM 20564, Streptococcus cricetus DSM 20562, Streptococcus ferus DSM 20646, или Streptococcus macacae DSM 20714. Термин "mutans Streptococci" относится, по меньшей мере, к одному микроорганизму из группы mutans Streptococcus, как описано здесь выше. Предпочтительно, термин относится к какой-либо комбинации и подгруппе микроорганизмов, принадлежащих к группе mutans Streptococcus, как описано здесь выше.
Термин "предупреждение кариеса" включает профилактику кариеса. Таким образом, субъект, который никогда ранее не сталкивался с mutans Streptococci, причинными агентами кариеса, но рискующий встретиться, то есть быть инфицированным mutans Streptococci, извлекает пользу, например, из применений и способов настоящего изобретения до того, как названный субъект будет страдать от кариеса. Следовательно, применения и способы настоящего изобретения можно, например, применять к младенцам, детям или молодым животным для профилактики кариеса, поскольку ротовая полость младенцев или молодых животных обычно свободна от mutans Streptococci. Однако, композиции, применяемые по настоящему изобретению, не ограничиваются введением младенцам, детям или молодым животным.
Термин "лечение кариеса" включает введение композиций, как описано здесь ниже, субъекту, страдающему от кариеса, с целью снижения количества клеток mutans Streptococci и/или для полного очищения рта от mutans Streptococci, в частности ротовой полости, включая зубы. Конечно, после проведенного лечения от mutans Streptococci, представляется возможным, что соответствующий субъект извлекает пользу из применений и способов настоящего изобретения с точки зрения профилактического противокариозного воздействия, направленного на mutans Streptococci.
Если требуется, упомянутый выше микроорганизм, принадлежащий к группе молочнокислых бактерий, представляет собой пробиотический микроорганизм, который, кроме своих противокариозных эффектов, оказывает благоприятное влияние на организм хозяина, которому он вводится. "Пробиотик", по общепринятому определению, представляет собой "пищевую добавку из живых микроорганизмов, которые благоприятно влияют на хозяина-животное, улучшая микробный баланс его кишечника".
Mutans Streptococci встречаются как часть нормальной флоры во рту. Они вовлекаются в случае зубного кариеса у людей и животных, в частности, млекопитающих. Зубной камень пристает к трещинкам и впадинкам зубов, расположенных рядом с деснами. Вначале он состоит из гликопротеина, который осаждается и адсорбируется на зубной эмали. Ротовые бактерии затем начинают объединяться с гликопротеином. Пищевая сахароза является важным участником в развитии кариеса, особенно если сахароза находится в виде клейкой сладкой пищи, часть которой может оставаться во рту в течение некоторого времени. Сахароза, таким образом, более полно метаболизируется mutans Streptococci с образованием кислоты. Напитки, которые содержат сахарозу, проглатываются, и таким образом сахароза проводит во рту меньше времени. Существенно, что наличие зубного камня контролируется регулярным применением зубной щетки, зубочистки и зубной нити. Добавление 1 миллионной доли фторида к питьевой воде оказывается очень эффективным для снижения кариеса. Кроме того, возможность применения вакцины против Streptococcus mutans рассматривалось в научном сообществе. Таким образом, кроме общих схем оральной гигиены, которая воздействует по большей части на бактерии в полости рта, уровень техники почти полностью сфокусирован на специфических мерах против Streptococcus mutans. Однако, согласно удивительной находке настоящего изобретения, такие естественно встречающиеся микроорганизмы, принадлежащие к группе молочнокислых бактерий, предпочтительно, к роду Lactobacillus, которые идентифицированы по их способности связывать Streptococcus mutans, также способны связывать штаммы mutans Streptococci, подобных, например, Streptococcus sobrinus, Streptococcus cricetus, Streptococcus ratti, Streptococcus ferus, или Streptococcus macacae, теперь возможно эффективно предотвратить и/или лечить кариес, вызванный mutans Streptococci, другими, чем Streptococcus mutans, так как вышеупомянутые микроорганизмы, принадлежащие к группе молочнокислых бактерий, способны к агрегированию и смыванию mutans Streptococci, подобных, например, Streptococcus sobrinus, Streptococcus cricetus, Streptococcus ratti, Streptococcus ferus, или Streptococcus macacae. Таким образом, настоящее изобретение обеспечивает применение легко вводимых бактерий, которые представляют собой организмы пищевого класса, которые, в дополнение к их противокариозным свойствам, могут применяться как пробиотики.
В частности, при анализе микроорганизмов, принадлежащих к группе молочнокислых бактерий, предпочтительно, к роду Lactobacillus, которые первоначально были идентифицированы благодаря их способности связывать Streptococcus mutans, но не Streptococcus salivarius, Streptococcus oralis, Streptococcus mitis и Streptococcus sanguinis, с удивлением было обнаружено, что названные микроорганизмы не только способны связываться с Streptococcus mutans, но также присоединять другие виды mutans Streptococci, подобных, например, Streptococcus sobrinus, Streptococcus cricetus, Streptococcus ratti, Streptococcus ferus, или Streptococcus macacae, которые являются причиной кариеса. Посредством связывания с этими mutans Streptococci, микроорганизм, принадлежащий к группе молочнокислых бактерий, предпочтительно, к роду Lactobacillus, как здесь описано, между прочим, присоединяется и агрегирует mutans Streptococcus, и таким образом, в результате вымывает mutans Streptococcus естественным потоком слюны, тем самым предупреждая и/или излечивая кариес. Кроме того, упомянутые выше микроорганизмы, принадлежащие к группе молочнокислых бактерий, действительно, предпочтительно, не связываются с другими микроорганизмами, которые не принадлежат к группе mutans Streptococci, присутствующих в ротовой полости, как описано здесь, и в частности в Примере 6 здесь ниже. Таким образом, микросреда ротовой полости не нарушается, поскольку только mutans Streptococci, как причинные агенты кариеса убывают. Для лучшего понимания, mutans Streptococci не оказывают каких-либо полезных действий в ротовой полости, и таким образом, их потеря не имеет никакого неблагоприятного эффекта для соответствующего хозяина.
Поразительно, что специфическое связывание упомянутого выше микроорганизма, принадлежащего к группе молочнокислых бактерий, в частности, к виду Lactobacillus, описанное здесь, с mutans Streptococci, обладает стойкостью к тепловой обработке и/или обработке протеазой. В дополнение, специфическое связывание зависит от кальция и/или не зависит от магния, и устойчиво при кислотной точке 4.5, и оно совершается в присутствии слюны, что делает, в частности, его подходящим для применения в виде оральных аппликаций или как добавку к пище, фуражу или напиткам, которые могут содержать более высокие концентрации кальция, таким как молоко. Замечательно, что термически инактивированные или лиофилизованные аналоги, производные или фрагмент(ы) названных микроорганизмов, раскрытых здесь, все еще способны к специфическому связыванию с mutans Streptococci. Этот удивительный эффект представляет собой предпочтение для применения названного аналога(ов) или фрагмента(ов) названных микроорганизмов, так же как мутантов, или их производных в композициях для применения у животных, предпочтительно, людей или млекопитающих для предупреждения и/или лечения кариеса. В частности, названные аналоги или фрагменты можно легко добавить к любой композиции, например, к косметической или фармацевтической композиции, пище, или фуражу, или напиткам и подобным. К тому же производство таких аналогов или фрагментов является дешевым и легким, и они могут храниться продолжительные периоды времени без потери своей способности к специфическому связыванию с mutans Streptococci. Другим преимуществом вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, является то, что он сохраняет свою способность к специфическому связыванию с mutans Streptococci, когда он лиофилизован, или высушен, или подвергнут распылительной сушке. Это делает его удобным ингредиентом для применения в описанных здесь композициях.
Другие варианты выполнения и преимущества изобретения частично изложены здесь в описании и частично могут быть очевидными из описания или можно узнать из выполнения изобретения.
До того, как настоящее изобретение будет описано в деталях, следует понимать, что это изобретение не ограничивается отдельной методологией, протоколами, бактериями, векторами, реагентами и т.д., описанными здесь, так как они могут варьироваться. Также следует понимать, что терминология, использованная здесь, применяется только для целей описания конкретных вариантов выполнения и не предназначена ограничить объем настоящего изобретения, который ограничивается только прилагаемой формулой изобретения. Кроме указанного иначе, все технические и научные термины, использованные здесь, имеют те же самые значения, какие обыкновенно подразумеваются обычным специалистом в данной области техники.
Предпочтительно, использованные здесь термины образованы так, как описано в "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)", Leuenberger, H.G.W, Nagel, В and Kölbl, H. eds. (1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerland).
Во всем описании и формуле изобретения, которая следует, если контекст не требует иначе, слово "содержать", и вариации, такие как "содержат" и "содержащий", понимаются таким образом, чтобы означать включение установленного целого или действия, или группы целых или действий, но без исключения любого другого целого или действия, или группы целых или действий.
В данном описании цитируются некоторые документы. Каждый из документов, цитируемых здесь (включая все патенты, заявки на патент, научные публикации, производственные спецификации, инструкции и т.д.), выше или ниже, введены здесь ссылками во всей полноте. Ничто здесь не должно быть истолковано как признание действительным, что изобретение не озаглавлено, чтобы датировать более ранним числом такое открытие, благодаря предшествующему изобретению.
Следует отметить, что, так как применяется здесь и в прилагаемой формуле изобретения, формы единственного числа включают многие объекты ссылки, если контекст не указывает ясно другое. Так, например, ссылка на "реагент" включает один или более таких разных реагентов, и ссылка на "способ" включает ссылку на эквивалентные действия и способы, известные обычным специалистам в данной области техники, которые могли бы быть модифицированы или заменены на способы, описанные здесь.
При использовании в контексте настоящего изобретения, выражение "микроорганизм, принадлежащий к группе молочнокислых бактерий" охватывает микроорганизм(ы), который принадлежит(ат) к бактериям, в частности, принадлежащим к грамположительным ферментирующим эубактериям, более конкретно, принадлежащим к семейству lactobacteriaceae, включающим молочнокислые бактерии. В дополнение, названное выражение охватывает также производных, или мутантов, или аналогов, или фрагментов, таких как часть мембраны, как описано здесь, из названных микроорганизма(ов), которые сохраняют способность к специфическому связыванию с mutans Streptococci. Термины "производные", "мутанты", "аналоги" и "фрагменты" описаны здесь в другом месте. Молочнокислые бактерии с таксономической точки зрения подразделяются на подгруппы Streptococcus, Leuconostoc, Pediococcus и Lactobacillus. Упомянутый выше микроорганизм, принадлежащий к группе молочнокислых бактерий, представляет собой, предпочтительно, вид Lactobacillus. У членов группы молочнокислых бактерий обычно отсутствуют порфирины и цитохромы, не выполняется перенос электронов при фосфорилировании, и поэтому они получают энергию только посредством фосфорилирования на субстратном уровне. То есть в молочнокислых бактериях АТР синтезируется вследствие ферментации углеводов. Все молочнокислые бактерии растут анаэробно, однако, в отличие от других анаэробов, большинство молочнокислых бактерий не чувствительны к кислороду и могут, таким образом, расти в его присутствии, так же как и в его отсутствие. Следовательно, упомянутые выше микроорганизмы, принадлежащие к группе молочнокислых бактерий, представляют собой, предпочтительно, аэротолерантные, анаэробные молочнокислые бактерии, предпочтительно, принадлежащие к роду Lactobacillus.
Упомянутые выше молочнокислые бактерии представляют собой, предпочтительно, палочкообразную или сферическую форму, изменяющуюся от длинных и тонких до коротких изогнутых палочек, являются, кроме того, предпочтительно, неподвижными и/или аспорогенными и производят молочную кислоту как основной или единственный продукт ферментативного метаболизма. Род Lactobacillus, к которому принадлежит упомянутый выше микроорганизм, разделяется по следующим характеристикам на три основные подгруппы, таким образом, представляется, что упомянутые выше виды Lactobacillus могут принадлежать к каждой из трех основных подгрупп:
(a) гомоферментативные молочнокислые бактерии;
(i) производящие молочную кислоту, предпочтительно, L-, D- или DL-изомер(ы) молочной кислоты в количестве, по меньшей мере, 85% из глюкозы путем Эмбдена-Мейергофа;
(ii) растущие при температуре 45°С, но не при температуре 15°С;
(iii) имеющие длинную палочкообразную форму;
(iv) имеющие глицерол тейхоевую кислоту в клеточной стенке;
(b) гомоферментативные молочнокислые бактерии;
(i) производящие молочную кислоту, предпочтительно, L-, или DL-изомер(ы) молочной кислоты путем Эмбдена-Мейергофа;
(ii) растущие при температуре 15°С, показывающие непостоянный рост при температуре 45°С;
(iii) имеющие короткую палочкообразную форму или дифтериеподобную форму;
(iv) имеющие рибитол и/или глицерол тейхоевую кислоту в своей клеточной стенке;
(c) гетероферментативные молочнокислые бактерии;
(i) производящие молочную кислоту, предпочтительно, DL-изомер молочной кислоты в количестве, по меньшей мере, 50% из глюкозы пентоза-фосфатным путем;
(ii) производящие двуокись углерода и этанол;
(iii) показывающие непостоянный рост при температуре 15°С или 45°С;
(iv) имеющие длинную или короткую палочкообразную форму;
(v) имеющие глицерол тейхоевую кислоту в своей клеточной стенке.
На основе описанных выше характеристик, упомянутые выше микроорганизмы могут быть классифицированы как принадлежащие к группе молочнокислых бактерий, в частности, к роду Lactobacillus. Используя классические системы, например, согласно ссылке, относящейся к описанию в "Bergey's Manual of Systematic Bacteriology" (Williams & Wilkins Co., 1984), микроорганизм может быть определен как принадлежащий к роду Lactobacillus. Как альтернатива, микроорганизмы могут быть классифицированы как принадлежащие к роду Lactobacillus согласно способам, известным в данной области техники, например, по их характерным признакам метаболизма, то есть по сравнительному рассмотрению способности такого микроорганизма(ов) метаболизировать сахара или согласно другим способам, описанным, например, Schleifer et al., System. Appl. Microb., 18 (1995), 461-467 or Ludwiq et al., System. Appl. Microb., 15 (1992), 487-501. Упомянутые выше микроорганизмы способны метаболизировать источники сахара, которые являются обычными и известными в данной области техники для микроорганизмов, принадлежащих к роду Lactobacillus. Предпочтительно, однако, что упомянутый выше микроорганизм имеет характерные признаки метаболизма, выбранные из группы, состоящей из:
(i) он метаболизирует D-лактозу, но не L-сорбозу и/или D-сахарозу и/или D-инулин,
(ii) он метаболизирует инулин,
(iii) он метаболизирует L-сорбозу, но не D-лактозу и/или D-сахарозу и/или инулин,
(iv) он метаболизирует L-сорбозу, D-лактозу и инулин.
Предпочтительно, вышеупомянутый микроорганизм имеет характерные признаки метаболизма, выбранные из группы, состоящей из:
(i) он метаболизирует D-лактозу, но не L-сорбозу, D-сахарозу и инулин,
(ii) он метаболизирует L-сорбозу, D-лактозу и инулин, но не D-сахарозу,
(iii) он метаболизирует L-сорбозу, но не D-лактозу, D-сахарозу и инулин,
(iv) он метаболизирует L-сорбозу, D-лактозу, D-сахарозу, но не инулин.
Конечно, вышеупомянутый микроорганизм не ограничен метаболизмом сахаров, упомянутых в приведенных выше характерных признаках метаболизма, но может быть способен метаболизировать другие сахара, которые обычно метаболизируются видами Lactobacillus.
Присоединение упомянутых выше микроорганизмов к роду Lactobacillus может также характеризоваться путем применения других способов, известных в данной области техники, например, используя SDS-PAGE электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия общего белка видов, и сравнивая их с известными и уже охарактеризованными штаммами рода Lactobacillus. Способы изготовления общего белкового профиля, как описано выше, также как многочисленные анализы таких профилей хорошо известны специалисту в данной области техники. Однако результаты являются надежными только тогда, когда каждая стадия процесса достаточно стандартизована. Сталкиваясь с требованием точности при определении присоединения микроорганизма к роду Lactobacillus, стандартизованные процедуры постоянно делаются доступными для общественности их авторами, такими как Pot et al., как представлено во время "симпозиума", организованного Европейским Союзом, в Университете г.Гент, в Бельгии, 12-16 сентября, 1994 г. (Способы определения характерных признаков для классификации и идентификации бактерий, SDS-PAGE цельного клеточного белка). Программное обеспечение, использованное в этой методике для анализа посредством SDS-PAGE электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия, имеет решающее значение, поскольку степень корреляции между видами зависит от параметров и алгоритмов, использованных в этом программном обеспечении. Не вдаваясь в теоретические детали, количественное сравнение окрашенных зон, измеренное денситометром и нормированное компьютером, предпочтительно, осуществляется с коэффициентом корреляции Пирсона. Матрица подобия, полученная таким образом, может быть организована с помощью UPGMA (не взвешенный попарно-групповой способ, использующий среднее сцепление) алгоритма, который не только делает возможным сгруппировать вместе наиболее подобные профили, но также построить дендрограммы (см. Kersters, Numerical methods in the classification and identification of bacteria by electrophoresis, in Computer-assisted Bacterial Systematics, 337-368. M.Goodfellow, A.G.O'Donnell Ed., John Wiley and Sons Ltd, 1985).
В качестве альтернативы, присоединение названных микроорганизмов к роду Lactobacillus может характеризоваться по отношению к рибосомной РНК в так называемом Riboprinter.RTM. Более предпочтительно, присоединение упомянутого выше вида к роду Lactobacillus демонстрируется посредством сравнения нуклеотидной последовательности 16S рибосомной РНК названных бактерий или их геномной ДНК, которая кодирует 16S рибосомную РНК, с нуклеотидными последовательностями других родов и видов молочнокислых бактерий, известных на сегодняшний день. Другой предпочтительной альтернативой для определения присоединения видов к роду Lactobacillus является применение видоспецифических ПЦР праймеров, которые нацелены на участок-спейсер рРНК 16S-23S. Другой предпочтительной альтернативой является RAPD-PCR (ПЦР со случайной амплификацией полиморфной ДНК) (Nigatu et al. in Antonie van Leenwenhoek (79), 1-6, 2001), на основании которой генерируется образец штамма специфической ДНК, который позволяет определить присоединение идентифицируемых микроорганизмов к роду Lactobacillus. Другие техники, пригодные для определения присоединения микроорганизма к роду Lactobacillus, представляют собой RFLP (изменчивость размеров фрагментов ДНК, выщепляемых рестриктазами) (Giraffa et al., Int. J. Food Microbiol. 82 (2003), 163-172), определение характерных признаков повторяющихся элементов (Gevers et al., FEMS Microbiol. Lett. 205 (2001) 31-36) или анализ эфирного образца бактериальных клеток (сложного метилового эфира жирной кислоты (FAME)) (Heyrman et al., FEEMS Microbiol. Lett. 181 (1991), 55-62). Альтернативно, лактобактерии можно определить посредством лектинового типирования (Annuk et al., J. Med. Microbiol. 50 (2001), 1069-1074) или посредством анализа клеточных стенок их белков (Gatti et al., Lett. Appl. Microbiol. 25 (1997), 345-348).
Вышеупомянутые микроорганизмы представляют собой, предпочтительно, молочнокислые бактерии, принадлежащие к роду Lactobacillus, более предпочтительно, к виду Lactobacillus, как здесь описано. Даже более предпочтительно, названные Lactobacillus представляют собой Lactobacillus paracasei или Lactobacillus rhamnosus. Однако виды Lactobacillus не ограничиваются этим.
Вышеупомянутые микроорганизмы могут быть "выделены" или "очищены". Термин "выделенные" означает, что материал удален из его первоначального окружения, например, природного окружения, если он встречается в природе. Например, встречающийся в природе микроорганизм, предпочтительно, вид Lactobacillus, отделенный от некоторых или всех сосуществующих материалов в природной системе, выделяется. Такой микроорганизм может быть частью композиции, и все же его следует рассматривать как выделенный, поскольку эта композиция не является частью его природного окружения.
Термин "очищенный" в действительности не требует абсолютной чистоты; скорее имеется в виду относительное определение. Отдельные микроорганизмы, полученные из библиотеки, обычно очищены до микробиологической гомогенности, то есть они выращены как отдельные колонии, когда засеваются штрихом на агаровых пластинках по способу, известному в данной области техники. Предпочтительно, агаровые пластинки, которые используются для этой цели, выбираются для вида Lactobacillus. Такие выбранные агаровые пластинки известны в данной области техники.
Более предпочтительно, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий n, выбирается из группы, состоящей из Lactobacillus paracasei или Lactobacillus rhamnosus, имеющих DSMZ номер доступа DSM 16667 (L. paracasei ssp. paracasei Lb-Ob-K1), DSMZ номер доступа DSM 16668 (L. paracasei ssp. paracasei Lb-Ob-K2), DSMZ номер доступа DSM 16669 (L. paracasei ssp. paracasei Lb-Ob-K3), DSMZ номер доступа DSM 16670 (L. paracasei ssp. paracasei Lb-Ob-K4), DSMZ номер доступа DSM 16671 (L. paracasei ssp. paracasei Lb-Ob-K5), DSMZ номер доступа DSM 16672 (L. ramnosus Lb-Ob-K6) и DSM номер доступа DSM 16673 (L. ramnosus Lb-Ob-K7), или мутант, или его производный, в котором названный мутант или производный сохраняют способность специфически связываться с mutans Streptococci. Термин "Lactobacillus paracasei или Lactobacillus rhamnosus, имеющие DSMZ номер доступа", относится к клеткам микроорганизма, принадлежащего к виду Lactobacillus paracasei или Lactobacillus rhamnosus, размещенным в Deutsche Sammlung für Mikroorganismen und Zellkulturen GmbH ("DSMZ") в августе 26, 2004, и имеющие следующие депозитные номера DSM 16667, 16668, 16669, 16670, 16671, 16672 или 16673. DSMZ размещаются в Mascheroder Weg 1b, D-38124 Braunschweig, Germany. Вышеупомянутые DSMZ депозиты были созданы в соответствии с Будапештским договором о признании депозита микроорганизмов для целей патентной процедуры.
"Мутант или производная" упомянутого выше микроорганизма, принадлежащего к группе молочнокислых бактерий, предпочтительно, из депозитных клеток Lactobacillus paracasei или Lactobacillus rhamnosus, имеют, предпочтительно такие же характеристики, как соответствующие депозитные штаммы, то есть он сохраняет способность специфически связываться с mutans Streptococci, предпочтительно, с такими же характеристиками связывания, как описано выше. Например, названная производная может быть генно-инженерной. В контексте настоящего изобретения термин "генно-инженерный" используется в его самом широком смысле в отношении способов, известных специалисту в данной области техники, для модификации желаемых нуклеиновых кислот in vitro и in vivo, таким образом, чтобы производились генетические модификации и гены изменялись способом рекомбинантных ДНК. Таким образом, предпочтительно, чтобы названные способы содержали клонирование, секвенирование и трансформацию рекомбинантных нуклеиновых кислот. Для этой цели соответствующие векторы, включая экспрессионные векторы для видов Lactobacillus, например, описаны в ЕР-В1 506789, ЕР-В1 316677, ЕР-В1 251064. ЕР-В1 218230, ЕР-В1 133046 или WO 89/01970.
Праймеры, ферменты, другие клетки хозяина для клонирования промежуточных конструкций и подобные можно использовать, и они известны специалисту в данной области техники. Предпочтительно, генно-инженерные мутанты содержат клетки упомянутых выше микроорганизмов, принадлежащих к группе молочнокислых бактерий, предпочтительно, депозитного вида Lactobacillus, содержащих рекомбинантные нуклеиновые кислоты, содержащие в них либо бактериальную хромосому, либо плазмиду(ы), или содержащие в них бактериальную хромосому и/или плазмиду(ы). Названные рекомбинантные нуклеиновые кислоты являются, предпочтительно, чужеродными упомянутому выше микроорганизму, принадлежащему к группе молочнокислых бактерий. Под "чужеродным" имеется в виду, что полинуклеотид или молекула нуклеиновой кислоты является либо гетерологичной по отношению к клетке хозяина, что означает производную от клетки или организма с другим геномным происхождением, или гомологичной относительно клетки хозяина, но помещенной в другое геномное окружение, чем встречающийся в природе аналог названной молекулы нуклеиновой кислоты. Это означает, что если молекула нуклеиновой кислоты является гомологичной относительно клетки хозяина, она не находится в ее естественном положении в геноме названной клетки хозяина, в частности, она окружена другими генами. В этом случае полинуклеотид может находиться либо под контролем своего собственного промотора, либо под контролем гетерологичного промотора. Описанный выше вектор или молекула нуклеиновой кислоты, которая присутствует в клетке хозяина, может быть либо интегрирована в геном клетки хозяина, либо она может сохраняться в некоторой форме внехромосомно. В этом отношении также можно считать, что описанная выше молекула нуклеиновой кислоты может быть использована для того, чтобы восстановить или создать мутантный ген посредством гомологичной рекомбинации.
Плазмиды могут представлять низкое, среднее и высокое число копий плазмид. Названные генно-инженерные мутанты могут содержать нуклеиновые кислоты, кодирующие глюканазу и мутаназу, которые способны разрушать мутантную специфическую 1,3-гликозидную связь субъединиц сахарозы. Грибковые глюканы описаны, например, в Fuqlsanq et al., J. Biol. Chem. 275 (2000), 2009-2018. Также представляется возможным, что генно-инженерные мутанты содержат клетки находящихся в них рекомбинантных нуклеиновых кислот, кодирующих антитела, которые, предпочтительно, секретируются или закрепляются в стенке бактериальной клетки. Термин "антитело" включает цельные антитела, а также фрагменты антител, подобные легким и тяжелым цепям, Fab, Fab/c, Fv, Fab', F(ab')2. Термин "антитело" включает также гуманизированные антитела, гетеровалентные антитела и конструкции антител, подобные единичной цепи Fvs (scFv), или антитело-гибридные белки. Также предусматривается в контексте этого изобретения, что термин "антитело" включает конструкции антител, которые могут быть экспрессированы в клетках производного упомянутого выше депозитного микроорганизма, например, конструкции антител, которые могут быть трансформированы, между прочим, посредством векторов, способами, известными в данной области техники. В частности, представляется возможным, что такие конструкции антител специфически распознают, например, стрептококковый антиген I/II. Такой подход описан, например, Krueqer et al., Nat. Biotechnol. 20 (2002), 702-706 или Shiroza, Biochim Biophys Acta 1626 (2003), 57-64.
Секреция экспрессируемого антитела, предпочтительно, достигается посредством функционально связывающей нуклеиновой кислоты, кодирующей антитело для секреции сигнальной последовательности. Закрепление в стенке бактериальной клетки может быть достигнуто путем использования фермента сортаза. То есть, поверхностные белки грамположительных бактерий соединяются с клеточной стенкой бактерии путем механизма, который вызывает расщепление консервативного Leu-Pro-Х-Thr-Gly (LPXTG) мотива и который происходит во время сборки клеточной стенки пептидогликана. Таким образом, молекула нуклеиновой кислоты, кодирующая антитело, может быть соединена с последовательностью вышеупомянутого консервативного мотива, который используется сортазой, чтобы закрепить белок в клеточной стенке бактерии.
Также представляется возможным, что упомянутый выше микроорганизм, принадлежащий к группе молочнокислых бактерий, предпочтительно, депозитному виду Lactobacillus, является генетически модифицированным, чтобы присоединить молекулу нуклеиновой кислоты, кодирующую reuterin, который представляет собой противомикробный препарат, между прочим эффективный против Streptococcus mutans. Reuterin, например, описан в Talarico et al., Chemother. 33 (1989), 674-679.
Мутант упомянутого выше микроорганизма, принадлежащего к группе молочнокислых бактерий, предпочтительно, мутанту депозитных штаммов Lactobacillus, предпочтительно, подвергнут искусственной мутации. В соответствии с настоящим изобретением, термин «мутантный» обозначает (а) долговременную модификацию генетического материала, т.е. нуклеиновых кислот, вызванную, например природными или физическими средствами или химическими соединениями/веществами/агентами, такими как EMS или ENU. Указанные модификации включают в себя точечные мутации, такие как транзиции или трансверсии, делеция/инсерция/вставка одного или более оснований в нуклеиновой кислоте/гене/хромосоме, таким образом модифицирующая нуклеиновую кислоту/ген/хромосому, что затем вызывает, среди прочего, аномальную экспрессию/транскрипцию/трансляцию генов или инактивацию генных продуктов, активацию/инактивацию основных генных продуктов, что ведет к доминантно-негативному эффекту. Предпочтительно, мутация ведет к увеличенной мощности специфического связывания mutans Streptococci. Таким образом, также предпочтительно, чтобы мутантные клетки указанного микроорганизма, которые несут мутацию (мутации) в желаемом гене (генах) или в которых мутация (мутации) в желаемом гене (генах) индуцируются способами, известными специалистам в данной области. Также известно в прежних областях науки, что мутантные или генно-инженерные бактериальные клетки могут быть выбраны по любому подходящему способу/фенотипу. В контексте настоящего изобретения, мутант, имеющий увеличенную способность специфически связываться с mutans Streptococci, может быть протестирован согласно способам, описанным в прилагающихся Примерах. Термин «мутант», однако, включает в себя также клетки вышеуказанного микроорганизма, принадлежащего к группе молочнокислых бактерий, предпочтительно клетки рассматриваемого здесь микроорганизма, которые несет появившиеся естественным путем спонтанные мутации в геноме, т.е. в бактериальной хромосоме. «Спонтанные мутации» - это такие мутации, которые появляются естественным путем, т.е. без прямых генетических манипуляций человека или воздействия мутагена. Отбор спонтанных мутантов может сопровождаться культивированием штаммов и отбором желаемых вариантов путем, например, способности какого-либо вида бактерий проявлять увеличенную связывающую способность к mutans Streptococci. Способы отбора спонтанных мутантов хорошо известны в этой области (см., например, Sambrook. Russell "Molecular Cloning, A Laboratory Manual", Cold Spring Harbor Laboratory, N.Y. (2001); Ausubel. "Current Protocols in Molecular Biology", Green Publishing Associates и Wiley Interscience, N.Y. (1989)). Например, такие мутации могут появляться во время культивирования, например, во время процесса деления нормальных клеток, объединенного с репликацией ДНК, или в течение пассирования и/или защиты мутанта от вышеупомянутого микроорганизма, относящегося к группе молочнокислых бактерий.
В ротовой полости содержится множество различных видов стрептококков, и неудивительно, что, полагая, что они занимают одну и ту же нишу, что у них много общих признаков. Так, предпочтительно, чтобы вышеупомянутый микроорганизм, относящийся к группе молочнокислых бактерий, специфически связывался с mutans Streptococci. Соответственно, термин «специфическое связывание» в контексте настоящего изобретения обозначает, что вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, предпочтительно к роду Lactobacillus, связывается с mutans Streptococcus, в частности Streptococcus mutans, но не связывается с большинством других видов, относящихся к роду Streptococcus, где другие виды, относящиеся к роду Streptococcus, описаны в Примере 6. Именно, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, предпочтительно не связывается с бактериями, принадлежащими к виду Streptococcus salivarius, предпочтительно принадлежащими к подвиду thermophilus, к виду Streptococcus oralis, к виду Streptococcus mitis и/или к виду Streptococcus sanguinis. Более предпочтительно, он не связывается с Streptococcus salivarius ssp. thermophilus (определено API 50 CH (Biomerieux, France), Streptococcus oralis (DSMZ 20066), Streptococcus oralis (DSMZ 20395), Streptococcus oralis (DSMZ 20627), Streptococcus mitis (DSMZ 12643) и/или Streptococcus sanguinis (DSMZ 20567). В дополнение, указанный микроорганизм предпочтительно не связывается с родами, отличными от Streptococcus, например, принадлежащими к роду Staphylococcus. Более предпочтительно, он не связывается с бактериями, принадлежащими к виду Staphylococcus epidermidis. Более предпочтительно, он не связывается с Staphylococcus epidermidis (DSMZ 1798) и/или Staphylococcus epidermidis (DSMZ 20044).
Как уже упоминалось выше, было удивительно обнаружить, что молочнокислые бактерии, которые отбираются по их связыванию с Streptococcus mutans, в то время как они не связываются с другими видами Streptococcus: Streptococcus salivarius, Streptococcus oralis, Streptococcus mitis и/или Streptococcus sanguinis, показывают способность к связыванию других mutans Streptococci, т.е. другие виды Streptococcus, которые показывают вышеупомянутые обычные характеристики и которые также предполагаются в качестве обычных агентов, вызывающих кариес. Так, молочнокислые бактерии, которые показывают вышеупомянутые характеристики специфического связывания Streptococcus mutans, показывают также способность к использованию в качестве средства для профилактики или лечения кариеса, вызванного mutans Streptococci, отличными от Streptococcus mutans. Таким образом, в предпочтительном варианте выполнения, молочнокислые бактерии характеризуют по проявлению ими вышеупомянутых характеристик (т.е. (i) устойчивость к термообработке; и/или (ii) устойчивость к обработке протеазами; и/или (iii) зависимость от кальция; и/или (iv) образование связывания при pH в интервале между 4.5 и 8.5; и/или (v) образование связывания в присутствии слюны) по отношению к Streptococcus mutans и связывание тестируется в тесте, как описано здесь выше, в котором Streptococcus mutans используются в качестве бактерии, принадлежащей к группе mutans Streptococci.
Для тестирования специфического связывания, каждые из вышеупомянутых бактерий предпочтительно смешиваются в объемном соотношении 3:1 с культурами Lactobacillus, как описано здесь выше, и агрегирование тестируется, как описано здесь выше и например в Примере 4 или в Примере 5. Было показано, что вышеупомянутые Lactobacillus paracasei, предпочтительно L. paracasei ssp. paracasei не агрегируют ни с одной из вышеупомянутых бактерий ротовой полости, принадлежащей к роду Streptococcus, и не связывает бактерии, принадлежащие к роду Staphylococcus, упомянутых здесь выше. Вышеупомянутые штаммы Lactobacillus rhamnosus, как было показано, не агрегируют ни с одним из упомянутых выше strains видов Streptococcus и Staphylococcus, за исключением Streptococcus salivarius ssp. thermophilus. Предпочтительно термин «специфическое связывание» также обозначает, что вышеупомянутый микроорганизм, принадлежащий к молочнокислым бактериям, связывается с такими штаммами mutans Streptococci, которые являются кариогенными дентальными патогенами.
Реакция специфического связывания содержит в себе связывание и, предпочтительно, агрегацию клеток mutans Streptococcus, как описано здесь для вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий ротовой полости. Это специфическое связывание ведет, как следствие, к оттоку клеток Streptococcus посредством, например, потока слюны или при полоскании рта или промывании рта и тому подобное, как описано здесь. Ротовое отверстие определяет ротовую полость млекопитающих, предпочтительно людей или таких животных, как домашние питомцы, которая состоит из ротовой слизистой оболочки (десны, губы, щеки, нижнее и верхнее небо), языка и зубов (включая в себя искусственные имплантаты). Предпочтительно, реакция специфического связывания вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий mutans Streptococci, предотвращает попадание клеток mutans Streptococcus на поверхность зуба или зубов (или по теории, пока они не связаны, они могли приводить к удалению клеток mutans Streptococcus с поверхности зуба или зубов). Вследствие этого, реакция специфического связывания приводит к оттоку клеток mutans Streptococcus из ротовой полости, таким образом, уменьшая количество агентов, вызывающих кариес и предотвращая и/или подвергая кариес лечению.
Полагают, что вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, может специфически связываться со стрептококковым антигеном I/II, который также известен, как антиген В, IF, Р1, SR, MSL-1 или PAc. Однако вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, может связываться с любым другим белком или структурным элементом поверхности mutans Streptococci, таким образом, агрегируя с mutans Streptococci и удаляя их из ротовой полости, как описано здесь. Известно, что Streptococcus mutans связывается посредством указанного стрептококкового антигена I/II с пленкой. Соответственно, когда вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, может связываться с, например, указанным стрептококковым антигеном I/II, Streptococcus mutans также как и другим микроорганизмам, принадлежащим к группе mutans Streptococci, создается препятствие для связывания с поверхностью зубов, что помогает предотвратить и/или вылечить кариес.
Пленка - это чистая тонкая покровная поверхность, содержащая белки и липиды (жиры), найденные в слюне. Она образуется в течение секунд после очищения поверхности зуба. Образование пленки является первым шагом к появлению зубного налета. Зубной налет представляет собой мягкий осадок, который накапливается на зубах. Налет может быть определен как комплексная группа микробов, с более чем 1010 бактерий на миллиграмм. Было установлено, что до 400 отдельных видов бактерий можно найти в налете. В дополнение к бактериальным клеткам, налет содержит небольшое количество эпителиальных клеток, лейкоцитов и макрофагов. Клетки содержатся внутри внеклеточного матрикса, который образован продуктами жизнедеятельности бактерий и слюной. Внеклеточный матрикс содержит в себе белки, полисахариды и липиды. Одним из белков, присутствующих в слюне, является агглютинин, который с одной стороны, как полагают, ведет к частичному удалению Streptococcus mutans из ротовой полости, однако с другой стороны, предполагают, что они обеспечивают адгезию Streptococcus mutans на поверхности зубов, таким образом, обеспечение первоначального прикрепления Streptococcus mutans к зубам и, таким образом, развитие кариеса. Связывается ли вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, специфически с mutans Streptococci, как определено здесь выше, можно легко определить, помимо прочего, сравнением реакции клеток указанного микроорганизма mutans Streptococcus с микроорганизмом, также принадлежащим к роду Lactobacillus, которые, однако, не связываются специфически с mutans Streptococci при помощи предпочтительного способа, как описано здесь выше и в прилагаемых Примерах ниже.
Предпочтительно, указанный микроорганизм, принадлежащий к группе молочнокислых бактерий, способен специфически связываться с серотипом с Streptococcus mutans (DSMZ 20523) и/или серотипом е (NCTC 10923) и/или серотипом f (NCTC 11060) и/или Streptococcus sobrinus DSM 20742 и/или Streptococcus ratti DSM 20564 и/или Streptococcus cricetus DSM 20562 и/или Streptococcus ferus DSM 20646 и/или Streptococcus macacae DSM 20714.
Это означает, что вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, предпочтительно связывается с по меньшей мере одним микроорганизмом, выбранным из группы, состоящей из Streptococcus mutans серотипа c (DSMZ 20523), серотипа e (NCTC 10923), серотипа f (NCTC 11060), Streptococcus sobrinus DSM 20742, Streptococcus ratti DSM 20564, Streptococcus cricetus DSM 20562, Streptococcus ferus DSM 20646 и Streptococcus macacae DSM 20714. Более предпочтительно вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, связывается с какой-либо комбинацией, группой или подгруппой вышеупомянутых бактерий. Даже более предпочтительно вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, связывается со всеми вышеупомянутыми бактериями. Согласно настоящему изобретению, «серотип» является антигенным свойством бактериальной клетки, предпочтительно Streptococcus mutans или Streptococcus sobrinus, идентифицированными серологическими способами, известными в данной области техники.
Как описано выше, специфическое связывание вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, с mutans Streptococci является устойчивым к тепловой обработке. Соответственно, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, проходит тепловую обработку при температуре, например, выше 15 или 37°С. Более предпочтительно инкубировать клетки при температуре более чем 55°С, даже еще более предпочтительно при температуре более чем 65°С, особенно предпочтительно при температуре 95°С и наиболее предпочтительно при температуре 121°С. После охлаждения способность вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, специфически связываться с mutans Streptococci определяется как описано здесь. Соответствующая температура может зависеть от специфических видов Lactobacillus, но может быть легко определена специалистом в данной области техники при помощи стандартных способов, например, путем инкубации соответствующих клеток при различных температурах и определения количества клеток Lactobacillus, которые остаются способны к специфическому связыванию с mutans Streptococci с помощью способов, описанных здесь. В общем, тепловая обработка должна длиться в течение по меньшей мере 1 мин. Предпочтительно тепловая обработка длится в течение по меньшей мере n мин, где n - целое число в интервале от 2 до 6, с n=20 особенно предпочтительным. Однако существует принцип не превышать порог времени инкубации. Однако она предпочтительно длится не дольше, чем 4, 3, 2 или 1 ч. Наиболее предпочтительный вариант тепловой обработки - это, по меньшей мере, 121°С в насыщенном потоке, при атмосферном давлении 2 бар. Наиболее предпочтительный вариант тепловой обработки рассматривают как отменяющий любую функцию белка или какого-либо жизненно важного компонента клеток, который таким образом различает вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, и другой микроорганизм, в котором сохраняется способность к специфическому связыванию с mutans Streptococci. Следовательно, очень полезным является применение его в какой-либо пище, корме, питье или их сочетании в контексте настоящего изобретения, если желательно, чтобы микроорганизм не был живым. Предпочтительно вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, который подвергался тепловой обработке, как описано здесь выше, обладает увеличенной способностью к специфическому связыванию с бактериями, принадлежащими к группе mutans Streptococci. Термин «увеличенная способность» означает увеличение связывания, измеренное, например, в тесте, описанном здесь, предпочтительно как описано в Примере 5, на, по меньшей мере, 5%, предпочтительно, по меньшей мере 10%, более предпочтительно 20% и наиболее предпочтительно по меньшей мере 30%. В предпочтительном варианте выполнения изобретения, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, который имеет повышенную способность к специфическому связыванию с бактериями, принадлежащими к mutans Streptococci при тепловой обработке, принадлежит к виду Lactobacillus paracasei, более предпочтительно к L. paracasei ssp. paracasei и наиболее предпочтительно к L. paracasei ssp. paracasei Lb-Ob-K5 (DSM 16671).
Специфическое связывание вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, далее охарактеризовано по его устойчивости к обработке протеазами, которые выбираются из группы, состоящей из протеиназы Е, протеиназы К, трипсина и хемотрипсина. Эти протеиназы являются протеиназами, которые не проявляют специфичности и, таким образом, рассматриваются как деградирующие любой белок на поверхности клетки микроорганизма. Другие протеиназы, которые, как известно, обладают специфичностью к определенным наборам аминокислотных остатков, - это эластаза, тромбин, аминопептидаза I, карбоксипептидаза, дострипаин, эндопротеиназа, папаин, пепсин или протеазы. Последние протеазы могли также использоваться при тестировании, устойчиво ли специфическое связывание вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, с mutans Streptococci к последним более специфичным протеазам. Таким образом, после обработки протеазой, которая описывается в прилагаемых примерах, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, пока остается способным к специфическому связыванию с mutans Streptococci.
В дополнение, специфическое связывание вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, далее характеризуется по его зависимости от кальция. Предпочтительно специфическое связывание происходит в присутствии ионов кальция в концентрации в интервале от 0.05 мМ и 500 мМ, предпочтительно между 1 мМ и 100 мМ. Особенно предпочтительна концентрация кальция в интервале между 2 мМ и 30 мМ. Зависимость специфического связывания от кальция можно протестировать, как описано в прилагаемых Примерах.
Более того, специфическое связывание с вышеупомянутым микроорганизмом, принадлежащим к группе молочнокислых бактерий, достигается при pH в интервале от 4.0 до 9.0, предпочтительно от 4.0 до 7.0. В частности, значение pH, при котором протекает специфическое связывание, предпочтительно 4.5. Исследование достижения специфического связывания в интервале pH, описанном выше, показано в прилагаемых примерах. Более того, специфическое связывание не зависит от магния. Таким образом, присутствие солей магния или ионов магния необязательно, что показано в прилагаемых примерах.
Далее характеристикой специфического связывания является появление его в присутствие слюны. Слюна - экзогенная секретируемая жидкость, которая вырабатывается в слюнных железах. Это комплексная жидкость, содержащая в себе, помимо 99% воды, сложную смесь органических и неорганических соединений. Физиологическими ингредиентами слюны являются, помимо прочего, ферменты, например, амилизы, карбоангидразы, лизоцим, пероксидазы, или белки, например, муцины, лактоферрин, белки, обогащенные пролином, цистатины, гистатины или статерины или растворимые IgA. Таким образом, хотя в слюне присутствует разнообразные, потенциально взаимодействующие между собой соединения, это не мешает или не подавляет специфическое связывание вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий. Для тестирования специфического связывания предпочтительно, чтобы использовали слюну, которая предпочтительно содержит вид Streptococcus, описанный в Примере 6, и/или вид Staphylococcus из Примера 6. Если, однако, на специфическое связывание с mutans Streptococci в присутствии слюны тестируется вид Lactobacillus rhamnosus species, как описано в Примере 6, предпочтительно, чтобы не включали that Streptococcus salivarius ssp. thermophilus. Специфическое связывание тестируется, как описано здесь.
Вышеупомянутые характеристики вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, делают его сильным и эффективным агентом для предотвращения и/или лечения кариеса, т.к. он в основном назначается в различных формах перорально, включая ротовую полость и зубы, где, помимо прочего, присутствует слюна, содержащая в себе определенные протеазы и имеющая низкие значения pH после проглатывания углеводов, содержащихся в пище. Более того, устойчивость к термообработке оказывает положительные эффекты на добавление вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, в качестве добавки к пище в течение ее приготовления. Именно, пища часто стерилизуется тепловой обработкой, подготавливается, пастеризуется, и все тому подобное губительно для жизнеспособности микроорганизмов.
В другом объекте настоящего изобретения производное вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, применяется здесь, как описано. Термин «производное вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий» обозначает инактивированную форму или аналог или фрагмент вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, который термически инактивирован или лиофилизирован, где указанная инактивированная форма, аналог или фрагмент сохраняют способность к специфическому связыванию с mutans Streptococci. Согласно настоящему изобретению, термин «инактивированная форма или аналог вышеупомянутого организма, принадлежащего к группе молочнокислых бактерий» включает в себя мертвые или инактивированные клетки вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, предпочтительно к виду Lactobacillus, показанного здесь, который более не способен к формированию одиночной колонии на планшете, специфичном для микроорганизмов, принадлежащих к роду Lactobacillus. Указанные мертвые или инактивированные клетки могут иметь либо интактную, либо разрушенную клеточную мембрану. Способы для умерщвления или инактивации клеток вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, известны в данной области. EI-Nezami et al. J. Food Prot. 61 (1998), 466-468 описывает способ для инактивации вида Lactobacillus УФ-излучением. Предпочтительно клетки вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, термически инактивируются или лиофилизируются, как описывается в прилагаемых Примерах. Лиофилизация клеток, как описано выше, имеет преимущество в том, что они могут легко храниться и использоваться, оставаясь способными к специфическому связыванию с mutans Streptococci. Более того, лиофилизированные клетки могут быть выращены снова при соблюдении условий, известных в данной области техники, для подходящей жидкой или твердой среды. Лиофилизацию проводят способами, известными в данной области техники. Предпочтительно ее проводят в течение по меньшей мере 2 ч при комнатной температуре, т.е. при любой температуре между 16 и 25°С. Более того, лиофилизированные клетки вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, стабильны в течение по меньшей мере 4 недель при 4°С, так что они сохраняют способность специфически связываться с mutans Streptococci, как показано в Примере 7 или 8 здесь ниже. Термическая инактивация может достигаться инкубацией клеток вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, в течение, по меньшей мере, 2 ч при температуре 170°С. Пока термическая инактивация предпочтительно достигается автоклавированием указанных клеток при температуре 121°С в течение по меньшей мере 20 мин в присутствии насыщенного потока при атмосферном давлении 2 бар. В альтернативном случае, термическая инактивация клеток вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, достигается путем замораживания указанных клеток в течение по меньшей мере 4 недель, 3 недель, 2 недель, 1 недели, 12 ч, 6 ч, 2 ч или 1 ч при -20°С. Предпочтительно, чтобы по меньшей мере 70%, 75% или 80%, более предпочтительно, чтобы 85%, 90% или 95% и особенно предпочтительно 97%, 98%, 99% и еще более особенно предпочтительно, 99.1%, 99.2%, 99.3%, 99.4%, 99.5%, 99.6%. 99.7%, 99.8% или 99.9% и наиболее предпочтительно 100% клеток аналога вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, были мертвы или инактивированы, однако, по прежнему имели способность специфически связываться с mutans Streptococci. Действительно ли инактивированная форма, аналог или фрагмент вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, мертвы или инактивированы, можно протестировать способами, известными в данной области, например, с помощью теста на жизнеспособность.
Термин «инактивированная форма или аналог вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий» также включает в себя лизаты, фракции или экстракты вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, предпочтительно к виду Lactobacillus, описанных здесь, где указанные лизаты, фракции или экстракты способны специфически связывать mutans Streptococci. Это связывающая способность может быть протестирована, как описано здесь и в частности как описано в прилагаемых примерах. Если лизат, фракция или экстракт из микроорганизма в соответствии с объектом (i) изобретения, как описано здесь выше, может неспецифически связываться с бактериями, принадлежащими к группе mutans Streptococci, то специалист в данной области техники может, например, далее очистить указанный лизат, фракцию или экстракт способами, известными в данной области техники, которые приведены здесь в примерах ниже, так чтобы удалить вещество, которое ингибирует связывание. Впоследствии специалист в данной области техники может опять протестировать указанный лизат, фракцию или экстракт, связываются ли они специфически с бактериями, принадлежащими к группе mutans Streptococci.
Согласно настоящему изобретению, термин «лизат» обозначает раствор или суспензию клеток вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, с разрушенными мембранами в водной среде. Однако термин не должен быть истолкован с какими-либо ограничениями. Клеточный лизат содержит в себе, например, макромолекулы, такие как ДНК, РНК, белки, пептиды, углеводы, липиды и тому подобное, и/или микромолекулы, такие как аминокислоты, сахара, жирные кислоты и тому подобное, или их фракции. В дополнение указанный лизат содержит в себе обломки клеток, которые могут иметь гладкую или шероховатую структуру. Предпочтительно, указанный лизат содержит в себе клеточную стенку или клеточную мембрану или оба компонента, или части или фрагменты клеточной стенки или клеточной мембраны или обоих компонентов. Способы получения лизатов клеток хорошо известны в данной области техники, например, с помощью использования Френч-пресса, где клетки перемалывают с помощью стеклянных или железных бусин, или ферментативный лизис клеток и тому подобное. В дополнение, лизирование клеток относится к различным способам, известным в данной области техники, для лизиса/разрушения клеток. Способ лизиса клеток не важен, и можно использовать любой способ, которым может быть достигнут лизис клеток вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий. Подходящий способ может быть выбран специалистом в этой области техники, например, лизис/разрушение клеток может быть проведено ферментативно, химически или физически. Не ограничивающими примерами для ферментов и смесей ферментов являются протеазы, такие как протеиназа К, липазы или гликозидазы; не ограничивающими примерами для химических соединений являются ионофоры, детергенты, такие как додецилсульфат натрия, кислоты или основания; и не ограничивающими примерами физических средств являются высокое давление, как Френч-пресс, осмотическое давление, температура, как например, нагревание или охлаждение. В дополнение, способ, содержащий в себе подходящую комбинацию фермента, отличного от протеолитического фермента, кислоту, основание и тому подобное, может также быть использован. Например, клетки вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, лизируют при помощи замораживания и оттаивания, более предпочтительно замораживать при температуре ниже -70°С и оттаивать при температуре выше чем 30°С, особенно предпочтительно замораживание при температуре ниже -75°С и оттаивание при температуре выше 35°С, и наиболее предпочтительно замораживание при температуре ниже -80°С и оттаивание при температуре выше чем 37°С. Также предпочтительно, чтобы указанное замораживание/оттаивание повторяли, по меньшей мере, 1 раз, более предпочтительно, по меньшей мере, 2 раза, даже более предпочтительно, по меньшей мере, 3 раза, особенно предпочтительно, по меньшей мере, 4 раза и наиболее предпочтительно, по меньшей мере, 5 раз.
Соответственно, специалист в данной области техники может приготовить желаемый лизат, следуя общим объяснениям и производя подходящие модификации или изменения данного способа, если это необходимо. Предпочтительно, чтобы водная среда, используемая для лизатов, была водой, физиологическим раствором или буферным раствором. Достоинством лизата бактериальных клеток является то, что его можно легко получить, а хранение требует меньших технических затрат и стоит дешевле.
Предпочтительно, термин «экстракт» обозначает внутриклеточный компонент вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, например, макромолекулы, такие как белок, ДНК, РНК, пептид, углевод, липид и тому подобное, и/или микромолекулы, такие как аминокислота, сахара, жирная кислота и тому подобное или любое другое органическое соединение или молекула, или комбинация указанных макромолекул и/или микромолекул или какой-либо их фракции, где указанный экстракт сохраняет способность специфически связываться с бактериями, принадлежащими к группе mutans Streptococci. Это специфическое связывание можно протестировать, как описано здесь, в частности, как описано в прилагаемых Примерах. Предпочтительно, указанный экстракт содержит в себе клеточную стенку или клеточную мембрану или оба компонента, или части или фрагменты клеточной стенки или клеточной мембраны или обоих компонентов. Более предпочтительно, термин «экстракт» относится к любому из описанных выше внутриклеточных компонентов в среде, свободной от клеток.
В дальнейшем предпочтительном варианте выполнения изобретения, экстракт может быть получен путем лизиса клеток способами, известными в данной области техники для разрушения клеток, как описано здесь выше, и/или как супернатант после процедуры центрифугирования культуры вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, в любой подходящей жидкости, среде или буфере, известным специалисту в данной области техники, или лизата такой культуры, или любой другой подходящей клеточной суспензии. Более предпочтительно, экстракт может представлять собой очищенный лизат или супернатант культуры клеток или любую фракцию или часть его, сохраняющую способность к специфическому связыванию с бактериями, принадлежащими к группе mutans Streptococci. Это связывание можно протестировать, как описано здесь, и, в частности, в прилагаемых Примерах. Подходящие способы фракционирования и очистки лизата, супернатанта культуры или экстракта известны специалистам в данной области техники и содержат в себе, например, хроматографию, например, аффинную хроматографию, ионообменную хроматографию, гель-проникающую хроматографию, обращенно-фазовую хроматографию и хроматографию с другим хроматографическим материалом в колонке, или смешанные способы, другие способы фракционирования, например, способы фильтрации, например, ультрафильтрация, диализ, диализ и концентрирование с гель-фильтрацией при центрифугировании, центрифугирование в градиенте плотности или ступенчатых матрицах, преципитации, например, аффинной преципитации, высаливания или всаливания (преципитация сульфатом аммония), спиртовые преципитации или любой дугой подходящий белково-химический, молекулярно-биологический, биохимический, иммунологический, химический или физический способ.
Согласно изобретению, лизаты также готовятся из фракций молекул вышеупомянутых лизатов. Эти фракции могут быть получены с помощью способов, известных специалистам в данной области техники, например, хроматографию, включая в себя, например, аффинную хроматографию, ионообменную хроматографию, гель-проникающую хроматографию, обращенно-фазовую хроматографию и хроматографию с другим хроматографическим материалом в колонке, или смешанные способы, другие способы фракционирования, например, способы фильтрации, например, ультрафильтрация, диализ, диализ и концентрирование с гель-фильтрацией при центрифугировании, центрифугирование в градиенте плотности или ступенчатых матрицах, преципитации, например, аффинной преципитации, высаливания или всаливания (преципитация сульфатом аммония), спиртовые преципитации или любыми другими подходящими белково-химическими, молекулярно-биологическими, биохимическими, иммунологическими, химическими или физическими способами для разделения вышеуказанных компонентов лизата. В предпочтительном варианте выполнения предпочтительны те фракции, которые являются более иммуногенными. Специалист в данной области техники может выбрать подходящий способ и определить его иммуногенный потенциал, следуя вышеуказанным общим объяснениям и специфическим объяснениям в примерах, приведенных здесь, и модифицируя или изменяя эти способы так, чтобы они были подходящими, если это необходимо.
Соответственно, термин «инактивированная форма или аналог вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий» также включает в себя фильтраты микроорганизма из изобретения, как описано здесь выше, предпочтительно вида Lactobacillus, описанного здесь, где указанные фильтраты предпочтительно сохраняют способность специфически связываться с бактериями, принадлежащими к группе mutans Streptococci. Это связывание можно протестировать, как описано здесь, и, в частности, как описано в прилагаемых Примерах. Если фильтрат вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, как описано здесь выше, может не связываться специфически с бактериями, принадлежащими к группе mutans Streptococci, то специалист в данной области техники, например, может в дальнейшем очистить указанный фильтрат с помощью способов, известных в данной области техники, которые здесь приведены в примерах ниже, так чтобы удалить вещества, которые ингибируют связывание. Впоследствии специалист в данной области техники может снова протестировать указанный фильтрат, может ли он специфически связываться с бактериями, принадлежащими к группе Streptococci.
Термин «фильтрат» обозначает раствор, свободный от клеток, или суспензию микроорганизма из изобретения, как описано здесь выше, который был получен как супернатант после центрифугирования культуры вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, в любой подходящей жидкости, среде или буфере, известных специалисту в данной области техники. Однако термин не должен быть истолкован в каком-либо ограничивающем направлении. Фильтрат содержит, например, макромолекулы, такие как ДНК, РНК, белки, пептиды, углеводы, липиды и тому подобное, и/или микромолекулы, такие как аминокислоты, сахара, жирные кислоты и тому подобное, или их фракции. Способы для получения фильтратов известны в данной области техники. В дополнение, «фильтрат» связан с различными способами, известными в данной области техники. Точный способ не важен и любой способ, с помощью которого можно провести фильтрацию клеток микроорганизма изобретения, как описано здесь, может быть использован.
«Фрагмент вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий» включает в себя любую часть клеток вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий. Предпочтительно, указанный фрагмент является фракцией мембраны, полученной путем подготовки мембраны. Подготовка мембраны микроорганизма, принадлежащего к Lactobacillus, может быть проведена способами, известными в данной области техники, например, используя способ, описанный Rollan et al. Int. J. Food Microbiol. 70 (2001), 303-307, Matsuquchi et al., Clin. Diagn. Lab. Immunol. 10 (2003), 259-266 или Stentz et al. Appl. Environ. Microbiol. 66 (2000), 4272-4278 или Varmanen et al. J. Bacteriology 182 (2000), 146-154. В качестве альтернативы, рассматривается также подготовка целых клеток. Предпочтительно, описанные здесь производное или фрагмент вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, сохраняет способность специфически связываться с mutans Streptococci, которые описаны здесь в деталях.
В одном объекте настоящее изобретение относится к применению производного или мутанта или аналога или фрагмента вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, для приготовления противокариесной композиции, предпочтительно фармацевтической или косметической композиции, для лечения или предотвращения кариеса, вызванного mutans Streptococci, отличных от Streptococcus mutans. Предпочтительно, композиция содержит в себе микроорганизм, принадлежащий к группе молочнокислых бактерий, который способен специфически связываться с mutans Streptococci или мутантом, производным, аналогом или фрагментом этого микроорганизма. Более предпочтительно, этот микроорганизм является осажденным микроорганизмом, как описано здесь выше, или мутантом или производным указанного микроорганизма. В дальнейшем предпочтительном варианте выполнения, указанная композиция содержит в себе микроорганизм, как описано выше, в количестве в интервале между 102 и 1012 клеток, предпочтительно, 103 и 108 клеток на мг в твердой форме композиции. Если композиция находится в жидкой форме, то количество микроорганизмов находится в интервале между 102 и 1013 клеток на мл. Однако для конкретных композиций количество микроорганизма может различаться, как описано здесь. Предпочтительная противокариесная композиция настоящего изобретения не содержит лактозу в интервале между 1% мас. и 6% мас. Также предпочтительно, чтобы композиция содержала не более чем 1% мас. лактозы, например, он содержит менее чем 1%, предпочтительно менее чем 0.9% мас., 0.8% мас. лактозы и т.д., или что композиция содержит более чем 6%, 7%, 8% мас. лактозы и т.д. В качестве альтернативы, но также предпочтительно, чтобы композиция не содержала лактозу.
В другом объекте такая противокариесная композиция может быть получена путем включения этапов разработки рецептуры микроорганизма, принадлежащего к группе молочнокислых бактерий, которые способны специфически связываться с mutans Streptococci или мутантом, производным, аналогом или фрагментом этого микроорганизма с косметически, перорально или фармацевтически приемлемым носителем или наполнителем. Предпочтительно этот микроорганизм - это осажденный микроорганизм, как описано здесь выше, или его мутант, производное, аналог или фрагмент. Предпочтительная противокариесная композиция, используемая согласно настоящему изобретению, не содержит лактозу в интервале между 1% мас. и 6% мас. Также предпочтительно, чтобы композиция содержала не более чем 1% мас. лактозы, например, он содержит менее чем 1%, предпочтительно, менее чем 0.9% мас., 0.8% мас. лактозы и т.д., или противокариесная композиция содержит более чем 6%, 7%, 8% и т.д. мас. лактозы. В качестве альтернативы, но также предпочтительно, чтобы противокариесная композиция не содержала лактозы.
Термин «композиция», как использовано согласно настоящему изобретению, относится к композиции (композициям), которая (которые) содержит в себе по меньшей мере один микроорганизм или его мутант, или производное, как описано выше, предпочтительно осажденный микроорганизм, как описано выше, или аналог, или фрагмент указанного микроорганизма. Рассматривается, что композиции, используемые согласно настоящему изобретению, которые описаны здесь ниже, содержат в себе вышеупомянутые ингредиенты в любой комбинации. Они могут необязательно содержать в себе по меньшей мере один дополнительный ингредиент, подходящий для предотвращения или лечения кариеса. Соответственно, они могут необязательно содержать в себе любую комбинацию описанных здесь далее ингредиентов. Термин «ингредиенты, подходящие для предотвращения и/или лечения кариеса» включают в себя соединения или их композиции и/или комбинации, которые либо ингибируют связывание mutans Streptococci с поверхностью зубов и с пленкой и/или которые инактивируют mutans Streptococci. Более предпочтительно, указанный термин включает в себя соединения или их композиции и/или комбинации, которые могут ингибировать адгезию mutans Streptococci на поверхности зубов, ингибировать активность гликозилтрансфераз mutans Streptococci, ингибировать или инактивировать mutans Streptococci, ингибировать агглютинин-зависимое связывание mutans Streptococci и/или ингибировать сахарозозависимое связывание mutans Streptococci, как будет указано ниже.
В частности, рассматривается, что композиция необязательно далее содержит в себе соединения, которые ингибируют адгезию mutans Streptococci на поверхности зуба. Соответственно, рассматривается, что такое соединение является ингибитором сигнального пептида CSP Streptococcus mutans. Указанный ингибитор описывается в СА 2,302,861, поскольку он является производным или фрагментом указанного CSP, который конкурентно ингибирует связывание указанного CSP с его природным рецептором, рецептором гистидин-киназы, или который является антителом к указанному CSP. Указанный ингибитор предотвращает появление окружения из биопленки зубного налета на поверхности зубов и, таким образом, предотвращает mutans Streptococci. В качестве альтернативы, композиция, используемая согласно настоящему изобретению, может необязательно в дальнейшем содержать в себе фрагменты полипептидов антигена I/II Streptococcus mutans, которые полезны в лечении и/или предотвращении кариеса зубов. Такие полипептидные фрагменты описаны в US 6,500,433. Именно, указанные полипептидные фрагменты могут иметь способность к адгезии к зубной поверхности млекопитающих посредством связывания с агглютинином, конкурируя с природно встречающимся антигеном I/II Streptococcus mutans, таким образом, предотвращая или уменьшая адгезию S. mutans на зубе. Некоторые из пептидов из US 6.500.433, как было показано, подавляют адгезию S. mutans к модельной поверхности зуба (цельная слюна человека, адсорбированная в лунках плашек для микротитрования из полистирола или на шариках из гидроксиапатита). Соответственно, US 6,500,433 описывает эти пептиды, как содержащие один или более с сайтов адгезии, и которые будут способны к адгезии к зубу млекопитающего, конкурируя с природно встречающимся SA I/II. Другим дополнительным ингредиентом, используемым согласно настоящему изобретению, является белок адгезии, ассоциированный с фимбриллами, из Streptococus mutans, SmaA, или его фрагмент, как описано в WO 00/66616. Белок SmaA является белком адгезии из фимбрилл S. mutans, которые обеспечивают прикрепление бактерий к пленке слюны, как полагают, посредством связывания с 52 кДа белком слюны, амилазой. У зрелого белка SmaA низкая молекулярная масса около 65 кДа, как измерено в истощенном полиакриламидном геле, показывает способность к связыванию амилазы и является главным иммунодоминантным фимбриальным белком S. mutans. Соответственно, SmaA, как полагают, конкурирует с mutans Streptococci за сайты адгезии на поверхности зубов.
Как описано выше, рассматривается, что соединения, которые ингибируют активность гликозилтрансферазы mutans Streptococci, необязательно далее содержатся в композиции, используемой согласно настоящему изобретению. Например, US 2004/0057908 описывает смесь терпеноидов и флавоноидов, которые ингибируют активность указанных гликозилтрансфераз. Duarte et al., Biol. Pharm. Bull. 26 (2003), 527-531 описывают действие нового типа прополиса и его химических составляющих на гликозилтрансферазы и на рост и адгезию Streptococcus mutans. Соответственно, указанный новый тип прополиса и его химические составляющие рассматриваются как возможные дальнейшие ингредиенты композиции, используемой согласно настоящему изобретению. Koo et al., J. Antimicrob. Chemother. 52 (2003), 782-789 описывает, что апигенин и tt-фарнезол ингибируют накопление пленки Streptococcus mutans и продукцию полисахаридов. Следовательно, апигенин и tt-фарнезол рассматривают как возможные составляющие композиции, используемой согласно настоящему изобретению. Так как эфиры жирных кислот описаны в Devulapalle et al., Carbohydr. Res. 339 (2004), 1029-1034 как влияющие на активность гликозилтрансферазы, указанные углеводы и эфиры жирных кислот рассматривают как возможные составляющие для композиции, используемой согласно настоящему изобретению. Непосредственное ингибирование Streptococcus mutans описано, например, в WO 2004/000222. Именно, генетически модифицированные бактериофаги, специфические к Streptococcus mutans, используют для лечения бактериального кариеса, вызванного Streptococcus mutans. WO 2004/017988 описывает композицию биологически активной протеазы и по меньшей мере одной биологически активной гликозидазы, которая используется для лечения бактериального кариеса. Imazato et al., Biomaterials 24 (2003), 3605-3609 описывают, что бромид метакрилоилоксидодецилпиридина (MDPB) используется для ингибирования роста Streptococcus mutans. Соответственно, рассматривается возможное дальнейшее содержание вышеупомянутых соединений в композиции, используемой согласно настоящему изобретению. Бычий молочный лактоферрин, описанный Mitoma et al., J. Biol. Chem. 276 (2001), 18060-18065 или экстракты Helichrysum italicum, Nostro et al., Lett. Appl. Microbiol. 38 (2004), 423-427, которые ингибируют агглютинин-зависимое или сахарозозависимое связывание Streptococcus mutans, рассматриваются как возможные составляющие в композиции, используемой согласно настоящему изобретению. Более того, композиция, используемая согласно настоящему изобретению, может далее необязательно содержать в себе мутаназу (1,3-глуканазу), которая описана, например в DE 2152620 или Fuglsang (2000), цитируемый здесь, или антибиотик против Streptococcus mutans, например, описанный в US 6.342.385: US 5.932.469: US 5.872.001 или US 5.833.958. В дополнение, отмечают, что композиция, используемая согласно настоящему изобретению, может необязательно содержать в себе один или более вышеупомянутых необязательных ингредиентов, подходящих для предотвращения и/или лечения кариеса. Таким образом, указанная композиция может содержать в себе по меньшей мере два, три, четыре, пять и т.д., т.е. "n" необязательных ингредиентов, где "n" - это целое число, больше, чем 2, что не является ограничением. Указанные необязательные ингредиенты могут сочетаться в любых возможных комбинациях. Композиция может быть твердой, жидкой или газообразной и может быть, среди прочего, в форме порошка (порошков), таблетки (таблеток), приготовленной пленки (пленок), раствора (растворов), аэрозоля (аэрозолей), гранул, пилюль, суспензий, эмульсий, капсул, сиропов, жидкостей, эликсиров, экстрактов, настоек или жидких экстрактов, или в форме, особенно подходящей для перорального применения.
Жидкие препараты, подходящие для перорального применения, например, сиропы, могут быть приготовлены с применением воды, обычных сахаров, таких как сахароза, сорбитол и фруктоза, гликолей, таких как полиэтиленгликоль и пропиленгликоль, масел, таких как кунжутное масло, оливковое масло и соевое масло, антисептиков, таких как п-гидроксибензойный эфир, консервантов, таких как производные гидроксибензоата, например, метил п-гидроксибензоат и бензоат натрия, и других соединений, таких как ароматизаторы, например, клубничный ароматизатор или ароматизатор перечной мяты.
Далее могут быть приготовлены смеси, подходящие для перорального применения, например, таблетки, порошки и гранулы, с применением обычных сахаров, такие как сахароза, глюкоза, маннитол и сорбитол, крахмалы, такие как картофельный, пшеничный и кукурузный крахмалы, неорганические соединения, такие как карбонат кальция, сульфат кальция, гидрокарбонат натрия и хлорид натрия, растительные порошки, такие, как кристаллическая целлюлоза, лакричный порошок и порошок горечавки, наполнители, такие, как пинедекс, дезинтеграторы, такие как крахмал, агар, желатиновый порошок, кристаллическая целлюлоза, натрия кармеллоза, кальция кармеллоза, карбонат кальция, гидрокарбонат натрия и альгинат натрия, лубриканты, такие как стеарат магния, тальк, гидрогенизированные масла из овощей, макроголь и силиконовое масло, связующие соединения, такие, как поливиниловый спирт, гидроксипропилцеллюлоза, метилцеллюлоза, этилцеллюлоза, кармеллоза, желатин и жидкий крахмальный клей, ПАВ, такие, как эфиры жирных кислот, и пластификаторы, такие как глицерин. Приготовленная пленка (пленки) может быть приготовлена с применением способов, известных в данной области техники. Пример приготовления пленки находится здесь, в Примере 27.
В случае обычного перорального применения доза описанного выше микроорганизма или аналога или фрагмента могла составлять (в сухой массе), как описано здесь выше, по отношению к числу клеток или по отношению к массе, например, 1 мкг на 50 г, 1 мкг на 10 г, 1 мкг на 5 мг, 1 мкг на 1 мг или какую-либо другую массу на человека в день или отдельными частями ежедневно. В случае дозировки животным, не относящимся к человеку, далее доза может варьироваться в зависимости от возраста и вида животного, и от природы и остроты симптомов. Без каких-либо специальных ограничений, доза для животных составляет 0.1 мг на 10 г на 1 кг массы тела, предпочтительно 1 мг на 1 г на 1 кг массы тела один раз в день или отдельными порциями. Однако эти дозы и количество доз варьируются в зависимости от индивидуального состояния. Предпочтительно, противокариесная композиция, используемая согласно настоящему изобретению, является косметической композицией, далее содержащей в себе косметически приемлемый носитель или наполнитель. Более предпочтительно, указанная косметическая композиция представляет собой зубную пасту, жевательную резинку, пастилки, промывание для ротовой полости, полоскание для ротовой полости, зубную нить или зубную ленту, которые обладают активностью против mutans Streptococci. Предпочтительная косметическая композиция, используемая согласно настоящему изобретению, не содержит лактозы в интервале между 1% (по массе) и 6% (по массе). Также предпочтительно, чтобы косметическая композиция содержала не более чем 1%(по массе) лактозы, например, менее чем 1%, предпочтительно менее чем 0.9% (по массе), 0.8% (по массе) лактозы и т.д., или чтобы косметическая композиция содержала более чем 6%, 7%, 8% и т.д. (по массе) лактозы. В качестве альтернативы, но также предпочтительно, чтобы косметическая композиция не содержала лактозы.
Косметическая композиция, используемая согласно настоящему изобретению, содержит в себе микроорганизм, его мутант, производное, аналог или фрагмент, как описано выше в связи с композицией изобретения и с косметически или перорально приемлемым носителем далее. Предпочтительным является, как указывается в связи с композицией, используемой согласно настоящему изобретению, микроорганизм, его мутант, производное, аналог или фрагмент, как описывается здесь выше. Предпочтительно, косметическая композиция, используемая согласно настоящему изобретению, подходит для перорального применения. Соответственно, она может быть в форме зубной пасты, зубного порошка, топического геля для ротовой полости, полоскания для ротовой полости, продукта для зубных протезов, спрея для ротовой полости, пастилок, таблеток для перорального применения, жевательной резинки, зубной нити или зубной ленты.
Термин «перорально или косметически приемлемый носитель», как используется здесь, обозначает подходящий переносчик, который можно использовать для применения настоящих композиций в ротовой полости безопасным и эффективным образом. Такие переносчики могут включать в себя вещества, такие как источники фторид-ионов, дополнительные агенты против зубного камня, буфера, другие абразивные материалы, источники пероксида, бикарбонатные соли щелочных металлов, загущающие материалы, увлажнители, воду, ПАВ, диоксид титана, ароматизаторы, подсластители, ксилитол, красители и их смеси. Термин «безопасное и эффективное количество», используемый здесь, обозначает достаточное количество для очищения зубов и уменьшения пятен/налета/воспаления десен/зубного камня без повреждения ткани и структуры ротовой полости. pH настоящих описанных здесь композиций лежит в интервале приблизительно от 3.0 до приблизительно 9.0, с предпочтительным pH в интервале приблизительно от 5.5 до приблизительно 9.0 и наиболее предпочтительным pH в интервале приблизительно от 7.0 до приблизительно 8.5 или 9.0.
Косметическая композиция является продуктом, который при обычном способе использования, не применяется международно для системного назначения отдельных терапевтических агентов, но она в значительной мере остается в ротовой полости на время, достаточное для существенного контакта с поверхностью зубов и/или тканями ротовой полости для целей активирования ротовой полости. Пероральная композиция может быть однофазной пероральной композицией или может быть комбинацией двух или более пероральных композиций.
Термин «средство для ухода за зубами», используемый здесь, обозначает пасту, гель или жидкую рецептуру, если не указано иное. Композиция средства для ухода за зубами может находиться в любой желаемой форме, такой как насквозь полосатой, полосатой на поверхности, многослойной, имеющей в своем составе гель, окружающий пасту, или любую их комбинацию. Композиция средства для ухода за зубами может содержаться в физически разделенных участках дозатора и дозируемых от стороны к стороне. Композиции для ухода за зубами описаны, например, в ЕР-В1 0617608.
Предпочтительные композиции для ухода за зубами описаны в Примерах 21-24. в дополнение к вышеуказанным компонентам, композиции для ухода за зубами этого изобретения могут содержать ряд необязательных ингредиентов средства для ухода за зубами, некоторые из которых описаны ниже. Необязательные ингредиенты включают в себя, например, но не ограничивают, адгезивные материалы, вспениватели, ароматизаторы, подсластители, дополнительные агенты против налета, дополнительные абразивные вещества и красители. Эти и другие необязательные компоненты далее описаны, например, в US 5.004.597: US 4.885.155: US 3.959.458 и US 3.937.807.
Например, зубная паста может включать в себя ПАВ, хелатирующие агенты, источники фтора, вещества для отбеливания зубов и для изменения цвета зубов, загущающие агенты, увлажнители, ароматизаторы и подсластители, бикарбонатные соли щелочных металлов, разнообразные носители и/или другие активные агенты.
Одним из предпочтительных необязательных агентов, используемых согласно настоящему изобретению, является ПАВ, предпочтительно один, выбранный из группы, состоящей из ПАВ группы саркозинатов, тиоцианатов и тауратов. Предпочтительно использовать здесь аммонийные соли или соли щелочных металлов этих ПАВ. Наиболее предпочтительно использовать здесь натриевые и калиевые соли следующих: лауроил саркозинат, миристоил саркозинат, пальмитоил саркозинат, стеароил саркозинат и олеоил саркозинат.
Другим предпочтительным необязательным агентом является хелатирующий агент, такой как винная кислота и ее фармацевтически приемлемые соли, лимонная кислота и цитраты щелочных металлов и их смеси. Хелатирующие агенты способны образовывать комплекс с кальцием, находящимся в клеточной стенке бактерий. Хелатирующие агенты также могут разрушать налет посредством удаления кальция из кальциевых мостиков, которые помогают этой биомассе оставаться нетронутой.
Обычно имеется дополнительное водорастворимое фторсодержащее соединение, присутствующее в зубной пасте и других пероральных композициях в достаточном количестве, чтобы получить концентрацию фторид-ионов в композиции при 25°С, и/или когда используется концентрация приблизительно от 0.0025% до приблизительно 5.0% по массе, предпочтительно приблизительно от 0.005% до приблизительно 2.0% по массе, для того чтобы обеспечить дополнительную противокариесную эффективность. Широкое разнообразие соединений, дающих фторид-ионы, может применяться в качестве источника растворимых фторидов в настоящих композициях. Примеры подходящих соединений, дающих фторид-ионы, находятся в US 3.535,421 и US 3.678.154. Представленные источники фторид-ионов включают в себя фторид олова, фторид натрия, фторид калия, монофторфосфат натрия и многие другие. Фторид олова и фторид натрия особенно предпочтительны, так же как и их смеси.
Композиции для ухода за ротовой полостью, используемые согласно настоящему изобретению, могут также содержать в себе вещества для отбеливания зубов, включающие в себя отбеливающие или окисляющие агенты, такие как пероксиды, пербораты, перкарбонаты, пероксикислоты, персульфаты, хлориты металлов и их сочетания. Подходящие пероксиды включают в себя пероксид водорода, пероксид мочевины, пероксид кальция и их смеси. Предпочтительным перкарбонатом является перкарбонат натрия. Другие подходящие отбеливающие агенты включают в себя персульфаты калия, аммония, натрия и лития и пербораты моно- и тетрагидратов, и пероксигидрат пирофосфата натрия. Подходящими хлоритами металлов являются хлорит кальция, хлорит бария, хлорит магния, хлорит натрия и хлорит калия. Предпочтительным хлоритом является хлорит натрия. Дополнительными отбеливающими агентами могут служить гипохлориты и диоксид хлора.
В дополнение к зубным отбеливающим агентам, можно рассматривать соединения, меняющие цвет зубов, как средства по уходу за ротовой полостью, используемые в настоящем изобретении. Эти вещества могут подходить для изменения окраски зубов для удовлетворения потребителя. Эти соединения включают в себя частицы, которые, при применении к поверхности зуба, модифицируют эту поверхность по показателю абсорбции и/или отражения света. Такие частицы обеспечивают выгодный внешний вид, когда пленка, содержащая такие частицы, применяется к поверхности зуба или зубов.
При приготовлении зубной пасты или геля необходимо добавлять некоторые загущающие соединения для обеспечения желаемой консистенции композиции, для обеспечения проявления желаемых активных характеристик при использовании, для обеспечения стабильности выступа и для обеспечения стабильности композиции и т.д. Предпочтительными загущающими агентами являются карбоксивиниловые полимеры, каррагенан, гидроксиэтилцеллюлоза, лапонит и водорастворимые соли сложных эфиров целлюлозы, таких как натриевая соль карбоксиметилцеллюлозы и карбоксиметилгидроксиэтилцеллюлозы. Также могут использоваться природные смолы, такие как смола карайа, гуммиарабик, ксантановая смола и трагакантовая камедь. Коллоидный алюмосиликат магния или тонко разделенный кремний может использоваться в качестве части загущающего агента для дальнейшего улучшения текстуры.
Другим необязательным компонентом топических переносчиков для ротовой полости композиций данного соединения является увлажнитель. Увлажнитель служит для того, чтобы беречь композицию зубной пасты от повреждения под воздействием воздуха, чтобы придавать композиции ощущение влажности во рту и, для отдельных увлажнителей, включить желаемую сладость или аромат в состав зубной пасты. Увлажнитель, на основе чистого увлажнителя, в основном содержит в себе приблизительно от 0% до приблизительно 70%, предпочтительно приблизительно от 5% до приблизительно 25%, от массы композиций, указанных здесь. Подходящими увлажнителями для применения в составах данного изобретения являются съедобные многоатомные спирты, такие как глицерин, сорбитол, ксилитол, бутиленгликоль, полиэтиленгликоль и пропиленгликоль, особенно сорбитол и глицерин.
Ароматизирующие и подслащивающие агенты также можно добавить в композиции. Подходящие ароматизирующие агенты включают в себя масло зимолюбки, масло перечной мяты, масло курчавой мяты, масло гвоздичных бутонов, ментол, анетол, метилсалицилат, эвкалиптол, кассию, 1-ментилацетат, шалфей, эвгенол, масло петрушки, оксанон, альфа-иризон, майоран, лимон, апельсин, пропенилгваэтол, корицу, ванилин, тимол, линалоол, глицеролацеталь коричного альдегида, известный как CGA, и их смесей. Ароматизирующие агенты обычно используют в составах в концентрации приблизительно от 0.001% до приблизительно 5%, от массы композиции.
Подслащивающие агенты, которые можно использовать, включают в себя сахарозу, глюкозу, сахарин, декстрозу, левулозу, лактозу, как описывается здесь выше, маннитол, сорбитол, фруктозу, мальтозу, ксилитол, соли сахарина, тауматин, аспартам, D-триптофан, дигидрохальконы, ацесульфам и цикламатные соли, особенно цикламат натрия и натриевая соль сахарина, и их смеси. Композиция предпочтительно содержит приблизительно от 0.1% до приблизительно 10% этих агентов, предпочтительно приблизительно от 0.1% до приблизительно 1%, от массы состава.
Настоящее изобретение также может включать в себя бикарбонатные соли щелочных металлов. Бикарбонатные соли щелочных металлов растворимы в воде и, если не стабилизировать их, стремятся к высвобождению диоксида углерода в водной системе. Бикарбонат натрия, также известный как пищевая сода, является предпочтительной бикарбонатной солью щелочных металлов. Настоящая композиция может содержать приблизительно от 0.5% до приблизительно 30%, предпочтительно приблизительно от 0.5% до приблизительно 15%, и наиболее предпочтительно приблизительно от 0.5% до приблизительно 5% бикарбонатной соли щелочного металла. Вода, используемая в приготовлении коммерчески подходящих композиций для ротовой полости, должна предпочтительно обладать низким содержанием ионов и быть свободной от органических примесей. Вода в основном содержит в себе приблизительно от 10% до приблизительно 50%, и предпочтительно приблизительно от 20% до приблизительно 40%, от массы композиции для ухода за зубами, приведенной здесь. Эти количества воды включают в себя свободную воду, которую добавляют, и ту, которая добавляется вместе с другими соединениями, такими как сорбитол. Диоксид титана также можно добавить в настоящую композицию. Диоксид титана представляет собой белый порошок, который добавляет мутности в композиции. Диоксид титана обычно содержится приблизительно от 0.25% до приблизительно 5% от массы композиции для ухода за зубами.
pH настоящих композиций предпочтительно доводят с помощью буферных агентов. Буферные агенты, используемые здесь, относятся к агентам, которые могут быть использованы для доведения pH композиций в интервале приблизительно от 4.5 до приблизительно 9.5. Буферные агенты включают в себя мононатриевую соль фосфорной кислоты, тринатриевую соль фосфорной кислоты, гидроксид натрия, карбонат натрия, кислый пирофосфат натрия, лимонную кислоту и цитрат натрия. Буферные агенты могут применяться в концентрации приблизительно от 0.5% до приблизительно 10%, от массы настоящих композиций. pH композиций для ухода за полостью рта измеряется в их жидком водном растворе 3:1, например, 3 части воды к 1 части зубной пасты.
Другими необязательными агентами, которые можно использовать в настоящем изобретении, являются диметиконы кополиолы, выбранные из алкил- и алкокси-диметикон кополиолов, таких как С12-С20 алкил-диметикон кополиолы и их смеси. Высоко предпочтительным является цетил-диметикон кополиол, поставляемый под маркой Abil EM90. этот диметикон кополиол в основном присутствует в концентрации приблизительно от 0.01% до приблизительно 25%, предпочтительно приблизительно от 0.1% до приблизительно 5%, более предпочтительно приблизительно от 0.5% до приблизительно 1.5% по массе. Диметикон кополиолы обеспечивают выгоду для зубов. Другие полезные носители включают в себя двухфазные рецептуры зубной пасты, такие как рассматривались в US 5,213.790; US 5.145.666; US 5.281.410; US 4,849,213 и US 4,528.180.
Настоящие косметические композиции могут также включать в себя другие активные ингредиенты, такие как противомикробные агенты. Среди таких агентов включаются водонерастворимые некатионные противомикробные агенты, такие как галогенированные дифенильные эфиры, фенольные соединения, включающие в себя фенол и его гомологи, моно- и полиалкильные и ароматические галогенофенолы, резорцинол и его производные, бисфенольные соединения и галогенированные салициланилиды, бензойные эфиры и галогенированные карбоанилиды. Водорастворимые противомикробные агенты включают в себя четвертичные соли аммония и соли би-бисгуанида, среди прочих. Монофосфат триклозана является дополнительным водорастворимым противомикробным агентом. Четвертичные соли аммония включают в себя такие соли, в которых один или два заместителя четвертичного азота несут в своем составе длинную углеродную цепь (обычно алкильные группы) приблизительно от 8 до приблизительно 20, обычно приблизительно от 10 до приблизительно 18 атомов углерода, в то время как оставшиеся заместители (обычно алкильная или бензильная группы) содержат в своем составе более низкое количество атомов углерода, такое как приблизительно от 1 до приблизительно 7 атомов углерода, обычно метильные или этильные группы. Бромид додецилтриметиламмония, хлорид тетрадецилпиридина, бромид домифена, хлорид N-тетрадецил-4-этилпиридина, бромид додецилдиметил(2-феноксиэтил) аммония, хлорид бензилдиметилстеариламмония, хлорид цетилпиридина, четвертичный 5-амино-1,3-бис(2-этилгексил)-5-метилгексагидропиримидин, безалконий хлорид, безтезоний хлорид и метилбезтезоний хлорид являются примерами типичных четвертичных аммонийных солей как противомикробных агентов. Другие соединения включают в себя бис[4-(R-амино)-1-пиридин]алканы, как указано в US 4,206,215. Другие противомикробные агенты, такие как бисглицинат меди, глицинат меди, цитрат цинка, лактат цинка, также могут быть включены. Ферменты представляют собой другой тип активных соединений, который можно использовать в настоящих композициях. Полезные ферменты включают в себя те, которые принадлежат к категории протеаз, литических ферментов, ингибиторов матрицы налета и оксидаз. Протеазы включают в себя папаин, пепсин, трипсин, фицин, бромелин, литические ферменты клеточной стенки включают в себя лизоцим, ингибиторы матрицы налета включают в себя декстраназы, мутаназы, и оксидазы включают в себя глюкозооксидазу, лактатоксидазу, галатозооксидазу, оксидазу мочевой кислоты, пероксидазы, включающие в себя пероксидазу хрена, миелопероксидазу, лактопероксидазу, хлоропероксидазу. Оксидазы также обладают отбеливающей/чистящей активностью, в дополнение к противомикробным свойствам. Такие агенты описаны в US 2,946,725 и US 4,051,234. Другие противомикробные агенты включают в себя хлоргексидин, триклозан, монофосфат триклозана, и ароматические масла, такие как тимол. Триклозан и другие агенты этого типа описаны в US 5,015,466 и US 4,894,220. Такие агенты, которые обеспечивают противоналетный эффект, могут присутствовать в концентрации приблизительно от 0.01% до приблизительно 5.0%, от массы композиции для ухода за зубами.
Термин «жевательная резинка», как определено здесь, обозначает кондитерскую композицию, которая подходит для жевания и который содержит в себе какое-либо подходящее количество эластомера, известного специалистам в данной области техники, предпочтительно в количестве 2% или более от массы композиции. Подходящие компоненты пастилок и жевательной резинки описаны, например, в US 4,083,955; US 6,770,264 или US 6,270,781. Предпочтительные пастилки описаны в Примерах 19 и 20. Предпочтительная композиция жевательной резинки описана в Примере 25. Композиции, используемые согласно настоящему изобретению, предпочтительно содержат в себе эластомер, или смесь нескольких разных эластомеров. Эластомерные материалы обычно известны в данной области техники, но иллюстративные примеры включают в себя стирол-бутадиеновый каучук (SBR); синтетические смолы, полиизобутилен и изобутилен-изопреновые сополимеры, природные смолы, чикл, натуральный каучук, джелутонг, балату, гуттаперчу, lechi caspi; sorva и их смеси. Композиции, используемые согласно настоящему изобретению, предпочтительно содержат в себе приблизительно от 2% до приблизительно 30%, более предпочтительно приблизительно от 5% до приблизительно 25%, от массы эластомера. Эти концентрации определяются конечным желаемым составом жевательной резинки, т.к. если общее содержание эластомера ниже 2%, базовая композиция теряет эластичность, жевательную текстуру и свойство сцепления, в то время как при концентрации выше 30% рецептура становится твердой, резиновой и делает жевание затрудненным. Растворители эластомеров также предпочтительно присутствуют в композициях, используемых согласно настоящему изобретению, т.к. они обеспечивают смягчение эластомерного компонента. Предпочтительные примеры растворителей эластомеров, используемых здесь, включают в себя пентаэритритоловый эфир частично гидрогенированной древесной смолы, пентаэритритоловый эфир древесной смолы, глицероловый эфир древесной смолы, глицероловый эфир частично димеризованной древесной смолы, глицероловый эфир полимеризованной смолы, глицероловый эфир таллового масла, древесной или каучуковой смолы, глицероловый эфир частично гидрогенированной древесной смолы, метиловый эфир частично гидрогенированной смолы, и их смеси. Композиции, используемые согласно настоящему изобретению, предпочтительно содержат в себе приблизительно от 2% до приблизительно 50%, более предпочтительно приблизительно от 10% до приблизительно 35%, от массы растворителя эластомера.
Пастилки для применения согласно настоящему изобретению могут быть приготовлены, например, известными в данной области техники способами для формирования сжатых таблеток, где дисахарид распределен по сжатому твердому носителю, необязательно смешан с каким-либо подходящим таблетирующим агентом, таким как лубриканты (например, стеарат магния) и сжат в таблетки. Твердым носителем для таких таблетированных рецептур может быть твердое вещество, растворимое в слюне, такое как растворимый в холодной воде крахмал, или моносахарид, так что пастилка будет легко растворяться в ротовой полости с высвобождением содержащегося в ней кислотного дисахарида в растворе слюны для контакта и абсорбции мукозой ротовой полости/носоглотки, при помещении пастилки в рот. pH вышеописанных рецептур может лежать в интервале приблизительно от 4 до приблизительно 8.5.
Пастилки для применения согласно настоящему изобретению могут также быть приготовлены с применением других известных в данной области техники способов получения твердых рецептур единичной дозировки.
Промывание для ротовой полости или полоскание для ротовой полости, используемое согласно настоящему изобретению, может быть предпочтительно приготовлено, как указано ниже:
А должно быть хорошо размешано, В добавляют при перемешивании и С добавляют после. Конечную чистую жидкость нужно отфильтровать в течение 48 ч после приготовления. Другое предпочтительное промывание для ротовой полости описано в Примере 26.
В зависимости от формы дозировки, жидкой или твердой, в одном предпочтительном варианте выполнения настоящего изобретения дозировочная форма помещается пациенту в рот на период времени, обеспечивающий контакт микроорганизма или аналога или фрагмента вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, с ротовой полостью пациента.
Термины «зубная нить» и «зубная лента», используемые здесь, относятся к материалам для вытеснения и удаления разлагающихся частиц пищи, которые накапливаются на межпроксимальной и сублингвальной поверхностях, и для вытеснения и удаления бактерий, налета и/или зубного камня, который накапливается в ротовой полости. Зубная нить или зубная лента могут в дальнейшем содержать в себе, в дополнение к микроорганизмам согласно настоящему изобретению, как описывается здесь выше, чистящие агенты, абразивные материалы, ингредиенты для контроля винного камня, отбеливатели, ПАВ и/или активные ингредиенты, подобные фторидам, противомикробным агентам, химиотерапевтическим агентам или антибиотикам. Далее дополнительными агентами являются агенты против налета, ароматизаторы и красители. Зубная нить или зубная лента может быть в любой подходящей форме, известной специалисту в данной области техники, например, в форме PTFE (Тефлон) зубной нити, как описано, например, в US 3,664,915, US 3,953,566, US 3,962,153, US 4,096,227, US 4,187,390, US 4,256,806, US 4,385,093, US 4,478,665, US 4,776,358, US 5,033,488, US 5,209,251, US 5,220,932, US 5,518,012, US 5,718,251, US 5,765,576 или US 5,911,228, в форме монофиламентного межпроксимального приспособления, как описано, например, в US 3,800,812, US 4,974,615, US 5,760,117, US 5,433,226, US 5,479,952, US 5,503,842, US 5,755,243, US 5,884,639, US 6,003,525 или US 6,027,592, или в форме лент из биокомпонентов. Предпочтительно, чтобы зубная нить или зубная лента были в форме элатомерного покрытого монофиламента, как описано, например в US 20050226820 или в форме ориентированной с термопластической основой зубной ленты, как описано, например, в US 20020144704.
Противокариесные косметические композиции, как описано здесь выше, могут быть использованы в рамках перорального применения у человека, так же как и в рамках перорального применения у животных в ветеринарии, предпочтительно млекопитающих, но не человека, более предпочтительно для домашних животных. Если противокариесная косметическая композиция используется в ветеринарии в рамках перорального применения у животных, композиция может далее содержать в себе ингредиенты, подходящие для такого применения, как известно специалистам в данной области техники.
В другом объекте настоящее изобретение относится к применению микроорганизма, принадлежащего к группе молочнокислых бактерий, который способен специфически связываться с бактериями, принадлежащими к группе mutans Streptococci, как описано выше, для приготовления фармацевтической композиции для лечения или профилактики кариеса, mutans Streptococci, отличными от Streptococcus mutans. Предпочтительно, такая фармацевтическая композиция содержит в себе микроорганизм или его производное, или аналог, или мутант, или фрагмент, как описано выше. Более предпочтительно, чтобы фармацевтическая композиция далее содержала в себе фармацевтически приемлемый носитель или наполнитель. Фармацевтические композиции содержат в себе терапевтически эффективное количество вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, или его производное, мутант, аналог или фрагмент указанного микроорганизма, описанного в связи с композицией, используемой согласно настоящему изобретению, и которая может быть получена в различной форме, например, в твердой, жидкой, в форме порошка, в водной форме и лиофилизированной форме.
Фармацевтическая композиция может назначаться пациенту вместе с фармацевтически приемлемым носителем, как описано здесь. В конкретном варианте выполнения изобретения, термин «фармацевтически приемлемый» обозначает принятый агентством по регулированию или другим общеизвестным фармакопейным агентством, для применения у животных и, в частности, у человека. Предпочтительная фармацевтическая композиция, используемая согласно настоящему изобретению, не содержит лактозы в интервале между 1% (мас.) и 6% (мас.). Также предпочтительно, чтобы фармацевтическая композиция содержала не более чем 1%(мас.) лактозы, например, она содержит менее чем 1%, предпочтительно менее чем 0.9% (мас.), 0.8% (мас.) лактозы и т.д., или чтобы фармацевтическая композиция содержала более чем 6%, 7%, 8% и т.д. (мас.) лактозы. В качестве альтернативы, но также предпочтительно, чтобы фармацевтическая композиция не содержала лактозы. Термин «носитель» относится к растворителям, адъювантам, наполнителям или переносчикам, которые применяются терапевтически. Такой носитель фармацевтически приемлем, т.е. он не токсичен для реципиента при используемых дозах и концентрациях. Предпочтительно он изотонический, гипотонический или слабо гипертонический и обладает относительно низкой ионной силой, такой, которая обеспечивается раствором сахарозы. Такие фармацевтические носители могут быть стерильными жидкостями, такими как вода и масла, включая в себя петролейное, животное, растительное или масла синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Солевые растворы и водные растворы декстрозы и глицерина могут также использоваться в качестве жидких носителей, особенно для растворов для инъекций. Подходящие фармацевтические наполнители включают в себя крахмал, глюкозу, желатин, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, ионы натрия, сухое молоко, глицерин, пропилен, гликоль, воду, этанол и тому подобное. Наполнитель может содержать лактозу, как описано выше, наиболее предпочтительно, чтобы он не содержал лактозу. Композиция, при желании, может также содержать в себе малые количества увлажняющих или эмульгирующих агентов, или pH буферных агентов. Эти композиции могут быть в форме растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, рецептур, обеспечивающих высвобождение, и тому подобное. Рецептуры для перорального применения могут включать в себя стандартные носители, такие как маннитол, крахмал, стеарат магния, натриевая соль сахарозы, целлюлозы, карбонат магния фармацевтической степени чистоты. Примеры подходящих фармакологических носителей описаны в "Remington's Pharmaceutical Sciences" E.W.Martin. Молоко, сухое молоко, продукты, не содержащие лактозу или молоко, также могут быть использованы. Сухое молоко обычно суспендируется в фосфатно-солевом буфере (PBS), автоклавируется или фильтруется для удаления протеиназ и живых загрязнителей, затем сушится на холоде, сушится при нагревании, сушится под вакуумом или лиофилизируется. Некоторые другие примеры веществ, которые могут служить в качестве фармацевтических носителей, - это сахара, такие как глюкоза и сахароза, крахмалы, такие как кукурузный крахмал и картофельный крахмал, целлюлоза и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлозы и ацетаты целлюлозы, порошковый трагакант, солод, тальк, желатин, стеариновые кислоты, стеарат магния, сульфат кальция, карбонат кальция, растительные масла, такие как арахисовое масло, масло из льняного семени, кунжутное масло, оливковое масло, кукурузное масло и масло какао, полиолы, такие как пропиленгликоль, глицерин, сорбитол, манитол и полиэтиленгликоль, агар, альгиновая кислота, непирогенная вода, изотонический солевой раствор, клюква, экстракты и фосфатно-солевой буферный раствор, сухое молоко, также как и другие нетоксичные совместимые соединения, используемые в фармацевтических рецептурах, такие как витамин С, эстроген и эхинацея, например. Смачивающие агенты и лубриканты, такие как лаурилсульфат натрия, также как и красители, ароматизаторы, лубриканты, наполнители, таблетирующие агенты, стабилизаторы, антиоксиданты и консерванты, также могут присутствовать.
Предпочтительно, пероральная рецептура содержит лактозу, как описано здесь, и наиболее предпочтительно не содержит лактозу. Могут использоваться хорошо известные в данной области техники различные носители и/или наполнители, подходящие для перорального применения. Композиция, не вызывающая кариес, может, при желании, далее содержать в себе различные известные добавки, такие как консерванты, загустители, лубриканты, эмульгаторы, стабилизаторы, эссенции и тому подобное. Такие композиции будут содержать терапевтическое количество вышеупомянутых соединений, предпочтительно в очищенной форме, вместе с подходящим количеством носителя для обеспечения формы для правильного применения у пациента. Рецептура должна подходить способу применения.
В основном, ингредиенты поставляют либо отдельно, либо смешанными в единую форму дозировки, например, в качестве сухого лиофилизированного порошка или безводного концентрата в герметично запечатанном контейнере, таком как ампула или маленький пакет, показывающий количество активного агента. Тогда, когда композицию необходимо принимать посредством вливания, его можно дозировать с помощью бутыли для вливания, содержащей воду фармацевтической степени стерильности или солевой раствор. Фармацевтическая композиция изобретения может быть записана в рецепте в нейтральной или в солевой форме. Фармацевтически приемлемые соли включают в себя соли, образованные такими анионами, как полученными от хлороводородной, фосфорной, уксусной, щавелевой, винной кислот и т.д., и образованные такими катионами, как полученные от натрия, калия, аммония, кальция, гидроксидов железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.д. Исследования in vitro могут необязательно применяться для определения оптимального интервала доз. Точная доза, которую необходимо применять, также будет зависеть от вида применения, и серьезности заболевания или нарушения, и ее следует определить согласно вердикту врача и состояния каждого пациента. Эффективные дозы могут быть экстраполированы по кривым ответа реакции на дозу, полученной in vitro или на животной тестовой модельной системе. Предпочтительно, фармацевтическая композиция применяется непосредственно или в сочетании с адъювантом. Адъюванты можно выбрать из группы, состоящей из хлорохина, протоносодержащих полярных соединений, таких как пропиленгликоль, полиэтиленгликоль, глицерин, 1-метил L-2-пирролидон или их производных, или апротонных полярных соединений, таких как диметилсульфоксид (ДМСО), диэтилсульфоксид, ди-N-пропилсульфоксид, диметилсульфон, сульфолан, диметилформамид, диметилацетамид, тетраметилмочевина, ацетонитрил или их производные. Эти соединения добавляют при учете состояния pH. Композицию, используемую согласно настоящему изобретению, можно применять к позвоночным. «Позвоночное», как используется здесь, должно иметь то же самое значение, как то, которое обычно понимают специалисты в данной области техники. В частности, «позвоночное» заключает в себе млекопитающих и в частности - человека.
Термин «введено» обозначает введение терапевтического количества вышеупомянутой композиции. Под «терапевтическим эффективным количеством» понимают дозу, которая вызывает эффекты, для которых она применяется, предпочтительно, чтобы эффект был противокариесный. Точная доза будет зависеть от цели лечения и будет определена специалистами в данной области техники при помощи способов, известных в данной области техники. Как известно в данной области техники и описано выше, могут быть необходимы приспособления для системного применения с учетом локализованной доставки, возраста, массы тела, общего состояния здоровья, пола, времени применения, диеты, взаимодействия лекарств и остроты состояния, и будут определены при помощи обычных экспериментов специалистами в данной области техники.
Способы применимы как для терапии человека, так и ветеринарной терапии. Соединения, описанные здесь и имеющие желаемую терапевтическую активность, можно применять вместе с физиологически приемлемым носителем у пациента, как описано здесь. В зависимости от способа введения, соединения могут быть изготовлены по рецепту разнообразными путями, которые обсуждаются ниже. Концентрация терапевтически активного соединения в рецептуре может изменяться приблизительно от 0.1-100 мас.%. Агенты могут применяться поодиночке или в сочетании с другими видами лечения. Введение фармацевтической композиции может происходить различными путями, как обсуждалось выше, включающими в себя, но не ограниченными этим, подкожно, внутривенно, внутриартериально, интранодально, интрамедуллярно, интратекально, интравентрикулярно, интраназально, интрабронхиально, интраректально, интраперитонеально, внутримышечно, внутрилегочно, трансдермально, вагинально, ректально или внутриглазно. Предпочтительно введение перорально или буккально. Лечащий врач и клиническая картина заболевания определят протокол дозировки. Как хорошо известно в данной области медицины, дозировки для любого пациента зависят от множества факторов, включающих в себя размеры пациента, площадь поверхности тела, возраст, конкретное соединение для применения, пол, время и способ применения, общее состояние здоровья и другие лекарства, которые назначаются в то же время. Типичная доза может лежать, например, в интервале от 0.001 до 1000 мкг; однако рассматриваются дозы выше или ниже этого примерного интервала, особенно принимая во внимание вышеупомянутые факторы.
Дозировки предпочтительно назначаются один раз в неделю, однако в ходе лечения дозы могут назначаться через более длинные промежутки времени и при необходимости они могут назначаться через гораздо более короткие интервалы времени, например, ежедневно. В предпочтительном случае иммунный ответ наблюдают при помощи описанных здесь способов и далее способов, известных специалисту в данной области техники, и дозы оптимизируют, например, по времени, количеству и/или составу. Прогресс наблюдают при помощи периодических осмотров. Фармацевтическая композиция изобретения может назначаться локально или системно. Также рассматривается то, что фармацевтические композиции применяются в совместной терапии, то есть совместном применении с другими медикаментами или лекарствами, например, другими лекарствами для предотвращения, лечения или улучшения кариеса, которые описаны здесь. В другом предпочтительном варианте выполнения настоящее изобретение относится к применению микроорганизма, принадлежащего к группе молочнокислых бактерий, которые способны специфически связываться с бактериями, принадлежащими к группе mutans Streptococci, как описано здесь выше, для приготовления противокариесной композиции для лечения или профилактики кариеса, вызванного mutans Streptococci, отличными от Streptococcus mutans, где противокариесная композиция является пищевым продуктом или кормом. Предпочтительно, чтобы противокариесная композиция в виде пищевого продукта или корма являлась пищевой или кормовой композицией, содержащей микроорганизмы, их мутанты, производные, аналоги или фрагменты, как описано здесь выше, далее содержащих в себе приемлемый для перорального введения носитель или наполнитель. Более предпочтительно, чтобы микроорганизм, его мутант, производное, аналог или фрагмент являлся депонированным микроорганизмом, как описано здесь выше, или его мутантом, производным или фрагментом.
«Пища» или «корм» содержат в себе привлекательные, аппетитные или годные для питья субстанции для млекопитающих, например для человека или животных, например, домашних животных, как описано здесь. Пища и корм описаны здесь. «Перорально приемлемый носитель» описан здесь выше, и он предпочтительно нетоксичен и относится к пище или к корму. Также этот термин охватывает носители, упомянутые в связи с фармацевтической композицией, используемой согласно настоящему изобретению. Предпочтительная композиция пищи или корма, используемого согласно настоящему изобретению, не содержит лактозы в интервале между 1% и 6% мас. Также предпочтительно, чтобы композиция пищи или корма содержала не более чем 1% мас. лактозы, например, она содержит менее чем 1%, предпочтительно менее чем 0.9% мас., 0.8% мас. лактозы и т.д., или чтобы композиция пищи или корма содержала более чем 6%, 7%, 8% и т.д. мас. лактозы. В качестве альтернативного варианта, но также предпочтительно, чтобы композиция пищи или корма не содержала лактозы.
Согласно настоящему изобретению, термин «пища» включает в себя все съедобное и питьевое. Соответственно, микроорганизм, его производное, аналог или фрагмент могут быть включены в пищу или питье. Это, например, жевательная резинка, спрей, напиток, конфеты, детское питание, мороженое, замороженный десерт, сладкая приправа к салату, молочные продукты, сыр, кварк, йогурт без лактозы, кислое молоко, кофейные сливки или взбитые сливки и тому подобное.
В рамках изобретения рассматриваются продукты на молочной основе. Молоко, как мы понимаем, имеет животную основу, т.е. оно коровье, козье, овечье, буйволиное, зебры, лошадиное, ослиное или верблюжье и тому подобное. Молоко может находиться в нативном состоянии, в восстановленном, в снятом или молоком, обогащенным соединениями, необходимыми для роста бактерий или для последующего получения ферментированного молока, таких как жир, белки дрожжевого экстракта, пептон и/или ПАВ, например. Термин «молоко» также применим для так называемого растительного молока, т.е. экстрактам растений, которые были обработаны или не обработаны, такие как бобовые растения (соя, горох, чечевица и тому подобное) или масличные культуры (рапс, соя, кунжут, хлопок и тому подобное), чьи экстракты содержат белки в растворе или в коллоидной суспензии, которые коагулируются при химическом действии, кислой ферментацией и/или нагреванием. Наконец, слово «молоко» также обозначает смеси молока животного и растительного происхождения.
Когда микроорганизм данного изобретения или его производное или аналог или фрагмент добавляют в йогурт и тому подобное, имеющее схожее содержимое, достаточно добавить микроорганизм из этого изобретения в концентрации приблизительно 105-107 клеток на мл. В таком случае возможно полностью предотвратить или ингибировать кариес зубов, вызванный кариогенными штаммами mutans Streptococci без значительных побочных эффектов на качество питья самого по себе.
Такую пищу, питье или корм можно получить при помощи общих способов получения пищи и напитков и корма, включая добавление активного ингредиента в сырую или приготовленную пищу, питье или корм. Пища, питье или корм согласно настоящему изобретению, могут быть сформованы и гранулированы в манере, аналогичной обычно используемой для пищи, питья и корма. Способ формования и грануляции включает в себя способы грануляции, такие как грануляция в жидком слое, грануляция перемешиванием, грануляция экструзией, грануляция обкатыванием, грануляция в потоке газа, грануляция прессованием-формовкой, грануляция растрескиванием, грануляция распылением и грануляция впрыскиванием, способы покрытия, такие как покрытие на противне, покрытие в жидком слое и сухое покрытие, сушка обдуванием, способ избыточного пара, способ пенного покрытия, способы расширения, такие как способ инкубации в микроволновой печи, и способы экструзии, с машиной для грануляции экструзией и экструдерами.
Пища, питье или корм, которые используются в настоящем изобретении, включают в себя любую пищу, питье или корм, которые содержат в себе микроорганизм по изобретению, его производное или аналог или фрагмент в качестве активного ингредиента. Активный ингредиент в пище, питье или корме не ограничен конкретно какой-либо концентрацией, пока конечная пища, питье или корм могут проявлять активность в специфическом связывании mutans Streptococci. Концентрация активного ингредиента предпочтительно от 0.001 до 100% по массе, более предпочтительно от 0.01 to 100% по массе, и наиболее предпочтительно от 0.1 до 100% от массы пищи, питья или корма, содержащих такой активный ингредиент, или по отношению к количеству клеток микроорганизма, описанного здесь.
Специфическая пища или питье, в которые добавляют активный ингредиент, включают в себя, например, соки, освежающие напитки, супы, чаи, кисломолочные напитки, молочные продукты, такие как ферментированное молоко, мороженое, масло, сыр, переработанное молоко и снятое молоко, мясные продукты, такие как ветчина, сосиски, гамбургеры, продукты из запеченной рыбы, яичные продукты, как сезонные яичные шарики и свернувшиеся яйца, кондитерские изделия, такие как выпечка, желе, легкие закуски и жевательная резинка, хлеб, лапша, маринованные продукты, копченые продукты, жареная рыба и приправы. Форма пищи или питья включает в себя порошковую пищу, листовую пищу, бутилированную пищу, баночную пищу, пищу в ретортах, пищу в капсулах, таблетированную пищу и жидкую пищу.
Пища или питье, с активностью специфически связываться с mutans Streptococci, которые потребляют дети, предпочтительно имеет питательную композицию для детей. Такая питательная композиция для детей включает в себя модифицированное молоко, приготовленное для детей, молоко с разложенными белками, специфически питательно модифицированное молоко или детское питание, и питание, приготовленное для ребенка ясельного возраста. Форма питательной композиции для детей включает в себя, не ограничивается этим, порошковое молоко, высушенное и распыленное, и детское питание, и также включает в себя общую пищу, такую как мороженое, ферментированное молоко и желе для проглатывания детьми.
Питательная композиция для детей, согласно настоящему изобретению, в основном состоит из белка, липидов, сахаридов, витаминов и/или минералов. В питательной композиции активный ингредиент взбивается вместе с этими компонентами. Белок включает в себя белки молока, такие как снятое молоко, казеин, сыворотка от сыра, концентрат сывороточных белков, и белки сыворотки выделяют, и их фракции следующие: альфа-S-казеин, бета-казеин, альфа-лактоальбумин и бета-лактоглобулин. Далее, могут использоваться яичные белки, такие как белок яичного желтка, белок яичного белка и овальбумин, или соевые белки, такие как обезжиренный соевый белок, разделенный соевый белок и концентрированный соевый белок. Другие белки, такие как клейковина из пшеницы, белок из мяса рыбы, белок из мяса крупного рогатого скота и коллаген, также могут успешно использоваться. Далее, фракции этих белков, пептиды после кислой или ферментативной обработки, или чистые от кислот, могут также успешно использоваться. Свободные аминокислоты могут служить в качестве источника азота и дополнительно могут быть использованы для получения специфического физиологического действия. Такие свободные аминокислоты включают в себя, например, таурин, аргинин, цистеин, цистин и глутамин. Липиды включают в себя животные жиры и масла, такие как молочный жир, свиной жир, бычий жир и рыбий жир, растительные масла, такие как соевое масло, рапсовое масло, кукурузное масло, кокосовое масло, пальмовое масло, масло из пальмовых семечек, подсолнечное масло, перилловое масло, масло льняного семени, масло вечерней примулы, триглицериды жирных кислот со средней длиной цепи и масло хлопкового семени, бактериально разложенные жиры и масла, и их фракционированные масла, гидрогенированные масла и масла эфирного обмена. Количество липидов, которое нужно взбить, изменяется в зависимости от применения.
Сахариды включают в себя, например, один или более крахмалов, растворимые полисахариды, декстрин, моносахариды, такие как сахароза, лактоза, как описано здесь, мальтоза, глюкоза и фруктоза и другие олигосахариды. Полное количество такого сахарида предпочтительно должно составлять от 40 до 80% от массы общего твердого вещества в питательной композиции. Далее успешно могут быть использованы такие искусственные подсластители, как аспартам. Количество искусственного подсластителя приблизительно от 0.05 до 1.0% от массы всего твердого вещества в питательной композиции.
Витамины включают в себя, но без ограничений, ликопен в качестве нужного компонента, и дополнительно включают, например, такие витамины, как витамин А, витамины группы В, витамины С, D и Е и витамины группы К, фолиевую кислоту, пантотеновую кислоту, никотинамид, карнитин, холин, инозитол и биотин, пока такие витамины можно назначать детям. Такие витамины предпочтительно назначаются от 10 мг до 5 г от массы всей питательной композиции для детей.
Далее, минералы включают в себя кальций, магний, калий, натрий, железо, медь, цинк, фосфор, хлор, марганец, селен и йод. Такие минералы предпочтительно содержатся в питательной композиции для детей в количестве от 1 мг до 5 г от массы общего твердого вещества.
Компоненты, отличные от описанных выше, в питательной композиции для детей, используемой согласно настоящему изобретению, могут быть взбиты с любым компонентом, по желанию смешанным с питательными составами, например, диетическим волокном, нуклеотидами, нуклеиновыми кислотами, ароматизаторами и красителями.
Пищу или питье, используемое согласно настоящему изобретению, можно использовать как здоровое питание или питье или как обычную пищу или питье для предотвращения и/или лечения кариеса, вызванного Streptococci, отличными от Streptococcus mutans.
Когда пища или питье, согласно настоящему изобретению, проглатывается, количество проглоченного не ограничено специфически. Количество, которое нужно проглотить, обычно лежит в интервале от 0.1 до 50 г, предпочтительно от 0.5 г до 20 г ежедневно, основываясь на общем количестве активного ингредиента.
Пища или питье постоянно проглатываются в этом количестве в течение периода от одного дня до 5 лет, предпочтительно от 2 недель до 1 года. Здесь проглоченное количество может быть подогнано под подходящий интервал в зависимости от остроты симптомов индивидуального проглатывания пищи или питья, возраста и массы тела и тому подобного.
Корм, используемый согласно настоящему изобретению, может быть любым, содержащим активный ингредиент. Корм включает в себя, например, корм для домашних животных - корм для собак, кошек и крыс, для крупного рогатого скота - для коров и свиней, куриный корм для кур и индюков, и корм для рыб для порги и желтохвостов.
Корм может быть получен при подходящем перемешивании активного ингредиента, как описано здесь выше, с сырьевыми продуктами для корма, включающими в себя, например, злаки, отруби, масличные продукты, сырьевые продукты для корма животного происхождения, другие сырьевые продукты для приготовления корма и очищенные продукты. Злаки включают в себя, например, просо, пшеницу, ячмень, овес, рожь, коричневый рис, гречку, головчатое просо, китайское просо, деканскую траву, кукурузу и сою.
Отруби включают в себя, например, рисовые отруби, обезжиренные рисовые отруби, отруби, муку грубого помола, пшеничные проростки, ячменные отруби, просеянное зерно, кукурузные отруби и кукурузные проростки.
Масличные продукты включают в себя, например, соевые продукты, соевый порошок, продукты из льняного семени, продукты из хлопкового семени, арахисовые продукты, сафлоровые продукты, кокосовые продукты, пальмовые продукты, кунжутные продукты, продукты из подсолнечника, рапсовые продукты, продукты из семени капока и горчичные продукты.
Сырьевые продукты для корма животного производства включают в себя, например, рыбный порошок, импортируемые продукты, цельные продукты, продукты с побережья, рыбу, мясной порошок, мясо-костный порошок, кровяной порошок, разложенные волосы, костный порошок, сопутствующие продукты из мясной лавки, продукты из пера, куколки тутового шелкопряда, снятое молоко, казеин, сухую сыворотку и криль.
Другие сырьевые продукты для корма включают в себя, например, стебли и листья растений, таких как люцерна, hey cube, продукты из листа люцерны, и порошок из листьев рожкового дерева, побочные продукты от переработки кукурузы, такие как продукты из кукурузной клейковины, корм из кукурузной клейковины и ликер от вымачивания кукурузы, крахмал, сахар, дрожжи, сопутствующие продукты из ферментативной промышленности, такие как пивной остаток, корень солодки, ликерный остаток и остаток соевого соуса, и сельскохозяйственные сопутствующие продукты, такие как остаток от переработки цитрусовых, остатки свернувшейся сои, кофейный остаток, остаток какао, маниока, конский боб, продукты из гуара, морские водоросли, спирулина и хлорелла.
Очищенные продукты включают в себя, например, белки, такие как казеин и альбумин, аминокислоты, крахмал, целлюлозу, сахариды, такие как сахароза и глюкоза, витамины и минералы.
В случае обеспечения корма для животных согласно настоящему изобретению, количество корма, которое нужно проглотить, не ограничено конкретно, но предпочтительно, например, 0.1 мг на 50 г на 1 кг массы тела в день, предпочтительно 0.5 мг на 20 г на 1 кг массы тела в день, основанное на количестве активного ингредиента. Корм постоянно проглатывается в этом количестве в течение периода от одного дня до 5 лет, предпочтительно от 2 недель до 1 года. Здесь проглоченное количество может быть подогнано под подходящий интервал в зависимости от остроты симптомов индивидуального проглатывания корма, возраста и массы тела и тому подобного.
В другом варианте выполнения, настоящее изобретение относится к применению микроорганизма, принадлежащего к группе молочнокислых бактерий, которые способны специфически связываться с бактериями, принадлежащими к группе mutans Streptococci, как описано здесь выше, для приготовления противокариесной композиции для лечения или профилактики кариеса, mutans Streptococci, отличными от Streptococcus mutans, где противокариесная композиция является добавкой в пищу, питье и корм. Предпочтительно, добавка в пищу, питье и корм является, из-за присутствия микроорганизма или его производного или мутанта или аналога или фрагмента, как описано здесь выше, среди прочего способной специфически связываться с mutans Streptococci, так чтобы предотвратить и/или вылечить кариес, вызванный mutans Streptococci, отличными от Streptococcus mutans. Предпочтительно, микроорганизм, его мутант, производное, аналог или фрагмент является депозитным микроорганизмом, как описано здесь выше, или его мутантом, производным или фрагментом. Добавка в пищу или питье включает в себя добавку для питательной композиции для детей.
Добавку к пище можно получить общим способом производства добавок для пищи, питья или корма. Если необходимо, могут быть добавлены добавки для пищи, питья и корма, например, добавки, описанные в Food Additive Handbook (The Japan Food Additives Association; вышла в печать January 6, 1997), включая подсластители, красители, консерванты, загустители и стабилизаторы, антиоксиданты и агенты, закрепляющие цвет, чистящие агенты, антисептики, жевательную основу, горькую настойку, ферменты, агенты для яркости, подкислители, приправы, эмульгаторы, усилители, агенты для производителя, ароматизаторы и острые экстракты. Далее, могут быть успешно добавлены обычные сахариды, крахмал, неорганические соединения, растительные порошки, наполнители, дезинтеграторы, лубриканты, связывающие агенты, ПАВ и пластификаторы, упомянутые прежде для фармацевтических таблеток. Добавки включают в себя следующие. Подсластители включают в себя аспартам, лакрицу, стевию, ксилозу и rakanka (фрукт Momordica grosvenori). Красители включают в себя каротеноид и олеорезин дерева турмерик, флавоноид, карамельный краситель, краситель спирулина, хлорофилл, краситель пурпурной сладкой картошки, краситель пурпурного сладкого картофеля, перилловый краситель и краситель из голубики.
Консерванты включают в себя, например, сульфит натрия, бензоаты, бензоиновый экстракт, сорбаты и пропионаты. Загустители и стабилизаторы включают в себя, например, смолы, такие как гуммиарабик и ксантановая камедь, альгинаты, хитин, хитозан, экстракт алоэ, гуаровую смолу, гидроксипропилцеллюлозу, желатин, агар, декстрин, метилцеллюлозу, поливиниловый спирт, микроволоконную целлюлозу, микрокристаллическую целлюлозу, целлюлозу из морских водорослей, полиакрилат натрия, полифосфат натрия, каррагенан или клеточную стенку дрожжей.
Антиоксиданты включают в себя, например, витамины группы С, этилендиаминтетраацетат натрия, этилендиаминтетраацетат кальция, натрия, эриторбовую кислоту, оризанол, катехин, гверцетин, гвоздичный экстракт, ферментативно обработанный рутин, яблочный экстракт, экстракт кунжутного семени, дибутилгидроксиолуен, экстракт фенхеля, экстракт хрена, экстракт водного сельдерея, экстракт чая, токоферолы, экстракт рапса, экстракт кофейных зерен, экстракт семян подсолнечника, кислоту из стеблей фенхеля, бутилгидроксианизол, экстракт листьев голубики, экстракт прополиса, экстракт перца, экстракт бальзамина садового, галловую кислоту, экстракт эвкалипта и экстракт розмарина.
Агенты для закрепления цвета включают в себя, например, нитрит натрия. Чистящие агенты включают в себя, например, сульфит натрия,
Антисептики включают в себя, например, о-фенилфенол. Жевательная основа включает в себя, например, метилацетонитрилолеат, воск уруши, эфирную смолу, элемовую смолу, воск урукури, смолу каури, воск карнауба, глицериновые эфиры жирных кислот, спермацетовый воск, бальзам copaiba, смолу копал, каучук, воск из рисовых отрубей, тростниковый воск, шеллак, джелутонг, эфиры жирных кислот и сахарозы, деполимеризованный натуральный каучук, парафиновый воск, пихтовый бальзам, эфиры жирных кислот и пропиленгликоля, порошковую мякоть, порошковую рисовую шелуху, масло жожоба, полиизобутилен, полибутен, микрокристаллический воск, мастику, пчелиный воск и фосфат кальция. Горькие настойки включают в себя, например, изо-альфа-горькую кислоту, кофеин, экстракт каваратаке (Coriolus versieolor), экстракт хинина из красной перуанской коры, экстракт коры филодендрона, экстракт корня горечавки, острые экстракты, ферментативно модифицированный нарингин, экстракт ямайской кассии, теабромин, нарингин, экстракт кассии, экстракт абсента, экстракт изодониса, оливковый чай, апельсиновый горький (Citrus aurantium), экстракт хмеля и экстракт полыни.
Ферменты включают в себя, например, амилазу, липазу, трипсин или сычужный белок.
Агенты, придающие яркость, включают в себя, например, воск уруши и японский воск. Подкислители включают в себя, например, адипиновую кислоту, кислоту itacania, лимонную кислоту, янтарную кислоту, ацетат натрия, винную кислоту, диоксид углерода, молочную кислоту, фитиновую кислоту, фумаровую кислоту, яблочную кислоту и фосфорную кислоту. Приправы включают в себя, например, аминокислоты, такие как аспарагин, аспартамовая кислота, глутаминовая кислота, глутамин, аланин, изолейцин, глицин, серин, цистин, тирозин, лейцин и пролин, нуклеиновые кислоты, такие как инозинат натрия, уридинат натрия, гуанилат натрия, цитидилат натрия, рибонуклеотид кальция и рибонуклеотид натрия, органические кислоты, такие как лимонная кислота и янтарная кислота, хлорид калия, хлорид натрия с уменьшенной засаливаемостью, неочищенный хлорид калия, сывороточная соль, фосфат калия, гидрофосфат дикалия, дигидрофосфат калия, гидрофосфат динатрия, дигидрофосфат натрия, фосфат тринатрия и экстракт хлореллы.
Усилители включают, например, соли цинка, витамины группы С, различные аминокислоты, 5-адениловую кислоту, хлорид железа, гесперидин, различный кальцинированный кальций, различный некальцинированный кальций, дибензоилтиамин, гидроксид кальция, карбонат кальция, гидрохлорид тиамина, Dunallella, Oarotene, токоферол, никотиновая кислота, каротин моркови, каротин пальмового масла, пантотенат кальция, витамин А, гидроксипролин, дигидропирофосфат кальция, железистый пирофосфат, пирофосфат железа, ферритин, железо гема, менахинон, фолиевую кислоту и рибофлавин.
Агенты для производства включают в себя, например, вспомогательные средства для обработки для собственных нужд, такие как ацетон и ионообменная смола. Ароматизаторы включают в себя, например, ванильную эссенцию, и острые экстракты включают в себя, например, экстракт стручкового перца.
Эти разнообразные добавки можно добавить к активному ингредиенту, принимая во внимание способ применения, согласно настоящему изобретению.
Противокариесная композиция, используемая согласно настоящему изобретению, охватывает количество вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, или его производного или мутанта, или его аналога, или его фрагмента. Предпочтительно, микроорганизм, его мутант, производное, аналог или фрагмент являются депозитным микроорганизмом, как описано здесь выше, или его мутантом, производным или фрагментом. Рассматривается, что композиции, в частности, противокариесная композиция содержит в себе вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, в форме пробиотического организма. Именно, в дополнение к пробиотическому эффекту, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, используется для лечения и/или предотвращения кариеса, вызванного mutans Streptococci, отличными от Streptococcus mutans. Количество указанного пробиотического организма вполне достаточно для значительного положительного изменения состояния, которое нужно лечить, предпочтительно кариес, но достаточно низкое для того, чтобы избежать серьезных побочных эффектов (при разумном соотношении выгода/риск), в рамках высказанного медицинского суждения. Эффективное количество указанного пробиотика будет варьироваться с учетом определенной цели, которую необходимо достигнуть, возраста и физического состояния пациента, подвергающегося лечению, остроты лежащего в основе заболевания, продолжительности лечения, природы сопутствующей терапии и применения специфического микроорганизма. Эффективное количество указанного пробиотического микроорганизма, таким образом, будет минимальным количеством, которое будет обеспечивать желаемое специфическое связывание с mutans Streptococci. Присутствие, например, 1×109 бактерий как жизнеспособных или нежизнеспособных целых клеток, или в 0.05 мл раствора фосфатно-солевого буфера, или в 0.05 мл суспензии агара, или сухого массового эквивалента фрагментов клеточной стенки, является эффективным при применении в количествах приблизительно от 0.05 мл до приблизительно 20 мл. Решенным практическим достоинством является то, что пробиотический организм может назначаться в обычной манере, такой как перорально. В зависимости от способа применения активным ингредиентам, которые содержат в себе указанный пробиотический организм, может потребоваться покрытие из материала, чтобы защитить указанные организмы от воздействия ферментов, кислот и других природных условий, которые могут инактивировать указанный организм. Для того чтобы применять пробиотические организмы способом, отличным от парентерального, они должны быть покрыты материалом для предотвращения инактивации или приниматься вместе с ним. Например, пробиотические организмы могут применяться совместно с ингибиторами ферментов или в липосомах. Ингибиторы ферментов включают в себя ингибитор панкреатического трипсина, диизопропилфторфосфат (DFP) и тразиол. Липосомы включают в себя эмульсии «вода-масло-вода» Р40 так же, как и обычные и специфически сконструированные липосомы, которые транспортируют молочнокислые бактерии или их сопутствующие продукты к урогенитальной поверхности. Дисперсии также можно приготовить, например, в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. В целом, дисперсии готовят путем включения разнообразных стерилизованных пробиотических организмов в стерильный переносчик, который содержит базовую дисперсионную среду и другие требуемые ингредиенты из тех, которые перечислены выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций, предпочтительными способами приготовления являются способы вакуумной сушки и сушки при замораживании, которые дают порошок активного ингредиента и любой желаемый дополнительный ингредиент из его предварительно простерилизованного раствора. Дополнительные предпочтительные способы приготовления включают в себя, но не ограничены, лиофилизацию и тепловую сушку. Противокариесная композиция также охватывает продукты, которые необходимо принимать перорально, или буккально, которые содержат в себе приемлемый фармацевтический носитель, как описано здесь, к которому или на который добавляют клетки вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, в свежей, концентрированной или высушенной форме, например. Конечно, также можно добавлять в любой комбинации производное или аналог или фрагмент указанного микроорганизма, производное и/или аналог и/или фрагмент которого описан здесь. Эти продукты могут быть в форме суспензии для глотания, геля, диффузера, капсулы, капсулы в твердой желатиновой оболочке, сиропа или в любой другой медицинской форме, известной специалисту в данной области техники.
Когда пробиотический организм защищен подходящим образом, как описано здесь, активный компонент может применяться перорально, например, вместе с инертным растворителем или усвояемым съедобным переносчиком, или он может быть вложен в твердую или мягкую желатиновую капсулу, или он может быть спрессован в таблетку, сконструированную для того, чтобы проходить в желудок (т.е. покрытые для кишечника), или он может быть включен непосредственно в пищевые продукты диеты. Для перорального терапевтического применения пробиотические организмы могут быть объединены с наполнителями и использованы в форме таблеток для глотания, таблеток для защечного рассасывания, таблеток, капсул, эликсиров, суспензий, сиропов, вод и тому подобного. Композиции или приготовления согласно настоящему изобретению готовятся так, чтобы пероральная единичная форма дозировки содержала, например, приблизительно 1×109 жизнеспособных или нежизнеспособных молочнокислых бактерий на мл. Пробиотический организм подготовлен для удобного и эффективного применения вместе с подходящим фармацевтическим или пищевым носителем в единичной форме дозировки, как перед этим описано здесь. Единичная форма дозировки может, например, содержать принципиальное активное вещество в количестве приблизительно 109 жизнеспособных или нежизнеспособных, например, молочнокислых бактерий на мл, в случае композиций, содержащих вспомогательные ингредиенты, такие как пребиотики, дозировку определяют соотнесением с обычной дозой и способом применения указанных ингредиентов. В другом варианте выполнения настоящее изобретение относится к способу профилактики или лечения кариеса, вызванного mutans Streptococci, отличными от Streptococcus mutans. Предпочтительно способ профилактики или лечения содержит в себе назначение пациенту микроорганизма, принадлежащего к группе молочнокислых бактерий, характеризующегося тем, что указанный микроорганизм способен специфически связываться с бактериями, принадлежащими к группе mutans Streptococci или с мутантами, производными, аналогами или фрагментами указанного микроорганизма, как описано здесь выше. Более предпочтительно, чтобы микроорганизм являлся микроорганизмом, как описано здесь выше, даже более предпочтительно, микроорганизм являлся молочнокислой бактерией, помещенной в DSMZ, как описано здесь выше. Аналог или фрагмент вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий, может быть любым аналогом или фрагментом, как описано здесь выше.
Предпочтительно, чтобы пациент, которому необходимо лечение, являлся животным. Более предпочтительно, чтобы животное относилось к млекопитающим, даже более предпочтительно, чтобы млекопитающее было домашним млекопитающим. В предпочтительном варианте выполнения домашнее животное - это собака, кошка, хомяк, обезьяна, крыса или мышь. В другом предпочтительном варианте животное принадлежит к крупному рогатому скоту, лошадям, свиньям, ослам, овцам или козам. В другом предпочтительном варианте выполнения изобретения млекопитающее является человеком.
Предпочтительно, что mutans Strepotoccus является микроорганизмом, принадлежащим к видам Streptococcus mutans, Streptococcus sobrinus, Streptococcus cricetus, Streptococcus ratti, Streptococcus ferus или Streptococcus macacae. Даже более предпочтительно, чтобы mutans Streptococcus относились к микроорганизму, принадлежащему к серотипу с Streptococcus mutans (DSMZ 20523), серотипу е Streptococcus mutans (NCTC 10923), серотипу f Streptococcus mutans (NCTC 11060), Streptococcus sobrinus DSM 20742, Streptococcus ratti DSM 20564, Streptococcus cricetus DSM 20562, Streptococcus ferus DSM 20646 или Streptococcus macacae DSM 20714. Кариес, который нужно вылечить или предотвратить, вызывется mutans Streptococci, отличными от Streptococcus mutans, предпочтительно, кариес вызывается по меньшей мере одной бактерией, выбранной из группы, состоящей из Streptococcus sobrinus, Streptococcus cricatus, Streptococcus ratti, Streptococcus ferus и Streptococcus macacae. Применение микроорганизма, принадлежащего к группе молочнокислых бактерий, как описано выше, в контексте способа лечения или профилактики, может быть проведено в любой подходящей форме специалистом в данной области техники. Предпочтительно, применение охватывает применение и заявку композиций, как описано здесь выше, которые могут необязательно содержать, например, фармацевтические или косметические носители или наполнители, как описано здесь выше. Дозировка и время курса применения могут быть установлены согласно любой подходящей информации, известной специалисту в данной области техники. Предпочтительно, указанная дозировка и время курса могут быть установлены, как описано выше.
Изобретение проиллюстрировано Фиг.1-3, как описано в следующем:
Фиг.1 показывает агрегацию Streptococcus mutans видом Lactobacillus. В частности, Фиг. описывает смесь агрегирующих Lactobacillus с S. mutans (левая пробирка) в сравнении со смесью неаггрегирующих Lactobacillus с S. mutans (правая пробирка). Эксперимент был проведен, как описано в Примере 4, и пробирки оставили в покое на 20 мин для того, чтобы дать агрегатам осесть.
Фиг.2 показывает микрофотографию агрегата Lactobacillus и S. mutans, показанный на Фиг.1 (левая пробирка). Фотография была сделана при 1000-кратном увеличении с применением микроскопа с контрастом фаз.
Фиг.3 показывает агрегацию различных mutans Streptococci молочнокислыми бактериями. Эксперимент был проведен так, как описано в Примере 5. Вкратце, mutans Streptococci были окрашены при помощи флуоресцентного красителя. После агрегации Streptococci молочнокислыми бактериями, конечные осадки были разделены с помощью центрифугирования. Интенсивность флуоресценции осадков была принята за меру количества агрегировавших mutans Streptococci.
Лучшее понимание настоящего изобретения и множества его достоинств можно получить из следующих примеров, предложенных только с иллюстративной целью, и не для ограничения рамок настоящего изобретения ни в коей мере.
Пример 1
Хранение и рост
Хранение и рост штаммов может наблюдаться согласно обычным процедурам. Например, штаммы могут храниться замороженными при -80°С. 1 мл культуры может быть выращен до стационарной фазы (OD600=4-8 в 1 мл) в среде MRS-Medium и смешан с 500 мкл стерильного раствора глицерина и заморожен. Культуры mutans Streptococci могут быть выращены в среде TSY до стационарной фазы (OD600=1-2 в 1 мл) и обработаны, как описано выше.
Культивирование mutans Streptococci (S. mutans, S. sobrinus, S. ratti, S. cricetus, S. ferus или S. macacae) также как культивирование молочнокислых бактерий может быть проведено в 5 мл в закрытых пробирках Falcon при 37°С без встряхивания в течение ночи.
В частности, штаммы, использованные в настоящей заявке, хранились в замороженном виде при -80°С. 1 мл культуры, выращенной до стационарной фазы (OD600=4-8 в 1 мл) в среде MRS, был смешан с 500 мкл стерильного 50% раствора глицерина и заморожен.
В частности, культуры mutans Streptococci были выращены в среде TSY до стационарной фазы (OD600=1-2 в 1 мл) и обработаны, как упоминалось выше.
Культивирование Streptococci (S. mutans (DSM 20523, серотип с; NCTC 10923, серотип e; NCTC 11060, серотип f), S. sobrinus DSM 20742, S. ratti DSM 20564, S. cricetus DSM 20562, S. ferus DSM 20646 или S. macacae DSM 20714) и культивирование молочнокислых бактерий было проведено в 5 мл в закрытых пробирках Falcon при 37°С без встряхивания в течение ночи. Для флуоресцентного теста, как описано в Примере 5, были использованы mutans DSM 20523.
Для эксперимента с агрегацией молочнокислые бактерии были выращены в среде MRS. 5 мл среды MRS были добавлены к 10 мкл стокового раствора и проинкубированы в течение 3 дней при 37°С в аэробных условиях. Была измерена оптическая плотность культуры при 600 нм (OD600). Культуру затем развели до OD600 2, используя буфер PBS. Mutans Streptococci были выращены в 7 мл среды TSY. 7 мл среды TSY были добавлены к 10 мкл стокового раствора и проинкубированы при 37°С в анаэробных условиях.
Пример 2
Таксонная классификация штаммов
Таксонная классификация штаммом была сделана согласно их модели ферментирования углеводов. Это было определено с помощью системы API 50 СН (bioMerieux, France) и проанализировано с применением пакета программ APILAB PLUS версии 3.3.3 (bioMerieux, France).
Пример 3
Окрашивание клеток
После того как молочнокислые бактерии и mutans Streptococci были выращены, как описано в Примере 1, mutans Streptococci были окрашены с помощью флуоресцентного красителя. Для этого была измерена OD600 культуры. Культура была собрана с помощью центрифугирования при 3200 g в течение 5 мин. Осадок был ресуспендирован в буфере PBS. Количество буфера было посчитано так, что результирующая суспензия имела малую OD600 4.2 мл такой суспензии, смешанной с 2 мкл раствора CFDA-SE (Invitrogen, USA), который был приготовлен согласно инструкциям производителя. Окрашивание клеток было проведено путем инкубации смеси в течение 2 ч при 37°С. Окрашенные клетки были собраны путем центрифугирования при 3200 g в течение 5 мин. Потом клетки были ресуспендированы в 2 мл буфера PBS.
Пример 4
Эксперимент по агрегации осадков mutans Streptococci
Для эксперимента смесь молочнокислых бактерий и mutans Streptococci была приготовлена в объемных отношениях от 3:1 до 60:1 (mutans Streptococci:молочнокислые бактерии), это соответствует соотношению колониеобразующих единиц от 1:50 до 1:2,5.
Оптическая плотность, измеренная при длине волны 600 нм в 1 мл, обозначает предпочтительно 3×108 колониеобразующих единиц mutans Streptococci и для молочнокислых бактерий предпочтительно 7×109 колониеобразующих единиц. Была приготовлена смесь объемом 2 мл в 15 мл пробирках Falcon. Суспензионные культуры были разведены буфером PBS для того, чтобы получить объемные соотношения, упомянутые выше, так, чтобы сохранить конечный объем 2 мл. Смесь встряхивалась в течение 15 сек. Агрегация наблюдается как непосредственная мутность суспензии. Пробирки оставляли в покое в течение 20 мин, после этого периода времени агрегаты осаждались как видимые осадки, в то время как неагрегирующие смеси оставались в виде суспензий. Образованные агрегаты были разделены центрифугированием при 500 g в течение 30 сек. После этого количество агрегатов оценивалось с помощью измерения количества несагрегировавших клеток, которые остались в супернатанте. Соответственно, 1 мл супернатанта был аккуратно отобран для измерения оптической плотности. Оптическая плотность измерялась при 600 нм. Значение после вычитания соответствующего контрольного эксперимента без молочнокислых бактерий представляет собой количество клеток, которые несагрегировали.
В качестве контроля в каждом случае была исследована самопроизвольная агрегация соответствующих штаммов Lactobacillus и Streptococcus с помощью теста с добавлением в пробирку только штаммов Lactobacillus или только mutans Streptococcus. Агрегация S. mutans видом Lactobacillus показана на Фиг.1 (левая пробирка) и 2.
Штаммы молочнокислых бактерий, как описано здесь, в частности, те, которые размещены в DSMZ, показывали агрегацию со всеми серотипами S. mutans без проявления самопроизвольной агрегации.
Среды:
Среда MRS:
смесь MRS (Difco, USA) 55 г/л
pH: 6.5
Среда TSY:
смесь TSY (Difco, USA) 30 г/л
Дрожжевой экстракт (Deutsche Hefewerke, Germany) 3 г/л
Буфер:
буфер PBS:
Na2HPO4·2H2O 1.5 г/л,
KH2PO4 0.2 г/л,
NaCl 8.8 г/л,
pH доведен HCl.
Пример 5
Эксперимент с флуоресцентной агрегацией mutans Streptococci

50 мкл суспензии молочнокислых бактерий были добавлены к 50 мкл окрашенных mutans Streptococci на 96-луночном планшете для раститровки. Планшет встряхивали при полной скорости в течение 12 мин. После этого планшет центрифугировали при 500g в течение 10 сек. Супернатант осторожно удаляли и выкидывали. Осадок ресуспендировали в 100 мкл буфера PBS. Флуоресценцию суспензии измеряли с помощью планшета для микротитра на флуоресцентном считывателе при длине волны возбуждения 495 нм и эмиссии 525 нм. В качестве контроля были обработаны и измерены, как описано, молочнокислые бактерии, также как и mutans Streptococci, поодиночке. Фоновая флуоресценция, измеренная для одних соответствующих mutans Streptococci, вычиталась из значения, измеренного для соответствующих молочнокислых бактерий. Все измерения были сделаны трижды. Mutans Streptococci агрегировались всеми тестируемыми молочнокислыми бактериями (см. Фиг.3).
Среды:
Среда MRS:
смесь MRS (Difco, USA) 55 г/л
pH: 6.5
Среда TSY:
смесь TSY (Difco, USA) 30 г/л
Дрожжевой экстракт (Deutsche Hefewerke, Germany) 3 г/л
Буфер:
буфер PBS:
Na2HPO4·2H2O 1.5 г/л,
KH2PO4 0.2 г/л,
NaCl 8.8 г/л,
pH доведен HCl.
Пример 6
Специфичность агрегации по отношению к типичным представителям микрофлоры ротовой полости
Культуры Lactobacillus были выращены, как описано в Примере 1. Бактерии ротовой полости, а именно: Streptococcus salivarius subsp. thermophilus (выделен OrganoBalance, идентифицирован API 50 CM (Biomerieux, France) согласно инструкциям производителя); Streptococcus oralis (DSMZ 20066); Streptococcus oralis (DSMZ 20395); Streptococcus oralis (DSMZ 20627); Staphylococcus epidermidis (DSMZ 1798); Staphylococcus epidermidis (DSMZ 20044); Streptococcus mitis (DSMZ 12643); Streptococcus sanguinis (DSMZ 20567) - были выращены в 5 мл среды BHI в 15 мл закрытых пробирках Falcon при 37°С в течение ночи. Каждая из вышеупомянутых бактерий предпочтительно смешивалась в объемном соотношении 3:1 с культурами Lactobacillus, и агрегация тестировалась, как в Примере 4. Для каждого тестирования агрегации/неагрегации предпочтительно используется только одна из вышеупомянутых бактерий для непосредственного определения результата тестирования.
В качестве контроля на самопроизвольную агрегацию также были протестированы бактерии ротовой полости.
Штаммы Lactobacillus всегда исследовались путем тестирования с помощью добавления только молочнокислых бактерий или только бактерий ротовой полости в пробирку.
L. paracasei ssp. paracasei strains Lb-OB-K1 (DSM 16667), Lb-OB-K2 (DSM 16668), Lb-OB-K3 (DSM 16669), Lb-OB-K4 (DSM 16670), Lb-OB-K5 (DSM 16671), не агрегировали вышеупомянутые бактерии ротовой полости. The L. rhamnosus strains Lb-OB-K6 (DSM 16672) и Lb-OB-K7 (DSM 16673) агрегировали Streptococcus salivarius subsp thermophilus.
Среда BHI:
BHI смесь (Difco, USA) 37 г/л
pH: 7.2
Пример 7
Температурная устойчивость способности к агрегации молочнокислых бактерий
Бактерии были выращены как в Примере 1. Выращенные культуры молочнокислых бактерий инкубировали при 121°С при 2 бар в насыщенном потоке в течение 20 мин (автоклавировали). После охлаждения автоклавированных культур до комнатной температуры, молочнокислые бактерии смешивали в объемном соотношении 1:3 с выращенными культурами S. Mutans, и агрегация тестировалась как в Примере 4, включая в себя контрольные эксперименты. Агрегация также тестировалась с применением бактерий ротовой полости, как вынесено в Примере 6. Было обнаружено, что процедура автоклавирования не влияет на агрегационное поведение молочнокислых бактерий по отношению к тестируемым серотипам S. mutans или бактериям ротовой полости.
Пример 8
Агрегация с помощью молочнокислых бактерий, инактивированных при нагревании
Молочнокислые бактерии были выращены, как описано в Примере 1. Mutans Streptococci были выращены и окрашены, как описано в Примерах 1 и 3. Выращенные культуры молочнокислых бактерий были приведены к OD600=2, как описано в Примере 1. 1 мл этой суспензии инкубировали при 121°С при 2 бар в насыщенном потоке в течение 20 мин (автоклавировали). После охлаждения автоклавированных культур до комнатной температуры агрегация измерялась, как описано в Примере 5, включая контрольные эксперименты. Инактивированные нагреванием молочнокислые бактерии по-прежнему вызывали агрегацию всех mutans Streptococci.
Пример 9
Зависимость агрегации от значения pH
Бактерии выращивали, как описано в Примере 1. 0.5 мл молочнокислых бактерий и 1.5 мл S. mutans были собраны с помощью инкубации при 3200 g в течение 10 мин, и супернатант затем сливали. Клетки ресуспендировали в их первоначальном объеме (0.5 мл и 1.5 мл, соответственно) в различных буферных растворах PBS, доведенных до различных значений pH. Значения pH буферных растворов были доведены до значений от 7.0 до 3.0 с шагом 0.5 единиц pH. Культуры были ресуспендированы в буферных растворах с соответствующим значением pH, которое было использовано для исследования протекания агрегации. После этого молочнокислые бактерии предпочтительно смешивали в объемном соотношении 1:3 с культурами S. Mutans, и агрегация исследовалась, как описано в Примере 4, включая контрольные эксперименты. Не наблюдалось видимой S. mutans молочнокислыми бактериями при pH ниже 4.5.
Пример 10
Зависимость агрегации от значения pH
Молочнокислые бактерии были выращены, как описано в Примере 1. Mutans Streptococci были выращены и окрашены, как описано в Примерах 1 и 3. После этого исследовали агрегацию при различных значениях pH. С этой целью молочнокислые бактерии, также как и streptococci ресуспендировали в ацетатном буфере, доведенном до соответствующего pH. Протестированные значения pH были 4.0, 4.5 и 5.0. Агрегация исследовалась, как описано в Примере 5. Не наблюдалось агрегации mutans Streptococci при значениях pH ниже 4.5.
Пример 11
Чувствительность протекания агрегации к лиофилизации
Бактерии были выращены, как описано в Примере 1. Аликвоты в 1 мл культур молочнокислых бактерий были отобраны с помощью центрифугирования при 3200 g в течение 10 мин. Супернатант сливали и осадки лиофилизировали при комнатной температуре под вакуумом в течение 2 ч. Конечные сухие осадки каждого тестируемого штамма Lactobacillus хранили при комнатной температуре и при 4°С, соответственно, в течение дня, 1 недели, 2 недель, 3 недель, 4 недель. После прохождения времени хранения лиофилизированные осадки ресуспендировали в 1 мл буфера PBS, pH 7.0. Ресуспендированные молочнокислые бактерии смешивали в объемном соотношении 1:3 со свежевыращенными культурами S. Mutans, и агрегация была исследована, как описано в Примере 4, включая контрольные эксперименты. Протекание агрегации упомянутых молочнокислых бактерий по отношению к S. mutans не изменилось из-за лиофилизации или хранения.
Пример 12
Чувствительность протекания агрегации к лиофилизации
Молочнокислые бактерии были выращены, как описано в Примере 1. Mutans Streptococci были выращены и окрашены, как описано в Примерах 1 и 3. Выращенные культуры молочнокислых бактерий доводили до OD600=2, как описано в Примере 1. 1 мл этой суспензии лиофилизировали при комнатной температуре под вакуумом в течение 2 ч. После этого лиофилизированные осадки ресуспендировали в 1 мл буфера PBS. Агрегацию измеряли, как описано в Примере 5, включая контрольные эксперименты. Протекание агрегации упомянутых молочнокислых бактерий по отношению к mutans Streptococci не изменялось при лиофилизации.
Пример 13
Тест на устойчивость к протеазам
Бактерии были выращены, как описано в Примере 1. Использовали Проназу Е, Протеиназу К, Трипсин, Хемотрипсин (все получено из Sigma, Germany). Аликвоты в 1 мл молочнокислых бактерий промывали в буфере PBS путем собирания клеток с помощью центрифугирования при 3200 g в течение 10 мин и ресуспендировали осадок в 1 мл буфера PBS (pH 7.0). После этого клетки снова собирали, как описано выше, и ресуспендировали в буфере PBS (pH 7.0), содержащем соответствующую протеазу в конечной концентрации 2.5 мг/мл. Суспензию инкубировали в течение 1 ч при 37°С. После этого клетки промывали и ресуспендировали в буфере PBS (pH 7.0), как описано выше. Агрегацию исследовали, как описано в Примере 3, включая контрольные эксперименты. Протекание агрегации упомянутых молочнокислых бактерий по отношению к S. mutans не изменялось при обработке какой-либо из упомянутых протеаз.
Пример 14
Чувствительность к протеазам протекания агрегации молочнокислых бактерий
Молочнокислые бактерии были выращены, как описано в Примере 1. Mutans Streptococci были выращены и окрашены, как описано в Примерах 1 и 3. Использовали Проназу Е, Протеиназу К, Трипсин, Хемотрипсин (все получено из Sigma, Germany). Аликвоты в 1 мл молочнокислых бактерий промывали в буфере PBS путем собирания клеток с помощью центрифугирования при 3200 g в течение 10 мин и ресуспендировали осадок в 1 мл буфера PBS (pH 7.0). После этого клетки снова собирали, как описано выше, и ресуспендировали в буфере PBS (pH 7.0), содержащем соответствующую протеазу в конечной концентрации 2.5 мг/мл. Суспензию инкубировали в течение 1 ч при 37°С. После этого клетки промывали и ресуспендировали в буфере PBS (pH 7.0), как описано выше. Агрегацию исследовали, как описано в Примере 5, включая контрольные эксперименты. Протекание агрегации упомянутых молочнокислых бактерий по отношению к S. mutans не изменялось при обработке какой-либо из упомянутых протеаз.
Пример 15
Ионная зависимость протекания агрегации
Бактерии были выращены, как описано в Примере 1. Аликвоты в 1 мл молочнокислых бактерий промывали в 200 мМ растворе ЭДТА дважды, как описано выше. После этого клетки собирали и ресуспендировали в 1 мл буфере PBS (pH 7.0). Агрегацию исследовали, как описано в примере 4, и наблюдали полную потерю агрегационной способности. Ресуспендирование молочнокислых бактерий в 1 мл 2 мМ раствора кальция после двукратного промывания в 200 мМ растворе ЭДТА восстанавливало способность к агрегации S. mutans. Ресуспендирование промытых ЭДТА клеток в до 100 мМ растворе магния не восстанавливало способность к агрегации S. mutans.
Пример 16
Ионная зависимость протекания агрегации
Бактерии были выращены, как описано в Примере 1. Аликвоты в 1 мл молочнокислых бактерий промывали в 200 мМ растворе ЭДТА дважды, как описано выше. После этого клетки собирали и ресуспендировали в 1 мл буфере PBS (pH 7.0). Агрегацию исследовали, как описано в примере 4, и наблюдали полную потерю агрегационной способности. Ресуспендирование молочнокислых бактерий в 1 мл 2 мМ раствора кальция после двукратного промывания в 200 мМ растворе ЭДТА восстанавливало способность к агрегации S. mutans. Ресуспендирование промытых ЭДТА клеток в до 100 мМ растворе магния не восстанавливало способность к агрегации mutans Streptococci.
Пример 17
Тест на агрегацию в присутствии слюны
Бактерии были выращены как в Примере 1. Аликвоты по 2 мл культур S. mutans собирали, как описано выше, и ресуспендировали в 2 мл слюны. Слюна была получена от двух добровольцев и использовалась непосредственно после сбора. Агрегацию исследовали, как описано в Примере 4. Протекание агрегации упомянутых молочнокислых бактерий по отношению к S. mutans не изменялось в присутствии слюны.
Пример 18
Агрегация mutans Streptococci в присутствии слюны
Свежая слюна была получена от добровольцев. Выработка слюны была индуцирована жеванием жевательной резинки без сахара. Добровольцы собрали 15 мл слюны в каждый образец. Свежесобранная слюна была разведена 1:2 буфером PBS для процедуры тестирования. Lactobacilli и mutans Streptococci культивировали, как описано в Примере 3, за исключением того, что после процедуры окрашивания окрашенные клетки ресуспендировали в слюне вместо буфера PBS. Агрегацию измеряли, как описано в Примере 5, включая контрольные эксперименты. Присутствие слюны не ингибировало агрегацию.
Пример 19
Композиция пастилок (I)
Композицию пастилок предпочтительно готовят, как описано в Примере 4 на странице 8 DE-C2 3645147, где, в дополнение к ингредиентам, упомянутым в указанном Примере 4, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, добавляют в количестве от 102-1012, предпочтительно 103-108 клеток на мг пастилки.
Пример 20
Композиция пастилок (II)
Композицию пастилок предпочтительно готовят, как описано в Примере 5 на странице 8 DE-C2 3645147, где, в дополнение к ингредиентам, упомянутым в указанном Примере 5, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, добавляют в количестве от 102-1012, предпочтительно 103-108 клеток на мг пастилки.
Пример 21
Композиция для ухода за полостью рта
Композицию для ухода за полостью рта предпочтительно готовят, как описано в Примере 3 на странице 8 DE-C2 3645147, где, в дополнение к ингредиентам, упомянутым в указанном Примере 3, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, добавляют в количестве от 102-1012, предпочтительно 103-108 клеток на мг композиции для ухода за полостью рта.
Пример 22
Композиция для ухода за полостью рта на меловой основе
Композицию для ухода за полостью рта на меловой основе предпочтительно готовят, как описано в разделе 7.1.4.4 "Rezepturbeispiel" на странице 205 книги "Kosmetik", W.Umbach (редактор), 2nd edition, Thieme Verlag, 1995, где, в дополнение к ингредиентам, упомянутым в указанном разделе на странице 205, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, добавляют в количестве от 102-1012, предпочтительно 103-108 клеток на мг композиции для ухода за полостью рта на меловой основе.
Пример 23
Гелевая композиция для ухода за полостью рта на основе кремниевой кислоты/фторида натрия
Композицию для ухода за полостью рта на основе кремниевой кислоты/фторида натрия предпочтительно готовят, как описано в разделе 7.1.4.4 "Rezepturbeispiel" на странице 205 книги "Kosmetik", W.Umbach (редактор), 2nd edition, Thieme Verlag, 1995, где, в дополнение к ингредиентам, упомянутым в указанном разделе на странице 205, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, добавляют в количестве от 102-1012, предпочтительно 103-108 клеток на мг композиции для ухода за полостью рта на основе кремниевой кислоты/фторида натрия.
Пример 24
Композиция для ухода за полостью рта против винного камня
Композицию для ухода за полостью рта против винного камня предпочтительно готовят, как описано в разделе 7.1.4.4 "Rezepturbeispiel" на странице 205 книги "Kosmetik", W.Umbach (редактор), 2nd edition, Thieme Verlag, 1995, где, в дополнение к ингредиентам, упомянутым в указанном разделе на странице 205, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, добавляют в количестве от 102-1012, предпочтительно 103-108 клеток на мг для композиции ухода за полостью рта против винного камня.
Пример 25
Композиция жевательной резинки
Композицию жевательной резинки предпочтительно готовят, как описано в Примере 6 на странице 9 DE-C2 3645147, где, в дополнение к ингредиентам, упомянутым в указанном Примере 6, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, добавляют в количестве от 102-1012, предпочтительно 103-108 клеток на мг жевательной резинки.
Пример 26
Концентрированная композиция для полоскания ротовой полости
Концентрированную композицию для полоскания ротовой полости предпочтительно готовят, как описано в разделе 7.1.4.4 "Rezepturbeispiel" на странице 206 книги "Kosmetik", W.Umbach (редактор), 2nd edition, Thieme Verlag, 1995, где, в дополнение к ингредиентам, упомянутым в указанном разделе на странице 206, вышеупомянутый микроорганизм, принадлежащий к группе молочнокислых бактерий, добавляют в количестве от 102-1012, предпочтительно 103-108 клеток на мг концентрированной композиции для полоскания ротовой полости.
Пример 27
Приготовление пленки
Приготовление пленок:
1) водная фаза
- нагревание воды до 60°С,
- добавление аспартама (подсластителя) при перемешивании,
- полное растворение аспартама,
- добавление при перемешивании образователей полимерных водорастворимых пленок, таких как, например, Kollicoat IR (полиэтиленгликоль или поливиниловый спирт) или PVP (поливинилпирролидон) или природных полимеров, такие как альгинаты, до тех пор, пока они не растворятся;
- удаление остатка пены спустя 10 мин,
- добавление вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий в количестве от 102-1012, предпочтительно 103-108 клеток на конечную ароматную пленку после охлаждения смеси, в качестве альтернативы, может быть добавлен мутант или производное вышеупомянутого микроорганизма, принадлежащего к группе молочнокислых бактерий;
2) масляная фаза
- растворение ментола в масле перечной мяты,
- добавление полисорбата 80 к смеси масла перечной мяты и ментола при перемешивании,
- затем добавление этой смеси к пропиленгликолю при перемешивании,
- могут быть добавлены необязательные красители (пигменты, лаки);
3) медленное смешивание масляной фазы с водной фазой при перемешивании;
4) механически образуются тонкие пленки при применении режущего прибора.
Другие варианты выполнения и применения изобретения будут понятны для специалиста в данной области техники из рассмотрения описания и практики изобретения, раскрытых здесь. Все ссылки, цитируемые здесь, по любой причине, включая все публикации, все патенты США и иностранные патенты, и все иностранные заявки на патент и заявки США, специфически и полностью включены сюда в виде ссылок для всех целей. Предполагается, что описание и примеры будут рассматриваться только примерно, в реальных рамках и сущности изобретения, определенных следующей формулой изобретения.
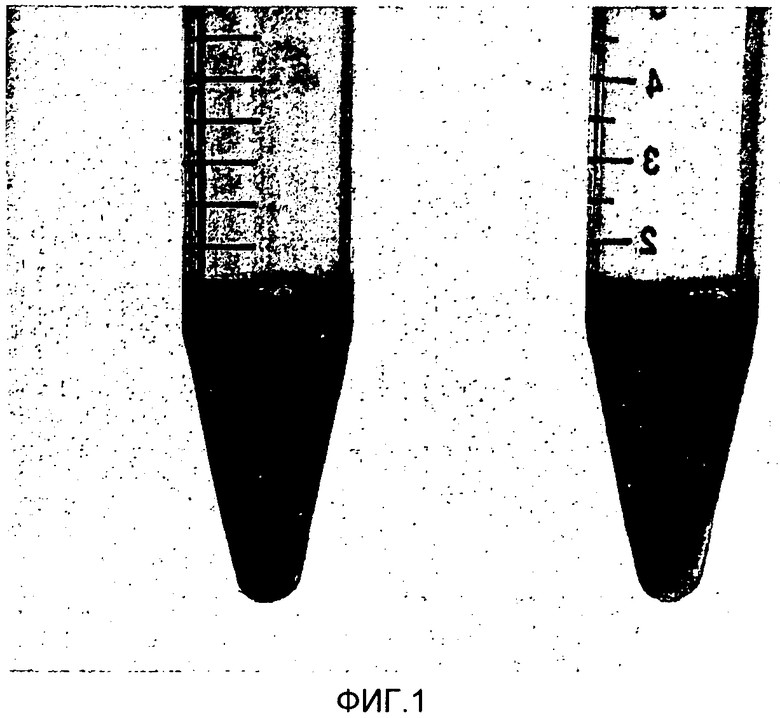


Изобретение относится к применению микроорганизма, принадлежащего к роду Lactobacillus, характеризующегося тем, что он способен к специфическому связыванию с бактерией, принадлежащей к группе mutans Streptococci, при котором специфическое связывание характеризуется: (i) стойкостью к тепловой обработке; и/или (ii) стойкостью к протеолитической обработке; и/или (iii) зависимостью от кальция; и/или (iv) формированием при pH в пределах между 4,5 и 8,5; и/или (v) формированием в присутствии слюны, для изготовления противокариозной композиции для лечения или предупреждения кариеса, вызванного mutans Streptococci, отличных от Streptococcus mutans. Специфическое связывание анализируют, осуществляя следующее: (а) выращивание названного микроорганизма до стационарной фазы; (b) смешивание названного микроорганизма с бактерией, принадлежащей к группе mutans Streptococci, которая была выращена до стационарной фазы; (с) инкубирование смеси, полученной на этапе (b) при условиях, позволяющих образование агрегатов названного микроорганизма и бактерии из группы mutans Streptococci; и (d) определение агрегатов по наличию осадка в пробирке. Способ профилактики или лечения кариеса, вызванного mutans Streptococci, отличных от Streptococcus mutans, включает введение пациенту микроорганизма, принадлежащего к роду Lactobacillus, который способен к специфическому связыванию с бактерией, принадлежащей к группе mutans Streptococci, при котором специфическое связывание характеризуется выше обозначенными признаками (i)-(v). Изобретение обеспечивает специфическое связывание вышеупомянутого микроорганизма, принадлежащего к роду Lactobacillus, с такими штаммами mutans Streptococci, отличных от Streptococcus mutans, которые являются кариогенными дентальными патогенами. 2 н. и 22 з.п. ф-лы, 3 ил., 1 табл., 27 пр.
1. Применение микроорганизма, принадлежащего к роду Lactobacillus, который способен специфически связываться с бактерией, принадлежащей к группе mutans Streptococci, где специфическое связывание характеризуется:
(i) стойкостью к тепловой обработке; и/или
(ii) стойкостью к протеолитической обработке; и/или
(iii) зависимостью от кальция; и/или
(iv) формированием при pH между 4,5 и 8,5; и/или
(v) формированием в присутствии слюны,
для изготовления противокариозной композиции для лечения или предупреждения кариеса, вызванного mutans Streptococci, отличными от Streptococcus mutans.
2. Применение по п.1, где специфическое связывание может быть проанализировано следующим образом:
(a) выращиванием названного микроорганизма до стационарной фазы;
(b) смешиванием названного микроорганизма с бактерией, принадлежащей к группе mutans Streptococci, которая была выращена до стационарной фазы;
(c) инкубированием смеси, полученной на этапе (b), при условиях, позволяющих образование агрегатов указанного микроорганизма и бактерии из группы mutans Streptococci; и
(d) определением агрегатов по наличию осадка в пробирке.
3. Применение по п.1, где указанная Lactobacillus является Lactobacillus paracasei или Lactobacillus rhamnosus.
4. Применение по п.3. где указанную Lactobacillus paracasei выбирают из группы, состоящей из Lactobacillus paracasei, имеющих DSMZ номер доступа DSM 16667, DSMZ номер доступа DSM 16668, DSMZ номер доступа DSM 16669, DSMZ номер доступа DSM 16670 и DSMZ номер доступа DSM 16671.
5. Применение по п.3, где указанную Lactobacillus rhamnosus выбирают из группы, состоящей из Lactobacillus rhamnosus, имеющих DSMZ номер доступа DSM 16672 и DSMZ номер доступа DSM 16673.
6. Применение по п.1, где указанный микроорганизм способен связываться, по меньшей мере, с одной бактерией, выбранной из группы, состоящей из Streptococcus mutans, Streptococcus sobrinus, Streptococcus cricetus, Streptococcus ratti, Streptococcus ferus и Streptococcus macacae.
7. Применение по п.1, где указанная mutans Streptococci, отличная от Streptococcus mutans, является, по меньшей мере, одной бактерией, выбранной из группы, состоящей из Streptococcus sobrinus, Streptococcus cricetus, Streptococcus ratti, Streptococcus ferus и Streptococcus macacae.
8. Применение по п.6, где указанная Streptococcus mutans является Streptococcus mutans серотипа с (DSMZ 20523) и/или серотипа е (NCTC 10923) и/или серотипа f (NCTC 11060).
9. Применение по п.6, где указанная Streptococcus sobrinus является Streptococcus sobrinus DSM 20742.
10. Применение по п.6, где указанная Streptococcus ratti является Streptococcus ratti DSM 20564.
11. Применение по п.6, где указанная Streptococcus cricetus является Streptococcus cricetus DSM 20562.
12. Применение по п.6, где указанная Streptococcus ferus является Streptococcus ferus DSM 20646.
13. Применение по п.6, где указанная Streptococcus macacae является Streptococcus macacae DSM 20714.
14. Применение по п.1, где указанная термообработка проводится при температуре от 4 до 121°С в течение по меньшей мере 20 мин.
15. Применение по п.1, где указанная обработка протеазой представляет собой обработку протеазой, выбранной из группы, состоящей из проназы Е, протеиназы К, трипсина и хемотрипсина.
16. Применение по п.1, где указанный микроорганизм используют в виде одного или нескольких фрагментов, получаемых термической инактивацией или лиофилизацией, причем фрагменты сохраняют указанную способность специфически связываться с mutans Streptococci, отличными от Streptococcus mutans.
17. Применение по любому из пп.1-16, где указанная противокариесная композиция является косметической или фармацевтической композицией, которая дополнительно содержит косметически, фармацевтически или перорально приемлемый носитель или наполнитель.
18. Применение по любому из пп.1-16, где указанная противокариесная композиция является зубной пастой, жевательной резинкой, пастилкой, средством для промывания ротовой полости, средством для полоскания ротовой полости, зубной нитью или зубной лентой.
19. Применение по любому из пп.1-16, где указанная противокариесная композиция является противокариесной пищей и кормом.
20. Применение по любому из пп.1-16, где указанная противокариесная композиция является добавкой к пище, корму или напиткам.
21. Способ профилактики или лечения кариеса, вызванного mutans Streptococci, отличных от Streptococcus mutans, включающий введение пациенту микроорганизма, определенного в любом из пп.1, 3-5.
22. Способ по п.21, где указанный микроорганизм используют в виде одного или нескольких его фрагментов, определенных в п.16.
23. Способ по п.21, где пациентом является человек или животное.
24. Способ по любому из пп.21-23, где кариес вызывается, по меньшей мере, одной бактерией, выбранной из группы, состоящей из Streptococcus sobrinus, Streptococcus cricetus, Streptococcus ratti, Streptococcus ferus и Streptococcus macacae.
| Устройство для определения места повреждения напорного трубопровода | 1989 |
|
SU1634948A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| ЛАНТИБИОТИК | 2000 |
|
RU2279481C2 |
Авторы
Даты
2012-03-27—Публикация
2007-12-18—Подача