Область техники, к которой относится изобретение
Настоящее изобретение относится к области здоровья человека; более конкретно к области состояния здоровья ротовой полости и зубов.
Уровень техники
Ротовая полость человека населена сотней видов бактерий, большинство из которых относится к видам-комменсалам, которые необходимы для поддержания равновесия в экосистеме полости рта. Однако некоторые из них играют ключевую роль в развитии заболеваний полости рта, в первую очередь, кариеса и заболеваний периодонта (1). Заболевания ротовой полости начинаются с роста бактериального зубного налета, биопленки, сформированной в результате накопления бактерий вместе с гликопротеинами из слюны человека и полисахаридами, секретируемыми микроорганизмами (2). Поддесневой налет, расположенный в поддесневом кармане с нейтральной или щелочной средой, обычно населен грамотрицательными анаэробами и служит местом развития гингивита и периодонтита. Наддесневой зубной налет формируется на поверхности зуба и включает кислотообразующие и ацидофильные бактерии, которые, в процессе ферментации потребляемых с пищей Сахаров, образуют кислоту и снижают рН. Если рН становится слишком кислым (обычно при величине менее чем 5,5), зубная эмаль деминерализуется и разрушается, и, следовательно, эти бактерии ответственны за кариес зубов, который считается наиболее распространенным инфекционным заболеванием в мире, поражающим свыше 80% человеческой популяции (3). Плохое состояние ротовой полости может быть связано с другими патологиями, такими как, например, среди прочего, язва желудка, рак желудка и сердечнососудистые заболевания.
Одна из главных причин, почему, на сегодняшний день, патогенные микроорганизмы ротовой полости до сих пор не искоренены, заключается в том, что изучение сообществ микроорганизмов, обитающих в ротовой полости, затруднено, поскольку, с одной стороны, сложность экосистемы (было обнаружено несколько сотен видов, с многочисленными уровнями взаимодействия) затрудняет обнаружение потенциальных патогенных видов (4); кроме того, нельзя идентифицировать единственный этиологический фактор, как в классических заболеваниях, согласно постулатам Коха. Этот факт был наглядно продемонстрирован при заболевании периодонта, при котором по меньшей мере 3 бактериальных вида, относящихся к очень разным таксономическим группам (так называемый «красный комплекс» периодонтальных патогенов), были связаны с развитием и прогрессированием заболеваний периодонта (5). С другой стороны, большая часть бактерий ротовой полости не поддается культивированию (6) и, следовательно, традиционные микробиологические способы дают неполную картину природных сообществ, населяющих зубной налет. Однако современное развитие метагеномных методов и методики секвенирования нового поколения позволяет проводить исследование сообщества бактерий в целом, анализируя общую ДНК сложных образцов микроорганизмов (метагеном), при котором нет необходимости культивировать сами бактерии.
В связи с этим, пионерские исследования в метагеномике были сосредоточены, в первую очередь, на экосистеме кишечника путем применения бессистемного (shot-gun) подхода, при котором ДНК клонируют в плазмиды небольшого размера, а затем проводят традиционное секвенирование по Сэнгеру (7, 8). Более поздние подходы включают секвенирование концов большеразмерных фосмид (9) и применение секвенирования с помощью технологии «Illumina», которая обеспечивает широкий охват коротких последовательностей (10). Исследования микробиоты ротовой полости, а также других мест обитания микроорганизмов в организме человека, таких как кожа, влагалище или дыхательные пути, были сосредоточены на секвенировании ампликонов рибосомальной РНК (11, 12). Эти исследования обеспечили существенное совершенствование наших знаний о сообществах этих бактерий по сравнению с предыдущими исследованиями, основанными на культивировании, но оценить разнообразие микроорганизмов мешают систематические ошибки при проведении ПЦР-амплификация (т.е. ПЦР только обнаруживает бактерии, которые наиболее похожи на те, что уже известны, на основе которых создавались используемые праймеры для амплификации, что дает неполную картину имеющегося разнообразия), систематическая ошибка при клонировании (большое число генов не клонируется, поскольку они токсичны для бактерии-хозяина и, следовательно, этот способ не позволяет исследовать весь генетический резервуар образца) и малая длина последовательности (последовательности в технологии «Illumina» имеют только 35-70 нуклеотидов, что во многих случаях делает невозможным надежное установление таксономической принадлежности или функциональной значимости), наряду с тем, что, как уже говорилось выше, большую часть бактерий ротовой полости невозможно культивировать.
Для решения вышеуказанных проблем, настоящее изобретение раскрывает получение метагенома бактериального зубного налета путем прямого секвенирования метагеномной ДНК, с помощью 454-пиросеквенирования, устраняя тем самым потенциальные системные ошибки, возникающие при клонировании и при применении методик ПЦР и, кроме того, обеспечивая доступ ко всему набору генов сообщества бактерий ротовой полости при разном состоянии здоровья, а также возможность анализировать, какие виды бактерий среди тех, которые были обнаружены в полученном метагеноме, могут быть связаны с хорошим состоянием ротовой полости, поскольку у тех индивидуумов, которые никогда не страдали от кариеса, была обнаружена бактериальная флора, отличающаяся от флоры индивидуумов, которые страдали или в настоящее время страдают от кариеса. С помощью полученного метагенома ротовой полости настоящего изобретения, существует возможность прямого выделения, культивирования и идентификации штаммов с противокариесной активностью из конгломерата бактерий в образце из ротовой полости; точнее говоря, из наддесневого налета индивидуумов, которые никогда не страдали от кариеса, т.е. те штаммы, которые способны ингибировать рост вызывающих кариес бактерий.
Другая стратегия, раскрытая в настоящем изобретении, заключается в получении метагеномной библиотеки фосмид (длинные ДНК-вставки, приблизительно, 35-45 Kb) из зубного налета индивидуумов, которые никогда не страдали от кариеса. Получение указанной библиотеки фосмид дает возможность выделить и идентифицировать биологически активные противокариесные пептиды, синтезируемые бактериями, находящимися в ротовой полости индивидуумов, которые никогда не страдали от кариеса. В связи с этим, учитывая, что, в существующем уровне техники, было показано, что Streptococcus mutans представляют собой основного возбудителя кариеса (13), не удивительно, что большинство стратегий по борьбе с этой болезнью были направлены против указанного микроорганизма. Эти стратегии включали, среди прочего, разработку вакцин с помощью известных поверхностных антигенов, стратегии пассивной иммунизации, которые могли бы нейтрализовать бактерии, коагрегацию S. mutans с пробиотическими штаммами и применение ингибирующих белков, специфических к S. mutans (14).
Другие различные стратегии, представляющие собой стратегии, раскрытые в разных патентных документах, предлагают применение разнообразных бактериальных штаммов, предпочтительно S. mutans, которые продуцирует кислоту в пониженных концентрациях (15), или применение одинаковых ресурсов, например, питательных веществ, для патогенных штаммов и непатогенных штаммов, постоянно обеспечивающее поставку непатогенных бактерий в высоких концентрациях, что приводит к замещению патогенных бактерий, при условии, что они используют тот же ресурс (16), или даже снижая прикрепление кариесогенных бактериальных штаммов к зубу (17). Напротив, биологически активные штаммы и пептиды, раскрытые в настоящем изобретении, обладают антибиотической активностью, предпочтительно противокариесной активностью, против своих собственных вызывающих кариес микроорганизмов. С другой стороны, патент WO 20040072093 (18) раскрывает ряд противомикробных средств, которые, в первую очередь, действуют против грамотрицательных микроорганизмов, но основные возбудители кариеса, S. mutans и S. sobrinus, представляют собой грамположительные микроорганизмы. Кроме того, изоляты S. mitis и S. oralis, продуцирующие противомикробные пептиды, раскрытые в WO 20040072093 (18), были выделены из горла пациентов с кистозным фиброзом, а не из ротовой полости людей, не имеющих кариеса, как в случае пептидов и/или штаммов изобретения. Подобным образом, терапевтическое применение указанных пептидов направлено на лечение заболеваний дыхательных путей, а не кариеса, как в случае биологически активных пептидов, раскрытых в настоящем изобретении.
В связи с этим, основные технические характеристики, которые отличают бактериальные штаммы, выделенные и раскрытые в настоящем изобретении, от остальных штаммов, раскрытых в существующем уровне техники, заключаются в том, что эти штаммы можно культивировать с помощью общепринятых микробиологических методик; что они обладают ингибирующим действием в отношении организмов, которые вызывают инфекционные заболевания ротовой полости, предпочтительно кариес, без необходимости применения к ним генетической модификации; и что их выделяют из индивидуумов, которые никогда не страдали от кариеса. Следовательно, как сами противокариесные бактерии, так и биологически активные противокариесные соединения, предпочтительно пептиды, раскрытые в настоящем изобретении, могут быть применены в качестве пробиотических и/или пребиотических композиций как таковые, или как часть различных фармацевтических композиций, применяемых для лечения инфекций ротовой полости, таких, например, как кариес, периодонтит, и т.п., или даже в качестве функциональных пищевых продуктов. Кроме того, настоящее изобретение также раскрывает способ предупреждения и/или лечения инфекционных заболеваний ротовой полости, предпочтительно кариеса, который включает введение фармацевтически эффективного количества по меньшей мере одного из штаммов и/или по меньшей мере одного из противомикробных соединений, предпочтительно описанных выше пептидов, или пробиотических или фармацевтических композиций или функциональных пищевых продуктов, которые включают по меньшей мере один из штаммов и/или по меньшей мере одно из соединений, предпочтительно пептиды изобретения.
Описание изобретения
Раскрытие изобретения
Трудности, имеющиеся в существующем уровне техники при идентификации бактериальных штаммов, которые непосредственно ингибируют рост патогенных микроорганизмов, вызывающих заболевания ротовой полости, таким образом, возникают из-за большого количества бактериальных видов в указанной полости; следовательно, трудность, связанная с выделением из всех из них штаммов, которые непосредственно ингибируют рост патогенных видов, многие из которых представляют собой некультивируемые виды, приводит к тому, что эту задачу непросто решить до сих пор.
Настоящее изобретение решает эту проблему путем создания метагенома ротовой полости индивидуумов, которые никогда не страдали от кариеса. Создание указанного метагенома, с помощью массивного секвенирования, предпочтительно пиросеквенирования, ДНК, присутствующей в образцах, взятых из ротовой полости указанных индивидуумов, которые никогда не страдали от кариеса, позволяет идентифицировать роды и виды бактерий, которые наиболее часто встречаются в популяции бактерий, находящихся в ротовой полости указанных индивидуумов. Такая количественная оценка частоты встречаемости каждой из бактерий в образце путем применения культивирования, клонирования или ПЦР-методик была до настоящего времени невозможна, поскольку эти методики позволяют идентифицировать только часть бактерий, и в соотношения тех из них, которые были идентифицированы, из-за самих методик были внесены ошибки (в первую очередь это было связано с предпочтительным культивированием, клонированием или амплификацией определенных видов, соответственно).
В принципе, изобретение было основано на человеческом организме, но оно может быть применено к любому высшему млекопитающему, в особенности, к домашним животным или домашнему скоту или даже к представителям дикой фауны. Было бы достаточно определить характерный метагеном каждого вида у индивидуумов, которые никогда не страдали от кариеса, взятого в качестве типичного заболевания ротовой полости. После того как бактериальные штаммы, наиболее часто встречающиеся в ротовой полости здоровых индивидуумов, будут идентифицированы по данным, полученным из метагенома, можно приступить к разработке следующей стадии настоящего изобретения, которая заключается в культивировании образцов, полученных из ротовой полости этих индивидуумов, в благоприятной среде культивирования и в благоприятных условиях, таких чтобы могли развиваться наиболее часто встречающиеся роды и виды, идентифицированные в метагеноме исследуемых видов млекопитающих.
Вторая альтернатива для решения вышеуказанной проблемы заключается в попытке выделить соединения, в особенности, активные пептиды, секретируемые, среди прочего, бактериальными штаммами, присутствующими в ротовой полости индивидуумов, которые никогда не страдали от кариеса, и которые непосредственно ингибируют рост вызывающих кариес видов. В настоящем изобретении, прямую ингибирующую способность определяют, как способность полностью ингибировать рост, создавая зоны ингибирования на высаженных газоном культурах, указанных патогенных видов, в результате антибиотической активности штаммов и соединений, не исключая того факта, что помимо указанного ингибирования, обусловленного их действием как антибиотиков, штаммы и соединения могут проявить свой антимикробный эффект, предпочтительно противокариесный эффект, препятствуя кариесогенному действию другими способами, такими как изменение рН, оптимального для роста указанных, вызывающих кариес штаммов, препятствуя их прикреплению к зубам и т.п.
С этой целью, изобретение снова начинают от образцов ротовой полости, взятых у здоровых индивидуумов, но, в этой альтернативе, оно сосредоточено не только на соединениях бактериального происхождения, которые могут быть секретированы, среди прочего, вышеуказанными изолированными штаммами. Кроме того, могут существовать соединения, секретируемые другими бактериальными штаммами, которые нельзя культивировать и, следовательно, они не могут быть изолированы с помощью предложенной выше стратегии. Наконец, помимо соединений бактериального происхождения из популяции бактериальных штаммов, населяющих ротовую полость, указанная полость также содержит соединения, секретируемые клетками самих млекопитающих, в особенности, клетками человека, на которых предпочтительно основано настоящее изобретение. Некоторые из этих соединений могут обладать прямым ингибирующим действием на рост вызывающих кариес микроорганизмов. В связи с этим, образцы, полученных из ротовой полости здоровых индивидуумов, лизируют, из них экстрагируют ДНК, с указанными фрагментами конструируют фосмиды и клонируют их в клетку-хозяина, которая может быть культивирована и исследована в культурах вызывающих кариес видов, для того, чтобы обнаружить, образуются ли зоны ингибирования роста вызывающих кариес патогенных видов.
Следует отметить, что, хотя выделенные ингибирующие штаммы и соединения были получены из образцов ротовой полости и были активны в отношении патогенных вызывающих кариес (кариесогенных) бактериальных видов, проявляя свою ингибирующую способность в отношении роста патогенных бактерий, которые предпочтительно населяют ротовую полость, в принципе, выделенные бактериальные штаммы и соединения могут быть обнаружены в других частях организма и могут вызывать другие заболевания или могут быть с ними связаны. В связи с этим, цель настоящего изобретения заключается в применении штаммов и соединений, выделенных в качестве лекарственных средств, в особенности, в качестве противомикробных средств и, более конкретно, в качестве антибактериальных средств.
Следовательно, настоящее изобретение раскрывает выделение поддающихся культивированию бактериальных штаммов и соединений, в первую очередь, биологически активных пептидов, способных ингибировать рост патогенных микроорганизмов, вовлеченных в возникновение заболеваний ротовой полости. Во всем настоящем изобретении, возникновение кариеса было принято в качестве типичного заболевания для заболеваний, характерных для ротовой полости, но изобретение может быть применено к любому инфекционному заболеванию, вызываемому патогенными микроорганизмами ротовой полости. В связи с этим, настоящее изобретение предпочтительно направлено на выделение бактериальных штаммов и соединений, в первую очередь, биологически активных пептидов, способных ингибировать рост патогенных микроорганизмов, в особенности, тех, которые вовлечены в возникновение кариеса.
Способ выделения подающихся культивированию бактериальных штаммов, способных противодействовать возникновению кариеса, основан на получении метагенома ротовой полости индивидуумов, которые никогда не страдали от кариеса, с целью определения, какой тип бактерий у указанных индивидуумов наиболее часто присутствует в их ротовой полости, на анализе, какой из этих типов связан с хорошим состоянием ротовой полости, в результате ингибирования роста вызывающих кариес бактерий. Указанный способ позволил выделить, охарактеризовать, культивировать и депонировать в Испанской коллекции типовых культур (СЕСТ) различные штаммы с противокариесным действием: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775. На основании анализа гомологии последовательностей, был сделан вывод, что четыре штамма, которые обладали противокариесным действием и которые были депонированы в СЕСТ, в особенности, штаммы СЕСТ 7746, 7747, 7773 и 7775, принадлежат к одному и тому же роду бактерий: Streptococcus; следовательно, в дополнение к их функциональным характеристикам (противокариесное действие) и способу их получения, указанные штаммы связаны структурным и таксономическим сходством, так как они принадлежат, как уже упоминалось ранее, к одному и тому же роду бактерий, Streptococcus.
С другой стороны, способ выделения и характеристики биологически активных противокариесных пептидов основан на получении метагеномной фосмидной библиотеки от индивидуумов, которые никогда не страдали от кариеса. Применяя указанный способ, можно охарактеризовать пептиды с противокариесной способностью, продуцируемые бактериями, обнаруженными у индивидуумов, которые никогда не страдали от кариеса, включая неподдающиеся культивированию бактерии, а также противомикробные соединения, например, дефензин-подобные соединения, синтезируемые самими индивидуумами. Указанные пептиды анализируют с целью установить их ингибирующее действие на рост вызывающих кариес бактерий, таких, например, как S. mutans или S. sobrinus.
Другой аспект настоящего изобретения раскрывает различные специфические подающиеся культивированию бактериальные штаммы, СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775, выделенные из индивидуумов с отличным состоянием ротовой полости, которые никогда не страдали от кариеса, характеризуемые тем, что они обладают ингибирующим действием в отношении организмов, которые вызывают инфекционные заболевания ротовой полости, предпочтительно в отношении вызывающих кариес микроорганизмов. По метагеному бактерий, присутствующих в зубном налете индивидуумов, которые никогда не страдали от кариеса, роды и виды бактерий, которые чаще всего появляются у здоровых индивидуумов, которые никогда не страдали от кариеса, идентифицируют по гомологии с существующими библиотеками бактериальной ДНК. Бактерии, которые чаще всего появляются у индивидуумов без кариеса, и которые, как оказалось, отсутствуют или встречаются с очень низкой частотой у индивидуумов с кариесом, принадлежат к одному из следующих родов: Rothia, Globicatella, Johnsonella, Kingella, Cardiobacterium, Phocoenobacter, Mannheimia, Haemophilus, Neisseria, Streptococcus и Aggregatibacter; причем род Streptococcus наиболее распространен. В связи с этим, предпочтительные бактериальные штаммы изобретения представляют собой штаммы СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 и СЕСТ 7775, все они принадлежат к роду Streptococcus.
Другой аспект, раскрытый в настоящем изобретении, описывает биологически активные соединения, предпочтительно пептиды, которые ингибируют рост организмов, вызывающих инфекционные заболевания ротовой полости, предпочтительно микроорганизмов, вызывающих кариес. В особенности, он описывает пептиды, кодируемые последовательностями ДНК, включенными в любую из следующих фосмидных вставок, и ингибирующие организмы, вызывающие инфекционные заболевания ротовой полости, предпочтительно микроорганизмы, вызывающие кариес: SEQ ID NO: I, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 13, SEQ ID NO: 14.
Конкретнее, пептиды, кодируемые последовательностями ДНК, включенными в фосмидные вставки, и ингибирующие организмы, которые вызывают инфекционные заболевания ротовой полости: SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5, характеризуются тем, что они имеют бактериальное происхождение и имеют характеристики, аналогичные характеристикам бактериоцинов. Подобным образом, пептиды, кодируемые последовательностями ДНК, включенными в фосмидные вставки, и ингибирующие организмы, которые вызывают инфекционные заболевания ротовой полости: SEQ ID NO: I, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 13 и SEQ ID NO: 14, характеризуются тем, что они происходят от человека и имеют характеристики, аналогичные характеристикам дефензинов.
В частности, изобретение раскрывает 2 специфических пептида: SEQ ID NO: 8, противомикробный пептид человеческого происхождения с характеристиками, аналогичными характеристикам дефензинов; и SEQ ID NO: 9, пептид бактериального происхождения с характеристиками, аналогичными характеристикам бактериоцинов.
Кроме того, изобретение раскрывает твердые, порошкообразные (для прямого поглощения или в растворе) или пастообразные композиции для гигиены ротовой полости, такие как зубная паста, жевательная резинка, конфеты, батончики и т.п., или жидкие растворы для полоскания рта, такие как растворы для полоскания рта, сиропы, напитки и т.п., или пробиотические и/или пребиотические пищевые композиции, композицию, в которую включают или штаммы, и/или соединения, предпочтительно пептиды изобретения, которые ингибируют рост организмов, вызывающие инфекционные заболевания ротовой полости, предпочтительно микроорганизмы, вызывающие кариес. В предпочтительном воплощении изобретения, штаммы и/или пептиды изобретения добавляют к композициям, которые обладают противомикробным действием в отношении флоры ротовой полости и которые доступны для приобретения, такие как растворы для полоскания типа Listerine®, указанные растворы для полоскания, демонстрирующие усовершенствованное ингибирующее действие в отношении организмов, которые вызывают инфекционные заболевания ротовой полости, предпочтительно в отношении микроорганизмов, вызывающих кариес, если к их композиции добавляют штаммы и/или пептиды изобретения.
Предпочтительное воплощение изобретения представляет собой пробиотики/пребиотики или функциональные пищевые продукты, композиция, в которую включены штаммы и/или соединения, предпочтительно пептиды, изобретения, которые ингибируют рост организмов, вызывающие инфекционные заболевания ротовой полости, предпочтительно микроорганизмы, вызывающие кариес.Концепция пробиотиков или функциональных пищевых продуктов включает, не ограничиваясь этим: молочные продукты, такие как йогурты, например, соки, твердые пищевые продукты, такие как, например, конфеты, а также чаи, фиточаи и продукты парафармацевтики, такие как витаминные комплексы, продукты с пищевыми добавками и т.п.
Для целей настоящего изобретения, будут объяснены следующие термины:
Инфекционное заболевание ротовой полости: для целей настоящего изобретения, инфекционные заболевания ротовой полости предпочтительно представляют собой кариес, периодонтит, гингивит и неприятный запах изо рта.
Пробиотики: для целей настоящего изобретения, термин «пробиотик» означает применение живых микроорганизмов, которые добавляют к пищевым продуктам (молоку, йогуртам и т.п.), к пищевым добавкам (в форме капсул, таблеток, пилюль, порошка и т.п.) или к другому, и которые остаются активными и оказывают свое физиологическое воздействие на субъекта, который поглощает пищу, или аналогичный продукт, содержащий указанный пробиотик. Поступая в организм в достаточном количестве, они оказывают благотворное воздействие, в данном случае, на состояние здоровья ротовой полости.
Пребиотики: для целей настоящего изобретения, термин пребиотик означает применение веществ, которые добавляют к пищевым продуктам, жевательной резинке, пищевым добавкам или к другому, и которые оказывают влияние на композицию микробиоты ротовой полости, способствуя выживанию бактерий, которые полезны для состояния здоровья ротовой полости, и/или препятствуя выживанию патогенных бактерий.
Метагеном: представляет собой геномы всех бактерии, присутствующих в образце, индивидууме или экосистеме и т.п.
Микробиом: представляет собой набор микроорганизмов или бактерий, которые сосуществуют вместе с человеком.
Биологически активные противомикробные соединения: представляют собой соединения, такие как биологически активные пептиды, белки, антибиотики, пигменты и т.п., которые были обнаружены у позвоночных и беспозвоночных и которые действуют как природные антибиотики, представляя собой часть врожденного иммунного ответа. Некоторые из этих соединений, например, пептиды, такие как, например, среди прочего, дефензины и кателицидины, производятся людьми. Они активны в отношении бактерий, грибов и отдельных вирусов.
Бактериоцины: представляют собой биологически активные пептиды, секретируемые бактериями, которые обладают бактерицидными свойствами в отношении других видов, близко напоминающих продуцирующий штамм, или в отношении штаммов, которые филогенетически отдалены от продуцирующего штамма.
Фосмиды: кольцевые фрагменты ДНК, которые могут быть легко введены в клетки-хозяева, обычно бактериальные клетки, и которые транспортируют фрагменты бактериальной ДНК или ДНК человека.
Функциональные пищевые продукты: определяют как пищевые продукты, которые получают не только за их питательные характеристики, но также для выполнения специфической функции, такой как улучшение состояния здоровья или снижение риска заражения заболеваниями. В связи с этим, к ним добавляют биологически активные соединения, такие как минералы, витамины, жирные кислоты, бактерии с полезными эффектами, диетические волокна и антиоксиданты и т.п.
Поддающиеся культивированию бактериальные штаммы: считается, что поддающиеся культивированию бактериальные штаммы представляют собой те штаммы, которые растут в чистой культуре и сохраняют способность к стабильному росту в искусственной лабораторной среде культивирования в аэробных или в анаэробных условиях.
Описание чертежей
Фигура 1. А. Фотография чашки Петри, которая показывает первоначальный отбор клонов Е. coli, содержащих фосмиды из ДНК из зубного налета индивидуумов без кариеса, которые продуцируют области ингибирования роста на высеянной газоном культуре S. mutans. В. Фотография чашки Петри, которая показывает подтверждающий отбора клонов Е. coli, содержащих фосмиды из ДНК из зубного налета индивидуумов без кариеса, которые продуцируют области ингибирования роста на высеянной газоном культуре S. mutans.
Фигура 2. Кривые роста вызывающих кариес бактерий S. mutans (положительный контроль, без добавления ингибитора кариогенеза, представленные на графике в виде сплошной линии) в среде BHI (сердечно-мозговая вытяжка), и в среде BHI, обогащенной 100 мкл (пунктирная линия из точек), 150 мкл (линия с короткими штрихами), 200 мкл (линия с короткими штрихами и точками), 300 мкл (линия с длинными штрихами) или 400 мкл (линия с длинными штрихами и двойными точками) 3-10-кДа фракции концентрированного супернатанта, полученного, соответственно, из 5, 2,25, 3,0, 4,5 и 6 мл культур клеток, несущих фосмиду S12E, содержащую противомикробный бактериоцин-подобный пептид изобретения бактериального происхождения. Данные, регистрируемые каждые полчаса в течение 19-ти часов, представляют собой среднее из 3-х экспериментов. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 3. Кривые роста вызывающих кариес бактерий S. mutans в среде BHI (сплошная линия, положительный контроль без добавления ингибитора кариогенеза) и в среде BHI с 50 мкл (пунктирная линия из штрихов) и 100 мкл (пунктирная линия из точек) 0-3-кДа фракции концентрированного супернатанта, полученного, соответственно, из 2 и 4 мл культур клеток, несущих фосмиду Т5А, содержащую противомикробный дефензин-подобный пептид изобретения человеческого происхождения. Данные, регистрируемые каждые полчаса в течение 12-х часов, представляют собой среднее из 3-х экспериментов. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 4. Кривые роста вызывающих кариес бактерий S. mutans в присутствии Listerine® и S12E, ингибитора бактериального происхождения. Данные регистрировали в течение 19-ти часов при температуре, равной 37°C, в культуральной среде BHI и представляли как среднее из 3-х экспериментов. Сплошная линия показывает негативный контроль, без бактерий. Линия с короткими штрихами показывает положительный контроль, рост S. mutans в отсутствии Listerine® и ингибитора S12E. Линия с длинными штрихами показывает рост S. mutans в присутствии 100 мкл Listerine®. Пунктирная линия из точек показывает рост S. mutans в присутствии 100 мкл ингибитора S12E. Линия с короткими штрихами и точками показывает рост S. mutans в присутствии 100 мкл Listerine® + 100 мкл ингибитора S12E. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 5. Кривые роста вызывающих кариес бактерий S. mutans в присутствии ингибитора S12E (противомикробный бактериоцин-подобный пептид изобретения бактериального происхождения), синтезированного химическим способом в лаборатории и ресуспендированного в 0,1%-ном ТСА. Результаты показывают рост S. mutans, измеренный как поглощение при 600 нм в течение 30-ти минут на протяжении 30-ти часов при температуре, равной 37°C, в 100 мкл культуральной среды BHI, в трех независимых экспериментах. Сплошная линия показывает негативный контроль, без бактерий. Линия с черными квадратами показывает рост S. mutans в культуральной среде BHI. Пунктирная линия из точек показывает положительный контроль, рост S. mutans в культуральной среде BHI в присутствии 10 мкл 0,1%-ного ТСА. Линия с короткими штрихами и точками показывает рост S. mutans в культуральной среде BHI в присутствии 0,3 мг пептида S12E ресуспендированного в 10 мкл 0,1%-ного ТСА. Линия с короткими штрихами показывает рост S. mutans в культуральной среде BHI в присутствии 0,03 мг пептида S12E, ресуспендированного в 10 мкл 0,1%-ного ТСА. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 6. Кривые роста вызывающих кариес бактерий S. mutans (А) и S. sobrinus (В) в присутствии ингибитора S12E (противомикробный бактериоцин-подобный пептид изобретения бактериального происхождения), синтезированного химическим способом в лаборатории, и ресуспендированного в воде высшей степени очистки. Результаты показывают рост S. mutans, измеренный как поглощение при 600 нм в течение 30-ти минут на протяжении 48-ми часов при температуре, равной 37°C, в 200 мкл культуральной среды BHI, и представлены как среднее из трех независимых экспериментов. На обоих графиках, графике А и графике В, сплошными линиями показан негативный контроль, без бактерий;
пунктирными линиями из точек показан рост S. mutans (А) или S. sobrinus (В) в культуральной среде BHI. Линия с короткими штрихами показывает положительный контроль, рост S. mutans (А) или S. sobrinus (В) в культуральной среде BHI в присутствии воды. Линия с черными квадратами показывает рост S. mutans (А) или S. sobrinus (В) в культуральной среде BHI в присутствии 0,23 мг пептида изобретения S12E, ресуспендированного в воде высшей степени очистки. Линия с черными ромбами показывает рост S. mutans (А) или S. sobrinus (В) в культуральной среде BHI в присутствии 0,047 мг пептида S12E изобретения, ресуспендированного в воде высшей степени очистки. Линия с черными треугольниками показывает рост S. mutans (А) или S. sobrinus (В) в культуральной среде BHI в присутствии 0,094 мг пептида S12E изобретения, ресуспендированного в воде высшей степени очистки. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 7. Кривые роста вызывающих кариес бактерий S. mutans в присутствии 4 мкг, 40 мкг и 80 мкг ингибитора изобретения T5A, синтезированного химическим способом в лаборатории и ресуспендированного в воде высшей степени очистки. Результаты показывают рост S. mutans, измеренный как поглощение при 600 нм, в течение 30-ти минут на протяжении 44-х часов при температуре, равной 37°C в 200 мкл культуральной среды BHI, и представлены как среднее из трех независимых экспериментов. Сплошная линия показывает негативный контроль, без клеток. Линия с короткими штрихами показывает рост S. mutans в культуральной среде BHI (положительный контроль) с водой высшей степени очистки. Линия с черными квадратами показывает рост S. mutans в культуральной среде BHI в присутствии 1 мкл пептида изобретения T5A (противомикробный дефензин-подобный пептид, происходящий от человека). Линия с черными ромбами показывает рост S. mutans в культуральной среде BHI в присутствии 10 мкл пептида изобретения T5A. Линия с черными треугольниками показывает рост S. mutans в культуральной среде BHI в присутствии 20 мкл пептида изобретения T5A. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 8. Кривые роста вызывающих кариес бактерий S. mutans в жидкой культуральной среде в присутствии супернатантов, сконцентрированных в 10 раз и выделенных в зависимости от их молекулярной массы, произведенных культурами бактериальных клеток Е. coli, несущих фосмиду W4D, которая включает полинуклеотидную последовательность SEQ IDNO: 13, кодирующую противомикробный дефензин-подобный пептид изобретения человеческого происхождения. Данные, регистрируемые каждые полчаса в течение 24-х часов, представляют собой среднее из 3-х экспериментов. В качестве контроля, на графике показана кривая роста S. mutans в присутствии сконцентрированного супернатанта нетрансформированной бактериальной культуры Е. coli epi300. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 9. Кривые роста вызывающих кариес бактерий S. mutans в жидкой культуральной среде в присутствии супернатантов, сконцентрированных в 10 раз и выделенных в зависимости от их молекулярной массы, произведенных культурами бактериальных клеток Е. coli, несущих фосмиду T5H, которая включает полинуклеотидную последовательность SEQ ID NO: 14, кодирующую противомикробный дефензин-подобный пептид изобретения человеческого происхождения. Данные, регистрируемые каждые полчаса в течение 24-х часов, представляют собой среднее из 3-х экспериментов. В качестве контроля, на графике показана кривая роста S. mutans в присутствии сконцентрированного супернатанта нетрансформированной бактериальной культуры Е. coli epi300. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 10. Кривые роста вызывающих кариес бактерий S. mutans в жидкой культуральной среде в присутствии супернатантов, сконцентрированных в 10 раз и выделенных в зависимости от их молекулярной массы, произведенных культурами бактериальных клеток Е. coli, несущих фосмиду A5D11, которая включает полинуклеотидную последовательность SEQ ID NO: 6, кодирующую противомикробный дефензин-подобный пептид изобретения человеческого происхождения. Данные, регистрируемые каждые полчаса в течение 24-х часов, представляют собой среднее из 3-х экспериментов. В качестве контроля, на графике показана кривая роста S. mutans в присутствии сконцентрированного супернатанта культуры нетрансформированных бактерий Е. coli epi300. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 11. Кривые роста вызывающих кариес бактерий S. mutans в жидкой культуральной среде в присутствии супернатантов, сконцентрированных в 10 раз и выделенных в зависимости от их молекулярной массы, произведенных культурами бактериальных клеток Е. coli, несущих фосмиду A4H11, которая включает полинуклеотидную последовательность SEQ ID NO: 7, кодирующую противомикробный дефензин-подобный пептид изобретения человеческого происхождения. Данные, регистрируемые каждые полчаса в течение 24-х часов, представляют собой среднее из 3-х экспериментов. В качестве контроля, на графике показана кривая роста S. mutans в присутствии сконцентрированного супернатанта культуры нетрансформированных бактерий Е. coli epi300. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 12. Фотографии чашек Петри, демонстрирующие ингибирование роста посеянных газоном культур S. mutans в присутствии изолятов штаммов СЕСТ 7746 (А), СЕСТ 7747 (В), СЕСТ 7773 (С), СЕСТ 7774 (D) и СЕСТ 7775 (Е), раскрытых в изобретении.
Фигура 13. Фотографии чашек Петри, демонстрирующие ингибирование роста посеянных газоном культур S. sobrinus в присутствии изолятов штаммов СЕСТ 7746 (А), СЕСТ 7747 (В) и СЕСТ 7775 (С), раскрытых в изобретении.
Фигура 14. Кривые роста вызывающих кариес бактерий S. mutans в культуральной среде BHI в присутствии супернатантов, сконцентрированных в 10 раз и выделенных в зависимости от их молекулярной массы, полученных из культур штаммов СЕСТ 7746 (А) и СЕСТ 7747 (В) на стационарной фазе роста. Данные, регистрируемые каждые 15 минут в течение 20-ти часов, представляют собой среднее из 4 экспериментов. Линия, маркированная как antb, показывает обработку антибиотиком хлорамфениколом (положительный контроль). На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 15. Кривые роста вызывающих кариес бактерий S. mutans в культуральной среде BHI в присутствии супернатантов, сконцентрированных в 10 раз и выделенных в зависимости от их молекулярной массы, полученных из культур штамма СЕСТ 7746 на стационарной фазе (est) и экспоненциальной фазе (ЕХР) роста. Данные, регистрируемые каждые 15 минут в течение 24-х часов, представляют собой среднее из 4-х экспериментов. Линия, маркированная как clorf, показывает обработку антибиотиком хлорамфениколом (положительный контроль). На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 16. Кривые роста вызывающих кариес бактерий S. mutans в культуральной среде BHI в присутствии супернатанта, сконцентрированного в 10 раз и с молекулярной массой менее чем 3 кДа, полученного из культур штаммов СЕСТ 7746 (А) и СЕСТ 7747 (В), подвергнутого обработке при 100°C в течение 10 минут. Данные, регистрируемые каждые 15 минут в течение 24-х часов, представляют собой среднее из 4-х экспериментов. На оси Х графика показано время, выраженное в часах, и на оси Y показана оптическая плотность (OD) бактериальных культур.
Фигура 17. Фотографии чашек Петри, демонстрирующие ингибирование роста посеянных газоном культур S. mutans в присутствии супернатантов культур штаммов СЕСТ 7746 (показан как 46 на фотографии) и СЕСТ 7747 (показан как 47 на фотографии) в аэробных и анаэробных условиях.
Фигура 18. Концентрация молочной кислоты, выраженная в мМ, образованной биопленкой из культуры слюны человека в модели искусственного зуба в аэробных и анаэробных условиях, к которой были добавлены бактериальные штаммы СЕСТ 7746 и СЕСТ 7747, или их соответствующие супернатанты. Для более подробной информации, смотри пример 15. В качестве негативного контроля применяли штамм C7.1, который представляет собой изолят, принадлежащий к видам группы Streptococcus mitis/oralis/infantis, полученный от индивидуума без кариеса, но который не производит ингибирование роста вызывающих кариес видов.
Осуществление изобретения
Объектом настоящего изобретения является подающийся культивированию противомикробный бактериальный штамм, который выбирают из любого из следующих штаммов: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775. В предпочтительном воплощении, бактериальные штаммы изобретения, характеризуемые тем, что они принадлежат к роду Streptococcus, выбирают из: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 или СЕСТ 7775. В другом предпочтительном воплощении, противомикробные бактериальные штаммы, раскрытые в изобретении, обладают ингибирующим действием на рост организмов, которые вызывают инфекционные заболевания ротовой полости, предпочтительно организмов, вызывающих кариес. В предпочтительном воплощении, штаммы изобретения характеризуются тем, что, в дополнение к конкурентному росту при захвате зуба, они способны продуцировать вещества, ингибирующие рост бактерий, вызывающих кариес.
Еще один объект настоящего изобретения относится к поддающимся культивированию противомикробным бактериальным штаммам, который выбирают из любого из следующих штаммов: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775, или их комбинации, для применения в качестве лекарственного средства. В предпочтительном воплощении, противомикробные бактериальные штаммы, раскрытые в изобретении, характеризуются тем, что они принадлежат к роду Streptococcus и представляют собой штаммы, который выбирают из: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 или СЕСТ 7775.
Еще один объект настоящего изобретения относится к применению по меньшей мере одного из поддающихся культивированию противомикробных бактериальных штаммов, который выбирают из любого из следующих штаммов: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775, или их комбинации, при производстве лекарственного средства. В предпочтительном воплощении, указанное применение характеризуется тем, что бактериальные штаммы принадлежат к роду Streptococcus и их выбирают из: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 или СЕСТ 7775.
Еще один объект настоящего изобретения относится к поддающимся культивированию противомикробным бактериальным штаммам, которые выбирают из любого из следующих штаммов: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775, или их комбинации, для применения в качестве противомикробного средства, предпочтительно антибактериального средства. В предпочтительном воплощении, противомикробный бактериальный штамм характеризуется тем, что он принадлежит к роду Streptococcus и представляет собой штамм, который выбирают из: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 или СЕСТ 7775.
Еще один объект настоящего изобретения относится к применению по меньшей мере одного из поддающихся культивированию противомикробных бактериальных штаммов, который выбирают из любого из следующих штаммов: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775, или их комбинации, при производстве противомикробной композиции, предпочтительно антибактериальной композиции. В предпочтительном воплощении, указанное применение характеризуется тем, что бактериальный штамм принадлежит к роду Streptococcus и представляет собой штамм, который выбирают из: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 или СЕСТ 7775.
Еще один объект настоящего изобретения относится к поддающемуся культивированию противомикробному бактериальному штамму, который выбирают из любого из следующих штаммов: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775, или их комбинации, для применения при лечении инфекционных заболеваний ротовой полости, предпочтительно лечении кариеса. В предпочтительном воплощении, бактериальный штамм изобретения характеризуется тем, что он принадлежит к роду Streptococcus и представляет собой штамм, который выбирают из: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 или СЕСТ 7775.
Еще один объект настоящего изобретения относится к применению по меньшей мере одного из поддающихся культивированию противомикробных бактериальных штаммов, который выбирают из любого из следующих штаммов: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775, или их комбинации, при получении композиции, разработанной для лечения инфекционных заболеваний ротовой полости, предпочтительно для лечения кариеса. В предпочтительном воплощении, применение штаммов изобретения характеризуется тем, что подающийся культивированию бактериальный штамм принадлежит к роду Streptococcus и представляет собой штамм, который выбирают из: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 или СЕСТ 7775.
Еще один объект настоящего изобретения относится к поддающимся культивированию противомикробным бактериальным штаммам, которые выбирают из любого из следующих штаммов: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775, или их комбинации, для применения в качестве пробиотика или функционального пищевого продукта, разработанного для улучшения состояния здоровья ротовой полости, предпочтительно для предупреждения кариеса. В предпочтительном воплощении, штаммы изобретения характеризуются тем, что они принадлежат к роду Streptococcus, который выбирают из: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 или СЕСТ 7775.
Еще один объект, раскрытый в настоящем изобретении, относится к применению по меньшей мере одного из поддающихся культивированию противомикробных бактериальных штаммов, который выбирают из любого из следующих штаммов: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775, или их комбинации, в препарате пробиотика или функционального пищевого продукта, разработанного для улучшения состояния здоровья ротовой полости, предпочтительно для предупреждения кариеса. В предпочтительном воплощении, применение по меньшей мере одного из вышеуказанных бактериальных штаммов характеризуется тем, что указанные штаммы принадлежат к роду Streptococcus и представляют собой штаммы, который выбирают из: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 или СЕСТ 7775.
Еще один объект, раскрытый в настоящем изобретении, относится к пробиотическим/пребиотическим композициям или функциональному пищевому продукту, который включает по меньшей мере один подающийся культивированию противомикробный штамм, такой как указан во всем настоящем изобретении, а также противокариесные вещества, соединения или молекулы, секретируемые указанным штаммом.
Еще один объект, раскрытый в настоящем изобретении, относится к медико-фармацевтическим композициям или к композиции, разработанной для поддержания ротовой полости в здоровом состоянии, которая включает по меньшей мере один подающийся культивированию противомикробный штамм, такой как описан во всем настоящем изобретении, или противокариесные вещества, соединения или молекулы, секретируемые указанными штаммами.
Еще один объект, раскрытый в настоящем изобретении, относится к противомикробному соединению, которое включает SEQ ID NO: 8, или к противомикробному соединению, кодируемому последовательностью ДНК, которая включает любую из следующих последовательностей: SEQ ID NO: I, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 13, SEQ ID NO: 14.
Еще один объект, раскрытый в настоящем изобретении, относится к противомикробному соединению, которое состоит из SEQ ID NO: 8, или к противомикробному соединению, кодируемому последовательностью ДНК, которая состоит из любой из следующих последовательностей: SEQ ID NO: I, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 13, SEQ ID NO: 14. В предпочтительном воплощении изобретения описанные выше противомикробные соединения обладают ингибирующим действием на рост организмов, которые вызывают инфекционные заболевания ротовой полости, предпочтительно организмов, вызывающих кариес. В другом предпочтительном воплощении, указанные противомикробные соединения представляют собой пептиды.
Еще один объект настоящего изобретения относится к противомикробным соединениям, упомянутым в предыдущих параграфах, или к их комбинации, для применения в качестве лекарственного средства.
Еще один объект, раскрытый в настоящем изобретении, относится к применению по меньшей мере одного описанного выше противомикробного соединения, или их комбинации, при производстве лекарственного средства.
Еще один объект настоящего изобретения относится к описанным выше противомикробным соединениям, или их комбинации, для применения при производстве противомикробной композиции, предпочтительно антибактериальной композиции. Еще один объект, раскрытый в настоящем изобретении, относится к применению по меньшей мере одного описанного выше противомикробного соединения, или их комбинации, при производстве противомикробной композиции, предпочтительно антибактериальной композиции.
Еще один объект настоящего изобретения относится к описанным выше противомикробным соединениям, или их комбинации, для применения при лечении инфекционных заболеваний ротовой полости, предпочтительно при лечении кариеса.
Еще один объект, раскрытый в настоящем изобретении, относится к применению по меньшей мере одного описанного выше противомикробного соединения, или их комбинации, при получении композиции, разработанной для лечения инфекционных заболеваний ротовой полости, предпочтительно противокариесной композиции.
Еще один объект настоящего изобретения относится к вышеуказанным в настоящем изобретении противомикробным соединениям, для применения в качестве пребиотика или функционального пищевого продукта, разработанного для улучшения состояния здоровья ротовой полости, предпочтительно для предупреждения кариеса.
Еще один объект, раскрытый в настоящем изобретении, относится к применению по меньшей мере одного описанного выше противомикробного соединения, или их комбинации, в препарате пребиотика или функционального пищевого продукта, разработанного для улучшения состояния здоровья ротовой полости, предпочтительно для предупреждения кариеса.
Еще один объект, раскрытый в настоящем изобретении, относится к пробиотическим/пребиотическим композициям или функциональному пищевому продукту, которые включают по меньшей мере одно противомикробное соединение, как описано во всем настоящем изобретении.
Еще один объект, раскрытый в настоящем изобретении, относится к медико-фармацевтической композиции или композиции для поддержания ротовой полости в здоровом состоянии, которая включает по меньшей мере одно противомикробное соединение, такое как описано во всем настоящем изобретении.
Еще один объект, раскрытый в настоящем изобретении, относится к противомикробному соединению, которое включает последовательность SEQ ID NO: 9, или к противомикробному соединению, кодируемому последовательностью ДНК, которая включает любую из следующих последовательностей: SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5.
Еще один объект, раскрытый в настоящем изобретении, относится к противомикробному соединению, которое состоит из последовательности SEQ ID NO: 9, или к противомикробному соединению, кодируемому последовательностью ДНК, которая состоит из любой из следующих последовательностей: SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5. В предпочтительном воплощении, указанные противомикробные соединения обладают ингибирующим действием на рост организмов, которые вызывают инфекционные заболевания ротовой полости, предпочтительно организмов, вызывающих кариес. В другом предпочтительном воплощении, описанные выше противомикробные соединения характеризуются тем, что они представляют собой пептиды. В другом предпочтительном воплощении, описанные выше противомикробные соединения характеризуются тем, что они ингибируют образование кислоты, предпочтительно молочной кислоты, в ротовой полости.
Еще один объект, раскрытый в настоящем изобретении, относится к противомикробному соединению, как описано выше, или к их комбинации, для применения в качестве лекарственного средства.
Еще один объект настоящего изобретения относится к применению по меньшей мере одного противомикробного соединения, как описано в настоящем изобретении, или их комбинации, при производстве лекарственного средства.
Еще один объект настоящего изобретения относится к противомикробному соединению, как уже говорилось выше, или к их комбинации, для применения при производстве противомикробной композиции, предпочтительно антибактериальной композиции.
Еще один объект настоящего изобретения относится к применению по меньшей мере одного описанного выше противомикробного соединения, или их комбинации, при производстве противомикробной композиции, предпочтительно антибактериальной композиции.
Еще один объект, раскрытый в настоящем изобретении, относится к противомикробному соединению, как описано выше, или к их комбинации, для применения при лечении инфекционных заболеваний ротовой полости, предпочтительно при лечении кариеса.
Еще один объект, раскрытый в настоящем изобретении, относится к применению по меньшей мере одного описанного выше противомикробного соединения, или их комбинации, при получении композиции, разработанной для лечения инфекционных заболеваний ротовой полости, предпочтительно противокариесной композиции.
Еще один объект настоящего изобретения относится к описанным выше противомикробным соединениям, или к их комбинации, для применения в качестве пребиотиков или функциональных пищевых продуктов, разработанных для улучшения состояния здоровья ротовой полости, предпочтительно для предупреждения кариеса.
Еще один объект, раскрытый в настоящем изобретении, относится к применению, по меньшей мере, одного описанного выше противомикробного соединения, или их комбинации, в препарате пребиотика или функционального пищевого продукта, разработанного для улучшения состояния здоровья ротовой полости, предпочтительно для предупреждения кариеса.
Еще один объект, раскрытый в настоящем изобретении, относится к пробиотическим/пребиотическим композициям или функциональному пищевому продукту, которые включают по меньшей мере одно противомикробное соединение, как описано в настоящем изобретении.
Еще один объект, раскрытый в настоящем изобретении, относится к медико-фармацевтическим композициям или к композициям для поддержания ротовой полости в здоровом состоянии, которые включают по меньшей мере одно противомикробное соединение, как описано в настоящем изобретении.
Еще один объект, раскрытый в настоящем изобретении, относится к способу выделения поддающихся культивированию противомикробных бактериальных штаммов, предпочтительно ингибирующих рост организмов, которые вызывают инфекционные заболевания ротовой полости, и более предпочтительно организмов, вызывающих кариес, характеризуемому тем, что он включает:
a) Получение образцов из наддесневого зубного налета индивидуумов, которые никогда не страдали от кариеса.
b) Посев образцов в соответствующую среду и в соответствующих условиях таким образом, чтобы вырастить и изолировать только те бактерии, которые наиболее часто встречаются у индивидуумов, которые никогда не страдали от кариеса, оценивая последнее путем пиросеквенирования метагенома.
c) Культивирование выделенных штаммов в среде роста для вызывающих кариес бактерий и отбор, после соответствующего времени культивирования, тех штаммов, которые дают зоны ингибирования в отношении указанного роста.
В предпочтительном воплощении, описанный выше способ характеризуется тем, что на стадии b) бактерий, наиболее часто встречающихся у индивидуумов, которые никогда не страдали от кариеса, оценивают с помощью пиросеквенирования метагенома, методики, которая позволяет оценить долю каждого бактериального вида. В другом предпочтительном воплощении, описанный выше способ характеризуется тем, что на стадии с) предпочтительно отбирают бактерии, принадлежащие к следующим родам: Streptococcus, Rothia, Neisseria, Globicatella, Johnsonella, Haemophilus, Kingella, Cardiobacterium, Mannheimia, Phocoenobacter и Aggregatibacter. В особенности, отбирают следующие штаммы: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775. В частности, отбирают бактерии, принадлежащие к роду Streptococcus, предпочтительно те, которые принадлежат к следующим видам: S. sanguis, S. oralis, S. mitis, S. infantis или к новым видам, которые не были описаны, но принадлежат к подгруппе Streptococcus, включающей эти четыре вида. В частности, по меньшей мере один противомикробный бактериальный штамм представляет собой штамм, который выбирают из: СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 или СЕСТ 7775.
Еще один объект, раскрытый в настоящем изобретении, относится к способу предупреждения и/или лечения инфекционных заболеваний, предпочтительно заболеваний ротовой полости и более предпочтительно кариеса, включающему введение по меньшей мере одного из поддающихся культивированию противомикробных штаммов, описанных в настоящем изобретении, в количестве, которое является эффективным для ингибирования роста патогенный микроорганизмов, предпочтительно вызывающих кариес микроорганизмов, постоянно присутствующих в указанной полости; или пробиотической/пребиотической композиции или функциональных пищевых продуктов, описанных в настоящем изобретении, которые включают указанные штаммы; или медико-фармацевтической композиции или композиции для поддержания ротовой полости в здоровом состоянии, описанных в настоящем изобретении, которые включают указанной штаммы.
Еще один объект настоящего изобретения относится к способу получения противомикробного соединения, предпочтительно ингибирующего рост организмов, которые вызывают инфекционные заболевания ротовой полости, и более предпочтительно организмов, вызывающих кариес, характеризуемому тем, что он включает:
a) Получение образцов из наддесневого зубного налета индивидуумов, которые никогда не страдали от кариеса.
b) Лизирование указанных образцов и экстрагирование из них интактной геномной ДНК.
c) Получение из оставшейся экстрагированной ДНК, метагеномной библиотеки векторов, предпочтительно плазмид или фосмид, в которые возможно вставить и провести экспрессию в клетке-хозяине экстрагированной ДНК, которую они несут.
d) Введение векторов в клетку-хозяина.
e) Посев клонов клеток-хозяев, содержащих векторы, в культуру с вызывающими кариес микроорганизмами и отбор, после соответствующего времени культивирования, тех клонов, которые способны образовывать зоны ингибирования роста.
f) Секвенирование ДНК векторов клонов, проявляющих ингибирующее действие, синтез и/или очистка соединения, кодируемого указанной ДНК.
В предпочтительном воплощении, описанный выше способ характеризуется тем, что концентрация экстрагированной ДНК равна по меньшей мере 300 мкг/мл. В другом предпочтительном воплощении, указанный способ характеризуется тем, что, следуя способу экстракции ДНК, конструируют такие фосмиды, которые содержат ДНК, имеющую размер в диапазоне, предпочтительно от 35 идо 45 т.п.о. В другом предпочтительном воплощении, указанные фосмиды содержат ДНК, размер которой меньше чем 1 т.п.о. В другом предпочтительном воплощении, указанный способ характеризуется тем, что клетка-хозяин, в которую вводят фосмиды, представляет собой Е. coli.
В другом предпочтительном воплощении, указанный способ характеризуется тем, что культура микроорганизма, на которую высевают клоны с ДНК-вставками, содержащими в фосмидах, представляет собой вызывающих кариес бактерий, предпочтительно S. mutans или S. sobrinus. В другом предпочтительном воплощении, указанный способ характеризуется тем, что последовательность ДНК фосмид, выбирают из последовательностей, которые включают: SEQ ID NO: I, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 13, SEQ ID NO: 14, или их комбинаций. В другом предпочтительном воплощении, указанный способ характеризуется тем, что последовательность ДНК фосмид, выбирают из последовательностей, которые состоят из: SEQ ID NO: I, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 13, SEQ ID NO: 14, или их комбинаций.
В другом предпочтительном воплощении, указанный способ характеризуется тем, что получают по меньшей мере один противомикробный пептид, включающий последовательность, которую выбирают из SEQ ID NO: 8 или SEQ ID NO: 9, или противомикробное соединение, кодируемое последовательностью ДНК, включающей любую из следующих последовательностей: SEQ ID NO: I, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 13, SEQ ID NO: 14. В другом предпочтительном воплощении, указанный способ характеризуется тем, что получают по меньшей мере один противомикробный пептид, состоящий из последовательности, которую выбирают из SEQ ID NO: 8 или SEQ ID NO: 9, или противомикробное соединение, кодируемое последовательностью ДНК, которая состоит из любой из следующих последовательностей: SEQ ID NO: I, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 13, SEQ ID NO: 14.
В другом предпочтительном воплощении, последовательности ДНК фосмид SEQ ID NO: I, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 13 и SEQ ID NO: 14, и противомикробный пептид с SEQ ID NO: 9 имеют бактериальное происхождение, предпочтительно представляют собой бактериоцины. В другом предпочтительном воплощении, ДНК последовательности фосмид SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5 происходят от человека и предпочтительно представляют собой дефензины/кателицидины.
Еще один объект, раскрытый в настоящем изобретении, относится к способу предупреждения и/или лечения инфекционных заболеваний, предпочтительно заболеваний ротовой полости и более предпочтительно кариеса, включающему введение в количестве, которое является эффективным для ингибирования роста патогенных микроорганизмов, постоянно присутствующих в указанной полости по меньшей мере одного противомикробного соединения, такого как описано во всем настоящем изобретении; или пробиотической/пребиотической композиции или функциональных пищевых продуктов, которые включают по меньшей мере одно из противомикробных соединений, описанных в настоящем изобретении, или медико-фармацевтической композиции или композиции для поддержания ротовой полости в здоровом состоянии, включающей по меньшей мере одно из противомикробных соединений, описанных в настоящем изобретении.
Депонирование микроорганизмов в соответствии с Будапештским договором
Микроорганизмы, примененные в настоящем изобретении, были депонированы в Испанской коллекции типовых культур (СЕСТ), расположенной в Исследовательском корпусе Университета Валенсии, Campus Burjassot, Бурхасот 46100 (Валенсия, Испания), с регистрационными номерами:
- СЕСТ 7746: бактериальный штамм рода Streptococcus, депонированный 7 июня 2010.
- СЕСТ 7747: бактериальный штамм рода Streptococcus, депонированный 7 июня 2010.
- СЕСТ 7773: бактериальный штамм рода Streptococcus, депонированный 22 июля 2010.
- СЕСТ 7774: бактериальный штамм рода Rothia, депонированный 22 июля 2010.
- СЕСТ 7775: бактериальный штамм рода Streptococcus, депонированный 22 июля 2010.
Приведенные ниже примеры предназначены для иллюстрации изобретения, без ограничения его объема.
Пример 1. Получение метагенома наддесневого зубного налета
В первую очередь, после подписания информированного согласия, у волонтеров, которые никогда не страдали от кариеса, берут образцы наддесневого зубного налета и, для сравнения, аналогичные образцы берут у волонтеров, которые ранее страдали от кариеса, и у волонтеров, которые страдают от кариеса и у которых, помимо этого, были обнаружены участки повреждения в указанном кариесе. Способ отбора образцов был одобрен Комитетом по этике в области клинических исследований Главного управления здравоохранения регионального правительства Валенсии (GSP-CSISP). Состояние здоровья ротовой полости каждого волонтера оценивал дантист в соответствии с рекомендациями и номенклатурой Исследовании в области состояния здоровья ротовой полости Всемирной организации здравоохранения (WHO), и образцы отбирали, применяя стерильные зонды. Волонтеров просили не чистить зубы в течение 24-х часов перед отбором образцов.
Для исследования разнообразия микроорганизмов в зубном налете и получения их метагенома, материал, собранный из налета с поверхностей всех зубов каждого индивидуума, перемешивали для последующего его лизирования и получения общей ДНК каждого зубного налета. ДНК экстрагировали с помощью набора «MasterPure» для полной очистки ДНК и РНК («MasterPure™ Complete DNA and RNA Purification Kit») компании «Epicentre Biotechnologies», следуя инструкциям производителя и добавив обработку лизоцимом (1 мг/мл при 37°C в течение 30-ти минут) на стадии лизиса. Концентрацию ДНК измеряли с помощью прибора «NanoDrop» (компания «Thermo Scientific»), и концентрация ДНК в выбранных образцах должна быть предпочтительно равна более чем 300 мкг/мл, а ее общее количество по меньшей мере 5 мкг (это связано с порогом чувствительности оборудования и способов, применяемых для пиросеквенирования). Кроме того, образцы ДНК разгоняли на агарозном геле для проверки целостности геномной ДНК, экстрагированной из зубных налетов волонтеров. В дальнейшем, проводили пиросеквенирование указанной экстрагированной ДНК с помощью секвенатора «GS FLX-Titanium Chemistry» (компании «Roche»). Пиросеквенирование состоит из фрагментации ДНК на фрагменты, размером примерно 500-800 нуклеотидов, с помощью азота под давлением, присоединения адаптеров к каждому концу, которые позволяют прикрепить ДНК к сферам, размером меньше одного микрометра в диаметре. Сферы вносят в специальное масло, которое действует как микрореактор, для проведения эмульсионной ПЦР (emPCR), при которой амплифицируют ДНК, интегрированную в каждую сферу.
После обогащения сфер, содержащих амплифицированную ДНК, раствор помещают на титановые пластины в секвенатор модели «GS FLX» (компания «Roche»), в котором проходит реакция пиросеквенирования. Эта реакция состоит из трансформации каждой молекулы пирофосфата, высвобождаемого полимеразой при добавлении нуклеотидов, в световой пучок, с помощью набора ферментов, таких как люцифераза. Этот световой пучок пропорционален числу добавленных нуклеотидов и, таким способом, высокочувствительная камера транслирует импульсы света в соответствующую последовательность ДНК (19). Средняя длина указанной ДНК равна 425 pb. Те систематически появляющиеся последовательности, которые были артефактно реплицированные с помощью методики 454-пиросеквенирования, исключают из набора окончательных данных с помощью «454 Replicar Filter» (20), так чтобы число прочтений данной последовательности отражала только частоту ее встречаемости в образце.
Количество ДНК человека в метагеномах из образцов из наддесневого зубного налета варьирует в диапазоне 0,5%-40% (Таблица 1), и ее идентифицируют с помощью базы данных генома человека, применяя программу «Megablast» (21) и исключают из набора окончательных данных.
2 Число частей зуба с кариесом (С), отсутствуют (А) и затруднен доступ (O). Число в скобках указывают число открытого кариеса у пациента.
3 Число последовательностей 16S rRNA, обнаруженных метагеноме и определенных с помощью классификатора RDP.
4 Индексы разнообразия Симпсона, Шеннона и rao, примененные на уровне рода.
Затем, в среднем 425 прочтений «последовательности-штрихкода» (pbs) позволило определить функциональную значимость в существенной фракции метагенома (таблица 2). Кроме того, совокупность указанных прочтений дала 1103 контигов, размером более чем 5 т.п.о., и 354, размером более чем 10 т.п.о. Мы получили в среднем 129,5 млн п.о. высококачественных отфильтрованных последовательностей (более чем 100 п.о., и в которых свыше 90% нуклеотидов были установлены с 99,99% точностью: Вероятность того, что прочтение нуклеотида с помощью пиросеквенатора правильно; т.е. точность в 99,99% означает, что только 0,01% нуклеотидов определи неправильно (ошибки секвенирования)) для каждого из 6-ти образцов из ротовой полости. В двух образцах с кариесными поражениями, примерно 70% последовательностей относились к ДНК человека, и в этом случае получали среднее из 32,5 млн п.о. высококачественно отфильтрованных прочтений.
(n): абсолютное число.
(%): общий процент прочтений в образце, для которых были определены функции.
acdd: отнесение к консервативным доменам, проанализированным в базе данных консервативных доменов Национального центра биотехнологической информации (NCBI Conserved Domains database).
bcog: отнесение к наборам ортологических групп.
cTfam: отнесение к Tigr Fams.
dSeed: отнесение к подсистемам Seed/MG-RAST.
Пример 2. Конструирование метагеномной библиотеки фосмид наддесневого зубного налета
Применяя образцы интактной ДНК, экстрагированной из наддесневого зубного налета включенных в исследование здоровых волонтеров, образцы, которые не были применены в способе пиросеквенирования, создавали метагеномную библиотеку фосмид (вставок, которые имеют длину предпочтительно в диапазоне 35-45 kb) зубного налета указанных волонтеров, применяя, в этом случае, набор для формирования библиотеки фосмид (EpiFOS™ Fosmid Library Production Kit) (компания «Epicentre Biotechnologies»), согласно инструкциям, которые предоставил производитель. Коротко, в предпочтительной альтернативе способа конструирования метагеномной библиотеки изобретения, фосмиды вводят в хозяина, предпочтительно в Escherichia coli. Библиотеку получают, как объяснено выше, с помощью набора для формирования библиотеки фосмид EpiFOS™ («Epicentre»), следуя инструкциям производителя с некоторыми изменениями, такими как увеличение времени лигирования (12 часов на бане при 20°C), применение для вставки общей ДНК, и не ДНК, экстрагированной с помощью гель-электрофореза в пульсирующем электрическом поле, незначительная модификация способа экстракции ДНК, так чтобы последняя разрывалась как можно меньше (применяя обрезанные носики для пипеток, избегая применения вортекса, применяя мембраны «Centricom» (компания «Millipore») для концентрирования ДНК).
Введение ДНК в клетку-хозяина Е. coli проводят, упаковывая фосмиды в частицы фага лямбда, и в дальнейшем инфицируя ими штаммы Epi300T1R Е. coli. Во время упаковки, обеспечивают контакт продукта лигирования с вирусами в течение 3-х часов при 30°C в 1 мл фагового буфера. Инфицирование проводят при 37°C в течение 30-ти минут, приводят вирусные частицы в контакт со штаммом Е. coli. Для того чтобы выбрать оптимальную концентрацию колоний на чашке (настолько удаленных друг от друга, чтобы была возможность посеять одиночную колонию с помощью стерильной палочки), проводят предварительное титрование, выращивая смесь в различных разведениях на LB-агаровой среде с хлорамфениколом.
В дальнейшем, каждую колонию инокулируют в 96-луночный планшет Elisa в жидкую среду LB с хлорамфениколом, в которой они снова смогут вырасти перед хранением. Клоны хранят в 96-луночных планшетах типа Elisa (компания «Nunc») при температуре, равной -80°C в 19%-ном глицерине, для предотвращения образования кристаллов льда и поддержания целостности клеток. Фосмиды замораживают без индукции множественного копирования с целью предотвратить протекание между ними рекомбинации.
Затем различные клоны Е. coli с различными фосмидными вставками высевают в культуры вызывающих кариес бактерий, таких как Streptococcus mutans или Streptococcus sobrinus. Отбирают те клонов, которые, в указанных культурах, демонстрируют зону ингибирования вокруг места посева (фигура 1). Полученные клоны, идентифицируют с помощью гомологии последовательности ДНК, содержащейся в каждой фосмиде, на основе различных общедоступных баз данных о последовательностях. С целью получить последовательность ДНК каждой фосмиды, ее общую ДНК экстрагируют путем отделения ее от ДНК вектора с помощью наборов «Midiprep» компании «QIAGEN», и проводят ее прямое пиросеквенирование. Таким способом получают соответствующие ORF и, в дальнейшем, кодируемые ими пептиды.
Пример 3. Анализ разнообразия метагенома ротовой полости человека
После того как, следуя способу, описанному в настоящем изобретении, получают метагеном наддесневого зубного налета от индивидуумов с кариесом и от здоровых индивидуумов, анализируют разнообразие указанного метагенома ротовой полости с помощью трех различных методик:
Определение таксономической принадлежности с помощью анализа 16S рРНК: последовательности 16S рРНК экстрагировали из прочтений, полученных от каждого метагенома путем поиска подобия с помощью программы «BLASTN» (26) в базе данных RDP (Проект по рибосомальным базам данных). Последовательности размером меньше, чем 200 п.о., отбрасывали. Определение филогенетической принадлежности последовательностей проводили с помощью пакета программ «RDP Classifier» (27), с порогом достоверности, равным 80%.
Определение таксономической принадлежности генов: определение таксономической принадлежности всех ORF проводили на основе алгоритма наименьшего общего предка (LCA), с помощью характеристики, описанной в программе MEGAN (28). С целью получения LCA для каждой последовательности, поиски гомологии проводили с помощью базы данных BLASTx против другой специально разработанной базы данных, которая включала неэукариотические последовательности из неизбыточной базы данных NCBI (NR). Для каждого прочтения последовательности, рассматривали только те результаты, которые при получении LCA показали совпадение по меньшей мере на 90%.
Определение таксономической принадлежности прочтений (PhyMM): указанное определение таксономической принадлежности проводят с помощью программы «PhymmBL» (29), которая сочетает в себе определение принадлежности последовательности, как по гомологии, так и по композиции нуклеотидов; в связи с этим, применяют скрытые Марковские модели. Все доступные полные геномы получали из базы данных по Микробному полости рта человека (HOMD) (30), а также по базе данных NCBI (RefSeq), которые содержат все геномы бактерий и архебактерий (на март 2010), и которые применяют для создания локальной базы данных, разрабатываемой для создания моделей таксономических построений и поиска гомологии с помощью программы «PhymmBL». В этом анализе, для предсказания таксономической идентификация мы применяли только те последовательности, которые имели размер более чем 200 п.о. Применяя прочтения указанной длины, класс точности поиска с PhymmBL оценивали на уровне более чем 75%. Все таксономические и функциональные результаты анализировали в базе данных MySQL для их последующего анализа.
Результаты, полученные с помощью этих трех способов, показали, что небольшого числа генов 16S в метагеномах, полученных путем прямого секвенирования, достаточно для описания основных таксономические групп, присутствующих в метагеноме ротовой полости, без системных ошибок, возникающих при применении методики клонирования или ПЦР.
Среди проанализированных образцов можно обнаружить интересные различия между здоровыми и больными индивидуумами. Тенденция, продемонстрированная тремя способами, показывает, что у здоровых индивидуумов наиболее распространены таксономические группы Bacilli и гамма-протеобактерии, тогда как типично анаэробные таксоны, такие как Clostridials и Bacteroidets, чаще встречаются в образцах из больных субъектов. Прочтения, отнесенные к бета-протеобактериям (в первую очередь, к Neisserials) и филуму ТМ7 (до настоящего времени пока еще не имеющему определенного названия и без какого-либо члена, выращенного в культуре), присутствовали в очень низкой пропорции в образцах из больных индивидуумов и, следовательно, могут быть связаны со здоровыми условиями.
Анализ на соответствие между метагеномами, основанный на определении таксономической принадлежности прочтений 16S рРНК, показал, что образцы от индивидуумов с плохим состоянием ротовой полости имеют тенденцию группироваться вместе, в то время как у здоровых индивидуумов могут быть обнаружены разнообразные бактериальные консорциумы. С помощью настоящего исследования метагеномов, изобретение продемонстрировало, что роды Streptococcus и Rothia, более предпочтительно род Streptococcus, представляют собой преобладающие роды у субъектов без кариеса. В связи с этим, когда мы отбирали, из образцов наддесневого налета индивидуумов, которые никогда не страдали от кариеса, те бактерии, которые могут обладать противокариесным действием, отбор был направлен на поиск (культуральная среда, параметры культивирования, микроскопическая морфология бактерий, морфология колоний и т.п.) видов, принадлежащих к указанным родам, Streptococcus и Rothia, более предпочтительно к роду Streptococcus.
Одно из мощных приложений подходов LCA и PhymmBL заключается в том, что для большинства прочтений таксономическое происхождение и, кроме того, вероятная функциональная значимость могут быть предсказаны со значительными совпадениями. После установления взаимосвязи между таксономией и функцией, появляется возможность предсказать, которую экологическую или метаболическую роль может играть каждая бактериальная группа. С помощью COG (Кластеры ортологичных групп) функциональных систем классификации, можно видеть, что категории распределены неравномерно, и что определенные бактериальные группы особенно подходят для выполнения определенных функций. Например, значительная часть генов, вовлеченных в механизмы защиты (например, рестрикционные эндонуклеазы и насосы для высвобождения лекарственных средств) кодируются Bacilli, что, совместно со значительным присутствием Streptococci у людей без кариеса, позволило нам предсказать, что эти бактерии могут быть потенциальными производителями природных ингибиторов патогенных организмов человека в возможной стратегии заместительной терапии для лечения инфекционных заболеваний ротовой полости.
Пример 4. Анализ многообразия и численности микроорганизмов, присутствующих в метагеноме ротовой полости человека
Исходные исследования, основанные на традиционной методике культивирования и пионерских молекулярно-биологических работах, включая амплификацию и клонирование гена 16S рРНК, предсказали разнообразие в ротовой полости, равное примерно 500 различным видам (6). Оценки с применение технологий последнего поколения (Next Generation Sequencing, NGS) дают величину от 4000 до 19000 операционных таксономических единиц (OTU). OTU представляют собой оценки числа видов на основании анализа последовательностей ДНК, в котором принимают во внимание тот факт, что последовательности гена 16S рРНК со сходством ниже заданного порога принадлежат к разным видам. Примененный порог, 97% идентичности в последовательности, представляет собой стандарт для гена 16S рРНК; следовательно, если сходство было более чем 97%, принято считать, что это одни и те же виды, но, если оно ниже чем 97%, то вероятно, что это разные виды. Более длинные прочтения (250 pbs), полученные способом пиросеквенирования у трех здоровых субъектов, были оценены как примерно 600 OTU на персону, и в недавнем проекте путем секвенирования по Сэнгеру попытались секвенировать 11447 ампликонов практически по всей длине 16S рРНК ампликонов (22), снизив оценки до менее чем 300 OTU у 10 индивидуумов.
Хотя наши оценки разнообразия микроорганизмов ближе к тем, в которых прочтения были получены с помощью секвенирования по Сэнгеру (6,22), в прочтениях 16S рРНК, извлеченные из данных по нашему метагеному, идентифицировали 186 новых OTU, которые не были обнаружены ранее с помощью ПЦР-амплификации. Кривые разрежения (насыщение в числе видов при увеличении стресса при отборе) и различные индексы разнообразия, как описано в таблице 1 (в особенности, индексы разнообразия Симпсона, Шеннона и rao), основанные на 4254 прочтениях рРНК, указывают на оценку в 73-120 видов для образцов зубного налета (таблицы 1 и 2). Ясного различия в отношении разнообразия между образцами волонтеров с различным состоянием здоровья не наблюдали, хотя в двух образцах с кариозными поражениями наблюдали тенденцию к снижению разнообразия.
Создание набора последовательностей представляет собой эффективный инструмент для количественного определения присутствия выбранных видов в метагеномах. Эти индивидуальные метагеномные прочтения с совпадениями, превышающими определенный порог идентичности по сравнению с эталонным бактериальным геномом, «набирают» для построения графика, который будет варьировать по плотности в зависимости от относительное содержания этого организма в образце. Если полученная средняя идентичность нуклеотидов превышает 94%, то набор, вероятно, был выполнен против прочтений от одних и тех же видов (23).
При сравнении наших метагеномов с 1117 геномами, доступными в настоящее время с помощью алгоритмов «Nucmer» и «Promer v 3.06», нам удалось оценить относительное содержания этих видов в наших образцах. Удивительно, но среди наиболее распространенных бактерий у людей без кариеса, были бактерии, относящиеся к Aggregatibacter и Streptococcus sanguis, что согласуется с более высокой частотой ПЦР-амплификации этих видов в ротовой полости здоровых индивидуумов. Род Neisseria также часто встречался в образцах от здоровых индивидуумов. Кроме того, графы рекрутинга указывают на то, что небольшое число таксонов в норме доминируют в каждом метагеноме, что свидетельствует о том, что хотя существует значительное бактериальное разнообразие в ротовой полости, всего несколько таксонов составляют большинство бактериальных клеток.
Пример 5. Функциональное разнообразие в экосистеме ротовой полости
С целью проанализировать функциональное разнообразие организмов, представляющих собой часть экосистемы ротовой полости индивидуумов, проанализированных в настоящем изобретении, все полученные прочтения метагеномной последовательности сравнивали с разными базами данных: базой данных консервативных доменов (CDD) (24), основанной на подсистемах системы аннотации (SEED) и профилях TigrFams (25).
Анализ соответствий (СоА) образцов на основе функциональной значимости прочтений обеспечивает одинаковые типы объединения в группы для трех функциональных систем классификации (CDD, SEED и TigrFams). Образцы от больных субъектов (с кариесом) имели тенденцию группироваться вместе, указывая на то, что похожая группа функций кодируется в их метагеномах, а образцы от индивидуумов, которые никогда не страдали от кариеса, вместе с индивидуумами, у которых его число было мало, группировались отдельно. При сравнении функциональной значимости метагеномов ротовой полости в отношении микробиома кишечника взрослых персон (8), образцы из ротовой полости группируются вместе, указывая на то, что кишечник и ротовая полость представляют собой две различные экосистемы в терминах относительной частоты кодируемых функций. Настоящее изобретение продемонстрировало, что существуют блоки функций, которые избыточно представлены в кишечном микробиоме, в то же время другие блоки функций избыточно представлены в образцах из ротовой полости.
В образцах из ротовой полости, индивидуумы были сгруппированы на основании состояния их здоровья. С прикладной точки зрения, интересно отметить, что многие функциональные категории избыточно представлены в образцах от индивидуумов без кариеса. Эти категории включают гены захвата ДНК, вовлеченные в конкуренцию в грамположительных бактериях, другие гены, вовлеченные в метаболизм фосфолипидов, фруктозы и в индуцируемые маннозой фосфотрансферазные системы, в регулон Streptococcus mga, белки, вовлеченные в смешанную ферментацию кислоты, гены, ответственные за дистанционные микроб-микробные взаимодействия (quorum-sensing) и бактериоцин-подобные антибактериальные пептиды. Указанные биологически активные соединения, бактериоцины, представляют собой потенциальные противокариесные средства и, следовательно, настоящее изобретение продемонстрировало, что зубной налет индивидуумов, которые никогда не страдали от кариеса, представляет собой генетический резервуар новых противомикробных и потенциально противокариесных веществ.
Пример 6. Ингибиторный анализ клонов, полученных в фосмидной библиотеке изобретения на кариесогенных культурах Streptococcus
После того как была получена библиотека фосмид наддесневого зубного налета от индивидуумов, которые никогда не страдали от кариеса, различные клоны Е. coli, с различными фосмидными вставками, высевали в культуры вызывающих кариес бактерий, таких как Streptococcus mutans или Streptococcus sobrinus. Реплику фосмидных метагеномный библиотек тех волонтеров, которые никогда не страдали от кариеса, переносили с помощью иглы на указанные чашки, с помощью 96-игольчатого репликатора компании «Nunc», так чтобы каждая чашка Петри могла принять для роста 96 клонов каждой чашки в библиотеке, предварительно стимулированных к множественному копированию с помощью индуктора («Epicentre Technologies»). Применяя этот простой отбор, можно выполнить высокопродуктивный анализ активности тысяч клонов в течение ограниченного времени, отбирая те клоны, которые продуцирует зону ингибирования на вызывающих кариес бактериях (фигура 1).
Последовательности ДНК или вставки этих фосмид, как объяснено в примере 2 настоящего изобретения, это те, которые потенциально продуцируют выделяемые вещества, которые распространяются в агаре и предотвращают рост тех бактерий, которые вызывают кариес зубов. В дальнейшем, проводили второй отбор по активности с положительными клонами для устранения ложноположительных клонов (фигура 1B). Полученные клоны идентифицируют с помощью гомологии последовательностей ДНК, содержащейся в каждой фосмиде, с помощью различных общедоступных баз данных имеющихся последовательностей.
С целью получить последовательность ДНК каждой фосмиды, ее общую ДНК экстрагируют путем отделения ее от ДНК вектора с помощью наборов «Midiprep» компании «QIAGEN», и проводят прямое секвенирование. Концы двадцати фосмид секвенируют с помощью классической методики Сэнгера, применяя обратные праймеры (SEQ ID NO: 10 и SEQ ID NO: 11) и Т7 (SEQ ID NO: 12) коммерческих векторов PCC1Fos. Из двадцати секвенированных фосмид, четыре последовательности показали гомологию с бактериальной ДНК (30%-98%) и пять других последовательностей показали 99%-100% гомологию с ДНК человека. Следовательно, среди концов последовательностей фосмид, которые продемонстрировали способность к ингибированию, четыре были бактериального происхождения и пять других происходили от человека. В двух случаях (один бактериальный и один человеческий), вставка оказалась очень маленькой длины; в связи с этим, последовательность двух концов перекрылась, таким образом, была получена полная длина вставки. Полностью секвенированная с помощью этого способа вставка человеческого происхождения имела 244 нуклеотидов (SEQ ID NO: 1), и бактериальная вставка имела 666 нуклеотидов (SEQ ID NO: 2).
Последовательность других семи вставок получали с помощью пиросеквенирования, применяя группы из 2-5 фосмид, и комбинируя их ДНК в 1/16 или 1/8 чашки пиросеквенатора «Genome Sequencer FLX» (компания «Roche»). Полученные последовательности собирали с помощью программы «Newbler» («Roche»), применяя стандартные параметры, и полученные сборки относили к соответствующим фосмидам на основании предварительно полученных последовательностей конца вставки. Характеристика девяти вставок приведена в таблице 3.
Пример 7. Идентификация противомикробных пептидов в коротких фосмидах S12E и T5A.
После того как были получены последовательности семи фосмид, как описано в примере 6, проанализировали последовательность ДНК двух ДНК-вставок небольшой длины, для получения всех ORF, кодируемых в направлении 3’-5’ и 5’-3’. Из этих ORF, мы отобрали те, которые содержали последовательности связывания рибосом (с 3’-концевой комплементарной последовательностью 16S из Е. coli) и, следовательно, те, которые могут быть эффективно транслированы, и те, которые могут быть выделены, либо благодаря присутствию сигнального пептида (идентифицированного с помощью программы «SIGNAL-IP») или неклассического секреторного пути (идентифицированного с помощью программы «SECRETOME-P»). Применяя указанные способы, в фосмиде человеческого происхождения (T5A) получили ORF-кандидата, имеющего только 26 аминокислот в длину (SEQ ID NO: 8), а другого ORF-кандидата получили в фосмиде бактериального происхождения (S12E), 39 аминокислот в длину (SEQ ID NO: 9). Кроме того, эти гены продемонстрировали композицию аминокислот, характерную для противомикробных пептидов, и, кроме того, в случае T5A человеческого происхождения, обнаружили присутствие двух цистеинов, которые могут образовывать дисульфидный мостик. Все это, вместе с их небольшой длиной и их общим положительным зарядом, позволяет предположить, что они представляют собой биологически активные противомикробные пептиды.
В дальнейшем, указанные пептиды очищали. В связи с этим, их разделяли с остальными секретированными продуктами по их молекулярным массам. Таким образом, 15 мл каждого клона, индуцированного для образования множества копий, культивировали в среде с сердечно-мозговой вытяжкой (BHI), клетки центрифугировали и собирали супернатант, который фильтровали через фильтры «Millipore» с размером пор 0,2 микрон для того, чтобы отделить любой бактериальный остаток. Этот супернатант, содержащий секретированные продукты, фильтровали еще раз через 10-кДа фильтры «Amicon» компании «Millipore», и фильтрат прогоняли через 3-кДа фильтры «Amicon» «Millipore», получая, таким образом, фракцию с молекулярной массой 3-10 кДа в объеме 1 мл. Фракцию меньше чем 3 кДа (0-3 кДа фракция) концентрировали на холоде в центробежном испарителе до объема, равного 1 мл.
В дальнейшем, эти две фракции, 3-10 кДа и 0-3 кДа, соответственно, в объемах 50, 100 и 150 мкл, добавляли к жидкой культуре S. mutans и к жидкой культуре S. sobrinus, и измеряли оптическую плотность в 48-луночном люминометре «Fluostar» каждые полчаса, для каждой обработки в тройном повторе, в течение 12-19-ти часов. Как можно видеть на фигурах 2 и 3, кривые роста вызывающих кариес бактерий показали, что, в случае дефензин-подобного противомикробного пептида человеческого происхождения (фигура 3), фракция меньше 3 кДа показала дозозависимое ингибирование вызывающих кариес бактерий, тогда как, в случае бактериоцин-подобного противомикробного пептида бактериального происхождения, 3-10 кДа фракция показала дозозависимое ингибирование указанных вызывающих кариес бактерий (фигура 2), что согласуется с молекулярными массами, рассчитанными на основе аминокислотной последовательности для каждой фосмиды.
Пример 8. Сравнительный анализ ингибирования роста вызывающих кариес бактерий под действием биологически активных пептидов изобретения
Для сравнения ингибирующего действия бактериоцина с действием других доступных для приобретения конкурентных продуктов, провели эксперименты по росту S. mutans в жидкой среде BHI, аналогичные тем, что были описаны в предыдущем примере, но в этом случае добавляли: а) 100 мкл одного из лидирующих на рынке полосканий для рта (Listerine®, которое представляет собой средство против зубного налета и антисептическое средство для полости рта), b) 100 мкл концентрированного супернатанта (как объяснено в предыдущем примере) клона S12E, содержащего бактериоцин (3-10 кДа фракция), и с) 100 мкл Listerine® + 100 мкл супернатанта клона S12E, содержащего бактериоцин. Ингибирующий эффект бактериоцина в этой концентрации, 100 мкл, на рост S. mutans превышал эффект продукта, запущенного в коммерческое производство для этих бактериальных видов (фигура 4) и, кроме того, на указанной фигуре 4 можно видеть, что добавление бактериоцина к коммерческому продукту значительно улучшает ингибирование S. mutans указанным продуктом.
Пример 9. Анализ кариесогенной активности синтезированных химическим способом пептидов S12E и T5A.
Химический синтез 2-х выделенных ингибиторных пептидов (SEQ ID NO: 8 и 9) проводили в соответствии со способом твердофазного синтеза (32 и 33). Синтез пептидов с помощью SPPS (твердофазный синтез пептидов) представляет собой наиболее распространенный способ, применяемый для синтетического создания пептидов и белков в лаборатории, и позволяет синтезировать природные пептиды, которые трудно экспрессировать в бактериях, включать не встречающиеся в природе аминокислоты или модификации в пептиде (например, образование дисульфидных связей).
В случае пептида человеческого происхождения для защиты -SH групп, которые достаточно реактивны и относительно часто встречаются в этом пептиде, применяют защитную группу, Fmoc-Cys(trt)-OH. Пептиды ковалентно присоединяют к сферам, оставляя N-концевую аминогруппу свободной, так чтобы она могла связаться с единственной N-защищенной аминокислотой. После связывания, защиту с последней снимают и отмывают. После повторных циклов связывания, отмывания, снятия защиты и отмывания, конструируют пептидные цепи. После того как пептид полностью закончен, его высвобождают добавлением химического реагента (в данном случае, безводный фтористый водород). Контроль качества, разработанный для подтверждения того, что синтезированный пептид представляет собой правильный пептид и не содержит примеси, проводили с помощью масс-спектрометрии и HPLC.
Для того чтобы подтвердить, что идентифицированные пептиды представляют собой пептиды, ответственные за ингибирование вызывающих кариес бактерий, S12E (бактериоцины бактериального происхождения) и T5A (пептид человеческого происхождения со структурой аналогичной структуре дефензинов) пептиды были получены с помощью химического синтеза, выход составил приблизительно по 4 мг каждого из указанных пептидов с чистотой более чем 80%. Они были полностью ресуспендированы в 0,1%-ной трихлоруксусной кислоте (ТСА), и с ними проводили эксперименты, разработанные для тестирования ингибирования жидких культур S. mutans указанными полученными с помощью химического синтеза соединениями.
В случае бактериоцин-подобного пептида S12E, бактериального происхождения, было подтверждено то, что он ингибирует культуры S. mutans, в особенности, в высоких концентрациях (фигура 5). В дальнейшем, провели дополнительный химический синтез пептида S12E, на этот раз с чистотой более чем 95%, и указанный пептид ресуспендировали в воде высшей степени очистки, для того чтобы продемонстрировать, что ранее полученное ингибирование не было связано с TCA, а было обусловлено самим полученным с помощью химического синтеза пептидом S12E. Еще раз, наблюдали, что обработка культур S. mutans и S. sobrinus химически синтезированным S12E пептидом с высокой чистотой продуцирует дозозависимое ингибирование обеих вызывающих кариес бактерий, S. mutans (фигура 6A) и S. sobrinus (фигура 6B).
В случае пептида T5A (человеческого происхождения, дефензин-подобные), исходно не было обнаружено ингибирующего эффекта. Оказалось, что этот пептид имеет несколько реакционно-способных аминокислот, включая два цистеина, присутствие которых типично для человеческих противомикробных пептидов, и часто дисульфидный мостик между этими двумя цистеинами необходим для того, чтобы пептид был активен. В связи с этим, указанный пептид синтезировали снова, добавляя дисульфидный мостик между цистеинами 3 и 12, и защищая реакционно-способные аминокислоты во время синтеза. Следуя этим модификациям, было подтверждено, что этот пептид способен ингибировать рост вызывающих кариес бактерий, S. mutans, в различных концентрациях, с полным ингибированием роста, если пептид добавляют в максимальной концентрации 80 мкг (фигура 7).
Пример 10. Идентификация ингибиторных генов в длинных фосмидах.
В отношении остальных потенциальных противомикробных соединений, ДНК выделяли из фосмиды, которая продуцирует зону ингибирования, и секвенировали их концы и полную вставку (Таблица 3). Это делает возможным получение каталога бактерий, которые продуцируют противомикробные соединения (не только антибактериальные пептиды), а также участки в геноме человека, которые их кодируют. Эксперименты по ингибированию проводили на жидких культурах S. mutans, добавляя концентрированный супернатант (как указано в предыдущих примерах), продуцированный соответствующими клонами, в виде фракций 0-3 кДа, 3-10 кДа, 10-100 кДа и >100 кДа. Эти эксперименты показали, что фракции, которые вызывают ингибирование, представляют собой 0-3 кДа фракцию в бактериальных фосмидах T9B и T4H и в фосмидах человека W4D (фигура 8), T5H (фигура 9), A5D11 (фигура 10) и A4H11 (фигура 11), и 3-10 кДа фракцию в бактериальной фосмиде T1F. Следовательно, эти результаты снова показали, что ингибирование продуцируют пептиды небольшого размера, т.е. пептиды размером 0-3 кДа или 3-10 кДа, что согласуется с тем фактом, что они представляют собой антибактериальные бактериоцин-подобные пептиды или дефензины/кателицидины человека.
Подобным образом, поиск ORF, кодирующих пептиды с такими размерами (т.е., 0-3 кДа или 3-10 кДа, в зависимости от конкретной ситуации) проводили на последовательностях указанных фосмид, и в качестве возможных кандидатов на роль генов, кодирующих ингибитор, отбирали следующие гены: гены со связывающей рибосому последовательностью, гены, у которых имеются сигнальные пептиды и в которых используются аминокислоты, аналогичные аминокислотами антибактериальных пептидов, и/или гены с последовательностью, аналогичной последовательности других известных антибактериальных пептидов, и/или гены, кодирующие гидрофобные пептиды и/или пептиды с общим положительным зарядом.
Пример 11. Идентификация противокариесных бактерий.
Поскольку во взрослой человеческой популяции есть небольшая доля людей, которые никогда не страдали от кариеса, то это привело к предположению о существовании бактериальных видов с потенциально антагонистическим эффектом в отношении вызывающих кариес бактерий (23). Бактериальное замещение патогенных штаммов безвредными изолятами, полученными у здоровых индивидуумов, было удовлетворительно доказано в исследовании по предотвращению глоточных инфекций, и послужило основой для пробиотиков, разработанных для предотвращения инфекционных заболевания в кишечнике и в других экосистемах организма человека (31). Сравнение метагеномных наборов последовательностей вызывающих кариес бактерий с микробиомой ротовой полости здоровых субъектов, показало полное отсутствие S. mutans и S sobrinus. Удивительно, но параллельно с отсутствием вызывающих кариес бактерий был обнаружен интенсивный набор последовательностей других видов Streptococcus (в первую очередь, тех, которые похожи на S. sanguis), Aggregatibacter и Neisseria, которые представляли собой наиболее обильно представленные роды у этих индивидуумов.
Учитывая возможность того, что изоляты этих преобладающих видов могут быть вовлечены в антагонистические взаимодействия с вызывающими кариес бактериями, у 10-ти здоровых индивидуумов (включая 2-х здоровых индивидуумов, от которых получали метагеномные последовательности) брали свежие образцы бактериального зубного налета, которые применяли для культивирования видов Neisseria, Rothia и Streptococcus в оптимальных условиях роста (в частности, на кровяном агаре, шоколадном агаре, агаре для культивирования бруцелл и культуральной среде TSA, в аэробных условиях и в анаэростатах). После микроскопического исследования, отбирали диплококки и стрептококки (для того чтобы иметь максимальную возможность обнаружить виды Streptococcus, Rothia и Neisseria), и получали набор из 249 изолятов.
Тех бактерий, которые были способны расти в той же среде, что и S. mutans и S. sobrinus, переносили в посеянные газоном культуры в присутствии указанных вызывающих кариес бактерий. С помощью такого простого отбора идентифицировали 16 штаммов с зонами ингибирования роста (фигуры 12 и 13). С помощью методики ПЦР и секвенирования 16S рРНК большинство из указанных штаммов были идентифицированы как принадлежащие к видам Streptococcus, они продемонстрировали 96%-99% идентичность последовательности с видами S. oralis, S. mitis и S. sanguis или с другими родственными видам, и также с видами Rothia, с 100% идентичностью последовательности в гене 16S с видом R. mucilaginosa. Штаммы, которые продемонстрировали зоны ингибирования в отношении S. mutans и/или S. sobrinus, депонировали в СЕСТ, с присвоением регистрационных номеров СЕСТ 7746, СЕСТ 7747, СЕСТ 7773, СЕСТ 7774 и СЕСТ 7775. Как уже обсуждалось предварительно, штаммы СЕСТ 7746, СЕСТ 7747, СЕСТ 7773 и СЕСТ 7775 принадлежат к одному и тому же роду бактерий Streptococcus и, следовательно, в дополнение к их способу получения, характеризуются структурным и таксономическим сходством, поскольку они принадлежат к одному и тому же роду бактерий.
В особенности, на основе последовательности 16S рибосомального гена, указанные штаммы, принадлежащие к бактериальныму роду Streptococcus, похожи на виды S. mitis (СЕСТ 7746 и СЕСТ 7775) и S. oralis (CECT 7747 и СЕСТ 7779). Секвенирование полного генома штаммов СЕСТ 7746 и 7747 показало, что они представляют собой новые виды рода Streptococcus (смотри пример 12), что они представляют собой сестринские штаммы, несмотря на то, что они происходят от различные индивидуумов, и, кроме того, принадлежат к кластеру видов S. mitis/oralis/infantis. Другой бактериальный штамм, депонированный в СЕСТ, с номером СЕСТ 7774, принадлежит к роду Rothia и, в частности, к виду R. mucilaginosa. Зоны ингибирования роста в культурах вызывающих кариес видов, S. mutans или S. sobrinus, возникшие под действием указанных штаммов, депонированных в СЕСТ, можно видеть на фигурах 12 и 13, соответственно.
Пример 12. Характеристика бактериальных штаммов СЕСТ 7746 и СЕСТ 7747.
Характеристику бактериальных штаммов СЕСТ 7746 и СЕСТ 7747 проводили с помощью различных методик. В первую очередь, получали полный геном этих двух штаммов методом пиросеквенирования случайной выборки (shot-gun) (7, 8) и пиросеквенирования пары концов; последний заключается в нарезании ДНК на фрагменты, длиной примерно в 3000 нуклеотидов, и секвенирования приблизительно 200 нуклеотидов с каждого конца, так чтобы известное расстояние между этими двумя концами помогало при сборке последовательностей.
С целью получить полный геном каждого из штаммов СЕСТ 7746 и СЕСТ 7747, мы начали с образцов, собранных из каждой из культур указанных штаммов; в частности, для экспериментов по пиросеквенированию посредством системы случайной выборки (7, 8), выполненных на пиросеквенаторе «GS-FLX» от компании «Roche» (Titanium Chemistry), применяли разделенную на четыре части культуральную чашку, и другую разделенную на четыре части культуральную чашку применяли для экспериментов по пиросеквенированию с помощью системы с парой концов. Количество последовательностей, полученное для каждого из штаммов с помощью каждой из систем, приведено далее:
Штамм 7746
Случайная выборка: 441549 прочтений, с общим числом в 165105921 нуклеотидов
Пара концов: 187530 прочтений, с общим числом в 32721622 нуклеотидов
Штамм 7747
Случайная выборка: 28021 прочтений, с общим числом в 5711998 нуклеотидов
Пара концов: 305826 прочтений, с общим числом в 51501510 нуклеотидов
Ожидаемый размер генома каждого штамма равен примерно 2,1 млн п.о. Для штамма СЕСТ 7746, размер контигов более чем 500 п.о. равен 2122087 п.о. В случае штамма СЕСТ 7747, размер контигов более чем 500 п.о. равен 1953989 п.о.
Последовательности фильтровали и собирали с помощью программы «Newbler» («Roche»), адаптированной авторами изобретения со стандартными параметрами, для получения в общей сложности 109 контигов >500 п.о. для штамма СЕСТ 7746 и 51 контиг для штамма СЕСТ 7747. В дальнейшем, указанные геномы автоматически аннотируют и получают полную последовательность генома указанных штаммов СЕСТ 7746 и СЕСТ 7747.
После получения полного генома штаммов СЕСТ 7746 и СЕСТ 7747 определяли таксономическую принадлежность указанных изолятов по филогенетическим деревьям, полученным на основе полной последовательности генов 16S и 23 S рРНК, которые наиболее широко применяют при получении бактериальных филогенетических деревьев.
Связав вместе последовательности генов 16S и 23S рРНК, получали единственный фрагмент, размером в более 4000 нуклеотидов, который выравнивали с таким же фрагментом видов Streptococci, секвенированных к настоящему времени. Последовательности выравнивали с помощью общедоступной компьютерной программы «MAFFT», выравнивая отдельно гены 16S и 23S, и в дальнейшем связывая выравнивания вместе. После этого, выравнивание очищали с помощью общедоступной компьютерной программы «GBlocks» для того, чтобы отобрать консервативные информативные положения. Дерево получали с помощью программы «RAxML», способ максимального правдоподобия с 500 повторами. Полученное филогенетическое дерево показало, что оба штамма представляют собой сестринские штаммы, несмотря на то, что происходят от разных индивидуумов и, кроме того, принадлежат к кластеру видов S. mitis/oralis/infantis, и на основании топологии дерева предположили, что они представляют собой штаммы, которые принадлежат к новым, неописанным видам.
С целью установить, принадлежат ли указанные штаммы к различным видам, применяли ANI (средняя идентичность нуклеотидов). При сравнении геномов секвенированных штаммов, средняя величина сходства между гомологичными генами одних и тех же видов на уровне нуклеотидов составляет более чем 95% (34, 35). Фактически, систематик принимает величину ANI, равную 95%, в качестве ограничения для разделения бактериальных изолятов, принадлежащих к различным видам, и в качестве альтернативы классическому 70%-ному порогу для величины гибридизации ДНК-ДНК (36). С помощью общедоступной компьютерной программы J-типа для определения величин ANI между двумя секвенированными штаммами изобретения, СЕСТ 7746 и СЕСТ 7747, и оставшейся части секвенированных Streptococci, было показано, что они представляют собой два штамма, принадлежащие к новым видам, которые еще не были описаны. В случае бактериального штамма изобретения СЕСТ 7746, не существует штамма со сходством, превышающим 95%-ный порог, и в случае бактериального штамма изобретения СЕСТ 7747, только другой штамм из этих секвенированных. Streptococcus Ml 43, превышает указанный порог. Указанный штамм Ml 43 представляет собой штамм, который несмотря на то, что для его генома была получена лишь предварительная последовательность, не был таксономически описан как вид. Результаты, примененные для расчетов ANI, получали с помощью двух различные методик: «Mummer» и «Blast» (36), и обе методики показали практически идентичные результаты.
Пример 13. Анализ ингибирования супернатантами, полученными от культур раскрытых в изобретении штаммов СЕСТ 7746 и СЕСТ 7747, роста вызывающих кариес бактерий S. mutans.
Два штамма изобретения, СЕСТ 7746 и 7747, растили в культуральной среде BHI при температуре 37°C. В дальнейшем, супернатанты культур собирали на экспоненциальной фазе и в стационарной фазе роста, отфильтровывали через фильтр с размером пор, равным 0,2 микрон, для того чтобы отделить любой бактериальный остаток. В дальнейшем, указанные супернатанты снова фильтровали с помощью центрифугирования, применяя мембраны с размером пор 100, 10 и 3 кДа («Amicon», «Millipore»), как описано в предыдущих примерах, приведенных в настоящем изобретении.
Фракцию супернатантов, полученных от каждого из штаммов СЕСТ 7746 и 774, собранных на стационарной фазе роста, и продуцирующих ингибирование роста бактериальных культур S. mutans, концентрируют так, чтобы получить фракцию меньше 3 кДа для обоих тестируемых штаммов, СЕСТ 7746 (фигура 14A) и СЕСТ 7747 (фигура 14B). На основании указанных результатов заключили, что ингибирующее вещество, синтезируемое указанными штаммами, демонстрирующими специфический бактерицидный эффект в отношении вызывающих кариес видов, должно быть небольшого размера, предпочтительно <3 кДа, как в случае бактериоцинов.
Напротив, если аналогичные эксперименты проводили с образцами супернатантов культур штаммов изобретения СЕСТ 7746 и 7747, собранными на экспоненциальной фазе роста, то не наблюдали ингибирование роста бактериальных культурах S. mutans (фигура 15), следовательно, ингибирующий агент продуцируется только на стационарной фазе роста бактериальных рост штаммов изобретения.
Если образцы концентрированного супернатанта, который был получен на стационарной фазе роста и был меньше чем 3 кДа, подвергали температурной обработке при 100°C в течение 10-ти минут, то было подтверждено, что ингибирующее действие указанного супернатанта на культуры S. mutans сохраняется и даже усиливается (фигура 16). Эти результаты согласуется с тем фактом, что ингибирующий агент представляет собой бактериоцин, а не другой тип пептида, поскольку бактериоцины небольшого размера исключительно термостабильны и даже увеличивают свой противомикробный эффект, поскольку они лучше растворимы среде, после того как их агрегаты диссоциируют под действием теплового шока.
В дальнейшем, ингибиторный анализ в отношении культур S. mutans проводили с супернатантами, полученными от культур бактериальных штаммов изобретения СЕСТ 7746 и СЕСТ 7747, но изменив порядок посева и температуру рост культур указанных вызывающих кариес бактерий, для того чтобы проверить, оказывают ли указанные модификации какой-либо эффект на ингибирующее действие супернатантов штаммов изобретения.
В первую очередь, на культуральные чашки высевали вызывающие кариес бактерии S. mutans и через 24 часа, на те же культуральные чашки высевали штаммы изобретения. По прошествии некоторого времени, зоны ингибирования не наблюдали. Напротив, если культуральные чашки засевали одновременно обоими штаммами, наблюдали ингибирование роста S. mutans, такое как мы показывали ранее. Наибольшее ингибирование роста культурах S. mutans наблюдали, если сначала высевали штаммы изобретения, СЕСТ 7746 и 7747, а, 24 часа спустя, высевали штаммы & mutans, что указывало на то, что существовала более высокая концентрация ингибирующего агента или вещества перед ростом вызывающих кариес бактерий, и что, кроме того, присутствие указанных бактерии не обязательно для активации продукции ингибирующего агента штаммами изобретения.
В дальнейшем, эксперименты по ингибированию в отношении роста вызывающих кариес бактерий проводили на твердой среде, исходно высевая штаммы изобретения с каплей культуры в жидкой среде на стационарной фазе роста, затем переносили реплику культуры S. mutans при различных температурах: 30°C, 33°C и 36°C. Не наблюдали ингибирование роста S. mutans при температуре, равной 30°C, но при 33°C наблюдали ингибирование, которое фактически было больше, чем ингибирование, полученное при 36°C.
Пример 14. Анализ ингибирования супернатантами, полученными от культур бактериальных штаммов изобретения СЕСТ 7746 и СЕСТ 7747, роста вызывающих кариес бактерии, S. mutans, культивируемых в аэробных и анаэробных условиях.
С целью установить, модифицирует ли аэробное или анаэробное окружение ингибирование штаммами изобретения роста вызывающих кариес бактерий, проводили эксперименты по ингибированию в твердой среде BHI, исходно высевая штаммы изобретения с каплей культуры в жидкой среде на стационарной фазе роста, в анаэростатах в течение 12-ти часов, а затем переносили реплику культуру S. mutans при 37°C, или затем высевая с одной каплей культуры S. mutans при 37°C.
Результаты обоих экспериментов показали, что ингибирование роста S. mutans значительно ниже в анаэробных условиях, в особенности для штамма СЕСТ 7746 (фигура 17). Следовательно, результаты показали, что для штаммов изобретения ингибирование роста вызывающих кариес бактерий более эффективно во время аэробной стадии формирования зубного налета, т.е. на протяжении периода прикрепления и исходного формирования биопленки на зубе.
Пример 15. Противокариесный эффект бактериальных штаммов СЕСТ 7746 и СЕСТ 7747 и их супернатантов на биопленку в модели искусственного зуба.
Для того чтобы продемонстрировать Противокариесный эффект бактериальных штаммов, раскрытых в настоящем изобретении, провели анализы по ингибированию образования кислоты штаммами СЕСТ 7746 и СЕСТ 7747 на биопленке в модели искусственного зуба. Указанные эксперименты провели на модели Активного прикрепления биопленки Академического центра стоматологии, Амстердам (АСТА, Амстердам). Указанная модель биопленки описана в работе Exterkate RA et al. (37). Коротко, на диски, сделанные из гидроксиапатита или стекла, инокулируют человеческую слюну, полученную от волонтера с высоким процентным содержанием S. mutans (более чем 4%), с пробиотическим штаммом или его супернатантом или без них. В настоящих исследованиях тестировали штаммы СЕСТ 7746 и 7747, раскрытые в настоящем изобретении, а также штамм C7.1, изолят, принадлежащий к видам группы Streptococcus mitis/oralis/infantis, полученный от индивидуума без кариеса, но который не продуцирует ингибирование роста вызывающих кариес видов и, следовательно, действует как негативный контроль.
Человеческую слюну хранили при -80°C. Пробиотические штаммы СЕСТ 7746 и 7747 и контрольный штамм C7.1 растили в культуральной среде BHI с сахарозой в течение 12-ти часов, пока плотность культуры не становилась равной приблизительно 4×108 cfu (колониеобразующие единицы). В дальнейшем, образец слюны смешивали в 50%-ном соотношении с инокулятом пробиотических штаммов изобретения (СЕСТ 7746 или 7747) или с инокулятом контрольного штамма (C7.1), и наносили на стеклянный диск.
Биопленки формировались в течение 48-ми часов в модифицированной искусственной среде со слюной (38) в аэробных и анаэробных условиях, а после формирования их инкубировали в течение 3-х часов при температуре, равной 37°C в цистеин-пептонной воде (компания «Sigma-Aldrich», St Louis, США) содержащей 0,2% глюкозы, для того чтобы измерять образование кислоты. На протяжении этого инкубационного периода, штаммы продуцируют кислоту, которую измеряют с помощью колориметрической реакции: указанную биопленку переносили в пробирку Eppendorf и инкубируют при температуре, равной 80°C в течение 5 мин, для того чтобы остановить бактериальный метаболизм. Количество L-молочной кислоты определяли энзиматически с помощью колориметрического анализа на спектрофотометре «Spectra Max M2» (компании «Molecular Devices», США), следуя протоколу, описанному в работе Pham LC et al. (38).
С целью проанализировать ингибирование супернатантами штаммов изобретения (СЕСТ 7746 и 7747), а также контрольным штаммом (С7.1), образования кислоты, в первую очередь, получали супернатанты культур указанных бактериальных штаммов. В связи с этим, культуры указанных штаммов растили в среде BHI в течение 12-ти часов. В дальнейшем, бактериальные клетки удаляли центрифугированием и последующим фильтрованием через фильтр с порами размером 0,2 микрона. Среду фильтровали через ультрамембраны «Amicon», пропускающие соединения, размером 100, 10 и 3 кДа (компания «Millipore»). Фракцию меньше 3 кДа концентрировали до половины ее объема в роторном испарителе и спешивали в 50%-ном соотношении с образцом слюны; в дальнейшем, как в случае пробиотиков, биопленка формировалась в течение 48-ми часов и ее инкубировали в течение 3-х часов в культуральной среде, содержащей буфер и пептонную воду (38), а также 0,2% глюкозы, так чтобы была возможность измерять образование кислоты.
Каждую обработку проводили в четырех повторах в аэробных и анаэробных условиях. Проанализированные экспериментальные группы представлены далее:
1. Биопленки, образованные с инокулятом слюны.
2. Биопленки, образованные с инокулятом слюны + СЕСТ 7746.
3. Биопленки, образованные штаммом СЕСТ 7746.
4. Биопленки, образованные с инокулятом слюны + СЕСТ 7747.
5. Биопленки, образованные штаммом СЕСТ 7747.
6. Биопленки, образованные с инокулятом слюны + неингибирующий штамм Streptococcus (штамм C7.1).
7. Биопленки, образованные с инокулятом слюны + супернатант штамма СЕСТ 7746, содержащий активное ингибирующее вещество.
8. Биопленки, образованные с инокулятом слюны + супернатант штамма СЕСТ 7747, содержащий активное ингибирующее вещество.
9. Биопленки, образованные с инокулятом слюны + супернатант неингибирующего штамма (штамм C7.1).
10. Биопленки, образованные с неингибирующим штаммом Streptococcus (штамм C7.1).
Результаты, показанные на фигуре 18, указывают на то, что моноспецифическая биопленка, сформированная исключительно штаммами СЕСТ 7746 (экспериментальная группа 3) или СЕСТ 7747 (экспериментальная группа 5) продуцирует кислоту в таком количестве, которое значительно ниже, чем количество кислоты в слюне (экспериментальная группа 1). Если принять слюну человек в качестве величины для сравнения (экспериментальная группа 1), то видно, что супернатанты штамма СЕСТ 7747 (экспериментальная группа 8) значительно снижают образование кислоты, как в аэробных, так и в анаэробных условиях, тогда как супернатант штамма СЕСТ 7746 (экспериментальная группа 7) снижает количество кислоты, продуцируемой биопленкой, только в анаэробных условиях. Добавление штамма СЕСТ 7747 к биопленке снижает образование кислоты и при аэробиозе, и при анаэробиозе, тогда как добавление штамма СЕСТ 7746 к биопленке вызывает снижение только в аэробных условиях.
Снижение образования кислоты, в особенности, в случае штамма СЕСТ 7747 и его супернатантов, очень актуально для лечения и предотвращения кариеса зубов, поскольку последний возникает в результате образования кислоты при ферментации микроорганизмами Сахаров, потребляемых с пищей. Именно кислый рН вызывает деминерализацию эмали и образование кариеса, и, следовательно, любые кислотообразующие виды, а не только Streptococci из группы mutans, могут быть потенциально кариесогенными (2). Следовательно, снижение образования кислоты представляет собой индикатор того, что общий эффект лечения пробиотическим штаммом или его супернатантом заключается в снижении кислоты и, следовательно, снижает вероятность развития кариеса.
Литература
1. Р.D. Marsh, Dental Clinics of North America 54, 441 (2010).
2. P. Marsh, BMC Oral Health 6, S 14 (2006).
3. P.E. Petersen, Zhonghua Kou Qiang Yi Xue Za Zhi 39, 441 (Nov. 2004).
4. S.S. Socransky, A.D. et al. J Clin Periodontol 25, 134 (Feb, 1998).
5. R.P. Darveau, Nat Rev Microbiol 8, 481 (Jun 1, 2010).
6. В.J. Paster et al., J Bacteriol 183, 3770 (Jun, 2001).
7. S.R. Gill et al., Science 312, 1355 (Jun 2, 2006).
8. K. Kurokawa et al., DNA Res 14, 169 (Aug 31, 2007).
9. P.A. Vaishampayan et al., Genome Biol Evol 2010, 53 (2010).
10. J. Qin et al., Nature 464, 59 (Mar 4, 2010).
11. J.A. Aas et al., J Clin Microbiol 43, 5721 (Nov, 2005).
12. E.A. Grice et al., Genome Res 18, 1043 (Jul, 2008).
13. W.J. Loesche, Microbiol Rev 50, 353 (Dec, 1986).
14. M.W. Russell et al., Caries Res 38, 230 (May-Jun, 2004).
15. WO 2007/077210 «Probiotic oral health promoting product».
16. WO 2005/018342 «Compositions and methods for the maintenance of oral health».
17. EP 0195672 «Dental caries preventive preparations and methods for preparing said preparations».
18. WO 2004/072093 «Antimicrobial agents».
19. Margulies M et al., Nature 15; 437 (7057) (2005).
20. Gomez-Alvarez V et al., ISME J. 3 (11) (Nov 2009).
21. Zheng Zhang et al., J Comput Biol. 7 (1-2) (2000).
22. E.M. Bik et al., Isme J (Mar 25, 2010).
23. K.Т. Konstantinidis et al., Proc Natl Acad Sci USA 102, 2567 (Feb 15, 2005).
24. Marchler-Bauer A et al., Nucleic Acids Res. 37: D205-10 (Jan 2009).
25. Selengut JD et al., Nucleic Acids Res. 35: D260-4 (Jan 2007).
26. Altschul et al., J Mol Bio. 215 (3): 403-10 (Oct 5, 1990).
27. Cole JR. et al., Nucleic Acid Res. 37: D141-5 (Jan 2009).
28. Huson DH et al., Genome Res. 17 (3): 377-86 (Mar 2007).
29. Brady A and Salzberg SL. Nature Methods. 6 (9): 673-6 (Sep 2006).
30. Chen Т et al., Database (Oxford) 6 (July 2010).
31. J.R. Tagg et al., Trends Biotechnol 21, 217 (May, 2003).
32. R.В. Merrifield (1963), J. Am. Chem. Soc. 85 (14): 2149-2154.
33. Albericio, F. (2000). Solid-Phase Synthesis: A Practical Guide (1st ed.). CRC Press. pp.848. ISBN 0824703596.
34. Konstantinidis KT, Tiedje JM. J Bacteriol. 2005 Sep; 187 (18): 6258-64.
35. Goris J et al., Int J Syst Evol Microbiol. 2007 Jan; 57 (Pt 1): 81-91.
36. Richter M, Rosselló-Móra R. Proc Natl Acad Sci USA. 2009 Nov 10; 106 (45): 19126-31.
37. Exterkate RA et al., Res. 2010; 44 (4): 372-9.
38. Pham LC et al., Arch Oral Biol. 2011 Feb; 56 (2): 136-47.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОБИОТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЗДОРОВЬЯ ПОЛОСТИ РТА | 2011 |
|
RU2584610C2 |
| Набор реагентов для выявления Streptococcus mutans методом изотермической петлевой амплификации | 2022 |
|
RU2796603C1 |
| СПОСОБ ВЫЯВЛЕНИЯ STREPTOCOCCUS MUTANS МЕТОДОМ ИЗОТЕРМИЧЕСКОЙ ПЕТЛЕВОЙ АМПЛИФИКАЦИИ | 2022 |
|
RU2799413C1 |
| НАБОР ПРАЙМЕРОВ ДЛЯ ВЫЯВЛЕНИЯ STREPTOCOCCUS MUTANS МЕТОДОМ ИЗОТЕРМИЧЕСКОЙ ПЕТЛЕВОЙ АМПЛИФИКАЦИИ | 2022 |
|
RU2799414C1 |
| ГЕН И БЕЛОК ВИРУЛЕНТНОСТИ И ИХ ИСПОЛЬЗОВАНИЕ | 2000 |
|
RU2240327C2 |
| НОВЫЕ ПЕПТИДЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2583579C2 |
| ЛАНТИБИОТИК | 2000 |
|
RU2279481C2 |
| ПРИМЕНЕНИЕ И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ КАРИЕСА, ВЫЗВАННОГО MUTANS STREPTOCOCCI, ОТЛИЧНЫХ ОТ STREPTOCOCCUS MUTANS | 2007 |
|
RU2446208C9 |
| БАКТЕРИОЦИН, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ШТАММ MICROCOCCUS VARIANS, НУКЛЕОТИДНЫЙ ФРАГМЕНТ, СИГНАЛЬНЫЙ ПЕПТИД | 1996 |
|
RU2172324C2 |
| ПРЕДОТВРАЩЕНИЕ, РАЗРУШЕНИЕ И ОБРАБОТКА БИОПЛЕНКИ ЛИЗИНОМ БАКТЕРИОФАГА | 2013 |
|
RU2646102C2 |

































































































































































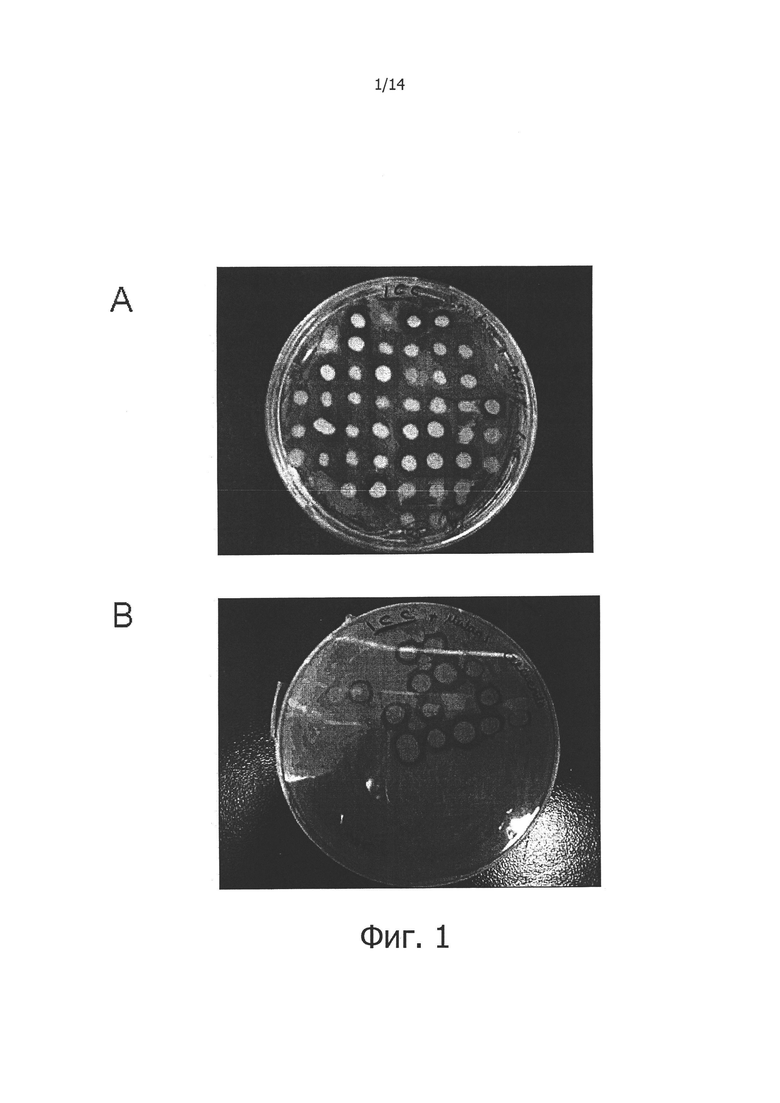
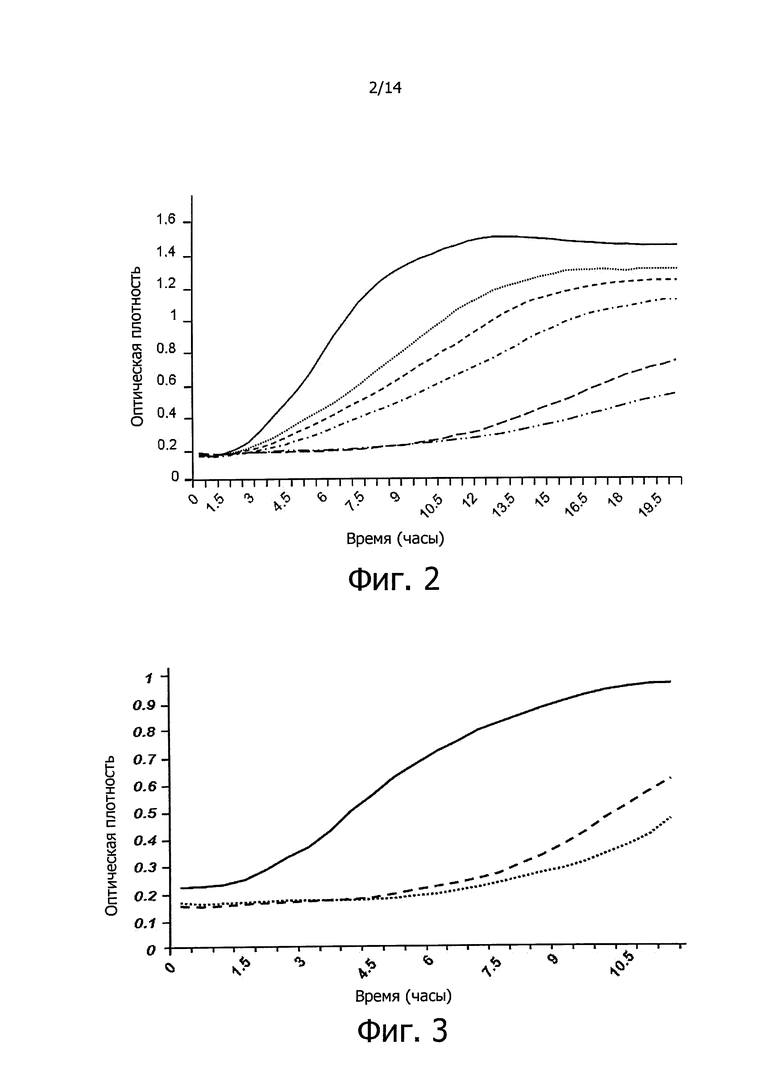
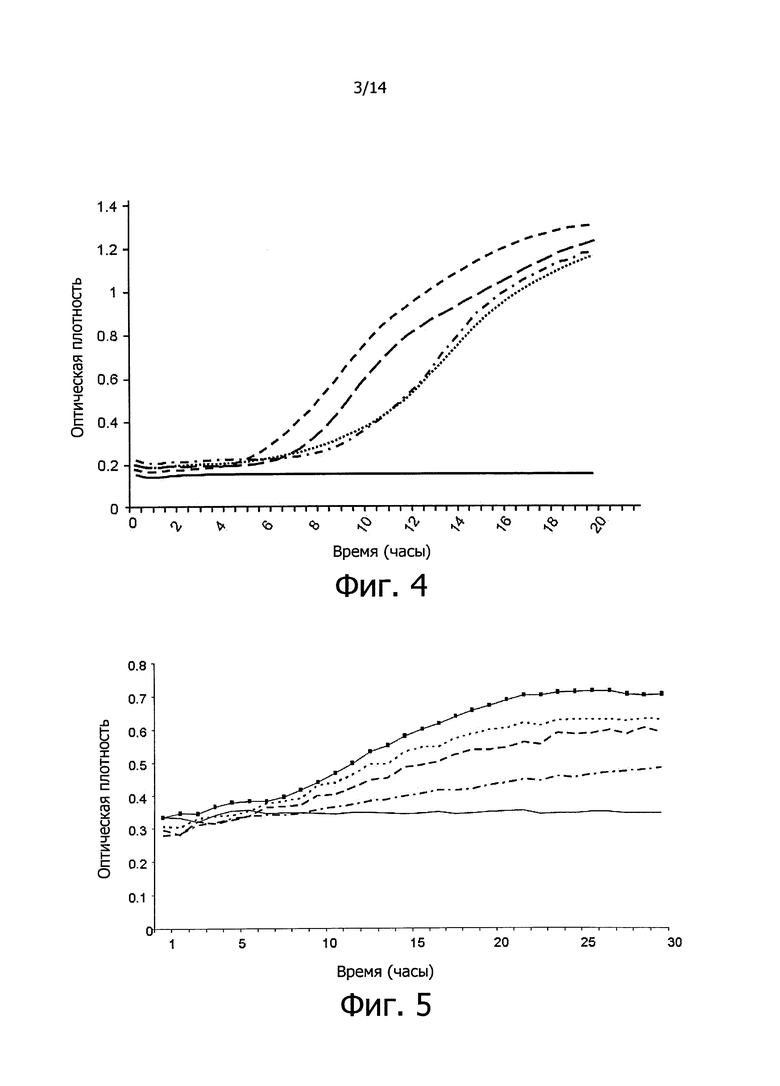
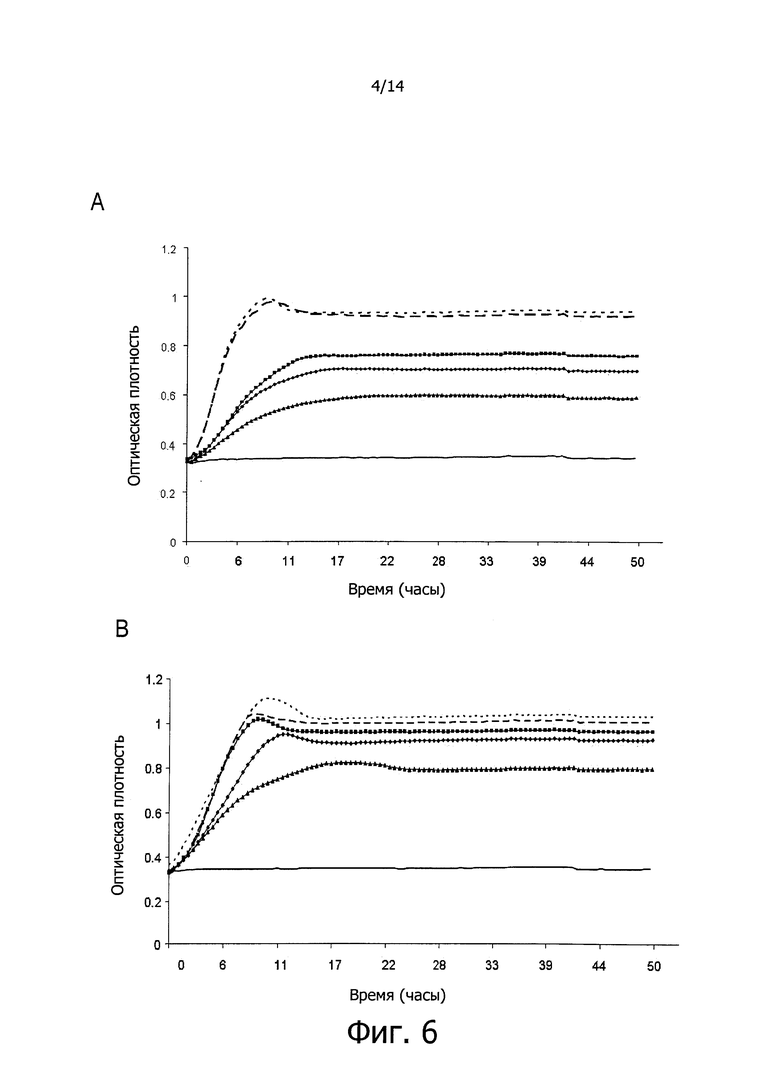
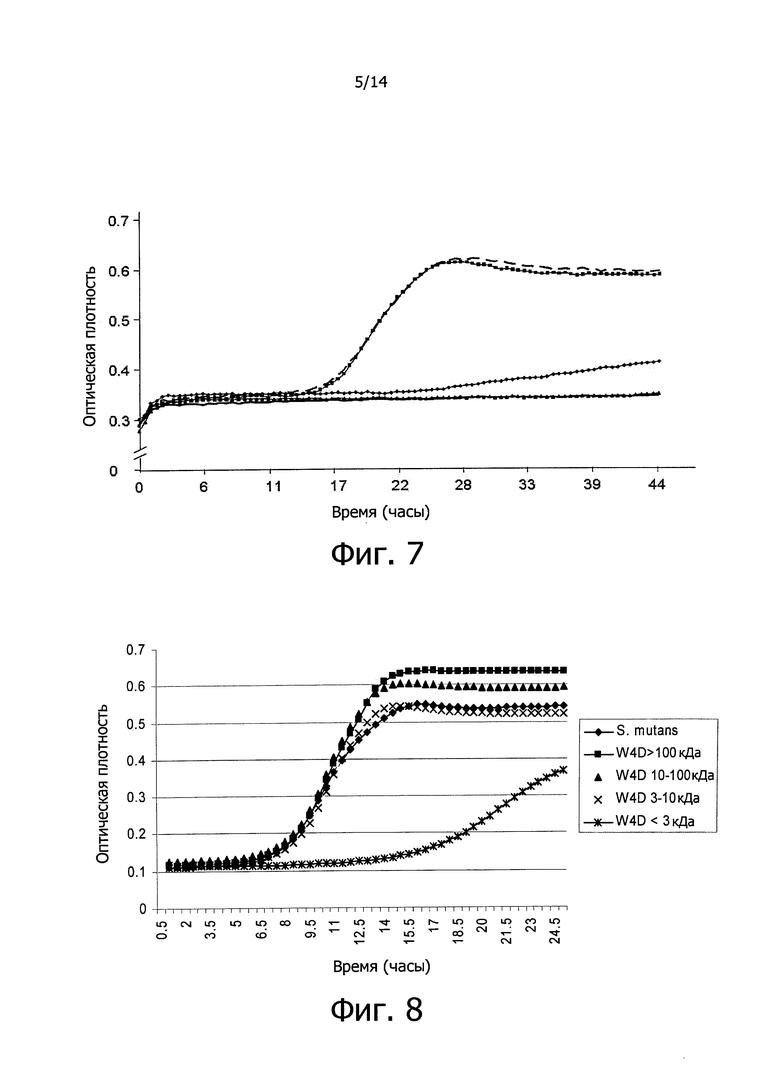
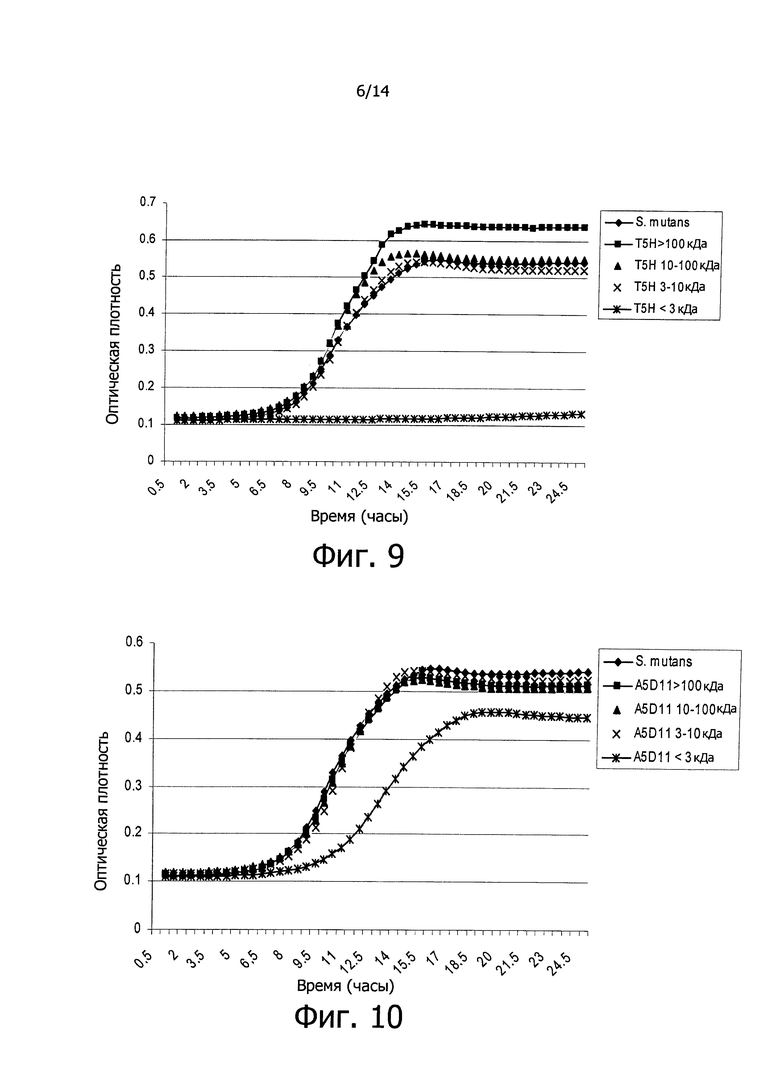
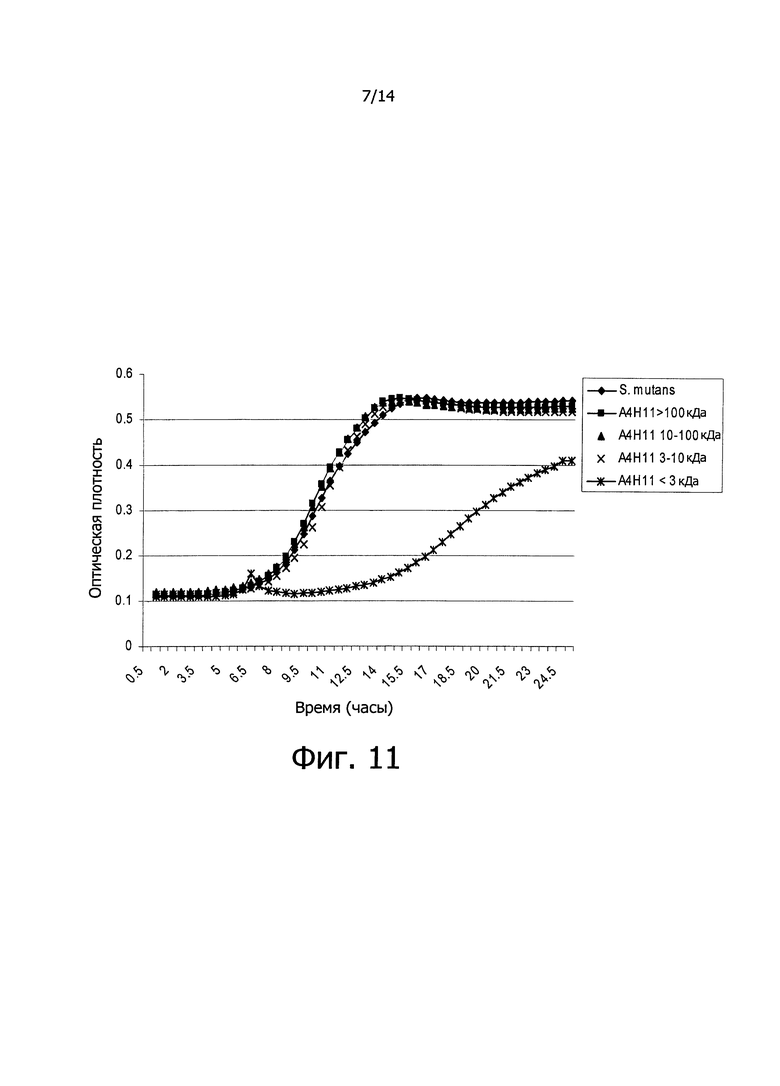
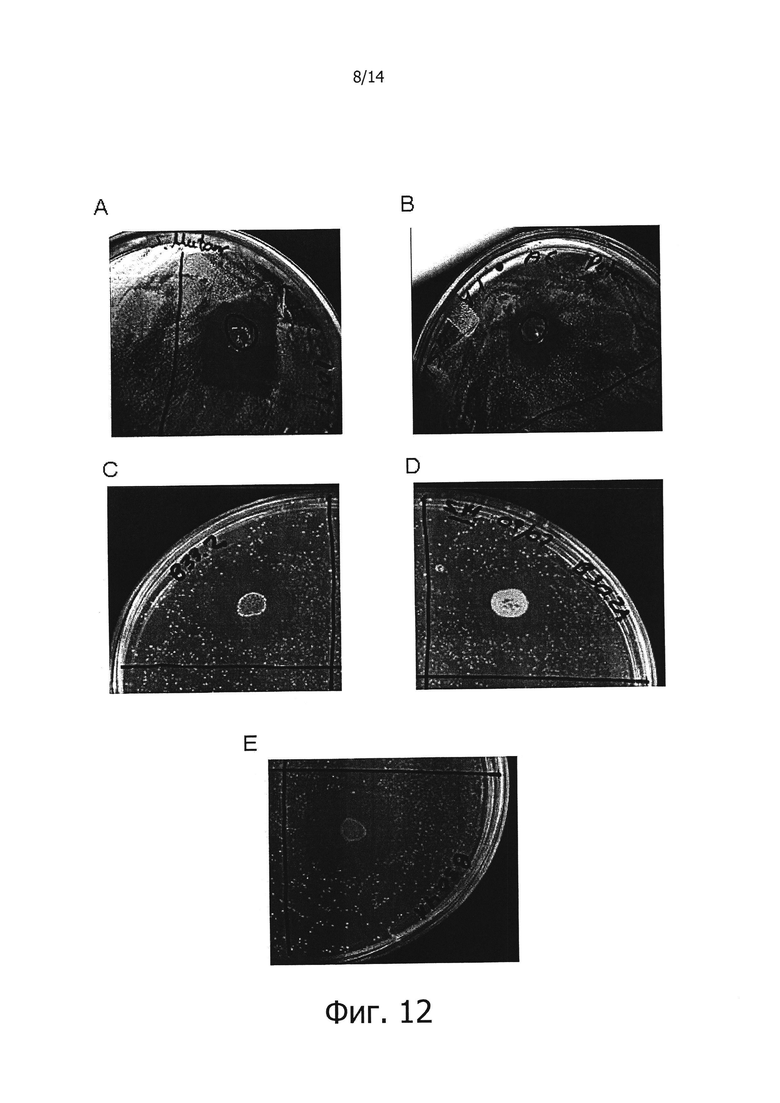
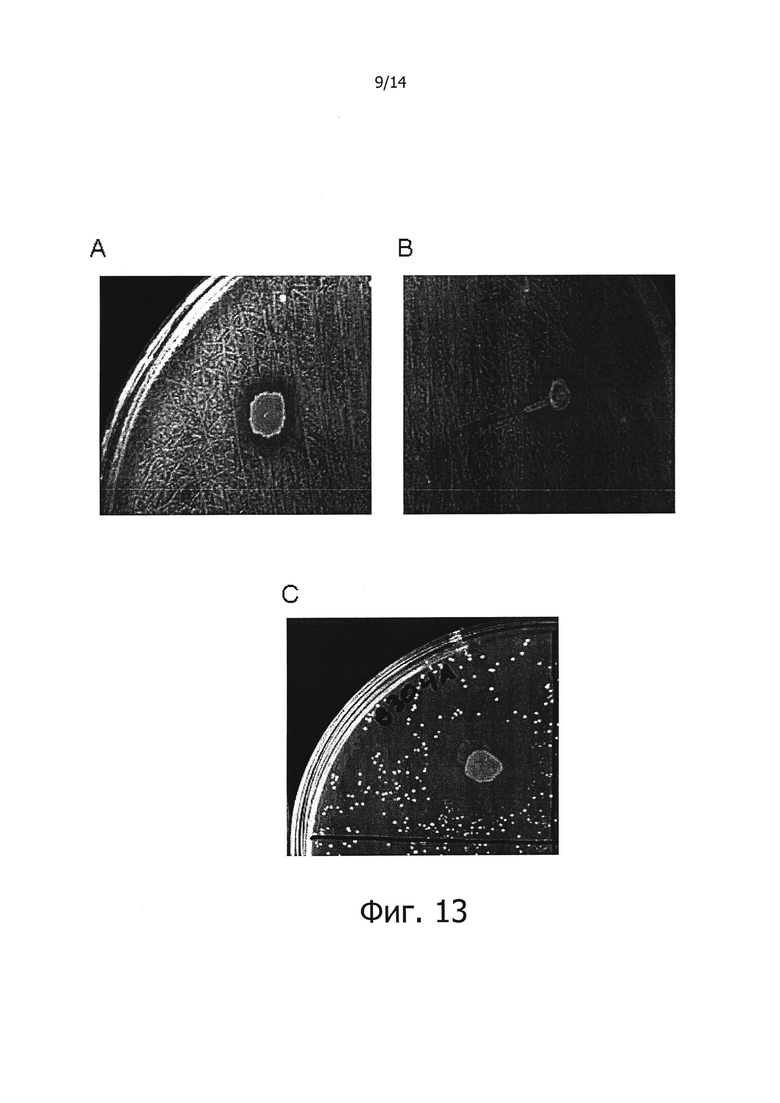
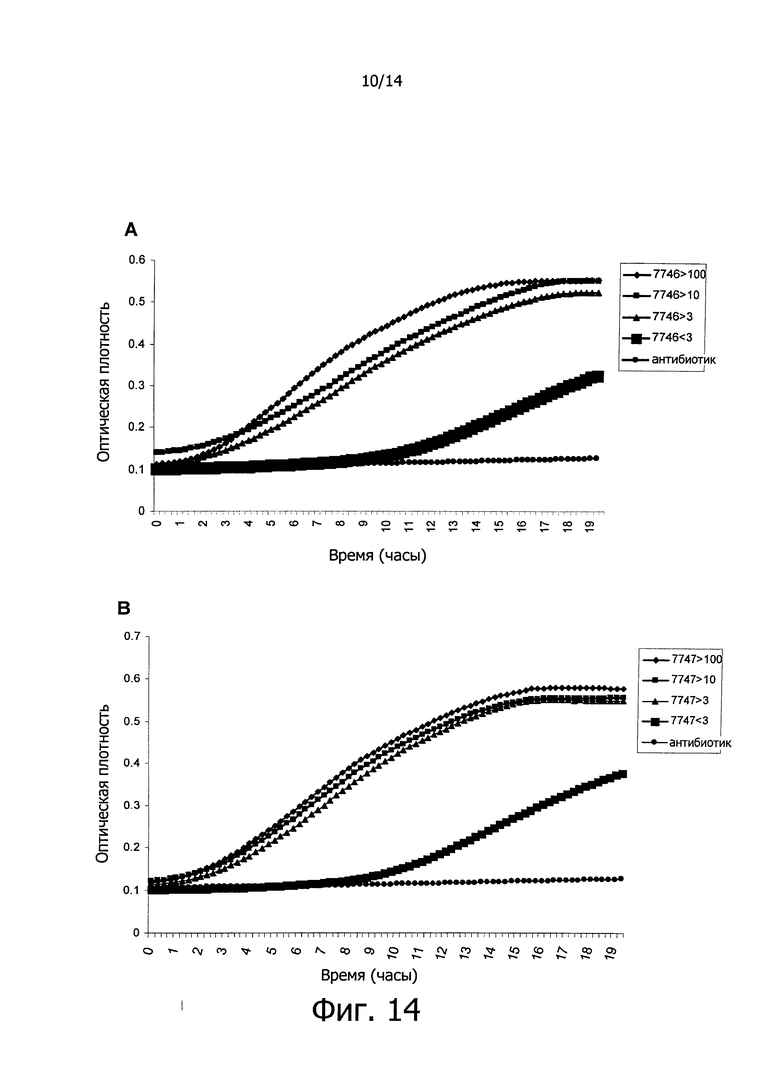
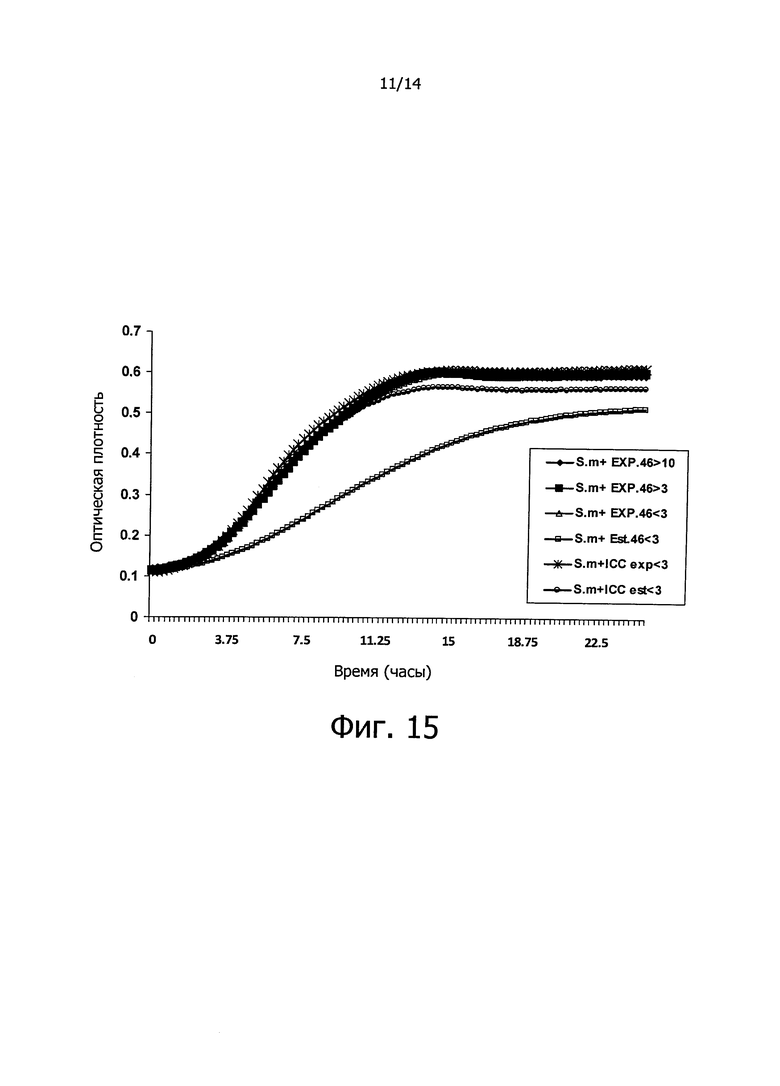
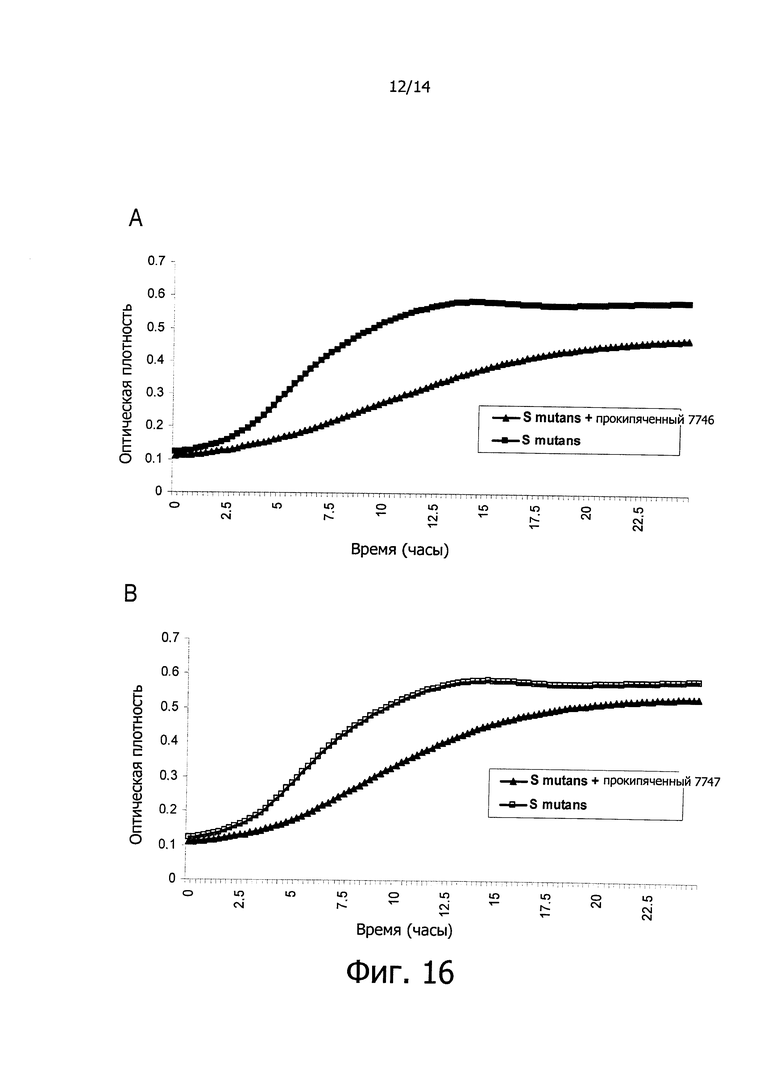

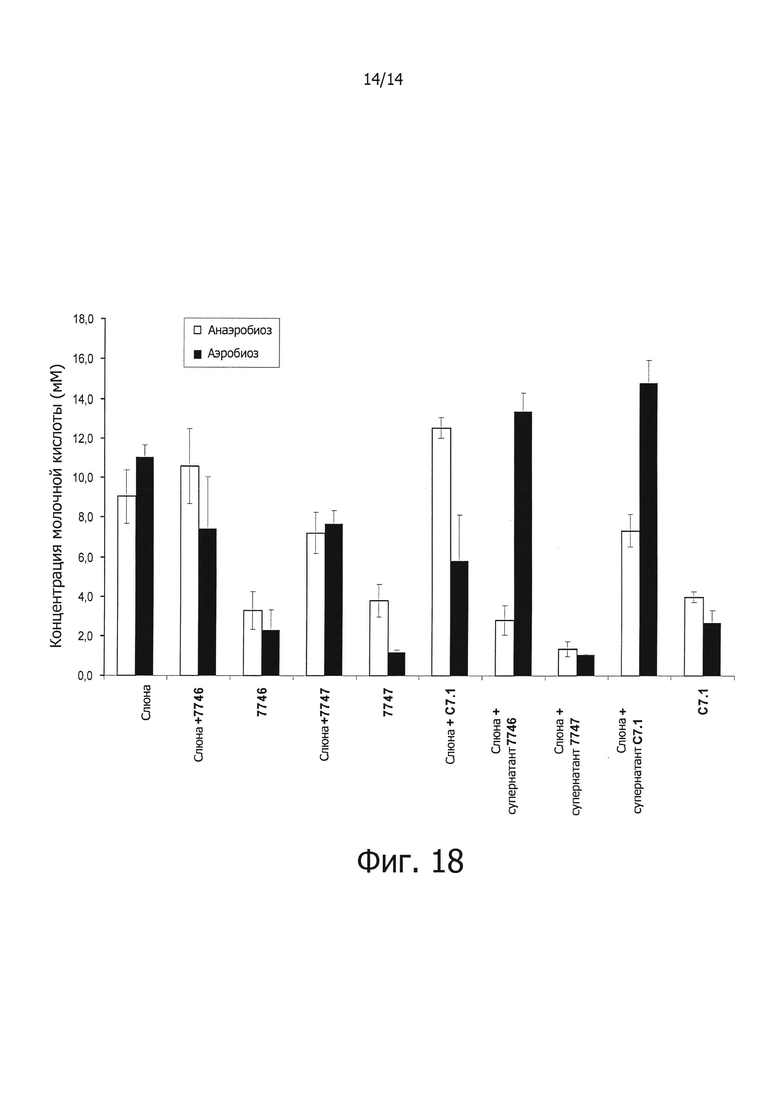
Группа изобретений относится к вариантам штамма Streptococcus и их применению. Предложены штамм Streptococcus CECT 7746, штамм Streptococcus CECT 7747, штамм Streptococcus CECT 7773, штамм Streptococcus CECT 7775, полезные как агенты против ротовых патогенных Streptococci. Указанные штаммы по отдельности или в комбинации применяют в качестве лекарственного средства для лечения болезней ротовой полости, выбранных из группы, состоящей из кариеса, периодонтита, гингивита и неприятного запаха изо рта или в качестве агента против ротового патогенного Streptococci или в качестве пробиотика или в составе функционального пищевого продукта. Предложены также медико-фармацевтическая композиция для лечения заболеваний ротовой полости, выбранных из группы, состоящей из кариеса, периодонтита, гингивита и неприятного запаха изо рта, пробиотическая, пребиотическая композиция, функциональный пищевой продукт, композиция для поддержания ротовой полости в здоровом состоянии, которые содержат в своем составе по меньшей мере один штамм, выбранный из CECT 7746, CECT 7747, CECT 7773 и CECT 7775, в эффективном количестве. Группа изобретений обеспечивает эффективное ингибирование роста микроорганизмов Streptococci ротовой полости. 12 н.п. ф-лы, 18 ил., 3 табл., 15 пр.
1. Штамм Streptococcus CECT 7746, полезный как агент против ротовых патогенных Streptococci.
2. Штамм Streptococcus CECT 7747, полезный как агент против ротовых патогенных Streptococci.
3. Штамм Streptococcus CECT 7773, полезный как агент против ротовых патогенных Streptococci.
4. Штамм Streptococcus CECT 7775, полезный как агент против ротовых патогенных Streptococci.
5. Применение противомикробного штамма Streptococcus, выбранного из: CECT 7746, CECT 7747, CECT 7773 и CECT 7775 или их комбинации, в качестве лекарственного средства для лечения болезней ротовой полости, выбранных из группы, состоящей из кариеса, периодонтита, гингивита и неприятного запаха изо рта.
6. Применение штамма Streptococcus, выбранного из: CECT 7746, CECT 7747, CECT 7773 и CECT 7775 или их комбинации, в качестве агента против ротового патогенного Streptococci.
7. Применение штамма Streptococcus, выбранного из: CECT 7746, CECT 7747, CECT 7773 и CECT 7775 или их комбинации, в качестве пробиотика или функционального пищевого продукта.
8. Пробиотическая композиция, которая включает по меньшей мере один штамм, выбранный из CECT 7746, CECT 7747, CECT 7773 и CECT 7775, в эффективном количестве.
9. Пребиотическая композиция, которая включает по меньшей мере один штамм, выбранный из CECT 7746, CECT 7747, CECT 7773 и CECT 7775, в эффективном количестве.
10. Функциональный пищевой продукт, который включает по меньшей мере один штамм, выбранный из CECT 7746, CECT 7747, CECT 7773 и CECT 7775, в эффективном количестве.
11. Медико-фармацевтическая композиция для лечения заболеваний ротовой полости, выбранных из группы, состоящей из кариеса, периодонтита, гингивита и неприятного запаха изо рта, которая включает по меньшей мере один штамм, выбранный из CECT 7746, CECT 7747, CECT 7773 и CECT 7775, в эффективном количестве.
12. Композиция для поддержания ротовой полости в здоровом состоянии, которая включает по меньшей мере один штамм, выбранный из CECT 7746, CECT 7747, CECT 7773 и CECT 7775, в эффективном количестве.
| WO 2003070919 A1, 28.08.2003 | |||
| СПОСОБ ПРОИЗВОДСТВА СТЕРИЛИЗУЕМЫХ КОНСЕРВОВ | 2002 |
|
RU2218774C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ STREPTOCOCCUS MUTANS, ИСПОЛЬЗУЕМЫЙ ДЛЯ СНИЖЕНИЯ ЧАСТОТЫ ВОЗНИКНОВЕНИЯ ИЛИ ТЯЖЕСТИ ЗАБОЛЕВАНИЯ ЗУБНЫМ КАРИЕСОМ (ВАРИАНТЫ), СПОСОБ ЕГО ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1996 |
|
RU2224794C2 |
| KOMATSUZAWA H | |||
| ET AL | |||
| Susceptibility of Periodontopathogenic and Cariogenic Bacteria to Defensins and Potential Therapeutic Use of Defensins in Oral diseases // Current Pharmaceutical Design, 2007, 13, pp | |||
| МЕХАНИЗМ ДЛЯ ИЗМЕНЕНИЯ ПРЕДВАРИТЕЛЬНОГО СЖАТИЯ ЗАРЯДА В ДВИГАТЕЛЯХ ВНУТРЕННЕГО ГОРЕНИЯ | 1923 |
|
SU3084A1 |
Авторы
Даты
2018-04-17—Публикация
2011-08-31—Подача