Настоящее изобретение относится к лантибиотикам - организмам, продуцирующим лантибиотики, и к использованию таких организмов и получаемым с их помощью лантибиотикам.
Предпосылки создания изобретения
Бактериальная инфекция у людей создает проблему, имеющую как личностное выражение, так и экономическую значимость для здравоохранения.
Стрептококковые инфекции относятся к числу особенно широко распространенных и вызывают различные недомогания, варьирующие от зубного кариеса и незначительных инфекций горла до серьезных заболеваний, таких как скарлатина, ревматическая лихорадка и острый гломерулонефрит.
Для снижения частоты стрептококковых инфекций желательно контролировать или предупреждать рост вредных болезнетворных бактерий. Одним из подходов к решению указанной проблемы является получение бактериоцинов и подобных веществ (включая лантибиотики), активных против стрептококков, а также организмов, продуцирующих вещества, которые могут применяться для борьбы с вредными стрептококковыми бактериями или для предупреждения их роста.
Известно множество бактериоцинов. Примеры бактериоцинов, получаемых из грамм-положительных бактерий, приведены в работе Тагга с соавт. (Tagg et al., (1976), Bacteriol Rev. Vol.40, pp.722-756). Другие примеры бактериоцинов включают лактицин 481 из Lactobacillus lactis (Piard et al., (1992), Applied and Environmental Microbiology, Vol.58, pp.279-284), вариацин из Micrococcus varians (US 5981261) и бактериоцины из Streptococcus themophilus, описанные в ЕР 0643136.
Известно, что Streptococcus salivarius характеризуется высоким уровнем продукции лантибиотиков (Dempster RP et al., (1982) Arch Oral Biol 27:151). Один из лантибиотиков был определен как саливарицин А из S. salivarius (Ross et al., (1993), Appi Envir Microbiol 59:2014). Однако несмотря на ингибирующую активность в отношении множества видов стрептококков, активность указанного лантибиотика была скорее бактериостатической, чем бактерицидной. В этой связи ни саливарицин А, ни продуцирующие его микроорганизмы не могут стать решением проблемы контроля стрептококковых инфекций.
Авторы настоящего изобретения идентифицировали другой антибактериальный белок в S. salivarius. Указанный белок, который, как показали заявители, обладает бактерицидной, а не просто бактериостатической эффективностью, стал основным объектом настоящего изобретения.
Краткое описание сущности изобретения
В связи с вышесказанным один аспект изобретения является достаточно широким и относится к антибактериальному белку, который может быть выделен из S. salivarius, штаммы К12 и К30, имеющему молекулярную массу примерно 2733 Да, по данным ионной масс-спектрометрии и содержит на N-конце аминокислотную последовательность Gly-Gly-Gly-Val-Ile-GIn, или его антибактериальному фрагменту или его варианту, который имеет гомологию по аминокислотной последовательности с указанным белком более, чем на 80%.
Белок согласно настоящему изобретению был назван заявителем "саливарицин В", полные нуклеотидные и аминокислотные последовательности которого даны на фиг.2 вместе с последовательностями части лидерного пептида.
Соответственно, саливарицин В получают при экспрессии последовательности ДНК, кодирующей его в хозяйской клетке, или при культивировании продуцирующих штаммов S. salivarius К12 или К30.
В другом аспекте изобретение относится к антибактериальной композиции, которая включает определенный выше белок или организм, который может экспрессировать определенный выше белок.
В еще одном аспекте изобретение относится к терапевтической композиции, включающей саливарицин В, определенный выше, или его антибактериальный фрагмент, или его вариант в сочетании с разбавителем, носителем и/или наполнителем.
В еще одном аспекте настоящее изобретение относится к терапевтической композиции, включающей организм, способный экспрессировать саливарицин В, определенный выше, или его антибактериальный фрагмент, или его вариант в сочетании с разбавителем, носителем и/или наполнителем.
Предпочтительно, указанный организм способен экспрессировать саливарицин В один или в сочетании со вторым антибактериальным средством.
Более предпочтительно, указанное второе антибактериальное средство представляет собой БПИВ, наиболее предпочтительно - саливарицин А2. Полные нуклеотидная и аминокислотная последовательности саливарицина А2 приведены на фиг.3 вместе с последовательностями лидерного пептида.
Соответственно, указанный организм выбирают из штаммов К12 и К30 S. salivarius.
В особенно предпочтительном варианте осуществления изобретения терапевтические композиции представлены в форме пищевых продуктов или напитков, наиболее предпочтительно, в форме пищи или напитков на основе молочного продукта.
Альтернативными формами лекарственных веществ являются кондитерские изделия.
В еще одном аспекте настоящее изобретение относится к организму, который экспрессирует саливарицин В.
Предпочтительно, указанный организм выбирают из штаммов К12 и К30 S. salivarius.
В других аспектах изобретения предлагаются способы лечения индивидуумов, позволяющие по меньшей мере ингибировать рост вредных стрептококковых бактерий в верхних дыхательных путях, включающие стадию орального введения эффективного количества саливарицина В указанному индивидууму.
Предпочтительно, указанный саливарицин В вводят в виде составной части терапевтической композиции.
Соответственно, в рамках указанного метода ингибирующий эффект вызывается посредством колонизации по меньшей мере части верхних дыхательных путей индивидуума жизнеспособным непатогенным организмом, который экспрессирует саливарицин В.
Предпочтительно, указанный организм вводят в виде составной части пищи или напитка.
Более предпочтительно, указанный организм представляет собой штамм S. salivarius, выбираемый из штаммов К12 и К30.
В еще одном варианте осуществления изобретения указанный способ включает предварительную стадию начального лечения указанного индивидуума, проводимого с целью по меньшей мере снизить бактериальную популяцию, имеющуюся в верхних дыхательных путях.
Предпочтительно, указанное предварительное лечение включает стадию орального введения антибиотика, предпочтительно эритромицина, указанному индивидууму.
В еще одном варианте осуществления настоящее изобретение относится к способу лечения пациента от инфекций верхних дыхательных путей, вызванных стрептококковыми организмами, который включает стадии:
(i) орального введения указанному пациенту антибиотика в количестве, эффективном для снижения числа имеющихся стрептококков; и
(ii) введения БПИВ-продуцирующих организмов S. salivarius для снижения бактериального окружения популяции для восстановления популяции в указанном окружении.
Несмотря на то, что, как видно из вышесказанного, тематика изобретения достаточно широка, любой специалист со средним уровнем знаний в данной области понимает, что изобретение не ограничивается данным описанием, но также включает другие варианты, реализация которых приведена ниже в соответствующих примерах, а также аспекты, определенные во всей полноте в прилагаемой формуле изобретения.
Описание чертежей
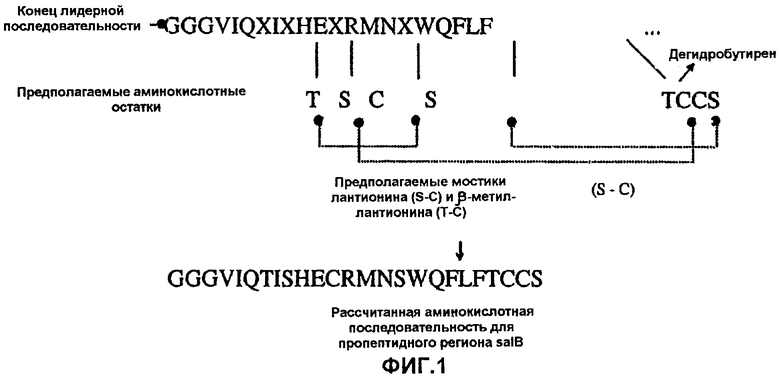
На фиг.1 показаны структурные особенности саливарицина В;
на фиг.2 - нуклеотидная и аминокислотная последовательности саливарицина В, включая часть лидерного пептида; и
на фиг.3 - нуклеотидная и аминокислотная последовательности саливарицина А2, включая лидерный пептид.
Описание изобретения
БПИВ (БПИВ - бактериоцин-подобные ингибирующие вещества) включают экстрацеллюларные бактериальные пептиды или белки, которые при низких концентрациях способны убить некоторые другие близкородственные бактерии за счет механизма, против которого продуцирующие клетки имеют определенный уровень специфического иммунитета.
Термин "лантибиотик" является производным термином от "лантионин-содержащие антибиотики" (Schnell et al., Nature 333:276, 1988). Лантибиотики относятся к категории БПИВ. Лантибиотики синтезируются в рибосомах как предлантибиотики, имеющие на N-конце расширение (лидерный пептид), которое отщепляется ферментом процессинга при образовании зрелой (биологически активной формы) молекулы. Характерной особенностью является то, что все они являются полициклическими полипептидами, содержащими лантионин и/или β-метиллантионин, которые могут образовывать тиоэфирные связи внутри пептидной цепи. Классификация известных в настоящее время лантибиотиков на два типа А и В была предложена Джангом (Jung in Angewandte Chemie 30:1051-1192, 1991).
Предшествующие исследования заявителя привели к обнаружению множества БПИВ-продуцирующих штаммов Streptoccoces salivarius, имеющих активность против ряда других стрептококков. Был выделен БПИВ, продуцируемый одним штаммом (штамм 20РЗ), который был далее частично очищен и предварительно охарактеризован. Изучение показало, что продуцируемый БПИВ является относительно термостабильным белком с молекулярной массой в диапазоне от 3500 до 8000 Да. Указанный БПИВ получил название SAL 20P3.
В последующих исследованиях была установлена аминокислотная последовательность SAL 20P3, а также его молекулярная масса. Конкретному идентифицированному лантибиотику было дано название саливарицин A (Ross et al., Appl. Envir. Microbiol 59:2014).
БПИВ согласно настоящему изобретению отличается от саливарицина А. Указанное различие относится как к молекулярной массе (2733 Да в сравнении с 2316 Да для саливарицина А), так и к аминокислотной последовательности, приведенной на фиг.2. Саливарицины А и В также отличаются по своей ингибирующей активности. Конкретно было показано, что тогда как саливарицин А эффективен в качестве бактериостатического средства в отношении большинства штаммов Streptoccocus pyogenes, саливарицин В имеет бактерицидное действие. Существенно, что не был идентифицирован ни один штамм S. pyogenes, устойчивый к саливарицину В.
Саливарицин В экспрессируется штаммами S. salivarius K12 и К30. Штаммы S. salivarius K12 и К30 были депонированы в коллекции микроорганизмов в Германии (Deutsche Sammlung von Mikroorganismen Und Zeilkulturen GmbH, Mascheroder Weg 1 b, D-38124 Braunschweig, Germany) 8 октября 1999 года. Штамму K12 был присвоен депозитный номер DSM 13084 и штамму К30 был присвоен депозитный номер DSM 13085.
Соответственно, первый объект настоящего изобретения относится к антибактериальному белку, саливарицину В. Настоящее изобретение также относится к фрагментам или вариантам саливарицина В в том случае, когда они демонстрируют функциональную эквивалентность.
Следует понимать также, что могут быть внесены модификации в нативную аминокислотную последовательность белка и его активных фрагментов при сохранении по существу их биологической активности. Такие модификации нативной аминокислотной последовательности возникают в результате инсерции, замещения или делеции одной, двух или трех аминокислот, которые являются частными случаями, входящими в область настоящего изобретения, при условии, что белковые варианты имеют или включают последовательность, которая более, чем на 80% гомологична аминокислотной последовательности нативного саливарицина В.
Следует, разумеется, понимать, что может быть проведено множество замещений аминокислот в случае их принципиальной достижимости. Консервативные замещения описаны в патентной литературе, например в патенте США №5264558 или №5487983. Ожидается также, что, например, возможен обмен между неполярными алифатическими нейтральными аминокислотами глицином, аланином, пролином, валином и изолейцином. Аналогично также возможны замещения в группе полярных алифатических нейтральных аминокислот серина, треонина, метионина, аспарагина и глютамина. Могут быть также осуществлены замещения среди заряженных аминокислот кислой природы: аспарагиновой кислоты и глютаминовой кислоты, а также возможны замещения между заряженными аминокислотами с основными свойствами: лизином и аргинином. Аналогично также возможны замещения между ароматическими аминокислотами, включающими фенилаланин, гистидин, триптофан и тирозин. Указанные виды замещений и обменов известны специалистам в данной области знаний. Могут быть приемлемы и другие замещения. Разумеется, можно ожидать, что больший процент гомологии, т.е. близости последовательностей вариантного белка и натурального белка, превышающий порог 80%, будет способствовать большему сохранению активности.
Белок и его фрагменты согласно настоящему изобретению могут быть получены разными способами. Например, при выделении из натурального источника (такого как штаммы S. salivarius K12 и/или К30, посредством синтеза с использованием любой подходящей известной методики (такой как описана для синтеза с низином в работе Wakamiya et al., (1991), in "Nisin and Novel Lantibiotics" ed. G.Jung and H.G. Shal, 189-203, Escom, Leiden) или посредством твердофазного синтеза, описанного в литературе (Merrifield (1964) J. Am. Chem. Assoc. 85, 2149-2154), или через синтез в гомогенном растворе (Houbenwycl (1987), Methods of Organic Chemistry, Vol.I and II) или с использованием методики рекомбинантной ДНК, описанной Самбруком (Sambrook, et al., (1989), Molecular cloning: A Laboratory Manual, Cold Spring Harbour Press, New York, USA).
Варианты как нативного белка, так и его фрагментов могут быть аналогично получены при использовании известных в технике методик. Так, например, варианты могут быть получены посредством направленного мутагенеза ДНК, кодирующей нативную аминокислотную последовательность так, как описано Адельманом с соавт. (Adelman et al., DNA 2, 183 (1983)).
В случае использования рекомбинантной техники для получения БПИВ необходимо на первой стадии получить ДНК, кодирующую желательный продукт. Такая ДНК также представляет объект настоящего изобретения.
Нуклеотидная последовательность полинуклеотида, кодирующая саливарицин В, показана на фиг.2.
ДНК согласно настоящему изобретению может кодировать нативный белок или его активный фрагмент.
ДНК может быть выделена, например, из штаммов S. salivarius K12 и К30 с использованием зондов и/или праймеров амплификации на основе известной нуклеотидной последовательности саливарицина В. Идентифицированная таким образом ДНК может быть с помощью обычных методик получена в виде кДНК, свободной от интрона. ДНК может быть также получена в виде синтетических олигонуклеотидов, размер активных фрагментов которых определяется возможностями, например, используемого фосфортриэфирного метода (Matteucci et al., J. Am. Chem. Soc. 103:3185-3191, 1981). Кроме того, ДНК может быть получена с использованием подходящего коммерчески доступного синтезатора ДНК, такого как Applied BioSystems DNA synthesiser.
Настоящее изобретение также включает варианты белка и их фрагменты, которые отличаются от нативной аминокислотной последовательности наличием инсерций, замещений или делеций одной или более аминокислот. В том случае, когда желателен такой вариант, соответствующим образом изменяют нуклеотидную последовательность нативной ДНК. Указанное изменение может быть осуществлено через элективный синтез ДНК или посредством модификации нативной ДНК, например, с помощью сайт-специфического или кассетного мутагенеза.
В том случае, когда требуется модификация последовательности частей кДНК или геномной ДНК, используют предпочтительно сайт-специфический мутагенез с использованием праймеров. Указанная методика в настоящее время является стандартной в данной области.
При получении модифицированную ДНК обрабатывают, с тем чтобы ее можно было ввести в соответствующий вектор клонирования и/или экспрессии. Для достижения указанной цели ДНК расщепляют, "вешают хвост" и повторно лигируют, по необходимости.
Расщепление проводят при обработке рестрикционными ферментами в подходящем буфере. Любая из множества коммерчески доступных рестриктаз может использоваться по методике, указанной производителем. После расщепления нуклеиновую кислоту выделяют, например, осаждением этанолом.
Присоединение к расщепленной ДНК "хвоста" проводят с помощью обычных методик. Так, например, если нужно получить тупые концы, ДНК может быть обработана ДНК-полимеразой 1 (Klenow) с последующей экстракцией фенолом и хлороформом и осаждением этанолом.
Повторное лигирование может быть проведено при добавлении примерно эквимолярных количеств желательных компонентов при введении соответствующего "хвоста" для правильного спаривания и обработки соответствующей лигазой (например, ДНК лигазой Т4).
Полученную таким образом молекулу ДНК вводят в вектор клонирования в том сайте, который позволяет провести экспрессию кодируемого ею белкового продукта.
Соответствующие векторы клонирования могут быть сконструированы с помощью известных методик или могут быть выбраны из большого числа доступных в технике векторов клонирования. Поскольку такие векторы клонирования могут различаться в зависимости от хозяйской клетки, в которой их предполагается использовать для экспрессии БПИВ-кодирующей ДНК, полезные векторы клонирования в основном должны обладать следующими характеристиками:
(i) способностью к саморепликации;
(ii) наличием одного целевого сайта для любой конкретной рестрикционной эндонуклеазы; и
(iii) желательным наличием генов маркера селекции, такого как устойчивость к антибиотикам.
Два основных типа векторов клонирования, обладающие вышеуказанными характеристиками, включают плазмиды и бактериальные вирусы (бактериофаги или фаги). Примеры подходящих векторов клонирования включают pUC18, Mp18, Мр19, pRB322, pMB9, ColE1 и pCR1 из Е. coli плазмиды для широкого перечня хозяйских клеток, включая RP4, фаговые ДНК, такие как лямбда и М13, и шаттл-векторы, такие как рSА3 и рАТ28.
Для экспрессии в хозяйских клетках БПИВ-кодирующей ДНК вектор клонирования должен включать последовательность контроля экспрессии. Типичная последовательность контроля экспрессии может быть описана пятью элементами. В том порядке, как они находятся в гене, указанные элементы представляют собой следующие:
(a) промоторный регион;
(b) 5'-нетранслируемый регион (сигнальная или лидерная последовательность);
(c) последовательность, кодирующая белок;
(d) 3'-нетранслируемый регион; и
(е) регион, терминирующий транскрипцию.
Функция каждого из указанных элементов хорошо известна.
Может использоваться любой представитель из широкого перечня таких последовательностей контроля, включая, например, соответствующие последовательности из гена липопротеина, гена β-галактозидазы, гена триптофана, гена β-лактамазы и фага лямбда.
Для получения элемента (с) последовательность ДНК, кодирующую лантибиотик, вставляют описанным выше способом в контрольную последовательность вектора клонирования.
Затем выбирают соответствующую хозяйскую клетку, в которую может быть введен вектор клонирования. Потенциально полезные хозяйские клетки включают бактериальные, дрожжевые, грибковые клетки, а также клетки насекомых, животных и растений. В основном для целей осуществления настоящего изобретения предпочтительны прокариотические хозяйские клетки. Особенно предпочтительны неболезнетворные бактериальные хозяйские клетки.
Бактериальные хозяйские клетки в основном выбирают из грам-положительных бактерий. Для использования согласно настоящему изобретению в качестве хозяйских клеток предпочтительны стрептококки.
Как будет показано, в выбранной хозяйской системе используют плазмидные векторы, которые содержат сайты репликации и контрольные последовательности, полученные из видов, совместимых с клетками хозяина.
Указанный выше вектор клонирования используют для трансформации выбранной хозяйской клетки с использованием известных в технике методик, например обработкой хлоридом кальция, как описано Коэном (Cohen, S.N. Proc. Nat. Acad. Sci. 69, 2110, 1972).
При трансформации выбранной хозяйской клетки вектором клонирования в ходе культивирования хозяйских клеток может быть получен кодируемый белок или его фрагмент, возможно в виде белка слияния. Затем экзогенный белковый продукт или его фрагмент выделяют с помощью обычных методик, включая осаждение сульфатом аммония, колоночную хроматографию (например, ионообменную хроматографию, гель фильтрацию, аффинную хроматографию и др.), электрофорез и, наконец, кристаллизацией (см. общее описание в "Enzyme Purification and Related Techniques" Methods in Enzymology, 22, 233-577 (1971)). Очистку проводят до необходимого уровня с помощью традиционных методик.
В рамках использования рекомбинантной технологии ДНК согласно настоящему изобретению может также кодировать белок слияния, включающий антибактерильный белок или его фрагмент и белковый вектор, для облегчения процедур выделения и очистки. В основном указанный векторный белок может быть отщеплен химически или энзиматически от антибактериального белка или его фрагмента с помощью известных методик.
Может также найти применение специфическая химерная белковая форма. Последовательность ДНК, кодирующая каждый полный белок или часть белка, может быть связана, например, с последовательностью, кодирующей другой БПИВ, такой как саливарицин А2, так что экспрессия последовательности ДНК приводит к продукции химерного белка с расширенным спектром антибактериальной активности.
После очистки белок становится пригодным для использования. Такие направления использования включают применение их в качестве антибактериальных средств общего характера (например, в качестве консервантов пищи), а также в качестве терапевтических средств. В указанном контексте следует понимать, что термин "терапевтические" включает профилактическое применение.
В связи с вышесказанным еще один объект настоящего изобретения относится к терапевтическим композициям, пригодным для использования при лечении или профилактике микробных инфекций, в частности стрептококковых инфекций. Указанные композиции особенно пригодны для применения против S. pyogenes и S. sobrinus. Такие терапевтические композиции включают саливарицин В, или его фрагмент, или его вариант в сочетании с разбавителем, носителем или наполнителем, в частности, из числа известных в технике. Примеры терапевтических композиций, в которых может использоваться саливарицин В, включают, не ограничиваясь приведенным перечнем, лекарственные средства для орального применения, такие как капсулы, пастилки, сиропы, жидкости для полоскания рта, жидкости для полоскания горла, зубные пасты и аэрозольные формы для полости рта. Другие примеры включают композиции для местного нанесения, такие как увлажняющие кремы и косметические средства для борьбы с ростом бактерий на коже.
Еще один объект настоящего изобретения относится к терапевтической композиции, включающей жизнеспособный неболезнетворный организм, способный к образованию колоний в верхних дыхательных путях или в их части, и к экспрессии лантибиотика согласно настоящему изобретению, включающей также носитель, разбавитель и/или наполнитель.
В одном варианте осуществления изобретения указанный организм представляет собой трансформированный хозяйский организм, получаемый согласно настоящему изобретению. Предпочтительно, однако, чтобы указанный организм представлял собой такой организм, который продуцирует саливарицин В в виде нативного продукта. Примерами таких организмов являются штаммы S. salivarius K12 и К30.
Было показано, что штаммы S. salivarius K12 и К30 экспрессируют не только саливарицин В, но также саливарицин А2. Саливарицин А2 близок, но не идентичен саливарицину А. Полные последовательности (полинуклеотидная и аминокислотная) саливарицина А2 приведены на фиг.3.
В указанном варианте предпочтительно, чтобы терапевтические композиции согласно настоящему изобретению имели вид пищи, кондитерских изделий или напитков. Особенно предпочтительно также, чтобы пищевые продукты или напитки представляли собой пищу или напиток на основе молочных продуктов, включая в качестве примера йогурт, сыр, молоко, молочные бисквиты и ароматизированное молоко. В случае кондитерских изделий терапевтические композиции могут представлять собой жевательную резинку, такую как жевательная резинка, описанная в WO 00/05972.
Особенно предпочтительной является композиция, которая представляет препараты порошкового молока с включением в них лиофильно высушенных штаммов S. salivarius, продуцирующих саливарицин В по способу, аналогичному описанному ранее для получения препарата порошкового молока Бифидус (Nagawa et al. (1988); J. Dairy Sci. 71:1777-1782).
Различные аспекты настоящего изобретения иллюстрируются далее в примерах, не несущих ограничивающих функций.
Примеры
Экстракция саливарицина
Саливарицин В получают и очищают из газонных культур исследуемых штаммов S. salivarius K12 и К30, растущих в течение 18 часов при 37°С в атмосфере воздуха с 5% содержанием двуокиси углерода на среде М17 с добавками 0,5% агара Дэвиса, 0,5% сахарозы, 0,5% человеческой плазмы и 0,1% карбоната кальция. Газонные культуры инокулируют мазком по поверхности агаровой среды из 18-часовой культуры продуцирующего штамма в бульоне Тодда Хьюита (Todd Hewitt). Экстракцию активности саливарицина В проводят при замораживании чашек с агаром при -70°С с последующим оттаиванием при комнатной температуре до разрушения агарового геля и затем центрифугированием до прозрачности экстрагированного раствора. Титр ингибирующей активности указанных замороженных/оттаявших экстрактов составляет в основном 2-4 УЕ/мл.
Титрование активности саливарицина
Активность саливарицина определяют титрованием с использованием теста на агаровых поверхностях. Капли (20 мкл) двукратного разведения образца в насыщенном солевом растворе анализируют против Micrococcus luteus T-18 на агаровой основе Колумбия (Columbia). Величина, обратная наибольшему разбавлению, при котором имеется четкая зона ингибирования роста индикаторного газона, обозначает титр активности саливарицина в условных единицах на мл (УЕ/мл).
Очистка саливарицина В
Двухлитровый объем замороженного/оттаявшего экстракта наносят на колонку с XAD-2 (диаметр 5,0 см, объем наполнителя 150 мл; Serva) и промывают семью объемами слоя 50% (объем/объем) метанолом. Активный саливарицин элюируют 5 объемами слоя 90% (объем/объем) метанолом (доведенного до рН 2 с помощью 11,6 М CHl) и концентрируют при выпаривании при 50°С под пониженным давлением. Аликвоты (по 1 мл) указанного материала наносят на колонку с обращенной фазой Brownlle C8 (Aquapore RP 300; размер пор 7 мкм; 30×4,6 мм; Applied Biosystems, Inc.), уравновешенную 0,1% трифторуксусной кислотой (ТФУ). Фракционирование указанного материала осуществляют с использованием системы Pharmacia для быстрой жидкостной хроматографии белков (ББЖХ) со скоростью течения 1 мл в минуту с использованием 10-минутного градиента (от 0 до 28% ацетонитрила, содержащего 0,085% ТФУ) с последующим 80-минутным изократическим (28% ацетонитрила) элюированием. В ходе указанного изократического элюирования достигается фазовое разделение саливарицина А (элюирование начинается примерно к 40 минуте) и саливарицина В (элюирование начинается примерно к 60 минуте). Каждую фракцию по 1 мл исследуют на наличие ингибирующей активности против M. luteus Т18. Активные фракции в каждом регионе, соответствующие саливарицину А и саливарицину В, объединяют по отдельности как частично очищенные препараты бактериоцинов. Каждый объединенный пул лиофилизируют и растворяют в 0,1% ТФУ. Аликвоты каждого из указанных препаратов наносят затем на колонку для ВЭЖХ с обращенной фазой C18 (Alltech Nucleosil C18; 10 мкм; 250,0×4,6 мм), уравновешенную 0,1% ТФУ и далее фракционируют с использованием системы ВЭЖХ Waters/Millipore при введении соответствующих градиентов ацетонитрила.
Саливарицин А2 элюируется 34-35% ацетонитрилом в виде гомогенного пика и саливарицин В при использовании 38-40% ацетонитрила. Поглощение отслеживают при 214 нм и фракции, соответствующие разным пикам, собирают вручную. Ингибирующую активность определяют по тесту на диффузию пятна с использованием М. luteus T18 в качестве индикатора. Активные фракции из каждой серии объединяют, лиофилизируют и вновь растворяют в 1 мл Milli ОТМ+-очищенной воды, содержащей 0,1% ТФУ. Фракции, содержащие ингибирующую активность (очищенный саливарицин), объединяют и хранят при -20°С.
Данные ионной масс-спектрометрии показывают, что молекулярная масса саливарицина В составляет 2733 Да. Анализ очищенного саливарицина В по методу Эдмана показывает наличие на N-конце последовательности Gly-Gly-Gly-Val-Ile-Gln.
Клонирование саливарицина В
Аминокислотная последовательность, полученная в ходе очистки и секвенирования пептида, позволяет разработать дегенеративные олигонуклеотидные зонды ДНК на основе универсального кодона. Используют специфический зонд (CF 481), соответствующий аминокислотной последовательности S W Q F L FT. Соответствующая нуклеотидная последовательность представляет TCNTGGCAATTTTTRTTTACT.
Из штамма Streptococcus salivarius Min 5 выделяют хромосомальную ДНК по методу Спаниера и Клири (Spanier and Cleary (1983). (Virology 130:514-522). Проводят расщепление рестриктазами EcoRl и HindIII, после чего разрезанную ДНК разделяют электрофорезом в 1% агарозном геле при 40 В/см в течение 18 часов (Sambrook et al., Molecular Cloning: A Laboratory Manual., 1989). ДНК переносят на полиамидную мембрану для саузерн-блотт-анализа, проводимого по инструкциям для использования Hybond-N+ (Amersham Pharmacia). Пробу CF481 метят гамма Р32 АТФ с использованием Т4 полинуклеотидкиназы. Гибридизацию пробы CF481 проводят в гибридизационной пробирке при 38°С в течение 18 часов. Мембрану промывают дважды в течение 5 минут в среде 5×SSC, 0,5% ДСН и затем дважды в течение 20 минут 2×SSC и 0,2% ДСН. Затем мембрану экспонируют на рентгеновской пленке при -70°С в течение 18 часов.
Из геля вырезают ту площадь геля, которая соответствует сайту гибридизации CF481 на саузерн-блотте, и ДНК экстрагируют с использованием набора для гель-экстракции Qiagen QIAquick. Для лигирования 1 мкл вектора pUC 19 после расщепления рестриктазами EcoRl и HindIII смешивают с 15 мкл очищенных фрагментов ДНК Min5, 2 мкл буфера для лигирования и 1 мкл ДНК лигазы Т4 (Roche). Инкубацию проводят в течение 18 часов при 15°С.
Штамм Е. coli DH10β используют для трансформации лигированного pUC 19 методом электропорации. Трансформированные клетки растят в течение 1 часа в 1 мл бульона Лурия (Luria) и затем помещают на чашки с агаровым бульоном Лурия с добавлением ампициллина (100 мкл/мл) и Х-gal (20 мг/мл). После инкубирования в течение ночи при 37°С отбирают белые колонии, проводят их субкультивирование и затем скрининг с использованием зонда CF481. Скрининг проводят при лизировании колоний Е. coli 10% раствором глицерина с 5% содержанием ДСН при 65°С в течение 30 минут. Затем колонии разгоняют в агарозном геле, проводят саузерн-блотт-анализ и мембрану гибридизуют с зондом CF481 указанным выше способом. Положительные колонии растят в бульоне Лурия с добавкой 100 мкл/мл ампициллина в течение 18 часов при 37°С на качалке. Плазмиду pUC 19 экстрагируют затем с использованием набора QIAprer Spin Miniprep (Qiagen) и проводят секвенирование с использованием pUC 19 с прямым и обратным праймерами.
Результаты приведены на фиг.2
Антибактериальная активность саливарицина В
Часть 1
Штаммы S. salivarius, такие как 20Р3 и 5, которые продуцируют саливарицин А (но не саливарицин В), ингибируют все 9 стандартных индикаторных бактерий, в отличие от индикатора 3. Картина ингибирования в кодированной форме известна как продукция (Р) типа 677. В отличие от указанной ситуации штаммы К12 и К30, которые продуцируют саливарицин А2 и саливарицин В, ингибируют рост всех 9 стандартных индикаторов и их активность описывается как активность Р типа 777. Определение активности Р-типа активность включает первое выращивание исследуемого штамма на кровяном агаре в виде округлой штриховой культуры. После прекращения роста агаровую поверхность стерилизуют парами хлороформа, аэрируют и наносят поперечными штрихами 9 стандартных индикаторных бактерий (включая 4 штамма Streptococcus pyogenes) через линию исходного инокулята исследуемого штамма. В ходе инкубации наличие интерференции с ростом индикаторов вблизи исходного штриха продуцента рассматривается как показание на наличие бактериоциновой активности. В случае штаммов 20Р3 и 5 (продуценты саливарицина А) ингибирующая активность, как было показано, является бактериостатической, то есть жизнеспособные индикаторные клетки могут быть выделены в большом количестве из зоны ингибирования при отборе образца мазком и перенесении клеток в свежую (не содержащую бактериоцина) агаровую среду. Тогда как эффект штаммов Р-типа 777 (также являющиеся продуцентами саливарицина В), наоборот, является бактерицидным в отношении стандартных индикаторов, то есть из зоны ингибирования в антагонистических тестах не выделяются жизнеспособные клетки. Кроме того, тесты с использованием очищенных препаратов саливарицина А и саливарицина В (данные не показаны) подтвердили, что действие саливарицина А против Streptococcus pyogenes является бактериостатическим, в то время как действие саливарицина В является бактерицидным.
Часть 2
Ингибирующую активность саливарицинов определяют измерением снижения со временем количества колоний-образующих единиц (КОЕ) в суспензии чувствительных индикаторных стрептококков (Streptococcus pyogenes штамм FF22) после смешивания клеток с препаратом саливарицина. Дважды промытые клетки из экспоненциальной культуры индикаторных стрептококков в бульоне Тодда Хьюита (Todd Hewitt) ресуспендируют в 0,067 М фосфатном буфере (рН 6,5) до исходного объема культуры. Порции частично очищенного саливарицина (16 УЕ/мл) или фосфатного буфера (контроль) смешивают с равным объемом суспензии промытых клеток и продолжают инкубацию при 37°С. Уровень выживания определяют через определенные интервалы времени при нанесении на чашки соответствующих 10-кратных разведений (в охлажденном бульоне Тодда Хьюита) исследуемых и контрольных смесей на основном агаре Columbia и при инкубировании при 37°С в течение 24 часов. Количество жизнеспособных клеток определяют как общее число КОЕ на мл.
Было показано, что препараты частично очищенного саливарицина В с титром 16 являются летальными для 99% КОЕ в эспоненциальных культурах штамма S. pyogenes FF22 в бульоне Тодда-Хьюита в течение 4 часов при 37°С. Тогда как частично очищенный препарат саливарицина А2 с титром 16 при испытании его в тех же условиях убивал менее 10% клеток штамма FF22.
Были проведены другие тесты по определению спектра ингибирования частично очищенных препаратов саливарицина А2 и саливарицина В с использованием описанного выше теста на агаровой поверхности. Капли (20 мкл) препарата с титром 16 УЕ/мл наносят в виде пятен на газонные культуры исследуемых штаммов, свежеинокулированных мазком на поверхность чашки с основным агаром Columbia в разведении 1/100 в насыщенном солевом растворе в течение 18 часов культурой указанного штамма в бульоне Тодда-Хьюита. Образование четкой зоны ингибирования роста испытуемого штамма при инкубировании указанных чашек при 37°С в течение 18 часов рассматривается как показатель чувствительности такого штамма к саливарицину.
Результаты приведены в Таблице.
Промышленная применимость
Показанные выше результаты демонстрируют ингибирующий и бактерицидный эффект саливарицина В и организмов, продуцирующих указанный БПИВ. Саливарицин В и/или организмы, которые его продуцируют, применимы в связи с этим в способах лечения индивидуумов от вредного эффекта стрептококковых инфекций в верхних дыхательных путях, включая ротовую полость. Указанные способы включают способы лечения состояний, таких как стрептококковая боль в горле (вызываемая преимущественно S. pyogenes) и кариес зубов (вызываемый частично S. sobrinus).
Предпочтительные согласно настоящему изобретению орально вводимые композиции представляют собой смеси лиофильно высушенных штаммов S. salivarius с порошком снятого молока или подобными агентами, в которые добавлены вкусовые вещества для улучшения вкуса.
Имеющиеся к настоящему времени данные показывают, что такие композиции эффективны при восстановлении посредством добавления воды и применении их три-четыре раза в течение дня, так чтобы в целом потреблялось 50 мл ароматизированного продукта (содержащего примерно 2×107 клеток/мл лиофильно высушенных организмов S. salivarius).
В случае выбора лиофильно высушенных штаммов S. salivarius, выбираемых из К12 и К30, имеется дополнительное преимущество, заключающееся в том, что саливарицин В экспрессируется вместе с саливарицином А2. Совместная экспрессия указанных БПИВ придает композиции особенно выраженный бактерицидный эффект против Streptococcus pyogenes и S. sobrinus, а также в отношении множества других бактерий.
Следует понимать, что приведенное выше описание дано с использованием примеров, которые следует понимать только как иллюстративные, и что возможны различные вариации как в материалах, так и в используемых методиках, которые известны специалистам в данной области техники. Область защиты ограничивается лишь приведенной формулой изобретения.





Изобретение относится к биотехнологии и касается антибактериального белка - саливарицина В, относящегося к лантибиотикам. Антибактериальный белок экспрессируется штаммом Streptococcus salivarius K12 (DSM №13084), имеет молекулярную массу приблизительно 2733 Да и содержит на N-конце аминокислотную последовательность (АП), представленную в SEQ ID NO:1, приведенную в описании или имеющий АП SEQ ID NO:3, обладает бактерицидной активностью в отношении S. pyogenes. Как белок, так и продуцирующий его микроорганизм могут быть использованы в качестве активных компонентов в антибактериальной и антибактериальной терапевтической композициях, при этом последняя может дополнительно содержать саливарицин А2 (АП SEQ ID No:5 приведена в описании). Описан также полинуклеотид, который кодирует белок (саливарицин В) и который может включать нуклеотидную последовательность (НП) SEQ ID No:2 (НП приведена в описании). Полинуклеотид может включать последовательность ДНК, кодирующую антибактериальный белок, которая является частью генома штамма K12 (DSM 13084). Описаны также штамм S. salivarius K12 (DSM 13084) и штамм S. salivarius К30 (DSM 13085) - продуценты белка саливарицина В. Полученный новый белок обладает как антибактериальной, так и бактерицидной активностью, что отличает его от известных саливарицинов А и А2. 6 н. и 23 з.п. ф-лы, 3 ил., 1 табл.
| US 3925160 А, 09.12.1975. |
Авторы
Даты
2006-07-10—Публикация
2000-10-12—Подача