По данной заявке испрашивается приоритет на основании предварительных заявок США 60/841365, поданной 30 августа 2006; 60/925513, поданной 20 апреля 2007, и 60/937782, поданной 28 июня 2007, которые во всей их полноте включены в описание посредством ссылок.
1. Область изобретения
Данное изобретение относится к 5-замещенным изоиндолиновым соединениям. Также раскрыты фармацевтические композиции, содержащие соединенияя, и способы лечения, профилактики и управления течением различных расстройств.
2. Предпосылки изобретения
2.1 Патобиология рака и других заболеваний
Рак, в первую очередь, характеризуется увеличением числа аномальных клеток, происходящих из данной нормальной ткани, инвазией этих аномальных клеток на соседние ткани или переносом злокачественных клеток лимфатической или кровеносной системой к периферическим лимфоузлам и к удаленным отделам (метастазирование). Клинические данные и молекулярные биологические исследования показывают, что рак является многостадийным процессом и начинается с незначительных пренеопластических изменений, которые, при определенных условиях, прогрессируют до неоплазии. Неопластическое повреждение может развиваться клонированием и развивать возрастающую способность к инвазии, росту, метастазированию и гетерогенности, особенно в условиях, при которых неопластические клетки ускользают из-под контроля иммунной система хозяина. Roitt, I., Brostoff, J. and Kale, D., Immunology, 17.1-17.12 (3rd ed., St. Louis, Mo., 1993).
Существует огромное разнообразие видов рака, которые подробно описаны в медицинской литературе. Примеры включают рак легких, прямой кишки, заднего прохода, простаты, груди, мозга и кишечника. Распространенность рака продолжает возрастать с общим старением населения, с появлением новых видов рака и с увеличением подверженности населения раку (например, люди, зараженные СПИД, или избыточно подвергающиеся солнечной радиации). Однако возможности выбора для лечения рака ограничены. Например, в случае различных видов рака крови (например, множественная миелома) доступны только немногие возможности выбора, особенно, если обычная химиотерапия не приводит к успеху, а трансплантация костного мозга не является выбором. Поэтому существует насущная потребность в новых способах и композициях, которые могут быть использованы для лечения пациентов, страдающих от рака.
Многие виды рака связаны с образованием новых кровеносных сосудов, с процессом, известным как ангиогенез. Были выявлены несколько механизмов, вовлеченных в индуцируемый раком ангиогенез. Самым непосредственным из этих механизмов является секреция раковыми клетками цитокинов, имеющих ангиогенетические свойства. Примерами таких цитокинов являются кислотные и основные факторы роста фибробластов (a,b-FGF), ангиогенин, фактор роста эндотелиальных сосудов (VEGF) и TNF-α. Альтернативно раковые клетки могут высвобождать ангиогенетические пептиды посредством продуцирования протеаз и последующего разрушения внешнеклеточного матрикса, когда некоторые цитокины накапливаются (например, b-FGF). Ангиогенез также может быть вызван косвенно посредством рекрутинга воспалительных клеток (особенно макрофагов) и последующего высвобождения ими ангиогенетических цитокинов (например, TNF-α, b-FGF).
Множество других заболеваний и расстройств связаны с нежелательным ангиогенезом или им характеризуются. Например, повышенный и неконтролируемый ангиогенез вовлечен в следующий ряд заболеваний и медицинских состояний, не ограничиваясь указанными: глазные неоваскулярные заболевания, хороидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки, рубеоз (неоваскуляризация угла глаза), вирусные заболевания, генетические заболевания, воспалительные заболевания, аллергические заболевания и аутоиммунные заболевания. Примеры таких заболеваний и состояний включают, без ограничения, диабетическую ретинопатию, ретинопатию недоношенных, отторжение трансплантата роговицы, неоваскулярную глаукому, ретролентальную фиброплазию, артрит и пролиферативную витреоретинопатию.
Соответственно, соединения, которые могут регулировать ангиогенез или ингибировать продуцирование некоторых цитокинов, включая TNF-α, могут оказаться полезными для лечения и профилактики различных заболеваний и состояний.
2.2 Способы лечения рака
Современное лечение рака может включать хирургию, химиотерапию, гормональную терапию и/или лучевое лечение для искоренения неопластических клеток у пациента (см., например, Stockdale, 1998, Medicine, vol. 3, Rubenstein and Federman, eds., Chapter 12, Section IV). С недавнего времени лечение рака также может включать биологическую терапию и иммунотерапию. Все указанные подходы имеют существенные недостатки для пациента. Хирургия может быть противопоказана по состоянию здоровья или может быть неприемлема для пациента. Кроме того, хирургия может не полностью удалить неопластическую ткань. Лучевая терапия эффективна только в том случае, если неопластическая ткань демонстрирует более высокую чувствительность к излучению, чем нормальная ткань. Лучевая терапия также часто может иметь серьезные побочные эффекты. Гормональную терапию редко проводят единственным агентом. Несмотря на то что гормональная терапия может быть эффективной, ее часто используют для предотвращения или отсрочки повторного появления рака после того, как другими видами лечения было удалено большинство раковых клеток. Биологические виды терапии и иммунотерапии немногочисленны и могут давать побочные эффекты, такие как сыпь и опухоли, симптомы, подобные гриппу, включая лихорадку, озноб и усталость, проблемы с пищеварительным трактом или аллергические реакции.
Что касается химиотерапии, существует ряд химиотерапевтических агентов, пригодных для лечения рака. Большинство противораковых химиотерапевтических агентов действуют, ингибируя синтез ДНК либо непосредственно, либо опосредованно путем ингибирования биосинтеза дезоксирибонуклеотидных трифосфатных предшественников для предотвращения репликации ДНК и последующего деления клеток (Gillman et al., Goodman and Gillman's: The Pharmacological Basis of Therapeutics, Tenth E. (McGraw Hill, New York).
Несмотря на доступность различных химиотерапевтических агентов, химиотерапия имеет множество недостатков. Stockdale, Medicine, vol. 3, Rubenstein and Federman, eds., Chapter 12, Section 10, 1998. Почти все химиотерапевтические агенты токсичны, и химиотерапия вызывает существенные, а зачастую опасные побочные эффекты, включая сильную тошноту, угнетение костного мозга и подавление иммунитета. Кроме того, даже при введении комбинаций химиотерапевтических агентов многие опухолевые клетки являются устойчивыми или у них развивается устойчивость к химиотерапевтическим агентам. Действительно, такие клетки, устойчивые к конкретным химиотерапевтическим агентам, используемым в соответствии с протоколом лечения, часто оказываются устойчивыми и к другим лекарствам, даже если такие агенты действуют по механизму, отличающемуся от такового для использованных лекарственных средств для данного лечения. Данное явление называют плеотропической или множественной лекарственной резистентностью. Вследствие лекарственной резистентности многие виды рака являются определенно невосприимчивыми к стандартным протоколам лечения химиотерапевтическими агентами или становятся таковыми.
Другие заболевания или состояния, связанные с нежелательным ангиогенезом или характеризуемые им, также трудно поддаются лечению. Однако были предложены некоторые соединения, такие как протамин, гепаин и стероиды, которые являются полезными для лечения некоторых конкретных заболеваний. Taylor et al., Nature 297:307 (1982); Folkman et al., Science 221:719 (1983); патенты США №№ 5001116 и 4994443.
До сих пор существует насущная потребность в эффективных способах лечения, профилактики и управления течением рака и других заболеваний и состояний, особенно для состояний, которые невосприимчивы к стандартным способам лечения, таким как хирургия, лучевая терапия, химиотерапия и гормональная терапия, с одновременным снижением или устранением токсичности и/или побочных эффектов, связанных с обычными видами терапии.
3. Краткое описание изобретения
Данное изобретение, в частности, направлено на 5-замещенные изоиндольные соединения и их фармацевтически приемлемые соли, сольваты (например, гидраты), пролекарства и стереоизомеры.
Данное изобретение также охватывает способы лечения и управления течением различных заболеваний и расстройств. Способы включают введение пациенту в целях такого лечения или управления течением заболевания терапевтически эффективного количества соединения по данному изобретению или его фармацевтически приемлемой соли, сольвата, стереоизомера или пролекарства.
Изобретение также охватывает способы профилактики различных заболеваний и расстройств, которые включают введение в целях такой профилактики пациенту профилактически эффективного количества соединения по данному изобретению или его фармацевтически приемлемой соли, сольвата, стереоизомера или пролекарства.
Изобретение также охватывает фармацевтические композиции, дискретные лекарственные формы, содержащие единицу дозы, режимы дозировки и наборы, которые включают соединение по данному изобретению или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер, клатрат или его пролекарство.
4. Подробное описание изобретения
В одном воплощении изобретение охватывает 5-замещенные изоиндольные соединения и их фармацевтически приемлемые соли, сольваты, стереоизомеры и пролекарства.
В другом воплощении данное изобретение охватывает способы лечения, управления течением и профилактики различных заболеваний и расстройств, которые включают введение пациенту в целях такого лечения или профилактики терапевтически или профилактически эффективного количества соединения по данному изобретению или его фармацевтически приемлемой соли, сольвата, стереоизомера или пролекарства. Примеры заболеваний и расстройств приведены в описании.
В частных воплощениях соединения по данному изобретению или их фармацевтически приемлемые соли, сольваты, стереоизомеры или пролекарства применяют в комбинации с другим лекарственным средством («вторым активным агентом») или лечением. Вторые активные агенты включают малые молекулы и большие молекулы (например, белки и антитела), примеры которых представлены в описании, так же как и стволовые клетки. Способы или терапии, которые могут быть использованы в комбинации с введением соединений по данному изобретению, включают, без ограничения, хирургию, переливания крови, иммунотерапию, биологическую терапию, лучевую терапию и другие нелекарственные виды терапии, используемые в настоящее время для лечения, профилактики и управления течением различных расстройств, раскрытых в описании.
Данное изобретение также охватывает фармацевтические композиции (например, лекарственные формы, содержащие единицу дозы), которые могут быть использованы в способах, раскрытых в описании. Конкретные фармацевтические композиции включают соединение данного изобретения или его фармацевтически приемлемую соль, сольват, стереоизомер или пролекарство и необязательно второй активный агент.
4.1. Соединения
В одном воплощении данное изобретение охватывает соединения формулы (I):
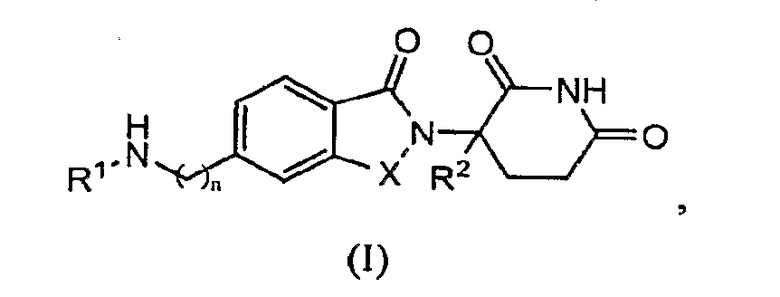
и их фармацевтически приемлемые соли, сольваты, стереоизомеры и пролекарства, в которых:
n равно 0 или 1;
Х представляет СН2, С=О или C=S;
R1 представляет:
а) -(CH2)mR3 или - СО(CH2)mR3, где
m равно 0, 1, 2 или 3; и
R3 представляет 5-10-членный арил или гетероарил, необязательно замещенный одним или несколькими галогенами;
b) -C=YR4, где
Y представляет О или S; и
R4 представляет:
(C1-C10)алкил; (C1-C10)алкокси;
(C0-C10)алкил-(5-10-членный гетероарил или гетероцикл), указанный гетероарил или гетероцикл необязательно замещен одним или несколькими заместителями из (C1-C6)алкила, галогена, оксо, (C1-C6)алкокси, или -Z-(C1-C6)алкила, где Z представляет S или SO2 и где указанный (C1-C6)алкил может быть необязательно замещен одним или несколькими галогенами;
(C0-C10)алкил-(5-10-членный арил), указанный арил необязательно замещен одним или несколькими заместителями из галогена; (C1-C6)алкокси, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкила, который сам необязательно замещен одним или несколькими галогенами; или -Z-(C1-C6)алкила, где Z представляет S или SO2 и где указанный (C1-C6)алкил может быть необязательно замещен одним или несколькими галогенами; или
(C1-C6)алкил-СО-О-R12, где R12 представляет Н или (C1-C6)алкил; или
с) -C=ZNHR6, где
Z представляет О или S; и
R6 представляет:
(C1-C10)алкил; (C1-C10)алкокси;
5-10-членный арил или гетероарил, необязательно замещеный одним или несколькими заместителями из галогена; циано; (C1-C6)алкилендиокси; (C1-C6)алкокси, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкил, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкилтио, который сам необязательно замещен одним или несколькими галогенами; и
R2 представляет Н или (C1-C6)алкил.
В одном частном воплощении данное изобретение охватывает соединения формулы (II):
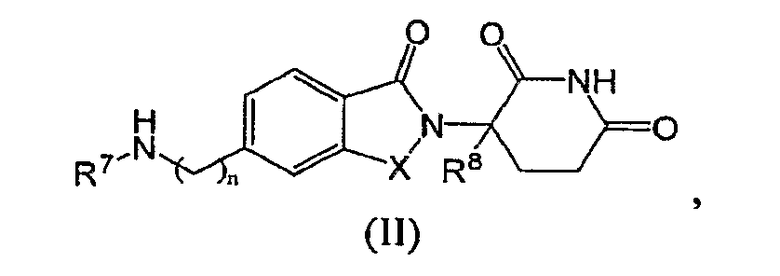
и их фармацевтически приемлемые соли, сольваты, стереоизомеры и пролекарства, в которых:
n равно 0 или 1;
Х представляет СН2 или С=О;
R7 представляет -(CH2)mR9, где m равно 0, 1, 2 или 3; и R9 представляет 5-10-членный арил или гетероарил, необязательно замещенный одним или несколькими галогенами; и
R8 представляет Н или (C1-C6)алкил.
В одном воплощении Х представляет С=О. В другом воплощении Х представляет СН2.
В одном воплощении n равно 0. В другом воплощении n равно 1.
В одном воплощении m равно 0. В другом воплощении m равно 1. В другом воплощении m равно 2. В другом воплощении m равно 3.
В одном воплощении R9 представляет 5-10-членный арил. В некоторых частных воплощениях R9 представляет фенил, необязательно замещенный одним или несколькими галогенами.
В одном воплощении R9 представляет 5-10-членный гетероарил. В некоторых частных воплощениях R9 представляет фурил или бензофурил.
В одном воплощении R8 представляет Н. В другом воплощении R8 представляет (C1-C6)алкил. В некоторых частных воплощениях R8 представляет метил.
Все комбинации указанных выше воплощений охватываются данным изобретением.
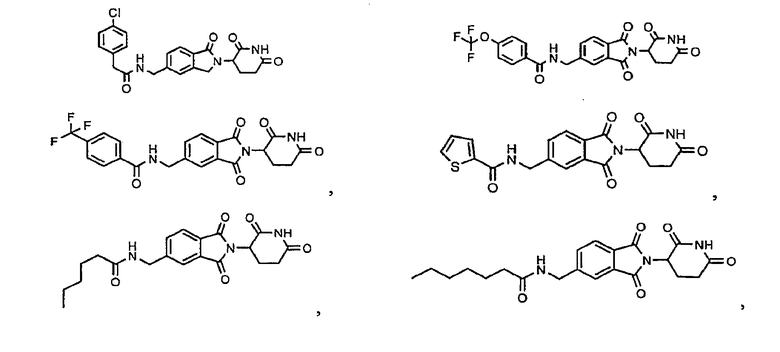
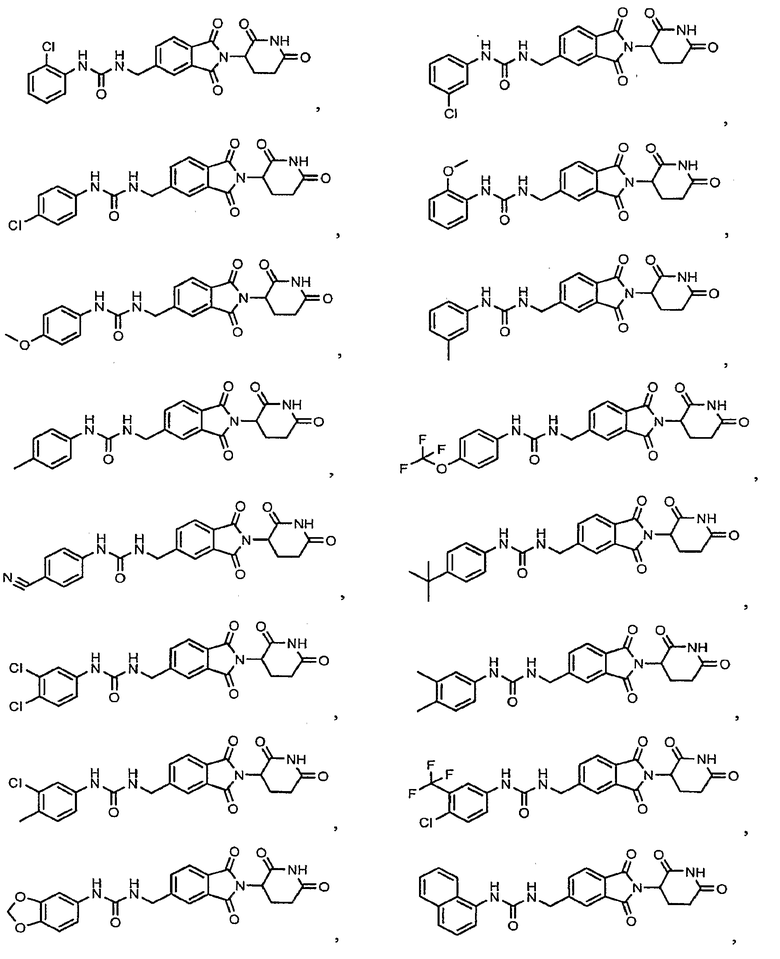
Примерами, включающими, но без ограничения, перечисленные выше соединения или их фармацевтически приемлемые соли, сольваты (например, гидраты), пролекарства или стереоизомеры, являются:
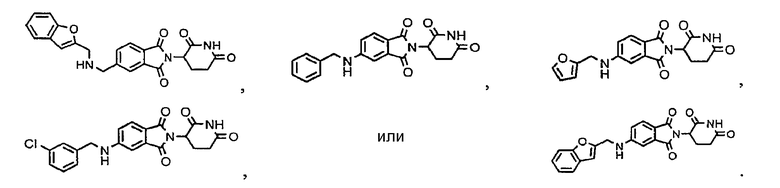
В другом воплощении данное изобретение охватывает соединения формулы (III):
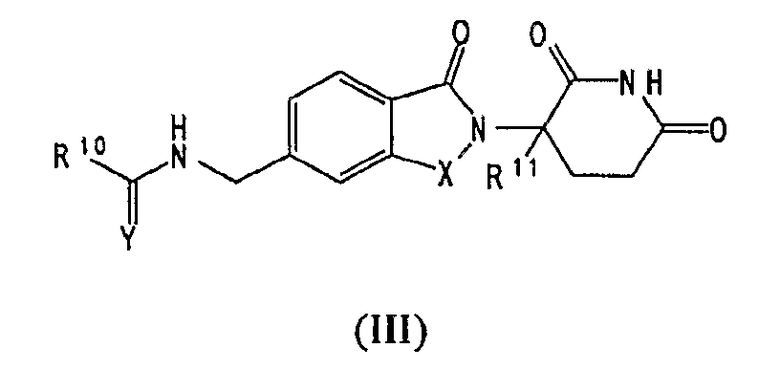 ,
,
и их фармацевтически приемлемые соли, сольваты, стереоизомеры и пролекарства, в которых:
Х представляет СН2 или С=О;
Y представляет O или S;
R10 представляет:
(C1-C10)алкил; (C1-C10)алкокси;
(C0-C10)алкил-(5-10-членный гетероарил или гетероцикл), указанный гетероарил или гетероцикл необязательно замещен одним или несколькими заместителями из (C1-C6)алкила, галогена, оксо, (C1-C6)алкокси, или -Z-(C1-C6)алкила, где Z представляет S или SO2 и где указанный (C1-C6)алкил может быть необязательно замещен одним или несколькими галогенами;
(C0-C10)алкил-(5-10-членный арил), указанный арил необязательно замещен одним или несколькими заместителями из галогена; (C1-C6)алкокси, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкила, который сам необязательно замещен одним или несколькими галогенами; или -Z-(C1-C6)алкила, где Z представляет S или SO2 и где указанный (C1-C6)алкил может быть необязательно замещен одним или несколькими галогенами; или
(C1-C6)алкил-СО-О-R12, где R12 представляет Н или (C1-C6)алкил; и
R11 представляет Н или (C1-C6)алкил.
В одном воплощении Х представляет СН2. В другом воплощении Х представляет С=О.
В одном воплощении Y представляет O. В другом воплощении Y представляет S.
В одном воплощении R10 представляет (C1-C10)алкил. В некоторых частных воплощениях R10 представляет (C5-C10)алкил. В некоторых частных воплощениях R10 представляет пентил или гексил.
В одном воплощении R10 представляет (C1-C10)алкокси. В некоторых частных воплощениях R10 представляет (C5-C10)алкокси. В некоторых частных воплощениях R10 представляет пентилокси или гексилокси.
В одном воплощении R10 представляет 5-10-членный гетероарил. В некоторых частных воплощениях R10 представляет тиофенил или фурил.
В одном воплощении R10 представляет 5-10-членный арил, необязательно замещенный одним или несколькими галогенами. В некоторых частных воплощениях R10 представляет фенил, необязательно замещенный одним или несколькими галогенами.
В одном воплощении R10 представляет 5-10-членный арил или гетероарил, необязательно замещенный (C1-C6)алкилом или (C1-C6)алкокси, которые сами необязательно замещены одним или несколькими галогенами. В некоторых частных воплощениях R10 представляет фенил, замещенный (C1-C3)алкилом или (C1-C6)алкокси, замещенными одним или несколькими галогенами. В некоторых частных воплощениях R10 представляет фенил, замещенный метилом или метокси, замещенными 1, 2 или 3 галогенами.
В одном воплощении R10 представляет арил или гетероарил, замещенный -S-(C1-C6)алкилом, где указанный алкил сам необязательно замещен одним или несколькими галогенами. В другом воплощении R10 представляет арил или гетероарил, замещенный -SO2-(C1-C6)алкилом, где указанный алкил сам необязательно замещен одним или несколькими галогенами.
В одном воплощении R10 представляет (C1-C6)алкил-СО-О-R12, где R12 представляет (C1-C6)алкил. В одном частном воплощении R10 представляет бутил-СО-О-tBu.
В одном воплощении R10 представляет (C1-C6)алкил-СО-О-R12, где R12 представляет Н. В одном частном воплощении R10 представляет бутил-СООН.
В одном воплощении R11 представляет Н. В другом воплощении R11 представляет (C1-C6)алкил. В некоторых частных воплощениях R11 представляет метил.
Все комбинации указанных выше воплощений охватываются данным изобретением.
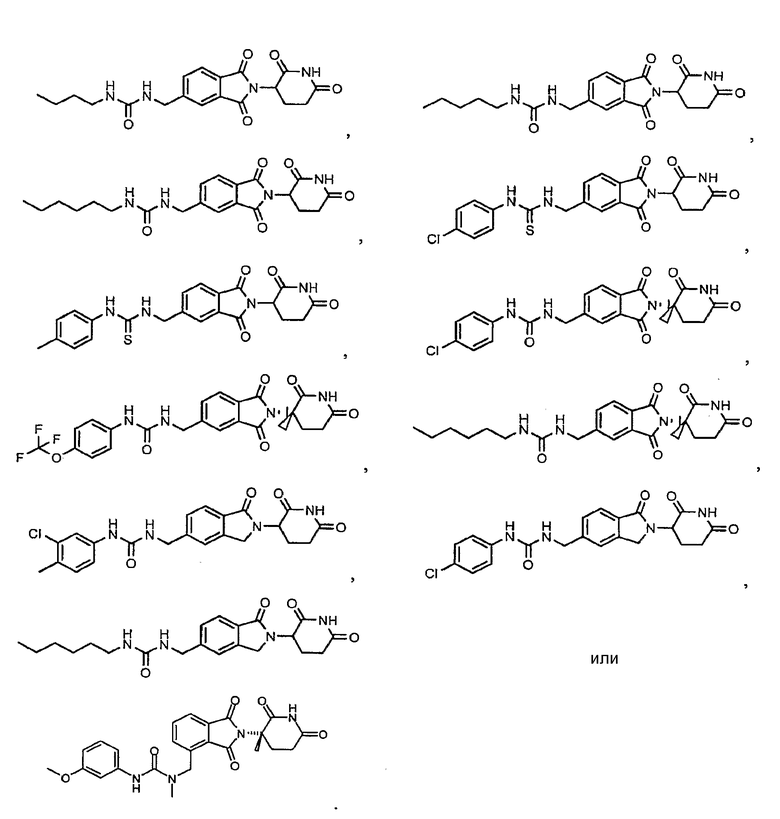
Примерами, включающими, но без ограничения, перечисленные выше соединения или их фармацевтически приемлемые соли, сольваты (например, гидраты), пролекарства или стереоизомеры, являются:
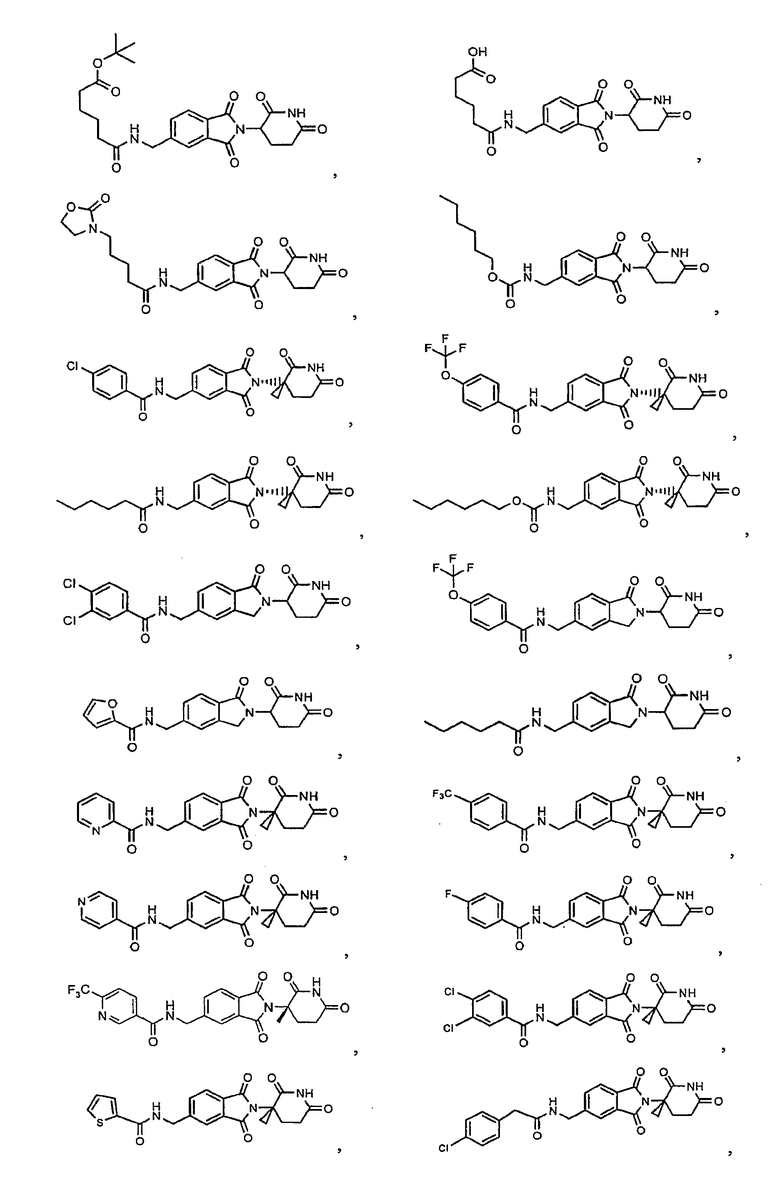
В другом воплощении данное изобретение охватывает соединения формулы (IV):
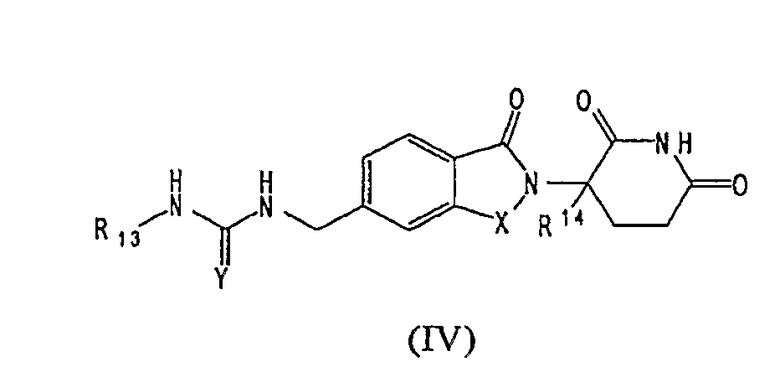 ,
,
и их фармацевтически приемлемые соли, сольваты, стереоизомеры и пролекарства, в которых:
Х представляет СН2 или С=О;
Y представляет O или S;
R13 представляет:
(C1-C10)алкил; (C1-C10)алкокси;
5-10-членный арил или гетероарил, необязательно замещенный одним или несколькими заместителями из галогена, циано, (C1-C6)алкилендиокси; (C1-C6)алкокси, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкила, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкилтио, который сам необязательно замещен одним или несколькими галогенами; и
R14 представляет Н или (C1-C6)алкил.
В одном воплощении Х представляет СН2. В другом воплощении Х представляет С=О.
В одном воплощении Y представляет O. В другом воплощении Y представляет S.
В одном воплощении R13 представляет (C1-C10)алкил. В некоторых частных воплощениях R13 представляет (C1-C6)алкил. В некоторых частных воплощениях R13 представляет пропил, бутил пентил или гексил.
В одном воплощении R13 представляет (C1-C10)алкокси.
В одном воплощении R13 представляет 5-10-членный арил или гетероарил, необязательно замещенный циано. В некоторых частных воплощениях R13 представляет фенил, необязательно замещенный циано.
В одном воплощении R13 представляет 5-10-членный арил или гетероарил, необязательно замещенный (C1-C6)алкилендиокси. В некоторых частных воплощениях R13 представляет фенил, необязательно замещенный метилендиокси.
В одном воплощении R13 представляет 5-10-членный арил или гетероарил, необязательно замещенный одним или несколькими галогенами. В некоторых частных воплощениях R13 представляет фенил, необязательно замещенный одним или несколькими галогенами.
В одном воплощении R13 представляет 5-10-членный арил или гетероарил, необязательно замещенный (C1-C6)алкилом или (C1-C6)алкокси, которые сами необязательно замещены одним или более галогенами. В некоторых частных воплощениях R13 представляет фенил, необязательно замещенный метилом или метокси, которые сами необязательно замещены 1, 2 или 3 галогенами.
В одном воплощении R13 представляет 5-10-членный арил или гетероарил, необязательно замещенный (C1-C6)алкилтио, который сам необязательно замещен одним или несколькими галогенами.
В одном воплощении R14 представляет Н. В другом воплощении R14 представляет (C1-C6)алкил. В некоторых частных воплощениях R14 представляет метил.
Все комбинации указанных выше воплощений охватываются данным изобретением.
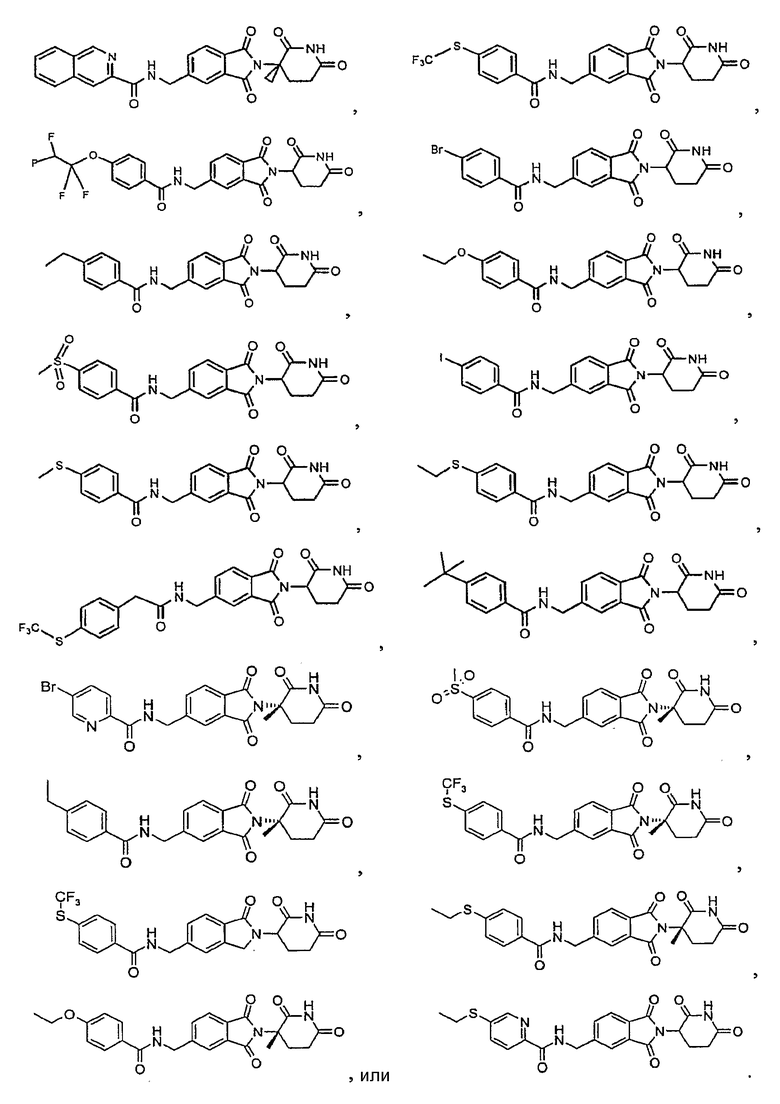
Примерами, включающими, но без ограничения, перечисленные выше соединения или их фармацевтически приемлемые соли, сольваты (например, гидраты), пролекарства или стереоизомеры, являются:
Используемый здесь термин «фармацевтически приемлемая соль», если не указано иного, относится к солям, полученным из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Подходящие нетоксичные кислоты включают неорганические и органические кислоты, такие как, без ограничения, уксусная, альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этансульфоновая, муравьиная, фумаровая, фуровая, глюконовая, глутамовая, глюкореновая, галактуроновая, глицидиловая, бромистоводородная, хлористоводородная, изетионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, муконовая, азотная, памовая, пантотеновая, фенилуксусная, пропионовая, фосфорная, салициловая, стеариновая, янтарная, сульфаниловая, серная, винная, п-толуолсульфоновая и тому подобные. Подходящими являются бромистоводородная, хлористоводородная, фосфорная и серная кислоты.
Используемый здесь термин «сольват», если не указано иного, обозначает соединение по данному изобретению или его соль, которое дополнительно включает стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами. Если растворителем является вода, то сольват является гидратом.
Используемый здесь термин «пролекарство», если не указано иного, обозначает производное соединения, которое способно гидролизоваться, окисляться или иным образом реагировать в биологических условиях (in vitro или in vivo) с образованием соединения. Примеры пролекарств включают, но без ограничения, соединения, которые содержат биологически гидролизуемые фрагменты, такие как биологически гидролизуемые амидные, биологически гидролизуемые сложноэфирные, биологически гидролизуемые карбаматные, биологически гидролизуемые карбонатные, биологически гидролизуемые уреидные и биологически гидролизуемые фосфатные аналоги. Другие примеры пролекарств включают соединения, которые содержат фрагменты -NO, -NO2, -ONO или -ONO2. Пролекарства обычно могут быть получены с применением хорошо известных способов, таких как описанные в Burger's Medicinal Chemistry and Drug Discovery, 172-178, 949-982 (Manfred E. Wolff ed., 5th ed., 1995) и Design of Prodrugs (H. Bundgaard ed., Elsevier, New York, 1985).
Используемые здесь термины «биологически гидролизуемый карбамат», «биологически гидролизуемый карбонат», «биологически гидролизуемый уреид» и «биологически гидролизуемый фосфат», если не указано иного, обозначают соответственно карбамат, карбонат, уреид и фосфат соединения, которые: 1) не влияют на биологическую активность соединения, но могут улучшить такие преимущественные свойства соединения in vivo, как всасываемость, продолжительность действия и время до начала действия, или 2) являются биологически неактивными, но превращаются in vivo в биологически активное соединение. Примеры биологически гидролизуемых карбаматов включают, но без ограничения, низшие алкиламины, замещенные этилендиамины, аминокислоты, гидроксиалкиамины, гетероциклические и гетероароматические амины и полиэфирамины.
Используемый здесь термин «стереоизомер», если не указано иного, охватывает все энантиомерно/стереоизомерно чистые и энантиомерно/стереоизомерно обогащенные соединения по данному изобретению.
Используемый здесь термин «стереоизомерно чистый», если не указано иного, обозначает композицию, которая содержит один стереоизомер соединения и является по существу свободной от других стереоизомеров данного соединения. Например, стереоизомерно чистая композиция соединения, имеющего один хиральный центр, должна быть свободной от противоположного энантиомера соединения. Стереоизомерно чистая композиция соединения, имеющего два хиральных центра, должна быть свободной от других диастереомеров соединения. Обычно стереоизомерно чистое соединение содержит более 80% по массе одного стереоизомера соединения и менее 20% по массе других стереоизомеров соединения, более предпочтительно - более 90% по массе одного стереоизомера соединения и менее 10% по массе других стереоизомеров соединения, еще более предпочтительно - более 95% по массе одного стереоизомера соединения и менее 5% по массе других стереоизомеров соединения, и наиболее предпочтительно - более 97% по массе одного стереоизомера соединения и менее 3% по массе других стереоизомеров соединения.
Используемый здесь термин «стереоизомерно обогащенный», если не указано иного, обозначает композицию, которая содержит более приблизительно 55% по массе одного стереоизомера соединения, более приблизительно 60% по массе одного стереоизомера соединения, предпочтительно - более приблизительно 70% по массе одного стереоизомера соединения, более предпочтительно - более приблизительно 80% по массе одного стереоизомера соединения.
Используемый здесь термин «энантиомерно чистый», если не указано иного, обозначает стереоизомерно чистую композицию соединения, имеющего один хиральный центр. Подобным образом, термин «энантиомерно обогащенный» обозначает стереоизомерно обогащенную композицию соединения, имеющего один хиральный центр.
Используемый здесь термин «алкил», если не указано иного, относится к насыщенному углеводороду с нормальной или разветвленной цепью, имеющему указанное для него число атомов углерода. Представители насыщенных алкилов с нормальной цепью включают метил, этил, н-пропил, н-бутил, н-пентил и н-гексил; тогда как насыщенные алкилы с разветвленной цепью включают изопропил, втор-бутил, изобутил, трет-бутил, изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил и подобные. Термин «алкил» также охватывает циклоалкил.
Используемый здесь термин «циклоалкил», если не указано иного, обозначает тип алкила, содержащего от 3 до 15 углеродных атомов без чередования или резонанса двойных связей между углеродными атомами. Он может содержать от 1 до 4 колец. Примеры незамещенных циклоалкилов включают, но без ограничения, циклопропил, циклобутил, циклопентил, циклогексил и адамантил. Циклоалкил может быть замещен одним или более заместителями, как определено ниже.
Используемый здесь термин «алкокси», если не указано иного, относится к -О-(алкилу), где алкил определен в описании. Примеры алкокси включают, но без ограничения, -ОСН3, -ОСН2СН3, -О(CH2)2CH3, -О(CH2)3CH3, -О(CH2)4CH3 и -О(CH2)5CH3.
Используемый здесь термин «арил», если не указано иного, обозначает карбоциклическое ароматическое кольцо, содержащее от 5 до 14 атомов в кольце. Все атомы в кольце карбоциклической ароматической группы являются атомами углерода. Арильные кольцевые структуры включают соединения, имеющие одну или несколько кольцевых структур, такие как моно-, би- или трициклические соединения, равно как и бензоконденсированные карбоциклические фрагменты, такие как 5,6,7,8-тетрагидронафтил и подобные. Представители арильных групп включают фенил, антраценил, флуоренил, инденил, азуленил, фенантренил и нафтил.
Используемый здесь термин «гетероарил», если не указано иного, обозначает ароматическое кольцо, содержащее от 5 до 14 атомов в кольце, среди которых, по меньшей мере, один (например, один, два или три) является гетероатомом (например, азотом, кислородом или серой). Гетероарильные кольцевые структуры включают соединения, имеющие одну или более кольцевых структур, такие как моно-, би- или трициклические соединения, равно как и конденсированные гетероциклические фрагменты. Примеры гетероарилов включают, но без ограничения, триазолил, тетразолил, оксадиазолил, пиридил, фурил, бензофуранил, тиофенил, тиазолил, бензотиофенил, бензоизоксазолил, бензоизотиазолил, хинолинил, изохинолинил, пирролил, индолил, оксазолил, бензоксазолил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изоксазолил, пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, циннолинил, фталазинил, хиназолинил, бензохиназолинил, хиноксалинил, акридинил, пиримидил, оксазолил, бензо[1,3]диоксол и 2,3-дигидробензо[1,4]диоксин.
Используемый здесь термин «гетероцикл», если не указано иного, обозначает моноциклическое или полициклическое кольцо, содержащее атомы углерода и водорода, необязательно имеющее 1 или 2-кратные связи, и атомы кольца содержат, по меньшей мере, один гетероатом, в частности - от 1 до 3 гетероатомов, независимо выбранных из азота, кислорода и серы. Гетероциклические кольцевые структуры включают, не без ограничения, моно-, би- или трициклические соединения. Частными случаями гетероциклов являются моноциклические или бициклические. Представители гетероциклов включают морфолинил, пирролидинонил, пирролидинил, пиперидинил, пиперазинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил и тетрагидротиопиранил. Гетероциклическое кольцо может быть незамещенным или замещенным.
Используемый здесь термин «гетероциклоалкил», если не указано иного, относится к циклоалкильной группе, в которой, по меньшей мере, один из атомов углерода в кольце заменен на гетероатом (например, O, S или N).
Следует отметить, что если существует расхождение между изображенной структурой и названием, данным такой структуре, то изображенная структура имеет большее значение. Кроме того, если стереохимия структуры или части структуры не указана, например, жирными или пунктирными линиями, то структуру или часть структуры рассматривают как охватывающую все ее стереоизомеры.
4.2 Способы лечения, профилактики и управления течением заболевания
Изобретение охватывает способы лечения, профилактики и/или управления течением различных заболеваний с применением соединения данного изобретения или его фармацевтически приемлемой соли, сольвата, стереоизомера или пролекарства.
Примеры заболеваний или расстройств включают, но без ограничения, рак, расстройства, связанные с ангиогенезом, боль, включая сложный региональный болевой синдром (CRPS), дегенерацию желтого пятна (MD) и родственные синдромы, кожные заболевания, легочные заболевания, расстройства, вызванные асбестом, паразитарные заболевания, расстройства с иммунодефицитом, расстройства ЦНС, повреждения ЦНС, атеросклероз и родственные расстройства, расстройства сна и родственные расстройства, гемоглобинопатию и родственные расстройства (например, анемию), расстройства, связанные с TNFα, и другие различные заболевания и расстройства.
Используемые здесь термины «лечить» и «лечение», если не указано иного, относятся к искоренению или улучшению течения заболевания или расстройства, или одного или более симптомов, связанных с заболеванием или расстройством. В определенных воплощениях термины относятся к минимизации распространения или ухудшения заболевания или расстройства, происходящей вследствие введения одного или более профилактических или терапевтических агентов пациенту, имеющему такое заболевание или расстройство.
Используемые здесь термины «предотвращать», «предотвращение» и «профилактика», если не указано иного, относятся к предотвращению начала, повторного возникновения или распространения заболевания или расстройства или одного или более его симптомов.
Используемые здесь термины «управлять течением» и «управление течением», если не указано иного, относятся к предотвращению или замедлению прогрессирования, распространения или ухудшения заболевания или расстройства или одного или более его симптомов. Зачастую благоприятные эффекты профилактического или терапевтического агента, которые достигаются у пациента, не приводят к излечению заболевания или расстройства.
Используемое здесь выражение «терапевтически эффективное количество» соединения, если не указано иного, определяет количество, достаточное для обеспечения терапевтического эффекта при лечении или управлении течением заболевания или расстройства или для отсрочки проявления или минимизации одного или нескольких симптомов, связанных с заболеванием или расстройством. Терапевтически эффективное количество соединения означает количество терапевтического агента в отдельности или в комбинации с другими видами терапии, которое обеспечивает терапевтический эффект при лечении или управлении течением заболевания или расстройства. Термин «терапевтически эффективное количество» может охватывать количество, которое улучшает общую терапию, позволяет уменьшить или избежать симптомов или причин заболевания или расстройства или повышает терапевтическую эффективность другого терапевтического агента.
Используемое здесь выражение «профилактически эффективное количество» соединения, если не указано иного, определяет количество, достаточное для предотвращения заболевания или расстройства или для предотвращения его повторного проявления. Профилактически эффективное количество соединения означает количество терапевтического агента в отдельности или в комбинации с другими агентами, которое обеспечивает профилактический эффект при предотвращении заболевания. Термин «профилактически эффективное количество» может охватывать количество, которое улучшает общую профилактику или повышает профилактическую эффективность другого профилактического агента.
В одном воплощении соединения, представленные в описании, применяют для лечения, профилактики и/или управления течением рака или предраковых состояний. Как раскрыто в описании, без ограничения какой-либо частной теорией и если не указано иное, было установлено, что некоторые соединения, представленные в описании, проявляют антипролиферативные эффекты на различных раковых клетках, что обнаружено методами, как указанными в описании, так и известными из уровня техники. Примеры раковых клеток включают, но без ограничения, Namalwa, HN 5q (оральную карциному), НТ-1080 (фибросаркому), SK-MES-1 (5q, легкие), U87MG (глиобластому, астроцитому), T98G (мутант р53, глиобластому), SH-SY5Y (нейробластому), SK-N-MC (нейробластому), РС-3 (простата), MCF-7 (грудь), T-47D (грудь), SF-268 (ЦНС), НСТ-116 (прямая кишка), 786-О (почки), АН98 (почки), SN12C (почки), ТК-10 (почки), CCRF-CEM (лейкемию), HL-60 (лейкемию), К0562 (лейкемию), А549 (легкие), Нор 92 (легкие), NCI-H1650 (легкие), NCI-H522 (легкие), GRANTA-519 (лимфому покровных клеток), REC-1 (лимфому покровных клеток), Malme-3M (меланому), MDA-MB-435 (меланому), SK-MEL-28 (меланому), M14 (меланому), SK-MEL-2 (меланому), U266B1 (множественную миелому), KARPAS-1106P (неходжкинскую лимфому), KARPAS-422 (неходжкинскую лимфому), OCI-LY-19 (неходжкинскую лимфому), WSU-DLCL2 (неходжкинскую лимфому).
Примеры раковых и предраковых состояний включают, но без ограничения, описанные в патентах США №№ 6281230 и 5635517, выданных Мюллеру с сотр., в различных патентных публикациях Зелдиса в США, включая публикацию 2004/0220144А1, опубликованную 4 ноября 2004 года (лечение миелодиспластического синдрома), 2004/0029832А1 опубликованную 12 февраля 2004 года (лечение различных типов рака) и 2004/0087546, опубликованную 6 мая 2004 года (лечение миелопролиферативных заболеваний). Примеры также включают раскрытое в РСТ/US04/14004, поданной 5 мая 2004 года. Все указанные источники включены в данное описание во всей их полноте посредством ссылок.
Частные примеры рака включают, но без ограничения, различные виды рака кожи, такие как меланома, лимфатического узла, груди, шейки матки, матки, желудочно-кишечного тракта, легких, яичников, простаты, прямой кишки, заднего прохода, ротовой полости, мозга, головы и шеи, горла, яичек, почек, поджелудочной железы, костей, селезенки, печени, мочевого пузыря, гортани, носовых ходов, и рак, связанный со СПИДом. Соединения особенно полезны для лечения видов рака крови и костного мозга, таких как множественная миелома и острые и хронические лейкемии, например, лимфобластические, миелогенные, лимфоцитарные и миелоцитарные лейкемии. Соединения по изобретению могут быть применены для лечения, профилактики и управления течением как первичных, так и метастатических опухолей.
Другие частные виды рака включают, но без ограничения, развитую злокачественность, амилоидоз, нейробластому, менингиому, гемангиоперицитому, множественные метастазы в мозгу, мультиформную глиобластому, глиобластому, глиому мозгового ствола, злокачественные опухоли мозга с плохим прогнозом, злокачественную глиому, возвратную злокачественную глиому, анапластическую астроцитому, анапластическую олигодендроглиому, нейроэндокринный рак, ректальную аденокарциному, колоректальный рак Дюка C и D, неоперабельную колоректальную карциному, метастатическую карциному клеток печени, саркому Капоши, острую каротипную миелобластическую лейкемию, хроническую лимфоцитарную лейкемию (CLL), лимфому Ходжкина, неходжкинскую лимфому, кожную Т-клеточную лимфому, кожную В-клеточную лимфому, диффузную лимфому тучных В-клеток, неразвитую фолликулярную лимфому, метастатическую меланому (локализованную меланому, включая, но без ограничения, глазную меланому), злокачественную мезотелиому, злокачественный плевральный эффузный мезотелиоматический синдром, перитонеальную карциному, папиллярную серозную карциному, гинекологическую саркому, саркому мягких тканей, склеродерму, кожный васкулит, гистоцитоз клеток Лангерганса, лейомиосаркому, костную прогрессирующую фибродисплазию, рак простаты, не поддающийся гормональной терапии, оперированную саркому мягких тканей с высоким риском, неоперабельную карциному клеток печени, макроглобулинемию Вальденстрома, вялотекущую миелому, безболезненную миелому, рак фаллопиевых труб, рак простаты, не зависящий от андрогенов, неметастатический рак простаты IV стадии, зависящий от андрогенов, рак простаты, невосприимчивый к химиотерапии, папиллярную тироидную карциному, фолликулярную тироидную карциному, медуллярную тироидную карциному и лейомиому. В частном воплощении рак невосприимчив или резистентен к химиотерапии или облучению.
В одном частном воплощении данное изобретение охватывает способы лечения, профилактики или управления течением различных форм лейкемии, таких как хроническая лимфоцитарная лейкемия, хроническая миелоцитарная лейкемия, острая лимфобластическая лейкемия, острая миелогенная лейкемия и острая миелобластическая лейкемия, включая лейкемии, которые имеют рецидив, невосприимчивы или резистентны, что описано в патентной публикации США № 2006/0030594, опубликованной 9 февраля 2006 года, которая включена во всей ее полноте посредством ссылки.
Термин «лейкемия» относится к злокачественным новообразованиям в кроветворных тканях. Лейкемия включает, но без ограничения, хроническую лимфоцитарную лейкемию, хроническую миелоцитарную лейкемию, острую лимфобластическую лейкемию, острую миелогенную лейкемию и острую миелобластическую лейкемию. Лейкемия может иметь рецидив, быть невосприимчивой или резистентной к обычной терапии. Термин «иметь рецидив» относится к ситуации, при которой у пациента, вошедшего перед этим в стадию ремиссии лейкемии после терапии, в костном мозге наблюдают возврат лейкемических клеток и снижение уровня нормальных кровяных клеток. Термин «невосприимчивый или резистентный» относится к обстоятельствам, в которых пациенты, даже после интенсивного лечения, имеют остаточные лейкемические клетки в костном мозге.
В другом частном воплощении данное изобретение охватывает способы лечения, профилактики и управления течением различных лимфом, включая неходжкинскую лимфому (NHL). Термин «лимфома» относится к разнородной группе новообразований, возникающих в ретикулоэндотелиальной и лимфатической системах. «NHL» относится к злокачественной моноклональной пролиферации лимфоидных клеток в отделах иммунной системы, включая лимфатические узлы, костный мозг, селезенку, печень и желудочно-кишечный тракт. Примеры NHL включают, но без ограничения, лимфому покровных клеток, MCL, среднедифференцированную лимфоцитарную лимфому, промежуточную лимфоцитарную лимфому, ILL, диффузную слабодифференцированную лимфоцитарную лимфому, PDL, центроцитарную лимфому, диффузную лимфоцитарную лимфому с малорасщепленными клетками, DSCCL, фолликулярную лимфому и любой тип лимфомы покровных клеток, который можно наблюдать под микроскопом (узелковую, диффузную, бластическую и лимфому покровной зоны).
Примеры заболеваний и расстройств, связанных с нежелательным ангиогенезом или характеризующихся им, включают, но без ограничения, воспалительные заболевания, аутоиммунные заболевания, вирусные заболевания, генетические заболевания, аллергические заболевания, бактериальные заболевания, глазные неоваскулярные заболевания, хороидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки и рубеоз (неоваскуляризацию угла глаза). Частные примеры заболеваний и расстройств, связанных с нежелательным ангиогенезом или характеризующихся им, включают, но без ограничения, эндометриоз, болезнь Крона, сердечную недостаточность, развитую сердечную недостаточность, поражение почек, эндотоксемию, синдром токсического шока, остеоартрит, репликацию ретровирусов, истощение, менингит, фиброз, вызванный кремнеземом, фиброз, вызванный асбестом, ветеринарные расстройства, гиперкальцемию, связанную со злокачественностью, удар, циркуляторный шок, периодонтит, гингивит, макроцитарную анемию, невосприимчивую анемию и синдром удаления 5q.
Примеры боли включают, но без ограничения, описанные в патентной публикации США 2005/0203142, опубликованной 15 сентября 2005 года, которая включена в описание посредством ссылки. Частные примеры боли включают, но без ограничения, злокачественную боль, невропатическую боль, смешанную ноцицептивную и невропатическую боль, боль во внутренних органах, мигрень, головную боль и послеоперационную боль.
Примеры ноцицептивной боли включают, но без ограничения, боль, связанную с химическими или термическими ожогами, порезами кожи, ушибами кожи, остеоартритом, ревматоидным артритом, тендонитом и миофасциальную боль.
Примеры невропатической боли включают, но без ограничения, CRPS типа 1, CRPS типа 2, рефлексную симпатическую дистрофию (RSD), рефлексную нейроваскулярную дистрофию, рефлексную дистрофию, симпатически-поддерживаемый болевой синдром, каузалгию, костную атрофию Зюдека, алгонейродистрофию, синдром плечевой руки ( shoulder hand ), посттравматическую дистрофию, тригеминальную невралгию, постгерпетическую невралгию, боль, связанную с раком, фантомную боль в конечности, фибромиалгию, синдром хронической усталости, боль при повреждении позвоночника, центральную боль после удара, радикулопатию, диабетическую невропатию, боль после удара, сифилитическую невропатию и другие болевые невропатические состояния, в частности - индуцируемые лекарствами, такими как винкристин и велкад.
Используемые здесь термины «комплексный региональный болевой синдром», «CRPS» и «синдромы, относящиеся к CRPS», если не указано иного, обозначают хроническое болевое расстройство, характеризуемое одним или более из перечисленного ниже: боль, спонтанная или вызываемая чем-либо, включая аллодинию (болезненный ответ на раздражитель, который обычно не является болевым) и гипералгезию (избыточный ответ на раздражитель, который обычно является умеренно болевым); боль, несоразмерная с вызывающим ее событием (например, годы сильной боли после растяжения связок в лодыжке); региональная боль, которая не ограничивается единственным периферическим нервным скоплением, и самостоятельное нарушение (например, сыпь, изменения кровотока и гипергидроз), связанные с трофическими изменениями кожи (аномалии роста волос и ногтей и изъязвления кожи).
Примеры дегенерации желтого пятна (MD) и связанных синдромов включают, но без ограничения, описанные в патентной публикации США № 2004/0091455, опубликованной 13 мая 2004 года, которая включена в описание посредством ссылки. Частные примеры включают, но без ограничения, атрофическую (сухую) MD, экссудативную (влажную) MD, возрастную макулопатию (ARM), хороидальную неоваскуляризацию (CNVM), отслоение пигментного эпителия сетчатки (PED) и атрофию пигментного эпителия сетчатки (RPE).
Примеры кожных заболеваний включают, но без ограничения, описанные в патентной публикации США № 2005/0214328А1, опубликованной 29 сентября 2005 года, которая включена в описание посредством ссылки. Частные примеры включают, но без ограничения, кератозы и родственные симптомы, заболевания или нарушения кожи, характеризуемые избыточным ростом эпидермиса, акне и морщинами.
Используемый здесь термин «кератоз», если не указано иного, относится к любому поражению эпидермиса, отмеченному присутствием очерченного избыточного роста рогового слоя, включая, но без ограничения, актиничный кератоз, себорейный кератоз, кератоакантому, фолликулярный кератоз (болезнь Дериера), обращенный фолликулярный кератоз, пальмоплантарную кератодерму (РРК, пальмарный и плантарный кератоз), пилярный кератоз и кератоз, похожий на штукатурку. Термин «актиничный кератоз» также относится к старческому кератозу, старческой бородавке, плоской старческой бородавке, солнечному кератозу, кератодерме или кератоме. Термин «себорейный кератоз» также относится к себорейной бородавке, старческой бородавке или базальноклеточной папилломе. Кератоз характеризуется одним или более из следующих симптомов: грубым внешним видом, чешуйчатыми эритематозными узелками, бляшками, спикулами и узелковыми утолщениями на пораженных поверхностях (например, лице, руках, ушах, шее, ногах и груди), образования кератина называют кожными ороговениями, гиперкератозом, телангиэктазом, эластозом, пигментированными выпуклостями, акантозом, паракератозом, дискератозом, папилломатозом, гиперпигментацией базальных клеток, клеточной атипией, митозными фигурами, аномальной межклеточной адгезией, плотными воспалительными инфильтратами и незначительным преобладанием сквамозно-клеточных карцином.
Примеры кожных заболеваний или расстройств, характеризуемые избыточным ростом эпидермиса, включают, но без ограничения, заболевания или расстройства, отмеченные наличием избыточного роста эпидермиса, включая, но без ограничения, инфекции, связанные с вирусом папиллом, мышьяковый кератоз, знаки Лесера-Трела, бородавчатую дискератому (WD), пучкообразные волосы (TS), изменчивую эритрокератодермию (EKV), сывороточный ихтиоз (ихтиоз арлекино), подушки на суставах пальцев, кожную меланоакантому, порокератоз, псориаз, сквамозно-клеточную карциному, слитный и сетчатый папилломатоз (CRP), акрохордоны, кожное ороговение, болезнь Коудена (синдром множественной гамартомы), черный папулозный дерматоз (DPN), синдром эпидермального невуса (ENS), обычный ихтиоз, контагиозный моллюск, узловатую почесуху и чернеющий акантоз (AN).
Примеры легочных расстройств включают, но без ограничения, описанные в публикации US 2005/0239842A1, опубликованной 27 октября 2005 года, которая включена в описание посредством ссылки. Частные примеры включают легочную гипертензию и родственные расстройства. Примеры легочной гипертензии и родственных расстройств включают, но без ограничения, первичную легочную гипертензию (РРН), вторичную легочную гипертензию (SPH), семейную РРН, спорадическую РРН, прекапиллярную легочную гипертензию, легочную артериальную гипертензию (РАН), гипертензию легочной артерии, идиопатическую легочную гипертензию, тромботическую легочную артериопатию (ТРА), плексогенную легочную артериопатию, функциональные классы легочной гипертензии с I по IV или легочную гипертензию, связанную или вторично возникающую при дисфункции левого желудочка, заболевание митрального клапана, стягивающий перикардит, стеноз аорты, кардиомиопатию, фиброз средостения, аномальный легочный венозный дренаж, заболевание с закупоркой легочной вены, коллагеновое сосудистое заболевание, врожденное сердечное заболевание, вирусная инфекция ВИЧ, воздействие лекарст и токсинов, таких как фенфлурамины, врожденное сердечное заболевание, легочная венозная гипертензия, хроническое обструктивное заболевание легких, внутритканевое легочное заболевание, нарушение дыхания во сне, расстройство с альвеолярной гиповентиляцией, хроническое воздействие большой высоты, легочное заболевание новорожденных, альвеолярно-капиллярную дисплазию, заболевание серповидных клеток, другие расстройства коагуляции, хроническую тромбоэмболию, заболевание соединительной ткани, волчанку, включая системную и кожную волчанку, шистосомиаз, саркоидоз или легочный капиллярный гемангиоматоз.
Примеры расстройств, связанных с асбестом, включают, но без ограничения, описанные в заявке US № 2005/0100529, поданной 12 мая 2005 года, которая включена в описание посредством ссылки. Частные примеры включают, но без ограничения, асбестовую мезотелиому, злокачественный плевральный выпот, доброкачественный экссудативный выпот, плевральные бляшки, плевральную кальцификацию, диффузное плевральное утолщение, круговой ателектаз, фиброзные массы и рак легкого.
Примеры паразитарных заболеваний включают, но без ограничения, описанные в заявке US № 11/271963, поданной 14 ноября 2005 года, которая включена в описание посредством ссылки. Паразитарные заболевания включают заболевания и расстройства, вызванные внутриклеточными паразитами человека, такими как, но без ограничения, P. falcifarium, P. ovale, P. vivax, P. malariae, L. donovari, L. infantum, L. aethiopica, L. major, L. tropica, L. mexicana, L. braziliensis, T. Gondii, B. microti, B. divergens, B. coli, C. parvum, C. cayetanensis, E. histolytica, I. belli, S. mansonii, S. haematobium, Trypanosoma ssp., Toxoplasma ssp. и O. volvulus. Также охватываются и другие заболевания и расстройства, вызванные внутриклеточными паразитами видов, отличных от человека, такими как, но без ограничения, Babesia bovis, Babesia canis, Banesia Gibsoni, Besnoitia darlingi, Cytauxzoon felis, Eimeria ssp., Hammondia ssp. и Theileria ssp. Частные примеры включают, но без ограничения, малярию, бабезиоз, трипаносимоз, лейшманиаз, токсоплазмоз, менингоэнцефалит, кератит, амебиаз, гиардиаз, криптоспоридиоз, изоспориаз, циклоспориаз, микроспоридиоз, аскаридоз, трихуриаз, анциклостомоз, стронгилоидоз, токсокариоз, трихинилез, лимфатический филяриоз, онхоцерциаз, филяриоз, шистосомоз и дерматит, вызванный шистосомами животных.
Примеры иммунодефицитных расстройств включают, но без ограничения, описанные в заявке US № 11/271963, поданной 30 ноября 2005 года. Частные примеры включают, но без ограничения, дефицит аденозиндезаминазы, дефицит антител с нормальными или повышенными Ig, атаксию-тенлангиэктазию, синдром оголенных лимфоцитов, обычный изменчивый иммунодефицит, дефицит Ig с гипер-IgM, удаление Ig с тяжелой цепью, дефицит IgA, иммунодефицит с тимомой, ретикулярный дисгенез, синдром Незелова, селективный дефицит подкласса IgG, преходящая детская гипогаммаглобулинемия, синдром Уискотта-Олдрича, Х-связанная агаммаглобулинемия, Х-связанный тяжелый комбинированный иммунодефицит.
Примеры расстройств ЦНС включают, но без ограничения, описанные в публикации US № 2005/0143344А1, опубликованной 30 июня 2005 года, которая включена в описание посредством ссылки. Частные примеры включают, но без ограничения, амиотрофический боковой склероз, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз и другие нейроиммунные расстройства, такие как синдром Туретта, делирий или нарушения сознания, которые возникают в короткий промежуток времени, или амнестическое расстройство, или частичные повреждения памяти, которые возникают в отсутствие других повреждений центральной нервной системы.
Примеры поражений ЦНС включают, но без ограничения, описанные в заявке US № 11/284403, поданной 18 ноября 2005 года, которая включена в описание посредством ссылки. Частные примеры включают, но без ограничения, поражения/повреждения ЦНС и родственные синдромы, включая, но без ограничения, первичное повреждение мозга, вторичное повреждение мозга, травматическое повреждение мозга, фокальное повреждение мозга, диффузное повреждение аксонов, повреждение головы, сотрясение мозга, синдром после сотрясения мозга, ушиб или разрыв позвоночника, субдуральную гематому, эпидермальную гематому, пост-травматическую эпилепсию, хроническое вегетативное состояние, полный SCI, неполный SCI, острый SCI, подострый SCI, хронический SCI, синдром центрального корда, синдром Брауна-Секварда, синдром наружнего корда, синдром мозгового конуса, синдром конского хвоста, нейрогенный шок, спинальный шок, чередование уровней сознания, головную боль, морскую болезнь, рвоту, потерю памяти, головокружение, диплопию, затуманенное зрение, эмоциональную лабильность, нарушения сна, раздражительность, неспособность к концентрации, нервозность, нарушения поведения, дефицит познавательной способности и припадок.
Другие заболевания или расстройства включают, но без ограничения, вирусные, генетические, аллергические и аутоиммунные заболевания. Частные примеры включают, но без ограничения, ВИЧ, гепатит, респираторный дистресс-синдром взрослых, заболевания с костной резорбцией, хронические воспалительные легочные заболевания, дерматиты, пузырчатый фиброз, септический шок, сепсис, эндотоксический шок, гемодинамический шок, септический синдром, постишемическое реперфузионное повреждение, менингит, псориаз, фибротическое заболевание, кахексию, заболевание «трансплантат против хозяина», отторжение трансплантата, аутоиммунное заболевание, ревматоидный спондилит, болезнь Крона, язвенный колит, воспалительное заболевание желудка, рассеянный склероз, системный волчаночный эритрематоз, ENL при проказе, радиационное поражение, рак, астму или гипероксическое альвеолярное поражение.
Примеры атеросклероза и родственных состояний включают, но без ограничения, описанные в публикации US № 2002/0054899, опубликованной 9 мая 2002 года, которая включена в описание посредством ссылки. Частные примеры включают, но без ограничения, все формы состояний, включающих атеросклероз, в том числе рестеноз после сосудистого вмешательства, такой как ангиопластика, стентирование, атерэктомия и пересадка. Изобретением охвачены все формы сосудистых вмешательств, включая проводимые при заболеваниях сердечно-сосудистой и почечной систем, такие как, но без ограничения, почечная ангиопластика, подкожное коронарное вмешательство (PCI), подкожная транслюминальная коронарная ангиопластика (PTCA), подкожная транслюминальная ангиопластика сонной артерии (РТА), коронарное шунтирование, ангиопластика с имплантацией стента, периферическое подкожное транслюминальное вмешательство на подвздошной, бедренной или подколенной артериях, и хирургическое вмешательство с применением импрегнированных искусственных трансплантатов. Последующая таблица содержит список главных системных артерий, которые могут нуждаться в лечении, все из них охватываются изобретением:
Примеры нарушений сна и родственных синдромов включают, но без ограничения, описанные в публикации US № 2005/0222209А1, опубликованной 6 октября 2005 года, которая включена в описание посредством ссылки. Частные примеры включают, но без ограничения, храп, апноэ во сне, бессонницу, нарколепсию, синдром усталых ног, кошмарные сновидения, лунатизм, потребление пищи во сне и нарушения сна, связанные с хроническими неврологическими или воспалительными состояниями. Хронические неврологические или воспалительные состояния включают, но без ограничения, комплексный региональный болевой синдром, хроническую боль в нижнем спинном отделе, скелетно-мышечную боль, артрит, радикулопатию, боль, связанную с раком, фибромиалгию, синдром хронической усталости, боль во внутренних органах, боль в мочевом пузыре, хронический панкреатит, нейропатии (диабетическую, постгерпетическую, травматическую или воспалительную) и нейродегенеративные расстройства, такие как болезнь Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз, рассеянный склероз, болезнь Хантингтона, брадикинезию, ригидность мышц, паркинсонический тремор, паркинсоническую походку, скованность движений, депрессию, долговременные нарушения памяти, синдром Рубинштейна-Тейби (RTS), деменцию, нестабильность положения тела, гипокинетические расстройства, синуклеиновые расстройства, множественные системные атрофии, дегенерацию полосатого и черного тела, оливопонтоцеребеллярную атрофию, синдром Шая-Дрегера, заболевание моторных нейронов с паркинсоническими чертами, деменция Леви, тау-патологические расстройства, прогрессирующий супрануклеарный паралич, кортикобазальную дегенерацию, временную деменцию переднего отдела мозга, амилоидные патологические расстройства, нарушение познавательной способности средней степени, болезнь Альцгеймера с паркинсонизмом, болезнь Вильсона, болезнь Халлерфордена-Шпаца, болезнь Хедьяка-Хагаши, атаксия спинного мозга SCA-3, паркинсонизм с Х-связанной дистонией, прионное заболевание, гиперкинетические расстройства, хорея, баллизм, дистонические виды тремора, амиотрофический боковой склероз (ALS), травма ЦНС и миоклонус.
Примеры гемоглобинопатии и родственных расстройств включают, но без ограничения, описанные в публикации US № 2005/0143420А1, опубликованной 30 июня 2005 года, которая включена в описание посредством ссылки. Частные примеры включают, но без ограничения, гемоглобинопатию, серповидно-клеточную анемию и любые другие расстройства, связанные с дифференцировкой клеток CD34+.
Примеры расстройств, связанных с TNFα, включают, но без ограничения, описанные в WO 98/03502 и WO 98/54170, оба документа включены в описание во всей их полноте посредством ссылки. Частные примеры включают, но без ограничения, эндотоксемию или синдром токсического шока, кахексию, респираторный дистресс-синдром взрослых, заболевания с костной резорбцией, такие как артрит, гиперкальцемию, реакцию «трансплантат против хозяина», церебральную малярию, воспаление, рост опухоли, хронические легочные воспалительные заболевания, реперфузионное повреждение, инфаркт миокарда, удар, циркуляторный шок, ревматоидный артрит, болезнь Крона, инфекцию ВИЧ и СПИД, другие расстройства, такие как ревматоидный артрит, ревматоидный спондилит, остеоартрит и другие артритные состояния, септический шок, сепсис, эндотоксический шок, заболевание «трансплантат против хозяина», истощение, болезнь Крона, язвенный колит, рассеянный склероз, системный волчаночный эритроматоз, ENL при проказе, ВИЧ, СПИД и присоединенные инфекции при СПИД, расстройства, связанные с сАМР, такие как септический шок, сепсис, эндотоксический шок, гемодинамический шок и септический синдром, постишемическое реперфузионное повреждение, малярию, микобактериальную инфекцию, менингит, псориаз, врожденный порок сердца, фибротическое заболевание, кахексию, отторжение трансплантата, онкогенные или раковые состояния, астму, аутоиммунное заболевание, радиационное поражение и гипероксическое альвеолярное поражение, вирусные инфекции, такие как вызываемые вирусами герпеса, вирусный конъюнктивит или атопический дерматит.
В других воплощениях изобретение также охватывает различные иммунологические применения соединений данного изобретения, в частности, как адъюванты вакцин, особенно - как адъюванты противораковых вакцин, как раскрыто в предварительной заявке США № 60/712823, поданной 1 сентября 2005 года, которая включена в описание во всей полноте посредством ссылки. Данный аспект изобретения также относится к применениям соединений данного изобретения в комбинации с вакцинами для лечения или профилактики рака или инфекционных заболеваний и к другим различным применениям иммуномодуляторных соединений, таким как снижение или десенсибилизация аллергических реакций.
Дозы соединения по данному изобретению или его фармацевтически приемлемой соли, сольвата, стереоизомера или пролекарства изменяются в зависимости от таких факторов, как: конкретные показания для лечения, профилактики или управления течением заболевания, возраст и состояние пациента и количество второго активного агента, если таковой применяют. Обычно соединение по данному изобретению или его фармацевтически приемлемую соль, сольват, стереоизомер или пролекарство можно применять в количестве от примерно 0,1 мг до примерно 500 мг в день, и может быть введено общепринятым способом (например, одно и то же количество, вводимое каждый день в период лечения, профилактики или управления течением заболевания), циклично (например, одна неделя введения, одна неделя без введения) или в количестве, которое увеличивают или уменьшают в курсе лечения, профилактики или управления течением заболевания.
В других воплощениях доза может составлять от примерно 1 мг до примерно 300 мг, от примерно 0,1 мг до примерно 150 мг, от примерно 1 мг до примерно 200 мг, от примерно 10 мг до примерно 100 мг, от примерно 0,1 мг до примерно 50 мг, от примерно 1 мг до примерно 50 мг, от примерно 10 мг до примерно 50 мг, от примерно 10 мг до примерно 25 мг, от примерно 20 мг до примерно 30 мг, или от примерно 1 мг до примерно 20 мг.
4.3 Вторые активные агенты
Соединение по данному изобретению или его фармацевтически приемлемую соль, сольват, стереоизомер или пролекарство можно комбинировать с другими фармакологически активными соединениями («вторыми активными агентами») в способах и композициях изобретения. Предполагается, что определенные комбинации могут действовать синергетически при лечении некоторых видов заболеваний или расстройств и состояний и симптомов, связанных с такими заболеваниями или расстройствами. Соединение по данному изобретению или его фармацевтически приемлемую соль, сольват, стереоизомер или пролекарство также могут способствовать снижению побочных эффектов, связанных со вторыми активными агентами, и наоборот.
В способах и композициях изобретения могут быть использованы один или несколько вторых активных ингредиентов или агентов. Вторыми активными агентами могут быть большие молекулы (например, белки) или малые молекулы (например, синтетические неорганические, металлорганические или органические молекулы).
Примеры активных агентов с большими молекулами включают, но без ограничения, кроветворные факторы роста, цитокины и моноклональные и поликлональные антитела. Частными примерами активных агентов являются анти-CD40 моноклональные антитела (такие как, например, SGN-40), ингибиторы гистондезацетилазы (такие как, например, SAHA и LAQ 824), ингибиторы протеина-90 сердечного шока (такие как, например, 17-AAG), ингибиторы рецепторной киназы инсулиноподобного фактора роста-1, ингибиторы рецепторной киназы сосудистого эндотелиального фактора роста (такие как, например, РТК787), ингибиторы рецептора инсулинового фактора роста, ингибиторы ацилтрансферазы лизофосфатидиловой кислоты, ингибиторы киназы IkB, ингибиторы р38МАРК, ингибиторы EGFR (такие как, например, гефитиниб и эрлотиниб HCL), антитела к HER-2 (такие как, например, трастузумаб (Herceptin®) и пертузумаб (Omnitarg™), антитела к VEGFR (такие как, например, бевакизумаб (Avastin™), ингибиторы VEGFR (такие как, например, ингибиторы специфической киназы flk-1, SU5416 и ptk787/zk222584), ингибиторы Р13К (такие как, например, уортманнин), ингибиторы C-Met (такие как, например, РНА-665752), моноклональные антитела (такие как, например, ритуксимаб (Rituxan®), тозитумомаб (Bexxar®), эдреколомаб (Panorex®) и G250) и антитела анти-TNFα. Примеры активных агентов с малыми молекулами включают, но без ограничения, противораковые агенты с малыми молекулами и антибиотики (например, кларитромицин).
Частные вторые активные соединения, которые могут быть комбинированы с соединениями по данному изобретению, изменяются в зависимости от конкретных показаний для лечения, профилактики или управления течением заболевания.
Например, для лечения, профилактики или управления течением рака второй активный агент включает, но без ограничения, семаксаниб, циклоспорин, этанерцепт, доксициклин, бортезомиб, ацивицин, акларубицин, гидрохлорид акодазола, акронин, адоцелезин, алдеслейкин, алтретамин, амбомицин, ацетат амитантрона, амсакрин, анастрозол, антрамицин, аспарагиназу, асперлин, азацитидин, азетепа, азотомицин, батимастат, бензодепа, бикалутамид, гидрохлорид бисантрена, димезилат биснафтида, бизелизин, сульфат блеомицина, брехинар натрий, бропиримин, бусульфан, кактиномицин, калустерон, карацемид, карбетимер, карбоплатин, кармустин, гидрохлорид карубицина, карцелизин, цедефингол, целекоксиб, хлорамбуцил, циролемицин, цисплатин, кладрибин, мезилат криснатола, циклофосфамид, цитарабин, дакарбазин, дактиномицин, гидрохлорид даунорубицина, децитабин, дексормаплатин, дезагуанин, мезилат дезагуанина, диазиквон, докетаксел, доксорубицин, гидрохлорид доксорубицина, дролоксифен, цитрат дролоксифена, пропионат дромостанолона, дуазомицин, эдатрексат, гидрохлорид эфлорнитина, элзамитруцин, энлоплатин, энпромат, эпипропидин, гидрохлорид эпирубицина, эрбулозол, гидрохлорид эзорубицина, эстрамустин, эстрамустин фосфат натрий, этанидазол, этопозид, фосфат этопозида, этоприн, гидрохлорид фадрозола, фазарабин, фенретинид, флоксуридин, фосфат флударобина, фторурацил, фтороцитабин, фосхидон, фостриецин натрий, гемцитабин, гидрохлорид гемцитабина, гидроксимочевина, гидрохлорид идорубицина, ифосфамид, илмофозин, ипроплатин, иринотекан, гидрохлорид иринотекана, ацетат ланреотида, летрозол, ацетат лейпролида, гидрохлорид лиарозола, лометрексол натрий, ломустин, гидрохлорид лозоксантрона, мазопрокол, майтанзин, гидрохлорид мехлорэтамина, ацетат магестрола, ацетат меленгестрола, мелфалан, меногарил, меркаптопурин, метотрексат, метотрексат натрий, метоприн, метуредепа, митиндомид, митокарцин, митокромин, митогиллин, митомальцин, митомицин, митоспер, митотан, гидрохлорид митоксантрона, микофенольная кислота, нокодазол, ногаламицин, ормаплатин, оксизуран, паклитаксел, пегаспаргаза, пелиомицин, пентамустин, сульфат пепломицина, перфосфамид, пипоброман, пипосульфан, гидрохлорид пироксантрона, пликамицин, пломестан, порфимер натрий, порфиромицин, преднимустин, гидрохлорид прокарбазина, пуромицин, гидрохлорид пуромицина, пиразофурин, рибоприн, сафингол, гидрохлорид сафингола, семустин, симтразен, спарфосат натрий, спарсомицин, гидрохлорид спирогермания, спиромустин, спироплатин, стрептонигрин, стрептозоцин, сулофенур, талисомицин, текогалан натрий, таксотер, тегафур, гидрохлорид телоксантрона, темопорфин, тенипозид, тероксирон, тестолактон, тиамиприн, тиогуанин, тиотепа, тиазофурин, тирапазамин, цитрат торемифена, ацетат трестолона, фосфат трикирибина, триметрексат, глюкуронат триметрексата, трипторелин, гидрохлорид тубулозола, урацил-горчичный газ, уредепа, вапреотид, вертепорфин, сульфат винбластина, сульфат винкристина, виндезин, сульфат виндезина, сульфат винепидина, сульфат винглицината, сульфат винлейрозина, тартрат винорелбина, сульфат винрозидина, сульфат винзолидина, ворозол, зениплатин, зиностатин и гидрохлорид зорубицина.
Другие вторые агенты включают, но без ограничения, 20-эпи-1,25-дигидрокси-витамин D3, 5-этинилурацил, абиратерон, акларубицин, ацилфульвен, адеципенол, адоцелезин, альдеслейкин, антагонисты ALL-TK, алтретамин, амбамустин, амидокс, амифостин, аминолевулиновую кислоту, амрубицин, амсакрин, анагрелид, анастрозол, андрографолид, ингибиторы ангиогенеза, антагонист D, антагонист G, антареликс, анти-дорсализирующий морфогенетический протеин-1, антиандроген, антиэстроген, антинеопластон, антисмысловые олигонуклеотиды, глицинат афидиколина, модуляторы гена апоптоза, регуляторы апоптоза, апуриновую кислоту, ара-CDP-DL-PTBA, аргининдезаминазу, азулакрин, атаместан, атримустин, аксинастатин 1, аксинастатин 2, аксинастатин 3, азасетрон, азатоксин, азатирозин, производные баккатина III, баланол, батимастат, антагонисты BCR/ABL, бензохлорины, бензоилставроспорин, бета-лактамные производные, бета-алетин, бетакламицин В, бетулиновую кислоту, ингибитор bFGF, бикалутамид, бисантрен, бисазиридинилспермин, биснафид, бистантен А, бицелизин, брефлат, бропиримин, будотитан, сульфоксимин бутионина, кальципотриол, калфостин С, производные камптотецина, капецитабин, карбоксамид-амино-триазол, карбоксиамидотриазол, CaRest M3, CARN 700, ингибиторы, полученные из хряща, карцелезин, ингибиторы казеинкиназы (ICOS), кастаноспермин, цекропин В, цетрореликс, хлорины, сульфамид хлорхиноксалина, цикапрост, цис-порфирин, кладрибин, аналоги кломифена, клотримазол, коллисмицин А, коллисмицин В, комбретастатин А4, аналог комбретастатина, конагенин, крамбесцидин 816, криснатол, криптофицин 8, производные криптофицина А, курацин А, циклопентантрахиноны, циклоплатам, ципемицин, октофосфат цитарабина, цитолитический фактор, цитостатин, дакликсимаб, децитабин, дегидродидемнин В, деслорелин, дексаметазон, дексифосфамид, дексразоксан, дексверапамил, диазикон, дидемнин В, дидокс, диэтилнорспермин, дигидро-5-азацитидин, дигидротаксол-9, диоксамицин, дифенилспиромустин, доцетаксел, докозанол, доласетрон, доксифлуридин, доксорубицин, дролоксифен, дронабинол, дуокармицин SA, эбселен, экомустин, эделфозин, эдреколомаб, эфлорнитин, элемен, эмитефур, эпирубицин, эпиристерид, аналог эстрамустина, агонисты эстрогена, антагонисты эстрогена, этанидазол, фосфат этопозида, экземестан, фадрозол, фазарабин, фенретинид, филграстим, финастерид, флавопиридол, флезеластин, флуастерон, флударабин, гидрохлорид фтордауноруницина, форфенимекс, форместан, фостриецин, фотемустин, тексафирин гадолиния, нитрат галлия, галоцитабин, ганиреликс, ингибиторы желатиназы, гемцитабин, ингибиторы глутатиона, гепсульфам, герегулин, гексаметиленбисацетамид, гиперицин, ибандроновую кислоту, идарубицин, идоксифен, идрамантон, илмофосин, иломастат, иматиниб (Gleevec®), имихимод, иммуностимулирующие пептиды, ингибитор рецептора инсулиноподобного фактора роста 1, агонисты интерферона, интерфероны, интерлейкины, иобенгуан, йододоксорубицин, 4-ипомеанол, ироплакт, ирсогладин, изобенгазол, изогомогаликондрин В, итасетрон, жасплакинолид, кагалалид F, ламелларин-N триацетат, ланреотид, лейнамицин, ленограстим, сульфат лентинана, лептолстатин, летрозол, фактор ингибирования лейкемии, альфа-лейкоцитный интерферон, лейпролид+эстроген+прогестерон, лейпрорелин, левамизол, лиарозол, аналог линейного полиамина, липофильный дисахаридный пептид, липофильные соединения платины, лиссоклинамид 7, лобаплатин, ломбрицин, лометрексол, лонидамин, лозоксантрон, локсорибин, луртотекан, тексафирин лютеция, лизофиллин, литические пептиды, майтанзин, манностатин А, маримастат, мазопрокол, маспин, ингибиторы матрилизина, ингибиторы металлопротеаз матрикса, меногарил, мербарон, метерелин, метиониназу, метоклопрамид, ингибитор MIF, мифепристон, милтефосин, миримостим, митогуазон, митолактол, аналоги митомицина, митонафид, митотоксиновый фибробластный фактор роста-сапорин, митоксантрон, мофаротен, молграмостим, Эрбитукс, хорионический гонадотропин человека, комплекс монофосфориллипид А+клеточная стенка миобактерии, мопидамол, горчичный газ как противораковый агент, микапероксид В, экстракт клеточных стенок миобактерий, мириапорон, N-ацетилдиналин, N-замещенные бензамиды, нафарелин, нагрестип, налоксон+пентазоцин, напавин, нафтеприн, нартограстим, недаплатин, неморубицин, неридроновую кислоту, нилутамид, низамицин, модуляторы оксида азота, нитроксидные антиоксиданты, нитруллин, облимерсен (Genasense®), О6-бензилгуанин, октреотид, окиценон, олигонуклеотиды, онапристон, ондансетрон, орацин, индуктор орального цитокина, ормаплатин, озатерон, оксалиплатин, оксауномицин, паклитаксел, аналоги паклитаксела, производные паклитаксела, палауамин, пальмитоилризоксин, памидроновую кислоту, панакситриол, паномифен, парабактин, пацеллиптин, пегаспаргазу, пелдезин, пентозан полисульфат натрий, пентостатин, пентрозол, перфлуброн, перфосфамид, периллиловый спирт, феназиномицин, фенилацетат, ингибиторы фосфатазы, пицибанил, гидрохлорид пилокарпина, пирарубицин, пиритрексим, плацетин А, плацетин В, ингибитор плазминогенного активатора, платиновый комплекс, соединения платины, комплекс платина-триамин, порфимер натрий, порфиромицин, преднизон, пропил бис-акридон, простагландин J2, протеасомные ингибиторы, иммуномодулятор на основе протеина А, ингибитор протеинкиназы С, микроалгал, ингибиторы протеинтирозинфосфатазы, ингибиторы пуриннуклеозидфосфорилазы, пурпурины, пиразолоакридин, пиридиксилированный коньюгат гемоглобин-полиоксиэтилен, антагонисты raf, ралтитрексед, рамосетрон, ингибиторы ras-фарнезилпротеинтрансферазы, ингибиторы ras, ингибитор ras-GAP, деметилированный ретиллиптин, этидронат рения Re 186, ризоксин, рибозимы, ретинамид RII, рогитукин, ромуртид, рокинимекс, рубигинон В1, рубоксил, сафингол, саинтопин, SarCNU, саркофитол А, сарграмостин, миметики Sdi 1, семустин, ингибитор 1 - производное сенесцена, смысловые олигонуклеотиды, ингибиторы передачи сигнала, сизофиран, собузоксан, боркаптат натрия, фенилацетат натрия, сольверол, связывающий соматомедин протеин, сонермин, спарфозовую кислоту, спикамицин D, спиромустин, спленопентин, спонгистатин 1, скваламин, стипиамид, ингибиторы стромелизина, сульфинозин, антагонист сверхактивного вазоактивного кишечного пептида, сурадисту, сурамин, сваинсонин, таллимустин, метиодид тамоксифена, тауромустин, тазаротен, текогалан натрий, тегафур, теллурапирилий, ингибиторы теломеразы, темопорфин, тенипозид, тетрахлордекаоксид, тетразомин, талибластин, тиокоралин, тромбопоэтин, миметик тромбопоэтина, тималфазин, агонист рецептора тимопоэтина, тимотринан, тироидный стимулирующий гормон, этиопурпурин этилолово, тирапазамин, бихлорид титаноцена, топсентин, торемифен, ингибитор трансляции, третиноин, триацетилуридин, трицирибин, триметрексат, трипторелин, трописетрон, туростерид, ингибиторы тирозинкиназы, тирфостины, ингибиторы UBC, убенимекс, ингибирующий рост урогенитальный фактор, полученный из синуса, антагонисты рецептора урокиназы, вапреотид, вариолин В, веларезол, верамин, вердинс, вертепорфин, винорелбин, винксалтин, витаксин, ворозол, занотерон, зениплатин, зиласкорб и стималамер зиностатина.
Частные вторые активные агенты включают, но без ограничения, 2-метоксиэстрадиол, теломестатин, вещества, вызывающие апоптоз в клетках множественной миеломы (такие как, например, TRAIL), статины, семаксаниб, циклоспорин, этанерцепт, доксициклин, бортезомиб, облимерсен (Genasense®), ремикад, докетаксел, целекоксиб, мелфалан, дексаметазон (Decadron®), стероиды, гемцитабин, цисплатин, темозоломид, этопозид, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, Tykerb® (лапатиниб), метотрексат, Arisa®, таксол, таксотер, фторурацил, лейковорин, иринотекан, кселоду, СРТ-11, альфа-интерферон, пегилированный альфа-интерферон (например, PEG INTRON-A), капецитабин, цисплатин, тиотепу, флударабин, карбоплатин, липосомный даунорубицин, цитарабин, доксетаксол, паклитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновую кислоту, палмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), ганцикловир, адриамицин, эстрамустин фосфат натрия (Emcyt®), сулиндак и этопозид.
Аналогично примеры частных вторых агентов, соответствующих показаниям для лечения, профилактики или управления течением различных заболеваний, можно найти в следующих ссылках, которые включены в описание во всей их полноте: патенты США №№ 6281230 и 5635517, заявки США №№ 10/441649, 10/483213, 10/411656, 10/693794, 10/699154 и 10/981189 и предварительные заявки США №№ 60/554923, 60/565172, 60/626975, 60/630599, 60/631870 и 60/533862.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления болью, включают, но без ограничения, общепринятые терапевтические средства, используемые для лечения или профилактики боли, такие как антидепрессанты, противосудорожные средства, антигипертензивные средства, анксиолитики, блокаторы кальциевого канала, мышечные релаксанты, ненаркотические анальгетики, опиоидные анальгетики, противовоспалительные средства, ингибиторы сох-2, иммуномодулирующие агенты, агонисты или антагонисты альфа-адренергического рецептора, иммуносуппрессанты, кортикостероиды, гипербарический кислород, кетамин, другие анестезирующие агенты, антагонисты NMDA и другие терапевтические средства, которые, например, можно найти в Physician's Desk Reference 2003. Частные примеры включают, но без ограничения, ацетат салициловой кислоты (Aspirin®), целекоксиб (Celebrex®), Enbrel®, кетамин, габатентин (Neurontin®), фенитоин (Dilantin®), карбамазепин (Tegretol®), окскарбазепин (Trileptal®), вальпровую кислоту (Depakene®), сульфат морфина, гидроморфон, преднизон, гризеофульвин, пентоний, алендронат, дифенгидрамид, гуанетидин, кеторолак (Acular®), тирокальцитонин, диметилсульфоксид (ДМСО), клонидин (Catapress®), бретилиум, кетансерин, резерпин, дроперидол, атропин, фентоламин, бупивакаин, лидокаин, ацетаминофен, нортриптилин (Pamerol®), амитриптилин (Elavil®), имипрамин (Tofranil®), доксепин (Sinequan®), кломипрамин (Anafranil®), флуоксетин (Prozac®), сертралин (Zoloft®), нефазодон (Serzone®), венлафаксин (Effexor®), тразодон (Desyrel®), бупропион (Wellbutrin®), мексилетин, нифедипин, пропранолол, трамадол, ламотригин, зиконотид, кетамин, декстромоторфан, бензодиазепины, баклофен, тизанидин и феноксибензамин.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления MD и родственных синдромов, включают, но без ограничения, стероид, световой очувствитель, интегрин, антиоксидант, интерферон, производное ксантина, гормон роста, нейротрофический фактор, регулятор неоваскуляризации, антитело анти-VEGF, простагландин, антибиотик, фитоэстроген, противовоспалительное соединение или антиангиогенетическое соединение, или их комбинацию. Частные примеры включают, но без ограничения, вертепорфин, пурлитин, ангиостатический стероид, rhuFab, интерферон-2α, пентоксифиллин, этиопурпурин олово, мотексафин лютеций, 9-фтор-11,21-дигидрокси-16,17-метилэтилиденбис(окси)прегна-1,4-диен-3,20-дион, латанопрост (см. патент США № 6225348), тетрациклин и его производные, рифамицин и его производные, макролиды, метронидазол (см. патенты США №№ 6218369 и 6015803), генистеин, генистин, 6'-O-Mal генистин, 6'-O-Ас генистин, даидзеин, даидзин, 6'-O-Mal даидзин, 6'-O-Ас даидзин, глицитеин, глицитин, 6'-O-Mal глицитин, биоханин А, формононитин (патент США № 6001368), ацетамид триамцинолона, дексаметазон (патент США № 5770589), талидомид, глутатион (патент США № 5632984), основной фактор роста фибробластов (bFGF), трансформирующий фактор роста b (TGF-b), нейротрофический фактор роста, полученный из мозга (BDNF), активаторный фактор 2 плазминогена (PAI-2), EYE101 (Eyetech Pharmaceuticals), LY333531 (Eli Lilly), Miravant и имплантат RETISERT (Bausch & Lomb). Все перечисленные выше источники включены в описание во всей их полноте посредством ссылок.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления течением кожных заболеваний, включают, но без ограничения, кератолитики, ретиноиды, α-гидроксикислоты, антибиотики, коллаген, ботулиновый токсин, интерферон, стероиды и иммуномодулирующие агенты. Частные примеры включают, но без ограничения, 5-фторурацил, мазопрокол, трихлоруксусную кислоту, салициловую кислоту, молочную кислоту, лактат аммония, мочевину, третиноин, изотретиноин, антибиотики, коллаген, ботулиновый токсин, интерферон, интерферон, кортикостероид, трансретиновую кислоту и коллагены, такие как коллаген плаценты человека, коллаген плаценты животных, Dermalogen, AlloDerm, Fascia, Cymetra, Autologen, Zyderm, Zyplast, Resoplast и Isolagen.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления течением легочной гипертензии и родственных расстройств, включают, но без ограничения, антикоагулянты, диуретики, сердечные гликозиды, блокаторы кальциевого канала, вазодилататоры, аналоги простациклина, антагонисты эндотелина, ингибиторы фосфодиэстеразы (например, ингибиторы PDE V), ингибиторы эндопептидазы, агенты, снижающие уровень липидов, ингибиторы тромбоксана и другие известные терапевтические средства, которые снижают давление в легочной артерии. Частные примеры включают, но без ограничения, варфарин (Coumadin®), диуретик, сердечный гликозид, дигоксин-кислород, дилтиазем, нифедипин, вазодилататор, такой как простациклин (например, простагландин 12 (PG 12), эпопростенол (EPO, Floran®), трепростинил (Remodulin®), оксид азота (NO), босентан (Tracleer®), амлодипин, простациклин, тадалафил (Cialis®), симвастатин (Zocor®), омапатрилат (Vanlev®), ирбесартан (Avapro®), правастатин (Pravachol®), дигоксин, L-аргинин, илопрост, бетапрост и силденафил (Viagra®).
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления течением расстройств, связанных с асбестом, включают, но без ограничения, антрациклин, платину, алкилирующий агент, облимерсен (Genasense®), цисплатину, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, таксотер, иринотекан, капецитабин, цисплатин, тиотепу, флударабин, липосомный даунорубицин, цитарабин, доксетаксол, паклитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновую кислоту, палмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), ганцикловир, адриамицин, блеомицин, гиалуронидазу, митомицин С, мепакрин, тетрациклин и гемцитабин.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления течением паразитарных заболеваний, включают, но без ограничения, хлорохин, хинин, хинидин, пириметамин, сульфадиазин, доксициклин, клиндамицин, мефлохин, галофантрин, примахин, гидроксихлорохин, прогуанил, атовакон, азитромицин, сурамин, пентамидин, меларсопрол, нифуртимокс, бензнидазол, амфотерицин В, соединения пятивалентной сурьмы (например, стильбоглюкуронат натрия), гамма-интерферон, итраконазол, комбинацию мертвых промастиготов и BCG, лейковорин, кортикостероиды, сульфонамид, спирамицин, IgG (серология), триметоприм и сульфометоксазол.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления течением иммунодефицитных расстройств, включают, но без ограничения, антибиотики (терапевтические или профилактические), такие как, но без ограничения, ампициллин, кларитромицин, тетрациклин, пенициллин, цефалоспорины, стрептомицин, канамицин и эритромицин, противовирусные агенты, такие как, но без ограничения, амантадин, римантадин, ацикловир и рибавирин, иммуноглобулин, плазму, лекарства, улучшающие иммунологию, такие как, но без ограничения, левамизол и изопринозин, биологические агенты, такие как, но без ограничения, гамма-глобулин, фактор переноса, интерлейкины и интерфероны, гормоны, такие как, но без ограничения, тимические и длугие иммунологические агенты, такие как, но без ограничения, стумуляторы В-клеток (например, BAFF/BlyS), цитокины (например, IL-2, IL-4 и IL-5), факторы роста (например, TGF-α), антитела (например, анти-CD40 или IgM), олигонуклеотиды, содержащие неметилированные CpG-мотивы, и вакцины (например, вирусные или опухолевые пептидные вакцины).
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления течением расстройств ЦНС, включают, но без ограничения, агонист или антагонист допамина, такой как, но без ограничения, леводопу, L-DOPA, кокаин, α-метил-тирозин, резерпин, тетрабеназин, бензотропин, паргилин, мезилат фенодолпама, каберголин, гидрохлорид прамипексола, ропинорол, гидрохлорид амантадина, гидрохлорид селегилина, карбидопу, мезилат перголида, Sinemet CR и Symmetrel, ингибитор МАО, такой как, но без ограничения, ипрониазид, клоргилин, фенелзин и изокарбоксазид, ингибитор СОМТ, такой как, но без ограничения, толкапон и энтакапон, ингибитор холинэстеразы, такой как, но без ограничения, салицилат физостигмина, сульфат физостигмина, бромид физостигмина, бромид меостигмина, метилсульфат неостигмина, хлорид амбенония, хлорид эдрофония, такрин, пралидоксимхлорид, обидоксимхлорид, тримедоксимбромид, диацетилмоноксим, эндрофоний, пиридостигмин и демекарий, противовоспалительный агент, такой как, но без ограничения, напроксен натрий, диклофенак натрий, диклофенак калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho-D иммуноглобулин, микофенилат мофетила, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовая кислота, меклофенамат натрия, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенилбутазон, антипирин, аминопирин, апазон, цилейтон, ауротиоглюкозу, тиомалат золота-натрия, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон или бетаметазон и другие глюкокортикоиды, противорвотный агент, такой как, но без ограничения, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондасетрон, гранисетрон, гидроксизин, ацетиллейцин моноэтаноламин, ализаприд, азасетрон, бензхинамид, биетанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопримазин, набилон, оксипернидил, пипамазин, скополамин, сульпирид, тетрагидроканнабинол, триэтилперазин, тиопроперазин, трописетрон и их смеси.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления течением повреждений ЦНС и родственных синдромов, включают, но без ограничения, иммуномодулирующие агенты, иммуносуппрессанты, антигипертензивные агенты, противосудорожные средства, фибринолитические агенты, агенты против образования бляшек, антипсихотические агенты, антидепрессанты, бензодиазепины, буспирон, амантадин и другие известные или общепринятые агенты, применяемые у пациентов с повреждением/поражением ЦНС и родственными синдромами. Частные примеры включают, но без ограничения, стероиды (например, глюкокортикоиды, такие как, но без ограничения, метилпреднизолон, дексаметазон и бетаметазон), противовоспалительный агент, включая, но без ограничения, напроксен натрий, диклофенак натрий, диклофенак калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho-D иммуноглобулин, микофенилат мофетила, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовую кислоту, меклофенамат натрия, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенилбутазон, антипирин, аминопирин, апазон, цилейтон, ауротиоглюкозу, тиомалат золота-натрия, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон, аналог сАМР, включая, но без ограничения, db-cAMP, агент, включающий метилфенидатное лекарственное средство, который включает l-трео-метилфенидат, d-трео-метилфенидат, dl-трео-метилфенидат, l-эритро-метилфенидат, d-эритро-метилфенидат, dl-эритро-метилфенидат и их смеси, диуретический агент, такой как, но без ограничения, маннит, фуросемид, глицерин и мочевину.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления расстройствами сна и родственными синдромами, включают, но без ограничения, трициклический антидепрессантный агент, селективный ингибитор повторного захвата серотонина, антиэпилептический агент (габапентин, прегабалин, карбамазепин, окскарбазепин, левитирацетам, топирамат), притивоаритмический агент, агент, блокирующий натриевый канал, селективный ингибитор воспалительного медиатора, опиоидный агент, второе иммуномодулирующее соединение, комбинированный агент и другие известные или общепринятые агенты, применяемые в терапии сна. Частные примеры включают, но без ограничения, Neurontin, оксиконтин, морфин, топирамат, амитриптилин, нортриптилин, карбамазепин, леводопу, L-DOPA, кокаин, α-метил-тирозин, резерпин, тетрабеназин, бензотропин, паргилин, мезилат фенодолпама, каберголин, дигидрохлорид прамипексола, ропинорол, гидрохлорид амантадина, гидрохлорид селегилина, карбидопу, мезилат перголида, Sinemet CR, Symmetrel, ипрониазид, клоргилин, фенелзин, изокарбоксазид, толкапон, энтакапон, салицилат физостигмина, сульфат физостигмина, бромид физостигмина, бромид меостигмина, метилсульфат неостигмина, хлорид амбенония, хлорид эдрофония, такрин, пралидоксимхлорид, обидоксимхлорид, тримедоксимбромид, диацетилмоноксим, эндрофоний, пиридостигмин, демекарий, напроксен натрий, диклофенак натрий, диклофенак калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho-D иммуноглобулин, микофенилат мофетила, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовая кислота, меклофенамат натрия, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенилбутазон, антипирин, аминопирин, апазон, цилейтон, ауротиоглюкозу, тиомалат золота-натрия, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон, бензбромарон, бетаметазон и другие глюкокортикоиды, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцин моноэтаноламин, ализаприд, азасетрон, бенхинамид, биетанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксипернидил, пипамазин, скополамин, сульпирид, тетрагидроканнабинол, триэтилперазин, тиопроперазин, трописетрон и их смеси.
Примеры вторых активных агентов, которые могут быть использованы для лечения, профилактики и/или управления течением гемоглобинопатии и родственных расстройств, включают, но без ограничения, интерлейкины, такие как IL-2 (включая рекомбинантный IL-II(«rIL2») и canarypox IL-2), IL-10, IL-12 и IL-18, интерфероны, такие как интерферон альфа-2а, интерферон альфа-2b, интерферон альфа-n1, интерферон альфа-n3, интерферон бета-1а и интерферон гамма-1b, и G-CSF, гидроксимочевину, бутираты или производные бутиратов, оксид азота, HEMOXIN™ (NIPRISAN™, см. патент США № 5800819), антагонисты канала Гардоса, такие как клотримазол и производные триарилметана, Deferoxamine, протеин С и переливание крови или кровезаменителя, такого как Hemospan™ или Hemospan PS™ (Sangart).
Введение пациенту соединения по данному изобретению, его фармацевтически приемлемой соли, сольвата, стереоизомера и пролекарства и вторых активных агентов может производиться одновременно или последовательно одним и тем же или разными путями введения. Пригодность используемого конкретного пути введения для частного активного агента будет зависеть от самого активного агента (например, может ли он быть введен орально без разложения перед тем, как попадет в кровоток) и заболевания, подлежащего лечению. Предпочтительные пути введения вторых активных агентов или ингредиентов изобретения известны среднему специалисту в данной области. См., например, Physician's Desk Reference, 1755-1760 (56th ed., 2002).
В одном воплощении изобретения второй активный агент вводят внутривенно или подкожно, однократно или дважды в день, в количестве от примерно 1 до примерно 1000 мг, от примерно 5 до примерно 500 мг, от примерно 10 до примерно 350 мг, от примерно 50 до примерно 200 мг. Конкретное количество второго активного агента будет зависеть от используемого частного агента, типа заболевания, подлежащего лечению или контролю, тяжести и стадии заболевания, количеств соединений изобретения и любых дополнительных активных агентов по выбору, одновременно вводимых пациенту.
Как было рассмотрено в любой части описания, изобретение охватывает способ снижения, устранения и/или предотвращения побочных и нежелательных эффектов, связанных с общепринятым лечением, включая, но без ограничения, хирургию, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию и иммунотерапию. Соединения по изобретению и другие активные ингредиенты могут быть введены пациенту до, во время или после проявления побочного эффекта, связанного с общепринятым лечением.
4.4 Циклическая терапия
В некоторых воплощениях профилактические или терапевтические агенты по изобретению вводят пациенту циклически. Циклическая терапия включает введение активного агента в течение периода времени с последующим периодом отдыха и повторение данного последовательного введения. Циклическая терапия способна уменьшить развитие резистентности к одному или более видам терапии, избежать или снизить побочные эффекты одного из видов терапии и/или улучшить эффективность лечения.
Далее, в одном частном воплощении изобретения соединение по изобретению вводят ежедневно в виде одной дозы или разделенных доз в цикле от четырех до шести недель с периодом отдыха примерно от недели до двух недель. Изобретение далее позволяет увеличивать частоту, число и продолжительность циклов дозирования. Таким образом, другое частное воплощение изобретения охватывает введение соединения по изобретению в большем, чем обычное, числе циклов, когда оно вводится отдельно. Еще в одном частном воплощении изобретения соединение по изобретению вводят в большем числе циклов, чем обычно вызывающее токсичность, ограничивающую дозу, у пациента, которому второй активный ингредиент не вводили.
В одном воплощении соединение изобретения вводят ежедневно и непрерывно в течение трех или четырех недель в дозировке от примерно 0,1 мг до примерно 500 мг в день с последующим перерывом в одну или две недели. В других воплощениях дозировки могут быть от примерно 1 мг до примерно 300 мг, от примерно 0,1 мг до примерно 150 мг, от примерно 1 мг до примерно 200 мг, от примерно 10 мг до примерно 100 мг, от примерно 0,1 мг до примерно 50 мг, от примерно 1 мг до примерно 50 мг, от примерно 10 мг до примерно 50 мг, от примерно 20 мг до примерно 30 мг, от примерно 1 мг до примерно 20 мг с последующим перерывом.
В одном воплощении изобретения соединение по изобретению и второй активный ингредиент вводят орально с введением соединения по изобретению за 30-60 минут до второго активного ингредиента в цикле от четырех до шести недель. В другом воплощении изобретения комбинацию соединения по изобретению и второго активного ингредиента вводят внутривенным вливанием в течение примерно 90 минут в каждом цикле.
Обычно число циклов, в течение которого пациент получает комбинированное лечение, будет составлять от примерно одного до примерно 24 циклов, более типично - от примерно двух до примерно 16 циклов и еще более типично - от примерно четырех до примерно трех циклов.
4.5 Фармацевтические композиции и дозированные формы
Фармацевтические композиции могут быть использованы для получения дискретных единичных дозированных форм. Фармацевтические композиции и дозированные формы изобретения содержат соединение по изобретению или его фармацевтически приемлемую соль, сольват, стереоизомер и пролекарство. Фармацевтические композиции и дозированные формы изобретения могут далее содержать один эксципиент или более.
Фармацевтические композиции и дозированные формы изобретения могут также содержать один или более дополнительных активных ингредиентов. Примеры необязательных или дополнительных активных ингредиентов приведены выше в разделе 4.3.
Едининичные дозированные формы согласно изобретению подходят для орального, слизистого (например, назального, сублингвального, вагинального, буккального или ректального), парентерального (например, подкожного, внутривенного, болюсно-инъекционного, внутримышечного или интраартериального), местного (например, глазные капли или другие офтальмологические препараты), трансдермального или чрескожного введения пациенту. Примеры дозированных форм включают, но без ограничения, таблетки, продолговатые таблетки, капсулы, такие как мягкие эластичные желатиновые капсулы, саше, таблетки, леденцы, дисперсии, суппозитории, порошки, аэрозоли (например, назальные спреи или ингаляторы), гели, жидкие дозированные формы, подходящие для орального или слизистого введения пациенту, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии «масло в воде» или жидкие эмульсии «вода в масле»), растворы и эликсиры, жидкие дозированные формы, подходящие для парентерального введения пациенту, глазные капли и другие офтальмологические препараты, подходящие для местного применения, и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), из которых могут быть восстановлены жидкие дозированные формы, подходящие для парентерального введения пациенту.
Состав, вид и тип дозированных форм изобретения обычно будет зависеть от их применения. Например, дозированные формы, применяемые для лечения острых форм заболеваний, могут содержать большие количества одного или более активных ингредиентов, чем содержит дозированная форма, применяемая для лечения хронической формы того же заболевания. Аналогично парентеральные дозированные формы могут содержать меньшие количества одного или более активных ингредиентов, чем содержит оральная дозированная форма, применяемая для лечения того же заболевания. Этот и другие аспекты, в которых частные дозированные формы, охватываемые данными изобретением, отличаются друг от друга, с ясностью очевидны специалисту в данной области. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990).
Типичные фармацевтические композиции и дозированные формы включают один или более эксципиентов. Подходящие эксципиенты хорошо известны специалисту в области фармации, а неограничивающие примеры подходящих эксципиентов приведены в описании. Пригодность конкретного эксципиента для включения в фармацевтическую композицию или дозированную форму зависит от набора факторов, хорошо известных в данной области, включая, но без ограничения, путь, которым дозированную форму будут вводить пациенту. Например, оральные дозированные формы, такие как таблетки, могут содержать эксципиенты, не подходящие для применения в парентеральных дозированных формах. Пригодность конкретного эксципиента может также зависеть от частных активных ингредиентов в дозированной форме. Например, разложение некоторых активных ингредиентов может быть ускорено некоторыми эксципиентами, такими как лактоза, или если они подвергаются действию воды. Активные ингредиенты, которые содержат первичные или вторичные амины, особенно подвержены такому ускоренному разложению. Следовательно, данное изобретение охватывает фармацевтические композиции и дозированные формы, которые содержат мало лактозы или других моно- или дисахаридов, если таковые присутствуют. Используемое здесь выражение «не содержащий лактозы» означает, что количество лактозы, если она присутствует, недостаточно для существенного увеличения скорости резрушения активного ингредиента.
Не содержащие лактозы композиции по изобретению могут включать эксципиенты, которые хорошо известны в данной области и перечислены, например, в U.S. Pharmacopeia (USP) 25-NF20 (2002). В общем, не содержащие лактозы композиции включают активные ингредиенты, связующее/наполнитель и смазывающее вещество в фармацевтически совместимых и фармацевтически приемлемых количествах. Предпочтительные не содержащие лактозы дозированные формы включают активные ингредиенты, микрокристаллическую целлюлозу, преджелатинизированный крахмал и стеарат магния.
Данное изобретение далее охватывает безводные фармацевтические композиции и дозированные формы, включающие активные ингредиенты, поскольку вода может способствовать разрушению некоторых соединений. Например, добавление воды (например, 5%) широко допустимо в фармацевтической области как средство имитации долговременного хранения с целью определения таких характеристик, как срок хранения или устойчивость препарата в течение времени. См., например, Jens T. Carstensen, Drug Stability: Principles & Practice, 2nd Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80. В действительности, вода и нагревание ускоряют разложение некоторых соединений. Таким образом, действие воды на препарат может иметь большое значение, поскольку с влагой и/или влажностью часто сталкиваются во время производства, переработки, упаковки, хранения, перевозки и применения препаратов.
Безводные фармацевтические композиции и дозированные формы по изобретению могут быть получены с использованием безводных или содержащих мало влаги ингредиентов в условиях малого присутствия влаги или низкой влажности. Фармацевтические композиции и дозированные формы, включающие лактозу и, по меньшей мере, один активный ингредиент, который содержит первичный или вторичный амин, предпочтительно являются безводными, если предполагается заметный контакт с влагой и/или влажностью во время производства, упаковки и/или хранения.
Безводные фармацевтические композиции следует готовить и хранить таким образом, чтобы поддерживать их безводную природу. Соответственно, безводные композиции предпочтительно упаковывают с использованием материалов, известных как защищающие от действия воды, так чтобы они могли быть включены в подходящие наборы. Примеры подходящей упаковки включают, но без ограничения, герметически запечатанную фольгу, пластики, контейнеры, содержащие единицу дозы (например, ампулы), блистерные упаковки и упаковки в виде полос.
Изобретение далее охватывает фармацевтические композиции и дозированные формы, которые содержат одно или более соединений, что снижает степень разложения активного ингредиента. Такие соединения, которые в описании называют «стабилизаторами», включают, но без ограничения, антиоксиданты, такие как аскорбиновая кислота, буферы рН или солевые буферы.
Подобно количествам и типам эксципиентов, количества и конкретные типы активных ингредиентов в дозированных формах могут различаться в зависимости от таких факторов, как, но без ограничения, путь, которым они должны быть введены пациенту. Однако типичные дозированные формы по изобретению содержат соединение изобретения в количестве от примерно 0,10 до примерно 500 мг. Типичные дозированные формы изобретения содержат соединение изобретения в количестве примерно 0,1, 1, 2, 5, 7,5, 10, 12,5, 15, 17,5, 20, 25, 50, 100, 150, 200, 250, 300, 350, 400, 450 или 500 мг.
Типичные дозированные формы содержат второй активный ингредиент в количестве от 1 до примерно 1000 мг, от примерно 5 до примерно 500 мг, от примерно 10 до примерно 350 мг, от примерно 50 до примерно 200 мг. Конечно, конкретное количество второго активного агента будет зависеть от конкретного используемого агента, типа подвергаемого лечению или управлению его течением рака, количеств(а) соединения по изобретению и любых необязательных активных агентов, параллельно вводимых пациенту.
4.5.1 Оральные дозированные формы
Фармацевтические композиции по изобретению, подходящие для орального введения, могут быть представлены в виде дискретных дозированных форм, таких как, но без ограничения, таблетки (например, таблетки для рассасывания), продолговатые таблетки, капсулы и жидкости (например, сиропы с вкусовыми добавками). Такие дозированные формы содержат заранее определенные количества активных ингредиентов и могут быть приготовлены фармацевтическими способами, хорошо известными специалисту в данной области. См., в общем случае, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990).
Типичные оральные дозированные формы согласно изобретению получают, объединяя активные ингредиенты в первоначальную смесь с, по меньшей мере, одним эксципиентом в соответствии с общепринятыми фармацевтическими методиками составления. Эксципиенты могут иметь широкое разнообразие форм в зависимости от формы препарата, желаемой для введения. Например, эксципиенты, подходящие для применения в оральных жидких или аэрозольных дозированных формах, включают, но без ограничения, воду, гликоли, масла, спирты, вкусовые добавки, консерванты и красители. Примеры эксципиентов, подходящих для применения в твердых оральных дозированных формах (например, порошках, таблетках, капсулах и продолговатых таблетках), включают, но без ограничения, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, агенты для гранулирования, смазки, связующие и дезинтегрирующие агенты.
Вследствие их легкого введения таблетки и капсулы представляют наиболее выгодные оральные формы, содержащие единицу дозы, в их случае используют твердые эксципиенты. Если желательно, таблетки могут быть покрыты оболочкой с помощью стандартных водных или неводных методик. Такие дозированные формы могут быть получены любым из методов фармации. В общем фармацевтические композиции и дозированные формы получают однородным и тщательным смешиванием активных ингредиентов с жидкими носителями, тонкоизмельченными твердыми носителями или обоими, а затем - формовкой продукта в желаемый вид, если требуется.
Например, таблетки могут быть получены прессованием или формованием. Прессованные таблетки могут быть получены прессованием в подходящей машине активных ингредиентов в свободнотекучей форме, такой как порошок или гранулы, необязательно смешанных с эксципиентом. Формованные таблетки могут быть получены формованием в подходящей машине смеси порошкообразного соединения, смоченного инертным жидким разбавителем.
Примеры эксципиентов, которые могут быть использованы в дозированных формах по изобретению, включают, но без ограничения, связующие, наполнители, дезинтегранты и смазки. Связующие, подходящие для применения в фармацевтических композициях и дозированных формах, включают, но без ограничения, кукурузный крахмал, картофельный крахмал и другие крахмалы, желатин, натуральные и синтетические смолы, такие как камедь, альгинат натрия, альгиновую кислоту, другие альгинаты, порошкообразный трагант, гуаровую смолу, целлюлозу и ее производные (например, этилцеллюлозу, ацетат целлюлозы, кальций карбоксиметилцеллюлозу, натрий карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу, преджелатинизированный крахмал, гидроксипропилметилцеллюлозу (например, №№ 2208, 2906, 2910), микрокристаллическую целлюлозу и их смеси.
Подходящие формы микрокристаллической целлюлозы включают, но без ограничения, материалы, продаваемые как AVICEL-PH-101, AVICEL-PH-103, AVICEL RC-581, AVICEL-PH-105 (доступны от FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA) и их смеси. Частным связующим является смесь микрокристаллической целлюлозы и натрий карбоксиметилцеллюлозы, продаваемая как AVICEL RC-581. Подходящие безводные или содержащие мало влаги эксципиенты или добавки включают AVICEL-PH-103™ и Starch 1500 LM.
Примеры наполнителей, подходящих для применения в фармацевтических композициях и дозированных формах, раскрытых в описании, включают, но без ограничения, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраты, маннит, кремневую кислоту, сорбит, крахмал, преджелатинизированный крахмал и их смеси. Связующее или наполнитель в фармацевтических композициях по изобретению обычно присутствуют в количестве от примерно 50 до примерно 99 массовых процентов от массы фармацевтической композиции или дозированной формы.
Дезинтегранты используют в композициях изобретения для получения таблеток, которые разрушаются под воздействием водной окружающей среды. Таблетки, которые содержат слишком много дезинтегранта, могут разрушаться при хранении, тогда как содержащие его слишком мало могут не разрушиться с желаемой скоростью в желаемых условиях. Таким образом, для получения твердых оральных дозированных форм согласно изобретению следует использовать достаточное количество дезинтегранта, которое не является не слишком большим, не слишком малым для того, чтобы нанести ущерб, изменив высвобождение активных ингредиентов. Количество используемого дезинтегранта изменяется, основываясь на типе препарата, и легко может быть определено обычным специалистом в данной области. Типичные фармацевтические композиции включают от примерно 0,5 до примерно 15 массовых процентов дезинтегранта, предпочтительно от примерно 1 до примерно 5 массовых процентов дезинтегранта.
Дезинтегранты, которые могут быть использованы в фармацевтических композициях и дозированных формах по изобретению, включают, но без ограничения, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, натрий кросскармелозу, кросповидон, калий полакрилин, натрий крахмал гликолят, крахмал из картофеля и тапиоки, другие крахмалы, преджелатинизированный крахмал, глины, другие альгины, другие целлюлозы, смолы и их смеси.
Смазки, которые могут быть использованы в фармацевтических композициях и дозированных формах по изобретению, включают, но без ограничения, стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, тальк, гидрированное растительное масло (например, масло земляных орехов, масло из семян хлопчатника, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и масло из соевых бобов), стеарат цинка, этилолеат, этиллаурат, агар и их смеси. Дополнительные смазки включают, например, силоидный силикагель (AEROSIL200, производимый W. R. Grace Co. of Baltimore, MD), коагулированный аэрозоль синтетического оксида кремния (выпускаемый на рынок Degussa Co. of Plano, TX), CAB-O-SIL (пирогенный диоксид кремния, продукт, продаваемый Cabot Co. of Boston, MA) и их смеси. Если вообще используются, смазки используются в количестве менее примерно 1 массового процента от фармацевтических композиций или дозированных форм, в которые их вводят.
Твердые оральные дозированные формы согласно изобретению включают соединение изобретения, безводную лактозу, микрокристаллическую целлюлозу, поливинилпирролидон, стеариновую кислоту, коллоидный безводный оксид кремния и желатин.
4.5.2 Дозированные формы с контролируемым высвобождением
Активные ингредиенты изобретения могут быть введены с помощью средств с контролируемым высвобождением или устройств для доставки, которые хорошо известны обычному специалисту в данной области. Примеры включают, но без ограничения, описанные в патентах США №№ 3845770, 3916899, 3536809, 3598123 и 4008719, 5674533, 5059595, 5591767, 5120548, 5073543, 5639473, 5354556 и 5733566, каждый из которых включен в описание посредством ссылки. Такие дозированные формы могут быть использованы для обеспечения медленного или контролируемого высвобождения одного или более активных ингредиентов, используя, например, гидроксипропилметилцеллюлозу, другие полимерные матрицы, гели, проницаемые мембраны, осмотические системы, многослойные покрытия, микрочастицы, липосомы, микросферы или их комбинации для получения желаемого профиля высвобождения в различных соотношениях. Подходящие препараты с контролируемым высвобождением, известные обычному специалисту в данной области, включая раскрытые в описании, могут быть легко подобраны для применения с активными ингредиентами по изобретению. Изобретение, таким образом, охватывает единичные дозированные формы, подходящие для орального введения, такие как, но без ограничения, таблетки, капсулы, желатиновые капсулы и продолговатые таблетки, которые приспособлены для контролируемого высвобождения.
Все фармацевтические продукты с контролируемым высвобождением имеют обычной целью улучшение лекарственной терапии по сравнению с достигаемой их конкурентами с неконтролируемым высвобождением. В идеале применение оптимально разработанного препарата с контролируемым высвобождением в медицинском лечении характеризуется минимумом лекарственной субстанции, применяемой для лечения или управления течением состояния в минимальное время. Преимущества составов с контролируемым высвобождением включают улучшенную активность лекарства, сниженную частоту введения и повышенную совместимость у пациента. Кроме того, составы с контролируемым высвобождением могут быть применены, чтобы повлиять на время начала действия или другие характеристики, такие как уровень лекарства в крови, и, таким образом, могут влиять на появление (например, нежелательных) побочных эффектов.
Большинство препаратов с контролируемым высвобождением разработаны для первоначального высвобождения количества лекарства (активного ингредиента), которое немедленно производит желаемый терапевтический эффект, и постепенного и непрерывного высвобождения других количеств лекарства для поддержания данного уровня терапевтического или профилактического эффекта в течение продолжительного периода времени. С целью поддержания данного постоянного уровня лекарства в организме лекарство должно высвобождаться из дозированной формы со скоростью, которая возмещает количество лекарства, метаболизированного и выведенного из организма. Контролируемое высвобождение активного ингредиента можно стимулировать различными условиями, включая, но без ограничения, рН, температуру, ферменты, воду или другие физиологические условия или соединения.
4.5.3 Парентеральные дозированные формы
Парентеральные дозированные формы могут быть введены пациентам различными путями, включая, но без ограничения, подкожный, внутривенный (включая инъекцию болюса), внутримышечный и внутриартериальный. Поскольку их введение обычно обходит естественные средства защиты пациента от посторонних веществ, парентеральные дозированные формы предпочтительно являются стерильными или пригодными к стерилизации перед введением пациенту. Примеры парентеральных дозированных форм включают, но без ограничения, готовые растворы для инъекций, сухие продукты, готовые для растворения или суспендирования в фармацевтически приемлемом носителе для инъекции, готовые суспензии для инъекции и эмульсии.
Подходящие носители, которые могут быть использованы для получения парентеральных дозированных форм согласно изобретению, хорошо известны специалисту в данной области. Примеры включают, но без ограничения, воду для инъекций по фармакопее США, водные носители, такие как, но без ограничения, хлорид натрия для инъекций, раствор Рингера для инъекций, декстрозу для инъекций, декстрозу и хлорид натрия для инъекций, раствор Рингера с лактатом для инъекций, смешивающиеся с водой носители, такие как, но без ограничения, этиловый спирт, полиэтиленгликоль и полипропиленгликоль, и неводные носители, такие как, но без ограничения, кукурузное масло, масло семян хлопчатника, масло земляных орехов, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
Соединения, которые увеличивают растворимость одного или более активных ингредиентов, раскрытых в описании, также могут быть введены в парентеральные дозированные формы согласно изобретению. Например, циклодекстрин и его производные могут быть использованы для повышения растворимости иммуномодуляторного соединения по изобретению и его производных. См., например, патент США № 5134127, который включен в описание посредством ссылки.
4.5.4 Дозированные формы для местного применения и для слизистых оболочек
Дозированные формы для местного применения и для слизистых оболочек согласно изобретению включают, но без ограничения, спреи, аэрозоли, растворы, эмульсии, суспензии, глазные капли и другие офтальмологические препараты или другие формы, известные специалисту в данной области. См., например, Remington's Pharmaceutical Sciences, 16th and 18th ed., Mack Publishing, Easton PA (1980 & 1990) и Introduction to Pharmaceutical Dosage Forms, 4th ed., Lea & Febiger, Philadelphia (1985). Дозированные формы, подходящие для лечения слизистых тканей в ротовой полости, могут быть получены как жидкости для полоскания рта или как оральные гели.
Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые могут быть использованы для получения дозированных форм для местного применения и для слизистых оболочек, охватываемые данным изобретением, хорошо известны специалисту в области фармацевтики и зависят от конкретной ткани, на которую данная фармацевтическая композиция или дозированная форма будет нанесена. Учитывая этот факт, типичные эксципиенты включают, но без ограничения, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмиат, минеральное масло и их смеси с образованием растворов, эмульсий или гелей, которые нетоксичны и фармацевтически приемлемы. Если желательно, то смачиватели или увлажнители также могут быть добавлены в фармацевтические композиции и дозированные формы. Примеры таких дополнительных ингредиентов хорошо известны в данной области. См., например, Remington's Pharmaceutical Sciences, 16th and 18th ed., Mack Publishing, Easton PA (1980 & 1990).
рН Фармацевтической композиции или дозированной формы также может быть отрегулирован для улучшения доставки одного или более ингредиентов. Аналогично полярность растворителя-носителя, его ионную силу или тоничность можно регулировать для улучшения доставки. Такие соединения, как стеараты, могут быть добавлены в фармацевтические композиции или дозированные формы, чтобы благоприятно изменить гидрофильность и липофильность одного или более ингредиентов, таким образом, чтобы улучшить доставку. В этом отношении стеараты могут служить как липидный носитель для препаратов, как эмульгирующий агент или поверхностно-активное вещество, и как агент, улучшающий доставку или усиливающий проникновение. Различные соли, гидраты или сольваты активных ингредиентов могут быть использованы для дальнейшего регулирования свойств получаемой композиции.
4.6 Наборы
В одном воплощении активные ингредиенты изобретения предпочтительно не вводят пациенту одновременно или одним и тем же путем введения. Поэтому данное изобретение охватывает наборы, которые при использовании практикующим медиком могут упростить введение пациенту подходящих количеств активных ингредиентов.
Набор согласно изобретению включает дозированную форму соединения изобретения. Наборы, охватываемые изобретением, далее могут включать дополнительные активные ингредиенты, такие как облимерсен (Genasense®), мелфалан, G-CSF, GM-CSF, EPO, топотекан, дакарбазин, иринотекан, таксотер, IFN, ингибитор СОХ-2, пентоксифиллин, ципрофлоксацин, дексаметазон, IL2, IL8, IL18, Ara-C, винорелбин, изотретиноин, 13-цис-ретиновую кислоту или их фармакологически активные мутанты или производные, или их комбинации. Примеры дополнительных активных ингредиентов включают, но без ограничения, раскрытые в описании (см., например, раздел 4.3).
Наборы согласно изобретению далее могут включать устройства, которые применяют для введения активных ингредиентов. Примеры таких устройств включают, но без ограничения, шприцы, резервуары капельниц, пластыри и ингаляторы.
Наборы согласно изобретению далее могут включать клетки или кровь для трансплантации, равно как и фармацевтически приемлемые носители, которые могут быть использованы для введения одного или более активных ингредиентов. Например, если активный ингредиент представлен в твердой форме, которая должна быть восстановлена для парентерального введения, то набор может содержать запечатанный контейнер с подходящим носителем, в котором активный ингредиент может быть растворен с образованием не содержащего твердых частиц стерильного раствора, подходящего для парентерального введения. Примеры фармацевтически приемлемых носителей включают, но без ограничения, воду для инъекций по фармакопее США, водные носители, такие как, но без ограничения, хлорид натрия для инъекций, раствор Рингера для инъекций, декстрозу для инъекций, декстрозу и хлорид натрия для инъекций, раствор Рингера с лактатом для инъекций, смешивающиеся с водой носители, такие как, но без ограничения, этиловый спирт, полиэтиленгликоль и полипропиленгликоль, и неводные носители, такие как, но без ограничения, кукурузное масло, масло семян хлопчатника, масло земляных орехов, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
5. Примеры
Некоторые воплощения изобретения проиллюстрированы нижеследующими неограничивающими примерами.
5.1 5-{[(Бензофуран-2-илметил)-амино]-метил}-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-дион
К смеси гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль) в CH2Cl2 (20 мл) добавляют диизопропилэтиламин (0,52 мл, 3,0 ммоль), 2-бензофуранкарбоксальдегид (0,36 мл, 3,0 ммоль) и ледяную уксусную кислоту (0,17 мл, 3,0 ммоль). Реакционную смесь перемешивают при комнатной температуре 2 часа. Добавляют триацетоксиборогидрид натрия (1,27 г, 6,0 ммоль) и смесь оставляют на ночь при перемешивании при комнатной температуре. Добавляют воду (20 мл), чтобы погасить реакцию, и смесь экстрагируют CH2Cl2 (2×50 мл). Органический слой промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл) и сушат (MgSO4), и выпаривают в вакууме. Остаток хроматографируют, используя градиент этилацетат-гексаны, элюируя 0,38 г продукта при соотношении этилацетат-гексаны 83:17 с выходом 30%. Т. пл. 133-135ºС, Waters Xterra RP18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% HCO2(NH4), 5,11 мин (98,22%); 1H ЯМР (ДМСО-d6) δ 2,04-2,10 (м, 1Н), 2,50-2,63 (м, 2H), 2,84-2,96 (м, 1Н), 3,20 (ушир, 1Н), 3,85 (с, 2H), 3,94 (с, 2H), 5,14 (дд, J=12,6 Гц, 5,1 Гц, 1Н), 6,73 (с, 1Н), 7,17-7,27 (м, 2H), 7,48-7,58 (м, 2H), 7,84 (т, J=7,8 Гц, 2H), 7,93 (с, 1Н), 11,12 (с, 1Н);
13C ЯМР (ДМСО-d6) δ 22,0, 30,9, 45,0, 48,9, 51,5, 103,6, 110,8, 120,7, 122,6, 123,2, 123,6, 128,2, 129,6, 131,4, 134,1, 148,8, 154,1, 157,3, 167,1, 167,2, 169,8, 172,7.
Анализ: Вычислено для C23H19N3O5: C, 66,18; H, 4,59; N, 10,07. Найдено: C, 66,02; H, 4,27; N, 9,94.
5.2 5-Бензиламино-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-дион
Стадия 1: Смесь диметил-4-нитрофталата (15,0 г, 62,7 ммоль) и 10% Pd-C (1,5 г) в этилацетате (100 мл) оставляют на ночь для гидрирования при 50 фунт/кв.дюйм. Реакционную смесь фильтруют через целит, и фильтр дополнительно промывают этилацетатом (50 мл). Растворитель выпаривают и остаток перемешивают в гексанах. Отфильтровывают твердую фазу, дополнительно промывают гексанами и сушат, получая 12,77 г диметилового эфира 4-амино-фталевой кислоты в виде бледно-оранжевого твердого вещества с выходом 97%. 1H ЯМР (ДМСО-d6) δ 3,71 (с, 3H), 3,75 (с, 3H), 6,17 (с, 2H), 6,58-6,65 (м, 2H), 7,57 (д, J=8,4 Гц, 1Н).
Стадия 2: Смесь диметилового эфира 4-амино-фталевой кислоты (0,84 г, 4,0 ммоль), бензальдегида (0,81 мл, 8,0 ммоль) и уксусной кислоты (1,37 мл, 24,0 ммоль) в CH2Cl2 (40 мл) перемешивают при комнатной температуре 10 минут. Добавляют триацетоксиборогидрид натрия (2,54 г, 12,0 ммоль) и смесь оставляют на ночь при перемешивании. Реакционную смесь разбавляют CH2Cl2 (20 мл), промывают водой (2×100 мл), насыщенным раствором бикарбоната натрия (1×100 мл) и насыщенным раствором соли (1×100 мл) и сушат (MgSO4), и выпаривают в вакууме. Полученное масло хроматографируют, используя градиент этилацетат-гексаны, элюируя продукт при соотношении этилацетат-гексаны 20:80, 1,1 г диметилового эфира 4-бензиламино-фталевой кислоты с выходом 93%. 1H ЯМР (ДМСО-d6) δ 3,70 (с, 3H), 3,74 (с, 3H), 4,36 (д, J=6,0 Гц, 2H), 6,57-6,69 (м, 2H), 7,22-7,39 (м, 6H), 7,60 (д, J=8,4 Гц, 1Н).
Стадия 3: Смесь диметилового эфира 4-бензиламино-фталевой кислоты (1,11 г, 3,71 ммоль) и 3н гидроксида натрия (50 мл) в этаноле (100 мл) кипятят с обратным холодильником один час. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток растворяют в воде (100 мл), промывают CH2Cl2 (2×100 мл) и подкисляют (HCl), полученную смесь экстрагируют этилацетатом (2×100 мл). Объединенные органические экстракты промывают водой (2×100 мл) и сушат (MgSO4), и выпаривают в вакууме. Полученное твердое вещество перемешивают в эфире 2 часа. Твердое вещество отфильтровывают и сушат, получая 0,50 г 4-бензиламино-фталевой кислоты с выходом 74%. 1H ЯМР (ДМСО-d6) δ 4,35 (д, J=5,7 Гц, 2H), 6,59-6,62 (м, 2H), 7,10-7,34 (м, 6H), 7,54-7,57 (м, 1Н), 12,48 (ушир, 2H).
Стадия 4: Смесь 4-бензиламино-фталевой кислоты (0,47 г, 1,7 ммоль) и гидрохлорида рац-α-аминоглутаримида (0,29 г, 1,7 ммоль) в пиридине (10 мл) оставляют на ночь при кипении с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток распределяют между этилацетатом (150 мл) и разбавленной водной HCl (150 мл). Водную фазу экстрагируют этилацетатом (100 мл). Объединенные органические фазы промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), и растворитель удаляют в вакууме. Остаток хроматографируют, используя градиент метанол-CH2Cl2, элюируя продукт при соотношении метанол-CH2Cl2 2:98. Полученное таким образом твердое вещество перемешивают 30 минут в эфире и фильтруют, дополнительно промывают эфиром и сушат, получая 0,49 г продукта в виде желтого твердого вещества с выходом 78%. Т. пл. 239-241°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 9,15 (95,32%). 1H ЯМР(ДМСО-d6) δ 1,94-2,01 (м, 1Н), 2,43-2,59 (м, 2H), 2,81-2,93 (м, 1Н), 4,46 (д, J=6,0 Гц, 2H), 5,02 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 6,89 (дд, J=8,4 Гц, J=1,8 Гц, 1Н), 6,96 (д, J=1,5 Гц, 1Н), 7,23-7,33 (м, 1Н), 7,35 (д, J=4,2 Гц, 4H), 7,56 (д, J=8,4 Гц, 1Н), 7,71 (т, J=5,7 Гц, 1Н), 11,06 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,2, 30,9, 45,9, 48,6, 105,7, 115,9, 116,5, 125,0, 127,0, 127,1, 128,5, 134,0, 138,6, 154,2, 167,1, 167,6, 170,1, 172,8. Анализ: Вычислено для C20H17N3O4+0,1H2O: C, 65,78; H, 4,75; N, 11,51. Найдено: C, 65,49; H, 4,71; N: 11,45.
5.3 2-(2,6-Диоксо-пиперидин-3-ил)-5-[(фуран-2-ил-метил)амино]-изоиндол-1,3-дион
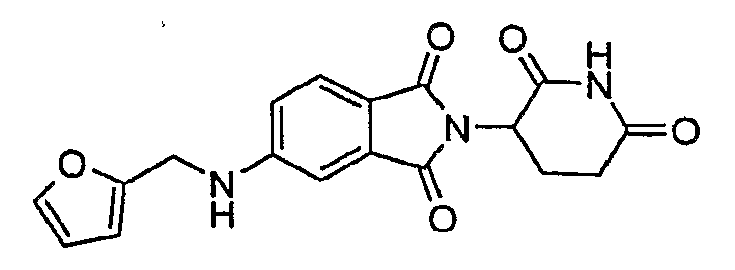
Стадия 1: Смесь диметилового эфира 4-амино-фталевой кислоты (0,84 г, 4,0 ммоль), 2-фуральдегида (0,66 мл, 8,0 ммоль) и уксусной кислоты (1,37 мл, 24,0 ммоль) в CH2Cl2 (40 мл) перемешивают 10 минут при комнатной температуре. Добавляют триацетоксиборогидрид натрия (2,54 г, 12,0 ммоль) и смесь оставляют на ночь при перемешивании. Реакционную смесь разбавляют CH2Cl2 (20 мл), промывают водой (2×100 мл), насыщенным раствором бикарбоната натрия (100 мл) и насыщенным раствором соли (100 мл) и сушат (MgSO4), и выпаривают в вакууме. Полученное масло хроматографируют, используя градиент этилацетат-гексаны, элюируя продукт при соотношении этилацетат-гексаны 40:60, 1,11 г диметилового эфира 4-[(фуран-2-илметил)амино]-фталевой кислоты с выходом 96%. 1H ЯМР (ДМСО-d6) δ 3,71 (с, 3H), 3,76 (с, 3H), 4,34 (д, J=5,7 Гц, 2H), 6,27-6,40 (м, 2H), 6,62-6,78 (м, 2H), 7,18 (т, J=5,7 Гц, 1Н), 7,59-7,64 (м, 2H).
Стадия 2: Смесь диметилового эфира 4-[(фуран-2-илметил)амино]-фталевой кислоты (1,11 г, 3,84 ммоль) и 3н гидроксида натрия (50 мл) в этаноле (100 мл) кипятят с обратным холодильником один час. Реакционную смесь охлаждают до комнатной температуры, и растворитель удаляют в вакууме. Остаток растворяют в воде (100 мл), промывают CH2Cl2 (2×100 мл) и подкисляют (HCl). Полученную смесь экстрагируют этилацетатом (2×100 мл), и органическую фазу промывают водой (2×100 мл) и сушат (MgSO4), и выпаривают. Полученное твердое вещество перемешивают в эфире 2 часа. Твердое вещество отфильтровывают и сушат, получая 0,44 г 4-[(фуран-2-илметил)амино]-фталевой кислоты с выходом 44%. 1H ЯМР (ДМСО-d6) δ 4,33 (д, J=5,1 Гц, 2H), 6,31 (д, J=3,0 Гц, 1Н), 6,39 (дд, J=3,0 Гц, 1,8 Гц, 1Н), 6,65-6,71 (м, 2H), 7,00 (т, J=5,7 Гц, 1Н), 7,57-7,60 (м, 2H), 12,51 (ушир, 2H).
Стадия 3: Смесь 4-[(фуран-2-илметил)амино]-фталевой кислоты (0,43 г, 1,7 ммоль) и гидрохлорида рац-α-аминоглутаримида (0,27 г, 1,7 ммоль) в пиридине (10 мл) оставляют на ночь при кипении с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры, и растворитель удаляют в вакууме. Остаток распределяют между этилацетатом (150 мл) и разбавленной водной HCl (150 мл). Водную фазу экстрагируют этилацетатом (100 мл). Объединенные органические фазы промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), и растворитель удаляют в вакууме. Остаток хроматографируют, используя градиент метанол-CH2Cl2, элюируя продукт при соотношении метанол-CH2Cl2 4:96. Полученное твердое вещество оставляют на ночь при перемешивании в эфире. Твердое вещество фильтруют, дополнительно промывают эфиром и сушат. Очищают препаративной ВЭЖХ, используя изократическое элюирование смесью ацетонитрил-вода, элюируя продукт при соотношении ацетонитрил-вода 45:55 и получая 0,24 г продукта в виде желтого твердого вещества с выходом 41%. Т. пл. 143-145°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 4,96 (96,16%). 1H ЯМР(ДМСО-d6) δ 1,96-2,03 (м, 1Н), 2,44-2,60 (м, 2H), 2,82-2,94 (м, 1Н), 4,44 (д, J=5,7 Гц, 2H), 5,03 (дд, J=12,6 Гц, J=5,1 Гц, 1H), 6,35-6,42 (м, 2H), 6,94-7,07 (м, 2H), 7,53-7,61 (м, 3H), 11,06 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,2, 30,9, 39,3, 48,6, 105,7, 107,5, 110,4, 116,0, 116,8, 124,9, 134,0, 142,5, 151,8, 154,0, 167,1, 167,6, 170,1, 172,8. Анализ: Вычислено для C18H15N3O5+0,1H2O: C, 60,88; H, 4,31; N, 11,83. Найдено: C, 60,58; H, 3,87; N: 11,59.
5.4 5-(3-Хлор-бензиламино)-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-дион
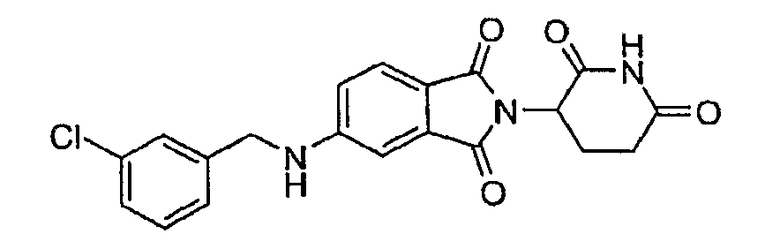
Стадия 1: Смесь диметилового эфира 4-амино-фталевой кислоты (0,84 г, 4,0 ммоль), 3-хлор-бензальдегида (0,91 мл, 8,0 ммоль) и уксусной кислоты (1,37 мл, 24,0 ммоль) в CH2Cl2 (40 мл) перемешивают 10 минут при комнатной температуре. Добавляют триацетоксиборогидрид натрия (2,54 г, 12,0 ммоль) и смесь оставляют на ночь при перемешивании. Реакционную массу разбавляют CH2Cl2 (20 мл), промывают водой (2×100 мл), насыщенным раствором бикарбоната натрия (100 мл) и насыщенным раствором соли (100 мл) и сушат (MgSO4), и выпаривают. Полученное масло хроматографируют, используя градиент этилацетат-гексаны, элюируя продукт при соотношении этилацетат-гексаны 35:65, 1,10 г диметилового эфира 4-(3-хлор-бензиламино)-фталевой кислоты с выходом 82%. 1H ЯМР (ДМСО-d6) δ 3,71 (с, 3H), 3,75 (с, 3H), 4,39 (д, J=6,0 Гц, 2H), 6,66-6,70 (м, 2H), 7,28-7,39 (м, 5H), 7,61 (д, J=9,0 Гц, 1Н).
Стадия 2: Смесь диметилового эфира 4-(3-хлор-бензиламино)-фталевой кислоты (1,10 г, 3,30 ммоль) и 3н гидроксида натрия (50 мл) в этаноле (100 мл) кипятят с обратным холодильником один час. Реакционную смесь охлаждают до комнатной температуры, и растворитель удаляют в вакууме. Остаток растворяют в воде (100 мл), промывают CH2Cl2 (2×100 мл) и подкисляют (HCl). Полученную смесь экстрагируют этилацетатом (2×100 мл), и органическую фазу промывают водой (2×100 мл), сушат (MgSO4) и выпаривают, получая 1,00 г 4-(3-хлор-бензиламино)-фталевой кислоты с выходом 99%. 1H ЯМР (ДМСО-d6) δ 4,37 (д, J=5,7 Гц, 2H), 6,59-6,62 (м, 2H), 7,18 (т, J=6,0 Гц, 1Н), 7,28-7,39 (м, 4H), 7,56-7,61 (м, 1Н), 12,51 (ушир, 2H).
Стадия 3: Смесь 4-(3-хлор-бензиламино)-фталевой кислоты (0,97 г, 3,2 ммоль) и гидрохлорида рац-α-аминоглутаримида (0,52 г, 3,2 ммоль) в пиридине (20 мл) оставляют на ночь при кипении с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры, и растворитель удаляют в вакууме. Остаток распределяют между этилацетатом (150 мл) и разбавленной водной HCl (150 мл). Водную фазу экстрагируют этилацетатом (100 мл). Объединенные органические фазы промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), и растворитель удаляют в вакууме. Остаток хроматографируют, используя градиент метанол-CH2Cl2, элюируя продукт при соотношении метанол-CH2Cl2 5:95. Полученное твердое вещество оставляют на ночь при перемешивании в метаноле (5 мл). Твердое вещество фильтруют, дополнительно промывают метанолом и сушат, получая 0,96 г продукта в виде желтого твердого вещества с выходом 76%. Т. пл. 250-252°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 6,46 (99,41%). 1H ЯМР (ДМСО-d6) δ 1,95-2,03 (м, 1Н), 2,42-2,59 (м, 2H), 2,81-2,93 (м, 1Н), 4,49 (д, J=6,0 Гц, 2H), 5,02 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 6,88-6,98 (м, 2H), 7,30-7,42 (м, 4H), 7,58 (д, J=8,4 Гц, 1Н), 7,72 (т, J=6,0 Гц, 1Н), 11,06 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,1, 30,9, 45,2, 48,6, 105,7, 116,0, 116,8, 125,1, 125,7, 126,9, 127,0, 130,4, 133,2, 134,1, 141,5, 154,0, 167,0, 167,5, 170,1, 172,8. Анализ: Вычислено для C20H16N3O4Cl+0,15H2O: C, 59,98; H, 4,10; N, 10,49. Найдено: C, 59,61; H, 3,84; N, 10,36.
5.5 5-[(Бензофуран-2-илметил)-амино]-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-дион

Стадия 1: Смесь диметилового эфира 4-амино-фталевой кислоты (0,84 г, 4,0 ммоль), 2-бензофуранкарбоксальдегида (0,83 мл, 8,0 ммоль) и уксусной кислоты (1,37 мл, 24,0 ммоль) в CH2Cl2 (40 мл) перемешивают 10 минут при комнатной температуре. Добавляют триацетоксиборогидрид натрия (2,54 г, 12,0 ммоль) и смесь оставляют на ночь при перемешивании. Реакционную массу разбавляют CH2Cl2 (20 мл), промывают водой (2×100 мл), насыщенным раствором бикарбоната натрия (100 мл) и насыщенным раствором соли (100 мл) и сушат (MgSO4), и выпаривают. Полученное масло хроматографируют, используя градиент этилацетат-гексаны, элюируя продукт при соотношении этилацетат-гексаны 25:75, 0,89 г диметилового эфира 4-[(бензофуран-2-илметил)-амино]-фталевой кислоты с выходом 65%. 1H ЯМР (ДМСО-d6) δ 3,71 (с, 3H), 3,76 (с, 3H), 4,56 (д, J=5,7 Гц, 2H), 6,76-6,83 (м, 3H), 7,20-7,29 (м, 2H), 7,35 (т, J=6,0 Гц, 1Н), 7,51-7,65 (м, 3H).
Стадия 2: Смесь диметилового эфира 4-[(бензофуран-2-илметил)-амино]-фталевой кислоты (0,89 г, 3,30 ммоль) и 3н гидроксида натрия (50 мл) в этаноле (100 мл) кипятят с обратным холодильником один час. Реакционную смесь охлаждают до комнатной температуры, и растворитель удаляют в вакууме. Остаток растворяют в воде (100 мл), промывают CH2Cl2 (2×100 мл) и подкисляют (HCl). Полученную смесь экстрагируют этилацетатом (2×100 мл), и объединенные органические слои промывают водой (2×100 мл), сушат (MgSO4) и выпаривают, получая 0,80 г 4-[(бензофуран-2-илметил)-амино]-фталевой кислоты с выходом 98%. 1H ЯМР (ДМСО-d6) δ 4,54 (д, J=4,5 Гц, 2H), 6,71-6,77 (м, 3H), 7,18-7,29 (м, 3H), 7,51-7,61 (м, 3H), 12,52 (ушир, 2H).
Стадия 3: Смесь 4-[(бензофуран-2-илметил)-амино]-фталевой кислоты (0,80 г, 2,6 ммоль) и гидрохлорида рац-α-аминоглутаримида (0,42 г, 2,6 ммоль) в пиридине (20 мл) оставляют на ночь при кипении с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры, и растворитель удаляют в вакууме. Остаток распределяют между этилацетатом (150 мл) и разбавленной водной HCl (150 мл). Водную фазу экстрагируют этилацетатом (100 мл). Объединенные органические фазы промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), и растворитель удаляют в вакууме. Остаток хроматографируют, используя градиент метанол-CH2Cl2, элюируя продукт при соотношении метанол-CH2Cl2 5:95. Соответствующие фракции собирают и обрабатывают углем для обесцвечивания (1,5 г), фильтруют через целит и выпаривают, получая 0,68 г продукта в виде желтого твердого вещества с выходом 66%. Т. пл. 259-261°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 5,14 (99,16%). 1H ЯМР (ДМСО-d6) δ 1,95-2,01 (м, 1Н), 2,43-2,60 (м, 2H), 2,81-2,93 (м, 1Н), 4,66 (д, J=6,0 Гц, 2H), 5,03 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 6,81 (с, 1Н), 7,01 (дд, J=8,4 Гц, J=2,1 Гц, 1Н), 7,12 (д, J=1,8 Гц, 1Н), 7,18-7,29 (м, 2H), 7,52-7,61 (м, 3H), 7,72 (т, J=5,7 Гц, 1Н), 11,06 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,2, 30,9, 48,6, 104,0, 105,8, 110,9, 116,1, 117,1, 120,9, 122,8, 124,0, 125,0, 127,9, 134,0, 153,9, 154,2, 155,1, 167,1, 167,5, 170,1, 172,8. Анализ: Вычислено для C22H17N3O5+0,1H2O: C, 65,21; H, 4,28; N, 10,37. Найдено: C, 65,07; H, 4,29; N, 10,32.
5.6 2-(4-Хлор-фенил)-N-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-ацетамид
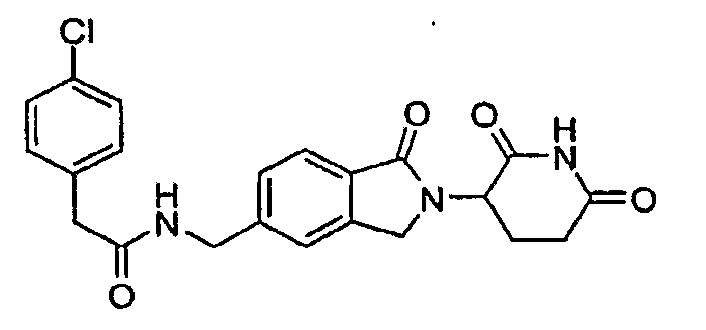
Смесь гидрохлорида 3-(5-аминометил-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона (0,40 г, 1,29 ммоль), 4-хлорфенилацетилхлорида (0,19 мл, 1,29 ммоль) и диизопропилэтиламина (0,41 мл, 2,37 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 2 дня. Добавляют дополнительный 4-хлорфенилацетилхлорид (0,04 мл) и реакционную смесь перемешивают 2 часа. Твердую фазу отфильтровывают, промывают дополнительно ацетонитрилом и водой, получая 0,13 г продукта с выходом 24%. Т. пл. 264-266°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 3,23 (98,97%). 1H ЯМР (ДМСО-d6) δ 1,96-2,03 (м, 1Н), 2,32-2,46 (м, 1Н), 2,53-2,63 (м, 1Н), 2,86-2,98 (м, 1Н), 3,51 (с, 2H), 4,25-4,45 (м, 4H), 5,1 1 (дд, J=13,2 Гц, J=5,1 Гц, 1Н), 7,29-7,42 (м, 6H), 7,67 (д, J=7,8 Гц, 1Н), 8,67 (т, J=6,0 Гц, 1Н), 10,99 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,5, 31,2, 41,5, 42,2, 47,1, 51,6, 122,0, 122,9, 127,0, 128,1, 130,4, 130,9, 131,1, 135,3, 142,3, 143,7, 167,9, 169,9, 171,0, 172,9. Анализ: Вычислено для C22H20N3O4Cl+0,2H2O: C, 61,53; H, 4,79; N, 9,78. Найдено: C, 61,52; H, 4,44; N, 9,40.
5.7 N-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-трифторметоксибензамид
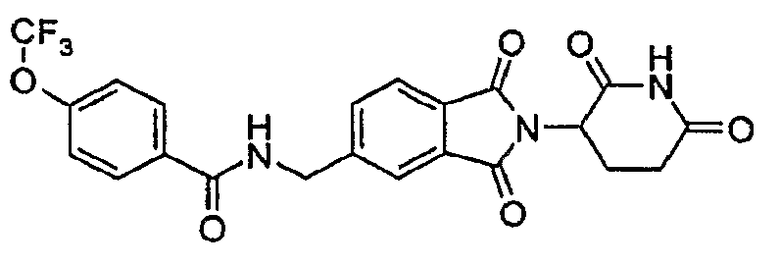
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль), 4-трифторметоксибензоилхлорида (0,70 г, 3,1 ммоль) и триэтиламина (0,63 г, 6,2 ммоль) в ДМФА (20 мл) перемешивают в атмосфере азота при комнатной температуре 1 час. Смесь распределяют между этилацетатом (75 мл) и водой (75 мл), и водную фазу экстрагируют этилацетатом (75 мл). Объединенные органические слои промывают водой (3×100 мл) и выпаривают. Остаток хроматографируют в этилацетате, получая 1,1 г продукта с выходом 75%. Т. пл. 200-202°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 4,85 (97,90%). 1H ЯМР (ДМСО-d6) δ 2,02-2,10 (м, 1Н), 2,46-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,66 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,48-7,51 (м, 2H), 7,81-7,91 (м, 3H), 8,02-8,05 (м, 2H), 9,34 (т, J=6,0 Гц, 1Н), 11,13 (с, 1Н); 13C ЯМР (ДМСО-d6) δ
22,0, 30,9, 42,7, 48,9, 119,9 (кв, J=255), 120,7, 122,0, 123,5, 129,6, 129,8, 131,6, 133,0, 133,4, 147,3, 150,4, 165,2, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C22H16F3N3O6: C, 55,58; H, 3,39; N, 8,84. Найдено: C, 55,38; H, 3,18; N, 8,69.
5.8 N-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-метил-бензамид

Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 4-(трифторметил)-бензоилхлорида (0,45 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют и остаток растворяют в этилацетате (100 мл). Органическую фазу промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Остаток хроматографируют, используя градиент метанол-CH2Cl2, элюируя продукт при соотношении метанол-CH2Cl2 5:95. Полученное твердое вещество оставляют на ночь при перемешивании в эфире, фильтруют и высушивают, получая 0,66 г продукта с выходом 48%. Т. пл. 168-170°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 8,49 (95,33%). 1H ЯМР (ДМСО-d6) δ 2,02-2,09 (м, 1Н), 2,46-2,63 (м, 2H), 2,84-2,96 (м, 1Н), 4,68 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,1 Гц, 1Н), 7,71-8,12 (м, 7H), 9,46 (т, J=6,0 Гц, 1Н), 11,13 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,7, 49,0, 122,0, 123,6, 123,9 (кв, J=270,8 Гц), 125,4 (кв, J=3,75 Гц), 128,2, 129,9, 131,3 (кв, J=31,5 Гц), 131,6, 133,5, 137,7, 147,2, 165,3, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C22H16N3O5F3: C, 57,52; H, 3,51 ; N, 9,15. Найдено: C, 57,27; H, 3,35; N, 9,00.
5.9 [2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-амид тиофен-2-карбоновой кислоты

Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 2-тиофенкарбонилхлорида (0,32 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в CH2Cl2 (20 мл) перемешивают при комнатной температуре 2 дня. Органическую фазу промывают разбавленной водной HCl (2×50 мл) и водой (2×50 мл), сушат (MgSO4) и выпаривают в вакууме. Остаток хроматографируют, используя градиент метанол-CH2Cl2, элюируя продукт при соотношении метанол-CH2Cl2 3:97. Полученное твердое вещество перемешивают в этилацетате 1 час, фильтруют и получают 0,69 г продукта с выходом 58%. Т. пл. 219-221°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 5,84 (95,85%). 1H ЯМР (ДМСО-d6) δ 1,99-2,09 (м, 1Н), 2,46-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,62 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,18 (дд, J=5,1 Гц, J=3,6 Гц, 1Н), 7,79-7,84 (м, 4H), 7,91 (д, J=7,8 Гц, 1Н), 9,23 (т, J=6,0 Гц, 1Н), 11,13 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,4, 49,0, 121,9, 123,6, 128,0, 128,4, 129,8, 131,2, 131,6, 133,4, 139,3, 147,4, 161,4, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C19H15N3O5S: C, 57,42; H, 3,80; N, 10,57. Найдено: C, 57,49; H, 3,42; N, 10,28.
5.10 [2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-амид гексановой кислоты
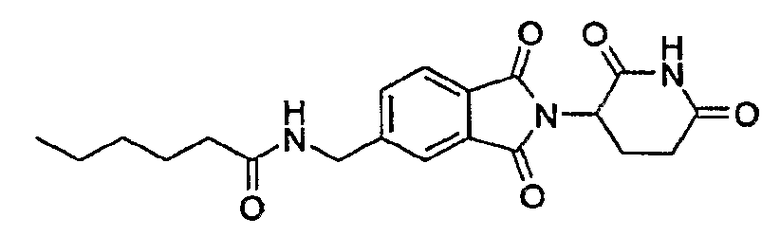
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), гексаноилхлорида (0,42 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) оставляют на ночь при перемешивании при 40°С. Реакционную смесь охлаждают до комнатной температуры, и растворитель удаляют в вакууме. Остаток растворяют в этилацетате (150 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Остаток оставляют на ночь при перемешивании в эфире (20 мл). Полученное твердое вещество фильтруют и выпаривают в вакууме, получая 0,71 г продукта с выходом 61%. Т. пл. 178-180°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 8,83 (98,70%). 1H ЯМР (ДМСО-d6) δ 0,86 (т, J=6,6 Гц, 3H), 1,27-1,33 (м, 4H), 1,48-1,58 (м, 2H), 2,02-2,09 (м, 1Н), 2,16 (т, J=7,5 Гц, 2H), 2,46-2,63 (м, 2H), 2,83-2,96 (м, 1Н), 4,43 (д, J=6,0 Гц, 2H), 5,14 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,72-7,90 (м, 3H), 8,51 (т, J=6,0 Гц, 1Н), 11,13 (с, 1Н); 13C 1H ЯМР (ДМСО-d6) δ 13,8, 21,8, 22,0, 24,9, 30,9, 30,9, 35,2, 41,8, 49,0, 121,8, 123,5, 129,7, 131,6, 133,3, 147,8, 167,0, 167,1, 169,8, 172,5, 172,7. Анализ: Вычислено для C20H23N3O5: C, 62,33; H, 6,02; N, 10,90. Найдено: C, 62,20; H, 5,99; N, 10,84.
5.11 [2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-амид гептановой кислоты
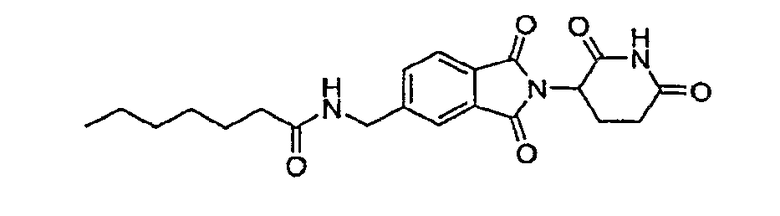
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), гептаноилхлорида (0,46 мл, 3,0 ммоль) и диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Остаток растворяют в этилацетате (100 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Остаток очищают препаративной ВЭЖХ, используя изократическое элюирование смесью ацетонитрил:вода 45:65, получая 0,60 г продукта с выходом 50%. Т. пл. 141-143°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 3,99 (98,05%). 1H ЯМР (ДМСО-d6) δ 0,84 (т, J=6,6 Гц, 3H), 1,24-1,30 (м, 6H), 1,48-1,54 (м, 2H), 2,02-2,09 (м, 1Н), 2,16 (т, J=7,2 Гц, 3H), 2,51-2,63 (м, 2H), 2,83-2,96 (м, 1Н), 4,43 (д, J=6,0 Гц, 2H), 5,14 (дд, J=5,4, 12,9 Гц, 1Н), 7,72-7,89 (м, 3H), 8,50 (т, J=6,0 Гц, 1Н), 11,12 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 13,9, 22,0, 25,2, 28,3, 30,9, 31,0, 35,3, 41,8, 49,0, 121,8, 123,4, 129,7, 131,6, 133,3, 147,8, 167,0, 167,1, 169,8, 172,5, 172,7. Анализ: Вычислено для C21H25N3O5+0,1H2O: C, 62,86; H, 6,33; N, 10,47. Найдено: C, 62,54; H, 6,21; N, 10,38.
5.12 Трет-бутиловый эфир 5-{[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-карбамоил}-пентановой кислоты
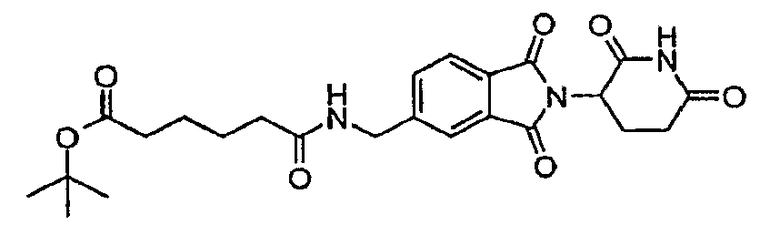
Стадия 1: К раствору монометилового эфира адипиновой кислоты (4,8 г, 30 ммоль) в ДМФА (30 мл) добавляют CDI (4,9 г, 30 ммоль) и полученную смесь перемешивают в атмосфере азота при 40°С 1 час. Добавляют трет-бутанол (4,4 г, 60 ммоль) и DBU (4,6 г, 30 ммоль) и проводят перемешивание при 40°С 70 часов. Смесь выливают в эфир (100 мл) и данную смесь промывают 10% водн. НОАс (100 мл), 10% водн. К2СО3 (100 мл) и водой (3×100 мл), сушат (MgSO4) и выпаривают, получая 5,1 г трет-бутилово-метилового эфира гександикарбоновой кислоты с выходом 78%. 1H ЯМР (CDCl3) δ 1,44 (с, 9H), 1,59-1,67 (м, 4H), 2,21-2,26 (м, 2H), 3,67 (с, 3H).
Стадия 2: Гидроксид лития (0,53 г, 22 ммоль) добавляют к раствору трет-бутилово-метилового эфира гександикарбоновой кислоты (4,8 г, 22 ммоль) в смеси метанол:вода 3:1 (80 мл) и полученную смесь перемешивают при комнатной температуре 16 часов. Смесь выпаривают в вакууме. Остаток распределяют между водой (60 мл) и метиленхлоридом (75 мл), и водную фазу промывают метиленхлоридом (3×75 мл) и выпаривают, получая 4,0 г литиевой соли моно-трет-бутилового эфира гександикарбоновой кислоты. 1H ЯМР (D2O) δ 1,45 (с, 9H), 1,54-1,58 (м, 4H), 2,15-2,20 (м, 2H), 2,25-2,34 (м, 2H).
Стадия 3: DBU (1,9 г, 12,3 ммоль) добавляют к перемешиваемой суспензии гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (2,5 г, 7,7 ммоль) в ацетонитриле (75 мл), что приводит к образованию прозрачного раствора. Смесь перемешивают при комнатной температуре 10 минут, а затем добавляют литиевую соль моно-трет-бутилового эфира гександикарбоновой кислоты (1,9 г, 9,2 ммоль) и HOBt (1,2 г, 9,2 ммоль) с последующим добавлением EDC (2,2 г, 11,6 ммоль). Смесь перемешивают в атмосфере N2 1 час и добавляют ДМФА (20 мл). После перемешивания в течение дополнительных 16 часов смесь выпаривают в вакууме. Остаток распределяют между этилацетатом (100 мл) и водой (100 мл), водную фазу экстрагируют этилацетатом (2×100 мл). Объединенные органические слои промывают водой (3×100 мл) и выпаривают. Остаток хроматографируют на оксиде кремния, элюируя этилацетатом, получая 2,1 г продукта с выходом 58%. Т. пл. 108-110°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 35/65 CH3CN/0,1% H3PO4, 7,64 (96,65%). 1H ЯМР (ДМСО-d6) δ 1,38 (с, 9H), 1,45-1,55 (м, 4H), 2,02-2,08 (м, 1Н), 2,15-2,21 (м, 4H), 2,46-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,43 (д, J=5,8 Гц, 2H), 5,14 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,72-7,76 (м, 2H), 7,87 (д, J=7,5 Гц, 1Н), 8,51 (т, J=5,8 Гц, 1Н), 11,12 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,0, 24,2, 24,6, 27,7, 30,9, 34,5, 34,9, 41,9, 49,0, 79,4, 121,9, 123,4, 129,7, 131,6, 133,3, 147,8, 167,0, 167,1, 169,8, 172,1, 172,2, 172,8. Анализ: Вычислено для C24H29N3O7+0,2H2O: C, 60,67; H, 6,24; N, 8,84. Найдено: C, 60,60; H, 6,16; N, 8,65.
5.13 5-{[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]карбамоил}-пентановая кислота

Раствор трет-бутилового эфира 5-{[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]карбамоил}-пентановой кислоты (0,85 г, 1,8 ммоль) в муравьиной кислоте (25 мл) перемешивают при комнатной температуре 90 минут. Смесь выпаривают в вакууме и остаток растирают в смеси эфир/этилацетат и фильтруют, получая 0,66 г с выходом 88%. Т. пл. 144-146°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 4,15 (95,81%). 1H ЯМР (ДМСО-d6) δ 1,44-1,59 (м, 4H), 2,02-2,09 (м, 1Н), 2,16-2,24 (м, 4H), 2,46-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,43 (д, J=6,0 Гц, 2H), 5,14 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,72-7,77 (м, 2H), 7,87 (д, J=7,8 Гц, 1Н), 8,51 (т, J=6,0 Гц, 1Н), 11,12 (с, 1Н), 12,00 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,0, 24,1, 24,7, 30,9, 33,3, 34,9, 41,9, 48,9, 121,9, 123,5, 129,7, 131,6, 133,3, 147,8, 167,0, 167,1, 169,8, 172,2, 172,7, 174,3. Анализ: Вычислено для C20H21N3O7+0,2H2O: C, 57,33; H, 5,13; N, 10,03. Найдено: C, 57,33; H, 4,89; N, 9,81.
5.14 [2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-амид 6-(2-оксо-оксазолидин-3-ил)-гексановой кислоты
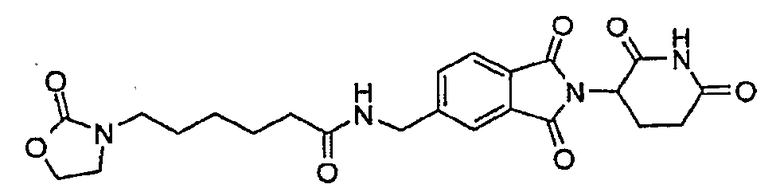
Стадия 1: Смесь 2-оксазолидинона (1,74 г, 20,0 ммоль), этил-6-бромгексаноата (4,46 г, 20,0 ммоль) и гидрида натрия (0,80 г 60% дисперсии, 20 ммоль) в ацетонитриле (10 мл) нагревают до 160°С в микроволновом реакторе 15 минут. Смесь охлаждают и растворитель удаляют при пониженном давлении. Неочищенный продукт - этиловый эфир 6-(2-оксо-оксазолидин-3-ил)-гексановой кислоты - используют непосредственно на следующей стадии.
Стадия 2: Гидроксид лития (0,48 г, 20 ммоль) добавляют к неочищенному продукту со стадии 1 в смеси метанол-вода (30 мл) и полученную смесь перемешивают при комнатной температуре 70 часов. Смесь выпаривают в вакууме. Остаток растворяют в воде (75 мл), промывают метиленхлоридом (3×75 мл) и подкисляют (HCl). Полученную смесь экстрагируют метиленхлоридом (6×50 мл), и объединенные экстракты сушат (MgSO4) и выпаривают, получая 2,0 г 6-(2-оксо-оксазолидин-3-ил)-гексановой кислоты с общим выходом 49% на двух стадиях. 1H ЯМР (CDCl3) δ 1,36-1,44 (м, 2H), 1,51-1,74 (м, 4H), 2,38 (т, J=7,4 Гц, 2H), 3,28 (т, J=7,2 Гц, 2H), 3,56 (т, J=8,0 Гц, 2H), 4,33 (т, J=8,0 Гц, 2H).
Стадия 3: DBU (1,2 г, 8,1 ммоль) добавляют к перемешиваемой суспензии гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль) в ацетонитриле (35 мл), что приводит к образованию прозрачного раствора. Смесь перемешивают при комнатной температуре 10 минут, а затем добавляют 6-(2-оксо-оксазолидин-3-ил)-гексановую кислоту (2,0 г, 10 ммоль) и HOBt (0,5 г, 3,7 ммоль) с последующим добавлением EDC (0,89 г, 4,7 ммоль). После перемешивания в течение дополнительных 16 часов смесь выпаривают в вакууме. Остаток распределяют между этилацетатом (50 мл) и водой (100 мл), и водную фазу экстрагируют этилацетатом (3×50 мл). Объединенные органические слои выпаривают. Остаток хроматографируют на оксиде кремния, используя градиент метиленхлорид-метанол, элюируя 0,61 г продукта при соотношении метиленхлорид-метанол 93:7 с выходом 42%. Т. пл. 178-180°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 3,36 (98,33%). 1H ЯМР (ДМСО-d6) δ 1,26-1,28 (м, 2H), 1,43-1,61 (м, 4H), 2,04-2,08 (м, lH), 2,18 (т, J=7,4 Гц, 2H), 2,46-2,63 (м, 2H), 2,83-2,96 (м, 1Н), 3,12 (т, J=7,1 Гц, 2H), 3,49 (т, J=8,0 Гц, 2H), 4,42 (т, J=8,0 Гц, 2H), 4,43 (д, J=5,8 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,72-7,77 (м, 2H), 7,89 (д, J=7,8 Гц, 1Н), 8,51 (т, J=5,8 Гц, 1Н), 11,12 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,0, 24,8, 25,7, 26,4, 30,9, 35,1, 41,9, 43,3, 43,8, 49,0, 61,5, 121,8, 123,5, 129,7, 131,6, 133,3, 147,8, 157,8, 167,0, 167,1, 169,8, 172,4, 172,7. Анализ: Вычислено для C23H26N4O7+0,3H2O: C, 58,05; H, 5,63; N, 11,77. Найдено: C, 58,05; H, 5,42; N, 11,62.
5.15 Гексиловый эфир [2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-карбаминовой кислоты
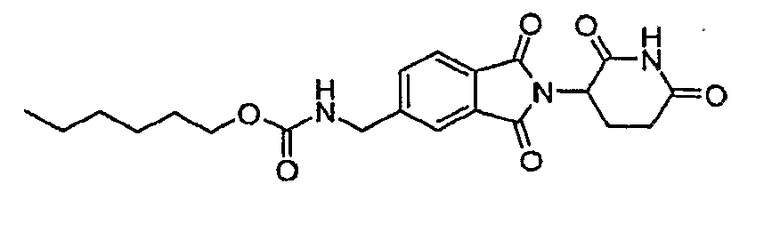
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль), гексилхлорформиата (0,51 г, 3,1 ммоль) и триэтиламина (0,63 г, 6,2 ммоль) в ТГФ (35 мл) перемешивают при 40°С в атмосфере азота 3 часа. Смесь охлаждают и разбавляют этилацетатом (100 мл), промывают водой (3×100 мл) и выпаривают. Остаток хроматографируют, используя градиент метиленхлорид-метанол, элюируя продукт при соотношении метиленхлорид-метанол 19:1. Данное вещество далее очищают препаративной ВЭЖХ, используя изократическое элюирование смесью ацетонитрил-вода 50-50, и получают 0,40 г в виде белого твердого вещества с выходом 31%. Т. Пл. 111-113°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 5,08 (99,11%). 1H ЯМР (ДМСО-d6) δ 1,11-1,57 (м, 11Н), 2,02-2,07 (м, 1Н), 2,46-2,63 (м, 2H), 2,84-2,96 (м, 1Н), 3,97 (т, J=8,3 Гц, 2H), 4,35 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,72-7,77 (м, 2H), 7,84-7,90 (м, 2H), 11,13 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 13,8, 22,0, 25,0, 28,6, 30,8, 30,9, 43,5, 49,0, 64,0, 121,6, 123,5, 129,8, 131,6, 133,2, 147,9, 156,6, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C21H15N3O6: C, 60,71; H, 6,07; N, 10,11. Найдено: C, 60,49; H, 6,13; N, 9,91.
5.16 4-Хлор-N-[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-бензамид
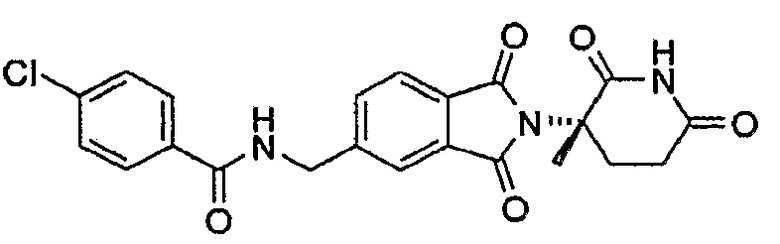
Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,4 г, 1,18 ммоль), 4-хлорбензоилхлорида (0,15 мл, 1,18 ммоль) и диизопропилэтиламина (0,41 мл, 2,37 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют, остаток растворяют в этилацетате (100 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме, получая 0,49 г продукта с выходом 94%. Т. пл. 163-165°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 3,38 (98,94%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,53-2,60 (м, 2H), 2,63-2,71 (м, 1Н), 4,62 (д, J=6,0 Гц, 2H), 7,56-7,59 (м, 2H), 7,77-7,83 (м, 3H), 7,90-7,94 (м, 2H), 9,30 (т, J=5,7 Гц, 1Н), 11,02 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 21,0, 28,5, 29,1, 42,6, 58,7, 121,6, 123,2, 128,5, 129,2, 129,6, 131,4, 132,6, 133,4, 136,3, 147,2, 165,4, 167,7, 167,9, 172,1, 172,2. Анализ: Вычислено для C22H18N3O5Cl: C, 60,08; H, 4,12; N, 9,55. Найдено: C, 59,70; H, 3,94; N, 9,43.
5.17 N-[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-трифторметокси-бензамид
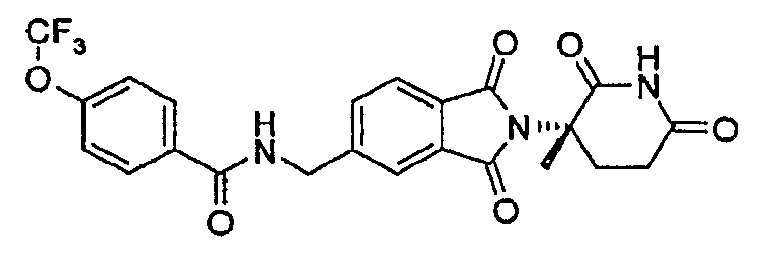
Смесь гидрохлорида 5-аминометил-2-((3S)-3-метил-2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,4 г, 1,18 ммоль), 4-(трифторметокси)бензоилхлорида (0,19 мл, 1,18 ммоль) и диизопропилэтиламина (0,41 мл, 2,37 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют, остаток растворяют в этилацетате (100 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Остаток перемешивают в эфире (20 мл). Твердое вещество фильтруют, получая 0,42 г продукта с выходом 72%. Т. пл. 161-163°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 5,58 (97,42%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,49-2,60 (м, 2H), 2,63-2,72 (м, 1Н), 4,63 (д, J=6,0 Гц, 2H), 7,48-7,51 (м, 2H), 7,78-7,84 (м, 3H), 8,00-8,05 (м, 2H), 9,34 (т, J=5,7 Гц, 1Н), 11,02 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 21,0, 28,5, 29,1, 42,6, 58,7, 119,9 (кв, J=255), 120,7, 121,6, 123,2, 125,0, 129,6, 131,4, 133,0, 133,4, 147,2, 150,4, 165,2, 167,7, 167,8, 172,1, 172,2. Анализ: Вычислено для C23H18N3O6F3: C, 56,45; H, 3,71; N, 8,59. Найдено: C, 56,16; H, 3,39; N, 8,45.
5.18 [2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-амид гексановой кислоты
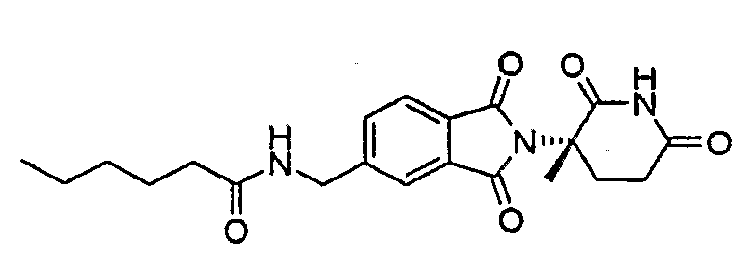
Смесь гидрохлорида 5-аминометил-2-((3S)-3-метил-2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,40 г, 1,2 ммоль), гексаноилхлорида (0,17 мл, 1,2 ммоль) и N,N-диизопропилэтиламина (0,41 мл, 2,4 ммоль) в безводном ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют, и остаток растворяют в этилацетате (100 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Полученное твердое вещество оставляют на ночь при перемешивании в эфире, фильтруют и сушат, получая 0,36 г продукта с выходом 77%. Т. пл. 154-156°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 4,51 (97,79%). 1H ЯМР (ДМСО-d6) δ 0,85 (т, J=6,9 Гц, 3H), 1,19-1,32 (м, 4H), 1,48-1,57 (м, 2H), 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,15 (т, J=7,5 Гц, 2H), 2,53-2,60 (м, 2H), 2,63-2,72 (м, 1Н), 4,41 (д, J=6,0 Гц, 2H), 7,68-7,81 (м, 3H), 8,49 (т, J=6,0 Гц, 1Н), 11,02 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 13,8, 21,0, 21,8, 24,9, 28,6, 29,1, 30,9, 35,2, 41,8, 58,7, 121,4, 123,1, 129,5, 131,3, 133,2, 147,7, 167,7, 167,9, 172,1, 172,2, 172,4. Анализ: Вычислено для C21H25N3O5: C, 63,15; H, 6,31; N, 10,52. Найдено: C, 63,06; H, 6,14; N, 10,48.
5.19 Гексиловый эфир {2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил}-карбаминовой кислоты
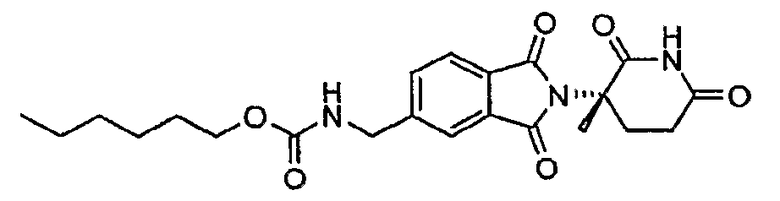
Смесь гидрохлорида 5-аминометил-2-((3S)-3-метил-2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,40 г, 1,18 ммоль), гексилхлорформиата (0,19 г, 1,18 ммоль) и диизопропилэтиламина (0,41 мл, 2,37 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют, и остаток растворяют в этилацетате (100 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме, получая 0,45 г продукта с выходом 88%. Т. пл. 95-97°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 6,94 (97,26%). 1H ЯМР (ДМСО-d6) δ 0,78-0,86 (м, 3H), 1,09-1,26 (м, 6H), 1,52-1,54 (м, 2H), 1,89 (с, 3H), 1,99-2,08 (м, 1Н), 2,54-2,59 (м, 2H), 2,64-2,72 (м, 1Н), 3,96 (т, J=6,6 Гц, 2H), 4,33 (д, J=6,0 Гц, 2H), 7,70-7,87 (м, 4H), 11,02 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 13,8, 21,0, 22,0, 25,0, 28,6, 29,1, 30,9, 43,5, 58,7, 64,0, 121,3, 123,1, 129,6, 131,4, 133,1, 147,7, 156,6, 167,7, 167,8, 172,1, 172,2. Анализ: Вычислено для C22H27N3O6: C, 61,53; H, 6,34; N, 9,78. Найдено: C, 61,73; H, 6,33; N, 9,58.
5.20 3,4-Дихлор-N-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]бензамид

Смесь гидрохлорида 3-(5-аминометил-1-оксо-1,3-дигидро- изоиндол-2-ил)-пиперидин-2,6-диона (0,50 г, 1,6 ммоль), 3,4-дихлорбензоилхлорида (0,34 г, 1,6 ммоль) и ТЕА (0,32 г, 3,2 ммоль) в ТГФ (25 мл) нагревают до 40°С при перемешивании в атмосфере N2 2,5 часа. Смесь фильтруют, отфильтрованное твердое вещество загружают на колонку с силикагелем, которуют промывают, используя градиент метиленхлорид-метанол. Продукт элюируют при соотношении метиленхлорид-метанол 93:7, 0,42 г, выход 58%. Т. пл. 260-262°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 3,36 (99,65%). 1H ЯМР (ДМСО-d6) δ 1,96-2,03 (м, 1Н), 2,31-2,43 (м, 1Н), 2,56-2,62 (м, 1Н), 2,85-2,97 (м, 1Н), 4,30 (д, J=17,4 Гц, 1Н), 4,44 (д, J=17,4 Гц, 1Н), 4,59 (д, J=6,0 Гц, 2H), 5,11 (дд, J=13,4 Гц, J=5,0 Гц, 1Н), 7,45-7,55 (м, 2H), 7,70 (д, J=7,8, 1Н), 7,78 (д, J=8,4 Гц, 1Н), 7,88 (дд, J=8,4 Гц, J=1,8 Гц, 1Н), 8,14 (д, J=2,1 Гц, 1H), 9,33 (т, J=6,0 Гц, 1Н), 10,98 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,5, 31,2, 42,9, 47,1, 51,6, 122,2, 123,0, 127,2, 127,6, 129,2, 130,4, 130,7, 131,3, 134,1, 134,4, 142,4, 143,4, 164,0, 167,9, 171,0, 172,8. Анализ: Вычислено для C21H17Cl2N3O4+0,25H2O: C, 55,95; H, 3,91; N, 9,32. Найдено: C, 55,98; H, 3,55; N, 9,32.
5.21 N-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-трифторметокси-бензамид
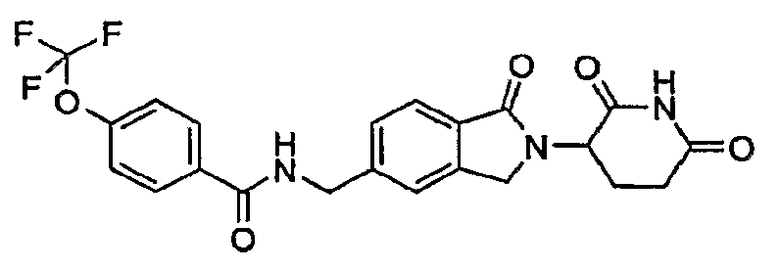
Смесь гидрохлорида 3-(5-аминометил-1-оксо-1,3-дигидро- изоиндол-2-ил)-пиперидин-2,6-диона (0,40 г, 1,29 ммоль), 4-(трифторметокси)бензоилхлорида (0,20 мл, 1,29 ммоль) и диизопропилэтиламина (0,41 мл, 2,37 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Твердое вещество фильтруют, дополнительно промывают ацетонитрилом (20 мл) и сушат, получая 0,41 г продукта с выходом 68%. Т. пл. 133-135°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 5,44 (99,98%). 1H ЯМР (ДМСО-d6) δ
1,98-2,01 (м, 1Н), 2,27-2,45 (м, 1Н), 2,57-2,62 (м, 1Н), 2,85-2,97 (м, 1Н), 4,30 (д, J=17,1 Гц, 1Н), 4,45 (д, J=17,4 Гц, 1Н), 4,60 (д, J=5,7 Гц, 2H), 5,11 (дд, J=13,5 Гц, J=5,1 Гц, 1Н), 7,46-7,55 (м, 4H), 7,70 (д, J=7,8 Гц, 1Н), 8,04 (д, J=8,7 Гц, 2H), 9,27 (т, J=5,7 Гц, 1H), 10,98 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,5, 31,2, 42,8, 47,1, 51,6, 119,9 (кв, J=255,8 Гц), 120,7, 122,1, 122,9, 127,1, 129,6, 130,4, 133,2, 142,4, 143,7, 150,3, 165,1, 167,9, 171,0, 172,8. Анализ: Вычислено для C22H18N3O5F3+0,15H2O: C, 56,94; H, 3,97; N, 9,05. Найдено: C, 56,54; H, 3,63; N, 8,95.
5.22 [2-(2,6-Диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]амид фуран-2-карбоновой кислоты
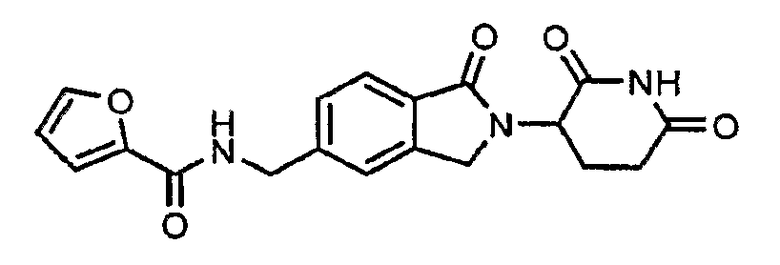
Смесь гидрохлорида 3-(5-аминометил-1-оксо-1,3-дигидро- изоиндол-2-ил)-пиперидин-2,6-диона (0,40 г, 1,29 ммоль), 2-фуроилхлорида (0,13 мл, 1,29 ммоль) и диизопропилэтиламина (0,41 мл, 2,37 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь фильтруют, и твердое вещество дополнительно промывают ацетонитрилом (20 мл) и сушат, получая 0,33 г продукта с выходом 71%. Т. пл. 338-340°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 5,65 (96,68%). 1H ЯМР (ДМСО-d6) δ 1,97-2,10 (м, 1Н), 2,19-2,45 (м, 1Н), 2,50-2,62 (м, 1Н), 2,73-3,03 (м, 1Н), 4,30 (д, J=17,1 Гц, 1Н), 4,44 (д, J=17,4 Гц, 1Н), 4,53 (д, J=5,7 Гц, 2H), 5,10 (дд, J=13,2 Гц, J=5,1 Гц, 1Н), 6,64-8,20 (м, 6H), 9,04 (т, J=6,0 Гц, 1Н), 10,98 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 22,5, 31,2, 42,0, 47,1, 51,6, 111,9, 113,6, 122,1, 122,9, 127,1, 130,4, 142,4, 143,7, 145,1, 147,7, 157,8, 167,9, 171,0, 172,8. Анализ: Вычислено для C19H17N3O5+0,1H2O: C, 61,82; H, 4,70; N, 11,38. Найдено: C, 61,45; H, 4,46; N, 11,37.
5.23 [2-(2,6-Диоксо-пиперидин-3-ил]-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]амид гексановой кислоты
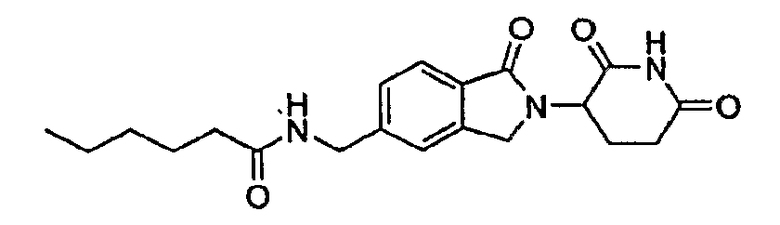
Смесь гидрохлорида 3-(5-аминометил-1-оксо-1,3-дигидро- изоиндол-2-ил)-пиперидин-2,6-диона (0,40 г, 1,29 ммоль), гексаноилхлорида (0,18 мл, 1,29 ммоль) и диизопропилэтиламина (0,41 мл, 2,37 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Твердое вещество фильтруют и дополнительно промывают ацетонитрилом, получают 0,26 г продукта с выходом 55%. Т. пл. 206-208°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 5,30 (98,77%). 1H ЯМР (ДМСО-d6) δ 0,86 (т, J=6,6 Гц, 3H), 1,25-1,29 (м, 4H), 1,48-1,58 (м, 2H), 1,98-2,01 (м, 1Н), 2,14 (т, J=7,2 Гц, 2H), 2,33-2,42 (м, 1Н), 2,57-2,63 (м, 1Н), 2,86-2,98 (м, 1Н), 4,27-4,47 (м, 4H), 5,11 (дд, J=13,2 Гц, J=4,8 Гц, 1Н), 7,37-7,45 (м, 2H), 7,68 (д, J=7,8 Гц, 1Н), 8,40 (т, J=5,4 Гц, 1Н), 10,98 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 13,8, 21,8, 22,5, 24,9, 30,9, 31,2, 35,3, 42,0, 47,1, 51,6, 122,0, 122,9, 127,0, 130,3, 142,3, 144,1, 167,9, 171,0, 172,2, 172,8. Анализ: Вычислено для C20H25N3O4+0,1H2O: C, 64,36; H, 6,81; N, 11,26. Найдено: C, 64,16; H, 6,80; N, 11,17.
5.24 [2-(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]амид пиридин-2-карбоновой кислоты
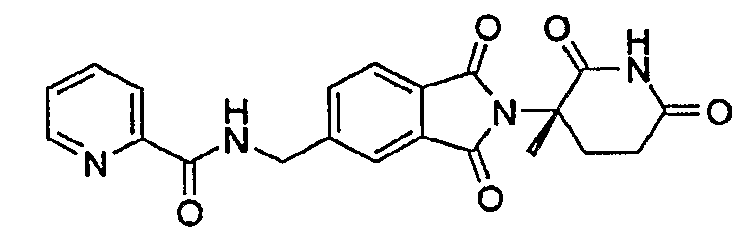
Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,85 г, 2,5 ммоль), гидрохлорида пиколиноилхлорида (0,45 г, 2,5 ммоль) и триэтиламина (0,76 г, 7,5 ммоль) в безводном ацетонитриле (20 мл) перемешивают при комнатной температуре 13 часов. Реакционную смесь фильтруют. Фильтрат концентрируют в вакууме и остаток растворяют в этилацетате (100 мл). Органическую фазу промывают 4н водной HCl (150 мл) и нейтрализуют бикарбонатом натрия. Твердый осадок выделяют фильтрацией, промывают водой (200 мл) и сушат, получая продукт в виде белого твердого вещества (0,47 г, 46%). Т. пл. 365-367°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 6,59 (96,15%). 1H ЯМР (ДМСО-d6) δ 1,88 (с, 3H), 2,01-2,07 (м, 1Н), 2,54-2,74 (м, 3H), 4,64 (д, J=6,3 Гц, 2H), 7,61-7,65 (м, 1Н), 7,79-7,83 (м, 3H), 7,98-8,06 (м, 2H), 8,68 (д, J=4,8 Гц, 1Н), 9,61 (т, J=6,3 Гц, 1Н), 11,01 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 21,0, 28,5, 29,1, 42,3, 58,7, 121,8, 122,0, 123,1, 126,7, 129,6, 131,3, 133,5, 137,8, 147,3, 148,5, 149,7, 164,2, 167,7, 167,9, 172,1, 172,2. Анализ: Вычислено для C21H18N4O5+0,3H2O: C, 61,25; H, 4,55; N, 13,61. Найдено: C, 60,88; H, 4,22; N, 13,33.
5.25 N-[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-трифторметилбензамид

Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,85 г, 2,5 ммоль), 4-(трифторметил)бензоилхлорида (0,52 мл, 2,5 ммоль) и триэтиламина (0,51 г, 5,0 ммоль) в безводном ацетонитриле (20 мл) перемешивают при комнатной температуре 13 часов. Реакционную смесь фильтруют. Фильтрат концентрируют и полученный остаток желтого цвета хроматографируют на силикагеле, используя градиент метанол-метиленхлорид, элюируя продукт при соотношении метанол-метиленхлорид 3:97, получают продукт в виде белого твердого вещества (0,94 г, выход 80%). Т. пл. 188-190°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 3,82 (99,33%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,53-2,72 (м, 3H), 4,65 (д, J=6,0 Гц, 2H), 7,79-8,11 (м, 7H), 9,46 (т, J=6,0 Гц, 1Н), 11,02 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,6, 29,1, 42,7, 58,8, 121,7, 123,2, 123,9 (кв, J=271 Гц), 125,5 (кв, J=3,8 Гц), 128,2, 129,7, 131,3 (кв, J=31,5 Гц), 131,4, 133,5, 137,7, 147,0, 165,3, 167,7, 167,9, 172,1, 172,2. Анализ: Вычислено для C23H18N3O5F3: C, 58,35; H, 3,83; N, 8,88. Найдено: C, 58,05; H, 3,64; N, 8,65.
5.26 N-[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-изоникотинамид
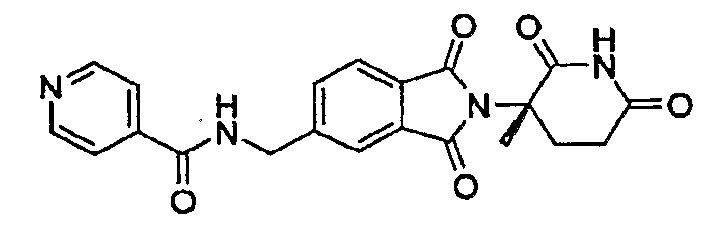
Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,85 г, 2,5 ммоль), гидрохлорида изоникотиноилхлорида (0,45 мл, 2,5 ммоль) и триэтиламина (0,76 г, 7,5 ммоль) в безводном ацетонитриле (20 мл) перемешивают при комнатной температуре 2 часа. Реакционную смесь концентрируют и полученный остаток желтого цвета хроматографируют на силикагеле, используя градиент метанол-метиленхлорид, элюируя продукт при соотношении метанол-метиленхлорид 5:95. Продукт перемешивают в воде (20 мл) 15 часов. Полученное твердое вещество фильтруют и дополнительно промывают водой (20 мл). Твердое вещество затем перемешивают в метаноле (20 мл) два дня, фильтруют и дополнительно промывают метанолом (20 мл), получая продукт в виде белого твердого вещества (0,23 г, выход 23%). Т. пл. 186-188°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 25/75 CH3CN/H2O, 3,06 (97,62%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,53-2,76 (м, 3H), 4,65 (д, J=5,7 Гц, 2H), 7,79-7,84 (м, 5H), 8,76 (д, J=6,0 Гц, 2H), 9,51 (т, J=6,0 Гц, 1Н), 11,02 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,5, 29,1, 42,6, 58,8, 121,2, 121,7, 123,2, 129,7, 131,4, 133,5, 140,9, 146,8, 150,3, 164,9, 167,7, 167,8, 172,1, 172,2. Анализ: Вычислено для C21H18N4O5+0,2H2O: C, 61,52; H, 4,52; N, 13,66. Найдено: C, 61,28; H. 4,36; N, 13,55.
5.27 4-Фтор-N-[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-бензамид
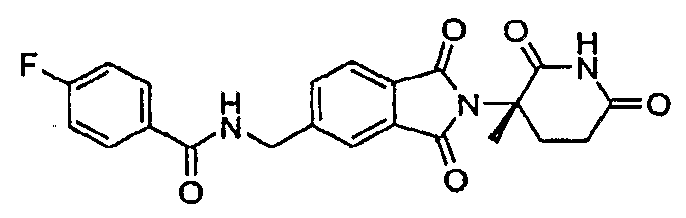
Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,85 г, 2,5 ммоль), 4-фторбензоилхлорида (0,40 мл, 2,5 ммоль) и триэтиламина (0,51 г, 5,0 ммоль) в безводном ацетонитриле (20 мл) перемешивают при комнатной температуре 2 часа. Реакционную смесь фильтруют. Фильтрат концентрируют в вакууме, и остаток хроматографируют на силикагеле, используя градиент метанол-метиленхлорид, элюируя продукт при соотношении метанол-метиленхлорид 5:95. Объединенные фракции концентрируют, и полученное твердое вещество перемешивают в эфире 2 часа. Суспензию фильтруют и твердое вещество дополнительно промывают эфиром, получая продукт в виде белого твердого вещества (0,41 г, выход 38%). Т. пл. 231-233°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 3,90 (96,87%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,02-2,06 (м, 1Н), 2,54-2,75 (м, 3H), 4,62 (д, J=5,7 Гц, 2H), 7,30-7,36 (м, 2H), 7,77-7,83 (м, 3H), 7,95-7,99 (м, 2H), 9,24 (т, J=6,0 Гц, 1Н), 11,02 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,5, 29,1, 42,6, 58,7, 115,3 (д, J=21 Гц), 121,6, 123,2, 129,6, 129,9 (д, J=8,3 Гц), 130,4 (д, J=3,0 Гц), 131,4, 133,4, 147,3, 164,0 (д, J=247 Гц), 165,3, 167,7, 167,9, 172,1, 172,2. Анализ: Вычислено для C22H18N3O5F: C, 62,41; H, 4,29; N, 9,92. Найдено: C, 62,46; H, 4,12; N, 9,88.
5.28 N-[2-(3S)-(3-метил-2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-6-трифторметил никотинамид

Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,65 г, 1,9 ммоль), 6-(трифторметил)никотиноилхлорида (0,40 мл, 1,9 ммоль) и триэтиламина (0,39 г, 3,8 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют в вакууме и остаток растворяют в этилацетате (100 мл) и промывают 4н HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Остаток хроматографируют на силикагеле (этилацетат), получая 0,58 г продукта с выходом 65% в виде белого твердого вещества. Т. пл. 358-360°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 5,10 (99,34%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,00-2,08 (м, 1Н), 2,55-2,72 (м, 3H), 4,69 (д, J=6,0 Гц, 2H), 7,83 (с, 3H), 8,08 (д, J=8,1 Гц, 1Н), 8,51 (дд, J=8,1 Гц и 1,8 Гц, 1Н), 9,21 (д, J=1,2 Гц, 1Н), 9,61 (т, J=6,0 Гц, 1Н), 11,02 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,6, 29,1, 42,7, 58,8, 120,7 (кв, J=3,0 Гц), 121,4 (кв, J=273 Гц), 121,8, 123,2, 129,8, 131,4, 132,6, 133,5, 137,5, 146,6, 148,2 (кв, J=33,8 Гц), 149,0, 163,9, 167,7, 167,8, 172,1, 172,2. Анализ: Вычислено для C22H17N4O5F3+0,1H2O: C, 55,49; H, 3,64; N, 11,77. Найдено: C, 55,11; H, 3,35; N, 11,64.
5.29 3,4-Дихлор-N-[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-бензамид
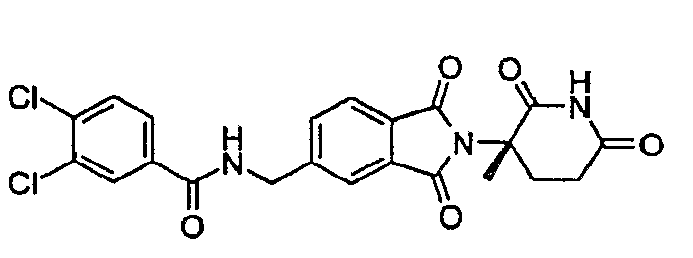
Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,65 г, 1,9 ммоль), 3,4-дихлорбензоилхлорида (0,40 мл, 1,9 ммоль) и триэтиламина (0,39 г, 3,8 ммоль) в безводном ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют в вакууме, и остаток растворяют в этилацетате (100 мл) и промывают 4н HCl (2×150 мл), водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Твердое вещество оставляют на ночь при перемешивании в эфире и затем фильтруют. Твердое вещество хроматографируют на силикагеле, используя градиент этилацетат-гексан, элюируя продукт при соотношении этилацетат-гексан 90:10. Объединенные фракции концентрируют в вакууме и полученное твердое вещество перемешивают в эфире 2 часа. Суспензию фильтруют и твердое вещество дополнительно промывают эфиром, получая продукт в виде белого твердого вещества (0,54 г, выход 60%). Т. пл. 162-164°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 4,89 (98,63%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 1,99-2,08 (м, 1Н), 2,55-2,75 (м, 3H), 4,63 (д, J=6,0 Гц, 2H), 7,78-7,89 (м, 5H), 8,13 (д, J=2,1 Гц, 1Н), 9,39 (т, J=6,0 Гц, 1Н), 11,01 (с, 1Н);
13C ЯМР (ДМСО-d6) δ 21,0, 28,6, 29,1, 42,7, 58,8, 121,7, 123,2, 127,6, 129,2, 129,7, 130,8, 131,3, 131,4, 133,5, 134,2, 134,3, 146,9, 164,2, 167,7, 167,8, 172,1, 172,2. Анализ: Вычислено для C22H17N3O5Cl2: C, 55,71; H, 3,61; N, 8,86. Найдено: C, 55,34; H, 3,66; N, 8,67.
5.30 [2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-амид тиофен-2-карбоновой кислоты
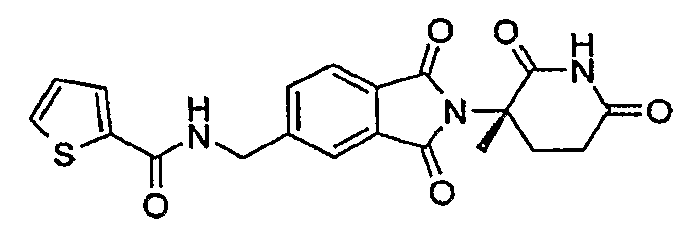
Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,85 г, 2,5 ммоль), 2-тиофенкарбонилхлорида (0,37 мл, 2,5 ммоль) и триэтиламина (0,51 г, 5,0 ммоль) в безводном ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют в вакууме и остаток хроматографируют на силикагеле, используя градиент метанол-метиленхлорид, элюируя продукт при соотношении метанол-метиленхлорид 5:95. Растворитель концентрируют в вакууме и полученное твердое вещество растворяют в ДМФА (4 мл) и смесь нагревают до 95°С в течение 1 часа. Затем по каплям добавляют воду (5 мл) и смеси дают охладиться до комнатной температуры и оставляют на ночь при перемешивании. Полученную суспензию фильтруют и дополнительно промывают водой, получая продукт в виде белого твердого вещества (0,62 г, выход 60%). Т. пл. 222-224°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 6,67 (96,69%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,53-2,73 (м, 3H), 4,60 (д, J=6,0 Гц, 2H), 7,16-7,19 (м, 1Н), 7,76-7,84 (м, 5H), 9,22 (т, J=6,0 Гц, 1Н), 11,01 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,5, 29,1, 42,4, 58,7, 121,6, 123,2, 128,0, 128,4, 129,6, 131,1, 131,4, 133,4, 139,3, 147,3, 161,3, 167,7, 167,9, 172,1, 172,2. Анализ: Вычислено для C20H17N3O5S: C, 58,39; H, 4,16; N, 10,21. Найдено: C, 58,55; H, 3,98; N, 10,06.
5.31 2-(4-Хлорфенил)-N-[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-ацетамид

Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,65 г, 1,9 ммоль), 4-хлорфенилацетилхлорида (0,36 мл, 1,9 ммоль) и триэтиламина (0,39 г, 3,8 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. К реакционной смеси добавляют дополнительные 4-хлорфенилацетилхлорид (0,36 мл, 1,9 ммоль) и триэтиламин (0,39 г, 3,8 ммоль) и продолжают перемешивание дополнительных 3 часа. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток растворяют в этилацетате (100 мл) и промывают 4н HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и концентрируют в вакууме. Остаток хроматографируют на силикагеле, используя градиент метанол-CH2Cl2, элюируя продукт при соотношении метанол-CH2Cl2 5:95, получая 0,60 г продукта в виде белого твердого вещества с выходом 69%. Т. пл. 156-158°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 6,09 (95,59%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,53-2,76 (м, 3H), 4,42 (д, J=6,0 Гц, 2H), 7,28-7,44 (м, 4H), 7,68-7,80 (м, 3H), 8,73 (т, J=6,0 Гц, 1Н), 11,03 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,6, 29,1, 41,4, 42,1, 58,8, 121,5, 123,1, 128,2, 129,6, 130,9, 131,2, 131,4, 133,3, 135,1, 147,3, 167,7, 167,8, 170,1, 172,1, 172,2. Анализ: Вычислено для C22H17N4O5F3+0,10H2O+0,15EtOAc: C, 60,45; H, 4,60; N, 8,96. Найдено: C, 60,37; H, 4,21; N, 8,56.
5.32 [2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-амид изохинолин-3-карбоновой кислоты
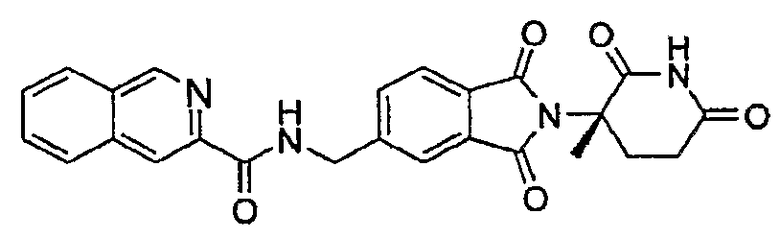
Гидрат 3-изохинолинкарбоновой кислоты (0,33 г, 1,9 ммоль) растворяют в ДМФА (20 мл) и добавляют CDI (0,34 г, 2,1 ммоль). Смесь перемешивают при 40°С 1 час. Затем добавляют гидрохлорид 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,65 г, 1,9 ммоль) и триэтиламин (0,39 г, 3,8 ммоль), и реакционную смесь перемешивают при 40°С в течение дополнительных 90 минут. Смесь охлаждают до комнатной температуры и оставляют на ночь при перемешивании. Добавляют воду (30 мл) и осаждается твердое вещество. Осажденное твердое вещество выделяют фильтрацией, дополнительно промывают водой и сушат, получая 0,66 г продукта с выходом 76%. Т. пл. 259-261°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 3,24 (97,97%). 1H ЯМР (ДМСО-d6) δ 1,88 (с, 3H), 2,01-2,07 (м, 1Н), 2,53-2,74 (м, 3H), 4,71 (д, J=6,3 Гц, 2H), 7,80-7,92 (м, 5H), 8,19-8,28 (м, 2H), 8,58 (с, 1Н), 9,42 (с, 1Н), 9,75 (т, J=6,3 Гц, 1Н), 11,02 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,5, 29,1, 42,4, 58,7, 120,0, 121,8, 123,1, 127,8, 128,0, 129,2, 129,3, 129,6, 131,4, 133,6, 135,3, 143,5, 147,5, 151,6, 164,5, 167,7, 167,9, 172,1, 172,2. Анализ: Вычислено для C22H20N4O5+0,20H2O: C, 65,27; H, 4,47; N, 12,18. Найдено: C, 64,98; H, 4,33; N, 12,18.
5.33 N-((2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-изоиндолин-5-ил)метил)-4-(трифторметилтио)бензамид
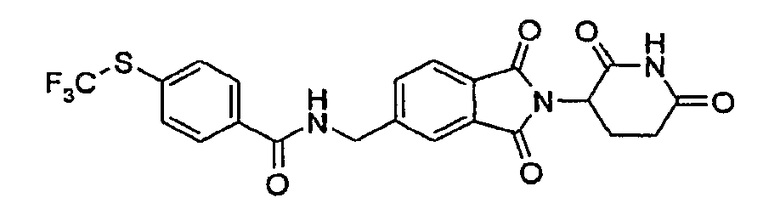
ТЕА добавляют к перемешиваемой смеси гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль) и 4-(трифторметилтио)бензоилхлорида (0,75 г, 3,1 ммоль) в ацетонитриле (30 мл), полученную смесь перемешивают при комнатной температуре 1 час. Смесь разбавляют водой (100 мл) и этилацетатом (100 мл). Органическую фазу отделяют и концентрируют в вакууме. Остаток хроматографируют на силикагеле, используя градиент гексаны-этилацетат, элюируя 1,2 г продукта при содержании этилацетата 60-70%, с выходом 76% в виде белого твердого вещества. Т. пл. 171-173°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 4,72 (97,94%). 1H ЯМР (ДМСО-d6) δ 2,02-2,10 (м, 1Н), 2,46-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,66 (д, J=5,8 Гц, 2H), 5,15 (дд, J=12,8 Гц, J=5,3 Гц, 1Н), 7,81-7,92 (м, 5H), 8,00-8,03 (м, 2H), 9,41 (т, J=5,8 Гц, 1Н), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,7, 49,0, 122,0, 123,6, 126,4, 128,7, 129,5 (кв, J=306 Гц), 129,9, 131,6, 133,5, 135,9, 136,5, 147,2, 165,5, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C22H16N3O5F3S: C, 53,77; H, 3,28; N, 8,55. Найдено: C, 53,55; H, 3,14; N, 8,37.
5.34 N-((2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-изоиндолин-5-ил)метил)-4-(1,1,2,2-тетрафторэтокси)бензамид
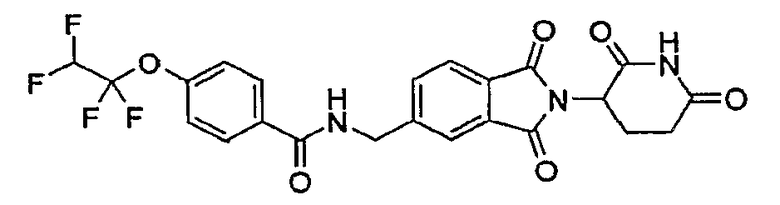
Смесь 4-(1,1,2,2-тетрафторэтокси)бензойной кислоты (0,73 г, 3,1 ммоль) и CDI (0,55 г, 3,4 ммоль) в ДМФА (20 мл) перемешивают при 40°С 2 часа, а затем добавляют гидрохлорид 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль). Спустя 2 часа смесь охлаждают до комнатной температуры, выливают в этилацетат (100 мл), а затем промывают NaHCO3 (3×75 мл) и затем концентрируют. Остаток хроматографируют на силикагеле (этилацетат), получая 0,79 г продукта в виде белого твердого вещества с выходом 51%. Т. пл. 148-150°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 4,72 (98,94%). 1H ЯМР (ДМСО-d6) δ 1,99-2,10 (м, 1Н), 2,48-2,63 (м, 2H), 2,84-2,96 (м, 1Н), 4,66 (д, J=5,8 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 6,85 (тт, J=51,9, J=3,1, 1Н), 7,42 (д, J=8,7 Гц, 2H), 7,81-7,92 (м, 3H), 8,00-8,04 (м, 2H), 9,32 (т, J=5,8 Гц, 1Н), 11,13 (с, 1Н); 1H ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,7, 49,0, 107,7 (тт, J=247, J=40), 116,4 (тт, J=269, J=27), 121,2, 122,0, 123,5, 129,5, 129,8, 131,6, 132,5, 133,4, 147,4, 150,3, 165,4, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C23H17N3O6F4: C, 54,44; H, 3,38; N, 8,28. Найдено: C, 54,24; H, 3,28; N, 8,15.
5.35 4-Бром-N-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-бензамид
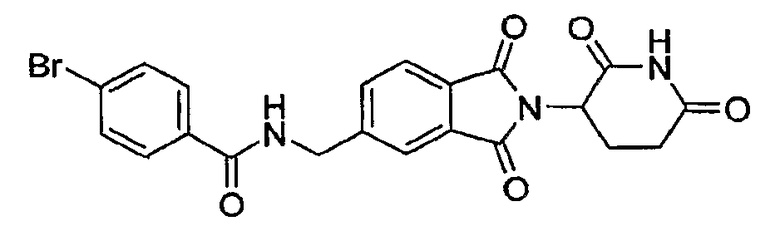
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль), 4-бромбензоилхлорида (0,68 г, 3,1 ммоль) и триэтиламина (0,63 г, 6,2 ммоль) в ацетонитриле (20 мл) перемешивают 3 часа при комнатной температуре. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток хроматографируют на силикагеле (этилацетат), получая 1,2 г продукта в виде белого твердого вещества с выходом 83%. Т. пл. 166-168°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 6,07 (97,97%). 1H ЯМР (ДМСО-d6) δ 2,02-2,10 (м, 1Н), 2,46-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,64 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,1 Гц, 1Н), 7,69-7,74 (м, 2H), 7,80-7,91 (м, 5H), 9,30 (т, J=6,0 Гц, 1Н), 11,12 (с, 1Н); 13H ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,7, 49,0, 122,0, 123,5, 125,2, 129,4, 129,8, 131,4, 131,6, 133,0, 133,5, 147,4, 165,5, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C21H16N3O5Br: C, 53,63; H, 3,43; N, 8,94; Br, 16,99. Найдено: C, 53,61; H, 3,14; N, 8,84; Br, 16,80.
5.36 N-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-этил-бензамид
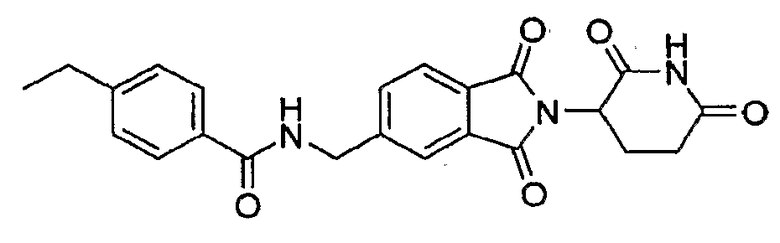
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,00 г, 3,1 ммоль), 4-этилбензоилхлорида (0,52 г, 3,1 ммоль) и триэтиламина (0,63 г, 6,2 ммоль) в ацетонитриле (20 мл) перемешивают 3 часа при комнатной температуре. Реакционную суспензию фильтруют и твердую фазу дополнительно промывают ацетонитрилом. Твердое вещество затем перемешивают в воде 2 часа, фильтруют и сушат, получая 0,51 г продукта. Фильтрат из реакционной смеси концентрируют. Остаток хроматографируют на силикагеле (этилацетат). Объединенные фракции концентрируют и полученное твердое вещество оставляют на ночь при перемешивании в эфире, фильтруют и сушат, получая 0,59 г продукта с общим выходом 85%. Продукт представляет собой белое твердое вещество. Т. пл. 191-193°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 6,56 (99,32%). 1H ЯМР (ДМСО-d6) δ 1,20 (т, J=5,7 Гц, 3H), 2,02-2,10 (м, 1Н), 2,47-2,70 (м, 2H), 2,83-2,95 (м, 1Н), 4,64 (д, J=5,7 Гц, 2H), 5,16 (дд, J=12,9 Гц, J=5,1 Гц, 1Н), 7,33 (д, J=8,1 Гц, 2H), 7,79-7,91 (м, 5H), 9,15 (т, J=6,0 Гц, 1Н), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 15,3, 22,0, 28,0, 30,9, 42,5, 49,0, 121,9, 123,5, 127,3, 127,7, 129,8, 131,4, 131,6, 133,4, 147,5, 147,7, 166,3, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C23H21N3O5: C, 65,86; H, 5,05; N, 10,02. Найдено: C, 65,73; H, 4,86; N, 9,91.
5.37 N-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-этокси-бензамид
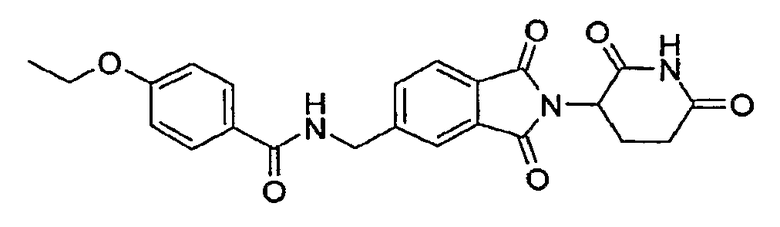
4-Этоксибензойную кислоту (0,51 г, 3,1 ммоль) растворяют в ДМФА (20 мл) и добавляют CDI (0,55 г, 3,4 ммоль). Смесь перемешивают при 40°С 1 час. Затем добавляют гидрохлорид 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,00 г, 3,1 ммоль) и триэтиламин (0,63 г, 6,2 ммоль) и реакционную смесь перемешивают при 40°С дополнительных 90 минут. Затем смесь охлаждают до комнатной температуры и оставляют на ночь при перемешивании. Затем добавляют воду (30 мл) и осаждается твердое вещество. Твердое вещество выделяют фильтрацией, дополнительно промывают водой и полученное твердое вещество хроматографируют на силикагеле (этилацетат), получая 0,21 г продукта с выходом 16% в виде белого твердого вещества. Т. пл. 213-215°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 3,77 (99,35%). 1H ЯМР (ДМСО-d6) δ 1,34 (т, J=6,9 Гц, 3H), 2,02-2,09 (м, 1Н), 2,46-2,62 (м, 2H), 2,83-2,95 (м, 1Н), 4,06-4,13 (м, 2H), 4,62 (д, J=6,0 Гц, 2H), 5,14 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 6,98-7,03 (м, 2H), 7,79-7,91 (м, 5H), 9,07 (т, J=5,7 Гц, 1Н), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 14,5, 22,0, 30,9, 42,5, 49,0, 63,3, 114,0, 121,9, 123,5, 125,9, 129,1, 129,7, 131,6, 133,4, 147,9, 161,0, 165,9, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C23H21N3O6: C, 63,44; H, 4,86; N, 9,65. Найдено: C, 63,41 ; H, 4,76; N, 9,41.
5.38 N-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-метансульфонил-бензамид
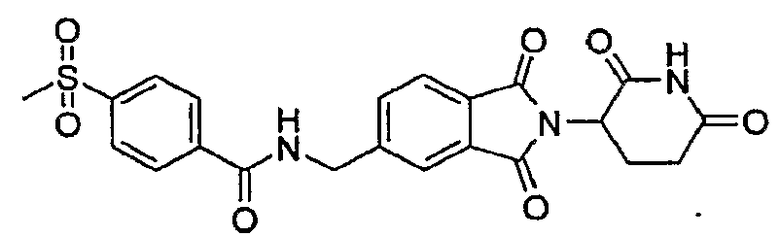
4-(Метилсульфонил)бензойную кислоту (0,62 г, 3,1 ммоль) растворяют в ДМФА (20 мл) и добавляют CDI (0,55 г, 3,4 ммоль). Смесь перемешивают при 40°С 1 час. Добавляют гидрохлорид 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль) и триэтиламин (0,63 г, 6,2 ммоль) и реакционную смесь перемешивают при 40°С дополнительных 90 минут. Смесь охлаждают до комнатной температуры и оставляют на ночь при перемешивании. Реакционную смесь концентрируют и остаток хроматографируют на силикагеле (этилацетат), получая 0,83 г продукта с выходом 57% в виде белого твердого вещества. Т. пл. 241-243°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 3,48 (98,80%). 1H ЯМР (ДМСО-d6) δ 2,03-2,08 (м, 1Н), 2,49-2,63 (м, 2H), 2,83-2,91 (м, 1Н), 3,27 (с, 3H), 4,68 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,1 Гц, 1Н), 7,82-7,92 (м, 3H), 8,04-8,07 (м, 2H), 8,12-8,15 (м, 2H), 9,49 (т, J=5,7 Гц, 1H), 1 1,12 (с, 1H); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,8, 43,3, 49,0, 122,0, 123,6, 127,1, 128,3, 129,9, 131,6, 133,5, 138,3, 143,1, 147,1, 165,2, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C22H19N3O7S: C, 56,28; H, 4,08; N, 8,95. Найдено: C, 56,13; H, 3,90; N, 8,74.
5.39 N-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-йод-бензамид

4-Йодбензойную кислоту (0,77 г, 3,1 ммоль) растворяют в ДМФА (20 мл) и добавляют CDI (0,55 г, 3,4 ммоль). Смесь перемешивают при 40°С 1 час. Добавляют гидрохлорид 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль) и триэтиламин (0,63 г, 6,2 ммоль), и реакционную смесь перемешивают при 40°С дополнительных 90 минут. Смесь охлаждают до комнатной температуры и оставляют на ночь при перемешивании. Реакционную смесь концентрируют и остаток хроматографируют на силикагеле (этилацетат) для получения твердого вещества, которое оставляют на ночь при перемешивании в эфире, фильтруют и сушат, получая 1,33 г продукта с выходом 83% в виде белого твердого вещества. Т. пл. 163-165°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 3,27 (97,68%). 1H ЯМР (ДМСО-d6) δ 2,03-2,09 (м, 1Н), 2,46-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,63 (д, J=6,0 Гц, 2H), 5,14 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,67-7,91 (м, 7H), 9,29 (т, J=5,7 Гц, 1Н), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,6, 49,0, 99,1, 122,0, 123,5, 129,2, 129,8, 131,6, 133,3, 133,5, 137,3, 147,4, 165,8, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C21H16N3O5I: C, 48,76; H, 3,12; N, 8,12. Найдено: C, 48,64; H, 2,77; N, 7,85.
5.40 N-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-метилсульфанил-бензамид
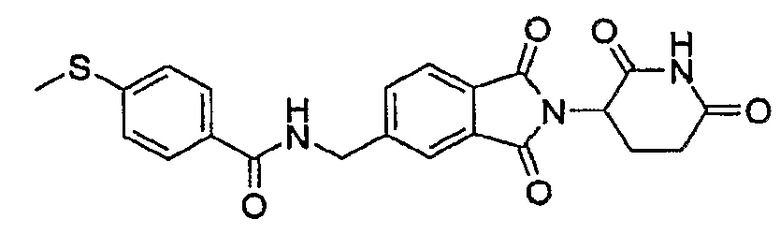
4-(Метилтио)бензойную кислоту (0,52 г, 3,1 ммоль) растворяют в ДМФА (20 мл) и добавляют CDI (0,55 г, 3,4 ммоль). Смесь перемешивают при 40°С 1 час. Добавляют гидрохлорид 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль) и триэтиламин (0,63 г, 6,2 ммоль) и реакционную смесь перемешивают при 40°С дополнительных 90 минут. Смесь охлаждают до комнатной температуры и оставляют на ночь при перемешивании. Реакционную смесь концентрируют и остаток хроматографируют на силикагеле (этилацетат), получая 0,75 г продукта с выходом 56% в виде белого твердого вещества. Т. пл. 187-189°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 4,61 (95,58%). 1H ЯМР (ДМСО-d6) δ 2,03-2,10 (м, 1Н), 2,46-2,63 (м, 2H), 2,52 (с, 3H), 2,83-2,95 (м, 1Н), 4,63 (д, J=6,0 Гц, 2H), 5,14 (дд, J=12,6 Гц, J=5,1 Гц, 1Н), 7,35 (д, J=8,4 Гц, 2H), 7,80-7,91 (м, 5H), 9,18 (т, J=6,0 Гц, 1Н), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 14,1, 22,0, 30,9, 42,6, 49,0, 121,9, 123,5, 124,9, 127,7, 129,8, 129,9, 131,6, 133,4, 142,8, 147,7, 165,9, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C22H19N3O5S+0,1H2O: C, 60,15; H, 4,41; N, 9,57. Найдено: C, 59,98; H, 4,32; N, 9,61.
5.41 N-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-4-этилсульфанил-бензамид

4-(Этилтио)бензойную кислоту (0,56 г, 3,1 ммоль) растворяют в ДМФА (20 мл) и добавляют CDI (0,55 г, 3,4 ммоль). Смесь перемешивают при 40°С 1 час. Добавляют гидрохлорид 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,00 г, 3,1 ммоль) и триэтиламин (0,63 г, 6,2 ммоль) и реакционную смесь перемешивают при 40°С дополнительных 90 минут. Смесь охлаждают до комнатной температуры и оставляют на ночь при перемешивании. Реакционную смесь концентрируют и остаток хроматографируют на силикагеле, используя градиент этилацетат-гексан, элюируя продукт при соотношении этилацетат-гексан 80:20, получая 1,1 г продукта с выходом 81% в виде белого твердого вещества. Т. пл. 175-177°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 6,93 (99,44%). 1H ЯМР (ДМСО-d6) δ 1,27 (т, J=7,5 Гц, 3H), 2,02-2,09 (м, 1Н), 2,47-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 3,06 (кв, J=7,5 Гц, 2H), 4,63 (д, J=5,7 Гц, 2H), 5,14 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,37-7,39 (м, 2H), 7,80-7,91 (м, 5H), 9,18 (т, J=6,0 Гц, 1Н), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 13,9, 22,0, 25,2, 30,9, 42,6, 49,0, 121,9, 123,5, 126,3, 127,8, 129,8, 130,4, 131,6, 133,4, 141,2, 147,6, 165,9, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C23H21N3O5S: C, 61,19; H, 4,69; N, 9,31. Найдено: C, 60,80; H, 4,34; N, 9,21.
5.42 N-((2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-изоиндолин-5-ил)метил)-2-(4-(трифторметилтио)фенил)ацетамид
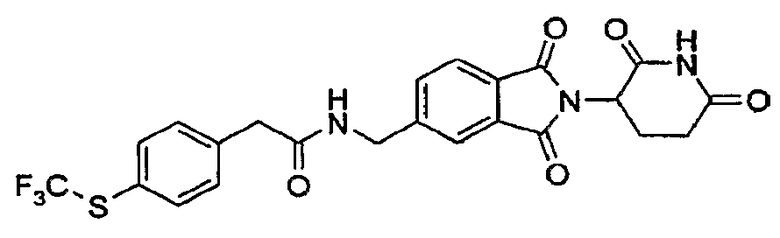
Смесь 4-(трифторметилтио)фенилуксусной кислоты (0,73 г, 3,1 ммоль) и CDI (0,55 г, 3,4 ммоль) в ДМФА (20 мл) перемешивают при 40°С 2 часа, а затем добавляют гидрохлорид 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль). Спустя 2 часа смесь охлаждают до комнатной температуры, выливают в этилацетат (100 мл) и промывают NaHCO3 (3×75 мл) и концентрируют. Остаток хроматографируют на силикагеле (этилацетат), получая 1,2 г продукта с выходом 77% в виде белого твердого вещества. Т. пл. 140-142°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 3,87 (98,06%). 1H ЯМР (ДМСО-d6) δ 2,02-2,09 (м, 1Н), 2,47-2,63 (м, 2H), 2,84-2,96 (м, 1Н), 3,62 (с, 2H), 4,46 (д, J=5,8 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,45 (д, J=8,4 Гц, 2H), 7,65-7,77 (м, 4H), 7,87 (д, J=7,5 Гц, 1Н), 8,82 (т, J=5,8 Гц, 1Н), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,2, 30,1, 40,9, 41,3, 48,2, 119,9, 120,0, 121,1, 122,6, 128,8 (кв, J=306 Гц), 129,0, 129,9, 130,8, 132,5, 135,3, 139,2, 146,5, 166,1, 166,2, 167,0, 171,9. Анализ: Вычислено для C23H18N3O5F3S: C, 54,65; H, 3,59; N, 8,31. Найдено: C, 54,45; H, 3,73; N, 7,93.
5.43 Трет-бутил-N-((2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-изоиндолин-5-ил)метил)-бензамид
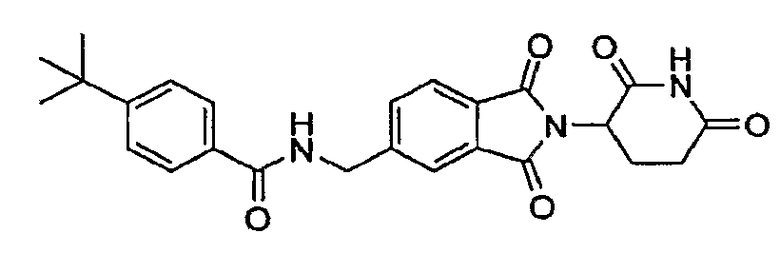
ТЕА добавляют к смеси гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль) и 4-(трет-бутил)бензоилхлорида (0,61 г, 3,1 ммоль) в ацетонитриле (35 мл) и полученную смесь перемешивают при комнатной температуре 1 час. Смесь разбавляют водой (100 мл) и этилацетатом (100 мл) и органическую фазу отделяют и концентрируют. Остаток хроматографируют на силикагеле, используя градиент гексаны-этилацетат, элюируя 1,1 г продукта при содержании этилацетата 80-90%, с выходом 80% в виде белого твердого вещества. Т. пл. 164-166°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 4,26 (99,57%). 1H ЯМР (ДМСО-d6) δ 1,30 (с, 9H), 2,01-2,09 (м, 1Н), 2,46-2,63 (м, 2H), 2,84-2,96 (м, 1Н), 4,65 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,49-7,52 (м, 2H), 7,79-7,91 (м, 5H), 9,16 (т, J=6,0 Гц, 1Н), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 34,6, 42,5, 49,0, 121,9, 123,5, 125,1, 127,1, 129,7, 131,1, 131,6, 133,3, 147,8, 154,3, 166,3, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C25H25N3O5+0,25H2O: C, 66,43; H, 5,69; N, 9,30. Найдено: C, 66,49; H, 5,62; N, 8,96.
5.44 5-Бром-N-[[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-изоиндолин-5-ил]метил]-пиколинамид
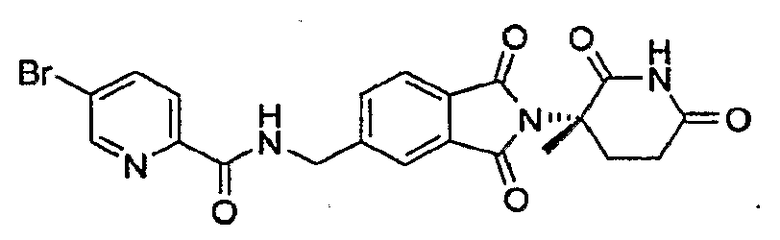
Смесь 5-бромпиколиновой кислоты (0,40 г, 2,0 ммоль) и CDI (0,36 г, 2,2 ммоль) в ДМФА (20 мл) перемешивают в атмосфере азота при 40°С 2 часа. Затем добавляют гидрохлорид 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,67 г, 2,0 ммоль) и смесь перемешивают при данной температуре дополнительных 2 часа. Смесь охлаждают до комнатной температуры и растворитель выпаривают в вакууме. Остаток растворяют в этилацетате (100 мл) и промывают насыщенным водным раствором бикарбоната натрия (2×100 мл). Органическую фазу выпаривают. Остаток хроматографируют на силикагеле, используя метиленхлорид в качестве подвижной фазы. Получают бледно-красное твердое вещество, данное твердое вещество растирают с 10 мл ацетонитрила в течение 16 часов. Твердую фазу фильтруют и дополнительно промывают 7 мл ацетонитрила. Продукт сушат в вакууме, получая 0,55 г (выход 57%) в виде белого твердого вещества. Т. пл. 260-262°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 45/55 CH3CN/0,1% H3PO4, 3,61 (96,62%). 1H ЯМР (ДМСО-d6) δ 1,88 (с, 3H), 2,00-2,08 (м, 1Н), 2,49-2,62 (м, 2H), 2,65-2,73 (м, 1Н), 4,62 (д, J=6,3 Гц, 2H), 7,76-7,82 (м, 3H), 7,97 (дд, J=8,4 Гц, J=0,6 Гц, 1Н), 8,26 (дд, J=8,4 Гц, J=2,3 Гц, 1Н), 8,81 (дд, J=2,3 Гц, J=0,6 Гц, 1Н), 9,63 (т, J=6,3 Гц, 1Н), 11,00 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,5, 29,1, 42,4, 58,7, 121,8, 123,1, 123,5, 123,9, 129,6, 131,3, 133,6, 140,5, 147,1, 148,5, 149,3, 163,5, 167,7, 167,8, 172,0, 172,1. Анализ: Вычислено для C21H17BrN4O5: C, 51,97; H, 3,53; N, 11,55. Найдено: C, 52,05; H, 3,44; N, 11,39.
5.45 N-[[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-изоиндолин-5-ил]метил]-4-(метилмульфонил)бензамид
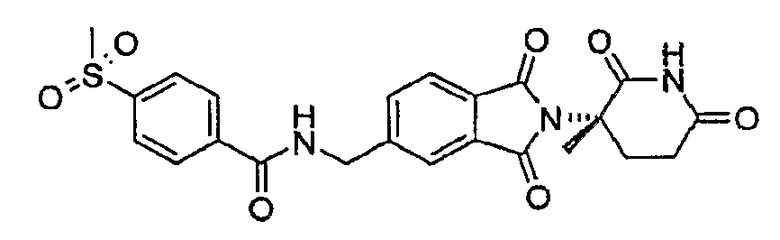
Смесь 4-(метилсульфонил)бензойной кислоты (0,40 г, 2,0 ммоль) и CDI (0,36 г, 2,2 ммоль) в ДМФА (20 мл) перемешивают в атмосфере азота при 40°С 2 часа. Затем добавляют гидрохлорид 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,67 г, 2,0 ммоль) и перемешивание продолжают при данной температуре дополнительных 2 часа. Смесь охлаждают до комнатной температуры и распределяют между этилацетатом (100 мл) и насыщенным водным раствором бикарбоната натрия (100 мл). Органическую фазу промывают насыщенным водным раствором бикарбоната натрия (2×100 мл) и выпаривают. Остаток хроматографируют на силикагеле, используя смесь метиленхлорид-метанол 99:1 в качестве подвижной фазы, получая 0,30 г с выходом 32%. Продукт получен в виде белого твердого вещества. Т. пл. 165,5-167,5°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 4,08 (96,23%). 1H ЯМР (ДМСО-d6) δ 2,09 (с, 3H), 2,22-2,28 (м, 1Н), 2,73-2,95 (м, 3H), 3,47 (с, 3H), 4,86 (д, J=5,7 Гц, 2H), 7,98-8,04 (м, 3H), 8,25 (д, J=8,7 Гц, 2H), 8,32 (д, J=8,7 Гц, 2H), 9,58 (т, J=5,7 Гц, 1Н), 11,21 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 23,0, 30,6, 31,1, 44,8, 45,6, 60,8, 123,7, 125,2, 129,2, 130,3, 131,7, 133,4, 135,5, 140,4, 145,2, 149,0, 167,2, 169,7, 169,9, 174,1, 174,2. Анализ: Вычислено для C23H21N3O7S+0,3H2O: C, 56,50; H, 4,45; N, 8,59. Найдено: C, 56,61; H, 4,42; N, 8,30.
5.46 4-Этил-N-[[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-изоиндолин-5-ил]метил]бензамид
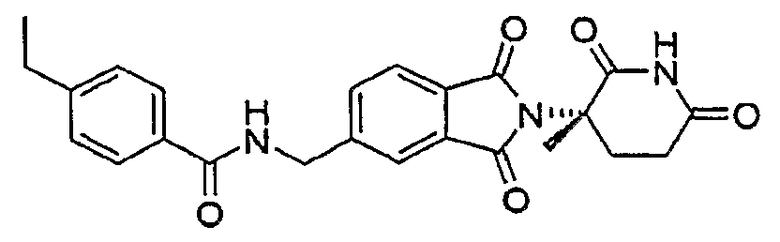
ТЕА (0,44 г, 4,4 ммоль) добавляют к смеси 4-этилбензоилхлорида (0,34 г, 2,0 ммоль) и гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,67 г, 2,0 ммоль) в ацетонитриле (20 мл). Смесь перемешивают при комнатной температуре 2 часа и выпаривают в вакууме. Остаток распределяют между водой (100 мл) и этилацетатом (100 мл) и органическую фазу выпаривают. Остаток хроматографируют на силикагеле, используя этилацетат в качестве подвижной фазы, получая 0,65 г с выходом 76%. Продукт получен в виде белого твердого вещества. Т. пл. 160-162°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 45/55 CH3CN/0,1% H3PO4, 4,20 (97,47%). 1H ЯМР (ДМСО-d6) δ 1,19 (т, J=7,7 Гц, 3H), 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,54-2,62 (м, 2H), 2,65-2,78 (м, 3H), 4,61 (д, J=6,0 Гц, 2H), 7,32 (д, J=8,1 Гц, 2H), 7,76-7,84 (м, 5H), 9,14 (т, J=6,0 Гц, 1Н), 11,01 (с, 1H); 13С ЯМР (ДМСО-d6) δ 15,4, 21,1, 28,1, 28,6, 29,2, 42,6, 58,8, 121,6, 123,2, 127,4, 127,8, 129,6, 131,4, 131,5, 133,4, 147,6, 147,7, 166,4, 167,8, 167,9, 172,2, 172,3. Анализ: Вычислено для C24H23N3O5: C, 66,50; H, 5,35; N, 9,69. Найдено: C, 66,30; H, 5,26; N, 9,56.
5.47 N-[[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-изоиндолин-5-ил]метил]-4-(трифторметилтио)-бензамид
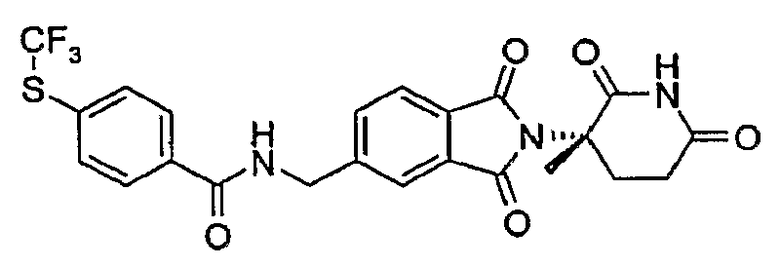
ТЕА (0,44 г, 4,4 ммоль) добавляют к смеси 4-(трифторметилтио)бензоилхлорида (0,48 г, 2,0 ммоль) и гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,67 г, 2,0 ммоль) в ацетонитриле (15 мл). Смесь перемешивают при комнатной температуре 2 часа и выпаривают в вакууме. Остаток распределяют между водой (75 мл) и этилацетатом (75 мл) и органическую фазу промывают водой (2×75 мл) и выпаривают. Остаток хроматографируют на силикагеле, используя этилацетат в качестве подвижной фазы, получая 0,62 г продукта с выходом 62%. Продукт получен в виде белого твердого вещества. Т. пл. 138-140°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 4,77 (96,89%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,54-2,60 (м, 2H), 2,63-2,75 (м, 1Н), 4,64 (д, J=6,0 Гц, 2H), 7,78-7,86 (м, 5H), 7,99-8,03 (м, 2H), 9,40 (т, J=6,0 Гц, 1Н), 11,01 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,5, 29,0, 42,7, 58,8, 121,7, 123,2, 126,5, 128,7, 129,5 (кв, J=306), 129,7, 131,4, 133,4, 135,9, 136,5, 147,0, 165,4, 167,7, 167,8, 172,1, 172,2. Анализ: Вычислено для C23H18F3N3O5S: C, 54,65; H, 3,59; N, 8,31. Найдено: C, 54,56; H, 3,36; N, 8,24.
5.48 N-[[2-(2,6-Диоксо-пиперидин-3-ил)-1-оксо-изоиндолин-5-ил]метил]-4-(трифторметилтио)-бензамид
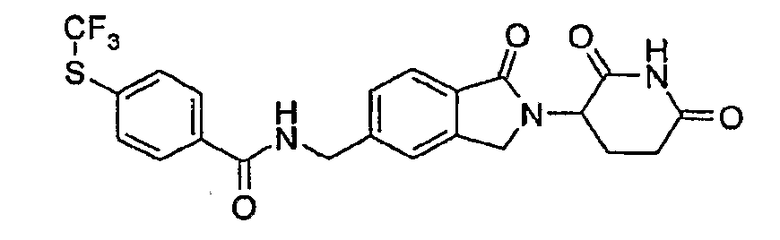
ТЕА (0,65 г, 6,4 ммоль) добавляют к смеси 4-(трифторметилтио)бензоилхлорида (0,77 г, 3,2 ммоль) и гидрохлорида 3-(5-аминометил-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона (1,0 г, 3,2 ммоль) в ДМФА (25 мл). Смесь перемешивают при комнатной температуре 1 час, а затем разбавляют водой (40 мл) и перемешивают 15 минут. Выпавшее в осадок твердое вещество фильтруют и дополнительно промывают водой (40 мл). Вещество перемешивают в 4% водной HCl (15 мл) и фильтруют, твердое вещество дополнительно промывают 4% водной HCl (15 мл) и водой (15 мл). Твердое вещество сушат в вакууме, получая 0,90 г продукта в виде твердого вещества кремового цвета с выходом 59%. Т. пл. 203-205°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 2,91 (96,41%). 1H ЯМР (ДМСО-d6) δ 1,96-2,03 (м, 1Н), 2,31-2,45 (м, 1Н), 2,54-2,63 (м, 1Н), 2,85-2,98 (м, 1Н), 4,31 (д, J=17,4 Гц, 1Н), 4,45 (д, J=17,4 Гц, 1Н), 4,61 (д, J=5,9 Гц, 2H), 5,11 (дд, J=13,2 Гц, J=5,1 Гц, 1Н), 7,50 (д, J=7,8 Гц, 1Н), 7,56 (с, 1Н), 7,70 (д, J=7,8 Гц, 1Н), 7,84 (д, J=8,1 Гц, 1Н), 8,02 (д, J=8,1 Гц, 1Н), 9,35 (т, J=5,9 Гц, 1Н), 10,98 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,5, 31,2, 42,8, 47,1, 51,6, 122,1, 122,9, 126,3, 127,1, 128,7, 129,5 (кв, J=306), 130,4, 135,9, 136,8, 142,4, 143,6, 165,3, 167,9, 171,0, 172,8. Анализ: Вычислено для C22H18F3N3O4S+0,4H2O: C, 54,52; H, 3,91; N, 8,65. Найдено: C, 54,51; H, 3,61; N, 8,64.
5.49 4-Этилсульфанил-N-[[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-ил]метил]бензамид

Смесь 4-(этилтио)бензойной кислоты (0,36 г, 2,0 ммоль) и CDI (0,34 г, 2,1 ммоль) в ДМФА (20 мл) перемешивают в атмосфере N2 при 40°С 2 часа. Затем добавляют гидрохлорид 5-аминометил-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,67 г, 2,0 ммоль) и перемешивание продолжают при 40°С в атмосфере N2 дополнительных 3 часа. Смесь распределяют между этилацетатом (75 мл) и насыщенным водным раствором бикарбоната натрия (100 мл), водную фазу экстрагируют этилацетатом (75 мл). Объединенные органические фазы затем промывают насыщенным водным раствором бикарбоната натрия (3×100 мл), сушат (MgSO4) и выпаривают. Остаток хроматографируют (силикагель), используя градиент этилацетат/гексаны, получая 0,92 г продукта с выходом 61% в виде белого твердого вещества. Т. пл.135-137°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 4,03 (99,73%). 1H ЯМР (ДМСО-d6) δ 1,27 (т, 3H, J=7,3 Гц), 1,99 (с, 3H), 2,00-2,02 (м, 1Н), 2,49-2,65 (м, 3H), 3,06 (кв, 2H, J=7,25 Гц), 4,61 (д, 2H, J=6,0 Гц), 7,38 (дд, 2H, J=6,0 Гц, J=3,0 Гц), 7,76-7,85 (м, 5H), 9,17 (т, 1Н, J=6,0 Гц), 11,01 (с, 1Н); 13C ЯМР (ДМСО-d6) δ 13,9, 21,0, 25,2, 28,5, 29,1, 42,6, 58,7, 121,6, 123,2, 126,3, 127,8, 129,6, 130,4, 131,4, 133,4, 141,2, 147,5, 165,9, 167,7, 167,9, 172,1, 172,2. Анализ: Вычислено для C24H23N3O5S+0,3H2O: C, 61,21; H, 5,05; N, 8,92. Найдено: C, 61,27; H, 5,13; N, 8,80.
5.50 4-Этокси-N-[[(2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-ил]метил]бензамид
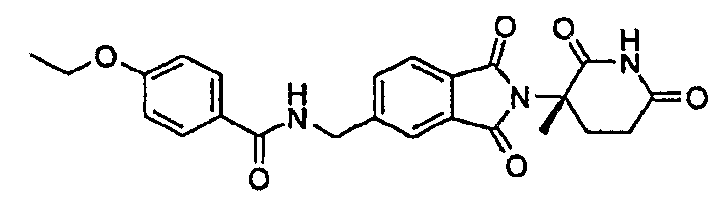
Смесь 4-(этокси)бензойной кислоты (0,33 г, 2,0 ммоль) и CDI (0,34 г, 2,1 ммоль) в ДМФА (20 мл) перемешивают при 40°С в атмосфере N2 2 часа. Затем добавляют гидрохлорид 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,67 г, 2,0 ммоль) и перемешивание продолжают при 40°С в атмосфере N2 дополнительных 2 часа. Реакционную смесь распределяют между этилацетатом (75 мл) и насыщенным водным раствором бикарбоната натрия (100 мл). Водную фазу экстрагируют этилацетатом (75 мл). Объединенные органические фазы затем промывают насыщенным водным раствором бикарбоната натрия (3×100 мл), сушат (MgSO4) и выпаривают. Остаток хроматографируют (силикагель), используя градиент этилацетат/гексаны, получая 0,27 г продукта с выходом 31% в виде белого твердого вещества. Т. пл.163-165°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 5,73 (97,04%). 1H ЯМР (ДМСО-d6) δ 1,34 (т, 3H, J=6,0 Гц), 2,01 (с, 3H), 2,03-2,06 (м, 1Н), 2,49-2,71 (м, 3H), 4,09 (кв, 2H, J=7,0 Гц), 4,60 (д, 2H, J=6,0 Гц), 7,00 (д, 2H, J=9,0), 7,75-7,87 (м, 5H), 9,06 (т, 1Н, J=6,0 Гц), 11,01 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 14,5, 21,0, 28,5, 29,1, 42,5, 58,7, 63,3, 114,0, 121,5, 123,1, 125,9, 129,1, 129,5, 131,4, 133,3, 147,7, 161,0, 165,9, 167,7, 167,9, 172,1, 172,2. Анализ: Вычислено для C24H23N3O6+0,75H2O: C, 62,26; H, 5,33; N, 9,08. Найдено: C, 62,25; H, 5,13; N, 9,17.
5.51 N-((2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-изоиндолин-5-ил)метил)-5-(этилтио)пиколинамид
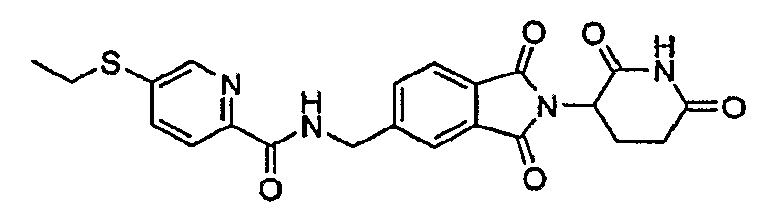
Стадия 1: Смесь 2-хлор-5-нитропиридина (25,0 г, 158 ммоль) и диметилмалоната (21,9 г, 166 ммоль) в ДМФА (150 мл) охлаждают до 0°С, небольшими порциями добавляют гидрид натрия (6,50 г 60% дисперсии в минеральном масле, 162 ммоль). Смесь перемешивают при 0°С 1 час, завершая добавление. Затем небольшими порциями добавляют еще один эквивалент гидрида натрия (6,50 г 60% дисперсии в минеральном масле, 162 ммоль). Реакцию гасят добавлением уксусной кислоты (10 мл) и смесь выпаривают досуха. Остаток оставляют на ночь для растирания с диэтиловым эфиром (150 мл), фильтруют, получая неочищенный диметил 2-(5-нитропиридин-2-ил)малонат в виде оранжевого твердого вещества.
Стадия 2: Неочищенный продукт со стадии 1 суспендируют в 250 мл воды на ледяной бане и добавляют 10н NaOH (15 мл). Из капельной воронки добавляют горячий раствор KMnO4 (33,3 г, 210 ммоль) в воде (140 мл) и 10н NaOH (8 мл). Дополнительный твердый KMnO4 (110 г, 690 ммоль) порциями добавляют вместе с 10н NaOH. Завершая добавление, смесь нагревают до 95°С в течение 90 минут. К смеси добавляют целит и отфильтровывают в еще горячем состоянии через подушку из целита. Фильтр промывают горячим 2н NaOH (200 мл). Фильтрат охлаждают и рН доводят до 3-4 концентрированной HCl. Твердый осадок отфильтровывают и сушат, получая 9,4 г 5-нитропиколиновой кислоты в виде твердого вещества кремового цвета с выходом 35% по двум стадиям. 1H ЯМР (ДМСО-d6) δ 8,26 (дд, 1Н, J=8,7 Гц, J=0,6 Гц), 8,74 (дд, 1Н, J=8,7 Гц, J=2,7 Гц), 9,44 (дд, 1Н, J=2,7 Гц, J=0,6 Гц), 13,92 (ушир, 1Н).
Стадия 3: Суспензию 5-нитропиколиновой кислоты (6,0 г, 36 ммоль) в метанольном HCl (1,25 М) кипятят с обратным холодильником и перемешивают 16 часов. Смесь охлаждают до температуры окружающей среды. Продукт фильтруют и дополнительно промывают метанолом (20 мл) и сушат в вакууме, получая 1,6 г метил 5-нитропиколината с выходом 94%. 1H ЯМР (ДМСО-d6) δ 3,95 (с, 3Н), 8,29 (дд, 1Н, J=8,4 Гц, J=0,6 Гц), 8,75 (дд,1н,J=8,4 Гц, J=2,7 Гц), 9,46 (дд, 1Н, J=2,7 Гц, J=0,6 Гц).
Стадия 4: Этантиолят натрия (1,6 г, 17,2 ммоль) добавляют к раствору метил 5-нитропиколината (2,8 г, 16 ммоль) в ДМФА (30 мл) и полученную смесь перемешивают при комнатной температуре. Спустя 3 часа добавляют уксусную кислоту (1 мл) и смесь выпаривают досуха. Остаток суспендируют в метаноле (50 мл) и обрабатывают 3н NaOH. Полученную смесь перемешивают при комнатной температуре 16 часов, а затем выпаривают. Остаток растворяют в воде (100 мл), промывают этилацетатом (2×100 мл) и подкисляют до рН 3-4 (конц. HCl), что приводит к осаждению продукта. Осадок фильтруют, промывают водой (100 мл) и сушат в вакууме, получая 2,3 г 5-(этилтио)пиколиновой кислоты с выходом 79%. 1H ЯМР (ДМСО-d6) δ 1,23 (т, 3H, J=7,3 Гц), 3,14 (кв, 2H, J=7,3 Гц), 7,86 (дд, 1Н, J=8,4 Гц, J=2,4 Гц), 7,95 (дд, 1Н, J=8,4 Гц, J=0,9 Гц), 8,57 (дд, 1Н, J=2,4 Гц, J=0,9 Гц), 13,09 (ушир, 1Н).
Стадия 5: CDI (0,44 г, 2,7 ммоль) добавляют к смеси 5-(этилтио)пиколиновой кислоты (0,48 г, 2,6 ммоль) и ДМФА (20 мл) и полученную смесь перемешивают при 40°С 2 часа. Затем добавляют метансульфонат 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,00 г, 2,6 ммоль) и перемешивание продолжают при 40°С в атмосфере N2 дополнительных 3 часа. Смесь распределяют между этилацетатом (75 мл) и насыщенным водным раствором бикарбоната натрия (100 мл), водную фазу экстрагируют этилацетатом (75 мл). Объединенные органические фазы промывают насыщенным водным раствором бикарбоната натрия (3×100 мл), сушат (MgSO4) и выпаривают. Остаток хроматографируют (силикагель), используя градиент этилацетат/гексаны, получая 0,65 г продукта с выходом 60% в виде белого твердого вещества. Т. пл. 198-200°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 7,53 (97,70%). 1H ЯМР (ДМСО-d6) δ 1,28 (т, 3H, J=7,3 Гц), 2,02-2,08 (м, 1Н), 2,45-2,62 (м, 2H), 2,83-2,95 (м, 1Н), 3,13 (кв, 2H, J=7,3 Гц), 4,65 (д, 2H, J=6,3 Гц), 5,14 (дд, 1Н, J=12,9 Гц, J=5,4 Гц), 7,83-7,95 (м, 5H), 8,54 (дд, 1Н, J=2,3 Гц, J=0,8 Гц), 9,53 (т, 1Н, J=6,3 Гц), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 13,8, 22,0, 25,2, 30,9, 42,3, 49,0, 122,1, 122,2, 123,5, 129,8, 131,5, 133,5, 135,4, 138,0, 146,3, 146,4, 147,5, 164,1, 167,0, 167,1, 169,8, 172,7. Анализ: Вычислено для C22H20N4O5S: C, 58,40; H, 4,46; N, 12,38. Найдено: C, 58,27; H, 4,35; N, 12,30.
5.52 1-(2-Хлор-фенил-)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]мочевина
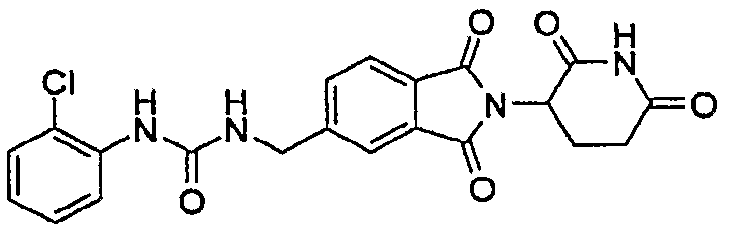
Стадия 1: Смесь 4-бромфталевого ангидрида (10,0 г, 44,1 ммоль), гидрохлорида рац-α-аминоглутаримида (7,25 г, 44,0 ммоль) и ацетата натрия (3,61 г, 44,0 ммоль) в уксусной кислоте (150 мл) оставляют на ночь при кипении с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры и растворитель выпаривают в вакууме. Остаток перемешивают в воде (170 мл) 3 часа и полученное твердое вещество отфильтровывают, дополнительно промывают водой (80 мл) и сушат в вакууме, получают 13,8 г 5-бром-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-5-диона с выходом 93%. 1H ЯМР (ДМСО-d6) δ 2,03-2,10 (м, 1Н), 2,43-2,63 (м, 2H), 2,82-2,97 (м, 1Н), 5,17 (дд, J=12,8 Гц, J=5,3 Гц, 1Н), 7,85-7,88 (д, J=7,9 Гц, 1Н), 8,10 (дд, J=7,9 Гц, J=1,7 Гц, 1Н), 8,16 (д, J=1,7 Гц, 1Н), 11,15 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,9, 30,9, 49,2, 125,3, 126,4, 128,5, 130,1, 133,2, 137,6, 165,9, 166,4, 169,7, 172,7. Анализ: Вычислено для C13H9N2O4Br: C, 46,32; H, 2,69; N, 8,31. Найдено: C, 46,23; H, 2,47; N, 8,41.
Стадия 2: ДМФА дегазируют через азотный барботер 1 час и добавляют 5-бром-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-дион (13,7 г, 40,6 ммоль), цианид цинка (2,86 г, 24,4 ммоль), трис(дибензилиденацетон)дипалладий (0,74 г, 0,80 ммоль) и 1,1'-бис(дифенилфосфино)ферроцен (0,90 г, 1,6 ммоль). Реакционную смесь нагревают до 120°С 3 часа, охлаждают до 60°С и фильтруют через целит. Фильтр дополнительно промывают ДМФА (160 мл), и фильтрат выпаривают в вакууме. Остаток перемешивают в воде (300 мл) 2 дня и фильтруют, дополнительно промывают водой и сушат в вакууме. Полученное твердое вещество растирают с ацетоном (300 мл) 1 час и фильтруют, твердое вещество дополнительно промывают ацетоном (300 мл) и сушат в вакууме. Полученное вещество кипятят в метаноле с обратным холодильником 1 час, охлаждают до комнатной температуры, фильтруют, дополнительно промывают метанолом и сушат, получают 11,1 г 2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-карбонитрила с выходом 96%. Т. пл.>60ºС. 1H ЯМР (ДМСО-d6) δ 2,03-2,12 (м, 1Н), 2,43-2,64 (м, 2H), 2,83-2,97 (м, 1Н), 5,22 (дд, J=12,8 Гц, J=5,2 Гц, 1Н), 8,12 (д, J=7,8 Гц, 1Н), 8,38 (дд, J=7,8 Гц, J=1,4 Гц, 1Н), 8,49 (с, 1Н), 11,17 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,8, 30,9, 49,3, 117,0, 117,4, 124,2, 127,3, 131,8, 134,5, 139,1, 165,6, 165,9, 169,5, 172,7. Анализ: Вычислено для C14H9N3O4+0,3H2O: C, 58,26; H, 3,35; N, 14,56. Найдено: C, 58,01; H, 3,01; N, 14,37.
Стадия 3: Смесь 2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-карбонитрила (1,00 г, 3,53 ммоль), 4н HCl (4,5 мл), 10% Pd-C (0,1 г) и угля для обесцвечивания (0,06 г) в ДМФА (30 мл) оставляют на ночь для гидрирования при 50 фунт/кв. дюйм. Добавляют воду (5 мл) и реакционную смесь фильтруют через целит. Фильтр промывают метанолом (10 мл). Фильтрат концентрируют, остаток совместно выпаривают с этанолом (2×5 мл). Полученное твердое вещество растирают с этанолом (5 мл) 1 час, фильтруют, дополнительно промывают этанолом (10 мл) и сушат, получая 0,97 г гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона в виде белого твердого вещества с выходом 85%. Т. пл.>260°С. 1H ЯМР (ДМСО-d6) δ 2,05-2,12 (м, 1Н), 2,45-2,63 (м, 2H), 2,83-2,98 (м, 1Н), 4,24 (с, 2H), 5,18 (дд, J=12,6 Гц, J=5,4 Гц, 1Н), 7,96-8,03 (м, 2H), 8,11 (с, 1Н), 8,73 (ушир, 3H), 11,15 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 41,7, 49,1, 123,6, 123,9, 131,0, 131,5, 135,4, 141,5, 166,8, 166,9, 169,8, 172,7. Анализ: Вычислено для C14H14N3O4Cl+0,15H2O: C, 51,51; H, 4,42; N, 12,87. Найдено: C, 51,16; H, 4,40; N, 12,59.
Стадия 4: Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 2-хлорфенилизоцианата (0,36 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) оставляют на ночь при перемешивании при 40°С. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток растворяют в этилацетате (100 мл) и промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл). Во время этой промывки осаждается твердое вещество. Его отфильтровывают и дополнительно промывают водой. Органическую фазу фильтрата сушат (MgSO4) и растворитель удаляют в вакууме. Объединенные твердые фазы перемешивают в эфире 3 часа и фильтруют, получают 1,2 г продукта с выходом 92%. Т. пл. 238-240°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 4,34 (98,10%). 1H ЯМР (ДМСО-d6) δ 1,99-2,08 (м, 1H), 2,50-2,63 (м, 2H), 2,82-2,95 (м, 1Н), 4,51 (д, J=5,8 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,3 Гц, 1Н), 6,94-7,43 (м, 3H), 7,65 (т, J=5,8 Гц, 1Н), 7,79-8,14 (м, 4H), 8,24 (с, 1Н), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,6, 49,0, 121,1, 121,6, 121,7, 122,8, 123,6, 127,5, 129,1, 129,8, 131,7, 133,3, 136,5, 148,2, 154,9, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C21H17N4O5Cl+0,1H2O: C, 56,98; H, 3,92; N, 12,66. Найдено: C, 56,71; H, 4,05; N, 12,33.
5.53 1-(3-Хлорфенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]мочевина
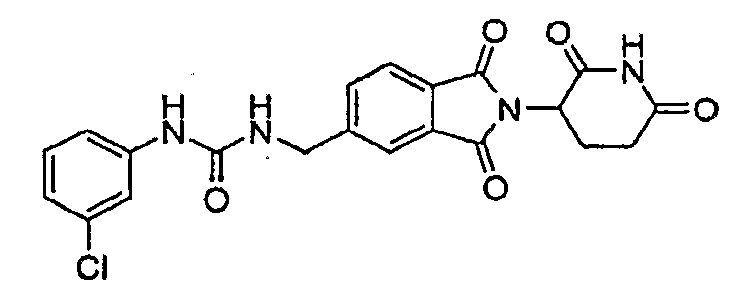
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 3-хлорфенилизоцианата (0,37 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) оставляют на ночь при перемешивании при 40°С. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток растворяют в этилацетате (150 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают. Полученное твердое вещество перемешивают в эфире 3 часа и фильтруют, получая 1,2 г продукта с выходом 92%. Т. пл. 214-216°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 4,58 (98,39%). 1H ЯМР (ДМСО-d6) δ 1,99-2,07 (м, 1Н), 2,50-2,62 (м, 2H), 2,82-2,95 (м, 1Н), 4,47 (д, J=5,5 Гц, 2H), 5,14 (дд, J=12,5 Гц, J=5,1 Гц, 1Н), 6,93-6,98 (м, 2H), 7,22-7,28 (м, 2H), 7,66-7,91 (м, 4H), 8,96 (с, 1Н), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,7, 49,0, 116,2, 117,2, 120,8, 121,7, 123,5, 129,7, 130,2, 131,6, 133,1, 133,2, 141,9, 148,5, 155,1, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C21H17N4O5Cl+0,1H2O: C, 56,98; H, 3,92; N, 12,66. Найдено: C, 56,96; H, 3,70; N, 12,29.
5.54 1-(4-Хлорфенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]мочевина
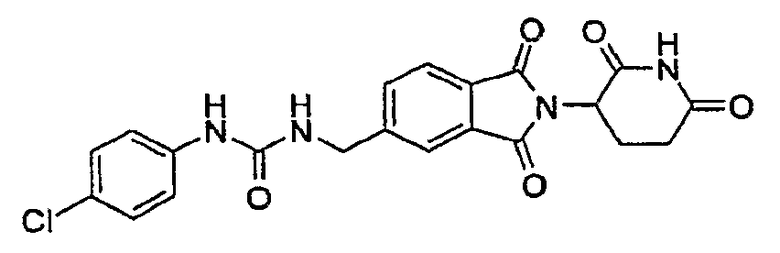
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 4-хлорфенилизоцианата (0,38 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) перемешивают при 40°С 2 дня. Реакционную смесь охлаждают до комнатной температуры. Твердое вещество фильтруют, промывают водой (20 мл), промывают этилацетатом (20 мл) и сушат, получают 0,64 г продукта с выходом 48%. Т. пл. 278-280°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 4,18 (98,85%). 1H ЯМР (ДМСО-d6) δ 2,03-2,07 (м, 1Н), 2,46-2,62 (м, 2H), 2,82-2,96 (м, 1Н), 4,47 (д, J=5,8 Гц, 2H), 5,14 (дд, J=12,5 Гц, J=5,2 Гц, 1Н), 6,91 (т, J=5,8 Гц, 1Н), 7,26 (д, J=8,8 Гц, 2H), 7,44 (д, J=8,9 Гц, 2H), 7,77-7,91 (м, 3H), 8,89 (с, 1Н), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,7, 49,0, 119,3, 121,7, 123,5, 124,7, 128,5, 129,7, 131,6, 133,2, 139,3, 148,6, 155,1, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C21H17N4O5Cl+0,3H2O: C, 56,52; H, 3,98; N, 12,55. Найдено: C, 56,19; H, 3,78; N, 12,28.
5.55 1-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(2-метоксифенил)-мочевина
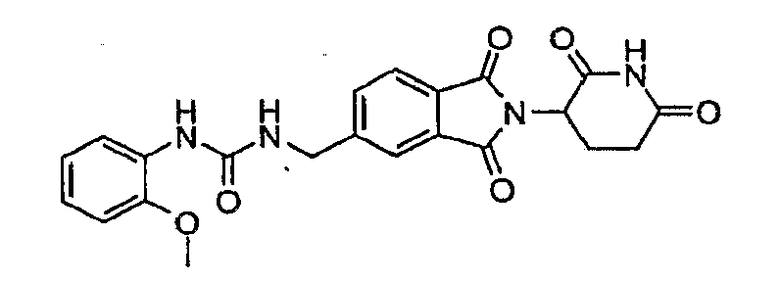
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 2-метоксифенилизоцианата (0,40 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) оставляют на ночь при перемешивании при 40°С. Реакционную смесь охлаждают до комнатной температуры, растворитель удаляют в вакууме. Остаток суспендируют в двухфазной смеси этилацетата (150 мл) и разбавленной водной HCl (150 мл). Твердое вещество фильтруют и промывают водой (50 мл). Полученное твердое вещество хроматографируют, используя градиент метанол-CH2Cl2, элюируют продукт при соотношении метанол-CH2Cl2 5:95, получая продукт (0,090 г, выход 7%). Т. пл. 276-278°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 8,93 (98,32%). 1H ЯМР (ДМСО-d6) δ 2,02-2,09 (м, 1Н), 2,46-2,62 (м, 2H), 2,83-2,95 (м, 1Н), 3,84 (с, 3H), 4,48 (д, J=5,8 Гц, 2H), 5,15 (дд, J=12,8 Гц, J=5,3 Гц, 1Н), 6,83-6,99 (м, 3H), 7,51 (т, J=6,0 Гц, 1Н), 7,78-8,11 (м, 5H), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,5, 49,0, 55,6, 110,59, 118,11, 120,4, 121,3, 121,6, 123,5, 129,1, 129,7, 131,6, 133,2, 147,4, 148,6, 155,2, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C22H20N4O6+1,2H2O: C, 57,69; H, 4,93; N, 12,23. Найдено: C, 57,63; H, 4,19; N, 11,84.
5.56 1-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(4-метоксифенил)-мочевина
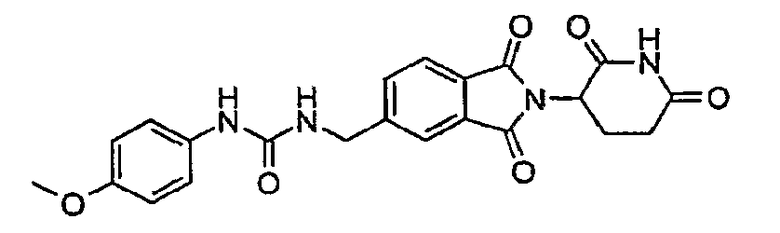
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 4-метоксифенилизоцианата (0,39 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) перемешивают при 40°С 2 дня. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток растворяют в этилацетате (150 мл) и промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл). Растворитель удаляют в вакууме и полученное твердое вещество хроматографируют, используя градиент метанол-CH2Cl2, элюируя продукт при соотношении метанол-CH2Cl2 5:95, получают 0,57 г продукта с выходом 44%. Т. пл. 241-243°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 5,69 (98,79%). 1H ЯМР (ДМСО-d6) δ 2,04-2,08 (м, 1Н), 2,49-2,63 (м, 2H), 2,85-2,90 (м, 1Н), 3,69 (с, 3H), 4,45 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,1 Гц, 1Н), 6,75 (т, J=6,0 Гц, 1Н), 6,80-6,84 (м, 2H), 7,29-7,32 (м, 2H), 7,77-7,91 (м, 3H), 8,51 (с, 1Н), 11,13 (с, 1Н); 1H ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,6, 49,0, 55,1, 113,8, 119,6, 121,7, 123,5, 129,6, 131,6, 133,2, 133,3, 148,9, 154,1, 155,5, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C22H20N4O6: C, 60,55; H, 4,62; N, 12,84. Найдено: C, 60,22; H, 4,35; N, 12,62.
5.57 1-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-м-толил-мочевина
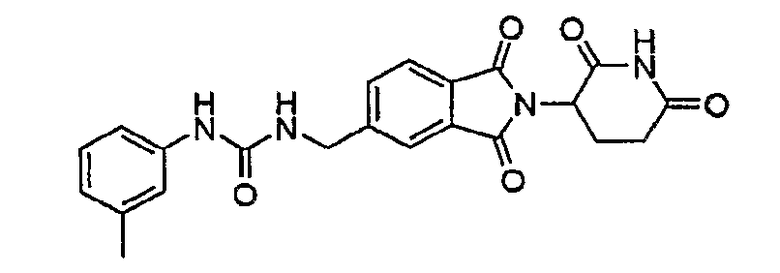
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), м-толилизоцианата (0,38 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Твердую фазу фильтруют, дополнительно промывают ацетонитрилом (20 мл) и сушат в вакууме, получая 0,72 г продукта с выходом 57%. Т. пл. 220-222°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 5,21 (95,95%). 1H ЯМР (ДМСО-d6) δ 2,02-2,10 (м, 1Н), 2,24 (с, 3H), 2,48-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,47 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,1 Гц, 1Н), 6,72 (д, J=7,2 Гц, 1Н), 6,83 (т, J=6,0 Гц, 1Н), 7,07-7,25 (м, 3H), 7,78-7,82 (м, 2H), 7,90 (д, J=7,8 Гц, 1Н), 8,64 (с, 1Н), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,2, 22,0, 30,9, 42,6, 49,0, 115,0, 118,4, 121,7, 122,0, 123,5, 128,5, 129,6, 131,6, 133,2, 137,7, 140,2, 148,8, 155,3, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C22H20N4O5: C, 62,85; H, 4,79; N, 13,33. Найдено: C, 62,54; H, 4,60; N, 13,38.
5.58 1-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-п-толил-мочевина
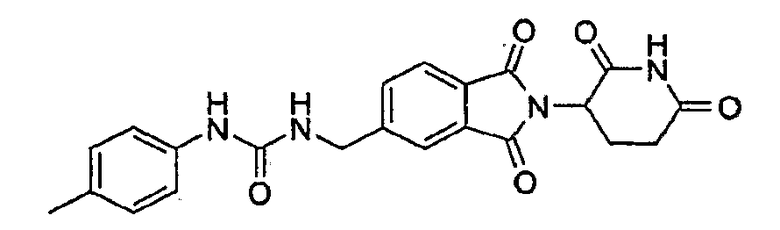
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), п-толилизоцианата (0,38 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в CH2Cl2 (20 мл) оставляют на ночь при перемешивании при комнатной температуре. Твердую фазу фильтруют, дополнительно промывают CH2Cl2 (20 мл). Твердую фазу оставляют на ночь при перемешивании в метаноле, кипятят с обратным холодильником 3 часа и фильтруют. Фильтрат концентрируют и остаток перемешивают в этилацетате и фильтруют. Объединяют твердые фазы, получают 0,70 г продукта с выходом 56%. Т. пл. 238-240°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 4,66 (98,56%). 1H ЯМР (ДМСО-d6) δ 1,99-2,10 (м, 1Н), 2,21 (с, 3H), 2,47-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,46 (д, J=5,7 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,1 Гц, 1Н), 6,79 (т, J=6,0 Гц, 1Н), 7,03 (д, J=8,4 Гц, 2H), 7,29 (д, J=8,4 Гц, 2H), 7,78-7,91 (м, 3H), 8,59 (с, 1Н), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 20,3, 22,0, 30,9, 42,6, 49,0, 117,94, 121,7, 123,5, 129,0, 129,6, 130,0, 131,6, 133,2, 137,7, 148,9, 155,3, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C22H20N4O5+0,1H2O: C, 62,58; H, 4,82; N, 13,27. Найдено: C, 62,37; H, 4,55; N, 12,92.
5.59 1-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(4-трифторметоксифенил)-мочевина
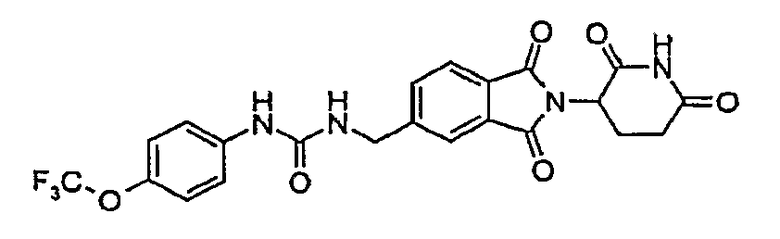
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 4-(трифторметокси)фенилизоцианата (0,45 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) оставляют на ночь при перемешивании при 40°С. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток растворяют в этилацетате (150 мл) и промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл). Растворитель удаляют в вакууме и остаток оставляют на ночь при перемешивании в эфире (20 мл). Полученную твердую фазу фильтруют, получают продукт (1,3 г, выход 89%). Т. пл. 226-228°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 9,50 (98,37%). 1H ЯМР (ДМСО-d6) δ 2,02-2,09 (м, 1Н), 2,47-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,48 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,1 Гц, 1Н), 6,93 (т, J=6,0 Гц, 1Н), 7,23 (д, J=8,4 Гц, 2H), 7,49-7,54 (м, 2H), 7,79-7,91 (м, 3H), 8,96 (с, 1Н), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,6, 49,0, 118,9, 120,16 (кв, J=254 Гц), 121,6, 121,7, 123,5, 129,7, 131,6, 133,2, 139,59, 142,1, 148,6, 155,2, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C22H17N4O6F3: C, 53,88; H, 3,49; N, 11,42. Найдено: C, 53,80; H, 3,15; N, 11,25.
5.60 1-(4-Цианофенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
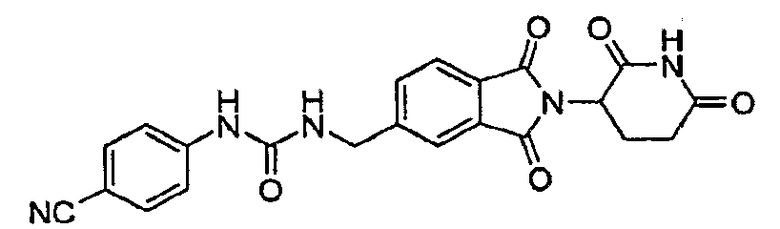
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 4-цианофенилизоцианата (0,43 г, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в CH2Cl2 (20 мл) перемешивают при комнатной температуре 2 дня. Твердую фазу фильтруют и дополнительно промывают CH2Cl2 (20 мл). Твердую фазу перемешивают в этилацетате 3 часа и фильтруют. Остаток очищают препаративной ВЭЖХ, используя градиент ацетонитрил-вода, элюируя продукт при соотношении ацетонитрил-вода 35:65, получают 0,56 г продукта с выходом 43%. Т. пл. 265-267°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 8,97 (97,25%). 1H ЯМР (ДМСО-d6) δ 2,04-2,08 (м, 1Н), 2,50-2,63 (м, 2H), 2,83-2,95 (м, 1Н), 4,49 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,18 (т, J=5,7 Гц, 1Н), 7,58-7,69 (м, 4H), 7,79-7,91 (м, 3H), 9,38 (с, 1Н), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,6, 49,0, 102,6, 117,6, 119,4, 121,7, 123,5, 129,7, 131,6, 133,1, 133,2, 144,8, 148,3, 154,8, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C22H17N5O5+0,4H2O: C, 60,25; H, 4,09; N, 15,97. Найдено: C, 59,87; H, 3,70; N, 15,87.
5.61 1-(4-Трет-бутил-фенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
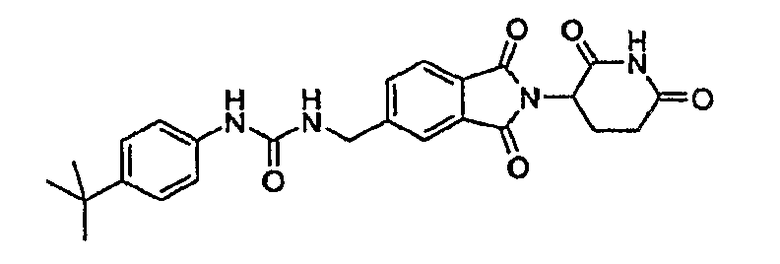
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 4-(трет-бутил)-фенилизоцианата (0,52 г, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) оставляют на ночь при перемешивании при 40°С. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток растворяют в этилацетате (100 мл) и промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают. Твердое вещество оставляют на ночь при перемешивании в эфире и фильтруют, получают 0,34 г продукта с выходом 24%. Т. пл. 207-209°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 4,87 (95,56%). 1H ЯМР (ДМСО-d6) δ 1,24 (с, 9H), 2,02-2,09 (м, 1H), 2,49-2,63 (м, 2H), 2,83-2,95 (м, 1 H), 4,47 (д, J=5,7 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,1 Гц, 1Н), 6,79 (т, J=6,0 Гц, 1Н), 7,22-7,33 (м, 4H), 7,78- 7,91 (м, 3H), 8,96 (с, 1Н), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 31,2, 33,8, 42,6, 49,0, 117,7, 121,6, 123,5, 125,2, 129,6, 131,6, 133,2, 137,6, 143,5, 148,9, 155,3, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C25H26N4O5+0,15H2O: C, 64,55; H, 5,70; N, 12,04. Найдено: C, 64,17; H, 5,44; N, 11,90.
5.62 1-(3,4-Дихлор-фенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
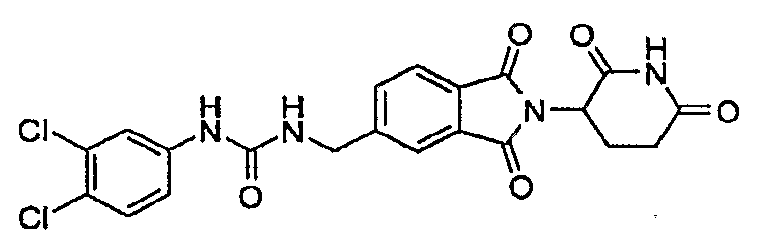
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 3,4-дихлорфенилизоцианата (0,56 г, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в пиридине (20 мл) оставляют на ночь при перемешивании при 40°С. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток суспендируют в двухфазной смеси CH2Cl2 (150 мл) и воды (150 мл) и перемешивают 2 часа. Твердое вещество фильтруют, дополнительно промывают водой (50 мл) и сушат. Полученное твердое вещество перемешивают в метаноле (200 мл) при комнатной температуре 1 час, фильтруют и сушат. Данное вещество кипятят с обратным холодильником в метаноле (2×200 мл) 3 часа, фильтруют и сушат. Полученное твердое вещество хроматографируют, используя градиент метанол-CH2Cl2 (с 0,1% триэтиламина), элюируют 0,23 г продукта при соотношении метанол-CH2Cl2 (с 0,1% триэтиламина) 7:93 с выходом 16%. Т. пл. 290-292°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 10,50 (97,00%). 1H ЯМР (ДМСО-d6) δ 2,03-2,07 (м, 1Н), 2,56-2,62 (м, 2H), 2,82-2,94 (м, 1Н), 4,47 (д, J=5,9 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,4 Гц, 1Н), 7,05 (т, J=6,1 Гц, 1Н), 7,29 (дд, J=8,8 Гц, J=2,4 Гц, 1Н), 7,46 (д, J=8,8 Гц, 1Н), 7,77-7,91 (м, 4H), 9,11 (с, 1Н), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,7, 49,0, 117,9, 118,9, 121,7, 122,4, 123,5, 129,7, 130,4, 130,9, 131,6, 133,3, 140,6, 148,4, 155,0, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C21H16N4O5Cl2+0,25H2O: C, 52,57; H, 3,47; N, 11,68. Найдено: C, 52,22; H, 3,25; N, 11,56.
5.63 1-(3,4-Диметил-фенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
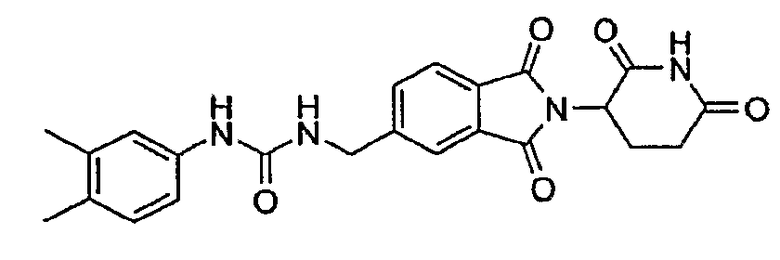
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 3,4-диметилфенилизоцианата (0,42 г, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) перемешивают при 40°С 2 дня. Реакционную смесь охлаждают до комнатной температуры. Твердое вещество фильтруют, промывают водой (20 мл), промывают этилацетатом (20 мл) и сушат, получают 1,0 г продукта с выходом 78%. Т. пл. 238-240°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 5,35 (98,53%). 1H ЯМР (ДМСО-d6) δ 2,03-2,07 (м, 1Н), 2,12 (с, 3H), 2,15 (с, 3H), 2,46-2,62 (м, 2H), 2,82-2,96 (м, 1H), 4,45 (д, J=5,9 Гц, 2H), 5,14 (дд, J=12,6 Гц, J=5,3 Гц, 1Н), 6,77 (т, J=5,9 Гц, 1Н), 6,96 (д, J=7,0 Гц, 1Н), 7,09-7,18 (м, 2H), 7,77-7,91 (м, 3H), 8,52 (с, 1Н), 11,12 (с, 1 H); 13С ЯМР (ДМСО-d6) δ 18,6, 19,6, 22,0, 30,9, 42,6, 49,0, 115,5, 119,3, 121,7, 123,5, 128,8, 129,5, 129,6, 131,6, 133,2, 136,1, 137,9, 148,9, 155,3, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C23H22N4O3+0,4H2O: C, 62,55; H, 5,20; N, 12,69. Найдено: C, 62,22; H, 5,12; N, 12,39.
5.64 1-(3-Хлор-4-метил-фенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
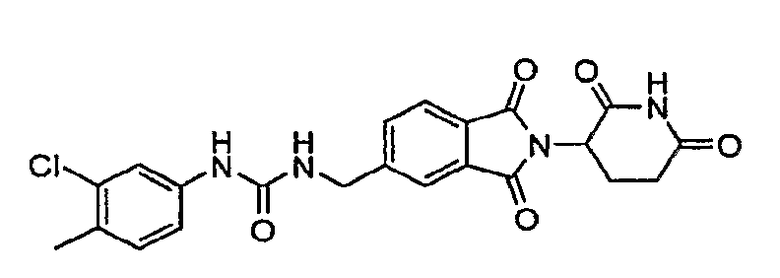
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 3-хлор-4-метилфенилизоцианата (0,41 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) оставляют на ночь при перемешивании при 40°С. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток перемешивают в двухфазной смеси CH2Cl2 (150 мл) и воды (150 мл) и органический растворитель удаляют в вакууме. Полученное твердое вещество фильтруют и оставляют на ночь при перемешивании в метаноле (100 мл) при комнатной температуре, фильтруют и сушат, получая продукт в виде белого твердого вещества (1,2 г, выход 88%). Т. пл. 243-245°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 8,42 (98,48%). 1H ЯМР (ДМСО-d6) δ 2,04-2,09 (м, 1Н), 2,24 (с, 3H), 2,47-2,64 (м, 2H), 2,83-2,96 (м, 1Н), 4,47 (д, J=5,6 Гц, 2H), 5,16 (дд, J=12,3 Гц, J=4,9 Гц, 1Н), 6,92 (т, J=5,7 Гц, 1Н), 7,13-7,21 (м, 2H), 7,66-7,92 (м, 4H), 8,86 (с, 1Н), 11,14 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 18,7, 22,0, 30,9, 42,7, 49,0, 116,5, 117,8, 121,7, 123,5, 127,5, 129,7, 131,0, 131,6, 133,0, 133,2, 139,5, 148,6, 155,1, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C22H19N4O5Cl+0,4H2O: C, 57,19; H, 4,32; N, 12,12. Найдено: C, 56,80; H, 4,12; N, 11,75.
5.65 1-(4-Хлор-3-метил-фенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
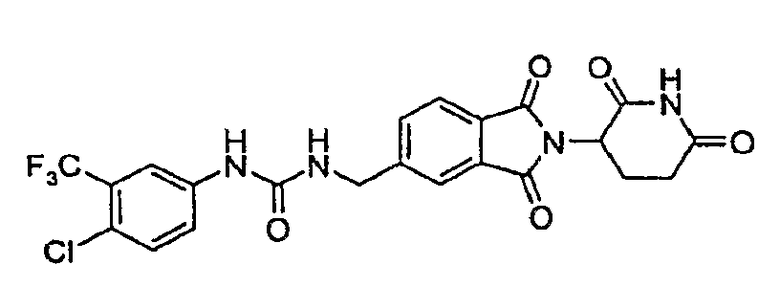
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 4-хлор-3-(трифторметил)фенилизоцианата (0,66 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в CH2Cl2 (20 мл) перемешивают при комнатной температуре 2 дня. Твердое вещество фильтруют и дополнительно промывают CH2Cl2 (20 мл) и сушат, получая 1,0 г продукта с выходом 68%. Т. пл. 285-287°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 6,01 (95,01%). 1H ЯМР (ДМСО-d6) δ 2,02-2,09 (м, 1Н), 2,46-2,63 (м, 2H), 2,84-2,94 (м, 1Н), 4,49 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,4 Гц, 1Н), 7,09 (т, J=6,0 Гц, 1Н), 7,54-7,65 (м, 2H), 7,79-7,94 (м, 3H), 8,06 (д, J=2,4 Гц, 1Н), 9,29 (с, 1Н), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,7, 49,0, 116,3 (кв, J=6,0 Гц), 122,8 (кв, J=270 Гц), 121,6, 121,7, 122,5, 123,5, 126,6 (кв, J=30 Гц), 129,7, 131,8, 131,6, 133,2, 139,9, 148,4, 155,0, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C20H16N4O5ClF3+0,2H2O: C, 51,03; H, 3,31; N, 10,82. Найдено: C, 50,68; H, 2,96; N, 10,55.
5.66 1-Бензо[1,3]диоксол-5-ил-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
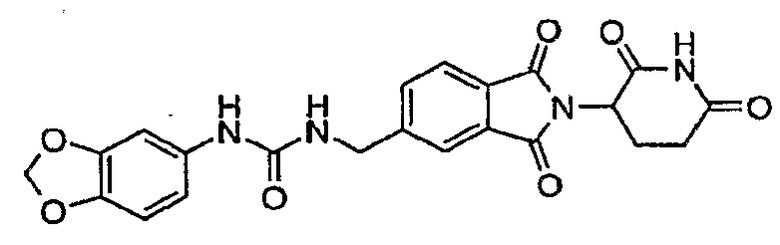
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 3,4-(метилендиокси)фенилизоцианата (0,49 г, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в метиленхлориде (20 мл) перемешивают при комнатной температуре 1 час. Твердое вещество фильтруют и дополнительно промывают метиленхлоридом (20 мл), сушат в вакууме, получают 0,86 г продукта с выходом 64%. Т. пл. 200-202°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 3,10 (96,75%). 1H ЯМР (ДМСО-d6) δ 2,02-2,09 (м, 1Н), 2,48-2,63 (м, 2H), 2,83-2,94 (м, 1Н), 4,45 (д, J=6,0 Гц, 2H), 5,15 (дд, J=12,6 Гц, J=5,1 Гц, 1Н), 5,93 (с, 2H), 6,70-6,80 (м, 3H), 7,16 (д, J=1,8 Гц, 1Н), 7,77-7,91 (м, 3H), 8,62 (с, 1Н), 11,13 (8, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,6, 49,0, 110,6, 100,6, 108,0, 110,5, 121,7, 123,5, 129,6, 131,6, 133,2, 134,7, 141,6, 147,1, 148,8, 155,4, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C22H18N4O7+0,1H2O: C, 58,43; H, 4,06; N, 12,39, Найдено: C, 58,20; H, 3,78; N, 12,21.
5.67 1-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-нафталин-мочевина
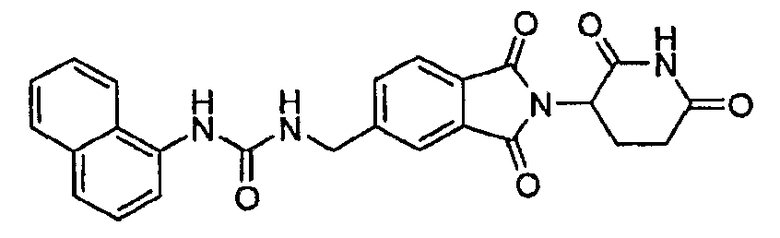
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (1,0 г, 3,1 ммоль), 1-нафтилизоцианата (0,52 г, 3,1 ммоль) и триэтиламина (0,63 г, 6,2 ммоль) в ТГФ (35 мл) нагревают до 40°С в атмосфере азота при перемешивании в течение 21 часа. Смесь охлаждают до комнатной температуры и распределяют между этилацетатом (100 мл) и разбавленной водной HCl (100 мл) и органическую фазу промывают водой (2×100 мл), сушат (MgSO4) и выпаривают. Остаток хроматографируют, используя градиент метиленхлорид-метанол, элюируя продукт при соотношении метиленхлорид-метанол 19:1. Данное вещество далее очищают препаративной ВЭЖХ, используя изократическое элюирование смесью ацетонитрил-вода 40-60, и получают 0,3 г в виде белого твердого вещества (21%). Т. пл. 229-231°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 4,76 (96,81%). 1H ЯМР (ДМСО-d6) δ 1,96-2,03 (м, 1Н), 2,40-2,56 (м, 2H), 2,76-2,89 (м, 1Н), 4,48 (д, J=6,0 Гц, 2H), 5,09 (дд, J=12,6 Гц, J=5,4 Гц, 1Н), 7,17 (т, J=6,0 Гц, 1Н), 7,36 (т, J=8,0 Гц, 1Н), 7,44-7,54 (м, 3H), 7,76-7,89 (м, 5H), 8,04 (д, J=7,8 Гц, 1Н), 8,68 (с, 1Н), 11,06 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 42,7, 49,0, 117,2, 121,5, 121,7, 122,5, 123,5, 125,5, 125,8, 125,9, 128,3, 129,7, 131,6, 133,2, 133,7, 134,8, 148,7, 155,8, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C25H26N4O5+0,2H2O: C, 65,27; H, 4,47; N, 12,18. Найдено: C, 65,32; H, 4,17; N, 12,14.
5.68 1-Бутил-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
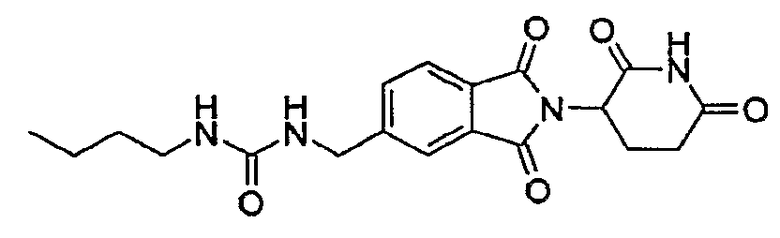
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), бутилизоцианата (0,33 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют. Остаток растворяют в этилацетате (100 мл) и промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Остаток очищают препаративной ВЭЖХ, используя изократическое элюирование смесью ацетонитрил-вода 35:65, получая 0,20 г продукта с выходом 17%. Т. пл. 171-173°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 35/65 CH3CN/0,1% H3PO4, 3,13 (97,37%). 1H ЯМР (ДМСО-d6) δ 0,87 (т, J=6,9 Гц, 3H), 1,21-1,41 (м, 4H), 2,02-2,10 (м, 1Н), 2,46-2,63 (м, 2H), 2,83-2,91 (м, 1Н), 2,94-3,04 (м, 2H), 4,36 (д, J=6,0 Гц, 2H), 5,14 (дд, J=12,6 Гц, J=5,4 Гц, 1Н), 6,07 (т, J=5,7 Гц, 1Н), 6,51 (т, J=6,0 Гц, 1Н), 7,71-7,88 (м, 3H), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 13,7, 19,5, 22,0, 30,9, 32,1, 39,0, 42,7, 49,0, 121,5, 123,4, 129,5, 131,5, 133,0, 149,5, 158,0, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C19H22N4O5: C, 59,06; H, 5,74; N, 14,50. Найдено: C, 58,84; H, 5,73; N, 14,29.
5.69 1-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-пентил-мочевина
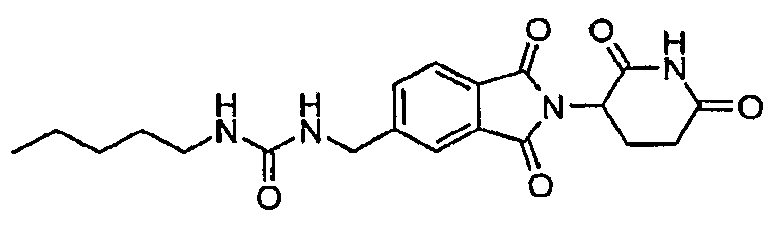
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), пентилизоцианата (0,39 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в CH2Cl2 (20 мл) оставляют на ночь при перемешивании при комнатной температуре. Твердое вещество фильтруют, дополнительно промывают CH2Cl2 (20 мл) и метанолом (20 мл). Вещество высыхает, давая 0,54 г продукта с выходом 45%. Т. пл. 176-178°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 3,15 (98,59%). 1H ЯМР (ДМСО-d6) δ 0,86 (т, J=6,6 Гц, 3H), 1,18-1,42 (м, 6H), 2,02-2,10 (м, 1Н), 2,46-2,63 (м, 2H), 2,83-3,03 (м, 3H), 4,46 (д, J=6,3 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 6,07 (т, J=5,7 Гц, 1Н), 6,51 (т, J=6,0 Гц, 1Н), 7,71-7,88 (м, 3H), 11,12 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 13,9, 21,9, 22,0, 28,6, 29,6, 30,9, 39,3, 42,7, 48,9, 121,5, 123,4, 129,5, 131,5, 133,1, 149,5, 158,0, 167,0, 167,2, 169,8, 172,7. Анализ: Вычислено для C20H24N4O5: C, 59,99; H, 6,04; N, 13,99. Найдено: C, 59,65; H, 5,89; N, 13,86.
5.70 1-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-гексил-мочевина
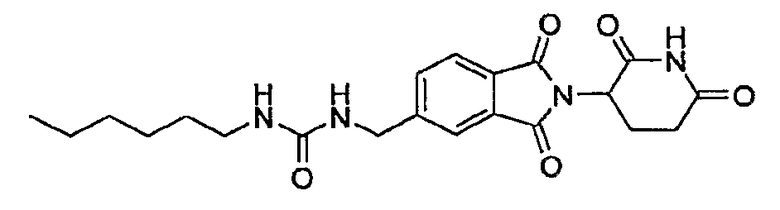
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), гексилизоцианата (0,43 мл, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) оставляют на ночь при перемешивании при 40°С. Реакционную смесь охлаждают до комнатной температуры. и растворитель удаляют в вакууме. Остаток растворяют в этилацетате (150 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают. Остаток очищают препаративной ВЭЖХ, используя изократическое элюирование смесью ацетонитрил-вода 55:45, получая 0,67 г продукта с выходом 54%. Т. пл. 162-164°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 3,41 (99,34%). 1H ЯМР (ДМСО-d6) δ 0,85 (т, J=6,3 Гц, 3H), 1,24-1,36 (м, 8H), 2,03-2,07 (м, 1Н), 2,45-2,62 (м, 2H), 2,82-2,91 (м, 1Н), 2,96-3,03 (м, 2H), 4,36 (д, J=5,9 Гц, 2H), 5,14 (дд, J=12,5 Гц, J=5,3 Гц, 1Н), 6,07 (т, J=5,6 Гц, 1Н), 6,52 (т, J=6,0 Гц, 1Н), 7,71-7,76 (м, 2H), 7,87 (д, J=7,7 Гц, 1Н), 11,12 (с, 1 H); 13С ЯМР (ДМСО-d6) δ 13,9, 22,0, 22,1, 26,0, 29,9, 30,9, 31,0, 39,37, 42,8, 49,0, 121,6, 123,4, 129,5, 131,5, 133,1, 149,5, 158,0, 167,1, 167,2, 169,8, 172,7. Анализ: Вычислено для C21H26N4O5+0,15H2O: C, 60,46; H, 6,35; N, 13,43. Найдено: C, 60,17; H, 6,23; N, 13,57.
5.71 1-(4-Хлорфенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-тиомочевина
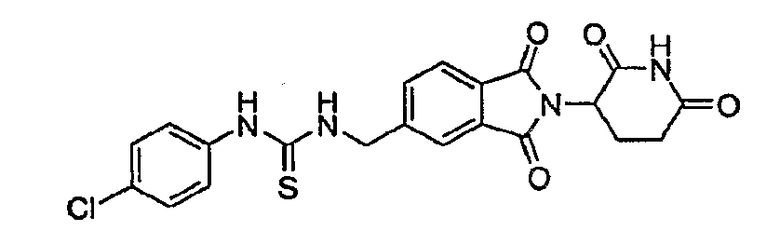
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), 4-хлорфенилизотиоцианата (0,51 г, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) оставляют на ночь при перемешивании при 40°С. Реакционную смесь охлаждают до комнатной температуры, и растворитель удаляют в вакууме. Остаток растворяют в этилацетате (100 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Полученное твердое вещество оставляют на ночь при перемешивании в эфире и фильтруют. Твердое вещество очищают препаративной ВЭЖХ, используя изократическое элюирование смесью ацетонитрил-вода 40:60. Полученное таким образом твердое вещество перемешивают в эфире и фильтруют, получая 0,75 г продукта с выходом 55%. Т. пл. 239-241°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 6,19 (95,49%). 1H ЯМР (ДМСО-d6) δ 2,03-2,10 (м, 1Н), 2,46-2,63 (м, 2H), 2,84-2,96 (м, 1Н), 4,91 (д, J=5,4 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,37-7,40 (м, 2H), 7,45-7,48 (м, 2H), 7,80-7,84 (м, 2H), 7,89-7,91 (м, 1Н), 8,46 (с, 1Н), 9,89 (с, 1Н), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,0, 30,9, 46,8, 49,0, 121,9, 123,4, 125,1, 128,3, 128,5, 129,7, 131,4, 133,4, 138,0, 147,2, 167,0, 167,2, 169,8, 172,7, 181,2. Анализ: Вычислено для C21H17N4O4SCl: C, 55,20; H, 3,75; N, 12,26. Найдено: C, 54,81 ; H, 3,51; N, 12,05.
5.72 1-[2-(2,6-Диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-п-толил-тиомочевина
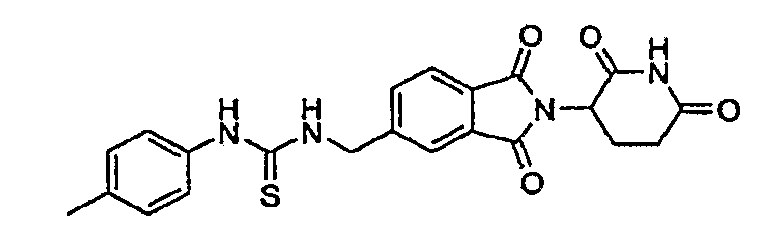
Смесь гидрохлорида 5-аминометил-2-(2,6-диоксо-пиперидин-3-ил)-изоиндол-1,3-диона (0,97 г, 3,0 ммоль), п-толилизотиоцианата (0,45 г, 3,0 ммоль) и N,N-диизопропилэтиламина (1,05 мл, 6,00 ммоль) в ТГФ (20 мл) нагревают до 40°С и оставляют на ночь при перемешивании. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют в вакууме. Остаток растворяют в этилацетате (100 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл). Твердое вещество фильтруют. Органический слой двухфазного фильтрата выпаривают и остаток объединяют с твердым веществом, которое было отфильтровано. Данное твердое вещество оставляют на ночь при перемешивании в эфире и фильтруют. Полученное твердое вещество перемешивают в ДМФА (10 мл), фильтруют, дополнительно промывают ДМФА и водой. Твердое вещество перемешивают в эфире и фильтруют, получая 0,31 г продукта с выходом 24%. Т. пл. 246-248°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 6,47 (96,05%). 1H ЯМР (ДМСО-d6) δ 2,02-2,10 (м, 1Н), 2,38 (с, 3H), 2,46-2,63 (м, 2H), 2,83-2,96 (м, 1Н), 4,89 (д, J=5,7 Гц, 2H), 5,15 (дд, J=12,9 Гц, J=5,4 Гц, 1Н), 7,12-7,26 (м, 4H), 7,79-7,95 (м, 3H), 8,23 (т, 1Н), 9,71 (с, 1Н), 11,13 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 20,5, 22,0, 30,9, 46,9, 49,0, 121,9, 123,4, 124,1, 129,3, 129,6, 131,4, 133,4, 134,1, 136,0, 147,6, 167,0, 167,2, 169,8, 172,7, 181,1. Анализ: Вычислено для C22H20N4O4S+0,1H2O: C, 60,29; H, 4,65; N5 12,78, Найдено: C, 60,10; H, 4,36; N, 12,67.
5.73 1-(4-Хлорфенил)-3-[2-(3S)-(3-метил-2,6-диоксо-пиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
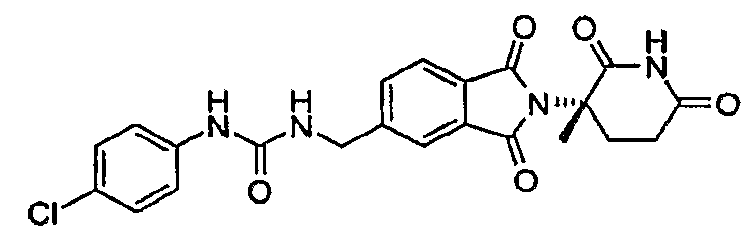
Стадия 1: Смесь 4-бромфталевого ангидрида (7,53 г, 33,2 ммоль), гидробромида (3S)-3-амино-3-метил-пиперидин-2,6-диона (8,00 г, 44,1 ммоль) и ацетата натрия (2,72 г, 33,2 ммоль) в уксусной кислоте (150 мл) кипятят с обратным холодильником 24 часа. Реакционную смесь охлаждают до комнатной температуры и растворитель выпаривают в вакууме. Остаток перемешивают в воде (170 мл) 3 часа и полученное твердое вещество фильтруют, дополнительно промывают водой (80 мл) и сушат, получают 6,3 г 5-бром-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона с выходом 54%. 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,01-2,09 (м, 1Н), 2,53-2,73 (м, 3H), 7,79 (дд, J=5,7 Гц, J=2,7 Гц, 1Н), 8,06 (м, 2H), 11,04 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,5, 29,0, 58,9, 124,9, 125,9, 128,3, 130,0, 133,0, 137,4, 166,6, 167,2, 172,0, 172,1.
Стадия 2: ДМФА (160 мл) дегазируют через азотный барботер 1 час и добавляют 5-бром-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-дион (6,31 г, 18,0 ммоль), цианид цинка (1,26 г, 10,8 ммоль), трис(дибензилиденацетон)дипалладий(0) (0,33 г, 0,40 ммоль) и 1,1'-бис(дифенилфосфино)ферроцен (0,4 г, 0,7 ммоль). Реакционную смесь нагревают до 120°С 3 часа, охлаждают до 60°С и фильтруют через целит. Фильтр дополнительно промывают ДМФА (100 мл) и фильтрат выпаривают в вакууме. Остаток перемешивают в воде (200 мл) 2 дня и фильтруют, дополнительно промывают водой (50 мл) и сушат. Полученное твердое вещество растирают с ацетоном (50 мл) и перемешивают 1 час, и фильтруют, и дополнительно промывают ацетоном (40 мл). Сушка дает 4,7 г 2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-карбонитрила с выходом 88%. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 5,21 (98,40%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,02-2,10 (м, 1Н), 2,51-2,73 (м, 3H), 8,03 (д, J=7,8 Гц, 1Н), 8,33 (дд, J=7,8 Гц, J=1,5 Гц, 1Н), 8,40 (с, 1Н), 11,06 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,5, 28,9, 59,1, 116,7, 117,4, 123,8, 126,9, 131,7, 134,4, 138,8, 166,3, 166,6, 171,8, 172,2.
Стадия 3: Смесь 2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-карбонитрила (4,70 г, 15,8 ммоль), 4н HCl (21 мл), 10% Pd-C (1,88 г) в СН3ОН (200 мл) гидрируют при 50 фунт/кв.дюйм Н2 16 часов. Добавляют воду (24 мл) и реакционную смесь фильтруют через целит. Фильтр дополнительно промывают метанолом (50 мл). Фильтрат концентрируют и сушат, получая 3,5 г гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона с выходом 66%. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 1,00 (97,70%). 1H ЯМР (ДМСО-d6) δ 1,91 (с, 3H), 2,03-2,10 (м, 1Н), 2,49-2,61 (м, 2H), 2,66-2,75 (м, 1Н), 4,23 (с, 2H), 7,89-8,03 (м, 3H), 8,68 (ушир, 3H), 11,04 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 20,9, 28,6, 29,0, 41,6, 58,9, 123,2, 123,5, 130,8, 131,4, 135,3, 141,2, 167,5, 167,6, 172,1, 172,2.
Стадия 4: Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,51 г, 1,5 ммоль), 4-хлорфенилизоцианата (0,19 мл, 1,5 ммоль) и N,N-диизопропилэтиламина (0,52 мл, 3,0 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют и остаток растворяют в этилацетате (100 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Остаток хроматографируют, используя градиент метанол-CH2Cl2, элюируя продукт при соотношении метанол-CH2Cl2 4:96. Полученное твердое вещество оставляют на ночь при перемешивании в эфире, фильтруют и сушат, получают 0,39 г продукта с выходом 57%. Т. пл. 245-247°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 45/55 CH3CN/0,1% H3PO4, 4,76 (99,33%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 1,99-2,08 (м, 1Н), 2,54-2,60 (м, 2H), 2,63-2,72 (м, 1Н), 4,45 (д, J=6,0 Гц, 2H), 6,89 (т, J=6,0 Гц, 1Н), 7,25-7,29 (м, 2H), 7,42-7,46 (м, 2H), 7,75-7,83 (м, 3H), 8,87 (с, 1Н), 11,02 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,6, 29,1, 42,6, 58,7, 119,3, 121,3, 123,1, 124,7, 128,4, 129,5, 131,3, 133,2, 139,3, 148,4, 155,1, 167,8, 167,9, 172,1, 172,2. Анализ: Вычислено для C22H19N4O5Cl: C, 58,09; H, 4,21; N, 12,32. Найдено: C, 57,70; H, 4,20; N, 11,99.
5.74 1-[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(4-трифторметокси-фенил)-мочевина
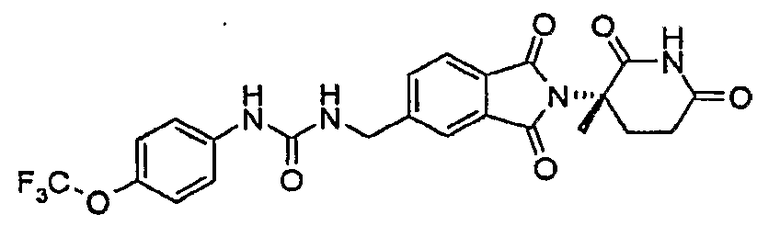
Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,40 г, 1,2 ммоль), 4-(трифторметокси)фенилизоцианата (0,18 мл, 1,2 ммоль) и N,N-диизопропилэтиламина (0,41 мл, 2,4 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют, и остаток растворяют в этилацетате (100 мл). Органическую фазу промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Полученное твердое вещество оставляют на ночь при перемешивании в эфире, фильтруют и сушат, получают 0,54 г продукта с выходом 90%. Т. пл. 168-170°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 6,04 (98,93%). 1H ЯМР (ДМСО-d6) δ 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,52-2,60 (м, 2H), 2,63-2,72 (м, 1Н), 4,46 (д, J=6,0 Гц, 2H), 6,91 (т, J=6,0 Гц, 1Н), 7,22 (д, J=8,1 Гц, 2H), 7,48-7,53 (м, 2H). 7,75-7,83 (м, 3H), 8,95 (с, 1Н), 11,02 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 21,0, 28,6, 29,1, 42,6, 58,7, 118,9, 120,2 (кв, J=254 Гц), 121,3, 121,6, 123,1, 129,5, 131,4, 133,2, 139,6, 142,1, 148,4, 155,1, 167,8, 167,9, 172,1, 172,2. Анализ: Вычислено для C23H19N4O6F3: C, 54,77; H, 3,80; N, 11,11. Найдено: C, 54,57; H, 3,44; N, 10,93.
5.75 1-Гексил-3-[2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
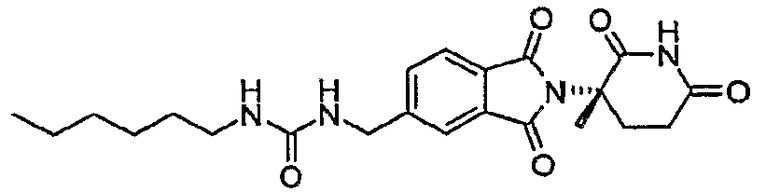
Смесь гидрохлорида 5-аминометил-2-[(3S)-3-метил-2,6-диоксо-пиперидин-3-ил]-изоиндол-1,3-диона (0,51 г, 1,5 ммоль), гексилизоцианата (0,22 мл, 1,5 ммоль) и N,N-диизопропилэтиламина (0,52 мл, 3,00 ммоль) в ацетонитриле (20 мл) перемешивают при комнатной температуре 1 час. Реакционную смесь концентрируют и остаток растворяют в этилацетате (100 мл), промывают разбавленной водной HCl (2×150 мл) и водой (2×150 мл), сушат (MgSO4) и выпаривают в вакууме. Полученное твердое вещество оставляют на ночь при перемешивании в эфире, фильтруют и сушат, получают 0,5 г продукта с выходом 78%. Т. пл. 195-197°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 45/55 CH3CN/0,1% H3PO4, 4,25 (98,51%). 1H ЯМР (ДМСО-d6) δ 0,85 (т, J=6,6 Гц, 3H), 1,24-1,30 (м, 6H), 1,32-1,38 (м, 2H), 1,89 (с, 3H), 2,02-2,08 (м, 1Н), 2,53-2,60 (м, 2H), 2,63-2,76 (м, 1Н), 2,99 (дд, J=12,9 Гц, J=6,6 Гц, 2H), 4,34 (д, J=6,0 Гц, 2H), 6,06 (т, J=5,7 Гц, 1Н), 6,50 (т, J=6,3 Гц, 1Н), 7,68-7,80 (м, 3H), 11,02 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 13,9, 21,0, 22,0, 26,0, 28,6, 29,1, 29,9, 31,0, 39,3, 42,7, 58,7, 121,2, 123,0, 129,3, 131,3, 133,0, 149,4, 158,0, 167,8, 167,9, 172,1, 172,2. Анализ: Вычислено для C22H28N4O5+0,10H2O: C, 61,41; H, 6,61; N, 13,02. Найдено: C, 61,16; H, 6,66; N, 12,70.
5.76 1-(3-Хлор-4-метил-фенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1,3-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
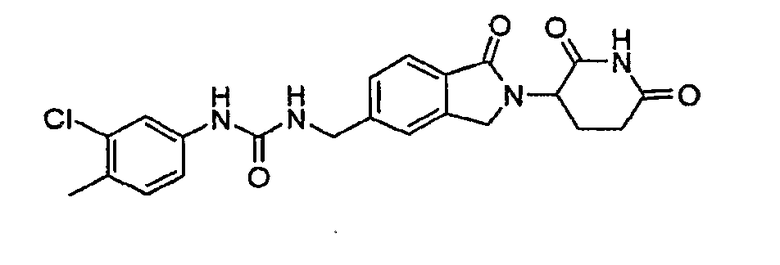
Стадия 1: Механически перемешиваемую смесь 4-бром-2-метилбензойной кислоты (100 г, 465 ммоль), йодметана (95 г, 670 ммоль) и бикарбоната натрия (112 г, 1340 ммоль) в ДМФА (325 мл) оствляют на ночь при нагревании до 80°С. Реакционную смесь охлаждают до комнатной температуры и распределяют между водой (1500 мл) и смесью гексаны:этилацетат 4:1 (1500 мл). Органический слой промывают водой и сушат (Na2SO4). Растворитель удаляют в вакууме, получают 110 г метилового эфира 4-бром-2-метилбензойной кислоты в виде масла с выходом 100%. 1H ЯМР (ДМСО-d6) δ 2,51 (с, 3H), 3,84 (с, 3H), 7,40-7,78 (м, 3H).
Стадия 2: Механически перемешиваемую смесь метилового эфира 4-бром-2-метилбензойной кислоты (115 г, 500 ммоль), N-бромсукцинимида (90 г, 500 ммоль) и AIBN (3,1 г) в ацетонитриле (700 мл) нагревают в течение 45 минут при слабом кипении и выдерживают при кипении с обратным холодильником 21 час. Реакционную смесь охлаждают до комнатной температуры, разбавляют насыщенным водным раствором бисульфита натрия и концентрируют в вакууме. Остаток распределяют между водой и смесью гексаны:этилацетат 1:1. Органическую фазу промывают водой, насыщенным раствором соли и фильтруют через подушку силикагеля. Растворитель удаляют в вакууме, получая смесь масло/твердое вещество, которую растворяют в эфире и фильтруют. Фильтрат хроматографируют на силикагеле, используя градиент гексаны:этилацетат, элюируя продукт при соотношении гексаны:этилацетат 4:1, и получают 102 г метилового эфира 4-бром-2-бромметил-бензойной кислоты с выходом 66%. 1H ЯМР (ДМСО-d6) δ 3,87 (с, 3H), 4,99 (с, 2H), 7,67-7,97 (м, 3H).
Стадия 3: Механически перемешиваемую смесь метилового эфира 4-бром-2-бромметил-бензойной кислоты (121 г, 390 ммоль) и гидрохлорида 3-амино-пиперидин-2,6-диона (64,2 г, 390 ммоль) в ДМФА (400 мл) по каплям обрабатывают триэтиламином (98,5 г, 980 ммоль) в течение 75 минут. По завершении добавления реакционную смесь оставляют на ночь при перемешивании при комнатной температуре. Смесь последовательно гасят уксусной кислотой (50 мл), водой (2500 мл) и смесью этилацетат:гексаны 1:1 (600 мл). После перемешивания смеси в течение 20 минут твердое вещество фильтруют, промывают водой и оставляют на ночь для сушки на воздухе. Твердое вощество перемешивают в уксусной кислоте (200 мл) и кипятят с обратным холодильником 2 часа. Смесь охлаждают до комнатной температуры и фильтруют. Твердое вещество дополнительно промывают уксусной кислотой, гексанами и оставляют на ночь для сушки на воздухе, получают 25,3 г 3-(5-бром-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона в виде серого твердого вещества с выходом 20%. 1H ЯМР (ДМСО-d6) δ 1,97-2,04 (м, 1Н), 2,32-2,46 (м, 1Н), 2,56-2,63 (м, 1Н), 2,85-2,97 (м, 1Н), 4,34 (д, J=17,7 Гц, 1Н), 4,47 (д, J=17,7 Гц, 1Н), 5,11 (дд, J=13,2 Гц, J=5,1 Гц, 1Н), 7,67 (д, J=8,1 Гц, 1Н), 7,72 (дд, J=8,1 Гц, J=1,5 Гц, 1Н), 7,89 (д, J=0,9 Гц, 1Н), 11,00 (с, 1Н).
Стадия 4: Механически перемешиваемую смесь 3-(5-бром-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона (25,2 г, 78 ммоль), бис(дифенилфосфино)ферроцена (2,0 г), трис(дибензилиденацетон)дипалладия (2,0 г) и цианида цинка (9,4 г, 80 ммоль) в ДМФА (300 мл) нагревают до 120°С и перемешивают при этой температуре 19 часов. Реакционную смесь охлаждают до 40°С и добавляют дополнительные 9,4 г цианида цинка, 2 г бис(дифенилфосфино)ферроцена и 2 г трис(дибензилиденацетон)дипалладия. Смесь перемешивают при 120°С 2 часа, охлаждают до комнатной температуры и гасят водой (900 мл). Твердую фазу фильтруют, дополнительно промывают водой и оставляют на ночь для сушки на воздухе. Твердое вещество перемешивают с горячей уксусной кислотой (200 мл) 20 минут. Твердое вещество фильтруют, дополнительно промывают уксусной кислотой, этилацетатом и гексанами и сушат на воздухе, получая 30,8 г неочищенного 2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-карбонитрила в виде серого твердого вещества. 1H ЯМР (ДМСО-d6) δ 1,99-2,06 (м, 1Н), 2,35-2,45 (м, 1Н), 2,57-2,63 (м, 1Н), 2,86-2,98 (м, 1Н), 4,42 (д, J=17,7 Гц, 1Н), 4,55 (д, J=17,7 Гц, 1Н), 5,15 (дд, J=13,2 Гц, J=5,1 Гц, 1Н), 7,91 (д, J=7,8 Гц, 1Н), 7,99 (дд, J=7,8 Гц, J=0,9 Гц, 1Н), 8,16 (с, 1Н), 11,03 (с, 1Н).
Стадия 5: Смесь 2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-карбонитрила (9,2 г, 34 ммоль), 10% Pd-C (1,7 г) и концентрированной HCl (5,3 г) в N-метилпирролидоне (300 мл) оставляют на ночь для гидрирования при 58 фунт/кв.дюйм. Неочищенную реакционную смесь фильтруют через целит, и катализатор промывают водой. Объединенные фильтраты концентрируют в вакууме, и продукт - гидрохлорид 3-(5-аминометил-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона - выделяют фракционной кристаллизацией остатка из смеси изопропанол-вода (1,9 г, 18%). 1H ЯМР (ДМСО-d6) δ 1,85-2,20 (м, 1Н), 2,35-2,45 (м, 1Н), 2,58-2,80 (м, 1Н), 2,87-2,99 (м, 1Н), 4,16 (с, 2H), 4,35 (д, J=17,5 Гц, 1Н), 4,49 (д, J=17,5 Гц, 1Н), 5,13 (дд, J=13,2 Гц, J=4,8 Гц, 1H), 7,63 (д, J=7,8 Гц, 1Н), 7,72 (с, 1Н), 7,79 (д, J=7,8 Гц, 1Н), 8,43 (ушир, 3H), 11,01 (с, 1Н).
Стадия 6: Смесь гидрохлорида 3-(5-аминометил-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона (0,50 г, 1,6 ммоль), 3-хлор-4-метилфенилизоцианата (0,27 г, 1,6 ммоль) и ТЕА (0,32 г, 3,2 ммоль) в ТГФ (25 мл) нагревают до 40°С при перемешивании в атмосфере N2. Спустя 3 часа добавляют дополнительную порцию 3-хлор-4-метилизоцианата (0,17 г, 1,1 ммоль) и продолжают перемешивание 2 часа. Смесь фильтруют и фильтр промывают этилацетатом. Твердое вещество растирают с 10 мл смеси ацетон-ДМФА 1:1 и фильтруют. Фильтр промывают ацетоном и твердое вещество сушат в вакууме, получая 430 мг продукта с выходом 60%. Т. пл. 258-260°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 4,49 (98,75%). 1H ЯМР (ДМСО-d6) δ 1,90-1,96 (м, 1Н), 2,16 (с, 3H), 2,25-2,39 (м, 1Н), 2,50-2,55 (м, 1Н), 2,78-2,91 (м, 1Н), 4,24 (д, J=18,0 Гц, 1Н), 4,33-4,41 (м, 3H), 5,04 (дд, J=13,5 Гц, J=4,5 Гц, 1Н), 6,73 (т, J=6,0 Гц, 1Н), 7,04-7,13 (м, 2H), 7,36-7,44 (м, 2H), 7,59-7,44 (м, 2H), 8,69 (с, 1Н), 10,92 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 18,7, 22,5, 31,2, 42,8, 47,1, 51,5, 116,4, 117,6, 121,9, 122,9, 126,9, 127,4, 130,3, 131,0, 133,0, 139,6, 142,4, 144,7, 155,1, 167,9, 171,0, 172,9. Анализ: Вычислено для C22H21ClN4O4: C, 59,93; H, 4,80; N, 12,71. Найдено: C, 59,77; H, 4,61; N, 12,69.
5.77 1-(4-Хлор-фенил)-3-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-мочевина
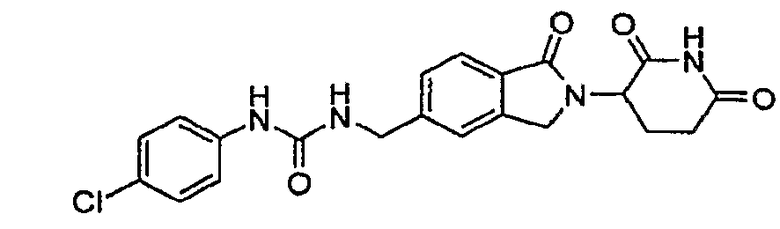
Смесь гидрохлорида 3-(5-аминометил-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона (0,50 г, 1,6 ммоль), 4-хлорфенилизоцианата (0,25 г, 1,6 ммоль) и ТЕА (0,32 г, 3,2 ммоль) в ТГФ (25 мл) нагревают до 40°С при перемешивании в атмосфере N2. Спустя 3 часа добавляют дополнительную порцию 4-хлорфенилизоцианата (0,17 г, 1,1 ммоль) и продолжают перемешивание 2 часа. Смесь фильтруют и фильтр промывают этилацетатом. Твердое вещество очищают препаративной ВЭЖХ, используя изократическое элюирование смесью ацетонитрил-вода 35:65, получая 0,22 г продукта с выходом 32%. Т. пл. 270-272°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 3,28 (95,95%). 1H ЯМР (ДМСО-d6) δ 1,96- 2,03 (м, 1Н), 2,35-2,41 (м, 1Н), 2,57-2,62 (м, 1Н), 2,85-2,96 (м, 1Н), 4,31 (д, J=15,0 Гц, 1Н), 4,41-4,48 (м, 3H), 5,11 (дд, J=13,5 Гц, J=4,5 Гц, 1Н), 6,81 (т, J=6,0 Гц, 1Н), 7,24-7,52 (м, 6H), 7,70 (д, J=9,0 Гц, 1Н), 8,81 (с, 1Н), 10,99 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 22,5, 31,2, 42,8, 47,1, 51,5, 119,2, 121,9, 122,9, 124,6, 126,9, 128,4, 130,3, 139,4, 142,4, 144,7, 155,1, 167,9, 171,0, 172,9. Анализ: Вычислено для C21H19ClN4O4+0,2H2O: C, 58,60; H, 4,54; N, 13,02. Найдено: C, 58,50; H, 4,15; N, 12,69.
5.78 1-[2-(2,6-диоксо-пиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-гексил-мочевина
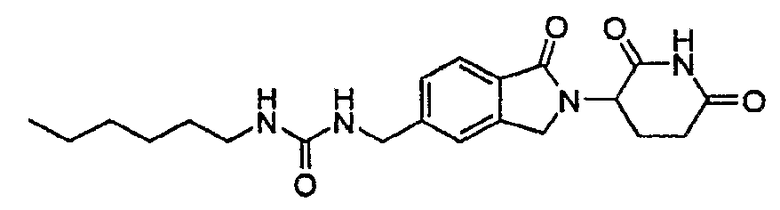
Смесь гидрохлорида 3-(5-аминометил-1-оксо-1,3-дигидро-изоиндол-2-ил)-пиперидин-2,6-диона (0,50 г, 1,6 ммоль), гексилизоцианата (0,20 г, 1,6 ммоль) и ТЕА (0,32 г, 3,2 ммоль) в ТГФ (25 мл) нагревают до 40°С при перемешивании в атмосфере N2. Спустя 3 часа добавляют дополнительную порцию гексилизоцианата (0,20 г, 1,6 ммоль) и продолжают перемешивание 20 часов. Смесь фильтруют и фильтр промывают этилацетатом и сушат в вакууме, получая 0,60 г продукта с выходом 92%. Т. пл. 234-236°С. ВЭЖХ, Waters Symmetry C-18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, 35/65 CH3CN/0,1% H3PO4, 3,57 (96,04%). 1H ЯМР (ДМСО-d6) δ 0,86 (т, J=7,5 Гц, 3H), 1,25-1,38 (м, 8H), 1,99-2,02 (м, 1Н), 2,37-2,41 (м, 1Н), 2,56-2,62 (м, 1Н), 2,87-3,03 (м, 3H), 4,26-4,32 (м, 3H), 4,43 (д, J=18,0 Гц, 1Н), 5,10 (дд, J=13,5 Гц, J=4,5 Гц, 1Н), 5,96 (т, J=6,0 Гц, 1Н), 6,39 (т, J=6,0 Гц, 1Н), 7,38 (д, J=7,5, 1Н), 7,44 (с, 1Н), 7,66 (д, J=6,0 Гц, 1Н), 10,98 (с, 1Н); 13С ЯМР (ДМСО-d6) δ 13,9, 22,1, 22,5, 26,0, 29,9, 31,0, 31,1, 39,3, 42,9, 47,0, 51,5, 121,7, 122,8, 126,8, 130,1, 142,3, 145,6, 158,0, 168,0, 171,0, 172,9. Анализ: Вычислено для C21H28N4O4+0,1H2O: C, 62,70; H, 7,07; N, 13,93. Найдено: C, 62,66; H, 6,89; N, 13,87.
5.79 (3'S)-3-(3'-Метоксифенил)-1-метил-1-[2-(3-метил-2',6'-диоксо-пиперидин-3'-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил]-мочевина
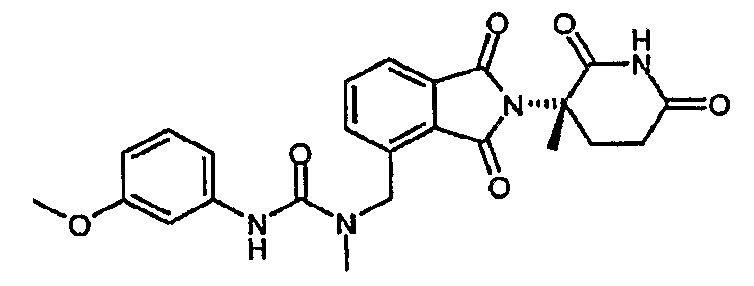
5.79.1 Гидрохлорид (3'S)-4-метиламинометил-2-(3'-метил-2',6'-диоксо-пиперидин-3'-ил)-изоиндол-1,3-диона
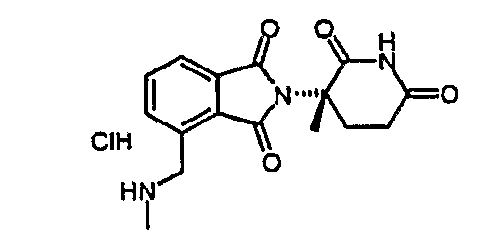
Стадия 1: Раствор гидроксида калия (1,3 г, 23,1 ммоль) в воде (5 мл) добавляют к перемешиваемому раствору диметилового эфира 3-[(трет-бутоксикарбонил-метил-амино)-метил]фталевой кислоты (2,6 г, 7,7 ммоль) в метаноле (35 мл). Полученный раствор оставляют на ночь при перемешивании при комнатной температуре. Смесь концентрируют и добавляют воду (30 мл). Полученную смесь промывают эфиром (30 мл). Водный слой подкисляют 4н HCl до рН 2. Смесь экстрагируют CH2Cl2 (3×40 мл) и сушат. Растворитель удаляют, получают смесь 3-[(трет-бутоксикарбонил-метил-амино)-метил]фталевой кислоты и ее монометилового сложного эфира, которую используют на следующей стадии без дальнейшей очистки.
Стадия 2: Смесь 3-[(трет-бутоксикарбонил-метил-амино)-метил]фталевой кислоты (2,5 г, 7,71 ммоль) и моногидрата гидробромида (3S)-3-амино-3-метилпиперидин-2,6-диона (2,0 г, 8,48 ммоль) в пиридине (40 мл) оставляют на ночь при кипении с обратным холодильником. Смесь охлаждают и концентрируют. Остаток растворяют в EtOAc (100 мл) и воде (50 мл). Раствор в EtOAc промывают водой (50 мл), 1н лимонной кислотой (50 мл), водой (50 мл), насыщ. NaHCO3 (50 мл), водой (50 мл) и насыщенным раствором соли (50 мл) и сушат (MgSO4). Растворитель удаляют и остаток очищают хроматографией (SiO2, CH2Cl2:EtOAc 9:1), получают трет-бутиловый эфир (3'S)-метил-[2-(3'-метил-2',6'-диоксо-пиперидин-3'-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил]карбаминовой кислоты (0,99 г, 31%).
Стадия 3: 2н HCl/эфир (3 мл) добавляют к перемешиваемому раствору трет-бутилового эфира (3'S)-метил-[2-(3'-метил-2',6'-диоксо-пиперидин-3'-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил]карбаминовой кислоты (0,99 г, 2,4 ммоль) в метиленхлориде (20 мл). Смесь оставляют на ночь при перемешивании при комнатной температуре. Добавляют эфир (20 мл) и смесь фильтруют и сушат, получают гидрохлорид (3'S)-4-метиламинометил-2-(3'-метил-2',6'-диоксо-пиперидин-3'-ил)-изоиндол-1,3-диона (0,73 г, 87%). 1H ЯМР (ДМСО-d6) δ l1,04 (с, 1Н), 9,56 (с, 2H), 8,05-7,88 (м, 3H), 4,56-4,45 (м, 2H), 2,73-2,53 (м, 6H), 2,10-2,04 (м, 1Н), 2,02 (с, 3H); 13С ЯМР (ДМСО-d6) δ 172,15, 171,96, 168,08, 167,31, 136,48, 134,68, 131,26, 130,23, 129,05, 123,59, 58,84, 54,88, 45,73, 32,42, 29,09, 28,55, 21,04.
5.79.2 (3'S)-3-(3-Метоксифенил)-1-метил-1-[2-(3'-метил-2',6'-диоксо-пиперидин-3'-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил]-мочевина
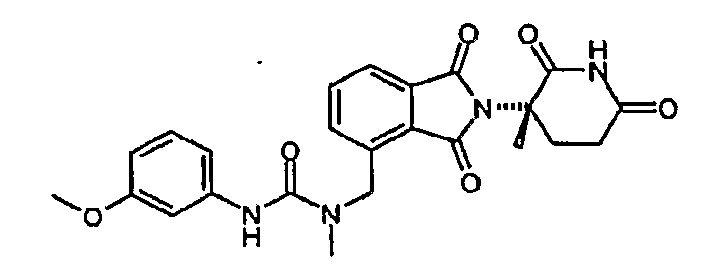
К перемешиваемой суспензии гидрохлорида (3'S)-4-(метиламинометил-2-(3'-метил-2',6'-диоксо-пиперидин-3'-ил)-изоиндол-1,3-диона и триэтиламина (0,3 г, 3,0 ммоль) в ТГФ (30 мл) добавляют 3-метоксифенилизоцианат (0,4 г, 2,6 ммоль). Полученную смесь перемешивают при комнатной температуре 2 часа. Реакционную смесь концентрируют и остаток растворяют в метиленхлориде (70 мл), промывают 1н HCl (30 мл), водой (2×30 мл) и насыщенным раствором соли (30 мл) и сушат (MgSO4). Растворитель удаляют и остаток очищают хроматографией (SiO2, CH2Cl2:EtOAc 9:1), получают (3'S)-3-(3-метоксифенил)-1-метил-1-[2-(3'-метил-2',6'-диоксо-пиперидин-3'-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил]-мочевину (0,7 г, 74%). Т. пл. 166-168ºС. 1H ЯМР (ДМСО-d6) δ 11,03 (с, 1Н), 8,46 (с, 1Н), 7,83 (т, J=7,5 Гц, 1Н), 7,75 (д, J=6,6 Гц, 1Н), 7,58 (д, J=7,3 Гц, 1Н), 7,19-7,07 (м, 3H), 6,55-6,51 (м, 1Н), 4,98 (с, 2H), 3,70 (с, 3H), 3,03 (с, 3H), 2,72-2,51 (м, 3H), 2,10-2,04 (м, 1Н), 1,91 (с, 3H); 13С ЯМР (ДМСО-d6) δ 172,46, 172,44, 168,70, 167,99, 159,59, 155,88, 141,87, 138,74, 135,11, 132,51, 131,98, 129,20, 127,57, 121,78, 112,38, 107,68, 105,78, 59,01, 55,15, 47,67, 35,39, 29,38, 28,86, 21,31. Анализ: Вычислено для C24H24N4O6: C, 62,06; H, 5,21; N, 12,06. Найдено: C, 62,15; H, 5,32; N, 11,71.
5.80 Исследования
5.80.1 Исследование ингибирования TNFα в РМВС
Моноядерные клетки периферической крови (РМВС) от нормальных доноров получены центрифугированием по плотности Ficoll Hypaque (Pharmacia, Piscataway, NJ, USA). Клетки культивируют в RPMI 1640 (Life Technologies, Grand Island, NY, USA), дополненном 10% АВ+человеческая сыворотка (Gemini Bio-products, Woodland, CA, USA), 2 мМ L-глутамина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (Life Technologies).
РМВС (2×105 клеток) трехкратно высевают в плоскодонные 96-луночные планшеты для клеточных культур Costar (Corning, NY, USA). Клетки стимулируют LPS (из Salmonella abortus equi, Sigma кат № L-1887, St. Louis, MO, USA) при конечной концентрации 1 нг/мл в отсутствие или в присутствии соединений. Соединения по изобретению растворяют в ДМСО (Sigma), и последующие разбавления производят в культуральной среде непосредственно перед применением. Конечная концентрация ДМСО во всех исследованиях должна составлять около 0,25%. Соединения добавляют к клеткам за 1 час до стимуляции LPS. Клетки затем инкубируют 18-20 часов при 37°С в 5% СО2 и затем собирают надосадочную жидкость, разбавляют культуральной средой и исследуют на уровни TNFα методом ELISA (Endogen, Boston, MA, USA). Вычисляют IC50, используя нелинейную регрессию, сигмоидальную функцию доза-ответ, ограничивая верх 100% и низ 0%, допуская варьирование наклона (GraphPad Prism v3.02).
5.80.2 Продуцирование IL-2 и MIP-3α Т-клетками
РМВС освобождают от прочно связанных моноцитов, помещая 1×108 РМВС в 10 мл полной среды (RPMI 1640, дополненной 10% фетальной бычьей сыворотки, прошедшей тепловую инактивацию, 2 мМ L-глутамина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина) на 10 см чашки тканевой культуры, в инкубатор при 37°С, 5% СО2 на 30-60 минут. Чашку промывают средой для удаления всех несвязанных РМВС. Т-клетки очищают отрицательным отбором, используя следующую смесь антител (Pharmingen) и Dynabead (Dynal) для каждых 1×108 несвязанных РМВС: 0,3 мл бусин IgG овцы против мыши, 0,15 мкл бусин анти-CD16, 0,15 мкл анти-CD33, 0,15 мкл анти-CD56, 0,23 мкл анти-CD19, 0,23 мкл бусин анти-HLA класс II и 56 мкл бусин анти-CD14. Смесь клеток и бусин/антител перемешивают переворачиванием 30-60 минут при 4°С. Очищенные Т-клетки отделяют от бусин, используя магнит Dynal. Обычный выход составляет 50% Т-клеток, 87-95% CD3+ по цитометрии в потоке.
Плоскодонные 96-луночные планшеты для тканевых культур покрывают антителом анти-CD3 ОКТ3 при 5 мкг/мл в PBS, 100 мкл на лунку, инкубируют при 37°С 3-6 часов и четырежды промывают полной средой 100 мкл/лунку непосредственно перед добавлением Т-клеток. Соединения разбавляют до 20 раз конечной концентрации в круглодонном 96-луночном планшете для тканевых культур. Конечные концентрации составляют от около 10 мкМ до около 0,00064 мкМ. Концентрат 10 мМ соединений по изобретению разбавляют 1:50 для первого 20х разбавления до 200 мкМ в 2% ДМСО и последовательно разбавляют 1:5 в 2% ДМСО. Соединение добавляют при 10 мкл на 200 мкл культуры, что дает конечную концентрацию ДМСО 0,1%. Культуры инкубируют при 37°С, 5% СО2 в течение 2-3 дней, и надосадочные жидкости анализируют на IL-2 и MIP-3α методом ELISA (R&D Systems). Уровни IL-2 и MIP-3α нормируют к количеству, продуцируемому в присутствии количества соединения по изобретению, и вычисляют ЕС50, используя нелинейную регрессию, сигмоидальную функцию доза-ответ, ограничивая верх 100% и низ 0%, допуская варьирование наклона (GraphPad Prism v3.02).
5.80.3 Исследование клеточной пролиферации
Клеточные линии Namalwa, MUTZ-5 и UT-7 получены от Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (Braunschweig, Germany). Клеточная линия KG-1 получена от American Type Culture Collection (Manassas, VA, USA). Клеточную пролиферацию по показаниям включения 3Н-тимидина измеряли во всех клеточных линиях следующим образом.
Клетки помещали в 96-луночные планшеты при 6000 клетках на лунку в среде. Клетки предварительно обрабатывали соединениями приблизительно при 100, 10, 1, 0,1, 0,01, 0,001, 0,0001 и 0 мкМ в конечной концентрации ДМСО приблизительно 0,25% в трех сериях 72 часа при 37°С в увлажненном инкубаторе при 5% СО2. Один микрокюри 3Н-тимидина (Amersham) добавляли затем в каждую лунку, и клетки вновь инкубировали 6 часов при 37°С в увлажненном инкубаторе при 5% СО2. Все клетки собирали в фильтровальные планшеты UniFilter GF/C (Perkin Elmer), используя сборщик клеток (Tomtec), и затем клетки оставляли на ночь, давая высохнуть. Добавляли Microscint 20 (Packard) (25 мкл/лунка), и планшеты анализировали на TopCount NXT (Packard). Каждую лунку подсчитывали одну минуту. Процент ингибирования клеточной пролиферации вычисляли усреднением всех трех серий и нормированием на контроль ДМСО (0% ингибирования). Каждое соединение тестировали на каждой клеточной линии в трех раздельных экспериментах. Конечные IC50 вычисляли, используя нелинейную регрессию, сигмоидальную функцию доза-ответ, ограничивая верх 100% и низ 0%, допуская варьирование наклона (GraphPad Prism v3.02).
5.80.4 Иммуноосаждение и иммуноблоттинг
Клетки Namalwa 1 час обрабатывали ДМСО или количеством соединения по изобретению, затем 30 минут стимулировали 10 ед/мл Еро (R&D Systems). Готовили клеточные лизаты и либо иммуноосаждали Еро рецептором Ab, либо немедленно отделяли SDS-PAGE. Иммуноблоты зондировали Akt, фосфо-Akt (Ser473 или Thr308), фосфо-Gab1 (Y627), Gab1, IRS3, актином и IRF-1 Abs и анализировали на Storm 860 Imager, используя программное обеспечение ImageQuant (Molecular Dynamics).
5.80.5 Анализ клеточного цикла
Клетки оставляли на ночь для обработки ДМСО или количеством соединения по изобретению. Выполняли окрашивание йодидом пропидия для клеточного цикла, используя CycleTEST PLUS (Becton Dickinson) согласно протоколу производителя. После окрашивания клетки анализировали на проточном цитометре FACSCalibur, используя программное обеспечение ModiFit LT (Becton Dickinson).
5.80.6 Анализ апоптоза
Клетки обрабатывали ДМСО или количеством соединения по изобретению в различные моменты времени, затем промывали промывочным буфером аннексин-В (BD Biosciences). Клетки 10 минут инкубировали с протеином, связывающим аннексин-В, и йодидом пропидия (BD Biosciences). Образцы анализировали, используя проточную цитометрию.
5.80.7 Исследование с люциферазой
Клетки Namalwa трансфицировали 4 мкг АР-1-люциферазой (Stratagene) на 1×106 клеток и 3 мкл реагента липофектамина (Invitrogen) согласно инструкциям производителя. Спустя шесть часов после трансфекции клетки обрабатывали ДМСО или количеством соединения по изобретению. Активность люциферазы исследовали, используя буфер для лизиса люциферазы и субстрат (Promega) и измеряли, используя люминометр (Turner Designs).
5.81 Антипролиферативная активность
В одном эксперименте антипролиферативный эффект некоторых соединений, предложенных в описании, тестируют, используя клетки Namalwa, HN 5q, HT-1080, SK-MES-1 и РС-3, в соответствии с исследованием пролиферации, которое по существу аналогично описанному выше в 5.80.3. Тестированные соединения показывают значения IC50 в диапазоне: от 0,5 до 200 мкМ для клеток Namalwa, от 0,0001 до 10 мкМ для клеток HN 5q, от 0,01 до 20 мкМ для клеток HT-1080, от 0,001 до 30 мкМ для клеток SK-MES-1 и от 0,005 до 10 мкМ для клеток РС-3. Данные результаты показывают, что соединения, предложенные в описании, проявляют антипролиферативный эффект на различных раковых клетках.
В другом эксперименте две клеточные линии глиобластомы человека, T98G (мультиформная глиобластома, мутант р53) и U87MG (глиобластома-астроцитома мозга вид III, дикий тип р53), и две клеточные линии нейробластомы человека, SH-SY5Y (полученная из метастатического сайта костного мозга; трисомия хромосомы 1q; усиленная MYCN) и SK-N-MC (полученная из метастатического сайта надорбитальной области; псевдодиплоид с числом модальных хромосом 46; вызывает опухоль у голых мышей) были получены из АТСС. Данные клеточные линии были выращены, концентраты нижнего уровня были заморожены в жидком азоте. Соединения были растворены в ДМСО с получением 10 мМ концентратов. Клетки поместили в 96-луночные планшеты по 5×103 клеток/100 мкл среды на лунку. Клетки оставили на ночь для достижения слипания при 37°С в инкубаторе с 94% влажностью и 5% СО2. После инкубирования в течение ночи клетки обработали в трех сериях 100, 10, 0,1, 0,01, 0,001, 0,0001 и 0 мкМ перспективных соединений при конечной концентрации ДМСО 0,1% в течение периода обработки 72 часа. Клеточную пролиферацию определяли исследованием клеточной пролиферации с 3Н-тимидином. IC50 вычислены из трансформированных данных, используя нелинейную регрессию, сигмоидальную функцию доза-ответ, с применением GraphPad Prism v4.0.
Тестированные соединения показывают значения IC50 в диапазоне: от 0,1 мкМ до примерно 1 мМ для клеток T98G, от 0,05 до примерно 150 мкМ для клеток U87MG, от 0,0001 до 0,5 мкМ для клеток SH-SY5Y и от 0,0001 до примерно 0,1 мкМ для клеток SK-N-MC. Данные результаты показывают, что соединения, предложенные в описании, проявляют антипролиферативную активность против различных раковых клеток.
Воплощения изобретения, описанные выше, предназначены быть только примерами, и специалист в данной области должен знать многочисленные эквиваленты конкретных соединений, материалов и методов либо должен быть способен прийти к ним путем исключительно рутинного экспериментирования. Все такие эквиваленты рассматриваются как входящие в объем изобретения и охватываются прилагаемой формулой изобретения.
Все патенты, патентные заявки и публикации, ссылки на которые содержит данное описание, включены в него во всей их полноте. Цитирование или определение любой ссылки в данной заявке не является допущением, что такая ссылка доступна как предшествующий уровень техники данного изобретения. Полный объем изобретения более понятен со ссылкой на прилагаемую формулу изобретения.
Изобретение описывает соединение формулы (I):
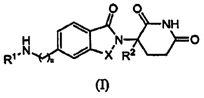
или его фармацевтически приемлемая соль, или стереоизомер, в котором: n равно 0 или 1; X представляет CH2, C=O; R1 представляет: a) -(CH2)mR3 или -CO(CH2)mR3, где m равно 0, 1; и R3 представляет 5-10-членный арил или гетероарил, где гетероарил означает моно- или бициклическое ароматическое кольцо, содержащее от 5 до 10 кольцевых атомов, из которых, по меньшей мере, один или два атома представляют собой гетероатом, выбранный из кислорода, азота или серы, необязательно замещенный одним или несколькими галогенами; b) -C=YR4, где Y представляет O; и R4 представляет: (C1-C10)алкил; (C1-C10)алкокси; (C0-C10)алкил-(5-10-членный гетероарил), где «гетероарил» означает моно- или бициклическое ароматическое кольцо, содержащее от 5 до 10 кольцевых атомов, из которых, по меньшей мере, один или два атома представляют собой гетероатом, выбранный из кислорода, азота или серы, указанный гетероарил необязательно замещен одним или несколькими заместителями из галогена, оксо или Z-(C1-C6)алкила, где Z представляет собой S; (C0-C10)алкил-(5-10-членный арил), указанный арил необязательно замещен одним или несколькими заместителями из галогена; (C1-C6)алкокси, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкила, который сам необязательно замещен одним или несколькими галогенами; или -Z-(C1-C6)алкила, где Z представляет S или SO2 и где указанный (C1-C6)алкил может быть необязательно замещен одним или несколькими галогенами; или (C1-C6)алкил-CO-O-R12, где R12 представляет H или (C1-C6)алкил; или c) -C=ZNHR6, где Z представляет O или S; и R6 представляет: (C1-C10)алкил; (C1-C10)алкокси; 5-10-членный арил или гетероарил, где «гетероарил» означает бициклическое ароматическое кольцо, содержащее 9 кольцевых атомов, из которых, по меньшей мере, один или два атома представляют собой кислород; необязательно замещеный одним или несколькими заместителями из галогена; циано; (C1-C6)алкокси, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкила, который сам необязательно замещен одним или несколькими галогенами; и R2 представляет H или (C1-C6)алкил. Также описывается фармацевтическая композиция для ингибирования TNFα, на основе соединения формулы I. Технический результат: получены и описаны новые соединения, которые могут регулировать продуцирование некоторых цитокинов, включая TNF-α. 5 н. и 22 з.п, 81 прим., 1 табл.
1. Соединение формулы (I)
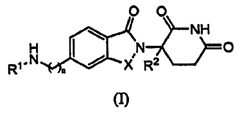
или его фармацевтически приемлемая соль, или стереоизомер, в котором:
n равно 0 или 1;
X представляет CH2, C=O;
R1 представляет:
а) -(CH2)mR3 или -CO(CH2)mR3, где
m равно 0, 1; и
R3 представляет 5-10-членный арил или гетероарил, где гетероарил означает моно- или бициклическое ароматическое кольцо, содержащее от 5 до 10 кольцевых атомов, из которых, по меньшей мере, один или два атома представляют собой гетероатом, выбранный из кислорода, азота или серы, необязательно замещенный одним или несколькими галогенами; b) -С=YR4, где
Y представляет O; и
R4 представляет:
(C1-C10)алкил; (C1-C10)алкокси;
(C0-C10)алкил-(5-10-членный гетероарил), где гетероарил означает моно- или бициклическое ароматическое кольцо, содержащее от 5 до 10 кольцевых атомов, из которых, по меньшей мере, один или два атома представляют собой гетероатом, выбранный из кислорода, азота или серы, указанный гетероарил необязательно замещен одним или несколькими заместителями из галогена, оксо или Z-(C1-C6)алкила, где Z представляет собой S;
(C0-C10)алкил-(5-10-членный арил), указанный арил необязательно замещен одним или несколькими заместителями из галогена; (C1-C6)алкокси, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкила, который сам необязательно замещен одним или несколькими галогенами; или -Z-(C1-C6)алкила, где Z представляет S или SO2, и где указанный (C1-C6)алкил может быть необязательно замещен одним или несколькими галогенами; или
(C1-C6)алкил-CO-O-R12, где R12 представляет H или (C1-C6)алкил; или
с) -С=ZNHR6, где
Z представляет O или S; и
R6 представляет:
(C1-C10)алкил; (C1-C10)алкокси;
5-10-членный арил или гетероарил, где гетероарил означает бициклическое ароматическое кольцо, содержащее 9 кольцевых атомов, из которых, по меньшей мере, один или два атома представляют собой кислород; необязательно замещеный одним или несколькими заместителями из галогена; циано; (C1-C6)алкокси, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкила, который сам необязательно замещен одним или несколькими галогенами; и
R2 представляет H или (C1-C6)алкил.
2. Соединение формулы (II)
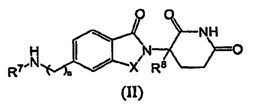
или его фармацевтически приемлемая соль, или стереоизомер, в котором: n равно 0 или 1;
X представляет CH2 или C=O;
R7 представляет -(CH2)mR9, где m равно 0, 1; и R9 представляет 5-10-членный арил или гетероарил, где гетероарил означает моно- или бициклическое ароматическое кольцо, содержащее от 5 до 10 кольцевых атомов, из которых, по меньшей мере, одно или два атома представляют собой гетероатом, выбранный из кислорода, азота или серы; необязательно замещенный одним или несколькими галогенами; и
R8 представляет H или (C1-C6)алкил.
3. Соединение по п.2, в котором X представляет C=O.
4. Соединение по п.2, в котором X представляет CH2.
5. Соединение по п.2, в котором R9 представляет фенил, необязательно замещенный одним или несколькими галогенами.
6. Соединение по п.2, в котором R9 представляет фурил или бензофурил.
7. Соединение по п.2, в котором соединение представляет
 ,
, 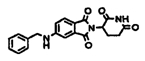 ,
, 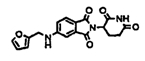 ,
,
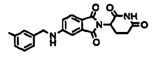 или
или 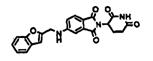 .
.
8. Соединение формулы (III)
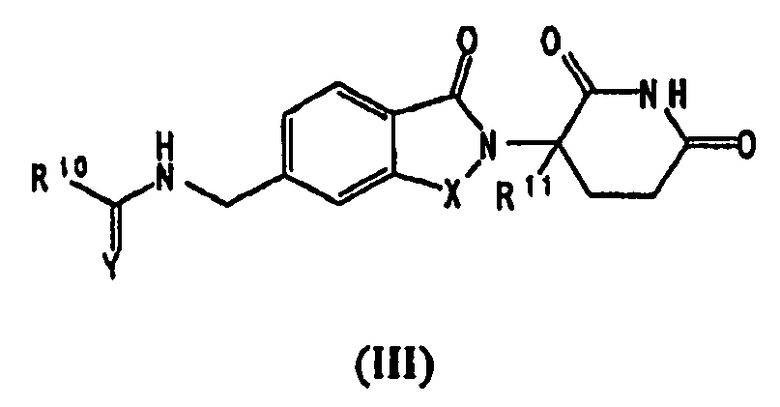
или его фармацевтически приемлемая соль, или стереоизомер, в котором:
X представляет CH2 или C=O;
Y представляет O;
R10 представляет:
(C1-C10)алкил; (C1-C10)алкокси;
(C0-C10)алкил-(5-10-членный гетероарил), указанный гетероарил означает моно- или бициклическое ароматическое кольцо, содержащее от 5 до 10 кольцевых атомов, из которых, по меньшей мере, один или два атома представляют собой гетероатом, выбранный из кислорода, азота или серы; указанный гетероарил необязательно замещен одним или несколькими заместителями из галогена, оксо или -Z-(C1-C6)алкила, где Z представляет S;
(C0-C10)алкил-(5-10-членный арил), указанный арил необязательно замещен одним или несколькими заместителями из галогена; (C1-C6)алкокси, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкила, который сам необязательно замещен одним или несколькими галогенами; или -Z-(C1-C6)алкила, где Z представляет S или SO2, и где указанный (C1-C6)алкил может быть необязательно замещен одним или несколькими галогенами; или
(C1-C6)алкил-CO-O-R12, где R12 представляет H или (C1-C6)алкил; и
R11 представляет H или (C1-C6)алкил.
9. Соединение по п.8, в котором X представляет C=O.
10. Соединение по п.8, в котором X представляет CH2.
11. Соединение по п.8, в котором R10 представляет пентил или гексил.
12. Соединение по п.8, в котором R10 представляет пентилокси или гексилокси.
13. Соединение по п.8, в котором R10 представляет тиофенил или фурил.
14. Соединение по п.8, в котором R10 представляет фенил или метил-фенил, необязательно замещенный одним или несколькими галогенами.
15. Соединение по п.8, в котором соединение представляет:
 ,
,  ,
,
 ,
, 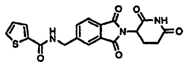 ,
,
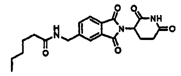 ,
, 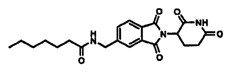 ,
,
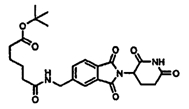 ,
, 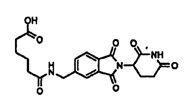 ,
,
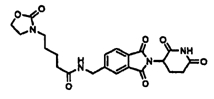 ,
, 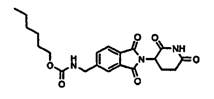 ,
,
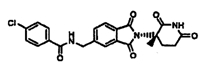 ,
, 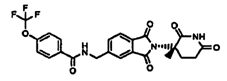 ,
,
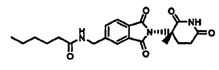 ,
, 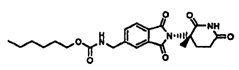
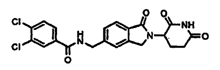 ,
, 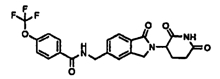 ,
,
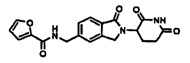 ,
, 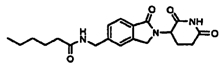 ,
,
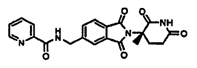 ,
, 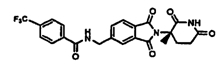 ,
,
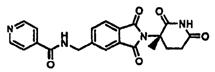 ,
, 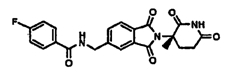 ,
,
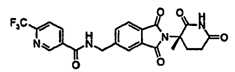 ,
, 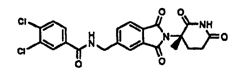 ,
,
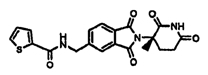 ,
, 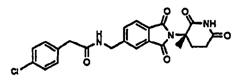 ,
,
 ,
,  ,
,
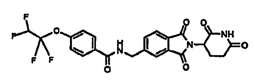 ,
, 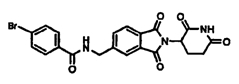 ,
,
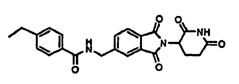 ,
, 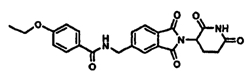 ,
,
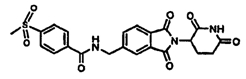 ,
, 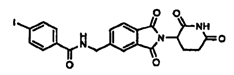 ,
,
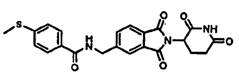 ,
, 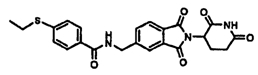 ,
,
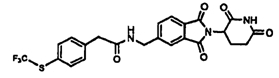 ,
, 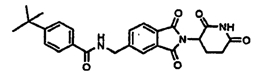 ,
,
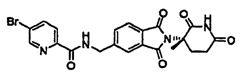 ,
, 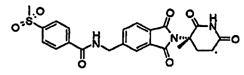 ,
,
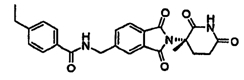 ,
, 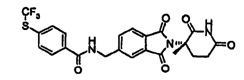 ,
,
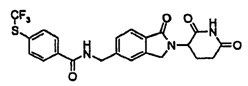 ,
, 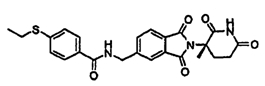 ,
,
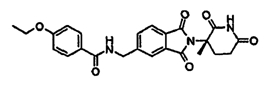 или
или 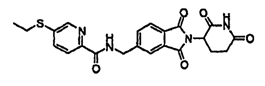 .
.
16. Соединение формулы (IV)
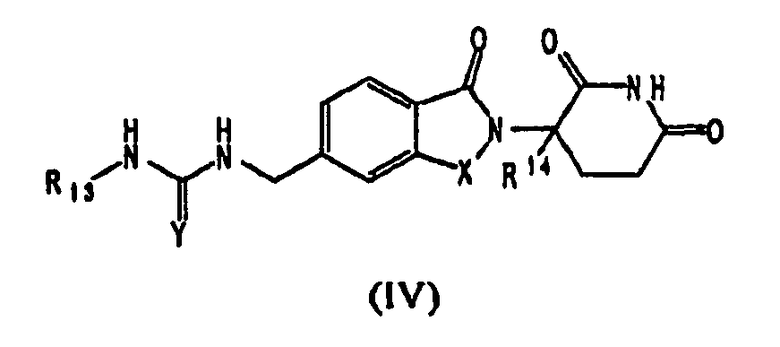
или его фармацевтически приемлемая соль или стереоизомер, в котором:
X представляет CH2 или C=O;
Y представляет O или S;
R13 представляет (C1-C10)алкил;
5-10-членный арил или гетероарил, где гетероарил означает бициклическое ароматическое кольцо, содержащее 9 кольцевых атомов, из которых, по меньшей мере, один или два атома представляют собой кислород; необязательно замещенный одним или несколькими заместителями из галогена; циано; (C1-C6)алкокси, который сам необязательно замещен одним или несколькими галогенами; (C1-C6)алкила, который сам необязательно замещен одним или несколькими галогенами; и
R14 представляет H или (C1-C6)алкил.
17. Соединение по п.16, в котором X представляет C=O.
18. Соединение по п.16, в котором X представляет CH2.
19. Соединение по п.16, в котором R13 представляет пропил, бутил, пентил или гексил.
20. Соединение по п.16, в котором R13 представляет фенил, необязательно замещенный одним или несколькими галогенами.
21. Соединение по п.16, в котором соединение представляет:
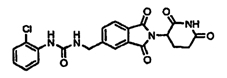 ,
, 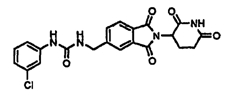 ,
,
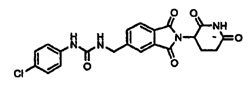 ,
, 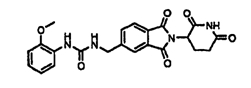 ,
,
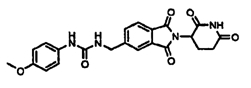 ,
, 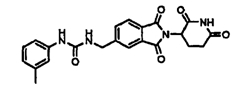 ,
,
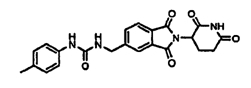 ,
, 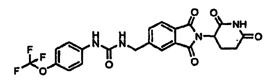 ,
,
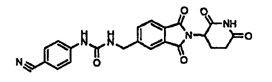 ,
, 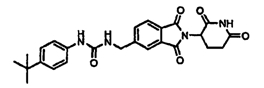 ,
,
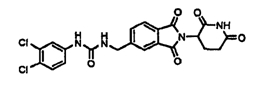 или
или 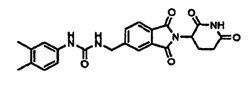 .
.
22. Соединение по п.16, в котором соединение представляет:
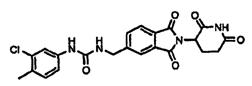 ,
, 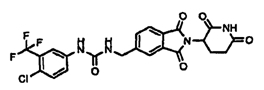 ,
,
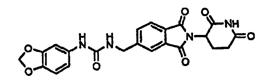 ,
, 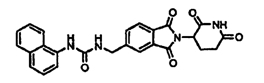 ,
,
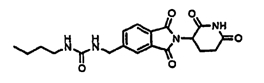 ,
, 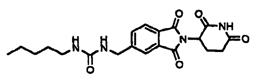 ,
,
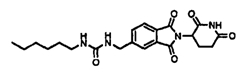 ,
, 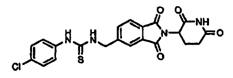 ,
,
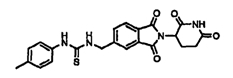 ,
, 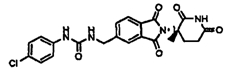 ,
,
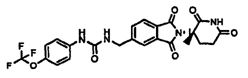 ,
, 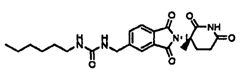 ,
,
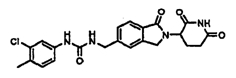 ,
, 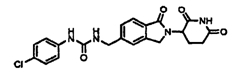 ,
,
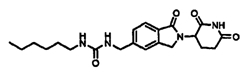 или
или
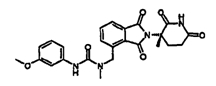 .
.
23. Фармацевтическая композиция для ингибирования TNFα, включающая соединение по п.1.
24. Фармацевтическая композиция по п.23 в виде единичной дозированной формы.
25. Фармацевтическая композиция по п.24, подходящая для орального или парентерального введения.
26. Фармацевтическая композиция по п.25, подходящая для орального введения.
27. Фармацевтическая композиция по п.26, которая представляет таблетку или капсулу.
| WO 2004103274 A2, 02.12.2004 | |||
| WO 02059106 A1, 01.08.2002 | |||
| 2,6-ДИОКСОПИПЕРИДИН, СПОСОБ СНИЖЕНИЯ НЕЖЕЛАТЕЛЬНЫХ УРОВНЕЙ ФНОα У МЛЕКОПИТАЮЩЕГО, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2209207C2 |
Авторы
Даты
2012-04-20—Публикация
2007-08-29—Подача