Данное изобретение относится к способу получения 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) и 10,11-дигидро-10-оксо-5Н-дибенз/b,f/азепин-5-карбоксамида (2). Соединение (2), известное как окскарбазепин, обладает ценными свойствами для лечения эпилепсии и, как заявлено, является лекарственным средством с улучшенной толерантностью по сравнению с карбамазепином (соединение 3, где R=NH2), родственным по структуре противосудорожным лекарственным средством (Grant, S.M. et al., Drugs, 43, 873-888 (1992)). Соединение (1) представляет собой также известное соединение с противосудорожной активностью и фактически является основным метаболитом соединения (2) (Schutz, H. et al., Xenobiotica, 16, 769-778 (1986)).
В дополнение к их противосудорожным активностям, соединения (1) и (2) также используются в качестве промежуточных соединений для получения (S)-(-)-10-ацетокси-10,11-дигидро-5Н- дибенз/b,f/азепин-5-карбоксамида (4), совсем недавно открытого противосудорожного средства (Benes, J. et al., J. Med. Chem., 42, 2582-2587, (1999)). Поэтому был бы желательным быстрый, экономичный, высокоэффективный и экологически приемлемый способ крупномасштабного получения обоих соединений, предпочтительно исходя из распространенного, легко доступного предшественника.
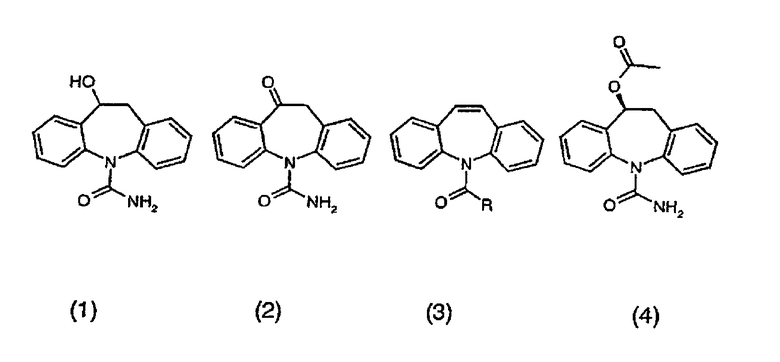
Описанный ранее синтез гидрокси соединения (1) показал необходимость, в первую очередь, эпоксидирования карбамазепина (т.е. соединения 3, где R=NH2) или хлорзамещенного аналога (т.е. соединения 3, где R=Cl) с использованием мета-хлорпероксибензойной кислоты, приводя, таким образом, к получению эпоксидов (т.е. соединения 5, где R представляет собой NH2 или Cl) с умеренным выходом (~60%)(Bellucci, G. et al., J. Med. Chem., 30, 768-773 (1987)). Аминирование соединения (6) аммиаком в таком случае приводит к соединению (5).
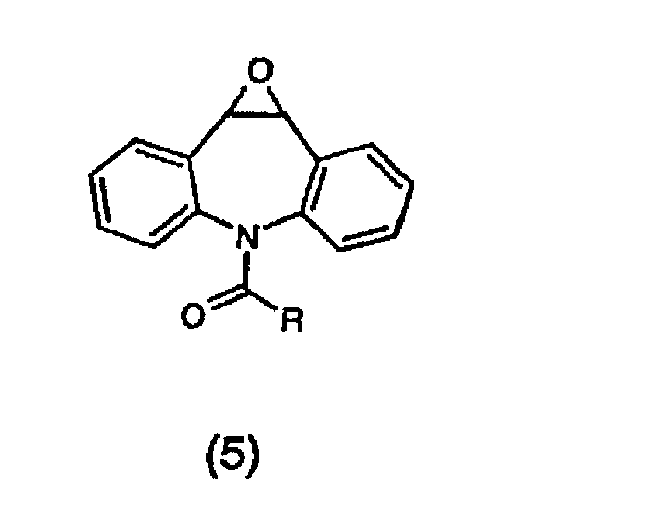
Главным недостатком, однако, является то, что мета-хлорпероксибензойная кислота является потенциально взрывчатой, и, таким образом, ее использование должно сопровождаться строгими мерами безопасности. Кроме того, для такого эпоксидирования необходим значительный избыток дорогостоящего реагента. По этой причине этот процесс не подходит для крупномасштабного синтеза, и действительно, многие коммерческие предприятия к настоящему времени прекратили производить этот опасный реагент. Другие сведения об эпоксидировании соединения (3) включают эпоксидирование с использованием микроорганизмов (Kittelmann, M. et al., Biosci. Biotechnol. Biochem., 57(9), 1589-1590 (1993); Chem. Abstr. 120:75516), эпоксидирование, катализируемое комплексом порфирин/пероксид железа (Yang, S. et al., Inorg. Chem., 37(4), 606-607 (1998); (Chem. Abstr. 128:140628) и опосредованное кобальтом эпоксидирование персульфатом (Nam, W. et al., Bull. Korean Chem. Soc., 17(5), 414-416 (1996); (Chem. Abstr. 125:86408). Эти способы, тем не менее, являются неподходящими для крупномасштабного производства.
Эпоксид (5) представляет собой подвижное промежуточное соединение. Перегруппировка с использованием галогенидов лития и магния дает прямой доступ к окскарбазепину (2) (NL 7902811 и HU 63390). Однако эти реагенты являются чувствительными к влаге, дорогостоящими при получении от коммерческих источников или требующими получения in situ, и выходы соединения (2) являются часто низкими выходами до средних. Альтернативно, эпоксид (5) превращали в спирт (1) путем каталитического гидрирования с использованием палладия (Baker, K.M. et al., J. Med. Chem., 16(6), 703-705 (1993)). Однако загрузки катализатора были очень высокими, а общий выход спирта был лишь умеренным.
Окскарбазепин получали несколькими способами с использованием различных исходных веществ (WO9621649 и WO0055138). Однако его получение прямым окислением спирта (1) не было описано.
Можно обобщить, что в предшествующим уровне техники существует недостаток в экономичном, с высоким выходом способе, который можно использовать в промышленном масштабе, пригодном для получения 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) и 10,11-дигидро-10-оксо-5Н-дибенз/b,f/азепин-5-карбоксамида (2) из одного и того же исходного вещества, карбамазепина (3), который является недорогим и легко доступным в больших количествах.
Целью данного изобретения является предоставление улучшенного способа получения 10,11-дигидро-10-оксо-5Н-дибенз/b,f/азепин-5-карбоксамида (2) из 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1). В частности, целью данного изобретения является предоставление способа, который избегает недостатков предшествующего уровня техники.
Таким образом, данное изобретение обеспечивает способы получения 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) и 10,11-дигидро-10-оксо-5Н-дибенз/b,f/азепин-5-карбоксамида (2) из карбамазепина (3) посредством трехстадийного процесса, включающего (i) эпоксидирование карбамазепина; (ii) раскрытие кольца полученного эпоксида и (iii) окисление полученного в результате спирта в соответствии с данным изобретением, стадии таких способов можно осуществлять отдельно или в комбинации. Таким образом, изобретение обеспечивает способ, включающий отдельно стадии (i), (ii) и (iii). Изобретение также обеспечивает способ, включающий только стадии (i) и (ii) или только стадии (ii) и (iii). Окончательно, изобретение обеспечивает способ, включающий все три стадии (i), (ii) и (iii).
Стадии (i), (ii) и (iii) будут описаны далее более подробно.
Стадия (i)
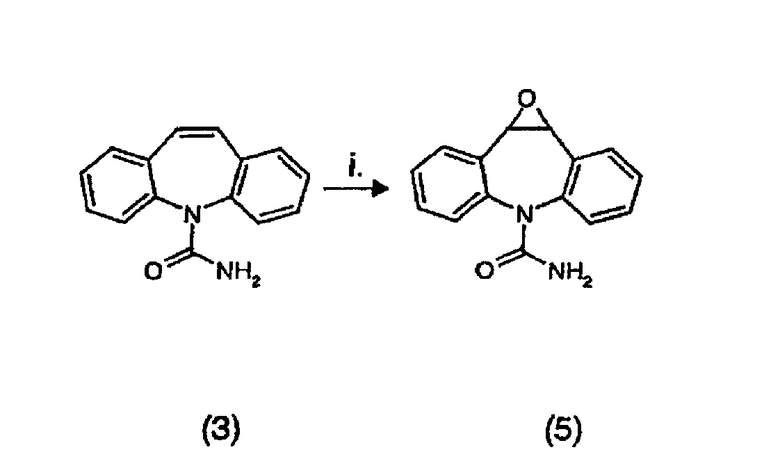
Эпоксидирование карбамазепина желательно проводить путем добавления избытка пероксиуксусной кислоты к перемешиваемой суспензии карбамазепина (3) и катализатора на основе металла в инертном растворителе. Реакцию можно проводить в присутствии неорганического основания. Пероксиуксусная кислота является недорогой и коммерчески легко доступной в виде раствора в уксусной кислоте или может быть получена in situ из смесей уксусной кислоты и перекиси водорода (Hudlicky, M. Oxidations in Organic Chemistry, ACS Monograph, Washington DC, 1990). Предпочтительно использовать 1,5-3 молярных эквивалентов пероксиуксусной кислоты.
Подходящие инертные растворители включают хлорированные углеводороды. Неорганическим основанием может быть, например, ацетат натрия, карбонат натрия и карбонат калия, все эти вещества являются легко доступными и недорогими; предпочтительно использовать 2,5-3,2 молярных эквивалента неорганического основания. Некоторые катализаторы на основе металла являются подходящими для реакции эпоксидирования, включая комплексы марганца, кобальта, никеля, меди, родия и железа.
Предпочтительные катализаторы включают сален марганца (III), ацетилацетонат марганца (III), оксид марганца (IV) и перманганат калия. Обычно для хорошей конверсии желательно 0,025-3 мол.% катализатора. Предпочтительно, может использоваться катализатор фазового переноса, такой как, например, Adogen 464 или Aliquat 336. Если требуется, катализатор на основе металла может быть нанесен на инертный носитель, такой как оксид алюминия, оксид кремния или инертная глина, в форме порошков, гранул или шариков, обеспечивающих возможность лучшего восстановления после реакции простым фильтрованием, что является важным фактором с учетом экологических требований. Обычно предпочтительным является 2-4% масс./масс. катализатора на носителе.
Альтернативно, и если желательно, порядок добавления реагентов может быть изменен на обратный, и карбамазепин (3) можно добавлять к раствору пероксиуксусной кислоты и катализатора в предпочтительной системе растворителя. В любом случае, после того как слабо экзотермическая реакция завершена, неорганическое основание и катализатор на основе металла на носителе могут быть удалены фильтрованием, и фильтрат может быть смешан с водным раствором сульфита натрия, чтобы избавиться от избытка пероксида. Органическую фазу затем можно отделить, промыть водой и бикарбонатом натрия. Неочищенный эпоксид (5) может быть получен выпариванием органического растворителя и, если требуется, может быть очищен от подходящего растворителя, такого как этилацетат или спирты, имеющие от 1 до 6 атомов углерода, такие как этанол или изопропанол. Выход обычно превышает 85%, и продукт обычно имеет чистоту >97%, определенную анализом ВЭЖХ.
Стадия (ii)
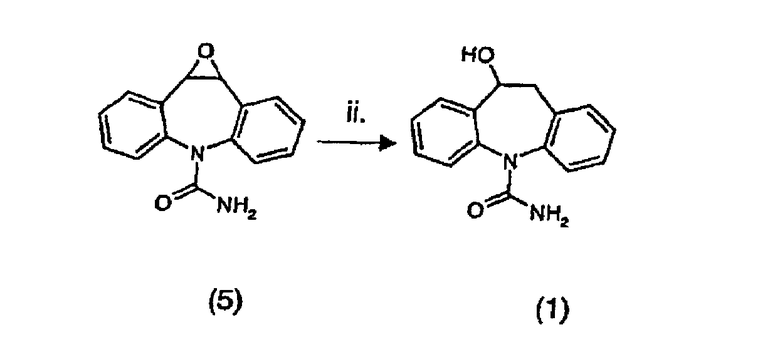
Раскрытие кольца эпоксида (5) можно просто осуществлять либо путем каталитического переноса водорода, либо путем каталитического гидрирования. Было обнаружено, что при тщательном выборе условий реакции можно получить неожиданно высокие выходы. Для реакции каталитического переноса водорода подходящий катализатор добавляют к раствору эпоксида и донора водорода в смеси подходящего растворителя, и смесь перемешивают при комнатной температуре до завершения реакции.
Предпочтительный катализатор представляет собой палладий, предпочтительно адсорбированный на инертном носителе, таком как активированный уголь, и обычно используется 0,1-1 мол.% от 5-10 мас.% палладия на носителе. Предпочтительно такое количество составляет 0,2-1 мол.%, более предпочтительно 0,25-0,4 мол.% от 5-10 мас.% палладия на носителе. Более предпочтительно такое количество составляет 5-7 мас.% палладия на носителе. Было обнаружено, что оптимальный выбор катализатора улучшает выход продукта реакции.
Предпочтительные доноры водорода включают циклогексан, муравьиную кислоту, формиат натрия и формиат аммония, и обычно используют 1,5-3 молярных эквивалента.
Предпочтительные растворители для реакции включают хлорированные алканы, такие как дихлорметан, спирты, содержащие от 1 до 6 атомов углерода, такие как метанол, этанол или изопропанол, и воду, или реакция может проходить в смесях вышеупомянутых растворителей. Было обнаружено, что наилучшие результаты достигаются с дихлорметаном, метанолом и водой. Было обнаружено, что добавление воды (предпочтительно в количестве 1 объема по отношению к эпоксиду) улучшает реакцию путем снижения количества побочных продуктов.
Предпочтительно проводить реакцию при температуре окружающей среды, т.е. при 15-25°С.
После завершения реакции катализатор может быть восстановлен фильтрованием через целит или оксид кремния, и фильтрат можно выпаривать в вакууме. Если требуется, неочищенный продукт можно перекристаллизовать из подходящего растворителя, такого как этилацетат или низшие спирты, такие как этанол.
Для реакции каталитического гидрирования подходящий катализатор добавляют к перемешиваемому раствору эпоксида (5) в подходящей смеси растворителей, необязательно содержащей органическое основание. Подходящие катализаторы и смеси растворителей такие же, как описаны в отношении реакции каталитического переноса водорода. Было обнаружено, что наилучшие результаты достигаются с метанолом (в количестве приблизительно 20 объемов по отношению к эпоксиду) и водой (в количестве приблизительно 1 объема по отношению к эпоксиду), самые лучшие результаты получают, когда используют оба растворителя, метанол и воду. Было обнаружено, что добавление воды (предпочтительно в количестве 1 объема по отношению к эпоксиду) улучшает реакцию путем снижения количества побочных продуктов. Было также обнаружено, что реакцию можно улучшить при использовании органического основания, особенно триалкиламинов, таких как триэтиламин. Это ускоряет реакцию, таким образом приводя к образованию меньшего количества побочных продуктов и увеличению выхода целевого продукта. Наилучшая концентрация органического основания составляет 3-4 молярных эквивалента по отношению к эпоксиду. Реакцию можно проводить при различных температурах и давлениях, хотя предпочтительными являются атмосферное давление и температура окружающей среды (15-25°С). Через реакционную смесь можно барботировать газообразный водород, и после завершения реакции (1-3 часа) катализатор может быть восстановлен фильтрованием, и продукт может быть выделен, как описано в отношении реакции каталитического переноса водорода.
Выходы в обеих реакциях, каталитического переноса водорода и каталитического гидрирования, обычно находятся в пределах 85-95%, и чистота продукта обычно составляет >97%.
Стадия (iii)
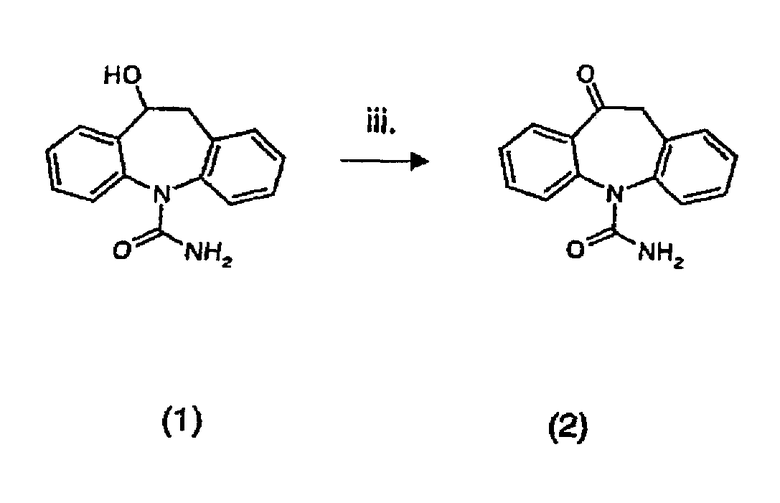
Окисление простых спиртов надкислотами в сочетании с катализаторами на основе металла были описаны в химической литературе (катализаторы на основе рутения: Murahashi, S.I. et al., Synlett, 7, 733-734 (1995)), (катализаторы на основе хрома: Corey, E.J. et al., Tetrahedron Letters, 26(48), 5855-5858 (1985)). Аналогичное окисление простых спиртов пероксиуксусной кислотой в присутствии бромида натрия описано (Morimoto,T. et al., Bull. Chem. Soc. Jpn,. 65, 703-706 (1992)). Однако более распространенные используемые окислители - это перекись водорода или трет-бутилгидропероксид (например, Muzart, J. et al., Synthesis, 785-787, (1993)).
Однако, в соответствии с особенно преимущественной целью данного изобретения, окисление спирта (1) проводят добавлением избытка пероксиуксусной кислоты к перемешиваемой суспензии спирта (1) и катализатора на основе металла в подходящем растворителе. Если желательно, можно использовать катализатор фазового переноса, такой как, например, Adogen 464 или Aliquat 336. Обычно требуется 3-5 молярных эквивалентов пероксиуксусной кислоты. Подходящие растворители включают хлорированные алканы, такие как, например, дихлорметан или 1,2-дихлорэтан. Предпочтительные катализаторы на основе металла представляют собой триоксид хрома, диоксид марганца, ацетат марганца (III), перманганат калия, хлорид кобальта (II) и дихромат калия и натрия. Если требуется, катализатор на основе металла после реакции может быть нанесен на инертный носитель, такой как оксид алюминия, оксид кремния или инертная глина, в форме порошков, гранул или шариков, обеспечивающих возможность лучшего восстановления, простым фильтрованием. Обычно предпочтительным является 2-4% масс./масс. катализатора на носителе, и для реакции окисления обычно используется 0,5-5 мол.% катализатора на основе металла.
Альтернативно, и если желательно, порядок добавления реагентов может быть изменен на обратный, и твердый спирт (1) можно добавлять к раствору пероксиуксусной кислоты и катализатора в предпочтительной системе растворителя. После того как слабо экзотермическая реакция завершена, катализатор на основе металла на носителе может быть удален фильтрованием, и фильтрат может быть смешан с водным раствором сульфита натрия, чтобы избавиться от избытка пероксида. Органическую фазу затем отделяют, промывают водой и бикарбонатом натрия. Неочищенный окскарбазепин (2) получают выпариванием органического растворителя и, если требуется, очищают из подходящего растворителя, такого как этилацетат или спирты, содержащие от 1 до 6 атомов углерода, такие как, например, этанол или изопропанол. Выход обычно превышает 85%, и продукт обычно имеет чистоту >97%.
В соответствии с другим аспектом изобретения обеспечивается способ получения 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) путем взаимодействия карбамазепина (3) с пероксиуксусной кислотой и катализатором на основе металла в, по существу, инертном растворителе с получением 1a,10b-дигидро-6Н-дибенз/b,f/оксирено[d]азепин-6-карбоксамида (5), с последующим раскрытием кольца 1a,10b-дигидро-6Н-дибенз/b,f/оксирено[d]азепин-6-карбоксамида (5) либо путем каталитического переноса водорода в присутствии донора водорода и катализатора на основе металла, либо, альтернативно, путем каталитического гидрирования газообразным водородом в присутствии катализатора на основе металла. Этот способ предпочтительно проводят в соответствии с признаками, описанными выше в отношении стадий (i) и (ii).
В соответствии с одним аспектом данного изобретения, обеспечивается способ получения 10,11-дигидро-10-оксо-5Н-дибенз/b,f/азепин-5-карбоксамида (2) из 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1), который включает окисление 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) реакцией с пероксиуксусной кислотой в присутствии катализатора на основе металла в, по существу, инертном растворителе.
В соответствии с другим аспектом изобретения, обеспечивается способ получения 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) путем раскрытия кольца 1a,10b-дигидро-6Н-дибенз/b,f/оксирено[d]азепин-6-карбоксамида (5) либо путем каталитического переноса водорода в присутствии донора водорода и катализатора на основе металла, либо, альтернативно, путем каталитического гидрирования газообразным водородом в присутствии катализатора на основе металла. Этот способ предпочтительно осуществляют в соответствии с признаками, описанными выше в отношении стадии (ii).
В соответствии с другим аспектом данного изобретения, обеспечивается способ получения 1a,10b-дигидро-6Н-дибенз/b,f/оксирено[d]азепин-6-карбоксамида (5) реакцией карбамазепина (3) с пероксиуксусной кислотой и металлическим катализатором в, по существу, инертном растворителе. Этот способ предпочтительно осуществляют в соответствии с признаками, описанными выше в отношении стадии (i).
В соответствии с другим аспектом данного изобретения обеспечивается способ получения соединения формулы (6):
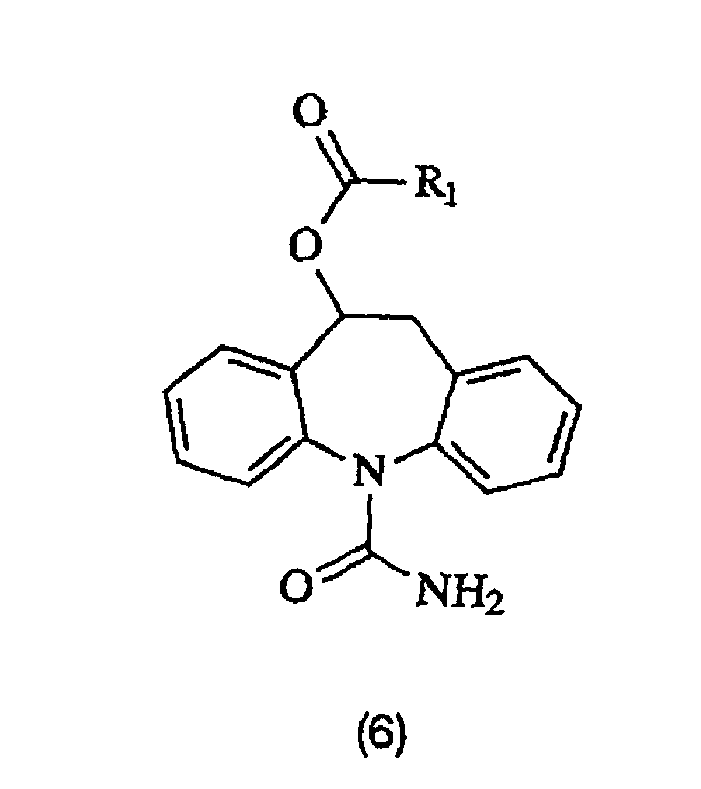
где R1 представляет собой водород, алкил, галогеналкил, аралкил, циклоалкил, циклоалкилалкил, алкокси, арил или пиридил; где термин алкил означает прямую или разветвленную углеводородную цепь, содержащую от 1 до 18 атомов углерода; термин галоген означает фтор, хлор, бром или йод; термин циклоалкил означает алициклическую насыщенную группу с 3-6 атомами углерода; и термин арил означает незамещенную фенильную группу или фенил, замещенный алкокси, галогеном или нитрогруппой, который включает образование 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида описанным выше способом, с последующей обработкой 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида, получая соединение формулы (6). Соединение формулы (6) предпочтительно получают ацилированием 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида.
Соединение формулы (6) более подробно описано в патенте США № 5753646, содержание которого включено в данное описание в качестве ссылки. Данный способ можно применять для получения любых соединений, раскрытых в US5753646. Например, для получения 10-ацетокси-10-дигидро-5Н-дибенз/b,f/азепин-5-карбоксамида возможно добавление ацетилхлорида в дихлорметане к суспензии 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида и пиридина в дихлорметане, как описано в примере 4 US5753646.
Соединения, описанные в примерах 4-17 US5753646, могут быть получены ацилированием с использованием подходящего галогенангидрида уксусной кислоты. Соединения, описанные в примерах 18-23, могут быть получены при использовании подходящей карбоновой кислоты.
Используя данное изобретение, могут быть получены следующие соединения:
(1) 10-ацетокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(2) 10-бензоилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(3) 10-(4-метоксибензоилокси)-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(4) 10-(3-метоксибензоилокси)-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(5) 10-(2-метоксибензолокси)-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(6) 10-(4-нитробензоилокси)-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(7) 10-(3-нитробензоилокси)-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(8) 10-(2-нитробензоилокси)-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(9) 10-(4-хлорбензоилокси)-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(10) 10-(3-хлорбензоилокси)-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(11) 10-(2-ацетоксибензоилокси)-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(12) 10-пропионилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(13) 10-бутирилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(14) 10-пивалоилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(15) 10-[(2-пропил)пентаноилокси]-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(16) 10-[(2-этил)гексаноилокси]-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(17) 10-стеароилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(18) 10-циклопентаноилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(19) 10-циклогексаноилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(20) 10-фенилацетокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(21) 10-(4-метоксифенил)ацетокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(22) 10-(3-метоксифенил)ацетокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(23) 10-(4-нитрофенил)ацетокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(24) 10-(3-нитрофенил)ацетокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(25) 10-никотиноилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(26) 10-изоникотиноилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(27) 10-хлорацетокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(28) 10-бромацетокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(29) 10-формилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(30) 10-этоксикарбонилокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид
(31) 10-(2-хлорпропионилокси)-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид.
10,11-Дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамид можно разделить на (R)-(+) и (S)-(-)-стереоизомеры и, таким образом, получить желаемый (R)-(+) или (S)-(-)-стереоизомер перечисленных выше соединений.
Эти соединения или их фармацевтически приемлемые производные (такие как соли) можно использовать в получении фармацевтических композиций, включающих само соединение или производное в комбинации с фармацевтически приемлемым носителем. Такие композиции обладают противосудорожными свойствами и могут применяться для лечения некоторых нарушений центральной и периферической нервной системы, таких как эпилепсия.
Изобретение, раскрываемое в данном описании, пояснено следующими примерами получения, которые не следует истолковывать как ограничивающие объем раскрываемого изобретения. Должно быть понятно, что изобретение не ограничивается конкретными деталями процесса, и специалисту в данной области должны быть очевидны модификации и эквиваленты данного изобретения.
Пример 1: 11a,10b-дигидро-6Н-дибенз/b,f/оксирено[d]азепин-6-карбоксамид (5)
К перемешиваемой суспензии карбамазепина (3) (200 г, 847,5 ммоль) и карбоната натрия (287,4 г, 2711 ммоль) в дихлорметане (1000 мл) добавляли таблетки перманганата калия, нанесенного на оксид алюминия (3,5% масс./масс., 3,46 г, 0,77 ммоль). После этого в течение одного часа по каплям добавляли пероксиуксусную кислоту (39% раствор в уксусной кислоте, 432 мл, 2538 ммоль), вызывая постепенное повышение до температуры слабого кипения растворителя с обратным холодильником. Смесь перемешивали в течение двадцати минут и затем оставляли выстаиваться в течение двадцати минут. Карбонат натрия и катализатор на носителе удаляли фильтрованием и промывали дихлорметаном (200 мл); шарики оксида алюминия отделяли от карбоната натрия просеиванием через сито. Объединенный фильтрат затем смешивали с водным раствором сульфита натрия (20 г) и бикарбоната натрия (20 г) в воде (250 мл) в течение одного часа. Фазы затем разделяли и водную фазу экстрагировали дихлорметаном (50 мл). Объединенные органические слои промывали водой (100 мл), насыщенным водным бикарбонатом натрия (100 мл), снова водой (100 мл) и насыщенным раствором соли, затем сушили над безводным сульфатом натрия и фильтровали. Выпаривание растворителя (роторный испаритель, давление водного аспиратора, 40°С) давало неочищенный эпоксид (5) в виде твердого вещества бежевого цвета, которое кристаллизовали из этилацетата (100 мл) с получением продукта в виде беловатого твердого вещества, 194,2 г, (выход 91%).
Пример 2: 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамид (1)
(а) Каталитический перенос водорода
К раствору 1a,10b-дигидро-6Н-дибенз/b,f/оксирено[d]азепин-6-карбоксамида (5) (5,03 г, 20 ммоль) в метаноле (100 мл), дихлорметане (50 мл) и воде (5 мл) при комнатной температуре в атмосфере водорода добавляли формиат аммония (3,78 г, 60 ммоль) с последующим добавлением 10% палладия на угле (540 мг, 0,51 ммоль Pd). Полученную смесь перемешивали при комнатной температуре в течение одного часа и затем катализатор восстанавливали фильтрованием через целит. Фильтровальную лепешку промывали дихлорметаном (20 мл), органическую фазу объединенного фильтрата отделяли и сушили над безводным сульфатом натрия. Фильтрование и выпаривание растворителя (роторный испаритель, давление водного аспиратора, 40°С) давали неочищенный спирт (1), который кристаллизовали из этилацетата (20 мл) с получением белых кристаллов, 4,7 г, (выход 93%).
(b) Каталитическое гидрирование
К перемешиваемому раствору 1a,10b-дигидро-6Н-дибенз/b,f/оксирено[d]азепин-6-карбоксамида (5) (50,0 г, 198 ммоль) в смеси метанола (950 мл) и воды (50 мл) и триэтиламина (64,8 г, 89 мл, 641 ммоль) при комнатной температуре добавляли 5% палладий на угле (1,29 г, 0,61 ммоль). Через реакционную смесь пропускали газообразный водород в течение двух часов при комнатной температуре и атмосферном давлении, и затем катализатор восстанавливали фильтрованием через целит. Фильтровальную лепешку промывали дихлорметаном (20 мл), органическую фазу объединенного фильтрата отделяли и сушили над безводным сульфатом натрия. Фильтрование и выпаривание растворителя (роторный испаритель, давление водного аспиратора, 40°С) давали неочищенный спирт (1), который кристаллизовали из этилацетата (100 мл) с получением белых кристаллов, 46,7 г, (выход 93%).
Пример 3: 10,11-дигидро-10-оксо-5Н-дибенз/b,f/азепин-5-карбоксамид (2)
К перемешиваемой суспензии 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) (100 г, 394 ммоль) в 1,2-дихлорэтане (1000 мл) при комнатной температуре добавляли дихромат калия, адсорбированный на силикагеле (46,0 г, (0,34 ммоль/г, 15,6 ммоль). Затем по каплям добавляли пероксиуксусную кислоту (300 мл, 39% раствор в уксусной кислоте, 1425 ммоль); реакционная смесь становилась пурпурного цвета, и проходила мягкая экзотермическая реакция. После перемешивания в течение еще одного часа катализатор, нанесенный на силикагель, удаляли фильтрованием и промывали дихлорметаном (100 мл). Объединенный фильтрат затем в течение часа смешивали с 5% водным раствором сульфита натрия (500 мл). Фазы затем разделяли и водную фазу экстрагировали дихлорметаном (50 мл). Объединенные органические слои промывали водой (100 мл), насыщенным водным бикарбонатом натрия (100 мл), снова водой (100 мл) и насыщенным раствором соли, затем сушили над безводным сульфатом натрия и фильтровали. Выпаривание растворителя (роторный испаритель, давление водного аспиратора, 40°С) давало неочищенный продукт (2) в виде беловатого твердого вещества, которое кристаллизовали из этанола (20 мл) с получением белых кристаллов, 89,5 г, (выход 90%).
Должно быть понятно, что описанное выше изобретение может быть модифицировано.
Настоящее изобретение относится к способу получения 10,11-дигидро-10-оксо-5Н-дибенз/b,f/азепин-5-карбоксамида из карбамазепина и может быть использовано в фармацевтической промышленности. В предложенном способе получают 10,11-дигадро-10-оксо-5Н-дибенз/b,f/азепин-5-карбоксамид окислением 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида пероксиуксусной кислотой в присутствии катализатора на основе металла в инертном растворителе.
Технический результат - разработка нового способа получения биологически активного соединения. 16 з.п.ф-лы, 3 пр.
1. Способ получения 10,11-дигидро-10-оксо-5Н-дибенз/b,f/азепин-5-карбоксамида (2) из 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1), который включает окисление 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) взаимодействием с пероксиуксусной кислотой в присутствии катализатора на основе металла в, по существу, инертном растворителе.
2. Способ по п.1, в котором катализатор на основе металла, используемый в реакции окисления, выбирают из диоксида марганца, ацетата марганца (III), триоксида хрома, перманганата калия, хлорида кобальта (II), дихромата калия и дихромата натрия.
3. Способ по любому из пп.1 или 2, в котором катализатор на основе металла, используемый в реакции окисления, нанесен на инертный носитель, выбранный из силикагеля, оксида алюминия, глины или молекулярных сит.
4. Способ по любому из пп.1 или 2, в котором, по существу, инертный растворитель, используемый в реакции окисления, представляет собой хлорированный углеводородный растворитель.
5. Способ по п.3, в котором, по существу, инертный растворитель, используемый в реакции окисления, представляет собой хлорированный углеводородный растворитель.
6. Способ по п.4, в котором, по существу, инертный растворитель представляет собой дихлорметан или 1,2-дихлорэтан.
7. Способ по п.5, в котором, по существу, инертный растворитель представляет собой дихлорметан или 1,2-дихлорэтан.
8. Способ по любому из пп.1, 2, 5, 6 или 7, где стадию окисления выполняют в избытке пероксиуксусной кислоты.
9. Способ по п.3, где стадию окисления выполняют в избытке пероксиуксусной кислоты.
10. Способ по п.4, где стадию окисления выполняют в избытке пероксиуксусной кислоты.
11. Способ по любому из пп.1, 2, 5, 6, 7, 9 или 10, где стадию окисления выполняют в присутствии 3-5 молярных эквивалентов пероксиуксусной кислоты.
12. Способ по п.3, где стадию окисления выполняют в присутствии 3-5 молярных эквивалентов пероксиуксусной кислоты.
13. Способ по п.4, где стадию окисления выполняют в присутствии 3-5 молярных эквивалентов пероксиуксусной кислоты.
14. Способ по п.8, где стадию окисления выполняют в присутствии 3-5 молярных эквивалентов пероксиуксусной кислоты.
15. Способ по любому из пп.1, 2, 5 или 6, где 10,11-дигидро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) в виде твердого вещества добавляют к раствору пероксиуксусной кислоты и катализатора в растворителе.
16. Способ по п.3, где 10,11-дигадро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) в виде твердого вещества добавляют к раствору пероксиуксусной кислоты и катализатора в растворителе.
17. Способ по п.4, где 10,11-дигадро-10-гидрокси-5Н-дибенз/b,f/азепин-5-карбоксамида (1) в виде твердого вещества добавляют к раствору пероксиуксусной кислоты и катализатора в растворителе.
| S.-I MURAHASHI ЕТ ALL, Synlett, 1995, 733, 734 | |||
| E.J | |||
| COREY ET ALL, Tetrahedron letters, 1985,26,48, 5855-5858 | |||
| RU98123571 А (БЕНЕШ ЯН) 27.09.2000. |
Авторы
Даты
2012-05-10—Публикация
2007-06-01—Подача